Quelques questions courantes en ophtalmologie pédiatrique
Coordonné Par D. Denis
D. Denis, E. Bui Quoc
Quotidiennement, des questions surviennent dans la pratique ophtalmopédiatrique. C’est pourquoi sont abordées dans ce chapitre les questions les plus fréquentes qui se posent, soit dans la pratique médicale courante, soit dans la vie quotidienne de l’enfant.
Sans être exhaustif, des points particuliers ou d’actualité sont
traités, sur des sujets très différents, qui peuvent toucher l’enfant à
tout âge ; certains concernent la pathologie fréquente du nouveauné,
du nourrisson ou de l’enfant plus grand, d’autres concernent
l’examen de l’enfant, ou encore le quotidien comme la problématique
du port de lentilles ou de la vision des écrans.
Sont abordées les questions suivantes :
– Quelles sont les atteintes oculaires possibles en cas de traumatisme
obstétrical ?
– Quel traitement antibiotique néonatal instiller après l’accouchement?
– Que faire devant un larmoiement du nourrisson ? Que faire
s’il persiste après l’âge de 1 an ?
– Que faire devant une dacryocystocèle ou une dacryocystite
du nourrisson ?
– Que faire devant une exophtalmie, une énophtalmie ou une
anomalie de taille du globe du nourrisson ?
– Que faire devant un enfant qui ne voit pas ?
– Que faire quand un enfant a les yeux qui bougent ?
– Que faire en cas d’anomalie pupillaire ?
– Quand demander et comment faire un bilan électrophysiologique?
– Comment voir et vivre avec une dyschromatopsie ?
– Mon enfant peut-il ou doit-il porter des lentilles de
contact ?
– Que devraient voir et ne pas voir les enfants ? Problématiques
des écrans et des jeux vidéo, de la 3D, de la lumière bleue, de
l’horloge biologique.
– Quelles antisepsie et antibioprophylaxie chirurgicales en ophtalmologie
pédiatrique ?
– Que penser de la chirurgie réfractive chez l’enfant ?
A Aziz-Alessi , C. d’Ercole, D. Denis
La possibilité de traumatismes du globe oculaire lors d’un accouchement
a été décrite dès la fin du xixe siècle. La détermination de la fréquence
de ces lésions oculaires reste problématique, car elle varie de
façon importante selon les séries. Ne faisant pas classiquement l’objet
d’un dépistage post-natal systématique, leur incidence pourrait être
sous-estimée. Le type d’accouchement (voie basse, avec ou sans instrumentation
mécanique, ou césarienne) semble être un point essentiel
dans la genèse de ces lésions. Si la littérature fait état de moins de
25 % de lésions oculaires après un accouchement simple et jusqu’à
50 % toutes lésions confondues après manoeuvres instrumentales,
certaines lésions comme les hémorragies rétiniennes après utilisation
de forceps sont très fréquentes, avec une incidence qui s’élèverait
pour plusieurs auteurs à environ 75 % [1, 2]. De plus, il est important
de préciser que certaines manoeuvres instrumentales obstétricales, au
premier rang desquelles l’emploi de forceps, majorent le risque de
lésions graves qui, bien que peu fréquentes, ont un impact visuel
certain pouvant mener à une amblyopie définitive et qu’il convient
donc, sinon de dépister systématiquement, du moins de le garder à
l’esprit dans l’examen ophtalmologique du nouveau-né.
Les lésions pouvant être observées sont nombreuses et sont
détaillées plus bas par type de structure oculaire lésée. Il existe
une tendance à l’observation plus fréquente de lésions oculaires à
gauche, du fait du mode de présentation foetale le plus classique
(occipito-iliaque antérieure gauche) [3], mais cette constatation
n’est pas retrouvée dans toutes les études [4].
Les hématomes palpébraux, en lien direct avec la pression exercée par la cuillère du forceps, sont classiques et quasi constants dans les observations de lésions oculaires plus profondes. Ceux-ci sont de bon pronostic et régressent le plus souvent spontanément sans séquelle. On peut également retrouver des plaies palpébrales avec possible atteinte canaliculaire [5] ; en cas d’arrachement canthal, des séquelles esthétiques sont possibles.
Les lésions du segment antérieur les plus fréquemment observées sont les hémorragies sous-conjonctivales qui régressent le plus souvent sans séquelle. On peut également retrouver des plaies conjonctivales voire cornéennes. Celles-ci existent notamment dans les accouchements par césarienne.
L’utilisation de forceps est directement incriminée dans les traumatismes du segment antérieur lors de l’observation de ruptures de la membrane de Descemet. Les contraintes de pression appliquées au globe oculaire par les forceps déterminent des forces d’étirement du globe oculaire à l’origine de ruptures verticales de la membrane de Descemet (fig. 5-1) [6, 7]. Aux stades initiaux, on constate classiquement une cornée trouble par oedème [6]. Il est important de noter que le caractère vertical des ruptures de la membrane de Descemet peut aider au diagnostic différentiel avec un glaucome congénital, dans lequel les ruptures sont horizontales ou parallèles au limbe. L’oedème entraîne une amblyopie par privation de contraste, les déformations cornéennes initiales associées à la déprivation visuelle induisant une myopie axile. De fait, ces enfants souffrent en général d’une amblyopie anisométropique par privation des hautes fréquences spatiales (anisométropie par myopie axile et astigmatisme fort). L’astigmatisme est souvent sévère avec un axe correspondant à celui des lésions membranaires (en général vertical).
Cette amblyopie dépend de la sévérité initiale du traumatisme et a un mauvais pronostic visuel, avec une efficacité très limitée des techniques de rééducation [7, 8].
Plus tardivement, des kératopathies bulleuses peuvent survenir, liées à la dysfonction endothéliale cornéenne chronique, aggravant encore le pronostic visuel.
Si des hyphémas néonataux spontanés peuvent exister, ils restent néanmoins extrêmement rares et un traumatisme de l’accouchement doit toujours être recherché avant d’évoquer des pathologies du nouveau-né comme le rétinoblastome, le médulloépithéliome, la rétinopathie des prématurés, le xanthogranulome juvénile de l’iris, l’hémangiomatose diffuse néonatale ou des anomalies de la coagulation (pouvant s’observer dans le cadre de leucémies infantiles). En dehors du cadre du traumatisme direct au cours de l’accouchement, un cas d’hyphéma associé à une hémorragie sous-conjonctivale et rétinienne a été décrit chez un enfant né à terme par voie naturelle, sans utilisation de forceps, mais après un travail long et une présentation faciale [9]. Une régression complète de l’hyphéma a été observée à une semaine de vie. De même, le travail très rapide et précipité (défini comme un travail complet dans un intervalle de 3 heures) peut être à l’origine d’une élévation des pressions veineuses, induisant possiblement des hémorragies en chambre antérieure. L’éventualité d’une iatrogénie médicamenteuse doit également être envisagée. Certains médicaments utilisés au cours du travail, comme l’ocytocine ou les prostaglandines par voie orale, ont montré un risque hémorragique accru du segment antérieur du nouveau-né [10]. Le mécanisme incriminé pourrait être celui d’une vasodilatation avec hyperperméabilité vasculaire s’accompagnant d’une élévation de la pression intra-oculaire et d’une fuite des vaisseaux iriens engorgés, aboutissant finalement à un hyphéma.
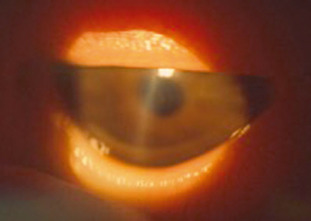
Fig. 5-1 Vergeture verticale descemétique après accouchement par forceps.
(Remerciements au Dr P. Dureau.)
La visualisation d’hémorragies rétiniennes correspond à un constat classique dans l’examen du fond d’oeil de nouveau-nés. La fréquence de ces anomalies s’avère très variable dans la littérature. Elle a été estimée à 35 % après un accouchement simple ou avec utilisation de ventouses, à 75 % après un accouchement par forceps et à 7 % après une césarienne. Ces proportions ont également été retrouvées dans d’autres études, notamment dans la revue systématique de la littérature conduite par Watts en 2013 incluant 13 études soit plus de 1 700 enfants [2]. L’importante variabilité des données d’incidence pourrait être en lien avec le délai entre l’accouchement et l’examen ophtalmologique, ces lésions ayant une tendance naturelle à l’amélioration puis à la disparition en quelques jours. Ces hémorragies sont généralement bilatérales, de nombre faible à modéré, prédominantes aux pôles postérieurs et plus fréquemment intrarétiniennes que pré- ou sousrétiniennes (fig. 5-2). Elles sont de forme variable, rondes ou en flammèche, et peuvent constituer des hématomes lorsqu’elles sont sous-rétiniennes. Les mécanismes physiopathologiques restent mal compris. Des facteurs en lien avec le foetus, la mère et le mode d’accouchement ont été successivement incriminés. Il semble toutefois que cette pathologie soit polyfactorielle et que l’impact de l’instrumentation au cours de l’accouchement ne soit pas négligeable, comme en témoigne le taux plus élevé de cas dans les suites de l’utilisation de forceps (impliquant un traumatisme oculaire direct avec compression plus ou moins importante des globes oculaires). Les localisations intrarétiniennes constatées plaident en faveur d’un lien avec l’hyperpression vasculaire existant chez le foetus au moment de l’accouchement [11]. En termes de facteurs épidémiologiques, une étude prospective sur plus de 2000 enfants en 2013 montrait une fréquence légèrement plus élevée en cas de sexe féminin. Les autres paramètres obstétricaux classiques (âge gestationnel, âge maternel, parité, présentation, taille du bassin, durée du travail) n’étaient pas associés à un risque majoré d’hémorragie [1]. Bien que la durée du travail n’ait pas été retenue comme facteur de risque de survenue d’hémorragies rétiniennes, celle-ci semble jouer un rôle dans certaines observations : un cas d’enfant avec hémorragies bilatérales après un travail long de plus de 20 heures sans instrumentation ou autre facteur de risque retrouvé a été rapporté par Emerson et al. [10]. Une importante étude prospective en 2013 [1] montrait que deux tiers des hémorragies constatées lors d’un examen systématique à l’accouchement avaient disparu au bout de 1 semaine et qu’elles avaient toutes disparu à 4 semaines. Toutefois, le risque de survenue d’une amblyopie liée aux localisations maculaires de ces hémorragies a été souligné par certains auteurs [12], mais non confirmé dans d’autres études avec suivi longitudinal sur 2 ans [1]. Les atteintes combinées (association d’une hémorragie rétinienne à un oedème rétinien maculaire ou à une hémorragie intravitréenne par exemple) ne sont pas rares et semblent aggraver le pronostic visuel.
Parmi les atteintes séquellaires classiquement observées, les plus fréquentes dans les suites d’une hémorragie rétinienne de l’accouchement semblent être les cicatrices maculaires et sous-rétiniennes, à type de cicatrices fibrogliales [4].
De plus, la littérature fait état d’un cas d’atrophie choriorétinienne [13], d’un cas de rupture de la choroïde [14] et d’un cas de syndrome de Purtscher [15].
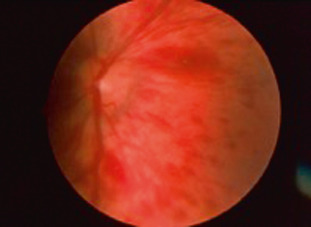
Fig. 5-2 Hémorragies rétiniennes multiples superficielles et profondes chez un enfant âgé de 1 jour après accouchement par forceps.
(Remerciements au Dr P. Dureau.)
Les ptosis dans ce contexte peuvent être en lien avec l’atteinte du nerf moteur oculaire (III) ou l’atteinte isolée du muscle releveur de la paupière supérieure ou de sa branche nerveuse provenant du III.
Les atteintes du nerf facial sont beaucoup plus fréquentes en cas d’utilisation de forceps qu’en cas d’utilisation de ventouses ou d’accouchement simple non instrumental (odds ratio ou rapport des cotes estimé à plus de 9 [16]). L’évolution d’une paralysie faciale induite par l’utilisation de forceps est en général bonne aboutissant à une récupération en 2 mois, laissant très peu de séquelles, à la différence des paralysies faciales résultant de pathologies survenant au cours de la vie intra-utérine.
Les lésions du nerf optique sont en général associées à des traumatismes cérébraux pendant l’accouchement par forceps. La gravité des lésions réside ici dans le pronostic des hémorragies intracérébrales et dans le mauvais pronostic visuel associé (risque d’atrophie optique et de cécité monoculaire définitive) [4].
Par ailleurs, la littérature fait état d’un cas d’énucléation [17] et de quelques cas de luxation oculaire [18–20].
Des atteintes des muscles oculomoteurs (fig. 5-3) et des fractures orbitaires ont également été rapportées, pouvant laisser des séquelles esthétiques et fonctionnelles importantes.
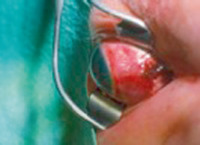
Fig. 5-3 (Remerciements au Dr P. Dureau.)
Les atteintes oculaires graves liées à un traumatisme obstétrical sont peu fréquentes et en raison de leur faible incidence, les obstétriciens considèrent généralement qu’elles ne justifient pas d’examen ophtalmologique systématique, notamment après une naissance assistée par forceps. L’évolution à long terme des enfants ayant subi une lésion oculaire au cours de l’accouchement est peu décrite dans la littérature, faute d’études longitudinales d’assez grande ampleur. En 1999, Johanson a cherché à quantifier les séquelles des enfants ayant subi une extraction instrumentale (forceps ou ventouse) à l’âge de 5 ans ; l’incidence de séquelles, y compris ophtalmologique, s’élevait entre 12 et 13 % [21].
Ainsi, la réalisation d’un bilan lésionnel initial exhaustif avec une description précise des lésions revêt une importance tant médico-légale que diagnostique et thérapeutique dans le but d’initier de façon précoce une prise en charge adaptée d
[1] Laghmari M, Skiker H, Handor H, et al. Birth-related retinal hemorrhages in the newborn: incidence and relationship with maternal, obstetric and neonatal factors. Prospective study of 2,031 cases. J Fr Ophtalmol 2014 ; 37 : 313-9.
[2] Watts P, Maguire S, Kwok T, et al A. Newborn retinal hemorrhages ; a systematic review. J AAPOS 2013 ; 17 : 70-8.
[3] Mc Donald MB, Burgess SK. Controlateral occipital depression related to obstetrical forceps injury to the eyes. Am J Ophthalmol 1992 ; 114 : 318-21.
[4] Regis A, Dureau P, Uteza Y, et al. Ocular injuries and childbirth. J Fr Ophtalmol 2004 ; 27(9 Pt 1) : 987-93.
[5] Khalil SK, Urso RG, Mintz-Hittner HA. Traumatic optic nerve injury occurring after forceps delivery of a term newborn. J AAPOS 2003 ; 7 : 146-7.
[6] Durand L, Burillon C, Normand F. Le traumatisme obstétrical, étiologie d’un oedème cornéen chronique. J Fr Ophthalmol 1987 ; 10 : 661-6.
[7] Lambert SR, MD, Drack AV, Hutchinson AK. Longitudinal changes in the refractive errors of children with tears in descemet’s membrane following forceps injuries. J AAPOS 2004 ; 8 : 368-70.
[8] Angell LK, Robb RM, Berson FG. Visual prognosis in patients with ruptures in Descemet’s membrane due to forceps injuries. Arch Ophthalmol 1981 ; 99 : 2137-9.
[9] Paciuc M, Garcia-Alonso P, Moragrega E. Hyphema and vitreous hemorrhage in a newborn. Ophthalmic Surg 1988 ; 19 : 680.
[10] Misra A, Watts P. Neonatal hyphema in precipitous delivery with dinoprostone. J AAPOS 2003 ; 7 : 213-4.
[11] Emerson MV, Pieramici DJ, Stoessel KM, et al. Incidence and rate of disappearance of retinal hemorrhage in newborns. Ophthalmology 2001 ; 108 : 36-9.
[12] Van Noorden GK, Khodadoust A. Retinal hemorrhage in newborns and organic amblyopia. Arch Ophthalmol 1973 ; 89 : 91-3.
[13] Le Rouic JF, Behar-Cohen F, Moussala M, et al. Lésion du fond d’oeil séquellaire d’un traumatisme obstétrical : à propos d’un cas. J Fr Ophthalmol 2001 ; 24 : 291-4.
[14] Estafanous FG, Seeley M, Traboulsi E. Choroidal rupture associated with forceps delivery. Am J Ophthalmol 2000 ; 129 : 819-20.
[15] Holden R, Morsmen DG, Davidek GMB, O’Connor GM. External ocular trauma in instrumental and deliveries. Br J Obstet Gynaecol 1992 ; 99 : 132-4.
[16] Towner D, Castro MA, Eby-Wilkens E, Gilbert WM. Effect of mode of delivery in nulliparous women on neonatal intra-cranial injury. N Engl J Med 1999 ; 341 : 1709-14.
[17] Wiegan W. Anophtalmos. Sequela of an usual birth injury. Fortschr Ophthalmol 1990 ; 87 : 540-1.
[18] Brasseur G, Charlin JF. Luxation du globe oculaire. Bull Mem Soc Fr Ophthalmol 1987 ; 87 : 1161-3.
[19] Friedenwald H. Luxation and alvusion of eyeball during birth. Am J Ophthalmol 1968 ; 65-69.
[20] Dutescu M, Lappe A. Luxation of eyeball in the newborn. J Pediatr Ophthalmol 1974 ; 11 : 82-5.
[21] Johanson RB, Heycock E, Carter J, et al. Maternal and child health after assisted vaginal delivery : five-year follow up of a randomised controlled study comparing forceps and ventouse. Br J Obstet Gynaecol 1999 ; 106 : 544-9.
P. Minodier
Les agents pathogènes sont :
– Neisseria gonorrhoeae (< 1 % ) ;
– Chlamydia trachomatis (2-40 % ) ;
– Staphylococcus spp. ;
– Streptococcus spp. ;
– Haemophilus spp. ;
– bacilles à Gram négatif (30-50 % ).
Des virus (herpes simplex virus, adénovirus, entérovirus) peuvent aussi causer des conjonctivites néonatales.
La transmission se fait par voie materno-foetale durant le passage de la filière génitale.
Neisseria gonorrhoeae et Chlamydia trachomatis sont les germes les
plus à risque :
– la conjonctivite à gonocoques ( « ophtalmie gonococcique »
= 30 à 50 % des nouveau-nés en l’absence de traitement maternel)
peut entraîner des ulcérations cornéennes pouvant aller
jusqu’à une perforation du globe oculaire avec trouble visuel
séquellaire ;
– les nouveau-nés de mères ayant une infection à Chlamydia
non traitée ont un risque d’infection de 50 % , de conjonctivite
néonatale de 30 à 50 % , et de pneumonie de 10 à 20 % .
–Risque maternel d’infections sexuellement transmissibles
(IST) : le risque d’IST à Neisseria gonorrhoeae et Chlamydia trachomatis
varie suivant les pays, l’accès aux soins, le suivi de la grossesse
et le comportement sexuel. Les IST augmentent en France.
– Dépistage : l’accent doit être mis sur le dépistage et le traitement
des IST durant la grossesse, qui, seuls, préviennent le risquenéonatal. Un prélèvement systématique chez la mère au 1er trimestre,
répété au 3e trimestre en cas de risque, devrait être pratiqué.
–Collyres antibiotiques actifs sur Neisseria gonorrhoeae et Chlamydia
trachomatis : rifamycine (recommandé par l’Agence nationale
de sécurité du médicament et des produits de santé en 2010),
azithromycine.
– Collyres antibiotiques non recommandés : tobramycine (pas
d’action sur Chlamydia trachomatis), tétracyclines (quelques résistances
de Neisseria gonorrhoeae, contre-indication avant 8 ans),
ciprofloxacine (résistances de Neisseria gonorrhoeae).
– Collyres ne devant plus être utilisés en raison de leurs effets
adverses : nitrate d’argent, gentamycine, povidone iodée.
–Population concernée : nouveau-nés dont un des parents est
colonisé par Neisseria gonorrhoeae ou Chlamydia trachomatis et,
éventuellement, nouveau-nés de mères à risque d’IST (migrant de pays à risque, précarité, comportements sexuels à risque, etc.) ou
dont la grossesse n’a pas été suivie.
– Population non concernée : les nouveau-nés de mères considérées
comme n’ayant pas de risque d’IST, ou dépistées négatives,
ne doivent pas recevoir de prévention oculaire.
Instillation d’une goutte de collyre actif sur Neisseria gonorrhoeae et Chlamydia trachomatis, dans chaque oeil, dans les premières 24 heures de vie.
Si une infection est découverte lors de l’accouchement, le nouveau-né doit également recevoir une injection unique de ceftriaxone (50 mg/kg) ou de céfotaxime (100 mg/kg).
Tous les nouveau-nés, quel que soit le risque d’IST de leur mère, doivent consulter en cas de conjonctivite du premier mois. Une recherche de Neisseria gonorrhoeae et Chlamydia trachomatis par prélèvement conjonctival doit être pratiquée dans les cas suivants : sécrétions purulentes abondantes, hyperhémie conjonctivale sévère, survenue dans la première semaine de vie, absence de larmoiement en dehors des sécrétions, kératite voire infection intra-oculaire avec hypopion.
B. Fayet, E. Racy
Dans tous les cas, à tout âge et en premier lieu, il faut éliminer des larmoiements réflexes du nourisson par hypersécrétion ; ils sont bilatéraux et plus ou moins symétriques.
La suppression de la stimulation trigéminale fera disparaître le larmoiement.
Les larmoiements par hypo-excrétion, dits passifs, sont isolés.
Le larmoiement peut être soit clair, soit accompagné de sécrétions.
Il faut rechercher : photophobie, rougeur oculaire, exophtalmie, asymétrie de la fente palpébrale, fièvre, etc. Devant l’un de ces signes, même mineurs, il faut réaliser un examen ophtalmologique en urgence.
Les instillations chroniques de bactériostatiques atténuent la présence de sécrétions.
Les collyres antibiotiques sont réservés aux traitements ponctuels des surinfections.
Le sondage lacrymal, aisé à cet âge, est avant tout diagnostique mais comporte des vertus thérapeutiques dans les sténoses muqueuses.
Les recommandations suivantes sont proposées :
– surtout ne pas se hâter : avec la croissance, bon nombre
de larmoiements vont guérir spontanément. Toutefois au-delà de
1 an, cette éventualité devient peu fréquente ;
– surtout ne pas trop tarder : plus l’enfant grandit et devient
vigoureux et plus la contention par momification et le sondage lacrymal seront pénibles, voire impossibles raisonnablement audelà
de 1 an ; ceci dit, le sondage en consultation sans anesthésie
devient rarement pratiqué ;
– sauf cas particulier, un premier sondage peut être réalisé vers
6 à 8 mois.
Le sondage lacrymal est moins aisé mais les possibilités thérapeutiques ne sont plus limitées par le jeune âge.
Dans un premier temps, il faut éliminer un larmoiement par hypersécrétion (voir plus haut).
Dans un deuxième temps, il faut entreprendre le bilan de l’hypo-excrétion. Le sondage lacrymal n’est plus possible simplement sans anesthésie. Le premier facteur limitant est la contention nécessaire à la qualité de l’examen. La momification doit donc être remplacée par une anesthésie générale (AG), éventuellement en ventilation spontanée à l’aide d’un masque facial.
L’indication de l’AG doit être appréciée en fonction :
– du risque évolutif du larmoiement :
–les larmoiements clairs sont liés à un obstacle méatique ou
canaliculaire ; ils sont dépourvus de tout risque infectieux ;
–les larmoiements avec sécrétions sont le fait d’obstacles
lacrymonasaux ; outre leur préjudice social, leur risque d’infection
est proportionnel à l’importance de la dilatation du
sac lacrymal.
– de l’âge de réalisation des principales chirurgies possibles :
–sondage lacrymal tardif et intubation au-delà de 1 an ;
–dacryocystorhinostomie externe : rarement avant 4 ans ;
–dacryocystorhinostomie endonasale : après 5 ans (en fait,
fonction de la largeur de la fosse nasale) ;
–lacorhinostomie : lorsque la croissance est terminée.
– du contexte général, des souhaits des parents, etc.
Le sondage lacrymal exploratoire sur table est la base de l’indication
opératoire :
– si après ce sondage, toutes les conditions nécessaires à la
chirurgie ne sont pas réunies, on réveille l’enfant et, à distance, le
bilan sera complété par imagerie et/ou avis complémentaires, etc. ;
– si toutes les conditions pour une chirurgie sont requises, le
geste sera réalisé au cours de cette même séance opératoire ;
– si la chirurgie retenue comporte un risque hémorragique, on
approfondira l’anesthésie générale pour la mise en place d’une
protection laryngée.
Schématiquement, l’opération comporte les séquences suivantes :
– en cas d’imperforation méatique simple : sondage ± conformateur
lacrymal ;
– en cas de sténose(s) canaliculaire(s) : sondage + intubation
le plus souvent bicanaliculonasale ;
– en cas de sténose lacrymonasale : sondage tardif ou intubation
poussée pour les sténoses muqueuses ; les intubations tirées
en allant récupérer la sonde dans la fosse nasale, par méthode de
Ritleng par exemple, sont indiquées pour les sténoses plus complexes
; la dacryocystorhinostomie est réservée en cas d’échec des
précédentes méthodes.
E. Racy, B. Fayet
Les diagnostics différentiels de dacryocystite sont : amniocèle, amniotocèle, mucocèle congénitale, dacryocèle, dacryocystocèle, kyste lacrymal congénital, dilatation ou distension néonatale du sac lacrymal, sablier lacrymal, etc.
L’apex de la distension se situe sous le tendon canthal médial. Le creux sus-tarsal n’est pas comblé. Sa coloration est bleutée pseudoangiomateuse. La palpation digitale perçoit un caractère liquidien rénitent. Aucun reflux de mucus ne se produit par les canalicules. L’imagerie (scanner, imagerie par résonance magnétique [IRM]) ne semble pas indispensable au diagnostic.
–Méningo-encéphalocèle, mais la tuméfaction part de la
région frontale et comble le creux sus-tarsal.
– Pathologie nasale congénitale (hétérotopie) : lorsque la poche
nasale descend aussi bas, le cornet inférieur est plaqué contre la
paroi latérale et non contre la paroi médiale.
–Guérison spontanée : elle s’observe dans 80 % des cas et au
cours du premier mois.
– Massage énergique du sac, méthode ancestrale.
– Sondage lacrymal efficace pour certains, douteux pour
d’autres car sur une paroi nasale aussi médialisée, l’axe de la
sonde a peu de chance de transfixier la muqueuse.
Instillation de bactériostatiques. Les parents sont prévenus des risques potentiels (changement de couleur).
–Surinfection (20 % ) : la coloration bleutée de la tuméfaction
est remplacée par une couleur rouge. La température est normale.
L’évolution vers une fistulisation sacculo-cutanée est exceptionnelle.
Bien que spectaculaire, le pronostic esthétique est excellent.
– Détresse respiratoire néonatale : elle est l’apanage des formes
bilatérales et extensives. Jusqu’à l’âge de 2 ans, l’enfant est un respirateur nasal exclusif et le flux d’air passe à 95 % par la partie
basse de la fosse nasale. Cette double obstruction est comparable
à celle d’une atrésie des choanes.
–Marsupialisation de la « poche nasale » : permet d’aspirer le
contenu (mucus très dense). La poche canthale s’aplatit immédiatement.
Cette ouverture nasale supprime les conditions de l’hypercontinence
de la valve canaliculosacculaire. Ce geste peut s’effectuer
avec une simple prémédication et un anesthésique topique
de la muqueuse nasale. Les récidives après « mucosectomie » sont
rares.
– Fistule du sac lacrymal : simple observation.
[1] Denis D, Saracco JB, Triglia JM. Nasolacrimal duct cysts in congenital dacryocystocele. Graefes Arch Clin Exp Ophthalmol 1994 ; 232 : 252-4.
[2] Fayet B, Racy E, Charrier JB. Neonatal pathologies of the lacrimal system. J Fr Ophtalmol 2009 ; 32 : 352-6.
M. Robert
La première question à poser devant une anomalie apparente de taille des yeux ( « cet oeil semble plus petit que l’autre » , ou « ces yeux semblent trop grands/trop petits » ) est de savoir s’il s’agit d’une anomalie oculaire ou orbitaire.
Les microphtalmies et les buphtalmies (anomalies de taille du globe oculaire) sont fréquentes ; les exophtalmies et énophtalmies (anomalies de position du globe dans l’orbite) sont plus rares. L’examen clinique permet généralement de répondre à cette question.
C’est le cas le plus fréquent. En cas d’asymétrie entre les deux yeux, s’agit-il d’une buphtalmie de l’oeil le plus grand ou d’une microphtalmie de l’oeil le plus petit ? Dans les cas extrêmes, cette question peut sembler superflue ; il faut toutefois faire attention à ne pas méconnaître une buphtalmie modérée d’un oeil alors que l’autre est microphtalme, le glaucome d’un oeil et la microphtalmie de l’oeil adelphe pouvant résulter tous deux d’une dysgénésie du segment antérieur. L’examen clinique, systématique, complété si besoin (ou si indication à une chirurgie) par un examen sous anesthésie générale, permet de collecter l’ensemble des paramètres biométriques (diamètre cornéen, pachymétrie, profondeur de la chambre antérieure, longueur axiale), de les reporter sur des courbes de croissance spécifiques en fonction de l’âge et de conclure. Il permet aussi de retrouver des signes en faveur d’un des diagnostics associés à ces diagnostics.
Le diagnostic étiologique est d’abord clinique : microphtalmie syndromique ou non syndromique ; microphtalmie entrant dans le cadre d’un colobome ; microphtalmie entrant dans le cadre d’une persistance de la vascularisation foetale ; microphtalmie entrant dans le cadre d’une dysgénésie du segment antérieur ; microphtalmie vraiment isolée.
La démarche est guidée par le type de microphtalmie et l’examen pédiatrique. Le diagnostic de microphtalmie repose sur la constatation d’une longueur axiale inférieure à la norme pour l’âge à l’échographie. Dans la microphtalmie pure, segment antérieur et segment postérieur sont plus petits. Dans la microphtalmie postérieure, le segment antérieur est normal.
Le diagnostic de microphtalmie pure (= nanophtalmie) est rare et se pose exceptionnellement chez le nourrisson ; en ce cas, l’oeil est harmonieusement petit, à l’exception du cristallin dont la taille est moins diminuée proportionnellement que le reste du globe, et l’oeil n’est pas malformé. À l’inverse, le diagnostic de microphtalmie postérieure, avec un segment antérieur sensiblement normal, souvent asymétrique, est plus fréquent.
En cas de microphtalmie bilatérale et assez symétrique, la priorité sera donnée au développement d’une fonction visuelle, en limitant au maximum la part fonctionnelle de l’amblyopie de l’oeil le plus atteint grâce à un programme d’occlusion séquentielle initialement alternée. L’aspect esthétique passe alors au second plan. En cas de microphtalmie très asymétrique avec un oeil très microphtalme et un oeil beaucoup moins atteint, et/ou en cas d’échec évident d’une amblyothérapie, on peut proposer des interventions orbitaires (injections de graisse autologue ou interposition de lame osseuse rétrooculaire) à partir de l’âge de 3 ans. Une autre option thérapeutique consiste en des programmes d’expansion orbitaire par prothèse de distraction, avec mise en place de conformateurs de taille croissante d’abord munis d’ergots de contention, puis avec mise en place d’une prothèse de recouvrement conventionnelle. Cette technique permet à la fois d’agrandir la cavité orbitaire, d’approfondir les culsde- sac conjonctivaux et d’allonger la fente palpébrale. Il n’est alors généralement pas nécessaire d’intervenir chirurgicalement sur l’orbite. Un tel programme condamne la fonction visuelle de l’oeil traité et ne doit donc être proposé que dans les cas sus-mentionnés ; il convient en revanche de débuter ce programme dès que possible, à savoir dès les toutes premières semaines de vie, si l’on veut obtenir les meilleurs résultats, mais encore une fois, les indications de cette chirurgie lourde sont à discuter.
Le glaucome congénital constitue une urgence chirurgicale ; en règle générale, le nourrisson sera examiné sans délai sous anesthésie générale afin de confirmer formellement le diagnostic et de l’opérer. Les cas de buphtalmie sans glaucome sont exceptionnels chez le nourrisson : les myopies extrêmes des collagénopathies ne donnent pas immédiatement un aspect de buphtalmie ; les buphtalmies sans glaucome de la neurofibromatose de type 1 (NF1) se constituent plus tardivement et sont d’ailleurs plus rares que les glaucomes congénitaux associés à la NF1. Il faut ici rappeler que le glaucome dit « congénital » se révèle non exceptionnellement de manière retardée après l’âge de 1 an, qu’alors la buphtalmie est moins évidente et que les dommages sur les cellules ganglionnaires sont d’autant plus rapides.
En cas d’exophtalmie du nouveau-né, parfois diagnostiquée chez le nourrisson, qu’elle soit uni- ou bilatérale, le premier diagnostic à évoquer est une craniofaciosténose. Il s’agit le plus souvent d’une plagiocéphalie antérieure en cas d’exophtalmie unilatérale modérée ou de craniosténoses syndromiques en cas d’exophtalmie bilatérale parfois majeure. Le diagnostic est une urgence ; il passe par la clinique et l’imagerie, avec réalisation d’un scanner cérébral.
La prise en charge des craniofaciosténoses est multidisciplinaire. En cas d’exophtalmie, la protection de la cornée est essentielle : application d’agents mouillants et de pommade la nuit ; tarsorraphies latérales protectrices, notamment en cas d’antécédent de luxation avérée ou de risque de luxation du globe oculaire en avant des paupières. En cas de luxation, qui expose la cornée et étire le nerf optique, la réintégration du globe oculaire doit être immédiate, en appuyant avec deux doigts sur la sclère de part et d’autre de la cornée.
Plus rarement, une exophtalmie du nourrisson, souvent pulsatile, peut résulter d’une encéphalocèle orbitaire par défect de la paroi orbitaire ; là encore, l’imagerie précise l’étendue de l’atteinte, qui peut s’inscrire dans le contexte d’une NF1 lorsque l’atteinte est postérieure.
En cas d’exophtalmie acquise et progressive du nourrisson, un processus tumoral doit être recherché : rhabdomyosarcome, métastase de neuroblastome (syndrome de Hutchinson), infiltration orbitaire par une leucémie aiguë, histiocytose, gliome du nerf optique (pour mémoire, l’orbitopathie dysthyroïdienne est exceptionnelle chez le petit enfant). Les causes infectieuses (cellulite rétroseptale, voir chapitres 6.4 et 27-14) posent rarement des problèmes diagnostiques. En première intention, une imagerie est indiquée en urgence et, en cas de diagnostic non suspecté sur l’imagerie, un frottis sanguin est proposé.
Les enophtalmies du nourrisson sont généralement constitutionnelles et font partie du tableau des syndromes de fibrose des muscles oculomoteurs. Il existe une restriction de la motilité oculaire, souvent un regard fixé vers le bas, un ptosis puis un torticolis vers l’arrière. Le syndrome de Stilling-Türk-Duane peut aussi s’accompagner d’une enophtalmie notable. Les interventions, en relâchant les muscles fibrosés, auront pour but de diminuer aussi l’enophtalmie. Plus rarement, une enophtalmie chez un nourrisson peut résulter de modifications du cadre osseux orbitaire.
Les enophtalmies acquises du nourrisson sont exceptionnelles ; il n’existe pas de vraie enophtalmie chez les nourrissons avec syndrome de Claude-Bernard-Horner. Les enophtalmies vraies du nourrisson peuvent soit s’intégrer dans un cadre de malformation du cadre osseux orbitaire, soit exceptionnellement résulter de métastases de neuroblastome.
P. Wary, D. Denis
À la naissance, un bébé né à terme est capable d’avoir d’une fixation visuelle. L’absence de fixation, ou de contact visuel est d’un motif de consultation très précoce dans un contexte de stress familial, soit à la demande des parents eux-mêmes, soit à la demande d’un pédiatre, d’un médecin généraliste ou souvent d’un orthoptiste.
L’enjeu du bilan initial est d’assurer un bilan clinique le plus complet possible pour poser un diagnostic de certitude en s’appuyant souvent sur des explorations complémentaires cliniques et paracliniques. L’ophtalmologiste doit être capable d’évaluer la profondeur du déficit sensoriel, chez un très jeune enfant immature sur le plan fonctionnel.
C’est la première étape de cette prise en charge :
– relever tous les antécédents personnels de l’enfant :
– au cours de la grossesse : infection maternelle au cours de la
gestation, traitement médicamenteux, traumatisme, hypoxie ;
– pendant l’accouchement ;
– au cours de la période périnatale : prématurité, lésions
neurologiques (hémorragie intraventriculaire, hydrocéphalie,
souffrance cérébrale, etc.), anomalies chromosomiques.
– relever les antécédents familiaux oculaires et généraux,
notamment l’existence de pathologie familiale génétique connue
dans la fratrie et chez les ascendants, la notion de consanguinité.
L’ophtalmologiste sera attentif à toute pathologie oculaire organique familiale telle que : les maladies dégénératives de la rétine ou du nerf optique comme l’achromatopsie ; l’existence de rétinites pigmentaires, de maladie de Leber, de cataracte congénitale, de glaucome congénital, d’albinisme et ou d’aniridie, avec la notion d’une photophobie marquée chez un membre de la famille.
S’il est très difficile de quantifier l’importance d’un déficit visuel chez un nouveau-né, le ressenti parental sur la qualité de la perception visuelle de nouveau-né dans sa vie quotidienne est un élément clé de l’orientation, notamment sur le caractère évolutif du trouble vers une amélioration progressive ou non.
L’ophtalmologiste doit pouvoir évaluer la qualité de la fonction
visuelle et son évolution en comparant le comportement de
l’enfant par rapport aux normes développementales admises. En
d’autres termes, il faut vérifier les grandes étapes du développement
de la fonction visuelle :
– moins de 1 heure après la naissance, l’enfant a les yeux
grand ouverts et donne déjà l’impression de regarder, et peut
de manière fugace suivre une cible en mouvement lent. Au cours
des premiers jours de vie, l’enfant regarde sa mère et il existe
des scènes d’échanges comme l’observation princeps de Meltzoff
d’imitation néonatale ;
– de 0 à 2 mois, l’enfant fixe de façon soutenue (l’enfant à un
regard aimanté) et est capable de reconnaître le visage maternel
dès le 10e jour de vie ;
– à 2 mois, le sourire apparaît annonçant l’existence d’une relation
sociale interactive fondée sur une perception visuelle établie ;
– à 4 mois, l’élaboration de la fonction visuelle offre une coordination
entre le système visuel et le système de préhension, dont
le raccourci erroné est parfois employé avec l’expression « coordination
oeil-main » qui permet à l’enfant au 5e mois d’attraper un
objet. Au 8e ou 9e mois, son champ visuel élargi lui permet de
percevoir des objets plus lointains, il commence à s’intéresser à
son environnement.
En cas de déficit de l’attention, chez un nouveau-né qui ne fixe pas, il faut rechercher des signes d’appel de basse vision : photophobie, altération du réflexe photomoteur, signe de Franceschetti, signe de l’éventail, mouvements d’errance oculaire (roving ou drifting), nystagmus, déviation oculaire.
L’examen alors orienté va rechercher la cause, en suivant un protocole classique d’examen, à savoir un premier temps d’examen sans dilatation pupillaire, vérifiant la motricité intrinsèque et extrinsèque, s’aidant de la normalité du nystgamus optocinétique pour éliminer un éventuel désordre oculomoteur, suivi d’un temps capital d’examen biomicroscopique sous dilatation incluant la mesure de la réfraction, l’analyse des milieux transparents et l’examen détaillé du fond d’oeil, grandement aidé par une exploration en imagerie grand champ type RetCam™.
La réalisation d’examens complémentaires notamment d’explorations électrophysiologiques (électrorétinogramme, potentiels évoqués visuels) est dictée par la clinique, ainsi que par l’avis partagé des pédiatres spécialisés. L’ensemble des données cliniques et paracliniques permet d’aboutir le plus souvent à un diagnostic dont les principaux sont résumés dans le tableau suivant (Tableau 5-1).
Même s’il existe des signes cliniques très caractéristiques, il est absolument nécessaire d’avoir un diagnostic correct, documenté par des examens complémentaires de confirmation (électrophysiologie, biologie moléculaire, neuro-imagerie, etc.) avant de retenir un diagnostic d’affection particulière mettant en jeu le pronostic de la fonction visuelle. L’ophtalmologiste se doit de garder à l’esprit que dans ce contexte très anxiogène, l’annonce d’une malvoyance a un effet dévastateur au niveau familial. Il ne faut donc jamais annoncer un diagnostic présumé lors du premier contact clinique sans preuve.
Tableau 5-1 – Classification des principales étiologies d’un trouble du comportement visuel du nourrisson.
ERG : électrorétinogramme ; FO : fond d’oeil ; IRM : imagerie par résonance magnétique ; LAF : lampe à fente ; PEV : potentiel évoqué visuel.
P. Lebranchu, A. Péchereau
Lorsqu’un enfant est adressé en consultation car « il a les yeux qui bougent » , il convient dans un premier temps de faire préciser ce que les parents entendent par cela. En particulier, certains parents peuvent utiliser cette expression en cas de déviation incomitante des axes oculaires, remarquant une anomalie du mouvement d’un oeil par rapport à l’autre dans une direction : paralysie de l’oblique supérieur, syndromes de Brown ou de Duane, etc.
Cependant dans la plupart des cas, les parents souhaitent nous faire comprendre que les yeux de leur enfant bougent « spontanément » , y compris pendant la fixation. L’interrogatoire relèvera les antécédents personnels de l’enfant (grossesse ; terme et poids de naissance ; circonstance de l’accouchement ; évolution de la croissance, des apprentissages). Les antécédents familiaux sont essentiels. Les circonstances d’apparition de ces mouvements anormaux seront précisées, et des questions orientées seront posées (contact visuel chez le petit enfant, comportement dans l’obscurité ou au contraire en pleine lumière). Un examen clinique complet doit être réalisé avant de programmer (éventuellement) des examens paracliniques.
L’examen clinique s’attachera à faire la différence entre un nystagmus et les autres mouvements oculaires anormaux. Le nystagmus est un mouvement de va-et-vient, comportant systématiquement au moins une phase lente. Il faut le décrire (horizontal, vertical, rotatoire ou combiné) dans la position primaire, dans les autres champs du regard, en monoculaire et binoculaire. Le port de tête naturel est noté, en particulier s’il existe une position préférentielle de torticolis. L’acuité visuelle sera estimée selon l’âge de l’enfant, avec en particulier des signes d’amblyopie. La poursuite des lumières et des formes structurées peut être réalisée dès les premiers mois de vie, donnant au moins une indication sur les capacités sensorielles de l’enfant. Un test à l’écran recherchera des signes de strabisme précoce en : ésoou exotropie, déviation verticale dissociée, absence de stéréoscopie, etc. L’examen sera complété par une analyse du segment antérieur avant dilatation (iris transilluminable ?), suivi d’un examen complet du cristallin et de la rétine après dilatation. La cycloplégie doit être systématique, idéalement dès la première consultation.
Le nystagmus manifeste latent est typiquement monoculaire, déclenché par l’occlusion d’un oeil. Il signe la précocité du strabisme, dont la déviation peut ne pas être visible en cas de microstrabisme.
Si le nystagmus est présent spontanément, il peut être expliqué
par des anomalies de l’examen ophtalmologique : opacité cornéenne,
aniridie, cataracte congénitale, albinisme, anomalie précoce
de la rétine ou du nerf optique. En cas d’absence de cause évidente,
des examens paracliniques sont nécessaires : ERG, PEV et IRM.
– En cas de normalité des examens, le diagnostic de nystagmus
idiopathique est probable.
– En cas d’ERG anormal, il faudra évoquer une achromatopsie,
une cécité nocturne stationnaire congénitale, une dystrophie rétinienne (en particulier une amaurose congénitale de Leber en cas
d’atteinte précoce) ou une ciliopathie.
– En cas d’ERG normal mais d’altération des PEV, il faudra penser
aux maladies métaboliques et mitochondriales ou aux ataxies
spinocérébelleuses.
– Une IRM anormale peut révéler des pathologies tumorales
(gliome du chiasma, etc.), des lésions néonatales (leucomalacie
périventriculaire), des malformations (Chiari, cervelet, etc.) ou des
signes de leucodystrophie.
Rarement, l’enfant dans la première année de vie présente un spasmus nutans, pathologie caractérisée typiquement par un nystagmus pendulaire (dysconjugué), un hochement de la tête et un torticolis (ce dernier signe étant inconstant). Un strabisme est fréquemment associé. L’examen du fond d’oeil et le bilan neurologique (ERG, PEV et IRM) sont normaux dans la forme idiopathique qui évolue spontanément vers la guérison du syndrome.
Contrairement au nystagmus, l’opscolonus-myoclonus est composé de mouvements oculaires rapides (pas de phase lente). Ils se présentent comme des bouffées de saccades rapides, multidirectionnelles et de grandes amplitudes. Cette pathologie doit systématiquement faire rechercher un syndrome paranéoplasique (particulièrement un neuroblastome par une IRM corps entier) ou plus rarement une encéphalite virale.
P. Lebranchu
Lorsqu’un clinicien est confronté à une anomalie des pupilles de l’enfant, il faut qu’il applique une démarche diagnostique rigoureuse pour identifier les rares causes potentiellement très graves au milieu d’une variété de diagnostics bénins.
L’interrogatoire s’attache à décrire le trouble pupillaire, la circonstance la plus fréquente étant l’anisocorie. Il faut s’enquérir alors de l’ancienneté et des circonstances de survenue ayant amené à sa découverte : atteinte congénitale, souvent de découverte fortuite, ou atteinte récente et souvent acquise. Existe-t-il un caractère fluctuant, et des circonstances particulières de révélation de l’anisocorie ? En particulier celle-ci est-elle plus visible à l’obscurité (typiquement lors de l’allaitement en pleine nuit) ou en ambiance très lumineuse ? La notion d’antécédent traumatique cervical ou claviculaire est importante.
Devant une anisocorie, il est impossible d’emblée de savoir si la pupille pathologique est celle en myosis ou l’autre en mydriase. La première étape du diagnostic est de comparer la taille et la forme des deux pupilles dans deux ambiances lumineuses différentes : en pleine lumière et à l’obscurité. Le diamètre des pupilles doit alors être estimé, idéalement à l’aide d’un gabarit. La pupille pathologique est celle qui présente la moins bonne cinétique, c’est-à-dire celle présentant la plus petite différence de diamètre entre l’obscurité et la lumière.
Une fois la pupille pathologique identifiée, il faut s’attacher à
rechercher des signes associés :
– mesure de la taille des pupilles en convergence ;
– recherche d’un déficit du réflexe pupillaire afférent relatif
(signe de Marcus-Gunn) ;
– examen attentif des paupières, en particulier à la recherche
d’un ptosis ;
– examen complet de la motricité oculaire, avec motilité et
déviométrie dans les 9 directions du regard ;
– examen de l’iris à la lampe à fente ;
– examen du fond d’oeil.
À l’issue de ces examens, quatre circonstances cliniques peuvent
être identifiées :
– anomalie de la forme des pupilles ;
– anisocorie identique à la lumière et à l’obscurité : anisocorie
physiologique ;
– anisocorie plus importante à la lumière : mydriase pathologique
;
– anisocorie plus importante à l’obscurité : myosis pathologique.
Parmi les anomalies de la forme de la pupille, beaucoup sont congénitales et de diagnostic précoce. Le colobome irien devra faire rechercher d’autres anomalies ophtalmologiques (colobome postérieur) ou généraux (syndrome CHARGE pour Coloboma, Heart defect, Atresia choanae, Retarded growth, Genital anomalies, Ear anomalies). La membrane pupillaire est une pathologie bénigne, mais parfois amblyogène. Devant une correctopie, il faudra penser à une atteinte traumatique, une subluxation cristallinienne (parfois spontanée) ou à des malformations du segment antérieur (Axenfeld-Rieger, etc.). Les anomalies acquises sont dominées par les synéchies iridocristaliniennes des uvéites pédiatriques, en particulier en cas d’arthrite juvénile idiopathique.
L’anisocorie physiologique est un diagnostic très fréquent d’anomalie pupillaire. La différence de taille des pupilles est constante, en général de l’ordre du millimètre. Cependant pour des raisons géométriques, les parents ne la remarquent qu’à l’obscurité, lorsqu’une augmentation de 1 mm du diamètre pupillaire provoque une augmentation de surface pupillaire beaucoup plus importante. On estime que 17 % des enfants présentent une différence de taille de pupille comprise entre 0,4 et 0,9 mm, 1,5 % entre 1 et 1,4 mm et 0,8 % supérieure à 1,4 mm [1].
Lorsqu’un enfant présente une mydriase pathologique, les tests à la pilocarpine recherchent des causes identiques à celles des adultes. Une contraction pupillaire à la pilocarpine diluée à 0,125 % oriente vers une pupille d’Adie, circonstance rare en pédiatrie. Une contraction pupillaire à l’instillation de pilocarpine 1 % oriente vers une atteinte de la IIIe paire crânienne, nécessitant une neuro-imagerie en urgence pour éliminer une cause compressive aiguë (anévrisme ?). Cette circonstance est rare sans trouble palpébral (ptosis) ou oculomoteur associé. Enfin si la mydriase ne réagit pas à l’instillation de pilocarpine 1 % , il s’agit d’une mydriase pharmacologique, de loin la cause la plus fréquente en ophtalmopédiatrie. L’interrogatoire s’attachera à rechercher le facteur causal, souvent un contact médicamenteux (atropine, scopolamine, nébulisation d’ipratropium, etc.) ou végétal (en particulier avec les plantes ornementales comme le datura, etc.).
Certains myosis pathologiques peuvent être secondaires à des douleurs oculaires, en particulier en cas d’iridocyclite. Mais la principale cause à éliminer est un syndrome de Claude-Bernard-Horner (CBH). La recherche de signes associés suffit souvent à poser le diagnostic : (1) myosis, (2) ptosis par atteinte du muscle de Müller, (3) ptosis inversé par élévation de la paupière inférieure, (4) pseudo-énophtalmie, (5) anhidrose. S’il s’agit d’une atteinte congénitale, l’hétérochromie irienne signe en général l’ancienneté de la dénervation. L’atteinte acquise nécessite une prise en charge pédiatrique pour faire le bilan d’un éventuel traumatisme (fracture claviculaire, cervicale ; dissection carotidienne) ou rechercher une atteinte tumorale, en particulier pour éliminer un neuroblastome cervical. Ainsi en cas de CBH sans cause évidente, une IRM thoracocervicale et encéphalique sera en général recommandée. L’échographie cervicale pourrait constituer une alternative dans les cas douteux, ne présentant pas de signes associés. Certains myosis pathologiques peuvent être totalement isolés et il est alors difficile de confirmer cliniquement un CBH. Le diagnostic peut alors être aidé par les tests aux collyres. La cocaïne provoque une mydriase des pupilles normales, mais n’a pas d’effet sur le myosis du CBH. L’apraclonidine (Iopidine®) est théoriquement contre-indiquée chez l’enfant, en raison du risque de dépression respiratoire avant l’âge de 1 an. Cependant la potentielle gravité du diagnostic associé (neuroblastome) et la difficulté à se fournir en collyre à la cocaïne peuvent faire discuter son utilisation chez l’enfant plus grand. Dans tous les cas, une surveillance sera recommandée.
[1] Silbert J, Matta N, Tian J, et al. Pupil size and anisocoria in children measured by the plusoptiX photoscreener. J AAPOS 2013 ; 17 : 609-11.
S. Defoort-Dhellemmes
Un bilan électrophysiologique est pratiqué :
– chez le nouveau-né ou le nourrisson qui a :
–un comportement de malvoyance ou de cécité ;
–un nystagmus précoce.
– chez l’enfant d’âge scolaire dont l’acuité visuelle est basse,
que ce soit :
–une baisse d’acuité visuelle (notion d’acuité visuelle normale
auparavant) ;
–une amblyopie congénitale non diagnostiquée dans la
petite enfance (avec ou sans nystagmus de faible amplitude).
– à tout âge :
–devant un comportement évoquant :
–une anomalie du champ visuel (enfant maladroit, qui se
cogne ou se bute) ;
–une héméralopie (l’enfant se cramponne à ses parents
dans la semi-obscurité) et/ou une gêne au changement
d’éclairage ;
–une photophobie importante.
–dans le cadre du bilan d’une maladie générale ou de symptômes
généraux (céphalées, surdité, retard mental, régression
des acquis) pouvant s’associer à une atteinte de la rétine et
des voies visuelles ;
–en cas d’antécédents familiaux de rétinopathie ou de neuropathie
héréditaire.
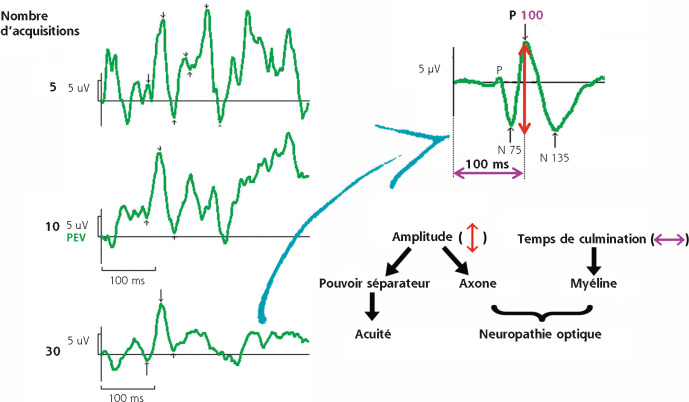
Les potentiels évoqués visuels (PEV) sont la réponse du cortex visuel à une stimulation visuelle brève et répétitive.
En clinique, deux types de stimuli sont utilisés : des damiers noirs et blancs, qui stimulent les fibres visuelles d’origine maculaire, et des flashes.
L’examen se fait en ambulatoire, sans anesthésie ni prémédication. L’enfant n’est pas à jeun et ne doit pas sucer de tétine. Ses pupilles ne sont pas dilatées. Une correction optique totale est nécessaire pour les PEV par damiers, pas pour les flashes.
Selon son âge, l’enfant est face au stimulateur, assis ou tenu par un adulte dans une position confortable, en prenant garde de ne pas toucher aux électrodes ni aux fils, dans une pièce dépourvue d’élément distracteur, en ambiance mésopique faible (fig. 5-4).

Fig. 5-4 PEV : généralités, conditions d’examen, installation (a, b).
a. PEV damier, oeil gauche. Une mire animée est présentée en cours d’examen quand l’attention de l’enfant se relâche (c).
Par des électrodes, non traumatisantes, positionnées au niveau du scalp au moyen d’une pâte conductrice adhésive, après l’avoir dégraissé avec une pâte légèrement abrasive (fig. 5-5).
L’événement stimulant est :
– par défaut, le renversement du damier : chaque carré blanc
devient noir et chaque carré noir devient blanc ;
– en cas de nystagmus, une succession d’apparitions-disparitions
du damier. Le damier alterne avec un écran uniformément
gris de même luminance globale que le damier.
Deux types de damiers sont utilisés. Ils sont définis par leur fréquence spatiale (nombre de couples carré noir-carré blanc par degré d’angle) ou par la valeur angulaire de l’élément stimulant : le damier 60′ et le damier 15′. Des damiers plus petits (30′ et 7′) peuvent être ajoutés au protocole pour étudier plus précisément les voies maculaires (vidéos 5-1 et 5-2 et fig. 5-6).
La fréquence temporelle de la stimulation est basse (< 2 Hz) :
– les PEV obtenus à chaque événement stimulant sont appelés
PEV transitoires car les neurones reviennent à leur état d’équilibre
entre chaque stimulation ;
– le tracé final qui est analysé résulte du moyennage de plusieurs
PEV transitoires (fig. 5-7).
Vidéo 5.1 - PEV par renversement de damier
Vidéo 5.2 - PEV ON-OFF

Fig. 5-5 Positionnement et branchement des électrodes.
a. Une électrode de référence sur le front (Fz) est connectée à la borne négative de l’amplificateur. b. Une électrode neutre est reliée à la terre. c. Une électrode active est branchée à la borne positive en regard de la scissure calcarine (Oz). d. Plusieurs électrodes actives sont branchées à la borne positive en regard de la scissure calcarine, des lobes occipitaux droit (O2, O4) et gauche (O1-O3) et parfois en pariétal. e. Quelques exemples d’électrodes : l’ISCEV recommande les cupules en argent chloruré ou des disques plaqués or. Leur impédance doit être inférieure à 5 kΩ et stable pendant tout l’examen.

Fig. 5-6 PEV par damiers 60′ et 15′.
a, b. Damier 60′. Fréquence spatiale basse (0,5 cycle/degré). Chaque carré est vu sous un angle de 60. Stimule la région périfovéolaire. c. Damier 15′. Haute fréquence spatiale (2 cycles/degré). Chaque carré est vu sous un angle de 15′. Stimule la zone fovéolaire. C’est avec ce stimulus que l’amplitude du PEV est la plus grande.
La méthode d’examen rapide fait appel à des stimuli à haute fréquence
temporelle (5 à 15 Hz) :
– plusieurs tailles de damiers sont présentées en une dizaine
de secondes. Chaque série de test est présentée au moins
5 fois ;
– la stimulation commence avec la présentation d’un damier
de grande taille qui diminue rapidement de façon quasi continue.
Chez l’enfant normal, lorsque la fréquence spatiale augmente, l’amplitude de la réponse augmente jusqu’à atteindre un maximum puis décroît rapidement jusqu’au niveau du bruit. L’acuité visuelle est évaluée à partir de la taille du plus petit damier pour laquelle une réponse est obtenue (vidéo 5-3 et fig. 5-8).
Vidéo 5.3 - PEV par balayage - Stimulus
Les flashes sont des stimulations lumineuses de durée brève (< 5 ms), achromes (flashes blancs) de luminance égale à 3 cd.s/m2, et de fréquence 1 Hz. Ils doivent couvrir une surface de 20° (fig. 5-9).
Elle se modifie avec l’âge et constitue un indice de maturation des voies visuelles (myélinisation, séparation des voies parvo- et magnocellulaires) (voir chapitre 3.3).
L’électrorétinogramme (ERG) par flashes ou global est l’enregistrement de l’activité électrique de la rétine en réponse à une stimulation lumineuse.
Il permet à tout âge de diagnostiquer une dystrophie rétinienne et de préciser le niveau de l’atteinte : système photopique et/ou scotopique, photorécepteurs et/ou couches internes de la rétine.
L’examen requiert la participation de 2 à 3 adultes.
Il se déroule dans une pièce qui peut être totalement obscurcie, en ambulatoire, sous simple anesthésie topique, parfois associée à une sédation ou rarement sous anesthésie générale.
L’enfant n’est pas à jeun. Le petit enfant est maintenu couché, parfois par un matelas coquille, ou assis dans un siège bébé ou sur les genoux d’un adulte.
Ses pupilles sont dilatées (plus l’éclairement rétinien est étendu, plus l’ERG est ample).
Les électrodes actives, une par oeil, sont :
– des verres de contact cornéoscléraux avec blépharostat,
recommandés par l’International Society for Electrophysiology of
Vision (ISCEV) ;
– d’autres types d’électrodes (cornéennes, conjonctivales,
cutanées) : elles sont utilisées dans tous les cas par certaines
équipes et selon les circonstances par d’autres. Ces électrodes ont
pour avantage d’être plus faciles à poser et plus confortables. En
revanche, elles présentent l’inconvénient suivant : plus l’électrode
est loin de l’apex cornéen, plus l’ERG enregistré est d’amplitude
faible. Il devra être amplifié. Il n’y a aucun signal si l’enfant
ferme les yeux.
Les électrodes de référence sont :
– soit intégrées à l’électrode cornéenne (électrodes bipolaires
les plus stables électriquement) ;
– soit situées au niveau des deux tempes près de l’électrode
active correspondante.
L’électrode de terre est en position indifférente, au front en général (fig. 5-10).

Fig. 5-10 Électrodes.
a. Électrodes actives cornéosclérales qui donnent les meilleurs signaux ERG. Pupilles dilatées. b. Quelques types d’électrodes d’ERG. c. Électrodes cutanées. Les électrodes actives sont collées sur la peau au niveau de la paupière inférieure, en regard de la pupille. Si l’ERG enregistré est normal, il suffit, sinon il doit être contrôlé avec des électrodes cornéosclérales, un autre jour.
Les stimulations se font :
– dans une coupole, en champ total, dès que la taille et la
coopération de l’enfant le permettent ou quand on possède une
coupole inclinable pour examen couché ;
– avec un flash portable à diodes électroluminescentes (lightemitting
diode [LED]) dans le cas contraire.
Il faut respecter deux phases successives d’adaptation à l’obscurité puis à la lumière : c’est le seul moyen de distinguer les rétinopathies par atteinte du système photopique de celles du système scotopique (fig. 5-11).
C’est le même que chez l’adulte : il comprend six types de stimulation (Tableau 5-3).
Tableau 5-3 – Protocoles d’examens et résultats normaux*.
* Comment lire un électrorétinogramme (ERG) :
– séquences de stimulation : nomenclature ISCEV actuelle (en gras) : nom de l’examen (ERG), intensité lumineuse du stimulus
(par exemple : 3,0 cd.s/m2) et type d’ambiance lumineuse (scotopique ou photopique). Les dénominations anglo-saxonnes sont indiquées
en italique entre parenthèses ;
– sont présentés ici les résultats d’un ERG normal :
• enfant de 12 ans : ERG en coupole, protocole ISCEV ;
• enfant de 8 mois : ERG avec flashes à LED protocole adapté à l’enfant.
L’ISCEV admet des temps d’adaptation à la lumière et à l’obscurité plus courts que chez l’adulte et l’utilisation de stimuli colorés.
Nous effectuons donc après adaptation à l’obscurité de 10 minutes :
– une séquence de stimulation aux flashes bleus et/ou aux
flashes blancs atténués (0,01 cd.s/m2). Si la réponse est normale, on
passe à la stimulation suivante. Si la réponse est faible, on poursuit
l’adaptation 10 minutes supplémentaires (sauf en cas de conditions
difficiles), avant de réitérer la stimulation (les lumières bleues et
blanches de faible intensité ne désadaptent pas la rétine) ;
– puis une stimulation avec un flash blanc plus lumineux : flash
standard à 3 cd.s/m2 et flash plus puissant à 10 cd.s/m2 actuellement
recommandé car il serait plus sensible pour différencier les
rétinopathies. Il est aussi plus éblouissant.
La rétine est ensuite adaptée à la lumière durant 3 minutes.
Le plafond et les murs de la pièce sont éclairés de façon à
obtenir un niveau de luminance moyen comparable à celle d’une
coupole. On effectue :
– une stimulation par flashes blancs standard (3 cd.s/m2) :
« ERG cône » ;
– puis une stimulation à 30 Hz qui est en général la moins
bien tolérée : « ERG flicker » .
Ces stimulations suffisent à diagnostiquer les principales rétinopathies.
La réponse ERG comporte plusieurs déflexions dont les plus
importantes sont les deux premières :
– l’onde a, déflexion négative mesurée du pied de l’onde à la
ligne isoélectrique, correspond à la réponse des photorécepteurs
et
des cellules bipolaires OFF hyperpolarisés par la lumière ;
– l’onde b, déflexion positive mesurée du creux de la déflexion
négative au sommet de la déflexion positive, générée dans la
couche nucléaire interne, correspond essentiellement à la réponse
des cellules bipolaires ON dépolarisées par la lumière (tableau 5-3).
Remarque : l’examinateur doit surveiller et décrire précisément par écrit les conditions de l’examen qu’il réalise (PEV ou ERG) pour qu’il soit interprétable.

Fig. 5-11 Les deux phases de l’enregistrement de l’ERG chez un bébé.
a. Adaptation à l’obscurité 10 minutes (versus 20 minutes chez l’adulte et le grand enfant). b. Adaptation à la lumière 3 minutes (versus 10 minutes). (Source : Defoort-Dhellemmes S, Drumare I, Basset D. Électrorétinogramme chez l’enfant. In : Du signe clinique au diagnostic. Imagerie et exploration fonctionnelle de la vision. Bulletin de Sociétés Ophtalmologiques de France 2012, p. 80-97. Reproduction autorisée.)
G. Le Meur
Avant de nous questionner sur la vision d’un dyschromate, souvenons- nous qu’il faut, pour voir les couleurs, la combinaison de plusieurs éléments : des cônes fovéolaires fonctionnels, des voies visuelles et un cortex visuel efficients. Les cônes captent les signaux colorés grâce à trois couleurs principales puis codent l’information colorée captée pour la transmettre au cerveau via les voies optiques. Les messages reçus au niveau cortical sont analysés pour élaborer la sensation colorée. L’interprétation des informations corticales par d’autres régions du cerveau a pour conséquence que chacun perçoit les couleurs grâce aux trois caractéristiques fondamentales d’une couleur : la clarté (correspond à la luminosité d’un objet), la saturation (mesure la part de coloration de l’objet) et la tonalité (renseigne sur la teinte de la couleur). Le dichromate ne dispose pas des trois canaux normaux pour former les couleurs. Si le rouge manque, le sujet est appelé protanope ; si le vert manque, il est deutéranope (le plus fréquent) ; si le bleu manque (extrêmement rare), il est tritanope. Les dichromates voient donc leur environnement avec deux couleurs dominantes (habituellement le bleu et le jaune pour les deutéranopes), mais avec un grand nombre de nuances.
Rappelons-nous que la dyschromatopsie est d’origine génétique avec environ 8 % des hommes atteints à divers degrés et un peu moins de 1 % des femmes. Les pigments rouges et verts sont codés par le chromosome X et le pigment bleu est codé par le chromosome 7.
Les premières manifestations du trouble de la vision des couleurs apparaissent dans la vie courante. Chez l’enfant, c’est dans les situations de jeu qu’une anomalie de reconnaissance des couleurs peut être mise en évidence. Toutefois, la macula étant en formation et les proportions maculaires des différents cônes étant en variation, il faut une certaine patience pour que le diagnostic complet soit possible. Il faut attendre environ les 6 ans de l’enfant, que la macula soit complètement formée, pour pouvoir faire un test des couleurs de qualité (voir chapitre 3.4) et donc un diagnostic précis du trouble de la vision colorée.
Les anomalies de la vision des couleurs auront toutefois des répercussions minimes sur la vie quotidienne. Il est, par exemple, noté une difficulté dans le repérage de la cuisson des viandes, dans l’appréciation de la maturité des fruits. Il faut être également méfiant dans la reconnaissance des champignons dont la cueillette seule sera contre-indiquée. La capacité à discriminer les objets en l’absence de couleurs fait que les dichromates peuvent être plus sensibles pour repérer des poissons gris bleuté dans la mer ou encore une proie camouflée dans un espace naturel. D’ailleurs, c’est cette caractéristique de perception des objets par leur luminance et non par leur couleur qui fait que les dichromates étaient ainsi recherchés durant la Seconde Guerre mondiale par les militaires, car plus à même de découvrir des personnes au milieu d’un camouflage, et plus particulièrement par les Japonais pour être pilote d’avion de nuit. Il est décrit que les patients atteints de dyschromatopsie auraient une vision nocturne meilleure du fait d’une sensibilité à la lumière supérieure. En pratique pour les enfants, il faut demander aux professeurs notamment de mathématiques que les devoirs ne soient pas faits avec un code couleur et les informer de la non-visibilité des pointeurs laser par les protanopes. C’est au moment du choix de l’orientation scolaire et professionnelle, qu’il faut être attentif car il y a des métiers interdits et d’autres peu recommandés, en sachant que parfois cela dépend des tests à réaliser pour être admissible et de la profondeur de la dyschromatopsie. Le mieux est de recommander au patient une bonne information quant aux exigences d’une profession avec une connaissance des éventuels tests préalables ainsi qu’une bonne connaissance du trouble de la vision des couleurs qu’il présente avant de faire un choix d’orientation.
Les métiers interdits sont :
– dans les transports :
–armée : pilote, conducteurs, mécanicien ;
–aviation civile ;
–marine marchande ;
–chemins de fer ;
–transport en commun.
– dans les métiers de la sécurité publique :
–police, gendarmerie ;
–douane ;
–pompier.
Il y a d’autres professions ou métiers où un trouble de la vision des couleurs peut être interdit ou non recommandé : électriciens et électroniciens ; démineurs ; pharmaciens ; métiers du textile et de l’imprimerie, de la peinture et de la photographie ; métiers de la lumière du théâtre, du cinéma et de la télévision ; métiers du tri dans l’alimentation. Certains métiers dans l’analyse de biologie médicale et certaines spécialités médicales (chirurgie par exemple du fait de la difficulté de l’évaluation et de la visualisation des hématomes et du sang) sont également non recommandés.
Il n’existe actuellement pas de traitement de la dyschromatopsie. Une aide pour la scolarité et la vie courante peut être apportée par le ColorADD®. C’est un système de pictogrammes pour identifier les couleurs qui peut ensuite être disposé sur les plans de bus, les étiquettes, les vêtements mais sa diffusion reste, pour le moment, anecdotique. Certains jeux vidéo commencent à être créés avec des supports adaptés. Toutefois, il reste encore beaucoup de codes de couleur dans les étiquettes alimentaires ; l’utilisation de diodes multiples ou de couleurs dans la signalisation reste encore prépondérante. Certains verres ou lunettes sont décrits pour filtrer la zone colorée non perçue chez les dichromates, mais ces dispositifs sont peu disponibles dans notre pays et, de ce fait, peu de retours ou peu d’études ne sont retrouvés quant aux bienfaits de ces dispositifs.
Diagnostic précis de la dyschromatopsie : 6 ans (macula terminée).
Métiers ou professions interdits ou non recommandés face à une dyschromatopsie.
Interdits :
dans les transports :
-
armée : pilote, conducteurs, mécanicien ;
aviation civile ;
marine marchande ;
chemins de fer ;
transport en commun.
dans les métiers sécurité publique :
-
police, gendarmerie ;
douane ;
pompier.
Autres métiers interdits ou non recommandés :
électriciens et électroniciens, démineurs, pharmaciens ;
métiers du textile et de l’imprimerie, de la peinture et de la photographie ;
métiers de la lumière du théâtre, du cinéma et de la télévision ainsi que les métiers du tri dans l’alimentation ;
métiers dans l’analyse de biologie médicale et certaines spécialités médicales (chirurgie par exemple du fait de la difficulté de l’évaluation et de la visualisation des hématomes et du sang).
M. -n. GeorGes, F. Malet, a. aziz-alessi
La contactologie chez l’enfant est une discipline à part entière en ophtalmopédiatrie, car elle permet de répondre à des exigences thérapeutiques particulières chez de très jeunes patients. La prescription de lentilles de contact, qui doit prendre en compte le caractère malléable et en cours de maturation de la vision de l’enfant (surtout en cas d’antécédent d’amblyopie), les potentiels effets indésirables graves du port de lentilles et le long avenir du porteur, est particulièrement exigeante. L’objectif de l’adaptation en lentilles de contact en ophtalmopédiatrie est d’optimiser la vision centrale et périphérique du jeune patient tout en respectant la surface oculaire. La demande d’équipement peut être suggérée par l’ophtalmologiste face à un contexte clinique le justifiant ou formulée par les parents ou par l’enfant directement. Le suivi d’un enfant porteur de lentilles doit être extrêmement rigoureux et prolongé.
Les lentilles permettent, lorsque l’adaptation est bonne, d’obtenir la meilleure image rétinienne possible [1], ce qui va contribuer à favoriser la maturation visuelle chez l’enfant et elles sont à ce titre un excellent moyen de lutte contre l’amblyopie (particulièrement en cas d’amblyopie unilatérale fonctionnelle). Par ailleurs, elles permettent l’amélioration de nombreux désordres accommodatifs et oculomoteurs retrouvés chez les enfants amétropes, ce qui concourt à optimiser leur développement psychomoteur.
Lorsque l’adaptation répond à une demande esthétique chez un enfant plus grand, son but est de favoriser l’épanouissement et d’améliorer sa qualité de vie. Elles permettent de contourner le retrait intempestif des lunettes avoué ou non par l’enfant qui peut mettre en danger une maturation visuelle encore fragile et aboutir parfois à une rechute d’amblyopie. Dans ce sens, les indications réfractives et esthétiques se rejoignent souvent.
Dans tous les cas, les lentilles rigides perméables aux gaz (LRPG) sont les lentilles de première intention quel que soit l’âge de l’enfant ; le port prolongé est incontournable qu’il soit programmé chez le bébé en particulier ou spontané chez l’enfant plus âgé. L’accoutumance est d’autant plus rapide que l’enfant est plus jeune.
Chez le très jeune enfant, les mesures anatomiques du globe oculaire sont parfois indisponibles et le recours à des tables de référence peut permettre l’adaptation qui sera empirique au début. L’utilisation d’un autokératomètre portable après cycloplégie est incontournable. L’examen au biomicroscope est réalisé en position du flying baby (fig. 5-12) avec l’aide des parents et d’un membre de l’équipe médicale et permet après pose de la lentille d’essai de s’assurer du positionnement de la lentille (lecture immédiate de l’image fluo en lumière bleue) et de sa bonne mobilité. Chez le jeune enfant, on devra prendre en compte le caractère très déformable de la cornée et le haut risque de ventousage de la lentille. Chez l’enfant plus grand, l’examen classique à la lampe à fente de la bonne adaptation de la lentille sera réalisé.
Les contrôles doivent être très rapprochés au début de l’adaptation
afin de :
– s’assurer du bon comportement visuel de l’enfant lors du port
de la lentille, de l’absence de pathologie infectieuse oculaire (en
raison du port nécessairement prolongé), de l’adaptation géométrique
de la lentille à la cornée du patient (mobilité) et de l’état de
l’équipement (état de la surface et absence de dépôts muqueux) ;
– vérifier la bonne compréhension par les parents des modalités
de nettoyage de la lentille (en cas de port continu un nettoyage
par Progent® ou Menilab® doit être réalisé à chaque retrait
de la lentille, idéalement de façon hebdomadaire) et la connaissance
des signes d’alerte devant entraîner le retrait de la lentille et
la consultation en urgence.
Par ailleurs, le suivi devra obligatoirement comporter des skiascopies répétées sous cycloplégique [2], avec et sans lentilles, dans le but d’ajuster la puissance réfractive de l’équipement, et des contrôles orthoptiques en cas de rééducation de l’amblyopie.
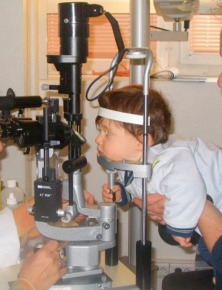
Fig. 5-12 Nourrisson de 6 mois en position d’examen à la lampe à fente.
Il s’agit de l’indication d’adaptation la plus fréquente à cet âge, dans le cadre d’une cataracte congénitale uni- ou bilatérale ou traumatique et en cas d’impossibilité ou dans l’attente d’une implantation intra-oculaire. L’adaptation doit être réalisée aussi précocement que possible après la chirurgie afin de permettre une maturation visuelle correcte, particulièrement en cas d’aphaquie unilatérale avec risque de strabisme et d’amblyopie majeurs sur l’oeil aphaque [3]. En cas d’aphaquie bilatérale, le port de lentilles de contact comparé à celui des lunettes améliore la vision périphérique de l’enfant et concourt à son développement psychomoteur général. Il permet d’améliorer la poursuite oculaire ainsi qu’un éventuel torticolis. Dans le cadre d’une aphaquie post-traumatique, on sera souvent confronté à un astigmatisme irrégulier en cas de plaie cornéenne associée et l’adaptation nécessairement par LRPG se fera après retrait des points cornéens qui peuvent entraîner un risque infectieux. Dans le contexte de l’aphaquie (congénitale ou acquise), chez le très jeune enfant jusqu’à l’âge de la marche, on prescrira une LRPG dont la correction sera adaptée à la vision de près ; il sera donc ajouté une addition de + 3,00 à la puissance calculée de la lentille [4].
L’anisométropie est susceptible de régresser avant 1 à 2 ans en raison du phénomène d’emmétropisation à cet âge. En cas d’anisomyopie importante, les lentilles de contact sont une indication privilégiée pour diminuer le risque d’amblyopie sur l’oeil le plus myope : c’est le cas lorsque la différence de puissance réfractive est grande entre l’oeil le plus myope corrigé par lentille et l’oeil adelphe moins myope, pouvant être corrigé par lunettes, est grande. Dans le suivi de l’enfant présentant une forte amétropie ou une importante anisométropie adaptées en lentilles, il convient de répéter les réfractions sous cycloplégique pour adapter au mieux la puissance réfractive de la lentille.
Chez l’enfant plus grand, de 2 à 7 ans, l’adaptation et le port de lentilles sont généralement plus difficiles à accepter que chez le très jeune enfant. Les manipulations de pose et de dépose (fig. 5-13) nécessitent une forte implication de l’enfant et de ses parents et cette complexité conduit à réserver les adaptations aux indications formelles, à but optique, dans cette tranche d’âge. En plus des indications pouvant être présentes dès un âge plus jeune (voir plus haut), on pourra indiquer le port de lentilles devant une amblyopie fonctionnelle récalcitrante (avec pénalisation du bon oeil).

Fig. 5-13 Enfant de 6 ans lors de la phase de pose d’une LRPG (a). Même enfant lors de la phase de dépose avec ventouse de manipulation (b).
Chez le préadolescent ou l’adolescent, l’adaptation en lentilles de contact peut être réalisée sur demande de l’enfant ou suggérée par l’ophtalmologiste. Elle nécessite une information répétée et complète de l’enfant et de ses parents et une forte motivation. L’adaptation en lentilles permet, dans cette tranche d’âge, de palier le retrait intempestif des lunettes.
Parmi les indications réfractives d’adaptation en lentilles de contact chez le grand enfant, on retrouve l’anisométropie le plus souvent myopique, l’astigmatisme unilatéral (notamment dans le cadre d’un kératocône), une hypermétropie unilatérale (plus rare), le nystagmus (le port de lentilles permet dans ce cas une meilleure stimulation de la vision périphérique et une amélioration subjective de l’acuité visuelle subjective).
Le port de lentille de contact en cas de strabisme convergent permet une diminution de l’effort accommodatif et donc de la convergence associée lors de la vision rapprochée. En présence d’une incomitance loin-près, il existe un intérêt au port de lentilles de contact d’autant plus que l’hypermétropie associée est importante (fig. 5-14). En cas de nystagmus, les lentilles de contact permettent de se rapprocher de la position de blocage (si elle existe) sans être confronté aux effets prismatiques des verres de lunettes et donc sans sortir du foyer optique de la correction puisqu’elles restent toujours centrées sur l’axe optique dans toutes les positions du regard.

Fig. 5-14 Amélioration de l’incomitance loin-près chez une enfant équipée en lentilles de contact progressives.
Regard en position primaire sans (a) et avec LRPG (b).
Chez l’enfant, les lentilles rigides perméables à l’oxygène sont les lentilles de première intention (diminution du risque infectieux, port prolongé possible, meilleure image rétinienne) [5]. Les lentilles souples peuvent être prescrites en cas d’astigmatisme mixte, d’intolérance vraie aux lentilles rigides (très rares). Dans le cas de la prescription de lentilles souples, on privilégiera des lentilles à renouvellement le plus fréquent possible (si possible jetables journalières), avec un rapport Dk/e élevé (silicone-hydrogels)1.
L’information sur les complications des lentilles et les précautions d’usage doivent être délivrées à l’enfant et ses parents à plusieurs reprises et notifiées par écrit dans le dossier.
1. Définition Dk/e (propriété de transmission de l’oxygène par une lentille) = le transport
d’oxygène à travers un matériau se fait par deux processus physiques différents
: la diffusion de molécules d’oxygène à travers la structure du matériau ;
la dissolution de l’oxygène dans le matériau. La diffusion est caractérisée par un
coefficient D (taux de diffusion). k est le coefficient de solubilité de l’oxygène dans
le matériau. La perméabilité est notée Dk. La perméabilité à l’oxygène dépend de
son épaisseur (e).
L’adaptation en lentilles de contact chez l’enfant engage la responsabilité de l’adaptateur qui ne doit en aucun cas la déléguer et nécessite un investissement important de l’enfant et de son entourage pour être réussie. Néanmoins les enfants s’avèrent être d’excellents porteurs, dont l’adaptation à l’équipement est rapide. Le but à long terme de l’adaptation en lentilles de contact chez l’enfant est de respecter les objectifs en termes de vision (recherche de la meilleure acuité visuelle corrigée) et de respect des tissus oculaires.
[1] Mintz-Hittner HA, Fernadez KM. Successful amblyopia therapy initiated after 7 years of age : compliance cures. Arch Ophthalmol 2000 ; 118 : 1535-41.
[2] Lavenant F. Cyclopégie. In : Roth A, Gomez A, Péchereau A. La réfraction de l’oeil : du diagnostic à l’équipement optique. Issy-les-Moulineaux : Elsevier Masson ; 2007, p. 98-100.
[3] Perucho-Martínez S, De-la-Cruz-Bertolo J, Tejada-Palacios P. Pediatric cataracts : epidemiology and diagnosis. Retrospective review of 79 cases. Arch Soc Esp Oftalmol 2007 ; 82 : 37-42.
[4] George MN. Lentilles chez l’enfant et l’adolescent. In : Malet F. Les lentilles de contact. Issy-les-Moulineaux : Elsevier Masson ; 2009, p. 673-709.
[5] Donshik PC, Ehlers WH, Anderson LD, Suchecki JK. Strategies to better engage, educate, and empower patient compliance and safe lens wear : compliance : what we know, what we do not know, and what we need to know. Eye Contact Lens 2007 ; 33 : 430-3 ; discussion 434.
E. Bui Quoc
Chez les enfants comme chez les adultes, les sollicitations visuelles sont multiples en ce troisième millénaire, que ce soient des stimulations en 2D ou en 3D, avec des livres, des écrans d’ordinateur, des tablettes, des consoles de jeux. Les parents se posent la question de la toxicité de la lumière chez l’enfant et peuvent poser cette question à l’ophtalmologiste. Ils veulent savoir si l’enfant « a le droit » d’utiliser tel ou tel écran, et combien de temps, etc.
La lumière est indispensable à la vision, mais elle peut également être délétère en particulier chez les enfants dont les yeux sont plus fragiles et sensibles à la toxicité de la stimulation lumineuse. La toxicité de la lumière dépend de la longueur d’onde de la lumière, c’est-à-dire de sa « couleur » [1].
La lumière visible ne constitue qu’une partie infime du spectre électromagnétique. Le spectre électromagnétique se compose d’un ensemble de rayonnements des rayons gamma, de haute énergie et de faible longueur d’onde, aux ondes radioélectriques de basse énergie et de grande longueur d’onde (fig. 5-15). Cette description ondulatoire est indissociable de la description corpusculaire qui divise la lumière en photons. L’étendue de la lumière visible est comprise entre les longueurs d’onde de 380 nm et 780 nm environ. Cette limitation du spectre visible est liée aux caractéristiques de sensibilité des pigments des photorécepteurs de la rétine, qui sont des protéines qui modifient leur structure sous l’influence de la lumière, ceci engendrant un signal électrique qui est la base du signal perceptif visuel.
En effet, la stimulation lumineuse des photorécepteurs situés dans la couche externe de la rétine est la première étape des phénomènes métaboliques qui engendrent le signal visuel. Les différents photorécepteurs (bâtonnets et cônes dits « bleus » , « verts » ou « rouges » ) possèdent des pigments dont la probabilité maximale d’absorption de la lumière varie selon la longueur d’onde.
Elle est de :
– 498 nm pour les bâtonnets ;
– 437 nm pour les cônes bleus ;
– 533 nm pour les cônes verts ;
– 564 nm pour les cônes rouges.
On distingue la lumière de faible longueur d’onde, dite « bleue » de haute énergie, la lumière de moyenne longueur d’onde dite « verte » d’énergie intermédiaire, la lumière de faible longueur d’onde dite « rouge » de basse énergie. Cette notion d’énergie correspond à l’énergie lumineuse, car la lumière rouge a « autant d’énergie » mais en diffuse une partie en chaleur ; c’est d’ailleurs pour cela que la lumière bleue est dite « froide » .
Entre 100 et 400 nm, la lumière n’est pas visible car elle ne stimule pas les photorécepteurs mais elle peut atteindre l’oeil ; il s’agit du rayonnement ultraviolet (UV) de type C (100-200 nm), de type B (200-300 nm), de type A (300-400 nm). Au-delà de 700 nm, on est dans le domaine des rayonnements infrarouges.
Plus la longueur d’onde est basse, plus l’énergie lumineuse (et donc sa toxicité éventuelle) est forte. La lumière peut se révéler toxique en particulier chez l’enfant, du fait des propriétés mêmes de ses structures oculaires qui se modifient avec le temps, et la question de la protection solaire se pose, dans l’environnement naturel mais aussi désormais avec les stimulations lumineuses artificielles (écrans des ordinateurs, tablettes, téléphones, etc.).
La lumière naturelle du soleil n’est pas complètement « blanche » . En effet, sa composition spectrale n’est pas homogène et il existe une certaine prédominance des basses longueurs d’onde (fig. 5-16a). Il faut noter que la lumière du soleil comprend des UV de type A et B (les UV de type C de haute énergie sont normalement arrêtés par la couche d’ozone). Environ 10 % de la lumière du jour est composée d’UV (longueur d’onde < 400 nm) et 25 % de lumière « bleue » (longueur d’onde entre 400 et 500 nm). La distribution énergétique de la lumière du jour dépend bien sûr de la latitude, de l’altitude, de l’atmosphère, de la saison, de l’heure de la journée, etc.
La lumière artificielle classique à incandescence produit une lumière de grande longueur d’onde et donc de basse énergie. L’énergie est perdue en chaleur, que l’on ressent d’ailleurs très facilement à proximité d’une telle ampoule (fig. 5-16b). Les lumières halogènes sont proches des lumières à incandescence avec cependant un peu plus de lumière de moyenne longueur d’onde.
Les lumières LED dites « froides » ou « blanches » – car leur composition spectrale comprend l’ensemble des longueurs d’onde d’où un aspect « blanc » , alors que la prédominance des grandes longueurs d’onde de la lumière incandescente donne un aspect plus jaune – sont composées en fait d’un pic de lumière de faible longueur d’onde « bleue » de haute énergie (fig. 5-16c).
Toute l’énergie est concentrée dans la lumière sans déperdition de chaleur d’où le terme de « lumière froide » . Ces « nouvelles » sources d’énergie lumineuse se développent pour l’éclairage et sont déjà utilisées en masse (écrans des ordinateurs, tablettes et téléphones).
Fig. 5-15 Qu’est-ce que la lumière ? Le spectre électromagnétique.
Le spectre électromagnétique correspond à la gamme de toutes les longueurs d’onde possibles du rayonnement électromagnétique. Toute source de rayonnement émet un rayonnement électromagnétique ayant une énergie caractéristique associée à chaque photon. L’énergie d’un photon E augmente avec la diminution de la longueur d’onde λ, selon la formule où h est la constante de Planck et c est la vitesse de la lumière dans le vide. FEV : fable énergie visible ; HEV : haute énergie visible ; IR : infrarouge ; UV : ultraviolet.
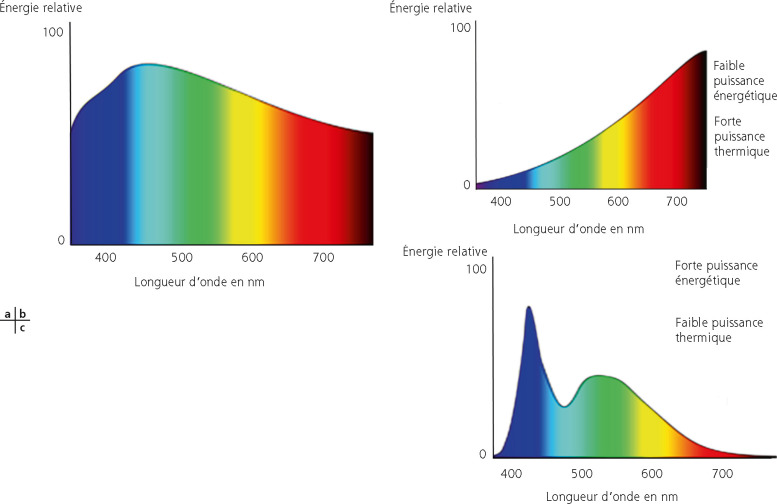
Fig. 5-16 Différents types de lumière.
Lumière du jour (a), d’une ampoule incandescente (b), d’une LED blanche « froide » (c).
–Les UV-C sont absorbés par la couche d’ozone (dont le « trou »
en Antarctique s’est agrandi jusqu’en 2016, ce qui augmentait
l’exposition des populations australes à un risque majoré de subir
des conséquences de cette situation ; en Australie, où il existe une
forte proportion de la population qui est d’origine irlandaise, avec
un teint plutôt roux, cette exposition accrue aux UV-C favoriserait
l’explosion du nombre de mélanomes).
– Les UV-B sont absorbés par la cornée et le cristallin.
– Les UV-C sont absorbés par la cornée et presque entièrement
par le cristallin.
– La lumière visible et une faible quantité d’UV atteignent donc
la rétine.
La raison essentielle de la sensibilité accrue des yeux des enfants est la transparence du cristallin. Celle-ci est quasiment totale à la naissance, c’est-à-dire que le cristallin laisse totalement passer la lumière qui le traverse, alors qu’avec le temps à partir de l’adolescence le cristallin « jaunit » , c’est-à-dire qu’il filtre de plus en plus les hautes longueurs d’onde « bleue » de haute énergie. Avec le vieillissement, ce jaunissement du cristallin devient la cataracte. Notons d’ailleurs qu’il est proposé par certains fabricants des implants cristalliniens (qui remplacent le cristallin naturel) teintés en jaune pour reproduire ce filtre naturel. Notons enfin que des enfants peuvent être opérés dans l’enfance de cataracte, et qu’il convient chez eux d’être particulièrement exigeant avec la protection solaire après l’intervention, car bien évidemment l’implant ne se modifie pas et n’acquiert pas avec le temps ses propriétés de filtre.
La lumière bleue peut être bénéfique car elle participe à la régulation du rythme circadien. En effet, il existe dans les cellules ganglionnaires de la rétine un pigment, la mélanopsine, dont la probabilité d’absorption maximale est d’environ 470 nm [2] ; ces cellules ganglionnaires projettent leurs axones sur le noyau suprachiasmatique qui est impliqué dans la sécrétion de mélatonine la nuit, alors que le jour c’est le cortisol qui est sécrété (fig. 5-17a). L’alternance physiologique de sécrétion diurne du cortisol et nocturne de la mélatonine est la base du rythme circadien (fig. 5-17b) qui règle l’humeur, le sommeil, et cela nécessite donc cette stimulation « bleu-turquoise » le jour (le « bleu-turquoise » a une longueur d’onde comprise entre 450 et 500 nm, alors que le « bleu-violet » a une longueur d’onde comprise entre 400 et 450 nm). De fait, il a été démontré que la stimulation des cellules à mélanopsine entraîne une diminution centrale de la sécrétion de mélatonine, et cette induction de suppression de mélatonine est maximale pour des longueurs d’onde entre 460 et 470 nm (fig. 5-17c) [3, 4]. C’est donc la lumière bleu-turquoise qui est impliquée dans le rythme circadien. D’autres expériences montrent que la suppression de la sécrétion de mélatonine est supérieure pour une lumière bleue de 470 nm de 18 lx, par rapport à un éclairage blanc/bleu non spécifique de 450 lx [5, 6].
Il faut noter que l’excès de stimulation visuelle le soir, en particulier avec des écrans LED diffusant de la lumière bleue mais de façon globale (à la fois turquoise et violet), pourrait être néfaste, car elle troublerait le rythme circadien en faisant croire au système que le jour est encore là.
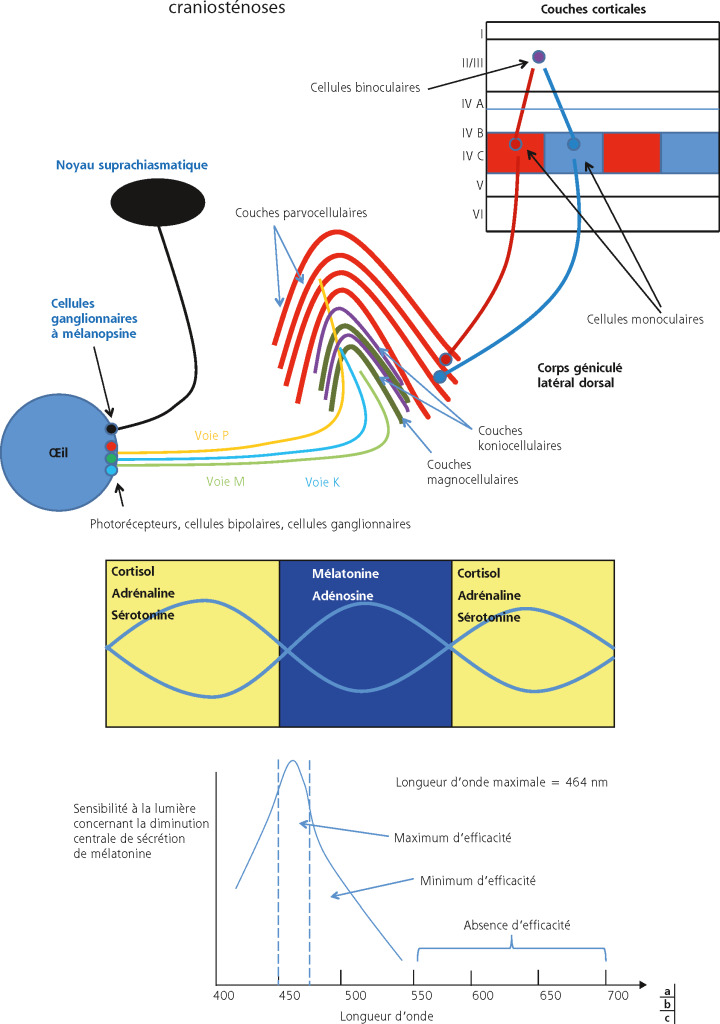
Fig. 5-17 Mélatonine et rythme circadien.
a. Circuit non visuel de la lumière. b. Représentation schématique de la sécrétion hormonale réglant le rythme circadien. c. Courbe de suppression de la mélatonine par la lumière. (D’après Brainard GC, et al. Action spectrum for melatonin regulation in humans : evidence for a novel circadian photoreceptor. J Neurosci 2001 ; 21 : 6405-12 ; Brainard GC, et al. Human melatonin regulation is not mediated by the three cone photopic visual system. J Clin Endocrinol Metab 2001 ; 86 : 433-6.)
Au niveau de la surface oculaire, une exposition aiguë à une lumière de haute énergie entraîne une abrasion superficielle de l’épithélium cornéen, qui s’apparente à un « coup de soleil » cutané. Il s’agit de la classique « ophtalmie des neiges » qui constitue en fait une kératite ponctuée superficielle aiguë.
L’exposition chronique à la lumière peut provoquer des tumeurs bénignes du limbe, en particulier chez les mélanodermes, et plus rarement des tumeurs malignes.
La survenue de la cataracte, qui est un phénomène normal du vieillissement après 70 ans, est accélérée par l’exposition solaire chronique.
C’est au niveau de la rétine que la toxicité cumulée de la lumière peut être la plus problématique.
La toxicité peut être aiguë lorsque par exemple on fixe le soleil de façon inconsidérée, ce qui peut entraîner une « brûlure » centrale de la rétine, entraînant un microscotome définitif (déficit négatif du champ visuel, c’est-à-dire en pratique visibilité d’une zone « noire » ) qui peut gêner le patient. Cela survient par exemple lors d’éclipses solaires observées de façon excessive sans protection.
Beaucoup plus fréquemment, c’est le problème de la toxicité
chronique cumulée de la lumière au plan rétinien qui pose problème,
et nous allons voir que c’est un certain type de lumière
bleue qui est la plus toxique. En effet, la lumière bleue peut
être plus néfaste du fait de sa haute énergie bien sûr, mais
aussi des caractères d’absorption spectrale des structures de la
rétine :
– cônes « bleus » – dont nous avons dit que leur probabilité
d’absorption spectrale est de 438 nm (ils sont ceci dit très minoritaires
parmi la population des cônes) – mais aussi bâtonnets dont
la probabilité d’absorption spectrale est de 498 nm ; la stimulation
répétée des bâtonnets ralentit le cycle de dégradation de la
rhodopsine, ralentit le cycle de phototransduction avec accumulation
de produits toxiques favorisant la mort cellulaire ;
– lipofuscine, produit de dégradation du métabolisme rétinien.
Elle peut s’accumuler dans la rétine avec l’âge et dont la
probabilité d’absorption maximale de la lumière est de 440 nm.
La stimulation de la lipofuscine augmente la production d’éléments
oxydants qui favorisent la dégradation et l’apoptose
de cellules rétiniennes. Il s’agit d’un facteur aggravant de la
dégénérescence maculaire liée à l’âge (DMLA), dont les autres
facteurs de risque principaux sont l’âge, l’hérédité, le tabac, le
régime alimentaire.
La lumière de façon globale peut être toxique, même si nous avons vu que la lumière bleue de haute énergie l’est davantage.
Des lunettes de soleil « conventionnelles » constituent un filtre non sélectif à l’ensemble du rayonnement entrant.
Les lunettes de soleil ont trois caractéristiques qui participent à
la protection de la lumière :
– la forme, car des lunettes profilées vont moins permettre le
passage latéral de la lumière ;
– le filtre UV qui est indépendant de la couleur du verre,
et il existe des verres « blancs » c’est-à-dire complètement
transparents avec filtre UV ; la norme CE (Communauté européenne)
UV 400 impose un filtre de 100 % des UV en deçà de
400 nm [7] ;
– la teinte qui filtre de façon équilibrée ou non la lumière
(filtre équilibré pour une teinte grise ; filtre plus important pour
les grandes longueurs d’onde pour une teinte marron). Les teintes
sont classées en quatre grades :
–filtre 1 = filtre de 20 à 57 % de la lumière ;
–filtre 2 = filtre de 57 à 82 % de la lumière ;
–filtre 3 = filtre de 82 à 92 % de la lumière (il s’agit des
filtres communs des lunettes de soleil classiques) ;
–filtre 4 = filtre de 92 à 97 % de la lumière (ce filtre n’est
utilisable qu’en conditions extrêmes comme en zone enneigée
avec ensoleillement d’altitude maximal ; ce filtre est
incompatible avec la conduite).
Les filtres non sélectifs des lunettes teintées anti-UV filtrent donc les UV de haute énergie, mais aussi toute la lumière avec en particulier la majorité de la lumière bleue (comme la majorité des lumières verte et rouge) (fig. 5-18).
Les verres photochromiques sont des verres qui se teintent au soleil, prenant une teinte non sélective plus ou moins forte ; il est à noter que derrière des filtres UV (pare-brise des voitures par exemple) ces verres ne se teintent pas.
Les lunettes de soleil de bonne qualité (on parle de verres et pas de marques de monture) sont indispensables chez l’enfant comme chez l’adulte, et il est raisonnable de proposer à un enfant une casquette mise dans le bon sens et des lunettes de soleil à l’extérieur et pas seulement en été. Un enfant ressent autant que ses parents l’éblouissement d’une trop forte luminosité, mais s’en plaindra rarement. Il est trop fréquent de voir dans les parcs ou sur les plages des enfants jouer sans chapeau ni lunettes de soleil, alors que leurs chers parents les surveillent vaguement d’un oeil ou de l’autre, les deux étant ceci dit bien protégés par des lunettes de soleil à la dernière mode. La nécessité de protection solaire des yeux est la même quelles que soient la couleur de peau ou la couleur des yeux (c’est différent pour la protection solaire cutanée qui peut varier selon le type de peau).
La lumière bleue de haute énergie est bien évidemment indispensable car en son absence la perception colorée serait faussée, et il est difficile de proposer un filtre qui permettrait de transmettre uniquement la lumière de longueur d’onde supérieure à 500 nm par exemple. On diminuerait d’ailleurs la stimulation des cônes indispensables à la vision nocturne.
Un filtre coloré sélectif peut permettre de filtrer de façon globale toute la lumière bleue. Il s’agit des filtres jaunes dont le principe est utilisé pour certains implants (fig. 5-19).
La lumière « bleu-turquoise » aux environs de 470 nm est utile pour régler le rythme circadien. Il est difficile d’envisager un filtre spécifique qu’adultes et enfants auraient à porter à partir de la tombée de la nuit pour éviter que la stimulation lumineuse de leurs tablettes, ordinateurs et autres téléphones nuisent à leur rythme circadien. Chez l’enfant, il peut être uniquement recommandé (c’est du bon sens) de ne pas abuser le soir des écrans et éventuellement de préférer un livre (même si la lecture sur écran devient aussi la norme) [8].
C’est la lumière bleu-violet aux alentours de 440 nm qui peut être nocive à long terme ; cela a été démontré sur cultures cellulaires [9]. La toxicité potentielle à long terme de cette exposition à la lumière bleue de faible longueur d’onde a conduit les fabricants de verres à développer des filtres ultrasélectifs de cette lumière bleu-violet. Ils pourraient être éventuellement utiles en cas de prédisposition à la DMLA par exemple.
Ainsi la protection contre « la lumière bleue » doit tenir compte
du risque rétinien à mettre en balance avec les nécessités physiologiques.
Il faut prendre en compte les actions différentes « des »
lumières bleues selon la longueur d’onde :
– 437 nm : sensibilité maximale des cônes S ;
– 440 nm : sensibilité maximale de la lipofuscine ;
– 470 nm : sensibilité maximale de la mélanopsine (bonne
lumière bleue le jour/mauvaise lumière bleue la nuit) ;
– 498 nm : sensibilité maximale des bâtonnets.
La question de la nécessité de filtres spécifiques étroits se pose donc, ils filtreraient la lumière bleue en deçà de 450 nm.
Les filtres devraient être variables selon l’heure de la journée : filtrer 470 nm la nuit, mais pas le jour.

Fig. 5-18 Comment se protéger de la lumière ?
Filtre non sélectif (versus filtre sélectif). UV : ultraviolet.

Fig. 5-19 Filtre sélectif pigmenté d’une couleur primaire : exemple : filtre jaune.
De nombreuses pathologies oculaires entraînent une plus grande sensibilité rétinienne à la lumière et, en ce cas, une protection supplémentaire peut être nécessaire. C’est pourquoi depuis longtemps des filtres permanents jaune-orangé ont été proposés dans les pathologies rétiniennes, comme la rétinite pigmentaire, pour filtrer toutes les lumières de haute énergie. Dans une pathologie particulière comme l’aniridie, l’absence d’iris empêche l’adaptation oculaire permanente à la luminosité (myosis en cas de forte luminosité pour diminuer la quantité de lumière qui pénètre dans l’oeil ; mydriase en cas de pénombre afin d’augmenter la quantité de lumière qui pénètre dans l’oeil). En ce cas, une protection par verres teintés en permanence est requise.
Les capacités visuelles de chacun dépendent de l’éclairage bien entendu, et la fonction visuelle mesurée sera variable selon l’éclairage. Il n’existe pour autant pas de norme particulière évoquant un éclairage nécessaire et suffisant à une fonction visuelle optimale. Il peut être cependant rappelé que les cônes qui sont responsables de la vision optimale ne fonctionnent qu’à partir d’un niveau lumineux suffisant et que l’éclairage nécessaire doit être adapté aux conditions ambiantes.
La luminosité est mesurée en physique en candélas par mètre carré, le candéla étant l’unité de base de mesure de l’intensité lumineuse. En deçà de 10−3 cd.m−2, on est en ambiance dite scotopique (la nuit) et seuls les bâtonnets fonctionnent, car ils n’ont pas besoin d’une quantité minimale de lumière pour être activés. La vision plafonne à 2 à 3/10. Entre 10−3 cd.m−2 et 10 cd. m−2, en ambiance mésopique (pénombre de la fin d’après-midi et du soir), à la fois les bâtonnets et les cônes fonctionnent, car ces derniers obtiennent une quantité de lumière au-delà du seuil nécessaire à leur mise en activité. En ambiance photopique, c’està- dire à la lumière du jour (luminosité supérieure à 10 cd.m−2), les bâtonnets arrivent à saturation (une quantité d’énergie lumineuse supplémentaire n’augmentera pas leur réponse) et seuls les cônes répondent à une augmentation de la quantité de lumière reçue.
Bien entendu deux paramètres coexistent : l’ambiance lumineuse, qui donne l’état de base d’activité des photorécepteurs, et l’intensité lumineuse du stimulus.
On peut donc au-delà de ces considérations biophysiques donner des conseils de simple bon sens. L’éclairage doit être nécessaire et suffisant pour une vision confortable. Si on lit un livre, la luminosité est réfléchie, soit par la lumière ambiante soit par la lumière artificielle, et le stimulus lumineux a une intensité lumineuse inférieure ou égale à celle de l’ambiance lumineuse (du fait d’une certaine absorption de la lumière par l’objet lu), et dans ce dernier cas une simple lampe de puissance minimale peut être suffisante pour un enfant, alors que chez l’adulte au cristallin moins transparent, un niveau de lumière plus important peut être nécessaire. Si on lit au contraire sur un écran d’ordinateur, de tablette ou de téléphone, c’est l’écran lui-même qui est le stimulus lumineux dont la puissance peut être réglée, et la puissance requise va dépendre de l’ambiance lumineuse. La puissance devrait donc être modifiée en permanence (c’est d’ailleurs pourquoi certains fabricants proposent des écrans dont la luminosité s’adapte automatiquement). Dans la pénombre ou la nuit, un éclairement minimum doit être réglé, car l’état de base des photorécepteurs est une activité faible ou nulle. En revanche ce même niveau d’éclairement de l’écran en plein jour n’est plus suffisant (que le lecteur en fasse l’expérience) et il faut augmenter la puissance lumineuse de l’écran (mais bien sûr au minimum suffisant et pas au maximum). En effet, l’activité de base des photorécepteurs est élevée et il est nécessaire qu’il y ait une différence de luminosité entre l’ambiance lumineuse et le stimulus visuel.
Alors que la vision poursuit sa maturation pendant la première décennie de la vie, au plan sensoriel comme au plan moteur, la vision de nos enfants serait de plus en plus soumise à des stimulations artificielles, que ce soit sur les écrans des ordinateurs, des tablettes ou des téléphones, ou au cinéma en 3 dimensions (3D), etc.
Est-ce délétère ? Est-ce dangereux ? Faut-il entendre voire même écouter les Cassandre qui prédisent le pire du fait de cette modernité ?
Au cours de la première décennie, la fonction visuelle se développe tant au plan sensoriel que moteur, tant au plan anatomique que fonctionnel [10].
De fait, au plan anatomique, l’oeil de 17 mm de longueur à la naissance atteint 23 mm vers 10 ans. Le diamètre de la cornée passe de 10 mm à 12 mm de la naissance à 4 ans. La macula (centre de la rétine) se différencie entre la naissance et l’âge de 4 ans avec un allongement des articles internes et externes des photorécepteurs.
Au plan cortical, les neurones visuels acquièrent au cours des premières années de vie les propriétés de binocularité, de sélectivité à l’orientation, de sensibilité à la vitesse, etc. Ces phénomènes de maturation corticale sont dépendants de l’expérience visuelle et une expérience visuelle anormale perturbe cette évolution au cours de la période sensible du développement visuel qui est la période au cours de laquelle la plasticité cérébrale fragilise le système si les conditions de développement sont anormales, mais aussi au cours de laquelle une récupération peut être possible en cas de traitement précoce ou de rétablissement des conditions de développement normales.
Au plan moteur, il existe une maturation des saccades, des poursuites et de la lecture jusqu’à l’adolescence.
Fonctionnellement, la vision estimée à 1/20 à la naissance atteint son maximum de 12 à 16/10 (voire 20/10) après l’âge de 5 ou 6 ans. La vision des couleurs est potentiellement mature à 4 ans. La vision du contraste est semblable à celle de l’adulte dès 6 ans. La vision du relief (vision binoculaire) est normale vers 10 ans.
C’est l’existence de cette maturation post-natale du système visuel qui a fait poser la question de l’influence potentielle des outils modernes sur le développement visuel.
En permanence nos enfants (comme nous adultes) sollicitent leur vision de près sur tablettes, écrans d’ordinateur ou de téléphone, et même parfois sur des livres. Nous avons évoqué les effets potentiellement toxiques de la lumière et la nécessité d’utiliser un éclairement minimum nécessaire de ces écrans, afin de limiter la toxicité potentielle à long terme d’une exposition prolongée à la lumière en particulier « bleu-violet » de haute énergie.
En vision de près, quel que soit le mode de lecture, l’accommodation est sollicitée. C’est le phénomène normal de mise au point des images sur la rétine.
Définissons d’abord un oeil emmétrope : un oeil est dit emmétrope s’il n’a pas besoin de correction optique car les rayons lumineux en provenance de l’infini (en pratique au-delà de 5 m) qui arrivent sur la face antérieure de la cornée convergent précisément sur la rétine (grâce à la convergence d’une quarantaine de dioptries de la cornée et d’une vingtaine de dioptries du cristallin). Un oeil myope fait converger les rayons lumineux en avant de la rétine et un oeil hypermétrope les fait converger en arrière. Un oeil astigmate lui ne fait pas converger au même endroit les images qui convergent à travers les deux méridiens perpendiculaires l’un à l’autre du système optique (l’image est « étirée » ).
Pour un oeil emmétrope, alors que les images de loin convergent sur sa rétine, les images de près convergent normalement en arrière de la rétine, et le phénomène d’accommodation (de mise au point) est sollicité pour ramener ces rayons sur la rétine (fig. 5-20). Cette accommodation est permise par le cristallin qui modifie sa forme et augmente sa puissance de convergence, sous la force de la contraction des muscles ciliaires de l’oeil, reliés au cristallin par les fibres zonulaires. Un enfant a un pouvoir d’accommodation de plus de 10 D (seules 3 D sont nécessaires pour voir net un objet à 33 cm, 2 D pour un objet à 50 cm, 1 D pour un objet à 1 m). À 40 ans, l’accommodation résiduelle n’est plus que de 3 D et elle se perd totalement après 60 ans. En effet, le cristallin devenu trop rigide ne modifie plus sa forme et sa puissance.
Pour un oeil myope, l’image de loin arrive en avant de la rétine et l’image de près arrive en arrière de cette première image, c’està- dire parfois sur la rétine, ce qui explique qu’un myope peut parfois lire de près sans effort.
Au contraire pour un oeil hypermétrope, l’image de loin se projette en arrière de la rétine, et l’image de près encore plus en arrière. Un hypermétrope jeune peut parfois bien voir de loin sans lunettes, car il sollicite son accommodation, mais de près, il peut lui être difficile de solliciter davantage son accommodation, entraînant fatigue visuelle et même parfois un strabisme.
Ces considérations optiques font comprendre que c’est la stimulation en vision de près qui peut poser problème lors de l’utilisation excessive d’écrans (mais pas plus que la lecture) et entraîner une fatigue visuelle.
Chez l’enfant, afin de limiter cette fatigue visuelle en vision de près du fait de l’utilisation d’écrans d’ordinateurs, de tablettes ou de téléphones, il peut être recommandé de dépister une hypermétropie latente significative, grâce à un examen ophtalmologique réfractif qui doit être obligatoirement fait sous cycloplégie, c’està- dire après instillation de gouttes mettant en repos l’accommodation et dilatant les pupilles, le jour de la consultation (Skiacol®) ou pendant plusieurs jours au préalable (atropine), même si cela prend du temps. Le diagnostic d’une hypermétropie ne conduit pas l’ophtalmologiste à prescrire systématiquement une correction optique, mais la décision dépend, en l’absence de strabisme patent, de l’importance de l’hypermétropie, d’une éventuelle symptomatologie et d’antécédents familiaux de strabisme [11].
Un écran vu de loin au-delà de 5 m, que ce soit une télévision ou un écran de cinéma, ne sollicite pas particulièrement l’accommodation, et finalement le système visuel est autant sollicité que lorsque l’enfant joue dehors au rugby ou au football.
S’il doit être recommandé de ne pas passer sa journée devant la télévision, c’est pour des raisons éducatives et de développement intellectuel et physique, plus que pour des raisons purement visuelles. Un autre point serait la myopisation en l’absence d’activité de plein air.
Fig. 5-20 Accommodation.
Que penser des recommandations récentes de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES), qui a publié un magnifique rapport intitulé Effets sanitaires potentiels des technologies audiovisuelles en 3D stéréoscopique [12] ? Que répondre aux parents qui nous demandent s’il faut autoriser leurs enfants à regarder des films en 3D ?
Rappelons ce que conclut l’ANSES pour résumer : « Face au développement rapide de nouvelles technologies audiovisuelles en 3D stéréoscopique (3Ds communément appelée 3D), l’ANSES s’est autosaisie afin d’évaluer les risques sanitaires potentiels liés à l’usage de ces technologies, notamment sur la vision humaine. Dans les travaux qu’elle publie ce jour, elle recommande que les enfants de moins de 6 ans, dont le système visuel est immature, ne soient pas exposés à ces technologies et que leur utilisation par les enfants de moins de 13 ans soit modérée. Elle fournit par ailleurs une série de recommandations pratiques afin de limiter les risques de fatigue visuelle pouvant être engendrée par ces technologies. Toutefois, compte tenu du manque de données disponibles sur l’exposition à ces technologies, l’Agence estime nécessaire de mener d’autres recherches. »
Nous l’avons expliqué, il existe de fait un développement de la fonction visuelle au cours de la première décennie de la vie et les fonctions sensorielles et motrices se mettent en place, en particulier la fonction binoculaire. Cependant la maturation visuelle est extrêmement rapide pendant les deux premières années de vie au cours desquelles se situe le pic de la période sensible du développement visuel, et plus l’âge avance, moins une altération de l’expérience visuelle perturbe la maturation visuelle.
Le rapport de l’ANSES souligne que les technologies 3D en particulier de cinéma ne sollicitent pas la vergence (mouvements des yeux dans la même direction) et l’accommodation de la même façon et de façon coordonnée, car les stimuli de l’une et de l’autre fonction ne se situent pas dans le même plan. C’est sur cette base que repose la recommandation de ne pas permettre aux enfants de moins de 6 ans de voir ces films en 3D, et de limiter l’usage chez les enfants de moins de 13 ans. Il est notable qu’aucune étude réellement scientifique ou statistique n’étaye ces hypothèses, et aucune preuve de la toxicité de ces stimulations 3D n’existe (pas plus certes qu’il n’y a de preuves de l’innocuité, mais le principe de précaution ne doit pas – à notre avis – être excessif).
Ceci dit, il peut être formulé plusieurs objections à ces recommandations:
– comme nous l’avons évoqué, l’accommodation n’est significative
qu’en deçà de 5 m, et au cinéma les distances différentes des stimuli
de l’accommodation et de la vergence sont probablement au-delà ;
– la fonction visuelle binoculaire se développe très tôt dans la
vie avec une différenciation des cellules binoculaires corticales et
une maturation des connexions interhémisphériques via le corps
calleux dans la première année de vie, donc l’influence de la 3D
sur un système binoculaire déjà presque achevé est peu probable ;
– par ailleurs, la première année de vie n’est pas celle au cours
de laquelle les parents emmènent leurs enfants au cinéma, et ce
n’est pas non plus la période où le nourrisson regardera la télévision
en 3D quand elle sera disponible dans les foyers, etc.
L’éventuelle nécessité de se protéger de la lumière (bleue) est la conséquence d’un possible effet délétère de celle-ci. La lumière est bénéfique mais toxique dans une certaine mesure, et il est bien clair que les yeux des enfants sont plus sensibles du fait essentiellement de la clarté de leurs cristallins.
Le risque rétinien théorique d’une exposition prolongée à la lumière et en particulier à la lumière dite « bleue » de haute énergie doit être nuancé par la simple nécessité physiologique de percevoir l’ensemble du spectre lumineux pour voir en couleur (grâce aux trois types de cônes), pour voir la nuit (grâce aux bâtonnets) et pour avoir un rythme circadien satisfaisant (grâce à la mélanopsine des cellules ganglionnaires).
La protection solaire des yeux des enfants requiert donc (comme
chez l’adulte) :
– éventuellement l’utilisation de verres à filtre bleu ultrasélectif,
même en l’absence de correction optique, chez des enfants présentant
une dystrophie rétinienne, voire même « à l’extrême » en cas
d’antécédent familial par exemple de DMLA prouvée et sévère.
Cette protection n’est probablement pas inutile même si son coût,
surtout en l’absence de nécessité de lunettes de vue, n’est pas
négligeable, et même si elle découle d’un principe de précaution
probablement excessif qui ne doit pas faire oublier les autres facteurs
de risque de la pathologie ;
– de façon obligatoire, l’utilisation de lunettes de soleil en cas
de forte luminosité, avec filtre UV (c’est le cas de l’immense majorité
des équipements) ;
-dans la mesure du possible, le réglage de l’intensité lumineuse
des lumières artificielles au minimum nécessaire, que ce soit pour
les lampes ou les écrans des ordinateurs, tablettes et téléphones ;
pour ces écrans, il convient de savoir modifier en permanence le
niveau d’éclairement selon l’ambiance lumineuse (c’est-à-dire minimum
dans la pénombre ou l’obscurité et minimum nécessaire pour
une vision confortable dans les autres conditions d’éclairement).
La surconsommation de vision de près, que ce soit avec des écrans ou pas, peut être délétère chez un enfant hypermétrope non corrigé, en lui occasionnant une fatigue visuelle, ce qui doit faire recommander vers 6 ans un examen ophtalmologique réfractif avec cycloplégie, afin de détecter des amétropies : un examen ophtalmologique de dépistage et de diagnostic de l’amblyopie et du strabisme, mais aussi des autres maladies ophtalmologiques pédiatriques plus rares, aura bien sûr été fait au préalable à 1 an et 3 ans.
Concernant les nouvelles technologies de vision 3D qui ne seraient pas recommandés au moins avant 6 ans, cette précaution est peut-être excessive et, inversement, si un enfant ne voit pas la 3D lorsque ses parents l’emmènent au cinéma, alors il faudra probablement requérir un examen ophtalmologique spécialisé afin de rechercher la cause de cette anomalie.
[1] Doly M, Ranchon-Cole I. Phénomènes chimiques de la vision et transmission synaptique de la rétine. Encylc Méd Chir (Elsevier, Paris). Ophtalmologie, 21-026-K-10. 2006 : p. 1-11.
[2] Schmidt TM, Do MT, Dacey D, et al. Melanopsin-positive intrinsically photosensitive retinal ganglion cells : from form to function. J Neurosci 2011 ; 31 : 16094-101.
[3] Brainard GC, Hanifi n JP, Greeson JM, et al. Action spectrum for melatonin regulation in humans : evidence for a novel circadian photoreceptor. J Neurosci 2001 ; 21 : 6405-12.
[4] Brainard GC, Hanifi n JP, Rollag MD, et al. Human melatonin regulation is not mediated by the three cone photopic visual system. J Clin Endocrinol Metab 2001 ; 86 : 433-6.
[5] Berson DM, Dunn FA, Takao M. Phototransduction by retinal ganglion cells that set the circadian clock. Science 2002 ; 295 : 1070-3.
[6] Ecker JL, Dumitrescu ON, Wong KY, et al. Melanopsin-expressing retinal ganglioncell photoreceptors : cellular diversity and role in pattern vision. Neuron 2010 ; 67 : 49-60.
[7] Norme AFNOR NF EN 1836 : lunettes solaires et fi ltres de protection contre les rayonnements solaires pour usage général privé ou public.
[8] Bonmati-Carrion MA, Arguelles-Prieto R, Martinez-Madrid MJ, et al. Protecting the melatonin rhythm through circadian healthy light exposure. Int J Mol Sci 2014 ; 15 : 23448-500.
[9] Arnault E, Barrau C, Nanteau C, et al. Phototoxic action spectrum on a retinal pigment epithelium model of age-related macular degeneration exposed to sunlight normalized conditions. PLoS One 2013 ; 8 : e71398.
[10] Bui Quoc E, Milleret C. Origins of strabismus and loss of binocular vision. Front Integr Neurosci 2014 ; 8 : 71.
[11] Clergeau G. La réfraction de l’enfant. ED A & J. Péchereau, Nantes, 2008. En ligne : http://www.larefraction.net/Documents/Ref-Enfant/Ref-Enfant.html
[12] ANSES. Effets sanitaires potentiels des technologies audiovisuelles en 3D stéréoscopique. 2014, 132 p. En ligne : https://www.anses.fr/fr/documents/AP2011sa0334Ra.pdf
HÔpital Universitaire Robert-Debré, Paris : E. Bui Quoc ; Hospices Civils de Strasbourg : A. Sauer, C. Speeg-schatz ; Fondation ophtalmologique Rothschild, Paris : P. Dureau ; Centre Hospitalier Universitaire de Nantes : P. Lebranchu, G. Lemeur ; HÔpital Neckerenfants Malades, Paris : M. Robert ; HÔpital édouard-Herriot, Lyon : C. Burillon ; Centre Hospitalier Universitaire d’amiens : S. Milazzo ; Centre Hospitalier Universitaire de la Croix-Rousse, Lyon : l. Kodjikian ; Centre Hospitalier Universitaire de Limoges : P. -Y. Robert ; Centre Hospitalier Universitaire Nord, Marseille : E. Zanin, P. Wary, A. Aziz-Alessi , D. Denis
Attention, aucune recommandation officielle, ni aucun consensus issu de la littérature ne sont disponibles en ophtalmologie pédiatrique.
N.B. – Chez l’adulte, les recommandations actuelles en chirurgie
du segment antérieur sont les suivantes :
– prophylaxie préopératoire : désinfection cutanée et des
culs-de-sac conjonctivaux à la povidone iodée avec attente de
3 minutes ;
– prophylaxie peropératoire :
– céfuroxime intracamérulaire (Aprokam®, 1 mg/0,1 ml) ;
– en cas de contre-indication à l’administration de céphalosporines
chez les patients à risque (diabète, implantation
d’un dispositif intra-oculaire autre que pour la chirurgie de
la cataracte, patient ayant déjà fait une endophtalmie postopératoire
sur l’autre oeil, patient monophtalme ; pour la
chirurgie de la cataracte : extraction intracapsulaire, implantation
secondaire) : lévofloxacine 200 mg (Tavanic®) par voie
orale, 500 mg la veille de l’intervention (16 à 12 heures
avant) et 500 mg le jour même de l’intervention (4 à
2 heures avant).
– absence de recommandations pour le postopératoire.
Cette fiche est le résultat de la concertation d’experts français, mais ne constitue pas encore des « recommandations par consensus formalisé » .
Désinfection cutanée et des culs-de-sac conjonctivaux à la povidone iodée (Bétadine® 10 % peau et 5 % conjonctive et oeil) avec attente de 2 à 3 minutes, sauf chez l’enfant de moins de 1 mois ou en cas d’allergie vraie : hypochlorite de sodium 0,06 % (Amukine ).
– Prophylaxie peropératoire :
– cataracte : céfuroxime intracamérulaire (Aprokam®)
1 mg/0,1 ml ; si ouverture capsulaire postérieure, pour certains
on peut utiliser la céfuroxime intracamérulaire (expérience
internationale ancienne notamment suédoise) ou la
céfotaxime (Claforan®) 40 à 50 mg/kg par voie intraveineuse
lente (IVL) ; en cas d’allergie, l’utilisation exceptionnelle de
quinolones par voie intraveineuse (IV) même chez l’enfant est
proposée par certains [1] ;
– glaucome : pas de céfuroxime intracamérulaire, pour certains
céfotaxime (Claforan®) 40 à 50 mg/kg IVL à l’induction anesthésique.
Pour certains, en cas de chirurgie perforante de type
trabéculectomie, utilisation de céfuroxime intracamérulaire ;
– chirurgie du segment postérieur :
– pour certains : ceftazidime (Fortum®) 30 mg/kg IV ;
– OU céfotaxime (Claforan®) 40 à 50 mg/kg IVL à l’induction
(contre-indication aux fluoroquinolones chez l’enfant).
– dans des cas particuliers de chirurgie du segment antérieur
(en cas de risque infectieux élevé, par exemple uvéite avec
traitement par immunosupresseurs, ou de patient monophtalme,
ou d’antécédent d’endophtalmie, ou de chirurgie bilatérale
d’emblée) : même protocole que pour la chirurgie du
segment postérieur, en plus de la possible injection intracamérulaire
(voir plus loin).
– Prophylaxie postopératoire :
– collyre antibiotique jusqu’à étanchéité des sutures (J3 à
J7) : azithromycine, rifamycine, tobramycine (après 1 an) ou
néomycine (après 2 ans) ;
– pour certains dans la chirurgie de la cataracte congénitale :
céfixime (Oroken®) 8 mg/kg/j en deux administrations, soit
4 mg/kg/prise, pendant 2 à 3 jours.
– Pas de prophylaxie peropératoire.
– Prophylaxie postopératoire :
– collyres antibiotiques 3 à 7 jours pour la chirurgie du strabisme
ou des voies lacrymales ;
– antisepsie ou antibioprophylaxie locale postopératoire pour
la chirurgie palpébrale.
1. Prophylaxie systémique per- et postopératoire
Deux protocoles proposés selon les équipes :
– ceftazidime (Fortum®) IV en dose de charge unique en peropératoire
(30 mg/kg) puis relais à 50 mg/kg/j en 3 prises pour
une durée de 5 jours ;
– OU céfotaxime (Claforan®) 40 à 50 mg/kg/j IVL en 3 injections
à 8 heures d’intervalle ;
– si allergie : imipénem (Tiénam®) 30 mg/kg/j + fosfomycine
(Fosfocine®) 100 à 200 mg/kg/j ;
2. Prophylaxie locale oculaire peropératoire
– si les conditions anatomiques le permettent : céfuroxime intracamérulaire
(Aprokam®) ;
– si risque infectieux élevé (plaie souillée) : rajouter des injections
intravitréennes (IVT) de vancomycine (Vancocine®) et de
ceftazidime (Fortum®). Pour certains auteurs, les IVT de ces
deux antibiotiques sont à utiliser d’emblée en cas de perforation
du segment postérieur de l’oeil.
3. Prophylaxie locale postopératoire : collyres antibiotiques 3 à
7 jours.
– Prophylaxie systémique peropératoire : amoxicilline 25 mg/kg
+ acide clavulanique 3,125 mg/kg (Augmentin®) IV, avec réinjection
si délai de prise en charge > 2 heures (maximum 1 g d’amoxicilline/
injection) sans dépasser 5 mg/kg d’acide clavulanique par injection ni
20 mg/kg/j, ce qui contraint dans ces cas à combiner l’Augmentin® avec
de l’amoxicilline non associée à de l’acide clavulanique (Clamoxyl®).
– Prophylaxie locale postopératoire : collyres antibiotiques 3 à
7 jours.
Le Tableau 5-4 résume la conduite à tenir pour mener à bien la prophylaxie chirurgicale.
Tableau 5-4 – Tableau récapitulatif de l’antisepsie et l’antibioprophylaxie chirurgicales en ophtalmologie pédiatrique.
IV : (voie) intraveineuse ; IVL : (voie) intraveineuse lente.
L’antibioprophylaxie topique préopératoire, sous forme de collyre (y compris avec des fluoroquinolones) n’est pas recommandée.
L’antibioprophylaxie peropératoire par voie sous- conjonctivale ou dans le liquide d’irrigation n’est pas recommandée.
L’Agence nationale de sécurité du médicament et des produits de santé (ANSM) a établi une gradation des recommandations selon le niveau de preuve scientifique de la littérature « ne [présumant] pas obligatoirement du degré de force de ces recommandations. En effet, il peut exister des recommandations de grade C ou fondées sur un accord d’experts néanmoins fortes malgré l’absence d’un appui scientifique » . Cette absence d’appui scientifique dans la littérature existe en particulier pour de nombreuses données pédiatriques en l’absence d’études réalisées [2].
Nos recommandations ici sont de grade B pour l’antisepsie préopératoire et l’utilisation intracamérulaire de céfuroxime ; les autres recommandations issues de la pratique et de discussions de spécialistes français peuvent être considérées comme de niveau C ; notons enfin que la prévention proposée a pour but la prévention de l’endophtalmie, avec une notion en particulier chez l’enfant de la possible contamination de proximité par un foyer infectieux de la sphère ORL, ce pourquoi sont visés les germes Haemophilus et pneumocoque, et que la notion de pénétration intra-oculaire des antibiotiques est relative si on considère que les germes visés sont « extra-oculaires » .
Grade de recommandation A : preuve scientifique établie
Niveau de preuve scientifique fourni par la littérature, niveau 1 :
essais comparatifs randomisés de forte puissance ;
méta-analyse d’essais comparatifs randomisés ;
analyse de décision fondée sur des études bien menées.
Grade B : présomption scientifique
Niveau 2 :
essais comparatifs randomisés de faible puissance ;
études comparatives non randomisées bien menées ;
études de cohorte.
Grade C : faible niveau de preuve scientifique
Niveau 3 :
études cas-témoins.
Niveau 4 :
études comparatives comportant des biais importants ;
études rétrospectives ;
séries de cas ;
études épidémiologiques descriptives (transversale, longitudinale).
[1] Dumont R, Pichenot V, Gras-Le Guen C, Launay E ; Groupe de pathologie infectieuse pédiatrique (GPIP). Antibioprophylaxie chirurgicale : les grands principes, état des lieux et exemple d’harmonisation des pratiques. Arch Pediatr 2013 ; 20 Suppl 3 : S61-6.
[2] Haute Autorité de Santé. Niveau de preuve er gradation des recommandations de bonne pratique. HAS ; avril 2013, p. 8. En ligne : http://www.has-sante.fr/portail/upload/ docs/application/pdf/2013-06/etat_des_lieux_niveau_preuve_gradation.pdf
C. Costet, N. Gamb arelli
Le principe même de la chirurgie réfractive chez l’enfant reste très controversé. Néanmoins, on commence à trouver dans la littérature des petites séries qui montrent que les idées sont en train d’évoluer. Le but de ce travail est de faire le point sur les indications qui pourraient être retenues chez l’enfant, et sur les techniques qui seraient les moins agressives et les mieux adaptées. La chirurgie réfractive modifie le pouvoir réfractif de l’oeil pour permettre une bonne focalisation de l’image sur la rétine, remplaçant ainsi une correction par lunettes ou lentilles de contact. À l’heure actuelle, deux techniques restent à l’ordre du jour : la chirurgie cornéenne, la chirurgie intra-oculaire avec mise en place d’implants. Ces quinze dernières années, la chirurgie réfractive chez l’enfant a fait l’objet de publications relativement plus nombreuses dans la correction du strabisme accommodatif, dans le cadre des amblyopies rebelles par amétropies fortes et anisométropies, et tout récemment dans le kératocône évolutif.
L’utilisation d’implants intra-oculaires a commencé chez l’enfant pour traiter les cataractes congénitales ou traumatiques. Dans ces cas-là, l’implantation sur oeil aphaque est devenue systématique et associée à un traitement énergique de l’amblyopie, elle donne des résultats absolument incontestables. Pour ce qui est de la chirurgie réfractive pure, les premières implantations sur des yeux phaques ont eu lieu chez des enfants porteurs de troubles du comportement, chez qui les traitements conventionnels n’étaient pas réalisables, qu’il s’agisse des verres correcteurs ou des lentilles de contact [1]. Ils présentaient des amétropies importantes, myopies supérieures à −10 D, hypermétropies supérieures à + 8 D. Chez de tels enfants, les résultats sont difficilement analysables, d’autant qu’il existe souvent d’autres pathologies, générales ou ophtalmologiques. Malgré tout, les auteurs décrivent de façon formelle une amélioration du confort de vie. Les strabologues et ophtalmopédiatres traitent la plupart du temps sans problème les amétropies de l’enfant en utilisant une correction par lunettes. L’enfant supporte de fortes corrections, et de fortes anisométropies, et un traitement d’occlusion associé donne la plupart du temps d’excellents résultats. Les lentilles de contact sont précieuses dans de telles indications, surtout chez le grand enfant [2]. Pourtant, ce sont ces fortes amétropies, et plus encore les anisométropies, qui motivent à l’heure actuelle la pose d’implants intra-oculaires chez l’enfant. Bien sûr, pour tous les auteurs, les indications restent limitées aux cas où les traitements traditionnels ont échoué.
Les implants sont de deux types, suivant qu’ils sont placés en avant ou en arrière de l’iris.
Les implants de chambre antérieure, fixés à l’iris, type iris-claw (Artisan™ et dérivés) sont les plus posés (fig. 5-21) avec un suivi de plusieurs années [3, 4]. Le préalable est une profondeur de chambre antérieure (CA) convenable (> 3,0 mm).
Les avantages sont la relative simplicité de la technique, bien codifiée, et le faible taux de cataractes induites.
Les risques sont spécifiques aux implants de chambre antérieure et sont majorés chez l’enfant : luxation de l’implant en cas de traumatisme, par lâchage d’une fixation irienne, déperdition de cellules endothéliales, d’autant que l’enfant a davantage tendance à se frotter les yeux.
Fig. 5-21 Implant clipé à l’iris en chambre antérieure.
Ces implants sont injectés dans la chambre postérieure, en arrière de l’iris (fig. 5-22).
Les avantages sont là encore une technique bien maîtrisée et l’obtention d’une excellente qualité de vision.
Le risque de cataracte reste le plus inquiétant sur le long terme. La luxation dans le vitré suite à un traumatisme est une complication grave [5].
La chirurgie réfractive intra-oculaire chez l’enfant restant encore fortement controversée, on ne retrouve dans la littérature que de petites séries, avec peu de suivi à long terme. Alio [6] rapporte les résultats de 10 enfants (âge moyen 8 ans), avec un suivi de 60 mois. Tous étaient porteurs d’une amblyopie unilatérale par forte anisométropie, avec échec des traitements conventionnels. La correction moyenne était de −9,00 D (de + 8,00 à −18,00 D). Neuf yeux ont reçu un implant de chambre antérieure fixé à l’iris, un seul a reçu un implant de chambre postérieure (PRL). La perte de cellules endothéliales était de 6 % à 2 ans, 11 % à 60 mois. On n’a pas retrouvé de cataracte induite, même chez le patient implanté en chambre postérieure, et suivi pendant 5 ans. Arné et Lesueur [7], chez 12 yeux d’enfants implantés en chambre postérieure pour myopie forte, n’en retrouvent pas non plus. Mais il semble que dans d’autres séries [8], ce risque soit confirmé.
Les implants phaques sont techniquement efficaces pour ces fortes anisométropies responsables d’amblyopies résistantes aux traitements conventionnels. Ils sont le dernier recours, puisqu’il s’agit d’amétropies trop fortes pour être accessibles à un traitement par chirurgie cornéenne.

Fig. 5-22 Implant de chambre postérieure en arrière de l’iris.
Comme pour la chirurgie intra-oculaire, les indications de chirurgie réfractive cornéenne chez l’enfant demeurent très limitées. Depuis plus de 20 ans, les kératotomies radiaires et les épikératophaquies ont été remplacées par les chirurgies cornéennes photoablatives réalisées au laser Excimer (excited dimer), soit au niveau de la couche de Bowman par photokératectomie réfractive (PKR) (fig. 5-23) ou laser-assisted sub-epithelial keratectomy (Lasek), soit in situ dans le stroma cornéen par laser assisted in situ keratomileusis (Lasik). Très récemment, le kératocône évolutif de l’enfant a commencé à faire l’objet de communications.
Un facteur limitant est la coopération de l’enfant, imposant dans
la majorité des cas une intervention sous anesthésie générale, qui
pose elle-même deux problèmes :
– la difficulté à trouver des centres de chirurgie réfractive habilités
à effectuer des anesthésies générales, avec un risque de dysfonctionnement
des lasers Excimer par les produits anesthésiques
halogénés [9] ;
– l’absence de fixation oculaire rendant délicat le centrage de
la photo-ablation, même avec l’assistance d’un eye-tracker, l’axe
pupillaire ne correspondant pas toujours à l’axe visuel. Les lasers
Excimer de 6e ou 7e génération commencent seulement à effectuer
un repérage de l’axe visuel et une reconnaissance irienne
en préopératoire immédiat, l’enfant n’étant que partiellement
endormi [10], pouvant laisser espérer une réduction des risques
de décentrement du traitement et des aberrations optiques en
découlant.
Les examens préopératoires réfractifs (topographie cornéenne, aberrométrie, front d’onde, etc.) préconisés chez l’adulte sont aussi de réalisation aléatoire chez l’enfant. Pour toutes ces raisons ajoutées à la croissance du globe oculaire, la prédictibilité du résultat devrait être moins bonne chez l’enfant, ce qui n’apparaît pas chez la plupart des auteurs : il est possible que seuls les résultats positifs aient fait l’objet de publications, les séries moins avantageuses ayant pu être passées sous silence [11]. PKR et Lasek ont, dans ces séries, été pratiqués chez l’enfant dans des indications d’amétropies plus importantes que chez l’adulte, avec corrections de myopies dépassant −10,00 D et d’hypermétropies allant jusqu’à + 5,00 D [12]. L’avantage des techniques de photo-ablation dites de surface réside dans l’absence de risque de déplacement du volet cornéen, redouté par certains chirurgiens en Lasik chez l’enfant, en raison de possibles frottements oculaires intempestifs. Le haze, d’après la méta-analyse de Pirouzian [13], rapporté dans 8 à 27 % en PKR ou Lasek, 5 à 12 % en Lasik, est le plus souvent modéré, avec perte de deux lignes de la meilleure acuité visuelle corrigée dans 2 à 7,5 % des cas. Aucun consensus n’existe sur le traitement postopératoire : corticoïdes au long cours, vitamine C orale, mitomycine, dont les effets sont mal évalués chez l’enfant. La régression de l’effet réfractif, susceptible d’être majoré par la croissance oculaire, est évaluée selon les auteurs de 0,8 à 1,7 D à 6 mois. Le recul réduit de toutes les séries ne permet pas de préjuger du risque possible de survenue d’ectasie cornéenne. Il est à noter un cas récent d’hydrops aigu avec kératite bactérienne secondaire, chez un adulte de 24 ans, aux antécédents dans l’enfance de trabéculectomies et PKR bilatérales retraitées en kératotomies radiaires [14]. Cela rappelle que la prudence doit rester de mise en l’absence d’études randomisées au long cours.
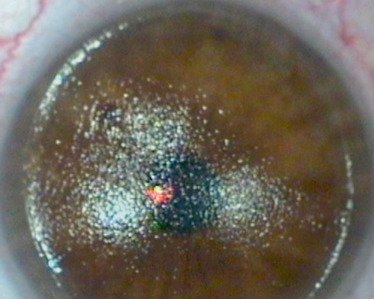
Fig. 5-23 Photokératectomie réfractive.
Les amblyopies par anisométropie ou fortes amétropies bilatérales, rebelles aux traitements conventionnels classiques, ont fait l’objet du plus grand nombre de communications [12, 15]. Même si les amétropies sont souvent au-delà de celles corrigées par des techniques similaires chez les adultes, les auteurs rapportent l’obtention d’acuité visuelle se rapprochant en moyenne à 1,5 D du but espéré, des améliorations significatives de la meilleure acuité visuelle corrigée de l’oeil amblyope, un gain de la vision stéréoscopique, un traitement d’amblyopie facilité et des complications quasi inexistantes. Il faut noter que le but de ces chirurgies précoces n’est pas l’emmétropie, mais l’obtention de la réduction de ces fortes anisométropies. Les résultats sur la vision stéréoscopique sont variables selon les auteurs, cela pouvant tenir aux âges des enfants opérés et aux types d’examens d’évaluation de la vision binoculaire. Certains auteurs insistent sur la précocité des interventions, pour optimiser la prise en charge de l’amblyopie [12], mais cette pratique se heurte aux aléas des examens et des procédures opératoires sous anesthésie générale des jeunes patients. D’autres, pour ces raisons, préfèrent opérer à des âges plus tardifs au-delà de 6 ans, justifiant ces interventions par une réduction de l’aniséïconie [15]. Le recul maximal des séries ne dépassant pas 1 à 4 ans, ces résultats demandent tous à être réévalués à long terme.
Le traitement des ésotropies accommodatives concerne exceptionnellement des populations purement pédiatriques. Saeed et al. [16] ont traité en Lasik, sous anesthésie générale, 20 yeux de 10 enfants de 5 à 9 ans présentant des ésotropies accommodatives pures, avec hypermétropie allant de + 3,5 à + 6,75 D : les résultats réfractifs vont de −0,75 à + 1,5 D avec orthophorie, mais ce pour un recul limité à 9 mois. La plupart des auteurs préfèrent attendre la stabilité de l’hypermétropie et la possibilité d’opérer sous anesthésie topique : des adolescents sont alors intégrés dans des cohortes plus larges de patients adultes, porteurs d’ésotropies accommodatives pures ou partielles [17]. Si les résultats réfractifs et stéréoscopiques rapportés paraissent bons, ils le sont avec une précision réfractive encore imparfaite et avec un recul n’excédant pas 1 à 3 ans : on connaît en strabologie l’importance, dans les strabismes accommodatifs, de la correction optique totale de l’hypermétropie [18], cela incite à la prudence sur ces indications.
Depuis les années 2010, les communications se multiplient sur les traitements par cross-linking cornéen et de nombreux auteurs s’intéressent aux populations pédiatriques avec kératocône évolutif [19, 19]. Les résultats initiaux semblent prometteurs, mais certains auteurs notent, après une amélioration relative des premiers mois, une régression à 24 mois [19].
Les indications de chirurgie réfractive sont encore confidentielles en ophtalmologie pédiatrique, demandant à être confirmées par des études randomisées multicentriques avec suivi à long terme, et aucun consensus pré-, per- ou postopératoire n’a encore été établi. Elles sont actuellement réservées aux échecs confirmés des équipements optiques ou contactologiques conventionnels pour des amblyopies profondes par fortes anisométropies ou amétropies importantes bilatérales et, de la même manière, à quelques cas d’ésotropies accommodatives. Les enfants présentant des troubles graves du comportement avec impossibilité d’équipement en verres correcteurs ou lentilles constitueraient la meilleure indication. Selon la méta-analyse de Tian et al. [21], les résultats réfractifs obtenus par chirurgie intra-oculaire avec implants phaques (682 yeux de 597 enfants) ou par chirurgie cornéenne (75 yeux de 61 enfants), dans le traitement d’amblyopies par forte myopie ou anisométropie, n’objectivent pas de différence statistiquement significative. Les implantations phaques pourraient néanmoins être préférentiellement proposées aux amétropies supérieures, pour les myopies à −10,00 D et pour les hypermétropies à + 6,00 D, les amétropies inférieures pouvant relever d’une chirurgie cornéenne. Dans tous les cas, une collaboration étroite entre ophtalmopédiatre, strabologue et chirurgien réfractif est indispensable pour effectuer un bilan préopératoire complet réfractif et sensoriel, et pour poursuivre en postopératoire le traitement de l’amblyopie. Les progrès réalisés ces toutes dernières années en recherche expérimentale et clinique dans la freination de la myopie aideront peut-être à limiter dans l’avenir les indications concernant les fortes myopies. Enfin, les kératocônes évolutifs, avec baisse visuelle avérée et aggravation objective des paramètres topographiques, peuvent relever d’un cross-linking cornéen, dont la stabilité au long cours reste encore à démontrer.
Même si les résultats de séries succinctes de la littérature paraissent concluants, la pratique de la chirurgie réfractive demeure encore très confidentielle chez l’enfant, limitée aux échecs des traitements optiques ou contactologiques conventionnels. Elle pourrait dans ces cas, notamment chez des enfants difficiles à gérer en raison de troubles graves du comportement, s’appliquer aux amblyopies profondes par forte amétropie ou anisométropie, voire à certains strabismes accommodatifs. Le traitement du kératocône évolutif de l’enfant par cross-linking cornéen semble, depuis ces dernières années, prometteur. Des études prospectives, randomisées, demeurent indispensables pour valider l’efficacité et le devenir de ces techniques au long cours, avec collaboration étroite entre ophtalmopédiatres, strabologues, contactologues et chirurgiens réfractifs.
[1] Tychsen L, Hoeckel J, Ghasia F, Yoon-Hang G. Phakic intraocular lens correction of high ametropia in children with neurobehavioral disorders. J AAPOS 2008 ; 12 : 282-9.
[2] George MN. Contact lenses in children. Rev Prat 2007 ; 57 : 2027-9.
[3] Saxena R, Van Minderhout HM, Luyten GP. Anterior chamber iris fixated phakic intraocular lens for anisometropic amblyopia. Cataract Refract Surg 2003 ; 29 : 835-8.
[4] Pirouzian A, Ip KC. Anterior chamber phakic intraocular lens implantation in children to treat severe anisometropic myopia and amblyopia : 3 year clinical results. Cataract Refract Surg 2010 ; 36 : 1486-93.
[5] Eleftheriadis H, Amoros S, Bilbao R, Teijeiro MA. Spontaneous dislocation of a phakic refractive lens into the vitreous cavity. J Cataract Refract Surg 2004 ; 30 : 2013-6.
[6] Alio J, Toffaha BT, Laria C, Pinero DP. Phakic intraocular lens implantation for treatment of anisometropia and amblyopia in children : 5 year follow-up. J Refract Surg 2011 ; 27 : 494-501.
[7] Lesueur L, Arne JL. Phakic intraocular lens to correct high myopia amblyopia in children. J Refract Surg 2002 ; 18 : 519-23.
[8] Chen JL, Chang YJ, Rajagopal R, Azar DT. Metaanalysis of cataract development after phakic intraocular lens surgery. J Cataract Refract Sur 2008 ; 34 : 1181-200.
[9] Paysse EA, Hussein MA, Koch DD, et al. Successful implementation of a protocol for photorefractive keratectomy in children requiring anesthesia. J Cataract Refract Surg 2003 ; 29 : 1744-7.
[10] El Bahrawy M, Alió JL. Excimer laser 6th generation : state of the art and refractive surgical outcomes. Eye Vis (Lond) 2015 ; 2 : 6.
[11] Daoud YJ, HutchinsonA, Wallace DK, et al. Refractive surgery in children : treatment options, outcomes, and controversies. Am J Ophthalmol 2009 ; 147 : 573-82.
[12] Paysse EA, Coats DK, Hussein MA, et al. Long-term outcomes of photorefractive keratectomy for anisometropic amblyopia in children. Ophthalmology 2006 ; 113 : 169-76.
[13] Pirouzian A, Hashemian H, Khodaparast M. Update on paediatric refractive surgery. European Ophthalmic Review 2015 ; 9 : 104-10.
[14] Bandivadekar P, Sharma N, Pillai G, et al. Acute hydrops with secondary bacterial keratitis: sequelae of paediatric refractive surgery. Int Ophthalmol 2014 ; 34 : 1275-8.
[15] Ghanem AA, Nematallah EH, El-Adawy IT, Anwar GM. Facilitation of amblyopia management by laser in situ keratomileusis in children with myopic anisometropia. Curr Eye Res 2010 ; 35 : 281-6.
[16] Saeed AM, Abdrabbo MA. LASIK as an alternative line to treat noncompliant esotropic children. Clin Ophthalmol 2011 ; 5 : 1795-801.
[17] Shi M, Jiang H, Niu X, et al. Hyperopic corneal refractive surgery in patients with accommodative esotropia and amblyopia. J AAPOS 2014 ; 18 : 316-20.
[18] Sauer A, Speeg-Scatz C. Strabisme accommodatif. In : Péchereau A, Denis D, Speeg-Schatz C. Strabisme. Rapport de la Société française d’ophtalmologie. Issy-les-Moulineaux : Elsevier Masson ; 2013, 544 p.
[19] Caporossi A, Mazzotta C, Baiocchi S. Riboflavin-UVAinduced corneal collagen cross-linking in pediatric patients. Cornea 2012 ; 31 : 227-31.
[20] Ozgurhan EB, Kara N, Cankaya KI, et al. Accelerated corneal cross-linking in pediatric patients with keratoconus : 24-month outcomes. J Refract Surg 2014 ; 30 : 843-9.
[21] Tian C, Peng X, Fan Z, Yin Z. Corneal refractive surgery and phakic intraocular lens for treatment of amblyopia caused by high myopia or anisometropia in children. Chinese Medical Journal 2014 ; 127 : 2167-72.
- Chapitre 5
Quelques questions courantes en ophtalmologie pédiatrique- 1 – Introduction
- 2 – Quelles sont les atteintes oculaires possibles en cas de traumatisme obstétrical ?
- 3 – Quel traitement antibiotique néonatal instiller après l’accouchement ?
- 4 – Que faire devant un larmoiement du nourrisson ? Que faire s’il persiste après l’âge de 1 an ?
- 5 – Que faire devant une dacryocystocèle ou une dacryocystite du nourrisson ?
- 6 – Que faire devant une exophtalmie, une enophtalmie ou une anomalie de taille du globe chez un nourrisson ?
- 7 – Que faire devant un nouveau-né qui ne voit pas ?
- 8 – Que faire quand un enfant a les yeux qui bougent ?
- 9 – Que faire en cas d’anomalie pupillaire ?
- 10 – Quand demander et comment faire un bilan électrophysiologique ?
- 11 – Comment voir et vivre avec une dyschromatopsie ?
- 12 – mon enfant peut-Il ou doIt-Il porter des lentIlles de contact ?
- 13 – Que devraient voir et ne pas voir les enfants ? Problématiques des écrans et des jeux vidéo, de la 3D, de la lumière bleue, de l’horloge biologique
- 14 – Quelles antisepsie et antibIoprophylaxie chirurguicales en ophtalmologie pédiatrique ?
- 15 – Prise en charge particulière de la réfraction de l’enfant : que penser de la chirurgie réfractive ?