Examen de l’enfant
Coordonné par D. Denis
P. Wary, D. Denis
L’examen clinique ophtalmologique en ophtalmopédiatrie oblige le praticien à adapter sa pratique clinique habituelle à un enfant d’âge verbal ou non, et a pour particularité une relation médecin-enfant-parents propre à la pratique pédiatrique en général. Si les outils utilisés peuvent différer en étant portable, il n’en reste pas moins que les étapes de l’examen reproduisent celles de l’examen adulte, suivant la démarche clinique habituelle classique : évaluer une fonction et analyser un organe sur le plan clinique et paraclinique pour faire aboutir sa démarche.
Le contexte clinique est également différent car l’enfant ne verbalise pas spontanément ses plaintes ou ses symptômes et l’essentiel de la démarche est orienté par un examen soit systématique, soit guidé sur des éléments cliniques relevés par la famille, le corps enseignant ou le pédiatre. L’enfant n’est pas le promoteur de sa propre consultation : cela place d’emblée les parents dans un rôle prépondérant de coopération tant au niveau de la démarche diagnostique que de la prise en charge thérapeutique ultérieure.
Cet examen requiert patience et talent, et s’il existe plusieurs artifices à connaître pour faire en sorte que l’examen se déroule efficacement et calmement, le premier élément clé de cette prise en charge est d’utiliser les parents comme ressource..
S’il est classique de dire que le « patient a toujours raison » , il est particulièrement juste d’écouter et de relever tout ce que les parents ont pu observer chez leurs enfants. La plupart des motifs de consultation viennent des observations parentales ou du corps enseignant. En effet, bon nombre d’enfants ne se plaignent jamais de trouble de la vision, de baisse de l’acuité visuelle ou de diplopie.
Pendant le temps de l’interrogatoire où le praticien s’adresse aux parents, il faut observer l’enfant sans établir encore de contact. C’est la phase hand off décrite par Laroche dans son approche clinique en 19 points [1].
En effet « l’enfant juge son examinateur » dès le premier contact direct verbal ou gestuel et toute maladresse peut rompre le lien rapidement, compliquant alors la suite de l’examen.
Ce temps de l’observation est un temps inestimable dans l’examen clinique (en salle d’attente ou en tout début de consultation lors du temps de l’interrogatoire des parents), il permet de préciser la morphologie faciale (apparence globale, malformation, handicap, trouble du tonus, etc.), la position de tête, le torticolis, l’alignement binoculaire, le strabisme, un nystagmus.
Il faut retranscrire sur le dossier de consultation sans interprétation, ce qui motive la consultation de la part des parents ou relever les mots propres de l’enfant. Sont précisés : le mode de survenue (depuis la naissance ou récemment, tous les jours, intermittent), l’existence de facteurs aggravants (fatigue, lumière, fixation, etc.), les antécédents personnels de l’enfant (antécédents médicaux, allergiques et chirurgicaux) et familiaux, en s’attachant à la recherche de facteurs de risque d’amétropie et de strabisme, et l’existence d’une maladie héréditaire à répercussion oculaire (maladie métabolique, anomalie chromosomique, glaucome congénital, cataracte congénitale, rétinoblastome, etc.).
Il faut rechercher et noter :
l’âge de la naissance (prématurité) (Encadré 3-1) ainsi que le poids de naissance et le périmètre crânien, en s’aidant pour cela du carnet de santé de l’enfant (fig. 3-1);
les éléments médicaux notables de la grossesse comme les infections (toxoplasmosis, other agents, rubella, cytomegalovirus, and Herpes simplex [TORCH]), la notion d’intoxication (tabac, alcool, irradiation, drogue) et les épisodes pathologiques du premier trimestre de grossesse;
les conditions de l’accouchement (durée, forceps, pré-éclampsie, hypertension artérielle gravidique, diabète gestationnel) et l’existence d’une souffrance néonatale (score APGAR pour American pediatric groos assesment record, procidence du cordon, inhalation liquide amniotique, réanimation néonatale avec hypoxie);
les facteurs majeurs de risque de strabisme précoce [2] tels que les lésions neurologiques pré- ou néonatales (souffrance neurologique, hydrocéphalie, embryofœtopathies, etc.), la prématurité (surtout si associée à une hémorragie intraventriculaire) et le petit poids de naissance (Tableau. 3-1);
les facteurs environnementaux tels que le tabagisme, l’alcoolisme et les intoxications exogènes.

Fig. 3-1 Carnet de santé : examen ophtalmologique du nouveau-né.
Définition du terme et de la prématurité
Le terme d’une naissance est défini comme 41,5 semaines après le 1er jour des dernières règles (41,5 SA : semaines d’aménorrhée) :
-
après 41,5 SA : nouveau-né post-terme;
37 à 41,5 SA : nouveau-né à terme;
avant 37 SA : nouveau-né prématuré.
Adaptation de l’examen par rapport à l’âge de l’enfant :
-
nouveau-né : naissance à 28 jours;
nourrisson : 1 à 24 mois;
jeune enfant à partir de 2 ans et demi.
L’ophtalmologiste a deux handicaps :
il est un étranger et peu d’enfants aiment s’ouvrir aux personnes qu’ils ne connaissent pas;
il peut porter une blouse blanche, ce qui est associé au soin et à la douleur (piqÛre pour vaccin).
Pour favoriser un lien privilégié avec l’enfant, il faut en premier lieu limiter le nombre de personnes présentes dans la même pièce pour éviter toute distraction. Il faut ensuite recréer une atmosphère de bienvenu en conduisant son examen comme un jeu ou une succession de jeux. Pour être mis en confiance, l’enfant doit être bien installé, parfois en restant dans la poussette qu’il connaît et qui le rassure, mais aussi en étant confortablement assis sur les genoux d’un parent. La « flexibilité » est essentielle, ne pas « braquer » l’enfant et ne pas le faire asseoir de force sur la chaise d’examen d’emblée. La mise en confiance est le premier temps de l’examen, ce sera autant de temps gagné pour la fiabilité des examens. Il faut l’appeler par son prénom usuel, lui parler d’une voix distincte calme et sans hausser le ton, en conservant une distance respectable et en évitant de le toucher d’emblée ou d’approcher un instrument de mesure. À l’âge verbal, il faut impliquer l’enfant dès cette étape de l’examen en lui demandant de « raconter son histoire » et lui faisant préciser ses plaintes.
À la naissance, l’examen ophtalmologique fait partie de l’examen pédiatrique systématique de la maternité. Le pédiatre s’assure pendant les phases d’éveil (ouverture spontanée des yeux) de la normalité du développement oculo-orbito-facial (symétrie oculo-orbito-faciale : distance interoculaire, distance intercanthale) [3]. Les réflexes photomoteurs présents dès la naissance peuvent être lents car immatures. Dès les premiers jours, on recherche le réflexe de clignement à la lumière; dans les mois qui suivent, le réflexe de clignement à la menace et les réflexes de poursuite apparaissent.
Au moindre doute, l’avis ophtalmologique est demandé par le pédiatre pour un examen clinique spécifique.
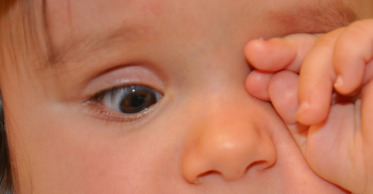
Fig. 3-2 Signe digito-oculaire de Francheschetti.
Le premier temps de l’observation consiste à noter l’ouverture spontanée des yeux ou à la sollicitation en « tapant des mains » . Cette première inspection élimine les signes de malvoyance profonde tels un signe de l’éventail ou un signe digito-oculaire de Francheschetti (l’enfant appuie sur ses globes oculaires pour se créer des perceptions lumineuses) (fig. 3-2).
Cette observation faite à 80 cm de l’enfant environ se prolonge par la réalisation des premiers tests psychovisuels : en attirant son attention avec un stylo-lampe, il faut jouer avec l’enfant, se rappelant que l’enfant « a soif de regarder » . L’observateur note le caractère aimanté du regard, les réflexes de poursuite de la lumière explorant la motilité oculaire extrinsèque, et essaie d’obtenir un sourire (l’absence de sourire à l’âge de 2 mois suspecte une pathologie).
Avant d’approcher la lumière de l’enfant, l’ophtalmologiste inspecte la morphologie craniofaciale et les annexes : relief palpébral, ouverture de la fente palpébrale (ptosis), état du bord libre (colobome, inflammation, infection), symétrie des paupières et taille des globes oculaires (énophtalmie, exophtalmie)
Puis avec un ophtalmoscope, le praticien analyse la pupille (diamètre, anisocorie), sa réaction à la lumière (clignement à la lumière, réflexe photomoteur direct et consensuel) et l’état de la lueur pupillaire (existence d’une leucocorie) (fig. 3-3).
Il est facile alors d’examiner les reflets de Hirschberg et de s’approcher en lui parlant pour solliciter la convergence, pour finir par un cover-test avec stimulation visuelle lumineuse ou non (cube de Lang) en réalisant préférentiellement le cover-test avec la main ou le pouce plutôt qu’avec une palette. C’est au cours de cet examen du cover-test que le premier contact physique avec l’enfant est fait, en posant la main sur le front d’un « geste doux » . Le comportement de l’enfant à l’occlusion monoculaire (fig. 3-4) – avec la main ou de manière optimale avec un Opticlude® – recherche une réaction de pleurs, suspecte alors d’amblyopie profonde unilatérale.
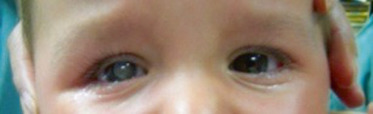
Fig. 3-3 Leucocorie.
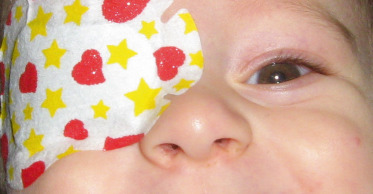
Fig. 3-4 Occlusion monoculaire chez un nourrisson de 4 mois.
La mesure de la réfraction est effectuée à l’aide d’un autoréfractomètre portable sous cycloplégique (fig. 3-5), rappelant que les autres appareils de mesure de la réfraction à distance sans cycloplégie ne permettent pas d’avoir une valeur de référence, mais restent utiles dans une pratique de dépistage de masse. Actuellement, seule la réfraction sous cycloplégie fait consensus (voir chapitre 2).
L’examen biomicroscopique du segment antérieur du nourrisson est facilité par l’utilisation d’une lampe à fente portable, l’enfant étant placé en décubitus dorsal, soit emmailloté dans un drap, soit maintenu par un aide avec les bras relevés de chaque côté de la tête. Le plus souvent, l’examen anatomique est réalisé avec une lampe à fente normale en utilisant la technique de l’avion ou flying baby (fig. 3-6) où l’enfant est porté par un(e) aide, tête en hyperextension, présenté en décubitus ventral, menton et front appuyé sur la lampe à fente. Une des difficultés est d’obtenir une bonne ouverture de la fente palpébrale, nécessitant fréquemment, si ce n’est systématiquement, l’usage d’un blépharostat adapté à l’âge en ayant auparavant instillé une goutte d’oxybuprocaïne unidose. Le recours à un blépharostat (fig. 3-7) exige un temps d’explication préalable, et il peut être recommandé à ce titre de faire sortir un des deux parents s’ils semblent être impressionnés.
Cet examen au biomicroscope obligatoire doit être rapide pour ne pas dire bref, mais rigoureux pour obtenir, sur le plan anatomique, toutes les informations nécessaires :
transparence de la cornée;
taille de la cornée (diamètre cornéen horizontal et vertical) évaluée subjectivement ou objectivement par les règles de calibrage (réfractomètre automatique). Ces valeurs normales sont évolutives avec l’âge (voir plus loin MESURES ET NORMES DE L‘EXAMEN OPHTALMOLOGIQUE DE L‘ENFANT) : il faut retenir que ce diamètre doit être inférieur à 12 mm avant 1 an et qu’une différence entre les deux yeux de plus de 1 à 2 mm est pathologique;
épaisseur de la cornée (examen réalisable par pachymétrie);
aspect de la pupille (myosis, mydriase, anisocorie, corectopie, atrophie irienne, ectropion);
profondeur et vacuité de la chambre antérieure;
transparence et position du cristallin.
Au moindre doute, si l’examen est impossible le jour de la consultation, s’il existe une suspicion de corps étranger, si un signe clinique d’examen doit être impérativement confirmé, il faut recourir sans déroger à un examen sous anesthésie générale (voir plus loin chapitre 3.5).
L’examen biomicroscopique du segment postérieur est réalisé après instillation de tropicamide à plusieurs reprises et, si nécessaire, de néosynéphrine diluée 2,5 % (voir plus loin chapitre 3.3). Une dilatation irienne de bonne qualité permet d’accéder au segment postérieur. Cet examen sous dilatation est réalisé en décubitus dorsal sur un enfant maintenu par un(e) aide. L’usage de l’ophtalmoscopie directe est toujours possible, mais l’ophtalmoscopie indirecte au casque avec lentilles de puissances différentes (20, 30, 45 D) (fig. 3-8) a l’avantage de permettre un examen plus panoramique, en stéréoscopie.
Il faut toujours veiller à éviter d’écarter les paupières avec les doigts, car l’effet de pression digitale sur le globe modifie l’aspect de la papille (ralentissement du flux artériel et pâleur de la papille).
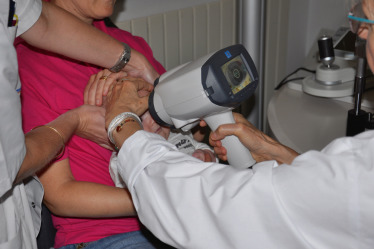
Fig. 3-5 Mesure de la réfraction sous cycloplégie par autoréfractomètre portable.

Fig. 3-6 a, b. Flying-baby.

Fig. 3-7 Examen aidé du blépharostat.
Au cours de cet examen, l’examinateur relève :
l’état de la transparence du vitré;
l’aspect de la papille et de la région maculaire (à noter que le reflet fovéal est absent avant 1 an par immaturité de la macula);
le trajet et le calibre du réseau vasculaire, éliminant une éventuelle rétinopathie des prématurés;
l’existence de lésion rétinienne au pôle postérieur et en périphérie en indentant doucement, geste délicat à réaliser en dehors du contexte de l’examen sous anesthésie générale.
Cet examen est délicat, aléatoire et l’analyse des éléments du fond d’œil ne peut être que rarement exhaustive du fait de la réaction de défense de l’enfant. Au fur et à mesure des visites, la répétition de cet examen génère du stress chez l’enfant et peut compliquer l’analyse clinique.
Le recours aujourd’hui à des techniques d’imagerie, telle la RetCam™ (fig. 3-9a-d), système de visualisation grand champ, a changé complètement la qualité du recueil des données cliniques, permettant d’établir un diagnostic immédiat et une prise en charge plus précoce. C’est devenu un outil incontournable pour une activité clinique ophtalmopédiatrique de référence; malheureusement, son coÛt non négligeable restreint encore sa diffusion. Grâce aux capacités d’enregistrement vidéo et de rétinophotographies grand champ, l’extrême périphérie est mieux analysée et documentée. Le fait de pouvoir reprendre de manière comparative ou contradictoire l’analyse clinique sur les données d’imagerie a posteriori est d’un grand secours pour le dépistage de la rétinopathie des prématurés (fig. 3-9e), des enfants battus et des situations cliniques complexes des syndromes rares.
Si le bilan clinique reconnaît une affection, l’ophtalmologiste doit planifier la poursuite des investigations hiérarchisées cliniques auprès de confrères pédiatres spécialisés (voir chapitre 27) et paracliniques avec la réalisation d’examens complémentaires notamment d’électrophysiologie (électrorétinogramme [ERG], potentiels évoqués visuels [PEV], imagerie par résonance magnétique [IRM], etc.).
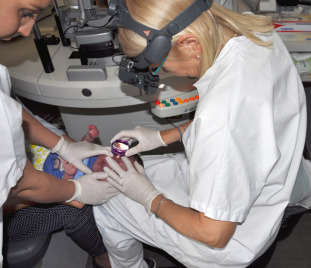
Fig. 3-8 Examen en ophtalmoscopie indirecte du fond d’oeil.
Le développement de l’enfant est très rapide entre 6 mois et 2 ans et demi, avec des acquisitions sur le plan moteur et sensoriel essentielles, au premier rang desquelles le tonus axial qui autorise la position assise facilitant l’examen. Dans cette tranche d’âge, le point clé est le développement de la vision binoculaire qui modifie les performances futures sensori-motrices de l’enfant (développement de la stéréoscopie, appréciation du relief et des distances, coordination œil/main).
De l’analyse du comportement visuel de l’enfant avant 6 mois, on peut désormais évaluer la fonction visuelle par la mesure de l’acuité visuelle de résolution et par la mesure de la réfraction afin de pouvoir dépister les facteurs de risque principaux de l’amblyopie : strabisme, trouble réfractif sans omettre de rechercher un trouble organique.
Dans la pratique quotidienne, les différents temps de l’examen fonctionnel et organique interfèrent les uns avec les autres, avec des temps d’examen obligatoirement sans dilatation pupillaire et d’autres sous cycloplégie.
La mise en place de la fusion binoculaire et du réflexe de convergence, témoignant d’une vision binoculaire normale, assure la coordination des mouvements oculaires, l’alignement des axes visuels et la vision stéréoscopique.
Ce bilan est essentiel dès cet âge de dépister un strabisme qui peut engager le pronostic fonctionnel de l’œil dévié avec risque certain d’amblyopie.
La mise en évidence de la déviation se fait par l’étude de la position ou direction des axes visuels en situation de dissociation par l’occlusion de l’un ou l’autre œil. L’enfant doit être assis, la tête en position primaire et fixer un point lumineux situé à 5 mètres pour l’examen de la vision de loin et à 33 cm pour celui de la vision de près, ce qui nécessite une bonne coopération de l’enfant.
Un écran est placé alternativement sur un œil, puis l’autre en pratiquant une occlusion unilatérale ou cover-uncover-test (manœuvre peu dissociante) (fig. 3-10).
Plusieurs cas peuvent se présenter après avoir enlevé l’écran dans le cover unilatéral :
pas de mouvement, quel que soit l’œil étudié : il s’agit d’une orthophorie que l’on désigne par O de loin et O’ de près;
un mouvement, l’œil caché reprend la fixation sans que l’autre œil ait bougé, cela se reproduit quel que soit l’œil étudié : il s’agit d’une hétérophorie, caractérisée par le mouvement de restitution qui implique une vision binoculaire normale (correspondance rétinienne normale [CRN]). Si à la levée de l’écran, le mouvement de restitution se fait de l’intérieur vers la position primaire (PP), il s’agit d’une ésophorie, E de loin, E’ de près; s’il se fait de l’extérieur vers la PP, il s’agit d’une exophorie, X de loin, X’ de près; si l’œil fait un mouvement d’abaissement vers la PP, il s’agit d’une hyperphorie droite (HD) ou gauche (HG), si c’est un mouvement d’élévation vers la PP, il s’agit d’une hypophorie;
pas de mouvement, mais à l’occlusion de l’autre œil, l’œil précédemment caché fait un mouvement pour reprendre la fixation : il s’agit d’un mouvement de fixation, caractéristique d’une tropie (strabisme), impliquant une perturbation de la vision binoculaire plus ou moins importante. Ce mouvement de fixation permet de différencier un strabisme monoculaire d’un strabisme alternant. Dans un strabisme monoculaire, la fixation ne sera prise par l’œil dévié que lorsque l’autre œil sera occlus, et perdue lorsque l’œil fixateur sera de nouveau dégagé. Dans un strabisme alternant, alternativement l’un ou l’autre œil gardera la fixation à la levée de l’occlusion.
Secondairement, la manœuvre de l’écran alterné, ou cover-test alterné, plus dissociante, permet la décompensation totale du déséquilibre oculomoteur pour déceler les cas limites des phories se transformant en tropies et faire la différence, dans les angles variables, entre l’angle de base sans décompensation et l’angle maximum. Cet examen permet de différencier phorie-tropie-paralysie, et donne le sens de la déviation et l’œil fixateur.
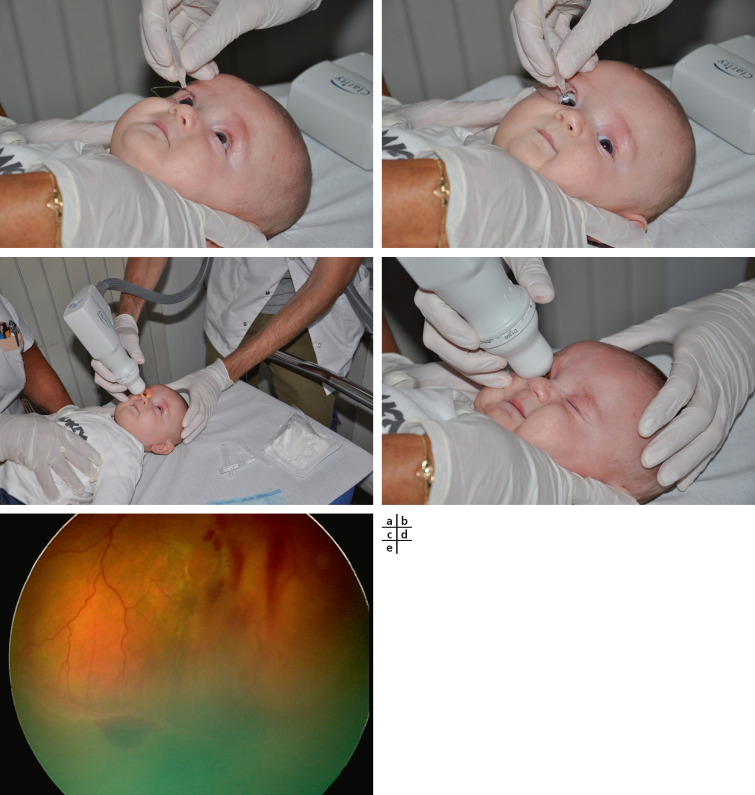
Fig. 3-9 Fond d’oeil avec RetCamTM
a-d. Rétinopathie du prématuré. e. Stade 3, zone 2 avec signes plus (tortuosité vasculaire, bourrelet situé en temporal rougeoyant).
L’étude de la motilité se fait par la réalisation des mouvements de duction, de version et de vergence [4] :
pour l’étude des ductions : l’enfant tenu immobile tête droite, un œil occlus, suit un point lumineux que l’on mobilise à partir de la position primaire dans les 9 positions diagnostiques du regard;
pour l’étude des versions : la même manœuvre est répétée les deux yeux ouverts, la tête du sujet toujours immobile. Les versions étudient les champs d’action des muscles synergiques, les hypo- ou hyperactions sont révélées;
pour l’étude des vergences : la recherche du punctum proximum de convergence se réalise en fixant une cible, en l’occurrence un cube de Lang, et en le rapprochant lentement. La distance à laquelle la diplopie apparaît ou bien à laquelle un œil relâche l’effort de convergence peut être mesurée avec une règle graduée ou estimée à bonne (6 cm), moyenne (10 cm) ou mauvaise (15 cm) distance.
Le test de Lang évalue le sens stéréoscopique. Il se présente sous l’aspect d’une plaquette rigide et maniable en format de poche (14,5 × 9 cm) sur laquelle sont représentés trois stéréogrammes : l’étoile, le chat et la voiture (fig. 3-11). Il existe des cas où la réponse de l’enfant est intermédiaire ou douteuse.
La classification adoptée est donc la suivante :
Lang positif : perception nette du relief et désignation précise des trois dessins; pour les tout petits (< 2 ans), le fait de montrer les objets est considéré comme un critère positif;
Lang négatif : pas de perception nette des dessins et du relief;
Lang limite : cas incertains, l’enfant perçoit le chat seul ou des formes en relief non définies.
Au terme de cet examen moteur, l’ophtalmologiste doit avoir dépisté l’existence d’un déséquilibre, et l’avoir caractérisé. L’orthoptiste confirmera et mesurera la valeur de la déviation au cours d’un premier bilan orthoptique, ce qui implique une coopération forte du binôme ophtalmologiste-orthoptiste pour la prise en charge de l’enfant.

Fig. 3-11 Évaluation du sens stéréoscopique au test de Lang.
L’évaluation de la fonction visuelle peut se faire par le déclenchement du nystagmus optocinétique (NOC), c’est-à-dire un mouvement de poursuite d’une cible en mouvement (tambour de Barany). Le pouvoir de résolution est déterminé par le plus petit stimulus de valeur angulaire connu qui déclenche le nystagmus : ce stimulus est constitué par un réseau de raies noires sur fond blanc de plus en plus fines jusqu’à la perception d’une surface grise uniforme, le mouvement de poursuite étant alors arrêté. Cependant cette méthode est peu sÛre dans l’évaluation de l’acuité visuelle et permet surtout de savoir s’il y a perception visuelle ou non, cette technique est réservée au nourrisson.
La technique du regard préférentiel est la méthode qui se rapproche le plus des réponses comportementales verbales données par l’enfant plus grand, cette méthode est souvent appelée le « bébé vision » . La technique est fondée sur le fait que l’enfant préfère fixer un stimulus structuré plutôt qu’un champ homogène. Cette méthode d’évaluation subjective dépend de la coopération de l’enfant. Il s’agit de l’évaluation d’une acuité visuelle par résolution (distance de séparation entre 2 lignes d’un réseau) qui est une acuité moins élaborée que celle impliquant une reconnaissance de formes. Elle permet une évaluation plus qu’une cotation, et l’attention doit être surtout portée sur l’égalité des réponses entre les deux yeux afin de détecter une amblyopie débutante. Ainsi, si cette technique est réalisable dès le 9e mois, elle ne mesure en aucun cas une valeur d’acuité fovéale comme les échelles classiques d’acuité, et ne doit pas être utilisée comme test de dépistage isolé. Elle permet surtout de rechercher l’existence d’une asymétrie des réponses. Au-delà de 14 mois, cette technique perd de son intérêt, car l’enfant plus facilement distrait se désintéresse des mires des cartes de Teller.
Entre 14 et 30 mois, il existe une traversée du « désert ophtalmologique » sans test fiable pour cette mesure précise de l’acuité. C’est alors essentiellement l’analyse critique du comportement visuel (fixation, poursuite, nystagmus, etc.) confrontée à l’examen clinique qui guide la conduite à tenir et le suivi des enfants.
C’est un acte médical essentiel de l’examen systématique. Il peut être réalisé à tout âge avec des réfractomètres fixes ou portables afin d’éviter les erreurs dues à l’accommodation sur la mire.
La cycloplégie est obtenue par des substances qui bloquent les réponses aux stimulations cholinergiques du sphincter de l’iris et du muscle ciliaire entraînant à la fois une dilatation de la pupille et une paralysie de l’accommodation. On peut obtenir une cycloplégie rapide le jour même de l’examen par instillation de collyre au cyclopentolate (Skiacol®) à 0,5 % , en respectant les contre-indications chez les enfants de plus de 1 an. En cas de contre-indication, on pratiquera une instillation de collyre au sulfate d’atropine. Il est donc important de prévenir de la gêne occasionnée par une exposition solaire.
La mesure réfractive se fait mais par réfractométrie automatisée portable. Si une amétropie est retrouvée au-delà des valeurs physiologiques, il existe alors un double risque de strabisme et surtout d’amblyopie. Ce risque d’amblyopie est évalué à près de 48 % si la sphère est supérieure à 3,5 D, le cylindre supérieur à 1 D et l’anisométropie supérieure à 1 D. Une prévention active est nécessaire par la prescription de la correction optique totale (voir chapitre 2).
Si l’interrogatoire ne diffère pas de celui du nouveau-né, le praticien s’attache à vérifier que le développement général est normal, et qu’il n’a pas de suivi pédiatrique particulier. Il sera particulièrement sensible à la morphologie générale et oculo-orbito-faciale, de même qu’à l’apparition d’un torticolis.
Dès que l’enfant est un peu plus grand, l’examen ne pose généralement pas de difficulté (fig. 3-12). L’enfant est debout sur le siège ou assis sur un rehausseur en mousse et se tient de part et d’autre de l’appui-tête de la lampe à fente.
L’examen du globe vérifie l’aspect des paupières, de la cornée, des milieux transparents comme précédemment décrit. L’examen du segment antérieur doit être réalisé avant et après dilatation, pour juger de la qualité du réflexe photomoteur. L’analyse clinique du segment antérieur et du segment postérieur reprend une exploration plan par plan des différentes tuniques et structures oculaires, avec l’ophtalmoscopie indirecte au casque ou bien, dès que l’enfant devient coopérant, par un examen à la lampe à fente classique. L’examen est complété par la prise systématique du tonus oculaire au tonomètre à air ou au tonomètre à aplanation (lampe à fente).
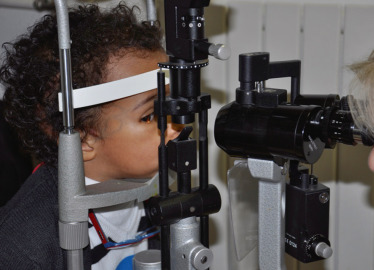
Fig. 3-12 Examen à la lampe à fente d’un enfant âgé de 18 mois.
Après l’âge de 2 ans et demi, l’acuité visuelle fovéale est fiable et l’enfant est capable de répondre aux optotypes. Ceux-ci permettent d’évaluer la capacité visuelle par l’angle, en minutes d’arc, sous lequel apparaissent les détails qui constituent le test utilisé. Les tests sont nombreux; on dispose de différentes familles de tests (Tableau. 3-2).
La valeur de l’acuité visuelle varie d’un auteur à l’autre, l’acuité de 10/10 est obtenue entre 4 et 6 ans. Lors de la toute première consultation, le début de l’examen se fait en binoculaire, puis l’examen est poursuivi un œil après l’autre, en commençant par l’œil fixateur s’il y a un strabisme. L’inverse sera fait lorsqu’un traitement amblyopique est en cours.
Mieux vaut se contenter d’une acuité visuelle à 8/10 et examiner les deux yeux, que d’être obligé d’interrompre l’examen, lorsqu’on est resté trop longtemps sur l’acuité d’un œil. Le but principal n’est pas de chiffrer à la perfection l’acuité, mais de déterminer s’il existe une différence d’acuité entre les deux yeux. En d’autres termes ce qui importe, dans ce premier temps, c’est de faire la preuve de la présence ou de l’absence de l’amblyopie, c’est-à-dire de la différence d’acuité entre les deux yeux. On peut retenir grossièrement que « l’enfant doit avoir deux fois son âge en acuité visuelle » sinon il existe une amblyopie (4/10 à 2 ans, 6/10 à 3 ans et ainsi de suite avec l’exigence d’avoir 10/10 à 5 ans).

Fig. 3-13 Échelle d’acuité visuelle PEDIG.
Parmi les tests les plus utilisés, le test du E de Snellen est ludique et permet l’adhésion de plus grande majorité des enfants, bien qu’il soit également un test directionnel, impliquant des notions de latéralisation (si les réponses sont nettes pour les directions en haut et en bas, elles peuvent l’être moins pour les directions à gauche ou à droite). Dans le déroulement du test du E de Snellen, l’enfant doit indiquer soit par la direction de la main, soit à l’aide du même test tenu à la main, le sens de la direction du E.
Pour les tests dessins dont les plus répandus sont le test de Rossano-Weiss et le test de Pigassou, l’enfant peut répondre verbalement ou par appariement. Il est conseillé alors de fournir aux parents sur un support papier les différents optotypes de ces tests afin que l’enfant soit familiarisé avec les dessins présentés.
D’autres tests pour enfant utilisent des lettres (cercle d’action pour le dépistage des troubles visuels de l’enfant ou CADET), mais par rapport aux échelles de Parinaud, ce sont des tests simplifiés avec un nombre de lettres restreint. Ils peuvent être employés dès la scolarisation de l’enfant.
Parmi tous les tests de mesure de l’acuité visuelle chez l’enfant, seules les méthodes d’évaluation décrites par le Pediatric Eye Disease Investigator Group (PEDIG) [5] sont rigoureusement validées. Ces techniques, inspirées des méthodes Early Treatment Diabetic Retinopathy Study (ETDRS), sont adaptées aux enfants en tenant compte de leur fatigabilité : un seul optotype est présenté à la fois sur un moniteur, entouré de barres, ce qui augmente la sensibilité pour la détection d’une amblyopie fonctionnelle (fig. 3-13).
Dans tous les cas, la mise en confiance de l’enfant pourra améliorer sa coopération d’une consultation à l’autre; on pourra le rassurer en le laissant sur les genoux du parent et on gardera à l’esprit que l’examen doit se dérouler comme un jeu pour lui.
L’utilisation de ces optotypes nécessite le respect de quelques recommandations :
les différentes échelles d’acuité ne testent pas le même type d’acuité : acuité angulaire pour les échelles directionnelles, acuité morphoscopique pour les symboles et les tests images. Les résultats ne seront donc pas comparables;
les méthodes d’évaluation d’acuité visuelle par appariement peuvent encore être utiles chez les enfants timides ou présentant un retard psychomoteur;
la mesure de l’acuité visuelle doit débuter par l’œil amblyope, si celui-ci prend correctement la fixation, cette mesure demandant le plus de concentration;
les tests sont prévus pour être utilisés à une distance donnée. La distance de lecture des enfants est souvent plus faible, il faudra en tenir compte pour l’évaluation de l’acuité visuelle aussi bien de loin que de près. Chez les plus grands, la distance peut être de 5 mètres, chez les plus petits, grâce à certains tests récents (animaux), elle peut être de 2,50 mètres (Tableau. 3-3);
il faut utiliser toujours le même test et dans les mêmes conditions (éclairage, distance dans une ambiance calme) à chaque examen. Un enfant lit spontanément à une distance différente de celle de l’adulte, classiquement à une distance bras semi-fléchis, soit 18 cm, ce qui interfère sur la valeur du test de l’échelle de Parinaud. Ainsi un test de Parinaud P2 lu a 33 cm devient un test P3 s’il est lu à une distance de 18 cm;
l’optotype utilisé doit comporter des signes groupés et non un signe isolé qui peut donner une acuité surévaluée (crowding effect). L’acuité doit être mesurée avec et sans correction, en position de torticolis s’il y a lieu, en monoculaire et en binoculaire notamment dans les cas de nystagmus.

Fig. 3-14 Examen à la lampe à fente d’un grand enfant.

Fig. 3-15 Test de lecture d’un enfant scolarisé.
Les techniques d’examen ne diffèrent plus de celles de l’examen du grand enfant ou même de l’adulte (fig. 3-14), en dehors des difficultés d’expression orale parfois rencontrées et des variations liées au relevé de la valeur de l’acuité visuelle utilisant des tests avec optotypes ou des échelles d’acuité visuelle différentes (fig. 3-15). Même si l’enfant est bientôt ou déjà scolarisé, il faut savoir, au cours du déroulement de l’examen, rester dans le jeu pour mettre l’enfant en confiance.
Peu d’éléments diffèrent dans la pratique clinique, les difficultés rencontrées sont celles de la pratique pédiatrique générale. Dans cette classe d’âge, il est possible de réaliser l’ensemble de l’examen clinique avec notamment la prise de la tension oculaire, par tonomètre à air (fig. 3-16a) ou à l’aplanation (fig. 3-16b) avec pachymétrie (fig. 3-16c); ces mesures peuvent être éventuellement précisées avec l’évaluation de la biomécanique cornéenne (fig. 3-16d à f). En effet, l’appareil de mesure de la biomécanique cornéenne permet dans un même temps les mesures très précises de la pression intra-oculaire (PIO), de la pachymétrie et de l’élasticité cornéenne. Les avantages de cette technique sont : une première mesure déterminée avec précision même si l’apex est décentré; une mesure non perturbée par une mauvaise fixation de l’enfant; une capture automatique non utilisateur-dépendante. Ces mesures sont particulièrement utiles dans les pathologies telles que le glaucome congénital et juvénile, où elles permettent un meilleur dépistage d’une aggravation et, par conséquent, une meilleure prise en charge de ces pathologies cécitantes.
Les autres examens pratiqués sont la rétinophotographie non mydriatique (fig. 3-17), la tomographie à cohérence optique (optical coherence tomography [OCT]) (fig. 3-18), le champ visuel, l’électrophysiologie (voir plus loin EXAMENS PARACLINIQUES). Les particularités de l’examen sont dues aux difficultés de réalisation et d’interprétation; pour l’OCT et le champ visuel statique, rappelons qu’il n’existe pas de programme normatif adapté à l’enfant ou à l’adolescent. Dans le cadre particulier d’une amétropie forte ou d’une cataracte, le recours à une analyse biométrique par biomètre sans contact (fig. 3-19), mesurant à la fois les valeurs de la longueur axiale, de la pachymétrie, de la profondeur de la chambre antérieure et de la puissance du cristallin, doit être réalisée pour orienter la prise en charge médicale ou chirurgicale.
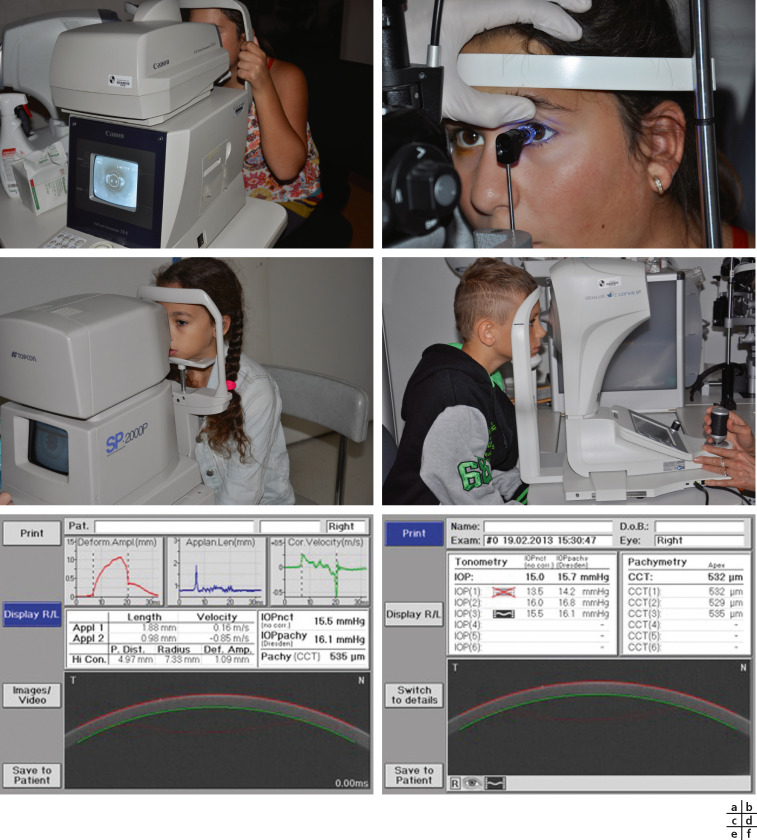
Fig. 3-16 Mesure de la pression intra-oculaire.
a. Tonométrie à air. b. Tonométrie à aplanation. c. Pachymétrie. d-f. Analyse de la biomécanique cornéenne Corvis®.
À chaque âge de l’enfant, l’ophtalmologiste se doit de conserver un lien de confiance sans jamais perdre patience afin d’aller au bout de sa démarche clinique. Parce que toute prise en charge ophtalmopédiatrique dépend des données recueillies au cours de l’examen clinique, le praticien se doit non seulement de connaître les étapes du développement visuel, les valeurs normatives pour chaque âge, mais aussi de mettre en œuvre tous les moyens cliniques et paracliniques pour poser un diagnostic. Dans le cadre d’un examen difficile ou incomplet, l’examen doit être effectué sous anesthésie générale. Cette exigence de résultat a pour but d’éliminer avec certitude toute pathologie engageant le pronostic visuel et/ou vital de l’enfant.
Cet examen ophtalmologique exige donc des qualités éthiques de rigueur, la connaissance des pathologies cécitantes de l’enfant, l’enjeu essentiel étant le dépistage et la prise en charge précoce des pathologies curables ou non.
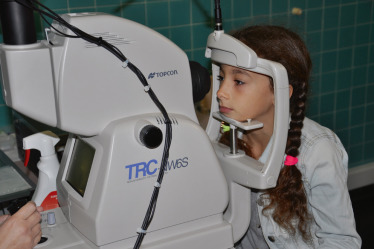
Fig. 3-17 Rétinophotographie non mydriatique.
Fig. 3-18 Tomographie à cohérence optique.
Fig. 3-19 Biométrie sans contact Lenstar LS 900®.
[1] Laroche GR Examination, history and special tests in pediatric ophthalmolgy Pediatric ophthalmology and strabismus : Elsevier Saunders (2013). 45-54section 2, chap. 7.
[2] Denis D, Wary P, Fogliarini C, et al. Facteurs de risque de l’ésotropie précoce J Fr Ophtalmol 2006 ; 29 : 103-109
[3] Moller HU Milestones and Normative Data Pediatric ophthalmology and strabismus : Elsevier Saunders (2013). 36-44section 1, chap. 6.
[4] Speeg-Schatz C Examen de l’enfant strabique Péchereau A. Dir. Strabisme. Rapport de la SFO : Elsevier Masson (2013). 171-182
[5] Audren F Évaluation de la fonction monoculaure Péchereau A. Dir. Strabisme. Rapport de la SFO : Elsevier Masson (2013). 27-39
M. Callet, A. Aziz-Alessi , D. Denis
Le développement de l’œil de l’enfant, régi par un ordre méticuleusement séquencé, aboutit à l’œil adulte. Les paramètres, témoins de ce développement aux différents âges, permettent de préjuger du caractère physiologique ou pathologique des observations cliniques.
La mesure du diamètre cornéen est indispensable pour le diagnostic des glaucomes de l’enfant et de la mégalocornée congénitale.
Voir Tableau. 3-4 et fig. 3-20.
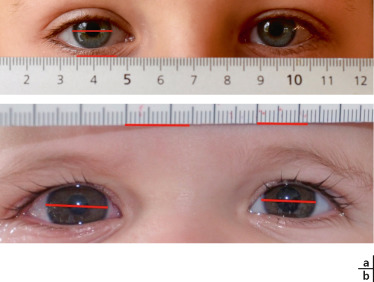
Fig. 3-20 Photographie du diamètre cornéen de l’enfant avec une réglette apposée au niveau du front.
Après modification de l’image sur ordinateur, on peut obtenir une valeur du diamètre : ici à 12 mm chez un enfant de 6 ans. a. Enfant présentant un diamètre cornéen normal pour l’âge. b. Enfant présentant une mégalocornée droite dans le cadre d’un glaucome congénital de découverte retardée.
La mesure de la pachymétrie est indispensable chez l’enfant et en particulier dans le glaucome [1].
Voir Tableau. 3-5.
Les propriétés biomécaniques de la cornée ou hystérèse cornéenne sont estimées à 10,88 ± 1,78 mmHg chez les enfants d’âge scolaire avec un facteur de résistance cornéenne de 11,46 ± 1,69 mmHg [2]. Ces données, qui permettent d’évaluer au plus juste la PIO, peuvent être obtenues par le biais de l’ocular response analyser (ORA) ou plus récemment par le corneal visualization Corvis® ST (Scheimpflug Technology) qui sont des techniques émergentes ayant démontré le potentiel de caractérisation des propriétés biomécaniques de la cornée, utiles notamment dans le dépistage du kératocône de l’enfant.
Les valeurs de référence de la longueur axiale chez le fœtus (obtenues par études anatomopathologiques [3, 4]) et chez le jeune enfant sont présentées dans le Tableau. 3-6.
Après 10 ans, le diamètre est stable (variable selon myopie ou pas); l’épaisseur quant à elle continue d’augmenter (Tableau. 3-7) [5].
La profondeur de la chambre antérieure diminue du fait de l’augmentation de l’épaisseur du cristallin (Tableau. 3-8) [5].
Au 3e trimestre de la grossesse, la largeur de la pars plana est de 1,17 mm (1/3 de la valeur adulte). La distance entre le limbe sclérocornéen et l’ora serrata est de 3,22 mm en nasal et de 3,33 mm en temporal.
Cinquante pour cent de la croissance du nerf optique et du disque est obtenue à la 20e semaine de gestation, 75 % à la naissance et 95 % avant l’âge de 1 an. Le diamètre vertical du disque optique, l’aire du disque ainsi que le rapport cup/disk sont significativement plus larges chez les enfants mélanodermies que chez les Caucasiens [6].
Le développement de la tête du nerf optique a fait l’objet d’une étude récente de grande ampleur concernant 352 enfants dont les résultats sont détaillés dans le Tableau. 3-9 [7, 8] procurant désormais des bases normatives utiles en pratique courante.
L’évolution de la PIO normale chez l’enfant varie de la naissance à l’adolescence. Les valeurs de référence sont décrites dans le Tableau. 3-10 [9].
La croissance de l’œil se fait en majorité dans la première année de vie. La distance entre l’insertion des muscles oculomoteurs droits et le limbe augmente avec l’âge d’environ 1 mm pour aboutir à l’âge adulte à des distances respectives entre le limbe et les muscles droit médial, droit inférieur, droit latéral et droit supérieur, d’environ 5, 6, 7 et 8 mm (classique spirale de Tillaux) (fig. 3-21).
L’acuité visuelle augmente pendant les premières années de vie (Tableau. 3-11).
L’évaluation des capacités de vision stéréoscopiques de l’enfant est décrite dans le Tableau. 3-12.

Fig. 3-21 Distance d’insertion des muscles oculomoteurs au limbe cornéen.
Chez le nourrisson, la perception de l’espace est limitée à 20° de part et d’autre du point de fixation en verticalité et 30° en horizontalité.
Le champ visuel temporal bénéficie d’une importante maturation pour arriver vers l’âge de 1 an à des valeurs proches de celles de l’adulte : le champ visuel nasal mature plus rapidement que le champ visuel temporal (Fig. 3-22).
En pratique, l’examen du champ visuel est difficile avant l’âge de 8 à 9 ans.
L’analyse de la distance intercanthale est capitale dans les syndromes d’alcoolisation fœtale et lors de malformations craniofaciales. On distingue la distance intercanthale interne de la distance intercanthale externe, dont les bases normatives figurent dans le Tableau. 3-13 [10].

Fig. 3-22 Développement du champ visuel binoculaire de l’enfant.
Connaître les valeurs normatives de la biométrie oculaire en fonction de l’âge de l’enfant est un prérequis indispensable à la prise en charge des pathologies ophtalmopédiatriques.
La croissance du globe oculaire se fait essentiellement durant les deux premières années de vie; elle est surtout marquée au niveau de la sclère et minime au niveau de la cornée : la surface de la cornée à la naissance représente les trois quarts de celle de l’adulte, alors que la surface sclérale moyenne à la naissance correspond à un tiers de celle de l’adulte et le volume du globe à la moitié de celui de l’adulte.
Les propriétés biomécaniques oculaires font l’objet d’un intérêt croissant actuellement, car le succès de nombreuses techniques chirurgicales est grandement influencé par la biomécanique et le remodelage des tissus ciblés et leur analyse tend à faire partie de l’examen de routine.
[1] Pediatric Eye Disease Investigator Group, Bradfield YS, Melia BM, Repka MX, et al. Central corneal thickness in children Arch Ophthalmol 2011 ; 129 : 1132-1138
[2] Huang Y, Lin S, Ma D, et al. Corneal biomechanical properties and associated factors in school-age children Eye Sci 2013 ; 28 : 34-39
[3] Denis D, Burguière O, Burillon C A biometric study of the eye, orbit, and face in 205 normal human fetuses Invest Ophthalmol Vis Sci 1998 ; 39 : 2232-2238
[4] Lods F, Fast M L’œil du nouveau-né et ses particularités Clinique d’ophtalmo-pédiatrie : Vigot (1989). 30-43
[5] Hoyt C, Taylor D Pediatric ophthalmology and strabismus : Elsevier Saunders (2013). 36-44chap. 6.
[6] Mansour AM Racial variation of optic disc parameters in children Ophthalmic Surg 1992 ; 23 : 469-471
[7] Patel A, Purohit R, Lee H, et al. Optic nerve head development in healthy infants and children using handheld spectral-domain optical coherence tomography Ophthalmology 2016 ; 123 : 2147-2157
[8] Huynh SC, Wang XY, Burlutsky G, et al. Retinal and optic disc findings in adolescence : a population-based OCT study Invest Ophtalmol Vis Sci 2008 ; 49 : 4328-4335
[9] Pensiero S, Da Pozzo S, Perissutti P, et al. Normal intraocular pressure in children J Pediatr Ophthalmol Strabismus 1992 ; 29 : 79-84
[10] Laestadius ND, Aase JM, Smith DW Normal inner canthal and outer orbital dimensions J Pediatr 1969 ; 74 : 465-468
R. Dumont, E. Bui Quoc, S. Ajzenf isz, O. Bourdon, S. Prot-Labarthe
La problématique de la galénique des médicaments est une question générale en pédiatrie. En ophtalmologie pédiatrique, elle concerne en particulier les collyres, notamment les collyres mydriatiques. Plusieurs questions très courantes se posent au praticien à ce sujet : quelle dilatation des pupilles pratiquer? avec quels produits et quelles contre-indications? quelles posologies choisir?, etc.
Une autre question est celle des personnes habilitées à dilater les pupilles, à la fois dans un but réfractif, mais peut-être même avec un but d’examen anatomique, puisqu’il existe des moyens automatisés de photos du fond d’œil, même chez l’enfant, avec des appareils portables, dont les images pourraient faire l’objet d’un diagnostic à distance, etc. C’est une autre question qui concerne la délégation des tâches, à des infirmiers(ières), à des orthoptistes, etc.
Pour revenir à la problématique de la dilatation chez l’enfant, il faut souligner que de façon générale, très souvent, certains médicaments n’ont pas l’indication chez l’enfant ou sont présentés sous une forme galénique inadaptée [1]. De plus, les posologies dans la population pédiatrique ne sont pas toujours précisées, notamment chez les nouveau-nés, les nourrissons ou encore les prématurés et cela peut entraîner des conséquences préjudiciables de l’utilisation des médicaments si des posologies inadaptées sont employées [2].
Les collyres mydriatiques ont trois indications différentes et complémentaires :
la mydriase : elle permet de dilater les pupilles et faire l’examen du fond d’œil;
la cycloplégie : elle est indispensable pour réaliser une réfraction correcte et précise chez un enfant, grâce à la mise au repos de l’accommodation;
la dilatation : elle peut permettre également la prévention des synéchies iridocristalliniennes en cas d’uvéite.
Des précautions particulières doivent être respectées avec les collyres mydriatiques [3, 4] car ils peuvent engendrer des effets indésirables cardiovasculaires, du fait du risque de passage dans la circulation systémique en particulier avec l’atropine et la phényléphrine [5 - 10].
Cet article a pour but de redéfinir le protocole de prescription des collyres mydriatiques et cycloplégiants, les règles de leur administration et de leur utilisation avec en particulier la mise à disposition d’un nouveau dosage de la phényléphrine (2,5 % ). L’objectif est de réviser les protocoles en cours, en recensant les formes galéniques des collyres disponibles, afin de rappeler les posologies recommandées et préconisées en fonction de l’âge, et d’émettre des recommandations de bon usage disponibles à tous.
La méthode d’étude a été :
de recenser les collyres mydriatiques disponibles;
d’analyser leurs monographies depuis la base de données Thériaque (Centre national hospitalier d’information sur le médicament [CNHIM]) [11] pour collecter les concentrations et les quantités administrées par goutte, les indications par limite d’âge, les posologies, les modalités d’utilisation;
de contacter les laboratoires directement en cas d’information manquante ou discordante;
de consulter les données des sociétés savantes et leurs recommandations.
Les quatre types de collyres mydriatiques utilisés avec des délais et des durées de mydriase variables, sont les suivants :
l’atropine à 0,3 % , 0,5 % et 1 % ;
le cyclopentolate;
le tropicamide;
la phényléphrine à 2,5 % , 5 % (et 10 % ) (Tableau. 3-14).
L’homatropine collyre n’a pas été étudiée. En effet, l’homatropine possède l’autorisation de mise sur le marché (AMM) pour la cycloplégie et la mydriase mais seulement chez l’adulte; son effet cycloplégiant demeure par ailleurs imprécis (peu d’études valables ont testé d’une part l’effet mydriatique, d’autre part l’effet cycloplégiant) et la durée maximale de la mydriase est de 3 à 4 heures, ce qui est court par rapport à l’atropine et au cyclopentolate. La commercialisation de l’homatropine a été arrêtée en France en octobre 2016.
Il faut souligner et répéter que seuls l’atropine et le cyclopentolate, outre leur effet de dilatation comme le tropicamide et la phényléphrine, ont un effet cycloplégiant reconnu et reproductible, mais que le tropicamide et la phényléphrine n’ont pas d’effet cycloplégiant reconnu et valable.
L’analyse des monographies de tous ces médicaments a pu être délicate car certaines monographies étaient en cours de mise à jour par les laboratoires en 2015/2016. Certaines données en cours de modification ont été fournies par les laboratoires [12]. Ainsi, en 2016, la phényléphrine (Néosynéphrine®) à 5 % n’est plus indiquée pour les moins de 12 ans, mais devient disponible à une posologie de 2,5 % . Il est précisé qu’une goutte contient en moyenne 2,25 mg de substance active pour un volume de 45 µl.
Notre travail de synthèse a conduit à la révision de la rédaction d’une note d’information à l’attention des médecins et des soignants (Encadré 3-2). Cette note rappelle les conseils liés à l’administration des collyres selon l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) [13]. Mais certains aspects ont été rajoutés, en particulier : précision du nombre de gouttes maximal à ne pas dépasser; nécessité de mettre tout flacon de collyre hors de portée des enfants (ressemblance des flacons multidoses avec des petits biberons de jeux d’enfants).
Tableau 3-14 - Présentation des différents collyres mydriatiques : indications, posologies, délais et durées d’action, limites d’âge de l’AMM et limite d’âge conseillée.
Fiche synthétique de recommandation de prescription, d’administration et de surveillance de l’enfant pour les collyres mydriatiques
Contexte 1, 2
Les enfants sont :
plus particulièrement à risque de développer des effets systémiques après l’instillation d’un collyre :
-
atropine : augmentation de la fréquence cardiaque,
phényléphrine : augmentation de la tension artérielle;
plus sensibles aux effets centraux de l’atropine et de dérivés que les adultes.
Des cas graves d’effets indésirables, parfois mortels, ont été rapportés chez des enfants ayant reçu des collyres mydriatiques ou une association de collyres mydriatiques, l’imputabilité pouvant être partagée entre le collyre en soi, le stress de l’examen et la pathologie initiale des enfants.
Rappel des règles d’utilisation 1, 2
Chez le prématuré et le nouveau-né
Conserver une grande prudence lors de l’administration des collyres mydriatiques, en raison notamment des risques digestifs (distension abdominale, iléus, occlusion) et des risques hémodynamiques.
Pour une mydriase, préférer l’utilisation du tropicamide (Mydriaticum®) à celle de l’atropine, compte tenu du profil de tolérance.
Se rappeler que seuls l’atropine et le cyclopentolate ont un effet cycloplégiant.
Chez tous les enfants 1, 2
Tenir compte du délai d’obtention de la mydriase, avant une éventuelle nouvelle administration du produit (voir Tableau. 3-14).
Adapter le dosage de l’atropine à l’âge3 :
-
0-3 ans : 0,3 % ;
3-12 ans : 0,5 % ;
>12 ans : 1 % .
Adapter le dosage de la phényléphrine à l’âge4 :
-
< 12 ans : 2,5 % ;
de 12 à 18 ans : 5 % ;
> 18 ans : 10 % .
Ne pas dépasser les posologies maximales recommandées dans un intervalle de temps donné (respecter l’espacement recommandé entre les instillations).
Limiter l’administration au nombre de gouttes précisé dans le tableau (ne pas doubler l’administration sauf si la première goutte n’a absolument pas atteint l’œil).
Évaluer soigneusement et prendre en compte les risques supplémentaires liés à une éventuelle comorbidité.
Administrer avec précaution chez les patients présentant des symptômes d’une atteinte du système nerveux central.
Faire plus particulièrement attention au risque de surdosage en cas d’iris foncé (les iris foncés se dilatant moins facilement que les iris clairs).
Appuyer sur l’angle interne de l’œil pendant 15 secondes pour occlure les points lacrymaux.
Essuyer sur la joue de l’enfant la partie du collyre administré qui s’y écoule (pour éviter toute ingestion, limiter les effets systémiques et, chez le prématuré, prévenir le risque de passage au travers de la peau).
Vérifier l’efficacité correspondant à une bonne dilatation, sans quoi l’examen sera inutile et non contributif.
Ne pas laisser les collyres à portée des enfants (un flacon peut être assimilé à un petit biberon, etc.).
Pour la néosynéphrine à 2,5 % , la notice d’utilisation précise que, pour le nouveau-né (< 7 jours) et le nourrisson (< 1 an) ancien prématuré, une surveillance tensionnelle et cardiorespiratoire est requise pendant les 30 minutes qui suivent l’instillation.
1.Utilisation des collyres mydriatiques en pédiatrie pour l’obtention d’une mydriase ou d’une cycloplégie à visée diagnostique – Point d’information. (ANSM, novembre 2012.)
2.Collyre à base de phényléphrine 10 % : risque d’effets indésirables graves chez l’enfant de moins de 12 ans. (Lettre aux professionnels de santé ANSM 2011.)
3.http://www.strabisme.net/strabologie/Colloques/StrabPrecoce/StrbPrc_CycloRef/StrbPrc_CycloRef.html consulté le 21 novembre 2016.
4.Micromedex® (Thomson Healthcare).
Certaines incohérences ont été relevées dans les monographies, ce qui peut perturber la pratique et le choix des produits et/ou des posologies obligeant le praticien à un certain arbitrage dans ses choix.
Il existe trois concentrations différentes d’atropine collyre pour couvrir les différentes classes d’âge : 0,3 % , 0,5 % et 1 % (Tableau. 3-14). On peut remarquer que la dose maximale que l’on peut administrer avec de l’atropine 0,3 % est de 558 pg (2 gouttes/œil, 3 fois/j) pour un enfant de 30 à 36 mois, alors qu’elle est seulement de 465 pg (1 goutte/œil, 3 fois/j) avec l’atropine 0,5 % pour un enfant de 3 à 12 ans. Ces doses ont été calculées en prenant en compte le fait qu’une goutte d’atropine 0,3 % et une goutte d’atropine 0,5 % contiennent respectivement 93 pg et 155 pg d’atropine selon les monographies. Une dose maximale plus faible aurait été attendue chez un enfant plus jeune. C’est pourquoi nous recommandons d’utiliser l’atropine 0,3 % et 0,5 % à la dose de 1 goutte/œil, 2 fois/j en posologie usuelle pour leur tranche d’âge respective.
De plus, aucune recommandation de posologie n’est établie pour un nourrisson de moins de 30 mois, avec l’atropine 0,3 % . L’emploi chez les nourrissons de moins de 30 mois, nous amène à utiliser l’atropine 0,3 % à la même posologie que chez les nourrissons de 30 à 36 mois hors AMM. L’atropine 1 % existe sous deux formes : unidose de 0,4 ml (Atropine Faure®, Europhta) et multidose de 10 ml (Atropine Alcon®, Alcon). L’unidose délivre 500 pg d’atropine par goutte, tandis que le flacon multidose délivre 310 pg d’atropine par goutte.
Concernant la phényléphrine (Néosynéphrine®), plusieurs incohérences existent dans les monographies. En effet, selon les monographies, 1 goutte de phényléphrine 2,5 % contient 0,75 mg de phényléphrine, alors que 1 goutte de phényléphrine 5 % contient 2,25 mg de phényléphrine et 1 goutte de phényléphrine 10 % contient 3,4 mg ou 4,5 mg de phényléphrine (respectivement pour les conditionnements en unidose ou multidose). Le volume des gouttes délivrées par administration varie selon les présentations de phényléphrine : 30 pl pour le dosage à 2,5 % , 45 pl pour le dosage à 5 % , entre 28 et 42,8 µl pour l’unidose à 10 % et 45 µl pour la forme multidose à 10 % . Ces variations seraient expliquées par la méthode d’ouverture variable de l’unidose ou du flacon (languette d’ouverture coupée manuellement) et le degré d’inclinaison du collyre lors de l’administration, paramètre bien difficile à contrôler en pratique, etc.
Quoi qu’il en soit, la nouvelle présentation de la phényléphrine (Néosynéphrine®) 2,5 % doit être désormais recommandée chez les enfants.
Le tableau récapitulatif proposé est un outil pratique pour l’aide à la prescription des collyres mydriatiques et cycloplégiants. Il résume l’utilisation des collyres mydriatiques dans l’obtention d’une mydriase ou d’une cycloplégie chez les enfants. Notre étude en cours de publication [14] permet d’établir une source d’information synthétique et simple pouvant répondre au besoin de tous les professionnels de santé en pédiatrie et en ophtalmologie pédiatrique. Les outils présentés permettent de retrouver facilement les posologies de chaque collyre et évitent aux professionnels de devoir recroiser les sources d’information qui sont variées et parfois contradictoires.
Ces outils peuvent servir de référence en tant que conseils d’utilisation mais aussi en tant qu’information pour les posologies des collyres mydriatiques et cycloplégiants selon les tranches d’âge.
Les recommandations de l’ANSM de 2012 concernant l’utilisation des collyres mydriatiques en pédiatrie pour l’obtention d’une mydriase ou d’une cycloplégie à visée diagnostique peuvent être consultées à l’adresse : http://ansm.sante.fr/S-informer/Points-dinformation-Points-d-information/Utilisation-des-collyres-mydriatiques-en-pediatrie-pour-l-obtention-d-une-mydriase-ou-d-unecycloplegie-a-visee-diagnostique-Point-d-information.
La fiche d’information de la Société française d’ophtalmologie concernant l’utilisation des collyres mydriatiques en pédiatrie pour la dilatation pupillaire : prématurés, nouveau-nés, enfants peut être consultée à l’adresse : http://sfo.dev.saegir.cyim.com/professionnels/fiches-dinformations-aux-medecins#Collyres% 20myadriatiques
[1] Joret-Descout P, Bataille J, Brion F, et al. Attitudes and experiences of off-label prescribing among paediatricians in a French university teaching hospital Ann Pharm Fr 2016 ; 74 : 222-231
[2] Ekins-Daukes S, Helms PJ, et al. Off-label prescribing to children : attitudes and experience of general practitioners Br J Clin Pharmacol 2005 ; 60 : 145-149
[3] Elibol O, Alçelik T, Yüksel N, et al. The influence of drop size of cyclopentolate, phenylephrine and tropicamide on pupil dilatation and systemic side effects in infants Acta Ophthalmologica Scandinavica 1997 ; 75 : 178-180
[4] Wheatcroft S, Sharma A, McAllister J Reduction in mydriatic drop size in premature infants Br J Clin Pharmacol 1993 ; 77 : 364-365
[5] Abdelhalim AA, Mostafa M, et al. Severe hypertension and pulmonary edema associated with systemic absorption of topical phenylephrine in a child during retinal surgery Saudi J Anaesthesia 2012 ; 6 : 285-288
[6] Bolt B, Benz B, Koerner F, et al. A mydriatic eye-drop combination without systemic effects for premature infants : a prospective double-blind study Journal of Pediatric Ophthalmology and Strabismus 1992 ; 29 : 157-162
[7] Calenda E, Richez F, Muraine M Acute hypertension due to phenylephrine eyedrops in a newborn Can J Ophthalmol 2007 ; 42 : 486
[8] Oğüt MS, Bozkurt N, Ozek E, et al. Effects and side effects of mydriatic eyedrops in neonates Eur J Ophthalmol 1996 ; 6 : 192-196
[9] Sindel BD, Baker MJ, Maisels, et al. A comparison of the pupillary and cardiovascular effects of various mydriatic agents in preterm infants Journal of Pediatric Ophthalmology and Strabismus 1986 ; 23 : 273-276
[10] Tsui E, Sehi M, Cheng RW, et al. The impact of topical mydriatic ophthalmic solutions on retinal vascular reactivity and blood flow Exp Eye Res 2013 ; 112 : 134-138
[11] Thériaque, base de données http://www.theriaque.org/apps/contenu/accueil.php
[12] Europhta Le laboratoire de L’unidose, spécialisé en produit pharmaceutique à visée ophtamologique http://www.laboratoires-europhta.com/contact
[13] ANSM Utilisation des collyres mydriatiques en pédiatrie pour l’obtention d’une mydriase ou d’une cycloplégie à visée diagnostique : recommandations 2012. En ligne : http://ansm.sante.fr/S-informer/Points-d-information-Points-d-information/Utilisation-des-collyres-mydriatiques-en-pediatrie-pour-l-obtention-d-une-mydriase-ou-d-une-cycloplegie-a-visee-diagnostique-Point-d-information 2012.
[14] Dumont R, Bui Quoc E, Ajzenfisz S, et al. Collyres mydriatiques en pédiatrie Arch Ped 2016 ; (sous presse).
S. Defoort-Dhellemmes et I. Drumare, X. Zanlonghi, V. Smirnov, D. Basset, V. Canel
Les examens fonctionnels de la vision (EFV) – potentiels évoqués visuels (PEV), électrorétinogramme (ERG), champ visuel (CV) et vision des couleurs (VC) – contribuent chez l’enfant au diagnostic étiologique précis et précoce d’une déficience visuelle. Savoir quelle est la pathologie en cause permet d’avoir d’emblée une idée de son retentissement sur l’ensemble des fonctions visuelles et sur leur évolutivité. Ces notions sont indispensables à connaître pour décider s’il faut, et dans quel délai, demander des examens complémentaires (IRM, bilan pédiatrique, bilan génétique) et diriger l’enfant vers des services médico-sociaux prenant en charge les déficients visuels.
Les PEV et l’ERG sont réalisables à tout âge, les examens de la VC et du CV sont intéressants chez le grand enfant non seulement pour le diagnostic mais surtout pour suivre l’évolution de l’atteinte visuelle et déterminer les aptitudes et le handicap.
Aussitôt qu’est constaté : un comportement de malvoyance ou de cécité et/ou un nystagmus précoce (une acuité visuelle basse), un comportement évoquant une anomalie du CV (une héméralopie et/ou une gêne au changement d’éclairage), une photophobie importante.
Essentiellement lorsque le fond d’œil est normal ou que l’atteinte de la fonction visuelle ne paraît pas correspondre à l’anomalie visible au fond d’œil ou à la tomographie par cohérence optique (optical coherence tomography [OCT]).
Chez les enfants souffrant d’une maladie générale ou de symptômes généraux pouvant s’associer à une atteinte de la rétine et des voies visuelles.
En cas d’antécédents familiaux de rétinopathie ou de neuropathie héréditaire.
Cette place dépend de l’âge de l’enfant, des données de l’examen clinique mais aussi de l’accessibilité de ces examens par rapport aux examens d’imagerie oculaire et cérébrale.
Il n’est pas utile que l’enfant soit à jeun pour un examen fonctionnel. Il est souhaitable d’expliquer aux parents et à l’enfant son déroulement, son intérêt et son caractère indolore mais plus ou moins contraignant. Il est recommandé pour les examens électrophysiologiques de suivre les standards de l’International Society For Electrophysiology of Vision (ISCEV) [1, 2].
Pour interpréter un examen fonctionnel chez l’enfant de façon fiable, il faut connaître :
les conditions d’examen. L’ophtalmologiste, s’il n’est pas le réalisateur de l’examen, doit donc exiger de ce dernier qu’elles soient précisément décrites;
l’aspect normal qui évolue avec la maturation
Les conditions d’examen et les protocoles d’étude des examens électrophysiologiques sont traités au chapitre 5.10 que nous vous conseillons de lire avant d’aborder ce chapitre.
Les PEV par damiers permettent d’évaluer l’acuité visuelle objective. Ils contribuent, avec les PEV flash, au diagnostic des atteintes du nerf optique et des voies visuelles et renseignent sur la maturation cérébrale car leur forme varie avec elle (fig. 3-23).
Le PEV est un signal de faible voltage noyé dans un bruit de fond (constitué de l’électro-encéphalogramme et de signaux parasites issus du patient ou de l’environnement) duquel il faut l’extraire. Chez l’enfant, le manque d’attention diminue le nombre de signaux enregistrés et l’agitation augmente les artefacts d’origine musculaire ou liés au mauvais contact des électrodes. Il est donc nécessaire pour obtenir un examen fiable :
Il existe plusieurs protocoles de PEV qui diffèrent selon le mode, la fréquence spatiale et la fréquence temporelle de stimulation. Le choix du protocole dépend du diagnostic évoqué à l’issue de l’examen clinique (voir chapitre 5.10).
Des PEV altérés (de latence augmentée et/ou de faible amplitude, voire plats, ou déstructurés), chez un enfant qui a une baisse d’acuité visuelle (BAV) non expliquée par l’examen clinique, font évoquer une neuropathie optique sans préjuger de son étiologie (fig. 3-24). Cependant, avant de poser ce diagnostic, il faut s’assurer que :
-
la correction optique est adaptée, qu’il n’y a aucun trouble des milieux ni de cause d’amblyopie fonctionnelle, car toute atteinte sur le trajet du faisceau maculaire peut être cause d’altération du PEV par damiers (baisse d’amplitude proportionnelle à la BAV ± retard de latence);
l’enfant a bien regardé l’écran pendant toutes les stimulations et n’a pas fait de spasme accommodatif. Dans le doute, il est souhaitable de refaire l’examen, si possible dans la même session après cycloplégie (cyclopentolate) et correction optique totale adaptée à la distance de l’écran (voir chapitre 5.10).
Si le PEV par damiers standard est normal (mais altéré aux plus petits damiers) et la BAV relative, une maculopathie débutante (exemple : Stargardt, hypoplasie maculaire) ou une compression tumorale (craniopharyngiome surtout) sera à rechercher après s’être assuré qu’il ne s’agit pas d’une amblyopie fonctionnelle insuffisamment traitée ou liée à un microstrabisme.
Si le PEV par damiers standard est normal et que l’enfant a une BAV massive, il s’agit probablement d’une cause non organique.
Le PEV par damiers standard peut être intéressant pour dépister une atteinte débutante du nerf optique dans la neurofibromatose de type 1 (NF1) ou lors de traitements neurotoxiques comme l’éthambutol ou pour surveiller l’évolution de certaines pathologies des voies visuelles quand le champ visuel n’est pas réalisable (exemple : gliome des voies optiques) (voir chapitre 22).
Le PEV flash est indiqué en cas de comportement de cécité ou de malvoyance profonde ou quand il n’y a pas de réponse au PEV par damiers. Contrairement au PEV par damiers, il ne nécessite pas l’attention de l’enfant et il est peu influencé par les troubles de réfraction et des milieux.
Son altération (PEV plat, déstructuré) signe une atteinte organique sévère (fig. 3-25). Elle est de mauvais pronostic dans les anomalies des nerfs optiques (exemple : hypoplasie des nerfs optiques, colobome papillaire) [6], mais n’a de valeur pronostique chez l’enfant ni dans les neuropathies optiques inflammatoires ou démyélinisantes, ni dans les cécités corticales pour lesquelles la récupération ad integrum est parfois possible [3].
Si le PEV flash est normal, il n’y a pas d’atteinte majeure des voies optiques, mais cela n’exclut pas la possibilité d’une amblyopie fonctionnelle, d’une anomalie CV ou d’une cécité corticale.
Un aspect immature (correspondant à un PEV de nouveau-né) retrouvé chez un enfant cérébro-lésé est lié à une immaturité des voies visuelles mais n’est pas un synonyme de malvoyance. Chez un enfant qui a un trouble des milieux occultant le fond d’œil, il témoigne d’un trouble survenu dans les premiers mois de vie. Il est aussi retrouvé chez un enfant qui dort profondément.

Fig. 3-23 Maturation du PEV flash.
Avec l’âge, le pic principal P2 du PEV apparaît puis diminue de latence et d’amplitude, le tracé s’enrichit en composantes précoces puis tardives. Il existe une très grande variabilité interindividuelle dans la rapidité de maturation.
S’il y a une réponse au damier chez un bébé de moins de 3 mois avec un comportement de cécité sans nystagmus qui a des réflexes pupillaires normaux, un fond d’œil normal ou avec pâleur papillaire, il s’agit d’un simple retard de maturation visuelle (syndrome de Beauvieux) de très bon pronostic (voir chapitre 24). Si seul le PEV flash est présent, il n’est pas possible de trancher entre une cécité corticale et un retard de maturation. Un contrôle est nécessaire entre 4 et 5 mois de vie.
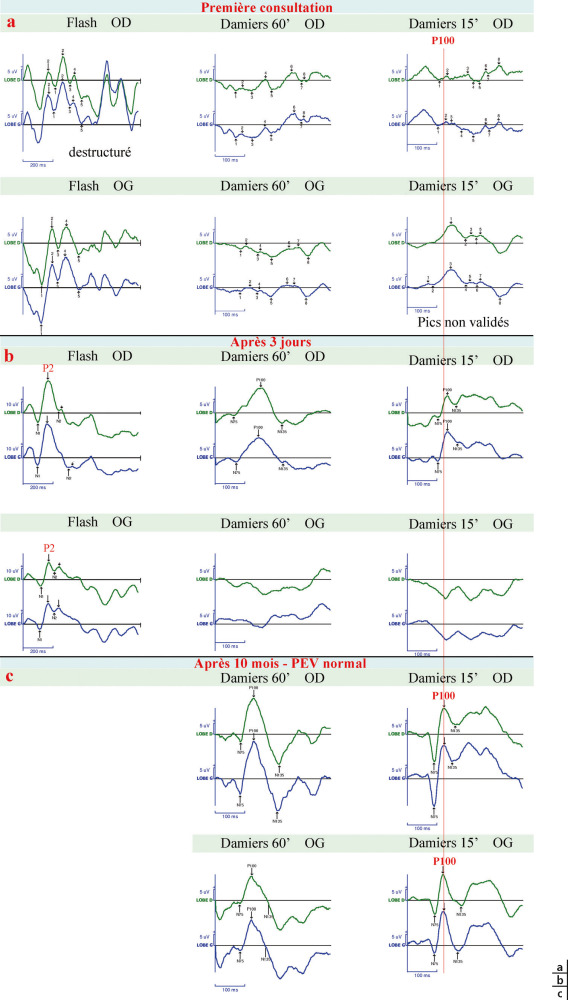
Fig. 3-24 PEV et névrite optique.
a. Enfant de 11 ans qui consulte pour une BAV brutale bilatérale (oeil droit [OD] : 2/10 ; oeil gauche [OG] : perception lumineuse). Les PEV par damiers ne sont pas analysables, les PEV flash sont altérés, déstructurés. b. Trois jours plus tard l’acuité visuelle est remontée (OD 10/10, OG 3/10). c. 10 mois après l’acuité visuelle a récupéré (ODG 12/10). Le PEV est normal à droite et à gauche. Le pic principal est la deuxième déflexion positive nommée P2 en PEV flash et P100 en PEV par damiers. Le temps de culmination normal de cette dernière est aux environs de 100 ms au damier 15′ (il diffère en fonction des laboratoires qui doivent donc chacun déterminer leurs normes).

Fig. 3-25 PEV flash : divers types d’anomalies.

Fig. 3-26 Fig. 3-26 Asymétries des PEV.
a-c. Asymétrie croisée : enfant de 9 mois châtain aux yeux bruns clairs ayant un nystagmus. OD : le PEV est mieux structuré et plus ample en regard du lobe occipital gauche (a). OG : le PEV est mieux structuré et plus ample en regard du lobe occipital droit (b). La soustraction de la réponse du lobe gauche de celle du lobe droit donne une onde négative pour l’OD et négative pour l’OG (c). d. Asymétrie entre les deux hémicortex. Le PEV binoculaire (60′ et 15′) enregistré en regard du lobe occipital gauche est plat chez cet enfant de 10 mois victime d’un accident vasculaire cérébral ischémique pariéto-occipital gauche (l’asymétrie entre les deux hémicortex est pathologique après 8 mois).
Il y a normalement une symétrie de réponse entre les deux yeux et entre les deux hémicortex.
Si le PEV enregistré en regard de l’hémicortex droit est différent de celui obtenu en regard du gauche, il faut évoquer, après vérification du positionnement des électrodes, une atteinte rétrochiasmatique ou chiasmatique (albinisme, achiasmie ou compression) (fig. 3-26) [7, 8].
Quand l’acuité n’a pu être évaluée par les autres méthodes (chez les enfants handicapés par exemple) ou en cas de suspicion de baisse d’acuité visuelle anorganique, il faut utiliser une méthode d’examen rapide, qui fait appel à des stimuli à haute fréquence temporelle, appelée PEV par balayage (sweep visual evoked potential [sweep VEP]) dans laquelle toutes les tailles de damiers sont présentées successivement en 10 secondes. Cette méthode d’estimation de l’acuité visuelle est considérée comme fiable et reproductible (voir chapitre 5.10) [9, 10].
Chez l’enfant, les PEV par damiers ne sont interprétables de façon fiable que s’ils sont normaux, éliminant une atteinte des voies visuelles maculaires, ou s’ils retrouvent une asymétrie croisée témoignant d’une atteinte chiasmatique. Dans tous les autres cas, il faut être certain que les conditions techniques et la coopération de l’enfant étaient optimales avant de conclure. Les PEV flash sont intéressants s’ils sont altérés signant une atteinte organique.
L’électrorétinogramme flash (ERGfl) ou global permet à tout âge, dès 3 mois, en ambulatoire de diagnostiquer précocement une dystrophie/dysfonction rétinienne et de préciser le niveau de l’atteinte : cônes, bâtonnets et couches internes de la rétine (cellules bipolaires essentiellement). C’est le seul examen fonctionnel qui requiert une dilatation pupillaire. Il est impressionnant à voir lorsqu’il est réalisé selon les conditions de l’ISCEV (avec des électrodes de recueil cornéosclérales) mais il n’est pas douloureux. Une simple anesthésie topique suffit en général si l’examen se déroule dans une ambiance calme et rassurante, en parlant constamment à l’enfant d’une voie douce et égale. Une lumière inactinique (rouge) peut être allumée pendant l’obscurité, car elle ne désadapte pas la rétine. Une sédation est parfois nécessaire, une anesthésie générale exceptionnellement, lorsque l’enfant est très agité ou très handicapé [11].
Voir chapitre 5.10.
L’ERGfl est nécessaire au diagnostic de rétinopathies à fond d’œil (FO) normal ou peu évocateur. Il permet d’en distinguer quatre types qui ont des âges de début, des signes et des pronostics fonctionnels différents (Tableau. 3-15) [12].
L’ERGfl a un intérêt pronostique : il est de mauvais pronostic quand il est globalement altéré dans des rétinopathies qui à l’examen du FO apparaissent localisées (par exemple dans la maladie de Stargardt type III).
L’ERGfl traduit la réponse globale de la rétine (qui est proportionnelle à l’étendue de rétine stimulée). Il peut être normal dans les atteintes peu étendues de la rétine, comme les maculopathies isolées (Stargardt par exemple), et plat dans les rétinites pigmentaires évoluées même si la fonction maculaire est préservée.
Dans ces cas, la fonction maculaire peut être évaluée par l’ERG pattern ou damier (p-ERG) couplé aux PEV. Le p-ERG, comme le PEV, nécessite une attention soutenue de l’enfant. C’est donc essentiellement l’imagerie oculaire (OCT et autofluorescence) qui est utilisée actuellement pour le diagnostic des maculopathies de l’enfant. L’ERG multifocal qui étudie la rétine centrale est difficilement ou non réalisable avant 7 ans.
L’examen de la VC est important pour dépister les dyschromatopsies congénitales héréditaires afin de donner dès la maternelle des conseils éducatifs appropriés aux parents et aux enseignants. II permet d’éviter que l’enfant dyschromate soit pris en défaut dans sa scolarité et qu’à l’adolescence, il s’oriente vers des filières professionnelles inappropriées. Il contribue au diagnostic et à l’évaluation des séquelles de certaines neuropathies optiques et maculopathies acquises.
Les dyschromatopsies chez l’enfant sont essentiellement congénitales et héréditaires (DC), rarement acquises (DA) [13, 14].
Les DC sont bilatérales, symétriques et non évolutives. Les plus fréquentes sont les DC liées à l’X ou daltonisme qui concernent 8 % de la population masculine et 0,45 % de la population féminine. Le daltonisme comprend : les trichromatismes anormaux liés à l’altération ou à la diminution de densité d’une opsine; les dichromatismes dus à l’absence d’une opsine; le très rare monochromatisme à cône S conséquence de l’absence des deux opsines M et L. Les différents types de DC, leur mode d’étude, leur fréquence sont rapportés dans le Tableau. 3-16.
Les dyschromatopsies acquises peuvent être évolutives et sont en général unilatérales ou asymétriques entre les deux yeux.
Les planches pseudo-isochromatiques sont surtout destinées au dépistage des DC pour lesquelles elles ont été conçues. Le plus connu et le plus utilisé, le test d’Ishihara, ne comporte que des planches de confusion rouge-vert. Il est très performant, son efficacité dépassant les 95 % . D’autres tests utilisant le suivi manuel de tracé, l’appariement de formes ou la dénomination de formes simples (carré, croix, triangle) (fig. 3-27) sont destinés à l’usage pédiatrique. Les DC sont dépistées en vision binoculaire. La lecture des planches pseudo-isochromatiques se fait sous un éclairement de 400 lux.
Les tests pigmentaires, qui évaluent la capacité de l’enfant à classer des pions colorés par ordre de tonalité successive à partir d’un pion de référence fixe, peuvent mettre en évidence tous les axes de confusion colorés potentiels. Ils sont donc utilisables aussi bien pour les DC que pour les DA. Le diagnostic des DA se fait en monoculaire, après avoir éliminé une DC qui peut avoir été méconnue chez l’enfant.
Le test de référence est le test 15 Hue saturé (ou 15 Hue standard ou panel D-15 de Farnsworth) qui permet une évaluation rapide de l’axe et la distinction d’un axe protan d’un axe deutan (fig. 3-28). Le test 15 Hue désaturé est plus sensible mais plus difficile à réaliser avant 10 ans.
Les autres tests sont :
les anomaloscopes. Ils ne sont pas utilisés pour le dépistage mais sont les plus précis pour diagnostiquer les DC. Ils permettent de différencier les trichromates anormaux des dichromates. L’examen de la VC avec ces colorimètres peut être réalisé dès l’âge de 5 ans. Il se limite à l’équation de Rayleigh qui suffit au diagnostic. Il est selon Vola plus facile à comprendre que les tests de classement [15];
les tests professionnels. Ce sont par exemple des résistances électriques, des câbles des laines, des feux colorés.
Tableau 3-15 - ERG dans les dystrophies rétiniennes de l’enfant*.
* Quatre types d’électrorétinogramme par flashes (ERGfl) selon le type d’atteinte :
• en cas d’atteinte des cônes : les réponses scotopiques sont normales. Les réponses photopiques ne sont pas enregistrables ;
• en cas d’atteinte mixte des cônes et des bâtonnets : atteinte des composantes photopiques et scotopiques (onde a et b) ;
• en cas d’atteinte des couches internes de la rétine (anomalie de transmission entre photorécepteurs et cellules bipolaires) : l’ERG scotopique 3.0 montre que l’onde a est préservée, l’onde b très diminuée.

Fig. 3-27 Planches pseudo-isochromatiques destinées à l’enfant.
a. Test d’Ishihara enfants. L’enfant doit suivre du doigt « un petit chemin » sinueux. b. Test de Matsubara méthode par appariement. c. L’American optical Hardy-Rand-Rittler color vision plates (AO-HRR) permet de reconnaître 3 types de déficiences (protan, deutan, tritan) et leur gravité. L’enfant nomme les formes ou les suit du doigt ou avec un pinceau. d. Test d’Ohkuma constitué du C de Landoldt, très facile pour les enfants qui doivent indiquer où est le « trou » . e. Album tritan de Lanthony qui permet de dépister les dyschromatopsies d’axe bleu-jaune.
(Remerciements au Dr Zanlonghi pour les b et c.)
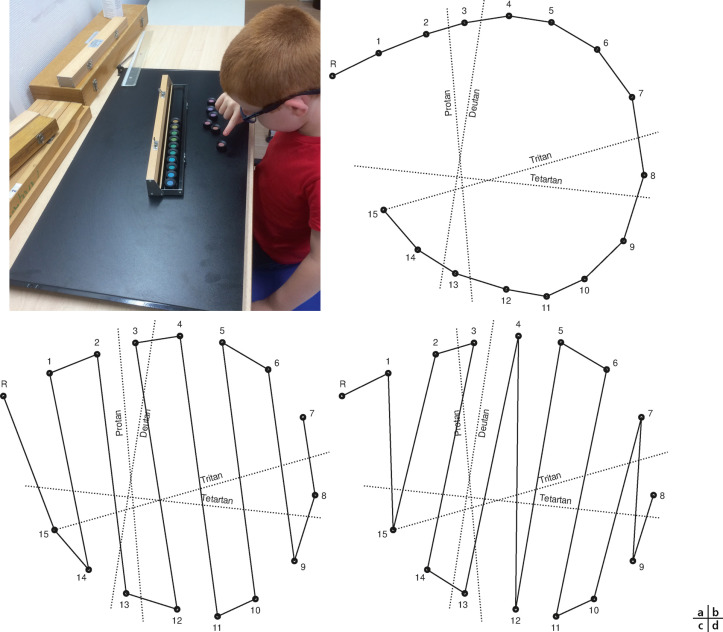
Fig. 3-28 Test 15 Hue saturé. Test pigmentaire de classement de pions colorés.
a. L’enfant classe les pions à partir du premier pion qui est fixe. b-d. Dès qu’il a terminé, l’examinateur transcrit les numéros des jetons sur une feuille de recueil et trace le schéma qui permet la visualisation directe de l’axe de confusion : 15 Hue normal (b), axe protan (c), axe deutan (d).
Une étude de la VC est indiquée (souvent à la demande de la famille) chez un garçon dont le grand-père ou un apparenté mâle du côté maternel est daltonien; chez une fille seulement si elle a en plus un père atteint. Cet examen est recommandé dans le carnet de santé aux visites des 6 et 8 ans, entre 10 et 13 ans et entre 14 et 18 ans. Il est hélas peu réalisé, nous conseillons donc de le vérifier chez tout garçon de plus de 7 ans qui consulte pour la première fois un ophtalmologiste. Il est indispensable pour les adolescents avant l’orientation vers certaines formations professionnelles (transports, militaires, électriciens, etc.)
Le daltonisme peut être dépisté quelle que soit la méthode dès la maternelle, mais s’il est anormal l’examen devra être contrôlé car ce n’est qu’à partir de 7 ans que le diagnostic est fiable et précis. Avant cet âge, les faux positifs sont nombreux. Environ un quart des enfants se trompent au test d’Ishihara classique (serpentin) avant 4 ans et 15 % à 5 ans. Ce test étant celui qui donne à tout âge le taux le plus bas de faux positifs [16, 17].
Chez un grand enfant ou un adolescent qui a une acuité visuelle basse bilatérale non expliquée, la mise en évidence d’une dyschromatopsie, surtout si elle est associée à une photophobie, oriente vers un syndrome de dysfonction des cônes : achromatopsie incomplète si l’enfant a un nystagmus de faible amplitude quelles qu’en soient les caractéristiques, monochromatisme à cônes S (lié à l’X) si c’est de surcroît un garçon myope.
L’intérêt de l’étude de la VC est limité dans l’achromatopsie complète, car le diagnostic de cette affection cause de malvoyance profonde doit être posé dès le plus jeune âge par l’ERG.
Une DA bilatérale et symétrique évoquera chez un enfant soit une rétinopathie soit une neuropathie toxique ou hérédodégénerative : dystrophie progressive des cônes, maladie de Stargardt ou atrophie optique dominante. L’atteinte de la VC est fréquente mais souvent peu spécifique. Elle est rarement ressentie et motif de consultation. Elle est mise en évidence lors du bilan d’une BAV ou lors des examens systématiques de suivi d’un traitement toxique (par exemple éthambutol). Des anomalies de la VC peuvent aussi être séquellaires de neuropathies optiques qui ont plus ou moins récupéré.

Fig. 3-29 Champ visuel par attraction.
L’examinateur est placé face à un enfant dont il attire le regard en position primaire avec un jouet. Une personne placée derrière l’enfant déplace de la périphérie du champ visuel vers le centre une boule placée au bout d’une fine baguette. Aussitôt que l’enfant dirige son regard vers la boule, l’examinateur note l’endroit où elle se situe. L’examinateur peut aussi déplacer sa main ou un jouet dans un plan vertical à mi-chemin ntre ses yeux et celui de l’enfant de la périphérie vers le centre. Dans cette méthode dite par confrontation, l’examinateur juge de la normalité ou non de sa réponse en fonction de ce qu’il perçoit lui-même.
Le CV est la portion de l’espace dans laquelle l’œil immobile fixant droit devant peut détecter des stimuli. Ses limites sont définies par la morphologie de la face (rebords orbitaires, nez). L’étude du CV permet de localiser une atteinte des voies visuelles, préchiasmatiques, chiasmatiques et rétrochiasmatiques, et contribue à l’évaluation du handicap et des aptitudes.
Chez le petit enfant avant 5 ans, il n’est pas possible de mesurer le champ visuel statique. Il est néanmoins possible d’apprécier le CV cinétique par des méthodes fondées sur l’étude du réflexe d’attraction du regard vers une cible périphérique soit par des méthodes manuelles de dépistage, soit par des méthodes instrumentales de quantification des déficits.
Le CV par attraction et confrontation avant l’âge de 3 ans (fig. 3-29) nécessite l’intervention de deux à trois personnes.
Le test de comptage des doigts peut être réalisé chez l’enfant plus grand, dès 4 ou 5 ans (fig. 3-30). Nous ne l’étudions que chez les enfants qui auraient été capables de faire un CV instrumental mais ne le peuvent pas pour des raisons physiques (hémiplégies par exemple).
Les autres méthodes manuelles de dépistage sont :
le champ visuel avec papier-crayon. Il explore les 10–20°. L’enfant fixe une croix dessinée au centre du papier et doit dire quand il voit disparaître un crayon qui se déplace de la croix vers la périphérie du champ (en haut, en bas, à droite, à gauche et en diagonale) puis de la périphérie vers le centre;
le test d’Amsler qui peut être utilisé chez l’enfant dans sa version modifiée plus contrastée.
Avec l’arc périmétrique, les limites périphériques du CV et leur maturation sont évaluées en déplaçant une boule blanche sur un arc de périmétrie [18].
Plusieurs variantes de cette technique ont été proposées depuis. L’arc périmétrique a été modifié, dans le behavorial visual field screening test (BEFIE), par exemple, la boule blanche a été remplacée par des diodes [19, 20]. Il a été démontré avec ces méthodes que l’aspect du CV périphérique était comparable à celui de l’adulte vers 30 mois [21] et augmentait en surface jusque 11 à 12 ans [22].
Fig. 3-30 Champ visuel par comptage des doigts.
L’examinateur montre 1, 2 ou 5 doigts à 45° de l’axe de fixation dans les 4 quadrants du champ visuel, dans un plan vertical situé à mi-chemin entre ses yeux et celui de l’enfant. L’enfant doit signaler à chaque fois combien il voit de doigts. S’il ne les voit pas, ceux-ci sont rapprochés vers le centre jusqu’à ce qu’ils puissent être vus.
Cette étude est réalisable chez l’enfant indemne de pathologie neurologique, dès l’âge de 5 ans en périmétrie cinétique (Goldmann®) et statique Humprey SITA-24-2 FAST, et en périmétrie statique à 7 ans (avec le tendency oriented perimetry [TOP] d’Octopus®), surtout si l’enfant a bénéficié au préalable d’un petit programme d’apprentissage. Une mesure précise, fiable et reproductible du CV n’est cependant possible qu’à partir de 8 à 9 ans en moyenne, la périmétrie de Goldmann étant la méthode la plus fiable avant cet âge [23, 24, 25]. Des normes en fonction de l’âge ont été récemment rapportées pour ces trois techniques. Le CV de Goldmann augmente en surface surtout en temporal et en inférotemporal, peu en nasal et le CV d’Humphrey® en sensibilité de 0,3 dB/an jusqu’à l’âge de 12 ans [26, 27].
Ces méthodes destinées à pallier l’insuffisance des méthodes précédentes (enfants < 5 ans et/ou cérébrolésés) sont proposées ces dernières années pour le diagnostic et le suivi des déficits campimétriques. Nous citerons notamment :
la méthode de périmétrie statique suprathreshold saccadic vector optometric perimetry (SVOP) dans laquelle les mouvements des yeux vers les points lumineux présentés dans les 30° centraux sont enregistrés par eyetracker [28];
les méthodes semi-automatiques de CV (MonCv®, Métrovision) dans lesquelles le regard de l’enfant est filmé et enregistré, mais c’est l’examinateur qui appuie sur la sonnette dès qu’il estime que l’enfant a regardé la lumière présentée dans son CV (fig. 3-31).

Fig. 3-31 Champ visuel semi-automatique type Goldmann réalisé chez un enfant de 3 ans en coupole.
Le regard de l’enfant est filmé permettant un contrôle a posteriori de l’examen. La technique est la même que le champ visuel au Goldmann, mais c’est l’examinateur qui appuie sur la sonnette dès que l’enfant dirige son regard vers la cible.
Le CV est dans la démarche diagnostique, l’examen fonctionnel de première intention, après la mesure d’acuité.
Il est réalisé dans les indications suivantes :
chez l’enfant qui a une baisse d’acuité visuelle inexpliquée, qui est maladroit ou chute de façon fréquente, qui tourne la tête pour regarder droit devant, qui se plaint de céphalées atypiques;
pour diagnostiquer et évaluer le retentissement visuel d’affections pouvant toucher les voies optiques : lésions secondaires à une souffrance périnatale, traumatismes crâniens, tumeurs cérébrales;
en préopératoire de tumeurs cérébrales volumineuses ou infiltrantes (craniopharyngiome par exemple), car il peut orienter la voie d’abord chirurgicale. Il est important de connaître le côté le moins atteint pour ne pas aggraver le déficit visuel;
en cas de NF1 (dépistage et suivi d’un gliome des voies optiques);
en cas d’antécédents familiaux pour conforter le diagnostic précoce de dystrophie rétinienne en cas de suspicion de pathologie des bâtonnets et/ou des cônes évoquée sur des coupes OCT périphériques; pour apprécier le handicap et guider la rééducation.
Les méthodes manuelles de dépistage du CV sont d’un grand intérêt chez le petit enfant ou le plus grand invalide. Elles permettent de dépister les amputations du CV périphérique hémianopsique, quadranopsique ou altitudinale et les rétrécissements concentriques. Quand un déficit est détecté, le résultat est fiable. Leur sensibilité est faible pour les autres types de déficits.
Il y a peu d’études concernant la périmétrie en pathologie :
elles concernent essentiellement les méthodes manuelles de mesure des déficits qui restent peu fiables en pathologie chez le jeune enfant. Par exemple, une étude récente réalisée avec le BEFIE sur une grande série d’enfants ayant une atteinte neurologique montre que cette méthode est fiable chez 57 % des enfants de moins de 1 an, 71 % des enfants de 1 à 2 ans et 75 % au-delà [29];
quand un champ visuel instrumental en périmétrie statique ou de type Goldmann est réalisable chez un enfant, il est reproductible. L’interprétation des déficits en périmétrie cinétique et statique est la même que chez l’adulte. La principale limitation de ces examens qui nécessitent d’être valide, attentif et coopérant est qu’ils sont indiqués chez des enfants ayant des pathologies visuelles cause de mauvaise fixation, ou neurologiques cause de fatigue, de céphalées ou d’invalidité. Il faudra donc, avant de les interpréter particulièrement, tenir compte des indices de fiabilité et des conditions d’examen;
les méthodes de CV instrumentales fondées sur l’attraction visuelle semblent intéressantes, prometteuses pour l’étude du CV dès 3 ans, mais ce sont des techniques partiellement subjectives et/ou utilisant des tests non standardisés et/ou dont la fiabilité et la sensibilité chez l’enfant sont encore à démontrer [30].
[1] McCulloch DL, Marmor MF, Brigell MG, et al. ISCEV Standard for full-field clinical electroretinography (2015 update) Doc Ophthalmol Adv Ophthalmol 2015 ; 130 : 1-12
[2] Odom JV, Bach M, Brigell M, et al. ISCEV standard for clinical visual evoked potentials (2016 update) Doc Ophthalmol Adv Ophthalmol 2016 ; 133 : 1-9
[3] Defoort-Dhellemmes S Potentiels évoqués visuels de l’enfant Exploration de la fonction visuelle. Rapport annuel de la SFO Paris: Masson (1999). 617-645
[4] Rigaudière F Spécificités de l’électrophysiologie chez l’enfant Ophtalmologie pédiatrique et strabismes Paris: Médecine Sciences/Lavoisier (2014). 90-104
[5] Defoort-Dhellemmes S, Drumare I, Basset D, Leroy F Les potentiels évoqués visuels chez l’enfant Du signe clinique au diagnostic. Imagerie et exploration fonctionnelle de la vision : Bulletin de Sociétés Ophthalmologiques de France (2012). 71-83
[6] McCulloch DL, Garcia-Filion P, Fink C, et al. Clinical electrophysiology and visual outcome in optic nerve hypoplasia Br J Ophthalmol 2010 ; 94 : 1017-1023
[7] Apkarian P, Reits D, Spekreijse H Component specificity in albino VEP asymmetry : maturation of the visual pathway anomaly Exp Brain Res 1984 ; 53 : 285-294
[8] Brecelj J, Sustar M, Pečarič-Meglič N, et al. VEP characteristics in children with achiasmia, in comparison to albino and healthy children Doc Ophthalmol Adv Ophthalmol 2012 ; 124 : 109-123
[9] Ridder WH, Tong A, Floresca T Reliability of acuities determined with the sweep visual evoked potential (sVEP) Doc Ophthalmol Adv Ophthalmol 2012 ; 124 : 99-107
[10] Cavascan NN, Salomão SR, Sacai PY, et al. Contributing factors to VEP grating acuity deficit and inter-ocular acuity difference in children with cerebral visual impairment Doc Ophthalmol 2013 ; 128 : 91-99
[11] Defoort-Dhellemmes S, Drumare I, Basset D Électrorétinogramme chez l’enfant Du signe clinique au diagnostic. Imagerie et exploration fonctionnelle de la vision : Bulletin de Sociétés Ophthalmologiques de France (2012). 80-97
[12] Defoort-Dhellemmes S, Drumare I Les rétinopathies héréditaires non évolutives. L’achromatopsie et autres syndromes de dysfonction des cones Dir. Hérédo-dégénérescences rétiniennes. Vol. 2 : rétine Paris: Médecine Sciences/Lavoisier (2012).
[13] Zanlonghi X Vision des couleurs chez l’enfant Paris: Médecine Sciences/Lavoisier (2014). 74-83
[14] Roth A, Lanthony P La vision des couleurs Exploration de la fonction visuelle. Rapport annuel de la SFO Paris: Masson (1999). 367-387
[15] Vola J L’examen de la vision des couleurs chez le jeune enfant Les dyschromatopsies : Bulletin des Sociétés Ophthalmologiques de France (2001). 162-165
[16] Birch J, Platts CE Colour vision screening in children: an evaluation of three pseudoisochromatic tests Ophthalmic Physiol Opt 1993 ; 13 : 344-349
[17] Denis D, Vola J, Saracco J Dyschromatopsies héréditaires chez l’enfant Ophtalmologie 1990 ; 4 : 419-421
[18] Mohn G, Van Hof-Van Duin J Development of the binocular and monocular visual fields of human infants during the first year of life Clinical Vision Science 1986 ; 1 : 51-64
[19] Lewis TL, Maurer D The development of the temporal and nasal visual fields during infancy Vision Res 1992 ; 32 : 903-911
[20] Mayer DL, Fulton AB, Cummings MF Visual fields of infants assessed with a new perimetric technique Invest Ophthalmol Vis Sci 1988 ; 29 : 452-459
[21] Dobson V, Brown AM, Harvey EM, Narter DB Visual field extent in children 3.5-30 months of age tested with a double-arc LED perimeter Vision Res 1998 ; 38 : 2743-2760
[22] Wilson M, Quinn G, Dobson V, Breton M Normative values for visual fields in 4 – to 12-year-old children using kinetic perimetry J Pediatr Ophthalmol Strabismus 1991 ; 28 : 151-153discussion 154.
[23] Safran AB, Laffi GL, Bullinger A, et al. Feasibility of automated visual field examination in children between 5 and 8 years of age Br J Ophthalmol 1996 ; 80 : 515-518
[24] Tschopp C, Safran AB, Laffi JL, et al. Automated static perimetry in the child : methodologic and practical problems Klin Monatsblätter Für Augenheilkd 1995 ; 206 : 416-419
[25] Brown SM, Bradley JC, Monhart MJ, Baker DK Normal values for Octopus tendency oriented perimetry in children 7 through 13 years old Graefes Arch Clin Exp Ophthalmol 2005 ; 243 : 886-893
[26] Patel DE, Cumberland PM, Walters BC, , et al. OPTIC study group Study of Optimal Perimetric Testing in Children (OPTIC) : feasibility, reliability and repeatability of perimetry in children PloS One 2015 ; 10 : e0130895
[27] Patel DE, Cumberland PM, Walters BC, et al. Study of Optimal Perimetric Testing In Children (OPTIC) : normative visual field values in children Ophthalmology 2015 ; 122 : 1711-1717
[28] Murray IC, Cameron LA, McTrusty AD, et al. Feasibility, accuracy, and repeatability of suprathreshold saccadic vector optokinetic perimetry Transl Vis Sci Technol 2016 ; 5 : 15
[29] Koenraads Y, Braun KJ, van der Linden DP, et al. Perimetry in young and neurologically impaired children : the behavioral visual field (befie) screening test revisited JAMA Ophthalmol 2015 ; 133 : 319-325
[30] Tailor V, Glaze S, Unwin H, et al. Saccadic vector optokinetic perimetry in children with neurodisability or isolated visual pathway lesions : observational cohort study Br J Ophthalmol 2016 ; 100 : 1427-1432
C. Guis, M. Perez, G. Touvron, D. Denis
Une lampe à fente avec vidéo-caméra numérique (fig. 3-32) permet d’effectuer, dans le même temps que l’examen du segment antérieur, des photographies de ce même segment antérieur (fig. 3-33 et fig. 3-34). Ces photographies réalisées en position assise permettent d’évaluer l’état des structures de l’œil situées à l’avant du cristallin et d’effectuer un suivi clinique objectif par comparaison temporo-spatiale des différentes photos réalisées à chacune des consultations de suivi.
L’échographie repose sur l’utilisation à but diagnostique des propriétés physiques des ultrasons. Le principe est d’émettre, grâce à une sonde, de courtes impulsions ultrasonores et de recueillir leur réflexion sur différentes interfaces.
L’avènement de l’UBM a eu lieu dans les années 1990. Elle a été développée par Pavlin [1] à Toronto et permet l’exploration du segment antérieur avec une grande résolution spatiale. La sonde de biomicroscopie ultrasonore utilise de très hautes fréquences (50 mHz) avec une petite cellule d’exploration (5 mm par 5 mm) [2].
L’examen se pratique en décubitus dorsal après anesthésie topique de façon bilatérale et symétrique. Il se réalise en immersion grâce à un embout à paroi très fine rempli d’eau fixé à la sonde ou une grande quantité de gel carbomère déposé sur la cornée.
Différentes coupes permettent l’étude du segment antérieur [2, 3, 4]; d’une manière générale, il faut penser à toujours être perpendiculaire à la structure que l’on désire étudier :
coupes axiales : afin de visualiser le centre de la cornée, la pupille, la région centrale de la chambre antérieure. L’épaisseur de la cornée, la profondeur de la chambre antérieure, l’épaisseur du cristallin peuvent être mesurées grâce au mode A reconstruit;
coupes visant à explorer l’angle iridocornéen (AIC) : 8 méridiens sont à explorer de façon systématique (9 H, 10 H 30, 12 H, 1 H 30, 3 H, 4 H 30, 6 H et 7 H 30) afin de mesurer l’AIC. Pour étudier un méridien, il faut positionner la sonde selon ce dernier, en regard du limbe, et de façon à ce que le faisceau ultrasonore soit perpendiculaire à la surface de la racine de l’iris;
coupes orthogonales : sur la périphérie oculaire, la pars plicata du corps ciliaire et l’iris.

Fig. 3-32 Lampe à fente avec vidéo-caméra numérique intégrée.
Étude de l’AIC en cas de glaucome ou d’hypertonie oculaire (fig. 3-35) [6] :
-
mesure des valeurs angulaires de l’AIC : normal > 15°, limite entre 10 et 15°, étroit < 10°. Cette valeur angulaire est de moins en moins utilisée en raison d’une trop grande variabilité de la morphologie de l’AIC (convexité plus ou moins importante de la racine de l’iris);
mesure de la distance d’ouverture de l’angle (angle-opening distance [AOD]) : mesure de référence, distance entre le point cornéoscléral situé à 500 mm de l’éperon scléral et la surface antérieure de l’iris. Normal : AOD > 250 µm; limite : AOD entre 150 et 250 µm; étroit : AOD entre 100 et 150 µm; fermé : AOD entre 50 et 100 µm;
mesure de la surface de récession de l’angle (angle recess area);
mesure de la surface iridotrabéculaire (trabecular iris surface area);
aspect de l’angle en ambiance photopique;
morphologie et position du corps ciliaire : recherche d’une antéversion dans l’iris plateau;
mesure de l’épaisseur de l’iris : mesures au niveau de sa racine, de sa partie moyenne et près du bord pupillaire, la mesure de référence étant celle mesurée à 750 µm de l’éperon scléral;
aspect de l’iris : convexe vers l’avant dans les blocs pupillaires, angulé dans le syndrome de l’iris plateau, concave (inversion de courbure) dans le glaucome pigmentaire;
mesure de la flèche cristallinienne : distance entre l’apex de la cristalloïde antérieure et le diamètre d’angle à angle. Normale de 0 à 500 µm, modérément augmentée de 500 à 750 µm, fortement augmentée de 750 µm à 1 mm et très fortement augmentée au-delà de 1 mm.
Tumeur de l’iris et du corps ciliaire : chez l’enfant les masses iridociliaires sont principalement les kystes (fig. 3-36).
Malformations du segment antérieur : irido-cornéo-trabéculo-dysgénésies comme le syndrome de Peters, le staphylome du segment antérieur, la sclérocornée. L’UBM permet de visualiser les rapports entre la cornée, l’iris et le cristallin, la présence de synéchies iridocornéennes, la présence ou l’absence du cristallin et ainsi de poser le diagnostic de la malformation (fig. 3-37).
Traumatisme : recherche d’une iridodialyse, d’une rupture zonulaire, d’une effraction de la cristalloïde antérieure et postérieure, d’un corps étranger (notamment dans le sulcus), d’un recul traumatique de l’AlC, de décollements ciliaires.
Suivi postopératoire d’une chirurgie filtrante : recherche du mécanisme à l’origine d’une moins bonne filtration comme une apposition de la racine de l’iris, un volet scléral collabé, une bulle de filtration fibrosée.
Bilan préopératoire et postopératoire d’une chirurgie réfractive avec mise en place d’implants phakes de chambre antérieure (mesure des distances de sécurité, analyse de la position de l’implant) et de chambre postérieure (position de l’implant dans le sac).
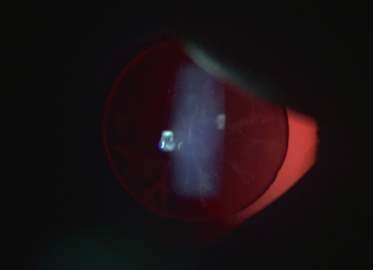
Fig. 3-33 Segment antérieur chez un enfant présentant une aniridie totale.

Fig. 3-34 Colobome uvéal entraînant une déformation cristallinienne en regard associée à une cataracte partielle nucléaire ovalaire.

Fig. 3-35 Échographie UBM morphologie normale montrant un angle ouvert > 15°.
L’OCT est fondée sur une technique d’interférométrie à basse cohérence avec émission d’une onde lumineuse. C’est une technique largement employée en segment postérieur et utilisée pour la première fois en 1994 [7, 8] pour le segment antérieur avec une longueur d’onde de 820 nm. Depuis 2001, une OCT d’une longueur d’onde de 1310 nm permet une visualisation optimale du segment antérieur de limbe à limbe. Il s’agit d’un examen sans contact avec l’œil, non invasif, chez un patient assis.

Fig. 3-36 Kystes du corps ciliaire.

Fig. 3-37 Syndrome de Peters de type 1 avec synéchies iridocornéennes.
Le cristallin est à distance de la cornée, ce qui permet de le distinguer d’un syndrome de Peters de type 2.
L’OCT du segment antérieur (OCT-SA) est une technique de réalisation simple, rapide, non invasive, reproductible et non opérateur-dépendant. Elle permet d’obtenir des coupes cornéennes précises avec de bonnes résolutions et donne une analyse qualitative et quantitative des structures cornéennes. L’OCT-SA utilise une longueur d’onde de 1310 nm réalisant 2048 acquisitions par seconde permettant d’effectuer des images en temps réel avec une bonne résolution de la chambre antérieure et de la cornée. L’exploration du segment antérieur par OCT peut s’effectuer soit par :
un appareil OCT conçu pour l’exploration du segment antérieur : l’OCT-SA Visante® (fig. 3-38), ou le slit lamp-OCT (SL-OCT), longueur d’onde de 1310 nm, permettant une coupe de tout le segment antérieur. Il permet d’effectuer des mesures de toutes les couches cornéennes pouvant déterminer la localisation exacte de dépôts, de dystrophie ou de taie cornéenne (fig. 3-39) [9, 10, 11]. La visualisation des procès ciliaires est limitée du fait de l’utilisation de faisceaux infrarouges ayant des limites de pénétrance au sein des tissus les plus pigmentés comme les iris foncés. La taille des images est de 3 mm de profondeur par 10 mm de large pour les examens de haute résolution. La durée d’acquisition est de 0,25 seconde par coupe. La résolution optique des images est de 18 µm en axial et 60 µm en transversal;
un appareil OCT conçu pour l’exploration maculaire : longueur d’onde de 820 nm. En pratique, on utilise des optiques additionnelles à placer sur les spectral-domain OCT ou SD-OCT (fig. 3-40). Il permet seulement une vue d’ensemble. La taille des images est de 6 mm de profondeur par 16 mm de large. La durée d’acquisition est de 0,125 seconde par coupe. La résolution spatiale est d’environ 5 µm. Cet appareil a une meilleure résolution que l’OCT, dédié au segment antérieur (de type OCT-SA Visante®), avec une durée d’acquisition moindre non négligeable quant il s’agit d’un examen de l’enfant. Il ne peut, pour le moment, réaliser des coupes limbe à limbe de segment antérieur et sa longueur d’onde limite la visualisation des structures angulaires.
L’OCT-SA est un examen de haute rentabilité, facile d’accès, sans contact oculaire, non invasif, avec un apprentissage facile et reproductible. Chez les enfants, la faisabilité est moins évidente. Il faut pouvoir canaliser l’attention de l’enfant sur l’appareil ainsi que son regard en fonction de la coupe voulue.

Fig. 3-38 Appareil l’OCT-SA Visante®.
La caméra Scheimpflug est utilisée pour la biométrie de segment antérieur depuis les années 1990 [12]. Elle augmente la profondeur de champ sur une coupe biomicroscopique engendrant une image nette sur l’apex cornéen, en arrière de l’iris ainsi qu’au niveau de cristallin. Grâce à la caméra Scheimpflug, il est possible d’évaluer quantitativement les structures de la chambre antérieure (fig. 3-41). Plusieurs systèmes ont été développés comme les lampes à fente photographiques Topcon® SL-45 ou Nidek® EAS-1000. La Pentacam® (fig. 3-42) est un examen non-contact qui enregistre entre 12 et 50 images en 2 secondes utilisant une lumière bleue à 475 nm. Une modélisation en trois dimensions du segment antérieur et de l’AIC est effectuée. Il n’est pas possible de visualiser l’éperon scléral, le corps ciliaire ou le sulcus ciliaire comme en OCT-SA ou mieux en UBM. La Pentacam® est un examen d’accessibilité moindre pour le jeune enfant. Elle peut être utilisée seulement chez l’enfant d’âge moyen où elle est nécessaire et indispensable dans la prise en charge et le suivi des kératocônes ainsi que pour l’adaptation de lentilles souples ou rigides.

Fig. 3-39 Coupes OCT du segment antérieur.
a. Coupe horizontale montrant la présence d’une taie cornéenne stromale avec affinement cornéen en regard de la taie : 578 μm cornée saine pour 413 μm en regard de la taie cornéenne. b. Coupe verticale montrant la présence d’un corps étranger intracornéen avec effraction de l’endothélium.
Fig. 3-40 Appareil SD-OCT.
Fig. 3-41 Clichés caméra Scheimpflug du segment antérieur.

Fig. 3-42 Appareil Pentacam®.

Fig. 3-43 Coupe horizontale SD-OCT, avec objectif adapté, du segment antérieur de limbe à limbe.
a. Avec mesure des angles iridocornéens : angles étroits de 17° en temporal et 9° en nasal. b, c. En semi-mydriase (b) et mydriase (c). d. En myosis : angle étroit, < 15° en temporal et nasal.
Le rôle premier et majeur de l’OCT-SA est l’apport d’informations complémentaires à la gonioscopie. En effet, le degré d’ouverture de l’angle (fig. 3-43a), la position de l’iris et l’existence de synéchies sont facilement analysés. Elle a donc une indication optimale dans le glaucome permettant d’effectuer une analyse morphologique, biométrique et dynamique des structures de la chambre antérieure et de l’AIC [13, 14].
Il est intéressant et facile d’effectuer des acquisitions en conditions photopique et scotopique permettant de faire varier la dilatation pupillaire et d’analyser de manière dynamique les structures angulaires (fig. 3-43) [15].
L’OCT-SA a rendu l’analyse de l’AIC plus simple et plus facile d’acquisition que l’UBM. Mais cette analyse peut être limitée par sa plus mauvaise pénétration au travers des tissus iriens. Elle a contribué à une meilleure connaissance des mécanismes de fermeture de l’AIC. La caméra Scheimpflug n’a pas prouvé une réelle utilité dans l’analyse de l’AIC [15].
L’OCT-SA permet un dépistage des angles à risque ainsi que la compréhension anatomique de certains glaucomes. Son utilisation devient de plus en plus courante chez les enfants et les grands enfants. Elle permet également le suivi de l’AIC en pré- et postopératoire de chirurgie filtrante dans le glaucome juvénile et l’évaluation de la bulle de filtration [16].
S. Milazzo, G. Guedira
Tout examen ophtalmologique pédiatrique doit aboutir à la réalisation du fond d’œil et à une analyse séméiologique pointilleuse de celui-ci. L’acquisition rapide de photographies du fond d’œil, et notamment grand champ, contribue à une meilleure évaluation chez l’enfant. La numérisation des images et leur acquisition instantanée permettent un archivage des clichés, un suivi évolutif objectif comparatif et sont d’un intérêt indéniable sur le plan médico-légal.
L’échange entre spécialistes de clichés du fond d’œil est désormais permis, d’où le développement de la télémédecine, notamment dans le cadre de la rétinopathie du prématuré (retinopathy of prematurity [ROP]). Un traitement informatique de l’image est possible, ce qui aide considérablement au diagnostic, comme la modification des contrastes et le grossissement des images. Ces outils d’exploration de la rétine permettent de dresser un bilan anatomique et fonctionnel précis, et parfois d’éviter un examen sous anesthésie générale aux enfants.
Il existe de nombreux modèles de rétinographes avec leurs avantages et inconvénients. Il convient de les classer selon la technique d’acquisition de l’image. À l’heure actuelle, deux techniques d’obtention de l’image ont révolutionné le domaine de l’imagerie ophtalmologique : il s’agit de l’acquisition numérisée de photographies et de l’acquisition par balayage laser.
Ce sont les rétinographes classiques. Ils permettent d’utiliser des filtres de longueurs d’onde différentes afin d’obtenir différents types d’images.
Les clichés couleur, en lumière blanche, sont les images les plus proches de la biomicroscopie. Elles permettent notamment l’analyse de la coloration de la papille qui est plus pâle chez le nouveau-né et le nourrisson et dont l’excavation est minime ou absente. Le reflet fovéolaire, la pigmentation maculaire et la dépression centrale n’apparaissent que progressivement et peuvent être analysés également sur ces clichés.
Les clichés anérythres ou en filtre vert s’obtiennent par interposition d’un filtre à 570 nm. Ils permettent une bonne visualisation des éléments rouges ou orange, principalement les vaisseaux et les hémorragies.
Les clichés en filtre bleu utilisent un filtre à 500 nm. La transparence des milieux est indispensable à leur interprétation, car il existe une forte absorption de cette lumière par les milieux, ce qui rend ces clichés peu utiles en cas de cataracte congénitale ou d’opacité cornéenne ou vitréenne par exemple. Ils mettent en évidence le pigment xanthophylle, les logettes des œdèmes maculaires cystoïdes, l’interface vitréorétinienne et des déficits fasciculaires en fibres optiques, par exemple dans le glaucome juvénile.
Comme la longueur d’onde verte ne traverse pas l’épithélium pigmentaire rétinien, certains éléments peuvent passer inaperçus comme des tumeurs pigmentées choroïdiennes (nævi).
Les clichés en lumière rouge, réalisés à l’aide d’un filtre centré à 645 nm, visualisent les éléments pigmentés. La lumière traverse l’épithélium pigmentaire, mettant ainsi en évidence les éléments en arrière de celui-ci. Son interprétation est utile en cas de troubles des milieux, telle une cataracte congénitale car la lumière rouge y est peu absorbée.
Les clichés en autofluorescence visualisent la distribution de lipofuschine au sein de l’épithélium pigmentaire rétinien. Une accumulation de lipofuschine se traduit par une hyperautofluorescence et traduit un dysfonctionnement de l’épithélium pigmentaire. Les drusen de la papille apparaissent également hyperautofluorescents. Les troubles des milieux dégradent considérablement l’image. La dilatation pupillaire est alors obligatoire. Une dilatation insuffisante rend les clichés ininterprétables et empêche l’accès à la périphérie.
La réalisation de rétinographies non-contact mydriatiques nécessite la coopération de l’enfant. Cette condition rend inapplicable cette technique d’imagerie avant l’âge de 3 ans. L’enfant est installé devant l’objectif, tête posée sur une mentonnière. La lueur pupillaire est placée au centre de l’image alors que l’appareil est reculé, éloigné au maximum du visage de l’enfant. Progressivement, l’examinateur rapproche l’appareil et effectue la mise au point sur les vaisseaux qui apparaissent nets. À ce moment, la totalité de l’image du fond d’œil est visible dans l’objectif et la photographie peut être prise (fig. 3-44). Un point de fixation interne fixe ou clignotant peut attirer l’attention de l’enfant afin de guider son regard. Un point de fixation externe aide à la réalisation des clichés plus périphériques, si la coopération de l’enfant le permet. Certains appareils sont équipés d’une fonction permettant une mise au point sur le fond d’œil sans lumière éclairante, uniquement par ajustement de mires, ce qui peut se révéler utile chez les enfants, en particulier porteurs de pathologies responsables de photophobie. Cinq clichés permettent l’analyse complète du fond d’œil et sa reconstitution en mosaïque : un cliché du pôle postérieur sur lequel apparaissent la papille et la macula, un cliché nasal inférieur, nasal supérieur, temporal inférieur et temporal supérieur.

Fig. 3-44 Enfant de 4 ans installée au rétinographe numérique noncontact.
L’usage non mydriatique signifie que de la lumière infrarouge est utilisée pour cibler une image du fond d’œil et qu’une lumière visible est ensuite flashée lorsque l’image est prise. La pupille ne réagit pas à la lumière infrarouge rendant l’examen facile. Les rétinographes non mydriatiques réalisent des clichés couleurs de 30 ou 45° de très bonne qualité. Tous les types de clichés monochromatiques peuvent être obtenus par application de filtres numériques à partir de l’image couleur. La faible intensité de la lumière incidente lors de la mise au point et la rapidité d’acquisition autorisent une moindre compliance de l’enfant. Le grand champ, la qualité des images et le confort du patient et du praticien rendent les rétinographies non mydriatiques indispensables à l’examen de l’enfant. Les appareils classiques employés chez l’adulte sont également utilisables chez l’enfant avec les mêmes limites que les rétinographes mydriatiques liées à la position inconfortable pour l’enfant, sa coopération et un âge minimum de 3 ans. Les rétinographes non mydriatiques sont utilisables en mode mydriatique. D’autres appareils peuvent être utilisés chez l’enfant : TRC-NW6® (Topcon), Kowa Non-Myd 7® (Luneau) et CR-DGI® (Canon).
Le Smartscope M5® avec module optique amovible EY4 (Optomed Oy, Oulu, Finlande) est un autre type de rétinographe plus adapté au nouveau-né et au nourrisson. C’est un appareil compact et portatif qui permet un examen du fond d’œil non mydriatique, chez le bébé, chez lequel la dilatation est souvent longue, médiocre et pourvoyeuse de iatrogénicité. Cet outil est d’utilisation aisée pour effectuer un examen du fond d’œil afin de détecter des signes précoces d’anomalies rétiniennes chez le nourrisson et l’enfant : ROP, bébé secoué, rétinoblastome, toxoplasmose, etc. Il permet un examen rapide. L’objectif permet un champ de vue de 40°, ce qui limite l’examen de la périphérie. Il existe neuf cibles de fixation interne pour l’obtention d’images périphériques (pour les enfants plus grands et coopérants).
En pratique, le nourrisson est emmailloté, idéalement après la prise du biberon. Parfois, la mise en place d’un blépharostat de taille adaptée après instillation de collyre anesthésiant est nécessaire. L’enfant est allongé sur le dos, tête vers l’extrémité de la table, où se place l’examinateur. L’appareil est approché de la pupille jusqu’à ce que la mise au point soit faite à l’écran. Le flash est de faible intensité. Il existe 10 niveaux de brillance pour les photos en couleurs. En cas d’instillation de mydriatiques, une illumination peut être sélectionnée dans le menu de l’appareil.
L’appareil comporte un mode autofocus (de -11 à + 3 D) pour une prise de vue silencieuse et précise. Les images numériques sont transférables par réseau Wi-Fi vers un ordinateur portable, permettant un stockage et un partage rapide. Il est très utile dans le dépistage de la ROP pour les bébés pesant jusqu’à 2,5 kg. La qualité supérieure de l’image est conforme à la norme pour rétinographes ISO 10940 (fig. 3-45 et fig. 3-46). C’est un outil simple, ingénieux et pratique en ophtalmologie pédiatrique.
La RetCam™ (Massie Lab, Pleasanton, Californie, États-Unis) est une référence incontestée en imagerie rétinienne pédiatrique. C’est une caméra de rétine digitale et compacte grand angle disponible en deux modèles (RetCam™ 3 et RetCam™ Shuttle). Utilisée sous anesthésie générale et/ou dans le cadre du dépistage de la rétinopathie du prématuré, elle équipe souvent les services de néonatologie. Le champ très large des clichés (jusqu’à 130° pour l’objectif ROP) permet l’accès à l’extrême périphérie du fond d’œil et la reconstitution de celui-ci en totalité en seulement trois clichés. Par ailleurs, il faut noter sa grande performance en cas de troubles des milieux. La caméra permet l’acquisition de clichés différents selon l’objectif utilisé : objectif ROP (130° pour les prématurés); objectif enfant (120°); objectif fort grossissement pour les détails maculaires (30°); objectif 80° à contraste élevé. Dans le dépistage de la ROP, elle est plus sensible qu’un examen de dépistage classique au casque et mieux tolérée par le nouveau-né (moins de bradycardies et de désaturations). De nombreuses études ont montré la supériorité de l’examen ophtalmologique par rétinographie numérisée par rapport au fond d’œil au casque [17]. La sensibilité est de 100 % dans plusieurs études et la spécificité comprise entre 85 et 99,8 % [17, 18, 19], De plus, la caméra compacte peut être acheminée très facilement à proximité de la couveuse. D’un point de vue pratique, l’examen commence par l’entrée des données de l’enfant dans la base de données, puis l’enfant est positionné à 90° de l’examinateur. Un collyre anesthésiant est instillé dans l’œil à examiner, afin de mettre en place un blépharostat de taille adaptée (fig. 3-47). La caméra est ensuite posée sur la surface cornéenne, avec un gel de transmission en interface. Le fond d’œil est visible en direct sur l’écran et les rétinographies peuvent être enregistrées. Les commandes d’intensité lumineuse et de prise de clichés se font à la pédale.
La RetCam™ est devenue un outil médico-légal indispensable pour le dépistage des pathologies rétiniennes du prématuré et du nourrisson. Son intérêt est à la fois diagnostique et de surveillance. En dehors de son utilisation pour la ROP, la RetCam™ permet d’explorer toutes les pathologies du fond d’œil chez le nourrisson (syndrome des bébés secoués, toxoplasmose congénitale, rétinoblastome, etc.) (fig. 3-48).
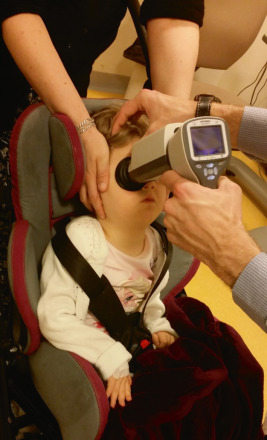
Fig. 3-45 Enfant de 4 ans atteinte d’un syndrome de West, examinée dans son adaptateur.
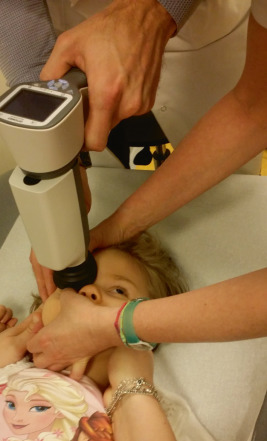
Fig. 3-46 Enfant de 4 ans examinée allongée avec le Smartscope®.
L’ophtalmoscope confocal à balayage laser (confocal scanning laser ophtalmoscope [cSLO]) – Heidelberg Retinal Angiograph® [HRA®], Heidelberg engineering, Allemagne) – est un système ophtalmoscopique permettant l’obtention d’une image de la surface rétinienne en utilisant la technologie d’un faisceau laser mobile. Il permet l’obtention de clichés infrarouges, ou red-free (lumière verte), et en autofluorescence mais ne permet pas l’obtention de clichés en couleurs. Le mode confocal rend possible la mise au point dans le plan frontal sur les structures à analyser. Plusieurs images identiques peuvent être prises à un rythme très rapide grâce au balayage laser couplé au système d’eyetracking (système de recalage par rapport aux mouvements des yeux entre deux prises de photographie). Les clichés obtenus, parfois jusqu’à cent, sont superposables et peuvent être moyennés afin d’augmenter la résolution de l’image finale. L’adaptation par une lentille grand champ (55°) est possible, ce qui permet l’accès à la périphérie même en cas de faible dilatation. Il est possible de coupler l’image à un SD-OCT (Spectralis®, HRA/OCT, Heidelberg Engineering, Allemagne).
L’Optomap® (Optos PLC, Dunfermline, Écosse, Royaume-Uni) est un système de visualisation du fond d’œil non contact et non mydriatique utilisant le principe de l’ophtalmoscopie à balayage laser (scanning laser ophtalmoscope [SLO]). Sa particularité réside dans le champ très large des images obtenues (200°) en un temps très court de 0,25 seconde. Il permet la réalisation de clichés en couleurs et monochromatiques. Son principe est le suivant : une lumière incidente composée de trois faisceaux laser de longueur d’onde bleue (488 nm), verte (532 nm), et rouge (633 nm) est projetée sur la rétine par l’intermédiaire d’un miroir elliptique, expliquant la surface très large de rétine explorée. La lumière réfléchie est ensuite soumise à un séparateur de faisceau qui permet l’analyse dissociée de ses deux composantes verte et rouge. Le faisceau laser vert recueille principalement les informations de la rétine neurosensorielle jusqu’à l’épithélium pigmentaire, alors que le faisceau laser rouge pénètre dans la choroïde. Le cliché en couleurs reconstitué à partir de cette analyse montre en conséquence une coloration particulière des structures rétiniennes les plus superficielles, notamment des opacités vitréennes (anneau de Weiss) ou des zones de rétine soulevées qui apparaissent de couleur verte. Les clichés monochromatiques sont en revanche obtenus de façon directe. L’Optomap® permet d’explorer près de 80 % de la surface rétinienne en un seul cliché. La visualisation concomitante du pôle postérieur et de la périphérie en fait un instrument unique d’analyse du fond d’œil. Sa facilité d’exécution le rend très intéressant en ophtalmopédiatrie, car il pourrait éviter des examens sous anesthésie générale. L’appareil peut également réaliser des angiographies à la fluorescéine.

Fig. 3-47 Préparation du prématuré pour l’examen à la RetCam™. Mise en place du blépharostat et du gel de contact.

Fig. 3-48 Rétinographie par RetCam™ réalisée dans la couveuse sur un prématuré.
L’angiographie à la fluorescéine est un examen clé et irremplaçable pour de nombreuses pathologies vasculaires et tumorales rétiniennes [20, 21, 22]. Elle permet de mettre en évidence des zones de non-perfusion, de néovascularisation qui ne sont pas visibles sur des clichés de rétinographie en couleurs [23]. Pour des enfants en bas âge, la réalisation de l’angiographie par un rétinographe classique est souvent peu contributive. Depuis l’avènement du système Optos® (Optos PLC, Dunfermline, Écosse, Royaume-Uni), il est possible d’effectuer une angiographie de bonne qualité chez des patients jusqu’à 6 mois, avec ou sans sédation et en position « d’avion » [24, 25]. Au-delà de 6 mois, les enfants sont en général trop agités pour permettre ce mode d’acquisition et une angiographie sous anesthésie générale est recommandée.
La RetCam™ (Clarity Medical System, Pleasanton, Californie, États-Unis) est un moyen d’angiographie grand champ disponible pour l’enfant en décubitus dorsal sous anesthésie générale, il nécessite un contact direct avec l’œil de l’enfant et une certaine technicité pour l’acquisition des clichés. De multiples acquisitions de la périphérie associées à des montages sont nécessaires afin d’avoir une bonne imagerie de la périphérie rétinienne. Ce mode d’acquisition limite l’évaluation et la comparaison des différentes phases de l’angiographie sur le fond d’œil.
Un autre système d’angiographie ultragrand champ, le Spectralis® (HRA/OCT, Heidelberg Engineering, Allemagne), permet la réalisation d’un cliché de très grand champ sans la nécessité d’un contact avec l’œil de l’enfant. Cet appareil a été modifié pour son utilisation au bloc opératoire chez l’enfant en décubitus dorsal. Une étude récente faite par Fung et al. [24] a montré que l’angiographe ultragrand champ Spectralis® dans sa version modifiée pour l’examen sous anesthésie générale est un examen efficace et reproductible, permettant l’acquisition d’une imagerie de grand angle de haute qualité. Par ailleurs, sur un œil artificiel, l’angiographe ultragrand champ Spectralis® permet l’acquisition d’une image de plus grand angle que l’image obtenue avec la RetCam™ équipée de la lentille 130° [26].
L’angiographie nécessite une mydriase pharmacologique, ainsi que l’utilisation d’un blépharostat pédiatrique adapté à la morphologie de l’enfant. L’application d’une crème anesthésiante est recommandée avant la mise en place de la voie veineuse. La fluorescéine est administrée par voie intraveineuse par bolus (dose de 0,1 ml/kg), puis un rinçage de la tubulure par une solution de sérum salé à 0,9 % est effectué. Aucune donnée sur l’administration de fluorescéine chez l’enfant n’est disponible. La dose de fluorescéine doit être adaptée au poids de l’enfant, la dose de 5 mg/kg de fluorescéine à 10 % est habituellement utilisée. En cas de système non-contact, une hydratation régulière de la cornée est nécessaire pour permettre l’acquisition d’images de qualité. Une acquisition jusqu’à l’ora serrata est rendue possible par la mobilisation de l’œil par une pince à griffes voire l’indentation avec un indentateur. Il est possible de réaliser une angiogaphie à la fluorescéine par voie orale, qui consiste à administrer 2 ampoules à 10 % pour 20 kg de poids diluées dans un demi-verre de jus d’orange par voie orale (à noter la non-obtention de temps précoces avec cette technique). L’angiographie au vert d’indocyanine est rarement réalisée chez les enfants petits, plutôt utilisée chez les grands enfants dans la recherche de pathologies inflammatoires.
Les rétinographies permettent une exploration optimale du fond d’œil chez l’enfant afin d’aboutir au diagnostic des maladies vitréennes, rétiniennes et choriorétiniennes.
Ce sont des examens non invasifs présentant de multiples intérêts :
pédagogique : en facilitant la formation des internes dans les centres universitaires. Le diagnostic de certaines pathologies pédiatriques est en effet délicat. Il a été par exemple prouvé que la rétinopathie des prématurés était sous-diagnostiquée lorsque l’examen du nouveau-né était pratiqué par un interne comparativement à un senior, en se fondant sur des rétinographies RetCam™ [27];
diagnostique : des avis spécialisés peuvent être demandés aisément par l’échange d’images numériques (télémédecine);
thérapeutique : en permettant une prise en charge immédiate après analyse des clichés;
médico-légal : l’archivage des photos est rendu possible dans le dossier des patients, c’est un examen objectif permettant de discuter rétrospectivement des prises en charge, notamment en cas de litige.
M. Perez, G. Touvron, D. Denis
Comme pour l’échographie UBM, la sonde d’échographie émet de courtes impulsions ultrasonores et analyse ensuite les échos réfléchis quand deux zones d’impédance acoustique différentes sont traversées [3].
L’examen se réalise en décubitus dorsal après instillation de collyre anesthésique. Il peut être fait par contact direct ou par voie transpalpébrale. Un gel est utilisé pour permettre la transmission correcte des ultrasons.
Il existe principalement trois modes : mode A dit temps amplitude, mode B dit temps brillance, mode Doppler pour l’analyse des vaisseaux.
L’exploration se fait selon une direction unique qui est celle du faisceau d’ultrasons. La coupe du globe se fait donc selon un seul axe. Le résultat est un graphique où chaque échographie de retour correspond à un pic. Sa principale indication est la mesure des différentes structures du globe, c’est-à-dire la biométrie. L’échographie en mode A en immersion guidée par le mode B est devenue la méthode de référence pour la mesure de la longueur axiale (fig. 3-49). Bien qu’elle soit supplantée dans la majorité des cas par la biométrie optique par interférométrie en cohérence partielle (partial coherence interferometry [PCI]), c’est la seule méthode qui permet de s’affranchir à la fois des problèmes de pression sur la cornée et des problèmes d’alignement avec l’axe visuel comme chez le myope fort ou en cas de trouble des milieux important telles une cataracte blanche ou une hémorragie intravitréenne où la PCI s’avère inefficace.
Chez l’enfant, il est important de noter que l’œil étant en croissance jusqu’à l’âge de 5 ans, il faut appliquer un facteur correctif dans le calcul de la puissance de l’implant [2].
En pratique, la biométrie permet :
la mesure des dimensions du globe en cas de troubles des milieux (fig. 3-50);
la mesure d’une mégalocornée, d’une microcornée, d’une microphtalmie;
la mesure d’une lésion en cas d’abstention thérapeutique;
le calcul de la puissance de l’implant avant chirurgie de cataracte.
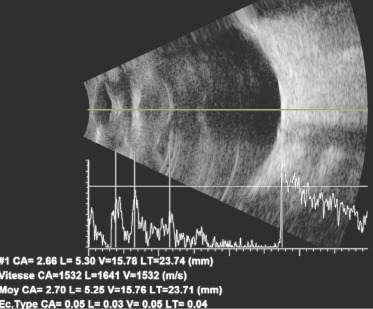
Fig. 3-49 Échographie mode A guidée par le mode B dans le cadre du bilan préopératoire d’un enfant de 12 ans atteint de cataracte blanche.
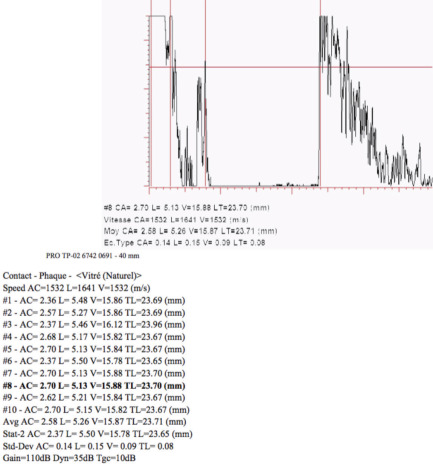
Fig. 3-50 Exemple de calcul de longueur axiale en échographie mode A chez le même enfant.
Elle est bidirectionnelle. Chaque échographie est représentée par un point plus ou moins blanc ce qui permet d’obtenir une image. La succession rapide de ces images donne une image dynamique des structures étudiées. Deux types de sondes sont couramment utilisés : 10 et 20 MHz [4, 28]. Dans un premier temps, la sonde de 10 MHz permet l’obtention d’images des structures oculaires et orbitaires avec une bonne résolution. La sonde de 20 MHz permet une analyse complémentaire de la papille, la région inter-maculo-papillaire et la macula mais avec un bruit de fond augmenté.
Il faut toujours être perpendiculaire à la structure à étudier.
Plusieurs coupes sont réalisées :
une coupe axiale de l’œil et de l’orbite;
des coupes multidirectionnelles pour explorer tous les quadrants du globe : afin d’analyser au mieux une structure, il faut penser à obtenir au moins deux incidences orthogonales.
Ses principales indications sont [2, 4, 28] :
trouble des milieux : taie cornéenne, hyphéma, cataracte blanche, hémorragie intravitréenne;
étude du vitré : hyalite, décollement postérieur du vitré, persistance du vitré primitif (fig. 3-51);
étude de la rétine : rapports vitréorétiniens et rétinochoroïdiens, décollement de rétine, déchirure, décollement séreux, hémorragique ou tumoral (rétinoblastome chez l’enfant : fig. 3-52);
étude de la macula (sonde 20 MHz) : trou maculaire, membrane épimaculaire, dégénérescence maculaire liée à l’âge;
étude de la papille : recherche de drusen du nerf optique (fig. 3-53);
étude de la choroïde : décollement choroïdien, tumeurs (mélanome);
étude de la sclère : sclérite postérieure;
pathologie traumatique : corps étranger, bilan lésionnel;
pathologie tumorale : structure atteinte, extension, mesures.

Fig. 3-51 Persistance du vitré primitif chez une enfant de 5 ans.

Fig. 3-52 Rétinoblastome avec présence d’une calcification hyperéchogène au sein de la tumeur.
Fig. 3-53 Drusen de la papille chez une enfant présentant un tableau de faux oedème papillaire.
Les flux vasculaires du globe sont superposés aux images en échographie en mode B. Par convention, les vaisseaux oculaires qui se dirigent vers la sonde (principalement les artères) sont codés en rouge alors que ceux qui s’en éloignent (les veines) sont en bleus. Le mode pulsé permet d’étudier les vitesses du flux au sein du vaisseau [2].
S. Defoort-Dhellemmes, I. Drumare, V. Smirnov
L’OCT du segment postérieur est actuellement le premier examen complémentaire à demander devant une baisse d’acuité visuelle non expliquée de l’enfant de plus de 3 ans. Il est plus rapide, plus accessible et moins invasif que les autres examens (ERG, PEV, CV, cliché en autofluorescence). Il met en évidence la plupart des maculopathies de l’enfant dès le stade infraclinique.
Il existe actuellement deux technologies d’OCT commercialisées. La technologie SD-OCT mesure la réflectivité simultanée de l’ensemble des structures rétiniennes, grâce à l’utilisation d’une source située dans le proche infrarouge à spectre large (superluminescent diode [SLD]). Une analyse spectrale du signal d’interférence permet de reconstruire les coupes rétiniennes. La technologie swept-source OCT mesure successivement la réflectivité des différentes couches rétiniennes par l’utilisation d’une source infrarouge à spectre étroit dont on fait varier la longueur d’onde très rapidement (laser swept-source). L’image en coupe est obtenue par la mesure de l’intensité du signal d’interférence en fonction de la longueur d’onde du laser.

Fig. 3-54 a-c. OCT « à la volée » chez un bébé de 7 mois qui a un nystagmus précoce.
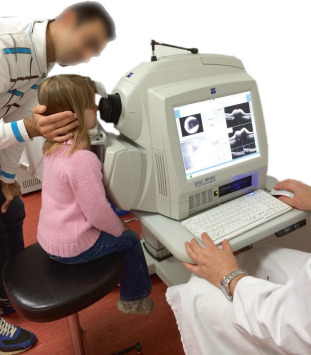
Fig. 3-55 OCT chez une enfant de 4 ans. Drusen de la papille.
L’examen de l’enfant est réalisé de préférence pupille dilatée. La stratégie d’examen est guidée par la clinique, l’âge, la coopération et l’attention de l’enfant.
Chez le nouveau-né et le nourrisson l’examen est réalisé avec :
soit une OCT portable [29] : l’examen peut être fait en consultation ou lors d’une sédation ou anesthésie générale indiquée pour un autre examen;
soit une OCT « classique » .
L’enfant est en position oblique penchée en avant (la position à plat ventre est à éviter car la tête est en hyperextension). La hauteur mentonnière-appui-front n’étant pas adaptée, nous recommandons de descendre la mentonnière au plus bas. Le front de l’enfant est maintenu sur l’appui-front, son menton est posé sur la paume de l’aide [30]. Chez l’enfant d’âge scolaire, les conditions sont les mêmes que chez l’adulte (fig. 3-54 et fig. 3-55).
Si l’enfant est coopérant et peut garder une fixation stable, l’opérateur privilégiera l’étude de quelques lignes maculaires (5 lignes) de largeur moyenne suivies si possible d’un cube maculaire (fig. 3-54). Si l’enfant n’est pas capable de fixer assez longtemps, l’opérateur va balayer la zone d’intérêt en se concentrant sur l’image en scopie. La numérisation se fait à « la volée » (fig. 3-56). Même ainsi, les images ne sont pas toujours enregistrables. Il faut donc filmer l’écran de scopie ou faire une capture vidéo de l’écran de l’OCT et sélectionner secondairement les images utiles. Si l’enfant a un nystagmus, les coupes sont d’emblée réalisées dans le sens du nystagmus : coupes horizontales pour un nystagmus horizontal; coupes verticales pour un nystagmus vertical. Les images OCT peuvent néanmoins être déformées. Il ne faut pas prendre les images construites pour une lésion (fig. 3-57).
Les protocoles sont comparables à ceux de l’adulte (voir « Limites » ci-dessous).
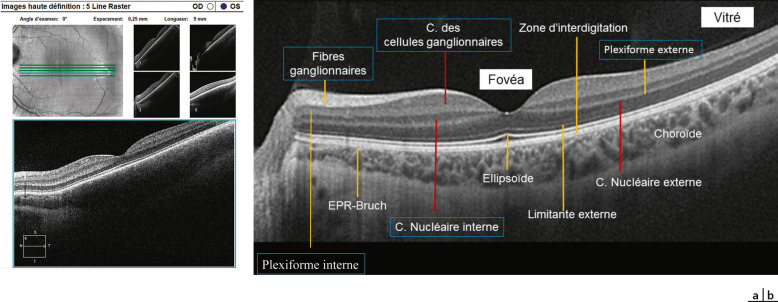
Fig. 3-56 OCT chez un enfant de 7 mois.
a. Une coupe passant par la macula a pu être enregistrée. Elle est normale pour l’âge (enfant de la figure 3-54). b. Stratification rétinienne normale chez l’adulte.

Fig. 3-57 Artéfacts dus aux saccades oculaires. Comparaison de deux coupes horizontales réalisées dans une même séquence chez deux enfants avec nystagmus horizontal. Coupes OCT horizontales.
a, b. Garçon de 4 ans. En b, aspect de compression de la coupe en interpapillomaculaire (IPM). c, d. Fille de 4,5 ans. En d, aspect d’étirement de la coupe IPM (flèche jaune), bien visible en parafovéolaire au niveau des couches internes.
Les indications de l’OCT sont en grande partie les mêmes que celles des examens électrophysiologiques. L’OCT est essentiel au diagnostic étiologique de tout comportement visuel anormal ou acuité visuelle basse de l’enfant quand le fond d’œil est normal ou qu’il existe une anomalie ne paraissant pas expliquer le trouble visuel. Elle est intéressante, au même titre que chez l’adulte, quand l’anomalie du fond d’œil est à l’évidence la cause de la déficience visuelle, pour caractériser les lésions et en suivre l’évolution (par exemple rétinopathies héréditaires, tumeurs). Elle peut révéler des lésions associées, parfois responsables du trouble visuel ou de son aggravation inexpliquée, comme l’œdème maculaire dans une rétinopathie pigmentaire précoce.
L’OCT a permis de préciser les étapes de la maturation de la rétine et du nerf optique chez l’enfant à terme et le prématuré et de décrire une nouvelle séméiologie soit des formes de début de maladies connues, soit de pathologies spécifiques de l’enfant. Enfin, elle est proposée pour le dépistage et le suivi de pathologies évolutives (gliome des voies optiques, glaucome) [31].
Il reste difficile chez l’enfant de savoir précisément quelle est la zone rétinienne scannée lors des coupes en ligne d’autant plus qu’il est souvent nécessaire de débrayer l’eyetrader, ce dernier n’étant pas assez rapide sur les OCT actuellement sur le marché pour repositionner les scans d’un enfant qui bouge.
L’examen des fibres optiques par un scan circulaire péripapillaire (retinal nerve fiber layer [RNFL]) est très difficile à réaliser. Le jeune enfant a du mal à garder la fixation latérale suffisamment longtemps, il revient invariablement au centre. L’étude des fibres ganglionnaires est moins difficile, car elle se fait à partir d’un cube maculaire mais elle n’apprécie que les fibres temporales. Les coupes transpapillaires restent intéressantes en cas d’œdème ou de malformation papillaire (fig. 3-58).
Dans le dépistage (traitement toxique, NF1) et le suivi des neuropathies optiques (tumeurs des voies optiques, glaucome) de l’enfant, la fiabilité et sa reproductibilité de l’OCT restent à confirmer. Les séries rapportées dans la littérature comportent un très petit nombre d’enfants de moins de 6 ans ou sont réalisées sous sédation [32, 33, 34].
L’OCT chez l’enfant devrait bénéficier de la diffusion des OCT portables et de l’arrivée des OCT swept-source plus rapides et dont les lignes de scan ne sont pas visibles, l’enfant n’ayant ainsi que la croix de fixation à regarder.
Chez le prématuré, les couches rétiniennes internes (membrane limitante interne, couche des cellules ganglionnaires, couche plexiforme interne, couche nucléaire interne) sont présentes au niveau de la fovéa, ce qui n’est pas le cas chez l’adulte [35]. Avec la maturation, chez le nouveau-né entre 31 et 42 semaines d’aménorrhée (SA), il se produit une migration cellulaire hors de la fovéa de façon centrifuge. Il en résulte une diminution d’épaisseur puis une disparition des couches rétiniennes internes de la fovéa (entre 3 et 18 mois environ). C’est ainsi que la dépression fovéolaire apparaît.
Chez le prématuré et le nouveau-né à terme, la limitante externe, l’ellipsoïde et la zone d’interdigitation sont souvent absents [36]. La couche des phorécepteurs du nouveau-né est plus mince en fovéolaire qu’en périphérie. La zone d’interdigitation est la dernière à apparaître. Les différentes couches de la rétine externe augmentent d’épaisseur sur toute leur surface, de façon centripète (de la périphérie vers la fovéola), rapidement dans les premières semaines de vie (dès 38 SA), puis progressivement jusqu’à l’âge adulte (17 mois à 16 ans) (fig. 3-59). La choroïde du nouveau-né est plus fine que chez l’adulte. La maturation des nerfs optiques s’effectue rapidement dans les 2 premières années et progressivement jusqu’à l’âge de 13 ans : le RNFL diminue, le diamètre de la tête du nerf optique et de l’excavation augmente (lorsqu’il est exprimé en valeur absolue). Le rapport cup/disk reste stable [37]. Cette immaturité de la rétine et des nerfs optiques est plus marquée et parfois plus prolongée chez le prématuré. Ces notions sont importantes à connaître avant d’interpréter une OCT chez le jeune enfant. La plupart des données normatives actuelles concernent l’OCT portable.
Pour un panel complet des anomalies OCT dans les rétinopathies et neuropathies de l’enfant, voir les chapitres spécifiques 17 et 21.
L’OCT a révolutionné chez l’enfant la stratégie diagnostique d’une acuité visuelle basse ou d’un trouble visuel non expliqué par l’aspect du fond d’œil [38, 39] :
une simple coupe peut suffire à poser le diagnostic de maculopathie ou d’atteinte rétinienne plus périphérique et éviter de considérer à tort certains enfants comme des « simulateurs » . Le fond d’œil est en effet souvent normal, douteux ou trompeur dans les rétinopathies chez le jeune enfant ou dans les formes de début de la maladie (fig. 3-60);
une OCT maculaire normale ou subnormale ne suffit cependant pas à exclure une rétinopathie débutante ou limitée à une diminution d’épaisseur d’une ou de plusieurs couches rétiniennes. Les altérations rétiniennes sont parfois plus évidentes et révélées plus précocement avec les clichés en autofluorescence ou l’électrorétinogramme;
si l’OCT et l’autofluorescence rétinienne sont normales, il faut rechercher une atteinte des voies visuelles antérieures rétrobulbaires. Ce diagnostic est évoqué d’emblée à l’OCT, lorsque l’étude du nerf optique est possible et de bonne qualité et montre une diminution des fibres ganglionnaires. Sinon, ou pour confirmer le diagnostic, d’autres examens paracliniques sont nécessaires (examens fonctionnels de la vision et neuro-imagerie), a fortiori en cas de BAV unilatérale, avant de conclure à une cause anorganique.
Dans le syndrome du nystagmus précoce, l’OCT maculaire permet de distinguer un nystagmus idiopathique d’une forme fruste d’albinisme. Il est normal dans le premier cas et montre une hypoplasie fovéolaire « typique » dans le second (fig. 3-61a) [40]. Il évoque une achromatopsie quand il met en évidence une hypoplasie « atypique » avec discontinuité de l’ellipsoïde et/ou une zone hyporéflective au niveau de la fovéa (fig. 3-61b) [38]. Il ne suffit cependant pas au diagnostic étiologique des nystagmus précoces, l’ERG reste indispensable (fig. 3-61).
L’OCT révèle des anomalies au stade présymptomatique, par exemple dans la maladie de Stargardt ou dans les céroïdes Iipofuscinoses juvéniles (fig. 3-62). Cela n’est pas sans poser de nouvelles questions éthiques tant qu’un dépistage très précoce ne débouche pas sur un traitement.
Lorsqu’un enfant à une anomalie évidente au fond d’œil, l’OCT permet de décrire une séméiologie propre à l’enfant : forme très précoce de la maladie de Best, tache rouge cerise des maladies métaboliques (fig. 3-63), hémorragies rétiniennes des enfants secoués (fig. 3-64) [41, 42].
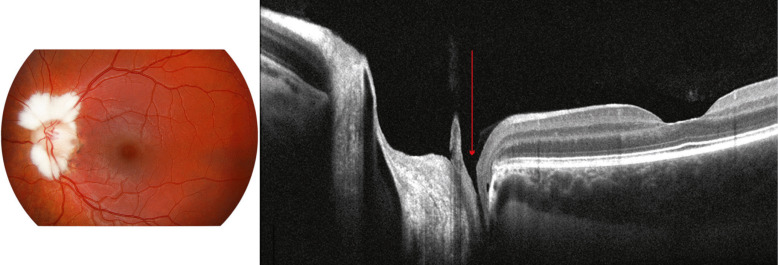
Fig. 3-58 Fibres à myéline ; coupe passant par le nerf optique.
Fille de 12 ans, troubles du comportement. Une coupe transpapillaire suffit pour mettre en évidence la fossette visible sur la photographie de FO et l’aspect normal mais en cuvette de la macula. Pas de coupe sur les fibres à myéline.
Fig. 3-59 Maturation de l’OCT.
Enfant de 3 mois, rétine en voie de maturation (a). Au niveau fovéolaire, les couches rétiniennes internes présentes dans la rétine immature du nouveau-né ont disparu. La rétine externe est encore immature : la membrane limitante externe (MLE) est à peine visible ; la bande ellipsoïde (ligne hyper-réflective la plus interne) est présente et est parallèle sur toute la longueur de la coupe à l’épithélium pigmentaire (EP) (ligne hyper-réflective externe) en raison de l’immaturité des photorécepteurs (PR) ; la zone d’interdigitation (segment externe des PR-EP de la rétine) n’est pas visible, elle l’est chez l’enfant de 4 ans (b).

Fig. 3-60 OCT et BAV à fond d’oeil (FO) normal, trompeur ou douteux.
a. Rétinoschisis congénital. Garçon de 5 ans. AV : OD 1/10 ; OG 2/10. FO : simple perte du reflet fovéolaire. OCT de l’OG : lésions kystiques au niveau de la couche nucléaire interne. L’OCT suffit au diagnostic confirmé par la biologie. b. Maladie de Stargardt. Garçon de 12 ans. BAV progressive bilatérale. AV : ODG 4/10. Considéré comme « simulateur » . FO : aspect sombre en navette de la région fovéolaire. OCT : disparition de l’ellipsoïde et diminution de la couche nucléaire externe rétrofovéolaire (entre les flèches jaunes) qui n’est plus discernable en périphérie. MLE : membrane limitante externe. c. Dystrophie rétinienne mixte bâtonnets-cônes. Garçon de 5 ans. Antécédents du côté maternel de rétinite pigmentaire. AV : ODG 5/10. Héméralopie. FO : hypopigmenté, albinoïde. OCT : disparition de l’ellipsoïde (entre les flèches jaunes) et diminution d’épaisseur de la couche nucléaire externe.

Fig. 3-61 OCT et nystagmus congénital.
a. Albinisme oculo-cutané AOC (oculocutaneous albinism 2 [OCA-2]). Fille de 4 ans, yeux marron, cheveux châtain foncé, nystagmus précoce. FO : hypopigmentation rétinienne. OCT : hypoplasie fovéale typique. Absence de dépression fovéolaire. Persistance des couches rétiniennes internes (flèche rouge) dans la zone fovéolaire. Les couches rétiniennes externes sont normales. b. Achromatopsie probable. Garçon de 4 ans, ses frères ont une achromatopsie incomplète. AV : ODG 1/10. FO : doute sur un remaniement maculaire. OCT « à la volée » , seul examen possible chez cet enfant peu coopérant. Hypoplasie fovéale atypique. Même aspect immature de la rétine interne que dans l’AOC mais, en plus, interruption de l’ellipsoïde avec zone optiquement vide. c. Achromatopsie incomplète. Garçon de 4,5 ans. Nystagmus précoce, photophobie. FO : normal. OCT : atteinte peu caractéristique. Stratification normale de la rétine, petites zones de discontinuité de l’ellipsoïde. ERG : altération des composantes photopiques mais pas des composantes scotopiques. d. Héméralopie congénitale stationnaire. Garçon de 4 ans. FO normal. OCT aspect comparable à celui de l’enfant normal de 8 mois. Ne suffit pas au diagnostic. ERG négatif.
L’OCT est l’examen de première intention dès qu’une rétinopathie ou une neuropathie est évoquée chez l’enfant.
Il est associé aux photographies du fond d’œil en couleurs et dès que possible en autofluorescence. Une seule coupe peut parfois permettre le diagnostic de maculopathie ou de dystrophie mixte.
Comme tout examen paraclinique, ses indications et son interprétation doivent tenir compte de la clinique.
L’OCT peut suffire au diagnostic étiologique s’il montre des anomalies compatibles avec une rétinopathie héréditaire chez un enfant qui a des antécédents familiaux prouvés de cette maladie.
L’OCT n’a cependant pas remplacé les autres examens paracliniques.
Il ne faudra surtout pas s’en contenter s’il semble normal et si le trouble visuel persiste. Son intérêt reste, comme chez l’adulte, limité dans le diagnostic étiologique des atteintes des voies visuelles. Il peut être trompeur dans celui des rétinopathies.
Fig. 3-62 Maladie de Stargardt infraclinique. Enfant de 10 ans asymptomatique.
AV : ODG 10/10. Stargardt dans la fratrie. FO normal. Hyper-réfl ectivité de la couche nucléaire externe, discontinuité de l’ellipsoïde périfovéolaire. MLE : membrane limitante externe.
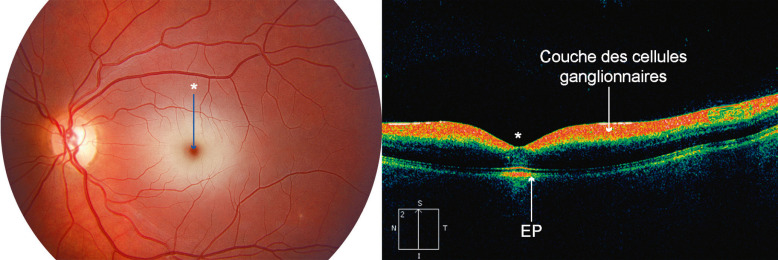
Fig. 3-63 Tache rouge cerise.
Fille de 4 ans. Sialidose diagnostiquée un an avant. FO : la couleur blanche de la région périfovéolaire fait ressortir la couleur rouge normale de la fovéola. OCT : hyper-réfl ectivité et épaississement de la couche des cellules ganglionnaires. Zone d’ombre au niveau des couches externes sous-jacentes, contrastant avec l’aspect normal de la fovéola [44].
Fig. 3-64 Syndrome du bébé secoué.
FO : hémorragies de tout type avec une vaste hémorragie prérétinienne en nid de pigeon et pli rétinien arciforme (flèche bleue) caractéristiques du syndrome.
OCT : elle met en évidence la traction du vitré sur la rétine due à la poussée en avant de l’hémorragie et cause du pli rétinien [45].
N. Girard et E. Zanin, H. Brunel, D. Denis
L’imagerie cérébro-orbitaire a une place importante dans la prise en charge des pathologies ophtalmologiques aussi bien sur le plan diagnostique que thérapeutique [43, 44, 45, 46, 47, 48]. Les signes cliniques comme un comportement visuel anormal, une baisse d’acuité visuelle, une déviation oculaire, une diplopie ou un œdème papillaire sont non spécifiques : le dialogue entre clinicien et radiologue est indispensable. La demande doit être claire et comporter des renseignements cliniques précis (structures oculaires atteintes, côté, contexte général, orientations étiologiques), afin de guider l’examen neuroradiologique (plans, type de coupe, séquence, injection ou non) qui sera, le plus souvent en ophtalmologie, cérébral et orbitaire.
Les techniques d’imagerie principales sont le scanner X ou tomodensitométrie (TDM) et l’IRM.
Le scanner X est un excellent examen pour évaluer les pathologies intra-orbitaires et l’intégrité osseuse de l’orbite et de la base du crâne. Il est l’examen de choix des indications d’urgence car facile d’accès et permet d’orienter l’examen IRM complémentaire si nécessaire. Il faut utiliser des protocoles d’acquisition optimisés avec dose la plus basse admissible pour un diagnostic efficace. Le scanner permet des reconstructions surfaciques de la voÛte crânienne et de la face comme dans le bilan des craniosténoses par exemple. Il permet aussi la réalisation d’angio-TDM avec injection de produit de contraste en bolus pour les pathologies vasculaires (artérielles ou veineuses). Il détecte très rapidement hémorragies, effets de masse (tumeurs), corps étrangers (métal, verre) et calcifications (ces dernières étant très difficiles à identifier en IRM).
L’IRM est la technique de choix pour évaluer le tissu cérébral dans son ensemble (tronc cérébral et fosse postérieure compris) ainsi que les tissus des cavités orbitaires. C’est de plus la seule technique d’imagerie permettant d’évaluer le cerveau en développement. Elle apporte des informations anatomiques excellentes et permet, à travers des techniques avancées d’IRM, d’étudier la microstructure des tissus (IRM de diffusion ou DTI pour diffusion tensor imaging), la myélinisation, la connectivité cérébrale, la composition biochimique des tissus (spectroscopie par résonance magnétique) et enfin l’activation cérébrale (IRM fonctionnelle). Pour l’étude de l’orbite et des nerfs crâniens, des séquences avec coupes fines (inframillimétriques) sont nécessaires : ces séquences sont longues et nécessitent une immobilité parfaite. Toute indication chez un enfant non coopérant nécessite la réalisation d’une anesthésie générale ou d’une autre méthode de sédation. L’IRM est une méthode non irradiante mais présente des contre-indications liées à l’utilisation du champ magnétique : enfant porteur d’un pacemaker, d’une valve cardiaque mécanique ou de clips neurochirurgicaux. Les sources d’artefacts autres que le mouvement sont multiples comme le port de matériel dentaire inamovible, le maquillage, le gel d’électrocardiogramme et les crèmes cosmétiques.
L’évaluation cérébro-orbitaire quelle que soit la méthode utilisée, est réalisée avant et après injection de produit de contraste intraveineux sauf dans la pathologie traumatique en urgence. Chez le jeune enfant, la pose d’une voie veineuse est réalisée par un professionnel formé à la pédiatrie (puériculteur, infirmier anesthésiste ou infirmier de bloc pédiatrique).
Le scanner X est indiqué en première intention pour les pathologies urgentes comme les traumatismes au stade aigu, la suspicion de corps étranger, les pathologies inflammatoires ou infectieuses (ethmoïdite), l’hypertension intracrânienne, ou les paralysies/parésies oculomotrices aiguës. Le scanner est également préféré en première intention dans l’évaluation des craniosténoses et des malformations faciales : l’IRM cérébrale dans ces cas est réalisée secondairement pour rechercher une malformation intracrânienne associée, évaluer la taille de la fosse postérieure et le retour veineux en particulier dans les craniosténoses postérieures. À distance, une IRM orbitaire permet d’évaluer la présence ou l’absence de muscles oculomoteurs ainsi que le trajet et la configuration du nerf optique.
L’IRM a des indications très larges.
Les trois tableaux suivants résument les principales indications d’imagerie cérébro-orbitaires en pédiatrie et leurs délais en fonction de différents contextes : oculaire (Tableau. 3-17), orbitaire (Tableau. 3-18) et neuro-ophtalmologique (Tableau. 3-19).
Les principales malformations rencontrées sont : l’anophtalmie; la microphtalmie simple ou complexe (exemple : microphtalmie sévère unilatérale avec angiome, fig. 3-65; microphtalmie minime avec canal de Cloquet, fig. 3-66); la persistance de vitré primitif (fig. 3-67); les colobomes iriens, cristalliniens ou choriorétiniens isolés (fig. 3-68) ou syndromiques (exemple : syndrome de CHARGE ou Coloboma, Heart defect, Atresia choanae, Retarded growth, Genital anomalies, Ear anomalies, fig. 3-69). Au niveau des nerfs optiques, on peut retrouver une hypoplasie papillaire (exemple : syndrome de de Morsier) ou encore un morning glory. Dans tous les cas de malformation oculaire, l’IRM orbitaire sera complétée par une IRM cérébrale à la recherche de malformations cérébrales associées.
Les principales tumeurs oculaires sont dominées par le rétinoblastome (fig. 3-70).
Fig. 3-65 Nourrisson de 2 mois, présentant une microphtalmie gauche associée à un angiome.
Scanner, coupe axiale avec injection de produit de contraste.
On retrouve dans ce contexte :
les pathologies infectieuses et inflammatoires comme les ethmoïdites, cellulites, dacryocystites et les pseudo-tumeurs inflammatoires (rare chez l’enfant);
les traumatismes (exemple : fracture du plancher, fig. 3-71);
les tumeurs malignes (exemple : rhabdomyosarcome, fig. 3-72);
les tumeurs bénignes (exemple : gliome du nerf optique, fig. 3-73; lésion épi/dermoïde, fig. 3-74);
les lésions vasculaires (hémangiome, angiome leptoméningé dans le cadre de la maladie de Sturge-Weber-Krabe).
Tableau 3-17 - Contexte oculaire.
CHARGE : Coloboma, Heart defect, Atresia choanae, Retarded growth, Genital anomalies, Ear anomalies ; IRM : imagerie par résonance magnétique ; MOM : muscles oculomoteurs ; NF1 : neurofibromatose de type 1 ; NO : nerf optique ; OBNI : objet brillant non identifié ; PDC : produit de contraste ; TDM : tomodensitométrie.
Tableau 3-18 - Devant un contexte orbitaire.
IRM : imagerie par résonance magnétique ; MOM : muscles oculomoteurs ; NO : nerf optique ; TDM : tomodensitométrie.
Tableau 3-19 - Contexte neuro-ophtalmologique.
HTIC : hypertension intracrânienne ; IRM : imagerie par résonance magnétique ; MOM : muscles oculomoteurs ; SB : substance blanche ; SEP : sclérose en plaques ; SG : substance grise ; TDM : tomodensitométrie.
Les indications les plus fréquentes de réalisation d’une IRM en neuro-ophtalmologie pédiatrique sont :
sensorielles comme :
-
une baisse d’acuité visuelle en rapport avec un œdème papillaire;
une atrophie optique (exemple 1 – atrophie papillaire droite par hypoplasie du nerf optique droit intéressant la portion intra-orbitaire et cisternale du nerf optique, fig. 3-75; exemple 2 – gliome avec compression chiasmatique, fig. 3-76);
une névrite optique (exemple : névrite optique dans le cadre d’une sclérose en plaques, fig. 3-77).
oculomotrices devant :
-
un nystagmus (exemple : nystagmus dans le cadre d’un syndrome de Joubert, fig. 3-78; nystagmus et schizencéphalie, fig. 3-79; nystagmus et leucomalacie périventriculaire, fig. 3-80; nystagmus et cytopathie mitochondriale, fig. 3-81);
une exotropie précoce;
une paralysie oculomotrice;
un torticolis;
une fibrose oculomotrice (exemple : syndrome de Duane type I, fig. 3-82);
ou encore une craniosténose simple ou syndromique (fig. 3-83).
Enfin, toute inflammation oculaire accompagnée d’une altération de l’état général, en particulier fébrile, devra faire craindre une uvéoméningite et être prise en charge en urgence extrême en secteur pédiatrique avec bilan infectieux (ponction lombaire) et imagerie dès que l’état de l’enfant le permet.

Fig. 3-66 Nourrisson de 8 mois présentant un canal de Cloquet droit avec déformation triangulaire du cristallin.
a, b. IRM, coupes axiales haute résolution T2. c, d. T1 avec saturation de graisse et gadolinium.
Fig. 3-67 Nouveau-né de 3 mois avec persistance de vitré primitif droit, présence d’un décollement hyperintense en T1, hypo-intense en T2 avec une masse en arrière du cristallin très discrètement rehaussée correspondant au vitré primitif.
a. Scanner, coupe axiale avec produit de contraste. b, d. IRM, coupes axiales T1 (b) avec gadolinium (d). c. Coupe sagittale T2 dans le plan du nerf optique droit.
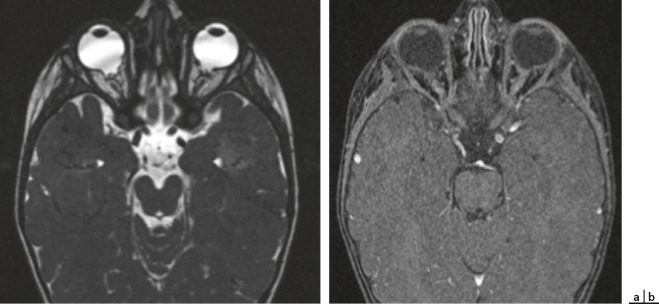
Fig. 3-68 Nourrisson de 17 mois avec colobome choroïdien et papillaire bilatéral plus sévère à droite.
IRM, coupes axiales T2 haute résolution (a) et T1 après gadolinium avec saturation de graisse (b).

Fig. 3-69 Nouveau-né de 3 mois avec colobome choriorétinien associé à une anomalie de la gyration temporale droite (flèche) sous la forme d’un enroulement grossier du cortex.
IRM, coupe axiale T2.
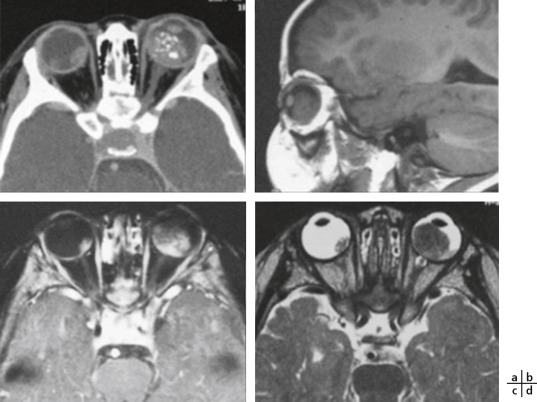
Fig. 3-70 Rétinoblastome bilatéral, avec calcifications à gauche. Les masses intraoculaires sont hypo-intenses en T2 et rehaussées par le gadolinium en T1.
a. TDM, coupe axiale. b-d. IRM, coupe sagittale T1 centrée sur l’oeil gauche (b), axiale T1 avec gadolinium et saturation de graisse (c) et axiale T2 (d).
Fig. 3-71 Fracture du plancher de l’orbite droite s’étendant au canal sous-orbitaire sans incarcération du muscle droit inférieur.
Scanner, coupe coronale.
Fig. 3-72 çon de 8 ans, présentant une discrète exophtalmie droite en rapport avec une masse indurée à la palpation. Présence d’une masse développée aux dépens du muscle droit supérieur iso-intense en T2, rehaussée par le produit de contraste évoquant un rhabdomyosarcome.
a, b. Scanner, coupes axiale et coronale avec injection de contraste. c-e. IRM, coupe axiale T2 (c), coronales T1 avec saturation de graisse avant (d) et après injection de gadolinium (e).
Fig. 3-73 Gliome du nerf optique droit intra-orbitaire : élargissement du nerf optique droit, rehaussé après injection de gadolinium avec atteinte de la portion intracisternale du nerf optique.
a. Scanner, coupe axiale avec injection de contraste. b. IRM, coupes axiale T1. c. IRM, coupe sagittale après injection de gadolinium.

Fig. 3-74 Kyste dermoïde de l’arête nasale droite : lésion bien limitée hypodense en scanner qui apparaît hyperintense en T1 et T2, et hypo-intense après saturation de la graisse.
a. Scanner, coupe axiale. b-d. IRM, coupe axiale T2 (b), axiale T1 (c) et axiale T1 avec saturation de graisse et gadolinium (d).
Fig. 3-75 Nourrisson de 11 mois avec découverte d’une atrophie optique droite : hypoplasie du nerf optique droit intéressant la portion intra-orbitaire et cisternale du nerf optique, agénésie septale, anomalie de la gyration (micropolygirie, flèches blanches) et hétérotopies périventriculaires (flèche jaune).
IRM, coupes axiales T2 centrées sur le parenchyme cérébral (a, b), coupes axiales T2 (c), T1 après gadolinium centrées sur les orbites (d) et le chiasma (e).

Fig. 3-76 Garçon de 5 ans présentant un nystagmus et une pâleur papillaire bilatérale, gliome des voies optiques dans le cadre d’une NF1. Gliome du chiasma étendu au plancher du 3e ventricule, aux nerfs optiques intracrâniens, partiellement rehaussé après injection de produit de contraste. Présence d’un hypersignal T2 intéressant les pallidums et les thalamus compatibles avec des OBNI dans le cadre d’une NF1.
IRM, coupes sagittale T1 (a), axiale T2 (b), coronale et axiale T1 avec gadolinium (c, d).
Fig. 3-77 Enfant de 9 ans avec tableau clinique de névrite optique rétrobulbaire sans contexte de sclérose en plaques.
IRM, coupes coronales T2 (a, b) et axiale diffusion (c), axiales T1 avec gadolinium et saturation de graisse (d, e). Le nerf optique gauche apparaît hyperintense en T2.
Fig. 3-78 Nourrisson de 5 mois, mauvaise poursuite oculaire, ataxie-télangiectasie dans le cadre d’un syndrome de Joubert.
Aspect de dent molaire (au niveau des pédoncules supérieurs) avec absence du vermis inférieur. La décussation des pédoncules cérébelleux supérieurs n’est pas présente sur l’image d’anisotropie couleur : cet aspect est caractéristique du syndrome de Joubert et apparentés. IRM, coupes sagittale T1 (a), axiales T2 (b, c) et cartographie d’anisotropie avec tractographie en couleurs passant par le mésencéphale (d).
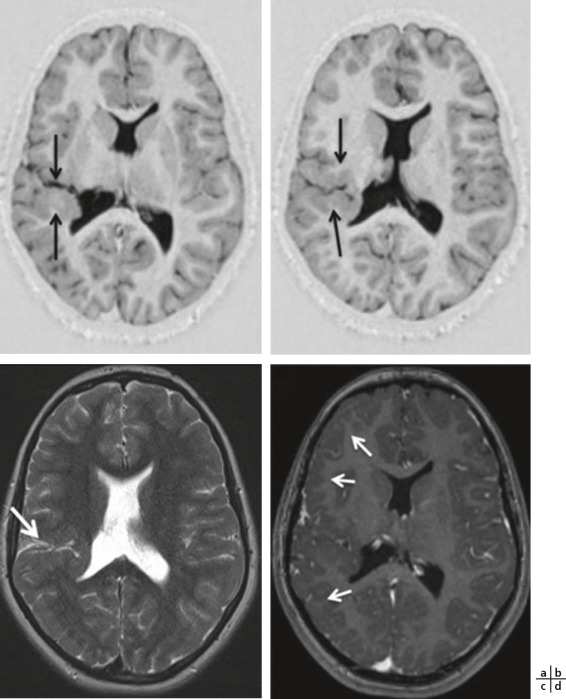
Fig. 3-79 Enfant de 13 ans, atrophie optique, nystagmus et strabisme.
IRM, coupes axiales T1 de type inversion récupération (a, b), axiale T2 (c) et T1 avec gadolinium (d). Présence d’une schizencéphalie droite (flèches noires et blanches) avec un cortex micropolygirique au niveau des berges associé à un aspect de polygirie à distance en particulier au niveau de la région frontale et temporale droite (flèches blanches courtes en d). Le septum est absent ce qui est classique dans les schizencéphalies antérieures.

Fig. 3-80 Enfant de 8 ans, ancien prématuré présentant un nystagmus et une diplégie spastique.
Élargissement du 4e ventricule et des ventricules latéraux en rapport avec une atrophie cérébrale, anomalies de signal de la substance blanche périventriculaire hyperintenses en T2 avec aspect festonné es ventricules latéraux caractéristique de leucomalacie. IRM, coupes axiales T2 (a, b) et T1 inversion récupération (c).

Fig. 3-81 Enfant de 6 ans présentant une rétinite pigmentaire associée à un retard des acquisitions et une hypoglycémie dans le cadre d’une maladie mitochondriale.
IRM, coupes axiales T2. Anomalies de signal (hyperintense) intéressant les noyaux gris centraux (a), le mésencéphale (b) et les faisceaux postérieurs de la protubérance (c).
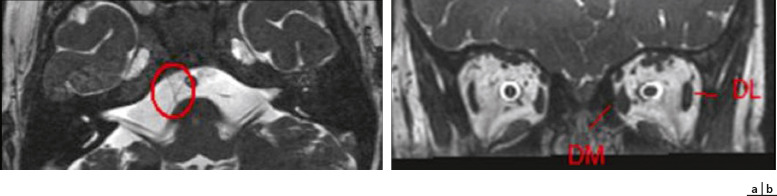
Fig. 3-82 Syndrome de Duane de type I.
IRM, coupe axiale CISS centrée sur l’émergence du VI gauche (a) et coronale orbitaire (b). On note le VI droit entouré en rouge et l’absence de VI gauche. Les muscles droits médiaux (DM) et latéraux (DL) gauches sont hypertrophiques par rapport à leurs homologues droits.

Fig. 3-83 Nouveau-né de 1 mois atteint de craniosténose syndromique (Saethre-Chotzen) avec plagiocéphalie antérieure gauche.
TDM, reconstruction 3D. a. Suture coronale droite normale (flèche rouge). b. Fusion partielle de la partie médiale de la suture coronale gauche (flèche rouge).
[1] Pavlin CJ, Harasiewicz K, Foster FS Ultrasound biomicroscopy of anterior segment structures in normal and glaucomatous eyes Am J Ophthalmol 1992 ; 113 : 381-389
[2] Berges O, Siahmed K Échographie de l’oeil et de l’orbite. Encycl Méd Chir Paris: Elsevier (2014). 1-24Ophtalmologie, 21-062-A-10.
[3] Ducasse A, Bonnet-Gausserand F, Menanteau B, et al. Imagerie du globe oculaire. Encycl Méd Chir Paris: Elsevier (1995). Ophtalmologie, 21-050-A-20.
[4] Berges O, Koskas P, Moret J Imagerie de l’œil et de l’orbite. Encycl Méd Chir Paris: Elsevier (2000). Ophtalmologie.
[5] Fénolland JM, Puech M, Baudouin C, Labbé A Imagerie de l’angle iridocornéen. Encycl Méd Chir (Elsevier, Paris) Ophtalmologie 2013 ; 10 : 1-7
[6] Berges O L’angle iridocornéen et ses mesures en échographie de très haute fréquence ophtalmologiques 2015 ; octobre : 32-41
[7] Izatt Hee MR, Swanson EA, Lin CP, et al. Micrometer-scale resolution imaging of the anterior eye in vivo with optical coherence tomography Arch Ophthalmol 1994 ; 112 : 1584-1589
[8] Puech M, El Maftouhi A Exploration du segment antérieur en OCT 3 JFR Ophthalmol 2004 ; 27 : 459-466
[9] Zhao PS, Wong TY, Wong WL, et al. Comparison of central corneal thickness measurements by visante anterior segment optical coherence tomography with ultrasound pachymetry Am J Ophthalmol 2007 ; 143 : 1047-1049
[10] Prakash G, Agarwal A, Jacob S, et al. Comparison of fourier-domain and time-domain optical coherence tomography for assessment of corneal thickness and intersession repeatability Am J Ophthalmol 2009 ; 148 : 282-290
[11] Simpson T, Fonn D Optical coherence tomography of the anterior segment Ocul Surf 2008 ; 6 : 117-127
[12] Drews RC Fundus photography by electronic flash. III. A new fundus-anterior segment camera Am J Ophthalmol 1957 ; 44 : 522-525
[13] Li H, Leung CK, Cheung CY, et al. Repeatability and reproducibility of anterior chamber angle measurement with anterior segment optical coherence tomography Br J Ophthalmol 2007 ; 91 : 1490-1492
[14] Leung CKS, Chan WM, Yu Ko C, et al. Visualisation of anterior chamber angle dynamics using optical coherence tomography Ophthalmology 2005 ; 112 : 980-984
[15] Friedman DS, He M Anterior chamber angle assessment techniques Surv Ophthalmol 2008 ; 53 : 250-273
[16] Labbé A, Hamard P, Iordanidou V, et al. Apport de l’OCT-Visante® dans le suivi de la chirurgie du glaucome J Fr Ophtalmol 2007 ; 30 : 225-231
[17] Chiang MF, Wang L, Busuioc M, et al. Telemedical retinopathy of prematurity diagnosis : accuracy, reliability, and image quality Arch Ophthalmol 2007 ; 125 : 1531-1538
[18] Ells AL, Holmes JM, Astle WF, et al. Telemedicine approach to screening for severe retinopathy of prematurity : a pilot study Ophthalmology 2003 ; 110 : 2113-2117
[19] Wu C, Peterson RA, VanderVeen DK RetCam imaging for retinopathy of prematurity screening J AAPOS 2006 ; 10 : 107-111
[20] Patel CK, Fung THM, Muqit MMK, et al. Non-contact ultra-widefield retinal imaging and fundus fluorescein angiography of an infant with incontinentia pigmenti without sedation in an ophthalmic office setting J AAPOS 2013 ; 17 : 309-311
[21] Patel SN, Klufas MA, Ryan MC, et al. Color fundus photography versus fluorescein angiography in identification of the macular center and zone in retinopathy of prematurity Am J Ophthalmol 2015 ; 159 : 950-957
[22] Tsui I, Franco-Cardenas V, Hubschman JP, Schwartz SD Pediatric retinal conditions imaged by ultra wide field fluorescein angiography Ophthalmic Surg Lasers Imaging Retina 2013 ; 44 : 59-67
[23] Klufas MA, Patel SN, Ryan MC, et al. Influence of fluorescein angiography on the diagnosis and management of retinopathy of prematurity Ophthalmology 2015 ; 122 : 1601-1608
[24] Fung THM, Yusuf IH, Smith LM, et al. Outpatient ultra- widefield intravenous fundus fuorescein angiography in infants using the Optos P200MA scanning laser ophthalmoscope Br J Ophthalmol 2014 ; 98 : 302-304
[25] Fung TH, Yusuf IH, Xue K, et al. Heidelberg Spectralis ultra-widefield fundus fluorescein angiography in infants Am J Ophthalmol 2015 ; 159 : 78-84
[26] Kang KB, Wessel MM, Tong J, D’Amico DJ, Chan RV Ultra-widefield imaging for the management of pediatric retinal diseases J Pediatr Ophthalmol Strabismus 2013 ; 50 : 282-288
[27] Myung JS, Paul Chan RV, Espiritu MJ, et al. Accuracy of retinopathy of prematurity image-based diagnosis by pediatric ophthalmology fellows : implications for training J AAPOS 2011 ; 15 : 573-578
[28] Poujol J Échographie. Encycl Méd Chir Paris: Elsevier (1992). Ophtalmologie, 21-062-A-10.
[29] Lee H, Proudlock FA, Gottlob I Pediatric optical coherence tomography in clinical practice. Recent Progress Invest Ophthalmol Vis Sci 2016 ; 57 : 69-79
[30] Meunier I, Andt C, Drumare I, Defoort-Dhellemmes S Tomographie en cohérence optique Du signe clinique au diagnostic. Imagerie et exploration de la vision Marseille, Lamy: BSOF (2012). 140-156
[31] Avery RA, Liu GT, Fisher MJ, et al. Retinal nerve fiber layer thickness in children with optic pathway gliomas Am J Ophthalmol 2011 ; 151 : 542-549
[32] Avery RA, Cnaan A, Schuman JS, et al. Intra- and Inter-visit reproducibility of ganglion cell – inner plexiform layer measurements using handheld optical coherence tomography in children with optic pathway gliomas Am J Ophthalmol 2014 ; 158 : 916-923
[33] Parrozzani R, Clementi M, Kotsafti O, et al. Optical coherence tomography in the diagnosis of optic pathway gliomas Invest Ophthalmol Vis Sci 2013 ; 54 : 8112-8118
[34] Gu S, Glaug N, Cnaan A, et al. Ganglion cell layer-inner plexiform layer thickness and vision loss in young children with optic pathway gliomas Invest Ophthalmol Vis Sci 2014 ; 55 : 1402-1408
[35] Vinekar A, Mangalesh S, Jayadev C, et al. Retinal imaging of infants on spectral domain optical coherence tomography BioMed Res Int 2015 ; 2015 : 782420
[36] Vajzovic L, Hendrickson AE, O’Connell RV, et al. Maturation of the human fovea : correlation of spectral-domain optical coherence tomography findings with histology Am J Ophthalmol 2012 ; 154 : 779-789
[37] Patel A, Purohit R, Lee H, et al. Optic nerve head development in healthy infants and children using handheld spectral-domain optical coherence tomography Ophthalmology 2016 ; 123 : 2147-2157
[38] Lee H, Purohit R, Sheth V, et al. Retinal Development in infants and young children with achromatopsia Ophthalmology 2015 ; 122 : 2145-2147
[39] Avery RA, Rajjoub RD, Trimboli-Heidler C, Waldman AT Applications of optical coherence tomography in pediatric clinical neuroscience Neuropediatrics 2015 ; 46 : 88-97
[40] Chong GT, Farsiu S, Freedman SF, et al. Abnormal foveal morphology in ocular albinism imaged with spectral-domain optical coherence tomography Arch Ophthalmol 2009 ; 127 : 37-44
[41] Rosenberg R, Halimi E, Mention-Mulliez K, et al. Five year follow-up of two sisters with type II sialidosis : systemic and ophthalmic findings including OCT analysis J Pediatr Ophthalmol Strabismus 2013 ; 50 : e33-e36online.
[42] Sturm V, Landau K, Menke MN Optical coherence tomography findings in shaken baby syndrome Am J Ophthalmol 2008 ; 146 : 363-368
[43] Sachdeva R, Traboulsi E Disorders of the eye as the whole Pediatric ophthalmology and strabismus Edinbourg: Elsevier Saunders (2013). 139-146
[44] Vachha BA, Robson CD Imaging of pediatric orbital diseases Neuroimag Clin N Am 2015 ; 25 : 477-501
[45] Rahi JS, Cable N Severe visual impairment and blindness in children in the UK Lancet 2003 ; 362 : 1359-1365
[46] Bosch DGM, Boonstra FN, Willems MAAP, et al. Low vision due to cerebral visual impairment : differentiating between acquired and genetic causes BMB Ophthalmology 2014 ; 14 : 59-68
[47] Denis D, Girard N, Levy-Mozziconacci A, et al. Ocular coloboma and results of brain MRI : preliminary results J Fr Ophtalmol 2013 ; 36 : 210-220
[48] Denis D, Girard N, Toesca E, et al. MRI in congenital nystagmus J Fr Ophtalmol 2010 ; 33 : 189-205
M. Robert, S. Defoort-Dhel lemmes
En fonction de l’âge et du niveau de maturation psychomotrice de l’enfant, certaines étapes de l’examen clinique ou paraclinique peuvent être difficiles voire impossibles à réaliser en consultation. Il faut alors savoir poser l’indication d’un examen sous anesthésie générale (AG).
En fonction des centres, des habitudes et de l’expérience de chacun, les indications des examens sous AG varient. Chaque indication doit faire évaluer soigneusement la balance bénéfice/risque de l’examen. L’ophtalmologiste doit éviter deux sortes d’écueils : celui de ne pas poser l’indication d’un examen sous AG et retarder ainsi un diagnostic et un traitement; celui de poser des indications excessives et d’imposer une hospitalisation et une AG évitable à un enfant. Les techniques de sédation offrent aujourd’hui une alternative intéressante dans de nombreux cas. En cas d’indications multiples à des AG, notamment dans le cadre de prises en charge multidisciplinaires, on s’attachera à grouper au maximum les procédures (examens cliniques, complémentaires ou chirurgies) au cours d’une même AG.
La réalisation d’un examen sous anesthésie requiert non seulement une structure adaptée en termes d’anesthésie et de réveil pédiatrique, mais aussi le matériel utile à un examen complet : collyres d’examen, microscope opératoire avec lampe à fente et verres d’examen, non-contact et contact, de différentes tailles (nouveau-né, nourrisson), blépharostats de différentes tailles (nouveau-né, nourrisson), réfractomètre automatique, compas de Sourdille, échographie mode A et mode B, UBM, pachymètre, tonomètre de Perkins, si possible matériel photographique et d’angiographie, OCT, matériel d’électrophysiologie. La possibilité de réalisation d’un geste, dans le même temps anesthésique, s’il est indiqué, est appréciable (chirurgie de glaucome, laser argon d’une lésion rétinienne, etc.).
Les indications d’un examen sous AG sont toutes liées, dans une proportion variable, d’une part, au terrain de l’enfant et d’autre part, à la nature de l’examen à réaliser.
Les examens sous AG ponctuent le suivi des nourrissons atteints de glaucome congénital. La fréquence de ceux-ci a diminué depuis le développement des techniques de tonométrie par rebond de type Icare® et des techniques de sédation vigile. Ils demeurent néanmoins fréquemment indiqués, soit en cas de doute sur l’un des paramètres de suivi du glaucome, soit afin d’obtenir une évaluation très complète de la situation comportant l’ensemble des paramètres de suivi.
Les effets des techniques d’anesthésie sur la pression intra-oculaire (PIO) ont fait l’objet de plusieurs études [1, 2]. Ils requièrent donc des protocoles d’anesthésie précis et systématiques. Le sévoflurane, communément utilisé, diminue notablement la PIO; une correction de la pression intra-oculaire de 6 mmHg est alors généralement appliquée. Les effets de la kétamine sur la PIO sont moindres.
Les myopies fortes du nourrisson et de l’enfant, qu’elles s’inscrivent ou non dans le cadre syndromique d’une collagénopathie ou d’une neurofibromatose ou dans le cadre des séquelles d’une prématurité, sont pourvoyeuses de lésions périphériques dont le traitement préventif est moins consensuel que chez l’adulte, du fait notamment des difficultés à connaître par l’interrogatoire leur caractère ou non symptomatique [3]. L’examen de la périphérie rétinienne est particulièrement malaisé entre 9 mois et 9 ans. Il constitue souvent une indication à une AG.
Rarement, nous sommes confrontés en consultation d’urgence à un nourrisson ou un jeune enfant très photophobe depuis quelques jours, dont l’examen, même après instillation d’anesthésique topique et même parfois sous sédation vigile, est impossible. L’examen sous AG est alors indispensable. Il peut s’agir d’un corps étranger sous-palpébral, mais aussi d’une kératopathie (stromale herpétique notamment) ou d’une uvéite.
Beaucoup plus souvent, un nystagmus à début précoce associé à une photophobie intense constitue une indication à un examen clinique de la rétine et à un électrorétinogramme. Si celui-ci n’a pas été réalisé avant l’âge de 12 mois, il est parfois impossible de conclure chez l’enfant entre une dysfonction stationnaire des cônes et une dystrophie cônes-bâtonnets, affections aux prises en charge bien différentes.
Lorsqu’elles entrent dans le cadre d’un syndrome affectant également la vision, ou qu’elles s’associent à une modification du comportement visuel, il arrive rarement, en cas d’hétéro-agressivité associée chez un grand enfant, que la sédation vigile soit impossible. L’AG est alors indiquée.
Il est essentiel d’obtenir en un seul examen l’ensemble des informations utiles au suivi de l’enfant pendant une durée maximale. En fonction des cas, on procédera ou non à une dilatation. Une cycloplégie par cure d’atropine ou de cyclopentolate avant l’examen permet de réaliser une réfraction de qualité. Une dilatation pupillaire non cycloplégique est une autre option. Dans certains cas, notamment dans des cas de glaucome, aucune dilatation n’est pratiquée, afin de faciliter l’examen de l’angle iridocornéen ou de réaliser possiblement un geste sur la cornée ou le trabéculum.
Il convient de bien expliquer aux parents en cas de traitement topique chronique, si celui-ci doit être poursuivi ou au contraire interrompu avant l’examen.
Elle tiendra compte des possibilités de fluctuation de la PIO en fonction du type de gaz employé. Les facteurs de correction de la PIO dépendront du type d’anesthésie utilisée. Le pourcentage de gaz expiré (souvent sévorane) sera noté sur la feuille d’examen.
Il s’agit de : la réfraction objective (en précisant la nature de la cycloplégie éventuellement employée); l’examen clinique des segments antérieur et postérieur de l’œil; la mesure du(des) diamètre(s) cornéen(s), de l’épaisseur cornéenne et de la longueur axiale de l’œil.
Il s’agit de(s) : l’examen de l’angle iridocornéen; l’examen de la rétine périphérique au verre à trois miroirs; l’échographie en mode B ou l’UBM; photographies des segments antérieur et postérieur; l’angiographie à la fluorescéine et/ou au vert d’indocyanine; l’OCT; l’ERG global; PEV flash (examens ne nécessitant pas l’attention du patient).
Outre les risques connus inhérents à une AG chez un nourrisson, une controverse anime les sociétés d’anesthésie et de chirurgie pédiatrique depuis plusieurs décennies : la neurotoxicité des agents anesthésiques employés chez l’enfant fait-elle courir un risque en termes de développement psychomoteur, notamment aux nourrissons endormis de manière répétée? Propofol, étomidate, midazolam agissent sur les récepteurs gamma-aminobutyric acid (GABA) du cerveau, tandis que la kétamine agit sur les récepteurs N-méthyl-D-aspartate (NMDA). De nombreuses études – fondamentales et comportementales – portant sur l’AG chez le rat puis le primate, ont montré une augmentation de l’apoptose des neurones et de la glie, notamment à l’âge du début de la myélinisation [4], ainsi que des déficits de l’attention et de la mémoire chez ces animaux [5]. Plusieurs études chez l’enfant n’ont pour l’heure pas permis de conclure. De larges études sont en cours, qui permettront de répondre à ces questions et d’adapter en fonction les recommandations pratiques concernant les méthodes d’anesthésie chez le nourrisson et l’enfant.
Les techniques de sédation vigile se sont récemment développées dans notre système de soin. Elles sont sÛres, ne nécessitent pas la présence d’un anesthésiste ni donc d’un bloc opératoire; elles permettent d’éviter les risques connus et potentiels d’une AG et de désengorger des programmes opératoires souvent surchargés. Le mélange équimolaire oxygène-protoxyde d’azote (dit MEOPA) est couramment utilisé en inhalation; certaines équipes utilisent l’hydrate de chloral per os [6] ou encore la kétamine ou le midazolam par voie intrarectale, qui permettent une sédation plus profonde. Une infirmière ayant validé une formation spécifique peut conduire les étapes de la sédation. D’une manière générale, les techniques actuelles de sédation permettent d’éviter une AG dans un grand nombre de situations, notamment la réalisation d’examens complémentaires ponctuels et sont donc de plus en plus souvent utilisées avant de poser l’indication d’une AG. Aucune correction des chiffres de PIO n’est alors généralement appliquée, la diminution pressionnelle induite par les sédatifs n’étant pas statistiquement significative.
[1] Alipour M, Derakhshan A, Pourmazar R, et al. Effects of propofol, etomidate, and thiopental on intraocular pressure and hemodynamic responses in phacoemulsification by insertion of laryngeal mask airway J Ocul Pharmacol Ther 2014 ; 30 : 665-669
[2] Blumberg D, Congdon N, Jampel H, et al. The effects of sevoflurane and ketamine on intraocular pressure in children during examination under anesthesia Am J Ophthalmol 2007 ; 143 : 494-499
[3] Bansal AS, Hubbard GB Peripheral retinal findings in highly myopic children ≤ 10 years of age Retina 2010 ; 30 : S15-S19
[4] Creeley C, Dikranian K, Dissen G, et al. Propofol-induced apoptosis of neurones and oligodendrocytes in fetal and neonatal rhesus macaque brain Br J Anaesth 2013 ; 110 : i29-i38Suppl 1.
[5] Brambrink AM, Evers AS, Avidan MS, et al. Ketamine-induced neuroapoptosis in the fetal and neonatal rhesus macaque brain Anesthesiology 2012 ; 116 : 372-384
[6] West SK, Griffiths B, Shariff Y, et al. Utilisation of an outpatient sedation unit in paediatric ophthalmology : safety and effectiveness of chloral hydrate in 1509 sedation episodes Br J Ophthalmol 2013 ; 97 : 1437-1442
