Amétropies et complications des amétropies fortes
Coordonné par E. Bui Quoc
V. Soler, F. Malecaze, P. Calvas
La myopie est le trouble réfractif le plus fréquent dans le monde. La prévalence varie selon la région et l'ethnie considérée. Elle est d'environ 25 à 40 % dans les pays occidentaux. Mais ces chiffres augmentent dramatiquement dans les pays asiatiques, atteignant à Singapour et à Taïwan plus de 80 % dans certaines populations de jeunes enfants scolarisés [1,2].
Si la myopie se définit par une réfraction en deçà de – 0,5 D, la définition réfractive de la myopie forte est sujette à débat. Généralement, la myopie forte est définie par une longueur axiale supérieure à 26 mm [3]. La prévalence de la myopie forte est d'environ 4,5 % aux États-Unis et en Europe de l'Ouest mais elle atteint 20 % dans certaines populations asiatiques [1,4]. La myopie forte se classe parmi les cinq premières causes de cécité légale du fait de ses complications cécitantes.
Le déterminisme de la myopie est multifactoriel. Deux théories se sont longtemps opposées selon le classique « nature versus nurture » : étiologie génétique versus étiologie environnementale [5]. Un mécanisme mixte semble actuellement le plus probable. Cela est parfaitement mis en exergue par l'exemple des données ethniques de Singapour : pour les ethnies malaisienne, indienne et chinoise, en 1990, la prévalence de la myopie était respectivement d'environ 25 % , 30 % et 50 % , et en 2010, soit 20 ans plus tard, respectivement d'environ 70 % , 75 % et 85 % [1]. Soumises aux mêmes facteurs environnementaux (Singapour), ces ethnies ont donc présenté chacune une augmentation assez similaire de la prévalence de la myopie sur les vingt dernières années témoignant ainsi de l'importance des facteurs environnementaux. Sur la même période, les différences interethniques de prévalence ont persisté, les Malaisiens étant moins myopes que les Indiens et encore moins que les Chinois. Ainsi, chaque ethnie, même soumise à une pression environnementale, garde donc certaines caractéristiques propres, certainement du fait de l'hérédité témoignant de l'importance des facteurs héréditaires.
Du fait de l'hétérogénéité génétique, caractérisée par le nombre important de gènes impliqués, et du fait de l'intrication de facteurs génétiques et environnementaux dans le développement de la myopie, il n'est pas possible de définir un mode de transmission mendélien de la maladie.
Néanmoins, les analyses de familles de myopes forts ont montré qu'il est fréquent d'observer dans ces familles une transmission autosomique dominante, en particulier dans les familles françaises [6]. Plus rarement, des transmissions sur un mode autosomique récessif ou liées à l'X peuvent être observées.
Les premières études génétiques concernant la myopie furent avant tout des travaux d'observation. Ces études, s'intéressant aux paires de jumeaux et aux familles de myopes, ont ainsi permis de démontrer l'implication de facteurs génétiques multiples dans le développement de la myopie, sans pour autant fournir une preuve biologique. Cette preuve biologique a été apportée par les travaux de génétique moléculaire.
Les études de jumeaux ont été, il y a plus d'un siècle, les premières à mettre en évidence la contribution de mécanismes génétiques dans le déterminisme de la myopie.
Dans une grande étude de ce type, Sorsby et al. ont retrouvé en 1962 un taux de concordance pour la myopie de plus de 90 % chez les jumeaux monozygotes (78 paires) et de moins de 25 % chez les jumeaux dizygotes (40 paires) [7]. Les autres études de jumeaux ont montré des résultats similaires concernant les autres composants réfractifs comme la longueur axiale, la courbure cornéenne ou la puissance cristallinienne. Plus récemment, la série la plus importante, réalisée à partir d'une population de 2 301 paires de jumeaux (1 152 paires monozygotes versus 1 149 paires dizygotes), a estimé l'héritabilité de l'erreur réfractive à 77 % et le rôle de l'environnement à 7 % . Cela a ainsi confirmé les précédentes publications qui évaluaient l'héritabilité de l'erreur réfractive à des valeurs comprises entre 50 et 95 % [8]. Toutefois, en considérant que l'effet de l'environnement au sein d'une paire de jumeaux est indépendant de la zygotie, ces études ont pour inconvénient de pouvoir surestimer l'héritabilité de l'erreur réfractive.
Réalisées à partir de familles de patients, les analyses de liaison ont permis d'identifier différents loci, ou régions chromosomiques, qui sont susceptibles de contenir le ou les gènes imputés dans le développement de la myopie. Depuis la description du premier locus de susceptibilité à la myopie forte identifié en 1990 sur le chromosome Xq28 chez une famille danoise atteinte par une forme syndromique de myopie forte appelée maladie de Bornholm (Bornholm eye disease associant myopie forte, deutéranopie et hypoplasie optique), une vingtaine de loci de susceptibilité à la myopie non syndromique ont été décrits. Ces loci sont le résultat de différentes études s'intéressant au trait génétique « myopie » ou « myopie forte » et portant sur des populations différentes d'un point de vue ethnique et/ou géographique. Il est intéressant de noter que tous ces loci sont répartis sur plus de quinze chromosomes différents. La plupart de ces régions chromosomiques de susceptibilité génétique à la myopie qui ont été identifiées par analyse de liaison n'ont pu être répliquées et peu ont abouti à l'identification d'un gène.
Les régions identifiées sont données ci-après notées selon les termes Online Mendelian Inheritance in Man (OMIM) suivies entre parenthèses de la localisation chromosomique : MYP1 (Xq28), MYP2 (18p11.31), MYP3 (12q21-23), MYP4 (7q36), MYP5 (17q21-q22), MYP7 (11p13), MYP8 (3q26), MYP9 (4q12), MYP10 (8p23), MYP11 (4q22-q27), MYP12 (2q37.1), MYP13 (Xq23-q27), MYP14 (1p36), MYP15 (10q21.1), MYP16 (5p15.33-p15.2), MYP17 (7p15), MYP18 (14q22.1-q24.2), MYP19 (5p15.1-p13), MYP20 (13q12.12). Pour les régions suivantes, un gène a été identifié : MYP6 (22q12; gène SCO2 ), MYP 21 (1p22;ZNF644 ), MYP22 (4q35;CCDC111 ), MYP23 (4p16;LRPAP1 ), MYP24 (12q13.3;SLC39A5 ). Il est intéressant de relever que les quelques gènes précédemment cités ont été identifiés suite à l'apport des technologies de séquençage à haut débit.
Le gène SCO2 code pour une protéine chaperonne impliquée dans la biogenèse de la cytochrome C oxydase de la chaîne respiratoire mitochondriale [9]. Le gène ZNF644, identifié dans une grande famille chinoise et répliqué dans une cohorte américaine, code pour une protéine qui est un facteur de transcription de la famille des protéines à doigt de zinc et de fonction encore inconnue. Le gèneCCDC111 code pour une protéine qui est un acide désoxyribonucléique (ADN) primase-polymérase humaine intervenant dans la réplication et la réparation de l'ADN. Le gène LRPAP1, code pour une protéine qui intervient dans la régulation de l'activité du transforming growth factor, β (TGF-β). Le gène P4HA2 code pour une protéine qui est impliquée dans le repliement tridimensionnel des chaînes de procollagène. Le gène SLC39A5, code pour une protéine qui intervient dans la régulation du zinc intracellulaire.
Les analyses d'association étudient la probabilité qu'il existe une association entre des variants d'une base de l'ADN et le phénotype myopie. Elles sont réalisées à partir d'une population de cas et d'une population de contrôles. Ces études ont permis à ce jour de rapporter plus de cinquante gènes candidats pour lesquels une association positive à la myopie ou à la réfraction a été mise en évidence [10].
En 2013, une méta-analyse du consortium CREAM [11] et l'étude d'association du groupe 23andMe [12], réalisées toutes deux à partir de larges cohortes indépendantes de plus de 45 000 individus (méta-analyse de 32 études d'association pour la première et cohorte 23andMe pour la seconde), ont permis chacune l'identification de plus de 20 loci associés à la myopie, parmi lesquels 16 des 20 loci identifiés dans 23andMe ont été confirmés par CREAM et 14 des 22 loci identifiés par CREAM ont été répliqués par 23andMe [13]. Il est intéressant de noter que ces études présentaient une méthodologie totalement différente, le phénotype (myope/non myope) étant fondé pour le consortium CREAM sur la réfraction et/ou la longueur axiale et pour l'étude de 23anMe sur un simple questionnaire adressé aux individus (question :vous a-t-on déjà diagnostiqué une myopie? ; réponses possibles :oui/non/je ne sais pa ). Le nombre d'individus dans ces études, ainsi que la réplication de résultats obtenus avec des méthodologies différentes font tout l'intérêt de ces deux publications indépendantes.
Pour résumer, les gènes candidats identifiés par ces analyses d'association codent pour des protéines intervenant dans :
- – le remodelage de la matrice extracellulaire sclérale : les collagènes, un protéoglycane, la myociline ( COL1A1, COL2A1, LUM, MYOC), la famille des enzymes de dégradation de la matrice sclérale (matrix metalloproteinase [MMP]), et d'autres protéines (LAMA2, BMP2, BMP3);
- – la croissance cellulaire et tissulaire tels le TGF, l'hepatocyte growth factor, l'insulin-like growth factor;
- – l'adhésion et la motilité cellulaire (UMODL1, CTNND2, ACTC1);
- – le développement oculaire ou cérébral (TGIF1, SOX2OT, PAX6, ZIC2, PRSS56, SIX6);
- – la signalisation intracellulaire (RASGRF1) et la signalisation intercellulaire (GRIA4, GJD2, CHRM1 qui codent pour un récepteur muscarinique);
- – le transport ionique (KCNQ5, RBFOX1, KCNMA1);
- – le métabolisme de l'acide rétinoïque (RDH5);
- – la régulation de l'apoptose (PSARL, BLID), etc.
Enfin, certains auteurs se sont intéressés à identifier les facteurs prédisposant les sujets myopes forts à la survenue de néovaisseaux choroïdiens. Leveziel et al. ont ainsi montré l'implication du gène CFI, situé en 4q25, codant pour une sérine protéinase impliquée dans la cascade du complément [14].
L'étude de l'expression tissulaire des gènes identifiés comme étant associés à la myopie montre que ceux-ci peuvent s'exprimer, selon celui que l'on considère, au niveau des photorécepteurs, du reste de la rétine, de l'épithélium pigmentaire, de la choroïde, ou de la sclère. Ainsi, le nombre de gènes associés à la myopie est très important et ceux-ci interviennent physiologiquement dans de nombreuses fonctions tissulaires nécessaires à l'homéostasie tissulaire oculaire.
II ne faut pas oublier que la myopie est une des caractéristiques cliniques de certains syndromes tels que la maladie de Marfan, le syndrome de Stickler, la maladie de Weill-Marchesani ou l'homocystinurie. Certains syndromes peuvent même avoir une expression oculaire pure comme les syndromes de Stickler de type 1 liés à une mutation sur l'exon 2 du gène COL2A1 [15], la maladie de Wagner, la maladie de Bornholm, le syndrome de Goldmann-Favre.
L'interprétation de toutes ces données ne peut se faire sans revenir aux interactions avec l'environnement. Ainsi, en 2013, Verhoeven et al. [16] ont montré que l'effet synergique de l'association hérédité et haut niveau éducatif allait au-delà du simple effet additif, soulignant dans ce travail l'importance des interactions inné/acquis dans le développement de la myopie.
De plus, en 2016, le consortium CREAM a repris l'étude de 39 loci génétiques associés au développement de la myopie chez l'adulte et a ainsi identifié un nombre limité de variants génétiques (n ≤ 12) impliqués dans le développement de la myopie chez l'enfant, montrant ainsi que le début précoce ou tardif de la myopie, ainsi que sa stabilité dans l'enfance, avait une origine, au moins en partie, génétiquement déterminée [17]. Les auteurs de cette étude ont par ailleurs montré qu'un variant situé sur le gène ZMAT4 était associé à une myopie favorisée par le travail de près, mais ils n'ont pas retrouvé d'interactions entre les variants génétiques analysés et le temps passé à l'extérieur.
La génétique de la myopie, c'est au moins 20 paires de chromosomes concernées, et plus de 50 gènes impliqués [10]. Les mécanismes en jeu sont complexes, faisant intervenir de multiples molécules au sein de cascades de signalisation intracellulaire et extracellulaire. Ces phénomènes ont pour conséquence le remodelage scléral et l'allongement du globe oculaire. L'intervention pharmacologique sur un dénominateur commun à tous ces phénomènes physiopathologiques permettrait d'entrouvrir la porte à une thérapeutique préventive efficace vis-à-vis de la progression de la myopie et de la survenue de ses complications cécitantes. C'est là tout le but de la recherche actuelle.
[1] Morgan IG, Ohno-Matsui K, Saw SM Myopia Lancet: ( 2012 ) :379: 1739-1748.
[2] Williams KM, Verhoeven VJ, Cumberland P Prevalence of refractive error in Europe : the European Eye Epidemiology (E(3)) Consortium Eur J Epidemiol: ( 2015 ) :30: 305-315.
[3] Meng W, Butterworth J, Malecaze F, Calvas P Axial length : an underestimated endophenotype of myopia Med Hypotheses: ( 2010 ) :74: 252-253.
[4] Lin LL, Shih YF, Hsiao CK, Chen CJ Prevalence of myopia in Taiwanese schoolchildren : 1983 to 2000 Ann Acad Med Singapore: ( 2004 ) :33: 27-33.
[5] Wojciechowski R Nature and nurture : the complex genetics of myopia and refractive error Clin Genet: ( 2011 ) :79: 301-320.
[6] Naiglin L, Clayton J, Gazagne C Familial high myopia : evidence of an autosomal dominant mode of inheritance and genetic heterogeneity Ann Genet: ( 1999 ) :42: 140-146.
[7] Sorsby A, Sheridan M, Leary GA. Refraction and its components in twins. Medical Research Council Report no 303. London : Her Majesty’s Stationery Office ; 1962.
[8] Lopes MC, Andrew T, Carbonaro F Estimating heritability and shared environmental effects for refractive error in twin and family studies Invest Ophthalmol Vis Sci: ( 2009 ) :50: 126-131.
[9] Young TL, Powell A, Klemm T, et al. Identification of a novel gene for autosomal dominant high-grade myopia using whole exome sequencing. ASHG/ICHG 2011.
[10] Stambolian D Genetic susceptibility and mechanisms for refractive error Clin Genet: ( 2013 ) :84: 102-108.
[11] Verhoeven VJ, Hysi PG, Wojciechowski R Genome-wide meta-analyses of multiancestry cohorts identify multiple new susceptibility loci for refractive error and myopia Nat Genet: ( 2013 ) :45: 314-318.
[12] Kiefer AK, Tung JY, Do CB Genome-wide analysis points to roles for extracellular matrix remodeling, the visual cycle, and neuronal development in myopia PLoS Genet: ( 2013 ) :9: e1003299.
[13] Wojciechowski R, Hysi PG Focusing in on the complex genetics of myopia PLoS Genet: ( 2013 ) :9: e1003442.
[14] Leveziel N, Yu Y, Reynolds R Genetic factors for choroidal neovascularization associated with high myopia Invest Ophthalmol Vis Sci: ( 2012 ) :53: 5004-5009.
[15] Tran-Viet KN, Soler V, Quiette V Mutation in collagen II alpha 1 isoforms delineates Stickler and Wagner syndrome phenotypes Mol Vis: ( 2013 ) :19: 759-766.
[16] Verhoeven VJ, Buitendijk GH, Consortium for Refractive Error and Myopia (CREAM) Education influences the role of genetics in myopia Eur J Epidemiol: ( 2013 ) :28: 973-980.
[17] Fan Q, Guo X, Tideman JW Childhood gene-environment interactions and age-dependent effects of genetic variants associated with refractive error and myopia : The CREAM Consortium Sci Rep: ( 2016 ) :6: 25853.
P.-F. Kaeser
Au cours des dernières décennies, la prévalence de la myopie n'a cessé d'augmenter. Près de 90 % des jeunes asiatiques et 47,2 % des jeunes européens sont myopes, et les projections prévoient que la moitié de la population mondiale sera myope en 2050. Les myopies modérées se corrigent sans difficulté grâce aux lunettes, aux verres de contact ou à la chirurgie réfractive, avec néanmoins un coÛt important pour la société. Les myopies pathologiques sont quant à elles sources de nombreuses complications potentiellement invalidantes, comme le décollement de rétine, les dégénérescences rétiniennes, le glaucome ou la cataracte.
L'augmentation de la prévalence de la myopie semble influencée par des facteurs environnementaux ou comportementaux plutôt que génétiques, comme le démontre notamment une étude sur les jumeaux monozygotes. Le jumeau le plus myope a en effet un statut professionnel plus élevé, vit en zone urbaine, et pratique plus d'activités en vision rapprochée [1].
Cet article présente les principales hypothèses étiologiques environnementales de la myopie, ainsi que les résultats des interventions proposées pour en freiner l'évolution. Les influences de la focalisation des images sur la rétine et de l'exposition aux différents types de lumière sont en particulier abordées.
La croissance oculaire post-natale dépend des images projetées sur la rétine. Chez l'animal, le globe s'allonge en l'absence d'image ou lorsqu'un défocus hypermétropique (focalisation de l'image en arrière de la rétine) est créé par l'interposition de verres concaves, alors qu'un défocus myopique a l'effet inverse [2,3]. Chez l'homme, la sous-correction de la myopie (défocus myopique) provoque au contraire un accroissement de la longueur axiale [4,5].
L'ablation de la fovéa n'a pas d'effet significatif sur la croissance oculaire. Ce n'est donc pas la fovéa qui est déterminante pour la croissance oculaire, mais la rétine périphérique, probablement en raison de sa surface plus importante [6,7]. En effet, un défocus périphérique hypermétropique (images focalisées sur la fovéa, mais en arrière de la rétine périphérique) induit une myopie axile chez l'animal, avec un effet dépendant de l'étendue de la surface rétinienne concernée [2,3]. Chez l'homme, l'importance du défocus hypermétropique périphérique sur la myopisation est controversée. Dans certaines études, le défocus périphérique est plus marqué chez les enfants qui deviendront myopes, alors que dans d'autres, il est démontré que les changements réfractifs ne dépendent pas de la réfraction périphérique [8]. Il est donc possible que le défocus périphérique soit une conséquence plutôt qu'une cause de l'élongation axile myopique.
Les traitements optiques visant à « corriger » le défocus hypermétropique périphérique sont multiples. La compensation du défocus hypermétropique par des lunettes a cependant un effet peu significatif sur l'évolution de la myopie, alors que le port de verres de contact diurnes serait plus efficace, d'après une étude portant toutefois sur un petit collectif de patients et d'une durée limitée à une année, avec port de lentilles au design optique particulier visant à réduire l'hypermétropie périphérique [9]. L'orthokératologie, quant à elle, vise, outre la correction diurne du trouble réfractif par la modification de la réfraction centrale, à corriger le défocus périphérique par l'altération de l'épaisseur de l'épithélium cornéen, en diminuant l'épaisseur centrale et en augmentant l'épaisseur périphérique par un port nocturne de lentilles rigides. Un ralentissement de la progression de la myopie a été démontré, avec une efficacité comparable à celle de l'atropine au cours d'une étude sur 3 ans, période toutefois suivie d'un effet plateau [10–12]. Il existe de plus un possible effet rebond à l'arrêt du traitement, similaire à celui constaté avec l'atropine 0,5 % ou 1 % (voir ci-dessous), un cas clinique rapportant une accélération de la progression de la myopie à l'arrêt du traitement. L'orthokératologie n'est par ailleurs pas dénuée de risques infectieux, malgré l'absence de publication de complication à long terme.
L'accommodation liée au travail en vision rapprochée est un facteur de myopisation évoqué depuis plus d'un siècle : preuve en est l'application de mesures d'hygiène scolaire dès la fin du xix siècle. Cette association semble confirmée par une étude récente réalisée chez 5052 enfants, avec toutefois des mesures de réfraction réalisées sans cycloplégie, qui surestiment sans doute la myopie à l'autoréfractomètre [13]. Une méta-analyse conclut à un risque augmenté de myopisation de 2 % pour chaque heure supplémentaire de travail de près par semaine [14]. Cependant, des études animales ont démontré que l'accommodation n'est pas un facteur critique de progression de la myopie [15]. De même, une étude longitudinale conduite pendant 5 ans sur un échantillon de 1318 enfants âgés de 6 à 14 ans révèle que le nombre d'heures hebdomadaires de lecture ou de travail sur écran d'ordinateur ne permet pas de prévoir l'évolution de la réfraction [16]. Actuellement, la majorité des auteurs considère que le travail de près n'a pas de rôle causal majeur dans la myopisation [17,18].
L'absence d'effet significatif des interventions visant à soulager l'accommodation tend également à démontrer l'absence de lien avec l'évolution de la réfraction. Par exemple, le port de verres progressifs ou bifocaux a longtemps été préconisé, tant pour son effet sur le retard accommodatif des myopes qui aggraverait le défocus hypermétropique périphérique, que sur la supposée tension mécanique créée par le cristallin ou le corps ciliaire durant l'accommodation, qui diminuerait l'expansion oculaire équatoriale, augmentant ainsi la croissance axiale [19]. Dans la pratique, le port de verres progressifs ne diminue que peu la progression de la myopie, avec une modification certes statistiquement significative mais cliniquement insignifiante [19]. L'étude COMET (Correction of Myopia Evaluation Trial), qui porte sur 469 enfants de 6 à 11 ans, a rapporté une réduction de la progression de la myopie de seulement 0,20 D sur 3 ans, avec un effet principalement au cours de la première année [20]. Il existe non seulement un effet plateau, puisque l'effet du traitement n'est plus significatif après 5 ans, mais également un probable effet rebond lors du remplacement des verres de contact par des lunettes [21,22].
L'atropine, antagoniste muscarinique non sélectif, a d'abord été utilisée pour son effet cycloplégiant sur les récepteurs du corps ciliaire. La persistance de l'atténuation de la progression de la myopie chez des animaux de laboratoire rendus incapables d'accommoder par destruction du noyau d'Edinger-Westphal ou section du nerf optique, ou chez des animaux dont les récepteurs du corps ciliaire sont nicotiniques, démontre toutefois que l'effet « anti-myopie » de l'atropine est indépendant de l'accommodation [15,23]. Le mécanisme d'action est toujours inconnu, mais une action directe sur les récepteurs rétiniens ou scléraux est supposée. L'administration topique d'atropine est le traitement aux effets les plus systématiques sur la progression de la myopie [24]. L'effet est dose-dépendant, mais l'utilisation de concentrations élevées (0,5 ou 1 % ) est grevée non seulement d'effets secondaires (cycloplégie nécessitant une correction optique avec addition de près, mydriase avec photophobie), mais également d'un effet rebond significatif à l'arrêt du traitement. L'instillation d'atropine à concentration très faible (0,01 % ) paraît un compromis acceptable, puisqu'elle n'entraîne ni effet secondaire ni effet rebond, même à long terme (5 ans) [25, 26]. L'effet de l'atropine est similaire chez les Caucasiens et chez les Asiatiques, chez lesquels la plupart des études ont été conduites [27].
Si la focalisation des images sur la rétine paraît importante pour la régulation de la croissance oculaire, il en est de même de la composition de la lumière ambiante, dont deux facteurs semblent déterminants.
Premièrement, l'intensité de la lumière ambiante est significative pour son effet protecteur. Supérieure à l'extérieur, l'intensité lumineuse induit un myosis qui augmente la profondeur de champ et réduit le flou rétinien [28]. Les variations saisonnières de l'intensité de la lumière, ainsi que le rythme circadien endogène pourraient être importants pour l'emmétropisation [23]. Une association entre l'éclairage nocturne, altérant le rythme circadien, et la myopie a de fait été proposée par Quinn suite à une étude sur 479 enfants, mais cette association n'a pas été confirmée par plusieurs études réalisées par la suite [29,30].
Deuxièmement, la composition spectrale de la lumière, et donc son point focal maximal, est importante. La lumière naturelle a un pic dans les longueurs d'onde relativement courtes, dans la partie bleue du spectre (550 nm pour le soleil), alors que les ampoules au tungstène à incandescence émettent une lumière artificielle de plus grandes longueurs d'onde, dans le rouge. Les animaux élevés en lumière rouge, qui est focalisée principalement en arrière de la rétine (créant un défocus hypermétropique), sont plus myopes que ceux élevés en lumière bleue. La chromaticité de la lumière ambiante a donc un effet sur la croissance oculaire, et la partie bleue du spectre, très présente en lumière naturelle, pourrait être impliquée dans l'effet protecteur de la lumière extérieure [31]. Il ne faut toutefois pas négliger l'effet potentiellement délétère de la lumière bleue, sur la rétine en particulier. Ce problème est particulièrement d'actualité avec le développement des ampoules light-emitting diodes (LED), pourvoyeuses de lumière bleue. Les recommandations récentes conseillent en effet de limiter l'exposition des enfants aux ampoules LED, alors que leurs yeux sont paradoxalement les plus vulnérables à la myopisation. En raison de l'effet bénéfique potentiel de la lumière bleue, la prescription aux enfants de verres optiques avec filtre de lumière bleue pourrait être dommageable.
La régulation de la croissance oculaire post-natale par des phénomènes locaux dépendant de la vision suppose des mécanismes de signalisation entre la rétine et la sclère qui impliquent probablement la dopamine. En effet, la dopamine, produite en réponse à l'exposition à la lumière par les cellules amacrines dopaminergiques et par les cellules ganglionnaires rétiniennes intrinsèquement photosensibles qui forment des synapses entre elles, inhibe l'élongation axiale dans les myopies expérimentales. Cet effet est supprimé par l'administration intravitréenne d'un antagoniste dopaminergique [32].
Plusieurs études cliniques confirment l'effet protecteur du temps passé à l'extérieur sur l'apparition et la progression de la myopie, avec une diminution du risque de 2 % pour chaque heure par semaine passée à l'extérieur, sans relation avec l'activité pratiquée, sportive ou non [13,28 ,33 , 34]. Une étude chinoise portant sur plus de 3000 enfants de 6 à 14 ans a démontré que l'augmentation de 40 minutes du temps quotidien passé à l'extérieur a un effet protecteur sur l'apparition et la progression de la myopie [35]. De plus chez les enfants qui deviendront myopes, le temps d'exposition à la lumière naturelle est moindre avant même le début de l'élongation axiale [16]. Un effet précoce est possible, puisqu'une étude récente portant sur 1222 enfants a montré que les enfants nés en hiver sont plus myopes que les autres [36]. On observe par ailleurs des variations saisonnières de la progression de la myopie, plus faible durant l'été, ce qui pourrait être lié au plus grand nombre d'heures passées à l'extérieur durant la période ensoleillée. L'exposition à la lumière extérieure participe sans doute également à la fréquence moindre de myopie dans les zones rurales.
L'exposition prolongée aux ordinateurs (> 40 heures par semaine) et aux téléphones portables qui peuvent, souvent plus que les livres, hypnotiser les jeunes enfants durant des heures, est associée à une augmentation de la prévalence de la myopie et à sa progression [37]. Les hypothèses expliquant cette association sont un accroissement important du temps de travail en vision rapprochée, mais aussi une diminution du temps passé à l'extérieur. Le lien entre myopie et résultats scolaires, nombre d'années d'études et niveau de formation peut être expliqué de manière analogue [38].
Une corrélation entre myopie et intelligence est décrite de longue date [39]. Les causes supposées sont multiples et controversées : les développements oculaire et cérébral seraient liés, la myopie étant le reflet d'un surdéveloppement cérébral; la myopie serait secondaire à la quantité accrue de lecture effectuée par les plus intelligents, l'œil myope étant également mieux adapté à la lecture; un gène commun pourrait être responsable de la myopie et de l'intelligence. Mais le lien ne pourrait n'être qu'un artéfact de comportement : l'enfant devient meilleur aux tests d'intelligence en lisant plus, et en passant moins de temps à l'extérieur [40]. Certains auteurs proposent un raisonnement identique pour expliquer le lien entre myopie parentale et risque de myopisation, qui serait la conséquence d'un mode de vie « myopigène » plutôt que de facteurs génétiques, avec là encore plus d'activités en vision rapprochée mais surtout moins d'activités à l'extérieur [41].
Les facteurs comportementaux et environnementaux sont primordiaux dans la régulation de la croissance oculaire post-natale. L'importance des activités en vision rapprochée, mais surtout le temps d'exposition à la lumière naturelle extérieure sont déterminants. Agir sur ces deux facteurs pourrait constituer une prévention importante pour freiner l'épidémie mondiale de myopie. L'augmentation du temps passé à l'extérieur est en particulier une mesure simple pour diminuer l'apparition ou la progression de la myopie. Du point de vue thérapeutique, l'instillation d'atropine 0,01 % paraît être l'intervention la plus sÛre et la plus efficace à long terme.
[1] Ramessur R, Williams KM, Hammond CJ Risk factors for myopia in a discordant monozygotic twin study Ophthalmic Physiol Opt: ( 2015 ) :35: 643-651.
[2] Smith EL Optical treatment strategies to slow myopia progression : effects of the visual extent of the optical treatment zone Exp Eye Res: ( 2013 ) :114: 77-88.
[3] Smith EL, Hung LF, Arumugam B Visual regulation of refractive development : insights from animal studies Eye (Lond): ( 2014 ) :28: 180-188.
[4] Adler D, Millodot M The possible effect of undercorrection on myopic progression in children Clin Exp Optom: ( 2006 ) :89: 315-321.
[5] Chung K, Mohidin N, O'Leary DJ Undercorrection of myopia enhances rather than inhibits myopia progression Vision Res: ( 2002 ) :42: 2555-2559.
[6] Benavente-Pérez A, Nour A, Troilo D Axial eye growth and refractive error development can be modified by exposing the peripheral retina to relative myopic or hyperopic defocus Invest Ophthalmol Vis Sci: ( 2014 ) :55: 6765-6773.
[7] Charman WN, Radhakrishnan H Peripheral refraction and the development of refractive error : a review Ophthalmic Physiol Opt: ( 2010 ) :30: 321-338.
[8] Atchison DA, Li SM, Li H Relative peripheral hyperopia does not predict development and progression of myopia in children Invest Ophthalmol Vis Sci: ( 2015 ) :56: 6162-6170.
[9] Sankaridurg P, Holden B, Smith E Decrease in rate of myopia progression with a contact lens designed to reduce relative peripheral hyperopia : one-year results Invest Ophthalmol Vis Sci: ( 2011 ) :52: 9362-9367.
[10] Hiraoka T, Kakita T, Okamoto F Long-term effect of overnight orthokeratology on axial length elongation in childhood myopia : a 5-year follow-up study Invest Ophthalmol Vis Sci 2: ( 2012 ) :53: 3913-3919.
[11] Lin HJ, Wan L, Tsai FJ Overnight orthokeratology is comparable with atropine in controlling myopia BMC Ophthalmol: ( 2014 ) :14: 40.
[12] Sun Y, Xu F, Zhang T Orthokeratology to control myopia progression : a metaanalysis PLoS One: ( 2015 ) :10: e0124535.
[13] Wu LJ, Wang YX, You QS Risk factors of myopic shift among primary school children in Beijing, China : a prospective study In J Med: ( 2015 ) :12: 633-638.
[14] Huang HM, Chang DS, Wu PC The association between near work activities and myopia in children-a systematic review and meta-analysis PLoS One: ( 2015 ) :10: e0140419.
[15] McBrien NA, Moghaddam HO, Reeder AP Atropine reduces experimental myopia and eye enlargement via a nonaccommodative mechanism Invest Ophthalmol Vis Sci: ( 1993 ) :34: 205-215.
[16] Jones-Jordan LA, Mitchell GL, Cotter SA Visual activity before and after the onset of juvenile myopia Invest Ophthalmol Vis Sci: ( 2011 ) :52: 1841-1850.
[17] Ip JM, Saw SM, Rose KA Role of near work in myopia : findings in a sample of Australian school children Invest Ophthalmol Vis Sci: ( 2008 ) :49: 2903-2910.
[18] Lin Z, Vasudevan B, Jhanji V Near work, outdoor activity, and their association with refractive error Optom Vis Sci: ( 2014 ) :91: 376-382.
[19] Bernsten DA, Sinnott LT, Mutti DO A randomized trial using progressive addition lenses to evaluate theories of myopia progression in children with a high lag of accommodation Invest Ophthalmol Vis Sci: ( 2012 ) :53: 640-649.
[20] Gwiazda J, Hyman L, Hussein M A randomized clinical trial of progressive addition lenses versus single vision lenses on the progression of myopia in children Invest Ophthalmol Vis Sci: ( 2003 ) :44: 1492-1500.
[21] Gwiazda JE, Hyman L, Everett D Five-year results from the correction of myopia evaluation trial (COMET) IOVS: ( 2006 ) ; 47: ARVO E-Abstract 1166.
[22] Marsh-Tootle WL, Dong LM, Hyman L Myopia progression in children wearing spectacles vs. switching to contact lenses Optom Vis Sci: ( 2009 ) :86: 741-747.
[23] Stone RA, Pardue MT, Iuvone PM Pharmacology of myopia and potential role for intrinsic retinal circadian rhythms Exp Eye Res: ( 2013 ) :114: 35-47.
[24] Walline JJ, Lindsley K, Vedula SS Interventions to slow progression of myopia in children Cochrane Database Syst Rev: ( 2011 ) :12: - CD004916.
[25] Chia A, Chua WH, Wen L Atropine for the treatment of childhood myopia : changes after stopping atropine 0,01 % , 0,1 % and 0,5 % Am J Ophthalmol: ( 2014 ) :157: 451-457.
[26] Chia A, Lu QS, Tan D Five-year clinical trial on atropine for the treatment of myopia 2 Ophthalmology: ( 2016 ) :123: 391-399.
[27] Polling JR, Kok RGW, Tiderman JWL Effectiveness study of atropine for progressive myopia in Europeans Eye (Lond): ( 2016 ) :30: 998-1004.
[28] Rose KA, Morgan IG, Ip J Outdoor activity reduces the prevalence of myopia in children Ophthalmology: ( 2008 ) :115: 1279-1285.
[29] Quinn GE, Shin CH, Maguire MG Myopia and ambient lighting at night Nature: ( 1999 ) :399: 113.
[30] Zadnik K, Jones LA, Irvin BC Myopia and ambient night-time lighting Nature: ( 2000 ) :404: 143-144.
[31] Foulds WS, Barathi VA, Luu CD Progressive myopia or hyperopia can be induced in chicks and reversed by manipulation of the chromaticity of ambient light Invest Ophthalmol Vis Sci: ( 2013 ) :54: 8004-8012.
[32] Norton TT, Siegwart JT Light levels, refractive development, and myopia : a speculative review Exp Eye Res: ( 2013 ) :114: 48-57.
[33] French AN, Ashby RS, Morgan IG Time outdoors and the prevention of myopia Exp Eye Res: ( 2013 ) :114: 58-68.
[34] Sherwin JC, Reacher MH, Keogh RH The association between time spent outdoor and myopia in children and adolescents : a systematic review and meta-analysis Ophthalmology: ( 2012 ) :119: 2141-2151.
[35] Jin JX, Hua WJ, Jiang X Effect of outdoor activity on myopia onset and progression in school-aged children in Northeast China : the sujiatun eye care study BMC Ophthalmology: ( 2015 ) :15: 73.
[36] Ma Q, Xu W, Zhou X The relationship of season of birth with refractive error in very young children in eastern china PloS ONE: ( 2014 ) :9: e100472.
[37] Fernandez-Montero A, Olmo-Jimenez JM, Olmo N The impact of computer use in myopia progression : a cohort study in Spain Prev Med: ( 2015 ) :71: 67-71.
[38] Williams KM, Bertelsen G, Cumberland P Increasing prevalence of myopia in europe and the impact of education Ophthalmology: ( 2015 ) :122: 1489-1497.
[39] Rosner M, Belkin M Intelligence, education, and myopia in males Arch Ophthalmol: ( 1987 ) :105: 1508-1511.
[40] Mutti DO, Mitchell GL, Moeschberger ML Parental myopia, near work, school achievement, and children's refractive error Invest Ophthalmol Vis Sci: ( 2002 ) :43: 3633-3640.
[41] Parssinen O, Kauppinen M What is the influence of partents'myopia on their children's myopic progression? A 22-year follow-up study Acta Ophthalmol: ( 2016 ) :94: 579-585.
V. Daien
L'incidence et la prévalence de la myopie ont considérablement augmenté au cours des dernières décennies dans les pays industrialisés. Ce phénomène a été observé en Asie mais également aux États-Unis et en Europe. Ainsi, à Singapour, la prévalence de la myopie est passée respectivement de 26 % , 43 % , 66 % et 83 % entre les années 1970, 1980, 1990 et 2000 [1]. Aux États-Unis, la prévalence chez les adultes âgés de 12 à 54 ans a augmenté de 25 à 41,6 % entre 1971 et 2004, phénomène plus marqué chez les Caucasiens (26,3 à 43 % , respectivement) que chez les Afro-Américains (13 à 33,5 % , respectivement) [2]. En France en 2015, on estimait à 39 % la prévalence de la myopie dans la population, dont 3,4 % de myopies fortes ayant une réfraction inférieure à –6 D et 0,5 % de myopies inférieures à –10 D [3]. Une combinaison de facteurs de risque génétiques et environnementaux (carence en lumière naturelle, hyperaccommodation) serait susceptible d'être à l'origine de cette augmentation d'incidence de la myopie.
L'âge d'apparition de la myopie a une influence directe sur la vitesse de progression, et plus la myopie est forte, plus les facteurs de risque de pathologie oculaire sont nombreux : glaucome, dégénérescence rétinienne, décollement de rétine (DR) et cataracte.
Au regard de cette augmentation d'incidence de la myopie et des potentielles complications, il devient de plus en plus important de pouvoir contrôler la progression de la myopie [4]. Nous détailIons ici les moyens potentiels pour freiner l'évolution de la myopie : augmenter le temps passé à l'extérieur pendant l'enfance, verres de lunette à foyer bifocal ou progressif, lentilles de contact (souples, rigides, multifocales), orthokératologie, collyre à antimuscariniques (atropine et pirenzépine).
L'augmentation du temps passé à l'extérieur dans l'enfance prévient l'incidence de la myopie.
Suites aux études épidémiologiques qui ont mis en évidence le lien entre carence en lumière naturelle et myopie, des essais contrôlés randomisés ont été réalisés : 952 écoliers de 6 ans et demi à l'inclusion qui passaient 40 minutes d'activités à l'extérieur ont été comparés à 951 écoliers qui n'avaient pas ce temps d'activité. Dans le groupe avec activité à l'extérieur, l'incidence cumulée sur 3 ans de la myopie était inférieure au groupe contrôle (30 % versus 39 % , respectivement) [5].
Une correction optique totale versus sous-correction limite l'évolution de la myopie.
En entretenant un flou visuel dont on sait qu'il favorise l'évolution de la myopie chez le primate, une sous-correction myopique augmente la progression de la myopie chez l'homme également. Des patients myopes âgés entre 11 et 33 ans ont été suivis entre 6 et 8 ans et une correction optique totale a été comparée à une sous-correction optique de –0,12, –0,25, –0,37, –0,50 D. Plus la sous-correction était importante, plus la myopie était évolutive : –0,20 dans le groupe correction optique totale versus –0,28, –0,29, –0,30, –0,49 D dans les groupes sous-corrigés, respectivement [6].
Des verres bifocaux prismatiques ou progressifs peuvent freiner l'évolution de la myopie.
Afin de limiter les efforts accommodatifs, des verres bifocaux prismatiques et des verres progressifs ont été essayés chez l'enfant. Une étude randomisée incluant 469 enfants âgés de 6 à 11 ans a retrouvé une plus faible progression de la myopie à 3 ans chez ceux qui portaient des verres progressifs (-1,28 D) versus monofocaux (-1,48 D) [7]. Cette différence de 0,20 D était statistiquement significative, mais elle est cliniquement peu pertinente. Un effet plus important chez les enfants qui avaient une ésophorie et une grande amplitude d'accommodation a été rapporté par les auteurs de cette étude [7]. Dans un autre essai contrôlé randomisé, l'évolution à 3 ans dans le groupe verres monofocaux était de –2,06 D, tandis qu'elle était de –1,25 D dans le groupe verres bifocaux (addition + 1,5 D) et de –1,01 D dans le groupe verres bifocaux prismatiques (addition + 1,5 D associée à un prisme base interne de 3 D) [8].
Le port de lentilles de contact souples ou rigides ne prévient pas l'évolution de la myopie
Une étude contrôlée randomisée n'a pas retrouvé de différence chez les porteurs de lentilles souples versus porteurs de lunettes [9].
Une étude publiée en 2003 n'a pas retrouvé de différence significative sur l'évolution de la myopie du port de lentilles rigides versus lunettes [10]. Une étude ultérieure a suggéré un bénéfice des lentilles rigides sur la progression de la myopie comparativement aux lunettes. Mais le bénéfice portait uniquement sur la kératométrie et pas sur la longueur axiale [11].
Ces lentilles pourraient freiner l'évolution de la myopie.
Des lentilles de contact ont été développées selon deux stratégies optiques pour freiner l'évolution de la myopie : lentilles de contact fabriquées sur le même principe que les verres progressifs avec une zone d'addition progressive; lentilles de contact visant à diminuer l'hypermétropie périphérique induite par la lentille de contact. Une étude incluant 40 enfants âgés de 11 à 14 ans a retrouvé une efficacité de lentilles souples avec une zone centrale corrigeant la myopie associée à des zones de défocus concentriques de 2 D [12]. Des lentilles fabriquées pour réduire l'hypermétropie relative en périphérie ont montré une efficacité comparativement à un groupe contrôle porteur de lentilles souples (–0,26 versus –0,60 D) [13].
L'orthokératologie serait un moyen efficace pour freiner l'évolution de la myopie.
Le rôle optique principal attribué à l'orthokératologie serait soit la diminution de l'hypermétropie relative périphérique, soit la défocalisation périphérique induite par les verres ou les lentilles de contact simple vision. Des études menées chez le primate et chez l'homme suggèrent que cette hypermétropie relative périphérique présente chez les myopes (mais pas chez les emmétropes) favoriserait l'évolution de la myopie. Plusieurs études ont montré un ralentissement de la progression de la myopie avec l'orthokératologie. L'effet de 7 études a été combiné dans une méta-analyse publiée en 2015. Le ralentissement varie de 32 à 100 % sur une période entre 12 et 60 mois; au total, la méta-analyse conclut à une réduction de la progression de myopie de 45 % chez des enfants d'âge scolaire [14]. À noter que dans aucune de ces études n'a été rapporté d'effet secondaire grave à type d'abcès de cornée.
Les agents antimuscariniques (pirenzépine et atropine) en collyre freineraient l'évolution de la myopie efficacement.
L'atropine est un antagoniste muscarinique non spécifique et son mécanisme d'action pour freiner l'évolution de la myopie est encore mal connu. Il pourrait agir par trois mécanismes : en réduisant l'accommodation, en créant une mydriase (qui augmente la quantité de lumière captée par la rétine) ou en inhibant des récepteurs muscariniques présents au niveau rétinien, choroïdien et scléral.
L'efficacité de l'atropine a été confirmée dans une méta-analyse combinant 4 essais contrôlés randomisés et 7 cohortes, regroupant donc 1 850 enfants de 5 à 12 ans avec des myopies de –0,5 à –9,75 D [15].
Dans l'étude ATOM-1 (Atropine in the Treatment of Myopia), 400 enfants de 6 à 12 ans avec une erreur réfractive de –1,0 à –6,0 D ont reçu soit une goutte quotidienne d'atropine 1 % le soir, soit un placebo. À 2 ans, la différence d'évolution entre les deux groupes était de 0,92 D [16].
Dans l'étude ATOM-2, un effet dose a été observé avec une efficacité plus importante à 2 ans pour les groupes recevant de l'atropine à 0,5 % (–0,30 D) versus 0,1 % (–0,38 D) et 0,01 % (–0,49 D) [17]. Cependant, dans ATOM-2, il est rapporté que l'efficacité avec l'atropine 0,01 % reste significative et pour des effets secondaires moindres (photophobie et baisse d'acuité visuelle de près). À l'arrêt de l'atropine, un effet rebond a été observé dans l'étude ATOM-3. Étudier un tel effet est important pour savoir si l'atropine permet uniquement de retarder la myopie ou si l'effet est définitif. Dans une autre étude qui a traité les enfants pendant 2 ans puis a observé les enfants pendant 1 an sans traitement, la progression absolue de myopie à l'évaluation à 3 ans était plus faible dans le groupe initialement traité par atropine [18].
L'atropine à 0,01 % semble être la meilleure option en termes de ratio bénéfice/risque mais n'est, à ce jour, pas commercialisée en France. Des cas de conjonctivites allergiques ont été rapportés avec l'atropine dans les essais contrôlés randomisés [15]. Les effets secondaires au long cours au niveau cérébral et rétinien de l'atropine ne sont pas encore connus. En cas de photophobie et de gêne en vision de près importante, des verres photochromiques progressifs peuvent être prescrits en association avec l'atropine.
La pirenzépine est un antagoniste muscarinique spécifique des récepteurs M1 qui sont moins présents au niveau du corps ciliaire et l'iris que l'atropine. Il est donc responsable de nettement moins d'effets secondaires à type de mydriase, photophobie et gêne en vision de près que l'atropine. Son efficacité a été retrouvée dans deux études contrôlées randomisées menées aux États-Unis [19] et en Asie [20]. La pirenzépine n'est à ce jour pas commercialisée en France.
Les moyens les plus efficaces pour freiner l'évolution de la myopie semblent être les collyres antimuscariniques (atropine et pirenzépine) et l'orthokératologie. L'effet des dispositifs multifocaux (verres de lunettes ou lentilles) semble être plus modeste. Des études sur la sécurité locale et systémique au long cours des collyres antimuscariniques doivent être menées avant de traiter la myopie avec ces agents en pratique clinique. De plus, des études à plus long terme doivent être conduites afin de vérifier si l'effet observé est définitif ou simplement retardé. La plupart des moyens pour freiner l'évolution de la myopie sont à ce jour utilisés « hors autorisation de mise sur le marché » . Une information des bénéfices/risques et un consentement des parents sont donc indispensables avant toute prescription.
[1] Seet B, Wong T Y, Tan DT Myopia in Singapore : taking a public health approach Br J Ophthalmol: ( 2001 ) :85: 521-526.
[2] Vitale S, Sperduto RD, Ferris FL Increased prevalence of myopia in the United States between 1971-1972 and 1999-2004 Arch Ophthalmol: ( 2009 ) :127: 1632-1639.
[3] Matamoros E, Ingrand P, Pelen F Prevalence of myopia in France : a cross-sectional analysis Medicine (Baltimore): ( 2015 ) :94: e1976.
[4] Chassine T, Villain M, Hamel CP, Daien V How can we prevent myopia progression? Eur J Ophthalmol: ( 2015 ) :25: 280-285.
[5] He M, Xiang F, Zeng Y Effect of time spent outdoors at school on the development of myopia among children in China : a randomized clinical trial JAMA: ( 2015 ) :314: 1142-1148.
[6] Vasudevan B, Esposito C, Peterson C Under-correction of human myopia–is it myopigenic? a retrospective analysis of clinical refraction data J Optom: ( 2014 ) :7: 147-152.
[7] Gwiazda J, Hyman L, Hussein M A randomized clinical trial of progressive addition lenses versus single vision lenses on the progression of myopia in children Invest Ophthalmol Vis Sci: ( 2003 ) :44: 1492-1500.
[8] Cheng D, Woo GC, Drobe B, Schmid KL Effect of bifocal and prismatic bifocal spectacles on myopia progression in children : three-year results of a randomized clinical trial JAMA Ophthalmol: ( 2014 ) :132: 258-264.
[9] Walline JJ, Jones LA, Sinnott L A randomized trial of the effect of soft contact lenses on myopia progression in children Invest Ophthalmol Vis Sci: ( 2008 ) :49: 4702-4706.
[10] Katz J, Schein OD, Levy B A randomized trial of rigid gas permeable contact lenses to reduce progression of children's myopia Am J Ophthalmol: ( 2003 ) :136: 82-90.
[11] Walline JJ, Jones LA, Mutti DO, Zadnik K A randomized trial of the effects of rigid contact lenses on myopia progression Arch Ophthalmol: ( 2004 ) :122: 1760-1766.
[12] Anstice NS, Phillips JR Effect of dual-focus soft contact lens wear on axial myopia progression in children Ophthalmology: ( 2011 ) :118: 1152-1161.
[13] Sankaridurg P, Holden B, Smith E Decrease in rate of myopia progression with a contact lens designed to reduce relative peripheral hyperopia : one-year results Invest Ophthalmol Vis Sci: ( 2011 ) :52: 9362-9367.
[14] Sun Y, Xu F, Zhang T Orthokeratology to control myopia progression : a metaanalysis PloS One: ( 2015 ) :10: e0124535.
[15] Li SM, Wu SS, Kang MT Atropine slows myopia progression more in Asian than white children by meta-analysis Optom Vis Sci Off Publ Am Acad Optom: ( 2014 ) :91: 342-350.
[16] Chua WH, Balakrishnan V, Chan YH Atropine for the treatment of childhood myopia Ophthalmology: ( 2006 ) :113: 2285-2291.
[17] Chia A, Chua WH, Cheung YB Atropine for the treatment of childhood myopia : safety and efficacy of 0.5 % , 0.1 % , and 0.01 % doses (Atropine for the Treatment of Myopia 2) Ophthalmology: ( 2012 ) :119: 347-354.
[18] Tong L, Huang XL, Koh ALT Atropine for the treatment of childhood myopia : effect on myopia progression after cessation of atropine Ophthalmology: ( 2009 ) :116: 572-579.
[19] Siatkowski RM, Cotter S, Miller JM Safety and efficacy of 2 % pirenzepine ophthalmic gel in children with myopia : a 1-year, multicenter, double-masked, placebo-controlled parallel study Arch Ophthalmol: ( 2004 ) :122: 1667-1674.
[20] Siatkowski RM, Cotter SA, Crockett RS Two-year multicenter, randomized, double-masked, placebo-controlled, parallel safety and efficacy study of 2 % pirenzepine ophthalmic gel in children with myopia J AAPOS: ( 2008 ) :12: 332-339.
G. Le Meur
Parfois une forte myopie chez un enfant doit faire rechercher des pathologies soit générales, soit ophtalmologiques. Une myopie même chez l'enfant ne s'entend qu'avec la connaissance de la longueur axiale, qu'il faudra, dès que l'âge le permet, mesurer et contrôler régulièrement afin de voir si l'évolution myopique des réfractions est en adéquation avec les variations des longueurs axiales.
Dans les cas de fortes myopies, un interrogatoire minutieux doit être mené à la recherche de signes familiaux d'atteinte rétinienne, d'antécédents familiaux de décès ou de cardiopathie liés à une dissection aortique. L'interrogatoire doit s'attacher à rechercher une altération de la vision nocturne, un trouble du champ visuel périphérique, la présence d'une fente palatine ou labiopalatine, d'une laxité articulaire. Le regard posé sur le patient lorsqu'il rentre dans la salle d'examen doit s'attacher à rechercher des signes de maladie de Marfan, notamment une grande taille.
Quand l'interrogatoire fait suspecter un trouble du collagène, notamment une maladie de Marfan, la myopie décrite est liée notamment à deux éléments : la hausse de la longueur axiale associée à une cornée plate et une subluxation du cristallin [1]. En général, une myopie supérieure à 3 D est décrite. La subluxation du cristallin est retrouvée dans 36,4 à 50,7 % des cas de maladie de Marfan et une myopie supérieure à 3 D est retrouvée chez 38,4 à 62,5 % des patients [1,2]. Lorsqu'une subluxation du cristallin est présente, un astigmatisme important est mis en évidence lors des contrôles. D'ailleurs, la myopie et l'astigmatisme deviennent de plus en plus forts lors de l'aggravation de la subluxation cristallinienne. La recherche de complications rétiniennes secondaires à la subluxation du cristallin par un examen de la rétine périphérique est nécessaire, car elles surviennent dans 10,3 % o des cas [1]. Une consultation en génétique médicale à la recherche des signes de la maladie de Marfan ainsi qu'une consultation cardiologique à la recherche de dilatation de l'aorte seront nécessaires d'autant plus que l'instauration d'un traitement par p-bloquant diminue les risques de mortalité liés aux troubles aortiques [3]. Les critères diagnostiques de la maladie de Marfan sont présentés dans l’encadré 18-1, le tableau 18-1 et la figure 18-1.
Critères de Gand révisés pour le diagnostic du syndrome de Marfan
Sans anamnèse familiale positive pour le syndrome de Marfan
Dilatation de la racine aortique (Z-score ≥ 2,0) ou dissection aortique et (sub)luxation du cristallin = syndrome de Marfan
Dilatation de la racine aortique (Z-score ≥ 2,0) ou dissection aortique et mutation de FBN1 = syndrome de Marfan
Dilatation de la racine aortique (Z-score ≥ 2,0) ou dissection aortique et score systémique ≥ 7 points = syndrome de Marfan
(Sub)luxation du cristallin et mutation de FBN1 avec dilatation de la racine aortique connue ou dissection aortique connue = syndrome de Marfan
(Sub)luxation du cristallin et anamnèse familiale positive pour le syndrome de Marfan = syndrome de Marfan
Score systémique ≥ 7 points et anamnèse familiale positive pour le syndrome de Marfan = syndrome de Marfan*
Dilatation de la racine aortique (Z-score ≥ 2,0 en cas d’âge > 20 ans, Z-score ≥ 3,0 en cas d’âge < 20 ans) ou dissection aortique et anamnèse familiale positive pour le syndrome de Marfan = syndrome de Marfan*
Avec anamnèse familiale positive pour le syndrome de Marfan
Pas de syndrome de Marfan
(Sub)luxation du cristallin avec score systémique ≥ 1 point sans mutation de FBN1 connue provoquant une dilatation de la racine aortique ou une dissection aortique = syndrome d’ectopie du cristallin
Sans dilatation de la racine aortique (Z-score < 2,0), sans dissection aortique et score systémique ≥ 5 points (avec au minimum 1 anomalie squelettique) sans (sub)luxation du cristallin = MASS pour myopia, mitral valve prolapse, aortic root dilatation, striae, skeletal findings (myopie, prolapsus valve mitrale, dilatation racine aorte, vergetures, anomalies squelettiques)
Prolapsus de la valve mitrale sans dilatation de la racine aortique (Z-score < 2,0), sans dissection aortique et score systémique < 5 points sans (sub)luxation du cristallin = syndrome de prolapsus de la valve mitrale
Tableau 18-1 – Score systémique pour le syndrome de Marfan.
D’après : Loeys BL, Dietz HC, Braverman AC, et al. The revised Ghent nosology for Marfan syndrome. J Med Genet 2010 ; 47 : 476-85.
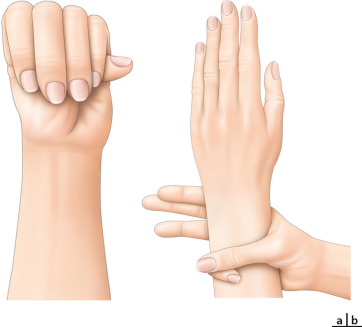
Fig. 18-1 Signes du pouce et du poignet.
a. Signe du pouce : la phalange distale du pouce dépasse clairement le bord de la main. b. Signe du poignet : le petit doigt recouvre la phalange distale du pouce lorsque le poignet est enserré.
Les autres anomalies du tissu collagène comme la maladie de Stickler sont plus difficiles à mettre en évidence par l'interrogatoire. La présence d'une fente palatine ou labiopalatine, d'une luette bifide ou d'un rétrognatisme, lors de l'interrogatoire en cas de forte myopie, doit inciter à se méfier d'un syndrome de Pierre-Robin où un syndrome de Stickler peut être présent dans 38 % des cas [4]. Dans ce contexte, les myopies sont d'emblée très fortes même à un plus jeune âge (moyenne –12,39± 2,72 D [4]) pouvant passer à tort pour un glaucome congénital devant des mégalocornées chez un enfant en bas âge. Au niveau ophtalmologique, des voiles vitréens, des cordages vitréens, des lésions palissadiques périphériques et des zones d'atrophies choriorétiniennes sont à rechercher. Au niveau général, une atteinte osseuse avec une dysplasie spondylo-épiphysaire, une scoliose et une cyphose, une hyperlaxité qui conduit à une arthrose précoce ainsi qu'une surdité de perception peuvent être présents [5]. Dans le cas d'un syndrome de Kniest, qui est un diagnostic différentiel du syndrome de Stickler, un tronc et des membres courts, des articulations proéminentes et une hypoplasie médio-faciale sont associés. Chez une femme enceinte avec myopie forte, l'échographiste doit s'attacher à rechercher des signes de fente palatine, de micrognathie ou rétrognathie [6]. Une consultation auprès d'un généticien permet de réaliser le diagnostic.
Quand l'interrogatoire retrouve une héméralopie ou une altération périphérique du champ visuel, une pathologie rétinienne peut être suspectée. Dans le cas d'une rétinopathie pigmentaire liée à X, pathologie retrouvée chez les garçons, une myopie d'environ –5,5 D en équivalent sphérique est décrite dans 95 % des cas [7], la myopie étant parfois le signe le plus précoce [8]. Dans ce cas, des dépôts pigmentaires à type d'ostéoblastes sont rapidement visibles lors de l'examen périphérique de la rétine et une atteinte centrale rétinienne peut survenir dès l'âge de 10 ans [9]. L'électrorétinogramme retrouve une atteinte sévère des fonctions scotopiques et photopiques. Il a également été décrit la présence de myopie lors de certaines mutations notamment du gène en cas de dystrophie rétinienne héréditaire de type autosomique récessive [10]. Cette altération de la vision nocturne associée à une myopie est également décrite dans la cécité congénitale nocturne (congenital stationary night blindness [CSNB]) [11]. Dans ce cas, elle est associée à un nystagmus, un strabisme, des anomalies rétiniennes [11]. Un électrorétinogramme électronégatif est alors présent dans une partie des cas [12].
L'enfant est majoritairement hypermétrope dans l'enfance; la présence d'une myopie importante dès le plus jeune âge est à surveiller, car elle signe les prémices d'une atteinte qui pourrait s'avérer plus générale.
[1] Drolsum L, Rand-Hendriksen S, Paus B Ocular findings in 87 adults with Ghent-1 verified Marfan syndrome Acta Ophthalmol (Copenh): ( 2015 ) :93: 46-53.
[2] Latasiewicz M, Fontecilla C, Millá E, Sánchez A Marfan syndrome : ocular findings and novel mutations-in pursuit of genotype-phenotype associations Can J Ophthalmol: ( 2016 ) :51: 113-118.
[3] Attenhofer Jost CH, Greutmann M, Connolly HM Medical treatment of aortic aneurysms in Marfan syndrome and other heritable conditions Curr Cardiol Rev: ( 2014 ) :10: 161-171.
[4] Huang F, Kuo HK, Hsieh CH Visual complications of Stickler syndrome in paediatric patients with Robin sequence J Craniomaxillofac Surg: ( 2007 ) :35: 76-80.
[5] Snead MP, McNinch AM, Poulson AV Stickler syndrome, ocular-only variants and a key diagnostic role for the ophthalmologist Eye: ( 2011 ) :25: 1389-1400.
[6] Kaufman MG, Cassady CI, Hyman CH Prenatal identification of Pierre Robin sequence : a review of the literature and look towards the future Fetal Diagn Ther: ( 2016 ) :39: 81-89.
[7] Sieving PA, Fishman GA Refractive errors of retinitis pigmentosa patients Br J Ophthalmol: ( 1978 ) :62: 163-167.
[8] Kaplan J, Pelet A, Martin C Phenotype-genotype correlations in X linked retinitis pigmentosa J Med Genet: ( 1992 ) :29: 615-623.
[9] Jayasundera T, Branham KEH, Othman M RP2 phenotype and pathogenetic correlations in X-linked retinitis pigmentosa Arch Ophthalmol: ( 2010 ) :128: 915-923.
[10] Chassine T, Bocquet B, Daien V Autosomal recessive retinitis pigmentosa with RP1 mutations is associated with myopia Br J Ophthalmol: ( 2015 ) :99: 1360-1365.
[11] Zeitz C, Robson AG, Audo I Congenital stationary night blindness : an analysis and update of genotype-phenotype correlations and pathogenic mechanisms Prog Retin Eye Res: ( 2015 ) :45: 58-110.
[12] Lachapelle P, Little JM, Polomeno RC The photopic electroretinogram in congenital stationary night blindness with myopia Invest Ophthalmol Vis Sci: ( 1983 ) :24: 442-450.
D. Thouvenin
Nous prendrons comme définition de l'hypermétropie forte (HMF), une hypermétropie supérieure ou égale à 7 D en résultat équivalent sphérique de la skiascopie faite sous cycloplégie. Lorsque l'HMF dépasse 10 D, on parle alors de microphtalmie. La longueur axiale de l'œil est par définition inférieure d'au moins 2 DS à celle de la même classe d'âge, en dessous de 20,5 mm à l'âge adulte. Les HMF semblent liées à un arrêt précoce de la croissance oculaire, parfois associée à des malformations oculaires, et toujours avec une enveloppe cornéo-sclérale épaisse et peuvent s'intégrer dans des pathologies dysgénétiques diverses.
L'entité des HMF inclut [1] :
- – des HMF avec réduction harmonieuse de tous les paramètres biométriques de l'œil ou nanophtalmies. Outre les complications communes aux microphtalmies, elles exposent au risque de glaucome par fermeture de l'angle (GFA), d'autant plus que l'œil est petit;
- – des HMF en relation avec une réduction non harmonieuse des paramètres biométriques, notamment aux dépens du segment postérieur (microphtalmies postérieures). Les patients ne sont pas exposés au risque de GFA;
- – des HMF sur œil « pathologique » en raison d'association syndromique à d'autres anomalies oculaires que nous ne traiterons pas ici : persistance de la vascularisation fœtale, colobomes, séquelles d'embryofœtopathies notamment.
Le pronostic visuel dépend de la précocité de la mise en place de la correction optique qui limite la profondeur de l'amblyopie bilatérale, et d'éventuels traitements de l'amblyopie dans les aniso-hypermétropies ou formes unilatérales. Mais bien sÛr, à long terme, il dépend des anomalies associées et complications évolutives fréquentes dont les plis rétiniens, l'association à une rétinite pigmentaire et le risque de GFA.
Si près de la moitié des Européens présentent une amétropie, la fréquence de l'HMF est rarement décrite dans les études épidémiologiques. La prévalence se situe entre 1 et 2 % dans une population européenne, mais peut être plus importante en fonction du taux de consanguinité.
L'origine génétique des microphtalmies semble certaine. Une consanguinité ou au moins une transmission autosomique récessive est retrouvée fréquemment devant l'atteinte de plusieurs enfants, voire jumeaux sur une seule génération. Quelques cas de transmission autosomique dominante ou liée à l'X ont été décrits et, en l'absence d'hérédité évidente, une mutation de novo ou un cas sporadique sont évoqués.
Des études récentes mettent en cause différents gènes, dont une mutation du gène de la MFRP (membrane-type frizzled-related protein) [2], du gène CRB1 [3], des gènes PRSS56 situés en 2q37.1 [4] et du gène TMEM98.
L'HMF est le plus souvent bilatérale, parfois asymétrique, rarement unilatérale. Les formes avec anisométropie de plus de 3 D exposent fortement à une amblyopie unilatérale, dont le traitement répond aux règles habituelles de traitement des amblyopies mixtes. Le résultat du traitement dépend, outre de la qualité et de l'observance au traitement, de l'absence de lésions oculaires associées.
Lors de la découverte de l'HMF, l'acuité visuelle sans correction est toujours basse, car le potentiel accommodatif des yeux est dépassé dans la vie courante. Contrairement au jeune myope fort qui garde un potentiel visuel en vision de près, le jeune HMF non équipé a une vision brouillée permanente et s'isole progressivement, d'où le caractère « rêveur » fréquemment rapporté. Il n'est pas rare de découvrir une HMF chez un enfant en cours de bilan de comportement autistique. L'effort accommodatif, quand il est réalisé, est responsable au mieux d'une asthénopie importante, voire d'un strabisme convergent accommodatif pur ou non. Le port de la correction optique de l'amétropie transforme souvent le comportement de l'enfant. La correction totale de l'amétropie est nécessaire afin d'éviter l'apparition ou l'aggravation d'un strabisme chez ces enfants à la vision binoculaire fragile. Elle est quasiment toujours bien supportée et réclamée, paradoxalement mieux que chez certains enfants myopes.
Malgré la correction optique, et même en l'absence de lésions rétiniennes, il existe fréquemment une amblyopie bilatérale inférieure à 5/10. Elle peut s'améliorer progressivement avec le port de la correction optique si des lésions rétiniennes ne sont pas associées. L'utilisation de pénalisations optiques alternées en cas de strabisme associé peut aider cette amélioration et éviter une asymétrie visuelle. Si malgré tout l'acuité stagne, il faudra compléter le bilan organique oculaire (voir plus loin).
Un enfant avec HMF gardera une fragilité oculaire pour toute sa vie et une surveillance devra être réalisée pour prévenir ou traiter les complications éventuelles, quand ce sera possible.
L'équipement optique est réalisé en lunettes le plus souvent, malgré l'épaisseur des verres. Un équipement en lentilles de contact est possible dès que l'enfant et la famille le demandent. L'HMF dépasse les possibilités de la chirurgie réfractive cornéenne actuelle. L'emmétropisation lors de la chirurgie de la cataracte est compliquée par la puissance élevée des implants nécessaires. Parfois une double implantation piggy-back est proposée. La chirurgie de ces petits yeux est de toute façon risquée et compliquée. Elle expose à des complications (prolapsus irien, hématome choroïdien notamment) et le risque de GFA, voire de glaucome malin doit toujours rester à l'esprit.
Quand une malvoyance est associée, soit en raison d'une pathologie rétinienne ou simplement liée à l'amblyopie fonctionnelle bilatérale, une prise en charge adaptée est nécessaire, tant chez l'enfant que l'adulte.
Lors de la découverte d'une HMF, il est conseillé de réaliser un bilan oculaire plus complet que dans des amétropies simples en raison des risques d'association pathologique. Les examens réalisés dépendent du contexte et de l'âge de l'enfant.
- – Acuité visuelle mono-, binoculaire, en vision de loin et de près.
- – Présence d'un strabisme, d'un nystagmus, potentiel de vision stéréoscopique.
Tous les cycloplégiques sont utilisables. Il faut répéter cet examen les premières années, car on ne trouve que rarement la valeur totale de l'hypermétropie lors de la première skiascopie. Le risque de provoquer une crise de GFA par dilatation pupillaire diagnostique est exceptionnel chez l'enfant, même en cas d'étroitesse de la chambre antérieure, sauf cas extrême ou polymalformatif. Il faut simplement prévenir prudemment la famille de consulter si la mydriase ne disparaît pas rapidement ou en cas de signes évocateurs. Les hypermétropies décrites dans les séries publiées sur la microphtalmie vont de + 7 à plus de + 22, en moyenne + 12. Comme pour la myopie, plus l'hypermétropie est forte, plus le pronostic visuel est réservé et le taux de complications élevé.
Chez l'enfant, un examen sous anesthésie générale brève peut être nécessaire pour détailler en cas d'anomalie ou d'examen vraiment difficile :
- – le segment antérieur (SA) : on examine le diamètre cornéen, la présence d'une dysgénésie du SA ou d'une cataracte, la profondeur de la chambre antérieure. L'aspect du SA permet de différencier les nanophtalmies des microphtalmies postérieures, avec leurs spécificités;
- – la tension oculaire : elle est prise avec un outil adapté à l'enfant (Icare par exemple) ou à l'aplanation;
- – le segment postérieur (SP) en examinant :
- –la papille (fig. 18-2) : de petite taille, parfois bombée et chargée ;
- –la vascularisation : la zone avasculaire centrale est toujours réduite, parfois absente ;
- –la macula : présentant parfois des amas pigmentaires jaunâtres ou toute autre anomalie ;
- –le reflet fovéolaire : parfois absent, faisant suspecter une hypoplasie maculaire ;
- –la rétine : plis rétiniens papillomaculaires, rétinite pigmentaire, colobome, rétinoschisis, effusion uvéale, DR non rhegmatogène. Bien sûr, les rétinophotographies permettent dès qu’elles sont possibles de suivre l’évolution de lésions.
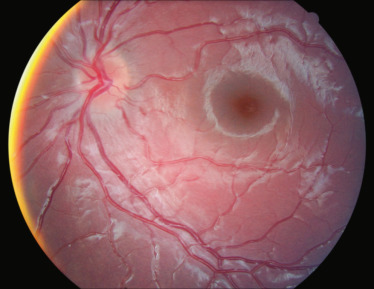
Fig. 18-2 Aspect typique de papille d'HMF.
Un bilan complémentaire est réalisé à un moment ou un autre de l'évolution, plus ou moins complet et fonction de l'état visuel, de l'évolution visuelle, des complications évolutives.
Le bilan biométrique doit être systématique au cours de la surveillance et vise à différencier les nanophtalmies des microphtalmies postérieures en raison des risques réels pour les premiers de développer un GFA à l'âge adulte (voir plus loin) :
- – kératométrie : la cornée est très bombée, surtout dans les nanophtalmies, le plus souvent supérieure à 46 D (normal 43-44 D);
- – diamètre cornéen inférieur à 11 mètres dans les nanophtalmies, normal dans les microphtalmies postérieures;
- – pachymétrie élevée;
- – biométrie avec évaluation de la profondeur de la chambre antérieure, du cristallin et du SP : réduction harmonieuse de tous les paramètres dans la nanophtalmie, réduction uniquement du SP dans la microphtalmie postérieure.
L'échographie en mode B montre bien la réduction harmonieuse ou aux dépens du SP du volume oculaire et toujours une épaisseur sclérale augmentée. Elle peut objectiver une effusion uvéale ou un DR peu soulevé. L'échographie haute fréquence (ultrasound biomicroscopy [UBM]) du SA permet d'analyser l'aspect des procès ciliaires et l'état de l'angle iridocornéen chez le grand enfant et l'adulte.
Dès qu'il est réalisable, éventuellement couplé à l'angiographie, c'est un examen diagnostique important, permettant de dépister une hypoplasie maculaire, et de faire le diagnostic des plis rétiniens. Les plis rétiniens sont uniquement constitués de neurorétine et laissent indemnes sclère, choroïde et épithélium pigmentaire (fig. 18-3)[5].
L'étude de la papille montre son étroitesse avec forte concentration des fibres optiques en raison d'un canal scléral étroit et des valeurs élevées de la retinal nerve fiber layer (RNFL), et un aspect bombant dans le SP.
En général, le champ visuel est plus étroit que la norme. Mais on peut bien sÛr retrouver des anomalies en relation avec une éventuelle rétinite pigmentaire ou un glaucome ou toute lésion rétinienne.
Sans être systématique, la réalisation de l'électrorétinographie (ERG) couplée aux potentiels évoqués visuels (PEV) est proposée dès qu'il existe une amblyopie bilatérale, une baisse visuelle ou des signes évocateurs d'atteinte de la rétine ou des voies optiques (photophobie, héméralopie, aspect du fond d'œil, autres). Elle permettra d'objectiver une dégénérescence tapéto-rétinienne associée à l'HMF.
Une IRM n'est ni systématique, ni nécessaire dans les cas simples. Il faut toutefois y avoir recours au moindre doute sur l'aspect papillaire, pour éliminer une cause d'hypertension intracrânienne. Toutefois, le plus souvent, la corrélation entre l'aspect assez typique de la papille d'hypermétrope, l'hypermétropie forte, l'absence de signes évocateurs d'hypertension intracrânienne évite cet examen. À noter qu'un aspect évocateur de drusen papillaire doit plutôt faire réaliser une tomodensitométrie (TDM) avec coupes sur la papille, qui permet d'en faire le diagnostic.
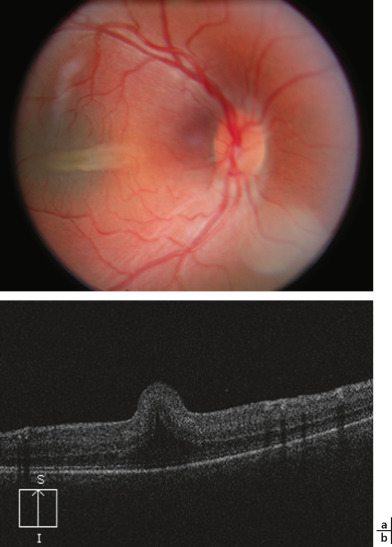
Fig. 18-3 Plis rétiniens papillomaculaires dans une microphtalmie postérieure (a). En OCT (b), on note qu’il n’intéresse que la neurorétine. Épithélium pigmentaire, choroïde et sclère sont indemnes.
Les caractères anatomiques communs sont les suivants :
–skiascopie > 7 D ;
–longueur axiale < 20,5 mm et toujours en dessous de 2 DS
pour l’âge ;
–sclère épaisse en échographie B ;
–association possible à des rétinites pigmentaires, anomalies
rétiniennes malformatives diverses : plis rétiniens papillomaculaires,
hypoplasie maculaire, kystes rétiniens, dépôts maculaires,
rétinoschisis, DR exsudatif et effusion uvéale liée à une gêne au
retour veineux vortiqueux au travers de cette sclère épaisse [6] ;
–possibilité de papille bombant dans le vitré, à différencier
d’un oedème papillaire.
Le pronostic visuel est généralement lié à l’importance de l’hypermétropie, à la précocité de l’équipement optique et aux lésions associées.
Outre les caractères communs aux HMF, la nanophtalmie est définie comme une réduction globale et harmonieuse de tous les paramètres biométriques oculaires. Le diamètre cornéen horizontal est inférieur à 11 mm. Le diagnostic est souvent précoce devant l’aspect de petits yeux en général énophtalmes. La biométrie retrouve une chambre antérieure étroite et un cristallin anormalement volumineux. Il existe une exposition au GFA à l’âge adulte (rarement décrite chez l’enfant [7]). Plus que dans les autres HMF, le pronostic est réservé en raison du risque fréquent de complications sur le SA, notamment de GFA, d’autant plus que l’oeil est petit.
La microphtalmie postérieure a été décrite [8] devant des yeux présentant une HMF avec un SA d’aspect normal sans réduction du diamètre cornéen (> 11 mm), mais avec et une brièveté anormale du SP. Le problème est surtout de le reconnaître, car l’aspect externe de l’oeil est normal. Le diagnostic est souvent tardif, devant des signes de malvoyance à l’âge scolaire. Les plis rétiniens semblent plus fréquents (25 % ). Le pronostic visuel est surtout lié aux anomalies rétiniennes associées. La normalité de la chambre antérieure n’expose pas au GFA.
[1] Relhan N, et al. High-hyperopia database, part 1 : clinical characterisation including morphometric (biometric) differenciation of posterior microphtalmos from nanophtalmos.Eye 2016 ; 30 : 120-6.
[2] Matsushita I, Kondo H, Tawara A. Novel compound heterozygous mutations in the MFRP gene in a Japanese patient with posterior microphthalmos Jpn J Ophthalmol 2012 ; 56 : 396-400.
[3] Paun CC, Pijl BJ, Siemiatkowska AM, et al. A novel crumbs homolog 1 mutation in a family with retinitis pigmentosa, nanophthalmos, and optic disc drusen. Mol Vis 2012 ; 18 : 2447-53.
[4] Gal A, Rau I, El Matri L, et al. Autosomal-recessive posterior microphthalmos is caused by mutations in PRSS56, a gene encoding a trypsin-like serine protease. Am J Hum Genet 2011 ; 88 : 382-90.
[5] Xerri O, Orssaud C, Kaluszyner M, et al. Bilateral retinal folds and familial high hyperopia : a case report. J Fr Ophtalmol 2013 ; 36 : e177-9.
[6] Bec P, Arne JL, Aubry JP. Uveal effusion, microphthalmos and severe hypermetropia. Mod Probl Ophthalmol 1979 ; 20 : 42-7.
[7] Ritch R, Chang BM, Liebmann JM. Angle closure in youger patients. Ophthalmology 2003 ; 110 : 1880-9.
[8] Boynton JR, Purnell EW. Bilateral microphthalmos without microcornea associated with unusual papillomacular retinal folds and high hyperopia. Am J Ophthalmol 1975 ; 79 : 820-6.
D. Benaim, M. Muraine
L’astigmatisme (du grec, a- privatif et -stigma « point » ) est un défaut optique qui donne d’un point une image non ponctuelle. Le système optique que constitue l’oeil s’apparente alors à une lentille torique définie par la puissance (ou le rayon de courbure) des deux principaux méridiens qui la composent. Il est régulier lorsqu’il peut être corrigé par des verres cylindriques usuels ; dans le cas inverse, il est dit irrégulier. On distingue l’astigmatisme direct ou conforme à la règle (with-the-rule [WTR]), dont l’axe du méridien le plus courbe est vertica, de l’astigmatisme inverse ou non conforme à la règle (against-the-rule [ATR]) dont l’axe du méridien le plus courbe est horizontal. Si les images formées au travers des deux méridiens principaux ne sont pas focalisées sur la rétine et se situent du même côté (en avant ou en arrière), on parle d’astigmatisme composé. Il sera simple si l’un des méridiens donne une image focalisée sur la rétine. Si les focales images se trouvent de part et d’autre de la rétine, on emploiera le terme d’astigmatisme mixte.
Il n’existe pas de consensus sur le seuil de l’astigmatisme fort ; arbitrairement nous retiendrons la limite de 3 D qui semble la plus rapportée [1,2]. Celui-ci peut alors être régulier, conforme à la règle ou non, ou irrégulier. Dans le premier cas, l’astigmatisme est le plus souvent physiologique, alors que dans le second, il est en général la conséquence d’un phénomène pathologique causal (kératocône, séquelle d’ulcère, traumatisme, etc.).
Les astigmatismes cornéen et interne peuvent être associés de différentes manières : astigmatisme cornéen antérieur pur, astigmatisme interne pur, astigmatisme composé (cornéen antérieur et interne), réfraction sphérique (par astigmatisme composé et neutralisé).
L’astigmatisme est principalement d’origine cornéenne chez les enfants. Un astigmatisme supérieur à 1 D est retrouvé chez près de 70 % des enfants à la naissance et décroît jusqu’à l’âge de 4 ans [3] pour ne concerner que 10 % d’entre eux. Il semble qu’une relation existe entre l’importance de l’astigmatisme cornéen à la naissance et la prématurité ; en effet, un terme précoce et un faible poids de naissance sont associés à un astigmatisme plus fort à la naissance [4].
L’étude de la topographie cornéenne dans un groupe de 200 nouveau-nés [5], avec un suivi de 6 mois, retrouve des courbures importantes, avec une puissance cornéenne centrale forte (48,5 D) et un astigmatisme central fort (en moyenne 6 D) majoritairement direct pour 80 % d’entre eux. L’évolution à 6 mois montre un aplatissement cornéen avec une diminution de la puissance cornéenne centrale (43 D) et de l’astigmatisme (2,3 D). Le mode d’accouchement a un impact significatif sur l’axe de l’astigmatisme qui est plus fréquemment retrouvé comme direct lorsque la délivrance se fait par voie basse plutôt que par césarienne ; ces données attestent d’une implication certaine des pressions exercées autour de l’orbite sur sa réfraction.
Concernant l’axe de l’astigmatisme, certaines études sont contradictoires, mais il semble qu’un astigmatisme fort non conforme à la règle soit prédominant à la naissance et régresse sous la forme d’un astigmatisme moins fort et conforme à la règle jusqu’à l’âge de 4 ans. Ces données sont appuyées par une étude australienne réalisée sur près de 2000 enfants de 6 ans qui décrit un astigmatisme supérieur à 1 D chez seulement 4,8 % enfants, conforme à la règle pour près des trois quarts d’entre eux (fig. 18-4) [6].
Chez l’adulte jeune (< 40 ans), l’astigmatisme supérieur à 1,5 D est retrouvé dans le même ordre de grandeur que chez les jeunes enfants (environ 5 % [7]) – c’est-à-dire très minoritairement –, et principalement conforme à la règle. Au-delà de 40 ans, se produit une majoration de l’astigmatisme avec une augmentation de la proportion d’astigmates non conformes à la règle [8].
L’interaction des paupières avec la surface oculaire semble être un facteur d’influence prépondérant sur l’astigmatisme de l’enfant. Grosvenor [9] le suggère à la fin des années 1970 : la modification de la rigidité palpébrale serait corrélée à l’évolution de l’astigmatisme en fonction de l’âge. Un astigmatisme direct dans les jeunes années laisse sa place à un astigmatisme plutôt inverse dans les âges plus avancés où les paupières sont moins rigides et exercent une pression moins forte sur la surface oculaire, imposant une courbure moins prononcée sur le méridien vertical (fig. 18-5).
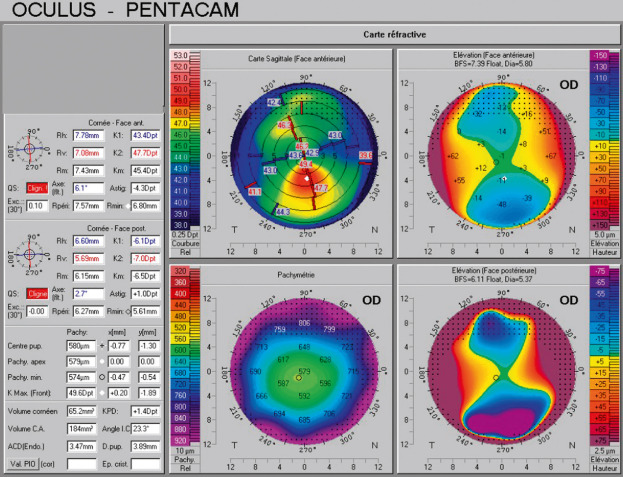
Fig. 18-4 Astigmatisme fort régulier et asymétrique physiologique direct de 4 D chez un enfant de 7 ans. Analyse par caméra de Scheimpflug (Pentacam, Oculus).
La mesure de l’astigmatisme n’est pas toujours facile chez les tout jeunes enfants. Avant 5 ans, il est très difficile de mesurer la kératométrie à l’aide d’un kératomètre automatique standard, de l’ophtalmomètre de Javal ou des topographies de type Placido ou par caméra de Scheimpflug.
Les progrès technologiques ont rendu aujourd’hui cet examen beaucoup plus facile, car la skiascopie, relativement difficile à réaliser est désormais remplacée par des réfractomètres automatiques portables adaptés aux tout petits enfants.
Pour rappel, la skiascopie permet une analyse de la réfraction totale de l’oeil : de la surface de la cornée à la rétine. Des rayons lumineux sont projetés sur la rétine et l’analyse de leur image réfléchie par celle-ci permet d’en déduire la réfraction de l’oeil. L’examinateur, placé en face du patient, observe le faisceau projeté par le skiascope, ainsi que la lueur qui se forme sur la rétine. On interpose des verres correcteurs jusqu’à obtenir une lueur diffuse sur la rétine, « l’ombre de masse » , correspondant à l’emmétropisation dans l’axe du faisceau. On reproduit le même procédé dans l’axe orthogonal pour en déterminer sa puissance. La réfractométrie automatique moderne, très répandue de nos jours, utilise un procédé similaire avec des rayons infrarouges, invisibles par l’oeil humain, limitant ainsi l’accommodation sur les rayons projetés.
Les réfractomètres automatiques actuels ont étés développés en format portatif permettant l’évaluation des paramètres réfractifs chez les plus jeunes. À titre d’exemple, le SureSight® et le Spot™ Vision Screener de Welch Allyn (États-Unis), et le Rétinomax K® de Luneau (France) ont déjà démontré de bonnes caractéristiques de performance pour la détection de l’astigmatisme chez l’enfant [10], en l’absence de cyclopégie.
Bien que les autoréfractomètres portables sous-estiment l’hypermétropie en l’absence de cycloplégie, ils semblent adaptés à la détection des astigmatismes forts chez l’enfant, même en l’absence de cycloplégie, probablement car l’astigmatisme est essentiellement d’origine cornéenne et donc non soumis aux phénomènes accommodatifs (fig. 18-6) [11].
Le Rétinomax® offre la possibilité d’une mesure rapide avec « auto quick mode » mais à une distance de quelques centimètres de l’oeil examiné ; d’ailleurs, l’examen se réalise oeil par oeil. Le Spot™ Vision Screener offre la possibilité d’effectuer les mesures à distance (1 mètre) des deux yeux simultanément avec un temps d’acquisition de 1 seconde. L’appareil n’étant pas à proximité de l’oeil, l’effet d’accommodation réflexe s’en trouve réduit mais ne dispense pas de la réalisation d’un examen sous cycloplégie.
L’astigmatisme total chez l’enfant est principalement d’origine cornéenne ; il est donc peu modifié par la cycloplégie, mais il est capital de bien identifier l’amétropie sphérique associée. Elle peut être réalisée par cyclopentolate dès l’âge de 1 an en l’absence de contre-indication (principalement comitialité).
L’usage de ces dispositifs nécessite une installation confortable du patient, qui doit être décontracté. Les pleurs peuvent modifier les valeurs mesurées par la formation d’un lac lacrymal ou la pression exercée par les paupières contractées sur la surface oculaire. De même, l’examinateur doit pouvoir maintenir l’appareil de manière stable, dans l’axe du visage. Des indicateurs d’alignement sont présents dans les modèles sus-cités. Une mauvaise position de l’appareil par rapport à l’oeil est une source d’erreur fréquente sur la mesure de l’astigmatisme.
La topographie cornéenne dérivée du disque de Placido ou d’élévation numérisée permet une étude fine de la réfraction de la cornée, mais ne peut se concevoir que lorsque la compliance de l’enfant le permet, à partir de l’âge de 6 à 7 ans. En effet, le patient doit s’asseoir devant l’appareil et positionner sa tête de manière stable sur les appuis frontaux et mentonniers (fig. 18-7).

Fig. 18-6 Autoréfractomètres portables adaptés pour les mesures chez l’enfant en bas âge.
a. Spot™ Vision Screener (Welch Allyn, États-Unis). b. Rétinomax K® (Luneau, France).
Fig. 18-7 Topographie d'élévation chez un enfant très compliant de 6 ans.
L’astigmatisme de l’enfant est très évolutif jusqu’à l’âge de 4 à 5 ans. En cas de correction optique, il devra être régulièrement réévalué pour être sûr de la correction correcte et de son éventuelle évolutivité. L’inconfort visuel ne fait en général pas l’objet d’une plainte par le patient, car le flou auquel il est assujetti est aussi important de près que de loin ; il n’a de moyen de comparaison que s’il existe un aniso-astigmatisme significatif, avec l’oeil controlatéral. À ce titre l’aniso-astigmatisme supérieur à 1 D est amblyogène [12] et justifie sa correction totale.
Si la règle est la correction totale de l’astigmatisme, une souscorrection peut parfois être envisagée pour améliorer la tolérance et l’observance du port de lunettes. Il n’existe pas de valeur plafond pour une correction initiale dont la tolérance dépendra notamment de l’âge, de la compliance et de l’amétropie sphériquesous-jacente. L’astigmatisme irrégulier doit être corrigé de manière privilégiée par lentilles de contact rigides.
On utilise des verres cylindriques pour corriger l’astigmatisme régulier. L’axe du cylindre est perpendiculaire à l’axe du méridien qui subit la correction. La correction d’un astigmatisme supérieur à 3 D est très mal supportée chez l’adulte, mais elle l’est bien mieux chez l’enfant. Cependant, il faut privilégier le confort du patient et il est d’usage de débuter par une correction plus faible que celle retrouvée. L’acuité visuelle doit être systématiquement réévaluée à distance de la prescription de verres correcteurs pour s’assurer de sa bonne tolérance, observance et de la maturation du cortex visuel. On privilégiera une monture en plastique, bien ajustée et stable, qui recouvre l’arcade sourcilière. L’utilisation d’une correction cylindrique impose que l’axe soit constant et fiable par rapport à l’oeil ; toute modification pourrait altérer grandement l’acuité visuelle et rendre les lunettes inconfortables.
Les lentilles corrigent l’astigmatisme en modifiant la puissance réfractive cylindrique des paramètres suivants : face antérieure et/ ou face postérieure de la lentille pour les lentilles souples et film lacrymal interposé entre la face postérieure de la lentille et la face antérieure de la cornée pour les lentilles rigides. L’adaptation en lentilles d’un enfant astigmate devra être régulièrement contrôlée, car l’astigmatisme est très évolutif avant 5 ans. Cette adaptation soulève deux principales problématiques que sont la stabilité de la lentille sur une surface torique et la correction de cet astigmatisme. La correction par lentilles de contact trouve son indication dans les astigmatismes d’origine cornéenne pure principalement. L’utilisation de lentilles rigides perméables aux gaz sphériques permet d’améliorer l’acuité visuelle versus le port de lunettes [13]. La correction du cylindre est constante car elle fait intervenir la puissance réfractive du ménisque de larmes interposé entre la face postérieure de la lentille sphérique et la face antérieure de la cornée torique ; la rotation de la lentille n’a donc aucune conséquence. Cette puissance réfractive du ménisque de larmes interposé sera particulièrement intéressante et sera la seule solution en cas d’astigmatisme irrégulier. Audelà d’un astigmatisme cornéen de 2 D, on demandera une lentille rigide torique postérieure afin d’améliorer sa stabilité sur l’oeil. A contrario, des lentilles, rigides ou souples, toriques antérieures sont à éviter car elles donnent une acuité visuelle fluctuante, elles ne serviront que lorsqu’il existe un astigmatisme interne résiduel.
L’indication varie en fonction de l’âge mais doit être « envisagée de manière systématique devant toute amblyopie dont la rééducation stagne malgré le port constant d’une correction optique adaptée et/ou d’une occlusion bien conduite en cas d’atteinte unilatérale » [14]. La participation de l’environnement de l’enfant est indispensable au succès de l’adaptation en lentille ; le praticien doit en tenir compte. Retenons que les parents doivent assurer la manipulation et l’entretien des lentilles et que le port permanent de lentilles souples est à proscrire en raison des risques infectieux.
Jusqu’à l’âge de 2 ans, l’indication est exceptionnelle. En première intention, on propose une adaptation par lentille rigide perméable au gaz permettant d’assurer une correction totale et autorisant le port permanent. Une lentille hybride (centre rigide, jupe souple) peut être essayée si le confort des lentilles rigides est insuffisant.
Si la tolérance reste mauvaise, la combinaison d’une correction sphérique par lentille souple sphérique et l’adjonction de verres correcteurs cylindriques est une bonne alternative en cas d’astigmatisme régulier. Si la correction le permet, une lentille jetable journalière est alors une solution de choix.
L’orthokératologie, grâce à des lentilles de remodelage cornéen torique, a déjà fait la preuve de son efficacité dans la correction d’astigmatisme modéré (jusqu’à 4 D) associé à une myopie allant jusqu’à –7 D chez l’adolescent [15, 16].
Cependant, elle n’a pas fait la preuve de son intérêt dans la correction de l’astigmatisme fort, non associé à une amétropie sphérique.
La prescription de lentilles de contact chez l’enfant nécessite l’autorisation écrite des deux parents. Le forfait d’adaptation en lentilles de contact peut donner lieu à une prise en charge par la Sécurité sociale dans les conditions suivantes (liste des produits et prestations remboursables /Journal Officiel du 23/02/99) : kératocône, astigmatisme irrégulier, myopie > 8 D, aphaquie, anisométropie > 3 D, strabisme accommodatif.
Une telle éventualité est extrêmement rare, mais la chirurgie réfractive par laser Excimer (excited dimer) a déjà été associée avec succès à la correction de sujets myope et avec astigmatisme fort par implant intra-oculaire du sujet phaque : le remodelage de la cornée est réalisé à 2 mois de la chirurgie d’implantation, sous réserve d’une acuité visuelle stable, par laser in situ keratomileusis (LASIK) pour les astigmatismes supérieurs à 1 D [17]. Cette combinaison a été réalisée chez de jeunes adultes au début des années 2000, alors que les implants intra-oculaires toriques du sujet phaque n’étaient pas encore disponibles sur le marché. La question de telles procédures chez l’enfant se discute. Récemment, une étude réalisée sur 6 enfants anisométropes et astigmates, compliqués d’amblyopie, a pu démontrer la viabilité d’une implantation d’implant de chambre postérieure torique du sujet phaque (Visian® Toric ICL™, STAAR Surgical Company, Monrovia, CA) chez des patients réfractaires à la correction optique par verres correcteurs et/ou lentilles de contact
Il existe un nombre important de situations d’astigmatisme fort non physiologique. Le kératocône en est la cause la plus fréquente, mais il ne faut pas oublier les séquelles d’ulcère cornéen de toutes origines, les cicatrices de traumatisme cornéen, ainsi que les ectopies cristalliniennes génératrices d’astigmatisme interne..
Le kératocône est une ectasie cornéenne bilatérale, non inflammatoire, inductrice d’astigmatisme irrégulier. L’âge moyen de découverte de l’affection se situe entre 20 et 30 ans, mais il n’est pas rare de le voir apparaître à l’âge de l’adolescence, voire plus tôt [14, 18]. Il existe une relative prédominance masculine, autour de 60 % [19-21], de l’atteinte. La progression de cette maladie n’est pas définie par des critères, ni des seuils consensuels dans la littérature. Il a un potentiel d’évolution très rapide chez les jeunes patients ; avec par exemple 88 % de progression à 12 mois, définie par une augmentation du Kmax supérieur à 1 D, dans un échantillon d’adolescents âgés entre 9 et 19 ans [22]. D’ailleurs, une corrélation inverse existe entre l’âge et la sévérité de l’atteinte [21] : les patients diagnostiqués les plus jeunes présentent des atteintes plus importantes. L’évolution est, la plupart du temps, asymétrique et la gêne ressentie par les patients est due à la baisse d’acuité visuelle sur le meilleur oeil et à l’asymétrie de l’atteinte entre les deux yeux [20]. L’astigmatisme cornéen antérieur est retrouvé le plus souvent comme non conforme à la règle et une étude récente propose des seuils de puissance d’astigmatisme cornéen antérieur et postérieur permettant son dépistage, respectivement 1,8 D et 0,4 D, avec près de 90 % de sensibilité et de spécificité [22]. Cette étude, fondée sur de larges effectifs (environ 2 000 patients), rétrospective, comparative sur des échantillons atteints de kératocône et sains, retrouve en moyenne 4,47± 2,14 D d’astigmatisme cornéen antérieur et 0,90 ± 0,43 D d’astigmatisme cornéen postérieur. Le kératocône doit être systématiquement évoqué devant tout astigmatisme irrégulier évolutif. La très forte probabilité de progression lorsque le kératocône est diagnostiqué avant l’âge adulte impose le plus souvent la réalisation d’un crosslinking du collagène. En cas de kératocône avancé, une adaptation par lentille rigide spécifique ou par lentille sclérale est souvent relativement aisée chez les enfants atteints (fig. 18-8) [23].
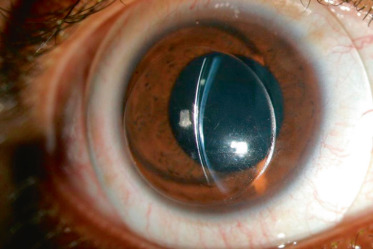
Fig. 18-8 Kératocône évolué chez un enfant de 12 ans et adaptation par lentille sclérale
Les traumatismes perforants sont une cause classique d’astigmatisme fort. En général, la plaie rompt l’architecture régulière de la cornée en créant une incision relaxante et donc un aplatissement en regard de la plaie. La présence de sutures cornéennes trop serrées entraîne un effet inverse (fig. 18-9).
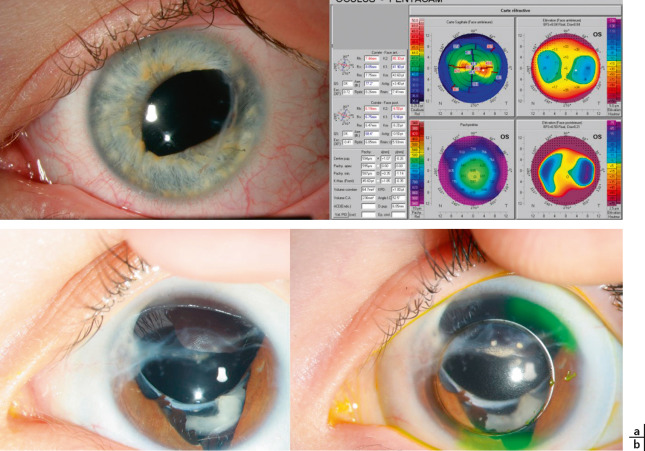
Fig. 18-9 Astigmatisme.
a. De 3,4 D, chez un enfant de 15 ans, régulier non conforme à la règle, secondaire à une plaie perforante verticale suturée. b. De 7 D, chez un enfant de 9 ans, suite à une plaie perforante et adaptée en lentille sclérale permettant une récupération visuelle de 8/10.
Les ulcères cicatrisés de toutes origines sont fréquemment une cause d’astigmatisme irrégulier résiduel. On peut les voir chez l’enfant après ulcère vernal ou après un ulcère d’origine infectieuse (herpès, varicelle, bactérie) (fig. 18-10). On citera aussi les cicatrices d’un glaucome congénital ou des déchirures cornéennes dues à l’utilisation de forceps à la naissance. Leur correction par lunettes est souvent impossible et seule une adaptation en lentille rigide permet une récupération visuelle significative. En raison du caractère unilatéral de l’affection, il n’est cependant pas rare de voir l’enfant abandonner le port de lentilles et le rôle des parents est alors forcément très important pour maintenir le port de lentilles. Dans quelques cas, il sera possible d’avoir recours à une greffe de cornée lamellaire dont l’indication devra toujours être posée avec prudence chez un enfant.

Fig. 18-10 a, b. Séquelle d’ulcère cornéen chez un enfant de 15 ans induisant un astigmatisme oblique régulier de 3,1 D.
L’ectopie cristallinienne est à l’origine d’un astigmatisme interne. La maladie de Marfan en est la cause la plus fréquente. L’inconfort visuel est dû à la malposition cristallinienne inductrice d’un astigmatisme important et au fait qu’une partie des rayons ne sont plus réfractés par le cristallin. L’accommodation est altérée du fait de la laxité des fibres zonulaires. La solution est chirurgicale lorsque les lunettes ne sont plus supportées et ne corrigent l’astigmatisme que trop faiblement (fig. 18-11).
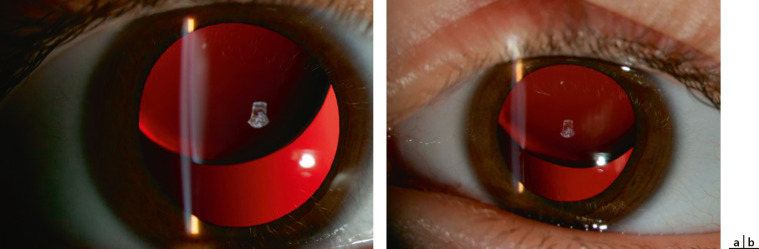
Fig. 18-11 a, b. Ectopie cristallinienne bilatérale chez un enfant de 10 ans atteint de maladie de Marfan. Astigmatisme interne de –2,75 D à droite et –3,5 D à gauche.
[1] Read SA, Vincent SJ, Collins MJ. The visual and functional impacts of astigmatism and its clinical management. Ophthalmic Physiol Opt 2014 ; 34 : 267-94.
[2] Lourdes Garcia M, et al. Relationship between the axis and degree of high astigmatism and obliquity of palpebral fissure. J AAPOS 2003 ; 7 : 14-22.
[3] Howland HC, Sayles N. Photorefractive measurements of astigmatism in infants and young children. Invest Ophthalmol Vis Sci 1984 ; 25 : 93-102.
[4] Friling R, et al. Keratometry measurements in preterm and full term newborn infants. Br J Ophthalmol 2004 ; 88 : 8-10.
[5] Isenberg SJ, et al. Corneal topography of neonates and infants. Arch Ophthalmol 2004 ; 122 : 1767-71.
[6] Huynh SC, et al. Astigmatism and its components in 6-year-old children. Invest Ophthalmol Vis Sci 2006 ; 47 : 55-64.
[7] Fledelius HC, Stubgaard M. Changes in refraction and corneal curvature during growth and adult life : a cross-sectional study. Acta Ophthalmologica 1986 ; 64 : 487-91.
[8] Baldwin WR, Mills D. A longitudinal study of corneal astigmatism and total astigmatism. Am J Optome Physiol Opt 1981 ; 58 : 206-11.
[9] Grosvenor T, et al. Etiology of astigmatism. Am J Optome Physiol Opt 1978 ; 55 : 214-8.
[10] Harvey EM, et al. Accuracy of the Welch Allyn Suresight for measurement of magnitude of astigmatism in 3 – to 7-year-old children. J AAPOS 2009 ; 13 : 466-71.
[11] Harvey EM, et al. Measurement of refractive error in native american preschoolers : validity and reproducibility of autorefraction. Optom Vis Sci 2000 ; 77 : 140-9.
[12] Huynh SC, et al. Prevalence and associations of anisometropia and aniso-astigmatism in a population based sample of 6 year old children. Br J Ophthalmol 2006 ; 90 : 597-601.
[13] Opačić D, Miljak S, Ćuruvija-Opačić K. The level of improvement of visual acuity in high corneal astigmatism with rigid gas permeable contact lenses. Collegium Antropologicum 2015 ; 39 : 229-32.
[14] Mallet F, et al. Les lentilles de contact. Rapport de la Société française d’ophtalmologie 2009 ; p. 676.
[15] Luo M, Ma S, Liang N. Clinical efficacy of toric orthokeratology in myopic adolescent with moderate to high astigmatism. Eye Science 2014 ; 29 : 209-13.
[16] Chen CC, Cheung SW, Cho P. Toric orthokeratology for highly astigmatic children. Optom Vis Sci 2012 ; 89 : 849-55.
[17] Arne J, Lesueur L, Hulin H. Photorefractive keratectomy or laser in situ keratomileusis for residual refractive error after phakic intraocular lens implantation. J Cataract Refract Surg 2003 ; 29 : 1167-73.
[18] Zadnik K, et al. Baseline findings in the Collaborative Longitudinal Evaluation of Keratoconus (CLEK) Study. Invest Ophthalmol Vis Sci 1998 ; 39 : 2537-46.
[19] Société française des ophtalmologistes adaptateurs de prothèses de contact, Malet F. Kératocône et lentilles de contact. SFOALC ; 2003.
[20] Jones-Jordan LA, et al. Asymmetry in keratoconus and vision-related quality of life. Cornea 2013 ; 32 : 267-72.
[21] Ertan A, Muftuoglu O. Keratoconus clinical findings according to different age and gender groups. Cornea 2008 ; 27 : 1109-13.
[22] Chatzis N, Hafezi F. Progression of keratoconus and efficacy of pediatric : corneal collagen cross-linking in children and adolescents. J Refract Surg 2012 ; 28 : 753-8.
[23] Naderan M, Taher Rajabi M, Zarrinbakhsh P. Distribution of anterior and posterior corneal astigmatism in eyes with keratoconus. Am J Ophthalmol 2016 ; 167 : 79-87.
A. Péchereau
Cette notion a été abordée par G. Clergeau dans le Rapport de la Société Française d’Ophtalmologie de 2013 [10] et par le même auteur de façon encore plus détaillée dans la deuxième édition de son livre consacré à La réfraction de l’enfant ([11], p. 264-294).
Traiter des amétropies et de leur évolution chez l’enfant pourrait être considéré comme un sujet fort simple. Or, très rapidement, de nombreuses difficultés apparaissent :
–la définition des amétropies : pendant de longues années, la définition optique a régné en maître ; aujourd’hui il n’en est rien.
Si la définition optique a encore du sens (mais pour combien de temps ?), la définition biométrique s’impose et est devenue le critère discriminant du suivi des amétropies (voir le chapitre 28.4) ;
–le problème de la cycloplégie : du prématuré au jeune presbyte, le problème de l’accommodation vient interférer avec l’évaluation objective de l’amétropie et pose un problème qui n’est pas résolu de façon satisfaisante aujourd’hui, même avec l’emploi systématique des cycloplégiques forts.
De plus, l’explosion des myopies dans le Sud-Est asiatique a réactualisé l’intérêt pour ce sujet. Nous allons voir successivement l’évolution des amétropies en France de la naissance à l’adulte jeune, puis les problèmes que pose l’épidémie de myopie.
Comme nous l’avons déjà dit, ce problème a été traité de façon exhaustive par Clergeau [10-12]. Pour cette partie, nous reproduirons les conclusions de l’auteur sur ce sujet : « L’étude de l’évolution globale exprime principalement le phénomène d’emmétropisation mais masque totalement la diversité des situations individuelles. La connaissance précise des limites de la réfraction physiologique en fonction de l’âge permet de prendre les mesures préventives et curatives optimales pour l’avenir visuel et moteur du jeune enfant… Le mode prospectif et le mode rétrospectif apportent chacun des renseignements qui semblent contradictoires mais sont en réalité complémentaires : le phénomène d’emmétropisation est loin d’être la règle. Ceci se traduit par une augmentation avec l’âge de l’épidémiologie amétropique. L’analyse de la réfraction strabique est celle qui met le mieux en évidence la notion d’hypermétropie latente. L’identité des ésotropies est indiscutablement marquée par une prévalence élevée et durable des fortes hypermétropies. Celle des exotropies est remarquable par la prévalence élevée des myopies mais aussi des hypermétropies, ce dernier élément les différenciant des orthophories. En revanche, sur le plan évolutif, la réfraction est avant tout liée au degré initial des amétropies et non au statut moteur » [10].
Nous retiendrons également les faits suivants [11].
Cette évolution est représentée sur la figure 18-12 [11].
– « Entre 2 à 7 ans :
– une progression modérée et constante amenant le maximum réfractif moyen à l’âge de 7 ans ;
– les fortes hypermétropies ne présentent pas de régression significative.
– Entre 7 à 15 ans :
–les hypermétropies régressent d’autant moins qu’elles sont fortes ;
– la plupart des myopies proviennent des réfractions initialement physiologiques ;
– un facteur essentiel dans ces diverses évolutions est certainement l’hérédité. »
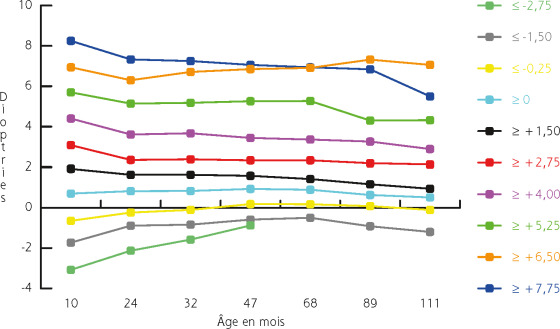
Fig. 18-12 Évolution de la sphère de base (la sphère la moins amétrope) entre 9 mois et 111 mois d’une population pédiatrique standard.
(D’après [11].)
Cette évolution est représentée sur la figure 18-13 [11].
– « Les forts astigmatismes > +2,75 D restent significativement élevés.
– Les astigmatismes moyens à forts présentent une diminution progressive lente qui se poursuit au moins jusqu’à l’âge de 13 ans.
– Les astigmatismes qui ne posent pas de problème sont ceux qui se situaient initialement dans la marge physiologique (≤ 1,75 D).
– 10 à 20 % des cylindres non physiologiques proviennent d’astigmatismes initialement physiologiques
Ceci démontre que l’astigmatisme n’est pas obligatoirement une amétropie initiale et peut par ailleurs être évolutif. »
Fig. 18-13 Évolution du cylindre absolu entre 9 mois et 111 mois d’une population pédiatrique standard.
(D’après [11].)
Cette évolution est représentée sur la figure 18-14 [11].
– Il existe « une progression de la prévalence des anisométropies » .
– « Cette progression est, en partie, liée à la non-régression d’anisométropies situées initialement dans les limites physiologiques. »
Fig. 18-14 Évolution de l’anisométropie entre 9 mois et 111 mois d’une population pédiatrique standard
(D’après [11].)
La réfraction du strabisme présente une identité certaine.
Chez l’ésotrope, l’évolution de la sphère est représentée sur la figure 18-15 [11].
– « L’hypermétropie est l’image de marque avec une prévalence de l’hypermétropie > +3,50 D de 60 % dans l’ésotropie et 40 % dans l’exotropie versus 10 % pour les sujets orthophoriques vers l’âge de 6 ans, après décompensation de l’hypermétropie latente.
– L’évolution ultérieure est caractérisée par la persistance d’hypermétropies non physiologiques chez l’ésotrope tandis que l’exotropie est caractérisée par une bipolarité avec également conservation d’hypermétropies significatives mais aussi un développement myopique similaire à celui des sujets orthophoriques. »
« L’ésotropie et l’exotropie présentent un profil similaire avec un cylindre moyen significatif modéré et surtout stable dans toute l’évolution. »
« On observe également un parallélisme entre ésotropie et exotropie. L’anisométropie initialement physiologique augmente progressivement et sensiblement plus dans les exotropies. »
Fig. 18-15 Évolution de la sphère méridienne (la sphère la plus amétrope) entre 9 mois et 230 mois d’une population d’ésotropes.
(D’après [11].)
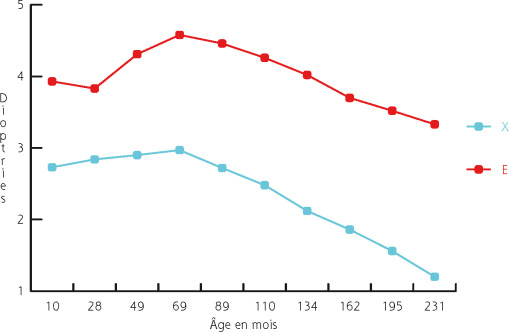
Fig. 18-16 Évolution de la sphère méridienne (la sphère la plus amétrope) entre 9 mois et 230 mois en fonction du type de déviation (ésotropies versus exotropies).
(D’après [11].)
L’évolution de la sphère en fonction du type de déviation (ésotropies versus exotropies) est représentée sur la figure 18-16 [11].
« L’ésotropie et l’exotropie appartiennent à la même famille car elles réagissent de la même façon à la fois sur le plan moteur et sur le plan réfractif en réponse au principe de la correction optique totale en port permanent. La seule vraie différence porte sur leur distribution réfractive initiale avec pour l’ésotropie un maximum d’hypermétropies significatives et fortes qui tendent à le rester et un contingent beaucoup plus important d’hypermétropies modérées et faibles pour l’exotropie, cette population étant connue pour être le principal réservoir des myopies comme chez les sujets orthophoriques. »
Les premières publications mentionnant une augmentation de l’incidence de la myopie datent des années 1980-1990. Tay [58] montre que « la prévalence de la myopie qui était de 26,3 % entre 1974 et 1984 s’élève à 43,3 % entre 1987 et 1991 » . Dès cette publication, il est noté un lien entre l’augmentation de la prévalence de la myopie et le niveau d’éducation.
Depuis cette date-là, de nombreuses publications ont confirmé cette épidémie. Par ailleurs, celle-ci s’est étendue à l’ensemble du Sud-Est asiatique et a atteint également les populations émigrées de même origine génétique.
Les chiffres de la myopie dans certaines populations atteignent des chiffres vertigineux : « en 60 ans, la proportion de myopies est passée de 10 à 20 % à une proportion de 90 % dans certaines populations d’adolescents et d’adultes jeunes. À Séoul, 96,5 % des hommes de 19 ans sont myopes » [14].
Celle-ci est moins bien documentée. Par exemple, on peut lire des textes comme le suivant : « La prévalence de la myopie est en augmentation spectaculaire, atteignant 70-80 % dans de nombreux pays d’Asie de l’Est et 25-40 % dans les pays occidentaux […]. Aux États-Unis, la myopie a doublé au cours des 30 dernières années » [23]. Ou : « Il existe une augmentation de la prévalence de la myopie avec l’âge qui varie selon l’origine ethnique. Les Asiatiques de l’Est ont la plus forte prévalence, atteignant 69 % […] à l’âge de 15 ans (86 % chez les Singapouriens). Les Noirs en Afrique ont la prévalence la plus faible : 5,5 % à 15 ans. Les tendances temporelles de la prévalence de la myopie au cours de la dernière décennie étaient faibles chez les Blancs, augmentées de 23 % chez les Asiatiques de l’Est, avec une augmentation plus faible chez les Asiatiques du Sud » [49] Ces différences ethniques sont également confirmées dans d’autres études [33, 40].
Par ailleurs, les jeunes Australiens sont moins amétropes que les jeunes Nord-Irlandais [17]. Ces derniers semblent avoir une augmentation significative de leur myopie (doublement) sans explication évidente [39].
Une étude chez les conscrits danois montre « une prévalence significativement décroissante de la myopie faible chez les recrues danoises en 2004 par rapport à 1964. Comparativement aux résultats de l’étude de 1882, la prévalence de la myopie faible semble stable. La prévalence de la myopie élevée a diminué de façon significative depuis 1882 et a également tendance à diminuer à partir de 1964 » [27].
Au niveau européen, une méta-analyse de l’European Eye Epidemiology (E3) Consortium semble indiquer une augmentation progressive de la myopie [59]. Cependant, la diversité des méthodes d’évaluation de la réfraction, d’âge des diverses populations et l’absence de mesure des composantes biométriques de la réfraction rendent impossible toute conclusion définitive.
L’épidémie de myopie du Sud-Est asiatique est parfaitement documentée. En revanche, pour le reste du monde, de grandes études épidémiologiques rigoureuses sont nécessaires. Tant qu’elles n’auront pas été menées, il persistera une incertitude sur l’ampleur du phénomène. On peut toutefois admettre que la fréquence et l’importance de la myopie sont en augmentation, mais dans quelles proportions ?
Chez l’homme (nous ne parlerons pas de l’animal), un nombre considérable de facteurs a été proposé pour expliquer cette épidémie. Sans avoir la prétention d’être exhaustif sur ce sujet, nous en avons retenu certains.
Le facteur de l’hérédité ne fait aucun doute. Il existe une composante héréditaire au développement de la myopie. C’est sans aucun doute le facteur le plus certain et le plus important parmi les étiologies [3, 9, 37, 41, 42]. Mais ce facteur a une prédictibilité faible pour la valeur de la myopie à l’âge adulte [32]. Il semble que le processus myopique soit différent pour le sexe masculin et féminin [2], sauf pour les très fortes myopies.
L’âge de la mère à la naissance de l’enfant, l’importance du retard intra-utérin, l’imprégnation tabagique et le déclassement social sont des facteurs favorisants la myopie et son importance [47].
La rétinopathie du prématuré, surtout traitée, s’accompagne d’une forte augmentation de la prévalence de la myopie [11, 45]. En revanche, pour les prématurés sans rétinopathie, il n’y a pas de consensus sur ce point [11].
Plus la myopie est précoce, plus elle devient importante [23].
Ces caractéristiques sont les suivantes :
– la taille à la naissance : même si celle-ci ne semble pas avoir d’influence sur l’équivalent sphérique, elle semble avoir une influence sur la longueur axiale [9] ;
–la taille : la longueur axiale semble corrélée avec la taille [15, 48, 52]. Plus on est grand, plus on est myope, ou plus la longueur axiale est grande [43] ;
– l’indice de masse corporelle : son élévation semble plutôt corrélée avec l’hypermétropie [48] ;
– les poussées de croissance : plus celles-ci sont précoces et/ou importantes, plus la myopie progresse [62].
Les éléments suivants sont concernés :
– le fait de dormir à l’obscurité ou non pendant les deux premières années de la vie : il a été publié une série [46] semblant indiquer une relation entre l’éclairement pendant le sommeil et le développement de la myopie, et ce pour les deux premières années de vie. Cette hypothèse n’a pas été confirmée par la suite [4, 20] ;
– l’éclairage nocturne : il n’a pas été retrouvé de lien entre ce paramètre et le développement de la myopie [54] ;
– le tabagisme familial : il n’a pas été retrouvé de lien entre ce paramètre et le développement de la myopie [50]. Certains auteurs ont même trouvé que le tabagisme familial semblait favoriser la composante hypermétropique [57] ;
– le lieu de vie : les résultats sont contradictoires suivant les études. Pour certains, la vie en milieu urbain favorise le développement de la myopie ; pour d’autres non [42]. De même, un environnement horizontal semble protecteur par rapport à un environnement vertical [61] ;
– la relation avec le sommeil : il a été montré une relation inverse entre le développement de la myopie et la durée du sommeil. Plus un adolescent dort, moins sa myopie progresse [28] ;
– le type d’alimentation : une forte consommation de graisses saturées et de cholestérol favoriserait l’accroissement de la longueur axiale [36].
– L’activité extérieure : les résultats suivant les études sont extrêmement variables. Certaines études ne trouvent pas d’influence [9] ; d’autres études, au contraire, sont plutôt favorables à cette hypothèse [13, 16, 18, 29, 30, 56]. Pour ce dernier paramètre, l’exposition aux UVA pourrait être l’élément protecteur [55]. De toute façon, ce facteur aurait beaucoup moins d’influence que l’hérédité [31].
– L’activité physique semblerait avoir un effet plutôt protecteur [26, 42].
– Le type de scolarité : les scolarités académiques semblent favoriser la myopie par rapport aux scolarités non académiques [42].
– Le rôle du travail de près : le travail de près est souvent invoqué comme facteur favorisant le développement de la myopie [51]. L’intensité du travail de près, plutôt que sa durée, semble favoriser la progression de la myopie [25]. Cependant, l’importance du travail de près semble beaucoup moins importante que le rôle des activités extérieures [30]. Certains ne retrouvent pas de lien [38, 53].
Comme nous venons de le voir, le nombre d’hypothèses étiologiques et la recherche de facteurs favorisants ont été considérables chez l’homme. Cependant, force est de constater que les résultats sont décevants et que les facteurs qui favorisent cette épidémie semblent, en partie, échapper à notre compréhension. Par ordre de certitude et d’importance, on peut retenir :
– le rôle de l’hérédité ;
– les conditions de la grossesse et de l’accouchement ;
– la précocité de la myopie ;
– l’importance de la taille ;
– le rôle des poussées de croissance ;
– le rôle protecteur des activités extérieures.
Quant aux très nombreux autres facteurs étudiés, il reste de très nombreuses incertitudes, sans oublier le caractère incomplet dans l’évaluation des paramètres réfractifs de très nombreuses études.
Devant cette épidémie de myopie, de nombreux conseils découlant des constations précédentes et des traitements spécifiques ont été proposés [1, 23, 24] :
– utilisation de verres bifocaux et de prismes [5, 6] ;
– utilisation d’atropine à différents dosages et différentes durées [7, 8, 24, 34, 44], les effets de l’atropine semblant avoir des effets différents suivant les origines ethniques des patients [34] ;
– bifocaux de +3 D à large foyer inférieur placé haut [19] ;
– utilisation de verres progressifs [21] ;
– sous-correction optique – celle-ci n’a, au mieux, aucun effet [35] ;
– augmentation du temps passé à des activités extérieures [22] ;
– traitement médicamenteux (pirenzépine) [22] ;
– lentilles de contact [22] ;
– orthokératologie [22] ;
– diminution de l’utilisation de la vision de près [30-33]
– cette série de publications est remarquable car les conclusions évoluent avec la durée de l’étude.
La World Society of Paediatric Ophthalmology and Strabismus a publié en 2016 un document de synthèse sur ce sujet : Myopia Consensus Statement [60]. On peut en faire la synthèse suivante en retenant ce qui fonctionnerait, ce qui ne fonctionnerait pas, et ce qui demeure incertain quant aux facteurs préventifs de l’apparition de la progression de la myopie :
– les conseils de vie :
– le temps passé à l’extérieur : oui
– le travail de près : les études sont discordantes
– les actions pour retarder la myopie :
– ce qui ne fonctionne pas :
– les sous-corrections
– ce qui ne fonctionne probablement pas :
– les verres bifocaux
– les verres progressifs
– les verres de contact
– ce qui fonctionne peut-être :
– l’orthokératologie
– la défocalisation périphérique – pour ces deux dernières techniques, c’est plutôt leur inefficacité qui n’a pas été prouvée qu’un début d’efficacité.
– ce qui fonctionne :
– l’atropine.
De toute cette littérature abondante, la seule méthode qui a, peutêtre, un rapport bénéfice/risque positif pour ralentir le développement de la myopie serait l’instillation d’atropine à 0,01 % , une fois par jour le soir au coucher [7]. Il faut noter que ce travail a été effectué sur une population originaire du Sud-Est asiatique qui n’est pas superposable avec les populations caucasiennes.
Ce sujet est un sujet brûlant avec des implications économiques
majeures. Le thérapeute va être l’objet de multiples pressions :
parents, médias, laboratoires pharmaceutiques, verriers, etc.,
son souci de répondre à l’attente des familles n’étant pas des
moindres. Dans la littérature abondante qui lui sera proposé, des
règles simples de validation des études peuvent être suivies :
– analyse soigneuse des populations témoin et étudiée qui
doivent être parfaitement superposables ;
– réfraction systématique sous cycloplégiques forts ;
– étude biométrique systématique de tous les patients. La longueur
axiale est vraiment le critère majeur de suivi ;
– population étudiée comparable à la population prise en charge ;
– suivi pendant au moins 2 à 3 ans après l’arrêt du traitement
préventif, afin de contrôler si un effet de rebond n’apparaît pas.
Toute publication ne répondant pas à ce cahier des charges
devra être écartée.
L’évolution des amétropies chez l’homme reste un problème complexe
pour lequel, malgré des travaux considérables, les données
restent parcellaires. Les deux points sur lesquels nous allons encore
insister sont :
– la nécessité impérieuse d’utiliser des cycloplégiques forts
pour l’évaluation des amétropies ;
– l’importance des éléments biométriques, en particulier de la
longueur axiale.
Chez l’enfant, on peut avancer quelques règles :
– pour l’hypermétropie :
– on peut affirmer que plus elle est forte, moins elle évoluera.
– pour l’astigmatisme :
– on peut affirmer que plus il est fort, moins il évoluera ;
– pour la myopie : nous avons vu combien ce problème
est devenu majeur et combien il était difficile d’aboutir à des
conclusions pratiques et simples. Ce problème sera un vaste sujet
d’études dans les années à venir. Nous encourageons le lecteur à
suivre les règles d’exigence que nous avons vues. Sinon, il risque
de se perdre dans une littérature qui sera vite contradictoire vu les
intérêts en jeu.
[1] Aller TA. Clinical management of progressive myopia. Eye (Lond) 2014 ; 28(2) : 147-53.
[2] Auriol S, Butterworth J, Macé M, et al. Caractérisation du profil biométrique oculaire d’une population de myope fort : la myopie forte correspond-elle à un phénotype homogène. J Fr Ophtalmol 2011 ; 34(4) : 217-28.
[3] Baird PN, Schäche M, Dirani M. The GEnes in Myopia (GEM) study in understanding the aetiology of refractive errors. Prog Retin Eye Res 2010 ; 29(6) : 520-42.
[4] Chapell M, Sullivan B, Saridakis S, et al. Myopia and night-time lighting during sleep in children and adults. Percept Mot Skills 2001 ; 92(3 Pt 1) : 640-2.
[5] Cheng D, Schmid KL, Woo GC, Drobe B. Randomized trial of effect of bifocal and prismatic bifocal spectacles on myopic progression : two-year results. Arch Ophthalmol 2010 ; 128(1) : 12-9.
[6] Cheng D, Woo GC, Drobe B, Schmid KL. Effect of bifocal and prismatic bifocal spectacles on myopia progression in children : three-year results of a randomized clinical trial. JAMA Ophthalmol 2014 ; 132(3) : 258-64.
[7] Chia A, Chua WH, Cheung YB, et al. Atropine for the treatment of childhood myopia : safety and efficacy of 0.5 % , 0.1 % , and 0.01 % doses (Atropine for the Treatment of Myopia 2). Ophthalmology 2012 ; 119(2) : 347-54.
[8] Chia A, Lu QS, Tan D. Five-Year Clinical Trial on Atropine for the Treatment of Myopia 2 : Myopia Control with Atropine 0.01 % Eyedrops. Ophthalmology 2016 ; 123(2) : 391-9.
[9] Chua SYL, Ikram MK, Tan CS, et al. Relative contribution of risk factors for earlyonset myopia in young Asian children. Invest Ophthalmol Vis Sci 2015 ; 56(13) : 8101-7.
[10] Clergeau G. Évolution de la réfraction. In : Péchereau A, Denis D, Speeg-Schatz C. Strabisme. Rapport à la Société Française d’Ophtalmologie, Paris, 2013.
[11] Clergeau G. La réfraction de l’enfant. Ed. A & J Péchereau, FNRO Édition ; 2014. p. 475.
[12] Clergeau G. La réfraction de l’enfant. Ed. A & J Péchereau, FNRO Édition ; 2008.
[13] Deng L, Gwiazda J, Thorn F. Children’s refractions and visual activities in the school year and summer. Optom Vis Sci 2010 ; 87(6) : 406-13.
[14] Dolgin E. The myopia boom. Nature 2015 ; 519(7543) : 276-8.
[15] Eysteinsson T, Jonasson F, Arnarsson A, et al. Relationships between ocular dimensions and adult stature among participants in the Reykjavik Eye Study. Acta Ophthalmol Scand 2005 ; 83(6) : 734-8.
[16] French AN, Ashby RS, Morgan IG, Rose KA. Time outdoors and the prevention of myopia. Exp Eye Res 2013 ; 114 : 58-68.
[17] French AN, O'Donoghue L, Morgan IG Comparison of refraction and ocular biometry in European Caucasian children living in Northern Ireland and Sydney, Australia Invest Ophthalmol Vis Sci: ( 2012 ) :53: 4021-4031
[18] Guo Y, Liu LJ, Xu L, et al. Outdoor activity and myopia among primary students in rural and urban regions of Beijing. Ophthalmology 2013 ; 120(2) : 277-83.
[19] Guyton D. Rapid progression of myopia can be successfully treated with +3.00 D bifocals having high-placed flat-top segments. The Krieger Children’s Eye Center at The Wilmer Institute, July, 2015.
[20] Gwiazda J, Ong E, Held R, Thorn F. Myopia and ambient night-time lighting. Nature 2000 ; 404(6774) : 144.
[21] Hasebe S, Ohtsuki H, Nonaka T, et al. Effect of progressive addition lenses on myopia progression in Japanese children : a prospective, randomized, double-masked, crossover trial. Invest Ophthalmol Vis Sci 2008 ; 49(7) : 2781-9.
[22] He M, Xiang F, Zeng Y, et al. Effect of time spent outdoors at school on the development of myopia among children in China : a randomized clinical trial. JAMA 2015 ; 314(11) : 1142-8.
[23] Holden B, Sankaridurg P, Smith E, et al. Myopia, an underrated global challenge to vision : where the current data takes us on myopia control. Eye (Lond) 2014 ; 28(2) : 142-6.
[24] Huang J, Wen D, Wang Q, et al. Efficacy comparison of 16 interventions for myopia control in children : a network meta-analysis. Ophthalmology 2016 ; 123(4) : 697-708.
[25] Ip JM, Saw SM, Rose KA, et al. Role of near work in myopia : findings in a sample of Australian school children. Invest Ophthalmol Vis Sci 2008 ; 49(7) : 2903-10.
[26] Jacobsen N, Jensen H, Goldschmidt E. Does the level of physical activity in university students influence development and progression of myopia ?--a 2-year prospective cohort study. Invest Ophthalmol Vis Sci 2008 ; 49(4) : 1322-7.
[27] Jacobsen N, Jensen H, Goldschmidt E. Prevalence of myopia in Danish conscripts. Acta Ophthalmol Scand 2007 ; 85(2) : 165-70.
[28] Jee D, Morgan IG, Kim EC. Inverse relationship between sleep duration and myopia. Acta Ophthalmol 2016 ; 94(3) : E204-10.
[29] Jin JX, Hua WJ, Jiang X, et al. Effect of outdoor activity on myopia onset and progression in school-aged children in northeast China : the Sujiatun Eye Care Study. BMC Ophthalmol 2015 ; 15 : 73.
[30] Jones LA, Sinnott LT, Mutti DO, et al. Parental history of myopia, sports and outdoor activities, and future myopia. Invest Ophthalmol Vis Sci 2007 ; 48(8) : 3524-32.
[31] Jones-Jordan LA, Sinnott LT, Graham ND, et al. The contributions of near work and outdoor activity to the correlation between siblings in the Collaborative Longitudinal Evaluation of Ethnicity and Refractive Error (CLEERE) Study. Invest Ophthalmol Vis Sci 2014 ; 55(10) : 6333-9.
[32] Jones-Jordan LA, Sinnott LT, Manny RE, et al. Early childhood refractive error and parental history of myopia as predictors of myopia. Invest Ophthalmol Vis Sci 2010 ; 51(1) : 115-21.
[33] Kleinstein RN, Jones LA, Hullett S, et al. Refractive error and ethnicity in children. Arch Ophthalmol 2003 ; 121(8) : 1141-7.
[34] Li SM, Wu SS, Kang MT, et al. Atropine slows myopia progression more in Asian than white children by meta-analysis. Optom Vis Sci 2014 ; 91(3) : 342-50.
[35] Li SY, Li SM, Zhou YH, et al. Effect of undercorrection on myopia progression in 12-year-old children. Graefes Arch Clin Exp Ophthalmol 2015 ; 253(8) : 1363-8.
[36] Lim LS, Gazzard G, Low YL, et al. Dietary factors, myopia, and axial dimensions in children. Ophthalmology 2010 ; 117(5) : 993-7.
[37] Low W, Dirani M, Gazzard G, et al. Family history, near work, outdoor activity, and myopia in Singapore Chinese preschool children. Br J Ophthalmol 2010 ; 94(8) : 1012-6.
[38] Lu B, Congdon N, Liu X, et al. Associations between near work, outdoor activity, and myopia among adolescent students in rural China : the Xichang Pediatric Refractive Error Study report no. 2. Arch Ophthalmol 2009 ; 127(6) : 769-75.
[39] McCullough SJ, O’Donoghue L, Saunders KJ. Six year refractive change among white children and young adults : evidence for significant increase in myopia among white UK children. PLoS ONE 2016 ; 11(1) : e0146332.
[40]Multi-Ethnic Pediatric Eye Disease Study Group. Prevalence of myopia and hyperopia in 6 – to 72-month-old African American and Hispanic children : the multi-ethnic pediatric eye disease study. Ophthalmology 2010 ; 117(1) : 140-7.e3.
[41] Mutti DO, Mitchell GL, Moeschberger ML, et al. Parental myopia, near work, school achievement, and children’s refractive error. Invest Ophthalmol Vis Sci 2002 ; 43(12) : 3633-40.
[42] O’Donoghue L, Kapetanankis VV, McClelland JF, et al. Risk factors for childhood myopia : findings from the NICER study. Invest Ophthalmol Vis Sci 2015 ; 56(3) : 1524-30.
[43] Ojaimi E, Morgan IG, Robaei D, et al. Effect of stature and other anthropometric parameters on eye size and refraction in a population-based study of Australian children. Invest Ophthalmol Vis Sci 2005 ; 46(12) : 4424-9.
[44] Polling JR, Kok RGW, Tideman JWL, et al. Effectiveness study of atropine for progressive myopia in Europeans. Eye (Lond) 2016 ; 30(7) : 998-1004.
[45] Quinn GE, Dobson V, Davitt BV, et al. Progression of myopia and high myopia in the Early Treatment for Retinopathy of Prematurity study : findings at 4 to 6 years of age. J AAPOS 2013 ; 17(2) : 124-8.
[46] Quinn GE, Shin CH, Maguire MG, Stone RA. Myopia and ambient lighting at night. Nature 1999 ; 399(6732) : 113-4.
[47] Rahi JS, Cumberland PM, Peckham CS. Myopia over the lifecourse : prevalence and early life influences in the 1958 British birth cohort. Ophthalmology 2011 ; 118(5) : 797-804.
[48] Roy A, Kar M, Mandal D, et al. Variation of axial ocular dimensions with age, sex, height, BMI-and their relation to refractive status. J Clin Diagn Res 2015 ; 9(1) : AC01-04.
[49] Rudnicka AR, Kapetanakis VV, Wathern AK, et al. Global variations and time trends in the prevalence of childhood myopia, a systematic review and quantitative meta-analysis : implications for aetiology and early prevention. Br J Ophthalmol 2016 Jan 22. pii: bjophthalmol-2015-307724.
[50] Saw SM, Chia KS, Lindstrom JM, et al. Childhood myopia and parental smoking. Br J Ophthalmol 2004 ; 88(7) : 934-7.
[51] Saw SM, Chua WH, Hong CY, et al. Nearwork in early-onset myopia. Invest Ophthalmol Vis Sci 2002 ; 43(2) : 332-9.
[52] Saw SM, Chua WH, Hong CY, et al. Height and its relationship to refraction and biometry parameters in Singapore Chinese children. Invest Ophthalmol Vis Sci 2002 ; 43(5) : 1408-13.
[53] Saw SM, Shankar A, Tan SB, et al. A cohort study of incident myopia in Singaporean children. Invest Ophthalmol Vis Sci 2006 ; 47(5) : 1839-44.
[54] Saw SM, Zhang MZ, Hong RZ, et al. Near-work activity, night-lights, and myopia in the Singapore-China study. Arch Ophthalmol 2002 ; 120(5) : 620-7.
[55] Sherwin JC, Hewitt AW, Coroneo MT, et al. The association between time spent outdoors and myopia using a novel biomarker of outdoor light exposure. Invest Ophthalmol Vis Sci 2012 ; 53(8) : 4363-70.
[56] Sherwin JC, Reacher MH, Keogh RH, et al. The association between time spent outdoors and myopia in children and adolescents : a systematic review and meta-analysis. Ophthalmology 2012 ; 119(10) : 2141-51.
[57] Stone RA, Wilson LB, Ying GS, et al. Associations between childhood refraction and parental smoking. Invest Ophthalmol Vis Sci 2006 ; 47(10) : 4277-87.
[58] Tay MT, Au Eong KG, Ng CY, Lim MK. Myopia and educational attainment in 421,116 young Singaporean males. Ann Acad Med Singap 1992 ; 21(6) : 785-91.
[59] Williams KM, Bertelsen G, Cumberland P, et al. Increasing prevalence of myopia in Europe and the impact of education. Ophthalmology 2015 ; 122(7) : 1489-97.
[60] World Society of Paediatric Ophthalmology & Strabismus Myopia Consensus Statement ; 2016, http://wspos.org/wp-content/uploads/2016/04/WSPOS_Consensus-Statement_Myopia.pdf.
[61] Wu X, Gao G, Jin J, et al. Housing type and myopia : the mediating rôle of parental myopia. BMC Ophthalmol 2016 ; 16(1) : 151.
[62] Yip VCH, Pan CW, Lin XY, et al. The relationship between growth spurts and myopia in Singapore children. Invest Ophthalmol Vis Sci 2012 ; 53(13) : 7961-6.
- Chapitre 18
Amétropies et complications des amétropies fortes- 1 - Myopie
- Génétique de la myopie
- Facteurs exogènes responsables de la myopie
- Quels moyens pour contrôler l’évolution de la myopie ?
- Comment évoquer une pathologie en cas de myopie forte ? Quelles explorations demander ?
- 2 - Hypermétropie forte de l’enfant
- 3 - Astigmatisme fort chez l’enfant
- 4 - Épidémiologie des amétropies
