A. Danan
La chirurgie de la cataracte avec implantation intraoculaire est aujourd’hui devenue une procédure de routine. Il y a seulement deux générations, l’ablation d’un cristallin opaque était le seul but de cette chirurgie et l’extraction intracapsulaire du cristallin sans remplacement prothétique a ainsi été pendant plusieurs décennies la technique de référence.
Nos chirurgies modernes associent maintenant la phako émulsification par micro-incision à des implants de plus en plus performants, souples, corrigeant l’astigmatisme et les aberrations optiques. La progression extraordinaire des techniques chirurgicales et la précision des appareils biométriques, couplée à l’évolution des formules de calcul, autorisent désormais — et imposent véritablement — des résultats optiques d’une grande précision et ont transformé la chirurgie de la cataracte en une véritable chirurgie réfractive.
Et pourtant, la presbytie reste encore le principal défi puisque nous n’avons pas encore réussi à résoudre ce problème de façon parfaitement satisfaisante.
Les implants multifocaux, ou plutôt bifocaux pour l’immense majorité d’entre eux, représentent bien évidemment une option très largement utilisée et leurs résultats sont infiniment meilleurs que ceux obtenus avec les implants multifocaux de première génération. Ils continuent cependant de représenter une solution de compromis, de modeste compensation de la perte d’accommodation, offrant une pseudo-accommodation certes de plus en plus acceptable mais qui laisse encore un certain nombre de problèmes non résolus : réduction de l’intensité lumineuse, diplopie monoculaire, éblouissement et, surtout, halos, pouvant constituer une gêne en vision nocturne, en particulier pour la conduite automobile. La sélection des patients doit être rigoureuse et écarter en particulier, à juste titre, tous les patients ayant des risques identifiables de pathologie maculaire, dont la multifocalité décuplerait les conséquences délétères sur la qualité de vision.
L’alternative à ces implants multifocaux réside dans des lentilles capables de modifier leur forme et/ou leur position dans le sac capsulaire sous l’effet du réflexe d’accommodation induisant une contraction du muscle ciliaire. C’est la définition même des implants accommodatifs qui visent un idéal : celui de la restauration de l’accommodation.
Sur le plan théorique, ces implants accommodatifs ont l’avantage majeur de réduire le risque d’aberrations optiques ou de perte de sensibilité au contraste puisqu’ils n’imposent pas au cerveau de choisir entre plusieurs images. Cependant, aucun des implants accommodatifs existant aujourd’hui n’est capable de reproduire de façon parfaite le mécanisme de l’accommodation et l’amélioration des performances de ces implants constitue donc un défi d’importance capitale dans les années à venir, ainsi qu’un enjeu commercial majeur pour les laboratoires impliqués dans la recherche et le développement des lentilles intraoculaires du futur.
L’accommodation se définit comme la modification dynamique du pouvoir de réfraction de l’œil, lui permettant de faire la mise au point à différentes distances ; elle dépend de la contraction du muscle ciliaire (cf. partie I).
La théorie de Helmholtz stipule que, lorsque le muscle ciliaire se contracte, l’essentiel de sa masse se contracte vers l’avant et surtout vers l’intérieur, ce qui réduit son diamètre interne et aboutit au relâchement de la tension des fibres zonulaires. Du fait de son élasticité naturelle, la capsule cristallinienne permet alors au cristallin d’augmenter sa convexité et donc sa puissance dioptrique. Cette modification de la forme du cristallin entraîne une avancée de la cristalloïde antérieure et un léger recul de la cristalloïde postérieure. La résultante de cette modification de forme et de position du cristallin est une puissance d’accommodation qui peut dépasser 10 D chez le sujet jeune et phaque.
Bien que les mécanismes en cause dans l’évolution de la presbytie ne soient pas totalement élucidés, car la théorie de Helm holtz ne résume sans doute pas tous les processus mis en jeu au cours de l’accommodation, beaucoup d’études ont démontré l’importance des modifications cristalliniennes qui sont impliquées dans la perte du pouvoir d’accommodation.
On connaît l’augmentation continue du volume cristallinien au cours de la vie, modifiant ses relations avec la zonule, et d’autres études ont montré qu’il existait, avec l’âge, des modifications des propriétés élastiques du cristallin et de sa capsule. A contrario, d’autres travaux utilisant l’UBM ou l’IRM de haute résolution ont pointé la persistance de bonnes capacités contractiles du muscle ciliaire chez des sujets âgés, y compris chez des sujets pseudophaques, rendant compte des performances parfois étonnantes en vision de près de certains patients opérés de cataracte équipés d’implants monofocaux, et faisant parler de pseudo-accommodation ou d’accommodation apparente — le terme de pseudo-accommodation est en effet aujourd’hui plutôt utilisé pour rendre compte des performances en vision de près des yeux pour lesquels la chirurgie vise à créer un système bi- ou multifocal, qu’il s’agisse d’implants cristalliniens, réfractifs et/ou diffractifs ou d’une chirurgie cornéenne en presbyLASIK ou en kératotomies intrastromales au laser femtoseconde.
Dans l’œil pseudophaque équipé d’un implant monofocal, cette accommodation apparente est généralement liée à la sommation d’un certain nombre de facteurs qui ne relèvent d’aucun facteur proprement accommodatif : constriction pupillaire augmentant la profondeur de champ, myopie faible résiduelle, astigmatisme inverse et, surtout, aberrations optiques de degré élevé, en particulier asphéricité négative et/ou coma.
Bien entendu, le but ultime poursuivi par toutes les équipes de recherche travaillant sur la restauration chirurgicale de l’accommodation serait de remplir le sac cristallinien avec une substance capable de reproduire le comportement d’un cristallin jeune : ces techniques sont regroupées sous le concept de phako-ersatz. Jusqu’à présent, un certain nombre d’expérimentations animales ont été réalisées avec des polymères élastiques ou avec des ballons liquidiens introduits dans le sac cristalliniens, sans pour l’instant qu’il ait été possible de passer à l’expérimentation humaine. Malgré l’importance des travaux réalisés dans ce domaine, de nombreux obstacles persistent :
– opacification capsulaire majeure et globale ;
– difficultés à réaliser l’ablation du cristallin au travers d’un petit orifice fait dans la cristalloïde antérieure, dont il faut en outre assurer ensuite l’étanchéité ;
– erreurs réfractives non prédictibles et instables ;
– inefficacité caractérisée par la faible amplitude d’accommodation obtenue.
En attendant la mise au point de ce phako-ersatz dont nous rêvons depuis plusieurs décennies, les implants accommodatifs représentent pour l’instant la seule approche cliniquement disponible visant à restaurer un vrai processus d’accommodation.
L’utilisation de ces implants nécessite cependant une technique chirurgicale sûre et reproductible, conduisant à la fois au succès chirurgical et à un résultat optique prédictible.
Un certain nombre de modèles d’implants accommodatifs sont actuellement distribués ou encore en cours d’évaluation clinique. La plupart de ces implants sont à simple ou à double optique ou encore à optiques déformables.
Les premiers implants accommodatifs mis au point puis commercialisés furent des implants à simple optique, avec le BioComfold® puis le 1CU®, le Crystalens® et, plus récemment, d’autres modèles comme le Tetraflex®.
Parallèlement au Crystalens® et à d’autres modèles d’implants accommodatifs à simple optique, d’autres équipes ont développé des concepts d’implants à double optique dont le mécanisme d’action est sensiblement proche, mais dont le fondement est de mieux « rentabiliser » le déplacement antérieur de l’optique de l’implant. L’objectif est, là encore, d’aboutir à une augmentation de la puissance dioptrique de l’implant lors des efforts accommodatifs, mais le principe optique utilisé est théoriquement plus performant. En effet, l’optique postérieure, de puissance négative, est censée rester fixe dans le sac capsulaire, alors que l’optique antérieure, de forte puissance, se déplace vers l’avant lors de la contraction du muscle ciliaire. Cette combinaison de deux lentilles, analogue à celle des télescopes traditionnels, a pour but de produire une amplitude d’accommodation supérieure à celle obtenue avec le déplacement antérieur d’un implant à optique simple. Elle impose en revanche un centrage parfait, les défauts d’alignement des deux optiques ayant des conséquences potentiellement dévastatrices sur la qualité de la vision. D’autres implants à double optique, encore en phase de développement, sont fondés sur un principe optique totalement différent.
D’autres concepts d’implants accommodatifs peuvent être regroupés sous le nom d’implants à optique déformable, dans lesquels un changement de courbure de l’implant au cours des efforts d’accommodation peut induire une modification importante de puissance de l’implant malgré un déplacement minime de l’optique.
D’autres dispositifs existent, reposant sur des déplacements magnétiques de la capsule et de l’implant sous l’effet de micro-aimants répulsifs activés lors de l’accommodation, et d’autres ne sont qu’au stade du concept, comme les implants autofocus électroniques.
Beaucoup de ces implants accommodatifs sont encore au stade du développement ou de l’évaluation expérimentale et ne font pas encore partie de nos pratiques. Ils comportent des risques d’astigma tisme liés à la nécessité de recourir à de grandes incisions, mais également de baisse de la sensibilité au contraste, de réduction du champ visuel périphérique et sont très sensibles à de faibles défauts de positionnement intraoculaire.
Pour pouvoir analyser l’efficacité d’un implant accommodatif, il est nécessaire de disposer de méthodes objectives de mesure des modifications biométriques associées aux efforts d’accommodation. Des tests seulement subjectifs, mesurant l’acuité visuelle de près ou l’amplitude d’accommodation grâce à une courbe de défocalisation, ne sont pas suffisants car ils ne peuvent différencier une accommodation réelle d’une pseudo-accommodation. Bien que ces mesures soient évidemment indissociables de l’étude de l’efficacité d’un implant, elles peuvent également être influencées par la motivation du patient et/ou du praticien et elles doivent donc obligatoirement être complétées par des tests objectifs incluant la rétinoscopie, l’aberrométrie et l’autoréfraction, complétées par l’analyse des mouvements de l’optique.
La mesure directe de la modification du pouvoir dioptrique de l’œil en réponse à un stimulus de l’accommodation est théoriquement la méthode optimale d’évaluation de l’efficacité d’un implant accommodatif, mais les différents travaux publiés laissent persister des controverses quant aux méthodes à utiliser.
La rétinoscopie est considérée comme une technique objective de mesure permettant de visualiser de façon directe la modification du pouvoir dioptrique de l’œil. La procédure « manuelle » traditionnelle repose cependant sur l’interprétation de celui qui procède à l’examen ; ces résultats apparaissent assez peu reproductibles [47].
En revanche, les techniques de photorétinoscopie automatisée fournissent des mesures objectives de la réfraction. Plusieurs publications portant sur l’évaluation d’implants accommodatifs rapportent les résultats, intéressants du fait de leur reproductibilité, obtenus avec le photorétinoscope PowerRefrator® de la société PlusOptix (Allemagne), cet appareil permettant une mesure rapide de la réfraction, qui se fait simultanément de façon bilatérale. La précision et la prédictibilité des mesures ont pu être comparées à celles obtenues avec un autoréfractomètre Nidek®, le PowerRefractor® ayant en outre l’intérêt de mesurer la position de l’œil, la taille de la pupille et la dynamique de l’accommodation [3]. Un calibrage préalable de l’appareil est cependant nécessaire avant chaque patient.
J.S. Wolffsohn [49] rapporte ainsi, dans une étude portant sur vingt patients implantés avec l’implant 1CU®, une amplitude objective moyenne d’accommodation de 0,72 D, alors que l’amplitude subjective mesurée était de 2,24 D, la différence s’expliquant par la profondeur de champ des yeux implantés et par la nature asphérique de l’implant. L’étude montrait en outre une diminution dans le temps des performances accommodatives de l’implant.
Les autoréfractomètres sont largement utilisés, tant en clinique qu’en recherche, puisqu’ils fournissent une mesure rapide et précise de la réfraction. L’addition du myosis sénile et de la constriction pupillaire lors de l’accommodation nécessite cependant l’utilisation d’appareils capables de réaliser des mesures à travers de très petites pupilles, ce qui constitue une limite à l’utilisation de ces dispositifs qui ne permettent pas de faire des mesures en dessous d’un minimum allant de 2,3 mm à 2,9 mm selon les autoréfractomètres. Les conditions de mesure peuvent en outre être aggravées par l’existence de reflets très brillants sur la surface antérieure de l’optique et par la présence éventuelle d’une opacification capsulaire postérieure.
Wolffsohn [49] rapporte cependant les résultats mesurés avec le Shin-Nippon® SRW 5000, autoréfractomètre réalisant des mesures en système ouvert et permettant un enregistrement continu objectif de l’accommodation dynamique.
L’aberrométrie représente une troisième possibilité de mesurer la réfraction sphérocylindrique d’un œil équipé d’un implant accommodatif, les aberromètres fournissant en pratique clinique une excellente mesure objective de la réfraction. Chez l’adulte jeune par exemple, ces mesures sont souvent comparables sans cyclo plégie aux mesures obtenues à partir d’un autoréfractomètre avec cycloplégie.
Cette méthode se heurte cependant aux mêmes limites que les autoréfractomètres en ce qui concerne le diamètre pupillaire et très peu d’études ont jusqu’à présent utilisé l’aberrométrie pour l’évaluation des implants accommodatifs. Dick et Kaiser [8] rapportent cependant en 2002 des résultats intéressants et reproductibles d’un aberromètre de type Hartmann-Shack pour analyser et comparer les résultats obtenus avec plusieurs implants qualifiés de « potentiellement accommodatifs ».
Cependant, malgré le caractère à la fois objectif et indépendant de l’observateur des mesures aberrométriques, elles sont généralement obtenues dans un espace fermé et avec un stimulus susceptible d’induire une myopie dite proximale ou instrumentale, et certains auteurs remettent de ce fait en question la précision et la reproductibilité des mesures de la réfraction effectuées en aberrométrie [32].
Au-delà des mesures optiques sur un œil équipé d’un implant accommodatif, la mise en évidence de modifications de la profondeur de la chambre antérieure lors de la contraction du muscle ciliaire peut être utilisée comme indicateur de la réelle capacité accommodative de l’implant grâce à un enregistrement dynamique des mouvements intraoculaires d’un œil soumis à accommodation (par variation de lumière ou changement de focus).
De nombreuses techniques biométriques ont été utilisées : biomicroscopie ultrasonique de haute fréquence, interférométrie à cohérence partielle (IOLMaster®, Carl Zeiss), OCT du segment antérieur (Visante®, Carl Zeiss) et, plus récemment, les appareils utilisant la réflectométrie de faible cohérence comme le Lenstar® (Haag-Streit), intéressant parce que capable de mesurer la position du cristallin avec une résolution de 10 µm. L’interférométrie est cependant sans doute aujourd’hui la méthode la plus appropriée pour mesurer les déplacements antéropostérieurs de l’optique d’un implant, du fait de sa très haute résolution et du système de fixation de l’œil analysé permettant un alignement parfait dans l’axe optique. D’autres techniques font intervenir la fixation de l’œil controlatéral et, de ce fait, peuvent induire un mouvement de convergence créant un biais dans la mesure de la profondeur de la chambre antérieure. La variété des méthodes de mesure utilisées est sans doute en partie à l’origine des différences d’appréciation qui peuvent exister d’une étude à l’autre en matière d’analyse de l’efficacité des implants accommodatifs.
Si ces différents appareils peuvent permettre de déterminer le déplacement axial d’une optique, ils ne mesurent en revanche pas de façon directe la modification de la puissance dioptrique de l’œil. Celle-ci peut cependant être calculée à l’aide d’une formule mathématique très simple, telle que proposée par McLeod [28] :
ΔDc = (Dm/13) × Δs,
avec :
– ΔDc, modification du pouvoir dioptrique de l’œil ;
– Dm, puissance dioptrique de la lentille mobile ;
– Δs, modification de la position de la lentille, exprimée en millimètre.
Ces mesures permettent de calculer que, pour un œil ayant des rayons de courbure cornéens antérieur et postérieur mesurant respectivement 7,8 mm et 6,5 mm et une pachymétrie cornéenne de 550 µm, il faut 0,67 mm de déplacement antérieur d’une optique de 19 D pour produire une accommodation d’environ 1 D.
La plupart des études qui ont essayé de mesurer le déplacement antérieur d’un implant accommodatif en réponse à un effort accommodatif ont utilisé une stimulation pharmacologique (test à la pilocarpine) du muscle ciliaire, le plus souvent par application topique de pilocarpine à 2 %, parfois couplée à des mesures faites, au contraire, après application de cyclopentolate destinée à entraîner une relaxation maximale du muscle ciliaire. Cette stimulation pharmacologique a l’avantage de ne pas dépendre de la compliance du patient, contrairement à l’accommodation induite par un stimulus visuel. Elle a cependant l’inconvénient de ne pas rendre compte de la réponse accommodative physiologique, puisqu’elle peut entraîner un véritable spasme accommodatif sans commune mesure avec celui produit par un stimulus visuel, conduisant à surestimer la réponse accommodative. Kriechbaum [19] a ainsi montré, dans un travail portant sur le 1CU® (cf. infra), que le déplacement antérieur moyen de l’implant était de 200 µm après pilocarpine, alors que les mouvements étaient non détectables avec un stimulus visuel.
La stimulation pharmacologique de l’accommodation garde cependant l’intérêt de permettre la mesure de la performance maximale d’un implant accommodatif.
En pratique, le myosis induit par la pilocarpine peut rendre difficiles voire impossibles les mesures objectives des modifications réfractives induites par l’accommodation.
Au total, l’évaluation idéale d’un implant accommodatif devrait associer des mesures objectives de la réfraction et des modifications biométriques, de préférence sans agent pharmacologique, afin de démontrer l’existence d’une réelle accommodation pseudo phaque en réponse à un stimulus visuel. Si les mesures subjectives de l’acuité visuelle ne peuvent évidemment pas être exclues d’une étude clinique, elles ne peuvent pas être le seul élément analysé.
Jusqu’à aujourd’hui, la plupart des études publiées portant sur des implants accommodatifs ont tendance à ne tenir compte que des résultats subjectifs, éventuellement associés aux résultats des stimulations pharmacologiques. À l’inverse, très peu de travaux ont analysé les modifications objectives de la réfraction et de la position des implants accommodatifs en réponse à des stimuli visuels. Une standardisation des méthodes objectives d’analyse de l’accommodation de l’œil pseudophaque paraît hautement souhaitable dans l’avenir [41].
Le principe des implants accommodatifs actuellement commercialisés est fondé sur le déplacement antérieur de l’optique sous l’effet de la contraction du muscle ciliaire, bien que le mécanisme précis de ce déplacement antérieur varie selon le type d’implant.
Le premier implant accommodatif mis sur le marché fut le BioComFold 43A® (Morcher, Allemagne) en 1996 mais, aujourd’hui, seul le Crystalens® (Bausch & Lomb) a reçu l’agrément de la FDA.
En Europe, le Crystalens® mais aussi le Tetraflex® (Lenstec, États-Unis) et le 1CU® (HumanOptics, Allemagne) ont obtenu le marquage CE. Le Tetraflex® est actuellement en phase III des études FDA.
Né des travaux de J.S. Cumming, l’implant Crystalens® a connu, depuis, de nombreuses modifications de son design. La version actuelle est un implant asphérique « aberration-free », en Biosil®, silicone biocompatible de troisième génération. Ses haptiques, plates et rectangulaires, sont pourvues à leurs extrémités de deux prolongements en polyimide destinés à maintenir l’implant dans le sac capsulaire, évitant ainsi sa luxation lors des mouvements antérieurs de l’optique. Il existe à la base de l’haptique, tout près de l’optique, une zone amincie de 50 %, constituant une charnière qui sert d’articulation à l’implant afin de permettre sa translation antérieure.
L’optique a un diamètre de 5 mm et l’implant existe en deux versions, de 11,5 mm ou de 12 mm de diamètre hors-tout selon la puissance (fig. 12-1). De 33 D à 17 D, le diamètre est ainsi de 11,5 mm et passe à 12 mm pour les implants de 16,5 D à 10 D, destinés à des yeux myopes dont le sac capsulaire est susceptible d’être de plus grand diamètre.

Fig. 12-1 Implant Crystalens® AO.
a. Implant. b. Détail géométrique montrant l’articulation des haptiques.
(Avec l’aimable autorisation de Bausch & Lomb.)
Stuart Cumming fut l’un des premiers chirurgiens à travailler sur les implants accommodatifs à optique simple car, dès 1989, il avait remarqué que certains opérés de la cataracte en situation d’emmétropie étaient pourtant capables d’excellentes performances en vision intermédiaire et en vision de près. Les études faites sur ces patients en utilisant des agents pharmacologiques induisant un spasme ou, au contraire, une relaxation du muscle ciliaire, lui permirent de démontrer, chez certains de ces patients, l’existence de mouvements antérieurs de l’optique de l’implant lors de la contraction du muscle ciliaire.
S’appuyant sur des travaux plus anciens de Busacca, Thornton et Coleman, il arriva à la conclusion que, lors de la contraction du muscle ciliaire, la redistribution spatiale de sa masse entraînait une augmentation de pression dans la cavité vitréenne dont la transmission à la chambre antérieure avait pour conséquence une bascule vers l’avant de l’optique de l’implant. À l’inverse, la relaxation du muscle ciliaire permettait un retour de l’optique à sa position initiale grâce à une diminution de la pression intravitréenne.
À la lumière de ces études, Cumming développa un concept d’implant utilisable dans la chirurgie de cataracte capable de reproduire ces déplacements antérieurs mimant l’accommodation.
Le premier prototype fut implanté en Grande-Bretagne en 1991 chez une patiente de quatre-vingt-cinq ans, avec des résultats plus qu’encourageants puisque des mouvements antérieurs de l’implant d’une amplitude de 2,5 mm furent mesurables, avec pour conséquence de bonnes performances de lecture. On sait en effet que, sur le plan théorique, un déplacement vers l’avant de l’optique de 1 mm équivaut à une accommodation d’environ 1,25 D.
Malheureusement, l’implant se luxa spontanément au bout de six mois, conduisant Cumming à travailler sur un nouveau design de son implant qui, lui aussi, donna de bons résultats initiaux avant d’aboutir de nouveau à des problèmes de luxations spontanées.
Le septième design de cet implant correspond à l’implant Crystalens® AT-45, qui fut utilisé pour la première fois en 1998 et qui fut le premier implant accommodatif à obtenir l’approbation de la FDA en 2003. Depuis lors, son dessin a encore été modifié à plusieurs reprises, pour aboutir aujourd’hui au Crystalens® AO (fig. 12-2), représentant la cinquième génération commercialisée de cet implant accommodatif qui est, encore aujourd’hui, le seul ayant reçu l’agrément de la FDA aux États-Unis.
Il a connu en vérité différentes évolutions de son dessin :
– l’AT-45 fut la première version commercialisée par la société Eyeonics ;
– l’AT-45 SE fut la deuxième version, marquée par l’apparition d’un bord carré sur l’optique ;
– le Five-O®, fut la troisième version, également dénommé AT-50 ou AT-52 selon le diamètre de l’implant : la demande des chirurgiens étant d’augmenter l’optique et d’améliorer la stabilité, l’optique passe de 4,5 mm à 5 mm et les haptiques sont élargies afin d’augmenter l’arc de contact ; c’est l’implant qui a réellement lancé l’accommodatif aux États-Unis ;
– le Crystalens® HD fut la quatrième génération, marquée par l’apparition d’une zone d’asphéricité négative au centre de l’optique (surépaisseur de 3 µm sur un diamètre de 1,5 mm), représentant une addition de 0,75 D au plan des lunettes ; la société Eyeonics est rachetée par Bausch & Lomb pour le lancement du Crystalens® HD ;
– le Crystalens® AO est la version actuelle, dans laquelle la pastille centrale a disparu ; elle rendait en effet l’implant très sensible aux problèmes de centrage et générait des halos en cas de décentrement ; l’optique de la version AO est en outre plus fine, lui permettant de se cambrer de façon plus importante.

Fig. 12-2 Évolution de l’implant Crystalens®, de l’AT-45 à l’implant AO.
a. AT45. b. AT-45 SE. c. Five-O. d. HD. e. AO.
(Avec l’aimable autorisation de Bausch & Lomb.)
Les implants asphériques à optique « aberration-free » sont conçus pour induire un taux d’aberrations sphériques proche de zéro. De tels implants sont censés avoir des performances optiques stables quelle que soit leur position par rapport à la cornée. Surtout, ils ont pour conséquence, comme les implants monofocaux asphériques, l’obtention d’un niveau élevé de transfert de modulation de contraste mais également d’une profondeur de champ réduite, qui condamne d’une certaine façon l’implant à avoir une véritable action accommodative pour être efficace en vision de près et en vision intermédiaire. Les mesures du front d’onde et de la MTF (Modulation Transfer Function) confirment pour cet implant une puissance constante sur toute sa surface et un taux négligeable d’aberrations sphériques, qui rendent son optique parfaitement comparable à celle d’un implant asphérique monofocal.
Ceci est intéressant lorsqu’on compare le Crystalens® AO au Crystalens® HD, qui en était la version précédente dans laquelle une petite pastille centrale de 1,5 D pouvait accréditer l’hypothèse d’un effet bifocal et non plus purement accommodatif. Les mêmes mesures de front d’onde et de MTF montrent que cet implant possède une optique se comportant plutôt comme celle d’un implant multifocal, avec une augmentation de la puissance centrale, une réduction du transfert de modulation du contraste et une augmentation de profondeur de champ (fig. 12-3 à 12-5).
Le mécanisme proposé pour expliquer l’efficacité accommodative du Crystalens® AO est double. Il repose d’abord sur la théorie dite de la « suspension hydraulique » proposée par Coleman en 1986 : lors de l’effort accommodatif, le muscle ciliaire se contracte et la redistribution de sa masse crée une protrusion dans la cavité vitréenne qui a pour conséquence une augmentation de la pression intravitréenne, qui a elle-même pour effet de repousser l’implant vers l’avant. L’optimisation du dessin de l’implant, en particulier l’existence de la charnière entre l’optique et les haptiques, permettrait ainsi d’obtenir une véritable translation antérieure de l’optique (figure animée 12-1 et fig. 12-6).

En outre, la contraction du sac capsulaire lors de l’accommodation entraîne une augmentation de la courbure de la face antérieure de l’implant qu’on peut mettre en évidence par analyse aberrométrique, montrant une augmentation des aberrations de haut degré, en particulier aberration sphérique et coma, qui sont, par la nature même de l’implant aberration-free, quasi nulles pour l’implant au repos.
Ce phénomène, dénommé « arching », permettrait ainsi, par pseudo-accommodation, d’augmenter la profondeur de champ et d’améliorer les performances visuelles de près et à distance intermédiaire, expliquant l’obtention de résultats cliniques supérieurs à ceux attendus par la seule translation antérieure de l’optique.
Ces deux mécanismes sont complémentaires à proportions variables selon la puissance dioptrique de l’implant. En effet, pour des raisons optiques (ΔDc = (Dm/13) × Δs), l’amplitude d’accommodation produite par le déplacement antérieur de l’optique est plus importante pour les fortes puissances d’implant avec, à l’inverse, une déformabilité réduite de l’optique liée à son épaisseur, rendant compte d’un arching plutôt faible. À l’opposé, les implants de faibles puissances bénéficient moins sur le plan optique d’un niveau identique d’antérotranslation mais ont une optique plus déformable, permettant aux phénomènes d’arching et de la pseudo-accommodation qui en résulte d’être plus marqués.
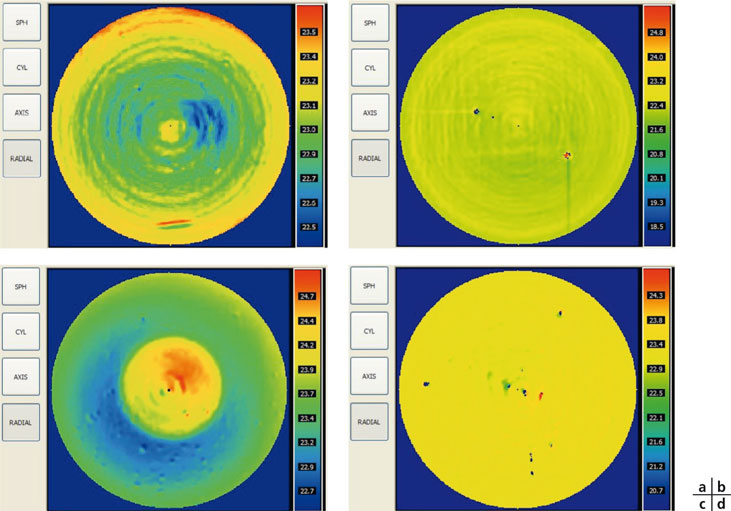
Fig. 12-3 Cartes de puissance locale, calculée grâce à la mesure du front d’onde (déduit d’une analyse par interférométrie).
a. Implant Akreos® Adapt. La courbure de ses surfaces est constante, mais sa puissance optique est inhomogène : de fait, on note une augmentation progressive de la puissance optique du centre vers les bords de l’optique (les petites fluctuations locales sont liées à des artefacts de mesure). Cette augmentation engendre de l’aberration sphérique positive.
b. Implant Akreos® AO. La puissance de l’optique est homogène et ceci confirme le caractère « aberration-free » (pas d’aberration).
c. Implant Crystalens® HD. La puissance est inhomogène : on note une zone centrale d’environ 1,5 mm où la puissance est plus élevée de 1 D à 1,5 D qu’en moyenne périphérie (soit environ 1 D dans le plan des verres de lunettes). L’optique de cet implant peut donc être qualifiée de « multifocale » (addition centrale).
d. Implant Crystalens® AO. La puissance de l’optique est homogène (les petites zones colorées sont artéfactuelles). Comme pour l’optique de l’Akréos AO, cette homogénéité de la puissance réfractive confirme le caractère « aberration-free » de l’optique.
(Documents de D. Gatinel.)
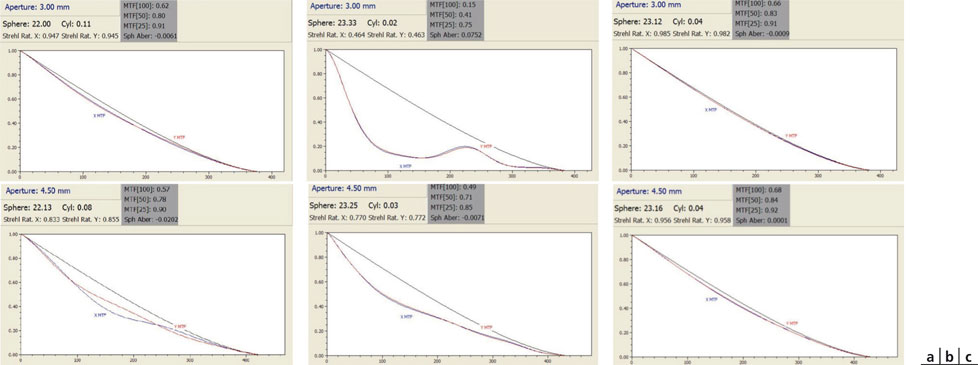
Fig. 12-4 Courbes de MTF pour un diamètre de 3 mm (en haut) et de 4,50 mm (en bas).
Les courbes rouges et bleues sont des mesures effectuées sur deux méridiens perpendiculaires arbitraires ; la courbe noire est la courbe de référence d’un système optiquement parfait, uniquement limité par les effets incontournables de la diffraction.
a. Implant Akreos® AO. Pour un diamètre de 3 mm, la courbe montre un excellent transfert de modulation du contraste. À 4,50 mm, on note une légère réduction du transfert du contraste pour les fréquences spatiales moyennes, qui sont liées à d’inévitables petites « imperfections » de position de l’implant lors des mesures.
b. Implant Crystalens® HD. Pour ces diamètres, la courbe révèle une réduction du transfert de modulation du contraste. Celle-ci est particulièrement évidente pour un diamètre de 3 mm, en raison de la conjonction de deux zones occupant une surface équivalente (au diamètre 4,5 mm, la surface occupée par l’addition centrale est moindre en proportion).
c. Implant Crystalens® AO. Pour les diamètres de 3 mm et de 4,5 mm, la courbe montre un excellent transfert de modulation du contraste.
(Documents de D. Gatinel.)
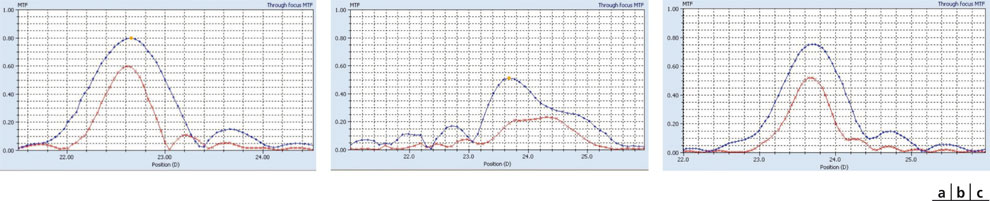
Fig. 12-5 Courbes de MTF « through focus » pour un diamètre de 3 mm et deux résolutions (50 lignes/mm en bleu, 100 lignes/mm en rouge). Ces courbes permettent d’apprécier la profondeur de foyer, qui est corrélée à la profondeur de champ permise par l’optique testée.
a. Implant Akreos® AO. Au pic central, le transfert du contraste est maximum. Ce transfert du contraste se dégrade très rapidement avec la défocalisation : le meilleur foyer (pic des courbes) se situe aux alentours de 22,6 D) et le transfert du contraste chute de moitié pour une variation focale de ± 0,25 D. Le haut degré de stigmatisme (qualité optique) de cet implant s’accompagne d’une faible profondeur de champ, ce qui est attendu.
b. Implant Crystalens® HD. On note une réduction de la hauteur des pics (foyer où le contraste est le meilleur) mais également un étalement des courbes, reflet d’une profondeur de foyer accrue. Les optiques multifocales sacrifient une partie du transfert du contraste au bénéfice d’une profondeur de foyer accrue.
c. Implant Crystalens® AO. En raison de l’excellente qualité optique au foyer, le transfert du contraste se dégrade très rapidement avec la défocalisa tion : le transfert du contraste chute de moitié pour une variation focale de ± 0,25 D.
(Documents de D. Gatinel.)

Fig. 12-6 Implant Crystalens®.
a. Vision de loin. b. Vision intermédiaire. c. Vision de près.
(Avec l’aimable autorisation de Bausch & Lomb.)
Le Crystalens® AO, dernière version commercialisée de cet implant, n’est utilisé en France que depuis avril 2010 et les résultats publiés par le laboratoire sont limités et consacrés essentiellement à ses résultats fonctionnels. Les résultats publiés en février 2011 portaient sur trente-huit yeux de dix-neuf patients présentant une cataracte non traumatique et sans pathologie oculaire associée :
– l’acuité visuelle monoculaire moyenne de loin sans correction évolue de 8,2/10 (0,09 logMAR) à quinze jours à 10/10 (0 logMAR) à trois mois ; avec correction, le niveau atteint est même de 12/10 (– 0,08 logMAR) à trois mois ;
– en vision intermédiaire sans correction, l’acuité passe de 10/10 (0 logMAR) à quinze jours à 9,4/10 (0,03 logMAR) à trois mois ; avec correction de la vision de loin, les chiffres obtenus passent de 6,3/10 (0,2 logMAR) à quinze jours à 7,5/10 (0,13 logMAR) à trois mois ;
– en vision de près sans correction, l’acuité moyenne est stable à Jaeger 3 (0,3 logMAR, équivalent de Parinaud 3-4) entre quinze jours et trois mois ; lorsque la correction de loin est portée, les chiffres passent de Jaeger 5 (0,4 logMAR) à quinze jours à Jaeger 4 (0,35 logMAR) à trois mois.
La différence de résultats en vision intermédiaire et en vision de près s’explique par l’existence pour un certain nombre de patients d’un défocus myopique de loin, majorant les performances en vision rapprochée.
La littérature est plus fournie sur le Crystalens® AT-45, première version commercialisée et premier implant accommodatif approuvé par la FDA en 2003, grâce à l’étude multicentrique menée pour la FDA portant sur deux cent soixante-trois patients [7]. Sur le plan fonctionnel, 79 % des patients opérés de façon unilatérale et 96 % des patients opérés de façon bilatérale obtenaient à la fois une acuité visuelle supérieure ou égale à 5/10 de loin et Jaeger 3 de près ; 73 % des yeux opérés obtenaient une acuité visuelle de près sans correction à Jaeger 1 (équivalent de Parinaud 2), cette proportion passant à 52 % après correction d’une éventuelle erreur réfractive en vision de loin. Sur le plan qualitatif, malgré le diamètre de 4,5 mm de l’optique dans cette première version de l’implant, il n’existait pas plus d’éblouissement ou de réduction de la sensibilité au contraste que dans le groupe contrôle équipé d’un implant monofocal standard.
À côté des résultats fonctionnels, d’autres publications portant sur un nombre plus restreint de patients ont tenté d’analyser les performances accommodatives objectives de cet implant. Plusieurs études ont porté sur la mesure du shift antérieur de l’implant ; les résultats sont contradictoires.
En utilisant une stimulation pharmacologique de l’accommodation par la pilocarpine, Stachs [43] rapporte en effet, grâce à des mesures réalisées à l’UBM sur un groupe de quatre patients seulement, un léger mouvement antérieur de l’optique, mesuré à 0,13 mm en moyenne avec des extrêmes à 0,05 mm et 0,20 mm, ainsi qu’une modification de l’angulation des haptiques de 3,3° en moyenne avec des extrêmes allant de 0° à 7°. Dans cette même étude, l’amplitude d’accommodation mesurée avec un réfractomètre n’est que de 0,44 D en moyenne avec des extrêmes entre 0,25 D et 0,75 D.
En revanche, Koeppl et Findl [17] présentent une étude sur quarante-quatre yeux de vingt-huit patients, dans laquelle le shift de l’optique de l’implant, induit par la pilocarpine et mesuré par interférométrie, est postérieur et non pas antérieur, d’une amplitude moyenne variant de 122 µm à 151 µm selon qu’on réalisait ou non un polissage de la capsule antérieure. Les auteurs ont en effet voulu individualiser un sous-groupe de vingt-quatre yeux dans lequel la fibrose capsulaire était prévenue par un polissage soigneux de la capsule antérieure. La différence de shift postérieur entre les deux groupes n’était cependant pas significative. Les auteurs concluent ainsi à un effet contre-productif de la pilocarpine et mesurent en outre des niveaux d’acuité visuelle de près sans correction à Jaeger 5 à un mois et Jaeger 4 à trois mois, qu’ils qualifient de comparables à ceux d’un implant monofocal.
Macsai et al. [22] ont en revanche mené une large étude multicentrique sur deux cent vingt-quatre yeux de cent douze patients, dans laquelle l’amplitude accommodative était mesurée de façon objective par rétinoscopie dynamique et de façon subjective par deux méthodes, courbe de défocalisation d’une part et mesure de l’amplitude d’accommodation sur une cible proche d’autre part. Les patients étaient en outre divisés en deux groupes, l’un recevant le Crystalens® AT-45 des deux côtés, alors que l’autre groupe de patients était équipé de façon bilatérale par un implant mono focal, l’observateur n’étant pas informé du type d’implants porté par chaque patient. Les résultats sont ici nettement en faveur du Crystalens®, avec 90 % de patients lisant Jaeger 3 ou mieux sans correction, contre 15 % dans le groupe contrôle.
La mesure de l’amplitude moyenne d’accommodation en rétinoscopie dynamique était de 2,42 D dans le groupe Crystalens® contre 0,91 D dans le groupe témoin. De même, l’étude montrait une différence significative de défocus monoculaire de 1,74 D dans le groupe Crystalens® contre 0,75 D dans le groupe témoin. Enfin, les auteurs notaient, sans en fournir d’explication, que dans le groupe Crystalens® l’accommodation subjectivement perçue par le patient était en moyenne de 5,79 D, très supérieure à l’accommodation réellement mesurée de façon objective ou par le défocus.
On peut enfin citer l’étude de Marchini [24], portant sur vingt yeux de quatorze patients pour lesquels le shift de l’implant était mesuré par l’UBM, avec des résultats montrant une réduction de la profondeur de chambre antérieure et donc un shift antérieur de l’optique de 320 µm (± 160) à un mois et de 330 µm (± 250) à six mois lors des efforts d’accommodation sur une cible rapprochée. L’UBM permettait également de mettre en évidence une réduction de l’ouverture de l’angle entre la sclère et les procès ciliaires lors de l’accommodation, mesurée à 4,43 D (± 1,85) à six mois. Le déplacement antérieur de l’implant et cette rotation du corps ciliaire mesurés par l’UBM étaient, selon les auteurs, proportionnels à l’amplitude accommodative mesurée chez ces patients.
À titre plus anecdotique, est à mentionner l’option développée à l’heure de la naissance du concept « custom-match » consistant à choisir le type d’implant et de combinaison en fonction des besoins visuels du patient : il fut ainsi proposé d’associer un implant accommodatif sur l’œil directeur préservant la vision de loin sans perturber la vision qualitative et un implant multifocal sur l’œil controlatéral permettant d’optimiser la vision de près. Le défaut de prédictibilité et l’inconstance de la tolérance binoculaire ont conduit à ne pas persévérer dans cette direction.
Sans surprise, les résultats dans ce type de configuration montrent une supériorité de l’implant multifocal en vision de près avec en revanche, pour l’implant accommodatif, des performances correctes en vision intermédiaire mais moins d’altérations de la sensibilité au contraste [36].
La fréquence de l’opacification capsulaire postérieure pose la question de l’effet de la capsulotomie au YAG sur le résultat réfractif. Nous n’avons pas trouvé dans la littérature de publication confirmant l’idée, souvent avancée, d’une amélioration des performances visuelles après réalisation d’une large capsulotomie. En revanche, la capsulotomie est évidemment bénéfique, voire salutaire, lorsqu’une fibrose capsulaire importante a conduit à une déformation de l’implant, ce qui a pu être observé avec le Crystalens®[16, 50] comme avec l’implant 1CU® [1].
Dessiné par Robert Kellan, le Tetraflex® est un implant en hydroxy éthylmétacrylate (HEMA), acrylique hydrophile dont le taux d’hydro philie est de 26 % (fig. 12-7). Avec une optique de 5,75 mm de diamètre et des bords carrés, ce monobloc est implantable au travers d’une incision de 2,5 mm. Les anses présentent avec l’optique une angulation antérieure de 5°, destinée à favoriser la translation antérieure de l’implant avec tout le sac capsulaire lors des efforts d’accommodation.
Il est commercialisé en Europe, en Australie, au Canada, en Chine et à Taïwan et au Moyen-Orient. Il est actuellement en phase III des études FDA, avec une étude multicentrique portant sur deux cent cinquante-cinq patients implantés de façon bilatérale avec un Tetraflex®, comparés à un groupe contrôle de cent un patients équipés de façon bilatérale d’implants monofocaux [39].
L’étude, présentée par Donald Sanders, consultant pour le laboratoire Lenstec, analyse les résultats fonctionnels subjectifs de deux cent trente-neuf Tetraflex® et de quatre-vingt-seize patients du groupe contrôle, examinés douze mois après la chirurgie. La méthode choisie pour analyser les résultats en vision de près était le Minnesota Low-Vision Reading Test (MNRead Test) dans lequel une série de phrases est présentée au patient à 40 cm de distance dans des conditions d’éclairage standardisées, avec des caractères de taille décroissante, l’élément analysé étant la vitesse de lecture des phrases présentées. Il s’agit en fait d’une série de planches reproduisant des phrases formées de dix mots de longueur standard et dont la taille des caractères décroît, correspondant à une acuité visuelle de près allant de 20/400 (1,3 logMAR) à 20/6 (– 0,5 logMAR) par intervalles réguliers de 0,1 logMAR. Il apparaît dans cette étude, de façon statistiquement significative, que les patients du groupe Tetraflex® lisent mieux que ceux du groupe contrôle, pour toutes les tailles de caractères avec, en particulier, un pourcentage significativement plus élevé de patients capables de lire plus de quatre-vingts mots par minute. Par ailleurs, 96 % des patients du groupe Tetraflex® ne portent jamais de correction en vision de loin contre 80 % des témoins ; 75 % des patients du groupe Tetraflex® ne portent jamais ou très occasionnellement une correction en vision de près (jamais : 21 %) pour la lecture de très petits caractères ou lorsque l’éclairage est tamisé ; ce pourcentage passe à 46 % dans le groupe contrôle (jamais : 9 %). Enfin, la puissance moyenne des verres correcteurs nécessaires en vision de près apparaît plus faible dans le groupe Tetraflex®, avec 28 % de patients portant une correction ne dépassant pas + 1,25 D contre 7 % dans le groupe contrôle.
Le même Donald Sanders avait présenté en 2007 [38] une étude portant sur quatre-vingt-quinze yeux de cinquante-neuf patients avec, outre les mesures d’acuité visuelle, une mesure subjective de l’amplitude d’accommodation par la méthode du « push-up ». Cette méthode, utilisée par la Royal Air Force, consiste à présenter au patient un test d’acuité visuelle de près qu’on rapproche progressivement de l’œil du patient, corrigé en vision de loin, jusqu’à la distance à laquelle il ne parvient plus à le lire. L’inverse de la distance parcourue exprimée en mètres permet de définir l’amplitude d’accommodation en dioptries. Selon cette méthode, il apparaît que, six mois après l’intervention, tous les patients ont au moins 1 D d’accommodation et 75,7 % ont au moins 2 D. Ces mesures ne sont cependant que fonctionnelles et on peut sans doute regretter l’absence de groupe témoin dans cette étude.
La littérature est assez pauvre sur cet implant et comporte très peu d’études mettant en évidence des modifications biométriques ou réfractives objectives. On peut cependant citer la publication de Wolffsohn [48], portant sur treize yeux de huit patients suivis en postopératoire pendant au moins deux ans. L’étude consistait à mesurer, en réponse à un stimulus accommodatif variant de 0 à 4 D, d’une part les modifications de profondeur de la chambre antérieure en OCT Visante® et, d’autre part, les aberrations optiques de haut degré avec un aberromètre de type Hartmann-Shack. Il ressort de cette publication qu’aucun mouvement antérieur de l’implant n’a pu être mis en évidence avec, en moyenne, une translation plutôt postérieure de 20 µm, les extrêmes allant de 30 µm en avant à 70 µm en arrière. En revanche, des modifications aberrométriques significatives sont observées et sont attribuées à une modification de la forme de l’optique de l’implant sous l’effet des efforts accommodatifs, qu’on peut rapprocher du phénomène d’arching décrit avec l’implant Crystalens®. Les aberrations dont les modifications sont significatives sont le défocus, l’astigmatisme vertical primaire et secondaire, la coma verticale, le trefoil et l’aberration sphérique. Les auteurs concluent à la responsabilité au moins partielle de ce phénomène d’arching et des aberrations qui en résultent dans les performances en vision de près de l’implant Tetraflex®.
On peut enfin citer dans la littérature consacrée au Tetraflex® une étude comparative [6] des performances en vision de près de l’implant Tetraflex® et du Crystalens® dans sa version AT-50, version proche de l’AT-45 avec une optique dont le diamètre était passé à 5 mm. Cette publication faisait partie de l’étude multicentrique FDA et comprenait quatre-vingt-seize patients implantés de façon bilatérale avec le Tetraflex® comparés à cinquante-cinq patients recevant un Crystalens® AT-50 dans les deux yeux suivis pendant un an. La méthode d’analyse était de nouveau le MNRead Test et les résultats rapportés mettaient en évidence de meilleures performances dans le groupe Tetraflex® pour la lecture des caractères de tailles correspondant à 20/25, 20/32, 20/40, 20/50 et 20/63, avec une vitesse significativement plus rapide dans le groupe Tetraflex®, dans lequel on notait en outre une proportion plus importante de patients capables de lire plus de quatre-vingts mots par minute pour ces cinq tailles de caractères.

Fig. 12-7 Implant Tetraflex®.
(Avec l’aimable autorisation de Lenstec.)
Dessiné par K. Hanna, l’implant 1CU® est sans doute l’implant accommodatif qui a donné lieu au plus grand nombre de travaux de recherche clinique. Certifié CE et mis sur le marché européen dès 2001, il n’a cependant pas reçu à ce jour l’agrément de la FDA américaine.
Il s’agit d’un implant monobloc en acrylique hydrophile de 9,8 mm de diamètre hors-tout, présentant une optique biconvexe de 5,5 mm de diamètre, s’articulant avec quatre haptiques à large base, dont l’épaisseur est réduite près de l’optique, afin d’y réaliser une charnière destinée à permettre la bascule vers l’avant de l’optique (fig. 12-8).
Le concept original a été élaboré à parti d’un modèle mathématique, la méthode des éléments finis, méthode d’analyse mathématique utilisée pour calculer de manière numérique le comportement dynamique de certains systèmes physiques, même très complexes, à condition que ces mouvements puissent être décrits par des équations aux dérivées partielles. Ce premier concept incluait un second élément sous la forme d’une lamelle élastique ultrafine destinée à doubler le sac capsulaire (2CU pour « two-components unit »), mais cette idée ne fut pas poursuivie et c’est finalement le concept du 1CU® qui fut concrétisé par l’élaboration de cet implant.
Le mécanisme d’action proposé de cet implant est que la réduction de la tension zonulaire lors de la contraction du muscle ciliaire entraîne une relaxation du sac capsulaire, qui a pour conséquence la compression des haptiques et une bascule vers l’avant de l’optique de l’implant.
Compte tenu de l’ancienneté de sa commercialisation en Europe, de nombreuses études randomisées ont été consacrées à cet implant avec, toutefois, des conclusions sensiblement différentes d’une publication à l’autre, ce qui ne semble pas exceptionnel en matière d’implants accommodatifs.
Ainsi, Küchle présentait dès 2001 [20] une première étude portant sur six yeux implantés de façon unilatérale avec le 1CU® et suivis sur une période allant de trois à six mois. Ces résultats préliminaires étaient encourageants, avec une accommodation mesurée par rétinoscopie dynamique et s’étalant entre 0,625 D et 1,875 D. L’acuité visuelle de près avec la correction de vision de loin variait de Jaeger 16 (chez un patient atteint de DMLA) à Jaeger 4.
Sauder [40] rapporte quelques années plus tard une étude portant sur quarante patients opérés de cataracte et affectés de façon randomisée soit au groupe recevant l’implant 1CU® soit au groupe équipé d’un implant monofocal, avec un suivi moyen de huit mois et demi. Dans le groupe 1CU®, l’amplitude moyenne d’accommodation mesurée est de 1,01 D contre 0,5 D dans le groupe contrôle et s’accompagne d’une réduction de profondeur de la chambre antérieure de 820 µm (± 300) contre 400 µm (± 320) dans le groupe contrôle, avec une corrélation significative entre la réduction de la chambre antérieure et l’amplitude d’accommodation mesurée.
En 2007, Utthoff [44] publie une très large étude prospective non randomisée portant sur cinq cent cinquante-trois yeux équipés de l’implant 1CU® comparés à un groupe témoin de deux cent dix-neuf yeux équipés d’un implant monofocal non accommodatif, les analyses de résultats étant réalisées à un mois, six mois et un an après l’intervention. Alors qu’il n’existait pas de différence entre les deux groupes en termes de meilleure acuité visuelle corrigée de loin, l’acuité visuelle de près avec la correction de vision de loin était assez proche dans les deux groupes, à 0,41 (4,1/10) dans le groupe 1CU® contre 0,35 dans le groupe témoin, ce qui ne représente en moyenne qu’une demi-ligne de plus dans l’échelle d’acuité visuelle de près pour le 1CU®. La mesure du parcours accommodatif montrait une différence de 11 cm dans le groupe 1CU® et la courbe de défocalisation montrait une tolérance de 0,25 D dans le groupe 1CU® et une tolérance nulle dans le groupe témoin. Les auteurs soulignent cependant la non-prédictibilité de l’effet accommodatif (ou pseudo-accommodatif), avec de grandes variations mesurées d’un patient à l’autre, ainsi que la nécessité d’un excellent centrage capsulaire de l’implant, des problèmes de décentrement ou de tilting ayant conduit à l’explantation dans trois cas.
En 2003, Mastropasqua et Toto [26] présentent une publication enthousiasmante, randomisée et en double aveugle, comparant de nouveau le 1CU® à un implant monofocal standard. L’étude porte sur quarante-deux yeux répartis entre les deux groupes et suivis du septième jour à six mois. Les résultats sont plutôt bons en vision de près, avec une acuité visuelle moyenne à Jaeger 5,43 au septième jour, Jaeger 2,33 à un et trois mois et Jaeger 3,66 à six mois, alors que dans le groupe contrôle, l’acuité visuelle de près varie entre Jaeger 7 et Jaeger 8 (Jaeger 7,43 en moyenne) pendant toute la durée du suivi. Les mesures d’accommodation rapportées laissent cependant un peu dubitatif et soulèvent de légitimes interrogations sur la méthodologie employée. En effet, si cette amplitude varie dans le groupe 1CU® à 1,14 D au septième jour, 2,36 D à un et trois mois et 1,90 D à six mois, ce qui peut être considéré comme un excellent résultat, elle est tout simplement mesurée à 0 D dans le groupe contrôle ! Les mêmes auteurs publient cependant en 2007 les résultats à long terme, portant cette fois-ci sur quatorze des yeux 1CU® de leur première série suivis pendant deux ans [25] avec, cette fois-ci, un enthousiasme beaucoup plus mesuré. En effet, ils notent une diminution des performances visuelles de loin comme de près, en grande partie liée à l’apparition d’une opacification capsulaire antérieure et postérieure dont l’incidence n’est que de 28 % (antérieure) et 21 % (postérieure) à six mois, mais qui est constante à un an de l’intervention. Après deux ans, 100 % des yeux étudiés ont subi une capsulotomie au YAG, permettant à l’acuité visuelle de loin de remonter à un niveau de 7/10 sans correction et à 10/10 avec correction. En revanche l’acuité visuelle de près avec la correction de loin ne passe que de Jaeger 8,1 à Jaeger 7,3 après capsulo tomie. L’amplitude d’accommodation qui était mesurée à 1,9 D à six mois chute ainsi à 0,3 D (± 0,2) à un an et à deux ans.
Dogru et Honda arrivent aux mêmes conclusions dans une étude publiée en 2005 [9], portant sur vingt-deux yeux implantés avec le 1CU® comparés à un groupe témoin de vingt yeux. Les auteurs notent un effet accommodatif avec le 1CU®, dont l’amplitude maximale atteint 0,5 D au troisième mois postopératoire, mais décroît à partir du sixième mois et devient indétectable à douze mois parallèlement au développement d’une intense opacification capsulaire antérieure et postérieure.
Wolffsohn [49] rapporte également les mêmes constatations après un suivi de deux ans et note dans sa série une diminution de l’acuité visuelle de près, qui passe de 0,60 à 0,72 logMAR malgré une légère myopisation moyenne de 0,26 D. Il existe également une réduction de l’amplitude d’accommodation objective mais qui reste cependant mesurée à 0,52 D alors qu’elle atteignait 0,71 D dans la période post opératoire précoce. À noter également dans cette étude des mesures beaucoup plus favorables pour l’accommodation subjective, qui passe de 2,2 D initialement à 1,95 D à deux ans, ce que les auteurs attribuent à la fois à la nature asphérique de l’implant et à la profondeur de champ accrue des yeux présentant un faible diamètre pupillaire.
Pour Menapace et Findl [31], l’hypothèse initiale de fonctionnement de l’implant 1CU® s’avère inappropriée. En effet, la fibrose capsulaire qui se développe essentiellement au cours des trois premiers mois postopératoires met en tension et immobilise ainsi rapidement le diaphragme formé par le sac capsulaire et l’implant. En outre, le diamètre anatomiquement variable de la lumière du corps ciliaire d’un patient à un autre, alors que l’implant a un diamètre fixe, explique que les forces de compression des haptiques puissent être insuffisantes et inopérantes en matière de bascule antérieure de l’implant. Par ailleurs, la fibrose capsulaire et l’épaississement qui en résulte ont toutes les raisons de faire disparaître toute trace d’élasticité de la capsule cristallinienne, dont la présence supposée est nécessaire pour comprimer l’implant lors de la relaxation zonulaire.
Les auteurs confirment les taux très élevés de capsulotomies, qui n’améliorent pas les performances accommodatives de l’implant, et rapportent en outre plusieurs cas de complications de la fibrose capsulaire à type de déformations importantes des haptiques de l’implant, se repliant sur l’optique et responsables d’un déplacement ou d’un tilting de l’optique ayant pour conséquence une hypermétropisation sévère ou un astigmatisme. Dans leur série, quatre cas sur soixante-quatorze ont ainsi nécessité une explantation.
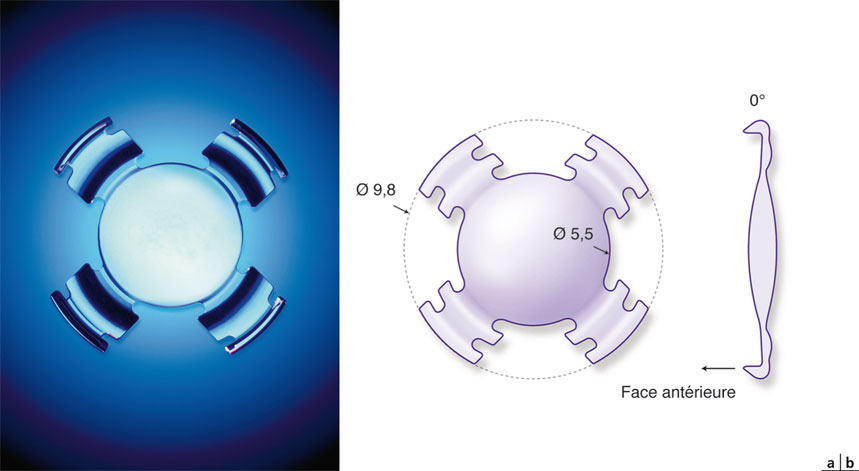
Fig. 12-8 Implant 1CU®.
a. Implant. b. Caractéristiques géométriques.
(Avec l’aimable autorisation de HumanOptics.)
Développé en coopération avec Helmut Payer, il fait également partie des implants accommodatifs de première génération, puisqu’il fut mis sur le marché à la fin des années quatre-vingt-dix. Avec une optique de 5,8 mm de diamètre et une haptique circulaire discontinue percée de plusieurs trous, cet implant en acrylique hydrophile fut proposé en deux versions :
– le modèle 43A avec un diamètre hors-tout de 9,8 mm et une angulation de 10° entre l’optique et l’haptique ;
– le modèle 43E avec un diamètre hors-tout de 10,2 mm et une angulation antérieure de 12° initialement mais qui est maintenant passée à 5° dans la dernière version (fig. 12-9), afin de réduire l’incidence de l’opacification capsulaire postérieure.
Son design à anse circulaire est destiné à faciliter son centrage dans le sac capsulaire. La zone d’interruption de l’anse circulaire est celle où le pliage de l’implant doit avoir lieu lors de sa mise en place dans la cartouche de l’injecteur.
Comme les autres implants à optique unique, la compression de l’haptique circulaire lors de la contraction du muscle ciliaire est censée entraîner une bascule vers l’avant de l’optique.
Les études cliniques concernant cet implant sont peu nombreuses et on manque en particulier de données cliniques évaluant les niveaux d’acuité visuelle de près obtenus avec le port de la correction de vision de loin.
Deux études ont cependant évalué, avec des résultats sensiblement différents, le shift antérieur de l’implant en réponse à une stimulation pharmacologique. Legeais et al. [21] ont analysé, un mois après chirurgie, les variations de profondeur de la chambre antérieure, d’une part après instillation de pilocarpine à 2 % simulant une contraction du muscle ciliaire et, d’autre part, après instillation de cyclopentolate, la différence des deux mesures permettant d’évaluer le parcours de l’optique de la relaxation maximale à la contraction maximale du muscle ciliaire. La valeur moyenne du shift (déplacement) observé et mesuré avec un biomètre est de 710 µm.
En utilisant les mêmes stimulations pharmacologiques mais avec des mesures de la chambre antérieure réalisées en interférométrie, Findl [11] retrouve quant à lui un shift antérieur moyen de 222 µm avec le 43E et 116 µm avec le 43A. Dans cette publication, les mouvements antérieurs de l’implant étaient en outre comparés à ceux observés avec des implants conventionnels, montrant une chambre antérieure stable avec un implant en PMMA et une tendance, au contraire, à l’approfondissement du fait d’un shift postérieur avec deux modèles d’implants souples étudiés, l’Acrysof® et le Sensar® AR40 (fig. 12-10).
Payer et Reiter [35] ont rapporté l’expérience sur cinq ans de l’implant 43E sur une série de 1 900 yeux de 1 400 patients, opérés entre 1996 et 2002, avec une durée d’observation moyenne de deux ans et demi. Ils notent un taux élevé de capsulotomie, puisqu’il atteint 40 % à trois ans, ce taux élevé étant à l’origine de la réduction de l’angulation entre l’optique et l’haptique dans la toute dernière version de l’implant. L’amplitude d’accommodation est évaluée en moyenne à 0,5 D avec les courbes de défocalisation, ce qui est tout à fait cohérent avec les mesures de Findl mesurant un shift antérieur à 222 µm, cette petite amplitude d’accommodation semblant stable au cours du temps. L’addition nécessaire en vision de près est de 2,5 D en moyenne — ce qui, pour les auteurs, est significativement différent des 3 D théoriques — sur l’ensemble des patients, avec des extrêmes à 1,5 D et 3 D.
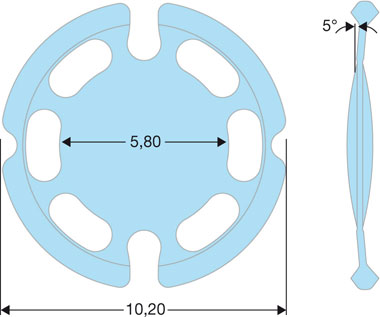
Fig. 12-9 Implant Biocomfold® 43E. Géométrie et dimensions.
(Avec l’aimable autorisation de Morcher.)

Fig. 12-10 Mesure du shift antérieur du Biocomfold® 43E, comparé à celui observé avec d’autres implants.
(Avec l’aimable autorisation de Morcher.)
D’autres implants accommodatifs à optique unique ont été mis au point et commercialisés et certains le sont encore, mais la littérature les concernant est pauvre voire inexistante, en dehors de la communication du laboratoire ou des présentations faites au cours de différents congrès.
Avec le marquage CE depuis septembre 2006, il s’agit d’un implant en acrylique hydrophile formé d’une optique de 5,5 mm, reliée par deux ponts à une haptique circulaire dont le diamètre total varie de 10 à 11 mm (fig. 12-11), avec des pas de 0,2 mm, le diamètre de l’implant étant choisi pour chaque patient, de manière à ce que l’implant occupe l’ensemble du sac capsulaire. L’haptique et l’optique possèdent toutes les deux des bords carrés destinés à limiter l’opacification capsulaire postérieure et ses conséquences visuelles ainsi que la perte de souplesse du sac capsulaire qui en résulte. Lors de l’accommodation, la compression de l’haptique circulaire entraîne un déplacement vers l’avant de l’optique reliée par ses deux ponts au bord de l’haptique (fig. 12-12).
Il n’y a pas d’étude publiée dans les revues scientifiques mais seulement des communications présentées lors de congrès, en particulier celle de J.M. Vargas (Venezuela) présentée à Berlin en 2010 et portant sur cent dix yeux de soixante-quinze patients, cinquante-huit yeux ayant pu être suivis sur deux ans. Les résultats présentés annoncent 72 % d’yeux lisant au moins Jaeger 3 sans correction, le chiffre étant ramené à 62 % lorsque l’acuité visuelle de près est mesurée avec la correction de vision de loin. La réduction de profondeur de la chambre antérieure est mesurée par l’OCT Visante® à 0,890 mm, avec des extrêmes à 0,220 mm et 1,09 mm (fig. 12-13).
Bien entendu, de plus larges séries et la publication d’études multicentriques dans la presse scientifique sont nécessaires pour étayer ces premiers résultats.

Fig. 12-11 Implant Tek-Clear®.
(Avec l’aimable autorisation de Tekia.)

Fig. 12-12 Schéma du fonctionnement théorique de l’implant Tek-Clear®.
a. Au repos. b. Lors de l’accommodation.
(Avec l’aimable autorisation de Tekia.)

Fig. 12-13 Profondeur de chambre antérieure avec l’implant Tek-Clear® en OCT Visante®.
a. Au repos. b. Lors de l’accommodation.
(Clichés de Jose Manuel Vargas, Venezuela.)
Constitué d’une optique pleine de 8,6 mm à 8,9 mm de diamètre (fig. 12-14), destinée à remplir le sac capsulaire, l’implant WIOL-CF® (GelMed, États-Unis ; AMI Care, République tchèque), convexe sur sa face postérieure et plan sur sa face antérieure, affiche des performances accommodatives et/ou pseudo-accommodatives pouvant atteindre 2 D. Il s’agit d’un implant destiné à mimer le comportement du cristallin naturel grâce à son matériau en hydrogel et du fait de son dessin visant à assurer un maximum de contact avec la capsule postérieure.
Il est implantable au travers d’une incision de 2,8 mm dans un état partiellement déshydraté et s’hydrate de façon progressive dans le milieu intraoculaire pour atteindre son volume définitif en quarante-huit heures.
Selon les concepteurs et les utilisateurs de cet implant, ses performances à différentes distances s’expliqueraient par plusieurs mécanismes incluant, d’une part, des mouvements antéropostérieurs et, d’autre part, une modification de forme sous l’effet de la relaxation ou de la tension zonulaires, mais également une certaine part de multifocalité, faisant de cet implant une sorte d’hybride entre implants accommodatifs et implants multifocaux.
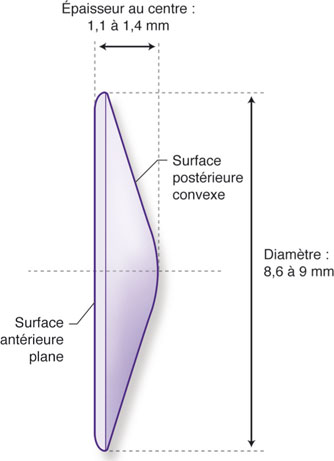
Fig. 12-14 Implant WIOL-CF® (GelMed et AMI Care).
Au total, malgré les données expérimentales confirmant les possibilités de mouvements antérieurs de l’optique lors des efforts d’accommodation, ce concept d’implant accommodatif à optique unique se heurte d’abord à la limitation de l’amplitude d’accommodation en fonction de la puissance de l’implant, favorisant les hypermétropes et limitant l’amplitude d’accommodation chez les myopes équipés d’implants de faible puissance dioptrique. En effet, si on se rappelle l’équation ΔDc = (Dm/13) × Δs, on comprend aisément que l’amplitude d’accommodation est directement proportionnelle à la puissance de l’implant et qu’elle peut ainsi varier, pour un même déplacement antérieur de 1 mm, de 1,2 D pour un implant de 15 D à 1,9 D pour un implant de 25 D. Or, les études publiées montrent que le déplacement antérieur maximal mesuré après stimulation par la pilocarpine [40] n’est que de 0,8 mm et que cette mesure ne dépasse pas 0,33 mm [24] lorsqu’on utilise un stimulus visuel et non pas pharmacologique pour reproduire le phénomène accommodatif. Le potentiel accommodatif de ces implants à optique unique apparaît dès lors relativement limité. En outre, plusieurs publications ont pointé la perte d’effet accommodatif avec le temps malgré des résultats initiaux parfois prometteurs [9, 25]. Si l’opacification capsulaire postérieure et la fibrose du sac capsulaire sont probablement impliquées dans la perte d’efficacité accommodative de ces implants, le polissage soigneux du sac capsulaire avec l’implant Crystalens® [17] comme avec l’implant 1CU® [12] n’a cependant pas montré de résultats supérieurs en termes d’amplitude accommodative. De plus, ces deux implants ne possèdent pas de bord carré au niveau des jonctions entre l’optique et les haptiques, ce qui permet aux cellules épithéliales de croître et d’atteindre la zone rétro-optique.
L’analyse de la littérature montre, pour ces implants, des différences importantes de résultats qui méritent une analyse précise de la méthodologie employée. La seule expression de l’acuité visuelle de près sans correction n’a que peu de valeur si cette acuité visuelle de près n’est pas mesurée avec la correction de vision de loin.
Il faut en outre s’attacher aux méthodes employées pour mesurer de façon objective les mouvements antérieurs de l’implant : dans les études publiées, la méthode utilisée pour mesurer les variations de la profondeur de chambre antérieure lors des efforts accommodatifs est très variable, même si l’interférométrie est sans doute aujourd’hui la méthode la plus précise, en particulier du fait du caractère parfaitement axial des mesures réalisées. Enfin, l’apparente efficacité clinique de ces implants, observée dans un certain nombre de publications, n’est pas imputable à la seule translation antérieure de l’optique de l’implant, mais s’explique également par des phénomènes de flexion ou d’arching de l’optique de l’implant, augmentant son asphéricité et, par voie de conséquence, la profondeur de champ de l’œil implanté.
La mise au point d’implants à double optique avait pour motivation essentielle le désir de résoudre le principal inconvénient des implants à optique unique, c’est-à-dire la limitation de l’amplitude d’accommodation liée à la puissance de l’implant lui-même. D’où l’idée d’un implant à double optique dont l’optique postérieure serait neutre, voire négative, et dont l’optique antérieure de forte puissance aurait un pouvoir de mobilité qui, même limitée, serait à l’origine d’une forte amplitude d’accommodation.
Le premier implant accommodatif à double optique fut imaginé au Japon, avec une publication dès 1990 par Hara, Yasuda et Yamada [14, 15], sous le nom d’« implant à ressort », présentant deux optiques en PMMA de 6 mm écartées de 4,4 mm et quatre haptiques flexibles. Seule l’optique antérieure possédait, dans ce modèle, un pouvoir optique, l’optique postérieure ne servant que de plateau pour limiter les mouvements de l’optique antérieure. Il ne connut apparemment qu’une courte expérimentation chez le lapin, chez lequel aucune accommodation ne put être démontrée.
D’autres implants ont ensuite vu le jour, en particulier l’implant Synchrony® et l’implant de Sarfarazi.
Avec un marquage CE depuis juin 2006 et en phase III d’essais cliniques pour la FDA, l’implant Synchrony® fut mis au point par une start-up californienne, la société Visiogen. Il est maintenant la propriété d’Abbott Medical Optics (AMO) qui a absorbé Visiogen en 2009. Il est le premier implant accommodatif à double optique implanté dans un œil humain.
Il s’agit d’un implant en silicone, dont les dimensions horizontales et verticales sont respectivement de 9,8 mm et 9,5 mm (fig. 12-15). Il est injectable par une incision de 3,8 mm grâce à un injecteur spécifique (fig. 12-15c), ce qui ne le rend pas compatible avec la mini-incision. L’implant est destiné à remplir l’ensemble du sac capsulaire, l’espace entre les deux optiques étant occupé par l’humeur aqueuse.
L’optique antérieure a un diamètre de 5,5 mm et une puissance dioptrique positive fixe de 32 D. L’optique postérieure mesure 6 mm de diamètre et sa puissance est négative, déterminée par la situation réfractive du patient. Les deux optiques sont réunies par quatre articulations construites de façon à générer un effet ressort. Pour faciliter la circulation d’humeur aqueuse dont le volume entre les deux optiques est censé varier selon le degré d’accommodation, des protubérances ont été ajoutées sur l’optique antérieure, afin de l’éloigner du bord du capsulorhexis, ce qui préserve ainsi en permanence une voie de passage pour l’humeur aqueuse. L’objectif est également de maintenir la capsule antérieure en tension, afin d’éviter les adhérences et les risques de frottement. L’optique postérieure est quant à elle équipée de petites ailettes souples destinées à promouvoir un centrage optimal de l’implant, quel que soit le diamètre du sac cristallinien.
Lorsque le muscle ciliaire est au repos en vision de loin, le sac cristallinien est, au contraire, mis en tension, comprimant les optiques. Cette compression génère une énergie qui est « stockée » dans les articulations entre les optiques. Lors de la contraction du muscle ciliaire, le relâchement de la zonule permet à cette énergie de se libérer, avec pour conséquence un déplacement antérieur de l’optique antérieure (figure animée 12-2).
Afin de maîtriser un écartement minimal entre les deux optiques en position de repos, donc de tension du sac, des séparateurs ont été intégrés et l’épaisseur totale des deux lentilles ne peut descendre en dessous de 2,2 mm. À l’inverse, en effort accommodatif maximal, la construction des haptiques permet aux optiques de former entre elles un espace qui peut atteindre 1,5 mm.
Le fait que la lentille en mouvement soit de forte puissance augmente bien évidemment l’amplitude d’accommodation produite par le déplacement antérieur de cette lentille, et les mesures en ray-tracing permettent de mesurer le résultat et de le comparer à l’accommodation produite par un système monolenticulaire à pouvoir dioptrique globalement équivalent (fig. 12-16). On voit ainsi que, pour un implant de puissance moyenne de 20 D, l’accommodation produite par un déplacement antérieur de 1 mm passe de 1,25 D pour une optique unique à 2,25 D avec la double optique [29].
Cette construction de l’implant avec deux optiques, l’une positive et l’autre négative, rappelle évidemment le principe optique du télescope de Galilée, à ceci près que, dans ce dernier, la position respective des deux lentilles est destinée à produire une magnification de l’image, ce qui n’est pas le cas dans l’implant Synchrony®. Il existe cependant une légère augmentation de la taille de l’image rétinienne, qui dépend de la longueur de l’œil et qui peut ainsi aller de 1 % pour les yeux courts à 2,5 % en cas de grande myopie axile, avec une moyenne qui est évaluée à 2,16 % pour les yeux de longueur axiale moyenne.
L’aniséiconie induite n’est cependant pas un obstacle à une implantation unilatérale, car elle est comparable à celle qui est induite par une lentille de contact chez un aphaque et reste au-dessous du seuil de 5 %, en deçà duquel on considère qu’il n’y a pas de risque de perturbation significative de la vision binoculaire.
Cette majoration de la taille de l’image n’a, d’autre part, que peu d’incidence sur les performances de l’implant en vision de près, si l’on considère qu’il faudrait une magnification de 25 % pour améliorer d’une ligne l’acuité visuelle de près.
Enfin, la composition en silicone de cet implant est vraisemblablement de nature à réduire le taux d’opacification capsulaire mais, surtout, d’opacification interlenticulaire telle que celle qui peut compliquer une implantation en piggyback et dont plusieurs publications [45, 13] tendent à montrer la faible incidence lorsque les deux lentilles sont en silicone — le risque maximal d’opacification interlenticulaire étant classiquement observé avec deux optiques en acrylique hydrophobe.
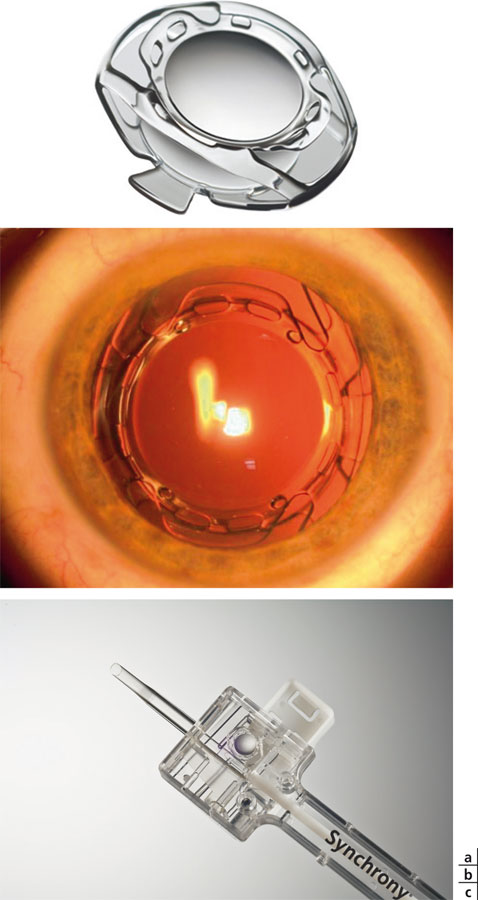
Fig. 12-15 Implant Synchrony®.
a. Implant. b. Implant en place.
c. Injecteur pour l’implant Synchrony®.
(Avec l’aimable autorisation d’Abbott Medical Optics.)

Fig. 12-16 Mesures en ray-tracing de l’effet accommodatif produit par un déplacement antérieur de 1 mm selon que l’optique est simple ou double.
L’accommodation induite est constante avec l’implant à double optique, puisqu’elle dépend de la puissance de l’optique antérieure qui est fixe à 32 D.
Avant la première utilisation du Synchrony® chez l’homme, plusieurs prototypes furent proposés et une étude de biocompatibilité fut réalisée chez le lapin [46]. Elle consistait à opérer dix lapins implantés d’un côté avec le Synchrony® et de l’autre côté avec un implant standard en silicone. L’objet de l’étude était d’évaluer la biocompatibilité de cet implant dessiné pour assurer une bonne expansion dans le sac capsulaire, tout en minimisant les contacts avec la capsule antérieure. Les éléments analysés étaient l’opacification capsulaire antérieure et postérieure et la fibrose capsulaire éventuellement responsable de phénomènes de phimosis au niveau du rhexis. Les conclusions de cette étude furent la quasi-absence de fibrose capsulaire et d’opacification capsulaire antérieure, ainsi que des niveaux significativement plus bas d’opacification capsulaire postérieure dans les yeux implantés avec le Synchrony®.
La première étude clinique portant sur l’évaluation du Synchrony® chez l’homme fut publiée en 2007 dans J Cataract Refract Surg [34] et portait sur vingt-six yeux de vingt et un patients, avec un groupe témoin de dix patients équipés avec un implant monofocal en acrylique hydrophobe ou en silicone. Parmi les vingt-six yeux implantés, deux furent exclus, l’un du fait du décès rapide du patient par pneumonie et l’autre en raison d’une explantation motivée par un décentrement de l’implant, mis en relation avec le trop grand diamètre du capsulorhexis. Les vingt-quatre yeux restants furent suivis : tous présents à six mois et onze yeux analysables au terme de l’étude, c’est-à-dire à un an. À six mois, dix-sept yeux (71 %) étaient à ± 1 D de l’emmétropie et dix-neuf yeux (79 %) avaient une acuité visuelle sans correction d’au moins 5/10. Les cinq autres yeux avaient une acuité visuelle sans correction réduite par un astigmatisme lié à l’incision ou à une myopie résiduelle. Tous les yeux dépassaient 5/10 de meilleure acuité visuelle corrigée de loin. En vision de près, des résultats plutôt encourageants sont rapportés tout au long du suivi. En effet, à six mois, tous les yeux avaient au moins Jaeger 3 sans correction, dont vingt-trois (96 %) avec le port de la correction de loin, et dix-sept yeux atteignaient Jaeger 1 sans correction. Au bout d’un an, les résultats présentés restent satisfaisants, avec onze yeux (100 % des yeux examinés à un an) avec au moins Jaeger 3 avec la correction de loin, dont sept (64 %) à Jaeger 1. Les courbes de défocalisation réalisées à six mois montraient une amplitude d’accommodation significativement plus élevée dans le groupe Synchrony® à 3,22 D ± 0,88 (avec des extrêmes de 1,00 D à 5,00 D) contre 1,65 D ± 0,65 (extrêmes de 1,00 D à 2,5 D) dans le groupe témoin. Sur le plan anatomique, l’examen en lampe à fente montrait à six mois une opacification capsulaire antérieure légère à modérée dans quatre cas (16,6 %) et une opacification capsulaire postérieure évidente dans un œil (4,2 %), sans toutefois qu’une capsulotomie au YAG ait été réalisée au cours de l’étude. Les auteurs concluaient donc au caractère encourageant des résultats de cette étude pilote, tout en admettant les limites de leur méthodologie, en particulier l’absence de mise en évidence objective des déplacements de l’implant et de la séparation entre les deux optiques au cours des efforts accommodatifs. L’absence de ces mesures objectives présente l’inconvénient de ne pas pouvoir exclure l’existence de phénomènes de pseudo-accommodation expliquant les performances de l’implant en vision de près.
Une publication cite brièvement le Synchrony® en 2008 [10]. Il s’agit d’une étude visant à valider un nouveau dispositif destiné à stimuler et à mesurer l’accommodation, testé dans différentes situations, qu’il s’agisse de sujets jeunes et phaques ou de sujets plus âgés et pseudophaques équipés soit avec un implant monofocal en acrylique hydrophobe soit avec l’implant Synchrony®. L’échantillon analysé est très réduit mais permet de mesurer une accommodation « négative » de – 0,5 D avec le monofocal, attribuée à une translation postérieure de l’implant, et une accommodation évaluée à + 1 D pour l’implant Synchrony®.
Plus récemment, en novembre 2010, Bohorkez et Alarcon (Bogota) ont publié leurs résultats à un an et à deux ans d’implantations bilatérales avec l’implant Synchrony® [5]. Il s’agit là encore d’une étude portant uniquement sur les performances visuelles de quinze patients, mesurées en vision binoculaire. La méthode utilisée était proche du MNRead Test, adapté en langue espagnole, et consistait à mesurer la vitesse de lecture de phrases présentées à 40 cm de distance sur des planches dont les caractères sont de tailles décroissantes, allant de 1 à 0 logMAR, et correspondant donc à des acuités visuelles de près croissantes de 20/200 à 20/20. Il apparaît dans cette étude que les performances de lecture en vision de près sont non seulement stables, mais qu’il existe même une amélioration à deux ans par rapport aux mesures faites à un an. La vitesse de lecture est en effet significativement meilleure à deux ans pour les caractères compris entre 0,3 et 0,1 logMAR. L’acuité visuelle moyenne de près passe de 0,15 logMAR à un an à 0,07 logMAR à deux ans. Enfin, la taille critique de caractères, définie comme étant celle qui ralentit la lecture au-dessous de 75 % de la meilleure vitesse enregistrée, passe de 0,48 logMAR à un an à 0,28 logMAR à deux ans. Les auteurs signalent quatre cas d’opacification capsulaire antérieure et postérieure, faible à modérée, sans aucune capsulotomie au YAG au cours de l’étude. Enfin, aucun cas d’opacification interlenticulaire n’est observé dans cette série.
Développé par F. Mona Sarfarazi avec le laboratoire Shenasa, les droits de marketing, de développement et de production de cet implant ont été acquis en 2003 par Bausch & Lomb qui a, depuis, renoncé à ce projet.
Il s’agit encore d’un implant monobloc en silicone, formé de deux optiques de 5 mm de diamètre réunies par trois haptiques (fig. 12-17), avec un design elliptique destiné à épouser la forme naturelle du sac capsulaire.
La principale publication porte sur son utilisation chez le singe rhésus [27], in vitro et in vivo. L’expérience in vitro permit de confirmer la possibilité pour les deux optiques de l’implant de se rapprocher lors de la mise en tension de la capsule cristallinienne et, au contraire, de s’éloigner jusqu’à 2,13 mm lors du relâchement capsulaire. In vivo, l’amplitude d’accommodation après stimulation pharmacologique fut mesurée dans trois yeux entre 6,25 D et 8 D, avec mesure parallèle d’une réduction de la profondeur de la chambre antérieure et d’un écartement entre les deux optiques de l’implant.
Les études portant sur l’utilisation humaine de cet implant font cependant cruellement défaut. Il semble même que son développement ait été abandonné.

Fig. 12-17 Implant de Sarfarazi.
Développé par M.C. Rombach et A.N. Simonov [42] (laboratoire AkkoLens International, Pays-Bas), il s’agit d’un implant à double optique mais dont le principe de fonctionnement est radicalement différent des deux précédents.
Le principe cet implant repose sur la superposition de deux surfaces optiques cubiques dont le glissement longitudinal, l’une part rapport à l’autre, produit un effet accommodatif par augmentation progressive de la puissance du système.
En optique, une surface cubique — qui n’a rien à voir avec la forme d’un cube — est une variété de surface algébrique, cette notion définissant une surface optique qui possède une équation cartésienne polynomiale à coefficients réels. Une surface algébrique est définie par son degré, ou son ordre, qui est le degré du polynôme P de l’équation Px :
– une surface algébrique de degré 1 est un plan ;
– une surface algébrique de degré 2 est une quadrique ;
– une surface algébrique de degré 3 est une surface cubique ;
– le degré 4 définit une surface quartique, etc.
En pratique, les deux surfaces cubiques de l’implant Akkolens® ont une forme un peu arrondie rappelant celle d’une selle (fig. 12-18). Une image transmise au travers d’une seule de ces surfaces cubiques serait totalement brouillée et déformée. En revanche, ces deux surfaces combinées forment une lentille sphérique et, surtout, si ces deux surfaces se déplacent l’une part rapport à l’autre, la puissance totale de la lentille est modifiée, l’augmentation de puissance pouvant atteindre 3,5 D.
Sur le plan pratique, l’implant est composé de deux lentilles en acrylique hydrophile capables de glisser l’une sur l’autre (fig. 12-19). Sa gamme de puissances va de 15 D à 22 D et — chose tout à fait inhabituelle aujourd’hui — il est destiné à être implanté dans le sulcus, afin d’être au plus près du muscle ciliaire. Le principe de fonctionnement de cet implant ne fait donc pas du tout intervenir le sac cristallinien et repose sur une action directe du muscle ciliaire sur les haptiques de l’implant (figure animée 12-3). Il n’y a donc a priori pas à craindre de perte d’efficacité dans le temps du fait de la fibrose et de l’opacification du sac capsulaire, si le muscle ciliaire garde ses capacités de contraction.

L’injecteur utilisé permet de le faire passer au travers d’une incision de 2,8 mm.
Une étude multicentrique de cet implant est actuellement en cours mais ses résultats, qui seraient prometteurs d’après le laboratoire, ne sont pour l’instant pas encore disponibles.
Fig. 12-18 Schéma de l’implant Akkolens®.
1, lentille sphérique en face postérieure corrigeant les défauts réfractifs de l’œil. 2, première surface cubique destinée à produire l’effet varifocal. 3, seconde surface cubique. 4, surface antérieure plane. 5, haptiques.
(Avec l’aimable autorisation de M.C. Rombach, laboratoire AkkoLens International.)

Fig. 12-19 Implant Akkolens®.
a. Implant. b. Injecteurs pour l’implant Akkolens®. L’injecteur jaune permet de passer à travers une incision de 2,8 mm pour une chirurgie sans suture.
(Avec l’aimable autorisation de M.C. Rombach, laboratoire AkkoLens International).
À côté des implants à simple ou à double optique, et grâce à l’inventivité humaine sans limites, un certain nombre d’autres concepts d’implants accommodatifs ont été proposés, la plupart d’entre eux fondés sur l’idée d’une optique se déformant lors de l’accommodation, de façon à augmenter sa puissance.
Développé par la société NuLens (Herzliya Pituach, Israël), il s’agit là aussi d’un implant destiné à être placé dans le sulcus ciliaire. Sa structure comporte des haptiques en PMMA destinées à assurer une fixation stable sans sutures dans le sulcus, une lentille en PMMA réglée pour la vision lointaine, une petite chambre contenant un gel en silicone flexible et un piston situé en position postérieure, destiné à être mis en action par le sac cristallinien vide et collabé (fig. 12-20). Lorsque le piston pousse la chambre en silicone au travers d’un orifice central dans la structure en PMMA, la saillie du silicone augmente la puissance centrale de l’implant, permettant de faire la mise au point sur une cible rapprochée.
La forme initiale de cet implant nécessitait une incision de 9 mm, alors qu’un dessin plus récent permet de réduire la taille de l’incision à 3,5 ou 4 mm.
En outre, dans le premier modèle proposé pour cet implant, la position de vision de près de l’implant correspondait à la relaxation du muscle ciliaire, alors que la position de vision de loin était obtenue lors de l’effort accommodatif, ce qui n’était pas sans problème potentiel du fait du réflexe accommodation-convergence, induisant avec cet implant une convergence en vision de loin et une divergence en vision de près et, donc, de prévisibles difficultés de vision binoculaire. Les concepteurs de l’implant suggéraient qu’il était possible, avec une période d’adaptation plus ou moins prolongée, de découpler l’accommodation et la convergence, mais il semble cependant que le modèle le plus récent ait permis d’inverser le mécanisme et de revenir ainsi à un mode de fonctionnement plus physiologique.
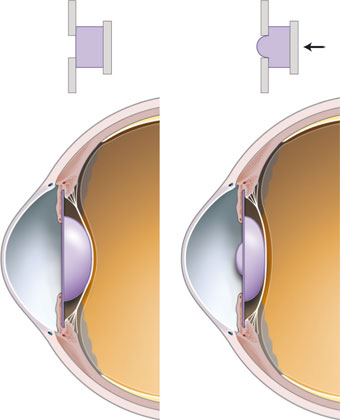
Fig. 12-20 Schéma de fonctionnement de l’implant NuLens® (NuLens Ltd).
Lors de l’accommodation, la pression du piston sur la chambre en silicone entraîne une protrusion du silicone à travers l’orifice de la structure en PMMA, augmentant ainsi la puissance dioptrique du système.
L’implant NuLens® (récemment baptisé Dynacurve®) a d’abord été évalué et essayé chez le primate [4]. Avec le prototype testé et dont les variations accommodatives étaient mesurées en UBM, l’utilisation d’agents pharmacologiques induisant un spasme ciliaire (pilocarpine) ou une cycloplégie (cyclopentolate) permit de mesurer une puissance d’implant passant de 9 D à 53 D, correspondant donc à une amplitude d’accommodation de plus de 40 D, la puissance maximale de 53 D étant effectivement obtenue avec ce premier prototype lors de la relaxation maximale du muscle ciliaire.
J. Alió a présente en 2009 dans le J Cataract Refract Surg une étude portant sur dix patients implantés de façon unilatérale avec l’implant NuLens® [2]. Il s’agissait dans cette étude de dix patients présentant une cataracte et une DMLA atrophique. Pour chaque patient, l’intervention était réalisée sur l’œil ayant l’acuité visuelle la plus médiocre et les patients étaient suivis pendant une année. Les mesures faites en UBM permettaient d’objectiver l’augmentation d’épaisseur centrale de l’implant maximale à 0,21 mm à trois mois, puis se stabilisant à 0,09 mm à partir du neuvième mois, correspondant, du fait de la réduction du rayon de courbure du centre de l’implant, à une accommodation de 10 D.
Une évaluation subjective de l’accommodation était également réalisée dans cette étude, aboutissant à ce chiffre de 10 D, du fait d’une légère amélioration des performances de vision de près, en dépit de la maculopathie, lors de la lecture à 10 cm avec la correction de vision de loin.
Cet implant pourrait obtenir rapidement le marquage CE, mais son éventuelle approbation par la FDA ne devrait pas pouvoir intervenir avant 2014.
Plusieurs questions restent en suspens, en particulier celle des aberrations optiques induites par ce type d’implant et la question cruciale des conséquences des modifications structurelles du sac capsulaire sur l’évolution des performances de l’implant.
Destiné à être placé dans le sac capsulaire, l’implant Fluid Vision® (PowerVision, Californie) est constitué d’haptiques et d’une optique de structure creuse, permettant un déplacement liquidien à l’intérieur de l’implant en réponse à la mise en action du muscle ciliaire (fig. 12-21).
En vision de loin, la relaxation du muscle ciliaire n’entraîne qu’une pression réduite sur les haptiques par l’intermédiaire de la région équatoriale de la capsule, et les haptiques restent pleines. À l’inverse, lors de la contraction du muscle ciliaire, le diamètre équatorial de la capsule se réduit grâce à la relaxation zonulaire, ce qui a pour conséquence d’augmenter la pression sur les haptiques de l’implant, avec pour résultat un déplacement liquidien des haptiques vers l’optique qui augmente alors de volume, avec un bombement qui augmente sa puissance optique.
Cet implant en est encore pour l’instant aux premiers stades de son développement et il n’existe pas de publication permettant d’en apprécier les résultats. Les présentations faites par le laboratoire annoncent une amplitude d’accommodation qui pourrait atteindre 10 D.

Fig. 12-21 Implant Fluidvision®.
(Avec l’aimable autorisation de PowerVision.)
Développé par Alain Grazier, l’implant LiquiLens® (Vision Solution Technologies, Maryland, Californie) est composé de deux liquides non miscibles possédant des indices de réfraction différents, dont la répartition dans l’optique dépend de la gravité. L’essentiel du volume de l’optique, environ 75 %, est occupé par un liquide de faible indice de réfraction ; le liquide à fort indice de réfraction flotte au-dessus du premier et reste à distance de l’axe optique en vision éloignée (fig. 12-22a). En vision rapprochée, à condition que le regard se dirige vers le bas, ou d’ailleurs vers le haut, l’axe optique traverse le milieu à fort indice (fig. 12-22b), ce qui augmente de façon très significative la puissance optique du système, jusqu’à 30 D selon son concepteur, justifiant son indication chez des patients présentant une DMLA, mais une variante de cet implant est également proposée comme système de compensation de la presbytie après chirurgie de la cataracte, avec l’objectif de produire plus de 5 D d’accommodation.
Cet implant se comporte en fait d’ailleurs plus comme un implant bifocal et reste, dans cet usage, dépendant de la position de la tête, ce qui ne réalise par véritablement une situation d’indépendance aux lunettes. Il a l’avantage sur le plan conceptuel de ne pas dépendre de l’activité du muscle ciliaire, ni de la persistance de l’élasticité du sac cristallinien.
Des essais cliniques de cet implant pourraient débuter en Europe à court terme.

Fig. 12-22 Implant LiquiLens®.
a. En vision de loin. b. En lecture de près.
(Avec l’aimable autorisation de Vision Solution Technologies.)
L’implant FlexOptics® (Quest Vision Technologies, Californie), qui en est encore au stade de développement, est un implant en silicone à simple optique conçu pour se modifier sous l’action du muscle ciliaire, en associant un mouvement antérieur de l’optique et une augmentation de sa courbure antérieure. De forme creuse comme un ballon, avec une optique située à sa partie antérieure, il est censé reproduire le comportement du cristallin naturel en réponse à la contraction du muscle ciliaire avec, en particulier, une augmentation de sa courbure antérieure. Selon son indice de réfraction, son amplitude d’accommodation maximale pourrait varier de 3,3 D à 4,5 D.
Beaucoup de travaux ont été consacrés au cours des dernières années au concept du phako-ersatz, désignant le fait de vider le sac capsulaire de son contenu pour le remplir d’un gel ou d’un polymère souple, polymérisés in situ, et capables, du fait de leur souplesse, d’avoir un comportement dynamique reproduisant le mécanisme de l’accommodation. Les principales difficultés que pose ce concept sont la prévention de l’opacification capsulaire postérieure et la difficulté à ajuster le volume de gel à injecter dans le sac capsulaire pour atteindre la puissance optique désirée. Il faut également assurer une étanchéité évitant les fuites du gel hors du sac capsulaire avant sa polymérisation et être capable, le cas échéant, de procéder à l’ablation du matériel.
Deux nouveaux concepts tentent de répondre à l’essentiel de ce cahier des charges.
Le Smart IOL® (Medennium, Californie) représente aujourd’hui l’implant qui se rapproche le plus du concept de phako-ersatz.
Son originalité repose dans son matériau, un acrylique hydrophile thermoplastique, propriété du laboratoire, qui permet de le présenter sous la forme déshydratée d’un bâtonnet solide d’environ 30 mm de longueur sur 2 mm d’épaisseur, forme sous laquelle limplant est introduit dans l’œil, ce qui se fait donc avec une très grande facilité au travers d’une incision étroite mais également d’un petit capsulorhexis. Confronté à la température intraoculaire, l’implant reprend sa forme initiale en moins d’une minute et « redevient » une lentille biconvexe de 9,5 mm de diamètre sur 2 mm à 4 mm d’épaisseur selon sa puissance dioptrique, elle-même prédéterminée lors de sa fabrication, et avec un design de lentille pleine lui permettant de bien occuper le sac cristallinien (fig. 12-23).
Son hypothèse de fonctionnement est fondée sur la théorie de Helmholtz qui suppose que, lorsque le muscle ciliaire se contracte et entraîne un relâchement zonulaire, le diamètre équatorial du sac cristallinien diminue alors que son épaisseur et sa convexité augmentent.
Le fait de remplir de façon totale le sac capsulaire est a priori intéressant en termes de prévention de la fibrose et de l’opacification capsulaires postérieures, du fait de l’absence d’espace favorisant la migration des cellules épithéliales cristalliniennes. En outre, on peut également espérer limiter les problèmes de décentrement, les effets de bords et, d’une manière générale, les aberrations optiques observées avec les implants de plus petit diamètre.
Il est également permis de penser que ce remplissage complet du sac capsulaire pourrait limiter le risque rhegmatogène de la chirurgie de la cataracte chez le myope fort, du fait de la moindre modification de la configuration du segment antérieur avec ce type d’implant.
Le matériau utilisé possède un indice de réfraction plus élevé que le cristallin naturel, ce qui est censé lui permettre de générer une amplitude d’accommodation importante pour des modifications modérées de forme ou de position de l’implant lui-même.
Cet implant a été testé de manière expérimentale sur des yeux de cadavre, mais il n’existe pas pour l’instant de publication d’essais cliniques chez l’homme, permettant en particulier d’apprécier l’incidence de l’opacification capsulaire postérieure, qui reste jusqu’à présent le principal écueil des techniques de phako-ersatz.

Fig. 12-23 Implant Smart IOL®.
L’implant est sous forme la forme d’un bâtonnet rigide à température ambiante. Introduit dans l’œil, il reprend rapidement sa forme et sa puissance prédéterminées et remplit le cas capsulaire.
Nishi a publié en 2008 [33] un article décrivant l’utilisation expérimentale sur des yeux de cadavres mais également dans une dizaine d’yeux de lapins, d’un système très ingénieux visant à résoudre les deux principales difficultés des modèles de phako-ersatz, c’est-à-dire d’une part la fuite de polymère lors de son injection intraoculaire et, d’autre part, l’opacification capsulaire postérieure.
La première version proposée de son implant est une lentille en silicone flexible de 9 mm de diamètre en tout et de 6 mm d’optique (fig. 12-24). Cette lentille est équipée d’une part d’un petit trou périphérique pouvant donner le passage à une aiguille de 22 G pour l’injection du polymère de silicone et, d’autre part, d’un petit orifice non traversant qui permet d’accrocher l’implant avec un crochet de Sinskey pour le déplacer. Le principe chirurgical consiste à réaliser une phakoémulsification au travers d’un petit rhexis de 3,5 mm à 4,0 mm, à placer l’implant dans le sac capsulaire, puis à l’excentrer pour accéder à l’orifice permettant d’injecter le polymère de silicone et, enfin, à se servir du crochet pour recentrer l’implant, mettant ainsi l’orifice d’injection au contact de la capsule antérieure afin d’éviter les fuites de polymère. Ce dernier est censé se polymériser en deux heures environ après son injection intraoculaire.
Nishi a présenté une variante de ce dispositif utilisant une seconde lentille, à bords carrés, placée en position postérieure et éventuellement associée un capsulorhexis de la capsule postérieure (fig. 12-25), afin de résoudre le problème de l’opacification capsulaire postérieure. Le polymère de silicone est alors injecté entre ces deux lentilles souples en silicone. La lentille postérieure sert à prévenir l’opacification capsulaire postérieure, tandis que la lentille antérieure sert à la fois de support optique et de bouchon pour empêcher les fuites de silicone dans la chambre antérieure.
Sur les dix yeux de lapins étudiés, cinq n’ont pas eu de rhexis postérieur et trois d’entre eux ont eu une opacification capsulaire qualifiée de modérée. Dans les cinq autres yeux, la réalisation d’un rhexis postérieur a empêché la formation d’une membranule, les animaux ayant été examinés dans un délai variant de cinq à huit semaines après l’intervention.
Cette publication conclut en tout cas à la faisabilité du dispositif pour d’éventuelles applications cliniques futures.

Fig. 12-24 Implant de Nishi à simple optique.

Fig. 12-25 Implant de Nishi à double optique.
Afin de pallier l’insuffisance de translation antérieure des implants à simple optique à déplacement passif sous l’effet de la contraction du muscle ciliaire, Preussner [37] avait proposé en 2001 d’utiliser l’énergie répulsive de deux aimants de charge identique pour mobiliser l’optique de l’implant. Le dispositif, un peu complexe, associait plusieurs éléments (fig. 12-26) :
– un implant classique à anses ouvertes ;
– un anneau de tension capsulaire spécial, muni d’ailettes dont les extrémités doivent être soudées l’une à l’autre dans la période postopératoire précoce grâce à l’application d’impacts de laser à l’argon, cet anneau étant également muni de deux micro-aimants destinés à être placés sur le méridien horizontal ;
– deux autres implants suturés à la sclère sous l’insertion de chacun des deux muscles droits verticaux.
Le principe de fonctionnement est le suivant : l’anneau de tension capsulaire est placé dans le sac en avant de l’implant, ses ailettes au contact et en avant de l’optique de l’implant. Lorsque le corps ciliaire se contracte, la zonule se détend, permettant aux implants répulsifs d’interagir et de repousser vers l’avant le complexe formé par le sac capsulaire, l’anneau et l’implant. Lorsqu’au contraire le muscle ciliaire se décontracte, la mise en tension de la zonule plaque les ailettes de l’anneau contre l’optique de l’implant, entraînant un déplacement postérieur de l’implant, cette énergie mécanique liée à la pression des ailettes de l’anneau étant censée être plus forte que l’énergie répulsive des aimants.
Menapace [31] avait présenté un essai clinique de ce dispositif portant sur huit yeux dans lequel il apparaissait que, dans trois cas, les soudures des ailettes de l’anneau n’étaient pas suffisamment solides pour résister aux forces de contraction. En outre, la présence de l’anneau n’empêchait ni le plissement capsulaire ni la migration centrale de cellules épithéliales du cristallin, conduisant à une opacification capsulaire postérieure.
Afin de prévenir ce problème, Menapace [30] proposa de modifier la technique d’implantation en réalisant un capsulorhexis postérieur, associé à une luxation de l’optique de l’implant en arrière du sac capsulaire, dans l’espace de Berger, afin de bloquer la capsule postérieure entre la capsule antérieure et l’implant. En emprisonnant les cellules épithéliales cristalliniennes et en empêchant leur contact avec l’optique de l’implant, on prévient ainsi le processus de fibrose capsulaire, qui ne peut se produire que dans une petite zone triangulaire en contact avec la jonction haptique-optique. Une meilleure mobilité du complexe formé par l’implant et le sac capsulaire peut ainsi théoriquement être préservée, a fortiori si la technique opératoire associe un polissage capsulaire antérieur.
Avec ce concept, l’utilisation d’un anneau de tension capsulaire devient inutile et on peut en revanche intégrer les aimants à la périphérie de l’optique de l’implant, qui sera placé en fin d’intervention, comme pour un implant torique, dans l’axe désiré, c’est-à-dire l’axe horizontal.
Ces deux concepts d’implants à déplacement magnéto-induit n’en sont qu’aux stades initiaux, mais ils portent en eux l’espoir de déplacements antéropostérieurs de plus grande amplitude que ceux observés avec les implants à déplacement passif.
L’implantation de tels dispositifs contre-indiquerait bien entendu la réalisation d’examens en résonance magnétique, mais des travaux sont en cours pour proposer des techniques de fixation des aimants qui permettraient d’en faire une ablation facile en cas de nécessité impérieuse de réaliser une IRM.
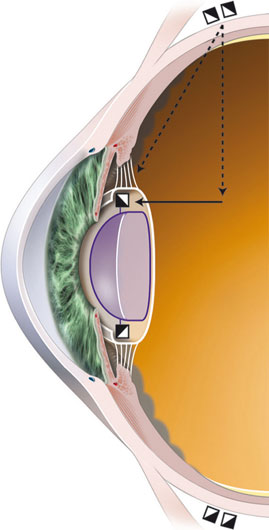
Fig. 12-26 Principe de l’implant magnétique.
D’autres types d’implants accommodatifs sont à l’étude, en particulier par la société Elenza (Virginie, États-Unis) qui travaille sur un projet d’implant à optique digitalisée dans lequel la combinaison de phénomènes chimiques, électriques et de circuits intégrés permettrait de créer un implant « intelligent », capable de se comporter comme un appareil photographique autofocus et de faire le point en permanence, quelle que soit la distance d’observation, avec une amplitude d’accommodation qui pourrait atteindre 4 D. Une batterie rechargeable, prenant la forme d’un anneau de tension capsulaire et dont la durée de vie pourrait dépasser cinquante ans, pourrait être associée à l’implant lors de l’intervention.
Cette technologie avait déjà été utilisée par la société PixelOptics pour la mise au point des premières lunettes à focus électronique.
Cet implant n’existe pour l’instant qu’à l’état de projet mais représente une autre voie fascinante de recherche dans le domaine des implants accommodatifs.
L’implantation d’un accommodatif dans l’état actuel des modèles disponibles nécessite un certain nombre de précautions spécifiques à ce type d’implant, à la fois dans la sélection des patients concernés et dans la technique opératoire elle-même.
La motivation du patient est certainement l’une des clefs du succès et doit être évaluée par un interrogatoire précis permettant de définir les attentes et les besoins visuels du candidat à l’implantation. Le patient idéal sera sans doute un patient emmétrope ou hypermétrope, désireux d’obtenir un certain niveau d’indépendance vis-à-vis des lunettes et privilégiant la vision intermédiaire dans ses activités. Un patient affecté d’une myopie moyenne et habitué à lire de près sans correction devra, le cas échéant, être prévenu d’une réduction attendue de ses performances en vision de près — ou pourra bénéficier du maintien d’une petite myopie résiduelle sur l’œil dominé. Comme pour tous les implants réfractifs, les patients obsessionnels ou dont l’exigence visuelle est manifestement majeure ne sont sans doute pas les meilleurs candidats. En revanche, à la différence des implants multifocaux qui restaurent une bonne vision de près au prix cependant d’une altération de la qualité de vision, l’avantage essentiel revendiqué par les implants accommodatifs est le respect de la transmission des 100 % d’énergie lumineuse tel un monofocal conventionnel.
Les patients doivent être indemnes d’autres pathologies, en particulier rétiniennes, et la cataracte ne doit pas être traumatique.
Il est bien entendu important de disposer d’une bonne dilatation pupillaire et d’éviter les patients présentant ou risquant de présenter un iris floppy pour cause de traitement d’un adénome prostatique par un alphabloquant.
La présence d’un syndrome de pseudo-exfoliation capsulaire contre-indique également ce type d’implant.
Il faut bien entendu également fournir au patient une information préalable sur le risque au cours de la chirurgie de ne pas pouvoir utiliser l’implant prévu en cas d’anomalie peropératoire même minime, compte tenu des conditions opératoires à impérativement réunir.
Il faut en premier lieu s’assurer de la possibilité d’obtenir une très bonne dilatation pupillaire et exclure les patients dont l’astigmatisme postopératoire prévisible sera supérieur à 0,75 D, en tenant compte de la nécessité d’une incision élargie à 2,8 mm pour l’implantation, à moins de les prévenir d’une chirurgie complémentaire correctrice du cylindre résiduel postopératoire.
Le capsulorhexis doit être parfaitement rond et centré, d’un diamètre compris entre 5,5 mm et 6 mm afin de permettre une mobilisation optimale de l’implant lors de l’accommodation. Trop petit, le rhexis risque de limiter la translation antérieure de l’implant. Trop grand, il réduit la prédictibilité des performances de l’implant.
Le nettoyage cortical doit être aussi minutieux que possible afin de réduire le risque de fibrose capsulaire.
L’implantation elle-même doit être réalisée avec une bonne quantité de produit viscoélastique afin de bien maîtriser le placement des haptiques dans le sac capsulaire. L’optique doit être placée en position postérieure, plaquée à la capsule postérieure. Il faut en outre s’assurer d’une étanchéité parfaite des incisions et instiller une goutte d’atropine en fin d’intervention afin de maintenir l’optique dans cette position postérieure dans la période postopératoire précoce. Il a pu être proposé en période postopératoire une correction de +2 D aux patients opérés dans le but de renforcer cette action ; cette attitude n’ayant pas fait ses preuves d’efficacité est désormais abandonnée.
Là encore, l’implant est conseillé pour les patients emmétropes ou hypermétropes, le patient myope de plus de 2 D n’étant pas le candidat idéal. Les puissances disponibles s’étalent du reste entre 16 D et 28 D dans la gamme actuelle, qui est donc, de fait, plus étendue dans l’hypermétropie. Le laboratoire note dans ses recommandations qu’un astigmatisme postopératoire prévisible supérieur à 1,5 D n’est pas une bonne indication à cet implant.
Sur le plan opératoire, la mise au point d’un injecteur spécifique a grandement facilité la mise en place de l’implant (figure animée 12-4), mais la technique opératoire doit être rigoureuse, avec une attention toute particulière pour le capsulorhexis qui doit être parfaitement circulaire et régulier et d’un diamètre précis compris entre 4,5 mm et 5 mm, afin de recouvrir sur 360° l’optique antérieure de l’implant.
Toute anomalie de réalisation du capsulorhexis doit conduire à renoncer à l’implantation, ce qui nécessite de toujours disposer d’une solution de secours, a priori sous la forme d’un implant multifocal.
Pour cet implant comme de manière générale pour tous les implants réfractifs, la femto-chirurgie de la cataracte sera bien évidemment d’un apport intéressant dans ces indications où la précision du rhexis est un élément capital de la chirurgie. En attendant, il est préférable d’utiliser un marqueur épithélial afin de régler de façon précise le diamètre du rhexis. Un capsulorhexis antérieur de trop grand diamètre est à proscrire formellement, puisqu’il comporterait un risque de capture de l’optique antérieure de l’implant.
En postopératoire, une légère myopisation temporaire est la règle, assurant de fait immédiatement un bon résultat en vision de près. La régression de cette myopisation initiale peut prendre plusieurs mois et il est alors important de demander au patient de résister à la tentation d’utiliser une correction en vision de près, car il doit apprendre à faire des efforts accommodatifs pour s’approprier le fonctionnement de l’implant. Cette phase d’adaptation est nécessaire pour obtenir, à terme, des performances optimales en vision de près.



[1] Alessio G., L’Abbate M., Boscia F., La Tegola M.G. Capsular block syndrome after implantation of an accommodating intraocular lens. J Cataract Refract Surg, 2008 ; 34 : 703-6.
[2] Alió J.L., Ben-Nun J., Rodriguez-Prats J.L., Plaza A.B. Visual and accommodative outcomes 1 year after implantation of an accommodating intraocular lens based on a new concept. J Cataract Refract Surg, 2009 ; 35 : 1671-8.
[3] Allen P.M., Radhakrishnan H., O’Leary D.J. Repeatability and validity of the PowerRefractor and the Nidek AR600-A in an adult population with healthy eyes. Optom Vis Sci, 2003 ; 80 : 245-51.
[4] Ben-Nun J., Alió J.L. Feasibility and development of a high-power real accommodating intraocular lens. J Cataract Refract Surg, 2005 ; 31 : 1802-8.
[5] Bohórquez V., Alarcon R. Long-term reading performance in patients with bilateral dual-optic accommodating intraocular lenses. J Cataract Refract Surg, 2010 ; 36 : 1880-6.
[6] Brown D., Dougherty P., Gills J.P. et al. Functional reading acuity and performance: comparison of 2 accommodating intraocular lenses. J Cataract Refract Surg, 2009 ; 35 : 1711-4.
[7] Cumming J.S., Colvard D.M., Dell S.J. et al. Clinical evaluation of the Crystalens AT-45 accommodating intraocular lens: results of the U.S. Food and Drug Administration clinical trial. J Cataract Refract Surg, 2006 ; 32 : 812-25.
[8] Dick H.B., Kaiser S. [Dynamic aberrometry during accommodation of phakic eyes and eyes with potentially accommodative intra ocular lenses.] Ophthalmologe, 2002 ; 99 : 825-34.
[9] Dogru M., Honda R., Omoto M. et al. Early visual results with the 1CU accommodating intraocular lens. J Cataract Refract Surg, 2005 ; 31 : 895-902.
[10] Ehmer A., Mannsfeld A., Auffarth G.U., Holzer M.P. Dynamic stimulation of accommodation. J Cataract Refract Surg, 2008 ; 34 : 2024-9.
[11] Findl O., Kiss B., Petternel V. et al. Intraocular lens movement caused by ciliary muscle contraction. J Cataract Refract Surg, 2003 ; 29 : 669-76.
[12] Findl O., Kriechbaum K., Menapace R. et al. Laser inter ferometric assessment of pilocarpine-induced movement of an accommodating intraocular lens: a randomized trial. Ophthalmology, 2004 ; 111 : 1515-21.
[13] Gayton J.L., Apple D.J., Peng Q. et al. Interlenticular opacification: clinicopathological correlation of a complication of posterior chamber piggyback intraocular lenses. J Cataract Refract Surg, 2000 ; 26 : 330-6.
[14] Hara T., Yasuda A., Yamada Y. Accommodative intraocular lens with spring action – Part 1. Design and placement in an excised animal eye. Ophthalmic Surg, 1990 ; 21 : 128-33.
[15] Hara T., Yasuda A., Mizumoto Y., Yamada Y. Accommodative intraocular lens with spring action – Part 2. Fixation in the living rabbit. Ophthalmic Surg, 1992 ; 23 : 632-5.
[16] Jardim D., Soloway B., Starr C. Asymmetric vault of an accommodating intraocular lens. J Cataract Refract Surg, 2006 ; 32 : 347-50.
[17] Koeppl C., Findl O., Menapace R. et al. Pilocarpine-induced shift of an accommodating intraocular lens: AT-45 Crystalens. J Cataract Refract Surg, 2005 ; 31 : 1290-7.
[18] Koopmans S.A., Terwee T., Glasser A. et al. Accommodative lens refilling in rhesus monkeys. Invest Ophthalmol Vis Sci, 2006 ; 47 : 2976-84.
[19] Kriechbaum K., Findl O., Koeppl C. et al. Stimulus-driven versus pilocarpine-induced biometric changes in pseudophakic eyes. Ophthalmology, 2005 ; 112 : 453-9.
[20] Kuchle M., Nguyen N.X., Langenbucher A. et al. Implantation of a new accommodative posterior chamber intraocular lens. J Refract Surg, 2002 ; 18 : 208-16.
[21] Legeais J.M., Werner L., Werner L. et al. Pseudoaccommodation: BioComFold versus a foldable silicone intraocular lens. J Cataract Refract Surg, 1999 ; 25 : 262-7.
[22] Macsai M.S., Padnick-Silver L., Fontes B.M. Visual outcomes after accommodating intraocular lens implantation. J Cataract Refract Surg, 2006 ; 32 : 628-33.
[23] Maloof A.J., Pandey S.K., Neilson G., Milverton E.J. Selective death of lens epithelial cells using demineralized water and Triton X-100 with Perfect Capsule sealed capsule irrigation: a histological study in rabbit eyes. Arch Ophthalmol, 2005 ; 123 : 1378-84.
[24] Marchini G., Pedrotti E., Sartori P., Tosi R. Ultrasound bio microscopic changes during accommodation in eyes with accommodating intraocular lenses: pilot study and hypothesis for the mechanism of accommodation. J Cataract Refract Surg, 2004 ; 30 : 2476-82.
[25] Mastropasqua L., Toto L., Falconio G. et al. Longterm results of 1 CU accommodative intraocular lens implantation: 2-year follow-up study. Acta Ophthalmol Scand, 2007 ; 85 : 409-14.
[26] Mastropasqua L., Toto L., Nubile M. et al. Clinical study of the 1CU accommodating intraocular lens. J Cataract Refract Surg, 2003 ; 29 : 1307-12.
[27] McDonald J.P., Croft M.A., Vinje E. et al. Sarfarazi Elliptical Accommodating IntraOcular Lens (EAIOL) in rhesus monkey eyes in vitro and in vivo. Invest Ophthalmol Vis Sci, 2003 ; 44 : E-Abstract 256.
[28] McLeod S.D., Portney V., Ting A. A dual optic accommodating foldable intraocular lens. Br J Ophthalmol, 2003 ; 87 : 1083-5.
[29] McLeod S.D., Vargas L.G., Portney V., Ting A. Synchrony dual-optic accommodating intraocular lens. Part 1. Optical and bio mechanical principles and design considerations. J Cataract Refract Surg, 2007 ; 33 : 37-46.
[30] Menapace R. Routine posterior optic buttonholing for eradication of posterior capsule opacification in adults: report of 500 consecutive cases. J Cataract Refract Surg, 2006 ; 32 : 929-43.
[31] Menapace R., Findl O., Kriechbaum K., Leydolt-Koeppl Ch. Accommodating intraocular lenses: a critical review of present and future concepts. Graefes Arch Clin Exp Ophthalmol, 2007 ; 245 : 473-89.
[32] Mirshahi A., Bühren J., Gerhardt D., Kohnen T. In vivo and in vitro repeatability of Hartmann-Shack aberrometry. J Cataract Refract Surg, 2003 ; 29 : 2295-301.
[33] Nishi O., Nishi K., Nishi Y., Chang S. Capsular bag refilling using a new accommodating intraocular lens implant. J Cataract Refract Surg, 2008 ; 34 : 302-9.
[34] Ossma I., Galvis A., Vargas L.G. et al. Synchrony dual-optic accommodating intraocular lens. Part 2: Pilot clinical evaluation. J Cataract Refract Surg, 2007 ; 33 : 47-52.
[35] Payer H., Reiter J. [Small incision injector-implanted annular ring lens. Does it increase pseudoaccommodation? 5 1/2 years experience.] Spekts Augenheik, 2002 ; 16 : 131-8.
[36] Pepose J.S., Qazi M.A., Davies J. et al. Visual performance of patients with bilateral vs combination Crystalens, ReZoom, and ReSTOR intraocular lens implants. Am J Ophthalmol, 2007 ; 144 : 347-57.
[37] Preussner P.R., Wahl J., Gerl R. et al. [Accommodative lens implant.] Ophthalmologe, 2001 ; 98 : 97-102.
[38] Sanders D.R., Sanders M.L. Visual performance results after Tetraflex accommodating intraocular lens implantation. Ophthalmology, 2007 ; 114 : 1679-84.
[39] Sanders D.R., Sanders M.L. Tetraflex Presbyopic IOL Study Group US FDA Clinical Trial of the Tetraflex Potentially Accommodating IOL: comparison to concurrent age-matched monofocal controls. J Refract Surg, 2010 ; 26 : 723.
[40] Sauder G., Degenring R.F., Kamppeter B., Hugger P. Potential of the 1 CU accommodative intraocular lens. Br J Ophthalmol, 2005 ; 89 : 1289-92.
[41] Sheppard A.L., Bashir A., Wolffsohn J.S., Davies L.N. Accommodating intraocular lenses: a review of design concepts, usage and assessment methods. Clin Exp Optom, 2010 ; 93 : 441-52.
[42] Simonov A.N., Vdovin G., Rombach M.C. Cubic optical elements for an accommodative intraocular lens. Opt Express, 2006 ; 14 : 7757-75.
[43] Stachs O., Schneider H., Beck R., Guthoff R. Pharmacological-induced haptic changes and the accommodative performance in patients with the AT-45 accommodative IOL. J Refract Surg, 2006 ; 22 : 145-50.
[44] Uthoff D., Gulati A., Hepper D., Holland D. Potentially accommodating 1CU intraocular lens: 1-year results in 553 eyes and literature review. J Refract Surg, 2007 ; 23 : 159-71.
[45] Werner L., Mamalis N., Stevens S. et al. Interlenticular opacification: dual-optic versus piggyback intraocular lenses. J Cataract Refract Surg, 2006 ; 32 : 655-61.
[46] Werner L., Pandey S.K., Izak A.M. et al. Capsular bag opacification after experimental implantation of a new accommodating intraocular lens in rabbit eyes. J Cataract Refract Surg, 2004 ; 30 : 1114-23.
[47] Whitefoot H., Charman W.N. Dynamic retinoscopy and accommodation. Ophthalmic Physiol Opt, 1992 ; 12 : 8-17.
[48] Wolffsohn J.S., Davies L.N., Gupta N. et al. Investigating the mechanism of action of the Tetraflex KH3500 accommodative intra ocular lens. J Refract Surg, 2010 ; 26 : 858-62.
[49] Wolffsohn J.S., Hunt O.A., Naroo S. et al. Objective accommodative amplitude and dynamics with the 1CU accommodative intra ocular lens. Invest Ophthalmol Vis Sci, 2006 ; 47 : 1230-5.
[50] Yuen L., Trattler W., Boxer Wachler B.S. Two cases of Z syndrome with the Crystalens after uneventful cataract surgery. J Cataract Refract Surg, 2008 ; 34 : 1986-9.

