C. Albou-Ganem
La correction intrastromale de la presbytie par incisions intrastromales de la cornée centrale (IntraCOR®) est une technique récente (2007) complétant l’arsenal thérapeutique à notre disposition pour la compensation de la perte d’accommodation. Cette chirurgie trouve ses indications chez les patients emmétropes ou faiblement hypermétropes qui restent les plus difficiles à corriger par l’exigence légitime de la conservation de l’acuité visuelle de loin. Elle demeure moins invasive que les chirurgies ablatives que sont le LASIK, décrit pour la première fois pas Pallikaris en 1990 [20], et la kératectomie photoréfractive (PRK) [29], qui sont actuellement les chirurgies réfractives les plus pratiquées. Même les dernières générations de logiciels de photoablation aboutissant à des profils d’ablation hyperprolates ou multifocaux peuvent être délétères sur la qualité de la vision de loin du patient emmétrope presbyte. Quant à la thermokératoplastie conductive — première technique validée par la FDA pour la correction de la presbytie [17] —, elle n’a pas fait la preuve de sa stabilité dans le temps.
Les incisions concentriques intrastromales dans la zone centrale de la cornée apportent donc une solution encourageante et peu invasive pour la correction de la presbytie chez l’emmétrope.
Les lasers femtoseconde sont des lasers à haute densité agissant en infrarouge avec une longueur d’onde variant entre 1 030 nm et 1 060 nm (fig. 6-1). Ils ont la propriété de fournir des impulsions ultrabrèves avec des puissances de crêtes élevées à partir d’impulsions de faible énergie. Pour une même énergie de 1 J/cm2, le laser argon délivre une irradiance moyenne de 30 W/cm2, alors que le laser femtoseconde délivrera, à la crête, une irradiance de l’ordre de 1014 W/cm2.
Le mécanisme d’action consiste à faire passer très rapidement par ionisation la matière de l’état basal à l’état plasma selon le processus suivant : un laser pulsé avec une fréquence ultracourte focalisé dans la cornée génère un champ électrique de haute densité, aboutissant à la formation de l’état plasma composé d’électrons libres et d’ions. Ce plasma chaud s’expand à une vitesse supersonique : c’est le claquage optique. L’expansion ultrarapide du plasma abaisse brutalement sa température, empêchant tout effet thermique. Lorsque la vitesse d’expansion diminue, le déplacement supersonique initial crée une onde de choc qui se propage en perdant à son tour de l’énergie et de la vitesse. La vaporisation des tissus forme une bulle de cavitation de la taille du faisceau laser au point de focalisation. Cette bulle de cavitation déplace les structures adjacentes. La bulle de cavitation est composée essentiellement de molécules de dioxyde de carbone, d’azote et d’eau, qui diffusent naturellement à travers les couches de la cornée par action de la pompe endothéliale. Si un impact est sans effet, une succession de milliers de pulses contigus aboutit à une photodisruption linéaire permettant de réaliser des incisions précises et régulières selon un dessin prédéterminé (fig. 6-2).

Fig. 6-1 Situation de la longueur d’onde du laser femtoseconde parmi les lasers utilisés en ophtalmologie.
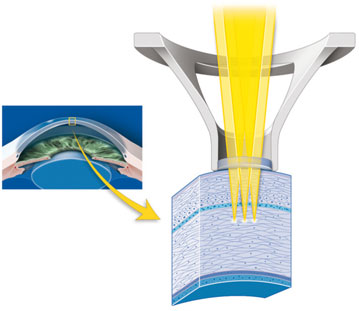
Fig. 6-2 Photodisruption.
La diminution de la taille du spot ou de la durée d’un pulse du laser diminue le seuil d’énergie nécessaire au claquage optique.
S’il est difficile de diminuer la taille du spot en dessous de quelques microns du fait de la mise au point des optiques, de la longueur d’onde du laser et de la propagation de l’effet, il a en revanche été possible de réduire à l’extrême la durée d’un pulse jusqu’à la femtoseconde (1 fs = 10–15 s). Cette diminution de la durée abaisse le seuil de fluence (rapport énergie/surface) pour le claquage optique, ce qui réduit les effets de l’onde de choc et la taille de la bulle de gaz.
La durée optimale d’un pulse pour obtenir le claquage optique et la photodisruption dans le tissu cornéen est de 500 à 800 femtosecondes. L’onde de choc est alors minimale.
Le laser photodisrupteur est focalisé à une épaisseur définie mesurée entre la surface inférieure de la lentille d’aplanation et le stroma cornéen. Les impacts sont réalisés selon un format variable, en trame, spirale ou tunnels, pour créer un plan de clivage horizontal, vertical, oblique. Des impacts de l’ordre de 5 µm à 10 µm avec des pulses de 1 µJ à 2 µJ sont les paramètres optimums pour les découpes les plus précises du stroma cornéen [15]. Il n’existe aucune interaction en surface ; les effets thermiques et mécaniques ne s’étendent que sur 1 µm autour de l’impact[15, 24] ; les fonctions tectoniques et trophiques de la cornée sont respectées [31].
Les lasers femtoseconde créent une photodisruption par cavitation avec une fréquence de pulse ultracourte. Les minispots, d’espacement variable, se rejoignent au sein du stroma cornéen et créent une incision linéaire sans effet thermique ni onde de choc. Il n’y a aucune ablation de tissu mais des microdissections intralamellaires par la création et l’expansion de bulles de cavitation qui séparent les lamelles de stroma cornéen, qui se prêtent bien à ce clivage gazeux. Les lasers femtoseconde permettent donc d’obtenir des découpes cornéennes très précises sans effet délétère pour le stroma avoisinant.
Les premiers résultats de l’utilisation du laser femtoseconde pour corriger les erreurs réfractives chez l’homme ont été publiés par Meteldorf et al. en 2007 [17] ; ils ont démontré que la transparence cornéenne n’était pas affectée par les incisions réalisées au laser femtoseconde.
La correction de la presbytie par le laser femtoseconde intrastromal entre dans le cadre des techniques qui confèrent au patient un certain degré de pseudo-accommodation.
La correction intrastromale de la presbytie au laser femtoseconde a été mise au point en 2007 par Luis A. Ruiz avec le laser Femtec® de la société Technolas Perfect Vision, remplacé aujourd’hui par le 520 F TPV®. Les premiers résultats sur quarante-cinq yeux et un recul allant jusqu’à six mois ont été rapportés au congrès mondial d’ophtalmologie (WOC) à Hong Kong en 2008 [25]. Le traitement était personnalisé, prenant en compte les données biomécaniques et géométriques de la cornée : un système dénommé FEM (Finite Element Modeling) (fig. 6-3) a permis de quantifier de manière tridimensionnelle les cornées de chaque patient et d’adapter les découpes intrastromales visant à modifier la kératométrie. Les auteurs ont rapporté au cours de ce congrès que tous les yeux ayant bénéficié du même protocole avaient obtenu une acuité visuelle de loin supérieure ou égale à 20/25 et une acuité visuelle de près supérieure ou égale à Jaeger 2 et ce, sans aucune perte de la meilleure acuité visuelle corrigée.
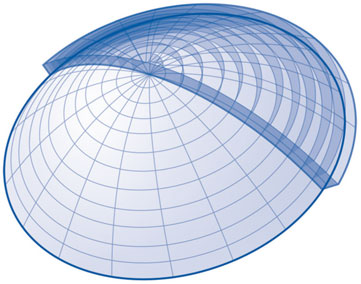
Fig. 6-3 Modélisation personnalisée de la cornée utilisée pour le traitement de la presbytie : système FEM (Finite Element Modeling).
(D’après Ruiz L.A. [25].)
Le laser Femtec® (fig. 6-4) a été le premier laser à pouvoir réaliser une découpe en spirale à travers un verre concave conservant la forme sphérique de la cornée, avec une aplanation faible et sans compression, afin de minimiser les déformations biomécaniques de la cornée. Cette particularité a permis le développement, par Technolas Perfect Vision, des traitements réfractifs pour la correction de la presbytie sans découpe associée, baptisés IntraCOR® (pour « Intrastromal Correction of Presbyopia »). Ce laser travaille avec des spots de 5 µm, à une fréquence de 40 Hz et une énergie ne dépassant pas 6 µJ pour obtenir une photodisruption située dans n’importe quel point visé de la cornée. La correction de la presbytie se fait en une quinzaine de secondes par une série de photodisruptions formant des anneaux cylindriques. Celles-ci sont délivrées à partir du stroma postérieur à des distances variables de la membrane de Descemet et s’étendant à travers la partie médiane du stroma jusqu’à un point précis situé à une distance prédéterminée de la membrane de Bowman. Les incisions sont uniquement intrastromales et n’impactent ni l’endothélium, ni la membrane de Descemet, ni l’épithélium, ni la membrane de Bowman. Ces incisions induisent un bombement cornéen central hyperprolate et multifocal induisant des aberrations optiques pupillodépendantes[4, 18]. La modification de la puissance de la cornée centrale améliore la profondeur de champ, donc la vision de près, d’autant que le myosis induit par l’accommodation permet un centrage des rayons sur la zone cornéenne traitée, alors que la vision de loin est peu ou pas modifiée puisque la majeure partie des rayons passent en dehors de la zone traitée. L’IntraCOR® induit une vision simultanée (fig. 6-5).

Fig. 6-4 Laser Femtec®.
(Avec l’aimable autorisation de Technolas Perfect Vision.)
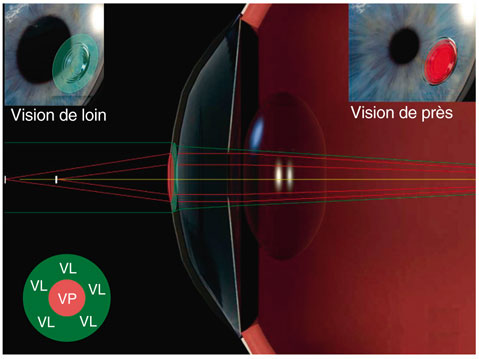
Fig. 6-5 Vision simultanée.
(Document de R. Amar. Design M. Saubion.)
La correction se fait par focalisation du laser femtoseconde dans l’épaisseur du stroma dans le but de remodeler la partie centrale de la cornée. La technique ne nécessite ni découpe de volet cornéen ni débridement épithélial. La membrane de Bowman reste donc intacte. Le traitement est totalement indolore et non invasif. La correction de la presbytie est obtenue par la réalisation de cinq incisions intracornéennes circulaires concentriques qui induisent un bombement de la cornée centrale (fig. 6-6). Les incisions sont espacées de 200 µm autour d’une zone optique libre de 1,7 mm. Leur longueur diminue du centre vers la périphérie tout en s’éloignant de la surface cornéenne (fig. 6-7). Le protocole appliqué sur la cornée est identique d’un patient à un autre, excepté la longueur des incisions qui est adaptée à la pachymétrie relevée en préopératoire à 2 mm, 4 mm, 6 mm, 8 mm. Le nombre des incisions, le diamètre de la zone optique centrale, l’intervalle entre les anneaux sont théoriquement identiques pour tous les patients.
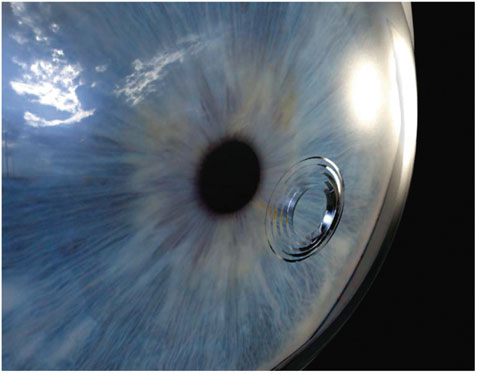
Fig. 6-6 Incisions intrastromales : vue d’artiste.
(Document de R. Amar. Design M. Saubion.)

Fig. 6-7 La longueur des incisions diminue du centre vers la périphérie tout en s’éloignant de la surface cornéenne.
(Document de T. Guedj, A. Danan et D.A. Lebuisson.)
Le point crucial de la technique est le centrage des incisions. En effet, la zone optique centrale des anneaux est de 1,7 mm et, une fois le cône inséré dans l’anneau de succion, il n’est possible de recentrer le laser que sur un rayon de 400 µm.
L’intervention se déroule en cinq étapes (vidéo 6-1) :
– une marque épithéliale est faite sur le reflet de Purkinje ;
– l’anneau de succion est ensuite lui-même centré sur la marque épithéliale ;
– le cône d’aplanation, dont la forme concave respecte la courbure de la cornée, est ventousé sous la tête du laser, puis encastré dans l’anneau de succion. La marque épithéliale doit alors se positionner au centre d’un cercle de 600 µm préalablement gravé sur la base du cône. Un réajustement du centrage d’un rayon de 400 µm est possible ;
– des diodes de couleurs permettent de vérifier que l’aplanation sur la cornée est bien homogène ;
– le laser est alors mis en route : les anneaux sont réalisés du centre vers la périphérie et de la profondeur vers la surface de la cornée ; la réalisation des cinq anneaux ne demande que huit à quinze secondes de traitement en fonction de la longueur des incisions programmées, qui dépend de la pachymétrie cornéenne du patient.
Le dépôt d’énergie femtoseconde entraîne une réaction inflammatoire proportionnelle au nombre d’impacts. Même si celle-ci est moindre que celle engendrée par un LASIK du fait du plus petit nombre d’impacts et de la situation plus postérieure dans le stroma, il est préférable de prescrire un traitement anti-inflammatoire stéroïdien pendant la première semaine.
La surface cornéenne étant préservée par le traitement IntraCOR®, le risque infectieux et de sécheresse oculaire est éliminé : tout autre traitement est inutile.
La chirurgie réfractive étant une chirurgie de convenance, la sélection des patients est fondamentale. Elle dépend de critères médicaux et chirurgicaux mais aussi des attentes des patients, qu’elles soient exprimées ou non. L’interrogatoire doit être minutieux et précis. Il doit répondre aux questions suivantes : Quelles sont les activités nécessitant le port de verres correcteurs ? La correction est-elle confortable ou non ? Est-elle handicapante sur le plan professionnel ou personnel ? Le patient a-t-il déjà été adapté en lentilles de contact ? Quel en était le type : monofocales en bascule ou multifocales ? Quel en a été le confort ? Quels sont les besoins visuels du patient et quelles sont ses exigences ? Quelles sont les conditions lumineuses de travail et de lecture ?
Les antécédents personnels ophtalmologiques et généraux sont colligés. Tout antécédent médico-chirurgical ophtalmologique ou tout traumatisme doivent faire l’objet d’un interrogatoire et d’une étude clinique approfondis et doivent appeler à la plus grande réserve dans l’indication opératoire pour qu’il n’y ait, dans l’esprit du patient, aucun lien de cause à effet quant à leur propre évolution. Il en est de même pour les antécédents familiaux. Il faudra également obtenir la liste des éventuels traitements locaux ou généraux, qui donnent des renseignements sur le passé clinique du patient.
La correction intrastromale de la presbytie ne s’adresse qu’aux patients emmétropes ou très faiblement hypermétropes (hypermétropie inférieure ou égale à 0,75 D) et ayant un astigmatisme inférieur à 0,75 D. La société Technolas Perfect Vision recommande pour toute procédure les critères réfractifs d’indication suivants : meilleure acuité visuelle corrigée supérieure ou égale à 0,63, équivalent sphérique minimum de + 0,25, sphère comprise entre + 0,25 et + 0,75, cylindre inférieur à 0,75 D, addition supérieure à 1,50 D.
Les indications cornéotopographiques sont identiques à celles de toutes les chirurgies ablatives, à savoir une morphologie cornéenne normale avec une pachymétrie supérieure à 500 µm. Les cornées à risque et a fortiori les kératocônes frustes sont des contre-indications aux incisions intrastromales.
Comme pour tout bilan de chirurgie réfractive, l’examen de la réfraction comprend une réfraction subjective de loin et de près avec détermination de la meilleure acuité visuelle corrigée. Elle est complétée par un examen de la réfraction objective sous cycloplégie, qui est le plus souvent corrélée à la réfraction retrouvée en aberrométrie. La réfraction sera complétée par une simulation du résultat réfractif par addition sur l’œil dominé d’un verre correcteur de + 1,50 D pour vérifier, en vision de loin et en vision de près, la tolérance de la légère bascule induite par la chirurgie.
Rappelons pour mémoire les différentes dominances, au nombre de quatre :
– l’œil directeur conserve la fixation ou la reprend vite lors de l’interposition d’un prisme sur l’autre œil ; il s’agit d’une dominance visuomotrice ;
– l’œil dominant possède la meilleure acuité visuelle en vision binoculaire pour une distance donnée ; il s’agit d’une dominance sensorielle ;
– l’œil de visée est celui de la visée en vision binoculaire ; il est mis en évidence par le test de la carte trouée qui est placée spontanément devant l’œil de visée lorsque le patient fixe un objet en vision binoculaire ;
– et, enfin, l’œil préféré est déterminé par le flou réfractif par surcorrection d’une addition de 1 D placée alternativement devant chaque œil (test du flou préférentiel) : l’œil qui est le plus gêné est l’œil préféré de loin.
La dominance visuelle est mise en évidence par plusieurs tests.
Ces deux dernières dominances sont recherchées dans le bilan préopératoire de l’IntraCOR®. L’œil dominant est dans 90 % des cas l’œil de visée et l’œil préféré.
L’œil droit est dominant dans 60 % des cas, l’œil gauche dans 20 % des cas et, dans 20 % des cas, les patients n’ont pas de préférence [21].
L’œil non dominant est opéré en premier car la chirurgie unilatérale suffit le plus souvent.
L’analyse topographique et l’analyse en cartes d’élévations sont indispensables. La topographie analyse la forme et la courbure de la surface cornéenne. L’analyse en cartes d’élévations permet une mesure et non pas une approximation de la forme de la cornée et de sa puissance réfractive réelle. Ces examens permettent d’éliminer tout astigmatisme cornéen supérieur à 0,75 D et, surtout, de diagnostiquer les formes cliniques ou infracliniques de kératocône. L’analyse topographique permet également de mesurer la pachymétrie centrale de la cornée pour éliminer les cornées fines inférieures à 500 µm. Les pachymétries moyennes retrouvées à 2 mm, 4 mm, 6 mm et 8 mm de l’axe visuel sont relevées. Il s’agit en effet des seules données variables d’un patient à un autre dans la programmation du laser. De ces données dépend la longueur des cinq incisions intrastromales réalisées par le laser.
Le bilan aberrométrique n’est pas obligatoire avant toute opération IntraCOR®. Cependant, il remplit deux objectifs : préciser de manière objective et plus précise la correction optique réelle de l’œil à traiter et apprécier le résultat attendu en postopératoire par une étude différentielle des données postopératoires et préopératoires.
Les aberromètres délivrent les valeurs des aberrations de bas et haut degré responsables d’une bonne ou mauvaise qualité de vision du patient. Ils reposent pour la plupart sur l’étude de la distorsion d’un front d’onde plan émis à travers les dioptres de l’œil (fig. 6-8). Les aberromètres de type Hartmann-Shack étudient la distorsion du front d’onde à la sortie de l’œil, au plan pupille. Les aberromètres de type Tscherning analysent cette distorsion du front d’onde plan au niveau du point fovéal.
Les aberromètres prennent en compte les aberrations totales (cornéennes et cristalliniennes) en fonction du diamètre pupillaire. D’autres aberromètres plus spécifiques font la part entre les aberrations cornéennes et les aberrations totales. Outre certaines valeurs quantitatives précieuses pour l’aide à l’indication du chirurgien, les aberromètres délivrent également une appréciation qualitative de la qualité de vision du patient par le biais de la fonction de dispersion du point. Cette analyse, dénommée en anglais PSF (Point Spread Function), décrit la simulation de dispersion d’un point lumineux vu à travers l’œil examiné. Plus cette PSF est large et irrégulière, plus l’œil du patient présente des aberrations optiques délétères.
Les aberromètres sont également très utiles pour l’optimisation de la correction sphérocylindrique à traiter par l’analyse de la PPR (Predicted Phoropter Refraction) indiquée sur certains aberromètres de type Hartmann-Shack. La PPR retranscrite sur le relevé aberrométrique est la reformulation en sphère, cylindre et axe de la totalité des aberrations mesurées des degrés 1 à 5, pour une pupille d’entrée standardisée de 3,5 mm. Cette fonction est particulièrement utile pour contrôler la réfraction du patient et vérifier qu’il ne compense pas une hypermétropie latente qui contre-indiquerait le traitement intrastromal.
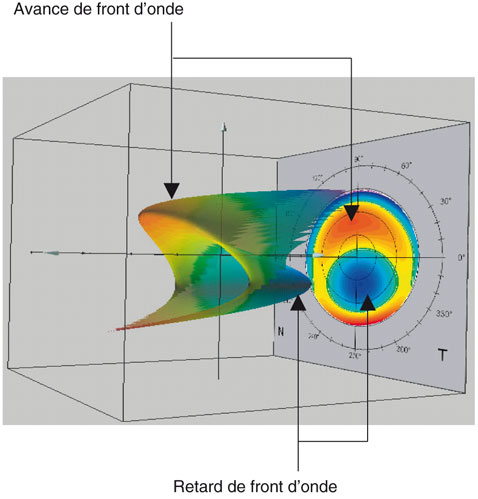
Fig. 6-8 Profils aberrométriques basés sur l’analyse d’erreur du front d’onde sortant de l’œil examiné en référence à un front d’onde plan. Le profil aberrométrique est donc constitué d’avance ou de retard de front d’onde.
(Document de R. Amar, C. Albou-Ganem, D.A. Lebuisson, A. Danan et T. Hoang-Xuan.)
Il doit être complet, comme pour toute chirurgie réfractive, et doit être strictement normal pour autoriser l’intervention. Il faudra particulièrement vérifier la transparence cornéenne de la zone centrale car le laser femtoseconde ne traverse pas les opacités.
Les maladies générales sont des contre-indications relatives. L’indication sera posée si l’état général du patient l’autorise mais il n’existe pas de contre-indication générale absolue.
Les anomalies de la surface oculaire, les syndromes secs majeurs, les cicatrices cornéennes sont des contre-indications absolues. Les pathologies ophtalmologiques sont des contre-indications relatives mais toute pathologie ophtalmologique patente contre-indique la chirurgie.
Ce sont les mêmes que pour toute chirurgie réfractive. Le kératocône, même infraclinique, est une contre-indication absolue. Les cornées présentant une valeur pachymétrique centrale inférieure à 500 µm doivent être contre-indiquées. Par ailleurs, la société Technolas Perfect Vision recommande de contre-indiquer l’IntraCOR® pour tout patient présentant sur l’œil à traiter un angle kappa supérieur ou égal à 10°.
Il est préférable de ne pas opérer les patients ayant des exigences visuelles et des attentes qui risquent de ne pas être obtenues.
L’information donnée au patient est obligatoire. Elle doit être complète et objective. Elle doit porter sur les risques, les bénéfices, les effets secondaires et l’attente possible du résultat chirurgical. Parmi les risques de cette chirurgie sont exposés le risque de sous-correction, d’éblouissement, de halos, de baisse de l’acuité visuelle de loin. Il faut bien insister sur le fait que l’action du laser sur la partie centrale de la cornée ne peut se faire sans induire de modifications de la qualité de vision de loin, même si elles sont modérées ; or, cette chirurgie s’adresse à des patients emmétropes ou très faiblement hypermétropes qui sont très exigeants sur leur acuité visuelle de loin. La tendance aujourd’hui est de maximaliser les risques potentiels au niveau de l’information. Bien qu’aucune cause de cécité après IntraCOR® n’ait été retenue dans la littérature, certains praticiens n’hésitent pas à la mentionner.
La correction de la presbytie se fait par focalisation du laser femtoseconde dans l’épaisseur du stroma pour remodeler et redistribuer les forces biomécaniques de la cornée. Les incisions préservent la membrane de Bowman et la partie antérieure des lamelles stromales, qui sont les plus résistantes[14, 18, 30]. Il n’y a aucune ablation de tissu : l’action est donc uniquement et entièrement biomécanique [17].
Les cinq incisions concentriques circulaires induisent des modifications morphologiques ayant pour base la striction apicale de la cornée centrale. Ce bombement central est associé à un aplatissement paracentral. La résultante de ces deux modifications géométriques est une diminution de la flèche cornéenne et donc de l’élévation cornéenne globale (fig. 6-9).
Il est important de rappeler que le bombement de la cornée centrale se fait à arc cornéen antérieur constant. Il n’existe aucune distension de la cornée centrale : il s’agit donc d’un prolapsus et non d’une ectasie.
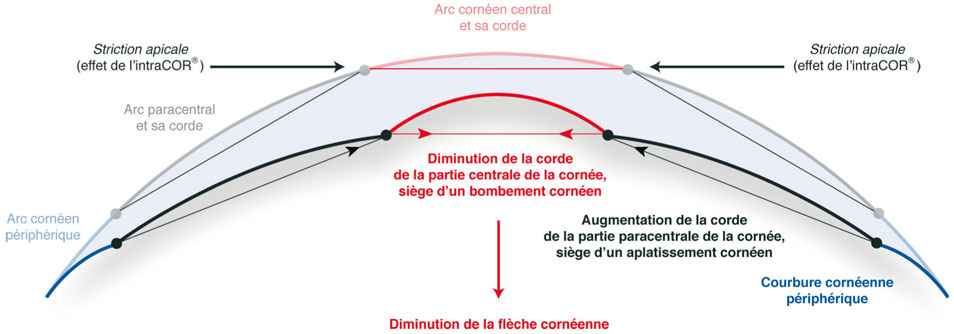
Fig. 6-9 Modification des courbures cornéennes après IntraCOR®.
(D’après Claude Pages.)
L’analyse des incisions réalisées par le traitement intrastromal de la procédure IntraCOR® a été menée avec le Pentacam® (Oculus) et l’OCT RTVue® 100 (Optovue). Afin de pouvoir interpréter l’aspect des incisions sur les cornées opérées, celles-ci ont été réalisées sur une cornée artificielle de PMMA dont le rayon de courbure (10,63 mm, 28 D) s’adapte parfaitement à celui du cône d’aplanation (fig. 6-10a). L’analyse en OCT des incisions sur la pièce de PMMA met en évidence un strict parallélisme entre l’axe optique et les incisions, qui sont parfaitement rectilignes (fig. 6-10b). Les cinq incisions créées par l’IntraCOR® sont parallèles, autour d’une zone optique de 1,6 mm. Elles sont espacées de 200 µm et leur longueur diminue du centre vers la périphérie, tout en s’éloignant de la surface cornéenne (fig. 6-10c).
L’analyse de plusieurs cornées opérées[1, 3] montre que les incisions perdent leur parallélisme et présentent une angulation avec une déviation centrifuge de leur segment antérieur et postérieur. L’angulation entre les deux déviations semble se faire dans la partie médiane des incisions centrales. La déviation de la partie antérieure des incisions serait liée au retour de la cornée à sa courbure naturelle à la levée de l’aplanation. La déviation de la partie postérieure des incisions serait liée au glissement centrifuge des structures postérieures de la cornée, conséquence géométrique de la constance de l’arc cornéen antérieur et de l’épaisseur cornéenne (fig. 6-11). L’incision interne est peu modifiée car la partie centrale de la cornée est la moins concernée par l’aplanation et le cisaillement dans la zone centrale reste minime. L’incision périphérique est le siège d’une déviation entièrement due au cisaillement du fait de sa localisation uniquement dans la partie postérieure du stroma.
L’analyse morphologique des incisions intrastromales après chirurgie IntraCOR® par Scheimpflug camera (Pentacam®) et par OCT montre que les cinq incisions sont concentriques et équidistantes les unes des autres, avec un espacement de 200 µm à 210 µm (fig. 6-12). La longueur des incisions varie d’un patient à un autre car elle dépend de la pachymétrie retrouvée à 2 mm, 4 mm, 6 mm et 8 mm du centre cornéen. La taille des incisions augmente de la périphérie vers le centre et l’incision centrale, qui occupe 70 % de l’épaisseur cornéenne, semble être deux fois plus longue que l’incision périphérique aussi bien en Scheimpflug camera qu’en OCT (tableau 6-I). La distance entre les extrémités des incisions et l’endothélium d’une part et l’épithélium d’autre part semble être au minimum de 100 µm pour un traitement centré.
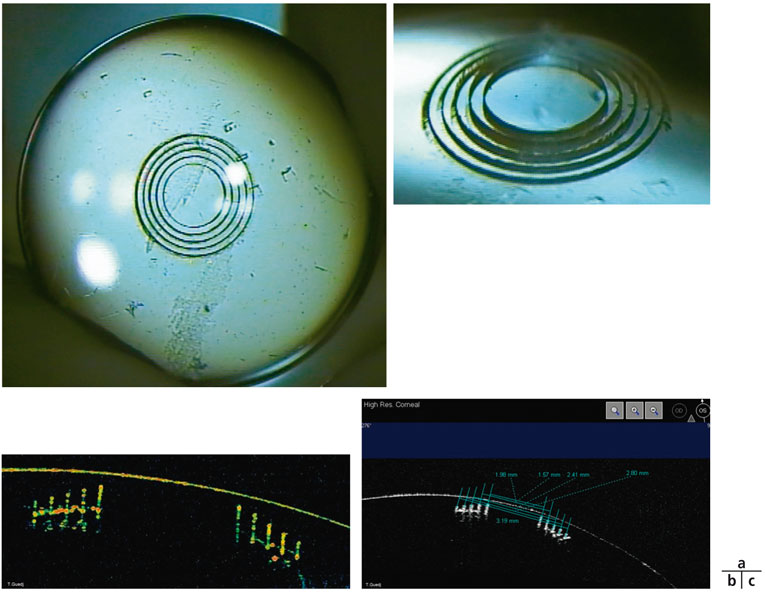
Fig. 6-10 Analyse en OCT sur cornée artificielle.
a. Protocole IntraCOR® réalisé sur une lentille de PMMA de 28 D. b. Image en OCT des incisions réalisées sur une lentille de PMMA. L’ombre portée inférieure est un artefact. c. Diamètre de chacune des cinq incisions sur la lentille de PMMA.
(Documents de T. Guedj.)
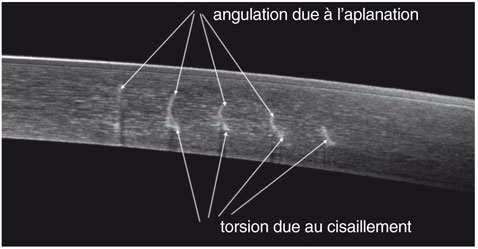
Fig. 6-11 Angulation des incisions en OCT sur une cornée d’un patient opéré en IntraCOR®.
(Cliché de T. Guedj, A. Danan et D.A. Lebuisson.)
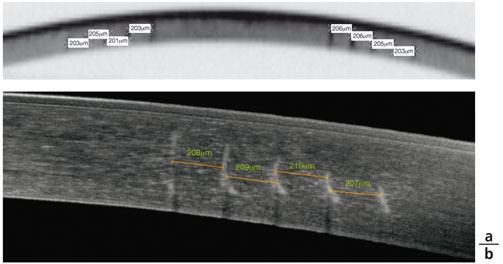
Fig. 6-12 Espacement des incisions sur une cornée d’un patient opéré en IntraCOR®.
a. Mesure au Pentacam®. b. Mesure en OCT.
(Clichés de T. Guedj, A. Danan et D.A. Lebuisson.)
L’étude topographique réalisée en postopératoire permet de vérifier plusieurs points essentiels : le centrage du traitement, l’efficacité de la procédure par l’analyse des modifications kératométriques sur le plan tangentiel et sagittal, ainsi que l’appréciation des modifications d’asphéricité cornéenne induites.
L’analyse topographique pré- et postopératoire est possible à partir des topographes de type Placido ou des topographes dits d’élévation, notamment les dispositifs Orbscan® (Technolas Perfect Vision) ou Pentacam® (Oculus). Ces derniers apprécient de manière plus globale plusieurs paramètres cornéens. Les cartes différentielles entre la topographie postopératoire et préopératoire ont également un intérêt primordial pour l’étude du centrage et l’analyse du pouvoir optique induit par la procédure.
Quels que soient les auteurs, le centrage de la procédure IntraCOR® s’avère crucial pour la bonne efficacité du traitement. En topographie de type Placido (fig. 6-13) ou en topographie d’élévation de type Orbscan® (fig. 6-14), la présence d’un bombement central situé au centre de l’anneau des 3 mm de diamètre semble être un élément clinique en faveur d’un bon centrage. Ce bombement est caractérisé par une modification de la kératométrie centrale. Le mode « profil » de la carte différentielle a permis d’apporter des éléments diagnostiques précieux pour la compréhension des modifications morphologiques induites par la procédure IntraCOR®. Il est apparu que l’analyse différentielle en mode tangentiel de la face antérieure de la cornée semblait être la plus adaptée pour optimiser l’analyse topographique (fig. 6-15). Grâce à cette visualisation en profil, il est possible d’apprécier le centrage de la procédure en vérifiant que le sommet du bombement est proche du reflet de Purkinje, visualisé sur la cartographie Orbscan® par un point blanc (fig. 6-15).
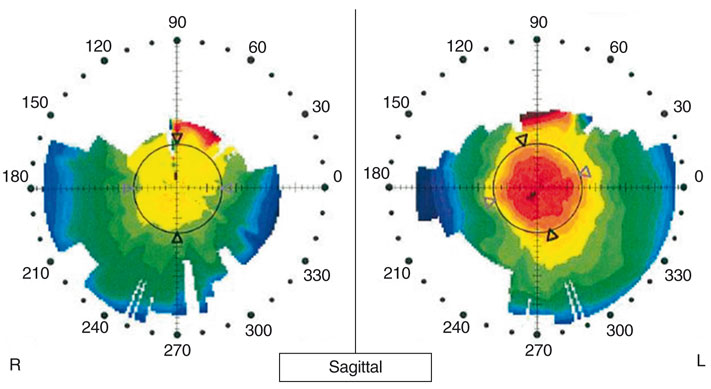
Fig. 6-13 Topographie cornéenne de type Placido.
L’œil gauche a bénéficié d’une procédure IntraCOR®. En comparaison avec l’œil adelphe non opéré, on note un bombement central et centré dans l’aire des 3 mm de diamètre.
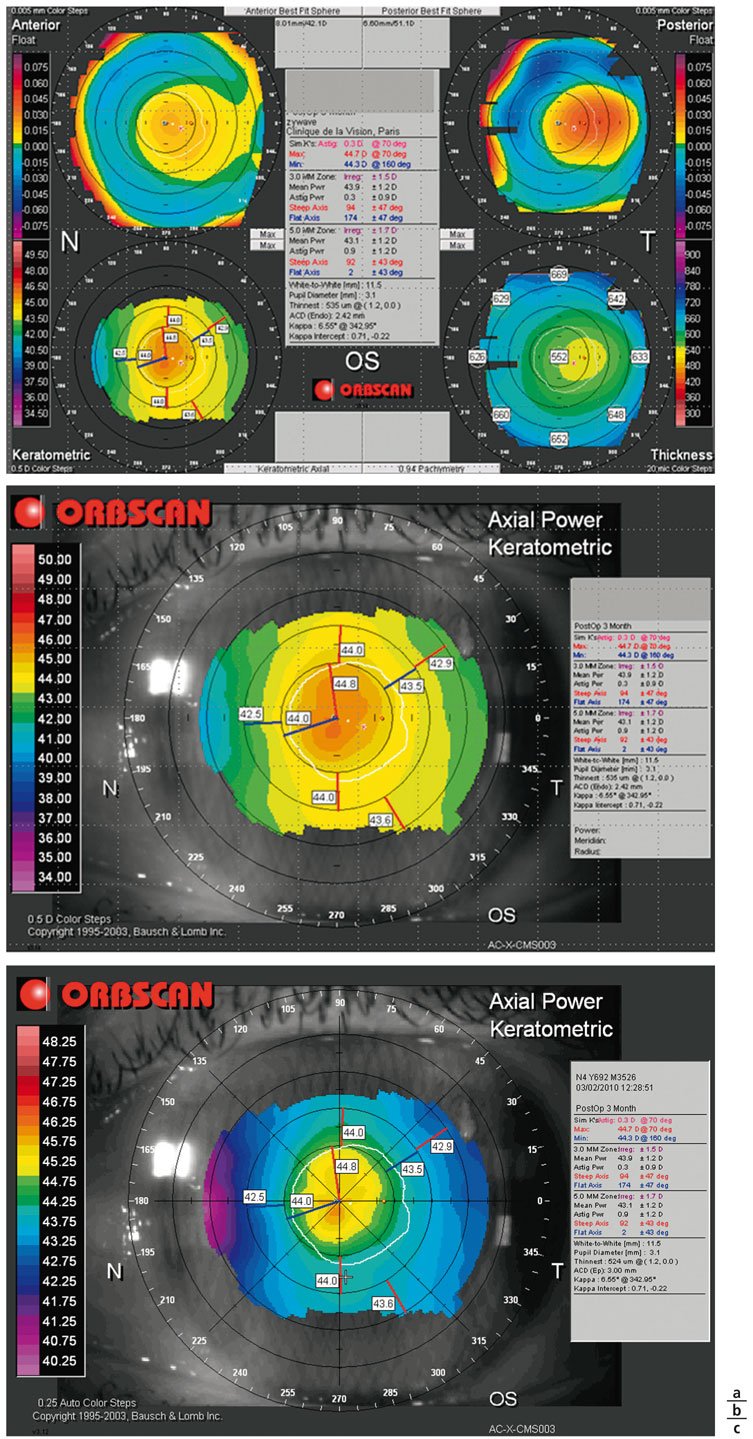
Fig. 6-14 Topographie cornéenne de type Orbscan®.
a. Carte de topographie d’élévation après traitement IntraCOR® centré. b. Carte de topographie axiale. Le bombement central respecte l’anneau des 3 mm de diamètre. c. Carte de topographie axiale. Accentuation colorimétrique par modifi cation du choix de l’échelle personnalisée dite « autoscale ».
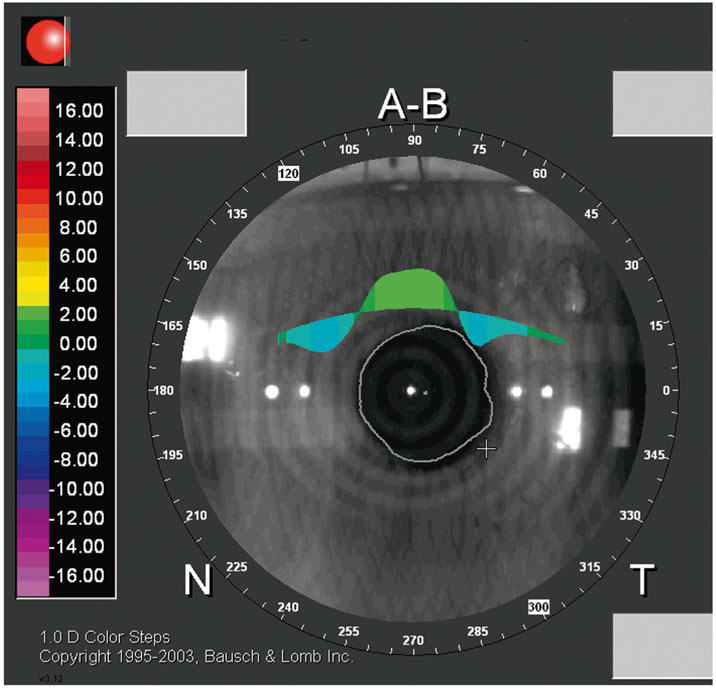
Fig. 6-15 Carte différentielle en mode tangentiel de la face antérieure, visualisation en profil.
Le trait en pointillé visualise l’axe sur lequel l’effet kératométrique est maximal. Ici, le traitement est centré et a permis d’induire une différence cornéenne de 3,59 D visualisée sur le méridien 0-180°.
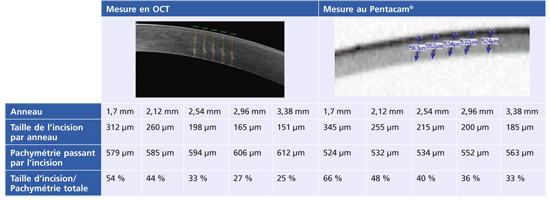
Tableau 6-I Variation de la longueur des incisions du centre vers la périphérie. (Données : Tony Guedj.)
Le traitement IntraCOR® induit pour tous les patients une augmentation de la kératométrie centrale.
Compte tenu de localisation de cette modification kératométrique, son évaluation peut être variable en fonction du mode de mesure des topographes cornéens.
Dans une première série de cinquante yeux publiée lors du congrès 2010 de la Société Française d’Ophtalmologie [1], Catherine Albou-Ganem et al. ont mis en évidence une variation moyenne de la kératométrie centrale de 1,10 D, précisant une valeur préopératoire moyenne de 42,44 ± 0,78 D [41,25-43,35] et une valeur moyenne postopératoire moyenne de 43,54 ± 1,18 D [41,5-44,6]. Le système utilisé lors de cette étude est l’autokératomètre KR 7000P de la société Topcon.
La carte différentielle tangentielle de puissance cornéenne semble apporter des éléments plus précis dans l’analyse de la variation du pouvoir optique central induit par la technique IntraCOR®. En 2011, Raphaël Amar et al. ont publié une série de cinquante yeux [4] à partir de laquelle plusieurs paramètres ont pu être évalués. Parmi ces paramètres, l’analyse des résultats mentionnait une variation maximale moyenne de la puissance cornéenne centrale de 2,13 ± 0,76 D [0,53-3,62] obtenue par la carte différentielle tangentielle. Cette valeur était calculée à partir de la moyenne de la variation de puissance maximale sur les méridien 0-180° et 90-270° (fig. 6-15). L’analyse des cartes différentielles révèle un gradient de puissance optique cornéenne induite par la chirurgie, augmentant de la périphérie vers le centre du bombement. Il semblerait que cette variation du pouvoir optique cornéen central justifie l’amélioration de l’acuité visuelle de près postopératoire. La modification kératométrique centrale observée serait à l’origine d’une modification de l’asphéricité de la face antérieure de la cornée et donc d’une modification de l’aberration sphérique cornéenne. Ces modifications morphologiques et aberrométriques cornéennes justifieraient, pour leur part, une augmentation de la profondeur de champ obtenue en postopératoire.
Plusieurs auteurs confirment une augmentation de l’asphéricité cornéenne obtenue après traitement IntraCOR®. Luis A. Ruiz et al. ont publié en octobre 2009 une variation proportionnelle de l’asphéricité de la face antérieure et de la face postérieure de la cornée. Pour la face antérieure, sur une zone de 6 mm, l’asphéricité préopératoire était équivalente à – 0,342 D et à – 0,402 D en postopératoire. Concernant la face postérieure, les valeurs passaient de – 0,494 D en préopératoire à – 0,578 D en postopératoire[ 26]. Mike P. Holzer et al. confirmaient en 2009 cette tendance sur une série de vingt-cinq yeux. Pour la face antérieure, la valeur préopératoire était de – 0,20 ± 0,16 et la valeur postopératoire à – 0,26 ± 0,18. Concernant la face postérieure, sur une zone d’analyse identique de 6 mm, l’asphéricité cornéenne passait de – 0,34 ± 0,16 à – 0,41 ± 0,16 [11].
L’étude des aberrations induites après traitement IntraCOR® a permis de mettre en évidence une modification minime des aberrations optiques totales associée à une modification de l’aberration sphérique postopératoire qui « s’hypernégative ». Cette modification de l’aberration sphérique semble être due à la variation de l’asphéricité cornéenne de la face antérieure de la cornée observée après traitement. Cette modification de l’aberration sphérique participerait à l’induction d’une augmentation de la profondeur de champ postopératoire. Luis A. Ruiz rapporte, en 2009, une variation des aberrations totales (total RMS) de 0,537 µm en préopératoire à 0,586 µm en postopératoire mesurées par l’aberromètre WASCA®. Cette même variation évaluée par le système Tracey met en évidence des valeurs de 0,547 µm en préopératoire et de 0,493 µm en postopératoire. En analysant spécifiquement la valeur de l’aberration sphérique à partir des mesures prises par le système WASCA®, celle-ci passe de 0,049 µm en préopératoire à – 0,111 µm en postopératoire. Le système Tracey mesure la même tendance, de 0,08 µm en préopératoire à – 0,065 µm en postopératoire [26]. En 2011, Raphaël Amar et al. confirment lors du congrès de l’ASCRS cette tendance sur une série de cinquante-deux yeux. Les valeurs publiées sont obtenues à partir du système ZyWave® sur une zone de 6 mm. Les aberrations totales (total RMS) passent de 1,1 ± 0,47 µm [0,59-2,19] en préopératoire à 0,94 ± 0,31 µm [0,45-1,41] en postopératoire. Concernant les aberrations de haut degré, la variation des valeurs était très faible : 0,47 ± 0,23 µm [0,20-0,65] en préopératoire contre 0,51 ± 0,19 µm [0,34-0,86] en postopératoire [5]. Plusieurs auteurs confirment une faible variation des valeurs des autres aberrations de haut degré mesurées en postopératoires[7, 11, 26].
Ces résultats appuient l’hypothèse selon laquelle la faiblesse des effets secondaires ressentis en postopératoire serait due en partie à l’absence de modification significative des aberrations optiques induite par le traitement.
Les résultats de méthodes d’évaluation des aberrations optiques fondées sur des zones d’analyse plus larges que la zone réelle de traitement seraient cependant des éléments à intégrer dans la discussion des résultats obtenus.
La résistance (CRF, Corneal Resistance Factor) et l’hystérésie cornéenne (CH, Corneal Hysteresis) mesurées avec l’Ocular Response Analyser (ORA) ne sont pas affectées par les incisions stromales de l’IntraCOR® [1]. Pour Luis A. Ruiz, les valeurs moyennes de résistance cornéenne préopératoires sont de 9,55 mm Hg et sont en postopératoires de 8,97 mm Hg ; les valeurs moyennes de l’hystérésie cornéenne étaient équivalentes à 9,69 en préopératoire et 9,71 en postopératoire [26].
La pachymétrie centrale n’est pas affectée par le traitement IntraCOR®[1, 12].
L’étude de la microscopie spéculaire après traitement IntraCOR® ne montre aucune détérioration de la densité cellulaire endothéliale [26].
Les premiers résultats réfractifs publiés par Luis A. Ruiz, avec un recul de plus d’un an sur quatre-vingt-trois yeux de quarante-cinq patients [25], font état, sur la totalité des yeux traités, d’une acuité visuelle moyenne de loin de 0,98 et 0,92 de près ; 91,6 % des yeux traités ont une acuité visuelle de près supérieure ou égale à Jaeger 2 et 69,9 % lisent Jaeger 1 (Parinaud 2). La profondeur de champ moyenne s’étale de 26 cm à 45 cm. Le shift myopique moyen de – 0,47 D reste stable les six premiers mois et diminue très légèrement pour atteindre – 0,39 D à un an.
Ces résultats ont été confirmés par plusieurs équipes.
Mike Holzer et al. rapportent les résultats d’une étude à trois mois de vingt-cinq yeux de vingt-cinq patients opérés de leur œil dominé [11]. L’acuité visuelle de près moyenne passe de 0,7 ± 0,16 logMAR à 0,26 ± 0,21 logMAR, parallèlement à une modification minime de l’acuité visuelle de loin moyenne, qui passe de 0,11 ± 0,11 logMAR à 0,05 ± 0,1 logMAR ; 54,2 % des yeux opérés ont une acuité visuelle de loin supérieure à 20/25 et lisent Jaeger 3 ou mieux.
Sinan Goker et al. rapportent les résultats de cent soixante-dix yeux de quatre-vingt-dix-huit patients avec neuf mois de recul [9]. Ils confirment l’amélioration de l’acuité visuelle moyenne de près, qui passe de Jaeger 13,3 à Jaeger 2,3.
Les résultats de l’étude européenne multicentrique avec un recul d’un an présentée par Michael Knorz [13] sur soixante-trois patients opérés de leur œil dominé montrent un gain de l’acuité visuelle de près de 4,7 lignes en moyenne.
Lors du congrès de la Société Française d’Ophtalmologie en 2011, Catherine Albou-Ganem et al. ont présenté les résultats de cent yeux de cent patients à douze mois postopératoires [3]. L’acuité visuelle de loin sans correction de l’œil opéré diminue non significativement au cours du suivi postopératoire, passant en moyenne de 0,86 à 0,85 (fig. 6-16). En notation logMAR, l’acuité visuelle de loin sans correction de l’œil traité était stable entre l’état pré- et postopératoire à 0,07 logMAR. En vision de près, l’acuité visuelle sans correction augmente de 0,58 à 0,09 logMAR (fig. 6-17). Concernant les valeurs réfractives observées, l’équivalent sphérique passe de + 0,46 ± 0,33 [– 0,37- + 1,12] en préopératoire à – 0,18 ± 0,31 [– 1,12-0] à douze mois postopératoires. Le shift myopique calculé sur l’équivalent sphérique dans cette série de cent yeux est en moyenne de – 0,64 D.
Ces résultats sont superposés à ceux de l’équipe d’Hélène Proust qui retrouve, sur une série de trente-huit patients avec un recul de six mois, une amélioration moyenne de l’acuité visuelle de près de cinq lignes et une acuité visuelle moyenne de près supérieure ou égale à Parinaud 3 pour 70 % des patients [22].
Quant à la profondeur de champ, une autre étude comparative avec d’autres moyens de correction de la presbytie retrouve pour l’intraCOR® un parcours d’accommodation à Parinaud 2 entre 27 cm et 67 cm [2].
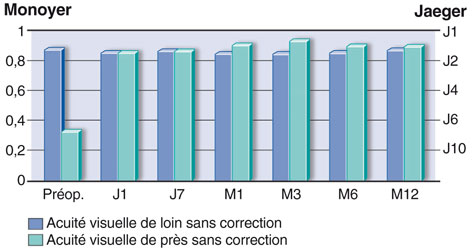
Fig. 6-16 Évolution de l’acuité visuelle de loin et de près en Monoyer et Jaeger au cours de la première année.

Fig. 6-17 Évolution de l’acuité visuelle de loin et de près en log-MAR au cours de la première année.
La prédictibilité des incisions intrastromales à ± 0,5 D est, selon les études, entre 75 % et 94 % [7, 12, 22, 26]. Il n’a pas été retrouvé de facteurs de prédictibilité, tels que la kératométrie, la pachymétrie, la tension oculaire ou la résistance cornéenne[6, 8].
Aucune équipe ne rapporte de baisse de la meilleure acuité visuelle corrigée supérieure à deux lignes[1, 7, 12, 13, 22, 26].
La correction de la presbytie par incisions intrastromales est une technique récente. Luis A. Ruiz, qui a opéré les premiers patients, a maintenant un recul de cinq ans. Ses résultats publiés à trois ans montrent une stabilité de la réfraction de loin et de près [27].
Les résultats des différentes études publiées fondées sur le même protocole de cinq incisions circulaires autour d’une zone optique de 1,7 mm et espacés de 200 µm semblent superposables[3, 6, 9, 10, 22] : 70 % à 85 % des yeux opérés ont une acuité visuelle de loin supérieure ou égale à 8/10 et une acuité visuelle de près supérieure ou égale à Parinaud 2. Ce taux augmente en cas de retraitement, qui permet en moyenne de doubler le résultat de la première procédure [19].
L’IntraCOR® semble trouver toute sa place dans le traitement de la presbytie chez le patient emmétrope ou faiblement hypermétrope ayant un examen ophtalmologique normal : la technique est moins invasive qu’un LASIK ; elle reste généralement unilatérale car le confort des patients opérés uniquement de l’œil dominé est le plus souvent suffisant pour leur quotidien ; la sécurité est bonne car le taux de baisse de la meilleure acuité visuelle de loin et de près est très faible ; le risque essentiel de la technique est la sous-correction qui peut bénéficier du protocole Re-COR®, c’est-à-dire d’une nouvelle procédure identique [19].
Le shift myopique induit par le traitement fait préférer à beaucoup d’équipes un traitement unilatéral sur l’œil dominé, en tout cas dans un premier temps. Celui-ci suffit la plupart du temps à donner aux patients une indépendance de leurs verres correcteurs. La firme Technolas Perfect Vision l’impose dans ses recommandations. La chirurgie du second œil peut être proposée dans un deuxième temps si l’acuité visuelle de loin sans correction est conservée, s’il n’existe pas d’effets secondaires délétères et si le patient est demandeur. Il faudra l’informer tout particulièrement de la légère baisse possible de la vision de loin.
Le concept du retraitement, ou protocole Re-COR®, est développé à partir du modèle biomécanique de la striction cornéenne apicale. Le retraitement complète la modification géométrique de l’arc cornéen en appliquant un second traitement. La technique est semblable à celle de la première procédure — centrage, nombre d’incisions et diamètre identiques.
Le bilan objectif postopératoire du premier traitement vérifie l’action du laser femtoseconde, le bon centrage et l’effet topographique cornéen, qui peut être quantifié. Le bilan subjectif note l’acuité visuelle de loin, l’acuité visuelle de près et la satisfaction du patient opéré. Si ces examens concluent à une insatisfaction due à une sous-correction après une première procédure IntraCOR® complète et bien centrée, le patient peut être traité de nouveau.
Sur dix cas présentés (tableau 6-II), tous opérés à la Clinique de la Vision (Paris, 2011) [19], le premier traitement avait apporté une modification kératométrique moyenne de + 1,48 ± 0,31 D [0,78-1,84] associée à une acuité de près passant de Parinaud 8,6 [P6-P10] à Parinaud 5,8 [P4-P8] et à une insatisfaction des patients. Les auteurs rapportent que le retraitement a doublé l’effet kératométrique, avec un gain moyen à + 3,13 ± 0,52 D [2,12-3,65] (fig. 6-18) améliorant l’acuité moyenne de près sans correction à Parinaud 2,5 [P1,5-P4], garantie de l’autonomie des opérés et de leur satisfaction. Le retraitement des patients permet de doubler le résultat obtenu après le premier traitement, la cornée semblant réagir de manière identique à chaque procédure. Le facteur multiplicatif du retraitement est en moyenne de 2,2 ± 0,43 [1,56-2,82].
Les incisions secondaires sont parfois parfaitement superposées aux premières mais un décalage minime est possible, sans incidence sur l’acuité visuelle ou la qualité de vision (fig. 6-19).
Une des limites attribuées initialement par certains auteurs au traitement IntraCOR® était son caractère « one shot ». Le retraitement Re-COR® a permis de dépasser cette limite avec des résultats probants. Le retraitement permet en effet, à la condition d’un centrage primitif convenable, d’apporter aux candidats un résultat satisfaisant en un ou deux temps.
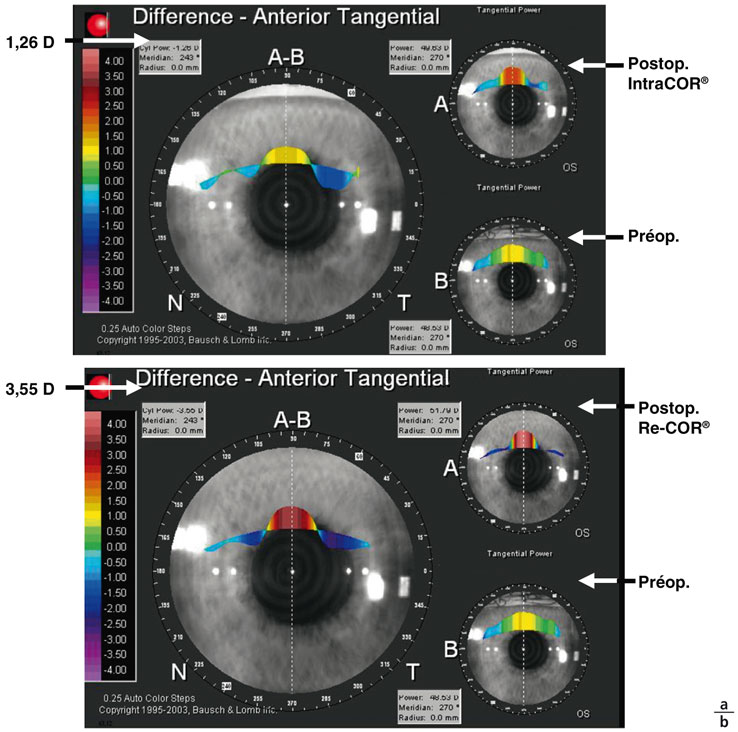
Fig. 6-18 Analyse du bombement central en topographie différentielle en mode tangentiel avant et après retraitement selon le protocole Re-COR®.
a. Avant et après le premier traitement IntraCOR®. b. Après le retraitement en protocole Re-COR®.

Fig. 6-19 Cornée après retraitement selon la même procédure. Les incisions peuvent être congruentes ou non, sans retentissement sur l’acuité visuelle.
a. Incisions congruentes. b. Incisions non congruentes.
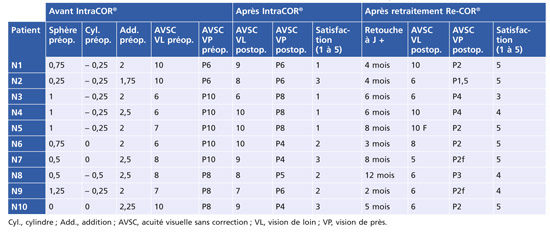
Tableau 6-II IntraCOR® suivi de Re-COR® : évolution de l’acuité visuelle de loin et de près.
Il est également possible de corriger certaines amétropies associées ou secondaires au traitement IntraCOR® par une photoablation de surface. Ce traitement peut être proposé simultanément ou, mieux — du fait du shift myopique difficile à anticiper —, à distance du traitement intrastromal, surtout en cas d’hypermétropie supérieure à celle entrant dans les indications de l’IntraCOR®, c’est-à-dire supérieure ou égale à 1 D. La photoablation de surface peut alors induire un haze plus marqué que pour un traitement de première intention [8].
Il semble risqué de pratiquer un LASIK après un traitement intrastromal ou un traitement intrastromal après un LASIK, surtout si le volet a été fait avec un microkératome et qu’il dépasse 100 µm d’épaisseur, car il est difficile, même après vérification en OCT, de garantir l’absence de croisement entre les incisions intrastromales et le plan du volet. Cette intersection des incisions, qui rend la réponse cornéenne donc le résultat imprédictibles, est source d’une baisse de la meilleure acuité visuelle corrigée. Un cas d’ectasie cornéenne bilatérale sans aucun facteur de risque dans la classification de Randleman [23] a été décrit après incisions intrastromales sur un LASIK hypermétropique stable [28].
Comme il a été vu précédemment, le traitement IntraCOR® induit un shift myopique qui est en moyenne de – 0,3 D à – 0,6 D[3, 6, 10, 22, 25]. Ce shift myopique est responsable d’une modification de l’acuité visuelle de loin. Celle-ci est améliorée chez les patients légèrement hypermétropiques, qui restent l’indication idéale de ce traitement, car ils conservent une acuité visuelle sans correction supérieure ou égale à 8/10, mais elle peut être diminuée chez les patients emmétropes. Cette diminution de l’acuité visuelle de loin est modérée et les études ne rapportent pas ou peu d’acuité visuelle sans correction inférieure ou égale à 6/10[3, 6, 10, 22, 25].
Les patients doivent être informés de cette modification possible de l’acuité visuelle de loin.
C’est pour cette raison que la plupart des auteurs proposent une chirurgie unilatérale sur l’œil dominé.
La modification de la courbure de la cornée centrale ainsi que l’augmentation de l’aberration sphérique négative qui augmentent la profondeur de champ sont responsables de phénomènes de halos, rapportés essentiellement au cours de la conduite nocturne. Ces halos seraient moindres que ceux induits par les implants multifocaux et sont le plus souvent décrits comme peu invalidants[1, 6, 11, 22, 25].
Il est actuellement difficile de prédire le résultat obtenu et si certains patients obtiennent une acuité visuelle de près à Parinaud 1,5 tout en conservant 10/10 de loin, 20 % à 25 % ne lisent pas Parinaud 3. Il n’a été retrouvé aucun facteur de prédictibilité[6, 8]. Cependant, les patients qui n’obtiennent pas un gain en vision de près suffisant peuvent bénéficier d’un nouveau traitement identique [19].
Les incisions intrastromales présentent l’avantage d’annuler les risques d’infection, de sécheresse oculaire ou ceux liés à une découpe cornéenne superficielle. Le risque essentiel des incisions intrastromales est le décentrement lié à la petite taille de la zone optique de traitement et au fait que le recentrage des anneaux, une fois le cône d’aplanation inséré dans l’anneau de succion, ne peut se faire que sur un diamètre de 400 µm. Le centrage est donc crucial, d’autant qu’aucune technique n’a été proposée pour recentrer les traitements mal centrés et que, en cas d’aberrations induites, seules des photoablations à excimères réalisées en surface sont possibles du fait du risque de croisement des incisions circulaires avec le plan du volet [28]. Il faut donc considérer ce traitement comme irréversible.
Il faut par ailleurs préciser que cette technique est récente et que les indications sont limitées, car elle est réservée à des patients emmétropes ou faiblement hypermétropes, ce qui explique que les séries portent sur un nombre faible de patients. Des études à plus long terme permettront de vérifier l’innocuité de la procédure et sa stabilité, notamment en ce qui concerne la biomécanique de la cornée.
De nouveaux traitements sont actuellement en évaluation en dehors des indications recommandées par la firme pour la correction intrastromale de la presbytie. Ces évaluations portent sur le traitement de la presbytie chez les patients strictement emmétropes ou faiblement myopes, grâce à l’association d’incisions circulaires et radiaires [12]. Une première étude rapporte les résultats de patients dont l’équivalent sphérique préopératoire moyen se situe entre – 0,125 D et – 0,25 D. L’acuité visuelle moyenne de près sans correction à un an passe de 0,60 logMAR (s’échelonnant entre 0,30 et 0,80) en préopératoire à 0,10 logMAR (s’échelonnant entre 0,00 et 0,20) et l’acuité visuelle moyenne de loin sans correction passe de 0,00 logMAR (s’échelonnant entre 0,10 et 0,20) en préopératoire à 0,10 logMAR (s’échelonnant entre 0,20 et 0,10). D’autres protocoles incluant un plus grand nombre d’incisions sont également évalués par Luis A. Ruiz en Colombie pour la correction des hypermétropes [27].


[1] Albou-Ganem C., Danan A., Lebuisson D.A. et al. Correction intrastromale de la presbytie par IntraCOR®. Premiers résultats. Free paper, Congrès de la Société Française d’Ophtalmologie 2010, Paris.
[2] Albou-Ganem C., Amar R. Pseudoaccommodation résiduelle après chirurgie de la presbytie par IntraCOR®, implant multifocal ATLisa, Fine Vision et LASIK hyperprolate. Free paper SAFIR 2011 Paris.
[3] Albou-Ganem C., Pages C., Danan A. et al. Correction chirurgicale de la presbytie par IntraCOR®. Résultats à 15 mois. Free paper, Congrès de la Société Française d’Ophtalmologie 2011, Paris.
[4] Amar R., Albou-Ganem C., Lebuisson D.A. et al. Intracor® : pupillo-dépendance et variation de l’asphéricité cornéenne. Free paper, SAFIR 2011, Paris.
[5] Amar R., Albou-Ganem C., Lebuisson D.A. et al. Corneal asphericity and high-order aberrations after intrastromal presbyopia correction. E-poster, ASCRS 2011, San Diego.
[6] Danan A., Albou-Ganem C., Lebuisson D.A. et al. Facteur de prédictibilité de l’IntraCOR®. Free paper, SAFIR 2011, Paris.
[7] Goker S., Ayoglu B. Intrastromal presbyopic treatment. Free paper, ESCRS 2009, Barcelone.
[8] Goker S., Ayoglu B., Orucolu F., Toksu B. Evaluation of factors effecting success rate in eyes performed with IntraCOR® for presbyopia. Free paper, ESCRS 2010, Paris.
[9] Guedj T., Danan A., Lebuisson D.A. In-vivo architectural analysis of intrastromal incisions after IntraCOR® surgery using Fourier domain OCT and Scheimpflug imaging. Free paper, ESCRS 2010, Paris.
[10] Hagège A. HyperCOR : nouvelle technique combinant IntraCOR® et photoablation hypermétropique. Free paper, Congrès de la Société Française d’Ophtalmologie 2011, Paris.
[11] Holzer M.P., Mannsfeld A., Ehmer A., Auffarth G.U. Early outcomes of IntraCOR® femtosecond laser treatment of presbyopia. J Refract Surg, 2009 ; 25 : 855-61.
[12] Holzer M.P., Ehmer A., Rabsilber T.M., Auffarth G. Expansion of intrastromal presbyopic femtosecond treatment: one-year outcomes of pattern for emmetropic presbyopia. Free paper, ASCRS 2011, San Diego.
[13] Knorz M. 12-months European Data IntraCOR®. Cataract & Refractive Surgery Today, June 2010 : 3-5.
[14] Krueger R.R. Biomechanical manipulation: The next frontier in corneal refractive surgery. J Refract Surg, 2009 ; 25 : 837-40.
[15] Lubatschowski H., Maatz G., Heisterkamp A. et al. Application of Ultrashortlaserpulses for intrastromal refractive surgery. Graefe’s Arch Clin Exp Ophthalmol, 2000 ; 238 : 33-9.
[16] McDonnald M.B., Hersh P.S., Manche E.E. et al. Conductive keratoplasty United States invertigators Group. Conductive keratoplasty for the correction of low to moderate hyperopia: U.S. clinical trial 1-year results on 355 eyes. Ophthalmology, 2002 ; 109 : 1978-89.
[17] Meltendorf C., Burbach G.J., Bühren J. et al. Corneal femtosecond laser keratotomy results in isolated stromal injury and favorablewound-healing reponse. InvestOphthalmol Vis Sci, 2007 ; 48 : 2068-75.
[18] Muller L.J., Pels E., Vrensen G.F. The specific architecture of the anterior stroma accounts for maintenance of corneal curvature. Br J Ophthalmol, 2001 ; 85 : 437-43.
[19] Pages C., Albou-Ganem C., Danan A. et al. Re-COR®: under correction treatment after IntraCOR®. E-poster ESCRS 2011.
[20] Pallikaris I.G., Papatzanaki M.E., Hrenschock O., Georgiadis A. Laser in situ keratomileusis. Lasers Surg Med, 1990 ; 10 : 463-8.
[21] Peyre C. Œil dominant, œil dominé : lequel choisir en contactologie ? Réalités Ophtalmologiques, 2008 ; 151 : 52-3.
[22] Proust H., Hoffart L., Combes J. et al. IntraCOR® treatment of presbyopia: 6 months follow up. ESCRS 2010, Paris.
[23] Randleman J.B., Woodward M., Lynn M.J., Stulting R.D. Risk assessment for ectasia after corneal refractive surgery. Ophthalmology, 2008 ; 115 : 37-50.
[24] Ratkay-Traub I., Juhnasz T., Horvath C. et al. Ultra-short pulse (femtosecond) laser surgery. Ophthalmol Clin N Am, 2001 ; 14 : 347-54.
[25] Ruiz L.A. Intrastromal correction of presbyopia using a femtosecond laser system (IntraCOR®). First results. Free paper, WOC 2008, Hong Kong.
[26] Ruiz L.A., Cepada L.M., Fuentes V.C. Intrastromal correction of presbyopia using a femtosecond laser system. J Refract Surg, 2009 ; 25 : 847-54.
[27] Ruiz L.A. Expanding IntraCOR®. Free paper, 2nd Technolas Perfect Vision Alliance Meeting 2010 Beijing.
[28] Saad A., Grise-Dulac A., Gatinel D. Bilateral loss in the quality of vision associated with anterior corneal protrusion after hyperopic LASIK followed by intrastromzlfemtolaser-assisted incisions. J Cataract Refract Surg, 2010 ; 36 : 1994-8.
[29] Seiler T., McDonnel P.J. Excimer laser photorefractivekeratectomy. Surv Ophthalmol, 1995 ; 40 : 89-118.
[30] Sugar A. Ultrafast (femtosecond) laser refractive surgery. Curr Op Ophthalmol, 2002 ; 13 : 246-9.
[31] Touboul D., Salin F., Mortemousque B. et al. Effets tissulaires et mécaniques observés lors de l’expérimentation d’un microkératome laser femtoseconde pour la chirurgie réfractive cornéenne. J Fr Ophtalmol, 2005 ; 28 : 274-8.

