C. Albou-Ganem, D. Gatinel
Les lenticules intrastromaux (ou inlays cornéens) connaissent depuis ces dernières années un regain d’intérêt par le développement de modèles spécifiques à la correction chirurgicale de la presbytie. L’enjeu est connu : cette procédure appartient aux chirurgies compensatrices de la perte d’accommodation.
Si l’atout majeur des inlays intracornéens est leur réversibilité, leur biocompatibilité constitue une nécessité incontournable pour une tolérance à long terme. De nouvelles générations d’inlays appuyés par des dispositifs de centrage plus sophistiqués semblent donner une impulsion nouvelle à cette technique. La technologie assistée par laser femtoseconde est venue renforcer la précision et la reproductibilité de la technique d’implantation.
Les inlays sont des lenticules qui se placent en position intrastromale, soit après découpe d’un volet soit après réalisation d’une « poche » par laser femtoseconde. Dans ce chapitre sont décrits les différents types d’inlays, leurs principes d’action et les résultats préliminaires ou publiés.
Trois modèles d’inlays sont actuellement distribués :
– l’inlay KAMRA® (AcuFocus), agissant par effet sténopéique sur la profondeur de champ induite ;
– l’inlay Vue+®, anciennement PresbyLens® (ReVision Optics), agissant sur la courbure de la cornée antérieure ;
– l’inlay Flexivue Microlens® (Presbia), agissant sur la puissance cornéenne centrale par variation de l’addition.
L’insertion de lenticules intracornéens dans le but de modifier le pouvoir réfractif de l’œil est un concept connu et ancien.
José Barraquer a été dans ce domaine une fois encore un pionnier. Dès 1949, il met en évidence la relation existant entre l’épaisseur de la cornée et son pouvoir réfractif et décrit sous le terme de « kératoplastie réfractive » une technique visant à corriger l’aphaquie et les fortes amétropies en insérant dans la cornée un lenticule artificiel transparent dans le but d’en modifier la puissance par augmentation de sa courbure [3]. Cependant, les résultats réfractifs étaient imprécis et le matériel en silex de verre utilisé à l’époque était imperméable à l’eau, aux électrolytes et aux métabolites cornéens, ce qui aboutissait à une nécrose stromale antérieure suivie de l’expulsion de l’implant[3, 13].
Après une longue période d’étude de la physiologie cornéenne et grâce à l’utilisation de nouveaux matériaux en hydrogel, les implants intracornéens suscitent un regain d’intérêt dans les années soixante[4, 5]. Mais les performances optiques et la biotolérance n’étaient toujours pas satisfaisantes, générant des complications graves à type d’œdème puis d’opacification cornéenne avec néovascularisation[4, 18, 21], d’amincissement cornéen[7, 20], d’invasion épithéliale [23] et même de nécrose aseptique du stroma antérieur avec extrusion du lenticule [15].
Toutefois, l’avantage de ce concept — son caractère réversible — a encouragé les équipes de recherche et développement à poursuivre dans cette voie et, après de nombreuses années de tâtonnement, des inlays en hydrogel ont été implantés avec des résultats visuels satisfaisants et une bonne prédictibilité, tout en étant mieux tolérés par la cornée[8, 19, 26]. Cette période de transition a permis de confirmer la réversibilité de la technique, avec restitution ad integrum de la transparence cornéenne si l’inlay est retiré dès qu’un haze survient [1]. Les qualités indispensables du matériau ont été également définies : être biocompatible, ne pas perturber le métabolisme et la physiologie cornéenne, être optiquement actif et entraîner des modifications réfractives prédictibles et durables[16, 17]. Enfin, la profondeur d’insertion, le diamètre et l’épaisseur de l’inlay ont été optimisés[9, 18] : il a été établi que l’implant doit être placé suffisamment profondément dans le stroma antérieur, dans une zone comprise entre 36 % et 60 % de l’épaisseur cornéenne, mais avec une technique peu invasive pour minimiser la réaction kératocytaire cicatricielle. L’arrivée du laser femtoseconde a permis d’améliorer largement la précision et le contrôle de la profondeur d’insertion de l’inlay, tout en diminuant le traumatisme chirurgical de la cornée. Il a également été établi qu’un diamètre inférieur à 4 mm pouvait faciliter le métabolisme cornéen. Par ailleurs, la puissance de l’inlay ne doit pas dépasser un certain seuil pour en limiter l’épaisseur, celle-ci devant être inférieure à 0,3 mm [25]. Le matériau doit de surcroît respecter certaines contraintes : présenter une résistance thermique, chimique et à la déformation, être bioperméable pour permettre le passage de l’oxygène et des nutriments et autoriser les échanges métaboliques dans la cornée, la plupart des complications à plus ou moins long terme étant secondaires à des complications métaboliques [1].
Après avoir été utilisés pour la correction de l’aphaquie et de l’hypermétropie, les inlays sont utilisés actuellement dans le cadre de la correction de la presbytie. Ils présentent l’avantage de la réversibilité. Ces inlays sont en hydrogel (Flexivue Microlens®, Vue+®), matériau perméable aux nutriments [19], ou en polymère de synthèse (KAMRA®). Leur tolérance semble bonne mais le recul n’atteint pas encore dix ans et les études publiées encore peu nombreuses.
Le dispositif KAMRA® (AcuFocus, Irvine, Californie) est un implant intracornéen (corneal inlay) destiné à corriger la presbytie. Le principe de cette technique est celui du sténopé. La création d’une « néopupille », d’un diamètre égal à 1,6 mm, permet d’augmenter la profondeur de champ, pour contrer la perte de l’accommodation. La pose de l’implant se fait sous anesthésie locale en ambulatoire. Elle peut s’accomplir chez les patients presbytes emmétropes, hypermétropes ou myopes. Chez les amétropes, elle vise à restaurer la vision de près sans corriger par l’implant lui-même l’amétropie associée, requérant alors une photoablation complémentaire.
Comme pour les autres corrections en chirurgie réfractive, les résultats dépendent de la sélection rigoureuse des candidats et de l’exécution minutieuse de la technique chirurgicale. Un bilan ophtalmologique préopératoire détaillé et le respect des contre-indications sont essentiels pour l’obtention d’un bon résultat fonctionnel.
L’implant KAMRA® est un dispositif dont la morphologie est celle d’un disque percé (fig. 10-1). Le matériau de l’implant KAMRA® est à base de polyfluorure de vinylidène (PVDF, polyvinylidene fluoride), auquel du carbone est ajouté afin d’en foncer la couleur. Le PVDF est un matériau hautement biocompatible, utilisé en chirurgie ophtalmique pour la réalisation des anses des implants de cataracte. L’implant possède une courbure proche de 7,5 mm, afin d’épouser la courbure du lit stromal cornéen dans lequel il est placé. Il peut être décrit comme une sorte de « confetti » très fin (5 µm pour la version actuelle, 10 µm pour les premières versions). Le diamètre externe mesure 3,8 mm et le diamètre interne, correspondant à la néopupille, 1,6 mm. Outre l’orifice central (à visée optique), l’inlay possède de nombreuses microperforations (plus de huit mille) disposées de manière aléatoire et destinées à faciliter le passage des métabolites (nutriments) cornéens. Inspecté sous la lumière d’un microscope chirurgical, l’implant présente une face mate et une face brillante ; cette dernière doit être placée au contact du tissu stromal.

Fig. 10-1 Diamètre interne : 1,6 mm
Diamètre externe : 3,8 mm
Épaisseur : 5 μm
8 400 microperforations (5 à 11 μm)
Description et dimensions de l’implant KAMRA® (AcuFocus).
L’implant KAMRA® permet une augmentation de la profondeur de champ par réduction du diamètre de la pupille d’entrée de l’œil. C’est un dispositif dont le mécanisme d’action est simple (sténopé) et bien connu. C’est en utilisant ce principe qu’ont été construits les premiers systèmes capables de former des images réelles du monde environnant : la camera obscura (chambre noire), conçue à la Renaissance, consistait en une simple boîte percée d’une petite ouverture destinée à recueillir les rayons lumineux émis depuis la scène à imager. Dans certaines conditions, on pouvait observer la formation d’une image nette et inversée de la scène vers laquelle était orientée l’ouverture. Ce dispositif fut ensuite perfectionné par l’ajout de lentilles et de miroir, ce qui en fait l’ancêtre de l’appareil photographique reflex. En photographie justement, l’effet bénéfique de la réduction du diamètre du diaphragme sur la profondeur de champ est bien connu et utilisé pour que des objets situés à des distances différentes soient rendus aussi nets que possible sur le cliché (fig. 10-2). En langage technique, on joue sur l’augmentation du nombre d’ouverture (f-number), qui est le rapport entre la focale utilisée (la focale détermine la largeur du champ de la prise de vue) et le diamètre choisi pour le diaphragme. Pour une focale de 50 mm et une ouverture du diaphragme de 10 mm, le nombre d’ouverture est égal à 50/10 = 5 (noté f:5).
En « fermant » beaucoup le diaphragme (par exemple, f:20), la plage de netteté augmente : les objets ou personnages situés à des distances différentes (plans rapprochés et lointains) sont plus « nets ». Le diaphragme naturel de l’œil est la pupille irienne ; chez les patients qui présentent un léger défaut réfractif (faible myopie, faible astigmatisme), on observe souvent qu’un myosis important entraîne une amélioration de l’acuité visuelle non corrigée. La constriction pupillaire permet aux myopes légers (par exemple, – 0,50 D) d’atteindre une acuité visuelle proche de 10/10 en cas de luminosité intense. Pourtant, quand la pupille de ces patients possède un diamètre voisin de 4 mm (ambiance lumineuse « standard »), la tache d’éclairement rétinien est « agrandie » par l’extension en divergence des rayons lumineux qui convergent en avant de la rétine. Ceci réduit la résolution théorique de l’œil à 8/10 environs. En cas d’éclairement intense, le diamètre de la pupille se réduit et ceci limite l’extension du faisceau des rayons défocalisés et, donc, réduit la tache d’éclairement rétinien, ce qui augmente le pouvoir de résolution de l’œil. Lors de l’accommodation, un réflexe de constriction pupillaire survient : cette constriction favorise la vision de près par l’augmentation de la profondeur de champ, mais elle n’est pas suffisante, seule, pour permettre à un sujet presbyte de lire confortablement.
L’insertion d’un dispositif permettant de « diaphragmer » de manière permanente la pupille d’entrée à une valeur de 1,6 mm permet de rendre à l’œil opéré une réduction du flou induit par l’insuffisance d’accommodation (fig. 10-3). Cette idée a présidé au développement d’un implant intracornéen permettant d’atteindre ce but et destiné à être mis en place dans l’œil dominé de sujets emmétropes et presbytes (seul un œil est opéré).

Fig. 10-2 Illustration par l’exemple de l’effet de la fermeture du diaphragme sur la profondeur de champ.
À gauche, le diaphragme est ouvert à f:1,4 ; à droite, il est ouvert à f:16. La mise au point est effectuée dans le même plan (encadre rouge). Les encadrés bleus et verts montrent un meilleur rendu des détails dans le cas ou le diaphragme est fermé (f:16) a la fois pour les objets proches et éloignés.

Fig. 10-3 Représentation schématique de l’effet de réduction du faisceau de lumière incidente sur l’image rétinienne.
Le pinceau de rayons défocalisés est plus étroit après implantation, ce qui, pour une même défocalisation, résulte en une réduction du flou de l’image rétinienne.
Les indications concernent tous les patients presbytes (emmétropes et amétropes) pour lesquels la création d’un capot de LASIK épais (200 µm) est possible, combinée à la réalisation d’une éventuelle photoablation, dont l’importance doit tenir compte de l’épaisseur du capot, pour corriger l’amétropie de loin associée à la presbytie. En effet, une correction par laser à excimères peut être effectuée dans le même temps opératoire, pour corriger le défaut réfractif en vision de loin, avant que l’implant KAMRA® ne soit ensuite placé dans l’interface, centré sur l’axe visuel, et le capot ne soit repositionné. La réfraction idéale pour recevoir l’implant KAMRA® sans photoablation complémentaire est emmétrope ou légèrement myope (0 à – 0,75 D). Chez les sujets emmétropes (ou légèrement myopes : – 0,50 D), l’implant peut être positionné au sein du stroma cornéen grâce à la réalisation d’un tunnel intrastromal réalisé grâce au laser femtoseconde. Ce tunnel est moins pourvoyeur de changement réfractif que la découpe d’un capot stromal épais ; ainsi, il est particulièrement indiqué chez le patient emmétrope. Cette voie d’implantation est également prometteuse chez des patients ayant déjà bénéficié d’une chirurgie réfractive cornéenne, en laser de surface ou en LASIK avec un capot d’épaisseur standard. La possibilité d’insertion de l’implant chez des patients opérés de cataracte avec implant monofocal offre également des perspectives intéressantes pour la restauration d’une acuité utile non corrigée en vision de près chez les emmétropes pseudophakes.
L’œil de choix pour recevoir l’implant KAMRA® est l’œil dominé ; l’œil adelphe (directeur) peut également faire l’objet d’une correction par LASIK dans le même temps opératoire.
La présence de toute pathologie oculaire associée, en particulier cornéenne ou cristallinienne (dystrophie cornéenne, cataracte), représente une contre-indication potentielle à la pose de l’implant. L’existence d’un désordre immunitaire est également une contre-indication logique à l’implantation intratissulaire. La sécheresse oculaire doit faire l’objet d’une attention particulière : ses manifestations doivent être systématiquement recherchées ; la mesure du break-up time et l’utilisation d’un colorant vital peuvent être utiles dans certains cas.
Comme pour toutes les techniques à visée réfractive, la qualité du centrage est un élément important pour le résultat fonctionnel. Il n’existe pas de méthode courante pour identifier la localisation de l’intersection de l’axe visuel et du dôme cornéen. Elle définit une zone optique fonctionnelle pour laquelle les rayons lumineux contribuent à former une image fovéale de qualité optimale (sans induction trop marquée d’aberrations chromatiques transverses) [12]. Cette zone est généralement centrée sur un point du dôme cornéen situé entre le vertex (reflet cornéen, première image de Purkinje) et la projection du centre pupillaire [23]. L’inspection des images brutes acquise lors d’un examen topographique préopératoire (reflet Placido sur la surface cornéenne antérieure) peut être utile pour apprécier la position du vertex vis-à-vis du centre pupillaire — le vertex correspond alors au reflet de la mire centrale. En peropératoire, le repérage du vertex exige de demander au patient de fixer la lumière du filament du microscope opératoire et que celle-ci soit facilement identifiable et coaxiale au système optique du microscope — le vertex correspond alors à la projection cornéenne du reflet cornéen du filament. La possibilité de recourir au système de visée et de guidage d’un laser à excimères est une alternative possible pour illuminer l’intersection supposée entre la cornée et l’axe visuel. L’utilisation d’un système de guidage peropératoire automatisé est en cours de développement : mis au point par la société SMI (SensoMotoric Instrument) en collaboration avec AcuFocus, l’AcuTarget® permet de mesurer la position du reflet cornéen vis-à-vis du centre de la pupille avant l’intervention puis, au cours de celle-ci, de projeter sur un moniteur ou dans le microscope opératoire une image virtuelle de l’emplacement jugé optimal de l’implant. Ce système permet également de documenter la position de l’implant en postopératoire, notamment pour s’assurer du centrage adéquat en mesurant sa distance vis-à-vis du vertex cornéen et du centre de la pupille (cf. fig. 10-7).
La technique chirurgicale de pose de l’implant KAMRA® sous un volet stromal comporte une première séquence en tous points comparable à celle d’un LASIK avec laser femtoseconde (fig. 10-4). L’épaisseur recommandée pour le capot est 200 µm, afin de permettre un meilleur transfert intrastromal des nutriments de l’endothélium vers l’épithélium sus-jacent. La découpe d’un volet épais ne se conçoit que si la cornée présente des caractéristiques compatibles avec celle-ci et les mêmes précautions qu’en LASIK — topographie et tomographie préopératoire systématique, calcul de l’épaisseur résiduelle du mur postérieur — s’imposent pour éviter la survenue d’une ectasie postopératoire. Toutefois, la chirurgie de la presbytie étant réalisée chez des sujets dans leur cinquième décennie au moins, la fréquence des formes frustes de kératocône est largement inférieure à celle d’une population de jeunes myopes. Une fois l’éventuelle photoablation emmétropisante délivrée, l’interface est rincée et le capot stromal repositionné. La réalisation d’une marque circulaire sur le versant épithélial du capot est alors conseillée, afin de pouvoir apprécier la position de l’implant KAMRA® en fin d’intervention. Le capot est ensuite délicatement soulevé et l’implant correctement orienté (face mate vers le haut) avant d’être positionné sur le stroma préalablement séché. Après hydratation précautionneuse de la charnière stromale, le capot est délicatement rabattu et le centrage de l’implant vis-à-vis de la marque épithéliale peut être alors vérifié. En cas de centrage imparfait, il est conseillé de soulever à nouveau le capot et de déplacer l’implant dans la direction souhaitée. Un examen à la lampe à fente est effectué au décours de l’intervention, à la recherche d’une malposition et/ou de macroplis du capot.
Le traitement postopératoire comprend l’instillation régulière d’antibiotiques et de stéroïdes locaux en plus de larmes artificielles. Il est recommandé d’instiller un collyre corticoïde (dexaméthasone) à la posologie de quatre gouttes par jour pendant un mois, puis de deux gouttes par jour le deuxième mois, puis d’une goutte par jour le troisième mois. La pression oculaire fait l’objet d’un suivi précautionneux.
En postopératoire, une surveillance comportant un contrôle à J1, J8, J30 et J60 s’impose. Ce nombre de contrôles est nécessaire du fait de la présence d’un implant dans l’interface, qui accroît le risque inflammatoire comparé à une procédure réfractive simple. La surveillance comprend la mesure de l’acuité visuelle non corrigée de loin, de près, en mono- et binoculaire, ainsi qu’une mesure de la réfraction subjective. L’instillation de larmes artificielles permet de gagner quelques lignes de meilleure acuité visuelle non corrigée et corrigée en cas de sécheresse oculaire. À la lampe à fente, on examine l’interface et l’aspect du stroma cornéen adjacent (fig. 10-5). L’instillation de fluorescéine est indiquée pour l’étude du break-up time et la mise en évidence d’une éventuelle kératite ponctuée superficielle. L’épaisseur du capot, qui correspond à l’épaisseur de l’interface, peut être appréciée grâce à une coupe OCT (fig. 10-6).
Les images capturées par le dispositif AcuTarget® (ou par un topographe cornéen de type Placido) permettent de comparer la position de l’implant KAMRA® vis-à-vis de la pupille d’entrée et du reflet cornéen central (vertex) (fig. 10-7). Le système AcuTarget® permet une acquisition numérisée de l’image du segment antérieur et permet de référencer la position du vertex vis-à-vis du centre de la pupille irienne et de la position de l’inlay. À terme, ce dispositif est destiné à faciliter l’identification de ces repères anatomiques en peropératoire grâce à l’adjonction sur le microscope opératoire d’un système de « réalité augmentée ».
Certaines modifications topographiques peuvent être observées en postopératoire, comme la survenue d’une zone annulaire de cambrure en regard de l’implant.
Sur le plan cosmétique, il est impossible d’en discerner la présence de visu et le regard du patient n’est pas modifié, l’implant étant de couleur sombre, mat et situé en regard de la pupille.
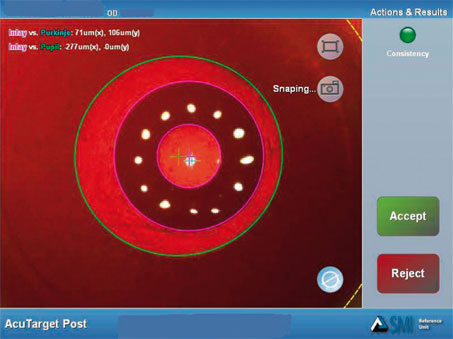
Fig. 10-7 Système AcuTarget®.
Estimation objective de la position de l’implant vis-à-vis du centre de la pupille (inlay vs pupille) et vis-à-vis du reflet cornéen central (inlay vs Purkinkje).

Fig. 10-4 Technique chirurgicale de l’insertion d’un implant KAMRA®.

Fig. 10-5 Examen biomicroscopique à un mois en postopératoire.
Noter la clarté de l’interface et l’absence de réaction stromale. Les microperforations au sein de l’inlay sont bien visibles.

Fig. 10-6 Examen par OCT de la cornée d’un patient ayant reçu l’inlay KAMRA®, placé sous un capot de LASIK (découpe au laser femtoseconde).
L’épaisseur mesurée du capot stromal est supérieure a 200 μm.
Noter l’absence d’écho en arrière de l’implant.
À la mi-année 2011, plus de quatre mille implants avaient été posés dans le monde. Le taux global d’explantation (toutes causes confondues) était inférieur à 2 %. Les premiers essais cliniques avec l’implant AcuFocus ACI-7000 (rebaptisé KAMRA® par la suite) ont été effectués en 2003 à Mexico (Mexique) et poursuivis ensuite à Istanbul (Turquie).
Une étude portant sur les résultats à quatre ans (52,2 ± 2,9 mois) de trente-neuf yeux de trente-neuf patients (âge moyen : 51,9 ans) et implantés de manière unilatérale avec la technique combinée LASIK a montré que tous les yeux avaient bénéficié d’une augmentation d’au moins deux lignes de l’acuité visuelle non corrigée de près, sans perte significative de lignes d’acuité visuelle de loin [28]. L’acuité visuelle de près non corrigée moyenne à J1 postopératoire était dans 96 % des cas d’au moins Jaeger 3. À la dernière visite, l’acuité visuelle non corrigée de loin était au moins de 5/10 pour tous les yeux, avec une légère réduction de l’acuité visuelle non corrigée vis-à-vis de la mesure préopératoire (8/10 contre 10/10 en préopératoire). D’autres études ont retrouvé des résultats similaires et une augmentation de la performance visuelle de près sans correction (acuité visuelle non corrigée, vitesse de lecture). Il n’était pas rapporté de perte significative en vision de loin[10, 11, 27].
Les complications rapportées liées à l’implant KAMRA® incluent la perte de lignes d’acuité visuelle de loin, la survenue d’un shift hypermétropique, l’existence d’une inflammation diffuse de l’interface, l’amincissement du stroma sus-jacent. Ces complications étaient réversibles au retrait de l’implant, dans les cas où ce dernier a dû être explanté. Le faible nombre d’études publiées rend difficile une estimation précise du pourcentage relatif pour chacune de ces complications ; selon la société AcuFocus, qui effectue un recueil prospectif anonyme des données postopératoires de tous les implants posés dans le cadre d’études cliniques et/ou dans des centres indépendants, le taux d’explantation global était proche de 1,7 % au début de l’année 2011. La survenue de dépôts ferriques cornéens superficiels situés soit dans la lumière de l’implant soit à son pourtour, mais sans manifestation clinique subjective associée, a été rapportée dans 56 % des cas d’une série de trente-deux patients à trois ans. Ils sont attribués à la conjonction d’altérations du film lacrymal et de modifications topographiques liées à l’insertion de l’inlay[10, 11].
Les effets indésirables le plus fréquemment rapportés consistent en une sensation de sécheresse au cours des premières semaines postopératoires, la présence de halos lumineux nocturnes, la perception d’une diplopie monoculaire (souvent intermittente)[11, 27, 28].
L’expérience pionnière en France de Damien Gatinel avec le dispositif KAMRA® est positive, l’augmentation de la plage de vision nette permettant aux presbytes de retrouver une acuité visuelle nette de près tout en préservant l’acuité visuelle de loin. Le caractère réversible (possibilité de retrait de l’implant) et ajustable (recentrage en cas de centrage initial imparfait) constitue un avantage certain, comme la possibilité de combiner la pose à une correction LASIK (l’implant est placé dans l’interface, sous le capot, après correction de la vision de loin au laser à excimères).
La tolérance à plus long terme de l’implant KAMRA® (au-delà de quatre ans) devrait faire l’objet d’études supplémentaires.
L’inlay PresbyLens®, rebaptisé depuis peu Vue+® (ReVision Optics, Lake Forest, Californie), est un inlay réfractif transparent (fig. 10-8). Par modification de la courbure antérieure de la cornée du fait de son épaisseur, il en modifie le pouvoir réfractif.

Fig. 10-8 Inlay Vue+® (ReVision Optics).
(Avec l’aimable autorisation de ReVision Optics.)
L’inlay Vue+® a un diamètre de 2 mm, son épaisseur est de 32 µm au centre (pour une puissance identique donnée, quel que soit le degré de presbytie du patient) et de 5 µm au niveau des bords. Son rayon de courbure antérieure est de 8,52 mm et sa courbure postérieure de 10 mm. Il est composé à 78 % d’eau et utilise un matériel hydrogel biocompatible. Son indice de réfringence est identique à celui de la cornée (n = 1,376), ce qui, notamment, le rend « transparent » en postopératoire à la lampe à fente.
L’inlay Vue+® agit sur la courbure antérieure de la cornée en modifiant la courbure de la membrane de Bowman, ce qui remodèle l’épithélium. L’inlay Vue+® augmente la kératométrie centrale sur une zone de 3 mm. Il repose sur le principe de vision simultanée en créant une pastille réfractive centrale pour la vision de près, laissant ainsi la périphérie de la cornée pour la vision éloignée.
La pose de l’inlay « hypernégativise » l’aberration sphérique, ce qui induit une augmentation de la profondeur de champ.
L’inlay Vue+® se place soit après découpe d’un volet intrastromal (par microkératome ou laser femtoseconde) chez le patient amétrope après LASIK hypermétropique, soit après réalisation d’une poche de dissection intrastromale par laser femtoseconde chez l’emmétrope presbyte. Selon les recommandations de ReVision Optics, le volet cornéen doit être réalisé à une profondeur équivalente à 30 % de l’épaisseur de la cornée, soit entre 140 µm et 180 µm (150 µm) de profondeur (fig. 10-9). Le stroma résiduel doit être au minimum de 300 µm.
Cette précaution liée à la profondeur d’insertion, que la découpe soit réalisée au microkératome ou au laser femtoseconde, a pour but de réduire au maximum les réactions intrastromales liées à l’activation des kératocytes — les kératocytes étant plus nombreux dans le stroma antérieur, la réaction y est plus active.

Fig. 10-9 Position de l’inlay Vue+®.
Schématisation du mode d’action par modification de la courbure cornéenne centrale. Visualisation par OCT de la position de l’inlay (à la base du volet).
(Avec l’aimable autorisation de ReVision Optics.)
L’inlay Vue+® est indiqué pour les patients emmétropes ou faiblement hypermétropes.
Cet inlay réfractif est positionné sur l’œil dominé, en monovision, comme le concept KAMRA®.
Il est contre-indiqué chez les patients présentant une épaisseur de cornée inférieure à 500 µm.
Comme tous les inlays, le Vue+® doit être centré sur le reflet de Purkinje. Il est positionné sous un volet cornéen de 150 µm ou dans une poche intrastromale calibrée réalisée au laser femtoseconde — l’inlay Vue+® est dans ce cas positionné à l’aide d’un injecteur spécifique. Une marque épithéliale aide au centrage. Le volet est ensuite repositionné sans rinçage pour éviter tout risque de glissement de l’inlay (fig. 10-10). L’épaisseur du volet est plus faible que celle imposée pour la mise en place des autres inlays, ce qui présente l’avantage de réduire de manière importante la sécheresse oculaire induite.
Si sa transparence est un atout majeur pour la qualité de vision postopératoire, elle peut être néanmoins un obstacle pour la bonne visualisation de l’inlay ainsi que pour son centrage, compte tenu également de son petit diamètre (2 mm).
À la lampe à fente, l’inlay Vue+® a la particularité d’être quasi invisible en postopératoire (fig. 10-11).

Fig. 10-10 Positionnement de l’inlay Vue+® après découpe du volet.
(Avec l’aimable autorisation de ReVision Optics.)

Fig. 10-11 Examen postopératoire à la lampe à fente.
En septembre 2010, le fabricant ReVision Optics a annoncé officiellement qu’il débutait la phase d’agrément de l’inlay Vue+® par la FDA, prévue sur trois ans, avec un objectif de quatre cents yeux implantés.
Compte tenu de l’arrivée récente de cet inlay, la bibliographie relative à la description des résultats obtenus n’est pas fournie. Cependant, quelques résultats préliminaires ont pu faire l’objet de communications au sein de congrès.
Les résultats de l’étude d’Arturo S. Chayet [6] portant sur huit yeux myopes presbytes ayant bénéficié d’un LASIK myopique (emmétropie visée en bilatéral) avec insertion de l’inlay PresbyLens® sur l’œil dominé de patients âgés de quarante-cinq à cinquante-six ans font état d’une récupération d’une acuité visuelle postopératoire sans correction bilatérale de 20/25 ou mieux. La totalité des patients avaient une acuité de près leur permettant d’être autonomes pour une lecture en vision rapprochée sans lunettes.
L’étude pré-FDA a été réalisée à Mexico par Enrique Barragan. Un article de la revue Review of Ophthalmology a relaté les résultats préliminaires en mars 2009 [2]. L’étude portait sur des patients emmétropes presbytes âgés de quarante-cinq à soixante-cinq ans. Avant implantation, l’ensemble des patients avait une acuité visuelle de loin non corrigée de 20/30 ou mieux et avait en moyenne 20/60 en vision de près, sans correction. En postopératoire, à un mois, l’ensemble des patients présentaient une acuité visuelle de près sans correction de 20/25 ou mieux ; 86 % des patients avaient une acuité visuelle sans correction de près de 20/20 ou mieux. En vision de loin, l’acuité visuelle sans correction n’est jamais inférieure à 20/40 ; 72 % des patients ont une acuité visuelle de loin sans correction supérieure ou égale à 20/30. Aucune explantation n’a été rapportée dans cette étude. Si la première génération d’inlays PresbyLens® (1,5 mm de diamètre) faisait état de phénomènes de haze postopératoire, il semble que la deuxième génération (2 mm de diamètre) permette de supprimer ces symptômes par l’optimisation de sa biocompatibilité.
Béatrice Cochener a rapporté à la SAFIR en 2011 les résultats de l’étude avant mise sur le marché européen, incluant six patients opérés à Brest de leur œil dominé avec un recul de trois à six mois. L’équivalent sphérique préopératoire varie entre – 0,36 D et + 0,50 D avec un cylindre préopératoire inférieur ou égal à 0,75 D. L’acuité visuelle préopératoire de ces patients emmétropes est de 10/10 sans correction de l’œil devant être opéré. En postopératoire, l’acuité visuelle s’échelonne entre 6/10 et 10/10 du fait d’une légère myopisation induite variant de 0 D à – 1 D. L’acuité visuelle de loin reste cependant à 10/10 en binoculaire. En vision de près, l’acuité visuelle postopératoire est de Parinaud 2 pour quatre patients sur six, Parinaud 3 pour un patient et Parinaud 4 pour un patient. L’auteur compare ses résultats avec l’étude menée par Stephen Slade qui retrouve à six mois une acuité visuelle de loin supérieure à 20/25 dans 55 % des cas et une acuité visuelle de près supérieure à 20/25 dans 83 % des cas.
La dernière étude mexicaine réalisée par Enrique Barragan et Arturo Chayet, rapportée par la firme, compare les résultats d’une implantation chez l’emmétrope (groupe 1) aux résultats obtenus après photoablation chez l’hypermétrope (groupe 2).
L’étude du groupe 1 porte sur vingt patients âgés entre quarante-huit et cinquante-cinq ans, emmétropes, avec un astigmatisme inférieur à 0,75 D et avec une addition comprise entre + 1,5 D et 2 D, ayant bénéficié de l’implantation de l’inlay Vue+® de leur œil dominé avec un recul de deux ans. L’acuité visuelle de près sans correction est supérieure ou égale à Jaeger 1 dès le huitième jour et reste stable avec le recul. En vision intermédiaire, dix-neuf patients sur vingt ont une acuité visuelle supérieure ou égale à 20/32 (6,25/10). De loin, avec un recul de six mois, 75 % des patients ont une acuité visuelle sans correction supérieure ou égale à 20/32 (6,25/10). La vision binoculaire reste inchangée puisque seul l’œil dominé est opéré. La satisfaction des patients notée entre 0 (« pas satisfait ») et 5 (« très satisfait ») est en moyenne à 4,5/5 aux trois distances de vision, avec des effets secondaires notés en moyenne, pour les halos et les éblouissements, comme très peu marqués. Le questionnaire de qualité de vie, notée entre 0 (le plus bas) et 100 (le plus élevé), montre que l’amélioration de la vision de près est perçue comme très positive et que le léger compromis sur la vision de loin n’affecte pas la qualité de vie, avec un score qui reste à 93 en vision de loin et qui passe de 53 en préopératoire à 84 en postopératoire en vision de près. Les patients se trouvent améliorés dans leur apparence, avec un score qui passe de 51 en préopératoire à 93 en postopératoire, et leur confort avec un score qui passe de 41 en préopératoire à 74 en postopératoire. Les patients rapportent une indépendance à la correction avec un score de 55 en préopératoire et de 87 en postopératoire, ne signalent aucune limitation dans leur activité et ont une satisfaction globale moyenne qui passe de 49 à 81.
Les résultats du groupe 2 sont également très prometteurs. L’étude porte sur trente-huit patients âgés de quarante-quatre à soixante et un ans, hypermétropes de 2 D en moyenne (entre +1 et + 3 D), avec une addition comprise entre + 1,5 D et 2,5 D. Le lendemain de l’intervention, 68 % des patients lisent Jaeger 2 ou mieux et, à un an, douze des treize patients examinés lisent Jaeger 1 ou mieux. En vision intermédiaire, tous les patients ont amélioré leur acuité visuelle de cinq lignes. En vision binoculaire de loin, tous les patients ont une acuité visuelle sans correction de 10/10. Toutes les activités sont possibles sans lunettes, avec une note moyenne maximale à 5 pour toutes les distances. Les effets secondaires sont encore moins marqués que pour les patients emmétropes et la satisfaction des patients est superposée à celle du groupe 1 avec, en moyenne, 4,5/5 aux trois distances de vision. L’acuité visuelle reste stable dans le temps sur les deux ans de recul de l’étude.
Une étude multicentrique européenne de cet inlay, recourant à un nouveau système de délivrance, est actuellement engagée.
L’inlay Flexivue Microlens® (Presbia) est un inlay réfractif transparent dont l’épaisseur est fonction de l’addition induite.
L’inlay Flexivue Microlens® est composé d’un polymère acrylique hydrophile utilisé habituellement dans les implants intraoculaires. Son diamètre est de 3,2 mm. Son épaisseur est fonction de l’addition induite, mais ses bords sont d’épaisseur constante de 15 µm. Cet inlay a la particularité d’être composé de deux parties réfractives différentes, transparentes. La partie centrale de 1,6 mm de diamètre est neutre sur le plan réfractif. La partie réfractive annulaire périphérique est de puissance variable, déterminée en fonction des besoins du patient : de + 1,25 à + 3,50 D (par incrément de 0,25 D) (fig. 10-12).
Le centre du disque central est percé d’un orifice de 0,50 mm de diamètre dans le but de faciliter le passage de l’oxygène et des nutriments de la cornée.
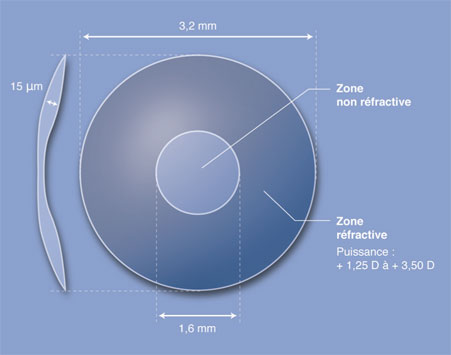
Fig. 10-12 Design de l’inlay Flexivue Microlens® (Presbia). L’implant est transparent.
L’inlay Flexivue Microlens® permet de modifier la puissance centrale de la cornée et utilise le principe de vision simultanée. L’inlay est implanté sur l’œil dominé.
En vision de près, l’addition induite par l’inlay permet une focalisation des rayons « centraux et paracentraux » sur la rétine ; en vision de loin, les rayons traversant le disque central plan et la cornée périphérique à l’inlay sont focalisés sur la rétine (fig. 10-13).
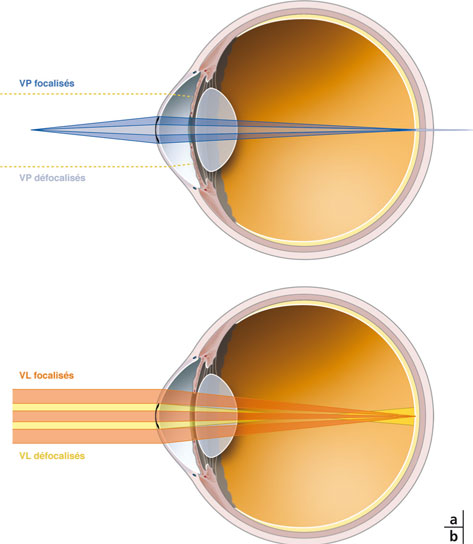
Fig. 10-13 Mode d’action de l’inlay Flexivue Microlens®.
a. En vision de près. Les rayons traversant la zone centrale non réfractive de l’inlay (en bleu clair) sont défocalisés en arrière de la rétine. Les rayons passant autour de l’inlay sont interrompus par l’iris (ligne pointillée jaune). Les rayons passant a travers la zone annulaire réfractive (en bleu fonce) sont focalises sur la rétine.
b. En vision de loin. Les rayons traversant la zone centrale non réfractive de l’inlay et les rayons passant autour de l’inlay (en orange) sont focalises sur la rétine. Les rayons passant à travers la zone annulaire réfractive (en jaune) sont focalisés en avant de la rétine.
L’implantation de l’inlay Flexivue Microlens® est indiquée chez les patients presbytes emmétropes ou faiblement hypermétropes. Un LASIK peut être associé pour des indications plus larges dans la limite des conditions biométriques imposées par la société Presbia.
La société Presbia recommande plusieurs critères à respecter avant implantation de l’œil non dominant : l’acuité visuelle de loin non corrigée doit être au minimum de 20/25, celle de près sans correction doit être inférieure ou égale à 20/50. L’acuité visuelle de près corrigée doit être supérieure à 20/25. L’équivalent sphérique doit être inférieur à plus ou moins 1 D, avec une sphère inférieure ou égale à 0,75 D pour les patients âgés de quarante-cinq à cinquante ans et inférieure ou égale à 1,00 D pour les patients âgés de cinquante à soixante ans, et avec un cylindre inférieur ou égal à 0,75 D. Le diamètre pupillaire photopique doit être supérieur ou égal à 3 mm. Comme pour toute chirurgie nécessitant une découpe d’un volet cornéen, la pachymétrie doit être supérieure ou égale à 500 µm.
En dehors de ces principaux critères, la chirurgie n’est pas indiquée.
D’autres contre-indications plus générales sont habituelles : pathologie cornéenne, glaucome, maladie auto-immune, amblyopie, kératocône, réfraction non stabilisée, allergies sévères, herpès oculaire, ptérygion, syndrome de l’œil sec réfractaire aux traitements.
L’inlay Flexivue Microlens® se place sous un volet ou après réalisation au laser femtoseconde d’une poche intrastromale calibrée grâce à un cache spécifique (fig. 10-14a).
La proportion des deux tiers de l’épaisseur cornéenne centrale est également requise pour la réalisation du volet ou de la poche intrastromale. Le mur résiduel postérieur doit être de 300 µm.
L’étape cruciale de l’opération est le centrage de l’inlay.
Pour l’aide au centrage de l’inlay sur le reflet de Purkinje, la société Presbia recommande d’utiliser l’instrument Thornton Optic Zone Marker (distribué par IMPEX Chirurgical) permettant une marque à l’encre de 3 mm de diamètre (fig. 10-14b), ou encore le Pallikaris Epi-LASIK Marker (Duckworth & Kent). Un injecteur spécifique fourni par la société Presbia permet l’implantation de l’inlay en respectant les bords de la marque préalablement réalisée (fig. 10-14c).
En postopératoire, l’inlay est invisible, ce qui permet l’examen facile du fond d’œil (fig. 10-15).

Fig. 14 Implantation de l’inlay Flexivue Microlens®.
a. Réalisation de la poche à l’aide d’un cache spécifique, visualisation de la progression du laser femtoseconde. b. Marque épithéliale annulaire centrée sur le refl et de Purkinje. c.Implantation a l’aide de l’injecteur.
(Avec l’aimable autorisation de Presbia.)

Fig. 10-15 Examen à la lampe à fente après implantation de l’inlay Flexivue Microlens®
(Avec l’aimable autorisation de Presbia.)
L’inlay Flexivue Microlens® dispose du marquage CE.
Lors du congrès de l’ASCRS 2011, la société Presbia mettait en avant les résultats suivants.
En préopératoire, 100 % de trente yeux implantés avaient une acuité visuelle de près sans correction supérieure à 20/50. En postopératoire, à un mois, cette acuité visuelle de près sans correction sur l’œil traité était comprise entre 20/16 et 20/20 pour 69 % des yeux opérés, 77 % à trois mois. Cette étude relatait également que 20 % des yeux opérés présentaient à trois mois une acuité visuelle de près sans correction comprise entre 20/30 et 20/25 et, pour 3 % d’entre eux, cette acuité était inférieure ou égale à 20/30.
L’amélioration de l’acuité visuelle de près sans correction se fait au prix d’une légère baisse des performances visuelles de loin sans correction de l’œil opéré à 20/40 en moyenne (fig. 10-16). L’acuité visuelle de loin non corrigée binoculaire n’est pas altérée et conserve de bonnes performances compte tenu de la démarche de traitement unilatérale (œil dominé). Ces résultats sont superposés à ceux rapportés par G. Kymionis [13].
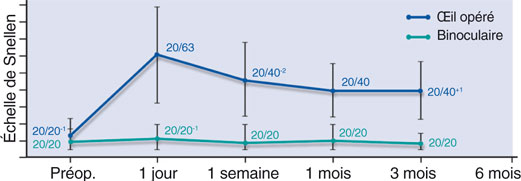
Fig. 10-16 Acuité visuelle sans correction en vision de loin sur l’oeil traité et en vision binoculaire.
(Avec l’aimable autorisation de Presbia.)


[1] Alio J.L., Mulet E., Zapata L. et al. Intracorneal inlay complicated by intrastromal epithelial opacification. Arch Ophthalmol, 2004 ; 122 : 1441-6.
[2] Barragan E. First pre-FDA study. Review of Ophthalmology, mars 2009.
[3] Barraquer J.I. Refractive keratoplasty. Este Inf Oftal, 1949 ; 2 : 10-30.
[4] Barraquer J.I. Modification of refraction by means of intracorneal inclusions. Int Ophthalmol Clin, 1966 ; 8 : 53-78.
[5] Binder P.S., Deg J.K., Zavala E.Y., Grossman R.G. Hydrogel keratophakia in non-human primates. Curr Eye Res, 1981-82 ; 1 : 535.
[6] Chayet A.S. First results of the Vue+ inlay for correction of presbyopia. Free paper, ASCRS 2009.
[7] Choyce D.P. Management of endothelial corneal dystrophy with acrylic corneal inlays. Brit J Ophthalmol, 1965 ; 49 : 432-40.
[8] Choyce D.P. The correction of refractive errors with polysulfone corneal inlays. A new frontier to be explored? Trans Ophthalmol Soc UK, 1985 ; 104 : 332-42.
[9] Climenhaga H., MacDonald J.M., McCarey B.E., Waring G.O. III. Effect of diameter and depth on the response to solid polysulfone intracorneal lenses in cats. Arch Ophthalmol, 1988 ; 106 : 818-24.
[10] Dexl A.K., Ruckhofer J., Riha W. et al. Central and peripheral corneal iron deposits after implantation of a small-aperture corneal inlay for correction of presbyopia. J Refract Surg, 2011 ; 8 : 1-5.
[11] Dexl A.K., Seyeddain O., Riha W. et al. Reading performance after implantation of a small-aperture corneal inlay for the surgical correction of presbyopia: Two-year follow-up. J Cataract Refract Surg, 2011 ; 37 : 525-31.
[12] Gatinel D. Principaux axes et angles utiles en topographie cornéenne. In : Topographie cornéenne. Elsevier, Paris, 2011 : 19-24.
[13] Knowles W.F. Effect of intralamellar plastic membranes on corneal physiology. Am Journal Ophthalmol, 1961 ; 51 : 274-6.
[14] Kymionis G., Bouzoukis D., Pallikaris I. Corneal inlays: a surgical correction of presbyopia. Cataract & Refractive Surgery Today Europe, September 2007.
[15] Lane S.L., Lindstrom R.L., Cameron J.D. et al. Polysulfone corneal lenses. J Cataract Refract Surg, 1986 ; 12 : 50-60.
[16] Laroche L., Honiger J., Thenot J.-C. et al. Alloplastic keratophakia. Use of a new polymer. Ophthalmology, 1989 ; 3 : 227-8.
[17] Laroche L. Les lenticules intracornéens synthétiques. Ophtalmologie, 1992 ; 6 : 255-61.
[18] McCarey B.E., Storie B.R., VanRij G., Khinght P.M. Refractive predictability of myopic hydrogel intracorneal lenses in nonhuman primates eyes. Arch Ophthalmol, 1990 ; 108 : 1310-5.
[19] McCarey B.E., Andrews D.M. Refractive keratoplasty with intrastromal hydrogel lenticular implants. Invest Ophthalmol Vis Sci, 1981 ; 21 : 107-15.
[20] McDonald M.B., McCarey B.E., Storie B. et al. Assessment of the long-termcorneal response to hydrogel intrastromal lenses implanted in monkey eyes for up to five years. J Cataract Refract Surg, 1993 ; 19 : 213-22.
[21] Ohroff C., Duffin M., Apple D.J., Olson R.J. Opacification, vascularization, and chronic inflammation produced by hydrogel intracorneal lenses in nonhuman primate eyes. Am J Ophthalmol, 1988 ; 106 : 818-24.
[22] Pallikaris I., Bouzoukis D., Panagopoulou S., Limnopoulou A. Avantages of corneal inlays for presbyopia. Cataract & Refractive Surgery Today Europe, April 2010.
[23] Pande M., Hillman J.S. Optical zone centration in keratorefractive surgery. Entrance pupil center, visual axis, coaxially sighted corneal reflex, or geometric corneal center? Ophthalmology, 1993 ; 100 : 1230-7.
[24] Peiffer R.L., Werblin T.P., Fryckowski A.W. Pathology of corneal hydrogel alloplastic implants. Ophthalmology, 1985 ; 92 : 1294-304.
[25] Samples J.R., Binder P.S., Zavala E.Y. et al. Morphology of hydrogel implants used for refractive keratoplasty. Ophthalmol Vis Sci, 1984 ; 25 : 843-50.
[26] Sendale D.D., Abelson M.B., Kenyon K.R., Hanninen L.A. Intracorneal lens implantation. Arch Ophthalmol, 1983 ; 101 : 940-3.
[27] Seyeddain O., Riha W., Hohensinn M. et al. Refractive surgical correction of presbyopia with the AcuFocus small aperture corneal inlay: two-year follow-up. J Refract Surg, 2010 ; 26 : 707-15.
[28] Yilmaz O.F., Alagöz N., Pekel G. et al. Intracorneal inlay to correct presbyopia: Long-term results. J Cataract Refract Surg, 2011 ; 37 : 1275-81.

