C. Albou-Ganem
L’expansion sclérale est l’une des rares approches, avec les implants accommodatifs (cf. chapitre suivant), de la correction chirurgicale de la presbytie qui permettent d’obtenir une restauration de l’accommodation monoculaire vraie. Une telle restauration repose sur : soit l’amélioration de la compliance lenticulaire, soit l’augmentation de l’efficacité ciliaire, soit l’augmentation de la courbure lenticulaire antérieure au cours de l’accommodation résiduelle (cf. partie I).
La technique d’expansion sclérale a pour but d’augmenter l’efficacité du muscle ciliaire par expansion du diamètre scléral supraciliaire.
Deux méthodes d’expansion sclérale sont décrites : les bandes d’expansion intrasclérales et les sclérotomies ciliaires antérieures.
Les bandes d’expansion intrasclérales ont pour but l’augmentation du diamètre scléral en regard de l’équateur du cristallin pour restaurer l’accommodation. Cette technique repose sur les conceptions non orthodoxes — contestées par de nombreux auteurs — du mécanisme de l’accommodation et de la presbytie développées par Marius Tscherning [36] et Ronald Schachar[23, 24]. Leurs résultats sont controversés et ces techniques chirurgicales ne sont à l’heure actuelle plus utilisées.
La théorie de l’accommodation de Ronald Schachar [29] repose sur une anatomie et un fonctionnement différents des fibres zonulaires et du muscle ciliaire.
Sur le plan anatomique, les fibres zonulaires équatoriales, qui sont très fines (5 µm à 15 µm d’épaisseur), partent de la pars plicata du corps ciliaire et s’insèrent directement sur l’équateur du cristallin. Les fibres zonulaires antérieures et postérieures, dix fois plus épaisses, ont une origine commune au niveau de la pars plana. Elles circulent ensuite à la surface du corps ciliaire et des procès ciliaires pour s’insérer respectivement sur la capsule antérieure ou la capsule postérieure. Les fibres zonulaires antérieures croisent sur leur trajet les fibres équatoriales. Les fibres zonulaires antérieures et postérieures ont un rôle de maintien du cristallin, alors que les fibres équatoriales représenteraient l’élément actif dans la modification du pouvoir optique du cristallin.
Le muscle ciliaire est composé de trois faisceaux, longitudinal, radiaire et circulaire, dont la contraction synergique provoque une traction de la zonule équatoriale, une tension sur l’éperon scléral ainsi que le déplacement antérieur de la pars plana et des procès ciliaires, réduisant de ce fait l’espace périlenticulaire.
Sur le plan fonctionnel, l’accommodation résulte, pour Schachar, non pas comme il est largement admis d’une diminution de la traction zonulaire associée à une diminution du diamètre équatorial du cristallin [8], mais d’une traction zonulaire au niveau de l’équateur du cristallin (fig. 11-1). Cette mise en tension augmente le diamètre lenticulaire, ce qui provoque un aplatissement de la courbure périphérique du cristallin et un bombement de la courbure centrale. Selon Schachar, l’augmentation du pouvoir réfractif du cristallin procède donc d’une augmentation de la traction sur la zonule équatoriale ; la presbytie serait due non pas à un durcissement du cristallin comme le pensent de nombreux auteurs[7, 12] mais à l’augmentation du diamètre du cristallin avec l’âge, ce qui rend inefficace la mise sous tension des fibres zonulaires. Pour supprimer ou retarder la presbytie, Schachar préconise d’augmenter l’espace entre le corps ciliaire et l’équateur du cristallin par un système d’expansion sclérale, afin de donner la possibilité aux fibres zonulaires de se tendre à nouveau (fig. 11-2).
Il confirme cette théorie malgré les controverses en 2008 [30].
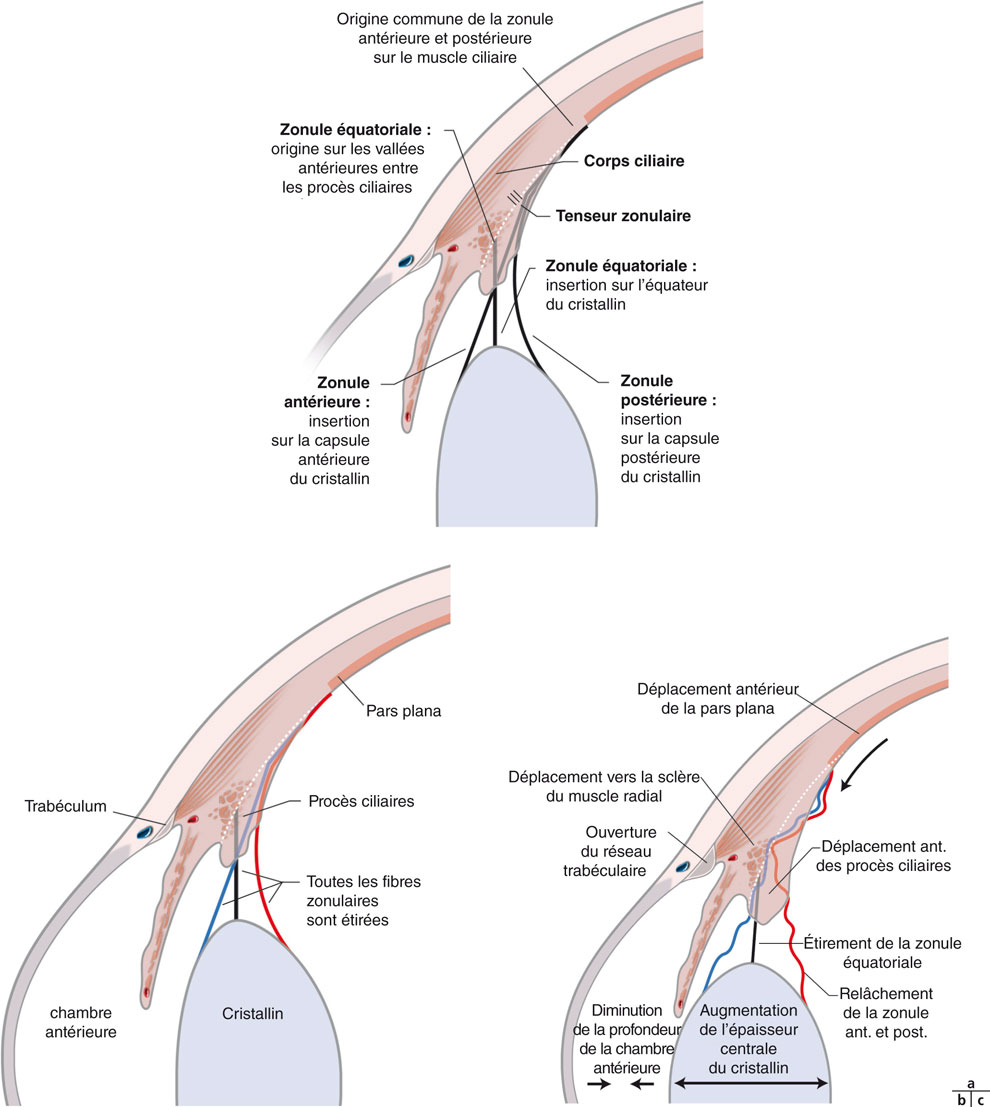
Fig. 11-1 Théorie contestée de l’accommodation selon R.A. Schachar.
a. Schéma de l’anatomie de la zonule selon Schachar. b. Cristallin relâché n’accommodant pas : toutes les fibres zonulaires sont étirées. c. Au cours de l’accommodation : traction par les fibres zonulaires équatoriales.
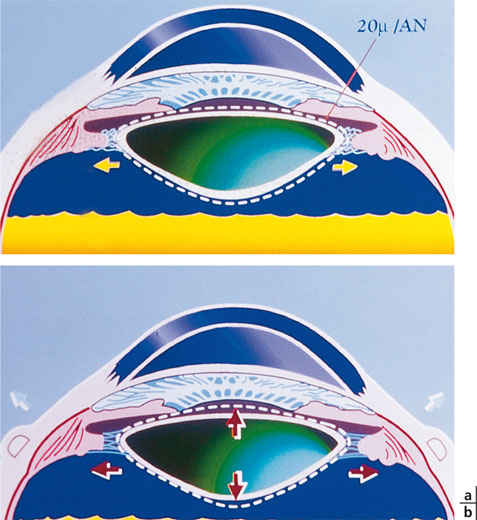
Fig. 11-2 Principe de l’expansion sclérale, fondé sur la théorie de Schachar.
a. La contraction zonulaire voit son amplitude réduite par l’augmentation du volume du cristallin avec l’âge. b. L’expansion sclérale restaurerait cette amplitude et donc le pourvoir accommodatif.
La théorie de Ronald Schachar est étayée par plusieurs études expérimentales.
L’infléchissement des aberrations sphériques vers la négativation au cours de l’accommodation a été observé par Thomas Young dès 1801 [40] et confirmé ensuite par l’aberrométrie[17, 20].
Thomas Young avait examiné les modifications de la forme des ombres obtenues par la projection de deux lignes parallèles au cours de l’accommodation. Il avait noté que ces lignes étaient parfaitement rectilignes dans le regard de loin et semblaient devenir convexes dans le regard de près. Il conclut que ce changement était dû à l’aplatissement de la périphérie du cristallin mais en aucun cas à des modifications cornéennes, comme le confirment certains auteurs [34].
Le cristallin étant plus dense que le vitré ou l’humeur aqueuse, ni l’un ni l’autre ne peuvent prétendre le stabiliser : c’est la tension zonulaire constante qui maintient la stabilité du cristallin. Au cours de l’accommodation, les zonules antérieures et postérieures se relâchent mais la tension de la zonule équatoriale augmente et maintient la stabilité du cristallin [31]. De ce fait, l’amplitude d’accommodation n’est pas affectée par la gravité, ce qu’avait confirmé John Glenn après son voyage spatial en 1962.
La zonule équatoriale n’a été mise en évidence que récemment grâce à la microscopie électronique [34] et au biomicroscope à ultrasons en trois dimensions [32]. Ses fibres sont en effet extrêmement fines et échappent à l’examen biomicroscopique. Sa fonction a été démontrée chez l’homme en visualisant le déplacement de l’équateur du cristallin vers la sclère au cours de l’accommodation [25], chez le primate par la diminution du pouvoir optique du cristallin secondaire au relâchement zonulaire obtenu par dissection in vivo du muscle ciliaire [11] et, enfin, par des expériences in vitro : un cristallin humain libre de toute traction zonulaire apparaît relâché et n’accommode pas ; une traction sur la zonule induit un bombement central et un aplatissement périphérique[19, 27, 28].
Les modifications du muscle ciliaire au cours du vieillissement ont été analysées. Il n’est plus à démontrer qu’un muscle au repos s’atrophie et qu’un muscle soumis à des contractions isométriques s’hypertrophie. Or, Tamm a constaté qu’il existait une atrophie des fibres antérieures radiales du muscle ciliaire, qui sont responsables de la traction sur la zonule équatoriale, avec la diminution de l’amplitude de l’accommodation liée à l’âge et, au contraire, une hypertrophie des autres fibres du muscle ciliaire du fait des contractions isométriques secondaires à l’effort d’accommodation qui persiste malgré le vieillissement [35]. En effet, la traction exercée par un muscle dépend directement de sa capacité à l’étirement. L’étirement des fibres antérieures radiales dépend de l’espace entre l’équateur du cristallin et le muscle ciliaire. Cet espace diminuant avec l’âge du fait de l’augmentation du diamètre équatorial du cristallin, l’étirement est moindre : le muscle s’atrophie et la traction sur la zonule équatoriale diminue.
Une étude récente portant sur la contribution de la géométrie lenticulaire et des propriétés mécaniques du cristallin sur le développement de la presbytie confirme que la perte d’accommodation serait due en majeure partie aux modifications géométriques du cristallin et moins à ses modifications mécaniques. En effet, le remodelage d’un cristallin correspondant à celui d’un sujet de quarante-cinq ans pour aboutir à la forme d’un cristallin d’un sujet de vingt-neuf ans tout en lui conservant les mêmes propriétés mécaniques restaure une amplitude d’accommodation de 72 % à 94 % de celle du cristallin de vingt-neuf ans, ce qui correspond à un gain accommodatif de 1,8 D à 3,7 D. En revanche, une restauration des propriétés mécaniques du cristallin ne permet un gain accommodatif que de 0,7 D [37].
Une traction équatoriale exercée sur une lentille biconvexe encapsulée déformable ayant le même profile que le cristallin (vésicules prolates, ballon rempli d’air, de gel ou d’eau) entraîne un aplatissement périphérique et un bombement central [25]. De même, une suture serrée d’une incision cornéenne induit un bombement central du méridien sur lequel elle est placée, alors qu’une incision en périphérie induit un aplatissement du méridien de l’incision [1].
La théorie d’Helmholtz stipule que le bombement cristallinien est à la fois central et périphérique et que les aberrations optiques se positivisent au cours de l’accommodation. Elle implique, entre autres, que le relâchement zonulaire secondaire à l’augmentation du diamètre équatorial liée à l’âge est responsable d’un shift myopique chez le patient presbyte ; or le shift est hypermétropique [24].
La théorie est infirmée par des travaux qui contredisent plusieurs de ces développements théoriques et pratiques [2].
Contrairement à ce que la modélisation physique ou mathématique de Schachar établit, il semble que l’étirement équatorial de cristallins humains in vitro disposés dans un banc optique induise une augmentation de la longueur focale et donc une réduction de la puissance réfractive lenticulaire [7].
Selon Schachar, les fibres zonulaires équatoriales seraient insérées sur la face antérieure du muscle ciliaire, près de la racine de l’iris, tandis que les fibres zonulaires postérieures s’attacheraient à la face postérieure du muscle ciliaire. Ceci est en contradiction avec les travaux histopathologiques les plus récents[7, 8] qui semblent indiquer l’absence d’insertion zonulaire sur la face antérieure du corps ciliaire ou la racine de l’iris.
La notion de déplacement postéro-externe de la pointe des procès ciliaires au cours de l’accommodation est infirmée [4]. L’apex interne du muscle ciliaire se déplace vers l’avant et de façon centripète sous l’effet combiné de la poussée vitréenne et de l’action des fibres zonulaires longitudinales. Les fibres zonulaires postérieures tendues entre l’apex interne du muscle ciliaire et l’insertion postérieure du muscle ciliaire sont étirées pendant l’accommodation.
Enfin, la réduction du diamètre équatorial au cours de l’accommodation a également été démontrée chez le sujet albinos [38].
Baikoff a par ailleurs confirmé que la traction sclérale réalisée avec une pince en regard du muscle ciliaire et de l’insertion de la zonule entraîne une traction du cristallin vers la sclère avec un aplatissement de sa périphérie. L’expansion sclérale induirait donc une pseudo-accommodation et non une restauration de l’accommodation physiologique. Cette pseudo-accommodation serait liée à l’aplatissement de la courbure périphérique du cristallin et au bombement de la courbure centrale, qui pourrait engendrer une multifocalité de la partie centrale du cristallin, se rapprochant ainsi du principe des implants multifocaux utilisés chez l’aphaque [3].
L’expansion sclérale a pour but de restaurer l’accommodation en augmentant le diamètre de l’anneau scléral pour accroître la distance entre le cristallin et le muscle ciliaire. Pour ce faire, l’expansion sclérale doit être réalisée en regard de la zonule équatoriale. Les fibres zonulaires retrouvent ainsi la tension qu’elles avaient avant la presbytie, ce qui permet au muscle ciliaire d’exercer sa traction sur le cristallin [22].
Cette chirurgie peut être proposée quelle que soit l’importance de la presbytie, à condition que les candidats soient par ailleurs emmétropes. Les segments d’expansion qui permettraient parfois d’obtenir un pouvoir accommodatif de près de 10 D ne compensent pas l’hypermétropie préexistante, même minime.
Une expansion sclérale de 500 µm suffirait à restaurer une accommodation pouvant atteindre 10 D [26].
Cette expansion se fait grâce à l’insertion dans la sclère de segments de polyméthylméthacrylate (PMMA), passés en « passants de ceinture », convexité vers l’extérieur, au centre de chaque quadrant sur le méridien de 45°, en regard du corps ciliaire, à très précisément 2,75 mm du limbe. Ces segments de 5,5 mm de long, de 1,38 mm de large et de 1 mm d’épaisseur (fig. 11-3) sont glissés dans un tunnel scléral situé à 300 µm de profondeur, réalisé à l’aide d’un couteau diamant précalibré de 3,8 mm de long, 0,9 mm de large (fig. 11-4) après une dissection soigneuse du plan conjonctivoténonien en regard. Les incisions sclérales correspondant aux extrémités des tunnels sont réalisées également avec un couteau précalibré à lame carrée sur une profondeur de 300 µm et une largeur de 1,5 mm. Ces incisions ne sont pas radiaires mais parallèles. Les extrémités doivent être placées de manière symétrique à l’extérieur du tunnel et doivent appuyer sur la sclère pour assurer la traction (fig. 11-5).
La chirurgie est réalisée sous anesthésie topique, les deux yeux le même jour, et dure environ trente minutes par œil. Elle se termine par une injection intraveineuse de mannitol à 20 % à passer en une demi-heure et à débuter vingt minutes avant la fin de la chirurgie en même temps que l’instillation de pilocarpine 2 % pour prévenir l’inévitable hypertonie oculaire qui suit la mise en place des segments d’expansion sclérale (fig. 11-6).
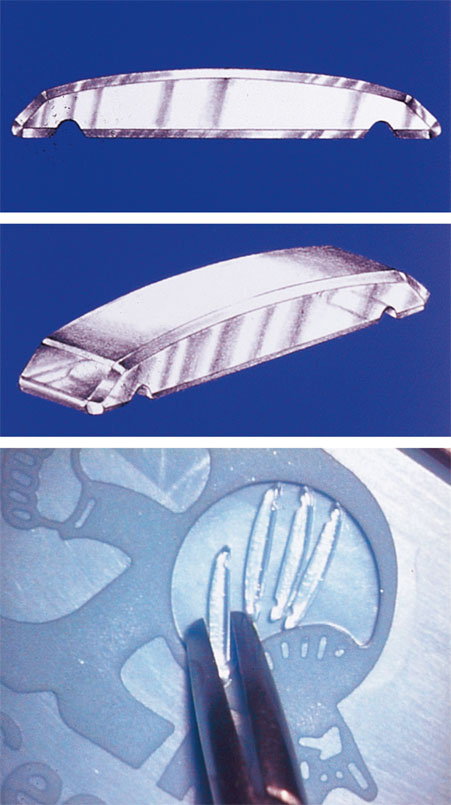
Fig. 11-3 Segments d’expansion sclérale en PMMA de PresbyCorp.
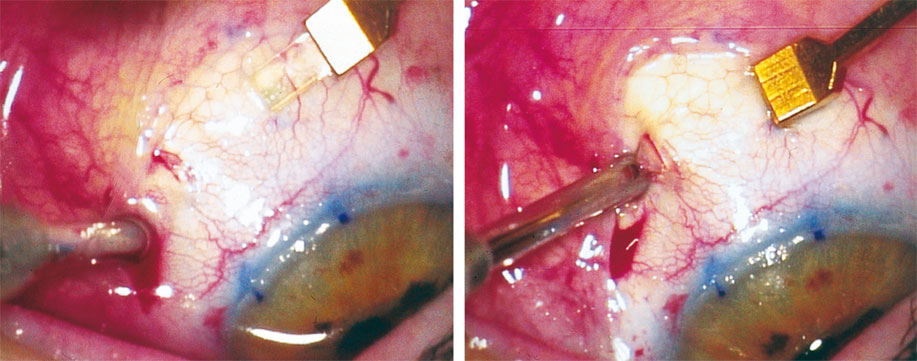
Fig. 11-4 Dissection du tunnel scléral à l’aide du couteau précalibré de 1,5 mm de large. La dissection doit être de profondeur constante.
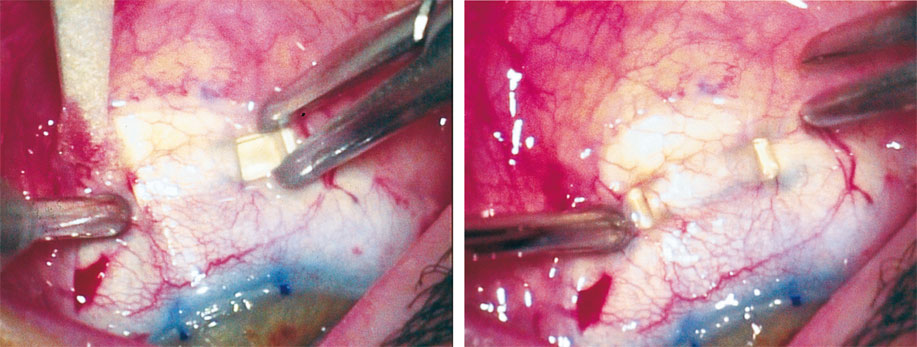
Fig. 11-5 Mise en place du segment. Les extrémités doivent être placées de manière symétrique à l’extérieur du tunnel et doivent appuyer sur la sclère pour assurer la traction.
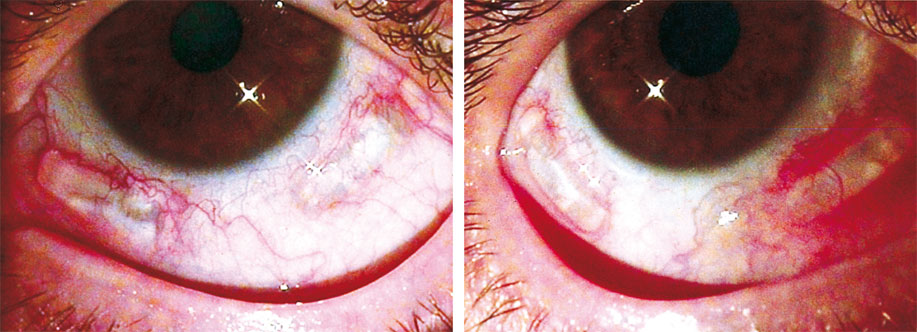
Fig. 11-6 Aspect postopératoire.
L’amélioration de la vision de près se fait de manière progressive sur plusieurs semaines.
Pour Schachar[22, 23], le punctum proximum passe en moyenne de 70 cm à 25 cm, avec une acuité visuelle de près s’échelonnant entre Parinaud 5 et Parinaud 2.
En 2001, Cros confirment les résultats de Schachar [5].
Qazi et al. rapportent, en 2002 [21], les résultats d’une étude prospective multicentrique portant sur vingt-neuf yeux de patients emmétropes et opérés d’un seul œil avec un recul de six mois. L’amélioration de l’acuité visuelle de près est en moyenne de 0,3 logMAR à 30 cm et 40 cm et de quatre lignes à 20 cm, avec une différence statistiquement significative entre l’acuité visuelle de près de l’œil opéré et celle de celui qui ne l’est pas.
Il semble cependant que la plupart des études rapportent des résultats de gain d’acuité visuelle de près chez seulement 50 % des patients.
Malecaze confirme en 2001 que l’amplitude d’accommodation se trouverait en effet améliorée de manière très variable [14].
Mathews, dès 1999 [15], a analysé par des enregistrements dynamiques l’accommodation à l’aide d’optomètres infrarouges et il arrive à la conclusion que l’effet obtenu chez certains patients doit avoir une autre explication car l’expansion sclérale ne restaure pas l’accommodation.
En 2004, Ostin retrouve une réponse accommodative de seulement 0,5 D et confirme la thèse de la pseudo-accommodation par la multifocalité induite à l’aide de l’analyse topographique et aberrométrique de patients opérés [18].
Par ailleurs, même chez les patients ayant une amélioration de leur acuité visuelle de près, il est rapporté dans la quasi-totalité des études une régression de l’effet obtenu dès la première année.
Cette méthode a été proposée par Fukasuku et Thornton et a pour but d’augmenter la circonférence du globe en regard du corps ciliaire par un autre moyen que les bandelettes d’expansion sclérale, afin d’améliorer les possibilités de contraction de celui-ci.
La technique chirurgicale consiste, après avoir mesuré l’épaisseur de la sclère antérieure avec un pachymètre ultrasonique, à réaliser une ou deux incisions sclérales par quadrant. Ces incisions ont une longueur de 3 mm, intéressent 95 % de l’épaisseur de la sclère et sont réalisées de façon radiaire en partant du limbe.
L’incision doit être suffisamment profonde pour apercevoir le bleu de l’uvée. Le problème de ces incisions était leur coaptation avec le temps. Pour éviter cet aléa, Fukasuku, en 2001 [6], a proposé d’insérer dans le fond de l’incision un bâtonnet de silicone de 2,5 mm de long sur 0,6 mm de large et de haut. Les incisions étaient ensuite fermées par une suture croisée. Malyugyn, quant à lui, a proposé d’insérer dans l’incision un implant en collagène et poly-HEMA en forme de « T » de 2 mm de long, 1 mm de large et 1 mm de haut [16]. Mais ces inlays ne font que retarder la régression de l’effet.
Enfin, la firme SurgiLight a adapté en 2000 un laser erbium-YAG pour réaliser des incisions plus larges, ne se coaptant pas.
Les incisions sclérales simples n’ont pas d’effet sur l’amplitude d’accommodation [10].
L’insertion d’un implant ou la réalisation des incisions au laser permet en moyenne de doubler l’amplitude d’accommodation, mais cet effet est également régressif [39] et, à un an, le gain accommodatif qui pouvait atteindre 3,5 D en postopératoire immédiat n’était plus que de 0,3 D [6].
Par ailleurs, les auteurs ont noté une diminution sensible et permanente de la pression intraoculaire, probablement par diminution de la densité cellulaire dans l’espace supraciliaire, créant une sorte de microcyclodialyse avec augmentation de l’élimination de la voie uvéosclérale.


[1] Agapitos P.J., Lindstrom R.L., Williams P.A., Sanders D.R. Analysis of astigmatic keratotomy. J Cataract Refract Surg, 1989 ; 15 : 13-8.
[2] Assouline M. Presbytie : de la physiopathologie à la chirurgie. In : Chirurgie réfractive. Saragoussi J.-J., Arné J.-L., Collin J., Montard M. (éd.). Rapport de la Société Française d’Ophtalmologie. Masson, Paris, 2001.
[3] Baikoff G. Chirurgie de la presbytie par expansion sclérale. In : Chirurgie réfractive. Saragoussi J.-J., Arné J.-L., Collin J., Montard M. (éd.). Rapport de la Société Française d’Ophtalmologie. Masson, Paris, 2001.
[4] Croft M.A., Glasser A., Heatley G. et al. Accommodative ciliary body and lens function in rhesus monkeys. I – Normal lens, zonule and ciliary process configuration in the iridectomized eye. Invest Ophthalmol Vis Sci, 2006 ; 47 : 1076-86.
[5] Cross W. Theory behind surgical correction of presbyopia. Ophthalmol Clin North Am, 2001 ; 14 : 315-33, VIII.
[6] Fukasaku H., Marron J.A. Anterior ciliary sclerotomy with silicone expansion plug implantation : effect on presbyopia and intra-ocular pressure. Int Ophthalmol Clin, 2001 ; 41 : 133-41.
[7] Glasser A., Campbell M.C. Presbyopia and the optical changes in the human crystalline lens with age. Vision Res, 1998 ; 38 : 209-29.
[8] Glasser A., Kaufman P.L. The mechanism of accommodation in primates. Ophthalmology, 1999 ; 106 : 863-72.
[9] Glasser A. Restoration of accommodation. Curr Opin Ophthalmol, 2006 ; 17 : 12-8.
[10] Hamilton D.R., Davidorf J.M., Maloney R.K. Anterior ciliary sclerotomy for treatment of presbyopia : a prospective controlled study. Ophthalmology, 2002 ; 109 : 1970-6.
[11] Kaufman P.L., Rohen J.W., Bárány E.H. Hyperopia and loss of accommodation following ciliary muscle disinsertion in the cynomolgus monkey: physiologic and scanning electron microscopic studies. Invest Ophthalmol Vis Sci, 1979 ; 18 : 665-73.
[12] Kasthurirangan S., Glasser A. Age-related changes in accommodative dynamics in humans: response to Dr. Schachar’s letter. Vision Res, 2006 ; 46 : 1507-19.
[13] Lee K.E., Klein B.E., Klein R., Wong T.Y. Changes in refraction over 10 years in an adult population: the Beaver Dam Eye study. Invest Ophthalmol Vis Sci, 2002 ; 43 : 2566-71.
[14] Malecaze F.-J., Gazagne C.-S., Tarroux M.-C., Gorrand J.-M. Scleral expansion bands for presbyopia. Ophthalmology, 2001 ; 108 : 2165-71.
[15] Mathews S. Scleral expansion surgery does not restore accommodation in human presbyopia. Ophthalmology, 1999 ; 106 : 873-7.
[16] Malyugin B., Antonian S., Lohman B.D. Anterior ciliary sclerotomy using collagen T-shaped implants for treatment of presbyopia. Ann Ophthalmol (Skokie), 2008 ; 40 : 130-6.
[17] Ninomiya S., Fujikado T., Kuroda T et al. Changes of ocular aberration with accommodation. Am J Ophthalmol, 2002 ; 134 : 924-6.
[18] Ostrin L.A., Kasthurirangan S., Glasser A. Evaluation of a satisfied bilateral scleral expansion band patient. J Cataract Refract Surg, 2004 ; 30 : 1445-53.
[19] Pierscionek B.K. In vitro alteration of human lens curvatures by radial stretching. Exp Eye Res, 1993 ; 57 : 629-35.
[20] Plainis S., Ginis H.S., Pallikaris A. The effect of ocular aberrations on steady-state errors of accommodative response. J Vis, 2005 ; 5 : 466-77.
[21] Qazi M.A., Pepose J.S., Shuster J.J. Implantation of scleral expansion band segments for the treatment of presbyopia. Am J Ophthalmol, 2002 ; 134 : 808-15.
[22] Schachar R.A. Cause and treatment of presbyopia with a method for increasing the amplitude of accommodation Ann Ophthalmol, 1992 ; 24 : 445-47.
[23] Schachar R.A., Huan T., Huang X. Mathematic proof of Schachar’s hypothesis of accommodation. Ann Ophthalmol, 1993 ; 25 : 5-9.
[24] Schachar RA. Pathophysiology of accommodation and presbyopia. Understanding the clinical implications. J Fla Med Assoc. 1994 ; 81 : 268-71.
[25] Schachar R.A., Tello C., Cudmore D.P. et al. In vivo increase of the human lens equatorial diameter during accommodation. Am J Physiol, 1996 ; 271 : R670-6.
[26] Schachar R.A. Presbyopic surgery. Int Oph Clin, 2002 ; 42 : 107-18.
[27] Schachar R.A. Qualitative effect of zonular tension on freshly extracted intact human crystalline lenses : implications for the mechanism of accommodation. Invest Ophthalmol Vis Sci, 2004 ; 45 : 2691-5.
[28] Schachar R.A. Central surface curvatures of postmortem-extracted intact human crystalline lenses: implications for understanding the mechanism of accommodation. Ophthalmology, 2004 ; 111 : 1699-704.
[29] Schachar R.A. The mechanism of accommodation and presbyopia. Int Ophthalmol Clin, 2006 ; 46 : 39-61.
[30] Schachar R.A., Koivula A. The stress on the anterior lens surface during human in vivo accommodation. Br J Ophthalmol, 2008 ; 92 : 348-50.
[31] Sokolowska A., Thorn F. Accommodation induced changes in crystalline lens position. Invest Ophthalmol Vis Sci, 2003 ; 44 : 4072.
[32] Stachs O., Martin H., Behrend D. et al. Three-dimensional ultrasound biomicroscopy, environmental and conventional scanning electron microscopy investigations of the human zonula ciliaris for numerical modelling of accommodation. Graefes Arch Clin Exp Ophthalmol, 2006 ; 244 : 836-44.
[33] Strenk S.A., Strenk L.M., Koretz J.F. The mechanism of presbyopia. Prog Ret Eye Res, 2005 ; 24 : 379-93.
[34] Streeten B. Zonular apparatus. In : Ocular Anatomy Embryology and Teratology. Jakobiec F.A. (ed.). Harper and Row, Philadelphia PA 1982 : 331-53.
[35] Tamm E., Lütjen-Drecoll E., Rohen J.W. Age-related changes of the ciliary muscle in comparison with changes induced by treatment with prostaglandin F2 alpha. An ultrastructural study in rhesus and cynomolgus monkeys. Mech Ageing Dev, 1990 ; 51 : 101-20.
[36] Tscherning M. Accommodation. In : Physiologic Optics. 3rd edition. The Keystone, Philadelphia, 1920 : 192-228.
[37] Van de Sompel D., Kunkel G.J., Hersh P.S., Smits A.J. Model of accommodation: contributions of lens geometry and mechanical properties to the development of presbyopia. J Cataract Refract Surg, 2010 ; 36 : 1960-71.
[38] Wilson R.S. Does the lens diameter increase or decrease during accommodation? Human accommodation studies: a new technique using infrared retro-illumination video photography and pixel unit measurements. Trans Am Ophthalmol Soc, 1997 ; 95 : 261-7.
[39] Wirbelauer C., Karandish A., Henning A., Pham D.T. Imaging scleral expansion bands for presbyopia with optical coherence tomography. J Cataract Refract Surg, 2003 ; 29 : 2435-8.
[40] Young T. On the mecanism of the eye. Philos Trans R Soc, 1801 ; 92 : 23-88.

