Stratégies thérapeutiques dans les atteintes virales de la surface oculaire
M. Labetoulle, A. Rousseau, M. M’Garrech, L. Bonin, E. Barreau, T. Bourcier
Pour les infections cornéennes et conjonctivales virales non liées à herpes simplex virus (HSV) et au virus varicelle–zona (varicella-zoster virus ou VZV), le traitement est en général purement symptomatique car il n’existe pas d’antiviral efficace sur ce type de virus.
Pour les infections à adénovirus ou entérovirus, la principale mesure à prendre relève de la santé publique, en limitant les risques de contamination secondaire autour du patient source, tant on sait la contagiosité de ces agents.
Pour les infections liées à herpes simplex virus (HSV) et au virus varicelle–zona (varicella-zoster virus ou VZV), les antiviraux spécifiques sont toujours indiqués. Les corticoïdes sont contre-indiqués lorsque l’épithélium cornéen est touché ou en cas de nécrose stromale. Ils sont en revanche indispensables pour la prise en charge des kératites stromales non nécrosantes ou des endothélites, car les antiviraux seuls ne sont pas suffisants pour limiter les dégâts tissulaires d’origine inflammatoire. La question de la prévention antivirale secondaire devient essentielle en cas de récurrences fréquentes.
La prise en charge thérapeutique des infections virales de la surface oculaire repose sur des principes simples, fondés sur les connaissances de la pathogénie des affections. Même si les traitements réellement étiologiques, c’est-à-dire les antiviraux, ne sont pas actifs sur tous les types de virus en cause, les outils thérapeutiques ne manquent pas pour le clinicien. En pratique, ce sont surtout les Herpesviridae, en particulier HSV et VZV, qui bénéficient d’un traitement spécifique. Mais la panoplie des stratégies antivirales reste vaste et adaptable à chaque situation clinique.
Elles sont communes à la prise en charge de toutes les formes de conjonctivite infectieuse, mais elles prennent une importance particulière dans celles dues aux virus non enveloppés (en particulier les entérovirus) en raison de leur contagiosité. Rappelons, à titre d’exemple, que l’adénovirus, un fois excrété dans le milieu extérieur, peut rester infectieux après 20 jours passés en atmosphère humide et 11 jours en milieu sec, et que la production de particules virales persiste au moins une quinzaine de jours après le début des signes cliniques, voire plus de 9 semaines chez certains patients [1]. Un rapide calcul amène donc à la conclusion que les surfaces de mobilier d’un cabinet d’ophtalmologie (dont la salle d’attente) peuvent héberger de l’adénovirus pendant 6 à 7 semaines après avoir été contaminées par les sécrétions d’un patient infecté. Même un virus enveloppé comme HSV n’est pas immédiatement détruit après excrétion, puisqu’il est capable de survivre plus de 8 h en atmosphère humide, c’est-à-dire sur un coin de table mal nettoyée ou dans une solution antiseptique mais inadaptée aux virus [2].
Il est donc essentiel de mettre en œuvre quelques mesures simples destinées à réduire le risque de cas secondaires, dans l’entourage social du patient de même que parmi les patients consultant dans le même cabinet d’ophtalmologie que le patient source. Une étude anglaise a particulièrement bien montré que des mesures d’hygiène simples sont très efficaces en milieu hospitalier [3] : circuit isolé pour les patients suspectés de conjonctivite infectieuse (en pratique réduire le temps passé au cabinet, notamment le passage en salle d’attente commune), utilisation par l’équipe soignante de gants et de matériel à usage unique, puis nettoyage systématique de toutes les surfaces potentiellement touchées par le patient avec un produit virucide. Ces mesures appliquées en centre de soins doivent être complétées par une remise de conseils visant à réduire le risque de contamination des proches (affaires de toilette personnelles, limitation des contacts cutanés, lavage des mains régulier) et des collaborateurs (application des mêmes règles dans le milieu professionnel du patient, voire arrêt de travail pour les métiers comportant un contact avec le public et éviction scolaire pour les enfants). Il est par ailleurs logique de surseoir au port des lentilles jusqu’à guérison complète de l’infection.
L’instillation répétée de sérum physiologique est une mesure logique et légitime dans toutes les formes d’infection de la surface oculaire, car elle permet de réduire à la fois la charge en particules infectieuses et la quantité d’effecteurs inflammatoires (cytokines, lymphocytes, polynucléaires) sur l’œil. De même, le lavage régulier du visage et des paupières permet de limiter l’inflammation péri-oculaire et la transmission de l’infection par le biais des mains sales. La prescription de collyres antiseptiques peut être envisagée si l’on craint une surinfection bactérienne, très rare toutefois dans le cadre des conjonctivites virales, sauf chez des patients immunodéprimés et/ou en cas de mauvaises conditions sanitaires [4].
La place des corticoïdes et autres anti-inflammatoires dans les conjonctivites virales est une question souvent débattue. De façon schématique, on peut retenir que les corticoïdes et la ciclosporine ne sont pas indiqués dans les conjonctivites à HSV ou VZV, car ils risquent de favoriser une infection extensive de la conjonctive, voire de la cornée. De même, les anti-inflammatoires non stéroïdiens (AINS) ne sont pas indiqués car ils retardent le processus de réparation épithéliale.
Dans les autres indications, la place des anti-inflammatoires a surtout été étudiée pour les infections à adénovirus. Administrés à la phase aiguë, les corticoïdes réduisent la gêne fonctionnelle, notamment les brûlures et démangeaisons [5], mais au prix d’une augmentation du temps de portage (production virale) pour le patient, et donc d’une augmentation du risque de transmission de la maladie à ses proches [6, 7]. Il n’est ainsi pas légitime, dans l’intérêt général, de prescrire des corticoïdes topiques pendant la phase symptomatique des kératoconjonctivites adénovirales, sauf dans les formes très sévères, notamment pseudo-membraneuses. En revanche, les corticoïdes sont incontestablement utiles au stade des complications, notamment les dépôts sous-épithéliaux. Il est alors licite de proposer une préparation à base de fluorométholone ou de rimexolone, pour limiter le risque d’hypertonie oculaire, sachant que le traitement devra probablement être poursuivi plusieurs semaines. Une fois la disparition des opacités obtenue, la posologie des corticoïdes doit être réduite de façon progressive pour éviter un effet rebond (réapparition des dépôts sous-épithéliaux). Malgré une décroissance lente, certains patients font tout de même l’objet d’une véritable cortico-dépendance. Les préparations de collyre à la ciclosporine (à 2 % dans cette indication) trouvent alors leur place pour d’abord réduire la posologie minimale de corticoïdes, puis obtenir un sevrage total [8–10]. La ciclosporine a cependant tendance, comme les corticoïdes, à proroger le temps de production d’adénovirus par les cellules de la surface oculaire [11]. Son utilisation ne doit donc pas être trop précoce dans l’histoire de la maladie du patient. Enfin, certains patients peuvent conserver des opacités sous-épithéliales malgré l’association de corticoïdes et de ciclosporine topique. Lorsqu’elles sont centrales et gênantes pour la vision, et sous réserve qu’elles persistent de nombreux mois, le recours à la photokératectomie est licite. Le risque est la récidive si le geste à été pratiqué trop tôt, c’est-à-dire avant l’extinction complète de toute production adénovirale. Ce délai peut être extrêmement long chez certains patients.
Seules les conjonctivites herpétiques, et par extension les conjonctivites à VZV, sont concernées par une autorisation de mise sur le marché (AMM) pour un des antiviraux topiques actuellement disponibles en France (ganciclovir, aciclovir, trifluridine, respectivement Virgan®, Zovirax® et Virophta®). À cet égard, on peut même noter que seule l’AMM de la trifluridine (Virophta®) mentionne clairement le terme de « conjonctivites herpétiques ». Le traitement antiviral oral peut aussi être utilisé dans les conjonctivites, soit dans le cadre d’une AMM lorsqu’une conjonctivite à VZV survient dans le cadre d’une varicelle ou d’un zona, soit hors AMM pour les conjonctivites herpétiques chez des patients pour lesquels l’instillation répétée serait inadéquate (enfants, patients grabataires ou à l’inverse très actifs) [12]. Les données d’utilisation des antiviraux dans les infections à HSV et VZV sont plus amplement décrites à propos des kératites. Enfin, il convient de noter que les conjonctivites herpétiques néonatales, acquises au moment du passage dans la filière génitale, imposent un traitement antiviral par voie générale et une consultation multidisciplinaire en raison du risque d’atteinte oculaire et aussi neurologique [13].
Pour les autres conjonctivites virales, il n’existe malheureusement pas de traitement antiviral ayant démontré son efficacité clinique. Le problème se pose tout particulièrement dans les conjonctivites adénovirales. Plusieurs antiviraux classiques ont été testés, sans succès, comme l’idoxuridine, la vidarabine (ara-A), la trifluridine, l’aciclovir [14, 15]. De même, les applications topiques d’interféron, antiviral non spécifique naturel, n’ont pas montré d’efficacité clinique [15]. Le cidofovir topique a montré une certaine efficacité dans des modèles expérimentaux [16, 17] mais les études chez l’homme ont montré un très faible index thérapeutique, la concentration efficace correspondant aussi à la dose toxique pour l’épithélium [18–21]. Le ganciclovir topique a aussi été testé dans cette indication. Une étude chez l’animal a montré l’efficacité d’une préparation à 3 % [22], sachant que le gel disponible sur le marché est dosé à 0,15 %. Sous cette forme, une étude réalisée chez 19 patients (versus 14 patients traités par un placebo) a montré une tendance à l’amélioration des symptômes [23]. Pour l’avenir, certaines pistes pour le traitement des infections adénovirus ont été proposées mais les données sont encore ténues. La stampidine, dérivée de la stavudine (d4T) est efficace in vitro contre l’adénovirus [24]. Le doxovir, la cyclopentenylcytosine et la zalcitabine (aussi appelée didésoxycitdine ou ddC) ont également montré une certaine efficacité expérimentale chez le lapin [25], mais la forme orale de cette dernière molécule (Hivid®) a été retirée du marché pour toxicité. L’association digoxine–furosémide possède aussi des propriétés antivirales in vitro [26], mais aucun essai in vivo n’a été publié. Plus récemment, deux études ont suggéré l’intérêt des immunoglobulines spécifiques dans un modèle expérimental [27] et de l’acide hyaluronique [28]. Enfin, la N-chloro-taurine est aussi efficace in vitro sur l’adénovirus [29] et a été utilisée de façon encourageante dans un essai de phase II chez l’homme [30, 31]. Finalement, une des pistes les plus sérieuses vient de l’iode, sous forme de povidone iodine [32], dont une solution aqueuse à 0,8 % est efficace in vitro sur l’adénovirus [33]. Une solution combinée de povidone iodine à 0,4 % et de dexaméthasone a récemment induit, dans un essai clinique, une réduction des symptômes liés à l’infection adénovirale [34]. Il était cependant difficile de savoir laquelle des deux molécules expliquait le plus la réduction des signes fonctionnels et les auteurs n’ont pas analysé l’incidence des cas d’infection secondaire chez les sujets contacts, du fait de l’effet promoteur persistant de la dexaméthasone sur la réplication virale, alors que l’action antivirale de la povidone iodine est immédiate et donc rapidement réduite après instillation.
Les conjonctivites observées dans le cadre du molluscum contagiosum sont avant tout des atteintes réactionnelles aux lésions cutanées, et il est exceptionnel d’observer une localisation conjonctivale directe [35]. L’atteinte inflammatoire de la conjonctive est en général très rapidement résolutive après l’ablation des lésions cutanées localisées au visage. En pratique, ces lésions peuvent être curetées au bloc opératoire, sous anesthésie locale. Il convient cependant d’être exhaustif dans le traitement chirurgical, car l’auto-inoculation à partir d’une seule lésion restante peut être à l’origine d’une rechute des signes conjonctivaux. Une cryo-application sur les bords des sites d’exérèse participe probablement à la réduction du risque de récidive. Dans l’avenir, l’application locale de crème à l’imiquimod, modificateur de la réponse immunitaire en favorisant la réponse interféron, pourrait peut-être supplanter les méthodes chirurgicales, mais ces dernières restent largement d’actualité [36].
Les blépharites virales liées aux infections éruptives ou assimilées (rougeole, rubéole, etc.) posent rarement des problèmes sérieux et la prise en charge consiste essentiellement en des soins d’hygiène cutanée pour éviter une surinfection bactérienne. La prise en charge des blépharites dans le cadre des lésions de molluscum contagiosum est mentionnée dans le paragraphe précédent.
Finalement, ce sont essentiellement les blépharites dues à HSV et VZV qui peuvent bénéficier d’un traitement spécifique. Outre les soins d’hygiène locale, il est logique de proposer à ces patients une préparation antivirale à visée dermatologique. En pratique, toutes les spécialités actuellement disponibles sont à base d’aciclovir. Leur intérêt réside dans les excipients qui favorisent la pénétration transcutanée de l’antiviral, ce que ne ferait pas la pommade à visée ophtalmologique. De façon plus précise, ces formulations contiennent plusieurs des excipients suivants : macrogolglycérides stéariques, diméticone, alcool cétylique, propylène glycol, poloxamère 407, laurylsulfate de sodium, alcool cétostéarylique, vaseline, diméticone, paraffine liquide, monostéarate de glycérol, macrogol stéarate 100 et eau purifiée. Compte tenu de la présence de ces excipients, le patient doit éviter le passage dans l’œil du produit dermatologique. Pour comparaison, le seul excipient de la pommade d’aciclovir à destinée ophtalmique est la vaseline.
Les sclérites survenant lors d’un épisode viral sont essentiellement liées à VZV, plus rarement à HSV. Leur prise en charge repose sur la combinaison d’antiviraux oraux, associés dans un second temps à des corticoïdes topiques, sur le mode de la prise en charge des kératites herpétiques (ou zostériennes) non nécrosantes. Dans les formes les plus douloureuses, les corticoïdes intraveineux peuvent être indiqués.
Le but est de proposer ici des conduites thérapeutiques simples, applicables au quotidien, pour la prise en charge des kératites à HSV (herpétiques). Par extension, ces propositions sont aussi valables pour les kératites à VZV (zostérienne), qu’elles surviennent de façon isolée ou dans le cadre d’une varicelle ou d’un zona ophtalmique.
Les mesures non spécifiques sont essentielles dans cette indication car elles améliorent nettement le confort du patient et accélèrent l’effet des antiviraux. Idéalement, le patient doit bénéficier d’un débridement et d’une prescription de collyre cycloplégique et de larmes artificielles. Un pansement peut aussi être mis en place à visée antalgique.
Les mesures spécifiques se résument à la prescription d’antiviraux, qui peuvent alternativement être proposés par voie topique ou orale, pour une durée de 7 à 15 jours en fonction de la réponse clinique. Il n’y a pas de supériorité d’un mode de traitement (oral ou topique) en termes de rapidité de cicatrisation épithéliale [37].
Si le choix est de donner les antiviraux par voie topique pour des raisons de sécurité médicale (pas d’effet systémique, pas d’interaction avec les fonctions vitales), il n’y a pas de supériorité clairement démontrée en faveur d’une des spécialités disponibles sur le marché, toujours en termes de rapidité de cicatrisation épithéliale [37]. Le choix sera donc guidé par le nombre d’instillations et le degré de gêne visuelle occasionnée en fonction de la spécialité choisie [12].
Si le choix est de donner les antiviraux par voie orale pour des raisons pratiques (pas de gêne visuelle induite par les instillations, pas de respect strict des horaires d’instillation, nécessité de gêner la vue le moins possible), l’ophtalmologiste peut alternativement choisir, en respectant les posologies, l’aciclovir ou le valaciclovir (ce dernier est toutefois à éviter chez l’enfant de moins de 12 ans, par manque de données). Il convient alors de s’assurer de la normalité de la fonction rénale (adapter les doses le cas échéant) et, pendant le traitement, de l’absence d’anomalies hépatiques, rénales et hématologiques. Elles sont toutefois exceptionnellement graves [12]. La voie orale est particulièrement adaptée chez les enfants pour des raisons pratiques [5, 38–41], de même que chez les patients dépendants ou à l’inverse très pris par leur vie sociale. À cet égard, le valaciclovir présente l’avantage d’un nombre réduit de prises quotidiennes.
Des modèles d’ordonnance sont proposés dans l’encadré 24-1.
Dans tous les cas
• Larmes artificielles sans conservateurs : 1 goutte 3 fois/j pendant 15 j
• Homatropine (Isopto Homatropine® 1 %) : 1 goutte 3 fois/j pendant 48 h ; passer à l’atropine 0,5 % voire 0,3 % chez l’enfant
ET SOIT traitement antiviral local
• Aciclovir (Zovirax®), pommade à 3 % : 1 application (taille d’un grain de riz) 5 fois/j à poursuivre 3 jours après la réépithélialisation
• OU ganciclovir (Virgan®), gel à 0,15 % : 1 goutte 5 fois/j jusqu’à réépithélialisation puis 3 fois/j pendant 7 j
• OU trifluridine (Virophta®), collyre à 1 % : 1 goutte/2 h jusqu’à réépithélialisation (max. 9 gouttes/j) puis 5 fois/j pendant 7 j (durée totale < 21 j)
SOIT traitement oral
• Aciclovir (Zovirax®) :
■ comprimé à 200 mg : 2 comprimés 5 fois/j pendant 7 à 14 j. Adapter la durée du traitement à la cicatrisation de l’épithélium
■ chez l’enfant de plus de 2 ans, même posologie avec la suspension à 200 mg/5 ml (10 ml 5 fois/j) pendant 7 à 14 j
• OU valaciclovir (Zelitrex®) : comprimé à 500 mg, 1 comprimé 2 fois/j pendant 7 à 14 j. Adapter la durée du traitement à la cicatrisation de l’épithélium
• Discuter la mise en route d’une prévention antivirale au long cours selon la fréquence des épisodes
(Source : Labetoulle et al. [69], autorisation JFO.)
L’efficacité des traitements mis en route doit être vérifiée cliniquement dans un délai de 2 à 7 jours, en fonction de la gravité.
L’analyse sémiologique de la forme clinique est essentielle dans les atteintes herpétiques stromales, car elle conditionne le degré d’urgence et la possibilité d’utiliser des corticoïdes pour réduire l’inflammation. Toute atteinte de type nécrotique, même partielle au sein d’une vaste partie non nécrotique, impose de donner la priorité à la maîtrise de la réplication virale, en utilisant des antiviraux à fortes doses et sans prendre le risque de promouvoir l’infection avec des corticostéroïdes d’emblée. Quand il n’existe aucune part nécrotique, ce qui est finalement la situation la plus fréquente, les corticoïdes sont indispensables, mais après avoir pris soin de bloquer la réplication virale grâce à des antiviraux prescrits à dose efficace.
Les kératites stromales avec nécrose doivent être considérées comme des urgences dont le risque immédiat est la fonte cornéenne puis la perforation. Il est donc légitime de limiter ce risque au maximum en proposant un traitement antiviral par voie intraveineuse, en pratique de l’aciclovir à la dose de 5 à 10 mg/kg toutes les 8 heures (à adapter à la fonction rénale) [42, 43]. Pour le confort du patient, une prévention des douleurs est utile, en utilisant un collyre d’atropine à 1 % (adapter la concentration chez l’enfant) et des pansements oculaires occlusifs. La surveillance doit être au moins quotidienne, pour vérifier que les zones nécrotiques réduisent en taille et en épaisseur. Si tel n’est pas le cas, une greffe de membrane amniotique (GMA) peut s’avérer utile [44, 45]. À l’inverse, quand la situation s’améliore sous antiviraux intraveineux (moindre opacité de la zone initialement nécrotique), un relais per os peut être envisagé, le plus souvent avec du valaciclovir à la dose de 3 g/jour en trois prises. L’utilisation des corticoïdes dans ses formes stromales avec nécrose est contre-indiquée tant que persiste le moindre signe nécrotique. Lorsque l’infection est clairement maîtrisée, ils peuvent être introduits, sous surveillance stricte, dans le but de réduire le risque de fibrose intrastromale ou de néovascularisation de la zone initialement touchée. Les antiviraux doivent être maintenus à dose efficace pendant toute la corticothérapie et à dose préventive au décours, compte tenu du risque de récidive rapide.
Il est malheureusement des cas de kératite herpétique stromale nécrotique pour lesquels les patients consultent tardivement, au stade de la perforation cornéenne. Une greffe à chaud est alors le seul moyen d’améliorer la situation architectonique, tout en prévenant le patient du pronostic fonctionnel très engagé [42].
Les kératites stromales sans nécrose nécessitent une association judicieuse entre antiviraux et corticoïdes. Il est maintenant admis que les meilleurs résultats sont obtenus en débutant les antiviraux par voie orale, puis en introduisant les corticoïdes par voie topique [12, 46].
Sur le plan théorique, les antiviraux pourraient aussi être utilisés par voie topique (en privilégiant ceux qui pénètrent le mieux la cornée). Cette attitude, longtemps utilisée [47], se solde dans 20 % des cas par une rechute inflammatoire au moment du sevrage en corticoïdes [5], probablement par persistance d’un certain niveau de production virale, source de stimulation pour le système immunitaire. La stratégie désormais usuelle est donc d’introduire, dans un premier temps, uniquement le traitement antiviral à dose suffisante pour bloquer la réplication virale (1 g/jour de valaciclovir selon l’AMM, parfois plus quand l’inflammation est importante). Une fois obtenue la preuve de l’efficacité clinique (absence d’aggravation, et même début de régression des signes inflammatoires), les corticoïdes topiques peuvent être débutés, le plus souvent avec de la dexaméthasone (ou de la rimexolone), à la posologie de quatre à huit gouttes/jour. Lorsque l’inflammation a réellement diminué (récupération de la transparence cornéenne), les posologies de corticoïdes peuvent être diminuées de façon progressive, par exemple en réduisant la posologie quotidienne d’une goutte par paliers de 5 à 10 jours. Pour éviter la rechute inflammatoire, il est essentiel de maintenir une couverture antivirale (valaciclovir oral, 0,5 à 1 g/j selon la gravité) pendant toute cette période, et même une ou deux semaines de plus. Ce traitement peut même être poursuivi à dose préventive pendant de nombreux mois si le patient est éligible (voir ci-dessous les indications du traitement antiviral préventif au long cours). Malheureusement, certains patients présentent d’emblée une récidive inflammatoire au moment même du sevrage en corticoïdes ou juste après. Il convient alors de reprendre le traitement initial pour juguler la nouvelle poussée inflammatoire, mais en respectant au décours des paliers plus long pour la décroissance des corticoïdes. En cas de nouvelle rechute, il est alors licite de proposer un traitement par ciclosporine topique (collyre magistral à 2 %) dans le but de maîtriser cette cortico-dépendance [48–50]. L’encadré 24-2 et la figure 24-1 sont donnés à titre d’exemple pour la prescription initiale et pour la gestion de la combinaison entre antiviraux et corticothérapie.
Ordonnance initiale
• Aciclovir (Zovirax®) : comprimé à 200 mg, 2 comprimés 5 fois/j pendant 7 à 14 j, voire 800 mg 5 jour/j dans les formes sévères (hors AMM)
• OU valaciclovir (Zelitrex®) : comprimé à 500 mg, 1 comprimé 2 fois/j pendant 7 à 14 j, voire 2 comprimés 3 fois/j dans les formes sévères (hors AMM)
• OU famciclovir (Oravir®) : comprimé à 500 mg, 1 comprimé 3 fois/j pendant 10 j (hors AMM)
Après 48 heures et la preuve clinique de l’efficacité des antiviraux
• Dexaméthasone ou rimexolone en collyre : 1 goutte 6 à 8 fois/j pendant 4 à 6 j, puis réduction progressive (par paliers de 3 à 6 j) en fonction de l’efficacité
• Tout en poursuivant les antiviraux oraux pendant toute la durée de la corticothérapie :
■ aciclovir (Zovirax®) : comprimé à 200 mg, 2 comprimés 5 fois/j pendant 5 à 12 j, puis 2 comprimés 2 fois/j
■ OU valaciclovir (Zelitrex®) : comprimé à 500 mg, 1 comprimé 2 fois/j pendant 5 à 12 jours, puis 1 comprimé/j
• Discuter la mise en route d’une prévention antivirale au long cours selon la fréquence et la gravité des épisodes
(Source : Labetoulle et al. [69], autorisation JFO.)

Fig. 24-1 Schéma simplifié de la place des corticoïdes dans la prise en charge des kératites herpétiques, adapté de Labetoulle [12].
(Source : d’après Labetoulle M, Rousseau A, Bourcier T. Atteintes herpétiques du segment antérieur de l'œil : aspects thérapeutiques. EMC Ophtalmologie 2014 [21-200-D 21] Copyright © 2014 Elsevier Masson. Tous droits réservés.)
De façon générale, les endothélites herpétiques et zostériennes sont prises en charge sur le modèle des atteintes stromales, avec cependant quelques particularités.
Les endothélites linéaires sont habituellement considérées comme des urgences virales, au même titre qu’une atteinte stromale nécrosante, en raison du risque majeur de perte endothéliale. Il est donc licite de proposer une hospitalisation qui permet la mise en place d’un traitement antiviral intraveineux (aciclovir, voire foscarnet) et une surveillance très rapprochée. Cependant, à la différence des kératites stromales nécrosantes, les corticoïdes topiques, voire par voie intraveineuse, doivent être proposés rapidement. En pratique, on attend les premières preuves de l’efficacité de l’antiviral (réduction des précipités rétrodescémétiques, réduction de l’hypertonie associée) pour débuter la corticothérapie. Si la voie topique est choisie, on associe souvent un collyre à la dexaméthasone et des injections sous-conjonctivales de corticoïdes, en évitant les formes retard. Bien entendu, la surveillance clinique permet de vérifier l’efficacité du traitement, et par là même l’absence d’aggravation lors de l’introduction des corticoïdes.
Les endothélites disciformes représentent à l’inverse la forme la plus bénigne de toutes les endothélites ; elles sont typiquement gérées comme les kératites stromales non nécrosantes. En pratique, on débute les antiviraux oraux à forte dose (valaciclovir 1 à 3 g/jour, posologies hors AMM dans ce dernier cas mais souvent utiles) avant d’introduire les corticoïdes topiques (voir ci-dessus).
Les endothélites diffuses ont une place intermédiaire en termes de gravité. En fonction des signes associés (importance de l’œdème, de l’hypertonie oculaire, etc.), on peut choisir la voie intraveineuse ou la voie orale pour débuter les antiviraux. La posologie du traitement et sa voie d’administration doivent être adaptées à la surveillance clinique [42, 43]. Les corticoïdes topiques sont aussi introduits quelques jours plus tard, une fois les premières améliorations observées.
Pour les trois types d’endothélites, la gestion de la décroissance de la corticothérapie, toujours sous couverture antivirale, suit les règles schématiques proposées dans la figure 24-1.
Les mesures préventives anti-herpétiques actuellement disponibles ne sont que partiellement efficaces. La principale explication est qu’il n’existe pas de médicament capable de détruire le stock de virus à l’état latent dans les neurones des principaux relais de l’innervation des tissus de la face (ganglion trigéminé, ganglion cervical supérieur). Ainsi, la seule possibilité pour le clinicien est de proposer des traitements dont le rôle n’est que suspensif, en bloquant les épisodes de réactivation lorsqu’ils ont déjà débuté (effet des antiviraux) et en limitant le nombre de situations facilitant la réactivation (mesures associées décrites ci-dessous).
La principale arme préventive est donc représentée par la classe des antiviraux. L’étude princeps a été publiée par The Herpetic Eye Disease Study Group (HEDS) en 1998, avec des résultats complémentaires délivrés en 2000 [51, 52]. Cette étude majeure a permis de confirmer les résultats de séries plus modestes, mais très innovantes, publiées dans les années 1990, en particulier sous la direction de Joseph Colin [53–56].
L’étude HEDS a marqué un tournant grâce à sa méthodologie (prospective, randomisée, en double insu et contrôlée), le nombre de patients inclus (703 sujets répartis en deux groupes : aciclovir ou placebo) et la clarté des résultats. En substance, les patients sélectionnés sur le critère de la sévérité de leur histoire d’herpès cornéen (au moins deux épisodes en moins de 12 mois) étaient traités par aciclovir oral à la dose de 800 mg/jour en deux prises (ou par un placebo dans le groupe contrôle) pendant 12 mois. Le traitement était ensuite arrêté mais les patients continuaient d’être suivis pendant 6 mois.
Les principales conclusions de l’étude HEDS sont résumées dans le tableau 24-1.
Depuis cette étude principale, il n’y a pas eu de grand essai thérapeutique contrôlé, randomisé et en double insu qui permette d’obtenir des informations complémentaires indiscutables. Cependant, quelques éléments intéressants peuvent être déduits des publications récentes. La dernière analyse des données de l’étude de observationnelle de Rochester suggère que le véritable effet préventif des antiviraux est plus important que celui initialement décrit, avec une réduction d’un facteur 8 à 10 de la fréquence des récidives herpétiques contre un facteur 2 dans l’étude HEDS. Cette différence est très probablement due à la moindre gravité de la maladie herpétique chez les patients vus en pratique courante, alors que ceux inclus dans l’étude HEDS étaient sévèrement atteints [57]. L’étude de Rochester montrait aussi que le pronostic visuel est clairement dû à la qualité de la prise en charge, puisque 65 % des patients dont l’acuité visuelle finale était inférieure à 1/10 étaient justement ceux n’ayant jamais bénéficié d’un traitement préventif.
D’autres publications permettent d’avoir quelques éléments de réponses sur les questions citées dans le tableau 24-1. Sur la foi d’une seule étude, non randomisée, il apparaît qu’un traitement préventif prolongé au-delà de 12 mois continue d’être efficace [58], et cela est conforté par l’expérience quotidienne. Par ailleurs, la relation entre posologie et effet préventif a été suggérée dans une publication [54], et l’expérience clinique montre aussi que certains patients peuvent être suffisamment couverts avec une posologie préventive faible [59], quand d’autres nécessitent des doses supérieures aux posologies habituelles. Le praticien est donc parfois amené à doubler la posologie préventive préconisée par l’AMM, pour réduire suffisamment la fréquence des récidives, et ainsi tenter de protéger le pronostic visuel.
Enfin, la question des résistances aux antiviraux induites par les traitements préventifs au long cours a été abordée dans quelques publications récentes troublantes. En France, la fréquence de portage de souches de HSV-1 résistantes était évaluée à 0,2 % en 2004, sans augmentation apparente sur les trente dernières années malgré l’avènement des antiviraux oraux dans les années 1980 [60–62]. À l’échelle de la population, le risque lié à l’utilisation croissante d’antiviraux à titre curatif ou préventif des différentes formes d’herpès (oral, oculaire et génital) ne semble pas majeur en comparaison de l’efficacité des traitements, et cette observation contredit quelque peu certaines modélisations mathématiques qui avaient visiblement surestimé le risque d’émergence de résistances à l’aciclovir dans la population générale [63, 64]. Cependant, force est de constater que la résistance clinique aux antiviraux existe chez certains patients, ce qui explique d’ailleurs la difficulté à réduire la fréquence de leurs récidives oculaires [65, 66]. Une étude plus systématique suggère que la résistance biologique (sur la base de tests in vitro) de souches herpétiques n’est pas un événement si rare, et qu’il s’agit effectivement d’un réel facteur de risque pour l’apparition d’une réelle résistance clinique [67].
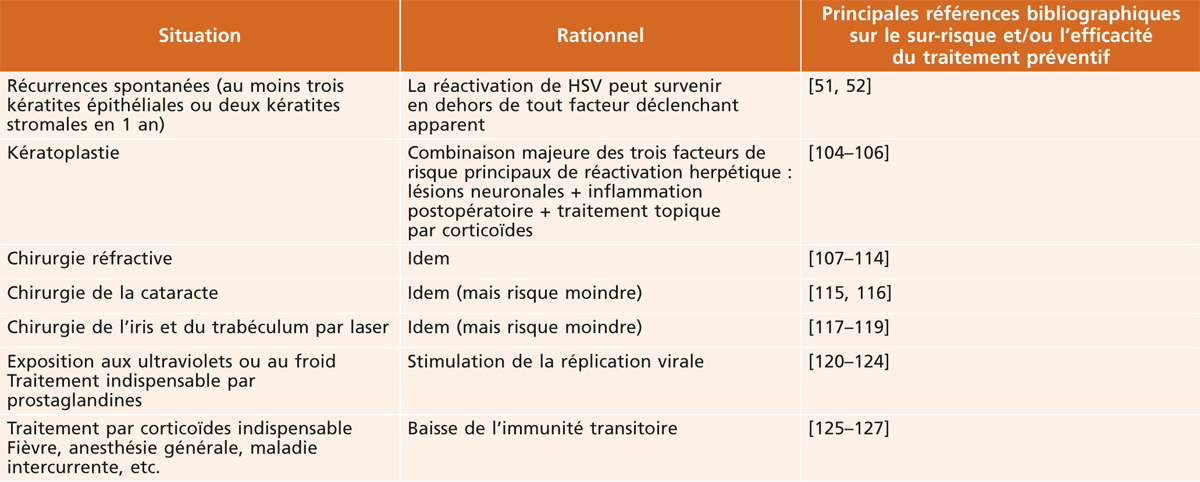
L’étude HEDS a servi de support à la reconnaissance par les autorités de santé de l’intérêt d’une prévention antivirale chez les patients déjà lourdement atteints par des kératites herpétiques récidivantes. Pour cette indication, l’AMM en France a été obtenue en 2000, pour une posologie d’aciclovir (Zovirax®) de 800 mg/jour en deux prises orales, chez les patients ayant subi au moins trois épisodes de kératite épithéliale ou deux épisodes de kératite stromale au cours des 12 mois précédents. Ce traitement est aussi proposé chez les patients avec antécédent d’herpès oculaire, même ancien, et soumis à un facteur de risque significatif de réactivation, notamment une chirurgie du segment antérieur de l’œil (voir le tableau 24-2 résumant les principales situations à risque).
Sur la base de la bio-équivalence entre les molécules [68], le valaciclovir a été gratifié d’une indication strictement identique, à la dose de 500 mg/jour en une prise (un comprimé de Zelitrex®).
Par extension aussi, les kératites récidivantes dues au VZV, d’ailleurs très proches cliniquement de celles dues au HSV, sont habituellement traitées en suivant les mêmes posologies et indications [69]. Rappelons enfin la possibilité reconnue par nombre de spécialistes de doubler la dose préventive en cas d’herpès oculaire particulièrement récidivant.
Des modèles d’ordonnance sont proposés dans l’encadré 24-3.
Ordonnance initiale
• Valaciclovir (Zelitrex®) : comprimé à 500 mg, 1 comprimé/j pendant 6 à 12 mois
• OU aciclovir (Zovirax®) : comprimé à 200 mg, 2 comprimés 2 fois/j pendant 6 à 12 mois
• Associer : collyres mouillants sans conservateurs, 3 à 5 instillations/j
• Éventuellement ciclosporine en collyre à 2 % :
■ 1 à 2 instillations/j
■ en fonction de la part inflammatoire dans les récidives cornéennes
En cas de récidives trop fréquentes
• Doubler les doses initiales de l’antiviral (hors AMM)
• Rapprocher la surveillance clinique et biologique du traitement
(Source : Labetoulle et al. [69], autorisation JFO.)
L’efficacité et la tolérance des traitements mis en route doivent être vérifiées cliniquement, selon un délai qui dépend de la gravité initiale.
Tableau 24-1 Résumé des conclusions de l’étude HEDS sur la prévention des récidives d’herpès cornéen [51, 52].
Tableau 24-2 Principales indications du traitement préventif.
(Extrait de Labetoulle M, Rousseau A, Bourcier T. Atteintes herpétiques du segment antérieur de l'œil : aspects thérapeutiques. EMC Ophtalmologie 2014 [21-200-D 21] Copyright © 2014 Elsevier Masson. Tous droits réservés.)
Les ophtalmologistes sont souvent en première ligne dans la prise en charge du zona ophtalmique. Il convient à cet égard de distinguer le traitement des complications oculaires du zona, c’est-à-dire les blépharites, conjonctivites et kératites (ces aspects sont développés dans les paragraphes précédents, par analogie entre le HSV et le VZV), du traitement du zona en soi, décrit ci-dessous. Les deux objectifs principaux de cette prise en charge sont de réduire aussi vite que possible la réplication virale (pour limiter les complications oculaires) et de lutter contre les douleurs, dès la phase aiguë, car elles conditionnent la survenue des redoutables neuropathies post-zostériennes.
Elle repose sur les antiviraux, le plus souvent prescrits par voie orale. Trois molécules disposent en France d’une AMM dans cette indication : l’aciclovir, le valaciclovir et le famciclovir (voir chapitre 17-II). Pour optimiser la prévention des risques des complications oculaires, il est recommandé d’initier le traitement antiviral le plus tôt possible, idéalement dans les 72 premières heures de l’éruption de vésicules zostériennes [70, 71].
L’aciclovir (Zovirax®) doit être donné par voie orale à la dose de 4 g/jour (répartis en cinq prises), afin d’obtenir la concentration sanguine compatible avec l’inhibition de la plupart des souches de VZV [68, 72–74]. Chez les patients fortement immunodéprimés, l’aciclovir est volontiers donné par voie intraveineuse (10 mg/kg toutes les 8 h) en raison du risque de complications oculaires sévères (notamment les nécroses rétiniennes aiguës) ou de forme hyperalgique [75]. La durée de traitement recommandée par l’AMM est de 7 jours. Ceci est basé sur les résultats d’études cliniques randomisées et contrôlées (contre placebo) ayant démontré la moindre fréquence des complications oculaires de la phase aiguë (ulcérations cornéennes surtout) et semi-retardées (kératites stromales, épisclérites, sclérites, uvéites) chez les patients traités pendant 7 à 10 jours [70, 76–79]. En revanche, des traitements antiviraux plus longs ne semblaient pas avoir d’avantages majeurs en termes de prévention des inflammations oculaires [80, 81]. Cependant, certaines situations particulières peuvent le justifier. Il s’agit surtout des sujets âgés et des patients soumis à d’autres causes d’immunodépression, car la réplication virale est plus prolongée avec un risque plus important de complications oculaires [82].
Le valaciclovir (Zelitrex®) doit être donné par voie orale à la dose 3 g/jour en trois prises, ce qui permet d’obtenir des concentrations sériques d’aciclovir similaires à celles obtenues avec une prise orale de 4 g/jour d’aciclovir (Zovirax®). Cette bio-équivalence a été contrôlée à l’échelle clinique par une étude multricentrique, randomisée et contrôlée [83]. Outre une efficacité comparable des deux molécules, la compliance des patients sous valaciclovir était augmentée grâce à la réduction du nombre de prises quotidiennes [83]. Certaines études, réalisées dans d’autres localisations du zona que l’atteinte ophtalmique, ont même montré une meilleure efficacité du valaciclovir pour la réduction des douleurs post-zostériennes [80, 81]. Cependant, la pharmacocinétique optimisée du valaciclovir ne permet tout de même pas d’obtenir les mêmes concentrations sériques d’aciclovir que lorsque ce dernier est directement administré en intraveineux : au mieux, la posologie de 3 g/jour de valaciclovir équivaut à une perfusion de 5 mg/kg d’aciclovir toutes les 8 h [84], c’est-à-dire 2 fois moins que les doses habituellement requises pour la prise en charge du zona chez les patients immunodéprimés.
Le famciclovir (Oravir®) doit être donné par voie orale à la dose de 1,5 g/jour en trois prises, posologie de l’AMM dont l’efficacité a été montrée comme au moins équivalente à celle de l’aciclovir oral à 4 g/jour en cinq prises [85]. Cependant, l’excellente biodisponibilité de cette molécule pourrait permettre des schémas thérapeutiques encore plus simples, puisque des posologies de 1 000 mg en deux prises quotidiennes, voire même 750 mg en une seule prise par jour, sont comparables à une prescription d’aciclovir aux doses habituelles [86].
La pharmacopée destinée au zona ne se limite pas aux trois molécules disponibles actuellement en France. Pour mémoire, la soruvidine a été un temps utilisée au Japon mais son développement industriel a été stoppé en raison d’effets indésirables et d’interactions médicamenteuses majeures [87, 88]. La brivudine est disponible dans certains pays européens, où elle joue même un rôle de premier plan dans le traitement du zona. Son avantage est de permettre une efficacité clinique comparable aux autres molécules, malgré une posologie réduite à 250 mg/jour en une seule prise [89, 90].
Elle est bien entendu essentielle pour le confort du patient. Le traitement de première ligne est finalement représenté par les antiviraux, car les douleurs sont intimement liées à l’inflammation des terminaisons et troncs nerveux dans les territoires infectés. Cependant, les antalgiques stricto sensu sont nécessaires et la collaboration avec un médecin généraliste, un interniste ou, mieux encore, un médecin spécialiste de la douleur est nécessaire pour optimiser l’effet de ces traitements [81, 91].
Les antalgiques topiques ont l’avantage de leur simplicité et de leur sécurité, d’autant que le zona touche souvent des sujets fragiles. Il s’agit essentiellement de produits à base de lidocaïne ou de capsaïcine, dont l’application est efficace pour soulager les paresthésies superficielles, notamment les démangeaisons récurrentes et les sensations de brûlures [81]. On peut rapprocher de ces traitements médicamenteux les techniques de contre-stimulation, qui visent à réduire l’intensité du message douloureux par la stimulation douce des territoires cutanés douloureux. Des injections locales d’opiacés peuvent être utiles pour réaliser un bloc sensitif à la phase aiguë dans certaines formes hyperalgiques ou dans les neuropathies post-zostériennes rebelles [81]. Il s’agit cependant d’une éventualité exceptionnelle dans les zonas ophtalmiques.
Les antalgiques systémiques sont indispensables dès que les mesures topiques sont insuffisantes. À la phase aiguë, les antalgiques de niveau II sont utilisés en première intention, mais les formes hyperalgiques peuvent requérir des opiacés. Dans cette indication, les corticoïdes oraux peuvent aussi trouver leur place. Dans les neuropathies post-zostériennes, les deux principales classes médicamenteuses sont les anti-épileptiques (surtout indiqués dans les allodynies) et les antidépresseurs tricycliques (surtout efficaces dans les douleurs fulgurantes ou chroniques et lancinantes) [81].
Les corticoïdes ont quelques indications indiscutables dans le cadre du zona ophtalmique, mais la règle essentielle est qu’ils ne doivent pas être utilisés hors couverture antivirale efficace.
L’indication la plus fréquente est la présence d’une inflammation oculaire au moment du zona ou dans les semaines qui suivent, par exemple sous forme d’une sclérite, d’une kératite stromale non nécrosante ou d’une uvéite. Le mode d’utilisation des corticoïdes dans ces situations a été décrit dans le paragraphe précédent.
Les autres indications reconnues sont :
Le risque de zona ophtalmique est de nos jours estimé entre 1 et 4 % pour une vie d’homme, mais il progressera encore probablement à l’avenir en raison de l’augmentation de l’espérance de vie. Compte tenu des conséquences majeures du zona sur la qualité de vie et de son impact financier sur le système de soins et sur la société de façon plus globale, il devient de plus en plus nécessaire de développer des stratégies préventives.
Puisque les antiviraux actuels ne peuvent agir sur le virus persistant à l’état latent dans les neurones, la seule arme préventive réellement efficace à l’heure actuelle est la stratégie vaccinale. Elle peut être réalisée en deux temps : lutte contre la varicelle pendant l’enfance (dans le but de réduire le risque ultérieur de réactivation virale et donc de zona), puis lutte contre le zona proprement dit.
Le vaccin contre la varicelle, approuvé aux États-Unis en 1995 et rapidement utilisé à grande échelle chez les enfants nord-américains, a permis en moins de 10 ans de réduire d’un facteur 4 les hospitalisations et le coût global de la varicelle [94]. Ce vaccin a aussi été approuvé en France en 2003, mais son utilisation est très faible dans notre pays. Comme tous les vaccins, l’efficacité peut être incomplète et une varicelle peut aussi survenir malgré une vaccination antérieure. L’éruption cutanée peut aussi traduire une varicelle dite vaccinale, car il s’agit d’un vaccin vivant, basé sur la souche OKA de VZV, qui est certes atténuée mais non totalement dénuée de pathogénie. Les varicelles survenant malgré (ou à la suite de) la vaccination sont toutefois beaucoup moins sévères que les varicelles habituelles, avec une éruption moins franche et moins invalidante [95, 96]. Cet événement est observé chez 3 % des enfants et 30 % des adultes vaccinés. Dans quelques cas, le vaccin contre la varicelle peut aussi entraîner des complications inflammatoires oculaires apparemment isolées [97–99].
Le vaccin contre le zona a été développé dans la foulée de la mise au point du vaccin contre la varicelle, à l’intention des patients non encore touchés par les zonas mais susceptibles de le développer (en pratique, toute la population de plus de 50 ans, par définition). Ce vaccin est déjà approuvé aux États-Unis et en cours de procédure d’autorisation en Europe. Il utilise aussi la souche OKA, mais 14 fois plus concentrée que dans le vaccin contre la varicelle, car le stimulus immunitaire doit être important chez les patients âgés pour obtenir une couverture vaccinale. Un essai clinique portant sur près de 38 000 volontaires de plus de 60 ans a montré une réduction de moitié de la survenue de zona. Chez les patients qui développent malgré tout une éruption zostérienne, le risque de douleurs post-zostériennes est lui-même réduit d’un facteur 2 à 3 (voire 4 chez les patients de plus de 70 ans). La combinaison de ces données amène à une réduction d’un facteur 6 à 8 de la fréquence des douleurs post-zostériennes chez les patients vaccinés, par rapport au groupe non vacciné [100, 101].
Sur la base de cette étude, le vaccin contre le zona a été enregistré par les autorités de santé nord-américaine pour les patients de 60 ans, mais cette indication devrait pourtant être logiquement étendue aux patients de plus de 50 ans. En effet, dans un pays où le vaccin contre la varicelle est presque systématique depuis le milieu des années 1990, la stimulation antigénique par le VZV des sujets actuellement trentenaires et quarantenaires est largement inférieure à ce qu’elle devrait être, car les enfants et leurs proches ne présentent plus de varicelle. Or, on sait que le risque de zona est inversement proportionnel au nombre de contacts avec un enfant en période de varicelle (même asymptomatique) [96, 102]. Pour cette raison, les épidémiologistes anticipent une augmentation de l’incidence du zona chez les adultes cinquantenaires non vaccinés contre la varicelle et non encore vaccinés contre le zona [103]. Les dix ou quinze années qui viennent nous diront si ces prévisions épidémiologiques sont vérifiées. En attendant, elles permettent de mieux appréhender les conséquences paradoxales de certaines décisions, et même de certains progrès, dans le domaine de la santé publique.
[1] Uchio E, Ishiko H, Aoki K, Ohno S. Adenovirus detected by polymerase chain reaction in multidose eyedrop bottles used by patients with adenoviral keratoconjunctivitis. Am J Ophthalmol 2002 ; 134 : 618-9.
[2] Ventura LM, Dix RD. Viability of herpes simplex virus type 1 on the applanation tonometer. Am J Ophthalmol 1987 ; 103 : 48-52.
[3] Dart JK, El-Amir AN, Maddison T, et al. Identification and control of nosocomial adenovirus keratoconjunctivitis in an ophthalmic department. Br J Ophthalmol 2009 ; 93 : 18-20.
[4] Afssaps. Collyres et autres antibiotiques dans les infections oculaires superficielles. Recommandations de l’Afssaps ; 2004.
[5] Kaufman HE. Treatment of viral diseases of the cornea and external eye. Prog Retin Eye Res 2000 ; 19 : 69-85.
[6] Romanowski EG, Yates KA, Gordon YJ. Topical corticosteroids of limited potency promote adenovirus replication in the Ad5/NZW rabbit ocular model. Cornea 2002 ; 21 : 289-91.
[7] Gordon YJ, Araullo-Cruz T, Romanowski EG. The effects of topical nonsteroidal anti-inflammatory drugs on adenoviral replication. Arch Ophthalmol 1998 ; 116 : 900-5.
[8] Levinger E, Slomovic A, Sansanayudh W, et al. Topical treatment with 1 % cyclosporine for subepithelial infiltrates secondary to adenoviral keratoconjunctivitis. Cornea 2010 ; 29 : 638-40.
[9] Jeng BH, Holsclaw DS. Cyclosporine A 1 % eye drops for the treatment of subepithelial infiltrates after adenoviral keratoconjunctivitis. Cornea 2011 ; 30 : 958-61.
[10] Okumus S, Coskun E, Tatar MG, et al. Cyclosporine a 0.05 % eye drops for the treatment of subepithelial infiltrates after epidemic keratoconjunctivitis. BMC Ophthalmol 2012 ; 12 : 42.
[11] Romanowski EG, Pless P, Yates KA, Gordon YJ. Topical cyclosporine a inhibits subepithelial immune infiltrates but also promotes viral shedding in experimental adenovirus models. Cornea 2005 ; 24 : 86-91.
[12] Labetoulle M, Rousseau A, Bourcier T. Atteintes herpétiques du segment antérieur de l’œil : aspects thérapeutiques. Enclyc Med Chir (Elsevier, Paris). Ophtalmologie. 2014. In press.
[13] Alvarenga L, Scarpi M, Mannis MJ. Viral conjunctivitis. In : Krachmer JH, Mannis MJ, Holland EJ. Eds. Cornea-Fundamentals, diagnosis and management. Mosby-Elsevier ; 2011 ; v. 1.
[14] Ward JB, Siojo LG, Waller SG. A prospective, masked clinical trial of trifluridine, dexamethasone, and artificial tears in the treatment of epidemic keratoconjunctivitis. Cornea 1993 ; 12 : 216-21.
[15] Gordon YJ. The evolution of antiviral therapy for external ocular viral infections over twenty-five years. Cornea 2000 ; 19 : 673-80.
[16] Romanowski EG, Gordon YJ. Efficacy of topical cidofovir on multiple adenoviral serotypes in the New Zealand rabbit ocular model. Invest Ophthalmol Vis Sci 2000 ; 41 : 460-3.
[17] Kaneko H, Mori S, Suzuki O, et al. The cotton rat model for adenovirus ocular infection : antiviral activity of cidofovir. Antiviral Res 2004 ; 61 : 63-6.
[18] Hillenkamp J, Reinhard T, Ross RS, et al. The effects of cidofovir 1 % with and without cyclosporin a 1 % as a topical treatment of acute adenoviral keratoconjunctivitis : a controlled clinical pilot study. Ophthalmology 2002 ; 109 : 845-50.
[19] Hillenkamp J, Reinhard T, Ross RS, et al. Topical treatment of acute adenoviral keratoconjunctivitis with 0.2 % cidofovir and 1 % cyclosporine : a controlled clinical pilot study. Arch Ophthalmol 2001 ; 119 : 1487-91.
[20] Gordon YJ, Naesens L, Declercq E, et al. Treatment of adenoviral conjunctivitis with topical cidofovir. Cornea 1996 ; 15 : 546.
[21] Lenaerts L, Naesens L. Antiviral therapy for adenovirus infections. Antiviral Res 2006 ; 71 : 172-80.
[22] Trousdale MD, Goldschmidt PL, Nobrega R. Activity of ganciclovir against human adenovirus type-5 infection in cell culture and cotton rat eyes. Cornea 1994 ; 13 : 435-9.
[23] Yabiku ST, Yabiku MM, Bottos KM, et al. Ganciclovir 0.15 % ophthalmic gel in the treatment of adenovirus keratoconjunctivitis. Arq Bras Oftalmol 2011 ; 74 : 417-21.
[24] D’Cruz OJ, Uckun FM. Stampidine : a selective oculo-genital microbicide. J Antimicrob Chemother 2005 ; 56 : 10-9.
[25] Romanowski EG, Yates KA, Gordon YJ. The in vitro and in vivo evaluation of ddC as a topical antiviral for ocular adenovirus infections. Invest Ophthalmol Vis Sci 2009 ; 50 : 5295-9.
[26] Hartley C, Hartley M, Pardoe I, Knight A. Ionic Contra-Viral Therapy (ICVT) ; a new approach to the treatment of DNA virus infections. Arch Virol 2006 ; 151 : 2495-501.
[27] Nwanegbo EC, Romanowski EG, Gordon YJ, Gambotto A. Efficacy of topical immunoglobulins against experimental adenoviral ocular infection. Invest Ophthalmol Vis Sci 2007 ; 48 : 4171-6.
[28] Cermelli C, Cuoghi A, Scuri M, et al. In vitro evaluation of antiviral and virucidal activity of a high molecular weight hyaluronic acid. Virol J 2011 ; 8 : 141.
[29] Romanowski EG, Yates KA, Teuchner B, et al. N-chlorotaurine is an effective antiviral agent against adenovirus in vitro and in the Ad5/NZW rabbit ocular model. Invest Ophthalmol Vis Sci 2006 ; 47 : 2021-6.
[30] Nagl M, Teuchner B, Pottinger E, Ulmer H, Gottardi W. Tolerance of N-chlorotaurine, a new antimicrobial agent, in infectious conjunctivitis - a phase II pilot study. Ophthalmologica 2000 ; 214 : 111-4.
[31] Teuchner B, Nagl M, Schidlbauer A, et al. Tolerability and efficacy of N-chlorotaurine in epidemic keratoconjunctivitis-a double-blind, randomized, phase-2 clinical trial. J Ocul Pharmacol Ther 2005 ; 21 : 157-65.
[32] Wutzler P, Sauerbrei A, Klocking R, Brogmann B, Reimer K. Virucidal activity and cytotoxicity of the liposomal formulation of povidone-iodine. Antiviral Res 2002 ; 54 : 89-97.
[33] Monnerat N, Bossart W, Thiel MA. Povidone-iodine for treatment of adenoviral conjunctivitis : an in vitro study. Klin Monbl Augenheilkd 2006 ; 223 : 349-52.
[34] Clement C, Capriotti JA, Kumar M, et al. Clinical and antiviral efficacy of an ophthalmic formulation of dexamethasone povidone-iodine in a rabbit model of adenoviral keratoconjunctivitis. Invest Ophthalmol Vis Sci 2011 ; 52 : 339-44.
[35] Merisier H, Cochereau I, Hoang-Xuan T, Toublanc M, Ruggeri C. Multiple molluscum contagiosum lesions of the limbus in a patient with HIV infection. Br J Ophthalmol 1995 ; 79 : 393-4.
[36] Al-Mutairi N, Al-Doukhi A, Al-Farag S, Al-Haddad A. Comparative study on the efficacy, safety, and acceptability of imiquimod 5 % cream versus cryotherapy for molluscum contagiosum in children. Pediatr Dermatol 2010 ; 27 : 388-94.
[37] Wilhelmus KR. Antiviral treatment and other therapeutic interventions for herpes simplex virus epithelial keratitis. Cochrane Database Syst Rev 2010 ; (12) : CD002898.
[38] Schwartz GS, Holland EJ. Oral acyclovir for the management of herpes simplex virus keratitis in children. Ophthalmology 2000 ; 107 : 278-82.
[39] Hsiao CH, Yeung L, Yeh LK, et al. Pediatric herpes simplex virus keratitis. Cornea 2009 ; 28 : 249-53.
[40] Liu S, Pavan-Langston D, Colby KA. Pediatric herpes simplex of the anterior segment : characteristics, treatment, and outcomes. Ophthalmology 2012 ; 119 : 2003-8.
[41] Revere K, Davidson SL. Update on management of herpes keratitis in children. Curr Opin Ophthalmol 2013 ; 24 : 343-7.
[42] Colin J. Pathologies de la cornée et de la conjonctive. Atteintes herpétiques. Zona ophtalmique. In : Offret H. Ed. Œil et virus. Paris : Masson ; 2000.
[43] Labetoulle M, Offret H, Colin J. Traitement des kératites herpétiques (formes métaherpétiques exclues). In : Labetoulle M. Ed. L’herpès et le zona oculaire en pratique : clinique, thérapeutique et prévention. Paris : Med’Com Editions ; 2009.
[44] Heiligenhaus A, Bauer D, Meller D, et al. Improvement of HSV-1 necrotizing keratitis with amniotic membrane transplantation. Invest Ophthalmol Vis Sci 2001 ; 42 : 1969-74.
[45] Shi W, Chen M, Xie L. Amniotic membrane transplantation combined with antiviral and steroid therapy for herpes necrotizing stromal keratitis. Ophthalmology 2007 ; 114 : 1476-81.
[46] Porter SM, Patterson A, Kho P. A comparison of local and systemic acyclovir in the management of herpetic disciform keratitis. Br J Ophthalmol 1990 ; 74 : 283-5.
[47] Wilhelmus KR, Gee L, Hauck WW, et al. Herpetic eye disease study. A controlled trial of topical corticosteroids for herpes simplex stromal keratitis. Ophthalmology 1994 ; 101 : 1883-95 ; discussion 95.
[48] Heiligenhaus A, Steuhl KP. Treatment of HSV-1 stromal keratitis with topical cyclosporin A : a pilot study. Graefes Arch Clin Exp Ophthalmol 1999 ; 237 : 435-8.
[49] Rao SN. Treatment of herpes simplex virus stromal keratitis unresponsive to topical prednisolone 1 % with topical cyclosporine 0.05 %. Am J Ophthalmol 2006 ; 141 : 771-2.
[50] Donnenfeld E, Pflugfelder SC. Topical ophthalmic cyclosporine : pharmacology and clinical uses. Surv Ophthalmol 2009 ; 54 : 321-38.
[51] The Herpetic Eye Disease Study Group. Acyclovir for the prevention of recurrent herpes simplex virus eye disease. N Engl J Med 1998 ; 339 : 300-6.
[52] The Herpetic Eye Disease Study Group. Oral acyclovir for herpes simplex virus eye disease : effect on prevention of epithelial keratitis and stromal keratitis. Arch Ophthalmol 2000 ; 118 : 1030-6.
[53] Colin J, Robinet A, Malet F. Traitement préventif des kératites herpétiques par l’aciclovir en comprimés. J Fr Ophtalmol 1993 ; 16 : 6-9.
[54] Simon AL, Pavan-Langston D. Long-term oral acyclovir therapy. Effect on recurrent infectious herpes simplex keratitis in patients with and without grafts. Ophthalmology 1996 ; 103 : 1399-404 ; discussion 404.
[55] Langston DP. Oral acyclovir suppresses recurrent epithelial and stromal herpes simplex. Arch Ophthalmol 1999 ; 117 : 391-2.
[56] Rodriguez A, Power WJ, Neves RA, Foster CS. Recurrence rate of herpetic uveitis in patients on long-term oral acyclovir. Doc Ophthalmol 1995 ; 90 : 331-40.
[57] Young RC, Hodge DO, Liesegang TJ, Baratz KH. Incidence, recurrence, and outcomes of herpes simplex virus eye disease in Olmsted County, Minnesota, 1976-2007 : the effect of oral antiviral prophylaxis. Arch Ophthalmol 2010 ; 128 : 1178-83.
[58] Uchoa UB, Rezende RA, Carrasco MA, et al. Long-term acyclovir use to prevent recurrent ocular herpes simplex virus infection. Arch Ophthalmol 2003 ; 121 : 1702-4.
[59] Wu X, Chen X. Acyclovir for the treatment and prevention of recurrent infectious herpes simplex keratitis. Chin Med J 2002 ; 115 : 1569-72.
[60] Danve-Szatanek C, Aymard M, Thouvenot D, et al. Surveillance network for herpes simplex virus resistance to antiviral drugs : 3-year follow-up. J Clin Microbiol 2004 ; 42 : 242-9.
[61] Labetoulle M, De Monchy I, Offret H. Épidémiologie de la maladie herpétique oculaire. In : Labetoulle M. Ed. L’herpès et le zona oculaire en pratique : clinique, thérapeutique et prévention. Paris : Med’Com Editions ; 2009.
[62] Labetoulle M, Colin J. Kératites à HSV. In : Bourcier T, Bodaghi B, Bron A. Eds. Les infections oculaires. Paris : Lamy Éditions ; 2010.
[63] Blower SM, Porco TC, Darby G. Predicting and preventing the emergence of antiviral drug resistance in HSV-2. Nat Med 1998 ; 4 : 673-8.
[64] Lipsitch M, Bacon TH, Leary JJ, et al. Effects of antiviral usage on transmission dynamics of herpes simplex virus type 1 and on antiviral resistance : predictions of mathematical models. Antimicrob Agents Chemother 2000 ; 44 : 2824-35.
[65] Pan D, Kaye SB, Hopkins M, et al. Common and new acyclovir resistant herpes simplex virus-1 mutants causing bilateral recurrent herpetic keratitis in an immunocompetent patient. J Infect Dis 2014 ; 204 : 345-9.
[66] Inoue T, Kawashima R, Suzuki T, Ohashi Y. Real-time polymerase chain reaction for diagnosing acyclovir-resistant herpetic keratitis based on changes in viral DNA copy number before and after treatment. Arch Ophthalmol 2012 ; 130 : 1462-4.
[67] Van Velzen M, Van De Vijver Da, Van Loenen FB, et al. Acyclovir Prophylaxis Predisposes to Antiviral-Resistant Recurrent Herpetic Keratitis. J Infect Dis 2013 ; 208 : 1359-65.
[68] Harding SP, Rigal D, Sharma MS, et al. Superior intraocular penetration of aciclovir after valaciclovir in comparison with oral aciclovir. 38th Interdisciplinary Conference on Antimicrobial Chemotherapy ; 1998 Oct ; San Diego, USA.
[69] Labetoulle M, Colin J. Aspects actuels du traitement des kératites herpétiques. J Fr Ophtalmol 2012 ; 35 : 292-307.
[70] Borruat FX, Buechi ER, Piguet B, et al. Prevention of ocular complications of herpes zoster ophthalmicus by adequate treatment with acyclovir. Klin Monatsbl Augenheilkd 1991 ; 198 : 358-60.
[71] Severson EA, Baratz KH, Hodge DO, Burke JP. Herpes zoster ophthalmicus in olmsted county, Minnesota : have systemic antivirals made a difference ? Arch Ophthalmol 2003 ; 121 : 386-90.
[72] Collum LM, Akhtar J, Mcgettrick P. Oral acyclovir in herpetic keratitis. Trans Ophthalmol Soc 1985 ; 104 : 629-32.
[73] McKendrick MW, McGill JI, White JE, Wood MJ. Oral acyclovir in acute herpes zoster. Br Med J 1986 ; 293 : 1529-32.
[74] McKendrick MW, Care C, Burke C, et al. Oral acyclovir in herpes zoster. J Antimicrob Chemother 1984 ; 14 : 661-5.
[75] Batisse D, Eliaszewicz M, Zazoun L, et al. Acute retinal necrosis in the course of AIDS : study of 26 cases. AIDS 1996 ; 10 : 55-60.
[76] Cobo LM, Foulks GN, Liesegang T, et al. Oral acyclovir in the treatment of acute herpes zoster ophthalmicus. Ophthalmology 1986 ; 93 : 763-70.
[77] Harding SP, Porter SM. Oral acyclovir in herpes zoster ophthalmicus. Curr Eye Res 1991 ; 10 Suppl : 177-82.
[78] Cobo LM, Foulks GN, Liesegang T, et al. Oral acyclovir in the therapy of acute herpes zoster ophthalmicus. An interim report. Ophthalmology 1985 ; 92 : 1574-83.
[79] Hoang-Xuan T, Buchi ER, Herbort CP, et al. Oral acyclovir for herpes zoster ophthalmicus. Ophthalmology 1992 ; 99 : 1062-70.
[80] Beutner KR, Friedman DJ, Forszpaniak C, et al. Valaciclovir compared with acyclovir for improved therapy for herpes zoster in immunocompetent adults. Antimicrob Agents Chemother 1995 ; 39 : 1546-53.
[81] Pavan-Langston D. Herpes zoster antivirals and pain management. Ophthalmology 2008 ; 115 : S13-S20.
[82] Liesegang TJ. Herpes zoster virus infection. Curr Opin Ophthalmol 2004 ; 15 : 531-6.
[83] Colin J, Prisant O, Cochener B, et al. Comparison of the efficacy and safety of valaciclovir and acyclovir for the treatment of herpes zoster ophthalmicus. Ophthalmology 2000 ; 107 : 1507-11.
[84] Ormrod D, Goa K. Valaciclovir : a review of its use in the management of herpes zoster. Drugs 2000 ; 59 : 1317-40.
[85] Tyring S, Engst R, Corriveau C, et al. Famciclovir for ophthalmic zoster : a randomised aciclovir controlled study. Br J Ophthalmol 2001 ; 85 : 576-81.
[86] Shafran SD, Tyring SK, Ashton R, et al. Once, twice, or three times daily famciclovir compared with aciclovir for the oral treatment of herpes zoster in immunocompetent adults : a randomized, multicenter, double-blind clinical trial. J Clin Virol 2004 ; 29 : 248-53.
[87] Gnann JW Jr, Crumpacker CS, Lalezari JP, et al. Sorivudine versus acyclovir for treatment of dermatomal herpes zoster in human immunodeficiency virus-infected patients : results from a randomized, controlled clinical trial. Collaborative Antiviral Study Group/AIDS Clinical Trials Group, Herpes Zoster Study Group. Antimicrob Agents Chemother 1998 ; 42 : 1139-45.
[88] Gnann JW Jr, Whitley RJ. Clinical practice. Herpes zoster. N Engl J Med 2002 ; 347 : 340-6.
[89] Wutzler P, De Clercq E, Wutke K, Farber I. Oral brivudin vs. intravenous acyclovir in the treatment of herpes zoster in immunocompromised patients : a randomized double-blind trial. J Med Virol 1995 ; 46 : 252-7.
[90] Gross G, Schofer H, Wassilew S, et al. Herpes zoster guideline of the German Dermatology Society (DDG). J Clin Virol 2003 ; 26 : 277-89.
[91] Nikkels AF, Pierard GE. Oral antivirals revisited in the treatment of herpes zoster : what do they accomplish ? Am J Clin Dermatol 2002 ; 3 : 591-8.
[92] Whitley RJ, Weiss H, Gnann JW Jr, et al. Acyclovir with and without prednisone for the treatment of herpes zoster. A randomized, placebo-controlled trial. The National Institute of Allergy and Infectious Diseases Collaborative Antiviral Study Group. Ann Intern Med 1996 ; 125 : 376-83.
[93] Wood MJ, Johnson RW, Mckendrick MW, et al. A randomized trial of acyclovir for 7 days or 21 days with and without prednisolone for treatment of acute herpes zoster. N Engl J Med 1994 ; 330 : 896-900.
[94] Liesegang TJ. Herpes zoster ophthalmicus natural history, risk factors, clinical presentation, and morbidity. Ophthalmology 2008 ; 115 : S3-12.
[95] Vazquez M, Shapiro ED. Varicella vaccine and infection with varicella-zoster virus. N Engl J Med 2005 ; 352 : 439-40.
[96] Vazquez M, Larussa PS, Gershon AA, et al. Effectiveness over time of varicella vaccine. JAMA 2004 ; 291 : 851-5.
[97] Nagpal A, Vora R, Margolis TP, Acharya NR. Interstitial keratitis following varicella vaccination. Arch Ophthalmol 2009 ; 127 : 222-3.
[98] Khalifa YM, Jacoby RM, Margolis TP. Exacerbation of zoster interstitial keratitis after zoster vaccination in an adult. Arch Ophthalmol 2010 ; 128 : 1079-80.
[99] Gonzales JA, Levison AL, Stewart JM, et al. Retinal necrosis following varicella-zoster vaccination. Arch Ophthalmol 2012 ; 130 : 1355-6.
[100] Oxman MN, Levin MJ, Johnson GR, et al. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. N Engl J Med 2005 ; 352 : 2271-84.
[101] Gelb LD. Preventing herpes zoster through vaccination. Ophthalmology 2008 ; 115 : S35-S8.
[102] Solomon BA, Kaporis AG, Glass AT, Simon SI, Baldwin HE. Lasting immunity to varicella in doctors study (L.I.V.I.D. study). J Am Acad Dermatol 1998 ; 38 : 763-5.
[103] Goldman GS. Cost-benefit analysis of universal varicella vaccination in the U.S. taking into account the closely related herpes-zoster epidemiology. Vaccine 2005 ; 23 : 3349-55.
[104] Tambasco FP, Cohen EJ, Nguyen LH, et al. Oral acyclovir after penetrating keratoplasty for herpes simplex keratitis. Arch Ophthalmol 1999 ; 117 : 445-9.
[105] Vanrooij J, Rijneveld WJ, Remeijer L, et al. Effect of oral acyclovir after penetrating keratoplasty for herpetic keratitis : a placebo-controlled multicenter trial. Ophthalmology 2003 ; 110 : 1916-9.
[106] Jansen AF, Rijneveld WJ, Remeijer L, et al. Five-year follow-up on the effect of oral acyclovir after penetrating keratoplasty for herpetic keratitis. Cornea 2009 ; 28 : 843-5.
[107] Asbell PA. Valacyclovir for the prevention of recurrent herpes simplex virus eye disease after excimer laser photokeratectomy. Trans Am Ophthalmol Soc 2000 ; 98 : 285-303.
[108] De Rojas Silva V, Rodriguez-Conde R, Cobo-Soriano R, et al. Laser in situ keratomileusis in patients with a history of ocular herpes. J Cataract Refract Surg 2007 ; 33 : 1855-9.
[109] Dhaliwal DK, Romanowski EG, Yates KA, et al. Valacyclovir inhibition of recovery of ocular herpes simplex virus type 1 after experimental reactivation by laser in situ keratomileusis. J Cataract Refract Surg 2001 ; 27 : 1288-93.
[110] Jarade EF, Tabbara KF. Laser in situ keratomileusis in eyes with inactive herpetic keratitis. Am J Ophthalmol 2001 ; 132 : 779-80.
[111] Gomez GS, Pinero Bustamante AM, Gutierrez SE, Pinero BA. Herpes simplex keratitis following laser in situ keratomileusis. Arch Soc Esp Oftalmol 2004 ; 79 : 139-41.
[112] Levy J, Lapid-Gortzak R, Klemperer I, Lifshitz T. Herpes simplex virus keratitis after laser in situ keratomileusis. J Refract Surg 2005 ; 21 : 400-2.
[113] Perry HD, Doshi SJ, Donnenfeld ED, Levinson DH, Cameron CD. Herpes simplex reactivation following laser in situ keratomileusis and subsequent corneal perforation. CLAO J 2002 ; 28 : 69-71.
[114] Davidorf JM. Herpes simplex keratitis after LASIK. J Refract Surg 1998 ; 14 : 667.
[115] Patel NN, Teng CC, Sperber LT, Dodick JM. New-onset herpes simplex virus keratitis after cataract surgery. Cornea 2009 ; 28 : 108-10.
[116] Barequet IS, Wasserzug Y. Herpes simplex keratitis after cataract surgery. Cornea 2007 ; 26 : 615-7.
[117] Gaynor BD, Stamper RL, Cunningham ET Jr. Presumed activation of herpetic keratouveitis after Argon laser peripheral iridotomy. Am J Ophthalmol 2000 ; 130 : 665-7.
[118] Hou YC, Chen CC, Wang IJ, Hu FR. Recurrent herpetic keratouveitis following YAG laser peripheral iridotomy. Cornea 2004 ; 23 : 641-2.
[119] Reed SY, Shin DH, Birt CM, Rhee RK. Herpes simplex keratitis following argon laser trabeculoplasty. Ophthalmic Surg 1994 ; 25 : 640.
[120] The Herpetic Eye Disease Study G. Psychological stress and other potential triggers for recurrences of herpes simplex virus eye infections. Arch Ophthalmol 2000 ; 118 : 1617-25.
[121] Alm A, Grierson I, Shields MB. Side effects associated with prostaglandin analog therapy. Surv Ophthalmol 2008 ; 53 Suppl 1 : S93-105.
[122] Chang JH, McCluskey P, Missotten T, et al. Use of ocular hypotensive prostaglandin analogues in patients with uveitis : does their use increase anterior uveitis and cystoid macular oedema ? Br J Ophthalmol 2008 ; 92 : 916-21.
[123] Sallam A, Sheth HG, Habot-Wilner Z, Lightman S. Outcome of raised intraocular pressure in uveitic eyes with and without a corticosteroid-induced hypertensive response. Am J Ophthalmol 2009 ; 148 : 207-13.
[124] Markomichelakis NN, Kostakou A, Halkiadakis I, et al. Efficacy and safety of latanoprost in eyes with uveitic glaucoma. Graefes Arch Clin Exp Ophthalmol 2009 ; 247 : 775-80.
[125] Shtein RM, Stahl RM, Saxe SJ, Mian SI. Herpes simplex keratitis after intravitreal triamcinolone acetonide. Cornea 2007 ; 26 : 641-2.
[126] Gulkilik G, Demirci G, Ozdamar Am, Muftuoglu GI. A case of herpetic keratitis after intravitreal triamcinolone injection. Cornea 2007 ; 26 : 1000-1.
[127] Hashizume K, Nabeshima T, Fujiwara T, et al. A case of herpetic epithelial keratitis after triamcinolone acetonide subtenon injection. Cornea 2009 ; 28 : 463-4.