Stratégies thérapeutiques dans la sécheresse oculaire
C. Baudouin, A. Rousseau, R. Tahiri Joutei Hassani, M. Labetoulle
Le traitement de la sécheresse oculaire est complexe, difficile à mener en raison de la multitude de mécanismes et de la fiabilité faible des critères diagnostiques, ainsi que de la discordance fréquente entre signes et symptômes.
Les traitements substitutifs lacrymaux sont la base du traitement mais leur nombre rend compte de leurs insuffisances, même avec le développement de formulations sans conservateur et de plus en plus sophistiquées.
Le traitement doit avant tout reposer sur une analyse fine des mécanismes sous-tendant la sécheresse oculaire.
Des algorithmes thérapeutiques basés sur la sévérité ou sur l’analyse des signes peuvent être proposés et aider à mieux appréhender cette maladie difficile et multifactorielle.
Traiter une sécheresse oculaire est toujours difficile, souvent frustrant, tant les mécanismes sous-jacents à la sécheresse sont complexes et les moyens thérapeutiques multiples. Même les objectifs sont ambigus : faut-il simplement chercher une thérapeutique symptomatique ou traiter la surface oculaire ? Doit-on se borner à réduire les douleurs ou peut-on ambitionner de guérir les patients ? Si la sécheresse oculaire se limitait à un simple manque d’eau à la surface de l’œil, il serait simple de la traiter et de soulager les patients par de banales larmes artificielles. Tous les ophtalmologistes savent en revanche à quel point il est difficile de soigner et de soulager réellement ces patients, encore plus de les débarrasser définitivement de la maladie, et combien les thérapeutiques sont souvent décevantes. Le schéma physiopathologique qui introduit la notion de cercle vicieux auto-entretenu dans la sécheresse oculaire [1, 2] et explique comment les patients peuvent enclencher ce cycle (fig. 21-1) offre différentes pistes thérapeutiques, en décrivant des phénomènes biologiques spécifiques dont certains sont déjà accessibles à des thérapeutiques et d’autres le seront dans un futur proche, de manière à bloquer les mécanismes de gravité de la maladie (fig. 21-2).
Pour mieux poser les indications thérapeutiques dans la sécheresse oculaire, il est classique de suivre un arbre décisionnel basé sur la sévérité : petit traitement pour petite sécheresse, traitement lourd pour sécheresse sévère. Ce schéma est cependant très réducteur même s’il est logique et bute d’emblée sur une des grandes difficultés dans l’analyse de la sécheresse, la définition même de la sévérité : les yeux les plus abîmés ne sont pas forcément les plus symptomatiques, et les patients se plaignant le plus n’ont pas toujours des signes cliniques objectifs expliquant leur plainte. Une autre approche thérapeutique peut se baser sur l’analyse conjointe des symptômes et des signes cliniques objectifs usuels (coloration à la fluorescéine), elle peut constituer une orientation utile et pratique à la fois pour le diagnostic et pour guider le traitement. Nous aborderons tour à tour ces deux approches.

Fig. 21-1 Schéma physiopathologique du cercle vicieux de la sécheresse oculaire adapté de Baudouin [2].
DGM : dysfonction des glandes de Meibomius ; MMP : métalloprotéinase matricielle.

Fig. 21-2 Proposition de thérapies, à partir du schéma de la figure 21-1, agissant sur différents points du cercle vicieux.
DGM : dysfonction des glandes de Meibomius ; MMP : métalloprotéinase matricielle.
En raison de sa diversité étiologique et physiopathologique, et du manque de corrélation systématique entre les symptômes d’irritation oculaire et les tests cliniques, l’évaluation de la sévérité d’une sécheresse oculaire peut s’avérer problématique [3]. Ces difficultés peuvent influer sur la prise de décisions thérapeutiques, compliquer l’évaluation de la progression de la maladie et compromettent souvent le succès des essais cliniques. Si chez la majorité des patients atteints de sécheresse oculaire, il existe une certaine concordance entre les symptômes et les signes cliniques, il a été rapporté que jusqu’à 40 % des patients avaient des discordances entre les symptômes et les signes cliniques et que la sévérité des symptômes n’était pas forcément corrélée à celles des dommages tissulaires [3, 4].
Plusieurs mécanismes physiologiques peuvent expliquer ces discordances. Au cours de la sécheresse oculaire précoce ou légère, on peut noter une hyperalgésie qui peut causer un inconfort oculaire important avec des lésions tissulaires minimes. À l’opposé, au cours d’une atteinte plus grave ou chronique, les nerfs cornéens peuvent être endommagés et entraîner une diminution de la sensibilité cornéenne, ce qui peut effectivement réduire l’inconfort ou en limiter l’intensité, alors même que les lésions cornéennes progressent. La discordance entre les signes et les symptômes peut aussi être due au manque de spécificité, de sensibilité et de reproductibilité des tests cliniques et biologiques utilisés pour l’évaluation de la sécheresse oculaire.
Une première classification de la sévérité de la sécheresse oculaire a été proposée par Behrens et al. en 2006 [5] puis reprise par le Dry Eye WorkShop (DEWS) en 2007 [6]. La gravité a été classée en quatre niveaux et a été basée sur l’augmentation de la fréquence et de l’intensité des divers signes et symptômes. Les critères retenus comprenaient les symptômes oculaires, les lésions de kératoconjonctivite sèche objectivées par un test colorimétrique, le test de Schirmer, le degré de dysfonction meibomienne et l’importance de la composante inflammatoire associée. Cette classification a rapidement été confrontée à l’absence de corrélation systématique entre les symptômes et les signes cliniques.
Ainsi, les patients ayant des symptômes très fréquents et sévères en l’absence de kératite se retrouvent aussi bien en stade 1 qu’en stade 4 (tableau 21-1). Par conséquent, la classification du DEWS peut ne pas être appropriée pour les patients dont les signes et les symptômes ne sont pas concordants.
Puisque l’évaluation de la sévérité de la sécheresse oculaire est un élément fondamental pour définir la stratégie thérapeutique [3, 5, 7], il est nécessaire d’utiliser un algorithme décisionnel précis qui permette de définir la sévérité de la sécheresse oculaire de façon claire et pratique en toutes circonstances et en particulier en cas de discordance entre les symptômes et les signes cliniques.
Dès lors, plusieurs interrogations s’imposent : quels sont les éléments qui devraient définir la sévérité la sécheresse oculaire ? Devrait-elle se baser sur les symptômes ? sur l’atteinte cornéenne ? sur le degré de baisse d’acuité visuelle ? sur la résistance aux traitements ? ou sur les biomarqueurs d’inflammation ou d’hyperosmolarité ? Comment définir la sévérité d’une sécheresse oculaire en cas de discordance entre les symptômes et les signes cliniques ?
Afin de répondre à ces interrogations, les experts du groupe de consensus européen ODISSEY ont établi un algorithme pour l’évaluation et le diagnostic de la sécheresse oculaire sévère [3].
Quatorze critères cliniques et biologiques couramment utilisés pour étudier la gravité du syndrome sec ont été évalués :
1. kératite (test à la fluorescéine) ;
2. hyperosmolarité ;
3. test de Schirmer ;
4. empreinte conjonctivale ;
5. kératite filamenteuse ;
6. coloration conjonctivale ;
7. atteinte visuelle ;
8. blépharite et dysfonctionnement meibomien ;
9. blépharospasme ;
10. tear break-up time (TBUT) ;
11. aberrométrie ;
12. microscopie confocale ;
13. marqueurs inflammatoires : HLA-DR, MMP-9, cytokines, protéomique ;
14. résistance aux traitements substitutifs.
Après un examen approfondi des connaissances actuelles ainsi qu’une analyse des résultats des questionnaires, le groupe de consensus européen ODISSEY a convenu que deux critères étaient capitaux pour définir une sécheresse oculaire sévère, à savoir un score OSDI (ocular surface disease index) supérieur ou égal à 33 (pour un maximum de 100) et un score d’Oxford supérieur ou égal à 3/5. Le groupe a défini un algorithme en deux étapes pour le diagnostic des sécheresses oculaires sévères (fig. 21-3) :
étape 1 : en cas de concordance entre les deux critères primaires (score OSDI ≥ 33 et score d’Oxford ≥ 3), le diagnostic de sécheresse oculaire sévère est d’emblée établi ;
étape 2 : en cas de discordance entre ces deux critères primaires, une évaluation plus approfondie en utilisant des critères complémentaires est recommandée.
Trois scénarios ont été identifiés :
scénario A : score OSDI < 33 et score d’Oxford ≥ 3. Dans ce cas, la symptomatologie est minime tandis que les lésions de la surface oculaire sont importantes ;
scénario B : score OSDI ≥ 33 et score d’Oxford = 2. Dans ce cas, la symptomatologie est sévère, mais les dégâts de la surface oculaire ne sont pas suffisamment concluants ;
scénario C : score OSDI ≥ 33 et score d’Oxford ≤ 1. Dans ce cas, la symptomatologie est sévère, mais les dégâts de la surface oculaire ne sont pas présents ou peu visibles.
Le groupe ODISSEY a déterminé pour chacun de ces trois scénarios des critères supplémentaires pour évaluer la gravité de la sécheresse oculaire. Ces critères cliniques et biologiques ont été divisés en deux groupes. Chaque critère a été étiqueté comme étant soit « déterminant » soit « contributif » pour le diagnostic de sécheresse oculaire sévère.
Tableau 21-1 Classification de la sévérité de la sécheresse oculaire* d’après Behrens et al. [5]
* Cette classification pose un problème pour classer les patients qui ont une discordance entre les symptômes et les signes cliniques. Par exemple, les patients ayant des symptômes très fréquents et sévères avec une absence de kératite se retrouvent aussi bien en stade 1 qu’en stade 4 (cercles rouges).
** Doit avoir les signes et les symptômes.
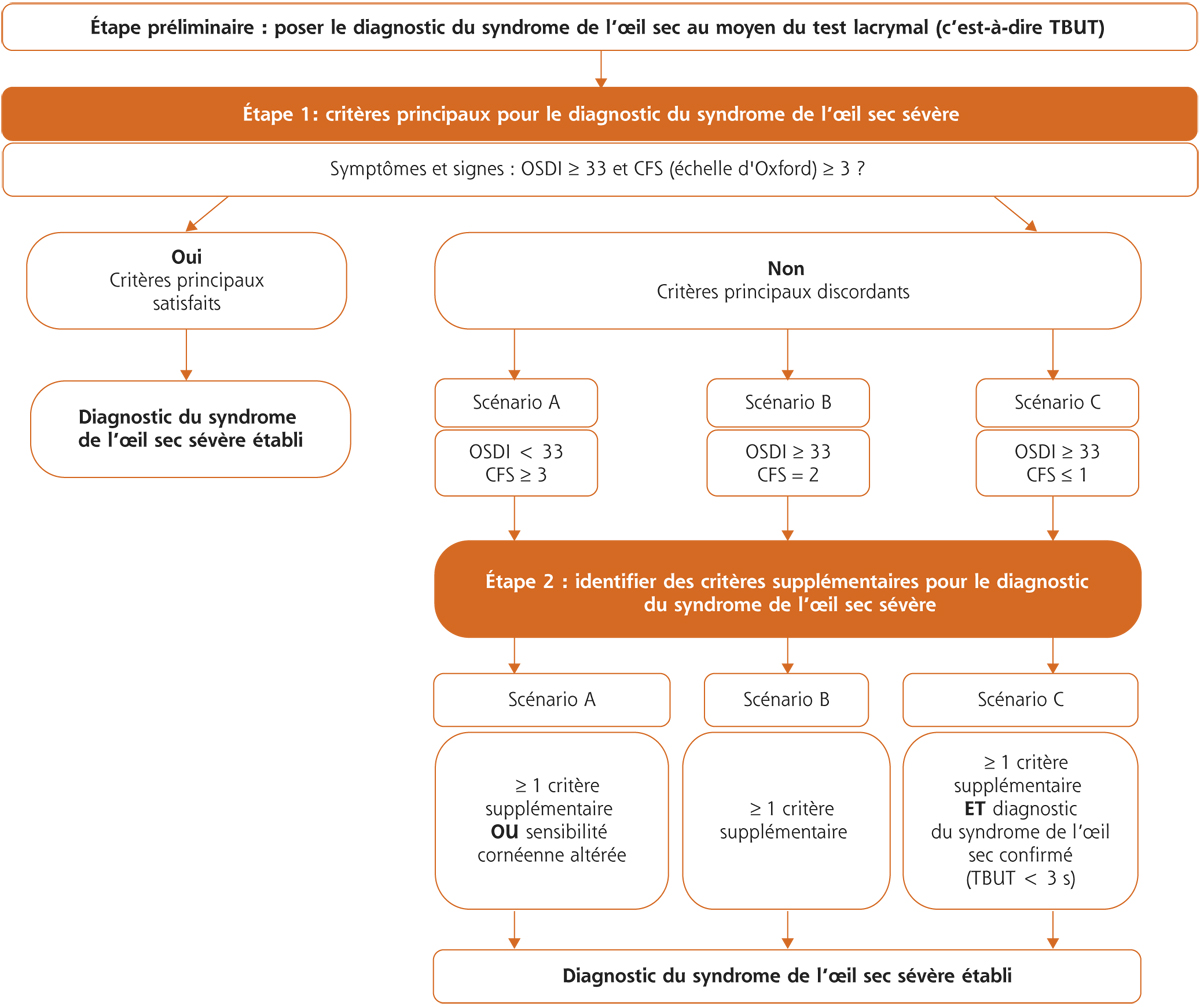
Fig. 21-3 Algorithme ODISSEY pour l’évaluation de la sévérité de la sécheresse oculaire (d’après [3]).
CFS : coloration cornéenne à la fluorescéine ; OSDI : ocular surface disease index ; TBUT : tear break-up time.
Huit des critères ont été classés comme déterminants pour le diagnostic de sécheresse oculaire sévère. Leurs valeurs seuils sont présentées dans le tableau 21-2. Quel que soit le scénario (A, B ou C), la présence d’un seul de ces critères cliniques, en plus d’un score OSDI supérieur ou égal à 33 ou d’un score d’Oxford supérieur ou égal à 3, permet d’établir le diagnostic de sécheresse oculaire sévère.
Tableau 21-2 Critères additionnels d’évaluation de la gravité de la sécheresse oculaire divisés en deux groupes : critères déterminants et critères contributifs.
Les critères contributifs sont énumérés dans le tableau 21-2. Ils comprennent l’aberrométrie, la microscopie confocale, les marqueurs inflammatoires et la résistance aux traitements standard. Bien qu’il ait été démontré que ces critères jouent un rôle potentiellement important dans le diagnostic et l’évaluation de la gravité de la sécheresse oculaire, ils ont été classés comme « contributifs » car leur validité n’est pas encore bien établie, et qu’ils ne sont pas encore systématiquement utilisés dans le contexte clinique. De même, il n’existe pas de méthodes normalisées pour l’évaluation de leurs résultats.
La sécheresse oculaire sévère a été définie dans chacun des trois scénarios de la manière suivante :
scénario A : le patient présente une altération importante de la surface oculaire, avec des symptômes peu importants. Dans ce cas, la présence d’un ou de plusieurs facteurs déterminants énumérés dans le tableau 21-2 est suffisante pour établir le diagnostic de sécheresse oculaire sévère. La baisse importante de la sensibilité cornéenne devrait également être considérée comme un signe déterminant supplémentaire expliquant la relative absence de symptômes. Cela signifie qu’en pratique, l’association d’une hypoesthésie cornéenne profonde à un score d’Oxford supérieur ou égal à 3 suffirait pour établir le diagnostic de sécheresse oculaire sévère ;
scénario B : dans ce cas les symptômes sont importants tandis que la coloration de la surface oculaire est modérée. Le Comité a établi que la présence de l’un des facteurs déterminants additionnels énumérés dans le tableau 21-2 est suffisante pour établir le diagnostic de sécheresse oculaire sévère. Cependant, l’algorithme pour le scénario B est différent du scénario A par le fait que de la sensibilité cornéenne n’est pas considérée comme un facteur déterminant, puisque le score OSDI supérieur ou égal à 33 confirme déjà que la sensibilité cornéenne est présente ;
scénario C : ce scénario requiert une attention particulière puisqu’il représente une discordance majeure entre des symptômes importants et une coloration minime de la surface oculaire. L’utilisation du test de TBUT dans ce scénario est donc une condition préalable afin d’évaluer l’instabilité du film lacrymal et confirmer le diagnostic initial de sécheresse oculaire. Il est probable que cette catégorie soit associée à des dysfonctionnements meibomiens responsables d’une instabilité majeure du film lacrymal. Dans ce cas, le scénario oriente directement vers une reconsidération diagnostique et physiopathologique.
L’algorithme ODISSEY est donc un outil pratique, simple et facile à utiliser, qui permet de surmonter le problème de la discordance signes–symptômes. Il est à espérer que l’utilisation de cet arbre décisionnel « sur mesure » permettra une évaluation et un traitement ciblés de la sécheresse oculaire sévère ainsi qu’une meilleure évaluation des résultats des essais cliniques.
La base logique des traitements de la sécheresse oculaire repose naturellement en priorité sur les substituts lacrymaux. Leur multitude, la complexité de leur composition, les associations désormais possibles, dans des formulations de plus en plus sophistiquées, traduisent à la fois les progrès réalisés et leurs insuffisances pour soigner efficacement les patients. Associer les moyens thérapeutiques est donc essentiel pour surmonter ces difficultés.
La sécheresse oculaire est une pathologie très sensible à l’environnement : le travail prolongé sur ordinateur, les efforts musculaires lors du travail sur écran et de la lecture, les environnements secs et climatisés, les problèmes de posture lors d’un travail prolongé sur ordinateur, sont autant de sources de fatigue visuelle et de sécheresse, les deux étant très souvent intriqués [8]. Le clignement est souvent diminué lors du travail sur écran, ce qui entretient la sécheresse dans un environnement déjà hostile. Le tabac, les pollutions intérieures ou extérieures contribuent également à aggraver la sécheresse. Tous ces facteurs peuvent être combattus grâce à l’information des patients et en jouant sur leur environnement. Des troubles oculomoteurs sont très fréquemment associés et doivent être recherchés, surtout lorsque les patients se plaignent de difficultés à la lecture, de maux de tête, de douleurs derrière les yeux ou en barre frontale. La dimension psychologique est enfin très importante à prendre en compte : de nombreux patients vivent dans l’angoisse de ne pas sortir de cette maladie et d’être menacés à terme d’une perte visuelle ; plus de 50 % des patients atteints de sécheresse oculaire avouent ainsi avoir peur de la cécité, 80 % se sentent rejetés, 10 à 15 % sont profondément dépressifs [9, 10].
Les patients utilisent souvent mal les substituts lacrymaux mis à leur disposition : ils vident la dosette entière, mettent trop de gel, laissant ainsi des dépôts désagréables (fig. 21-4), utilisent des produits conservés ou s’astreignent à des schémas rigides fixés par l’ophtalmologiste (telle goutte à telle heure, tant de fois par jour, etc.). Un gel visqueux et protecteur brouille un peu la vue ce qui pousse souvent l’ophtalmologiste à le prescrire le soir. Il est dommage de restreindre les produits les plus efficaces à des utilisations marginalisées ou mal adaptées à ce que ressentent les patients. Les gels peuvent être utilisés dans la journée, à des horaires variables en fonction de la symptomatologie. Il faut laisser libres les patients de les utiliser ou non, en leur expliquant le mode d’utilisation optimal.
La suppression du conservateur est fondamentale en cas de sécheresse oculaire et il faut aider ces patients à trouver l’horaire le plus convenable et les produits les plus adaptés à leurs symptômes. Il est souvent intéressant de proposer des produits de propriétés et de viscosités différentes et laisser les patients trouver tout seuls le schéma le plus adapté à ce qu’ils ressentent. C’est un traitement à la carte, bien souvent plus efficace que toutes les combinaisons rigides que l’on pourra proposer. Les produits les plus récents et les plus sophistiqués ne sont pas toujours les plus efficaces, certains patients apprécient des produits de haute viscosité, d’autres ne les supportent pas et plus que dans toute autre maladie le succès thérapeutique ne peut passer que par une écoute attentive de leur ressenti. Dans certaines formes sévères, les pommades pourront être utiles en particulier la nuit pour protéger l’œil d’un dessèchement ou d’une malocclusion.
Un insert de cellulose (Lacrisert®) peut également rendre des services pour les patients qui doivent instiller des substituts lacrymaux de manière quasi permanente (fig. 21-5). Onéreux et malheureusement non remboursé, il est souvent apprécié des patients souffrant de grandes sécheresses oculaires et mérite d’être connu.

Fig. 21-4 Instillation excessive de gel entraînant l’apparition de dépôts gênants dans les cils.

Fig. 21-5 Insert de cellulose dans le cul-de-sac conjonctival.
De faibles quantités de cellulose sont libérées de manière continue et permettent de diminuer le nombre d’instillations de substituts lacrymaux.
Dans de très nombreux cas, la sécheresse oculaire est secondaire à un dysfonctionnement meibomien ou à une atteinte palpébrale. Il est essentiel de reconnaître les anomalies qui touchent les paupières, que ce soit sur un mode inflammatoire ou mécanique. Un dysfonctionnement meibomien, isolé ou associé à une rosacée, se reconnaît à l’œil nu lors de l’interrogatoire. De même les anomalies cutanées, des problèmes de statique palpébrale, une malocclusion ou un clignement incomplet peuvent être facilement identifiés. Le testing meibomien, l’analyse fine du bord palpébral, la recherche de collerettes autour des cils, peuvent guider vers des thérapeutiques spécifiques : hygiène palpébrale, cyclines au long cours, antibiotiques ou traitement spécifique du Demodex, etc.
Des problèmes mécaniques comme une distension conjonctivale ou une laxité palpébrale peuvent aussi nécessiter un traitement adapté. Le conjonctivochalasis peut être responsable d’un stress mécanique par glissement sur la sclère ou cisaillement par les paupières. Au niveau du limbe supérieur, il peut même être responsable d’une kératoconjonctivite limbique supérieure. La laxité palpébrale est par elle-même responsable d’une mauvaise répartition du film lacrymal et d’une purge insuffisante des glandes de Meibomius lors du clignement. Des traitements chirurgicaux peuvent parfois être indiqués dans ces cas particuliers lorsque l’approche médicale est insuffisante.
Il paraît logique d’essayer de préserver l’humidité oculaire en empêchant les larmes ou les collyres substitutifs de s’évacuer par les voies lacrymales. C’est le principe de l’occlusion des points lacrymaux de manière provisoire ou définitive à l’aide de bouchons (clous méatiques) ou d’une chirurgie (fig. 21-6) [11]. Ce traitement parfaitement logique en théorie présente souvent l’inconvénient de retenir des larmes elles-mêmes très inflammatoires, ce qui peut rendre l’efficacité insuffisante ou décevante. Une stratégie peut consister à traiter d’abord l’inflammation, par des corticoïdes en cure courte ou de la ciclosporine, avant de placer les bouchons lacrymaux [12]. La mise au point de systèmes injectables et de bouchons souples et expansibles a grandement facilité la mise en place des bouchons lacrymaux. D’un point de vue strictement psychologique, il est utile de rappeler que l’expression d’usage « clous méatiques », mauvaise traduction de punctum plugs, n’est pas judicieuse auprès de patients qui viennent consulter en état de souffrance.
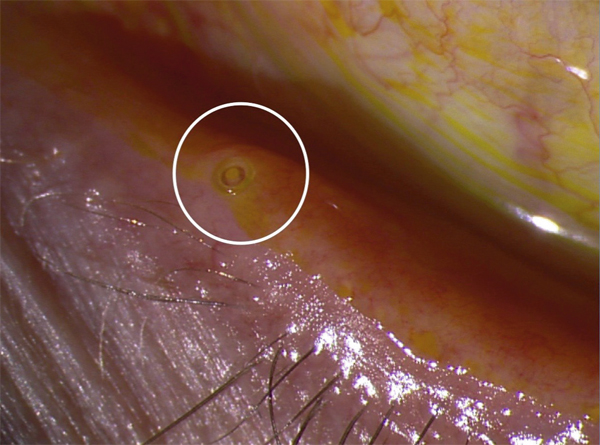
Fig. 21-6 Bouchon lacrymal (clou méatique) en place dans le point lacrymal.
Deux parasympathomimétiques administrés oralement, la pilocarpine et la céviméline, ont été évalués dans le traitement de la sécheresse oculaire au cours du syndrome de Gougerot- Sjögren (SGS) [13–15].
Le chlorhydrate de pilocarpine (Salagen®, 5 mg ou en préparation magistrale sous forme de sirop) est un cholinergique utilisé dans le traitement de la sécheresse buccale et oculaire au cours du SGS. Il a reçu son autorisation de mise sur le marché (AMM) dans cette indication en 2005. Ses propriétés parasympathomimétiques sont responsables de l’augmentation de la sécrétion des glandes exocrines (salivaires, lacrymales, sudoripares, intestinales et respiratoires). Elles entraînent aussi la stimulation des muscles lisses (voies digestives, bronches, vessie, vésicule biliaire et voies biliaires) [14, 15]. Ces propriétés permettent d’améliorer la sécheresse buccale et oculaire au cours du SGS, mais sont responsables d’effets secondaires tels que l’hypersudation qui est observée chez plus de 40 % des patients et qui peut parfois être très contraignante. Les propriétés parasympathomimétiques de la pilocarpine entraînent aussi une augmentation du tonus du muscle lisse bronchique et des sécrétions bronchiques et contre-indiquent ainsi son utilisation chez les asthmatiques et les insuffisants respiratoires. L’efficacité de la pilocarpine est plus importante sur la sécheresse buccale par rapport à la sécheresse oculaire. Soixante pour cent des patients rapportent une amélioration du syndrome sec buccal contre seulement 40 % pour la sécheresse oculaire [14, 15].
La posologie doit être instaurée à faible dose avant d’être progressivement augmentée. La dose de départ est de 5 mg, 3 à 4 fois/jour. Elle peut être augmentée jusqu’à 10 mg par prise, sans dépasser 30 mg/jour. Le traitement d’entretien doit reposer sur la dose minimale efficace et bien tolérée.
La céviméline (Evoxac®, 30 mg) est une autre molécule parasympathomimétique actuellement commercialisée aux États-Unis. En raison d’une plus grande spécificité de cette molécule pour les glandes salivaires et lacrymales, on lui rapporte moins d’effets secondaires systémiques par rapport à la pilocarpine par voie orale [13]. Cette molécule n’est pour l’instant pas encore disponible en Europe. Plusieurs autres molécules sont susceptibles de stimuler la sécrétion aqueuse et/ou muqueuse par voie topique. Parmi ces agents, le diquafosol est un agoniste de P2Y2 qui est capable de stimuler la sécrétion aqueuse et muqueuse aussi bien chez l’animal que chez l’homme [16]. Parmi les autres agents sécrétagogues, on citera le rébamipide, le géfarnate, l’écabet sodium et le 15(S)-HETE. Même si plusieurs essais cliniques ont montré leur efficacité chez les modèles animaux et chez l’homme, ces molécules ne sont pas commercialisées.
Les pommades et collyres cicatrisants classiques peuvent être utilisés mais certains, contenant des conservateurs, ne doivent pas être prescrits au long cours en raison de leur potentielle toxicité. Le sérum autologue, la membrane amniotique peuvent être des recours dans les formes les plus sévères ou en cas de menace de perforation [17, 18]. Des thérapeutiques dites matricielles sont en cours d’évaluation et semblent donner des résultats très prometteurs en cas de kératite résistant aux traitements conventionnels [19]. La tolérance est excellente, une efficacité particulière sur la douleur est apparue lors des premières études cliniques et des résultats spectaculaires ont été observés en cas de kératite neurotrophique [20].
L’inflammation joue un rôle très important dans le développement et la pérennisation de la sécheresse oculaire (voir fig. 21-1). La réduire est donc un enjeu réel pour tenter de sortir du cercle vicieux de la maladie. Pour cibler et limiter l’inflammation, les corticoïdes locaux peuvent être utilisés, mais on connaît leurs effets délétères au long cours, en raison des risques d’hypertonie oculaire, des risques infectieux et en cas de présence de conservateurs dans la formulation. Ils ont cependant pu être utilisés avec succès pour initier un traitement avec de la ciclosporine, dont l’effet est souvent plus long à apparaître, ou avec des bouchons méatiques [12]. Les anti-inflammatoires non stéroïdiens (AINS) ont un intérêt plus modéré, en particulier en raison de leur épithélio-toxicité. Cet effet de classe peut parfois conduire à une véritable nécrose cornéenne allant jusqu’à la perforation [21]. En cas d’épithéliopathie étendue, ces anti-inflammatoires ne doivent pas être utilisés et ils doivent être immédiatement arrêtés si cette complication apparaît en cours de traitement. En cas d’inflammation chronique d’origine allergique ou meibomienne, les AINS peuvent toutefois présenter un certain intérêt, surtout avec des formulations sans conservateurs. En outre, on peut rappeler que les cyclines ont aussi un effet anti-inflammatoire, en particulier aux doses faibles, insuffisantes pour obtenir un réel effet antibiotique. Cet effet anti-inflammatoire est particulièrement intéressant dans les dysfonctionnements meibomiens sévères, en cas de rosacée, lorsque l’hygiène palpébrale est insuffisante et que la cornée est menacée [22].
Cependant, le progrès majeur apparu depuis une quinzaine d’années est le développement de la ciclosporine locale pour traiter les sécheresses oculaires sévères. La ciclosporine à très faibles concentrations (0,05 à 0,1 %), bien plus faibles que celle à 2 % utilisée habituellement pour la prévention et le traitement des rejets de greffe, a montré son efficacité dans les kératoconjonctivites sèches à composante inflammatoire [23], en réduisant les symptômes, la kératite et l’inflammation [24, 25]. Cette molécule lipophile peut créer une irritation lors de son instillation, ce qui peut expliquer certains échecs et arrêts thérapeutiques. De même, lorsqu’elle est utilisée trop tard, sur des surfaces oculaires extrêmement altérées, la ciclosporine n’est pas toujours efficace. Elle est particulièrement indiquée en cas de kératite sèche d’origine auto-immune, mais elle a été étudiée dans d’autres indications, après Lasik (laser in situ keratomileusis), en cas de dysfonctionnement meibomien ou d’allergie sévère, avec des succès variables mais prometteurs [26–28].
Tous les moyens thérapeutiques à notre disposition traduisent bien la difficulté de traiter les sécheresses oculaires et de soulager les patients. Il paraît logique de proposer les traitements les plus simples (contrôle de l’environnement, larmes artificielles) aux formes les plus modestes et de réserver des stratégies plus lourdes (ciclosporine, clous méatiques, voire sérum autologue ou membrane amniotique) aux formes les plus sévères avec menace directe sur la vision et l’intégrité oculaire. Si cette règle semble évidente pour ces deux derniers traitements, la logique de l’escalade thérapeutique n’est pas toujours efficace en sécheresse oculaire. Le contrôle de l’environnement, l’association de différents substituts lacrymaux, l’hygiène palpébrale, l’absence de conservateurs restent des bases thérapeutiques valables quelle que soit la sévérité de la sécheresse. Des formes peu sévères du point de vue cornéen mais nécessitant l’instillation très fréquente de larmes artificielles peuvent justifier l’utilisation de clous méatiques. De même, est-il probablement important de bloquer l’inflammation rapidement lorsque la sécheresse s’installe, avant que des lésions irréversibles et une fibrose de la surface oculaire ne se développent, rendant le traitement beaucoup plus difficile.
On perçoit donc ainsi facilement que les indications thérapeutiques sont complexes et ne peuvent répondre à de strictes règles s’appliquant proportionnellement à la sévérité de la maladie. Adapter la thérapeutique au cas par cas est essentiel, traquer systématiquement les mécanismes sous-jacents ainsi que les maladies associées est le seul garant d’un traitement plus efficace, plus en phase avec les causes de la sécheresse et les espérances des patients. C’est pourquoi une approche thérapeutique basée sur les signes et symptômes ressentis et observés peut aussi constituer une base de réflexion et d’ajustement thérapeutiques.
Pour le clinicien, identifier le (ou les) primum movens de la pathologie permet d’adapter au mieux le traitement, qui vise bien sûr à soulager les symptômes, mais surtout à traiter le(s) mécanisme(s) étiologique(s) pour éviter que le « cercle vicieux » ne se mette en place, quel que soit le phénomène déclencheur [1]. Si, à l’inverse, la surface oculaire en est déjà à ce stade pathologique complexe, la tâche du clinicien sera plus difficile car les données cliniques manquent de spécificité, et il devient plus délicat d’identifier les mécanismes physiopathologiques sous-jacents [29, 30].
Nous proposons ainsi une approche simplifiée fondée sur une vision globale des symptômes ressentis par le patient et sur le type d’atteinte objective de la surface oculaire, telle qu’observée à la lampe à fente sans puis après instillation de fluorescéine [31].
La première étape consiste à distinguer trois situations :
1. les symptômes subjectifs sont plus intenses que ne le laisserait supposer l’atteinte objective de la surface oculaire (en particulier les colorations conjonctivales et cornéennes) ;
2. les symptômes subjectifs sont plus intenses que ne le laisserait supposer l’atteinte objective de la surface oculaire ;
3. les symptômes subjectifs semblent d’emblée cohérents avec le niveau objectif de dommage épithélial, cornéen et conjonctival (fig. 21-7).
Cette classification est bien évidemment schématique, elle se recoupe avec la démarche ODISSEY, mais elle est une aide, qu’il convient d’adapter à chaque patient, et même de réadapter en fonction de l’évolution des signes et symptômes, en réponse aux traitements proposés (fig. 21-8).
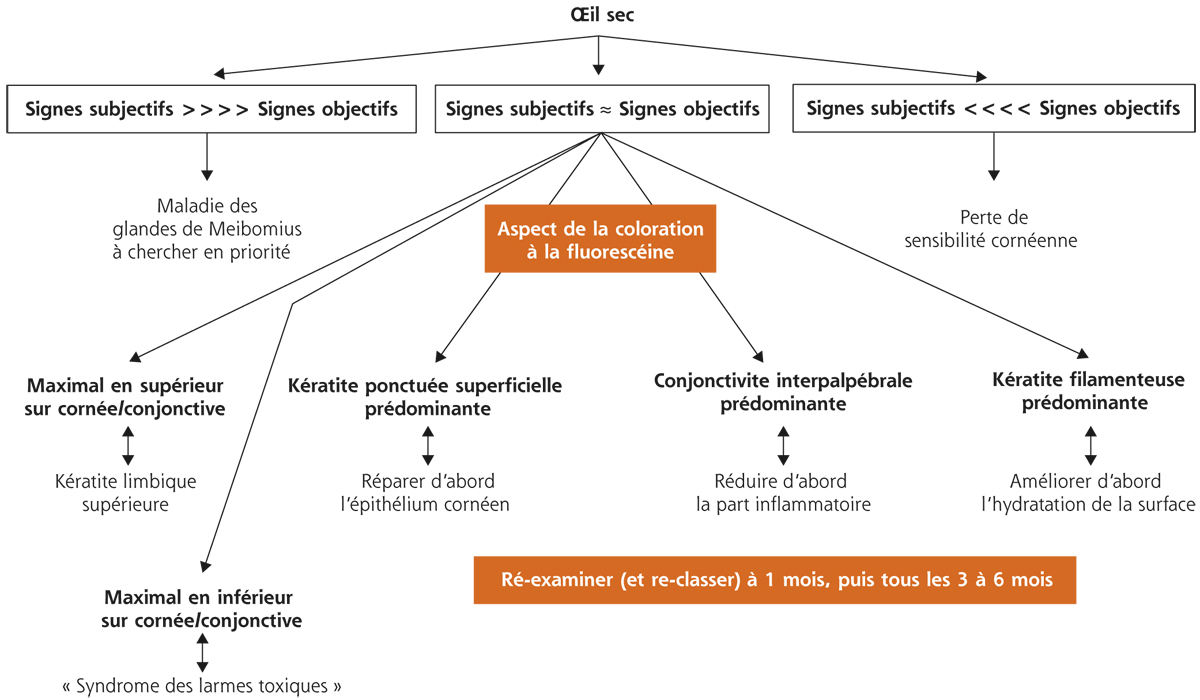
Fig. 21-7 Analyse des symptômes et des signes et définition des traitements de première intention et de leurs objectifs, d’après Labetoulle et Baudouin [31].

Fig. 21-8 Réévaluation des traitements en fonction de l’évolution, d’après Labetoulle et Baudouin [31].
CMC : carboxyméthylcellulose.
Lorsque les symptômes subjectifs sont très intenses, alors que l’atteinte épithéliale est faible et qu’il existe une instabilité lacrymale manifeste, le principal diagnostic à évoquer est celui de dysfonction des glandes de Meibomius (DGM) [29, 32, 33]. Si l’examen clinique le confirme, le traitement spécifique doit alors être mis en place (voir chapitre 4).
Certains patients atteints d’une réelle sécheresse oculaire d’origine inflammatoire éprouvent une hyperesthésie et/ou des allodynies (notamment déclenchées par la lumière ou le vent), notamment au tout début de leur évolution clinique. Il est probable que ces patients présentent des anomalies des terminaisons nerveuses cornéennes superficielles [34–36], notamment inflammatoires. L’altération secondaire des capacités nociceptives en cas de sécheresse chronique [37–40] explique probablement la régression secondaire de ce syndrome hyperesthésique initial. Ces patients doivent donc être pris en charge d’emblée comme des sécheresses oculaires modérées à sévères.
Les troubles de l’humeur peuvent contribuer à majorer les symptômes subjectifs, et inversement. Certains patients focalisent leur attention et leur stress sur les symptômes oculaires. La situation est parfois d’autant plus compliquée qu’ils reçoivent des traitements psychotropes, dont la plupart sont dotés de propriétés anticholinergiques qui aggravent l’hyposécrétion lacrymale [41]. Une prise en charge optimale de ces patients inclut donc celle de l’aspect psychologique, avec une éventuelle réévaluation des traitements psychotropes, en collaboration étroite avec le médecin généraliste ou le psychiatre.
Il s’agit de la cause la plus fréquente en pratique clinique, mais cela reste un diagnostic d’élimination. L’autre cause d’hypoesthésie cornéenne (la kératite neurotrophique traitée ci-dessous) doit être prise en charge de façon spécifique. L’histoire typique est celle d’un patient souffrant de sécheresse oculaire depuis de nombreuses années, la structure et la fonction des nerfs cornéens se dégradant avec l’ancienneté et la sévérité de la sécheresse oculaire [42, 43]. Ces patients doivent donc aussi être considérés comme sévères : leurs traitements incluent souvent rapidement des mesures anti-inflammatoires, en plus des substituts lacrymaux, et éventuellement des mesures de conservation du film lacrymal (bouchons méatiques, lunettes à chambre humide).
La dissociation entre atteinte sévère de la sécheresse et symptômes est très évocatrice d’une kératite neurotrophique, parfois diagnostiquée à tort comme une sécheresse oculaire primitive. Le traitement repose alors l’éviction de tous les collyres potentiellement toxiques (notamment ceux contenant des conservateurs ou des antibiotiques), associée à l’instillation fréquente de substituts lacrymaux. Dans les cas les plus rebelles, on pourra avoir recours au collyre au sérum autologue, aux lentilles sclérales, voire à des mesures chirurgicales réparatrices telles que les greffes de membrane amniotique et/ou de cellules souches limbiques [44].
Ce troisième cas de figure, celui dans lequel les symptômes sont cohérents avec les signes, est la situation la plus fréquente en pratique mais aussi celle qui demande une prise en charge thérapeutique en plusieurs étapes. La topographie des colorations conjonctivocornéennes (fluorescéine ± vert de lissamine) aide le clinicien dans le choix des traitements de première intention [31].
Lorsque le marquage est maximal sur la partie supérieure de la cornée et de la conjonctive bulbaire, l’étiologie la plus probable est une kératoconjonctivite limbique supérieure, dite de Theodore (fig. 21-9) [45]. Le traitement associe alors des substituts lacrymaux et un traitement anti-inflammatoire local. Dans certains cas, des cures courtes de collyres aux corticoïdes peuvent suffire. Il est parfois utile de traiter la composante inflammatoire chronique avec un collyre à la ciclosporine au long cours, à un dosage de 0,05 ou 0,5 % [46]. Il n’existe cependant pas de consensus sur ce point. Certains auteurs ont rapporté une bonne efficacité de l’occlusion des méats lacrymaux dans cette indication [47, 48], et plus récemment du rébamipide qui favorise la sécrétion mucinique [49]. Si le conjonctivochalasis persiste malgré ces mesures, une approche chirurgicale peut être discutée [50, 51].
Un marquage prédominant en supérieur peut également être le signe d’une allergie, d’autant plus que la conjonctive tarsale supérieure est atteinte, avec la présence de follicules ou de papilles. Dans ce cas, le traitement spécifique de la conjonctivite allergique est généralement efficace (voir chapitre 23).
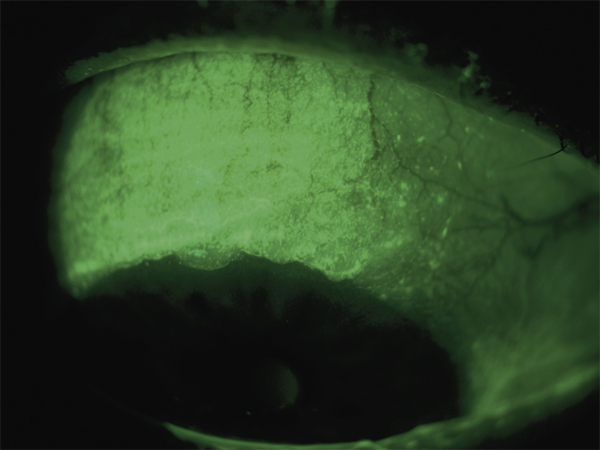
Fig. 21-9 Marquage prédominant en supérieur chez un patient atteint de kératoconjonctivite limbique supérieure.
Un marquage conjonctival cornéen prédominant en regard de la zone de contact avec la paupière inférieure signe le plus souvent un syndrome des « larmes toxiques », dont les deux causes majeures sont le DGM et les conséquences iatrogènes d’un collyre (en particulier les collyres contenant des conservateurs [52]). La prise en charge du DGM ou l’arrêt des collyres toxiques sont généralement efficaces sur cette forme de kératoconjonctivite.
Un marquage conjonctivocornéen prédominant dans l’aire de la fente palpébrale, et touchant aussi bien la conjonctive que la cornée, est très évocateur d’une inflammation chronique affectant l’ensemble de la surface oculaire, dont le chef de file est le syndrome de Gougerot-Sjögren primaire. Chez ces patients, il est essentiel de traiter les deux mécanismes physiopathologiques principaux : l’hyposécrétion lacrymale (et ses conséquences propres dont l’hyperosmolarité) et l’inflammation de la surface oculaire. Les substituts lacrymaux à haut pouvoir hydratant, et/ou dotés de propriétés mucomimétiques (collyres à l’acide hyaluronique, aux dérivés cellulosiques, aux carbomères), et/ou contenant des molécules à visée osmorégulatrice, sont très utiles en tant que traitement de première intention (voir chapitre 14). Dans tous les cas, il est important d’éviter les collyres mouillants contenant des conservateurs, notamment le chlorure de benzalkonium.
Les substituts lacrymaux les moins visqueux ont l’avantage d’améliorer la clairance des débris épithéliaux et muqueux ainsi que des éléments pro-inflammatoires (cytokines, métalloprotéinases, cellules de l’inflammation), tandis que les plus rémanents (donc ceux qui sont aussi les plus visqueux) permettent de maintenir plus longtemps un meilleur niveau d’hydratation de la surface oculaire et protègent le pôle apical des cellules de la surface oculaire (voir chapitre 14).
Comme évoqué précédemment, dans notre pratique quotidienne, nous prescrivons d’emblée plusieurs substituts lacrymaux de viscosités différentes, en donnant des indications sur les posologies, mais en conseillant au patient d’adapter la fréquence d’instillation de chacun des produits en fonction des différentes situations rencontrées dans la journée. La participation active du patient à l’optimisation de son traitement est en effet essentielle.
Si ce traitement de première intention n’améliore pas les signes objectifs et/ou les symptômes subjectifs de la sécheresse oculaire dans un délai de 3 mois, un traitement anti-inflammatoire au long cours doit être envisagé. Les collyres à la ciclosporine (0,05 ou 0,1 %) constituent le traitement de choix pour ces patients. Actuellement, ces collyres sont délivrés par les pharmacies hospitalières sous la forme de préparation magistrale ou dans le cadre d’une autorisation temporaire d’utilisation (voir chapitre 16). Les résultats sont souvent satisfaisants, mais il faut prévenir le patient du risque de picotements et de brûlures dans les heures suivant l’instillation. L’amélioration prend souvent plusieurs mois, deux à trois en moyenne, parfois jusqu’à six, phénomène dont il est préférable de prévenir le patient [53, 54].
Par rapport au marquage prédominant dans l’espace interpalpébral, le marquage diffus traduit souvent une forme plus évoluée de sécheresse oculaire à composante inflammatoire, avec dommage épithélial majeur (fig. 21-10). Le premier objectif du traitement est de restaurer la qualité de l’épithélium cornéen. Les substituts lacrymaux aux propriétés hydratantes, mucomimétiques et osmorégulatrices sont utiles pour améliorer l’interface entre les larmes et l’épithélium cornéen et ainsi réparer ou au moins atténuer les dégâts tissulaires. Là encore, une réévaluation clinique à 2 ou 3 mois de la mise en route du traitement permet d’adapter les posologies, de combiner les traitements entre eux si l’amélioration est trop partielle, voire d’ajouter un traitement anti-inflammatoire (ciclosporine) si les signes de sévérité persistent.

Fig. 21-10 Marquage diffus de l’épithélium cornéen.
La présence de filaments doit toujours être considérée comme le reflet d’un déséquilibre majeur de la surface oculaire, en particulier de la qualité de la couche mucinique, rempart essentiel pour l’homéostasie des cellules épithéliales cornéennes (fig. 21-11).
Le traitement de première intention consiste en premier lieu à améliorer la lubrification de la surface oculaire. À cet effet, on peut prescrire l’association de solutions fluides (salines ou à base de povidone), avec des substituts de la couche mucinique (carbomères notamment), le tout en instillations assez fréquemment répétées (jusqu’à 10 instillations/jour) [31]. Si la situation ne s’améliore pas rapidement, en l’espace d’un mois environ, il est alors légitime de débuter d’emblée un traitement anti-inflammatoire au long cours (c’est-à-dire ciclosporine 0,05 ou 0,1 %) et d’envisager la pose de bouchons méatiques dans les 3 mois. En effet, la pose trop précoce de bouchons méatiques risquerait d’aggraver la situation, en favorisant un syndrome des « larmes toxiques » (décrit ci-dessus), causé par la stagnation de larmes riches en cytokines inflammatoires en regard de la surface oculaire.
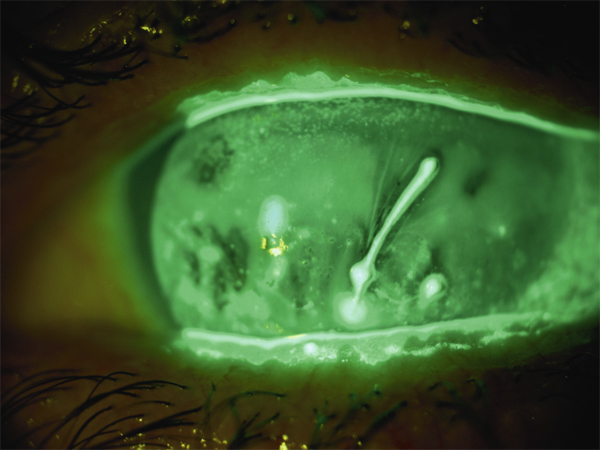
Fig. 21-11 Filament muqueux chez un patient atteint de sécheresse oculaire sévère.
Un certain nombre de mesures adjuvantes sont potentiellement utiles dans tous les cas de sécheresse oculaire. Un contrôle des facteurs aggravants est important : arrêter si possible les médicaments diminuant la sécrétion lacrymale (voir chapitre 12-II), éviter les environnements secs (climatisation notamment) ou toxiques (tabac, etc.). Quelques conseils simples peuvent être d’une grande utilité : augmenter la fréquence d’instillation des substituts lacrymaux lors des efforts de fixation (lecture, travail sur écran, télévision, etc.), en cas d’exposition à des environnements secs ou toxiques. La position des objets à regarder en fonction du port de tête est aussi importante (éviter par exemple les écrans d’ordinateur placés trop hauts). Le port de lunettes obturantes, éventuellement teintées, permet de protéger l’œil des agressions environnementales et de maintenir une hygrométrie péri-oculaire élevée. Dans les cas les plus sévères, les lunettes à chambre humide peuvent être d’une grande utilité, de même que les lentilles sclérales.
Enfin, la réassurance de ces patients (notamment en leur expliquant le caractère non cécitant de cette pathologie et l’existence de multiples solutions thérapeutiques) nous semble essentielle tant il est désormais démontré que cette pathologie génère de l’anxiété par son impact sur la qualité de vie [1, 55–57].
[1] Baudouin C. A new approach for better comprehension of diseases of the ocular surface. Journal Français d’Ophtalmologie 2007 ; 3 : 239-46.
[2] Baudouin C, Aragona P, Messmer EM, et al. Role of hyperosmolarity in the pathogenesis and management of dry eye disease : proceedings of the OCEAN group meeting. Ocul Surf 2013 ; 4 : 246-58.
[3] Baudouin C, Aragona P, Van Setten G, et al. Diagnosing the severity of dry eye : a clear and practical algorithm. The British Journal of Ophthalmology 2014 ; 9 : 1168-76.
[4] Lemp MA, Baudouin C, Amrane M, et al. Poor correlation between dry eye disease (DED) signs and symptoms in a phase III randomized clinical trial. Invest Ophthalmol Vis Sci 2011 ; 52 : 3821.
[5] Behrens A, Doyle JJ, Stern L, et al. Dysfunctional tear syndrome : a Delphi approach to treatment recommendations. Cornea 2006 ; 8 : 900-7.
[6] The definition and classification of dry eye disease : report of the definition and classification subcommittee of the International Dry Eye WorkShop (2007). Ocul Surf 2007 ; 2 : 75-92.
[7] Management and therapy of dry eye disease : report of the management and therapy subcommittee of the International Dry Eye WorkShop (2007). Ocul Surf 2007 ; 2 : 163-78.
[8] Uchino M, Uchino Y, Dogru M, et al. Dry eye disease and work productivity loss in visual display users : the Osaka study. Am J Ophthalmol 2014 ; 2 : 294-300.
[9] Baudouin C, Creuzot-Garcher C, Hoang-Xuan T, et al. Creating a specific diagnostic and quality-of-life questionnaire for patients with ocular surface disease. Journal Français d’Ophtalmologie 2003 ; 2 : 119-30.
[10] Labbe A, Wang YX, Jie Y, et al. Dry eye disease, dry eye symptoms and depression : the Beijing Eye Study. The British Journal of Ophthalmology 2013 ; 11 : 1399-403.
[11] Bourkiza R, Lee V. A review of the complications of lacrimal occlusion with punctal and canalicular plugs. Orbit 2012 ; 2 : 86-93.
[12] Roberts CW, Carniglia PE, Brazzo BG. Comparison of topical cyclosporine, punctal occlusion, and a combination for the treatment of dry eye. Cornea 2007 ; 7 : 805-9.
[13] Ono M, Takamura E, Shinozaki K, et al. Therapeutic effect of cevimeline on dry eye in patients with Sjogren’s syndrome : a randomized, double-blind clinical study. Am J Ophthalmol 2004 ; 1 : 6-17.
[14] Papas AS, Sherrer YS, Charney M, et al. Successful treatment of dry mouth and dry eye symptoms in Sjogren’s syndrome patients with oral pilocarpine : a randomized, placebo-controlled, dose-adjustment study. Journal of Clinical Rheumatology 2004 ; 4 : 169-77.
[15] Vivino FB, Al-Hashimi I, Khan Z, et al. Pilocarpine tablets for the treatment of dry mouth and dry eye symptoms in patients with Sjogren syndrome : a randomized, placebo-controlled, fixed-dose, multicenter trial. P92-01 Study Group. Archives of Internal Medicine 1999 ; 2 : 174-81.
[16] Tauber J, Davitt WF, Bokosky JE, et al. Double-masked, placebo-controlled safety and efficacy trial of diquafosol tetrasodium (INS365) ophthalmic solution for the treatment of dry eye. Cornea 2004 ; 8 : 784-92.
[17] Creuzot-Garcher C, Lafontaine PO, Brignole F, et al. Treating severe dry eye syndromes with autologous serum. Journal Français d’Ophtalmologie 2004 ; 4 : 346-51.
[18] Datta H, Sarkar K, Chatterjee PR. Amniotic membrane transplantation in ocular surface disorders. Journal of the Indian Medical Association 2004 ; 12 : 726-9.
[19] Brignole-Baudouin F, Warnet JM, Barritault D, et al. RGTA-based matrix therapy in severe experimental corneal lesions : safety and efficacy studies. Journal Français d’Ophtalmologie 2013 ; 9 : 740-7.
[20] Chebbi CK, Kichenin K, Amar N, et al. Pilot study of a new matrix therapy agent (RGTA OTR4120) in treatment-resistant corneal ulcers and corneal dystrophy. Journal Français d’Ophtalmologie 2008 ; 5 : 465-71.
[21] Asai T, Nakagami T, Mochizuki M, et al. Three cases of corneal melting after instillation of a new nonsteroidal anti-inflammatory drug. Cornea 2006 ; 2 : 224-7.
[22] Beardsley RM, De Paiva CS, Power DF, et al. Desiccating stress decreases apical corneal epithelial cell size--modulation by the metalloproteinase inhibitor doxycycline. Cornea 2008 ; 8 : 935-40.
[23] Schultz C. Safety and efficacy of cyclosporine in the treatment of chronic dry eye. Ophthalmology and Eye Diseases 2014 ; 6 : 37-42.
[24] Brignole F, Pisella PJ, De Saint Jean M, et al. Flow cytometric analysis of inflammatory markers in KCS : 6-month treatment with topical cyclosporin A. Invest Ophthalmol Vis Sci 2001 ; 1 : 90-5.
[25] Brignole F, Pisella PJ, Goldschild M, et al. Flow cytometric analysis of inflammatory markers in conjunctival epithelial cells of patients with dry eyes. Invest Ophthalmol Vis Sci 2000 ; 6 : 1356-63.
[26] Hessert D, Tanzer D, Brunstetter T, et al. Topical cyclosporine A for postoperative photorefractive keratectomy and laser in situ keratomileusis. J Cataract Refract Surg 2013 ; 4 : 539-47.
[27] Prabhasawat P, Tesavibul N, Mahawong W. A randomized double-masked study of 0.05 % cyclosporine ophthalmic emulsion in the treatment of meibomian gland dysfunction. Cornea 2012 ; 12 : 1386-93.
[28] Vichyanond P, Kosrirukvongs P. Use of cyclosporine A and tacrolimus in treatment of vernal keratoconjunctivitis. Current Allergy and Asthma Reports 2013 ; 3 : 308-14.
[29] Nichols KK, Nichols JJ, Mitchell GL. The lack of association between signs and symptoms in patients with dry eye disease. Cornea 2004 ; 8 : 762-70.
[30] Sullivan BD, Crews LA, Messmer EM, et al. Correlations between commonly used objective signs and symptoms for the diagnosis of dry eye disease : clinical implications. Acta Ophthalmologica 2014 ; 2 : 161-6.
[31] Labetoulle M, Baudouin C. From pathogenic considerations to a simplified decision-making schema in dry eye disease. J Fr Ophtalmol 2013 ; 6 : 543-7.
[32] Lemp MA, Crews LA, Bron AJ, et al. Distribution of aqueous-deficient and evaporative dry eye in a clinic-based patient cohort : a retrospective study. Cornea 2012 ; 5 : 472-8.
[33] Tomlinson A, Bron AJ, Korb DR, et al. The international workshop on meibomian gland dysfunction : report of the diagnosis subcommittee. Invest Ophthalmol Vis Sci 2011 ; 4 : 2006-49.
[34] Rosenthal P, Borsook D. The corneal pain system. Part I : the missing piece of the dry eye puzzle. Ocul Surf 2012 ; 1 : 2-14.
[35] Situ P, Simpson TL, Jones LW, et al. Conjunctival and corneal hyperesthesia in subjects with dryness symptoms. Optom Vis Sci 2008 ; 9 : 867-72.
[36] Vehof J, Kozareva D, Hysi PG, et al. Relationship between dry eye symptoms and pain sensitivity. JAMA Ophthalmology 2013 ; 10 : 1304-8.
[37] Belmonte C, Acosta MC, Gallar J. Neural basis of sensation in intact and injured corneas. Exp Eye Res 2004 ; 3 : 513-25.
[38] Belmonte C, Gallar J. Cold thermoreceptors, unexpected players in tear production and ocular dryness sensations. Invest Ophthalmol Vis Sci 2011 ; 6 : 3888-92.
[39] Bourcier T, Acosta MC, Borderie V, et al. Decreased corneal sensitivity in patients with dry eye. Invest Ophthalmol Vis Sci 2005 ; 7 : 2341-5.
[40] Parra A, Gonzalez-Gonzalez O, Gallar J, et al. Tear fluid hyperosmolality increases nerve impulse activity of cold thermoreceptor endings of the cornea. Pain 2014 ; 8 : 1481-91.
[41] Rousseau A, Labetoulle M. Atteintes ophtalmologiques d’origine médicamenteuse (Drug-induced eye damage). Encycl Méd Chir (Elsevier, Paris). 2012 : p. 1-9.
[42] Labbe A, Alalwani H, Van Went C, et al. The relationship between subbasal nerve morphology and corneal sensation in ocular surface disease. Invest Ophthalmol Vis Sci 2012 ; 8 : 4926-31.
[43] Labbe A, Liang Q, Wang Z, et al. Corneal nerve structure and function in patients with non-sjogren dry eye : clinical correlations. Invest Ophthalmol Vis Sci 2013 ; 8 : 5144-50.
[44] Sacchetti M, Lambiase A. Diagnosis and management of neurotrophic keratitis. Clin Ophthalmol 2014 ; 8 : 571-9.
[45] Theodore FH. Superior limbic keratoconjunctivitis. Eye, Ear, Nose & Throat Monthly 1963 ; 42 : 25-8.
[46] Perry HD, Doshi-Carnevale S, Donnenfeld ED, et al. Topical cyclosporine A 0.5 % as a possible new treatment for superior limbic keratoconjunctivitis. Ophthalmology 2003 ; 8 : 1578-81.
[47] Kabat AG. Lacrimal occlusion therapy for the treatment of superior limbic keratoconjunctivitis. Optom Vis Sci 1998 ; 10 : 714-8.
[48] Yang HY, Fujishima H, Toda I, et al. Lacrimal punctal occlusion for the treatment of superior limbic keratoconjunctivitis. Am J Ophthalmol 1997 ; 1 : 80-7.
[49] Takahashi Y, Ichinose A, Kakizaki H. Topical rebamipide treatment for superior limbic keratoconjunctivitis in patients with thyroid eye disease. Am J Ophthalmol 2014 ; 4 : 807-12 e2.
[50] Gris O, Plazas A, Lerma E, et al. Conjunctival resection with and without amniotic membrane graft for the treatment of superior limbic keratoconjunctivitis. Cornea 2010 ; 9 : 1025-30.
[51] Kheirkhah A, Casas V, Esquenazi S, et al. New surgical approach for superior conjunctivochalasis. Cornea 2007 ; 6 : 685-91.
[52] Baudouin C, Labbe A, Liang H, et al. Preservatives in eyedrops : the good, the bad and the ugly. Progr Ret Eye Res 2010 ; 4 : 312-34.
[53] Cross Wd, Lay LF Jr, Walt JG, et al. Clinical and economic implications of topical cyclosporin A for the treatment of dry eye. Managed Care Interface 2002 ; 9 : 44-9.
[54] Sall K, Stevenson OD, Mundorf TK, et al. Two multicenter, randomized studies of the efficacy and safety of cyclosporine ophthalmic emulsion in moderate to severe dry eye disease. CsA Phase 3 Study Group. Ophthalmology 2000 ; 4 : 631-9.
[55] Denoyer A, Rabut G, Baudouin C. Tear film aberration dynamics and vision-related quality of life in patients with dry eye disease. Ophthalmology 2012 ; 9 : 1811-8.
[56] Friedman NJ. Impact of dry eye disease and treatment on quality of life. Curr Opinion Ophthalmol 2010 ; 4 : 310-6.
[57] Guillemin I, Begley C, Chalmers R, et al. Appraisal of patient-reported outcome instruments available for randomized clinical trials in dry eye : revisiting the standards. Ocul Surf 2012 ; 2 : 84-99.

