L’œil sec
R. Tahiri Joutei Hassani, C. Baudouin, A. Denoyer
La sécheresse oculaire est une pathologie fréquente, souvent sous-estimée et sous-diagnostiquée. Elle représente environ 25 % des motifs des consultations en ophtalmologie. La fréquence relativement élevée de la sécheresse oculaire, son coût financier et son retentissement significatif sur la qualité de vie et même de la vision en font un véritable problème de santé publique. Les grandes études épidémiologiques indiquent que le sexe féminin et l’âge avancé augmentent le risque de sécheresse oculaire.
L’épidémiologie de la sécheresse oculaire était mal connue jusqu’au milieu des années 1990. En 1995, une réunion d’experts initiée conjointement par le National Eye Institute (NEI) et l’industrie pharmaceutique a réuni certains des plus grands spécialistes de la surface oculaire et conclut qu’« il y avait un manque de données concernant la fréquence de l’œil sec dans la population et la façon dont cette fréquence variait selon l’âge, le sexe et l’ethnie » [1]. Des progrès considérables ont depuis été réalisés et plusieurs rapports épidémiologiques ont été publiés, notamment la Salisbury Eye Evaluation [2-4], la Beaver Dam Eye Study [5], le Melbourne Visual Impairment Project [6], la Women’s Health Study [7] et la Physicians’ Health Study [8-10].
Les études épidémiologiques de la sécheresse oculaire sont confrontées à plusieurs obstacles qui les rendent complexes et inhomogènes [11]. Parmi ces obstacles, on citera les différences de définitions utilisées, la variabilité des tableaux cliniques, le manque de corrélation entre les symptômes d’irritation oculaire et les tests cliniques sur la sécheresse oculaire, la variabilité des tests diagnostiques utilisés et leur faible reproductibilité. Ainsi, bien que l’utilisation de nombreux tests diagnostiques soit aujourd’hui répandue en pratique courante, il n’existe pas de consensus portant sur l’utilisation combinée de plusieurs tests pour déterminer la présence de la maladie avec les meilleures valeurs prédictives.
En 2007, le dernier rapport du sous-comité d’épidémiologie du Dry Eye Workshop (DEWS) résumait les connaissances actualisées sur l’épidémiologie de l’œil sec [11]. Ce rapport soulignait la nécessité de réaliser plus d’études épidémiologiques à travers le monde, d’intégrer plus d’ethnies afin d’optimiser la représentativité des populations, et d’établir enfin un consensus sur les critères diagnostiques de l’œil sec, prérequis indispensable aux futures enquêtes épidémiologiques.
Dans la Beaver Dam Eye Study [5], la prévalence de la sécheresse oculaire était de 14 % chez les adultes âgés de 48 à 98 ans, avec une prédominance féminine (16,7 % pour les femmes versus 11,4 % pour les hommes). Selon d’autres larges études épidémiologiques, dont la Women’s Health Study [7] et la Physician’s Health Study [8–10], la prévalence de la sécheresse oculaire symptomatique aux États-Unis est d’environ 7 % chez les femmes et de 4 % chez les hommes de plus de 50 ans. Ainsi, près de 3,23 millions de femmes et 1,68 million d’hommes de plus de 50 ans souffrent de sécheresse oculaire symptomatique aux États-Unis, soit un total de 4,91 millions. Ce chiffre pourrait dépasser 20 millions si l’on considérait tous les degrés de sévérité de sécheresse oculaire [7, 11].
La prévalence de la sécheresse oculaire est approximativement de 7,4 % en Australie [6, 11, 12], avec une prédominance chez les sujets âgés et les femmes. En Indonésie, ce taux atteint 27,5 % et augmente avec l’âge, le tabagisme et la présence d’un ptérygion. À Taiwan, la prévalence de la sécheresse oculaire est de 33,7 % chez les sujets âgés avec une prédominance féminine [13] ; ce taux est de 28,7 % au Canada [14] et varie de 4,3 % à 76,5 % au Japon selon l’âge, le sexe et les critères diagnostiques [15–18]. Même si ces chiffres peuvent paraître relativement importants, il est très probable qu’ils soient cependant sous-estimés. La sécheresse oculaire reste encore mal diagnostiquée, soit parce que les patients ne reconnaissent pas les symptômes, soient parce qu’ils ne rapportent pas le problème au médecin [11]. Le tableau 3-1 récapitule les grandes études épidémiologiques sur la sécheresse oculaire [2–34].
Tableau 3-1 Récapitulatif des principales études épidémiologiques portant sur la sécheresse oculaire.
BUT : break-up time ; OSDI : Ocular Surface Disease Index.
L’analyse de l’ensemble de ces études suggère que la prévalence de la sécheresse oculaire varie de 3,9 % à près de 93 % selon les séries [8–10, 29]. Cependant, il faut noter que les définitions de la sécheresse oculaire utilisées dans ces études ont été différentes, et par conséquent, la prudence est conseillée dans l’interprétation des comparaisons directes de ces études. Ces écarts observés dépendent des populations étudiées, de leur âge, de leurs origines ethniques, mais surtout des critères qui ont été retenus pour définir la sécheresse oculaire [35–37]. En effet, la sécheresse oculaire est une maladie multifactorielle ; sa définition peut être différente selon les séries et ses critères diagnostiques sont plus au moins restrictifs selon les différentes études épidémiologiques, ce qui peut expliquer les écarts de prévalence entre ces différentes séries. Il est observé que les estimations les plus élevées sont obtenues à partir d’études dans lesquelles une définition moins restrictive a été utilisée, et les estimations les plus basses ont été observées dans les études dans lesquelles une définition plus restrictive a été utilisée. Ces écarts soulignent l’importance d’adopter une définition précise et d’avoir un consensus sur les examens diagnostiques [11]. Aux États-Unis, les estimations du bureau du recensement indiquent que, sur la période de 2000 à 2050, le nombre de personnes âgées de 65 à 84 ans augmentera de 100 %, et celui de personnes âgées de plus de 85 ans augmentera de 333 % [11]. On s’attend ainsi à ce que la fréquence de la sécheresse oculaire augmente de plus en plus durant les 40 prochaines années. Des tendances similaires sont attendues dans de nombreux autres pays [11].
La plupart des études épidémiologiques sur la sécheresse oculaire concernent sa prévalence. Il existe beaucoup moins d’études sur son incidence. D’après Doughty et al. [14], la sécheresse oculaire représente environ 25 % des motifs des consultations en ophtalmologie. Aux États-Unis, Ellwein et al. ont constaté que l’incidence de la sécheresse oculaire a augmenté de 57,4 %, passant de 1,22 pour 100 bénéficiaires de Medicare/Medicaid en 1991 à 1,92 en 1998 [38].
Même si cela n’a jamais été mesuré de façon formelle, la fréquence et la sévérité de la sécheresse oculaire dépendent du caractère saisonnier. La sécheresse oculaire est aggravée par les fortes températures, la sécheresse atmosphérique et la saison pollinique. On note ainsi une recrudescence relative de sécheresse oculaire au cours de l’été par rapport à l’hiver [39].
L’impact de la sécheresse oculaire sur la qualité de vie et la fonction visuelle est désormais inclus dans la définition même de la maladie [11]. Plusieurs facteurs déterminent le retentissement de la sécheresse oculaire sur la qualité de vie : le degré de douleurs et de symptômes irritatifs, l’impact sur la performance visuelle qui peut être directement responsable de la dégradation de certaines activités quotidiennes, comme la conduite automobile, la lecture ou le travail sur écran, le retentissement psychologique et enfin la nécessité d’instiller fréquemment des larmes artificielles qui peut affecter les interactions sociales et professionnelles.
Dans une étude parue en 2007 [40], les patients atteints d’une sécheresse oculaire étaient environ trois fois plus susceptibles de rapporter des problèmes dans leurs activités courantes que ceux qui n’étaient pas atteints d’une sécheresse oculaire. Les patients atteints de sécheresse oculaire avaient ainsi plus de problèmes pour lire, effectuer leur activité professionnelle, utiliser un ordinateur, regarder la télévision, conduire de jour et de nuit. De même, Mertzanis et al. [41] ont montré que la sécheresse oculaire entraînait des limitations considérables dans les activités de la vie quotidienne, des douleurs physiques et de l’inconfort, et diminuait la santé perçue, la vitalité et l’énergie. Ces altérations étaient par ailleurs corrélées au degré de sévérité de la sécheresse oculaire. L’impact de la sécheresse oculaire sur la qualité de vie est traité plus loin au paragraphe « Qualité de vie, qualité de vision ».
La sécheresse oculaire constitue un fardeau économique considérable pour la société. C’est confirmé par plusieurs études évaluant ses coûts directs et indirects [42–47]. Le coût direct de la sécheresse oculaire comprend les consultations, les tests diagnostiques ainsi que le coût des traitements pharmacologiques et non pharmacologiques [11].
Selon une étude réalisée sur six pays européens en 2006 (France, Allemagne, Italie, Espagne, Suède et Royaume-Uni), le coût direct moyen de la prise en charge de la sécheresse oculaire était de 600 dollars par patient et par an [42]. Ce coût variait entre 270 dollars par patient et par an en France et 1 100 dollars par patient et par an au Royaume-Uni. Mais ces chiffres étaient très probablement sous-estimés car ils ne prenaient pas en compte les patients qui étaient en automédication ou ceux qui étaient suivis par leur médecin généraliste. Selon une série américaine réalisée en 2008 [43], le coût direct de la sécheresse oculaire s’élèverait à 446 dollars par patient et par an. Dans une autre étude américaine publiée en 2011 [44], le coût direct était de 700 à 1 300 dollars par patient et par an et variait en fonction de la gravité des symptômes. Ainsi, pour des symptômes mineurs, le coût annuel était d’environ 678 dollars ; en cas de symptômes modérés, il était de 771 dollars, et pour les symptômes sévères, le coût direct atteignait jusqu’à 1 267 dollars par patient et par an. D’après les auteurs de cette étude, les coûts directs de la sécheresse oculaire représenteraient au total jusqu’à 3,8 milliards de dollars par an pour les États-Unis. Dans une étude japonaise réalisée en 2012 [45], le coût annuel des collyres chez les patients atteints de sécheresse oculaire est de 323 ± 219 dollars par patient et par an.
À côté des coûts directs qui paraissent déjà considérables, les coûts indirects sont encore plus importants. Ils comprennent l’absentéisme, la baisse de productivité ainsi que l’impact sur les interactions sociales [46]. D’après Yu et al. [44], les coûts indirects de la sécheresse oculaire sont estimés entre 12 000 et 18 000 dollars par patient et par an. Cela représenterait un coût indirect total de plus de 55 milliards de dollars par an pour les États-Unis. Une autre étude a estimé que le coût indirect de la sécheresse oculaire se situerait entre 9 et 15 milliards de dollars par an au Japon [47].
Il est actuellement démontré que la sécheresse oculaire diminue le rendement de travail des employés de bureau [44, 47]. Afin d’évaluer de façon fiable la productivité au travail, une échelle spécifique a été validée ; il s’agit du questionnaire WPAI-SHP (Work Productivity and Activity Impairment Questionnaire : Specific Health Problem) [48]. Ce score a récemment été utilisé par Yu et al. pour évaluer la productivité des patients atteints de sécheresse oculaire [44]. D’après les résultats de cette étude, le coût indirect lié à la baisse de productivité chez les patients atteints de sécheresse oculaire était plus important que celui qui était lié à l’absentéisme. Cette baisse de productivité était directement corrélée à la sévérité des symptômes. L’insuffisance globale de travail était ainsi significativement plus élevée chez les patients atteints de sécheresse oculaire sévère (33 %) que chez ceux atteints de sécheresse modérée (16 %) ou légère (12 %).
Enfin, il a été démontré que le traitement des symptômes de la sécheresse oculaire pourrait contribuer à l’amélioration de la productivité au travail [44, 47]. Selon une étude japonaise, les avantages économiques attendus du traitement de la sécheresse oculaire chez les travailleurs sont considérables. Ces avantages sont estimés entre 4 et 8 milliards de dollars lorsque 50 % des employés atteints de sécheresse oculaire ont reçu un traitement médical [47].
La prévalence de la sécheresse oculaire augmente avec l’âge ; plus de la moitié des sujets souffrant de sécheresse oculaire ont plus de 65 ans. D’après les grandes études épidémiologiques de la sécheresse oculaire, sa fréquence est significativement liée au vieillissement de la population [2-4, 8-11, 20].
Bien que très peu de données existent sur l’effet potentiel de l’origine ethnique sur la prévalence de la sécheresse oculaire, les données de la Women’s Health Study indiquent que la prévalence de symptômes sévères est probablement plus élevée chez les Hispaniques et les Asiatiques par rapport aux Blancs [7]. Les données de plusieurs études réalisées en Asie suggèrent une fréquence plus élevée de la sécheresse oculaire chez les asiatiques. Ainsi, dans la Henan Eye Study réalisée en 2010 en Chine [22], les symptômes de sécheresse oculaire étaient présents chez 50,1 % des sujets. Dans l’Osaka Study [18], la fréquence de sécheresse oculaire chez 672 utilisateurs d’ordinateurs âgés de 38 à 49 ans était de 76 % chez les femmes et de 60,2 % chez les hommes. Enfin, selon la série de Zhang et al., réalisée en Chine chez 1902 élèves de secondaire [23], la fréquence de sécheresse oculaire était de 23,7 %. Ces résultats suggèrent en effet la possibilité d’une prévalence plus élevée de l’œil sec dans ces populations [11, 18, 21, 22, 25].
Les données combinées de grandes études épidémiologiques indiquent que le nombre de femmes touchées par la sécheresse oculaire est supérieur à celui des hommes [11, 16–18, 20]. Le rôle des hormones sexuelles dans l’homéostasie de la surface oculaire a déjà été établi [49]. Les androgènes régulent le développement, la différenciation et la synthèse des lipides par les glandes de Meibomius. La déficience androgénique, telle qu’observée au cours de la ménopause, l’andropause, le syndrome d’insensibilité complète aux androgènes et les traitements anti-androgéniques sont associés à des altérations significatives dans les lipides polaires et neutres des sécrétions de glandes de Meibomius, une augmentation de l’érythème palpébral et des télangiectasies ainsi qu’une hyperkératinisation et une métaplasie des orifices des glandes de Meibomius [49].
Le taux des hormones sexuelles diminue avec l’âge aussi bien chez l’homme que chez la femme [49]. La diminution des hormones sexuelles avec l’âge s’associe à une augmentation de la sécheresse oculaire chez les hommes et les femmes [11]. Dans une étude comprenant plus de 25 000 femmes, le traitement hormonal substitutif (THS) était corrélé à une augmentation de la prévalence de la sécheresse oculaire. La prévalence de la sécheresse oculaire était de 5,93 % chez les femmes sans traitement, de 6,67 % chez celles traitées par des estrogènes combinés avec de la progestérone, et de 9,05 % chez celles traitées uniquement par des estrogènes [50]. Chez les femmes ménopausées, pour chaque tranche supplémentaire de 3 ans sous THS, l’odds ratio (OR) ou risque relatif de sécheresse oculaire était de 1,16 (1,09–1,24). Cette relation a ensuite été confirmée par l’étude Shihpai [21], dans laquelle le THS était associé à une augmentation du risque de sécheresse oculaire (OR = 1,28), et par la Blue Mountains Eye Study (OR = 1,7) [12]. Le rôle de la prise de contraceptifs oraux dans la genèse de la sécheresse oculaire est controversé ; les résultats disponibles sont contradictoires et portent sur de petites séries. En ce qui concerne le rôle de la grossesse, de l’hystérectomie, de l’ovariectomie et du dysfonctionnement ovarien, peu de données sont disponibles [51, 52].
Les collagénoses et les connectivites sont des maladies auto-immunes qui englobent plusieurs entités cliniques telles que la polyarthrite rhumatoïde, le lupus érythémateux systémique et la fibromyalgie. Dans ce contexte auto-immun, la sécheresse oculaire peut être soit isolée, soit associée à un syndrome de Gougerot-Sjögren [53–55]. D’autres facteurs de risque systémiques incluent le diabète sucré [56], la sarcoïdose, l’infection au virus de l’immunodéficience humaine (VIH) [57] et le virus T-lymphotrope 1 humain (HTLV1) [58]. Par ailleurs, les dysthyroïdies sont des comorbidités bien établies de la sécheresse oculaire puisqu’elles sont souvent associées au floppy eyelid syndrome, à la kératoconjonctivite limbique supérieure de Théodore ainsi qu’aux kératites d’expositions dans le cadre d’exophtalmies [59]. Parmi les autres facteurs de risques systémiques de la sécheresse oculaire, on cite les troubles anxieux et dépressifs qui peuvent être aussi bien une cause qu’une conséquence de la sécheresse oculaire [60–62]. Enfin, il existe parfois une prédisposition physiologique à la sécheresse oculaire [63, 64]. Celle-ci comprend une plus grande ouverture palpébrale, une ptose ainsi qu’un faible taux de clignements, souvent aggravé par l’utilisation prolongée d’un ordinateur, la lecture et le fait de regarder la télévision.
Plusieurs pathologies ophtalmologiques s’associent à la sécheresse oculaire. Elles constituent soit une porte d’entrée, soit une conséquence de la sécheresse oculaire. Mais le plus souvent, elles s’autostimulent et entretiennent aussi la sécheresse oculaire par le biais d’un cercle vicieux où s’intriquent irritation oculaire, inflammation de la surface oculaire, hyperosmolarité et apoptose. Les plus fréquentes et les plus étudiées des comorbidités ophtalmologiques de la sécheresse oculaire sont la rosacée et la dysfonction meibomienne [11, 49]. Cette pathologie est associée à des anomalies de la couche lipidique et à une instabilité lacrymale ; elle est détaillée dans le chapitre 4. Les autres comorbidités ophtalmologiques comprennent les allergies oculaires [65], les kératalgies récidivantes dans le cadre de dystrophies cornéennes [66], les conjonctivochalasis [67], les ptérygions [68], les kératoconjonctivites chroniques telles que le trachome [69, 70] ainsi que les anomalies palpébrales telles que l’entopion, l’ectopion, le trichiasis, le distichiasis, le blépharospasme et le floppy eyelid syndrome [70–73]. L’ensemble de ces comorbidités ophtalmologiques s’associe à une altération du film lacrymal et de la surface oculaire.
Il a par ailleurs été rapporté que l’œil adelphe d’une kératite herpétique présentait une baisse significative du test de Schirmer pas rapport à celui de sujets témoins (p=0,001 avec anesthésie et p=0,02 sans anesthésie). Il n’existait cependant pas de différence en termes de symptômes entre les deux groupes [74].
Les facteurs environnementaux ne sont pas négligeables. Ils comprennent les environnements artificiels faiblement humides, qu’ils soient chauffés ou climatisés, tels que les voyages en avion, le travail en bureau exigeant sur le plan visuel et cognitif, ou encore les endroits avec une pollution intérieure ou des fumées [75-78]. Plusieurs études épidémiologiques réalisées dans des environnements fermés et faiblement humides ont rapporté une exacerbation des plaintes d’irritation oculaire, telles que brûlure, sécheresse, picotement, et sensation d’avoir du sable dans les yeux [75-78]. D’autres séries ont montré qu’un taux d’humidité inférieur à 30 % était associé à une exacerbation de la sécheresse oculaire [77]. Dans ces conditions, la sécheresse oculaire est liée à l’augmentation de l’évaporation qui peut résulter de plusieurs facteurs tels qu’un faible taux d’humidité, une température ambiante élevée, la vitesse de l’air, la diminution de la fréquence des clignements, la pollution intérieure et la mauvaise qualité de l’air [77].
Le travail en bureau conjugue souvent plusieurs conditions défavorables pour la surface oculaire : pollution intérieure, températures et taux d’humidité inadéquats, présence d’allergènes, et problèmes de ventilation et d’aération. Lorsque ces conditions se croisent, elles constituent ce qu’on appelle le sick buildings syndrome ou le syndrome des immeubles malsains [79]. Ce syndrome comprend plusieurs manifestations dont des signes ORL, respiratoires, cutanés, des problèmes de concentration et d’asthénie, une baisse de productivité, ainsi que des signes de sécheresse oculaire [79, 80]. En 1999, on estimait qu’il y avait déjà plus de 25 millions de travailleurs présentant des symptômes en rapport avec le sick buildings syndrome aux États-Unis [79]. Une forte proportion (29 %) des occupants des immeubles présenterait ainsi des signes d’inconfort oculaire. Dans une série italienne publiée en 1998, 29,8 % des travailleurs présentaient des symptômes oculaires dans des immeubles climatisés [80]. On retrouve des fréquences similaires sur des séries plus récentes : 21 % des travailleurs présentaient des signes de sécheresse oculaire dans une série norvégienne réalisée en 2008 [81], et 27 à 33 % des travailleurs présentaient des symptômes oculaires dans la série de Rios et al., réalisée en 2009 au Brésil [82].
Ward et al. [78] ont étudié les effets de l’exposition passive à la fumée de cigarette sur la surface oculaire. Les auteurs ont observé que même une exposition passive et brève à la fumée de cigarette entraînait une instabilité significative du film lacrymal aussi bien chez les porteurs que les non-porteurs de lentilles de contact. Bien que l’exposition aiguë à la fumée de cigarette ait causé une augmentation négligeable des symptômes de sécheresse oculaire, les auteurs ont conclu que la répétition et/ou l’exposition chronique à la fumée de cigarette étaient probablement associées à une symptomatologie importante.
Les utilisateurs d’écrans d’ordinateur se plaignent souvent de problèmes oculaires à type de sensations de tension, de brûlures, d’irritation, de rougeur, de trouble de la vue et de fatigue visuelle [83, 84]. L’utilisation prolongée d’écrans est caractérisée par un soutien de l’attention visuelle et une fixité du regard qui peuvent entraîner une asthénopie, des difficultés d’accommodation et une diminution de la fréquence des clignements. Selon Cardona et al. [84], le travail sur écran est statistiquement associé à une réduction de 30 à 50 % de la fréquence et de l’amplitude des clignements par rapport au niveau de base. L’ensemble de ces microtraumatismes répétés est responsable de ce qui est désigné comme un « syndrome visuel sur ordinateur » ou computer vision syndrome (CVS). Parmi tous les aspects du CVS, la sécheresse oculaire semble être une composante importante favorisant les symptômes rapportés [85]. L’avènement des smartphones et des jeux vidéo renforce cette tendance, notamment chez les plus jeunes. Selon Moon et al. [86], l’utilisation de smartphones est associée à l’augmentation du risque de sécheresse oculaire chez les enfants. Ce risque augmente avec la durée d’utilisation quotidienne de ces écrans.
Dans une étude réalisée chez 3 549 employés de bureau [87], 26,93 % des hommes et 47,96 % des femmes présentaient des symptômes graves de sécheresse oculaire. L’utilisation des écrans pendant plus de 4 heures était associée à un risque accru de sécheresse oculaire (OR=1,68, intervalle de confiance [IC] 95 % = 1,40 à 2,02). Dans une autre étude réalisée en Malaisie chez 795 étudiants âgés de 18 à 25 ans, provenant de cinq universités [88], la prévalence des symptômes du CVS était de 89,9 %. Les étudiants qui utilisaient l’ordinateur plus de 2 heures par jour avaient statistiquement plus de symptômes de CVS (p=0,0001). Des résultats similaires ont été rapportés par Uchino et al. qui ont retrouvé dans une série de 561 utilisateurs d’écrans une prévalence de sécheresse oculaire de 76,5 % chez les femmes et de 60,2 % chez les hommes [87]. Les travailleurs de plus de 30 ans avaient un risque plus élevé de sécheresse oculaire (OR=2,22, IC 95 % = 1,06 à 4,66), de même que les travailleurs utilisant les écrans plus de 8 heures par jour (OR=1,94, IC 95 % = 1,22 à 3,9). Dans la série de Sa et al. réalisée chez 476 employés de deux centres d’appels à São Paulo [89], la prévalence du CVS était de 54,6 %. Les facteurs qui étaient associés au CVS étaient le sexe féminin (OR=2,6, IC 95 % = 1,6 à 4,1), le manque de reconnaissance au travail (OR=1,4, IC 95 % = 1,1 à 1,8), l’organisation du travail en centre d’appels (OR=1,4, IC 95 % = 1,1 à 1,7) et une forte charge de travail (OR=1,1, IC 95 % = 1,0 à 1,3).
Dans la série d’Izquierdo et al. [90], le facteur le plus important du CVS était l’angle de regard à l’écran d’ordinateur. Les symptômes du CVS étaient inférieurs quand le regard était dirigé vers le bas selon un angle égal ou supérieur à 14 degrés. Par ailleurs, Reddy et al. ont rapporté que le fait de faire des pauses pour regarder au loin était associé à une réduction significative des symptômes de CVS (p=0,0008) [88].
Au total, plusieurs éléments semblent favoriser le CVS et la sécheresse oculaire chez les travailleurs sur écran : une longue durée de travail sur écran sans faire de pause, un angle inadéquat entre les yeux et l’écran, et une courte distance entre les yeux et l’écran [87, 88, 90]. L’organisation du travail et les facteurs psychosociaux au travail semblent aussi être des éléments déterminants dans la survenue de symptômes de CVS [89]. La connaissance de tous ces facteurs est essentielle afin d’apporter des adaptations ergonomiques et organisationnelles pour réduire la morbidité de l’utilisation des écrans en milieu professionnel.
Le rôle des acides gras essentiels dans la sécheresse oculaire est solidement établi [11, 91, 92]. Cermak et al. ont rapporté que les femmes atteintes d’un syndrome de Gougerot-Sjögren (SGS) avaient un apport en acides gras oméga-3 significativement inférieur par rapport à des sujets témoins du même âge [91]. Dans une large série portant sur plus de 32 000 femmes, Miljanovic et al. ont démontré que la consommation de chaque gramme supplémentaire d’acides gras oméga-3 était associée à une réduction d’environ 30 % du risque de sécheresse oculaire [92]. Ainsi, les sujets qui consommaient plus de cinq portions de thon de 120 g chaque semaine présentaient une diminution du risque de sécheresse oculaire de plus de 60 %. Par ailleurs, l’apport en acides gras oméga-3 améliore le SGS [93, 94]. Plusieurs publications ont rapporté que la supplémentation en oméga-3 réduisait les concentrations des anticorps anti-ADN, diminuait la production de cytokines pro-inflammatoires, retardait l’apparition et diminuait la sévérité du SGS [93, 94]. D’après Sullivan et al., l’apport en oméga-3 est corrélé aux sécrétions de lipides polaires des glandes de Meibomius chez les femmes atteintes d’un SGS [95]. Par ailleurs, une consommation trop importante d’acides gras oméga-6 était associée à une augmentation statistiquement significative du risque de sécheresse oculaire [95].
La carence en vitamine A est un autre facteur de risque de la sécheresse oculaire bien identifié [96]. Cette carence peut aller d’une simple insuffisance d’apport jusqu’à la carence nutritionnelle liée à l’alcoolisme, la chirurgie de l’obésité, la malabsorption, aux troubles alimentaires et à l’alimentation végétalienne [96, 97].
Plusieurs médicaments systémiques peuvent entraîner, entretenir ou aggraver la sécheresse oculaire [11]. Parmi ces médicaments, on citera les antidépresseurs, les anticholinergiques, les antihistaminiques, les bêta-bloquants, les antispasmodiques, les diurétiques et l’isotrétinoïne connue sous le nom commercial de Ro-Accutane®.
Selon Schaumberg et al. [10], le traitement antidépresseur était significativement associé à une augmentation des symptômes de sécheresse oculaire (OR=1,90, IC 95 % = 1,39 à 2,61). Ces résultats rejoignent ceux de la Beaver Dam Eye Study qui a retrouvé une augmentation du risque relatif de symptômes de sécheresse oculaire au cours du traitement antidépresseur, après ajustement pour l’âge et le sexe (OR=1,42, IC 95 % = 1,08 à 1,88) [5].
Selon une étude randomisée comparant les effets de la loratadine et de la cétirizine sur la surface oculaire [98], 18 patients avaient été inclus en double insu. Le traitement par loratadine était associé à une augmentation de la kératite de 107 % et de la coloration conjonctivale de 133 %, ainsi qu’à une diminution du BUT (breack-up time) de 33,7 %. Le traitement par cétirizine était associé à une augmentation de la kératite de 60 % et de la coloration conjonctivale de 49,7 %. Le BUT était réduit de 19,6 %. La seule différence statistiquement significative entre les deux médicaments était que la loratadine provoquait 93 % de coloration conjonctivale de plus que la cétirizine. Les auteurs ont émis l’hypothèse que les antihistaminiques de deuxième génération tels que la cétirizine pénétraient moins dans les glandes lacrymales et les cellules caliciformes, réduisant ainsi les dommages de la surface oculaire documentés par la coloration conjonctivale.
Dans la série d’Altan-Yaycioglu et al. [99], les patients traités par anticholinergiques avaient des sensations de brûlures dans 42,9 à 58,3 % des cas, des sensations de corps étranger dans 21,4 à 25,0 % des cas, et des sensations de sécheresse oculaire dans 14,3 à 16,7 % des cas. En outre, les anticholinergiques étaient responsables de baisse significative du BUT de 10,83 secondes à 7,96 secondes (p=0,002).
Bien que le mécanisme d’action exact de l’isotrétinoïne ne soit pas clairement connu, celle-ci peut induire une sécheresse oculaire en provoquant une atrophie des glandes de Meibomius qui, à son tour, conduit à une diminution de la sécrétion lipidique, une déstabilisation du film lacrymal et une augmentation de l’évaporation des larmes [100]. Par ailleurs, Mathers et al. ont rapporté une augmentation significative de l’osmolarité lacrymale chez les patients traités par isotrétinoïne. Celle-ci est passée de 304,9 ± 11 mosmol/l à 316,3 ± 10 mosmol/l (p<0,005) [101].
Enfin, la radiothérapie et la chimiothérapie anticancéreuse sont d’autres causes iatrogènes de sécheresse oculaire [11]. Avec l’élargissement des indications de greffes de la moelle osseuse allogénique et l’augmentation du taux de survie, la sécheresse oculaire se voit de plus en plus chez les survivants comme l’une des manifestations de la maladie oculaire du greffon contre l’hôte [102, 103].
D’après plusieurs séries, le port de lentilles de contact peut être responsable de sécheresse oculaire [14, 104–106]. Les symptômes de sécheresse oculaire sont très fréquents chez les porteurs de lentilles de contact, avec 50 à 75 % d’entre eux qui rapportent des symptômes d’irritation oculaire [14, 104-106]. Ainsi, d’après ces estimations, 17 millions environ d’Américains souffriraient de sécheresse oculaire liée au port de lentilles de contact. D’après une analyse multivariée [107.], les facteurs associés à la sécheresse oculaire chez les porteurs de lentilles de contact sont : le sexe féminin (p=0,007), les lentilles avec une forte teneur en eau (p=0,002), l’utilisation fréquente de médicaments contre la douleur délivrés sans ordonnance (p=0,02), l’hyperhémie limbique (p=0,03), et l’augmentation de l’osmolarité du film lacrymal (p=0,05). La sécheresse oculaire est responsable d’inconfort, d’intolérance aux lentilles de contact. Elle est la cause la plus courante d’arrêt de port et d’insatisfaction chez les porteurs de lentilles de contact [108]. D’après Pritchard et al., 12 % des utilisateurs de lentilles de contact ont arrêté de les porter dans les 5 ans suivant la première utilisation, à cause des symptômes de sécheresse oculaire [109].
Il est actuellement établi que la chirurgie réfractive est une cause importante de sécheresse oculaire. Elle est due à la diminution de la sensibilité cornéenne et à celle des clignements (vidéo 3-1), qui sont elles-mêmes responsables d’insuffisance aqueuse [110]. Selon plusieurs auteurs, elle est aussi secondaire à la perte du soutien trophique sensoriel de la zone dénervée [110–112]. La prévalence de la sécheresse oculaire après Laser in situ keratomileusis (LASIK) varie selon les différentes séries de 0,25 % [111] à 48 % [112]. Ces écarts sont dus aux différences de définitions de la sécheresse oculaire, au type de chirurgie réfractive ainsi qu’aux différences de délais de réalisation des études après la chirurgie. La sécheresse oculaire après chirurgie réfractive est ainsi plus sévère et plus fréquente après LASIK qu’après photokératectomie réfractive (PKR) [11]. Cela s’explique par le fait que la réalisation de lambeau au cours du LASIK est responsable de résection plus étendue de nerfs cornéens par rapport à la PKR. C’est aussi pour cette raison que certaines techniques émergentes de chirurgie réfractives telles que le SMILE (small incision lenticule extraction ou ReLex®) seraient moins pourvoyeuses de sécheresse oculaire qu’au cours du LASIK (encadré 3-1) [113].
Le Laser in situ keratomileusis (LASIK) est actuellement la technique de référence en chirurgie réfractive. La sécheresse oculaire en reste la principale complication et la cause la plus fréquente d’insatisfaction pour les patients, alors même que le résultat réfractif est satisfaisant. Ainsi, la sécheresse oculaire après chirurgie réfractive entraîne une altération de la qualité visuelle et de la qualité de vie des patients pouvant à long terme avoir un impact négatif sur la vie sociale et professionnelle de cette population souvent jeune et active.
La section des nerfs cornéens sous-épithéliaux lors de la réalisation du capot de LASIK, ainsi que la photoablation stromale antérieure au laser excimer entraînent une altération majeure de l’innervation cornéenne qui serait la principale cause de sécheresse. Récemment, une technique innovante de chirurgie réfractive, le SMILE a été développée. Elle n’utilise qu’un laser femtoseconde qui découpe un lenticule intrastromal, lequel est alors retiré à travers une petite incision cornéenne (40° à 60°). En plus d’affranchir les patients des complications liées au capot (déplacements, décentrements, microplis, etc.), la procédure SMILE serait moins agressive sur la surface oculaire en préservant de fait la majorité de l’innervation cornéenne sous-épithéliale.
Une étude récente [114] ayant comparé 30 patients opérés avec la technique SMILE à 30 patients opérés par LASIK 6 mois après chirurgie a confirmé que la procédure SMILE diminuait sensiblement l’incidence de la sécheresse oculaire après chirurgie réfractive, améliorant ainsi la qualité de vie des patients. En résumé : (1) il existait plus de sécheresse oculaire après LASIK à 6 mois, conduisant à l’administration de substituts lacrymaux au long cours ; (2) l’altération des plexus nerveux sous-épithéliaux (densité, nombre de fibres, ramifications quantifiées par microscopie confocale in vivo) était significativement supérieure dans le groupe LASIK à 6 mois ; et (3) ces troubles chroniques de l’innervation cornéenne étaient corrélés à la diminution de la sensibilité cornéenne, à la dégradation de la qualité de vision perçue par le patient, ainsi qu’au test de Schirmer.
Par son caractère micro-invasif, la diminution de l’incidence des effets iatrogènes et l’absence d’utilisation d’un laser excimer, la procédure SMILE pourrait devenir une technique réfractive de référence. La difficulté d’évaluation de la sévérité de la sécheresse oculaire, l’absence de corrélations fortes entre signes et symptômes, et la complexité de la prise en charge des patients atteints de sécheresse constituent des enjeux majeurs encore aujourd’hui. En chirurgie réfractive, une meilleure évaluation de la pathologie iatrogène, le développement de nouvelles techniques ainsi qu’une meilleure compréhension des mécanismes pathogéniques qui sous-tendent cette sécheresse spécifique permettront à l’avenir de rompre avec la fatalité du syndrome sec post-LASIK.
La sécheresse oculaire après chirurgie réfractive aurait tendance à s’estomper avec le temps. De Paiva et al. [115] ont rapporté que la sécheresse oculaire était retrouvée chez 47 % des patients opérés de LASIK avec une charnière supérieure. Ce taux était descendu à 12,5 % à 6 mois post-LASIK. Ces résultats sont bien étayés par d’autres études en microscopie confocale in vivo qui ont permis de mettre en évidence des phénomènes de régénération des fibres nerveuses cornéennes.
La sévérité de la sécheresse oculaire après une chirurgie réfractive est liée à d’autres facteurs. Celle-ci est significativement proportionnellement associée à la myopie préopératoire et à la profondeur de la photoablation [115]. Certains auteurs ont rapporté un risque plus élevé de sécheresse oculaire chez les femmes que chez les hommes, et une prévalence plus élevée chez les personnes d’origine asiatique (28 %) que caucasienne (5 %) [116, 117]. Selon la série de Benitez-del-Castillo et al., la sécheresse oculaire préopératoire et le port de lentilles de contact à long terme étaient associés à une augmentation de la prévalence de la sécheresse oculaire post-LASIK (p<0,05) [118].
Vidéo 3-1 Syndrome sec après LASIK.
Il est actuellement largement admis que l’utilisation de collyres conservés au long cours est responsable d’altérations de la surface oculaire. En effet, le chlorure de benzalkonium, un ammonium quaternaire aux propriétés détergentes, pro-inflammatoires et cytotoxiques, est responsable d’une hyperévaporation lacrymale, d’une perte des cellules à mucus, ainsi que de phénomènes inflammatoires qui entraînent, aggravent ou entretiennent la sécheresse oculaire [119]. Ces phénomènes sont discutés plus en détail dans le paragraphe « Conservateurs et œil sec ».
La sécheresse oculaire est une pathologie fréquente. Elle a un retentissement important sur la qualité de vie et la productivité au travail ainsi que des coûts financiers directs et indirects élevés. D’après le rapport du DEWS [11], certains facteurs de risque de la sécheresse oculaire sont établis. Ce sont le sexe féminin, l’âge avancé, le traitement estrogénique postménopause [50], l’alimentation pauvre en acides gras essentiels oméga-3 ou riche en acides gras oméga [91, 92, 95], la carence en vitamine A [97, 98], la chirurgie réfractive [112–116], la radiothérapie [102], la greffe de moelle osseuse [11, 103] et certains médicaments dont les antihistaminiques [11, 98]. Les autres facteurs de risque sont plus controversés. Une meilleure connaissance de l’épidémiologie et des facteurs de risque de la sécheresse oculaire est nécessaire afin d’en améliorer la prise en charge.
[1] Lemp MA. Report of the National Eye Institute/Industry workshop on Clinical Trials in Dry Eyes. CLAO J 1995 ; 21 : 221-32.
[2] Schein OD, Hochberg MC, Munoz B, et al. Dry eye and dry mouth in the elderly : a population-based assessment. Arch Intern Med 1999 ; 159 : 1359-63.
[3] Schein OD, Munoz B, Tielsch JM, et al. Prevalence of dry eye among the elderly. Am J Ophthalmol 1997 ; 124 : 723-8.
[4] Munoz B, West SK, Rubin GS, et al. Causes of blindness and visual impairment in a population of older Americans : The Salisbury Eye Evaluation Study. Arch Ophthalmol 2000 ; 118 : 819-25.
[5] Moss SE, Klein R, Klein BE. Prevalence of and risk factors for dry eye syndrome. Arch Ophthalmol 2000 ; 118 : 1264-8.
[6] McCarty CA, Bansal AK, Livingston PM, et al. The epidemiology of dry eye in Melbourne, Australia. Ophthalmology 1998 ; 105 : 1114-9.
[7] Schaumberg DA, Sullivan DA, Buring JE, Dana MR. Prevalence of dry eye syndrome among US women. Am J Ophthalmol 2003 ; 136 : 318-26.
[8] Christen WG, Manson JE, Glynn RJ et al. Low-dose aspirin and risk of cataract and subtypes in a randomized trial of US physicians. Ophthalmic Epidemiol 1998 ; 5 : 133-42.
[9] Christen WG, Gaziano JM, Hennekens CH. Design of Physicians’ Health Study II - a randomized trial of beta-carotene, vitamins E and C, and multivitamins, in prevention of cancer, cardiovascular disease, and eye disease, and review of results of completed trials. Ann Epidemiol 2000 ; 10 : 125-34.
[10] Schaumberg DA, Dana R, Buring JE, Sullivan DA. Prevalence of dry eye disease among US men : estimates from the Physicians’ Health Studies. Arch Ophthalmol 2009 ; 127 : 763-8.
[11] (No authors listed). Epidemiology of dry eye : Report of the Epidemiology Subcommittee of the 2007 Dry Eye WorkShop (DEWS). Ocul Surf 2007 ; 5 : 93-107.
[12] Chia EM, Mitchell P, Rochtchina E, et al. Prevalence and associations of dry eye syndrome in an older population : the Blue Mountains Eye Study. Clin Experiment Ophthalmol 2003 ; 31 : 229-32.
[13] Lee AJ, Lee J, Saw SM et al. Prevalence and risk factors associated with dry eye symptoms : a population based study in Indonesia. Br J Ophthalmol 2002 ; 86 : 1347-51.
[14] Doughty MJ, Fonn D, Richter D, et al. A patient questionnaire approach to estimating the prevalence of dry eye symptoms in patients presenting to optometric practices across Canada. Optom Vis Sci 1997 ; 74 : 624-31.
[15] Uchino M, Schaumberg DA, Dogru M, et al. Prevalence of dry eye disease among Japanese visual display terminal users. Ophthalmology 2008 ; 115 : 1982-8.
[16] Uchino M, Nishiwaki Y, Michikawa T, et al. Prevalence and risk factors of dry eye disease in Japan : Koumi study. Ophthalmology 2011 ; 118 : 2361-7.
[17] Uchino M, Dogru M, Uchino Y, et al. Japan Ministry of Health study on prevalence of dry eye disease among Japanese high school students. Am J Ophthalmol 2008 ; 146 : 925-9.
[18] Uchino M, Yokoi N, Uchino Y, et al. Prevalence of dry eye disease and its risk factors in visual display terminal users : the Osaka study. Am J Ophthalmol 2013 ; 156 : 759-66.
[19] Van Landingham SW, West SK, Akpek EK, et al. Impact of dry eye on reading in a population based sample of the elderly : the Salisbury Eye Evaluation. Br J Ophthalmol 2013 Oct 11. doi :10.1136/bjophthalmol-2013-303518.
[20] Paulsen AJ, Cruickshanks KJ, Fischer ME, et al. Dry eye in the Beaver Dam Offspring Study : prevalence, risk factors, and health-related quality of life. Am J Ophthalmol 2014 ; 157 : 799-806.
[21] Lin PY, Tsai SY, Cheng CY, et al. Prevalence of dry eye among an elderly Chinese population in Taiwan : the Shihpai Eye Study. Ophthalmology 2003 ; 110 : 1096-1101.
[22] Guo B, Lu P, Chen X, et al. Prevalence of dry eye disease in Mongolians at high altitude in China : the Henan eye study. Ophthalmic Epidemiol 2010 ; 17 : 234-41.
[23] Zhang Y, Chen H, Wu X. Prevalence and risk factors associated with dry eye syndrome among senior high school students in a county of Shandong Province, China. Ophthalmic Epidemiol 2012 ; 19 : 226-30.
[24] Jie Y, Xu L, Wu YY, Jonas JB. Prevalence of dry eye among adult Chinese in the Beijing Eye Study. Eye 2009 ; 23 : 688-93.
[25] Basak SK, Pal PP, Basak S, et al. Prevalence of dry eye diseases in hospital-based population in West Bengal, Eastern India. J Indian Med Assoc 2012 ; 110 : 789-94.
[26] Rege A, Kulkarni V, Puthran N, Khandgave T. A clinical study of subtype-based prevalence of dry eye. J Clin Diagn Res 2013 ; 7 : 2207-10.
[27] Hashemi H, Khabazkhoob M, Kheirkhah A, et al. Prevalence of dry eye syndrome in an adult population. Clin Experiment Ophthalmol 2013 Aug 8. doi :10.1111/ceo.12183.
[28] Han SB, Hyon JY, Woo SJ, et al. Prevalence of dry eye disease in an elderly Korean population. Arch Ophthalmol 2011 ; 129 : 633-8.
[29] Bukhari A, Ajlan R, Alsaggaf H. Prevalence of dry eye in the normal population in Jeddah, Saudi Arabia. Orbit 2009 ; 28 : 392-7.
[30] Lekhanont K, Rojanaporn D, Chuck RS, Vongthongsri A. Prevalence of dry eye in Bangkok, Thailand. Cornea 2006 ; 25 : 1162-7.
[31] Onwubiko SN, Eze BI, Udeh NN, et al. Dry eye disease : Prevalence, distribution and determinants in a hospital-based population. Cont Lens Anterior Eye 2013 Oct 11. pii : S1367-0484(13)00279-8. doi : 10.1016/j.clae.2013.09.009. [Epub ahead of print]
[32] Viso E, Rodriguez-Ares MT, Gude F. Prevalence of and associated factors for dry eye in a Spanish adult population (the Salnes Eye Study). Ophthalmic Epidemiol 2009 ; 16 : 15-21.
[33] Malet F, Le Goff M, Colin J, et al. Dry eye disease in French elderly subjects : the Alienor Study. Acta Ophthalmol 2013 Jun 7. doi :10.1111/aos.12174. [Epub ahead of print]
[34] Bjerrum KB. Keratoconjunctivitis sicca and primary Sjögren’s syndrome in a Danish population aged 30-60 years. Acta Ophthalmol Scand 1997 ; 75 : 281-6.
[35] McMonnies CW. Key questions in a dry eye history. J Am Optometric Assn 1986 ; 57 : 512-7.
[36] Manthorpe R, Andersen V, Jensen OA, et al. Editorial comments to the four sets of criteria for Sjögren’s syndrome. Scand J Rheumatol Suppl 1986 ; 61 : 31-5.
[37] Vitali C, Bombardieri S, Moutsopoulos HM, et al. Preliminary criteria for the classification of Sjögren’s syndrome. Results of a prospective concerted action supported by the European community. Arthritis Rheum 1993 ; 36 : 340-7.
[38] Ellwein LB, Urato CJ. Use of eye care and associated charges among the Medicare population : 1991-1998. Arch Ophthalmol 2002 ; 120 : 804-11.
[39] Wade PD, Iwuora AN, Lopez L, Muhammad MA. Allergic conjunctivitis at Sheikh Zayed regional eye care center, Gambia. J Ophthalmic Vis Res 2012 ; 7 : 24-8.
[40] Miljanovic B, Dana R, Sullivan DA, Schaumberg DA. Impact of dry eye syndrome on vision-related quality of life. Am J Ophthalmol 2007 ; 143 : 409-15.
[41] Mertzanis P, Abetz L, Rajagopalan K, et al. The relative burden of dry eye in patients’ lives : comparisons to a US normative sample. Invest Ophthalmol Vis Sci 2005 ; 46 : 46-50.
[42] Clegg JP, Guest JF, Lehman A, Smith AF. The annual cost of dry eye syndrome in France, Germany, Italy, Spain, Sweden and the United Kingdom among patients managed by ophthalmologists. Ophthalmic Epidemiol 2006 ; 13 : 263-74.
[43] Pflugfelder SC. Prevalence, burden, and pharmacoeconomics of dry eye disease. Am J Manag Care 2008 ; 14(3 Suppl) : S102-6.
[44] Yu J, Asche CV, Fairchild CJ. The economic burden of dry eye disease in the United States : a decision tree analysis. Cornea 2011 ; 30 : 379-87.
[45] Mizuno Y, Yamada M, Shigeyasu C. Annual direct cost of dry eye in Japan. Clin Ophthalmol 2012 ; 6 : 755-60.
[46] Reddy P, Grad O, Rajagopalan K. The economic burden of dry eye : a conceptual framework and preliminary assessment. Cornea 2004 ; 23 : 751-61.
[47] Yamada M, Mizuno Y, Shigeyasu C. Impact of dry eye on work productivity. Clinicoecon Outcomes Res 2012 ; 4 : 307-12.
[48] Reilly MC, Zbrozek AS, Dukes EM. The validity and reproducibility of a work productivity and activity impairment instrument. Pharmacoeconomics 1993 ; 4 : 353-65.
[49] Sullivan BD, Evans JE, Dana MR, Sullivan DA. Influence of aging on the polar and neutral lipid profiles in human meibomian gland secretions. Arch Ophthalmol 2006 ; 124 : 1286-92.
[50] Schaumberg DA, Buring JE, Sullivan DA, Dana MR. Hormone replacement therapy and dry eye syndrome. JAMA 2001 ; 286 : 2114-9.
[51] Brennan MT, Sankar V, Leakan RA, et al. Sex steroid hormones in primary Sjogren’s syndrome. J Rheumatol 2003 ; 30 : 1267-71.
[52] Schechter JE, Pidgeon M, Chang D, et al. Potential role of disrupted lacrimal acinar cells in dry eye during pregnancy. Adv Exp Med Biol 2002 ; 506 : 153-7.
[53] Jensen JL, Bergem HO, Gilboe IM, et al. Oral and ocular sicca symptoms and findings are prevalent in systemic lupus erythematosus. J Oral Pathol Med 1999 ; 28 : 317-22.
[54] Türkyilmaz K, Türkyilmaz AK, Kurt EE, et al. Dry eye in patients with fibromyalgia and its relevance to functional and emotional status. Cornea 2013 ; 32 : 862-6.
[55] Kotaniemi KM, Salomaa PM, Sihto-Kauppi K, et al. An evaluation of dry eye symptoms and signs in a cohort of children with juvenile idiopathic arthritis. Clin Ophthalmol 2009 ; 3 : 271-5.
[56] Kaiserman IN, Kaiserman N, Nakar S, Vinker S. Dry eye in diabetic patients. Am J Ophthalmol 2005 ; 139 : 498-503.
[57] Chronister CL. Review of external ocular disease associated with aids and HIV infection. Optom Vis Sci 1996 ; 73 : 225-30.
[58] Merle HD, Smadja D, Le Hoang P, et al. Ocular manifestations in patients with HTLV-I associated infection - a clinical study of 93 cases. Jpn J Ophthalmol 1996 ; 40 : 260-70.
[59] Ismailova DS, Fedorov AA, Grusha YO. Ocular surface changes in thyroid eye disease. Orbit 2013 ; 32 : 87-90.
[60] Labbé A, Wang YX, Jie Y, et al. Dry eye disease, dry eye symptoms and depression : the Beijing Eye Study. Br J Ophthalmol 2013 ; 97 : 1399-403.
[61] Stevenson HA, Jones ME, Rostron JL, et al. UK patients with primary Sjogren’s syndrome are at increased risk from clinical depression. Gerodontology 2004 ; 21 : 141-5.
[62] Valtysdottir ST, Gudbjornsson B, Lindtqvist U, et al. Anxiety and depression in patients with primary Sjogren’s syndrome. J Rheumatol 2000 ; 27 : 165-9.
[63] Schlote T, Kadner G, Freudenthaler N. Marked reduction and distinct patterns of eye blinking in patients with moderately dry eyes during video display terminal use. Graefe’s Arch Clin Exp Ophthalmol 2004 ; 242 : 306-12.
[64] (No authors listed). The definition and classification of dry eye disease : Report of the Definition and Classification Subcommittee of the International Dry Eye Workshop (2007). Ocul Surf 2007 ; 5 : 75-92.
[65] Kim TH, Moon NJ. Clinical correlations of dry eye syndrome and allergic conjunctivitis in Korean children. J Pediatr Ophthalmol Strabismus 2013 ; 50 : 124-7.
[66] Heyworth P, Morlet N, Rayner S, et al. Natural history of recurrent erosion syndrome - a 4 year review of 117 patients. Br J Ophthalmol 1998 ; 82 : 26-8.
[67] Yokoi N, Komuro A, Nishii M, et al. Clinical impact of conjunctivochalasis on the ocular surface. Cornea 2005 ; 24 : S24-31.
[68] Julio G, Lluch S, Pujol P, et al. Tear osmolarity and ocular changes in pterygium. Cornea 2012 ; 31 : 1417-21.
[69] Guzey M, Karaman SK, Satici A, et al. Efficacy of topical cyclosporine A in the treatment of severe trachomatous dry eye. Clin Experiment Ophthalmol 2009 ; 37 : 541-9.
[70] Damasceno RW, Osaki MH, Dantas PE, Belfort R Jr. Involutional entropion and ectropion of the lower eyelid : prevalence and associated risk factors in the elderly population. Ophthal Plast Reconstr Surg 2011 ; 27 : 317-20.
[71] Lu R, Huang R, Li K, et al. The influence of benign essential blepharospasm on dry eye disease and ocular inflammation. Am J Ophthalmol 2014 ; 157 : 591-7.
[72] Mastrota KM. Impact of floppy eyelid syndrome in ocular surface and dry eye disease. Optom Vis Sci 2008 ; 85 : 814-6.
[73] Kirkwood BJ, Kirkwood RA. Trichiasis : characteristics and management options. Insight 2011 ; 36 : 5-9.
[74] Simard-Lebrun A, Boisjoly H, Al-Saadi A, et al. Association between unilateral quiescent stromal herpetic keratitis and bilateral dry eyes. Cornea 2010 ; 29 : 1291-5.
[75] Lindgren T, Andersson K, Dammstrom BG, Norback D. Ocular, nasal, dermal and general symptoms among commercial airline crews. Int Arch Occup Environ Health 2002 ; 75 : 475-83.
[76] Skyberg K, Skulberg KR, Eduard W, et al. Symptoms prevalence among office employees and associations to building characteristics. Indoor Air 2003 ; 13 : 246-52.
[77] McCulley JP, Aronowicz JD, Uchiyama E, et al. Correlations in a change in aqueous tear evaporation with a change in relative humidity and the impact. Am J Ophthalmol 2006 ; 141 : 758-60.
[78] Ward SK, Dogru M, Wakamatsu T, et al. Passive cigarette smoke exposure and soft contact lens wear. Optom Vis Sci 2010 ; 87 : 367-72.
[79] Backman H, Haghighat F. Indoor-air quality and ocular discomfort. J Am Optom Assoc 1999, 70 : 309-316.
[80] Muzi G, Abbritti G, Accattoli MP, Dell’Omo M. Prevalence of irritative symptoms in a nonproblem air-conditioned office building. Int Arch Occup Environ Health 1998 ; 71 : 372-8.
[81] Bakke JV, Wieslander G, Norbäck D, Moen BE. Atopy, symptoms and indoor environmental perceptions, tear film stability, nasal patency and lavage biomarkers in university staff. Int Arch Occup Environ Health 2008 ; 81 : 861-72.
[82] Rios JL, Boechat JL, Gioda A, et al. Symptoms prevalence among office workers of a sealed versus a non-sealed building : associations to indoor air quality. Environ Int 2009 ; 35 : 1136-41.
[83] Nakaishi H, Yamada Y. Abnormal tear dynamics and symptoms of eyestrain in operators of visual display terminals. Occup Environ Med 1999 ; 56 : 6-9.
[84] Cardona G, García C, Serés C, et al. Blink rate, blink amplitude, and tear film integrity during dynamic visual display terminal tasks. Curr Eye Res 2011 ; 36 : 190-7.
[85] Blehm CS, Vishnu S, Khattak A, et al. Computer vision syndrome : a review. Surv Ophthalmol 2005 ; 50 : 253-62.
[86] Moon JH, Lee MY, Moon NJ. Association between video display terminal use and dry eye disease in school children. J Pediatr Ophthalmol Strabismus 2014 ; 51 : 87-92.
[87] Uchino M, Schaumberg DA, Dogru M, et al. Prevalence of dry eye disease among Japanese visual display terminal users. Ophthalmology 2008 ; 115 : 1982-8.
[88] Reddy SC, Low CK, Lim YP, et al. Computer vision syndrome : a study of knowledge and practices in university students. Nepal J Ophthalmol 2013 ; 5 : 161-8.
[89] Sa EC, Ferreira Junior M, Rocha LE. Risk factors for computer visual syndrome (CVS) among operators of two call centers in São Paulo, Brazil. Work 2012 ; 41 Suppl 1 : 3568-74.
[90] Izquierdo JC, García M, Buxó C, Izquierdo NJ. Factors leading to the computer vision syndrome : an issue at the contemporary workplace. Bol Asoc Med PR 2007 ; 99 : 21-8.
[91] Cermak JM, Papas AS, Sullivan RM, et al. Nutrient intake in women with primary and secondary Sjogren’s syndrome. Eur J Clin Nutr 2003 ; 57 : 328-34.
[92] Miljanovic B, Trivedi KA, Dana MR, et al. Relation between dietary n-3 and n-6 fatty acids and clinically diagnosed dry eye syndrome in women. Am J Clin Nutr 2005 ; 82 : 887-93.
[93] Calder PC. n-3 polyunsaturated fatty acids and cytokine production in health and disease. Ann Nutr Metab 1997 ; 41 : 203-34.
[94] Alexander JW. Immunonutrition : the role of omega-3 fatty acids. Nutrition 1998 ; 14 : 627-33.
[95] Sullivan RM, Cermak JM, Papas AS et al. Economic and quality of life impact of dry eye symptoms in women with Sjogren’s syndrome. Adv Exp Med Biol 2002 ; 506 : 1183-8.
[96] Sommer A. Vitamin A deficiency and the global response. Forum Nutr 2003 ; 56 : 33-5.
[97] Colev MH, Engel H, Mayers M, et al. Vegan diet and vitamin A deficiency. Clin Pediatr 2004 ; 43 : 107-9.
[98] Ousler GW, Wilcox KA, Gupta G, Abelson MB. An evaluation of the ocular drying effects of 2 systemic antihistamines : loratadine and cetirizine hydrochloride. Ann Allergy Asthma Immunol 2004 ; 93 : 460-4.
[99] Altan-Yaycioglu R, Yaycioglu O, Aydin Akova Y, et al. Ocular side-effects of tolterodine and oxybutynin, a single-blind prospective randomized trial. Br J Clin Pharmacol 2005 ; 59 : 588-92.
[100] Caffery BE, Josephson JE. Ocular side effects of isotretinoin therapy. J Am Optom Assoc 1988 ; 59 : 221-4.
[101] Mathers WD, Shields WJ, Sachdev MS, et al. Meibomian gland morphology and tear osmolarity : changes with Accutane therapy. Cornea 1991 ; 10 : 286-90.
[102] Thomas O, Mahe M, Campion L, et al. Long-term complications of total body irradiation in adults. Int J Radiat Oncol Biol Phys 2001 ; 49 : 125-31.
[103] Ogawa Y, Kuwana M. Dry eye as a major complication associated with chronic graft-versus-host disease after hematopoietic stem cell transplantation. Cornea 2003 ; 22 : S19-27.
[104] Brennan NA, Efron N. Symptomatology of HEMA contact lens wear. Optom Vis Sci 1989 ; 66 : 834-8.
[105] Vajdic C, Holden BA, Sweeney DF, Cornish RM. The frequency of ocular symptoms during spectacle and daily soft and rigid contact lens wear. Optom Vis Sci 1999 ; 76 : 705-11.
[106] Begley CG, Caffery B, Nichols KK, Chalmers R. Responses of contact lens wearers to a dry eye survey. Optom Vis Sci 2000 ; 77 : 40-6.
[107] Nichols J J, Sinnott LT. Tear film, contact lens, and patient-related factors associated with contact lens-related dry eye. Invest Ophthalmol Vis Sci 2006 ; 47 : 1319-28.
[108] Richdale K, Sinnott LT, Skadahl E, Nichols JJ. Frequency of and factors associated with contact lens dissatisfaction and discontinuation. Cornea 2007 ; 26 : 168-74.
[109] Pritchard N, Fonn D, Brazeau D. Discontinuation of contact lens wear : a survey. Int Contact Lens Clin 1999 ; 26 : 157-62.
[110] Toda I, Asano-Kato N, Komai-Hori Y, Tsubota K. Dry eye after laser in situ keratomileusis. Am J Ophthalmol 2001 ; 132 : 1-7.
[111] Hammond MD, Madigan WP JR, Bower KS. Refractive surgery in the United States Army, 2000-2003. Ophthalmology 2005 ; 112 : 184-90.
[112] Hovanesian JA, Shah SS, Maloney RK. Symptoms of dry eye and recurrent erosion syndrome after refractive surgery. J Cataract Refract Surg 2001 ; 27 : 577-84.
[113] Li M, Zhao J, Shen Y, et al. Comparison of dry eye and corneal sensitivity between small incision lenticule extraction and femtosecond LASIK for myopia. PLoS One 2013 ; 8 : e77797.
[114] Denoyer A, Landman E, Trinh L, et al. Dry eye disease after refractive surgery : comparative outcomes of small incision lenticule extraction (SMILE) versus LASIK. Ophthalmology, sous presse.
[115] De Paiva CS, Chen Z, Koch DD, et al. The incidence and risk factors for developing dry eye after myopic LASIK. Am J Ophthalmol 2006 ; 141 : 438-45.
[116] Albietz JM, Lenton LN, McLennan SB. Chronic dry eye and regression after laser in situ keratomileusis for myopia. J Cataract Refract Surg 2004 ; 30 : 675-84.
[117] Albietz JM, Lenton LM, McLennan SG. Dry eye after LASIK : comparison of outcomes for Asian and Caucasian eyes. Clin Exp Optom 2005 ; 88 : 89-96.
[118] Benitez-Del-Castillo JM, Del Rio T, Iradier T, et al. Decrease in tear secretion and corneal sensitivity after laser in situ keratomileusis. Cornea 2001 ; 20 : 30-2.
[119] Baudouin C, Labbé A, Liang H, et al. Preservatives in eyedrops : the good, the bad and the ugly. Prog Retin Eye Res 2010 ; 29 : 312-34.
C. Baudouin
De nouvelles définitions de la sécheresse oculaire permettent d’appréhender plus facilement les mécanismes de cette complexe maladie, en introduisant les notions d’atteintes tissulaire et visuelle, d’inflammation et d’hyperosmolarité.
L’œil sec fonctionne comme un véritable cercle vicieux biologique auto-entretenu dans lequel les malades glissent progressivement ou parfois brutalement sous l’effet d’une maladie autonome ou d’une accumulation de facteurs de risque.
Une fois le cycle enclenché, la sécheresse peut s’autonomiser par rapport à sa cause, et il devient très difficile de bloquer les mécanismes qui entretiennent la kératite et l’inflammation chronique de la surface oculaire.
Les syndromes secs oculaires constituent, avec la cataracte et la dégénérescence maculaire liée à l’âge, la principale pathologie ophtalmologique du sujet âgé. On considère que 15 à 25 % de la population de plus de 65 ans se traitent de manière régulière par substituts lacrymaux. La plupart ne souffre que d’irritations et d’inconfort chroniques mais l’impact sur la qualité de vie est souvent très important. On ignore en outre trop souvent l’énorme impact psychologique d’une souffrance chronique qui, même si elle n’est pas intense, peut à la longue finir par entraîner de véritables dépressions. Bien entendu, en retour, un état dépressif ne peut que majorer le poids et l’intensité d’une douleur chronique voire nécessiter des traitements antidépresseurs, sources de sécheresse oculaire. On conçoit bien comment un cercle vicieux peut s’instaurer dans une pathologie pourtant apparemment très bénigne. Les sécheresses oculaires peuvent cependant avoir un impact bien plus important lorsqu’elles s’associent à une kératite qui peut, outre la douleur et l’inflammation générées par la maladie, avoir un véritable retentissement visuel [1].
Si la thérapeutique reste bien souvent décevante, la compréhension du mécanisme conduisant à une sécheresse oculaire chronique est également encore pleine de mystères. Or, comprendre comment et pourquoi se développe une atteinte chronique du film lacrymal pouvant aller jusqu’à une sécheresse sévère avec kératite est une base fondamentale pour tenter de soulager efficacement les patients.
La classification étiologique des syndromes secs, publiée en 1995 [2] et reprise en 2007 [3], propose différents types étiologiques avec une multitude de maladies pouvant entraîner des syndromes secs oculaires. Pourtant, on voit mal comment toutes ces maladies peuvent conduire à un mécanisme apparemment assez commun et il reste un certain nombre d’interrogations auxquelles les classifications actuelles répondent mal. En effet, comment comprendre qu’un syndrome sec se déclenche dans les suites d’une conjonctivite virale et persiste plusieurs années après alors que, bien évidemment, il n’y a plus de virus ? De la même manière, comment comprendre pourquoi certains patients se plaignent si fortement des suites d’une intervention chirurgicale (cataracte ou chirurgie réfractive) pourtant parfaitement menée alors même qu’ils ont des signes de sécheresse sur le côté qui n’a pas été touché ? Pourquoi certains porteurs de lentilles, alors qu’ils ont renoncé au port de lentilles du fait d’une sécheresse, continuent-ils à souffrir ? Est-ce la sécheresse qui a rendu les lentilles insupportables ou est-ce le port de lentilles au long cours qui a fini par modifier le film lacrymal au point que même la suppression du facteur causal n’améliore pas le patient ? Nous décrivons ici les classifications et définitions classiques, mais également un nouveau schéma physiologique destiné à tenter de répondre à ces interrogations grâce à une approche mécanistique et non plus étiologique. Le but de cette nouvelle classification est de compléter la classification étiologique classique en lui apportant une conception mécanistique qui permet d’éclairer sous un nouveau jour la complexe physiopathologie des syndromes secs oculaires.
La définition et la classification faisant référence jusqu’à récemment ont été publiées en 1995 par Lemp et al. [2] à la suite d’un workshop constitué d’experts internationaux ayant pour but de classifier les différents types de sécheresse oculaire. La définition était la suivante : « L’œil sec est un désordre du film lacrymal dû à un déficit en larmes ou à une évaporation excessive, entraînant une atteinte de la surface oculaire dans la fente palpébrale et s’associant à des symptômes d’inconfort oculaire1 » [2].
Cette définition, tout en mettant l’accent sur des mécanismes généraux, donnait un caractère trop bénin à cette affection et ne tenait pas compte des nouvelles découvertes physiopathologiques, en particulier sur le rôle central de l’inflammation de la surface oculaire.
Un nouveau workshop international a donc travaillé entre 2004 et 2006 et publié ses conclusions en 2007 [3]. Une nouvelle définition a été validée, plus adaptée à la gravité réelle de la maladie et à ses mécanismes biologiques. « L’œil sec est une maladie multifactorielle des larmes et de la surface oculaire, entraînant des symptômes d’inconfort, une gêne visuelle et une instabilité lacrymale, avec un risque d’atteinte de la surface oculaire. Il s’accompagne d’une augmentation de l’osmolarité du film lacrymal et d’une inflammation de l’unité fonctionnelle que constitue la surface oculaire1 » [3].
Les éléments principaux qui apparaissent dans cette définition sont les notions de maladie, d’atteinte visuelle et le rôle central de l’inflammation, qui constitue désormais une cible thérapeutique importante.
La classification étiologique de Lemp de 1995, quant à elle, a été reprise dans le Dry Eye Workshop de 2007. Elle différencie globalement les syndromes secs par hyposécrétion, comme le syndrome de Gougerot-Sjögren, des syndromes secs par instabilité du film lacrymal. Cette instabilité du film lacrymal, quel qu’en soit le mécanisme, contribue à entraîner une hyperévaporation des larmes [4].
Ces deux grandes catégories rendent compte des syndromes secs quantitatifs et qualitatifs, certainement encore plus fréquents que les premiers. Dans cette catégorie d’instabilité lacrymale, peuvent être retrouvés les allergies chroniques, les blépharites, les dysfonctionnements meibomiens, la rosacée, les facteurs environnementaux, le port de lentilles de contact ou les traitements locaux chroniques [5–8].
On pourrait ajouter, même si elle n’avait pas été prévue initialement, une catégorie d’événements aigus comme les conjonctivites virales, une intervention chirurgicale, l’utilisation à forte dose de collyres irritants ou même toxiques, des phénomènes allergiques aigus qui entraînent un stress inflammatoire de la surface oculaire et seront suivis des mois ou des années après de phénomènes lacrymaux, hyposécrétion ou instabilité lacrymale chronique, déconnectée, au moins dans le temps, du facteur causal identifié.
Cette classification a le mérite de mettre l’accent sur l’importance de l’instabilité lacrymale et donc du phénomène qualitatif, mais elle n’explique en aucun cas comment des maladies aussi disparates peuvent entraîner des phénomènes voisins pour ne pas dire communs. Elle ne rend pas compte non plus de la déconnexion apparente entre un facteur initial et une série de facteurs répétés mais éventuellement supprimés lors de la découverte et du traitement de la maladie.
La figure 3-1 reproduit les différentes étiologies connues pour entraîner des syndromes secs en différenciant l’hyposécrétion, l’instabilité chronique du film lacrymal et les phénomènes inflammatoires aigus qui peuvent être suivis de syndrome sec prolongé.
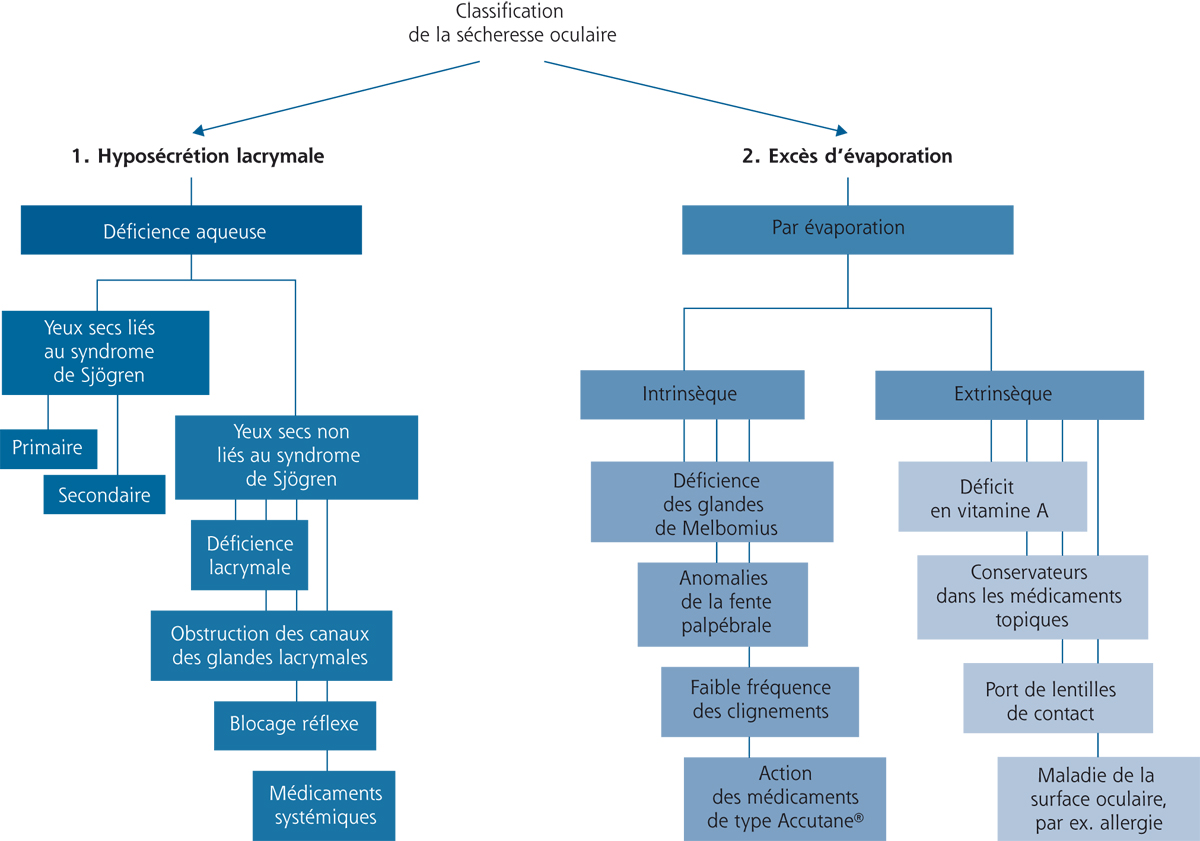
Fig. 3-1 Différentes catégories étiologiques de syndromes secs : classification inspirée de celle de Lemp et al. [2].
La littérature est riche, depuis plusieurs années, d’études réalisées in vitro sur des modèles expérimentaux ou chez l’homme s’intéressant aux médiateurs impliqués dans les sécheresses oculaires [10–12]. Les principaux éléments retrouvés se regroupent en quelques catégories dans lesquelles on peut évoquer l’hyperosmolarité du film lacrymal [13], l’apoptose des cellules de la surface oculaire [14, 15], la stimulation nerveuse responsable d’une inflammation [16] et surtout l’activation de médiateurs inflammatoires à tous les niveaux de la surface oculaire [12, 17, 18].
La figure 3-2 essaie de réunir dans un concept uniciste les liens qui peuvent exister entre ces différents phénomènes apparemment disparates. Si l’on repart du concept initial d’instabilité lacrymale ou d’hyposécrétion, on se rend compte que l’un comme l’autre vont entraîner une hyperosmolarité lacrymale et probablement cellulaire en regard des zones non protégées par un film lacrymal normal.
Cette hyperosmolarité est responsable dans un premier temps d’une souffrance cellulaire qui, au niveau de la cornée, peut favoriser une kératite mais, au minimum, entraîne des séries de décharges nerveuses envoyant dans le cerveau des signaux d’alerte en raison de la souffrance tissulaire induite.
Au niveau conjonctival, une souffrance cellulaire est responsable d’une apoptose accrue s’exerçant sur les cellules conjonctivales, mais également sur une structure particulièrement fragile de la conjonctive, les mucocytes, dont la destruction est le signe cytologique le plus caractéristique des syndromes secs [6, 11]. La stimulation nerveuse, induite par cette atteinte de la surface oculaire, va stimuler une boucle normale destinée à augmenter la sécrétion lacrymale et à activer par les terminaisons nerveuses conjonctivales et cornéennes la sécrétion de mucus et l’excitation des systèmes défensifs locaux. Mais, sur une surface oculaire pathologique et/ou une des glandes lacrymales pathologiques, cette stimulation nerveuse peut entraîner un effet d’épuisement ou une surstimulation aboutissant à un larmoiement paradoxal. Dans tous les cas, elle finit par aboutir à une inflammation locale appelée inflammation neurogène [16]. Celle-ci, même si on manque encore d’éléments pour en comprendre tous les mécanismes, a bien été identifiée dans les sécheresses oculaires et dans toutes les pathologies chroniques de la surface oculaire [5, 18–20].
L’inflammation induite par l’environnement et par la stimulation neuronale devenue progressivement excessive et inefficace conduit à la libération de cytokines pro-inflammatoires, TNF-α (tumor necrosis factor alpha), interleukines, interféron gamma [12], à l’expression anormale d’antigènes de classe II et de cytokines du système lymphocytaire TH1 [9, 17], ainsi qu’à l’activation de métalloprotéinases [10, 21], qui, elles-mêmes, transforment des précurseurs inactifs des cytokines inflammatoires en leurs formes activées, l’ensemble déclenchant une réaction inflammatoire en chaîne, elle-même cytotoxique pour la surface oculaire et notamment pour les cellules à mucus. On boucle enfin la boucle en montrant comment une instabilité lacrymale ou une hyposécrétion, par le biais de ces réactions en chaîne, aboutit à une destruction des mucocytes, elle-même responsable d’une instabilité supplémentaire du film lacrymal.
Une deuxième boucle, issue d’une instabilité lacrymale, peut également intervenir et rend compte de l’importance des paupières et du système lipidique (fig. 3-3). En effet, un film lacrymal instable ou insuffisant peut modifier la flore microbienne au niveau de la conjonctive mais aussi des paupières, flore qui va de son côté libérer des lipases et des toxines bactériennes issues de bactéries à Gram positif ou à Gram négatif, s’associant à une inflammation palpébrale et meibomienne, et entraînant des modifications de la composition lipidique qui aboutissent à leur tour à une instabilité lacrymale supplémentaire [3, 22, 23].
La figure 3-4 reprend tous ces éléments et montre comment ce système biologique se comporte comme un véritable cercle vicieux, une sorte d’engrenage qui, lorsque l’œil entre dans le système, n’a aucun moyen spontané d’en sortir. Elle permet également de comprendre pourquoi le système pathologique, lorsqu’il s’emballe, peut parfaitement se déconnecter de la cause initiale.
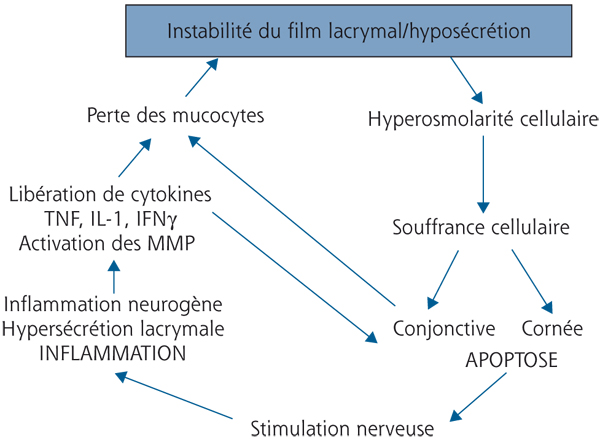
Fig. 3-2 Boucle physiopathologique faisant interagir l’instabilité lacrymale, les phénomènes inflammatoires, neurogènes et apoptotiques, conduisant à un cercle vicieux.
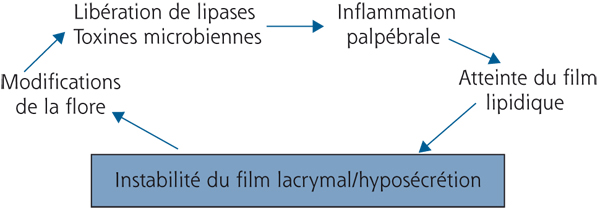
Fig. 3-3 Deuxième boucle d’autostimulation faisant intervenir l’inflammation palpébrale et le dysfonctionnement meibomien.

Fig. 3-4 Les cercles vicieux des syndromes secs oculaires.
La figure 3-5 a pour but de réunir les deux classifications. Elle permet d’associer les étiologies déjà identifiées dans la classification classique et la figure 3-1, en présentant les étiologies comme des moyens d’entrée dans l’engrenage et non plus comme des maladies autonomes. Cette compréhension permet de montrer que l’atteinte du film lacrymal, lorsqu’elle s’autonomise, n’a plus obligatoirement besoin d’être alimentée par sa cause initiale. Bien entendu, celle-ci peut être unique ou due à l’accumulation de phénomènes plus mineurs qui, additionnés les uns aux autres, vont faire rentrer l’œil dans son cercle vicieux.
Une maladie comme le syndrome de Gougerot-Sjögren a tous les éléments, à lui seul, pour expliquer l’entrée directe dans ce système infernal : glandes lacrymales pathologiques entraînant une hyposécrétion, inflammation responsable d’une destruction des mucocytes, mais également modification des paupières entraînant une instabilité lacrymale supplémentaire.
Dans d’autres cas, un phénomène aigu va transformer un état inflammatoire latent et fragilisé en une véritable souffrance chronique, elle-même autonomisée et indépendante du facteur initial. Parfois, il existe un terrain, type ménopause ou blépharite séborrhéique, sur lequel des agressions répétées (allergiques, toxiques, utilisation de conservateurs au long cours, lentilles de contact, etc.), éventuellement dans un contexte environnemental particulièrement agressif, vont elles-mêmes contribuer, par un effet cumulé, à créer une maladie dont les symptômes sont souvent largement aussi sévères que ceux d’affections bien plus graves au départ.
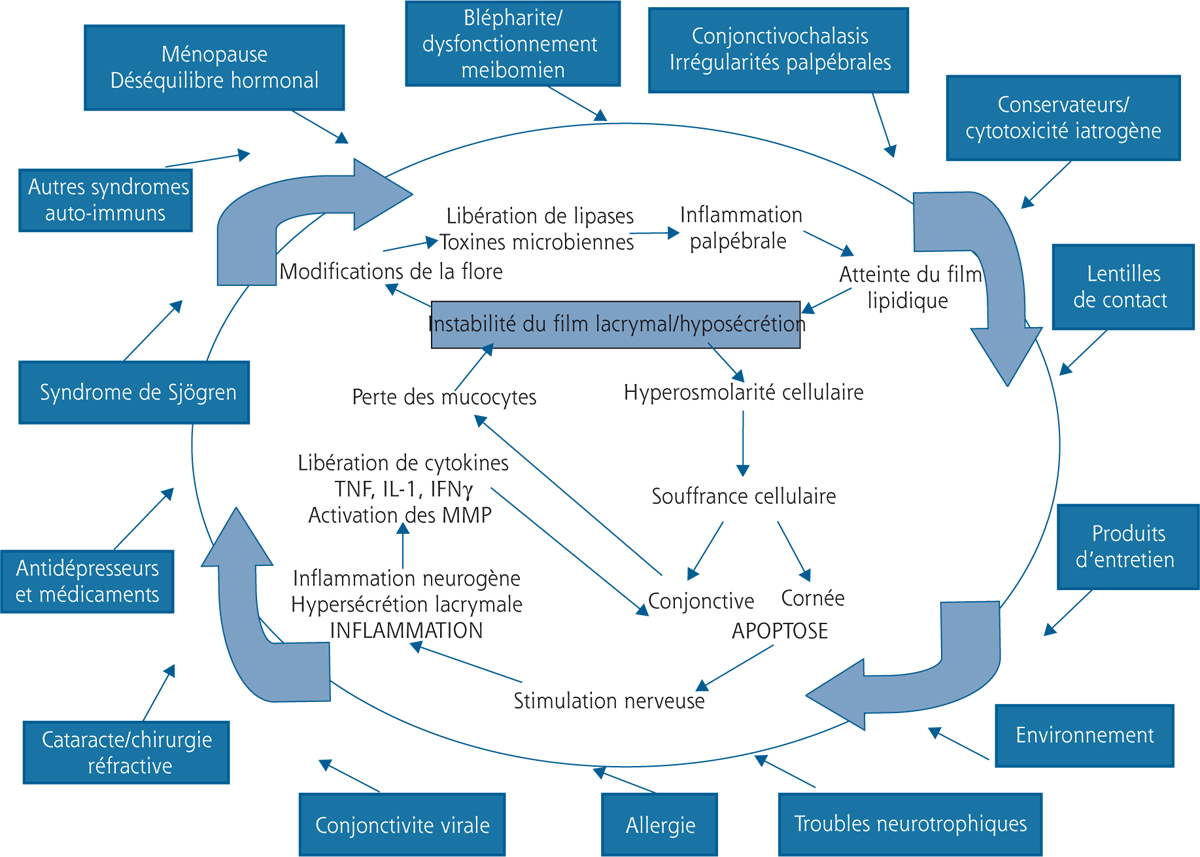
Fig. 3-5 Réunion des cercles vicieux et des étiologies qui deviennent dès lors des modes d’entrée dans une maladie autonome de la surface oculaire et non plus des maladies indépendantes.
À quoi peut servir ce type d’approche mécanistique des maladies de la surface oculaire ? Continuer à voir les sécheresses oculaires comme une maladie univoque liée à des étiologies extrêmement disparates est trop réducteur pour assurer une efficacité réelle à la prise en charge des malades qui en souffrent.
Tous les « yeux qui piquent » ne sont pas secs, tous les « yeux qui grattent » ne sont pas allergiques. Si l’on ne tente pas de comprendre précisément les mécanismes non seulement originaux, mais également ceux qui entretiennent le phénomène de souffrance de la surface oculaire et du film lacrymal, aucun traitement efficace ne pourra être trouvé. S’il existait un collyre capable de régler tous ces problèmes en lubrifiant simplement la surface oculaire, la communauté ophtalmologique le connaîtrait et les patients ne viendraient plus se plaindre si fréquemment de l’insuffisance de leur traitement. Si tous les « yeux qui grattent » étaient liés à une décharge mastocytaire dans un contexte pur, les traitements antihistaminiques désormais à notre disposition résoudraient tous les problèmes, ce qui est loin d’être le cas et, bien entendu, il n’existe aucun collyre capable de soigner une dépression induite par une souffrance chronique.
[1] Goto E, Yagi Y, Matsumoto Y, Tsubota K. Impaired functional visual acuity of dry eye patients. Am J Ophthalmol 2002 ; 133 : 181-6.
[2] Lemp MA. Report of the National Eye Institute/Industry Workshop on Clinical Trials in Dry Eye. CLAO J 1995 ; 21 : 221-32.
[3] Lemp MA, Baudouin C, Baum J, et al. The definition and classification of dry eye disease : Report of the Definition and Classification Subcommittee of the International Dry Eye WorkShop [2007]. Ocular Surface 2007 ; 5 : 75-92.
[4] Bron AJ, Tiffany JM, Gouveia SM, et al. Functional aspects of the tear film lipid layer. Exp Eye Res 2004 ; 78 : 347-60.
[5] Stern ME, Gao J, Siemasko KF, et al. The role of the lacrimal functional unit in the pathophysiology of dry eye. Exp Eye Res 2004 ; 78 : 409-16.
[6] Pisella PJ, Brignole F, Debbasch C, et al. Flow cytometric analysis of conjunctival epithelium in ocular rosacea and keratoconjunctivitis sicca. Ophthalmology 2000 ; 107 : 1841-9.
[7] Sullivan DA. Sex and sex steroid influences on the dry eye syndrome. In : Pflugfelder SC, Beuerman RW, Stern ME (Eds). Dry Eye and Ocular Surface Disorders. New York : Marcel Dekker ; 2004.
[8] Baudouin C, Liang H, Bremond-Gignac D, et al. CCR 4 and CCR 5 expression in conjunctival specimens as differential markers of T[H]1/T[H]2 in ocular surface disorders. J Allergy Clin Immunol 2005 ; 116 : 614-9.
[9] Baudouin C. A new approach for better comprehension of diseases of the ocular surface. J Fr Ophtalmol 2007 ; 30 : 239-46.
[10] Pflugfelder SC, De Paiva CS, Tong L, et al. Stress-activated protein kinase signaling pathways in dry eye and ocular surface disease. Ocul Surf 2005 ; 4 Suppl : S154-7.
[11] Baudouin C, Labbé A, Liang H, et al. Preservatives in eyedrops : the good, the bad and the ugly. Prog Retin Eye Res 2010 ; 29 : 312-34.
[12] Pflugfelder SC, Jones D, Ji Z, et al. Altered cytokine balance in the tear fluid and conjunctiva of patients with Sjogren’s syndrome keratoconjunctivitis sicca. Curr Eye Res 1999 ; 19 : 201-11.
[13] Baudouin C, Aragona P, Messmer EM, et al. Role of hyperosmolarity in the pathogenesis and management of dry eye disease : proceedings of the OCEAN group meeting. Ocul Surf 2013 ; 4 : 246-58.
[14] Gao J, Schwalb TA, Addeo JV, et al. The role of apoptosis in the pathogenesis of canine keratoconjunctivitis sicca : the effect of topical Cyclosporin A therapy. Cornea 1998 ; 17 : 654-63.
[15] Yeh S, Song XJ, Farley W, et al. Apoptosis of ocular surface cells in experimentally induced dry eye. Invest Ophthalmol Vis Sci 2003 ; 44 : 124-9.
[16] Beuerman RW, Stern ME. Neurogenic inflammation : a first line of defense for the ocular surface. Ocul Surf 2005 ; 4 Suppl : S203-6.
[17] Brignole F, Pisella PJ, Goldschild M, et al. Flow cytometric analysis of inflammatory markers in conjunctival epithelial cells of patients with dry eyes. Invest Ophthalmol Vis Sci 2000 ; 41 : 1356-63.
[18] Zierhut M, Dana MR, Stern ME, Sullivan DA. Immunology of the lacrimal gland and ocular tear film. Trends Immunol 2002 ; 23 : 333-5.
[19] Barabino S, Chen Y, Chauhan S, Dana R. Ocular surface immunity : homeostatic mechanisms and their disruption in dry eye disease. Prog Retin Eye Res 2012 ; 31 : 271-85.
[20] Stern ME, Schaumburg CS, Pflugfelder SC. Dry eye as a mucosal autoimmune disease. Int Rev Immunol 2013 ; 32 : 19-41.
[21] Corrales RM, Stern ME, De Paiva CS, et al. Desiccating stress stimulates expression of matrix metalloproteinases by the corneal epithelium. Invest Ophthalmol Vis Sci 2006 ; 47 : 3293-302.
[22] Dougherty JM, McCulley JP. Bacterial lipases and chronic blepharitis. Invest Ophthalmol Vis Sci 1986 ; 27 : 486-91.
[23] Foulks G, Bron AJ. A clinical description of meibomian gland dysfunction. Ocul Surf 2003 ; 1 : 107-26.
K. Tsubota
La sécheresse oculaire est un processus complexe et multifactoriel dans lequel le vieillissement de la surface oculaire semble jouer un rôle primordial. Il existe deux théories importantes concernant le vieillissement de la surface oculaire : la théorie de restriction calorique et celle des radicaux libres. La compréhension des mécanismes du vieillissement de la surface oculaire ouvre des perspectives prometteuses tant sur le plan préventif que thérapeutique.
La sécheresse oculaire est une pathologie complexe et multifactorielle qui survient plus fréquemment chez les sujets âgés que les sujets jeunes [1]. De ce fait, le vieillissement de la surface oculaire constitue probablement l’un des facteurs étiopathogéniques les plus importants de la sécheresse oculaire [2, 3]. Les progrès récents dans la compréhension des phénomènes de vieillissement ont permis de décrire deux théories étiopathogéniques importantes : celle de la restriction calorique et celle des radicaux libres [2, 3]. Concernant la théorie de la restriction calorique, il existe actuellement un consensus dans la communauté scientifique sur le fait que celle-ci peut prolonger la durée de vie de différents types de cellules et d’animaux [2–4]. En outre, la restriction calorique est associée à une réduction de pathologies liées au vieillissement telles que le cancer, le diabète et les pathologies cardiovasculaires. Enfin, la restriction calorique ou l’administration de traitements qui miment ses mécanismes moléculaires permettent de reporter l’apparition de ces pathologies liées à l’âge, voire de les guérir [5].
En plus de la théorie de restriction calorique, la théorie des radicaux libres est une autre hypothèse qui semble être impliquée dans le vieillissement de la surface oculaire [6]. Selon cette théorie, le processus de vieillissement est lié à l’apparition de radicaux libres de l’oxygène et pourrait de ce fait être contrôlé par la gestion du stress oxydant [7]. Dans ce chapitre, nous détaillons ces deux théories de vieillissement, et discutons comment les appliquer à la prévention et au traitement de la sécheresse oculaire.
Plusieurs auteurs ont rapporté que la durée de vie de nombreuses espèces, telles que les levures, les nématodes, les rongeurs et les singes, peut être augmentée jusqu’à 50 % en réduisant l’apport calorique [4]. Il est aussi actuellement admis que la restriction calorique réduit l’incidence des maladies liées à l’âge comme le cancer, les pathologies cardiovasculaires et les dysfonctions immunitaires [5, 6]. En conséquence, les changements physiologiques causés par la restriction calorique semblent contribuer à un meilleur état de santé et offrent une plus grande longévité [6].
Sur le plan moléculaire, la restriction calorique modifie les profils d’expression des gènes impliqués dans le processus de vieillissement [8]. Ainsi, elle induit une réduction de la signalisation insulinique et de l’insulin growth factor (IGF), la suppression des récepteurs de la rapamycine ainsi que l’activation des molécules de la famille des sirtuines. L’ensemble de ces modifications est responsable d’un effet antivieillissement [9] (fig. 3-6). Les sirtuines sont une classe d’enzymes ayant une activité désacétylasique sur les histones, leur conférant une fonction régulatrice de l’expression des gènes. Elles se retrouvent aussi bien chez les organismes eucaryotes que procaryotes. D’une manière générale, leur activation augmenterait la sensibilité à l’insuline, la lipolyse, diminuerait l’inflammation et jouerait un rôle préventif dans les maladies neurodégénératives et la carcinogenèse [4, 8]. Chez les souris comportant une mutation du gène SIRT1 entraînant la production de sirtuines non fonctionnelles, la mortalité in utero est importante. Les souris survivantes présentent un vieillissement accéléré et une augmentation des tumeurs malignes, probablement secondaires à une incapacité de réparation de l’ADN [10]. En dehors de la restriction calorique, il existe d’autres façons de stimuler le gène des sirtuines, telles que l’exercice physique, l’augmentation du nicotinamide adenine dinucleotide (NAD) ou le traitement au resvératrol (fig. 3-7).
Puisque la restriction calorique n’est pas toujours facile à suivre dans la vie quotidienne, plusieurs chercheurs sont en train de développer des molécules capables de reproduire les mêmes effets moléculaires que la restriction calorique [11, 12]. Parmi les substances qui miment la restriction calorique, on citera les polyphénols tels que le resvératrol, la quercétine et la butéine [11]. Le resvératrol est une molécule qui régule l’activité et la transcription des sirtuines. Il induit ainsi un effet antivieillissement qui imite ce que l’on observe au cours des restrictions caloriques.
Chez l’homme, il est clair que la consommation élevée de calories dans le temps est un facteur de risque dans diverses maladies liées à l’âge, comme on l’observe dans le syndrome métabolique [13]. Il n’est pas encore clair si les maladies oculaires liées à l’âge sont également réduites par la restriction calorique, mais cela semble très probable d’après plusieurs auteurs [14, 15].
Plusieurs études sur les effets de la restriction calorique au cours des pathologies ophtalmologiques ont été publiées [6, 14]. Parmi ces études, celles de Kawashima et al. a étudié l’effet de la restriction calorique chez des modèles de rats âgés atteints de sécheresse oculaire. Quand les rats devenaient de plus en plus âgés, le volume de larmes sécrétées diminuait. Toutefois, lorsque la restriction calorique a été appliquée à ces rats en réduisant l’apport calorique total de 70 % sur 6 mois, la diminution du volume des larmes a été stabilisée [16]. Bien que le mécanisme moléculaire ne soit pas complètement élucidé, ces résultats indiquent une reprise de la sécrétion des glandes lacrymales sous l’effet de la restriction calorique.
Par ailleurs, une étude préliminaire sur l’effet du resvératrol dans un modèle murin d’uvéite [16] a confirmé que cette molécule augmentait l’activité des sirtuines dans l’œil et réduisait l’inflammation dans la rétine (p=0,05) [17]. Étant donné que l’inflammation est considérée comme étant un facteur majeur de la sécheresse oculaire, le resvératrol pourrait être une nouvelle approche pour le contrôle de l’œil sec, au même titre que la ciclosporine A ou d’autres agents anti-inflammatoires. D’autres études sont nécessaires pour confirmer cette hypothèse.
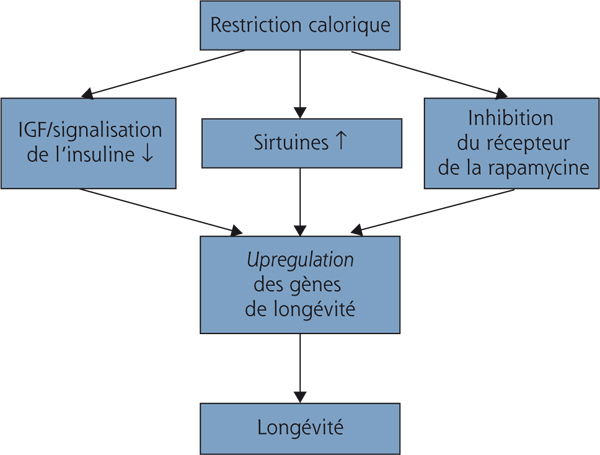
Fig. 3-6 La restriction calorique diminue l’insulin growth factor (IGF) et la signalisation de l’insuline, augmente l’activité des sirtuines et inhibe le récepteur de la rapamycine, ce qui entraîne l’activation des gènes associés à la longévité.
Fig. 3-7 Plusieurs stimuli permettent d’activer les sirtuines et d’obtenir un effet antivieillissement.
NAD : nicotinamide adenine dinucleotide.
La théorie des radicaux libres a d’abord été proposée par Harman en 1956 [7]. Elle est considérée comme un mécanisme important dans le processus de vieillissement cellulaire (fig. 3-8). Selon Ishii et al., la surproduction de radicaux libres dans les mitochondries raccourcit la durée de vie des nématodes [18]. En revanche, la surexpression de la superoxyde dismutase (SOD) et de la catalase, qui sont des enzymes anti-oxydantes, peut augmenter la durée de vie de la drosophile ou la souris [19, 20]. Les radicaux libres sont essentiellement générés par les réactions d’oxydation au niveau des mitochondries. Celles-ci sont aussi induites par l’exposition aux rayons ultraviolets au niveau de la surface oculaire et de la peau ; il s’agit donc de radicaux libres photo-induits qui peuvent être responsables du photovieillissement oculaire ou cutané.
Quelle que soit leur origine, les radicaux libres attaquent et dénaturent des molécules importantes au niveau cellulaire telles que les protéines, les lipides et l’ADN, et accélèrent ainsi les phénomènes de vieillissement cellulaire. Plusieurs arguments appuient l’hypothèse selon laquelle le stress oxydant serait un mécanisme important dans le processus de vieillissement oculaire. Il est admis que l’exposition à la lumière et aux rayons ultraviolets est un facteur de risque de cataracte et la dégénérescence maculaire liée à l’âge (DMLA). Ainsi, le photovieillissement pourrait être un mécanisme important dans le processus de vieillissement oculaire. Il est actuellement admis que le tabagisme, l’exposition au soleil et l’accumulation du fer, du plomb et du cadmium sont des facteurs de risque de la DMLA. Tous ces facteurs induisent un stress oxydant qui est probablement responsable d’une accélération du vieillissement oculaire et des phénomènes inflammatoires au cours de la DMLA. Par ailleurs, au cours de la DMLA, les études AREDS et AREDS2 (Age-Related Eye Disease Study) ont montré l’efficacité de la supplémentation en antioxydants pour supprimer la progression de la DMLA, ce qui est un argument en faveur de l’implication du stress oxydant dans la pathogenèse de cette pathologie [21–23].
La relation entre le stress oxydant et la sécheresse oculaire est bien décrite dans la littérature. L’oxydation des protéines, des lipides et de l’ADN semble accélérée au niveau de la surface oculaire chez des rats atteints de sécheresse oculaire [24]. Par ailleurs, la suppression du clignement lui-même peut exposer la surface oculaire à l’oxygène ambiant et provoquer l’oxydation directe des composants cellulaires. Les souris qui ont un déficit en SOD présentent clairement une diminution du volume lacrymal, avec des altérations de la surface oculaire [25]. Le tabagisme est considéré comme un facteur de risque pour l’œil sec. Au-delà de la présence de produits toxiques pouvant irriter la surface oculaire, la consommation de tabac induit des radicaux libres qui sont à l’origine de stress oxydant [26, 27].
La lactoferrine est une protéine présente dans le film lacrymal normal et qui a des propriétés antioxydantes. D’après plusieurs auteurs, l’administration de lactoferrine par voie orale peut augmenter le volume du film lacrymal et améliorer les symptômes de sécheresse oculaire [28, 29]. D’autres molécules, telles que la préalbumine, les sélénoprotéines, sont d’autres constituants des larmes et qui ont un rôle important pour contrôler le stress oxydant au niveau de la surface oculaire [30, 31].
L’élucidation des différents mécanismes moléculaires du stress oxydant au niveau de la surface oculaire permettra dans un avenir proche de développer des approches préventives et thérapeutiques de la sécheresse oculaire, fondées sur le contrôle des radicaux libres.
Fig. 3-8 Les radicaux libres d’oxygène induisent plusieurs modifications des lipides, des protéines et de l’ADN, entraînant des lésions tissulaires à l’origine du vieillissement. Ils engendrent aussi une inflammation qui contribue au vieillissement cellulaire.
La médecine antivieillissement a pendant longtemps été un rêve sans fondement scientifique. Dorénavant, cette recherche de « fontaine de jouvence » n’est plus un rêve inaccessible. La compréhension du processus de vieillissement ouvre de nouvelles perspectives et permettra dans un avenir proche de définir de nouvelles approches préventives et thérapeutiques des maladies liées au vieillissement [2, 3, 16, 17]. La sécheresse oculaire est une pathologie liée au vieillissement qui n’échappe pas à cette approche. L’élucidation des mécanismes moléculaires de vieillissement de la surface oculaire est actuellement en cours et permettra à terme de définir de nouvelles options thérapeutiques pour la sécheresse oculaire.
[1] (No authors listed). Epidemiology of dry eye : Report of the Epidemiology Subcommittee of the 2007 Dry Eye WorkShop (DEWS). Ocul Surf 2007 ; 5 : 93-107.
[2] Tsubota K, Kawashima M, Inaba T et al. The antiaging approach for the treatment of dry eye. Cornea 2012 ; 31 Suppl 1 : S3-8.
[3] Tsubota K, Kawashima M, Inaba T et al. The era of antiaging ophthalmology comes of age : antiaging approach for dry eye treatment. Ophthalmic Res 2010 ; 44 : 146-54.
[4] Bordone L, Guarente L. Calorie restriction, SIRT1 and metabolism : understanding longevity. Nat Rev Mol Cell Biol 2005 ; 6 : 298-305.
[5] Spindler SR. Calorie restriction enhances the expression of key metabolic enzymes associated with protein renewal during aging. Ann NY Acad Sci 2001 ; 928 : 296-304.
[6] Heilbronn LK, De Jonge L, Frisard MI, et al. Effect of 6-month calorie restriction on biomarkers of longevity, metabolic adaptation, and oxidative stress in overweight individuals : a randomized controlled trial. JAMA 2006 ; 295 : 1539-48.
[7] Harman D. Aging : a theory based on free radical and radiation chemistry. J Gerontol 1956 ; 11 : 298-300.
[8] Guarente L. Sirtuins as potential targets for metabolic syndrome. Nature 2006 ; 444 : 868-74.
[9] Longo VD, Kennedy BK. Sirtuins in aging and age-related disease. Cell 2006 ; 126 : 257-68.
[10] Wang RH, Sengupta K, Li C, et al. Impaired DNA damage response, genome instability, and tumorigenesis in SIRT1 mutant mice. Cancer Cell 2008 ; 14 : 312-23.
[11] Howitz KT, Bitterman KJ, Cohen HY, et al. Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan. Nature 2003 ; 425 : 191-6.
[12] Baur JA, Pearson KJ, Price NL, et al. Resveratrol improves health and survival of mice on a high-calorie diet. Nature 2006 ; 444 : 337-42.
[13] Matsuzawa Y. Therapy insight : adipocytokines in metabolic syndrome and related cardiovascular disease. Nat Clin Pract Cardiovasc Med 2006 ; 3 : 35-42.
[14] Abe T, Nakajima A, Satoh N, et al. Suppression of experimental autoimmune uveoretinitis by dietary calorie restriction. Jpn J Ophthalmol 2001 ; 45 : 46-52.
[15] Li Y, Wolf NS. Effects of age and long-term caloric restriction on the aqueous collecting channel in the mouse eye. J Glaucoma 1997 ; 6 : 18-22.
[16] Kawashima M, Kawakita T, Okada N, et al. Calorie restriction : a new therapeutic intervention for age-related dry eye disease in rats. Biochem Biophys Res Commun 2010 ; 397 : 724-8.
[17] Kubota S, Kurihara T, Mochimaru H, et al. Prevention of ocular inflammation in endotoxin-induced uveitis with resveratrol by inhibiting oxidative damage and nuclear factor-kappaB activation. Invest Ophthalmol Vis Sci 2009 ; 50 : 3512-9.
[18] Ishii N, Fujii M, Hartman PS, et al. A mutation in succinate dehydrogenase cytochrome b causes oxidative stress and ageing in nematodes. Nature 1998 ; 394 : 694-7.
[19] Schriner SE, Linford NJ, Martin GM, et al. Extension of murine life span by overexpression of catalase targeted to mitochondria. Science 2005 ; 308 : 1909-11.
[20] Sun J, Folk D, Bradley TJ, Tower J. Induced overexpression of mitochondrial Mn-superoxide dismutase extends the life span of adult Drosophila melanogaster. Genetics 2002 ; 161 : 661-72.
[21] Sackett CS, Schenning S. The Age-Related Eye Disease Study : the results of the clinical trial. Insight 2002 ; 27 : 5-7.
[22] Sasaki M, Ozawa Y, Kurihara T, et al. Neuroprotective effect of an antioxidant, lutein, during retinal inflammation. Invest Ophthalmol Vis Sci 2009 ; 50 : 1433-9.
[23] Izumi-Nagai K, Nagai N, Ohgami K, et al. Inhibition of choroidal neovascularization with an anti-inflammatory carotenoid astaxanthin. Invest Ophthalmol Vis Sci 2008 ; 49 : 1679-85.
[24] Nakamura S, Shibuya M, Nakashima H, et al. Involvement of oxidative stress on corneal epithelial alterations in a blink-suppressed dry eye. Invest Ophthalmol Vis Sci 2007 ; 48 : 1552-8.
[25] Kojima T, Wakamatsu TH, Dogru M, et al. Age-related dysfunction of the lacrimal gland and oxidative stress : evidence from the Cu,Zn-superoxide dismutase-1 (sod1) knockout mice. Am J Pathol 2012 ; 180 : 1879-96.
[26] Rummenie VT, Matsumoto Y, Dogru M, et al. Tear cytokine and ocular surface alterations following brief passive cigarette smoke exposure. Cytokine 2008 ; 43 : 200-8.
[27] Matsumoto Y, Dogru M, Goto E, et al. Alterations of the tear film and ocular surface health in chronic smokers. Eye 2008 ; 22 : 961-8.
[28] Dogru M, Matsumoto Y, Yamamoto Y, et al. Lactoferrin in Sjögren’s syndrome. Ophthalmology 2007 ; 114 : 2366-7.
[29] Kawashima M, Kawakita T, Inaba T, et al. Dietary lactoferrin alleviates age-related lacrimal gland dysfunction in mice. PLoS One 2012 ; 7 : e33148.
[30] Higuchi A, Ueno R, Shimmura S, et al. Albumin rescues ocular epithelial cells from cell death in dry eye. Curr Eye Res 2007 ; 32 : 83-8.
[31] Higuchi A, Takahashi K, Hirashima M, et al. Selenoprotein p controls oxidative stress in cornea. PLoS ONE 2010 ; 5 : e9911.
A. Denoyer, A. Labbé, C. Baudouin
La dégradation de la fonction visuelle est un des critères qui définissent aujourd’hui la sécheresse oculaire. La majorité des patients atteints de sécheresse souffrent de symptômes oculaires et d’une altération visuelle qui nuisent à leur qualité de vie au quotidien. De nouveaux indices de qualité de vision et de qualité de vie doivent être identifiés pour mieux définir la sévérité et l’impact de la maladie. L’aberrométrie dynamique permet de quantifier les conséquences visuelles de la maladie et pourrait ainsi constituer un nouveau standard pour l’évaluation de la sécheresse oculaire.
La sécheresse oculaire est une pathologie ophtalmologique très fréquente mais souvent mal considérée, en raison de son apparente bénignité et de son évolution frustrante pour les patients, et peu gratifiante pour les ophtalmologistes. Néanmoins, de nombreux travaux ont démontré l’impact très important de cette pathologie courante sur la qualité de vision et la qualité de vie des patients, allant même jusqu’à retentir sur leur état psychique [1-3]. La définition même de la sécheresse oculaire retenue par le Dry Eye WorkShop retient l’altération de la qualité de vision comme un des critères fondamentaux de la maladie [1]. Mais au-delà de la symptomatologie oculaire et visuelle se dessine l’impact psychologique et social de cette affection fréquente.
La qualité de vie est un concept complexe qui englobe des notions physiques, sociales, psychologiques et émotionnelles, ainsi que cognitives. Son évaluation est fondée sur des données subjectives rapportées par les patients qui ne peuvent pas être obtenues par des tests objectifs.
Mis à part les formes particulières comme le syndrome de Sjögren, la sécheresse oculaire est le plus souvent responsable de douleurs d’intensité modérée. Cependant, les symptômes de la sécheresse oculaire comme les sensations d’inconfort, de corps étranger, de picotements, de brûlures, les troubles visuels fluctuants ou encore le larmoiement, initialement intermittents, peuvent devenir permanents et altérer de manière importante la qualité de vie des patients. Celle-ci serait ainsi diminuée par l’atteinte de la fonction visuelle, par les symptômes douloureux ou d’irritations chroniques qu’elle entraîne ou encore par ses répercussions sur la notion de santé et de bien-être en général [1, 3]. L’impact sur la qualité de vie de la sécheresse oculaire serait ainsi comparable à celui de l’angine de poitrine modérée/sévère (stade III/IV) [4].
Plusieurs questionnaires ont été développés, soit en adaptant des outils de mesures mis au point pour d’autres pathologies chroniques, soit en les créant spécifiquement pour la sécheresse oculaire. Selon la nomenclature anglo-saxonne, ces instruments évaluent la qualité de vie relative à la fonction visuelle et ciblée sur l’état de santé, selon le concept de vision-related health-targeted quality of life instruments. Ces nouveaux outils ont émergé de la convergence d’intérêts pour le diagnostic comme pour l’évaluation des nouveaux traitements pour la sécheresse oculaire. Des questionnaires génériques, comme le NEI-VFQ, ou bien spécifiques de la sécheresse oculaire, comme l’Ocular Surface Disease Index (OSDI) (fig. 3-9) et l’Impact of Dry Eye on Everyday Life (IDEEL) [3, 5], ont ainsi été utilisés pour étudier l’impact global de la maladie. Ils ont précisément mis en exergue l’absence de corrélation entre les signes cliniques et les symptômes ressentis par les patients, et ainsi la nécessité de réaliser un score composite associant examen clinique et questionnaires pour s’approcher au mieux de la sévérité de l’atteinte. En outre, la précision des données obtenues par ces questionnaires dépend aussi de la personne qui dispense celui-ci (« l’interviewer »), du moment où celui-ci est complété, ainsi que du temps dans lequel il s’inscrit tout au long de l’historique du patient, celui-ci intégrant progressivement ses souffrances et leur perception au cours d’une telle maladie chronique. Ainsi, ces instruments apparaissent essentiels, mais probablement insuffisants s’ils sont utilisés seuls.
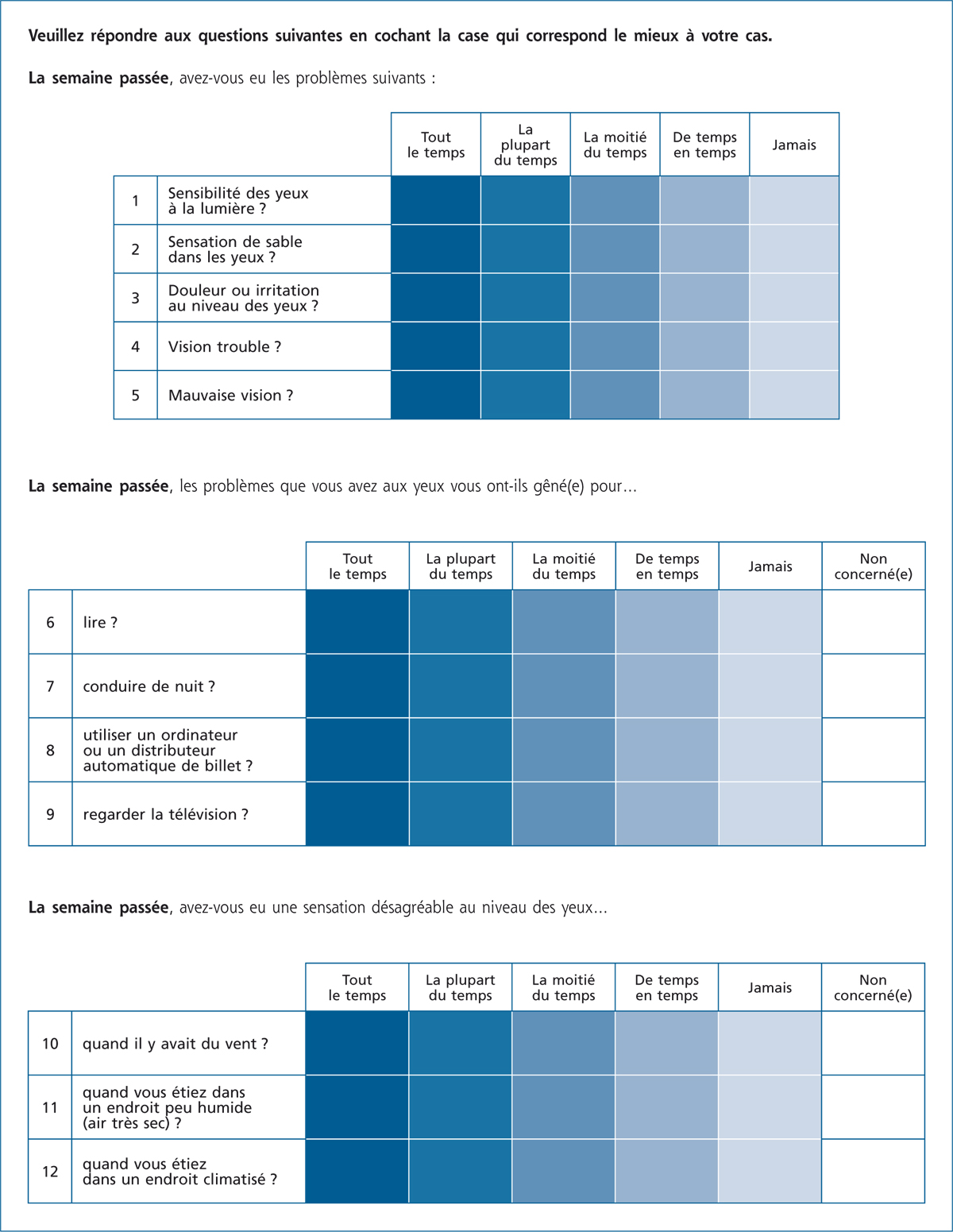
Fig. 3-9 Questionnaire sur les affections de la surface oculaire. Présentation française de l’Ocular Surface Disease Index (OSDI).
© Allergan, Inc. Reproduction autorisée.
Les patients atteints de syndrome de Sjögren rapportent que leur sécheresse oculaire interfère avec leurs activités de loisir approximativement 123 jours par an. Ils présentent des symptômes au travail 200 jours par an, et nécessitent 5 jours d’arrêt de travail annuels du fait de leurs symptômes oculaires [3]. Dans une cohorte de 70 patients souffrant de sécheresse oculaire (dont 86 % présentant une sécheresse oculaire non liée à un syndrome de Sjögren), presque les trois quarts d’entre eux rapportaient que leurs symptômes avaient un impact sur leur travail malgré des traitements appropriés. Les symptômes de sécheresse entraîneraient ainsi un changement d’activité professionnelle pour 7 % des patients et une réduction du temps de loisir pour 35 % d’entre eux [3]. Des études réalisées à partir de vastes cohortes de patients ont également mis en évidence que la sécheresse oculaire avait un impact négatif important sur de nombreuses activités quotidiennes comme la lecture, utiliser un ordinateur, regarder la télévision, ou encore conduire de jour ou de nuit [2, 6]. Enfin, il est possible de développer des outils spécifiques d’évaluation de l’impact de la sécheresse oculaire sur l’exécution de tâches de la vie courante telles que la conduite, comme l’a récemment démontré une étude sur un simulateur dédié (encadré 3-2) [7], ou bien la lecture ou l’utilisation d’un smartphone.
La sécheresse oculaire repose sur l’association de symptômes d’inconfort et d’altérations cliniques de la surface oculaire avec une dégradation de la qualité de vision. Les patients atteints de sécheresse souffrent ainsi de difficultés visuelles au quotidien qui entravent la réalisation de certaines tâches de la vie courante. Dans la majorité des cas, l’acuité visuelle mesurée de façon conventionnelle demeure excellente alors que l’instabilité lacrymale liée à la maladie entraîne des variations temporelles des qualités optiques de l’œil qui nuisent à la fonction visuelle. Ainsi, il a été montré que l’étude dynamique des aberrations optiques d’ordre élevé pourrait permettre de mesurer de façon objective et quantitative la sévérité de la sécheresse et son impact sur la vision [1]. Alors que nos patients rapportent une dégradation parfois importante de leur qualité de vie par l’intermédiaire de questionnaires spécifiques, aucune étude n’avait été réalisée pour tenter d’analyser de façon objective l’impact de la maladie au quotidien.
Récemment, il a été démontré que la sécheresse oculaire était associée à une dégradation de la fonction visuelle et des capacités de conduite à travers l’utilisation d’un simulateur de conduite spécifiquement dédié [2]. Vingt patients atteints de sécheresse et 20 témoins sains appariés en genre et en âge ont ainsi réalisé à trois reprises un parcours de conduite de 5 km dans un simulateur qui projetait des cibles d’intensité croissante de façon aléatoire. Les sujets devaient presser un bouton dès qu’ils apercevaient une cible. En résumé, cette étude clinique prospective et comparative a montré de façon significative dans le groupe « sécheresse » comparativement au groupe témoin :
• une diminution du nombre de cibles identifiées ;
• une augmentation du temps de réponse ;
• une difficulté d’identification des cibles en situation de conduite nécessitant une attention particulière comme la traversée des intersections et des ronds-points.
Ainsi, le développement et l’étude de nouveaux outils d’analyse de la qualité de vision et de son impact dans la vie courante semblent aujourd’hui nécessaires pour mieux évaluer la sévérité de la maladie à l’échelle de l’individu, d’une part, et pour définir de nouveaux indices afin d’harmoniser les conclusions des études cliniques multicentriques et de répondre ainsi aux exigences des autorités de santé, d’autre part.
Références
[1] Denoyer A, Rabut G, Baudouin C. Tear film aberration dynamics and vision-related quality of life in patients with dry eye disease. Ophthalmology 2012 ; 119 : 1811-8.
[2] Deschamps N, Ricaud X, Rabut G, et al. The impact of dry eye disease on visual performance while driving. Am J Ophthalmol 2013 ; 156 : 184-9.
De façon plus large, le recours à des questionnaires de qualité de vie posant des questions simples et concrètes, ancrées dans la réalité du vécu des patients, a permis de documenter l’impact véritable de la maladie sur les patients atteints de sécheresse oculaire de façon plus sensible que ne peut le faire le clinicien en pratique clinique [4]. En utilisant ce type de questionnaires, il apparaît que cette atteinte de la qualité de vie dépasse largement le cadre ophtalmologique puisque les patients indiquent craindre que leur pathologie ne soit incurable (53,9 % des patients) et sont inquiets pour leur avenir (51,6 %). De plus, dans une très large majorité (88,4 %), ils pensent que leur maladie n’est pas reconnue par leur entourage, et pour une moitié d’entre eux, ils se sentent rejetés par leur médecin [4].
Au-delà de cette atteinte de la qualité de vie, il semblerait aussi que la sécheresse oculaire soit associée à des troubles psychologiques comme l’anxiété et la dépression. À l’image d’autres pathologies responsables de douleurs chroniques, la sécheresse oculaire impacte de nombreux aspects incluant les processus cognitifs, les fonctions cérébrales, l’humeur et la santé mentale. Chez les patients souffrant d’un syndrome de Sjögren, les scores d’anxiété et de dépression sont significativement supérieurs par rapport à ceux des témoins sains, avec une prévalence plus importante de dépression caractérisée. En outre, le bien-être physique et mental est significativement moindre chez ces patients qui se plaignent plus volontiers d’humeur triste, d’irritabilité, de difficultés mnésiques et de concentration [8, 9]. Ces résultats sont aussi observés chez les patients atteints de sécheresse oculaire moins sévère et non liée à une maladie systémique. Dans une vaste étude de population ayant analysé la relation entre sécheresse oculaire et symptômes dépressifs, la dépression caractérisée était plus fréquente chez les sujets présentant des symptômes de sécheresse oculaire [1]. De même, les patients présentant des symptômes de sécheresse oculaire avaient significativement plus de symptômes dépressifs. Cette étude retrouvait également une corrélation significative entre les symptômes de sécheresse oculaire et les symptômes dépressifs [1]. Dans cette dernière étude, comme dans l’étude de Li et al., la prévalence des troubles psychologiques était corrélée aux symptômes d’atteinte de la surface oculaire et non aux scores cliniques d’évaluation de la sécheresse oculaire, soulignant le rôle majeur des symptômes subjectifs qui sont par ailleurs souvent non corrélés aux signes cliniques [10]. Li et al. ont également observé moins de symptômes d’anxiété chez les patients ayant un niveau d’éducation plus élevé qui ont plus facilement accès à l’information et donc à la compréhension de leur maladie [10]. Ainsi, une meilleure information dès le début de la prise en charge pourrait constituer un moyen de réduire l’anxiété des patients et les conséquences psychosociales de la sécheresse oculaire.
La sécheresse oculaire est une pathologie d’une grande variabilité en termes de signes et symptômes, mais en pratique clinique la majorité des patients souffrent d’un inconfort oculaire associé à des troubles de la fonction visuelle, lesquels affectent leur qualité de vie comme détaillé précédemment. Tout praticien confronté à des patients souffrant de sécheresse oculaire mesure combien la principale difficulté de prise en charge est liée à la variabilité des symptômes et à la faible corrélation entre l’examen clinique, les examens complémentaires et la dégradation de la qualité de vision vécue par les patients. Ainsi, il est aujourd’hui essentiel d’identifier un ou quelques biomarqueurs robustes de sécheresse oculaire qui permettraient d’évaluer la sévérité de l’atteinte et son impact visuel d’une part, et l’efficacité des mesures thérapeutiques mises en œuvre d’autre part, que ce soit pour la prise en charge quotidienne de nos patients ou dans le cadre d’études cliniques multicentriques.
L’évaluation des conséquences visuelles de la sécheresse oculaire pourrait à l’avenir constituer un indice fiable, objectif et reproductible de sévérité de la maladie. Cette nouvelle orientation diagnostique repose sur trois postulats fondamentaux :
-
les données de l’examen clinique sont aujourd’hui insuffisantes ;
-
les questionnaires de qualité de vision/vie spécifiquement dédiés à la sécheresse oculaire se heurtent à la variabilité et la subjectivité des mesures obtenues (voir plus haut) ;
-
les tests d’inflammation de la surface oculaire (HLA-DR, MMP-9) ou d’osmolarité lacrymale ne sont pas réalisables en routine ou le sont difficilement.
L’évaluation conventionnelle de l’acuité visuelle ne permet pas de discerner l’impact visuel réel de la sécheresse oculaire. Il apparaît donc nécessaire de se tourner vers des méthodes plus spécifiques d’évaluation de la fonction visuelle, comme l’étude de la sensibilité aux contrastes, mais aussi l’analyse de la dynamique lacrymale et ses conséquences sur les propriétés optiques oculaires, ce qui est aujourd’hui faisable grâce aux développements de l’aberrométrie.
L’épidémiologie nous apprend qu’environ 95 % des cas de sécheresse associent une altération de la qualité de vision à une altération qualitative voire quantitative du film lacrymal, sans altération centrale et l’épithélium cornéen [11]. Nous n’envisagerons donc pas les patients atteints de sécheresse sévère qui présentent des altérations majeures de l’épithélium cornéen central naturellement associées à une baisse directe de l’acuité visuelle mesurée de façon conventionnelle. Cette population de cas rares et graves relève de consultations spécialisées et sa problématique dépasse celle des symptômes associés à la qualité de vision.
Le film lacrymal précornéen constitue la première interface optique entre le milieu extérieur et le dioptre oculaire. Ainsi, ses caractéristiques conditionnent de façon importante les propriétés optiques de l’œil du fait de la grande variation d’indice optique entre l’air et le milieu aqueux. Un amincissement homogène du film lacrymal a peu d’effets optiques, alors que les défauts d’étalement et les irrégularités du film nuisent significativement à la qualité de vision. Ainsi, quelle que soit l’origine de la sécheresse oculaire, l’instabilité pathologique du film lacrymal introduit des aberrations optiques qui dégradent la qualité de l’image projetée sur la rétine [12–14].
Les patients souffrant de sécheresse oculaire se plaignent spontanément de perte de contrastes et de photophobie. La mesure de sensibilité aux contrastes est ainsi apparue comme un examen beaucoup plus informatif que l’évaluation conventionnelle de l’acuité visuelle. Dans une étude princeps, Rolando et al. ont pour la première fois mis en évidence que la sécheresse oculaire était associée à une diminution de la sensibilité aux contrastes chez 30 patients souffrant de sécheresse légère à modérée comparativement à 15 témoins sains, et ce indépendamment de l’acuité visuelle standard [15]. Plus récemment, Puel et al. sont parvenus à définir que la diminution de la sensibilité aux contrastes liée à la sécheresse concernait essentiellement les fréquences visuelles intermédiaires et élevées, tentant ainsi d’identifier les conséquences visuelles spécifiques et discriminantes de cette affection [16].
Néanmoins, les tests de sensibilité aux contrastes se heurtent à un certain nombre d’écueils. Sur le plan méthodologique, l’existence de différents moyens d’évaluation (échelles visuelles simples, contrastes automatisés sur optotypes, contrastes automatisés sur réseaux lumineux) et le caractère semi-quantitatif des données obtenues brouillent les conclusions des différentes études. À l’échelle du patient, la nécessité d’une participation active, la subjectivité de l’examen et la variabilité intra-individuelle liée à l’apprentissage de l’outil nuisent à la reproductibilité. Enfin, le plateau technique et le temps nécessaire, pour le patient comme le praticien, altèrent la qualité des résultats, d’autant plus que le temps passé à réaliser l’examen influence directement la qualité du film lacrymal, donc la fonction visuelle. Sur ces bases, d’autres méthodes ont été développées et évaluées, en se focalisant plus spécifiquement sur la composante dynamique de la relation entre film lacrymal et qualité de vision.
La principale difficulté rencontrée au cours de l’évaluation du film lacrymal repose sur son aspect dynamique. Le film lacrymal passe par plusieurs phases : après le clignement palpébral, un ménisque de larmes se forme et se repartit sur la totalité de la surface cornéenne de façon uniforme, puis il s’amincit progressivement et se rompt en laissant des zones asséchées sur la cornée qui s’étalent progressivement jusqu’au clignement palpébral suivant. Ces variations temporelles du film lacrymal rendent difficiles les explorations complémentaires statiques et nécessitent ainsi le recours à des méthodes d’enregistrement continu ou discontinu afin d’en étudier la composante variable et son influence sur la qualité de vision en temps réel [17-19].
La dynamique lacrymale peut être étudiée selon différentes approches. L’examen clinique, par la mesure du temps de rupture du film lacrymal, fournit peu d’informations sur la sévérité de l’atteinte, et encore moins sur la dégradation de la qualité de vision. La topographie et la vidéokératoscopie renseignent sur l’architecture du film lacrymal – cartographie de l’épaisseur et variations dans le temps –, de laquelle il est possible mathématiquement d’extrapoler certaines propriétés optiques, bien que cela demeure une mesure indirecte. L’interférométrie, quant à elle, définit des indices de quantité et de qualité du film lacrymal, mais n’offre pas d’analyse optique directe (voir plus loin). Le développement de l’aberrométrie, originellement porté par l’essor de la chirurgie réfractive, trouve ainsi depuis peu une nouvelle application dans l’évaluation de la qualité de vision au cours de certaines affections comme la sécheresse oculaire [20]. Les aberromètres permettent de quantifier les perturbations visuelles induites par les aberrations d’ordre élevé telles que celles créées par l’instabilité lacrymale. Ainsi, les modifications temporelles des aberrations d’ordre élevé après un clignement palpébral peuvent apparaître comme des éléments caractéristiques de l’instabilité lacrymale liée à la sécheresse oculaire (fig. 3-10). Celle-ci sera détaillée plus bas.

Fig. 3-10 Dégradation temporelle de la fonction de dispersion du point (PSF) mesurée par aberrométrie de Schack-Hartmann chez un patient atteint de sécheresse.
La mesure est indiquée en secondes après le clignement palpébral. L’étalement avec le temps de la PSF traduit l’augmentation des aberrations optiques liées à l’instabilité lacrymale.
La vidéokératoscopie est une topographie à enregistrement continu qui consiste à projeter un disque de Placido sur la surface cornéenne et à capturer la réflexion qui s’ensuit à l’aide d’une camera vidéo. La qualité de l’image reflétée donne une indication sur la régularité de la surface oculaire au cours du temps. Comme détaillé dans le tableau 3-2, il semblerait que cet examen soit très précis pour évaluer la qualité du film lacrymal en comparaison avec l’aberrométrie et l’interférométrie. Goto et al. ont montré la bonne sensibilité de cette technique pour l’étude de la stabilité du film lacrymal [21].
Tableau 3-2 Méthodes d’évaluation de la composante optique du film lacrymal.
L’interférométrie vise à diviser en deux un faisceau incident dans le but d’étudier au final le décalage de réception du signal, après réflexion sur la surface étudiée. L’évaluation principale est la mesure de l’épaisseur de la couche lipidique. L’œil du patient est positionné devant une source de lumière blanche. La lumière de la source d’illumination traverse le film lacrymal, se reflète, puis est capturée par une caméra de très haute définition. La lumière renvoyée à travers l’objectif de la caméra forme un tracé d’interférence désigné sous le nom d’interférogramme. L’épaisseur du film lacrymal est observée sous la forme d’une gamme de couleurs qui se reflètent lorsqu’une source de lumière blanche est dirigée sur la surface oculaire. Les OCT (optical coherence tomography ou tomographie par cohérence optique) actuels utilisent notamment ce principe d’interférométrie pour l’étude de l’épaisseur des structures de l’œil (rétine, cornée, fibres optiques, etc.). Les tracés de l’interférogramme rendent compte du clignement et de sa fréquence par les ruptures des tracés. L’analyse de l’examen de l’étirement du film lacrymal sur la surface cornéenne après chaque clignement est également possible en cas d’analyse dynamique avec capture vidéo. Dans leurs études, Szczesna et al. décrivent l’interférométrie comme une technique très précise, notamment dans la détection du syndrome sec. Ils démontrent que c’est aux alentours de 8 à 9 secondes après le clignement que les mesures du film lacrymal sont les plus discriminantes entre un groupe atteint de syndrome sec et un groupe contrôle [22].
L’aberrométrie a pour but de mesurer de façon objective et quantitative l’ensemble des propriétés optiques de l’œil. L’aberrométrie consiste à mesurer la résultante d’un front d’onde plan projeté dans l’œil et réfléchi par la rétine, en termes de longueur d’onde, d’intensité et de décalage de phase. Les déformations du front d’onde, ou aberrations optiques, dépendent des différents dioptres oculaires, et particulièrement de la face antérieure de la cornée recouverte par le film lacrymal. On notera en outre que celles-ci sont aussi directement conditionnées par la qualité des milieux traversés (transmission et diffraction) ainsi que par le diamètre pupillaire. Ainsi, si l’on s’affranchit des phénomènes accommodatifs et du jeu pupillaire, les aberrations optiques liées au film lacrymal peuvent être envisagées comme la part variable dans le temps du profil aberrométrique oculaire. De plus, des instruments récents permettent d’isoler la part antérieure de la part interne des aberrations oculaires totales.
Très brièvement, l’étude des aberrations optiques implique l’obtention d’indices numériques quantitatifs et compréhensibles. Les transformées de Fourier décrivent précisément les aberrations optiques mais demeurent inutilisables au quotidien. Ainsi, la décomposition des aberrations du front d’onde en polynômes de Zernike demeure à ce jour le meilleur moyen d’en appréhender facilement l’impact. On peut en extraire la « moyenne » des aberrations d’ordre élevé (RMS ou root mean square), ainsi que celle d’entités facilement identifiables qui nuisent fortement à la qualité de vision comme la coma et le trefoil de troisième ordre, ou bien l’aberration sphérique de quatrième ordre. D’autres index quantitatifs, plus spécialisés mais encore plus informatifs, peuvent en être extraits, en particulier le ratio d’énergie de la fonction d’étalement du point (point spread function [PSF]) pour un diamètre donné (energy encircled ratio [EER]), ou encore l’aire sous la courbe de la fonction de transfert de modulation (AUC MTF pour area under the curve, modulation transfer function).
Trois grands principes d’analyse, parfois associés à la topographie, permettent d’étudier les aberrations optiques oculaires totales et/ou cornéennes.
Ces analyseurs du front d’onde regroupés sous le terme d’aberrométrie réflective sortante sont les plus couramment utilisés en ophtalmologie. Une grille de rayons monochromatiques parallèles entre eux est projetée puis réfléchie sur la rétine. Un capteur capable d’analyser ces rayons à leur sortie détermine leur disposition par rapport à la grille initiale. Les déviations enregistrées permettent de calculer la déformation du front d’onde.
Dans l’aberromètre de Tscherning, un rayon monochromatique balaie l’aire maculaire en reproduisant une grille. Un capteur synchrone analyse directement en temps réel la position du reflet rétinien de ce rayon entrant (aberrométrie entrante). Ce système présente quelques avantages, notamment l’augmentation de la plage dynamique d’analyse et la possibilité d’une analyse en temps réel, permettant de faire varier l’accommodation du sujet au moyen d’un stimulus réfractif ou visuel, ce qui est plus adapté à l’examen du presbyte.
L’aberromètre à double passage utilise un capteur particulièrement sensible pour analyser directement l’image du reflet rétinien d’un faisceau monochromatique infrarouge projeté sur la fovéa et pour calculer la distorsion spatiale du point lumineux projeté puis réfléchi (fonction de dispersion du point [PSF]). Ce principe permet mieux que les autres aberromètres de mesurer précisément d’autres paramètres optiques, en particulier les phénomènes diffractifs qui participent aussi à la dégradation de la qualité de vision.
Plus récemment, certains appareils associant un aberromètre à un topographe de type Placido se sont développés afin d’acquérir un profil aberrométrique total ainsi qu’une topographie en élévation dont les mesures sont recalées sur l’axe optique de l’aberromètre. Ce principe présente l’avantage majeur d’analyser de façon concomitante les aberrations oculaires totales et les aberrations liées à la face antérieure de la cornée calculées via la topographie, décomposant ainsi la part antérieure (film lacrymal et face antérieure de la cornée) et la part interne (cornée postérieure, cristallin et fovéa) des aberrations oculaires. Ces instruments de mesure trouvent dans l’étude de la sécheresse oculaire un intérêt évident car ils permettent d’appréhender directement les conséquences des aberrations optiques liées au film lacrymal sur la qualité de vision globale.
Seule une analyse dans le temps permet de comprendre les variations des propriétés optiques liées à la dynamique du film lacrymal, en considérant le clignement palpébral comme référentiel temporel. Le premier écueil repose sur l’augmentation de la fréquence du clignement spontané liée à la sécheresse, car les premières secondes semblent peu discriminantes dans l’étude de la dynamique lacrymale. Ainsi, la majorité des auteurs s’accordent à utiliser un anesthésique local afin de minorer l’inconfort oculaire et de permettre au patient de ne pas cligner des paupières durant un laps de temps suffisant, au moins égal à 10 secondes. Même si cet artéfact ne semble pas biaiser les mesures dans le cadre d’études comparatives, c’est-à-dire œil sec versus témoins sains recevant tous un anesthésiant local, celui-ci peut porter à caution en cas de mesures absolues sans groupe témoin. En second lieu, il convient d’effectuer une analyse sériée des profils aberrométriques, soit de façon discontinue (une mesure par seconde du premier au second clignement palpébral), soit par enregistrement continu des aberrations optiques, en fonction de l’instrumentation utilisée [23, 24].
L’essor récent des techniques aberrométriques appliquées à l’étude de la qualité de vision au cours de la sécheresse oculaire ne permet pas encore de dégager l’index phare faisant office de consensus. Les différentes études à ce sujet, leurs méthodes ainsi que les principaux résultats sont détaillés dans le tableau 3-3. En résumé, si l’on s’attarde sur la description qualitative des altérations optiques liées au film lacrymal, il semble que la population puisse être scindée en trois profils de variation aberrométrique : le profil stable sans variation temporelle sur au moins 10 secondes après clignement ; le profil progressif avec augmentation temporelle des aberrations optiques liées aux altérations du film lacrymal ; et le profil périodique présentant des variations d’aberrations « en dents de scie » au cours du temps [24].
De façon quantitative, il apparaît plus clairement aujourd’hui que l’index de progression des aberrations optiques d’ordre élevé (PI), défini initialement par Koh [24] et modifié par Denoyer [23], semble constituer le meilleur reflet de la sévérité de la sécheresse oculaire, englobant ainsi un certain nombre de données cliniques et de qualité de vision perçue par le patient, et s’élevant ainsi au rang de biomarqueur ou de surrogate marker. Le PI repose sur une régression linéaire de l’évolution temporelle des aberrations optiques totales (fig. 3-11). Il peut en pratique se calculer simplement grâce à un aberromètre conventionnel, sans adjonction d’une topographie ni d’un enregistrement en continu, en réalisant une mesure aberrométrique chaque seconde après le clignement pendant 10 secondes, puis en calculant la pente de la variation du RMS des aberrations d’ordre élevé ou de l’aire sous la courbe de la MTF. Nous avons ainsi démontré qu’il existait une progression dans le temps des aberrations d’ordre élevé chez les patients atteints de sécheresse par rapport à une population de sujet sains, l’index de progression reflétant précisément la sévérité de l’atteinte (fig. 3-12). Enfin, il semble pertinent de mieux analyser chacune des aberrations d’ordre élevé pour mieux préciser s’il existe des profils de front d’onde caractérisant la sécheresse oculaire.
Tableau 3-3 Principales études évaluant l’analyse des aberrations optiques et sa relation avec la dynamique lacrymale.
Les lignes en italiques correspondent aux études comparatives incluant des patients atteints de sécheresse oculaire.
BUT : break-up time ; OSDI : Ocular Surface Disease Index ; SS : syndrome sec oculaire.

Fig. 3-11 L'indice de progression correspond à l'évolution temporelle des aberrations optiques d'ordre élevé après clignement palpébral.
L'indice de progression est très supérieur dans le groupe de patients atteints de sécheresse (n=20) comparativement aux témoins sains (n=20).
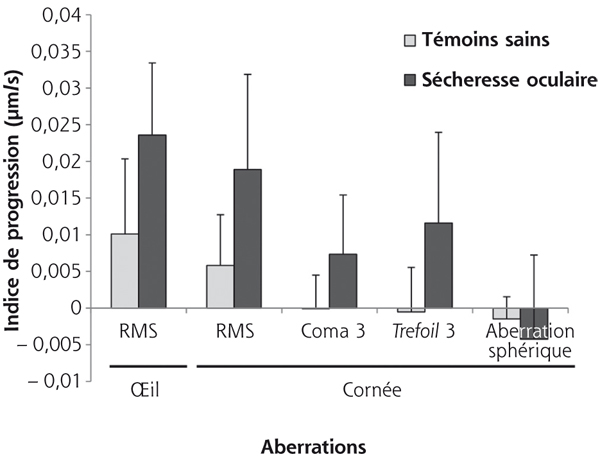
Fig. 3-12 Comparaison des indices de progression des sujets atteints de sécheresse par rapport à un groupe de sujets sains.
L’indice de progression des aberrations d’ordre élevé oculaires ou bien cornéennes antérieures est supérieur chez les patients atteints de sécheresse. Cette dégradation optique est essentiellement liée à une progression dans le temps des aberrations de troisième ordre (coma et trefoil).
Nous avons récemment proposé une méthode plus sophistiquée afin d’évaluer le retentissement du syndrome sec sur une des activités de la vie quotidienne (voir encadré 3-2). Cette méthode consiste à utiliser un simulateur de conduite automobile pour l’évaluation des difficultés ressenties par les patients atteint de sécheresse lors de la conduite. On pourrait envisager des méthodes similaires pour évaluer le retentissement de la sécheresse oculaire sur la lecture, l’utilisation d’un ordinateur ou d’un smartphone. Le praticien serait alors plus à même d’évaluer la plainte du patient et de tenter d’y répondre [7].
L’aberrométrie apparaît comme l’examen non invasif de choix pour l’étude du film lacrymal et de son impact sur la qualité de vision. En effet, il est facilement utilisable en pratique clinique, reproductible, et a prouvé son efficacité dans de nombreuses études pour l’aide au diagnostic de syndrome sec ainsi que l’évaluation de sa sévérité. Il est par ailleurs réalisable dans les conditions normales de clignement, ce qui est un avantage lors de l’examen du patient atteint de sécheresse oculaire. En pratique clinique, l’adaptation des logiciels pilotant les aberromètres pourrait permettre au praticien de quantifier à la consultation la sévérité de la sécheresse et de ses conséquences sur la qualité de vision, afin de mieux évaluer la symptomatologie du patient et d’y répondre immédiatement en adaptant la prise en charge. En parallèle, la définition de nouveaux biomarqueurs de sévérité pour la sécheresse oculaire demeure un enjeu majeur pour la réalisation d’études cliniques multicentriques et donc pour l’industrie pharmaceutique (voir plus loin dans ce chapitre « Sécheresse oculaire et biomarqueurs »).
Les syndromes secs ne comptent pas parmi les maladies fréquemment responsables de cécité, mais ils dégradent la qualité de vision et impactent de manière très importante la qualité de vie et la notion de bien-être des patients. Il y a fort à parier que les futures conférences de consensus portant sur la sécheresse oculaire valideront ces nouveaux indices de qualité de vie et de qualité de vision pour la définition même de la pathologie et l’évaluation objective et nécessaire de ses conséquences. La compréhension, l’évaluation et la prise en charge spécifique de celles-ci, à l’échelle de l’individu comme à celle de la société, doivent aujourd’hui faire partie intégrante de nos stratégies diagnostique et thérapeutique.
[1] Labbe A, Wang YX, Jie Y, et al. Dry eye disease, dry eye symptoms and depression : the Beijing Eye Study. Br J Ophthalmol 2013 ; 97 : 1399-403.
[2] Miljanovic B, Dana R, Sullivan DA, Schaumberg DA. Impact of dry eye syndrome on vision-related quality of life. Am J Ophthalmol 2007 ; 143 : 409-15.
[3] Friedman NJ. Impact of dry eye disease and treatment on quality of life. Curr Opin Ophthalmol 2010 ; 21 : 310-6.
[4] Baudouin C, Creuzot-Garcher C, Hoang-Xuan T, et al. Severe impairment of health-related quality of life in patients suffering from ocular surface diseases. J Fr Ophtalmol 2008 ; 31 : 369-78.
[5] Schiffman RM, Christianson MD, Jacobsen G, et al. Reliability and validity of the ocular surface disease index. Arch Ophthalmol 2000 ; 118 : 615-21.
[6] Denoyer A, Rabut G, Baudouin C. Tear film aberration dynamics and vision-related quality of life in patients with dry eye disease. Ophthalmology 2012 ; 119 : 1811-8.
[7] Deschamps N, Ricaud X, Rabut G, et al. The impact of dry eye disease on visual performance while driving. Am J Ophthalmol 2013 ; 156 : 184-9.
[8] Stevenson HA, Jones ME, Rostron JL, et al. UK patients with primary Sjogren’s syndrome are at increased risk from clinical depression. Gerodontology 2004 ; 21 : 141-5.
[9] Valtysdottir ST, Gudbjornsson B, Lindqvist U, et al. Anxiety and depression in patients with primary Sjogren’s syndrome. J Rheumatol 2000 ; 27 : 165-9.
[10] Li M, Gong L, Sun X, Chapin WJ. Anxiety and depression in patients with dry eye syndrome. Curr Eye Res 2011, 36 : 1-7.
[11] (No author listed). The epidemiology of dry eye disease : report of the epidemiology subcommittee of the International Dry Eye Workshop (2007). Ocul Surf 2007 ; 5 : 93-107.
[12] Montes-Mico R, Cervino A, Ferrer-Blasco T, et al. The tear film and the optical quality if the eye. Ocul Surf 2010 ; 8 : 185-92.
[13] Goto E, Yami Y, Matsumoto Y, Tsubota K. Impaired functional visual acuity of dry eye patients. Am J Ophthalmol 2002 ; 133 : 181-6.
[14] Tutt R, Bradley A, Begley C, Thibos LN. Optical and visual impact of tear break-up in human eyes. Invest Ophthalmol Vis Sci 2000 ; 41 : 4117-23.
[15] Rolando M, Lester M, Macri A, Calabria G. Low spatial-contrast sensitivity in dry eyes. Cornea 1998 ; 17 : 376-9.
[16] Puel MC, Benitez-del-Castillo JM, Martinez-de-la-Casa J, et al. Contrast sensitivity and disability glare in patients with dry eye. Acta Ophthalmol Scand 2006 ; 84 : 527-31.
[17] Montes-Mico R, Alio JL, Muñoz G, et al. Postblink changes in total and corneal ocular aberrations. Ophthalmology 2004 ; 111 : 758-67.
[18] Koh S, Maeda N, Kuroda T, et al. Effect of tear film break-up on higher-order aberrations measured with wavefront sensor. Am J Ophthalmol 2002 ; 134 : 115-7.
[19] Liu H, Thibos L, Begley CG, Bradley A. Measurement of the time course of optical quality and visual deterioration during tear break-up. Invest Ophthalmol Vis Sci 2010 ; 51 : 3318-26.
[20] Koh S, Maeda N, Hirohara Y, et al. Serial measurements of higher-order aberrations after blinking in patients with dry eye. Invest Ophthalmol Vis Sci 2008 ; 49 : 133-8.
[21] Goto T, Zheng X, Klyce SD, et al. A new method for tear film stability analysis using videokeratography. Am J Ophthalmol 2003 ; 135 : 607-12.
[22] Szczesna DH, Alonso-Caneiro D, Iskander DR, et al. Predicting dry eye using noninvasive techniques of tear film surface assessment. Invest Ophthalmol Vis Sci 2011 ; 52 : 751-6.
[23] Denoyer A, Rabut G, Baudouin C. Tear film aberration dynamics and vision-related quality of life in patients with dry eye disease. Ophthalmology 2012 ; 119 : 1811-8.
[24] Koh S, Maeda N, Hirohara Y, et al. Serial measurements of Higher-order aberrations after blinking in normal subjects. Invest Ophthalmol Vis Sci 2006 ; 47 : 3318-24.
M.A. Lemp, B.D. Sullivan
L’hyperosmolarité lacrymale est un facteur central au cours de la sécheresse oculaire. De nouvelles techniques permettent une mesure précise de l’osmolarité lacrymale. Ce test semble très prometteur pour diagnostiquer les formes sévères et suivre l’efficacité des traitements. Cependant, plus qu’une valeur seuil, il semble que la valeur la plus élevée et la différence entre deux mesures soient un critère plus fiable, témoin de l’instabilité lacrymale.
L’utilisation de l’osmolarité lacrymale comme marqueur du syndrome sec oculaire (SSO) a été largement étudiée depuis plusieurs années. Le prélèvement de larmes est difficile et son analyse nécessite des instruments de laboratoires spécialisés et de plus grands volumes que ceux qui sont souvent obtenus. Les sujets normaux ont une osmolarité presque identique à celle du sérum sanguin (285–295 mOsm/l), alors que les sujets atteints de SSO présentent des taux plus élevés. Plusieurs mesures indirectes de l’osmolarité lacrymale ont été utilisées comme les propriétés hémolytiques, la dépression du point de congélation ou la conductivité électrique. Plus récemment, une nouvelle méthode utilisant l’impédance électrique a été développée, grâce à une technique pratiquement indépendante du volume (un volume de seulement 50 nl est nécessaire). Elle permet un prélèvement simple, réalisable en quelques secondes [1]. Cette technologie permet des mesures rapides et répétées qui ont à leur tour élargi les connaissances sur la dynamique des larmes et la physiopathologie du SSO. Depuis la publication du Rapport international sur la sécheresse oculaire (Dry Eye Workshop Report ou DEWS) en 2007, plus de 160 articles sur l’osmolarité lacrymale ont été publiés dans la littérature scientifique.
La tonicité des larmes normales est principalement déterminée par sa teneur en cations (sodium, potassium, calcium, magnésium, fer et cuivre) et en anions (chlorures, bicarbonates et phosphates). L’élément le plus abondant est le chlorure de sodium. Une partie de la tonicité est due aux macromolécules comme les protéines ou les sucres qui, en raison de leur poids moléculaire élevé, représentent moins de 2 % de l’ensemble. L’évaporation est la principale méthode par laquelle les larmes se concentrent dans le SSO. L’instabilité du film lacrymal entraîne un amincissement localisé rapide et une perte d’eau. Les modèles théoriques suggèrent que, dans ces petites régions aléatoires d’instabilité, l’osmolarité lacrymale augmente au-dessus de la valeur de référence et induit de façon transitoire une inflammation et de l’apoptose épithéliale. En réponse à ces résultats, certains observateurs se sont opposés à la mesure de l’osmolarité lacrymale au niveau du ménisque lacrymal inférieur. L’échantillonnage direct du film lacrymal sur la surface oculaire serait ainsi plus sensible et représentatif des mécanismes instantanés de formation du film lacrymal. En vérité, le ménisque reflète un réservoir bien homogène qui moyenne les pics transitoires et qui est probablement le seul site stable pour mesurer de façon précise l’osmolarité lacrymale.
Des études réalisées en laboratoire ont complété notre connaissance du rôle de l’osmolarité lacrymale dans la pathogenèse de la maladie. Il a été montré que l’hyperosmolarité lacrymale stimule les voies pro-inflammatoires induisant des lésions tissulaires et elle est avec l’instabilité lacrymale une caractéristique du SSO [2, 3]. L’inflammation constitue l’autre principal sujet de la littérature récente dans la pathogenèse du SSO. Il existe plusieurs causes conduisant au développement du SSO, comme une maladie auto-immune systémique, par exemple le syndrome de Gougerot-Sjögren, une maladie du greffon contre l’hôte, une insuffisance androgénique ; d’autres causes associées incluent le vieillissement et le port de lentilles de contact. Comme cela a été développé par Baudouin, l’ensemble des événements conduisant à la pathogenèse du SSO peut être représenté par un cercle vicieux dans lequel instabilité et hyperosmolarité lacrymale se renforcent mutuellement et conduisent à une augmentation de l’inflammation et à la destruction des tissus [3, 4].
Une fois que ce cercle vicieux a été enclenché, il est démontré que l’exposition à des milieux hyperosmolaires induisait une augmentation de l’activation de la caspase-3 et de l’apoptose, de JNK/ERK [5], de la stimulation des métalloprotéinases matricielles [5, 6], une activation d’EMMPRIN, avec une augmentation de la perméabilité [6], une kératinisation des cellules épithéliales [7] et une surexpression de HLA-DR [8]. Une osmolarité excessive conduit à une augmentation des taux des cytokines contenues dans les larmes, des modifications statistiquement significatives des jonctions intercellulaires épithéliales, des rapports noyau/cytoplasme et des distributions des cellules caliciformes [9]. Les cellules épithéliales de la cornée cultivées dans des milieux hyperosmolaires ont présenté des modifications morphologiques importantes, dont la perte de leurs microvillosités de surface qui sont censées contribuer à réduire le frottement et maintenir l’hydratation à travers la couche de mucines. La perte des microvillosités causée par l’hyperosmolarité permettrait d’expliquer l’augmentation de l’évaporation et les lésions tissulaires observées chez les patients atteints du SSO à un stade plus avancé. Comme l’ont démontré Iwata et al. en 1969, l’altération de la couche lipidique de la surface oculaire compromet l’épithélium cornéen et altère significativement la capacité de maintenir l’hydratation de la surface oculaire [10].
Malgré des progrès importants dans notre connaissance de la pathogenèse du SSO, il reste de nombreux défis en matière de diagnostic, en particulier dans les cas légers à modérés chez lesquels il y a souvent peu de signes cliniques objectifs. La corrélation entre les tests réalisés et les symptômes est faible. Malgré les fonds importants engagés pour développer de nouvelles options thérapeutiques, aucun médicament de fond n’a été approuvé en Europe et seul un médicament a été approuvé aux États-Unis. L’un des principaux obstacles a été l’absence de critères d’évaluation adéquats pour démontrer l’efficacité thérapeutique. Il a été montré que l’hyperosmolarité lacrymale était réduite à des taux normaux lors de l’utilisation de thérapeutiques efficaces reposant sur la ciclosporine, le hyaluronate de sodium et d’autres composés comme les corticoïdes [11]. Étant donné les échecs répétés des grandes études réglementaires fondées sur la coloration de la cornée comme principal critère d’évaluation, il est peut-être temps que le domaine évolue vers une mesure plus centrale à la pathogenèse de la maladie.
Les données les plus récentes ont confirmé le fait que deux valeurs doivent être rapportées pour les tests d’osmolarité lacrymale : la plus élevée des valeurs obtenues pour les deux yeux, qui est plus indicative du processus du SSO, et la valeur de la différence entre les deux yeux, qui donne une idée de l’instabilité du film lacrymal [1]. L’obtention de valeurs élevées pour les deux mesures est due à la perte du contrôle homéostatique de la surface oculaire dans le SSO [4]. Quand un traitement efficace est initié, l’osmolarité et les deux valeurs précédemment citées retournent à des valeurs proches de la normale.
Les études utilisant les méthodes de mesures les plus récentes de l’osmolarité lacrymale (impédance électrique) montrent que de nombreux sujets atteints de SSO présentent une variabilité de l’osmolarité lacrymale entre les deux yeux et dans le même œil dans le temps. Les sujets sains, eux, ne présentent pas cette variabilité [12]. Certains investigateurs n’ont pas fait cette distinction et ont été déconcertés par cette variabilité ; ils ont alors conclu que le test manquait de précision. Des études ultérieures ont démontré que la technologie elle-même est très précise, avec un coefficient de variation dix fois inférieur à celui des autres tests diagnostiques courants comme les bandelettes de tests de la glycémie [13].
Le phénomène d’instabilité est le résultat d’une variation naturelle, d’un stress environnemental, et de tous les mécanismes compensatoires à un moment donné de la mesure. Il est important de saisir cette dynamique de variabilité plutôt que de la masquer en utilisant des valeurs moyennes. En effet, la présence d’une variabilité dans le même œil supérieure à 8 mOsm/l est maintenant considérée comme une preuve supplémentaire de la maladie, et l’existence de valeurs différentes entre les deux yeux constitue un élément que les cliniciens devraient rechercher afin de diagnostiquer la maladie à un stade précoce [1, 13]. De toute évidence, c’est la maladie elle-même qui produit l’instabilité du film lacrymal ; par conséquent, l’instabilité est une caractéristique du SSO.
La difficulté à recueillir des volumes de larmes suffisants contribue au fait que, dans la plupart des études, les mesures ne sont réalisées que dans un seul œil ou sur des échantillons regroupés des deux yeux, ou encore à partir de plusieurs sujets. Ces mêmes études fournissent des informations sur les osmolarités moyennes des différents groupes, mais n’abordent pas les questions de reproductibilité, de variation entre les deux yeux et de variations individuelles. Avant l’avènement des nouvelles technologies, seules quelques petites études ont analysé la reproductibilité de l’osmolarité lacrymale au cours du temps, notamment une publication dans les Transactions of the American Ophthalmological Society qui n’a pas été largement diffusée [14]. Ces publications ont cependant bien identifié que la mesure de l’osmolarité lacrymale permet d’estimer de façon fiable l’instabilité lacrymale chez les patients atteints.
Avant la réglementation de la Food and Drug Administration (FDA) en 2012, 113 systèmes TearLab® ont été installés aux États-Unis dans le cadre d’un programme de surveillance contrôlé par l’État qui a fait appel à des inspecteurs indépendants pour s’assurer que les systèmes étaient en adéquation avec les demandes du fabricant. En une journée, chaque site a réalisé 20 tests sur des patients avec osmolarité normale (297 mOsm/l) et élevée (338 mOsm/l), suivis de 10 jours d’analyse pour chaque groupe. En moyenne, la valeur obtenue le premier jour était de 295,4 ± 4,0 mOsm/l et 338,6 ± 4,8 mOsm/l respectivement. Au cours des 10 jours, une valeur moyenne de 294,1 ± 4,8 mOsm/l et 336,6 ± 5,2 mOsm/l a été obtenue. Comme le nombre de micropuces TearLab® fabriquées a augmenté, la qualité du produit s’est constamment améliorée.
En supposant une distribution normale de la courbe en cloche, obtenir deux tests consécutifs ≥ 4,5 mOsm/l par rapport à la valeur moyenne ne se produit qu’une fois sur cent, ce qui signifie que l’instabilité > 8 mOsm/l est très probablement d’ordre biologique (c’est-à-dire due à la maladie plutôt qu’à la technique de mesure). Comme cela a été démontré par Keech et al. [13], les sujets asymptomatiques ne présentent pratiquement aucune modification au cours du temps de leur osmolarité, avec des écarts-types nettement inférieurs à ceux des sujets atteints, mesurés successivement à des intervalles d’une minute (± 6,2 mOsm/l chez les sujets sains versus ± 11,3 mOsm/l chez les sujets atteints de SSO, p=0,027). Si l’on utilise la valeur maximale de l’osmolarité de chaque individu, les sujets sains ne présentent pas de différence significative entre les mesures prises à des intervalles d’une minute ou même à des intervalles de 15 minutes (302,6 ± 9,1 mOsm/l versus 300,3 ± 6,7 mOsm/l, p=0,526). Il semble donc que la variabilité observée œil par œil ou dans le temps chez un patient peut aider à poser le diagnostic de SSO [13].
Les faibles variations d’osmolarité des sujets sains ont conduit les chercheurs à utiliser la valeur maximale plutôt que la valeur moyenne des tests. Dans l’étude de Keech et al., la valeur moyenne chez les sujets normaux est de 287,7 ± 5,4 mOsm/l, alors que chez les sujets symptomatiques atteints de SSO, les moyennes sont significativement plus élevées : 296,0 ± 7,6 mOsm/l (p=0,002). Lorsque la valeur maximale des mesures de chaque patient était utilisée, les sujets normaux présentaient une moyenne de 301,2 ± 7,2 mOsm/l, alors que les sujets atteints de SSO rapportaient un niveau beaucoup plus élevé, de l’ordre de 323,0 ± 16,7 mOsm/l (p=0,002) [13].
Malheureusement, de nombreux chercheurs préfèrent encore utiliser la valeur moyenne plutôt que la valeur maximale pour rapporter les données. Une étude a porté sur la répartition de l’osmolarité lacrymale dans une petite cohorte de 49 sujets atteints de syndrome de Sjögren. Un seuil de 316 mOsm/l a été utilisé, appliqué à la moyenne des données, et il a malgré tout été constaté que 21/49 des sujets avaient une valeur très élevée [15]. Si les chercheurs avaient utilisé des seuils modernes (tels que ≥ 305 mOsm/l) [16], la proportion aurait augmenté à 34/49, et s’ils avaient utilisé la valeur maximale des deux yeux au lieu de la moyenne, la plupart des sujets atteints du syndrome de Sjögren auraient été considérés comme hyperosmolaires. Dans cette étude, en raison de la façon dont les données ont été recueillies et interprétées, les chercheurs ont publié une opinion peu favorable concernant l’utilisation de l’osmolarité lacrymale comme marqueur de sécheresse, et par ailleurs aucune donnée n’a été rapportée en ce qui concerne les différences entre les deux yeux.
Avec cette nouvelle technologie de mesure de l’osmolarité lacrymale (TearLab®), les modèles statistiques ont confirmé que seulement deux tests, un par œil, sont nécessaires pour produire une mesure ayant une variabilité de l’ordre de 1 % par rapport à la moyenne réelle, ce qui renforce la nécessité de devoir tester les deux yeux une fois dans le cadre d’un examen standard de l’osmolarité avec le système TearLab®. En contradiction directe avec ces derniers résultats, une des études précédentes utilisant le même système, afin d’étudier la reproductibilité de l’osmolarité lacrymale, a conclu que « seule la moyenne de trois mesures consécutives (318–320 mOsm/l) permettrait de diagnostiquer un SSO » [17]. Avec du recul, nous constatons que les auteurs ont appliqué la moyenne plutôt que la valeur maximale entre les deux yeux et qu’ils n’ont pas utilisé de seuils modernisés pour le diagnostic. Si les chercheurs avaient appliqué de tels seuils, considéré la valeur maximale des tests consécutifs, et pris en compte la différence entre les deux yeux, 100 % de leurs données auraient permis d’identifier correctement les patients atteints du SSO, comme indiqué dans le tableau 3-4. Compte tenu des connaissances que nous avons maintenant des variations attendues chez les sujets atteints du SSO, ces données sont très encourageantes et contrastent avec les conclusions initiales de cette étude, à savoir qu’il était « nécessaire de remédier à la variabilité instrumentale du TearLab® qui pouvait le rendre non fiable pour diagnostiquer un syndrome sec oculaire modéré. » Par ailleurs, si l’on compare les données du tableau 3-4 à celles recueillies chez des sujets sains, présentées dans le tableau 3-5, nous observons qu’il existe de grandes différences entre les patients atteints de syndrome sec modéré et les patients sains. En pratique clinique, les données sont rarement aussi claires, mais c’est précisément l’intérêt de telles techniques. Le SSO est une maladie progressive. Lorsque la sévérité de la maladie augmente, l’instabilité lacrymale progresse, suivie d’augmentations concomitantes de l’osmolarité attendue et de différences entre les deux yeux [1]. Il est important que les cliniciens reconnaissent une différence entre les deux yeux de plus de 8 mOsm/l comme une caractéristique de la maladie, même si l’osmolarité n’a pas encore dépassé la valeur seuil de 308 mOsm/l.
Tableau 3-4 Mesures consécutives réalisées chez un patient atteint de syndrome sec oculaire modéré [17].
Tableau 3-5 Mesures consécutives réalisées chez un patient sain [13].
Une revue de la littérature plus récente révèle que l’osmolarité lacrymale « est corrélée avec la sévérité de la maladie et est considérée comme étant la meilleure mesure pour diagnostiquer et classer le syndrome sec » [1, 3, 12]. En accord avec les études précédentes ayant montré que l’osmolarité était supérieure en termes de précision à tous les autres tests utilisés pour le diagnostic du syndrome sec oculaire [3], des données récentes utilisant le système TearLab® ont rapporté que l’osmolarité du film lacrymal est significativement plus élevée chez les patients atteints de kératoconjonctivite sèche sévère comparés aux contrôles sains. L’analyse de l’osmolarité du film lacrymal peut être un outil diagnostique objectif pertinent pour le diagnostic du syndrome sec oculaire [3]. De plus, une osmolarité lacrymale > 305 mOsm/l a été choisie comme valeur seuil pour le SSO : l’osmolarité est plus efficace que les autres tests considérés pour diagnostiquer un syndrome sec, principalement en présence d’une forme sévère. Les valeurs de l’osmolarité lacrymale doivent être interprétées comme un indicateur du processus évolutif du SSO vers la sévérité [16]. Une étude longitudinale réalisée en 2012 a montré que l’osmolarité lacrymale est le moins variable de tous les signes courants du SSO sur des échelles de temps cliniquement pertinentes [18].
Malgré plusieurs publications montrant l’utilité clinique de l’osmolarité lacrymale dans le diagnostic du SSO, il existe encore une certaine confusion en ce qui concerne les valeurs seuil. Une grande revue rétrospective des principales publications sur ce sujet a été publiée en 2006. Dans cette revue, Tomlinson et al. ont décrit les résultats des principales études et recommandé d’utiliser 316 mOsm/l comme valeur de référence utile (valeur seuil) pour le diagnostic du SSO [19]. Il convient de noter cependant que les études citées étaient fortement pondérées par une forme plus sévère de la maladie. Des études plus récentes de plus grands groupes suggèrent des valeurs de diagnostic moins élevées : une analyse complète réalisée par un groupe italien indépendant a suggéré que 305 mOsm/l était la valeur seuil optimale [16]. Une étude multicentrique regroupant 10 sites dans l’Union Européenne et aux États-Unis trouvait qu’une valeur de 308 mOsm/l avait de très bonnes sensibilité et spécificité chez les sujets atteints d’un SSO léger, alors qu’une valeur de 316 mOsm/l était un bien meilleur marqueur du SSO modéré [1]. Il ne faut pas oublier cependant que, comme dans la plupart des maladies, les valeurs de références diagnostiques ne sont pas absolues et sont surtout des repères utiles lors du suivi de la maladie.
L’osmolarité du film lacrymal peut être utile dans la surveillance de l’efficacité des traitements de la sécheresse oculaire. Les marqueurs du SSO varient indépendamment les uns des autres, et il existe peu de corrélation entre les signes et les symptômes initiaux [3]. Néanmoins, lors de la mise en place d’un traitement efficace et dans des conditions contrôlées, les modifications de l’osmolarité lacrymale sont corrélées avec l’amélioration clinique, comme cela a été démontré à de nombreuses reprises par le passé [18].
À notre connaissance, il n’y a pas eu de grandes études contrôlées, randomisées validant l’utilisation de l’osmolarité lacrymale comme marqueur de la maladie. Heureusement, il existe des dizaines d’études contrôlées, randomisées plus petites qui démontrent l’efficacité de l’osmolarité lacrymale pour suivre la progression de la maladie. Par exemple, une étude récente (n=27) sur les effets d’un traitement combiné par méthylprednisolone et hyaluronate de sodium sans conservateur à 0,1 % a démontré une réduction significative de l’osmolarité à 8 semaines associée à une réduction significative des taux d’IL-1β et d’IL-8 (également à 8 semaines) ainsi que du TBUT (tear film breack-up time), et de la prise de fluorescéine par la cornée et la conjonctive. Les auteurs ont conclu que « en mesurant les modifications des taux des cytokines et de l’osmolarité lacrymale, on pouvait évaluer objectivement les effets anti-inflammatoires de la méthylprednisolone topique utilisée comme traitement de la sécheresse modérée à sévère » [11]. Une étude clinique similaire utilisant un hyaluronate de sodium modifié appliqué trois fois par jour sur une durée de 8 semaines a montré une amélioration significative du score OSDI (Ocular Surface Disease Index ; 21,9 versus 35,8), du TBUT (6,5 versus 5,2 secondes), de la densité des cellules caliciformes de la conjonctive (140,8 versus 115,1 cellules/mm2), des scores d’Oxford des lésions de la cornée et de la conjonctive (0,56 versus 1,16) et de l’osmolarité lacrymale (294,6 versus 303,1 mOsm/l), avec p<0,01 pour toutes les mesures [20].
Des études concernant le traitement par sérum autologue ont montré que 4 semaines de traitement réduisaient le score OSDI de 32,5 à 8,9, ainsi que l’osmolarité (de 311,1 à 285,1). Cette réduction de 26 mOsm/l était associée à une modification substantielle des symptômes et à une baisse des scores de coloration de la cornée et de la conjonctive [21]. Une étude comparable portant sur 30 sujets atteints de la maladie du greffon contre l’hôte ou du syndrome de Sjögren a analysé les effets du sérum de sang de cordon ombilical et observé une réduction significative des lésions épithéliales cornéennes (16,1 versus 40,9 mm2), du score OSDI (22,3 versus 39,3), du score de cytologie obtenu par grattage (3,8 versus 6,6), et de l’osmolarité lacrymale (312,5 versus 322 mOsm/l) [22].
Une étude récente en cross-over, utilisant l’osmolarité lacrymale comme marqueur pour chacune des phases (traitement, washout et placebo), a pu démontrer un lien de causalité entre le traitement et l’amélioration clinique. Dans le groupe A, l’osmolarité lacrymale débutait à 361 mOsm/l, chutait à 310 mOsm/l sous corticothérapie, remontait à 325 mOsm/l pendant la phase de washout, puis restait élevée à 330 mOsm/l pendant la phase de placebo. Dans le groupe B, l’osmolarité lacrymale débutait à 360 mOsm/l, se maintenait à un niveau élevé à 351 mOsm/l pendant la phase de placebo, augmentait jusqu’au niveau initial à 360 mOsm/l pendant la phase de washout, puis diminuait de façon significative à 297 mOsm/l pendant la phase de traitement. Des tendances similaires ont été observées pour le TBUT et le score de Schirmer, ce qui démontre que, lorsqu’un traitement efficace est appliqué, l’osmolarité lacrymale est très utile pour suivre l’amélioration clinique [23].
Plusieurs études publiées ont également comparé l’efficacité des larmes artificielles en utilisant l’osmolarité comme critère d’évaluation. Une étude récente comparant la carboxyméthylcellulose et le hyaluronate de sodium (n=82) a montré des améliorations similaires de l’osmolarité lacrymale, des scores de coloration, des scores OSDI et des tests de Schirmer sur une durée de 35 jours [24]. Benelli et al. (n=60) ont étudié les différences entre les larmes artificielles contenant de la carboxyméthylcellulose, du hyaluronate de sodium ou de l’hydroxypropyl-guar (HP-guar). Des différences statistiquement significatives à court terme ont été observées entre les groupes, mais aucune différence significative n’a finalement été observée entre les traitements à l’issue de l’étude [25]. Les auteurs ont conclu que « l’osmolarité lacrymale constitue le test le plus objectif pour déterminer une amélioration chez les patients atteints du SSO », comparée au TBUT et au test de Schirmer. Une étude a examiné les effets à court terme des larmes artificielles et a montré que le temps d’utilisation pourrait être déterminé de façon précise grâce à l’utilisation de l’osmolarité lacrymale, le hyaluronate de sodium réduisant l’osmolarité lacrymale pendant environ 180 minutes, alors que la carboxyméthylcellulose permettrait de normaliser les valeurs pendant environ 120 minutes [26].
Une des plus grandes (n=135) et plus longues études comparatives portant sur l’efficacité des larmes artificielles a comparé le hyaluronate de sodium et une association d’hydroxypropoxyméthylcellulose (HPMC) et de dextran, appliqués six fois par jour pendant 90 jours. Les auteurs ont trouvé une différence significative entre les deux groupes. Ils ont constaté que l’amélioration de l’osmolarité était parfaitement corrélée avec les signes et symptômes : « Les améliorations du BUT, des scores de coloration conjonctivale, du score de Schirmer I et des symptômes étaient enregistrées dans les deux groupes. Il existait des différences significatives pour les patients traités par le hyaluronate de sodium hypotonique à 0,4 %. L’osmolarité lacrymale passait de 353 ± 23 à 305 ± 6 mOsm/l dans le groupe traité par le hyaluronate de sodium et de 346 ± 15 à 336 ± 8 mOsm/l dans le groupé traité par l’HPMC à 0,3 % (p<0,001 entre les groupes) » [27]. D’autres études d’efficacité à long terme sur les agents lubrifiants ont montré des réductions significatives de l’osmolarité de 34 à 25 mOsm/l sur 12 semaines associées à des améliorations de 26 à 28 points des scores OSDI, même si les effets étaient comparables entre les différents composés [28].
L’isotrétinoïne, utilisée pour altérer la production des glandes sébacées dans l’acné et connue pour avoir des effets oculaires délétères (probablement à cause de sa capacité d’inhiber les glandes de Meibomius), augmenterait de façon significative l’osmolarité lacrymale de 304,9 mOsm/l à 316,3 mOsm/l (p<0,005). Les glandes de Meibomius seraient significativement atrophiques, la viscosité des sécrétions significativement augmentée de 1,7 à 3,1 (p<0,005), et le volume exprimable des sécrétions significativement diminué de 1,5 à 1,1 (p<0,05) sur une échelle de 1 à 4 [29].
Il a été montré que l’application chronique d’un autre produit irritant la surface oculaire, le chlorure de benzalkonium, induisait une hyperosmolarité chez la majorité des patients. Dans cette étude sur une cohorte de 40 sujets, l’osmolarité était significativement corrélée avec les symptômes, comme le montraient le score OSDI (r=0,486 ; p=0,002) et le TBUT (r=–0,49 ; p=0,009), avec une corrélation significative entre l’osmolarité et le nombre de traitements (r=0,409 ; p=0,009), et avec le nombre d’instillations de collyres avec conservateur (r=0,629 ; p<0,0001) [30].
Dans l’ensemble, ces données confirment définitivement que l’osmolarité lacrymale est une mesure permettant de suivre les effets thérapeutiques. L’étude singulière qui suggère le contraire [31] n’a probablement pas pris en compte le fait que l’osmolarité tend à atteindre un équilibre avant d’autres signes tels que les scores de coloration ou les symptômes cliniques [18].
Le SSO est une maladie habituellement bilatérale. L’unité fonctionnelle lacrymale comprend les glandes lacrymales et les glandes de Meibomius, les glandes de la conjonctive produisant les mucines, la surface cornéenne, la conjonctive et le tractus lacrymal excréteur. Ces éléments interagissent dans un réseau de neurones interconnectés et l’altération de n’importe quel composant de ce système en réponse à un stress environnemental peut entraîner une rupture du contrôle homéostatique de la surface oculaire. Il existe des troubles entraînant un SSO unilatéral comme certaines neuropathies ou certaines anomalies palpébrales, mais ces derniers sont relativement rares.
Récemment, il a été montré que les patients atteints de kératite herpétique unilatérale présentaient une diminution de la sensibilité cornéenne et de la production de larmes. Ils présentaient également une production réduite de larmes dans l’œil controlatéral, indiquant un mécanisme de contrôle central régissant la production des larmes. Il a été montré que l’utilisation de l’osmolarité lacrymale à partir des données de l’œil controlatéral était aussi utile pour déterminer la présence et la sévérité d’un SSO que l’utilisation des données répétées du même œil.
L’insuffisance lacrymale liée à une hyposécrétion et celle liée à une hyperévaporation par dysfonctionnement des glandes de Meibomius sont les principaux sous-types du SSO. Alors que l’hyposécrétion pure est le sous-type le moins fréquent, le dysfonctionnement des glandes de Meibomius est très courant dans la population âgée et la plupart des patients atteints d’un SSO modéré à sévère présentent les deux sous-types de la maladie. La connaissance de ces données est importante pour développer une stratégie thérapeutique efficace.
Le SSO est souvent présenté comme une maladie entraînant de nombreux symptômes, ce qui implique que la réduction des symptômes des patients est l’objectif le plus important du traitement. Des études récentes ont démontré qu’une grande proportion de patients atteints d’un SSO cliniquement prouvé ne rapportaient pas de symptômes dans des questionnaires largement utilisés. Dans une grande étude fondée sur une population de patients atteints de dysfonctionnement des glandes de Meibomius en Espagne, le nombre de patients asymptomatiques était plus élevé que celui de patients symptomatiques. Bien que certains de ces résultats puissent être attribués aux limitations des questionnaires, le fait de ne se fier qu’aux symptômes pour identifier les patients atteints de SSO dans la pratique et pour l’inclusion dans des études cliniques n’est vraisemblablement pas recommandé. De récents rapports ont étudié l’influence de plusieurs facteurs sur la génération des symptômes, comme les différences de sensibilité corporelle, les états psychologiques des patients (tels que la dépression), et les différents effets de l’inflammation sur la conduction nerveuse à la surface oculaire. Ils soulignent tous qu’il faut développer de meilleures méthodes pour mesurer l’inconfort, notamment par le biais de questions portant sur la qualité de vie.
Un des principaux résultats des études récentes est qu’aucun marqueur couramment utilisé dans les SSO n’est bien corrélé avec les autres marqueurs ou avec les symptômes. C’est particulièrement vrai dans les formes légères à modérées de la maladie dans lesquelles des signes contradictoires sont fréquents. Dans les cas les plus sévères pour lesquels la rupture de l’homéostasie de la surface oculaire est marquée, tous les signes sont susceptibles d’être positifs. Une approche objective pour valider des marqueurs individuels consiste à construire un modèle composite avec une échelle de sévérité dans laquelle tous les signes et symptômes objectifs couramment utilisés sont pondérés de la même manière afin de ne pas en avantager un plus que les autres. Il est alors possible de tracer la relation des tests individuels en fonction de l’échelle de sévérité composite. Ces calculs ont montré que seule l’osmolarité lacrymale était associée de façon linéaire à l’augmentation de la sévérité du SSO quelle que soit la sévérité de la maladie. Ainsi, à lui seul, ce marqueur est aussi utile qu’une liste complète de tests cliniques. L’utilité clinique de ce modèle a été validée dans un rapport indépendant récent [32].
Dans une revue récente de la littérature scientifique remontant jusqu’en 1961, 220 publications en anglais ont été identifiées ; les conclusions étaient positives dans 186 publications, neutres dans 29 et négatives dans 5. Elles portent sur le diagnostic du SSO, la prise en charge de la maladie, et l’utilisation de l’osmolarité lacrymale comme critère d’évaluation dans les essais cliniques. Chacune des études négatives était caractérisée par une erreur statistique, de méthodologie et/ou conceptuelle comme détaillé ci-dessus. Malheureusement, la plupart des publications positives n’ont pas suivi les recommandations de la FDA pour ce qui concerne l’utilisation des données, à savoir analyser les deux yeux, utiliser la valeur la plus élevée et enregistrer la différence entre les deux yeux. Néanmoins, elles ont révélé l’utilité clinique de l’osmolarité lacrymale dans tous ces domaines. Le rôle essentiel de l’osmolarité dans l’évaluation de la maladie, de sa sévérité et de la réponse au traitement doit être plus largement étudié car celle-ci non seulement constitue un outil clinique utile qui reflète un mécanisme pathologique central de la maladie, mais elle permet aussi une mesure objective de la sévérité du SSO et de la réponse au traitement.
[1] Lemp MA, Bron AJ, Baudouin C, et al. Tear osmolarity in the diagnosis and management of dry eye disease. Am J Ophthalmol 2011 ; 151 : 792-8.
[2] Pflugfelder SC, De Paiva CS, Tong L, et al. Stress-activated protein kinase signaling pathways in dry eye and ocular surface disease. Ocul Surf 2005 ; 3 : S154-7.
[3] Baudouin C, Aragona P, Messner EM, et al. Role of hyperosmolarity in the pathogenesis and management of dry eye disease : proceeding of the OCEAN group meeting. Ocul Surf 2013 ; 11 : 246-58.
[4] Baudouin C. A new approach for better comprehension of diseases of the ocular surface. J Fr Ophtalmol 2007 ; 30 : 239-46.
[5] Li DQ, Chen Z, Song XJ, Luo L, Pflugfelder SC. Stimulation of matrix metalloproteinases by hyperosmolarity via a JNK pathway in human corneal epithelial cells. Invest Ophthalmol Vis Sci 2004 ; 45 : 4302-11.
[6] Huet E, Vallée B, Delbé J, et al. EMMPRIN modulates epithelial barrier function through a MMP-mediated occludin cleavage : implications in dry eye disease. Am J Pathol 2011 ; 179 : 1278-86.
[7] Chen Z, Tong L, Li Z, et al. Hyperosmolarity-induced cornification of human corneal epithelial cells is regulated by JNK MAPK. Invest Ophthalmol Vis Sci 2008 ; 49 : 539-49.
[8] Versura P, Profazio V, Schiavi C, Campos EC. Hyperosmolar stress upregulates HLA-DR expression in human conjunctival epithelium in dry eye patients and in vitro models. Invest Ophthalmol Vis Sci 2011 ; 52 : 5488-96.
[9] Aragona P, Giuffrida S, Di Stefano G, et al. Ocular surface changes in type 1 diabetic patients. Adv Exp Med Biol 2002 ; 506 : 667-72.
[10] Iwata S, Lemp MA, Holly FJ, Dohlman CH. Evaporation rate of water from the precorneal tear film and cornea in the rabbit. Invest Ophthalmol 1969 ; 8 : 613-9.
[11] Lee JH, Min K, Kim SK, et al. Inflammatory cytokine and osmolarity changes in the tears of dry eye patients treated with topical 1 % methylprednisolone. Yonsei Med J 2014 ; 55 : 203-8.
[12] Sullivan BD, Whitmer D, Nichols KK, et al. An objective approach to dry eye disease severity. Invest Ophthalmol Vis Sci 2010 ; 51 : 6125-30.
[13] Keech A, Senchyna M, Jones L. Impact of time between collection and collection method on human tear fluid osmolarity. Curr Eye Res 2013 ; 38 : 428-36.
[14] Farris RL, Stuchell RN, Mandel ID. Tear osmolarity variation in the dry eye. Trans Am Ophthalmol Soc 1986 ; 84 : 250-68.
[15] Bunya VY, Langelier N, Chen S, et al. Tear osmolarity in Sjögren syndrome. Cornea 2013 ; 32 : 922-7.
[16] Versura P, Profazio V, Campos EC. Performance of tear osmolarity compared to previous diagnostic tests for dry eye diseases. Curr Eye Res 2010 ; 35 : 553-64.
[17] Khanal S, Millar TJ. Barriers to clinical uptake of tear osmolarity measurements. Br J Ophthalmol 2012 ; 96 : 341-4.
[18] Sullivan BD, Crews LA, Sönmez B, et al. Clinical utility of objective tests for dry eye disease : variability over time and implications for clinical trials and disease management. Cornea 2012 ; 31 : 1000-8.
[19] Tomlinson A, Khanal S, Ramaesh K, et al. Tear film osmolarity : determination of a referent for dry eye diagnosis. Invest Ophthalmol Vis Sci 2006 ; 47 : 4309-15.
[20] Versura P, Profazio V, Giannaccare G, et al. Discomfort symptoms reduction and ocular surface parameters recovery with Artelac Rebalance treatment in mild-moderate dry eye. Eur J Ophthalmol 2013 ; 23 : 488-95.
[21] Na KS, Kim MS. Allogeneic serum eye drops for the treatment of dry eye patients with chronic graft-versus-host disease. J Ocul Pharmacol Ther 2012 ; 28 : 479-83.
[22] Versura P, Profazio V, Buzzi M, et al. Efficacy of standardized and quality-controlled cord blood serum eye drop therapy in the healing of severe corneal epithelial damage in dry eye. Cornea 2013 ; 32 : 412-8.
[23] Scuderi G, Contestabile MT, Gagliano C, et al. Effects of phytoestrogen supplementation in postmenopausal women with dry eye syndrome : a randomized clinical trial. Can J Ophthalmol 2012 ; 47 : 489-92.
[24] Baudouin C, Cochener B, Pisella PJ, et al. Randomized, Phase III study comparing osmoprotective carboxymethylcellulose with sodium hyaluronate in dry eye disease. Eur J Ophthalmol 2012 ; 22 : 751-61.
[25] Benelli U, Nardi M, Posarelli C, Albert TG. Tear osmolarity measurement using the tearlab osmolarity system in the assessment of dry eye treatment effectiveness. Cont Lens Anterior Eye 2010 ; 33 : 61-7.
[26] Montani G. Intrasubject tear osmolarity changes with two different types of eyedrops. Optom Vis Sci 2013 ; 90 : 372-7.
[27] Iester M, Orsoni GJ, Gamba G, et al. Improvement of the ocular surface using hypotonic 0.4 % hyaluronic acid drops in keratoconjunctivitis sicca. Eye (Lond) 2000 ; 14(Pt 6) : 892-8.
[28] Cömez AT, Tufan HA, Kocabıyık O, Gencer B. Effects of lubricating agents with different osmolalities on tear osmolarity and other tear function tests in patients with dry eye. Curr Eye Res 2013 ; 38 : 1095-103.
[29] Mathers WD, Shields WJ, Sachdev MS, et al. Meibomian gland morphology and tear osmolarity : changes with Accutane therapy. Cornea 1991 ; 10 : 286-90.
[30] Labbé A, Terry O, Brasnu E, et al. Tear film osmolarity in patients treated for glaucoma or ocular hypertension. Cornea 2012 ; 31 : 994-9.
[31] Amparo F, Jin Y, Hamrah P, et al. What is the value of incorporating tear osmolarity measurement in assessing patient response to therapy in dry eye disease ? Am J Ophthalmol 2014 ; 157 : 69-77.
[32] See C, Bilonick RA, Feuer W, Galor A. Comparison of two methods for composite score generation in dry eye syndrome. Invest Ophthalmol Vis Sci 2013 ; 5 : 6280-6.
S. Barabino, Y. Chen, S.K. Chauhan, R. Dana
La surface oculaire est une entité morphofonctionnelle immunitaire à part entière. Son équilibre immun repose sur l’immaturité des cellules présentatrices de l’antigène et la présence de lymphocytes T suppresseurs et régulateurs. L’absence de vascularisation hématique et lymphatique conditionne aussi le privilège immunitaire de la surface oculaire. La sécheresse oculaire crée les conditions d’une rupture de l’homéostasie immunitaire, enclenchant ainsi un cycle inflammatoire chronique. Les nouvelles stratégies immunomodulatrices constituent une voie thérapeutique d’avenir.
Près de 5 millions d’Américains souffriraient de sécheresse oculaire avérée, mais il est probable que des dizaines de millions présentent une forme moins sévère, donc mal diagnostiquée, qui nuit à la qualité de vie essentiellement de façon épisodique et dans certaines conditions comme les atmosphères sèches ou le port de lentilles de contact [1]. La sécheresse oculaire est aujourd’hui définie comme « une maladie multifactorielle des larmes et de la surface oculaire, qui se traduit par des symptômes d’inconfort, une gêne visuelle et une dégradation du film lacrymal voire de la surface oculaire, évoluant dans le cadre d’une hyperosmolarité lacrymale et d’une inflammation tissulaire » [2]. Il existe peu de traitements curatifs. Ainsi, la prévalence élevée de la sécheresse oculaire ainsi que son impact au quotidien sont autant d’arguments pour avancer rapidement dans la compréhension des mécanismes pathogéniques qui sous-tendent l’affection, avec pour objectif ultime le développement de nouvelles stratégies thérapeutiques adaptées.
Des études récentes ont démontré que la surface oculaire était non seulement une entité fonctionnelle participant à la vision, mais aussi une entité morphologique singulière sur le plan immunologique capable de répondre de façon spécifique aux différents stimuli internes et externes.
Les trois facteurs spécifiques majeurs qui déterminent la réponse immune de la surface oculaire sont :
-
les cellules résidentes présentatrices de l’antigène (antigen presentating cells [APC]) ;
-
les lymphocytes T régulateurs (Tregs) de la surface oculaire ;
-
l’absence de vaisseaux sanguins et lymphatiques.
Les APC sont des cellules spécialisées dans la capture, le conditionnement et la présentation des antigènes aux lymphocytes T, ainsi que la genèse de costimuli induisant la différenciation et la prolifération des lymphocytes. Les APC sont essentiellement situées en cornée périphérique et au niveau du limbe [3]. En conditions physiologiques, celles-ci présentent un phénotype d’immaturité – peu ou pas d’expression d’antigènes de classe II du complexe majeur d’histocompatibilité (CMH-II), de B7 ni de CD40 à la membrane –, contribuant probablement au phénomène de tolérance des lymphocytes T [4]. En revanche, dans des conditions pathologiques, les APC développent une maturité immunitaire, exprimant ainsi les CMH-II et des protéines membranaires de costimulation induites par certaines cytokines pro-inflammatoires comme l’IL-1 (interleukine 1) et le TNF (tumor necrosis factor) [5]. Dans ce cas de figure, un certain nombre de facteurs régulateurs contrôlent la réponse du système immunitaire au niveau de la surface oculaire : le TGF-β (transforming growth factor beta), retrouvé dans les larmes [6], qui réprime la maturation des APC ; le peptide vasoactif intestinal (VIP) sécrété par les terminaisons nerveuses [7], qui diminue la synthèse des cytokines pro-inflammatoires (IL-1, TNF-α) et augmente celle de certaines cytokines anti-inflammatoires (TGF, IL-10) via les récepteurs du VIP exprimés par les macrophages [8] ; et les récepteurs IL-1 Ra susceptibles de capturer et de neutraliser l’IL-1 circulante [9].
La réponse des lymphocytes T est ainsi régulée par les APC qui migrent vers le système lymphoïde, stimulent les cellules T naïves, lesquelles vont alors infiltrer en retour la surface oculaire. Les recherches dans ce domaine suggèrent l’existence d’une population de lymphocytes Tregs chargés de moduler les effets inflammatoires et délétères des lymphocytes T activés. Ainsi, plusieurs populations de Tregs se dessinent [10] :
-
Tregs suppresseurs : CD4+ CD25+ Foxp3+, caractérisés par la synthèse de cytokines anti-inflammatoires (IL-10 et TGF-β) ainsi que leurs effets immunosuppresseurs directs par interaction avec les APC et les autres populations de lymphocytes T [11] ;
-
Tregs modulateurs : CD8+ qui synthétisent de l’IL-10 [12] et inhibent les APC par contact direct [13], mais aussi détruisent les cellules cibles [14].
L’absence de vascularisation sanguine et lymphatique est un facteur déterminant de la transparence cornéenne, et participe communément au privilège immunitaire [15]. Des études récentes suggèrent néanmoins qu’il ne s’agit pas d’un phénotype statique, mais bien du résultat de processus dynamiques, fruits d’une balance entre des mécanismes proangiogéniques et des mécanismes antiangiogéniques, essentiellement au niveau de l’épithélium cornéen [16]. En conditions physiologiques, la cornée synthétise le récepteur soluble au vascular endothelial growth factor (VEGF, ici sVEGF-R1) qui capturerait le VEGF-A proangiogénique [17]. De même, l’épithélium cornéen exprime de façon constitutive le récepteur VEGF-R3 qui capte les VEGF-C et VEGF-D, contribuant ainsi à la régulation de l’immunité de la surface oculaire par inhibition de l’angiogenèse sanguine et lymphatique. D’autres facteurs antiangiogéniques sont exprimés constitutivement par la cornée : la thrombospondine-1 [18] qui inhibe la néovascularisation d’origine inflammatoire [19] ; l’antagoniste du récepteur IL-1 Ra [20] ; et certains inhibiteurs des métalloprotéinases (MMP), les tissue inhibitors of metalloproteinases 1 et 2 (TIMP-1 et TIMP-2), présents dans les larmes [21, 22].
Enfin, certains ligands des récepteurs d’apoptose exprimés à la surface des cellules épithéliales cornéennes contribueraient à l’immunomodulation de la réponse oculaire : PDL-1, constitutivement exprimé par l’épithélium [23] et l’endothélium [24], se lierait à PD-1 à la surface des lymphocytes T activés et inhiberait ainsi leur prolifération ainsi que la synthèse de cytokines pro-inflammatoires [24]. FasLigand induirait une apoptose des lymphocytes T activés en se liant au récepteur Fas [25], diminuant ainsi l’inflammation de la surface oculaire.
L’expression clinique de la sécheresse oculaire présente une grande variabilité et nécessite parfois des examens spécifiques pour parvenir à un diagnostic de certitude. L’ensemble des altérations de la surface oculaire au cours de la sécheresse est conditionné par des processus immunologiques.
La phase initiale pourrait reposer sur l’activation des acteurs de l’immunité innée. Dans un modèle de souris souffrant de sécheresse oculaire, une activation précoce des lymphocytes NK sécrétant de l’interféron gamma (INF-γ) a été rapportée comme la cause directe de dégradation des tissus et de la maturation des APC dans le compartiment lymphoïde [26]. Parallèlement, l’expression et l’activation précoce des récepteurs toll-like (TLR) participeraient aussi à l’apoptose des cellules de la surface oculaire retrouvée au cours de la sécheresse [27, 28], l’inhibition expérimentale de TLR4 diminuant la sévérité de la maladie [29]. Ainsi, la libération de fragments de chromatine et de protéines du ribosome activerait les TLR et conduirait in fine à la synthèse de cytokines, chimiokines et molécules d’adhésion pro-inflammatoires via une cascade de signaux intracellulaires liés aux TLR (MyD88>IRAK>AP-1/NFkB/IRF-5) [30].
Les cytokines IL-1α, IL-1β, TNF-α, IL-6, IL-23, IL-17 et IFN-γ sont surexprimées dans des modèles expérimentaux de sécheresse oculaire [31] et chez les patients souffrant de sécheresse [32]. L’IL-1 et le TNF-α stimulent le recrutement, l’activation et la prolifération des lymphocytes au niveau des sites inflammatoires en induisant une expression membranaire épithéliale de molécules d’adhésion (ICAM-1 pour intercellular adhesion molecule) [33], et celle de MHC-II et B7 à la surface des APC [5]. L’IL-6, dont l’augmentation de concentration dans les larmes serait corrélée à la sévérité de l’atteinte [34], et le TGF-β favorisent le développement de lymphocytes Th17 [35]. Les chimiokines, des cytokines de faible poids moléculaire jouant un rôle clé dans la communication intercellulaire et la régulation du trafic des cellules de l’immunité, semblent aussi très impliquées au niveau de la surface oculaire au cours des sécheresses primitives ou en cas d’inflammation induite de la surface oculaire [36]. Ainsi, l’expression de CXCL-9, -10, -11, de CCR5 et CXCR3 serait augmentée dans la maladie de Sjögren. En outre l’expression de CCL20 accrue au cours de la sécheresse oculaire induirait le recrutement des Th17 au niveau de la surface oculaire en conditions inflammatoires [32, 37].
L’épithélium et le stroma cornéens hébergent des APC résidentes et immatures CD11b+ et CD11c+ qui pourraient initier une réponse immunitaire de type « acquis » au cours de la sécheresse oculaire [38]. Ce phénomène bien connu au cours du rejet de greffe [39] semble cependant mal compris dans les pathologies inflammatoires de la surface comme la sécheresse. Des modèles de sécheresse induite par stress dessicatif montrent une infiltration accrue d’APC CD11b+ ainsi qu’une surexpression de MHC-II à leur surface, recrutement aussi constaté in vivo par l’excès de cellules dendritiques observées dans la cornée au cours de la maladie de Sjögren [40]. Récemment, il a été montré qu’une néoangiogenèse lymphatique centripète survenait dans la cornée d’un modèle animal de sécheresse, via IL-17 et la voie du VEGF-R3 [41]. Ces lymphatiques conduiraient ainsi les APC vers les centres lymphoïdes dans lesquels elles stimuleraient la genèse de sous-populations de lymphocytes autoréactifs, particulièrement l’émergence d’une population Th17 CD4+ synthétisant de l’IL-17 et retrouvée de façon prépondérante en cas de sécheresse oculaire [42]. La surexpression d’IL-17 a été rapportée chez l’animal et chez l’homme [32, 38], et l’inhibition des effets de celle-ci conduit expérimentalement à une diminution de la sévérité de la maladie en favorisant l’activité modulatrice des Tregs CD4+. Enfin, les lymphocytes Th17 « mémoire » seraient les responsables principaux de la chronicité de la sécheresse [43].
Administrés 3 à 4 fois par jour sur une période de quelques semaines, les corticoïdes locaux permettent d’améliorer significativement la maladie, en termes de symptômes mais aussi de signes cliniques, chez des patients atteints de sécheresse modérée à sévère dans le cadre d’un syndrome de Gougerot-Sjögren. Ces résultats ont aussi été rapportés dans un groupe de patients traités par méthylprednisolone sans conservateur puis occlusion des points lacrymaux comparativement à un autre groupe traité par occlusion seule [44].
L’effet immédiat des corticoïdes sur la surface oculaire repose sur la diminution de l’inflammation et de l’expression de MMP-9 qui renforce l’épithélium cornéen et restaure ainsi la barrière épithéliale [45]. En revanche, les corticoïdes conventionnels administrés au long cours sont associés à des effets iatrogènes sévères (cataracte, glaucome, infection), et sont donc à réserver aux formes graves ou bien en cure courte. Ainsi, les corticoïdes à potentiel anti-inflammatoire inférieur, moins délétères pour l’œil, sembleraient mieux adaptés au traitement de la sécheresse oculaire. Pflugfelder et al. ont rapporté que l’utilisation thérapeutique d’étabonate de lotéprednol était efficace sur l’atteinte clinique sans entraîner d’hypertonie oculaire [46]. La réponse aux corticoïdes locaux peut être considérée comme une réponse « éclair », d’où l’intérêt de cures courtes à dose efficace, contrairement à l’utilisation de la ciclosporine A, plutôt efficace sur le long terme.
La ciclosporine A agit par inhibition de l’activation des lymphocytes T et inhibition de l’apoptose. L’activation lymphocytaire entraîne une cascade de réactions intracellulaires (stimulation de la calcineurine-phosphatase, migration du facteur nucléaire NF-AT) conduisant à la transcription de certaines cytokines pro-inflammatoires, comme l’IL-2. Celle-ci active à son tour des récepteurs membranaires des lymphocytes T, induisant alors l’activation et la prolifération lymphocytaires.
La ciclosporine A agit sur deux axes [47] :
-
inhibition de l’activation des lymphocytes T : au niveau membranaire, la ciclosporine A forme des complexes avec la cyclophiline A, lesquels captent la calcineurine et inhibent ainsi la translocation de NF-AT, donc la synthèse de cytokines pro-inflammatoires ;
-
inhibition de l’apoptose : la ciclosporine A forme aussi des complexes avec la cyclophiline D, inhibant ainsi l’ouverture de certains pores mitochondriaux (MPT) impliqués dans le stress oxydant et l’initiation de l’apoptose.
L’innocuité, l’efficacité et les propriétés anti-inflammatoires de la ciclosporine A dans le traitement de la sécheresse oculaire ont été démontrées en 2000 par deux études cliniques de phase III comparatives, randomisées et multicentriques [48]. L’efficacité de la ciclosporine A repose sur la diminution significative des symptômes de sécheresse, l’amélioration des signes cliniques d’atteinte de la surface oculaire, l’amélioration de la qualité de vision, et le moindre recours aux substituts lacrymaux [49]. L’effet iatrogène notable est constitué par des symptômes fréquents de brûlure oculaire à l’instillation du collyre, lesquels ne nécessitent que rarement l’interruption du traitement. Deux limitations viennent cependant ternir les bénéfices thérapeutiques d’une telle molécule : (1) la nécessité d’un traitement au long cours nécessairement liée à des problèmes de persistance thérapeutique et donc d’interruption prématurée en l’absence d’effets bénéfiques précoces, et (2) l’importante proportion de patients non répondeurs (10 à 50 % selon les études), dont une partie peut trouver une explication dans les problèmes de tolérance locale.
Les tétracyclines agissent sur la synthèse protéique au niveau ribosomique sur un certain nombre de bactéries à Gram positif et négatif, mycoplasmes, Chlamydiae et spirochètes. Les tétracyclines possèdent aussi de nombreuses propriétés anti-inflammatoires : inhibition de la synthèse et de l’activité de MMP [50], de la synthèse de monoxyde d’azote (NO) [51], de l’activité protéolytique des collagénases [52] et de l’activation des lymphocytes B [53]. Au niveau de la surface oculaire, il a été démontré que la doxycycline inhibe la transcription ou la traduction des certaines MMP (MMP-1, -9, -10, -13) [54, 55] et l’expression épithéliale ainsi que l’effet de l’IL-1 [56]. Cependant, les multiples études conduites depuis des décennies ayant prouvé l’efficacité du traitement systémique par tétracyclines dans l’acné rosacée n’ont, semble-t-il, pas été réalisées contre placebo : celles-ci agiraient donc par un effet antibactérien et l’inhibition de la lipolyse bactérienne au niveau palpébral, sans qu’un effet anti-inflammatoire direct n’ait été encore prouvé [57]. Des études prospectives et comparatives paraissent donc aujourd’hui nécessaires pour mieux préciser les mécanismes et l’efficacité des traitements par tétracyclines, par voie locale ou bien générale.
Les macrolides présenteraient aussi des propriétés anti-inflammatoires dont les mécanismes demeurent encore mal compris. Récemment, Li et al. ont rapporté que l’azithromycine inhiberait directement la synthèse de médiateurs pro-inflammatoires en bloquant l’activation de NF-κB. [58]. Une étude clinique ciblée sur traitement de la blépharite a en outre confirmé l’efficacité d’un mois de traitement par azithromycine per os, sans parvenir à élucider un potentiel effet anti-inflammatoire au niveau lacrymal [59].
Les acides gras poly-insaturés oméga-3 et oméga-6 sont essentiels au maintien de l’intégrité de la surface oculaire. Ils ne sont pas synthétisés par l’organisme, donc apportés exclusivement par l’alimentation. Les oméga-3 ingérés sont rapidement convertis en médiateurs anti-inflammatoires (PGE-3, LTB-5, thromboxane et résolvines). Les oméga-6, acides linoléique et linolénique, sont les précurseurs de la PGE-1, une prostaglandine aux effets anti-inflammatoires oculaires prouvés dans un modèle animal [60].
Il n’y a que peu d’études cliniques comparatives ayant démontré le bénéfice de ces apports. Aragona et al. ont montré l’efficacité d’un traitement par oméga-6 sur les symptômes et signes de sécheresse oculaire chez des patients atteints de syndrome de Gougerot Sjögren, par l’intermédiaire d’une augmentation de la synthèse lacrymale de PGE-1 à un mois [61]. L’administration per os d’un mélange d’acides linoléique et linolénique diminuait l’inflammation de la surface oculaire évaluée par l’expression conjonctivale de HLA-DR sur empreintes et améliorait aussi la symptomatologie oculaire après 45 jours de traitement [62]. Plus récemment, Rashid et al. ont pour la première fois évalué les effets de l’acide alpha-linolénique en utilisation locale sur un modèle murin de sécheresse [31], rapportant de façon inédite une efficacité sur l’atteinte clinique corrélée à une action anti-inflammatoire locale (diminution de l’infiltration macrophagique, diminution de l’expression cornéenne d’IL-1a et de TNF-α, diminution de l’expression conjonctivale de TNF-α). Ainsi, de futures études cliniques complémentaires pourraient permettre de définir la place des acides gras poly-insaturés – par voie générale ou bien locale – dans notre arsenal thérapeutique.
Les résultats cliniques et fondamentaux de nombreuses équipes de recherche convergent vers une stratégie immunomodulatrice dans la prise en charge de la sécheresse oculaire. Ainsi, l’amélioration de notre connaissance des mécanismes immunologiques qui sous-tendent la sécheresse oculaire a conduit au développement de nouvelles stratégies thérapeutiques aujourd’hui en phases d’essai.
L’utilisation thérapeutique d’anticorps monoclonaux anti-CD4 a permis de moduler l’inflammation dans un modèle murin de Sjögren [63]. Dans un autre modèle animal de sécheresse oculaire, l’administration d’anti-VLA-4-sm visant à neutraliser certaines molécules d’adhésion a permis d’inhiber l’inflammation (infiltration de lymphocytes T et concentration de TNF-α) et de protéger la cornée et la conjonctive [64]. Le cilomilast – inhibiteur de la PDE4 – diminuerait aussi l’atteinte de la surface oculaire en supprimant la réponse Th17 [65]. Une autre molécule en développement, le DA-6034, améliorerait la fonction lacrymale et diminuerait l’inflammation dans un modèle animal de sécheresse [66].
En parallèle, la démonstration du rôle clé de la lymphangiogenèse au cours de la sécheresse oculaire laisse entrevoir l’intérêt thérapeutique de stratégies antiangiogéniques. Ainsi, l’inhibition de l’effet de l’IL-17 pourrait permettre de contrôler la synthèse de VEGF-D, minimisant ainsi la prolifération des lymphatiques au sein de la cornée donc l’emballement de la réponse immunitaire [41]. Ainsi, qu’ils soient la cause ou bien la conséquence de la sécheresse oculaire, les processus inflammatoires et immunologiques de la surface oculaire jouent un rôle déterminant dans la maladie, et apparaissent aujourd’hui comme des cibles de choix pour le développement de stratégies thérapeutiques pertinentes.
[1] Schaumberg DA, Sullivan DA, Dana MR. Epidemiology of dry eye syndrome. Adv Exp Med Biol 2002 ; 506 : 989-98.
[2] The definition and classification of dry eye disease : report of the Definition and Classification Subcommittee of the International Dry Eye Workshop. Ocul Surf 2007 ; 5 : 75-92.
[3] Hamrah P, Zhang Q, Liu Y, Dana MR. Novel characterization of MHC class II-negative population of resident corneal Langerhans cell-type dendritic cells. Invest Ophthalmol Vis Sci 2002 ; 43 : 639-46.
[4] Lutz MB, Schuler G. Immature, semi-mature and fully mature dendritic cells : which signals induce tolerance or immunity ? Trends Immunol 2002 ; 23 : 445-9.
[5] Hamrah P, LIU Y, Zhang Q, Dana MR. Alterations in corneal stromal dendritic cell phenotype and distribution in inflammation. Arch Ophthalmol 2003 ; 121 : 1132-40.
[6] Gupta A, Monroy D, JI Z, et al. Transforming growth factor beta-1 and beta-2 in human tear fluid. Curr Eye Res 1996 ; 15 : 605-14.
[7] Motterle L, Diebold Y, enríquez de Salamanca A, et al. Altered expression of neurotransmitter receptors and neuromediators in vernal keratoconjunctivitis. Arch Ophthalmol 2006 ; 124 : 462-8.
[8] Szliter EA, Lighvani S, Barrett RP, Hazlett LD. Vasoactive intestinal peptide balances pro- and anti-inflammatory cytokines in the Pseudomonas aeruginosa-infected cornea and protects against corneal perforation. J Immunol 2007 ; 178 : 1105-14.
[9] Hannum CH, Wilcox CJ, Arend WP, et al. Interleukin-1 receptor antagonist activity of a human interleukin-1 inhibitor. Nature 1990 ; 343 : 336-40.
[10] Shevach EM. From vanilla to 28 flavors : multiple varieties of t regulatory cells. Immunity 2006 ; 25 : 195-201.
[11] Levings MK, Allan S, D’Hennezel E, Piccirillo CA. Functional dynamics of naturally occurring regulatory T cells in health and autoimmunity. Adv Immunol 2006 ; 92 : 119-55.
[12] Endarthi AT, Rifa’i M, Shi Z, et al. CD8+CD122+ regulatory T cells produce IL-10 to suppress IFN-gamma production and proliferation of CD8+ T cells. J Immunol 2005 ; 175 : 7093-7.
[13] Chang CC, Ciubotariu R, Manavalan JS, et al. Tolerization of dendritic cells by T (S) cells : the crucial role of inhibitory receptors ILT3 and ILT4. Nat Immunol 2002 ; 3 : 237-43.
[14] Smith GN, Mickler EA, Hasty KA, Brandt KD. Specificity of inhibition of matrix metalloproteinase activity by doxycycline : relationship to structure of the enzyme. Arthritis Rheum 1999 ; 42 : 1140-6.
[15] Cursiefen C. Immune privilege and angiogenic privilege of the cornea. Chem Immunol Allergy 2007 ; 92 : 50-7.
[16] Ellenberg D, Azar DT, Hallak JA, et al. Novel aspects of corneal angiogenic and lymphangiogenic privilege. Prog Retin Eye Res 2010 ; 29 : 208-48.
[17] Ambati BK, Nozaki M, Singh N, et al. Corneal avascularity is due to soluble VEGF receptor-1. Nature 2006 ; 443 : 993-7.
[18] Hiscott P, Seitz B, Schlötzer-Schrehardt U, Naumann GO. Immunolocalisation of thrombospondin 1 in human, bovine and rabbit cornea. Cell Tissue Res 1997 ; 289 : 307-10.
[19] Cursiefen C, Maruyama K, Bock F, et al. Thrombospondin 1 inhibits inflammatory lymphangiogenesis by CD36 ligation on monocytes. J Exp Med 2011 ; 208 : 1083-92.
[20] Lu P, Li L, Liu G, et al. Enhanced experimental corneal neovascularization along with aberrant angiogenic factor expression in the absence of IL-1 receptor antagonist. Invest Ophthalmol Vis Sci 2009 ; 50 : 4761-8.
[21] Sack RA, Conradi L, Krumholz D, et al. Membrane array characterization of 80 chemokines, cytokines, and growth factors in open- and closed-eye tears : angiogenin and other defense system constituents. Invest Ophthalmol Vis Sci 2005 ; 46 : 1228-38.
[22] Ma X, Li J. Corneal neovascularization suppressed by TIMP2 released from human amniotic membranes. Yan Ke Xue Bao 2005 ; 21 : 56-61.
[23] Shen L, Jin Y, Freeman GJ, et al. The function of donor versus recipient programmed death-ligand 1 in corneal allograft survival. J Immunol 2007 ; 179 : 3672-79.
[24] Sugita S, Usui Y, Horie S, et al. Human corneal endothelial cells expressing programmed death-ligand 1 (PD-L1) suppress PD-1+ T helper 1 cells by a contact-dependent mechanism. Invest Ophthalmol Vis Sci 2009 ; 50 : 263-72.
[25] Griffith TS, Brunner T, Fletcher SM, et al. Fas ligand-induced apoptosis as a mechanism of immune privilege. Science 1995 ; 270 : 1189-92.
[26] Chen Y, Chauhan SK, Saban DR, et al. Interferon-γ-secreting NK cells promote induction of dry eye disease. J Leukoc Biol 2011 ; 89 : 965-72.
[27] Yeh S, Song XJ, Farley W, et al. Apoptosis of ocular surface cells in experimentally induced dry eye. Invest Ophthalmol Vis Sci 2003 ; 44 : 124-9.
[28] Redfern RL, Patel N, Hanlon S, et al. Toll-like receptor expression and activation in mice with experimental dry eye. Invest Ophthalmol Vis Sci 2013 ; 54 : 1554-63.
[29] Lee HS, Hattori T, Park EY, et al. Expression of toll-like receptor 4 contributes to corneal inflammation in experimental dry eye disease. Invest Ophthalmol Vis Sci 2012 ; 53 : 5632-40.
[30] Kawai T, Akira S. TLR signaling. Semin Immunol 2007 ; 19 : 24-32.
[31] Rashid S, Jin Y, Ecoiffier T, et al. Topical omega-3 and omega-6 Fatty acids for treatment of dry eye. Arch Ophthalmol 2008 ; 126 : 219-25.
[32] De Paiva CS, Chotikavanich S, Pangelinan SB, et al. IL-17 disrupts corneal barrier following desiccating stress. Mucosal Immunol 2009 ; 2 : 243-53.
[33] Pisella PJ, Brignole F, Debbasch C, et al. Flow cytometric analysis of conjunctival epithelium in ocular rosacea and keratoconjunctivitis sicca. Ophthalmology 2000 ; 107 : 1841-9.
[34] Enríquez-de-salamanca A, Castellanos E, Stern ME, et al. Tear cytokine and chemokine analysis and clinical correlations in evaporative-type dry eye disease. Mol Vis 2010 ; 16 : 862-73.
[35] Mills KH. Induction, function and regulation of IL-17-producing T cells. Eur J Immunol 2008 ; 38 : 2636-49.
[36] Denoyer A, Godefroy D, Célérier I, et al. CX3CL1 expression in the conjunctiva is involved in immune cell trafficking during toxic ocular surface inflammation. Mucosal Immunol 2012 ; 5 : 702-11.
[37] Dohlman TH, Chauhan SK, Kodati S, et al. The CCR6/CCL20 axis mediates Th17 cell migration to the ocular surface in dry eye disease. Invest Ophthalmol Vis Sci 2013 ; 54 : 4081-91.
[38] Chauhan SK, El Annan J, Ecoiffier T, et al. Autoimmunity in dry eye is due to resistance of Th17 to Treg suppression. J Immunol 2009 ; 182 : 1247-52.
[39] Liu Y, Hamrah P, Zhang Q, et al. Draining lymph nodes of corneal transplant hosts exhibit evidence for donor major histocompatibility complex (MHC) class II-positive dendritic cells derived from MHC class II-negative grafts. J Exp Med 2002 ; 195 : 259-68.
[40] Villani E, Galimberti D, Viola F, et al. The cornea in Sjogren’s syndrome : an in vivo confocal study. Invest Ophthalmol Vis Sci 2007 ; 48 : 2017-22.
[41] Chauhan SK, Jin Y, Goyal S, et al. A novel pro-lymphangiogenic function for Th17/IL17. Blood 2011 ; 118 : 4630-4.
[42] Chen Y, Chauhan SK, Lee HS, et al. Effect of desiccating environmental stress versus systemic muscarinic AChR blockade on dry eye immunopathogenesis. Invest Ophthalmol Vis Sci 2013 ; 54 : 2457-64.
[43] Chen Y, Chauhan SK, Lee HS, et al. Chronic dry eye disease is principally mediated by effector memory Th17 cells. Mucosal Immunol 2014 ; 7 : 38-45.
[44] Sainz de la Maza Serra M, Simon Castellvi C, Kabbani O. Nonpreserved topical steroids and lacrimal punctual occlusion for severe keratoconjunctivitis sicca. Arch Soc Esp Ophthalmol 2000 ; 75 : 751-6.
[45] De Paiva CS, Corrales RM, Villarreal AL, et al. Apical corneal barrier disruption in experimental murine dry eye is abrogated by methylprednisolone and doxycicline. Invest Ophthalmol Vis Sci 2006 ; 47 : 2847-56.
[46] Pflugfelder SC, Maskin SL, Anderson B, et al. A randomized, double-masked, placebo-controlled, multicenter comparison of loteprednol etabonate ophthalmic suspension, 0.5 %, and placebo for treatment of keratoconjunctivitis sicca in patients with delayed tear clearance. Am J Ophthalmol 2004 ; 138 : 444-57.
[47] Donnenfeld E, Pflugfelder SC. Topical ophthalmic cyclosporine : pharmacology and clinical uses. Surv Ophthalmol 2009 ; 54 : 321-38.
[48] Sall K, Stevenson OD, Mundorf TK, Reis BL, and the CSA Phase 3 Study Group. Two multicenter, randomized studies of the efficacy and safety of CsA ophthalmic emulsion in moderate to severe dry eye disease. Ophthalmology 2000 ; 107 : 631-9.
[49] Kunert KS, Tisdale AS, Stern ME, et al. Analysis of topical cyclosporine A treatment of patients with dry eye syndrome. Arch Ophthalmol 2000 ; 118 : 1489-96.
[50] Hanemaaijer R, Sorsa T, Konttinen YT, et al. Matrix metalloproteinase-8 is expressed in rheumatoid synovial fibroblasts and endothelial cells. Regulation by tumor necrosis factor-alpha and doxycycline. J Biol Chem 1997 ; 272 : 31504-9.
[51] Amin AR, Attur MG, Thakker GD, et al. A novel mechanism of action of tetracyclines : effects on nitric oxide syntheses. Proc Natl Acad Sci USA 1996 ; 93 : 14014-9.
[52] Shlopov BV, Smith GN, Cole AA, Hasty KA. Differential patterns of response to doxycycline and transforming growth factor beta1 in the downregulation of collagenases in osteoarthritic and normal human chondrocytes. Arthritis Rheum 1999 ; 42 : 719-27.
[53] Kuzin II, Snyder JE, Ugine GD, et al. Tetracyclines inhibit activated B cell function. Int Immunol 2001 ; 13 : 921-31.
[54] Li DQ, Lokeshwar BL, Solomon A, et al. Regulation of MMP-9 production by human corneal epithelial cells. Exp Eye Res 2001 ; 73 : 449-59.
[55] Li DQ, Shang TY, Kim HS, et al. Regulated expression of collagenases MMP-1, -8, and -13 and stromelysins MMP-3, -10, and -11 by human corneal epithelial cells. Invest Ophthalmol Vis Sci 2003 ; 44 : 2928-36.
[56] Solomon A, Rosenblatt M, Li DQ, et al. Doxycycline inhibition of interleukin-1 in the corneal epithelium. Invest Ophthalmol Vis Sci 2000 ; 41 : 2544-57.
[57] Shine WE, McCulley JP, Pandya AG. Minocycline effect on Meibomian gland lipids in meibomianitis patients. Exp Eye Res 2003 ; 76 : 417-20.
[58] Li DQ, Zhou N, Zhang L, et al. Azithromycin suppresses Zymosan-induced production of pro-inflammatory mediators by human corneal epithelial cells. Invest Ophthalmol Vis Sci 2010 ; 51 : 5623-9.
[59] Haque RM, Torkildsen GL, Brubaker K, et al. Multicenter open-label study evaluating the efficacy of azithromycin ophthalmic solution 1 % on the signs and symptoms of subjects with blepharitis. Cornea 2010 ; 29 : 871-7.
[60] Rosenberg ES, Asbell PA. Essential fatty acids in the treatment of dry eye. Ocul Surf 210 ; 8 : 18-28.
[61] Aragona P, Bucolo C, Spinella R, et al. Systemic omega-6 essential fatty acid treatment and PGE1 tear content in Sjögren’s syndrome patients. Invest Ophthalmol Vis Sci 2005 ; 46 : 4474-9.
[62] Barabino S, Rolando M, Camicione P, et al. Systemic linoleic and γ-linolenic acid therapy in dry eye syndrome with an inflammatory component. Cornea 2003 ; 22 : 97-101.
[63] Hayashi Y, Ishimaru N, Arakaki R, et al. Effective treatment of a mouse model of Sjögren’s syndrome with eyedrop administration of anti-CD4 monoclonal antibody. Arthritis Rheum 2004 ; 50 : 2903-10.
[64] Ecoiffier T, El Annan J, Rashid S, et al. Modulation of integrin alpha4beta1 (VLA-4) in dry eye disease. Arch Ophthalmol 2008 ; 126 : 1695-9.
[65] Sadrai Z, Stevenson W, Okanobo A, et al. PDE4 inhibition suppresses IL-17-associated immunity in dry eye disease. Invest Ophthalmol Vis Sci 2012 ; 53 : 3584-91.
[66] Seo MJ, Kim JM, Lee MJ, et al. The therapeutic effect of DA-6034 on ocular inflammation via suppression of MMP-9 and inflammatory cytokines and activation of the MAPK signaling pathway in an experimental dry eye model. Curr Eye Res 2010 ; 35 : 165-75.
N. Deschamps, C. Baudouin
Un biomarqueur biologique est un indicateur associé à une maladie. Il peut être utilisé à visée diagnostique, physiopathologique ou pronostique. La sécheresse oculaire pose un problème diagnostique illustré par la fréquente discordance entre signes et symptômes. Il est alors très difficile de prouver l’efficacité de nouvelles thérapeutiques. Le développement de biomarqueurs constitue donc un enjeu important afin de permettre de mieux comprendre la maladie et de mesurer sa sévérité lorsque la clinique est en difficulté.
La sécheresse oculaire est une maladie multifactorielle des larmes et de la surface oculaire, responsable d’une instabilité du film lacrymal, de symptômes d’inconfort et de troubles visuels [1]. Elle s’accompagne d’une augmentation de l’osmolarité du film lacrymal et d’une inflammation de la surface oculaire. Il semble que l’inflammation et un certain degré d’auto-immunité jouent un rôle dans la pathogénie du syndrome sec.
La principale difficulté pour le praticien dans la prise en charge du patient atteint de sécheresse oculaire est de mettre en relation les nombreuses plaintes du patient avec des signes cliniques objectifs peu nombreux et manquant de spécificité. En effet, les symptômes subjectifs ne sont que très rarement corrélés aux signes objectifs. Malgré leur utilisation fréquente en pratique clinique, les tests standard pour évaluer le syndrome sec et les maladies de la surface oculaire ont montré une reproductibilité et une fiabilité faibles. De nombreuses autres techniques d’exploration ont donc été développées pour évaluer objectivement le film lacrymal et la surface oculaire en pratique clinique d’une manière peu ou pas invasive. Certaines sont facilement accessibles aux cliniciens, comme l’osmolarité lacrymale ou l’empreinte conjonctivale ; d’autres restent des procédures de recherche qui nécessitent encore d’être validées [2–6]. On comprend alors l’intérêt de développer de nouveaux biomarqueurs pour le diagnostic de syndrome sec.
Un biomarqueur est un marqueur mesurable définissant un processus biologique, qu’il soit normal ou pathologique. Les biomarqueurs peuvent correspondre à des mesures très simples comme la mesure de la glycémie sanguine ou du taux de cholestérol, ou plus récemment à des mesures plus complexes comme l’identification d’une mutation spécifique du génome. Ils peuvent être utilisés comme marqueurs préventifs d’une pathologie afin d’identifier un risque, de diagnostiquer une maladie, de comprendre un mécanisme ou d’évaluer la sévérité.
Un bon biomarqueur doit être sensible, spécifique et facilement réalisable en pratique clinique. Dans le domaine de la surface oculaire, les biomarqueurs peuvent être dosés sur les larmes, sur les empreintes conjonctivales ou moins fréquemment sur des biopsies conjonctivales. Ils peuvent correspondre à une protéine libre ou à un marqueur cellulaire. Ils prennent une place croissante dans le diagnostic de sécheresse car ils permettent une mesure standardisée, objective de la maladie et de la réponse au traitement.
Les antigènes de classe II du complexe majeur d’histocompatibilité HLA-DR sont des protéines transmembranaires qui sont normalement exprimées principalement par les cellules présentatrices de l’antigène, comme les macrophages, les lymphocytes B et les lymphocytes T activés, pour lesquelles elles jouent un rôle majeur dans l’initiation de la réponse immune. Les cellules épithéliales de la conjonctive peuvent elles aussi exprimer les antigènes de classe II lors de désordres chroniques de la surface oculaire [4, 7, 8]. Brignole et al. ont montré une surexpression de HLA-DR dans les cellules épithéliales conjonctivales des patients atteints de kératoconjonctivite sèche (comme dans le syndrome de Gougerot-Sjögren), en comparaison avec des syndromes secs non auto-immuns [9]. L’expression de HLA-DR peut être mesurée sur les cellules épithéliales de la conjonctive, à partir d’empreintes conjonctivales. Elle est stimulée en présence de cytokines pro-inflammatoires comme l’interféron gamma (IFN-γ), le tumor necrosis factor alpha (TNFα), l’interleukine 6 (IL-6) et l’IL-1 [10]. Versura et al. ont étudié la réponse de l’épithélium conjonctival humain face à un stress osmotique et démontré un lien direct entre l’osmolarité des larmes et l’expression de HLA-DR [11].
Du fait de sa très grande sensibilité, dépendante de l’intensité des réactions inflammatoires, HLA-DR est actuellement un des meilleurs marqueurs d’inflammation au niveau de la surface oculaire. Ce biomarqueur est déjà utilisé en pratique clinique et a été validé dans de nombreuses études multicentriques. Par ailleurs, il a été montré que l’utilisation topique de ciclosporine A réduisait significativement l’expression de HLA-DR chez les patients atteints de sécheresse oculaire sévère [12]. Dans une large étude randomisée, la même équipe a montré plus récemment les effets de la supplémentation orale par oméga-3 et oméga-6 sur la réduction de l’expression de HLA-DR par les cellules conjonctivales en comparaison avec le placebo. Enfin, il existe une surexpression de ce biomarqueur au niveau de la surface oculaire des patients atteints de glaucome traités au long cours par antiglaucomateux, corrélée avec le nombre de traitements pris et à l’utilisation de collyres avec conservateurs [13].
ICAM-1 est une molécule d’adhésion intercellulaire qui est essentielle pour la communication entre les lymphocytes et les autres cellules, pour le contrôle de la migration leucocytaire et pour l’adhésion sur certains tissus cibles lors de processus inflammatoires. Comme pour HLA-DR, l’expression d’ICAM-1 est augmentée chez les patients atteints de sécheresse. Tsubota et al. ont retrouvé une bonne corrélation sur des frottis conjonctivaux entre l’expression de HLA-DR et celle d’ICAM-1 [8]. Le niveau d’ICAM-1 est positivement corrélé avec la sévérité de la maladie et sa progression. Par ailleurs, ICAM-1 est régulé positivement par l’IFN-γ via un mécanisme tyrosine-kinase dépendant [8, 14].
Les chimiokines (cytokines chimiotactiques) sont produites par une variété de cellules en réponse aux cytokines pro-inflammatoires. Les chimiokines ont la capacité d’attirer et d’activer les lymphocytes T et de réguler les cellules dendritiques. Elles opèrent par l’intermédiaire de récepteurs spécifiques régulés. La fixation des chimiokines est impliquée dans la différenciation des lymphocytes T en T helper 1 (TH1) et T helper 2 (TH2). Les récepteurs de chimiokines CCR5 et CXCR3 sont exprimés principalement sur des cellules TH1 alors que CCR3 et CCR4 sont exprimés par les cellules TH2. Les expériences suggèrent que le syndrome sec est associé aux réactions immuno-inflammatoires de type TH1, et il est connu que CCR5 joue un rôle essentiel dans la réponse à médiation TH1 [15]. Baudouin et al. ont montré que l’expression de CCR4 et CCR5 varie selon la voie immunitaire impliquée, CCR4 étant surexprimé de manière importante dans la conjonctivite vernale, tandis que CCR5 est plutôt surexprimé au niveau des cellules épithéliales dans le syndrome de Sjögren. Une augmentation de l’expression de CCR5 a également été retrouvée dans les syndromes secs associés aux maladies de surface oculaire [15, 16]. Gulati et al. ont montré que CCR5 est exprimé à un faible taux par l’épithélium conjonctival des sujets normaux. L’expression de CCR5 est significativement régulée à la hausse chez les patients atteints de syndrome sec. Il semblerait que les cellules épithéliales de surface oculaire joue donc un rôle central dans la modulation des réponses immuno-inflammatoires au cours de la sécheresse oculaire [15].
Le lysozyme et la lactoferrine sont deux protéines principales présentes dans les larmes. La diminution de leur taux dans le film lacrymal est un indicateur de dysfonctionnement de la glande lacrymale principale. La concentration du lysozyme varie entre 1 et 3 mg/ml chez le sujet normal en fonction des techniques utilisées, mais diminue de manière constante dans le syndrome sec. La lactoferrine a été mesurée à des taux très variables selon les études [2].
Les protéines calgranulines A et B appartiennent à la famille des protéines S100, un groupe de protéines liant le calcium. Ces protéines, exprimées par les macrophages activés et les polynucléaires neutrophiles, sont présentes lors d’affections inflammatoires aiguës et chroniques. Dans les maladies inflammatoires telles que la polyarthrite rhumatoïde, la surexpression de S100A8 et S100A9 est typiquement retrouvée aux sites d’inflammation et peut donc servir de biomarqueur de la maladie. S100A8 et S100A9 ont été par ailleurs retrouvées à des taux élevés dans les larmes en présence d’un ptérygion. La surexpression de S100A8 dans les larmes de patients atteints d’œil sec a été rapportée. Tong et al. ont montré que les niveaux de S100A8 et S100A9 sont corrélés avec la sévérité des dysfonctionnements des glandes de Meibomius chez les patients atteints de sécheresse ; ils ont émis l’hypothèse que les niveaux élevés de calgranulines A et B dans les larmes peuvent être liés à la kératinisation des glandes de Meibomius [17]. En effet, S100A8 et S100A9 peuvent favoriser ou répondre à une hyperprolifération épidermique et peuvent également être associées à l’hyperkératinisation de l’épithélium canalaire meibomien retrouvé dans les dysfonctionnements des glandes de Meibomius. De nombreuses fonctions pro-inflammatoires sont attribuées à S100A8 et S100A9, mais elles sont également impliquées dans des fonctions anti-inflammatoires comme la cicatrisation et la protection contre les lésions tissulaires liées à un stress oxydant. Par ailleurs, elles sont également retrouvées à faibles taux dans la conjonctive normale.
La cytokine pro-inflammatoire IL-1 est un médiateur important de l’inflammation et de l’immunité. IL-1α est un inducteur potentiel d’autres cytokines inflammatoires comme IL-6, IL-8, TNFα et GM-CSF [18]. IL-1α et IL-1β sont augmentées chez le patient atteint de syndrome sec, de même que la protéine MMP-9, une enzyme qui clive le précurseur de l’IL-1β en sa forme active. Ces médiateurs sont corrélés avec la gravité de l’atteinte épithéliale détectée grâce à l’utilisation de fluorescéine, mais ils ne permettent pas de distinguer un dysfonctionnement des glandes de Meibomius d’un syndrome de Gougerot-Sjögren, probablement parce qu’ils proviennent au moins en partie de l’épithélium conjonctival [19].
L’IL-1Ra est un inhibiteur spécifique d’origine naturelle de l’IL-1. Elle sert de modulateur de la réponse immunitaire en régulant les effets agonistes d’IL-1 dans les tissus inflammatoires [20]. Les niveaux d’IL-1Ra ont été retrouvés par Solomon et al. [19] comme significativement plus élevés dans les larmes de patients atteints de sécheresse oculaire. Ces niveaux élevés d’IL-1Ra retrouvés chez les patients présentant des dommages de la surface oculaire résultent probablement de la libération de cytokines inflammatoires.
La production de métalloprotéinases matricielles (MMP) peut être stimulée par un stress osmotique. MMP-9, la MMP principale produite par l’épithélium de la cornée, est un activateur physiologique de l’IL-1β. Solomon et al. ont montré un niveau significativement plus élevé de MMP-9 dans les larmes des patients atteints de syndrome sec oculaire (toutes causes confondues) par rapport aux témoins [19]. Huet et al. ont étudié un inducteur de métalloprotéinase appelé EMMPRIN/CD147. Ils ont évalué l’expression d’EMMPRIN et de MMP-9 par RT-PCR (reverse transcription polymerase chain reaction) sur des empreintes conjonctivales de patients atteints de sécheresse et ont constaté que l’expression d’EMMPRIN est augmentée chez ces patients et est corrélée avec les taux de MMP-9 en situation pathologique. Ils ont montré qu’EMMPRIN joue un rôle important dans la régulation de l’intégrité de l’épithélium en induisant MMP-9, ce qui conduit à un clivage des jonctions serrées de l’épithélium de surface. Cela suggère l’utilisation possible d’EMMPRIN comme un marqueur biologique de gravité de la sécheresse oculaire [21].
Un nouveau dispositif de test, appelé le RPS InflammaDry®, a été récemment mis au point. Par contact avec la surface oculaire, le dispositif recueille un petit échantillon de larmes. La solution est ensuite placée dans une machine qui détecte automatiquement des anticorps dirigés contre MMP-9, détectés avec des nanoparticules d’or. Si un nombre suffisant de nanoparticules est localisé sur l’échantillon de larmes du patient, le résultat est une ligne visible sur le dispositif. Ce test prêt à l’emploi est le premier disponible dans le commerce qui permette de détecter un biomarqueur sans avoir besoin de matériel spécifique ni d’un laboratoire spécialisé. Toutefois, la limite de ce test est le type de réponse : présence ou absence de MMP-9, sans possibilité de mesurer le niveau réel de MMP-9 ni ses variations éventuelles.
IL-6 est également une cytokine pro-inflammatoire. Plusieurs études ont montré une augmentation des taux d’IL-6 dans des larmes de patients atteints de syndrome de Sjögren. L’équipe de Pflugfelder a rapporté des niveaux d’ARNm (acide ribonucléique messager) d’IL-6 significativement augmentés dans l’épithélium conjonctival de patients atteints du syndrome de Sjögren [5]. Na et al. ont trouvé les mêmes résultats chez des patients atteints de sécheresse oculaire avec et sans syndrome de Gougerot-Sjögren. Ils ont montré une corrélation positive entre les concentrations d’IL-6 et les scores d’évaluation de la surface oculaire [22].
L’IL-8 est l’un des principaux médiateurs de la réponse inflammatoire grâce à des propriétés chimiotactiques puissantes sur les neutrophiles et les lymphocytes T. Huang et al. ont montré un niveau significativement plus élevé de l’IL-8 dans les larmes d’un groupe de syndromes secs sévères [23]. Ces résultats sont cohérents avec ceux d’Enriquez-de-Salamanca pour lequel les niveaux d’IL-8 sont corrélés avec les scores des colorations de la cornée et de la conjonctive [20]. L’augmentation de l’IL-8 dans les larmes des patients atteints de sécheresse oculaire peut être un signal puissant permettant le recrutement des lymphocytes T à la surface oculaire, entraînant ainsi des lésions de la cornée et de la conjonctive [24].
Plusieurs études ont démontré qu’un certain nombre d’autres cytokines et chimiokines sont augmentées dans le syndrome sec oculaire, telles que le TNF-α (tumor necrosis factor alpha), l’INFγ (interféron gamma) et l’EGF (epidermal growth factor). Les auto-anticorps ont également été testés dans les larmes de patients atteints du syndrome de Gougerot-Sjögren en utilisant la technique ELISA (enzyme-linked immunosorbent assay). Les auto-anticorps anti-SSA et anti-SSB ont été retrouvés dans les larmes et le sang, mais étonnamment certains patients présentaient des anticorps dans les larmes, alors qu’ils étaient négatifs dans le sérum.
De nombreux autres biomarqueurs prometteurs ont également été évalués sur des modèles expérimentaux. Ils ont été principalement étudiés afin de comprendre la pathogénie et de trouver de futures cibles thérapeutiques potentielles, tels que l’IL-17 et PDL1 [20, 25, 26]. Les plus pertinents sont résumés dans le tableau 3-6, mais n’ayant pas encore été testés chez l’homme, ils ne peuvent pas être considérés comme des biomarqueurs à part entière pour le moment.
Tableau 3-6 Résumé des principaux biomarqueurs retrouvés dans la sécheresse oculaire chez l’homme ou sur des modèles expérimentaux de syndrome sec.
La recherche de biomarqueurs est un domaine prometteur en raison de l’absence de marqueurs cliniques appropriés, tant sur le plan de la pathogenèse que sur l’évaluation de la gravité. Les questions techniques ont été progressivement abordées et résolues : des échantillonnages de larmes, des mesures sur de faibles volumes et des techniques immunocytologiques sont maintenant disponibles et adaptés à la spécificité de la maladie. Les modèles animaux de sécheresse ont permis d’identifier une grande variété de marqueurs potentiels qui pourraient étendre notre connaissance de la maladie dans un proche avenir et devenir des outils de routine pour le diagnostic et le traitement de l’œil sec.
[1] The definition and classification of dry eye disease : report of the definition and classification subcommittee of the International Dry Eye Workshop (2007). Ocul Surf 2007 ; 5 : 75-92.
[2] Baudouin C. Nonroutine tests. In : Asbell PA, Lemp MA (Eds). Dry Eye Disease : The Clinician’s Guide to Diagnosis And Treatment. New York : Thieme, Medical Publishers ; 2006 : 47-62.
[3] Nelson JD. Impression cytology. Cornea 1988 ; 7 : 71-81.
[4] Baudouin C, Haouat N, Brignole F, et al. Immunopathological findings in conjunctival cells using immunofluorescence staining of impression cytology specimens. Br J Ophthalmol 1992 ; 76 : 545-9.
[5] Jones DT, Monroy D, Ji Z, et al. Sjögren’s syndrome : cytokine and Epstein-Barr viral gene expression within the conjunctival epithelium. Invest Ophthalmol Vis Sci 1994 ; 35 : 3493-504.
[6] Sullivan BD, Whitmer D, Nichols KK, et al. An objective approach to dry eye disease severity. Invest Ophthalmol Vis Sci 2010 ; 51 : 6125-30.
[7] Rolando M, Barabino S, Mingari C, et al. Distribution of conjunctival HLA-DR expression and the pathogenesis of damage in early dry eyes. Cornea 2005 ; 24 : 951-4.
[8] Tsubota K, Fujihara T, Saito K, Takeuchi T. Conjunctival epithelium expression of HLA-DR in dry eye patients. Ophthalmologica 1999 ; 213 : 16-9.
[9] Brignole F, Pisella PJ, Goldschild M, et al. Flow cytometric analysis of inflammatory markers in conjunctival epithelial cells of patients with dry eyes. Invest Ophthalmol Vis Sci 2000 ; 41 : 1356-63.
[10] Chang CH, Furue M, Tamaki K. Selective regulation of ICAM-1 and major histocompatibility complex class I and II molecule expression on epidermal Langerhans cells by some of the cytokines released by keratinocytes and T cells. Eur J Immunol 1994 ; 24 : 2889-95.
[11] Versura P, Profazio V, Schiavi C, Campos EC. Hyperosmolar stress upregulates HLA-DR expression in human conjunctival epithelium in dry eye patients and in vitro models. Invest Ophthalmol Vis Sci 2011 ; 52 : 5488-96.
[12] Brignole F, Pisella PJ, De Saint Jean M, et al. Flow cytometric analysis of inflammatory markers in KCS : 6-month treatment with topical cyclosporin A. Invest Ophthalmol Vis Sci 2001 ; 42 : 90-5.
[13] Pisella PJ, Debbasch C, Hamard P, et al. Conjunctival proinflammatory and proapoptotic effects of latanoprost and preserved and unpreserved timolol : an ex vivo and in vitro study. Invest Ophthalmol Vis Sci 2004 ; 45 : 1360-8.
[14] De Saint Jean M, Brignole F, Feldmann G, et al. Interferon-gamma induces apoptosis and expression of inflammation-related proteins in Chang conjunctival cells. Invest Ophthalmol Vis Sci 1999 ; 40 : 2199-212.
[15] Gulati A, Sacchetti M, Bonini S, Dana R. Chemokine receptor CCR5 expression in conjunctival epithelium of patients with dry eye syndrome. Arch Ophthalmol 2006 ; 124 : 710-6.
[16] Baudouin C, Liang H, Bremond-Gignac D, et al. CCR 4 and CCR 5 expression in conjunctival specimens as differential markers of T(H)1/T(H)2 in ocular surface disorders. J Allergy Clin Immunol 2005 ; 116 : 614-9.
[17] Tong L, Zhou L, Beuerman RW, et al. Association of tears proteins with Meibomian gland disease and dry eye symptoms. Br J Ophthalmol 2011 ; 95 : 848-52.
[18] Fibbe WE, Daha MR, Hiemstra PS, et al. Interleukin 1 and poly(rI).poly(rC) induce production of granulocyte CSF, macrophage CSF, and granulocyte-macrophage CSF by human endothelial cells. Exp Hematol 1989 ; 17 : 229-34.
[19] Solomon A, Dursun D, Liu Z, et al. Pro- and anti-inflammatory forms of interleukin-1 in the tear fluid and conjunctiva of patients with dry-eye disease. Invest Ophthalmol Vis Sci 2001 ; 42 : 2283-92.
[20] Enríquez-de-Salamanca A, Castellanos E, Stern ME, et al. Tear cytokine and chemokine analysis and clinical correlations in evaporative-type dry eye disease. Mol Vis 2010 ; 16 : 862-73.
[21] Huet E, Vallée B, Delbé J, et al. EMMPRIN modulates epithelial barrier function through a MMP-mediated occludin cleavage : implications in dry eye disease. Am J Pathol 2011 ; 79 : 1278-86.
[22] Na KS, Mok JW, Kim JY, et al. Correlations between tear cytokines, chemokines, and soluble receptors and clinical severity of dry eye disease. Invest Ophthalmol Vis Sci 2012 ; 53 : 5443-50.
[23] Huang JF, Zhang Y, Rittenhouse KD, et al. Evaluations of tear protein markers in dry eye disease : repeatability of measurement and correlation with disease. Invest Ophthalmol Vis Sci 2012 ; 53 : 4556-64.
[24] Massingale ML, Li X, Vallabhajosyula M, et al. Analysis of inflammatory cytokines in the tears of dry eye patients. Cornea 2009 ; 28 : 1023-7.
[25] Sadrai Z, Stevenson W, Okanobo A, et al. PDE4 inhibition suppresses IL-17-associated immunity in dry eye disease. Invest Ophthalmol Vis Sci 2012 ; 53 : 3584-91.
[26] El Annan J, Goyal S, Zhang Q, et al. Regulation of T-cell chemotaxis by programmed death-ligand 1 (PD-L1) in dry eye-associated corneal inflammation. Invest Ophthalmol Vis Sci 2010, 51 : 3418-3423.
C. Baudouin
Les conservateurs, en particulier les ammoniums quaternaires, sont particulièrement redoutables en cas de sécheresse oculaire, en raison de leurs effets cytotoxiques, pro-inflammatoires et détergents. Leur usage doit être évité autant que possible en utilisation chronique sur des surfaces oculaires pathologiques. En cas d’atteinte cornéenne résistant à un traitement apparemment bien conduit, l’arrêt des produits potentiellement toxiques et en particulier des conservateurs s’impose et résout souvent des situations délicates.
« Je souffre depuis des années de sécheresse oculaire. Plus je mets de gouttes, plus je souffre. Les dernières étaient encore pires. Cela brûlait tellement que j’ai préféré les arrêter. C’est toujours très sec, mais au moins cela ne brûle plus… »
Ce type de témoignage, heureusement moins fréquent ces dernières années, ne traduit pas que l’impuissance, souvent réelle, des ophtalmologistes à soulager efficacement la souffrance des patients atteints de sécheresse oculaire. Il témoigne en plus du risque d’aggraver la situation par des traitements inappropriés ou trop agressifs. Les substituts lacrymaux sont destinés à lubrifier, humidifier, adoucir le frottement des paupières sur un œil desséché ou à le protéger au moins temporairement de l’air et des agressions extérieures. Quelle logique à y adjoindre des produits chimiques irritants, desséchants, voire toxiques ?
Et pourtant, même si la France est pionnière dans ce domaine, même si la prise de conscience gagne du terrain, il y a toujours dans le monde de nombreux produits contenant des conservateurs toxiques. On constate toujours une large indifférence ou au moins une méconnaissance de la part de la majorité des ophtalmologistes et un manque évident de soutien par les pouvoirs publics.
La réglementation impose qu’un collyre à usage répété contienne un conservateur pour empêcher la prolifération des germes après l’ouverture et éviter ainsi une infection lors des instillations ultérieures. Le risque infectieux, même s’il s’avère en réalité très exceptionnel, est en effet grave et l’on ne peut concevoir un flacon servant des semaines sans un additif antibactérien. Au fil des années, la recherche de conservateurs efficaces et tolérables a éliminé les plus allergisants et les plus irritants, pour s’orienter vers une famille au profil idéal, les ammoniums quaternaires, au premier rang desquels le chlorure de benzalkonium (BAK). Le BAK est le produit idéal : petite molécule, il crée peu de réactions proprement allergiques, il ne pique pas ou très peu lors de son instillation et il est un puissant agent antibactérien, mais il agit aussi sur les champignons et sur certains virus. La preuve : il est largement utilisé dans l’industrie comme nettoyant, savon antiseptique, désinfectant entre autres dans les piscines, mais aussi pour éliminer les mousses sur les pierres et même comme… spermicide [1] !
Ce produit si attrayant par son efficacité et sa polyvalence est donc le conservateur préféré de l’industrie pharmaceutique, mais aussi des autorités, qui, fondant leurs rapports sur des essais cliniques à court terme, considèrent avant tout l’efficacité de cet agent antibactérien sans en déceler la face cachée, largement sous-estimée car sournoise et surtout décalée dans le temps [2]. Le BAK, outre les avantages déjà cités, est en effet irritant (tous les dermatologues le connaissent bien), détergent (il dissout les graisses comme un savon), cytotoxique, en particulier pour les cellules à mucus [3], et il favorise inflammation [4] et dissolution du film lacrymal [5]. Il a ainsi été démontré que l’osmolarité lacrymale était augmentée chez des patients glaucomateux en proportion du nombre de collyres conservés qu’ils instillaient [5]. La prévalence de la sécheresse est ainsi très augmentée dans le glaucome, en raison des conservateurs des collyres, par rapport à la prévalence normale dans une population non soumise à ces traitements chroniques [6–9].
In vitro ou sur des modèles animaux, toutes ces propriétés délétères peuvent être démontrées et reproduites [2]. Une de ces expériences est particulièrement informative : le BAK exerce une toxicité bien identifiée, proportionnelle à la concentration utilisée et à la durée de contact avec des cellules en culture (fig. 3-13). Mais cette cytotoxicité est bien plus forte si les cellules ont été préalablement soumises à un stress osmotique, donc dans des conditions de sécheresse oculaire. Dans ce cas, la toxicité est bien plus marquée, ce qui explique que le BAK soit très fortement et rapidement mal toléré par les patients atteints de syndrome sec, mais signifie aussi que, dans le cas du glaucome, le BAK induit progressivement les conditions de sa propre toxicité, et donc que les manifestations oculaires sont souvent décalées, méconnues ou mises sur le compte d’autres pathologies [10].
BAK et sécheresse oculaire sont donc incompatibles. On peut schématiser ainsi le cercle vicieux induit par les conservateurs en cas de sécheresse oculaire : plus on a les yeux secs, plus on met de gouttes ; plus on met de gouttes, plus le BAK dissout le film lacrymal et crée de sécheresse, incitant à instiller encore plus de gouttes… Le clinicien lui-même peut participer à cette chronicisation en incitant le patient qui présente une kératite à instiller encore plus de gouttes. Une atteinte diffuse, localisée le long de la rivière lacrymale ou isolée sur la conjonctive nasale doit faire suspecter un problème toxique (fig. 3-14 et 3-15).
En outre, le BAK est neurotoxique, perturbant les nerfs cornéens, et créant une relative hypoesthésie cornéenne [11, 12], ce qui peut réduire éventuellement certains symptômes, mais est susceptible d’aggraver la sécheresse oculaire ou de créer un retard de cicatrisation par déprivation neurotrophique.
Devant une cornée qui ne cicatrise pas ou mal, il faut toujours essayer de supprimer le conservateur si cela est possible, ou d’en réduire la quantité instillée, car l’interaction entre le conservateur et la surface oculaire peut avoir des conséquences parfois dramatiques, pouvant aller jusqu’à de véritables pseudopemphigoïdes toxiques (fig. 3-16) [13]. Cette problématique sur les bénéfices/risques des conservateurs est encore source de débat si le conservateur est la contrepartie inévitable à un médicament indispensable, mais dans une sécheresse où le produit n’a pas d’action médicamenteuse proprement dite et sert avant tout à lubrifier et humidifier, le BAK détergent est simplement… un non-sens.
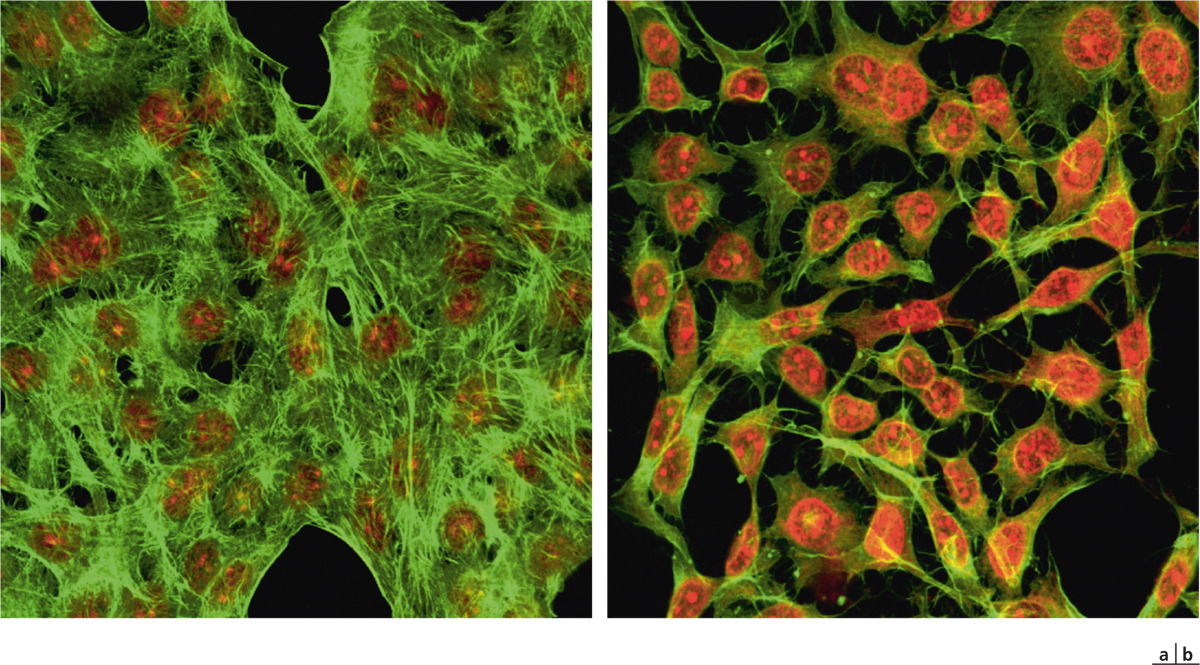
Fig. 3-13 Cytotoxicité du chlorure de benzalkonium sur des cultures cellulaires de conjonctive.
a. Cellules normales. b. Aspect de rétraction cellulaire majeure après 15 minutes de contact avec du benzalkonium à la concentration de 0,02 %.

Fig. 3-14 Kératite toxique inférieure.

Fig. 3-15 Coloration nasale de la conjonctive d’origine toxique.
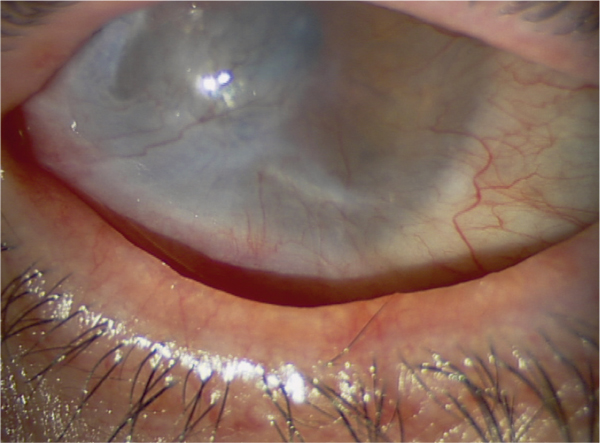
Fig. 3-16 Pseudopemphigoïde toxique.
Il existe des solutions pour éliminer ce produit et fort heureusement la prise de conscience de ses effets toxiques a permis des avancées réelles, même si l’on peut regretter encore des développements trop lents, des remboursements insuffisants, une indifférence persistante des acteurs de santé comme des décideurs, et l’absence de généralisation de produits sans conservateurs à toutes les pathologies, en tout cas chroniques.
Ces atermoiements s’expliquent par la recommandation sécuritaire, également légitime, de la prévention des infections. Il ne suffit donc pas de dire que les conservateurs sont nocifs et de les supprimer sans contrepartie. Il faut des adaptations techniques, nécessairement longues à développer et coûteuses.
Une technique simple et logique pour supprimer le conservateur est de présenter le collyre dans un flacon jetable immédiatement après usage, unidose ou monodose, qui représente la solution la plus adaptée. Encore faut-il pouvoir le manipuler, l’ouvrir, ce qui n’est pas toujours facile, le presser pour vider une ou deux gouttes. Lorsqu’on souffre de polyarthrite rhumatoïde, le casse-tête devient vite un enfer.
Des alternatives aux unidoses sont possibles, même si elles concernent un moins grand nombre de produits. Ce sont les flacons apparemment classiques dans leur volume et leur utilisation sur un mois, voire trois, mais associés à un filtre, qui élimine le conservateur ou empêche la contamination du flacon. Dans les deux cas, la goutte administrée ne contient pas de conservateur. On va trouver dans cette catégorie tous les collyres dont le nom est suivi des suffixes ABAK® (pour « absence de BAK »), MULTI® ou COMOD®. Ces types de flacons couvrent une large gamme de produits dans la sécheresse, appréciés pour leur efficacité globale et leur excellente tolérance, précisément du fait de l’absence de conservateur.
Enfin, certains laboratoires, conscients de la toxicité du BAK, mais aussi des problèmes liés aux dosettes jetables (peu rentables à fabriquer, difficiles à manipuler, quantités importantes de plastique peu ou non recyclé), ont préféré privilégier le développement de conservateurs alternatifs, non ou peu toxiques et surtout non détergents comme le BAK qui décape le film lacrymal. Ces alternatives, Purite® ou Polyquad®, sont encore peu nombreuses mais elles peuvent constituer un compromis entre toxicité et sécurité. Cependant, même non ou peu toxique, un conservateur reste un agent chimique chargé de détruire des germes. Il est possible que les patients les plus sensibles et les plus fragiles soient gênés, mais mieux informés, face à des ophtalmologistes plus attentifs, ils pourront toujours arrêter un traitement peu satisfaisant et bénéficier d’une gamme de plus en plus large dans la sécheresse oculaire.
Beaucoup de progrès ont été faits en 20 ans : partie de l’écoute et de l’observation des patients, une recherche scientifique active, en (très) grande partie française, a permis une prise de conscience progressive d’un problème jusqu’alors négligé pour ne pas dire carrément refoulé : des patients osant assez rarement se plaindre du traitement prescrit, des intolérances finalement très difficiles à identifier par rapport à la maladie initiale, des ophtalmologistes indifférents ou non informés, des laboratoires peu enclins à reconnaître les défauts de leurs produits et à développer des alternatives moins rentables, des autorités encore moins motivées pour rembourser mieux ce qui coûte plus…
Aujourd’hui, les patients souffrant de sécheresse oculaire peuvent bénéficier d’une large gamme de produits sans conservateur ou tout au moins sans BAK. Le même progrès a été réalisé, quoique avec beaucoup de retard, dans une autre maladie importante, l’allergie oculaire, où il est souvent nécessaire de se traiter de manière chronique. Mais pourquoi une autre maladie chronique comme le glaucome est-elle encore négligée ?
Le glaucome est une maladie qui expose à un risque de cécité si elle n’est pas traitée. On comprend que certains effets secondaires soient le prix à payer contre une évolution aussi grave, mais environ la moitié des patients traités au long cours (c’est-à-dire toute la vie) pour glaucome présentent une sécheresse oculaire. Cela représente approximativement 300 à 400 000 personnes rien qu’en France. Cette sécheresse est souvent due aux traitements locaux ou en tout cas aggravée par eux, et en particulier par le conservateur, le classique BAK, détergent et irritant. Les études sont toutes concordantes pour démontrer le rôle du BAK dans le développement progressif de cette sécheresse. Comme elle est décalée dans le temps, à la différence des allergies ou des syndromes secs déjà présents avant le traitement, cette sécheresse induite est la plupart du temps négligée voire niée dans son importance et sa sévérité compte tenu de la gravité du glaucome. Mais les patients glaucomateux traités développant une sécheresse souffrent tout autant que ceux qui ont une sécheresse spontanée ou due à une autre cause.
[1] Vaede D, Baudouin C, Warnet JM, Brignole-Baudouin F. Les conservateurs des collyres : vers une prise de conscience de leur toxicité. J Fr Ophtalmol 2010 ; 33 : 505-24.
[2] Baudouin C, Labbé A, Liang H, et al. Preservatives in eyedrops : the good, the bad and the ugly. Prog Retin Eye Res 2010 ; 29 : 312-34.
[3] Rolando M, Brezzo G, Giordano P, et al. The effect of different benzalkonium chloride concentrations on human normal ocular surface. A controlled prospective impression cytology study. The lacrimal system. Amsterdam : Kagler & Ghedini Publications ; 1991. p. 89-91.
[4] Baudouin C, Liang H, Bremond-Gignac D, et al. CCR 4 and CCR 5 expression in conjunctival specimens as differential markers of T(H)1/T(H)2 in ocular surface disorders. J Allergy Clin Immunol 2005 ; 116 : 614-9.
[5] Labbé A, Terry O, Brasnu E, et al. Tear film osmolarity in patients treated for glaucoma or ocular hypertension. Cornea 2012 ; 31 : 994-9.
[6] Pisella PJ, Pouliquen P, Baudouin C. Prevalence of ocular symptoms and signs with preserved and preservative free glaucoma medication. Br J Ophthalmol 2002 ; 86 : 418-23.
[7] Leung EW, Medeiros FA, Weinreb RN. Prevalence of ocular surface disease in glaucoma patients. J Glaucoma 2008 ; 17 : 350-5.
[8] Erb C, Gast U, Schremmer D. German register for glaucoma patients with dry eye. I. Basic outcome with respect to dry eye. Graefes Arch Clin Exp Ophthalmol 2008 ; 246 : 1593-601.
[9] Baudouin C, Renard JP, Nordmann JP, et al. Prevalence and risk factors for ocular surface disease among patients treated over the long term for glaucoma or ocular hypertension. Eur J Ophthalmol 2012 ; 11 : doi : 10.5301/ejo.5000181.
[10] Clouzeau C, Godefroy D, Riancho L, et al. Hyperosmolarity potentiates toxic effects of benzalkonium chloride on conjunctival epithelial cells in vitro. Mol Vis 2012 ; 18 : 851-63.
[11] Martone G, Frezzotti P, Tosi GM, et al. An in vivo confocal microscopy analysis of effects of topical antiglaucoma therapy with preservative on corneal innervation and morphology. Am J Ophthalmol 2009 ; 147 : 725-35 e1.
[12] Labbé A, Alalwani H, Van Went C, et al. The relationship between subbasal nerve morphology and corneal sensation in ocular surface disease. Invest Ophthalmol Vis Sci 2012 ; 53 : 4926-31.
[13] Thorne JE, Anhalt GJ, Jabs DA. Mucous membrane pemphigoid and pseudopemphigoid. Ophthalmology 2004 ; 111 : 45-52.
S. Michée, C. Baudouin, A. Denoyer
La sécheresse oculaire est un mécanisme physiopathologique complexe qui résulte de multiples facteurs dépendant de l’environnement. L’hyperosmolarité et l’instabilité du film lacrymal sont les deux mécanismes d’entrée dans un cercle vicieux inflammatoire entretenant une sécheresse oculaire. L’hyperosmolarité et l’instabilité du film lacrymal ne sont pas des mécanismes exclusifs ; ils peuvent s’associer et chacun peut entraîner l’autre. L’hyposécrétion lacrymale et l’hyperévaporation des larmes sont les deux principales causes physiopathologiques reconnues de sécheresse oculaire à ce jour. Différentes étiologies peuvent amener à une sécheresse oculaire en aboutissant aux mêmes mécanismes physiopathologiques.
La sécheresse oculaire est une pathologie multifactorielle dont les causes possibles sont multiples, persistantes et parfois intriquées. Même si la base de la classification étiologique demeure inchangée, c’est-à-dire l’insuffisance de sécrétion opposée à l’hyperévaporation, les nouvelles méthodes d’investigation ainsi que les résultats récents de la recherche fondamentale permettent de mieux définir le ou les mécanismes responsables de la pathologie dans chaque cas [1]. L’identification des processus inflammatoires comme acteurs centraux de la sécheresse oculaire d’une part et une meilleure évaluation de la composante neurogène d’autre part constituent des éléments indispensables pour reconstituer le chemin pathogénique menant à la sécheresse. Ainsi, l’amélioration de nos connaissances permet de mieux comprendre non pas l’origine unifactorielle mais les origines de la sécheresse [2].
L’hyperosmolarité des larmes est considérée comme un mécanisme central causant ou favorisant une inflammation de la surface oculaire, des lésions et des symptômes. Ce phénomène biologique réduit le volume cellulaire et augmente la concentration en solutés, causes d’un stress oxydant et de dommages irréversibles sur l’ADN conduisant à la mort cellulaire [3]. L’hyperosmolarité est la conséquence de l’évaporation de l’eau contenue dans le film lacrymal exposé à l’air dans des situations d’insuffisance de sécrétion et/ou d’une évaporation excessive [4]. L’épaisseur du film lacrymal est l’objet de variations importantes, en fonction de l’environnement et du clignement ; les amincissements et les ruptures lacrymales pourraient donc amener à une augmentation d’autant plus rapide de l’osmolarité [5]. Les sécrétions lacrymales étant naturellement hypotoniques, l’osmolarité mesurée sur le film lacrymal sera plus élevée que dans les ménisques de larmes [5].
L’hyperosmolarité entraîne une cascade de réactions inflammatoires à la surface des cellules épithéliales impliquant la voie des MAP kinases et de NF-κB [6] avec la production de cytokines pro-inflammatoires (IL-1α, IL-1β, TNF-α et métalloprotéinases, en particulier MMP-9) [7] qui activent et recrutent des cellules inflammatoires au niveau de la surface oculaire [8]. In vitro, un stress dessicatif [9] induit une apoptose des cellules de la surface oculaire, épithéliales mais aussi cellules à mucus avec une diminution de la concentration de mucine [10, 11]. Aux stades débutants de la sécheresse oculaire, les lésions causées par l’inflammation, l’hyperosmolarité et les stress mécaniques provoquent une stimulation réflexe du nerf trijumeau. L’activité réflexe du nerf trijumeau augmente la fréquence des clignements palpébraux et le flux de sécrétion lacrymale. Cette augmentation de sécrétion et de clignements pour compenser l’hyperosmolarité pourrait expliquer l’augmentation de sécrétion lors du test de Schirmer mesurée chez les patients avec dysfonctionnement meibomien [12]. L’augmentation de sécrétion lacrymale provoquée par l’inflammation de surface aurait cependant des limites, en induisant une libération de médiateurs inflammatoires [13] et un épuisement des glandes lacrymales [14]. Il a ainsi été suggéré que les périodes avec une activité réflexe intense sont suivies d’une période de diminution d’activité avec baisse de la sensibilité cornéenne liée probablement à une diminution du nombre et de la densité des nerfs sous-épithéliaux ainsi qu’à la diminution de la densité des cellules épithéliales [15]. Une fois les systèmes de compensation par hypersécrétion dépassés, quelle que soit la cause (insuffisance de sécrétion ou évaporation accrue), les deux mécanismes peuvent s’imbriquer, entretenant ainsi un cycle pathogénique auto-entretenu nourri par l’inflammation [16].
L’instabilité lacrymale est un mécanisme causal à part entière de sécheresse oculaire ; il entraîne une évaporation accrue de la composante aqueuse du film lacrymal (vidéo 3-2). La notion de temps de rupture du film lacrymal est à corréler à la fréquence des battements palpébraux – appelée indice de protection oculaire –, considérée comme normale lorsque les clignements palpébraux surviennent avant la rupture du film lacrymal [17]. L’instabilité du film lacrymal est reconnue pour assécher et augmenter l’osmolarité de la surface oculaire exposée à l’air, associant lésions épithéliales, perturbation des glycocalyx et perte en cellules à mucus [18].
La stabilité du film lacrymal dépend en grande partie de la qualité des lipides de surface [19]. L’épaisseur de la couche lipidique du film lacrymal influence le temps de rupture du film lacrymal (break-up time [BUT]), spontané (noninvasive BUT) ou mesuré avec de la fluorescéine, sans qu’il y ait une corrélation parfaite, les zones de rupture ne se situant pas toujours au niveau de la couche de lipides la plus fine [20]. Les lipides produits par les glandes de Meibomius semblent particulièrement efficaces pour maintenir la stabilité du film lacrymal et réduire l’évaporation [21].
Le rôle des mucines dans la stabilité du film lacrymal a aussi été mis en évidence, agissant comme agents mouillants [22]. Les mucines présentes à la surface du film lacrymal augmentent la pression de surface en comprimant les lipides et en les réorganisant pour modifier les propriétés viscoélastiques de la surface oculaire [23]. Ils assurent un rôle tensioactif, mais favorisent aussi l’adhérence du complexe aqueux lacrymal à la surface des cellules épithéliales cornéennes.
Vidéo 3-2 Instabilité du film lacrymal avec un BUT extrêmement court.
De nombreuses études mettent en relation une association entre les facteurs environnementaux, comme la pollution et le faible taux d’humidité, et les phénomènes de sécheresse oculaire [24], en particulier dans les lieux confinés tels que les cabines d’avion [25]. Ces situations sont liées au mode de vie et peuvent être quasi permanentes pour certains patients. Le travail sur écran d’ordinateur, l’usage prolongé de la télévision et la lecture sur de longues durées peuvent provoquer des symptômes de sécheresse oculaire [26]. Il existe également des variations diurnes des symptômes [27]. L’exposition à la poussière, au soleil ou au vent peut aussi provoquer des symptômes de sécheresse oculaire [28]. La prévalence de la sécheresse oculaire aux États-Unis est plus élevée dans les États du Sud que dans les États du Nord [29]. De plus, le tabagisme actif ou passif augmente fortement la symptomatologie de sécheresse oculaire [30]. Une réduction de la fréquence des clignements peut être induite par des contraintes psychologiques [31]. Le régime alimentaire semble également jouer un rôle, les régimes riches en acides gras oméga-3 semblant réduire l’incidence de sécheresse oculaire [32].
En outre, un âge avancé et le sexe féminin sont deux facteurs de risque généraux de sécheresse oculaire. La période postménopausique entraînerait une diminution de la production de larmes à partir de l’âge de 60 ans. Le vieillissement est associé à de nombreux changements physiologiques incluant une diminution du flux et du volume lacrymaux, une augmentation de l’osmolarité, une diminution de la stabilité du film lacrymal et des altérations de la composition des glandes de Meibomius [33, 34].
Maladie inflammatoire auto-immune chronique ciblant les glandes exocrines, le syndrome de Gougerot-Sjögren (SGS) est la plus fréquente des maladies inflammatoires rhumatoïdes, avec une prévalence allant jusqu’à 4,8 % en fonction des études [35]. Les femmes sont plus souvent atteintes avec un ratio de neuf pour un. Les causes de la maladie sont encore incertaines, avec de probables origines génétiques, environnementales et hormonales. Il n’y aurait pas de distribution géographique de la maladie [36, 37]. Les glandes lacrymales et salivaires sont infiltrées par des lymphocytes T, entraînant une mort des cellules des canaux excréteurs et des acini séreux. L’hyposécrétion résultant de la destruction des glandes explique le tableau clinique typique de xérophtalmie et de xérostomie présenté par ces patients. Le SGS peut être isolé – on parle alors de syndrome primaire –, ou bien associé à une connectivite entrant dans le cadre d’un syndrome dit secondaire.
Les critères diagnostiques établis en 2002 par l’American-European Consensus Group (AECG) ont été révisés en 2012 par la Sjögren’s International Collaborative Clinical Alliance (SICCA) (tableau 3-7) [38], où 2 critères sur 3 permettent de poser le diagnostic. Aucun test de laboratoire ne suffit à poser le diagnostic ; bien souvent, il existe une combinaison d’éléments évocateurs – élévation de la vitesse de sédimentation, anémie normocytaire normochrome, leucopénie et hypergammaglobulinémie polyclonale. Des auto-anticorps sont présents, dans la majorité des cas anti-Ro/SS-A et anti-La/SS-B pour le syndrome primaire, mais également le facteur rhumatoïde (FR) et les anticorps antinucléaires en cas de syndrome secondaire. Le rôle diagnostique de l’histopathologie des glandes salivaires accessoires est toujours considéré comme gold standard, mais l’analyse des glandes salivaires par échographie pourrait remplacer la biopsie [39]. La distinction entre formes primaires et secondaires serait purement biologique, sans variation sur le plan clinique.
Les principales connectivites associées sont le lupus érythémateux disséminé et la polyarthrite rhumatoïde [35]. En plus de la polyarthrite rhumatoïde et du lupus érythémateux disséminé, la périartérite noueuse, la maladie de Wegener, la sclérodermie systémique, la sclérose biliaire primitive peuvent aussi être des causes de SGS secondaire [40]. Un allèle commun lié au complexe majeur d’histocompatibilité a été retrouvé chez une majorité de patients atteints de SGS, connu sous le nom de HLA DQA1*0501 [41]. Certaines infections pourraient également jouer un rôle dans la survenue d’une maladie de Sjögren, telles que le virus d’Epstein-Barr (EBV), le cytomégalovirus (CMV), l’Helicobacter pylori pour les plus connues [42]. Un déficit nutritionnel en acides gras insaturés comme l’oméga-3 ainsi qu’en vitamine C a été rapporté chez les patients atteints de SGS [43]. La gravité de la maladie est liée à l’atteinte extraglandulaire et semble liée à une prévalence accrue de lymphomes. La vitamine D jouerait un rôle dans les processus pathogéniques et l’expression de la maladie [35].
Tableau 3-7 Critères diagnostiques de la maladie de Gougerot-Sjögren [37].
Ces maladies regroupent celles entraînant un dysfonctionnement des glandes lacrymales lorsque les caractéristiques de SGS ont été éliminées. La sarcoïdose, du fait de son infiltration des glandes lacrymales par des granulomes inflammatoires, entraîne une hyposécrétion lacrymale [44]. On peut citer également les réactions de greffon contre l’hôte, apparaissant environ 6 mois après transplantation de cellules souches hématopoïétiques, conséquence de la fibrose des glandes lacrymales par l’activation des lymphocytes T sur les fibroblastes ainsi que des glandes de Meibomius, de la cornée et de la conjonctive sans signes pathognomoniques [45]. La sécheresse oculaire reste le symptôme principal dans les réactions de greffon contre l’hôte.
Une cause principale semble être liée à l’âge. Il a été montré un lien significatif entre le vieillissement et l’osmolarité, le volume et l’évaporation des larmes [33]. Il est admis que des anomalies des conduits lacrymaux sont plus présentes dans les populations âgées [46]. Les infiltrats lymphocytaires touchant les glandes lacrymales sont similaires aux anomalies retrouvées en cas de SGS débutant. Cette fibrose progressive des canaux lacrymaux, pouvant aller jusqu’à l’atrophie, serait la conséquence d’épisodes de conjonctivites répétées ou d’inflammations infracliniques.
L’alacrymie congénitale est une cause rare de sécheresse par hyposécrétion. D’origine génétique, elle regroupe différentes formes associées ou non à des malformations. Le syndrome triple A, associant alacrymie, achalasie du cardia et insuffisance surrénalienne (syndrome d’Addison) [47], est causé par des mutations du gène codant pour la protéine ALADIN, située sur le chromosome 12, jouant un rôle dans l’adressage des protéines et de l’ARN entre le noyau et le cytoplasme [48]. L’achalasie-alacrymie est une variante du syndrome triple A sans atteinte surrénalienne [49]. L’alacrymie congénitale isolée est une autre variante du syndrome triple A avec une atteinte lacrymale isolée [49]. Enfin, la dysautonomie familiale [50] est une maladie rare avec perte de sensibilité et faible pression artérielle. Elle est causée par des mutations du gène codant pour la protéine associée au complexe IκB kinase, affectant le développement des neurones sensitifs et baroréflexes.
Une infiltration des glandes lacrymales peut être responsable d’une hyposécrétion, visible dans certaines pathologies acquises comme les lymphomes [51], ou le syndrome d’immunodéficience acquise (sida), avec une prédominance de lymphocytes T CD8 infiltrés dans les glandes lacrymales [52]. Citons enfin les causes traumatiques et iatrogènes : l’exérèse de la glande lacrymale et de son conduit principal peut entraîner un syndrome sec, sans pour autant être systématique, grâce à la compensation par les sécrétions des glandes lacrymales accessoires et des cellules conjonctivales [53] ; la dénervation parasympathique des glandes lacrymales est également une cause de sécheresse oculaire [54]. Des modifications inflammatoires des glandes lacrymales ainsi qu’une réduction des protéines et du volume lacrymal sont observées après dénervation [55].
L’obstruction des canaux et du conduit principal des glandes lacrymales peut induire une sécheresse lacrymale par hyposécrétion. De nombreuses conjonctivites cicatrisantes peuvent causer cet état d’obstruction.
Le trachome est une kératoconjonctivite causée par Chlamydiae trachomatis dont les séquelles cicatricielles sur la conjonctive tarsale supérieure entraînent un trichiasis et une obstruction des glandes de Meibomius [56]. La sécheresse est une conséquence de cet état auquel se surajoutent une obstruction des canaux lacrymaux, une malposition palpébrale et un déficit de la couche lipidique du film lacrymal.
La pemphigoïde des membranes muqueuses ou pemphigoïde cicatricielle est une dermatose des muqueuses marquée par une éruption bulleuse avec formation ultérieure de cicatrices. Histologiquement, des dépôts d’immunoglobuline G (IgG), d’IgA et/ou de C3 sont présents sur la membrane basale épidermique [57]. La sécheresse est la conséquence de l’obstruction lacrymale, du dysfonctionnement meibomien cicatriciel et des remaniements palpébraux. L’érythème polymorphe est une dermatose aiguë touchant la peau et les muqueuses provoquée par une prise médicamenteuse, une infection ou une atteinte carcinomateuse [58]. Les cicatrices séquellaires peuvent entraîner une sécheresse oculaire de la même façon que la pemphigoïde cicatricielle. Enfin, les brûlures chimiques et thermiques diffuses peuvent induire des cicatrices obturant le conduit lacrymal, provoquant une sécheresse par insuffisance de sécrétion [1].
Au-delà des principes actifs des collyres ainsi que des conservateurs dont les effets sur la surface oculaire sont décrits plus haut dans ce chapitre, de nombreux médicaments pris par voie systémique agissent sur l’inhibition du réflexe sensitivomoteur [59], avec pour résultante une sécheresse par hyposécrétion lacrymale. Les principales classes thérapeutiques de médicaments systémiques sont résumées dans le tableau 3-8.
Tableau 3-8 Principales classes médicamenteuses susceptibles de causer une sécheresse oculaire par hyposécrétion [58, 68].
La sécrétion lacrymale à l’état éveillé est due en grande partie à un récepteur dépendant du nerf trijumeau. Il existe un réflexe sensitif lorsque les yeux sont ouverts provenant de la surface oculaire exposée à l’air. Une réduction de l’arc réflexe de la surface oculaire peut provoquer une sécheresse par deux mécanismes, premièrement en réduisant la sécrétion lacrymale réflexe et deuxièmement en réduisant la fréquence des clignements, augmentant ainsi l’hyperévaporation [14, 17]. Ces hypothèses sont confortées par des expérimentations chez l’animal, où la dénervation du trijumeau modifie la production lacrymale [60]. De plus, l’anesthésie cornéenne topique entraîne une réduction des clignements et de la production de larmes [61].
Les porteurs de lentilles de contact sont plus exposés aux problèmes de sécheresse oculaire. Une des causes est liée à la diminution de la sensibilité cornéenne provoquée par le port des lentilles [62].
Le diabète a été identifié comme facteur de risque de sécheresse [63]. Une réduction de la sécrétion lacrymale réflexe sans différence sur le temps de rupture du film lacrymal ni sur la fluoroscopie chez les patients diabétiques a suggéré que les symptômes de sécheresse seraient liés à la neuropathie diabétique sensitive et autonome, sans exclure les possibles remaniements microvasculaires des glandes lacrymales.
La kératite neurotrophique est une maladie dégénérative de la cornée causée par le dysfonctionnement total ou partiel de l’innervation trigéminée [64]. L’hypoesthésie, voire l’anesthésie de la cornée provoquée par cette dénervation, souvent liée à l’herpès, diminue la sécrétion lacrymale réflexe et la fréquence des clignements palpébraux. Le métabolisme et la mitose des cellules épithéliales cornéennes sont compromis, induisant un déficit de cicatrisation épithéliale, un œdème stromal et intercellulaire avec une perte des microvillosités et un développement anormal de la membrane basale [65]. Les sensations de sécheresse survenant plusieurs mois après chirurgie réfractive, LASIK ou PKR, sont expliquées essentiellement par les lésions sur les nerfs cornéens, qui diminuent la sensibilité cornéenne [66]. Les sensations seraient transitoires chez les personnes ne souffrant pas de sécheresse oculaire avec des symptômes s’amendant au cours de la première année [67]. Il est possible en revanche de voir apparaître de véritables kératites neurotrophiques après chirurgie réfractive chez les patients ayant un syndrome sec préalable [65, 67].
Les lésions du nerf crânien VII (facial) impliquant la portion appelée nerf intermédiaire induisent une sécheresse oculaire par perte de la fonction sécrétoire motrice de la glande lacrymale. Le nerf intermédiaire porte les fibres nerveuses postganglionnaires et parasympathiques aboutissant à la glande lacrymale. La sécheresse oculaire est liée au déficit de sécrétion lacrymale associé à la fermeture palpébrale incomplète. La neurofibromatose est une des causes de parésie de cette portion du nerf facial [68]. De nombreux médicaments pris par voie systémique peuvent, par leurs effets secondaires, induire ou exacerber une sécheresse oculaire [59] (tableau 3-8). Les antihistaminiques et les antidépresseurs seraient les plus pourvoyeurs de sécheresse [69].
La figure 3-17 rappelle les différentes étiologies d’une sécheresse oculaire.
Cette affection est définie ainsi par le groupe d’étude du dysfonctionnement des glandes de Meibomius (DGM) [70] : une anomalie chronique, diffuse des glandes de Meibomius, caractérisée communément par une obstruction des canaux terminaux et/ou des changements en termes de qualité et de quantité des sécrétions glandulaires. Cet état peut altérer le film lacrymal, provoquer une irritation de la surface oculaire, réaliser une inflammation clinique et une pathologie de la surface oculaire. Reconnue comme la cause la plus fréquente de sécheresse oculaire par hyperévaporation [71], elle joue aussi un rôle dans les sécheresses par hyposécrétion [72]. De façon générale, la prévalence des DGM serait très élevée, variant de 20 à 60 % de la population selon les études et leur localisation géographique [72].
Il existe deux formes de DGM classées en fonction de la sécrétion des glandes : faible et haute délivrance. Les dysfonctionnements par faible délivrance sont les formes de DGM avec hyposécrétion et obstruction des glandes (forme la plus fréquente). L’obstruction des glandes est provoquée par une hyperkératinisation du conduit principal de la glande [72] évoluant vers l’atrophie progressive des glandes obstruées. Les formes avec hypersécrétion sont secondaires aux pathologies dermatologiques telles que la rosacée et la dermite séborrhéique. Les lipides produits par les glandes de Meibomius altérées diminuent la qualité du film lacrymal en modifiant sa composition.
Les DGM sont des maladies à mécanismes complémentaires (fig. 3-19) : l’atteinte palpébrale est une cause d’inflammation locale, faisant intervenir des facteurs microbiens et parasitaires, mais aussi de déficit lipidique quantitatif et/ou qualitatif. Inflammation palpébrale, prolifération microbienne et de Demodex, relargage de cytokines toxiques pour la cornée, sécheresse par hyperévaporation s’associent ainsi pour constituer un tableau physiopathologique faussement bénin, souvent très pénible, parfois dangereux pour la cornée, lorsque des infiltrats inflammatoires, des phlyctènes, des kératites ou des ulcérations périphériques viennent compliquer la meibomite.
Les causes de DGM sont multiples. La dysfonction peut être primaire ou secondaire. Initialement décrite chez les porteurs de lentilles de contact, elle est aussi présente chez les patients après chirurgie réfractive par LASIK. Les traitements hormonaux substitutifs semblent avoir une influence sur la progression et le développement d’une DGM [71], de même que les androgènes semblent avoir un effet bénéfique. L’aniridie, la colonisation par Demodex folliculorum, le tatouage des paupières, le floppy eyelid syndrome, la conjonctivite gigantopapillaire et le trachome sont des pathologies parmi les plus nombreuses impliquant une dysfonction des glandes de Meibomius [73].
Le rôle des médicaments dans la DGM n’a pas été spécifiquement étudié en dehors de l’isotrétinoïne qui entraîne une diminution de la densité des acini séreux associée à une réduction du volume et une augmentation de la viscosité du meibum [74].
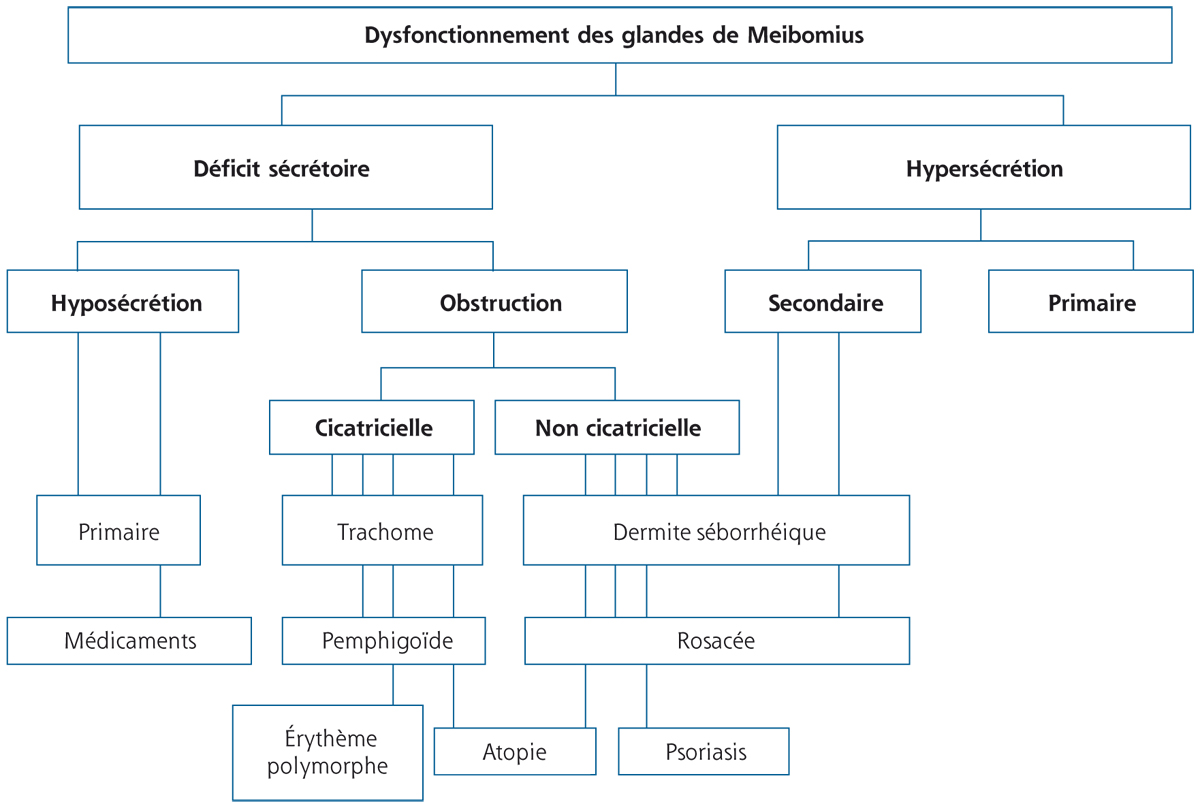
Fig. 3-18 Classification des dysfonctionnements meibomiens selon le taux de sécrétion du meibum [70].
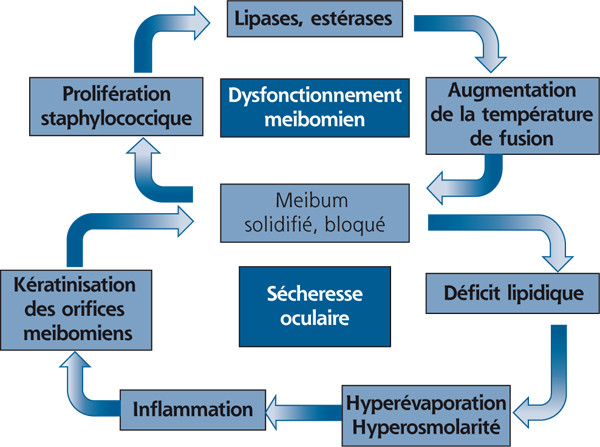
Fig. 3-19 Cercle vicieux illustrant la pathogénie des dysfonctionnements meibomiens.
L’augmentation de la surface oculaire exposée à l’air accélère l’évaporation par la diffusion et l’étalement du film lacrymal sur une plus grande surface. Les pathologies à l’origine de cette cause sont multiples : la craniosténose, certaines pathologies endocrines, les malpositions palpébrales (entropion et ectropion) et l’exophtalmie des myopies fortes, ou toute forme anatomique réalisant une exposition sclérale inférieure (scleral show) [75]. Les problèmes de congruence palpébrale postopératoires après blépharoplastie peuvent provoquer des phénomènes de sécheresse, de même que les clignements incomplets ou abortifs.
De nombreuses études ont montré que l’augmentation de l’ouverture palpébrale est associée à une hyperosmolarité lacrymale et à une hyperévaporation [75]. De même, l’augmentation de l’exposition à l’air de la surface oculaire peut être provoquée par certaines activités requérant une fixation en haut. On peut associer à ces troubles de la statique palpébrale les conjonctivochalasis réalisant une malocclusion palpébrale associée à des lésions de frottement cornéennes [76]. De même, la hauteur de l’ouverture palpébrale varie selon l’ethnie [77] et en fonction de la position du regard, augmentant d’autant plus l’évaporation que l’ouverture palpébrale est large.
Une faible fréquence de clignements palpébraux allonge la période d’exposition à l’air de la cornée entre deux renouvellements du film lacrymal [78]. Une diminution de la fréquence des clignements est observée dans plusieurs conditions, qu’elles soient liées au comportement ou à une pathologie. Certaines pathologies neurologiques extrapyramidales comme la maladie de Parkinson réduisent également la fréquence des clignements [79]. Présente chez environ 80 % des patients atteints de maladie de Parkinson, la sécheresse oculaire s’explique selon un triple mécanisme [80] : le principal est lié directement à la réduction de la fréquence des clignements et donc à la sécheresse par hyperévaporation ; les taux d’androgènes sont en outre plus faibles chez les patients parkinsoniens ; et enfin la neuropathie entraîne une diminution du larmoiement réflexe, soit une sécheresse par hyposécrétion.
En dehors de toute anomalie anatomique palpébrale ou oculaire, les clignements palpébraux réflexes ne sont pas systématiquement occlusifs. L’omniprésence des écrans dans certains domaines professionnels oblige une concentration et une fixation du regard diminuant la fréquence des clignements [81]. La réalisation de tâches de la vie courante impliquant la vision provoque une augmentation de clignements palpébraux incomplets associée à une diminution du temps de rupture du film lacrymal pouvant expliquer également des phénomènes de sécheresse oculaire même chez des sujets normaux [82].
Le déficit en vitamine A est responsable de sécheresse oculaire par deux mécanismes distincts. La vitamine A est essentielle pour le développement des cellules à mucus et l’expression des mucines à la base du glycocalyx [83]. Dans la xérophtalmie, où il existe un déficit en vitamine A, le film lacrymal est très instable avec un temps de rupture très réduit. Il a été montré également que les patients avec un déficit en vitamine A avaient des acini lacrymaux endommagés, exposant également à une sécheresse oculaire par insuffisance de sécrétion [84].
L’influence des hormones serait importante sur les phénomènes de sécheresse oculaire agissant sur les glandes de Meibomius, la sécrétion lacrymale, la densité en cellules à mucus sur la conjonctive [85]. De nombreuses pathologies impliquant les hormones sexuelles sont associées à une sécheresse oculaire. Cet effet a été suggéré après l’observation de troubles de la surface oculaire chez des femmes sous traitement hormonal substitutif ou chez des personnes avec un déficit androgénique chronique [29, 86]. L’amélioration des symptômes oculaires chez les patientes ménopausées sous traitement hormonal substitutif est controversée selon les études [85] ; ce dernier peut aussi bien améliorer qu’aggraver les symptômes, le bon fonctionnement de la surface oculaire nécessitant un équilibre hormonal constant que la substitution hormonale ne peut probablement pas assurer pleinement. Il a aussi été décrit l’apparition de signes de sécheresse oculaire chez les femmes avec une insuffisance ovarienne précoce [87], renforçant l’hypothèse du rôle des hormones sexuelles dans l’homéostasie de la surface oculaire. La sécheresse oculaire peut survenir également chez les patients sous traitement anti-androgénique dans le cadre d’un cancer de la prostate [88]. Un des mécanismes en cause serait l’augmentation de l’évaporation du film lacrymal [85]. La testostérone régule l’expression de milliers de gènes des glandes lacrymales et des glandes de Meibomius. Plus particulièrement, la stimulation androgène entraîne la production de lipides meibomiens et la suppression des gènes androgéniques entraîne une kératinisation de ces glandes [89]. Les hormones stéroïdes sexuelles pourraient induire des effets spécifiques sur les glandes de Meibomius et les glandes lacrymales selon leur caractère androgénique ou estrogénique.
D’autres hormones sont également en cause. Les pathologies thyroïdiennes sont fréquemment associées à des troubles de la surface oculaire en plus de l’association à la conjonctivite supérieure de Théodore. Il a été montré qu’environ 65 % des patients ayant une orbitopathie thyroïdienne présentaient également des signes de sécheresse oculaire [90]. L’association était d’autant plus fréquente que l’on retrouvait une exophtalmie, une lagophtalmie, une augmentation de l’ouverture palpébrale ainsi qu’une rétraction palpébrale inférieure.
Environ 30 % de la population générale souffrirait d’allergie, dont 40 à 80 % avec des symptômes oculaires [91]. Il est suggéré que les patients souffrant de conjonctivite allergique ont des signes de sécheresse oculaire dans la moitié des cas [92]. Les patients ayant des démangeaisons oculaires liées à l’allergie auraient un risque relatif supérieur à 2 d’avoir une sécheresse oculaire et un risque relatif supérieur à 7 d’avoir une inflammation oculaire.
La forme la plus fréquente est la conjonctivite saisonnière (90 %), suivie de la conjonctivite perannuelle (5 %) [93]. La conjonctivite gigantopapillaire et la blépharoconjonctivite de contact sont liées à une exposition locale à des corps étrangers ou cosmétiques. La kératoconjonctivite atopique ainsi que la kératoconjonctivite vernale sont souvent associées à un terrain atopique.
Les conjonctivites allergiques chroniques constituent un état complexe impliquant plusieurs mécanismes bien au-delà des mastocytes et des IgE [94]. L’implication du film lacrymal et des paupières dans les phénomènes allergiques met en jeu également les cellules à mucus, les éosinophiles ainsi que les lymphocytes. Les lymphocytes T sont impliqués dans l’inflammation concomitante à la sécheresse oculaire et aux conjonctivites allergiques. Les lymphocytes Th1 produisent de l’interféron gamma provoquant une cascade de médiateurs inflammatoires entretenant la sécheresse oculaire. Les lymphocytes Th2 seraient prédominants dans les phénomènes allergiques avec la production d’interleukines 4 et 13 [95]. Il est nécessaire de rechercher une allergie oculaire tant les phénomènes inflammatoires chroniques qui en résultent peuvent mimer un syndrome sec ou une rosacée.
Les produits contenus dans les collyres peuvent induire une sécheresse oculaire, que ce soit le principe actif ou les conservateurs, le chlorure de benzalkonium (BAK) étant en première ligne [96]. Le BAK est un détergent cationique qui s’incorpore de façon rapide et prolongée dans les lipides membranaires des cellules. La portion active du BAK interagit avec les sites de liaison guanine nucléotide triphosphate, influençant de nombreux processus cellulaires. Même à faible dose, le BAK est connu pour potentialiser l’effet pro-inflammatoire des cellules immunitaires [97]. De plus, il induit la synthèse de médiateurs de l’inflammation et de cytokines et possède une cytotoxicité dose-dépendante entraînant une apoptose [98]. Le BAK est retrouvé dans de nombreux collyres en tant que conservateur ; son effet pro-inflammatoire à faible concentration pourrait expliquer sa responsabilité dans de très nombreuses pathologies iatrogènes de la surface oculaire. Son effet a été identifié en comparant la toxicité de collyres avec la même molécule active avec et sans conservateur [99]. Il a également été montré que l’exposition au chlorure de benzalkonium entraîne une hypoesthésie cornéenne, qui aggrave elle-même une sécheresse [100].
Les collyres anesthésiants possèdent une activité toxique pour la surface oculaire par leurs effets secondaires. Ils réduisent la sécrétion lacrymale en diminuant le réflexe de larmoiement, et réduisent également la fréquence des clignements palpébraux. L’utilisation prolongée de collyres anesthésiants provoque une véritable kératite neurotrophique avec un risque de perforation cornéenne élevé [101].
La plupart des études rapportent une fréquence d’environ 50 % d’inconfort lié au port de lentilles de contact [102]. L’aspect et la composition de la couche lipidique sont modifiés par la présence de lentilles de contact, avec une variation de la concentration en esters de cholestérol, esters de cire et phospholipides. La couche de lipides en avant de la lentille de contact est spécialement pathologique avec une épaisseur réduite. L’évaporation des larmes est également augmentée ; les marqueurs d’inflammation oculaire sont augmentés [103] ; le temps de rupture du film lacrymal est lui abaissé. Les mécanismes physiopathologiques provoquant cet état de sécheresse ne sont pas complètement expliqués. L’inconfort lié au port de lentille serait augmenté d’autant plus que la couche de lipides en avant de la lentille est fine, avec une dégradation de ces lipides et une production de phospholipase A2 (PLA2) [104].
Le port de lentilles de contact induirait des changements de structure des glandes de Meibomius modifiant la production de meibum. Ces altérations pourraient expliquer les modifications d’épaisseur et d’instabilité du film lacrymal, augmenter l’osmolarité et déshydrater les lentilles de contact. Quelles que soient les propriétés d’hydratation, de mouillabilité, de souplesse et de perméabilité à l’oxygène, le port de lentilles de contact entraîne un déséquilibre de la surface oculaire avec des controverses entre différentes études sur la tolérance des matériaux [105].
La plupart des pathologies de surface cornéenne entraînent une déstabilisation du film lacrymal et ajoutent une composante de sécheresse à leur propre pathologie. On peut citer entre autres la conjonctivite supérieure limbique de Théodore, caractérisée par des épisodes d’inflammation en miroir des conjonctives bulbaire et tarsale en supérieur. Les causes et mécanismes sont encore inconnus ; la conjonctive elle-même semble contribuer à l’entretien de la maladie [106]. La physiopathologie illustre bien un phénomène de cercle vicieux inflammatoire, où il existe un frottement de la paupière en regard d’un excès de tissu conjonctival. Ce stress mécanique provoque une réaction inflammatoire locale, augmentant l’osmolarité de la surface oculaire et entraînant un œdème réactionnel de la conjonctive. Il résulte de l’œdème une augmentation des frottements conjonctivaux et des réactions inflammatoires cytotoxiques, détruisant les cellules à mucus, auto-entretenant la pathologie, qui déborde progressivement sur la cornée supérieure et entraîne une kératopathie chronique. L’arrêt des phénomènes inflammatoires semble être la clé du traitement. L’instillation de tacrolimus à 0,03 % en topique pourrait améliorer les cas réfractaires aux traitements anti-inflammatoires classiques [107].
De façon plus anodine, l’ingestion d’alcool a été mise en cause pour la réduction du temps de rupture du film lacrymal [108]. L’alcool est détectable dans les larmes et modifie l’osmolarité ainsi que le temps de rupture du film lacrymal. L’éthanol agirait comme un solvant des lipides de surface augmentant l’évaporation des larmes, avec hyperosmolarité et instabilité du film lacrymal. La déshydratation jouerait aussi un rôle sur la stabilité du film lacrymal en altérant la fonction des glandes lacrymales du fait de la baisse de pression sanguine et de l’augmentation de l’osmolarité sanguine [109].
Les progrès des méthodes d’évaluation et de la recherche ont permis de préciser les grands mécanismes responsables de sécheresse oculaire, affinant ainsi leur classification en regroupant les sécheresses en insuffisances de sécrétion et par instabilité du film lacrymal, qui semblent les plus fréquentes. L’amélioration de la compréhension de ces pathologies et de leur prise en charge globale, ces dernières années, a permis de mettre en avant les dysfonctions des glandes de Meibomius qui sont impliquées dans la majorité des sécheresses oculaires. La surface oculaire est un ensemble impliquant des phénomènes pro- et anti-inflammatoires dans un équilibre fragile, toute pathologie déséquilibrant la balance inflammatoire étant susceptible d’entraîner une sécheresse oculaire et de conduire les patients dans un véritable cercle vicieux biologique auto-entretenu.
[1] The definition and classification of dry eye disease : report of the Definition and Classification Subcommittee of the International Dry Eye WorkShop (2007). Ocul Surf 2007 ; 5 : 75-92.
[2] Labetoulle M, BAudouin C. From pathogenic considerations to a simplified decision-making schema in dry eye disease. J Fr Ophtalmol 2013 ; 36 : 543-47.
[3] Dmitrieva NI, Bulavin DV, Burg MB. High NaCl causes Mre11 to leave the nucleus, disrupting DNA damage signaling and repair. Am J Physiol Renal Physiol 2003 ; 285 : F266-74.
[4] Baudouin C, Aragona P, Messmer EM, et al. Role of hyperosmolarity in the pathogenesis and management of dry eye disease : proceedings of the OCEAN group meeting. Ocul Surf 2013 ; 11 : 246-58.
[5] Bron AJ, Tiffany JM, Yokoi N, Gouveia SM. Using osmolarity to diagnose dry eye : a compartmental hypothesis and review of our assumptions. Adv Exp Med Biol 2002 ; 506 : 1087-1095.
[6] Li DQ, Chen Z, Song XJ, et al. Stimulation of matrix metalloproteinases by hyperosmolarity via a JNK pathway in human corneal epithelial cells. Invest Ophthalmol Vis Sci 2004 ; 45 : 4302-11.
[7] De Paiva CS, Corrales RM, Villarreal AL, et al. Corticosteroid and doxycycline suppress MMP-9 and inflammatory cytokine expression, MAP K activation in the corneal epithelium in experimental dry eye. Exp Eye Res 2006 ; 83 : 526-35.
[8] Baudouin C. The pathology of dry eye. Surv Ophthalmol 2001 ; 45 : S211-20.
[9] Niederkorn JY, Stern ME, Pflugfelder SC, et al. Dessicating stress induces T-cell mediated Sjogren’s syndrome-like lacrimal keratoconjunctivitis sicca. J Immunol 2006 ; 176 : 3950-7.
[10] Kunert KS, Tisdale AS, Gipson IK. Goblet cell numbers and epithelial proliferation in the conjunctiva of patients with dry eye syndrome treated with cyclosporine. Arch Ophthalmol 2002 ; 120 : 330-7.
[11] Argüeso P, Balaram M, Spurr-Michaud S, et al. Decreased levels of the goblet cell mucin MUC 5AC in tears of Sjogren’s syndrome patients. Invest Ophthalmol Vis Sci 2002 ; 43 : 1004-11.
[12] Shimazaki J, Sakata M, Tsubota K. Ocular surface changes and discomfort in patients with meibomian gland dysfunction. Arch Ophthalmol 1995 ; 113 : 1266-70.
[13] Stern ME, Gao J, Siemasko KF, et al. The role of the lacrimal functional unit in the pathophysiology of dry eye. Exp Eye Res 2004 ; 78 : 409-16.
[14] Tang NE, Zuure PL, Pardo RD, et al. Reflex lacrimation in patients with glaucoma and healthy control subjects by fluorophotometry. Invest Ophthalmol Vis Sci 2000 ; 41 : 709-14.
[15] Benítez-del-Castillo JM, Acosta MC, Wassfi MA, et al. Relation between corneal innervation with confocal microscopy and corneal sensitivity with noncontact esthesiometry in patients with dry eye. Invest Ophthalmol Vis Sci 2007 ; 48 : 173-81.
[16] Tsubota K, Yamada M. Tear evaporation from the ocular surface. Invest Ophthalmol Vis Sci 1992 ; 33 : 2942-50.
[17] Abelson R, Lane KJ, Rodriguez J, et al. Validation and verification of the OPI 2.0 System. Clin Ophthalmol 2012 ; 6 : 613-22.
[18] Sweeney DF, Millar TJ, Raju SR. Tear film stability : A review. Exp Eye Res 2013 ; 117 : 28-38.
[19] Craig JP, Tomlinson A. Importance of the lipid layer in human tear film stability and evaporation. Optom Vis Sci 1997 ; 74 : 8-13.
[20] King-Smith PE, Reuter KS, Braun RJ, et al. Tear film breakup and structure studied by simultaneous video recording of fluorescence and tear film lipid layer images. Invest Ophthalmol Vis Sci 2013 ; 54 : 4900-9.
[21] Rosenfeld L, Fuller GG. Consequences of interfacial viscoelasticity on thin film stability. Langmuir 2012 ; 28 : 14238-44.
[22] Argüeso P, Gipson IK. Epithelial mucins of the ocular surface : structure, biosynthesis and function. Exp Eye Res 2001 ; 73 : 281-9.
[23] Millar TJ, Tragoulias ST, Anderton PJ, et al. The surface activity of purified ocular mucin at the air-liquid interface and interactions with meibomian lipids. Cornea 2006 ; 25 : 91-100.
[24] Wolkoff P, Nøjgaard JK, Franck C, Skov P. The modern office environment desiccate the eye ? Indoor Air 2006 ; 16 : 258-65.
[25] Tesón M, González-García MJ, López-Miguel A, et al. Influence of a controlled environment simulating an in-flight airplane cabin on dry eye disease. Invest Ophthalmol Vis Sci 2013 ; 54 : 2093-9.
[26] Schlote T, Kadner G, Frudenthaler N. Marked reduction and distinct pattern of eye blinking in patients with moderately dry eyes during video display terminal use. Graefes Arch Clin Exp Ophthalmol 2004 ; 242 : 306-12.
[27] Walker PM, Lane KJ, Ousler GW 3RD, Abelson MB. Diurnal variation of visual function and the signs and symptoms of dry eye. Cornea 2010 ; 29 : 607-12.
[28] Khurana AK, Choudhary R, Ahluwalia BK, Gupta S. Hospital epidemiology of dry eye. Indian J Ophthalmol 1991 ; 39 : 55-8.
[29] Schaumberg DA, Buring JE, Sullivan DA, Dana MR. Hormone replacement therapy and dry eye syndrome. JAMA 2001 ; 286 : 2114-9.
[30] Lee AJ, Lee J, Saw SM, et al. Prevalence and risk factors associated with dry eye symptoms : a population based study in Indonesia. Br J Ophthalmol 2002 ; 86 : 1347-51.
[31] Doughty MJ, Naase T. Further analysis of the human spontaneous eye blink rate by a cluster analysis-based approach to categorize individuals with “normal” versus “frequent” eye blink activity. Eye Contact Lens 2006 ; 32 : 294-9.
[32] Miljanović B, Trivedi KA, Dana MR, et al. Relation between dietary n-3 and n-6 fatty acids and clinically diagnosed dry eye syndrome in women. Am J Clin Nutr 2005 ; 82 : 887-93.
[33] Mathers WD, Lane JA, Zimmerman MB. Tear film changes associated with normal aging. Cornea 1996 ; 15 : 229-34.
[34] Sullivan BD, Evans JE, Dana MR, Sullivan DA. Influence of aging on the polar and neutral lipid profiles in human meibomian gland secretions. Arch Ophthalmol 2006 ; 124 : 286-92.
[35] Tincani A, Andreoli L, Cavazzana I, et al. Novel aspects of Sjögren’s syndrome in 2012. BMC Med 2013 ; 11 : 93.
[36] Piram M, Maldinia C, Mahr A. Effect on race/ethnicity on risk, presentation and course of connective tissue diseases and primary systemic vasculitides. Curr Opin Rheum 2012 ; 24 : 193-200.
[37] Whitcher JP, Shiboski CH, Shiboski SC, et al. A simplified quantitative method for assessing keratoconjunctivitis sicca from the Sjögren’s Syndrome International Registry. Am J Ophthalmol 2010 ; 149 : 405-15.
[38] Shiboski SC, Shiboski CH, Criswell L, et al. American College of Rheumatology classification criteria for Sjögren’s syndrome : a datadriven, expert consensus approach in the Sjögren’s International Collaborative Clinical Alliance cohort. Arthritis Care Res (Hoboken) 2012 ; 64 : 475-87.
[39] MILIC V, PETROVIC R, BORICIC I, et al. Ultrasonography of major salivary glands could be an alternative tool to sialoscintigraphy in the American-European classification criteria for primary Sjögren’s syndrome. Rheumatology 2012, 51 : 1081-1085.
[40] Goldblatt F, O’Neill SG. Clinical aspects of autoimmune rheumatic diseases. Lancet 2013 ; 382 : 797-808.
[41] Cruz-Tapias P, Rojas-Villarraga A, Maier-Moore S, Anaya JM. HLA and Sjögren’s syndrome susceptibility. A meta-analysis of worldwide studies. Autoimmun Rev 2012 ; 11 : 281-7.
[42] Kivity S, Agmon-Levin N, Blank M, Shoenfeld Y. Autoimmunity and environment : infections and autoimmunity - friends or foes ? Trends Immunol 2009 ; 30 : 409-14.
[43] Cermak JM, Papas AS, Sullivan RM, et al. Nutrient intake in women with primary and secondary Sjogren’s syndrome. Eur J Clin Nutr 2003 ; 57 : 328-34.
[44] James DG, Anderson R, Langley D, Ainslie D. Ocular sarcoidosis. Br J Ophthalmol 1964 ; 48 : 461-70.
[45] Espana EM, Shah S, Santhiago MR, Singh AD. Graft versus host disease : clinical evaluation, diagnosis and management. Graefes Arch Clin Exp Ophthalmol 2013 ; 251 : 1257-66.
[46] Obata H, Yamamoto S, Horiuchi H, Machinami R. Histopathologic study of human lacrimal gland. Statistical analysis with special reference to aging. Ophthalmology 1995 ; 102 : 678-86.
[47] Arya SK, Chaudhuri Z, Jain R, et al. Congenital alacrima in Pierre Robin sequence. Cornea 2004 ; 23 : 632-4.
[48] Krumbholz M, Koehler K, Huebner A. Cellular localization of 17 natural mutant variants of ALADIN protein in triple A syndrome—shedding light on an unexpected splice mutation. Biochem Cell Biol 2006 ; 84 : 243-9.
[49] Vallet AE, Verschueren A, Petiot P, et al. Neurological features in adult Triple-A (Allgrove) syndrome. J Neurol 2012 ; 259 : 39-46.
[50] Norcliffe-Kaufmann L, Kaufmann H. Familial dysautonomia (Riley-Day syndrome) : When baroreceptor feedback fails. Auton Neurosci 2012 ; 172 : 26-30.
[51] Heath P. Ocular lymphomas. Trans Am Ophthalmol Soc 1948 ; 46 : 385-98.
[52] Itescu S, Brancato LJ, Buxbaum J, et al. A diffuse infiltrative CD8 lymphocytosis syndrome in human immunodeficiency virus (HIV) infection : a host immune response associated with HLA-DR5. Ann Intern Med 1990 ; 112 : 3-10.
[53] Scherz W, Dohlman CH. Is the lacrimal gland dispensable ? Keratoconjunctivitis sicca after lacrimal gland removal. Arch Ophthalmol 1975 ; 93 : 81-3.
[54] Whitwell J. Denervation of the lacrimal gland. Br J Ophthalmol 1958, 42 : 518-525.
[55] Maitchouk DY, Beuerman RW, Ohta T, et al. Tear production after unilateral removal of the main lacrimal gland in squirrel monkeys. Arch Ophthalmol 2000 ; 118 : 246-52.
[56] Wright HR, Turner A, Taylor HR. Trachoma. Lancet 2008 ; 371 : 1945-54.
[57] Srikumaran D, Akpek EK. Mucous membrane pemphigoid : recent advances. Curr Opin Ophthalmol 2012 ; 23 : 523-7.
[58] Sokumbi O, Wetter DA. Clinical features, diagnosis, and treatment of erythema multiforme : a review for the practicing dermatologist. Int J Dermatol 2012 ; 51 : 889-902.
[59] Fraunfelder FT, Sciubba JJ, Mathers WD. The role of medications in causing dry eye. J Ophthalmol 2012 ; 2012 : 285851.
[60] Nguyen DH, Beuerman RW, Toshida H. The effects of sensory and parasympathetic denervation on the kinases and initiation factors controlling protein synthesis in the lacrimal gland. Adv Exp Med Biol 2002 ; 506 : 65-70.
[61] Jordan A, Baum J. Basic tear flow. Does it exist ? Ophthalmology 1980 ; 87 : 920.
[62] Gilbard JP, Gray KL, Rossi SR. A proposed mechanism for increased tear-film osmolarity in contact lens wearers. Am J Ophthalmology 1986 ; 102 : 505-7.
[63] Kaiserman I, Kaiserman N, Nakar S, Vinker S. Dry eye in diabetic patients. Am J Ophthalmol 2005 ; 139 : 498-503.
[64] Semeraro F, Forbice E, Romano V, et al. Neurotrophic Keratitis. Ophthalmologica 2013. [Epub ahead of print].
[65] Lambiase A, Sacchetti M, Mastropasqua A, Bonini S. Corneal changes in neurosurgically induced neurotrophic keratitis. JAMA Ophthalmol 2013 ; 131 : 1547-53.
[66] Ang RT, Dartt DA, Tsubota K. Dry eye after refractive surgery. Curr Opin Ophthalmol 2001 ; 12 : 318-22.
[67] Murakami Y, Manche EE. Prospective, randomized comparison of self-reported postoperative dry eye and visual fluctuation in LASIK and photorefractive keratectomy. Ophthalmology 2012 ; 119 : 2220-4.
[68] Baum JL, Adler ME. Pheochromocytoma, medullary thyroid carcinoma, multiple mucosal neuroma. A variant of the syndrome. Arch Ophthalmol 1972 ; 87 : 74-84.
[69] Terry MA. Dry eye in the elderly. Drugs Aging 2001 ; 18 : 101-7.
[70] Nelson JD, Shimazaki J, Benitez-del-Castillo JM, et al. The international workshop on meibomian gland dysfunction : report of the definition and classification subcommittee. Invest Ophthalmol Vis Sci 2011 ; 52 : 1930-7.
[71] Foulks GN, Nichols KK, Bron AJ, et al. Improving awareness, identification, and management of meibomian gland dysfunction. Ophthalmology 2012 ; 119 : S1-12.
[72] Schaumberg DA, Nichols JJ, Papas EB, et al. The International Workshop on Meibomian Gland Dysfunction : report of the subcommittee on the epidemiology of, and associated risk factors for, MGD. Invest Ophthalmol Vis Sci 2011 ; 52 : 1994-2005.
[73] Knop E, Knop N, Millar T, et al. The International Workshop on Meibomian Gland Dysfunction : report of the subcommittee on anatomy, physiology, and pathophysiology of the meibomian gland. Invest Ophthalmol Vis Sci 2011 ; 52 : 1938-78.
[74] Mathers WD, Shields WJ, Sachdev MS, et al. Meibomian gland morphology and tear osmolarity changes with Accutane therapy. Cornea 1991 ; 10 : 286-90.
[75] Tsubota K, Nakamori K. Effects of ocular surface area and blink rate on tear dynamics. Arch Ophthalmol 1995 ; 113 : 155-8.
[76] Yokoi N, Komuro A, Nishii M, et al. Clinical impact of conjunctivochalasis on the ocular surface. Cornea 2005 ; 24 : S24-31.
[77] Mangubat L, Luague S. Normal measurements of the palpebral fissure and the interpalpebral distance among Filipinos. Philipp J Surg Surg Spec 1966 ; 21 : 304-6.
[78] Abelson MB, Ousler GW 3rd, Nally LA, et al. Alternative reference values for tear film break up time in normal and dry eye populations. Adv Exp Med Biol 2002 ; 506 : 121-5.
[79] Biousse V, Skibell BC, Watts RL, et al. Ophthalmologic features of Parkinson’s disease. Neurology 2004 ; 62 : 177-80.
[80] Reddy VC, Patel SV, Hodge DO, Leavitt JA. Corneal sensitivity, blink rate, and corneal nerve density in progressive supranuclear palsy and Parkinson disease. Cornea 2013 ; 32 : 631-5.
[81] Nakamori K, Odawara M, Nakajima T, et al. Blinking is controlled primarily by ocular surface conditions. Am J Ophthalmol 1997 ; 124 : 24-30.
[82] Himebaugh NL, Begley CG, Bradley A, Wilkinson JA. Blinking and tear break-up during four visual tasks. Optom Vis Sci 2009 ; 86 : E106-14.
[83] Hori Y, Spurr-Michaud S, Russo CL, et al. Differential regulation of membrane-associated mucins in the human ocular surface epithelium. Invest Ophthalmol Vis Sci 2004 ; 45 : 114-22.
[84] Sommer A, Emran N. Tear production in a vitamin A responsive xerophthalmia. Am J Ophthalmol 1982 ; 93 : 84-7.
[85] Rocha EM, Mantelli F, Nominato LF, Bonini S. Hormones and dry eye syndrome : an update on what we do and don’t know. Curr Opin Ophthalmol 2013 ; 24 : 348-55.
[86] Krenzer KL, Dana MR, Ullman MD, et al. Effect of androgen deficiency on the human meibomian gland and ocular surface. J Clin Endocrinol Metab 2000 ; 85 : 4874-82.
[87] Smith JA, Vitale S, Reed GF, et al. Dry eye signs and symptoms in women with premature ovarian failure. Arch Ophthalmol 2004 ; 122 : 151-6.
[88] Sullivan BD, Evans JE, Krenzer KL, et al. Impact of antiandrogen treatment on the fatty acid profile of neutral lipids in human meibomian gland secretions. J Clin Endocr Metab 2000 ; 85 : 4866-73.
[89] Sullivan DA, Jensen RV, Suzuki T, Richards SM. Do sex steroids exert sex-specific and/or opposite effects on gene expression in lacrimal and meibomian glands ? Mol Vis 2009 ; 15 : 1553-1572.
[90] Ismailova DS, Fedorov AA, Grusha YO. Ocular surface changes in thyroid eye disease. Orbit 2013 ; 32 : 87-90.
[91] Kari O, Saari KM. Diagnostics and new developments in the treatment of ocular allergies. Curr Allergy Asthma Rep 2012 ; 12 : 232-9.
[92] Hom MM, Nguyen AL, Bielory L. Allergic conjunctivitis and dry eye syndrome. Ann Allergy Asthma Immunol 2012 ; 108 : 163-6.
[93] Bilkhu PS, Wolffsohn JS, Naroo SA. A review of non-pharmacological and pharmacological management of seasonal and perennial allergic conjunctivitis. Cont Lens Anterior Eye 2012 ; 35 : 9-16.
[94] Baudouin C. Conditions bordering on allergy. J Fr Ophtalmol 2007 ; 30 : 306-13.
[95] Stern ME, Siemasko KF, Gao J, et al. Evaluation of ocular surface inflammation in the presence of dry eye and allergic conjunctival disease. Ocul Surf 2005 ; 3 : S161-4.
[96] Baudouin C, Labbé A, Liang H, et al. Preservatives in eyedrops : the good, the bad and the ugly. Prog Retin Eye Res 2010 ; 29 : 312-34.
[97] Michée S, Brignole-Baudouin F, Riancho L, et al. Effects of benzalkonium chloride on THP-1 differentiated macrophages in vitro. PLoS One 2013 ; 8 : e72459.
[98] De Saint Jean M, Brignole F, Bringuier AF, et al. Effects of benzalkonium chloride on growth and survival of Chang conjunctival cells. Invest Ophthalmol Vis Sci 1999 ; 40 : 619-30.
[99] Pisella PJ, Debbasch C, Hamard P, et al. Conjunctival proinflammatory and proapoptotic effects of latanoprost and preserved and unpreserved timolol : an ex vivo and in vitro study. Invest Ophthalmol Vis Sci 2004 ; 45 : 1360-8.
[100] Chen W, Zhang Z, Hu J, et al. Changes in rabbit corneal innervation induced by the topical application of benzalkonium chloride. Cornea 2013 ; 32 : 1599-606.
[101] Pharmakakis NM, Katsimpris JM, Melachrinou MP, Koliopoulos JX. Corneal complications following abuse of topical anesthetics. Eur J Ophthalmol 2002 ; 12 : 373-8.
[102] Nichols JJ, Sinnott LT. Tear film, contact lens, and patient-related factors associated with contact lens-related dry eye. Invest Ophthalmol Vis Sci 2006 ; 47 : 1319-28.
[103] Pisella PJ, Malet F, Lejeune S, et al. Ocular surface changes induced by contact lens wear. Cornea 2001 ; 20 : 820-5.
[104] Rohit A, Willcox M, Stapleton F. Tear lipid layer and contact lens comfort : a review. Eye Contact Lens 2013 ; 39 : 247-53.
[105] Thai LC, Tomlinson A, Doane MG. Effect of refractive contact lens materials on tear physiology. Optom Vis Sci 2004 ; 81 : 194-204.
[106] Sun YC, Hsiao CH, Chen WL, et al. Conjunctival resection combined with tenon layer excision and the involvement of mast cells in superior limbic keratoconjunctivitis. Am J Ophthalmol 2008 ; 145 : 445-52.
[107] Kymionis GD, Klados NE, Kontadakis GA, Mikropoulos DG. Treatment of superior limbic keratoconjunctivitis with topical tacrolimus 0.03 % ointment. Cornea 2013 ; 32 : 1499-501.
[108] Kim JH, Kim JH, Nam WH, et al. Oral alcohol administration disturbs tear film and ocular surface. Ophthalmology 2012 ; 119 : 965-71.
[109] Sollanek KJ, Kenefick RW, Walsh NP, et al. Assessment of thermal dehydration using the human eye : what is the potential ? J. Thermal Biol 2012 ; 37 : 111-7.
M. El Hamdaoui, A. Denoyer, C. Baudouin
L’interrogatoire est un temps fort de la prise en charge du patient souffrant de sécheresse oculaire. La multitude d’étiologies impose une rigueur dans l’analyse de l’histoire du malade et de son examen. L’examen clinique doit être méticuleux, systématique et commencer par le test le moins invasif. L’absence de corrélation entre les symptômes et l’examen clinique est souvent déroutante : c’est un faisceau d’arguments qui permettra d’évaluer au mieux la sévérité de l’atteinte, guidant ainsi la stratégie thérapeutique.
Selon le sous-comité de définition et classification internationale du Dry Eye WorkShop (DEWS) [1] de 2007, la sécheresse oculaire est une maladie multifactorielle du film lacrymal et de la surface oculaire qui entraîne des symptômes d’inconfort, une perturbation visuelle et une instabilité du film lacrymal avec des lésions potentielles de la surface oculaire. Elle est accompagnée d’une augmentation de l’osmolarité du film lacrymal et d’une inflammation de la surface oculaire. Cette pathologie occupe une place nosologique importante en pathologie ophtalmologique, en raison de son extrême fréquence, de son association avec le syndrome de Gougerot-Sjögren et de son incidence croissante avec l’âge. Son retentissement psychologique et sur la vie quotidienne en fait une pathologie extrêmement mal vécue par les patients. Dans ce chapitre, nous allons tenter de comprendre comment une analyse clinique bien menée peut nous permettre d’optimiser la prise en charge du patient qui souffre de sécheresse oculaire et qui souvent a consulté nombre de nos confrères. Après un interrogatoire bien conduit, l’examen physique sera systématique et orienté.
L’interrogatoire est un des principaux temps de la prise en charge du patient qui souffre de sécheresse oculaire. Il nous permettra très souvent d’orienter l’examen clinique vers une étiologie particulière et, par conséquent, une thérapeutique adaptée. Il doit s’efforcer d’être le plus complet possible afin de ne pas passer à côté d’un élément important de l’histoire du malade. Telle une enquête criminelle, les indices seront recueillis avec acuité afin d’en déterminer le(s) coupable(s). Loin de faire perdre du temps à écouter des patients souvent prolixes pour décrire leur souffrance et leurs échecs précédents, un interrogatoire bien conduit peut aider à aller plus vite vers une prise en charge adaptée et efficace.
L’âge du patient est un élément important car cette pathologie est plus fréquente chez les personnes âgées [1, 2]. Si un sujet jeune présente des signes de sécheresse oculaire, il faut alors rechercher des étiologies plus spécifiques non liées au simple vieillissement oculaire [3]. De même, une sécheresse chez un homme oriente vers des étiologies particulières car le plus souvent c’est le sexe féminin qui est concerné [4, 5]. La consommation de toxiques (tabac, alcool, drogues) sera recherchée et quantifiée. De même, l’origine ethnique sera demandée au patient. En effet, la prévalence de la sécheresse varie beaucoup d’un pays voire d’un continent à l’autre (l’Asie est par exemple très touchée par cette pathologie) [6].
Ainsi est-il essentiel de recueillir les antécédents personnels et familiaux du patient en recherchant ceux qui sont en rapport avec les étiologies de la sécheresse oculaire. On recherchera les antécédents personnels de pathologies auto-immunes. En effet, celles-ci peuvent très souvent s’associer à une sécheresse oculaire [7]. Le syndrome de Gougerot-Sjögren est une cause majeure de sécheresse, oculaire et globale [8, 9]. Les pathologies articulaires [10] (polyarthrite rhumatoïde par exemple), cutanées (rosacée [11, 12], sclérodermie [13], ichtyose [14, 15], dermite séborrhéique, acné [16], etc.), du tissu conjonctif [17], endocrinologiques (dysthyroïdies auto-immunes [18-20], déficit androgénique [21-25], diabète [26, 27]), nutritionnelles (déficit en vitamine A [28, 29], déséquilibres nutritionnels concernant les acides gras alimentaires oméga-6 et oméga-3 [30]), infectieuses (hépatite C [31], infection par le VIH [32, 33]), neurologiques (neurotrophiques [34]), cancérologiques [35, 36] et digestives seront identifiées. À noter que les pathologies psychiatriques éventuelles doivent être recherchées car elles peuvent, ainsi que leurs traitements, majorer les signes de sécheresse oculaire. De plus, les patients occultent souvent cette part de leur histoire tant ils pensent qu’il n’y a pas de lien avec le motif de leur consultation. Ainsi, les traitements systémiques en cours et passés dont ont bénéficié les patients sont des éléments à répertorier.
On citera les antihistaminiques, les bêta-bloquants, les dérivés de la vitamine A [37, 38] (isotrétinoïdes), les traitements hormonaux substitutifs de la ménopause [39] et les psychotropes dont on a précédemment parlé. Dans le domaine cancérologique, les traitements par chimiothérapie, radiothérapie et greffe de moelle osseuse [35, 36] seront notés. Concernant les traitements topiques ophtalmologiques (en cure d’une hypertonie oculaire par exemple), ceux contenant des conservateurs [40-42] sont pourvoyeurs de sécheresse oculaire et devront être recherchés.
Les antécédents personnels ophtalmologiques sont essentiels. Il faut ainsi rechercher la réalisation, même ancienne, d’un acte chirurgical (cataracte [43-45], chirurgie réfractive). En effet, la chirurgie de la cataracte, le plus souvent réalisée chez une personne d’âge avancé, est très pourvoyeuse de sécheresse oculaire, ou plutôt constitue un facteur de décompensation d’une sécheresse préexistante, jusqu’alors latente. Quant à la chirurgie réfractive, en particulier la technique LASIK [46, 47], elle est responsable de sécheresses oculaires parfois très invalidantes. Il est classique qu’une sécheresse apparaisse transitoirement dans les 6 mois suivant la chirurgie, mais sa persistance au-delà de 6 mois n’est pas rare et constitue actuellement la principale cause de mécontentement des patients bénéficiant d’une chirurgie pourtant sûre et efficace.
Nous enquêterons également sur la notion de brûlures oculaires chimiques ou physiques qui peuvent se compliquer d’une altération importante de la surface oculaire voire de l’unité fonctionnelle lacrymale et ainsi être responsables d’une sécheresse plus ou moins sévère.
Un point important est le port de lentilles de contact [48-52] au sujet duquel il faudra identifier le type de lentille, la durée du port, et surtout la tolérance. Beaucoup de patients ont dû ainsi arrêter le port de leurs lentilles à cause de l’apparition progressive d’une sécheresse, mais dans la mesure où ils ne les portent plus, ils n’identifient plus le lien avec les lentilles.
De même, des antécédents allergiques ophtalmologiques et généraux seront renseignés (rhinite allergique, conjonctivite saisonnière ou perannuelle), car même s’ils remontent à l’enfance ou à l’adolescence et se sont amendés par la suite, ils peuvent avoir une réelle influence sur une sécheresse ultérieure.
L’histoire de la maladie doit être établie. La date de début des signes fonctionnels peut être floue, le patient se plaignant depuis longtemps de signes variés, inconstants, mal caractérisés ; ou, au contraire, clairement définie, le patient identifiant clairement un facteur ayant déclenché les symptômes (chirurgie oculaire, conjonctivite, collyre contenant un conservateur, etc.).
Les signes fonctionnels [53, 54] les plus souvent retrouvés dans cette pathologie sont la sensation d’œil sec, la sensation de corps étranger ou de grain de sable, les picotements, les brûlures oculaires, et même le prurit. De plus, l’on peut être face à des patients qui se plaignent de sécrétions fibreuses gênantes, d’éblouissement passager, de rougeur oculaire, d’épiphora ou de dépôts croûteux sur la base des cils. Il faut se rappeler qu’aucun symptôme n’est spécifique. Ces symptômes peuvent être aggravés pas certains facteurs.
Il est important de rechercher auprès du patient s’il existe une périodicité des signes fonctionnels. Ceux-ci peuvent, en effet, être plus marqués au cours de certaines périodes de la journée ou de l’année. Très souvent, les signes sont plus invalidants en fin de journée et pendant les mois secs de l’année. La périodicité avec le rythme du travail est également à vérifier et doit faire rechercher un ou des facteurs favorisants. Certaines patientes identifient des liens avec le cycle menstruel, ce qui peut faire rechercher des facteurs hormonaux ou liés à la contraception orale. La corrélation des symptômes avec les calendriers polliniques est aussi un élément très important car l’existence d’une allergie oculaire peut donner les mêmes signes que la sécheresse (diagnostic différentiel), mais elle peut également en aggraver les manifestations.
Des facteurs déclenchant l’apparition des signes de sécheresse peuvent être identifiés par les patients. Les facteurs locaux comme une chirurgie oculaire, une conjonctivite infectieuse ou allergique, un traumatisme oculaire, un corps étranger ou la prise de collyres comprenant un ou plusieurs conservateurs sont le plus souvent identifiés lorsqu’un facteur déclenchant est retrouvé. Les facteurs généraux comme les prises médicamenteuses ou les troubles hormonaux peuvent être mis en évidence à l’interrogatoire.
Certains patients peuvent clairement identifier des facteurs d’aggravation des symptômes ; cela apporte une aide importante dans la prise en charge du patient, l’éviction de ces facteurs pouvant être un élément thérapeutique non négligeable. Les facteurs environnementaux sont les plus incriminés (fumée de tabac, vent, climatisation, soleil ou forte luminosité, etc.). Les mêmes facteurs ayant déclenché les symptômes peuvent aggraver une sécheresse oculaire déjà manifeste. À l’inverse, certains patients peuvent mettre en évidence des éléments qui vont atténuer leur symptomatologie. Par exemple, un voyage en zone humide peut soulager les patients.
Il faut, à l’interrogatoire, rechercher des signes de sécheresse extraoculaire. La sécheresse buccale [55] est en particulier un élément important compte tenu de sa forte association avec la sécheresse oculaire dans le syndrome de Gougerot-Sjögren. La sécheresse des autres muqueuses chez la femme (notamment vaginale) doit être identifiée ; en effet, son existence est évocatrice d’un syndrome de Gougerot-Sjögren mais aussi de troubles hormonaux (ménopause, autres dysfonctionnements hormonaux) [39].
Il est important de recueillir auprès du patient le listing le plus complet possible des différents traitements dont il a pu bénéficier, ainsi que leurs effets, positifs, mitigés, ou négatifs, tant en termes de manque d’efficacité que d’effets secondaires, voire d’intolérance totale et rédhibitoire. Il faut répertorier la date de début de prise des traitements ainsi que leur fin. L’efficacité sur les signes fonctionnels et la tolérance des différents traitements seront également soigneusement évaluées et notées, de manière à éviter certains traitements, ou à identifier des facteurs communs, comme les conservateurs ou des principes actifs allergisants. On rencontre souvent des patients qui ont essayé de multiples traitements, mais il faut s’interroger sur la cause d’une telle multiplication de ces traitements et de leur arrêt. Les traitements correspondent le plus souvent à des larmes artificielles ; il faut interroger les patients sur le nombre de gouttes instillées par jour permettant d’obtenir une efficacité satisfaisante. Concernant l’hygiène palpébrale, il est important de demander au patient comment celle-ci est pratiquée ; en effet, souvent, les patients ne réalisent pas bien les soins de paupières, ce qui conduit à une inefficacité sur les signes fonctionnels.
L’utilisation de collyres anti-inflammatoires est également à rechercher dans l’histoire thérapeutique du patient afin d’évaluer leur efficacité, leur tolérance (pression intraoculaire, cataracte, etc.), leur type et la durée de leur prise. Un point particulier est intéressant à évoquer : la prise de ciclosporine en collyre. Lorsqu’elle a été prescrite, il arrive fréquemment que les patients arrêtent rapidement ce traitement avant même la période théorique d’efficacité compte tenu d’une certaine mauvaise tolérance à l’instillation. Les traitements par cyclines pour traiter une rosacée doivent enfin être notés, car ils sont souvent utilisés pour des périodes trop courtes, ou trop espacées pour maintenir une efficacité suffisante.
L’évaluation du retentissement des symptômes sur la vie quotidienne est à réaliser systématiquement lors du bilan initial ainsi que pour le suivi du patient. Il existe de nombreuses échelles qui permettent d’y répondre. Les questionnaires sont utilisés en recherche clinique pour dépister les individus présentant un diagnostic de sécheresse oculaire, ainsi qu’en pratique clinique pour évaluer les effets des traitements ou le degré de sévérité de la maladie. Selon le DEWS de 2007, le sous-comité d’épidémiologie a procédé à l’évaluation des questionnaires déjà parus sur la sécheresse oculaire.
Ceux-ci ont été validés selon les critères suivants :
1. Le questionnaire a été utilisé dans des essais cliniques randomisés.
2. Le questionnaire a été testé ou utilisé dans des études épidémiologiques.
3. Le questionnaire a été soumis à des tests psychométriques.
4. Le questionnaire est disponible et utilisable sur des populations atteintes de sécheresse oculaire de type générique non spécifique.
5. Le questionnaire doit répondre aux critères 1 ou 2, 3 et 4.
Au final, 14 questionnaires ont été retenus, comme détaillé dans le tableau 3-9 (voir aussi le chapitre 2-I).
Tableau 3-9 Détail des questionnaires d’évaluation des symptômes, de la fonction visuelle et de la qualité de vie validés par le Dry Eye Workshop (DEWS) de 2007 pour le diagnostic, l’évaluation de la sévérité et de l’impact de la sécheresse oculaire.
Dans le domaine de la sécheresse oculaire, il existe un grand nombre de tests disponibles et il est nécessaire d’effectuer une sélection. Certains sont peu utilisés ou peu concluants, d’autres sont souvent chronophages et généralement non pris en charge par l’Assurance Maladie. De plus, les résultats sont parfois non ou peu reproductibles.
L’ordre dans l’utilisation des tests est important. Il faut commencer avec le test le moins invasif et évoluer vers le plus invasif [56]. Il est également important de procéder par étapes afin de limiter l’influence d’un test sur les résultats du test qui suit. Les tests aident souvent à confirmer le diagnostic, mais les signes et symptômes ne correspondent pas toujours en termes d’intensité. Il n’existe pas de gold standard du diagnostic de l’œil sec. Par conséquent, lorsque l’efficacité d’un test tel que le test de Schirmer ou la coloration à la fluorescéine ou au vert de lissamine est évaluée, la population examinée peut avoir été classée comme atteinte ou non atteinte sur la base de ces mêmes tests. De même, la performance de tout nouveau test peut être compromise si les participants souffrant de sécheresse oculaire ont été diagnostiqués à l’aide de critères non standardisés. Lorsque les études d’efficacité d’un test examinent la manière dont le test définit les individus atteints et non atteints sur la base d’échantillons à partir desquels ont été dérivés les seuils de diagnostic, les taux de sensibilité et de spécificité sont potentiellement plus élevés que s’il s’agissait d’échantillons indépendants. En outre, l’efficacité d’un test a tendance à varier d’une étude à une autre en raison de la nature multifactorielle de l’œil sec.
• Antécédents cliniques
• Questionnaire sur les symptômes
• Observation du visage, du clignement et des paupières
• Morphologie palpébrale et examen des glandes de Meibomius
• Examen à la lampe à fente de la conjonctive, du limbe et de la cornée
• Coloration de la surface oculaire à la fluorescéine (de préférence avec un filtre jaune)
• Break-up time (BUT) à la fluorescéine
• Expression des glandes de Meibomius
• Test de Schirmer I sans anesthésie ou avec anesthésie
D’autres tests peuvent être ajoutés (selon la disponibilité).
Le modèle « A sequence of tests », disponible sur le site Internet du DEWS, fournit des informations complémentaires.
L’examen des paupières est un point fondamental dans la prise en charge diagnostique de ce type de patient. La simple observation du visage et des paupières donne souvent de très importantes informations : couperose, blépharite antérieure ou postérieure, plus discrète mais souvent mieux visible à l’œil nu qu’à la lampe à fente, clignement, fente palpébrale, etc. On réalisera un examen statique et dynamique de la fonction palpébrale afin de détecter les causes mécaniques à la sécheresse oculaire ou les causes de l’aggravation de ses symptômes. L’examen statique (les yeux ouverts) permettra de rechercher un entropion, un ectropion, une laxité palpébrale inférieure, une exophtalmie (scleral show), une position anormale des cils (trichiasis, distichiasis) et tout autre anomalie de l’anatomie palpébrale. On évaluera la fréquence des clignements [57]. L’examen dynamique recherchera une lagophtalmie lors du clignement (voir vidéo 3-1), ainsi qu’un blépharospasme, que l’on retrouve souvent en cas de sécheresse sévère. La photophobie tend à induire une dystonie faciale, mais celle-ci s’autonomise parfois et entretient une souffrance chronique du fait des contractions orbiculaires incontrôlables.
La recherche d’un dysfonctionnement des glandes de Meibomius (DGM) est indispensable [58-61]. En effet, il s’agit d’un facteur clé pour identifier un déficit lipidique (fig. 3-20). L’étude des bords libres des paupières permet d’en analyser son épaississement, sa vascularité, la présence de télangiectasies (fig. 3-20a) ou d’autres lésions. L’étude des orifices permet, de plus, en vérifiant les glandes centrales de chaque paupière, de déterminer le nombre de glandes présentes et le nombre de glandes obstruées. On retrouve environ 30 glandes sur les paupières supérieures et 25 glandes sur les paupières inférieures. L’analyse est habituellement réalisée sur les dix glandes centrales.
L’étude de la sécrétion du meibum (fig. 3-20b) est également importante (vidéo 3-3). Il faut en déterminer le volume, la qualité (aspect clair, nuageux, granulaire, solide), l’expressibilité (pression minimale, légère, modérée, élevée) et le degré de perte de glandes de Meibomius (nombre de pertes dans les deux tiers centraux de la paupière inférieure) (fig. 3-20c). Dans ce contexte, on recherchera une rosacée cutanée (fig. 3-20d) [11, 12] par la présence de télangiectasies et de flushes sur les pommettes et le nez.

Fig. 3-20 Signes cliniques d’un dysfonctionnement meibomien.
a. Télangiectasies. b. Meibum épais après pression sur les glandes de Meibomius (testing meibomien). c. Aspect atrophique de glandes de Meibomius. d. Aspect typique de rosacée cutanée et oculaire.
Vidéo 3-3 Dysfonctionnement meibomien avec testing meibomien et film lacrymal épais, grumeleux, s’évaporant de manière inhomogène.
La recherche et la quantification d’une kératite ponctuée superficielle (ou dommage épithélial cornéen) fait partie des éléments clés d’évaluation de la sévérité de la sécheresse oculaire. Elle est réalisée, en pratique clinique, par l’instillation de fluorescéine. Il existe deux principaux scores qui permettent la quantification de la kératite.
Le score de Van Bijsterveld (fig. 3-21a) apprécie l’intensité du marquage des défects épithéliaux cornéen et conjonctival [62] : il considère chaque secteur (nasal, temporal et cornéen), pour attribuer à chacun un score de 0 à 3 et ainsi donner un score final sur 9. Les scores d’Oxford et du National Eye Institute (NEI) qui sont adaptés à la sécheresse oculaire (fig. 3-21b) [62] ont pour principe de coter l’atteinte de la surface oculaire dans sa globalité. Ainsi, l’on quantifie la sévérité de l’atteinte de la surface oculaire en 6 stades (grade 0 : 1 spot fluo-positif ou pas de prise de fluorescéine ; puis la prise de fluorescéine est croissante du grade 1 au grade 5) (fig. 3-22). Ces deux scores sont intéressants à déterminer lors du bilan initial mais aussi lors du suivi afin d’évaluer l’évolution de la sécheresse oculaire et de déterminer l’efficacité des thérapeutiques. Il est à noter qu’il est possible de les déterminer également à l’aide du vert de lissamine [63] et du Rose Bengale, presque plus utilisé désormais en raison de sa toxicité [64] (voir plus loin).
Lorsque la sécheresse oculaire est plus importante, on peut mettre en évidence des ulcérations plus étendues et profondes. La présence de filaments (fig. 3-23) (agglomérats de sécrétions lacrymales mucolipidiques à la surface de la cornée) est également importante à rechercher car elle témoigne d’une sévérité avancée et de certaines étiologies (syndrome de Gougerot-Sjögren dans le cadre d’une polyarthrite rhumatoïde par exemple). Notons enfin qu’un examen attentif de la cornée permettra d’identifier certaines étiologies spécifiques ou bien des pathologies cornéennes associées : des cicatrices de traumatismes antérieurs ou de chirurgie (LASIK), des épithéliopathies en vagues (fig. 3-24) traduisant des érosions anciennes, des reliefs pathologiques de la surface oculaire responsables d’un effet Dellen (fig. 3-25), ou encore certaines dystrophies antérieures comme celle de Cogan. En parallèle, l’examen du limbe recherchera des signes d’infiltration/inflammation (fig. 3-26), des néovaisseaux voire un début de conjonctivalisation de l’épithélium cornéen signant là une insuffisance limbique, la conjonctive pouvant elle aussi être examinée à l’aide de colorants.
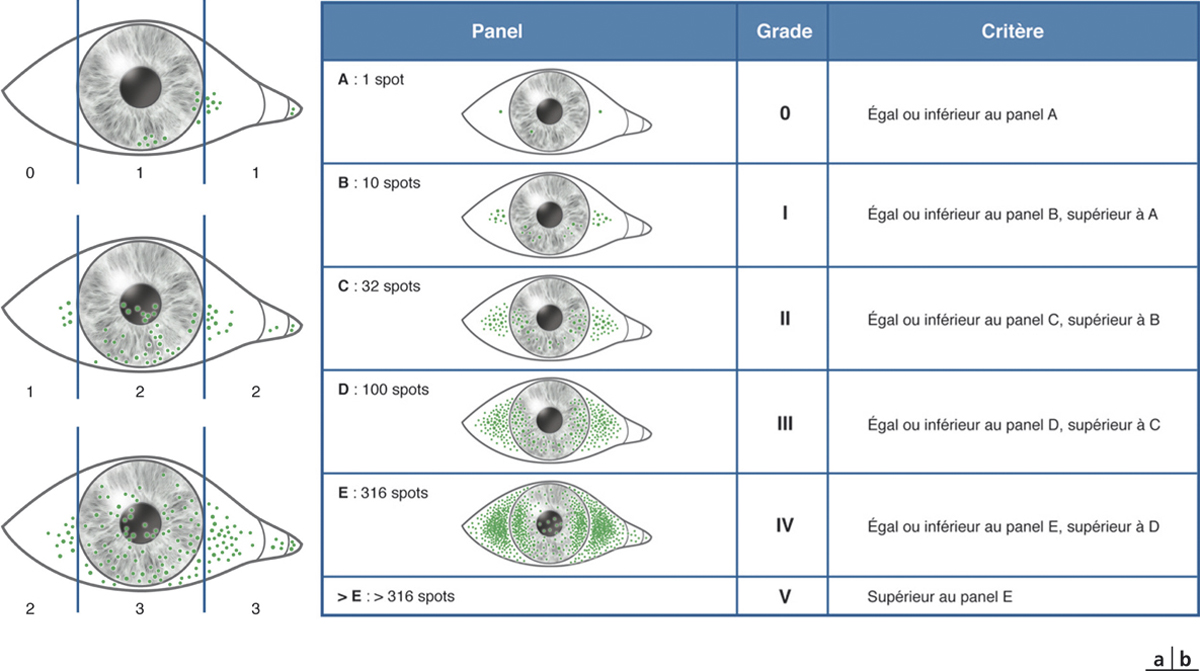
Fig. 3-21 Scores usuels d’évaluation clinique de l’atteinte de la surface oculaire au cours de la sécheresse.
a. Score de Van Bijsterveld. b. Score d’Oxford [62].
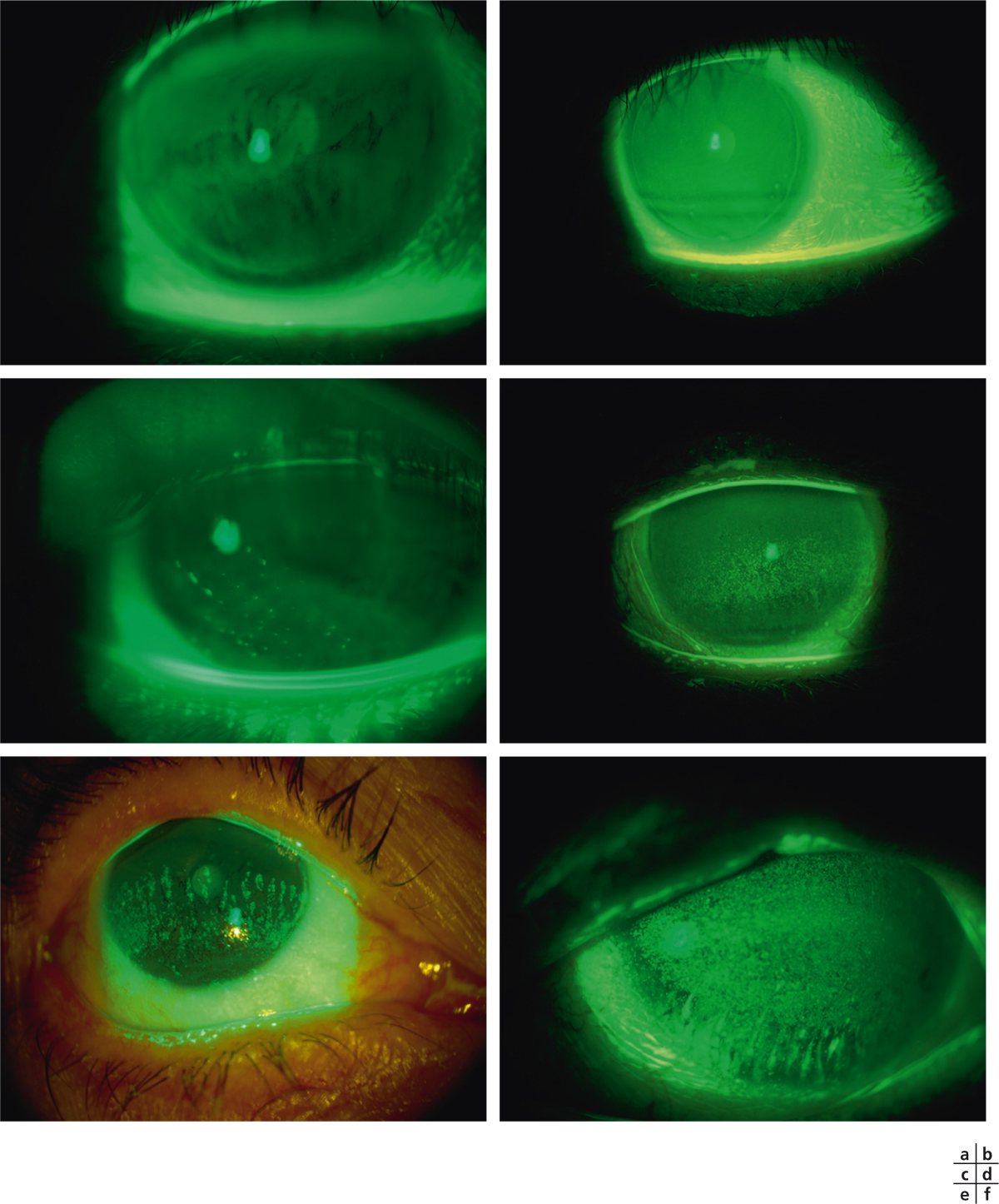
Fig. 3-22 Exemples cliniques de scores d’Oxford.
a. 0. b. 1. c. 2. d. 3. e. 4. f. 5.
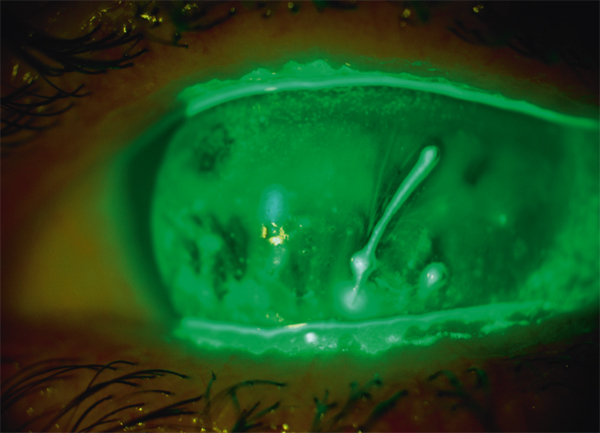
Fig. 3-23 Kératite filamenteuse dans un cas de syndrome de Gougerot-Sjögren.
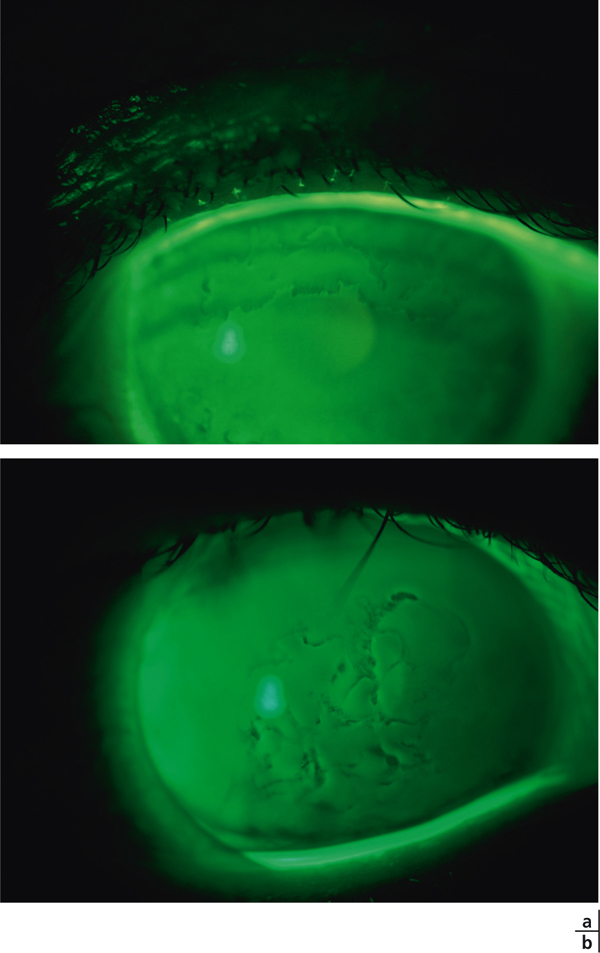
Fig. 3-24 a, b. Reliefs épithéliaux liés à d’anciennes kératites avec réépithélialisation irrégulière.
Le film lacrymal s’étale mal sur ces reliefs qui peuvent être cause d’une symptomatologie d’œil sec ou d’érosions récidivantes.
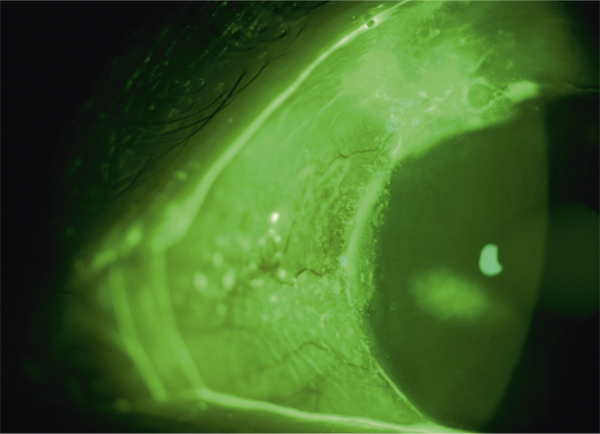
Fig. 3-25 Effet Dellen avec dessiccation d’une zone cornéenne sur laquelle le film lacrymal ne peut s’étaler en raison du relief adjacent, une bulle de filtration.
Noter aussi l’accumulation de fluorescéine entre deux plis de la bulle.
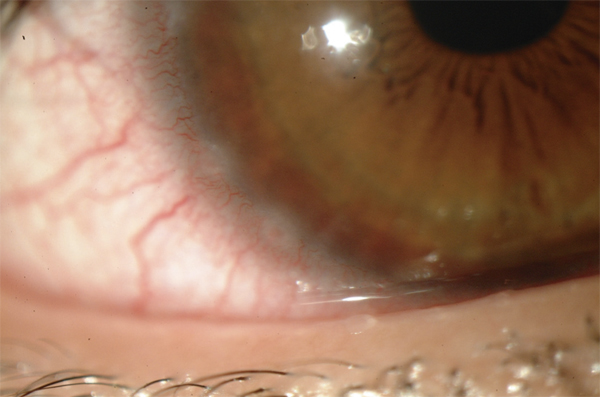
Fig. 3-26 Infiltrats limbiques dans une rosacée oculaire.
Comme nous l’avons vu précédemment, les scores de Van Bijsterveld et d’Oxford permettent de quantifier les défects épithéliaux cornéens mais aussi conjonctivaux. La coloration de la conjonctive à la fluorescéine est encore mieux analysée en utilisant un filtre jaune (fig. 3-27). Ainsi, la souffrance conjonctivale est aussi importante que la souffrance cornéenne, non pas pour l’évaluation du pronostic visuel mais pour l’étude de la sévérité de la sécheresse.
L’examen conjonctival recherchera aussi une hyperhémie et évaluera son étendue et sa sévérité. Le conjonctivochalasis [65] (fig. 3-28) est une maladie liée à l’âge causée par une conjonctive bulbaire trop lâche (vidéos 3-4 et 3-5). Elle est caractérisée par une distension et des plis de la conjonctive bulbaire qui s’accumulent par l’effet mécanique du clignement sur le bord de la paupière inférieure et les angles internes et externes de l’œil, conduisant à des anomalies de la surface oculaire et à une mauvaise répartition du film lacrymal à la surface de l’œil [66]. Les patients se plaignent généralement de symptômes tels que des larmoiements, des sensations de sécheresse et de corps étranger. Cette pathologie est importante à rechercher car son traitement (notamment chirurgical) permet de diminuer les symptômes invalidants.
De plus, l’étude de la conjonctive supérieure est également intéressante afin de rechercher une kératoconjonctivite limbique supérieure de Théodore [67] se manifestant fonctionnellement par les mêmes symptômes et cliniquement par une laxité exagérée de la conjonctive supérieure et une kératite ponctuée superficielle en regard (fig. 3-29). Elle est souvent associée à une laxité palpébrale et à une dysthyroïdie. Une hyperlaxité palpébrale majeure (floppy eyelid syndrome) s’associe volontiers à une sécheresse oculaire pour trois raisons mécaniques : un défaut d’étalement du film lacrymal, des frottements pathologiques entre paupières et surface, fréquemment associés à un conjonctivochalasis qui agresse la cornée périphérique, et un défaut de clairance des glandes de Meibomius (fig. 3-30). L’interrogatoire ainsi que l’examen clinique peuvent aussi permettre de dépister une maladie de Basedow associant fréquemment une exophtalmie et un scleral show avec asynergie oculopalpébrale (signe de Von Graefe) sur le plan ophtalmologique, mais aussi une hypertrophie lacrymale, un œdème du visage ou encore un goitre sur le plan général.
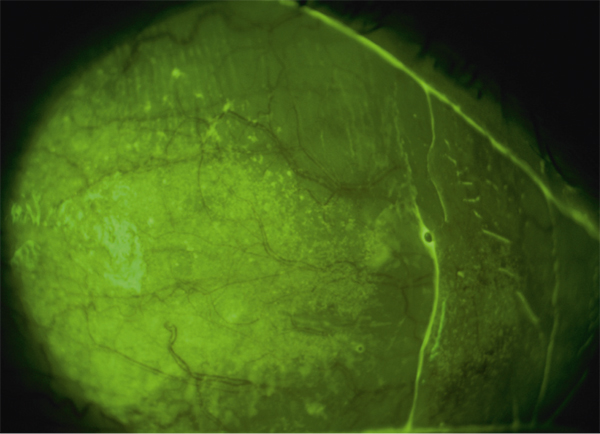
Fig. 3-27 Coloration conjonctivale par la fluorescéine (à travers un filtre jaune).
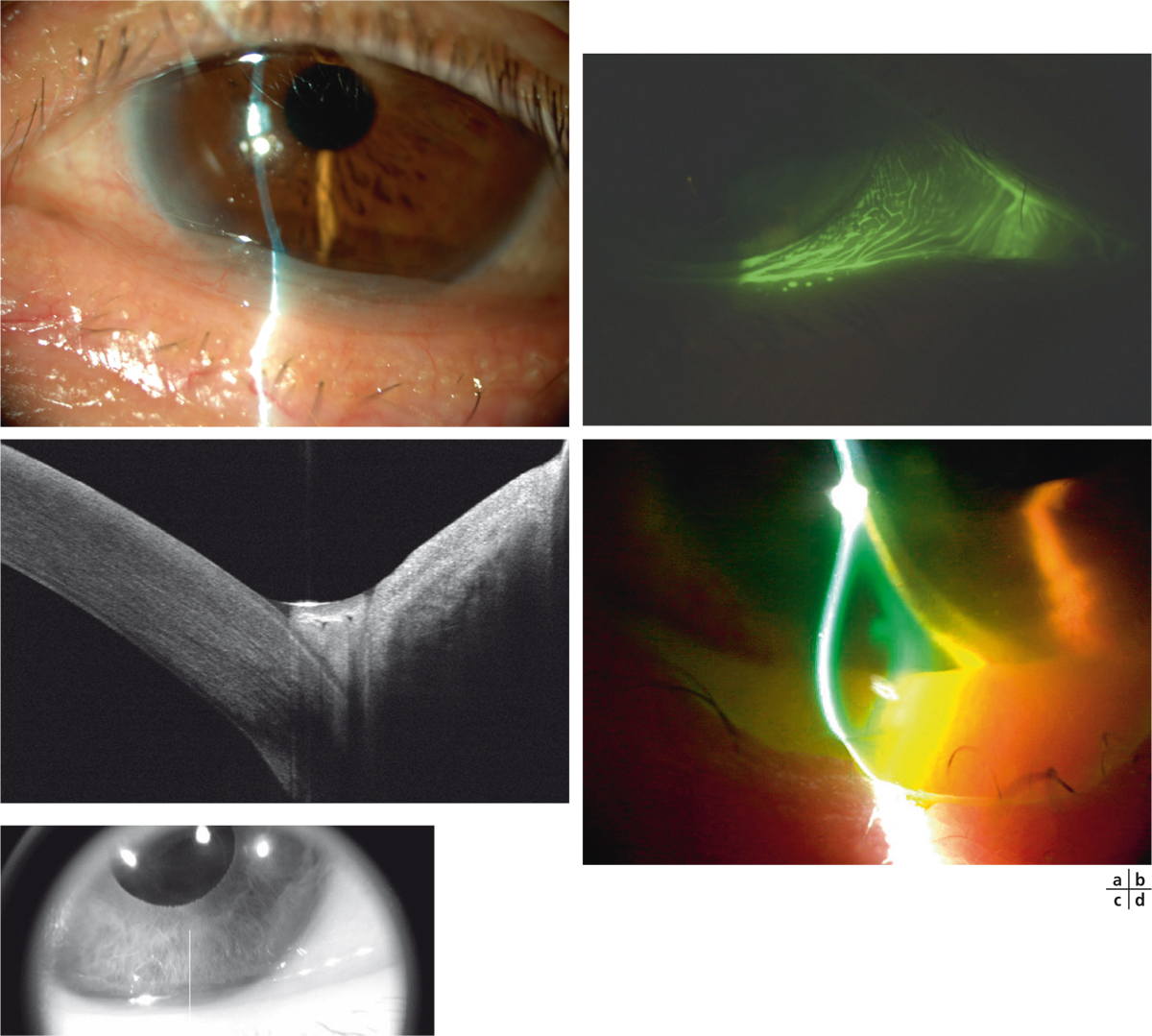
Fig. 3-28 a. Conjonctivochalasis. b. Plis conjonctivaux en fluorescéine. c. Image en OCT du conjonctivochalasis. d. Abondante rivière lacrymale, responsable d’un larmoiement par mauvaise dynamique lacrymale le long du conjonctivochalasis.
Vidéo 3-4 Conjonctivochalasis majeur séquellaire d’un chémosis ancien, d’origine allergique.
Vidéo 3-5 Conjonctivochalasis, responsable d’une mauvaise répartition du film lacrymal et d’un stress mécanique entre la conjonctive et les paupières.
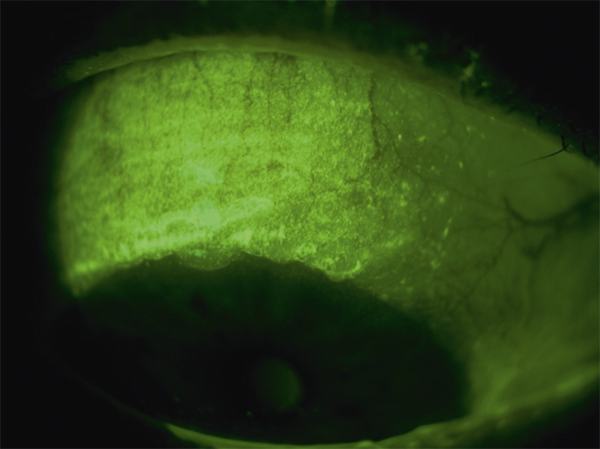
Fig. 3-29 Kératoconjonctivite limbique supérieure (dite de Théodore).
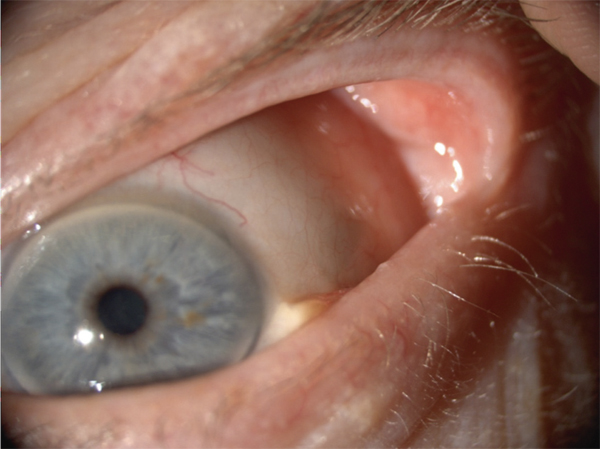
Fig. 3-30 Laxité palpébrale majeure (floppy eyelid syndrome), entraînant à la fois un mauvais étalement du film lacrymal, un frottement en regard de la conjonctive supérieure et une mauvaise vidange des glandes de Meibomius.
Il est tout d’abord nécessaire d’observer la répartition et la dynamique du film lacrymal de façon simple et qualitative. L’examen à la lampe à fente permet d’évaluer la rivière lacrymale et sa dynamique, la répartition (étalement et épaisseur) du film lacrymal parfois sujette à des défauts d’homogénéité (fig. 3-31 et (vidéo 3-6). Des dispositifs d’évaluation plus élaborés, comme l’interférométrie des larmes, permettent de mieux identifier la phase lipidique, donc d’approcher la composition biochimique de la sécheresse (fig. 3-32 et (vidéos 3-7 à 3-9). L’analyse de la dynamique lacrymale en relation avec les clignements palpébraux nécessite aussi un examen attentif : un clignement palpébral spontané incomplet peut être responsable d’un dessèchement mécanique de la cornée inférieure (fig. 3-33), ou bien une hyperlaxité palpébrale inférieure associée ou non à une sténose des points lacrymaux peut engendrer une augmentation de volume de la rivière lacrymale, un défaut de clairance des larmes, et donc une accumulation des médiateurs de l’inflammation, des allergènes, ou des toxiques à la surface oculaire.

Fig. 3-31 Aspect anormalement épais et irrégulier du film lacrymal visible à la lampe à fente.
Vidéo 3-6 Film lacrymal épais et inhomogène.
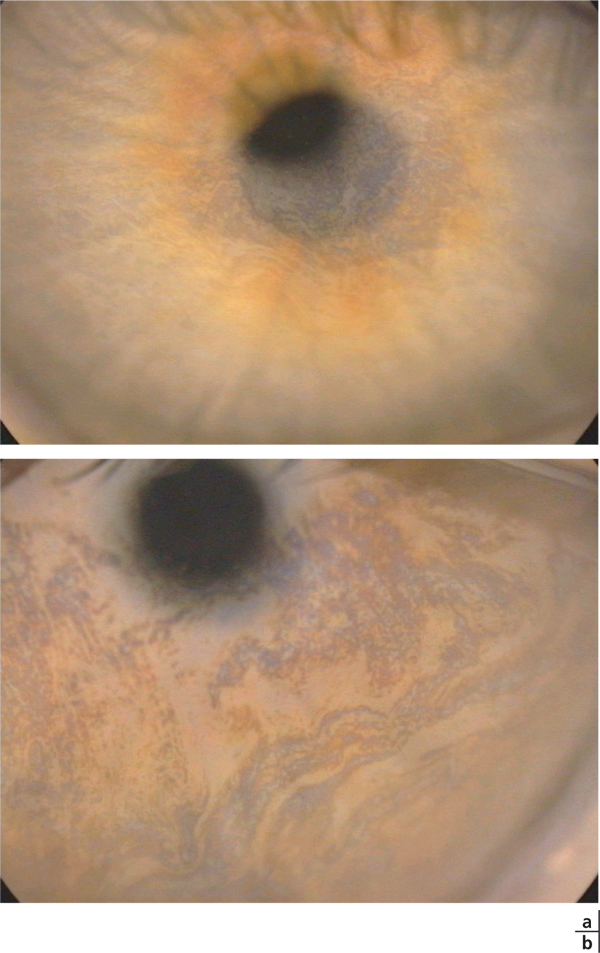
Fig. 3-32 a, b. Exemples d’aspect de la phase lipidique du film lacrymal par la technique d’éclairage en lumière froide (Tearscope®).
Noter les franges d’interférences en fonction de l’épaisseur de la couche lipidique.
Vidéo 3-7 Interférométrie du film lacrymal par technique du Tearscope®.
Vidéo 3-8 Même technique montrant un film moins homogène avec une réorganisation verticale du film lipidique
Vidéo 3-9 Aspect très inhomogène avec un film épais, gardant cependant une réorganisation horizontale.
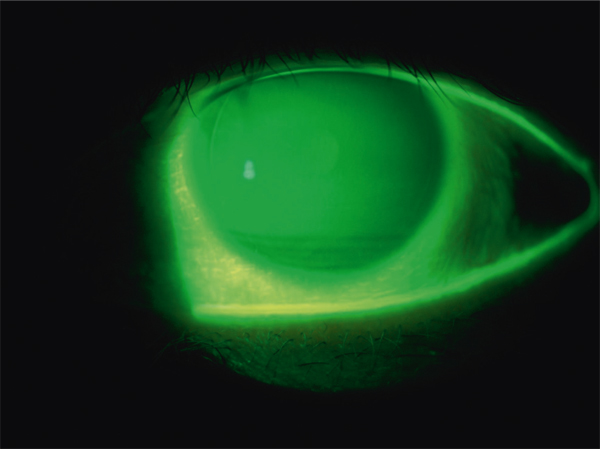
Fig. 3-33 Mauvaise répartition du film lacrymal lors des clignements avec probable malocclusion palpébrale intermittente et clignement abortif après un LASIK.
La mesure du temps de rupture du film lacrymal (ou break-up time [BUT]) (fig. 3-34) est un temps essentiel de l’examen d’une sécheresse oculaire [1]. Ce test, réalisé à la lampe à fente à grossissement ×10 en gardant l’intensité de l’illumination de fond constante après instillation de fluorescéine, permet d’évaluer la stabilité du film lacrymal précornéen. Le BUT est normalement supérieur à 12 secondes ; il est considéré comme anormal en dessous de 10 secondes [1]. Les valeurs inférieures à 5 secondes suggèrent fortement une sécheresse oculaire [1] par instabilité lacrymale.
Il s’agit d’un test standardisé. Après instillation de la fluorescéine à 0,5 ou 2 % sans conservateur sur la conjonctive bulbaire, le patient doit cligner naturellement plusieurs fois sans contracter, afin d’imprégner la fluorescéine sur l’ensemble de la surface oculaire de manière homogène. Le patient doit fixer devant lui sans cligner, tant qu’il ne ressent pas de souffrance l’obligeant à cligner. On peut alors enregistrer le temps entre le dernier clignement complet et l’apparition du premier développement micellaire. On retiendra la moyenne sur trois mesures. Si le patient ne peut pas s’empêcher de cligner au bout de quelques secondes, ce temps est considéré comme un témoin du BUT.
Il s’agit d’une technique dite invasive de mesure du BUT, même si elle n’est pas douloureuse, car elle introduit une grosse molécule dans le film lacrymal, et n’est donc pas totalement physiologique. Il existe en effet d’autres méthodes considérées non invasives (non invasive BUT, ou NI-BUT) qui n’utilisent pas l’instillation de fluorescéine. Elles sont réalisables à l’aide de kératographes ou de meibographes automatisés.

Fig. 3-34 Rupture anormalement précoce et généralisée du film lacrymal.
Facilement réalisable sans instrumentation particulière (fig. 3-35), le test de Schirmer évalue l’aspect quantitatif de la production lacrymale (phase aqueuse du film lacrymal) [62]. Une bandelette de papier filtre, dont les cinq premiers millimètres sont repliés sur eux-mêmes en forme de crochet, est placée au sein du cul-de-sac conjonctival inférieur à la jonction entre le tiers externe et les deux tiers internes [68]. Le patient garde les yeux ouverts et cligne normalement. Au bout de 5 minutes, le papier filtre est retiré. La longueur humidifiée par les larmes est quantifiée par les graduations du test. Le test est considéré comme normal si l’imprégnation est supérieure à 15 mm soit 3 graduations ; entre 5 et 15 mm, il est considéré comme douteux ; inférieur à 5 mm, il est pathologique et signe un syndrome sec avéré, voire sévère [69, 70]. Il s’agit d’un test clé pour identifier un déficit aqueux. Il existe deux types de tests de Schirmer.
-
Le test de Schirmer I mesure la sécrétion lacrymale de base comme décrit ci-dessus. Ce test peut être réalisé avant ou après instillation de collyre anesthésiant (dans ce cas, les valeurs sont plus faibles).
-
Le test de Schirmer II mesure la sécrétion lacrymale après stimulation de la muqueuse nasale par un coton. Peu utilisé, il teste surtout la capacité de l’œil de garder une sécrétion réflexe lorsque le test classique est très faible, ou même à 0.
Le test du fil au rouge phénol [70] (fig. 3-36) est une autre technique dérivée du test de Schirmer utilisant un fil de coton imprégné de rouge phénol. Le fil est inséré dans l’œil pendant 15 secondes, et sa coloration passe du jaune au rouge dans la partie humidifiée par les larmes. Une imprégnation inférieure à 10 mm indique une sécheresse oculaire avérée [71]. Entre 10 et 20 mm, cela indique une sécheresse oculaire non significative [71]. Ce test est plus rapide que celui de Schirmer [71], offre un meilleur confort aux patients et moins de réflexes de larmoiement. Cependant, ses résultats face au test de Schirmer ne sont pas toujours concordants : certains auteurs mettent en évidence des résultats très proches, tandis que d’autres prouvent l’inverse. Ce test ne doit pas remplacer le test de Schirmer mais doit en être complémentaire afin de mettre en évidence le déficit aqueux.
Fig. 3-35 Réalisation pratique d’un test de Schirmer.
Fig. 3-36 Réalisation d’un test au rouge phénol.
Le rose Bengale (1 %) [64] est un colorant qui a une affinité pour les cellules épithéliales mortes ou dévitalisées. Il permet de mettre en évidence de façon très nette les zones dévitalisées de l’épithélium conjonctival ou cornéen, caractéristiques du syndrome sec. Relativement douloureux, il n’est presque plus utilisé et a été remplacé par le vert de lissamine, même si la visualisation de la coloration est souvent plus ténue et donc plus difficile. Le vert de lissamine [63] a pour particularité par rapport au rose Bengale de ne pas induire d’irritation oculaire. Il en a les mêmes qualités dans l’évaluation clinique de la sécheresse oculaire. Ces deux tests sont en général évalués en utilisant le score de Van Bijsterveld déjà décrit (fig. 3-37).

Fig. 3-37 Photographie d’une coloration au vert de lissamine.
Au total, nous avons vu comment le syndrome sec est une pathologie de surface oculaire extrêmement fréquente et contraignante pour les patients qui en souffrent. Elle représente un motif fréquent de consultation et conduit parfois à des errances diagnostiques et thérapeutiques graves. Il est donc très important de savoir dès la première consultation poser le bon diagnostic et d’avoir recours aux examens d’exploration les plus adaptés afin de caractériser au mieux la sévérité, le type et le retentissement de cette pathologie sur la vie quotidienne des patients. Une certaine approche psychologique est également fondamentale pour le bon déroulement de la consultation, l’acceptation de la maladie et la réussite des examens pratiqués ainsi que du (des) traitement(s) prescrit(s).
[1] The definition and classification of dry eye disease : report of the Definition and Classification Subcommittee of the International Dry Eye WorkShop (2007). Ocul Surf 2007 ; 5 : 75-92.
[2] Yazdani C, McLaughlin T, Smeeding JE, Walt J. Prevalence of treated dry eye disease in a managed care population. Clin Ther 2001 ; 23 : 1672-82.
[3] Toda I, Asano-Kato N, Komai-Hori Y, Tsubota K. Dry eye after laser in situ keratomileusis. Am J Ophthalmol 2001 ; 132 : 1-7.
[4] Truong S, Cole N, Stapleton F, Golebiowski B. Sex hormones and the dry eye. Clin Exp Optom 2014 ; doi : 10.1111/cxo.12147.
[5] Schaumberg DA, Sullivan DA, Buring JE, Dana MR. Prevalence of dry eye syndrome among US women. Am J Ophthalmol 2003 ; 136 : 318-26.
[6] Lin PY, Tsai SY, Cheng CY, et al. Prevalence of dry eye among an elderly Chinese population in Taiwan : the Shihpai Eye Study. Ophthalmology 2003 ; 110 : 1096-101.
[7] Liu KC, Huynh K, Grubbs J JR, Davis RM. Autoimmunity in the pathogenesis and treatment of keratoconjunctivitis sicca. Curr Allergy Asthma Rep 2014 ; 14 : 403.
[8] Miyawaki S, Nishiyama S. Classification criteria for Sjogren’s syndrome sensitivity and specificity of criteria of the Japanese Ministry of Health and Welfare (1977) and criteria of European community (1993). Nihon Rinsho 1995 ; 53 : 2371-5.
[9] Bowman SJ, Booth DA, Platts RG, et al. UK Sjogren’s Interest Group. Validation of the Sicca Symptoms Inventory for clinical studies of Sjogren’s syndrome. J Rheumatol 2003 ; 30 : 1259-66.
[10] Aliko A, Ciancaglini R, Alushi A, Tafaj A. Sicca symptoms, and lacrimal and salivary flow in Albanian patients with rheumatoid arthritis. J Oral Pathol Med 2010 ; 39 : 651-6.
[11] Hoang-Xuan T. Ocular rosacea. J Fr Ophtalmol 1999 ; 22 : 467-74.
[12] Pisella PJ, Brignole F, Debbasch C, et al. Flow cytometric analysis of conjunctival epithelium in ocular rosacea and keratoconjunctivitis sicca. Ophthalmology 2000 ; 107 : 1841-9.
[13] Tailor R, Gupta A, Herrick A, Kwartz J. Ocular manifestations of scleroderma. Surv Ophthalmol 2009 ; 54 : 292-304.
[14] Turgut B, Aydemir O, Kaya M, et al. Spontaneous corneal perforation in a patient with lamellar ichthyosis and dry eye. Clin Ophthalmol 2009 ; 3 : 611-3.
[15] Jay B, Blach RK, Wells RS. Ocular manifestations of ichthyosis. Br J Ophthalmol 1968 ; 52 : 217-26.
[16] Ozdemir M, Ozdemir G, Sasmaz S, Arican O. Ocular surface disorders and tear function changes in nodulo-cystic acne. J Dermatol 2005 ; 32 : 174-8.
[17] Konradsen TR, Zetterström C. A descriptive study of ocular characteristics in Marfan syndrome. Acta Ophthalmol 2013 ; 91 : 751-5.
[18] Ismailova DS, Fedorov AA, Grusha YO. Ocular surface changes in thyroid eye disease. Orbit 2013 ; 32 : 87-90.
[19] Milic VD, Radunovic G, Boricic I, et al. High prevalence of autoimmune thyroid disease in subjects with sicca symptoms without Sjogren’s syndrome. Rheumatology (Oxford) 2013 ; 52 : 754-5.
[20] Gürdal C, Saraç O, Genç I, et al. Ocular surface and dry eye in Graves’ disease. Curr Eye Res 2011 ; 36 : 8-13.
[21] Sullivan BD, Evans JE, Cermak JM, et al. Complete androgen insensitivity syndrome : effect on human meibomian gland secretions. Arch Ophthalmol 2002 ; 120 : 1689-99.
[22] Cermak JM, Krenzer KL, Sullivan RM, et al. Is complete androgen insensitivity syndrome associated with alterations in the meibomian gland and ocular surface ? Cornea 2003 ; 22 : 516-21.
[23] Sullivan BD, Evans JE, Krenzer KL, et al. Impact of antiandrogen treatment on the fatty acid profile of neutral lipids in human meibomian gland secretions. J Clin Endocr Metab 2000 ; 85 : 4866-73.
[24] Krenzer KL, Dana MR, Ullman MD, et al. Effect of androgen deficiency on the human meibomian gland and ocular surface. J Clin Endocrinol Metab 2000 ; 85 : 4874-82.
[25] Sullivan DA. Androgen deficiency and dry eye syndromes. Arch Soc Esp Oftalmol 2004 ; 79 : 49-50.
[26] Fuerst N, Langelier N, Massaro-Giordano M, P et al. Tear osmolarity and dry eye symptoms in diabetics. Clin Ophthalmol 2014 ; 8 : 507-15.
[27] Kaiserman IN, Kaiserman N, Nakar S, Vinker S. Dry eye in diabetic patients. Am J Ophthalmol 2005 ; 139 : 498-503.
[28] Lee WB, Hamilton SM, Harris JP, Schwab IR. Ocular complications of hypovitaminosis a after bariatric surgery. Ophthalmology 2005 ; 112 : 1031-4.
[29] Sommer A. Vitamin A deficiency and the global response. Forum Nutr 2003 ; 56 : 33-5.
[30] Miljanović B, Trivedi KA, Dana MR, et al. Relation between dietary n-3 and n-6 fatty acids and clinically diagnosed dry eye syndrome in women. Am J Clin Nutr 2005 ; 82 : 887-93.
[31] Zegans ME, Anninger W, Chapman C, Gordon SR. Ocular manifestations of hepatitis C virus infection. Curr Opin Ophthalmol 2002 ; 13 : 423-7.
[32] Chronister CL. Review of external ocular disease associated with aids and HIV infection. Optom Vis Sci 1996 ; 73 : 225-30.
[33] Vitali C. Immunopathologic differences of Sjögren’s syndrome versus sicca syndrome in HCV and HIV infection. Arthritis Res Ther 2011 ; 13 : 233.
[34] Gilbard JP, Rossi SR. Tear film and ocular surface changes in a rabbit model of neurotrophic keratitis. Ophthalmology 1990 ; 97 : 308-12.
[35] Bray LC, Carey PJ, Proctor SJ, et al. Ocular complications of bone marrow transplantation. Br J Ophthalmol 1991 ; 75 : 611-4.
[36] Ogawa Y, Kuwana M. Dry eye as a major complication associated with chronic graft versus-host disease after hematopoietic stem cell transplantation. Cornea 2003 ; 22 : S19-27.
[37] Aragona P, Cannavo SP, Boragia F, Guarneri F. Utility of studying the ocular surface in patients with acne vulgaris treated with oral isotretinoin : a randomized controlled trial. Br J Dermatol 2005 ; 152 : 576-8.
[38] Ding J, Kam WR, Dieckow J, Sullivan DA. The influence of 13-cis retinoic acid on human meibomian gland epithelial cells. Invest Ophthalmol Vis Sci 2013 ; 54 : 4341-50.
[39] Schaumberg DA, Buring JE, Sullivan DA, Dana MR. Hormone replacement therapy and dry eye syndrome. JAMA 2001 ; 286 : 2114-9.
[40] Labbé A, Terry O, Brasnu E, et al. Tear film osmolarity in patients treated for glaucoma or ocular hypertension. Cornea 2012 ; 31 : 994-9.
[41] Zhivov A, Kraak R, Bergter H, et al. Influence of benzalkonium chloride on langerhans cells in corneal epithelium and development of dry eye in healthy volunteers. Curr Eye Res 2010 ; 35 : 762-9.
[42] Baudouin C. Detrimental effect of preservatives in eyedrops : implications for the treatment of glaucoma. Acta Ophthalmol 2008 ; 86 : 716-26.
[43] Ram J, Sharma A, Pandav SS, et al. Cataract surgery in patients with dry eyes. J Cataract Refract Surg 1998 ; 24 : 1119-24.
[44] Han KE, Yoon SC, Ahn JM, et al. Evaluation of dry eye and meibomian gland dysfunction after cataract surgery. Am J Ophthalmol 2014, pii : S0002 9394(14)00100-7. doi : 10.1016/j.ajo.2014.02.036.
[45] Kasetsuwan N, Satitpitakul V, Changul T, Jariyakosol S. Incidence and pattern of dry eye after cataract surgery. PLoS One 2013 ; 8 : e78657.
[46] Lin YY, Carrel H, Wang IJ, et al. Effect of tear film break-up on higher order aberrations of the anterior cornea in normal, dry, and post-LASIK eyes. J Refract Surg 2005 ; 21 : S525-9.
[47] Albietz JM, Lenton LN, McLennan SB. Chronic dry eye and regression after laser in situ keratomileusis for myopia. J Cataract Refract Surg 2004 ; 30 : 675-84.
[48] Farris RL. The dry eye : its mechanisms and therapy, with evidence that contact lens is a cause. CLAO J 1986 ; 12 : 234-46.
[49] Brennan NA, Efron N. Symptomatology of HEMA contact lens wear. Optom Vis Sci 1989 ; 66 : 834-8.
[50] Vajdic C, Holden BA, Sweeney DF, Cornish RM. The frequency of ocular symptoms during spectacle and daily soft and rigid contact lens wear. Optom Vis Sci 1999 ; 76 : 705-11.
[51] Begley CG, Caffery B, Nichols KK, Chalmers R. Responses of contact lens wearers to a dry eye survey. Optom Vis Sci 2000 ; 77 : 40-6.
[52] Ramamoorthy P, Nichols JJ. Compliance factors associated with contact lens-related dry eye. Eye Contact Lens 2014 ; 40 : 17-22.
[53] Bjerrum KB. Primary Sjogren syndrome and keratoconjunctivitis sicca : diagnostic methods, frequency and social disease aspects. Acta Ophthalmol (Scand) 2000 ; 231 : 1-37.
[54] Kanski JJ, Bowling B. Clinical Ophthalmology, 7th edition. Elsevier ; 2011.
[55] Hochberg MC, Tielsch J, Munoz B, et al. Dry eye and dry mouth in the elderly : a population-based assessment. Arch Intern Med 1999 ; 159 : 1359-63.
[56] Baudouin C, Aragona P, Van Setten G, et al ; ODISSEY European Consensus Group members. Diagnosing the severity of dry eye : a clear and practical algorithm. Br J Ophthalmol 2014 ; doi : 10.1136/bjophthalmol-2013-304619.
[57] Pult H, Riede-Pult BH, Murphy PJ. The relation between blinking and conjunctival folds and dry eye symptoms. Optom Vis Sci 2013 ; 90 : 1034-9.
[58] Cuevas M, Gonzalez-Garcia MJ, Castellanos E, et al. Correlations among symptoms, signs, and clinical tests in evaporative-type dry eye disease caused by Meibomian gland dysfunction (MGD). Curr Eye Res 2012 ; 37 : 855-63.
[59] Finis D, Schrader S, Geerling G. Meibomian gland dysfunction. Klin Monbl Augenheilkd 2012 ; 229 : 506-13.
[60] Nelson JD, Shimazaki J, Benitez-del-Castillo JM, et al. The international workshop on meibomian gland dysfunction : report of the definition and classification subcommittee. Invest Ophthalmol Vis Sci 2011 ; 52 : 1930-7.
[61] Foulks GN, Bron AJ. Meibomian gland dysfunction : a clinical scheme for description, diagnosis, classification, and grading. Ocul Surf 2003 ; 1 : 107-26.
[62] Bron AJ, Evans VE, Smith JA. Grading of corneal and conjunctival staining in the context of other dry eye tests. Cornea 2003 ; 22 : 640-50.
[63] Hamrah P, Alipour F, Jiang S, et al. Optimizing evaluation of Lissamine Green parameters for ocular surface staining. Eye (Lond) 2011 ; 25 : 1429-34.
[64] Doughty MJ. Rose bengal staining as an assessment of ocular surface damage and recovery in dry eye disease-a review. Cont Lens Anterior Eye 2013 ; 36 : 272-80.
[65] Yokoi N, Komuro A, Nishii M, et al. Clinical impact of conjunctivochalasis on the ocular surface. Cornea 2005 ; 24 : S24-31.
[66] Di Pascuale MA, Espana EM, Kawakita T, Tseng SC. Clinical characteristics of conjunctivochalasis with or without aqueous tear deficiency. Br J Ophthalmol 2004 ; 88 : 388-92.
[67] Bainbridge JW, Mackie IA, Mackie I. Diagnosis of Theodore’s superior limbic keratoconjunctivitis. Eye (Lond) 1998 ; 12 : 748-9.
[68] Bitton E, Wittich W. Influence of eye position on the Schirmer tear test. Cont Lens Anterior Eye 2013. pii : S1367-0484(13)00316-0.
[69] Lemp MA, Crews LA, Bron AJ, et al. Distribution of aqueous-deficient and evaporative dry eye in a clinic-based patient cohort : a retrospective study. Cornea 2012 ; 31 : 472-8.
[70] Savini G, Prabhawasat P, Kojima T, et al. The challenge of dry eye diagnosis. Clin Ophthalmol 2008 ; 2 : 31-55.
[71] Saleh TA, McDermott B, Bates AK, Ewings P. Phenol red thread test vs Schirmer’s test : a comparative study. Eye (Lond) 2006 ; 20 : 913-5.
[72] McMonnies CW. Key questions in a dry eye history. J Am Optometric Assoc 1986 ; 5 : 512-7.
[73] Doughty MJ, Fonn D, Richter D, et al. A patient questionnaire approach to estimating the prevalence of dry eye symptoms in patients presenting to optometric practices accross Canada. Optom Vis Sci 1997 ; 74 : 624-31.
[74] Schiffman RM, Christianson MD, Jacobsen G, et al. Reliability and validity of the Ocular Surface Disease Index. Arch Ophthalmol 2000 ; 118 : 615-21.
[75] Rajagopalan K, Abetz L, Mertzanis P, et al. Comparing the discriminative validity of two generic and one disease-specific health-related quality of life measures in sample of patients with dry eye. Value Health 2005 ; 8 : 168-74.
[76] Schein OD, Tielsch JM, Munõz B, et al. Relation between signs and symptoms of dry eye in the elderly. A population-based perspective. Ophthalmology 1997 ; 104 : 1395-401.
[77] Bandeen-Roche K, Muñoz B, Tielsch JM, et al. Self-reported assessment of dry eye in a population-based setting. Invest Ophthalmol Vis Sci 1997 ; 38 : 2469-75.
[78] Oden NL, Lilienfeld DE, Lemp MA, et al. Sensitivity and specificity of a screening questionnaire for dry eye. Adv Exp Med Biol 1998 ; 438 : 807-20.
[79] Schaumberg DA, Sullivan DA, Buring JE, Dana MR. Prevalence of dry eye syndrome among US women. Am J Ophthalmol 2003 ; 136 : 318-26.
[80] Mangione C, Lee PP, Pitts J, et al. Psychometric properties of the National Eye Institute Visual Function Questionnaire (NEI-VFQ). NEI-VFQ Field Test Investigators. Arch Ophthalmol 1998 ; 116 : 1496-504.
[81] Begley CG, Chalmers RL, Abetz L, et al. The relationship between habitual patient-reported symptoms and clinical signs among patients with dry eye of varying severity. Invest Ophthalmol Vis Sci 2003 ; 44 : 4753-61.
[82] Begley CG, Caffery B, Chalmers RL, Mitchell GL. Use of the dry eye questionnaire to measure symptoms of ocular irritation in patients with aqueous tear deficient dry eye ; Dry Eye Investigation (DREI) Study Group. Cornea 2002 ; 21 : 664-70.
[83] Begley CG, Caffery B, Nichols KK, Chalmers R. Responses of contact lens wearers to a dry eye survey. Optom Vis Sci 2000 ; 77 : 40-6.
[84] McCarty CA, Bansal AK, Livingston PM, et al. The epidemiology of dry eye in Melbourne, Australia. Ophthalmology 1998 ; 105 : 1114-9.
- Chapitre 3
L’œil sec- I - Épidémiologie
- II - Nouveaux concepts
- De nouveaux schémas pour mieux comprendre les maladies de la surface oculaire
- Le vieillissement de la surface oculaire
- Qualité de vie, qualité de vision
- L’osmolarité lacrymale : son rôle dans la compréhension, le diagnostic et la prise en charge du syndrome sec oculaire
- Immunité de la surface oculaire et sécheresse
- Sécheresse oculaire et biomarqueurs
- Conservateurs et œil sec
- III - Étiologie des sécheresses oculaires
- IV - L’enquête diagnostique