Greffes de membranes amniotiques : indications et techniques
M. Muraine, J. Gueudry
La greffe de membrane amniotique est indispensable dans la prise en charge des pathologies de la surface oculaire. La greffe de membrane amniotique, épithélium vers le haut (ou « inlay »), sert de substrat à la repousse épithéliale cornéenne. Elle est utilisée dans le traitement des ulcères cornéens trophiques tout particulièrement, mais aussi infectieux et post-infectieux. La greffe de membrane amniotique en patch est suturée épithélium vers le bas de façon à délivrer une concentration maximale de facteurs biologiques. Elle est utilisée au cours de situations inflammatoires de la surface oculaire comme les brûlures au stade aigu tout particulièrement.
L’utilisation chirurgicale de la membrane amniotique humaine en pathologie remonte à plusieurs dizaines d’années. De Rötth en 1940 a été le premier à l’utiliser en ophtalmologie dans le traitement des symblépharons et des déficits conjonctivaux [1], et Tseng [2] à partir de 1995 a réévalué cette technique dans le traitement des pathologies oculaires de surface. En 1997, Lee et Tseng [3] ont proposé pour la première fois une étude clinique rapportant l’utilisation de membrane amniotique dans le traitement des ulcères trophiques de la cornée. La même année, Shimazaki et Tsubota [4] associaient avec succès une greffe de membrane amniotique à une greffe de limbe dans sept cas de brûlures cornéennes.
La membrane amniotique recouvre le placenta, le cordon ombilical et tapisse toute la cavité amniotique. Elle se compose d’un stroma avasculaire, d’une membrane basale épaisse composée de collagène IV et V, de laminine et d’un épithélium (fig. 18-1). Les propriétés de ce tissu sont en effet uniques puisqu’il facilite la migration des cellules épithéliales, renforce l’adhésion des cellules épithéliales basales et favorise la différenciation épithéliale [2, 5]. À cela s’ajoutent ses propriétés cicatrisantes sur l’épithélium, sa capacité à moduler la cicatrisation stromale [6] ainsi que ses propriétés anti-inflammatoires [7-9], antibactériennes [8, 10] et anti-angiogéniques [9-11], qui font comprendre son intérêt actuel dans les pathologies de la surface oculaire (tableau 18-1) [12]. Certaines études sur la membrane amniotique cryopréservée à – 80 °C pendant 1 mois ont révélé que les facteurs de croissance étaient retrouvés à des niveaux supérieurs dans une membrane amniotique non dénudée que dans une membrane amniotique dénudée, suggérant leur origine épithéliale [13]. Cependant, il semble exister une variabilité interindividuelle et intra-individuelle (en fonction de la localisation du prélèvement sur toute la surface de l’amnios) de la quantité de facteurs de croissance contenus pouvant peut-être expliquer certaines variabilités d’efficacité clinique [14-16]. La membrane amniotique peut également jouer un rôle antalgique comme pourrait le faire une lentille souple thérapeutique [10, 17]. Enfin, la membrane amniotique a l’avantage de ne quasiment pas exprimer les antigènes d’histocompatibilité et n’entraîne de ce fait pas de réaction de rejet [18].
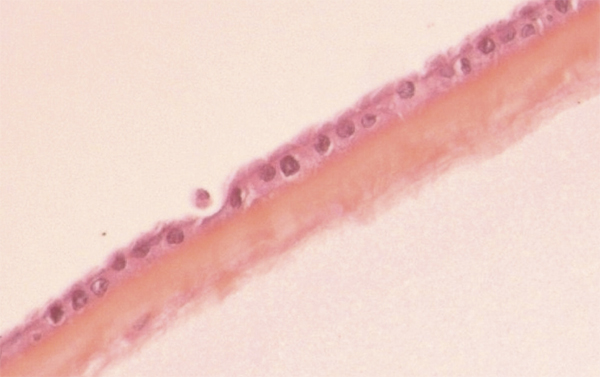
Fig. 18-1 La membrane amniotique se compose d’un stroma avasculaire, d’une membrane basale et d’un épithélium (coupe HES).
Tableau 18-1 Propriétés biologiques de la membrane amniotique [12].
EGF : epithelial growth factor ; HGF : hepatocyte growth factor ; IL : interleukine ; KGF : keratinocyte growth factor ; MMP : métalloprotéinase ; TGF-β : transforming growth factor β ; TIMP : tissue inhibitor of metalloproteinase
La sélection des donneuses est réalisée par l’obstétricien dans les cas des grossesses non pathologiques pour lesquelles une césarienne est programmée. La patiente est prévenue qu’en cas d’accord des examens biologiques (les sérologies VIH-1 et 2, hépatites B et C et syphilis ainsi que l’antigénémie p24 et les PCR VIH, hépatites B et C) seront réalisés le jour de l’accouchement. Depuis 2010, le diagnostic génomique viral par PCR (polymerase chain reaction) libère de l’obligation de quarantaine des prélèvements.
Le prélèvement du placenta est réalisé par l’obstétricien au bloc opératoire dans des conditions de stérilité chirurgicale. Il est ensuite abondamment rincé avec une solution saline stérile contenant 50 mg/ml de pénicilline, 50 mg/ml de streptomycine, 100 mg/ml de néomycine et 2,5 mg/ml d’amphotéricine B. L’amnios est détaché du chorion. Des petits carrés de 4 cm de côté de membrane de nitrocellulose sont alors disposés sur l’amnios positionné, face choriale, vers le haut, auquel ils adhèrent immédiatement. L’amnios est enfin découpé autour de son support, au bistouri, ce qui permet de réaliser plus d’une trentaine de prélèvements. Ces carrés de nitrocellulose supportant l’amnios épithélium vers le haut sont enroulés, puis introduits dans un flacon à congélation contenant un mélange à volume égal de glycérol et de milieu de culture. Ils sont alors conservés à – 80 °C pendant une durée possible de 1 an. Le flacon contenant la membrane amniotique est envoyé par la banque de tissus dans de la carboglace la veille de l’intervention (fig. 18-2).

Fig. 18-2 Préparation des membranes amniotiques.
a. Placenta prélevé au bloc opératoire le jour de la césarienne. b. Chorion et amnios isolés sur un support. c. Séparation du chorion et de l’amnios. d, e. Amnios isolé, épithélium au contact du support. e, f. Disposition de supports en nitrocellulose. g. Découpe de la membrane amniotique autour de chaque support de nitrocellulose. h. Enroulement du support et du fragment de membrane amniotique ; introduction dans le flacon, conditionnement primaire, rempli de milieu et d’un cryoprotecteur. i. Étiquetage des conditionnements secondaires et stockage à – 80 °C dans un congélateur.
Tous les modes de conservation de la membrane amniotique limitent probablement ses propriétés biologiques. La lyophilisation, plus récemment développée, qui permettrait de limiter les problèmes de stockage, de transport et de stérilité, semble être plus délétère pour la conservation des facteurs de croissance que la « classique » cryoconservation [19]. Par ailleurs, les données cliniques sont rares, même si la membrane lyophilisée dans la chirurgie du ptérygion a permis une épithélialisation conjonctivale complète chez 13 patients sur 13 [20]. Certaines mises au point techniques en limitant la phase de congélation ou en ajoutant des substances protectrices lors de la lyophilisation semblent améliorer la conservation des propriétés biologiques [21]. Ce mode de conservation pourrait permettre un degré de transparence supérieure à la membrane amniotique cryoconservée [22]. Enfin le cross-linking de la membrane amniotique permettrait de la rendre plus résistante à certaines enzymes [23].
La membrane amniotique sert de substrat à la repousse épithéliale déficiente et remplace en partie la matrice du stroma manquant. Le chirurgien vise l’intégration de la membrane amniotique dans la cornée ; elle est alors utilisée dans les ulcères épithéliaux et stromaux cornéens. Ainsi, après désépithélialisation des bords de l’ulcère, la membrane amniotique est découpée de façon à recouvrir toute la zone de stroma mise à nu, puis elle est habituellement suturée par des points séparés de Nylon 10/0 et ne dépasse pas les limites du limbe sclérocornéen (fig. 18-3a). En cas de perte de substance stromale, la meilleure technique est la réalisation d’une greffe amniotique en multicouches. Cette technique a été rapportée pour la première fois par Kruse [24] dans la prise en charge des ulcères profonds. En cas de perforation, celle-ci ne doit pas dépasser 2 mm de diamètre. Elle consiste en l’application d’une membrane amniotique de taille légèrement supérieure à celle de l’ulcère en la suturant à ses berges avec du monofilament 10/0. Un autre fragment de membrane est alors glissé sous la membrane préalablement suturée (fig. 18-3b). Par la suite, la membrane est intégrée à la cornée et persiste sous la forme d’une opacité nuageuse sous-épithéliale.
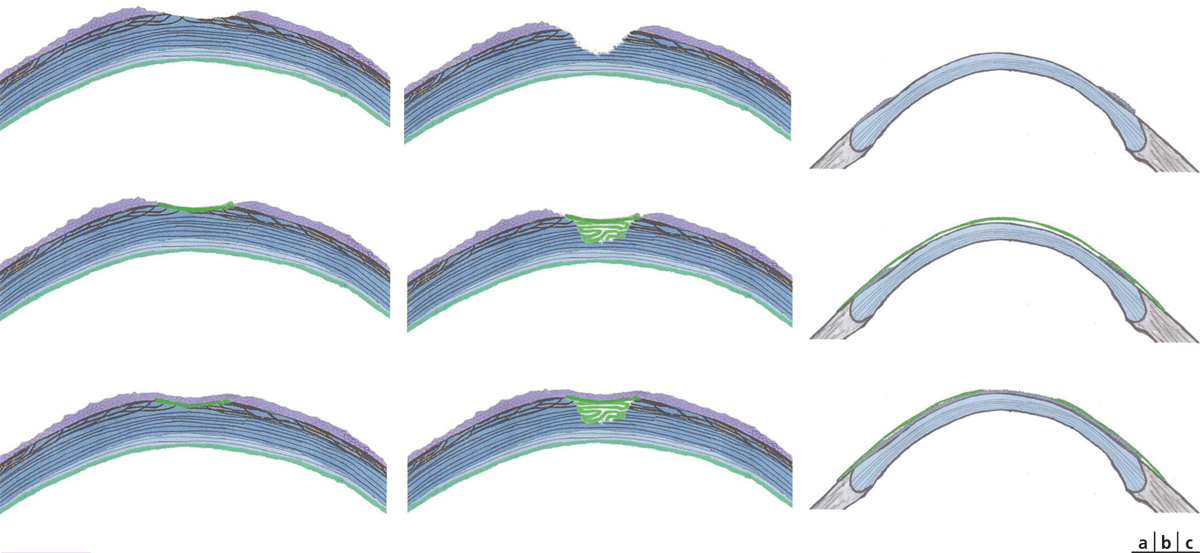
Fig. 18-3 Utilisation des membranes amniotiques en chirurgie oculaire (en vert, la membrane amniotique et en violet, l’épithélium cornéen).
a. En « greffe » ou « inlay » : ulcère cornéen (en haut) ; greffe de membrane amniotique avec l’épithélium vers le haut (au milieu) ; cicatrisation épithéliale cornéenne par-dessus la membrane amniotique (en bas). b. Greffe amniotique en multicouches : ulcère cornéen épithélial et stromal (en haut) ; greffe de membrane amniotique avec l’épithélium vers le haut, noter le morceau de membrane amniotique glissé sous le précédent pour combler l’ulcère creusant (au milieu) ; cicatrisation épithéliale cornéenne par-dessus la membrane amniotique (en bas). c. En patch (ou épithélium vers le bas) : atteinte sévère inflammatoire de la surface oculaire (en haut) ; greffe amniotique avec l’épithélium vers le haut sur la surface lésée (au milieu) ; cicatrisation épithéliale cornéenne sous la membrane amniotique qui se délite progressivement (en bas).
La membrane amniotique est suturée épithélium vers le bas de façon à délivrer une concentration maximale de facteurs biologiques (au cours de situations inflammatoires comme une brûlure de la surface oculaire) : elle recouvre la cornée pathologique en jouant un rôle à la fois de pansement biologique et d’antalgique. L’épithélialisation de la cornée se faisant sous la membrane amniotique, cette dernière est éliminée 2 à 3 semaines après sa mise en place (fig. 18-3c). Parfois, cette membrane recouvre une première suturée en greffe. Celle-ci est alors plus large, suturée par-dessus la première avec l’épithélium vers le bas. Il semble nécessaire dans cette technique de faire dépasser la seconde membrane de la zone de désinsertion de la conjonctive pour éviter une réépithélialisation par-dessus la seconde membrane [10]. Il est désormais possible d’utiliser un dispositif sans sutures appelé Prokera®, non disponible pour le moment en France, comprenant un anneau de symblépharon recouvert d’une membrane amniotique. Ce dispositif temporaire a l’avantage de pouvoir être positionné sans intervention [25, 26].
Le pronostic de la greffe de membrane amniotique dépend de la pathologie sous-jacente et de la qualité de la surface oculaire. Il est inverse au degré d’inflammation locale.
L’utilisation de la greffe amniotique peut être utile dans les reconstructions conjonctivales lors de la chirurgie d’exérèse des symblépharons ou des tumeurs conjonctivales [27]. En effet, il est parfois difficile d’obtenir du tissu conjonctival en quantité suffisante. En cas de symblépharon, il est nécessaire de le disséquer puis de juxtaposer un greffon amniotique que l’on suture par points séparés de Vicryl 8/0. Suivant les cas, on maintient le cul-de-sac conjonctival à l’aide de sutures extériorisées à la peau, ou en interposant dans le cul-de-sac un conformateur troué en son centre. Tseng rapporte cette technique avec succès [28]. Il confirmait le bon recouvrement de l’amnios par un épithélium de type conjonctival [29] et signalait par ailleurs que dans la majorité des échecs, la conjonctive entourant le greffon amniotique était pathologique. Solomon rapporte une bonne reconstruction du fornix dans 12 yeux sur 17 (70,6 %) [30]. Plus récemment, Tseng conseille l’association de mitomycine à la greffe amniotique dans les cas de destruction importante des fornix [31]. La greffe de membrane amniotique permet de traiter des symblépharons localisés et lorsque l’inflammation de la surface oculaire est encore modérée (fig. 18-4). Dans le cas contraire (pemphigoïde oculaire cicatricielle, Steven-Johnson, brûlure chimique, etc.), la récidive est fréquente et une greffe de muqueuse buccale est alors nécessaire. Certaines études ont évalué l’intérêt de la greffe amniotique dans la chirurgie du ptérygion, mais seule l’étude de Prabhasawat la compare aux autres techniques [32]. L’exérèse du ptérygion associée au recouvrement par une greffe amniotique est moins efficace que l’excision avec une simple autogreffe conjonctivale. De ce fait, la greffe amniotique n’est utilisée dans ce type de chirurgie qu’en association avec la greffe de limbe. Par ailleurs, la greffe de membrane amniotique a été utilisée pour la prise en charge des kératoconjonctivites limbiques supérieures et des conjonctivochalasis [27, 33]. Dans la chirurgie du glaucome, la greffe de membrane amniotique utilisée comme agent antifibrotique dans les chirurgies filtrantes ou pour recouvrir des valves dénudées a été d’une efficacité limitée [34]. Enfin l’utilisation de la membrane amniotique en chirurgie orbitopalpébrale (reconstruction palpébrale, recouvrement d’exposition de bille ou occlusion des points lacrymaux) reste controversée [35].

Fig. 18-4 Libération par greffe de membrane amniotique d’un symblépharon.
a. Aspect préopératoire. b. Aspect postopératoire à J7. c. Aspect à 2 mois postopératoires. d. Aspect postopératoire à 3 mois, noter la reconstruction partielle du cul-de-sac.
L’ulcère cornéen trophique réfractaire au traitement médical est sans doute la meilleure indication de la greffe de membrane amniotique et permet d’éviter le recours à une kératoplastie « à chaud » dont le pronostic est le plus souvent réservé sur un tel terrain. Dans cette indication, la membrane amniotique est utilisée en greffe (fig. 18-5). En quelques jours, la membrane basale amniotique sert de support pour la repousse de l’épithélium cornéen. Dans cette indication, les taux de succès avoisinent 80 % [3, 24, 33, 36]. Les cas d’échec rapportés sont secondaires à une anesthésie cornéenne totale ou à un syndrome de déficience limbique associé. Ainsi, en cas d’anesthésie complète, le clignement est plus rare et l’exposition prolongée du greffon amniotique avant son recouvrement par l’épithélium cornéen peut être la cause de son élimination. Une telle explication a été proposée par Chen [37] qui suggère alors de coupler la greffe amniotique à une tarsorraphie partielle dans le même temps opératoire afin de laisser le temps à l’épithélium de recouvrir la membrane et de l’intégrer. Par ailleurs, il a été rapporté 24 patients opérés d’une greffe amniotique en multicouches pour une perforation cornéenne non traumatique avérée. L’intervention a permis la cicatrisation cornéenne et la récupération d’une chambre antérieure étanche dans tous les cas avec un recul de 20,5 mois [38]. L’étude de Hanada [39] retrouve une cicatrisation après greffe amniotique en multicouches dans les ulcérations sévères de la cornée et de la sclère dans 72,7 % des cas en 16,5 jours en moyenne. Les échecs de la greffe amniotique sont souvent retrouvés en cas de maladie auto-immune associée à l’ulcère (la lyse dirigée contre le stroma peut se faire également contre l’amnios greffé), même si la mise en route d’une corticothérapie par voie générale améliore le pronostic (fig. 18-6), ou de déficit limbique total (l’amnios ne peut alors être épithélialisé correctement). Une autre possibilité en cas de perforation est d’associer une greffe amniotique à l’utilisation de colle comme l’ont proposé avec succès Su avec de la colle cyanoacrylate [40] et Duchesne avec une colle de fibrine [41]. Une greffe de membrane amniotique a également été proposée dans le traitement des ulcères des kératoconjonctivites vernales avec une cicatrisation obtenue dans sept cas sur sept [42]. Enfin, la greffe de membrane amniotique est utile pour la prise en charge des kératopathies bulleuses quand la kératoplastie n’est pas envisagée, à visée antalgique. Dans ce cas, elle est le plus souvent utilisée en greffe [43].
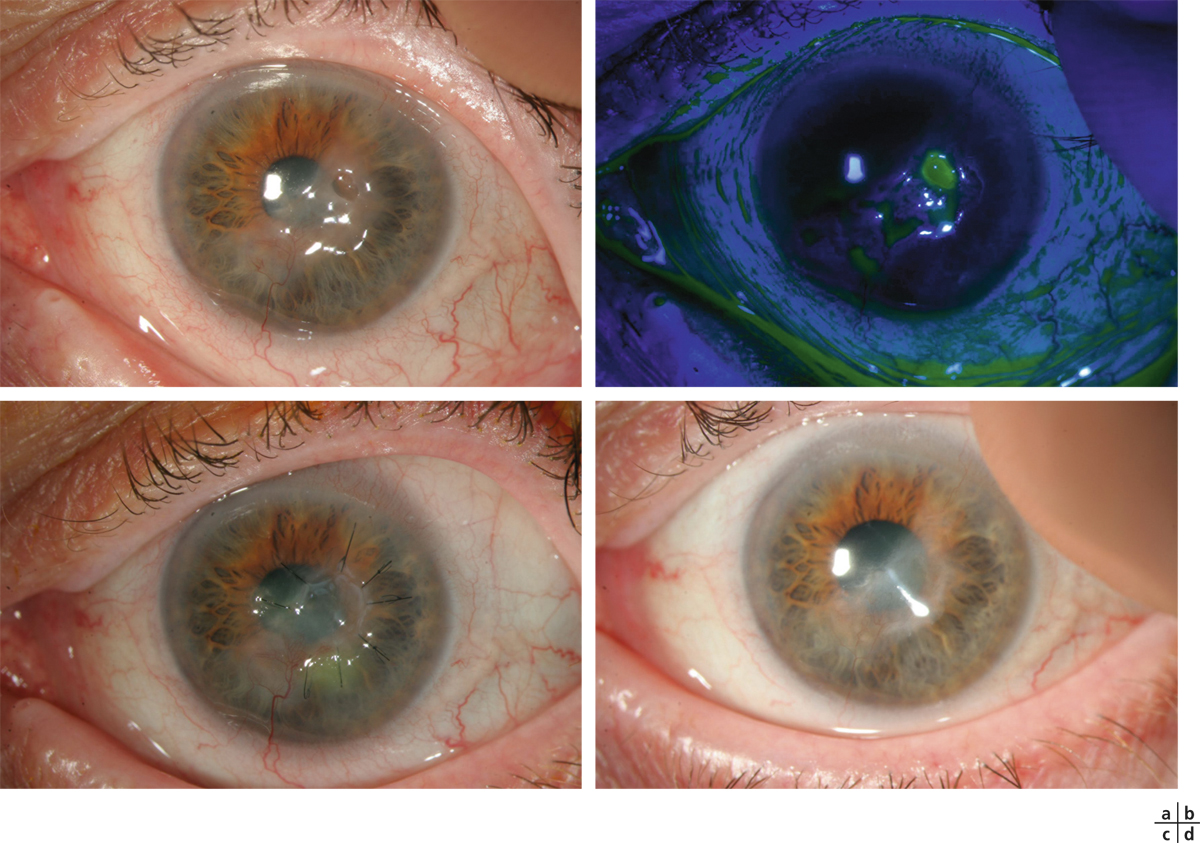
Fig. 18-5 Ulcère neurotrophique.
a. Secondaire à une kératite herpétique. b. Aspect après instillation de fluorescéine. c. Aspect à 3 semaines après une greffe de membrane amniotique suturée, épithélium vers le haut. d. Aspect à 3 mois postopératoires.
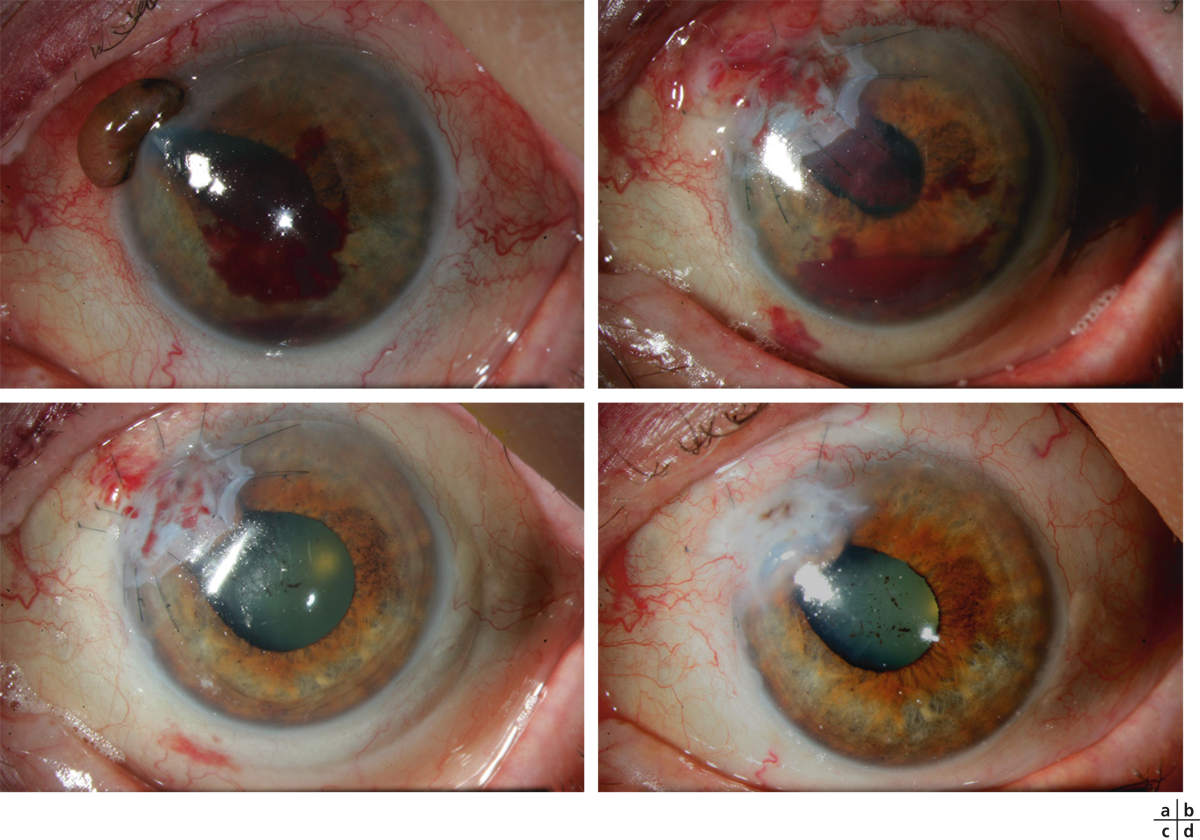
Fig. 18-6 Kératite marginale.
a. Secondaire à une polyarthrite rhumatoïde, perforée suite à un traumatisme minime avec hernie de l’iris. b. Aspect le lendemain d’une greffe de membrane amniotique en multicouches et mise en place d’une corticothérapie par voie générale à 1 mg/kg/jour. c. Aspect à J15 postopératoires. d. Aspect à 3 mois postopératoires ; à noter la persistance de l’incarcération irienne au niveau de la cicatrice cornéenne.
Au cours de cette phase précoce, le limbe cornéoconjonctival n’est pas encore détruit mais est soumis à de multiples agressions venant principalement de la région conjonctivale périlimbique. L’objectif principal est alors d’éviter la destruction du limbe cornéoconjonctival en tentant d’améliorer l’environnement périlimbique. C’est à ce stade la place privilégiée de la greffe amniotique dont les propriétés principales sont de diminuer l’inflammation locale et de favoriser la réépithélialisation normale de la cornée en cas d’échec du traitement médical.
Au stade aigu des brûlures chimiques et suivant la gravité du tableau [7, 44, 45], elle doit être réalisée au cours de la première semaine si l’ischémie du limbe et l’inflammation conjonctivale persistent. Le plus souvent, la technique chirurgicale consiste à réséquer la conjonctive ischémique puis à recouvrir l’ensemble de la cornée par un patch amniotique (fig. 18-7). Meller et al. [44] rapportent le cas de 13 yeux présentant une brûlure chimique de grade II et III traités par une greffe amniotique au stade aigu. Onze yeux ont présenté une épithélialisation satisfaisante, évoluant entre 2 et 5 semaines. Le résultat final dépend bien sûr de la gravité de l’atteinte initiale [46]. Cependant, il est difficile d’établir la preuve irréfutable de son efficacité du fait probablement de l’hétérogénéité des populations traitées et des critères de succès dans la littérature [47]. Plus récemment, la greffe amniotique a été proposée également pendant la première semaine d’évolution des syndromes de Stevens-Johnson et de Lyell pour minimiser les séquelles au niveau de la surface oculaire [48, 49]. Il semble nécessaire que la membrane amniotique en patch recouvre à la fois la cornée puis les fornix et enfin les deux bords libres [49]. Ainsi les dispositifs sans sutures, tels que Prokera®, ne doivent pas être utilisés seuls dans ce type de pathologies, car alors seuls la cornée et le limbe sont recouverts [50]. Cependant il est difficile de vérifier l’efficacité de la greffe de membrane amniotique par rapport à l’évolution spontanée de la maladie en l’absence d’étude comparative difficile à mener pour ce type de maladies rares. Dans les pemphigoïdes oculaires cicatricielles, le rôle des immunosuppresseurs est majeur afin de limiter l’atteinte de la surface et la greffe amniotique n’a qu’un intérêt limité.
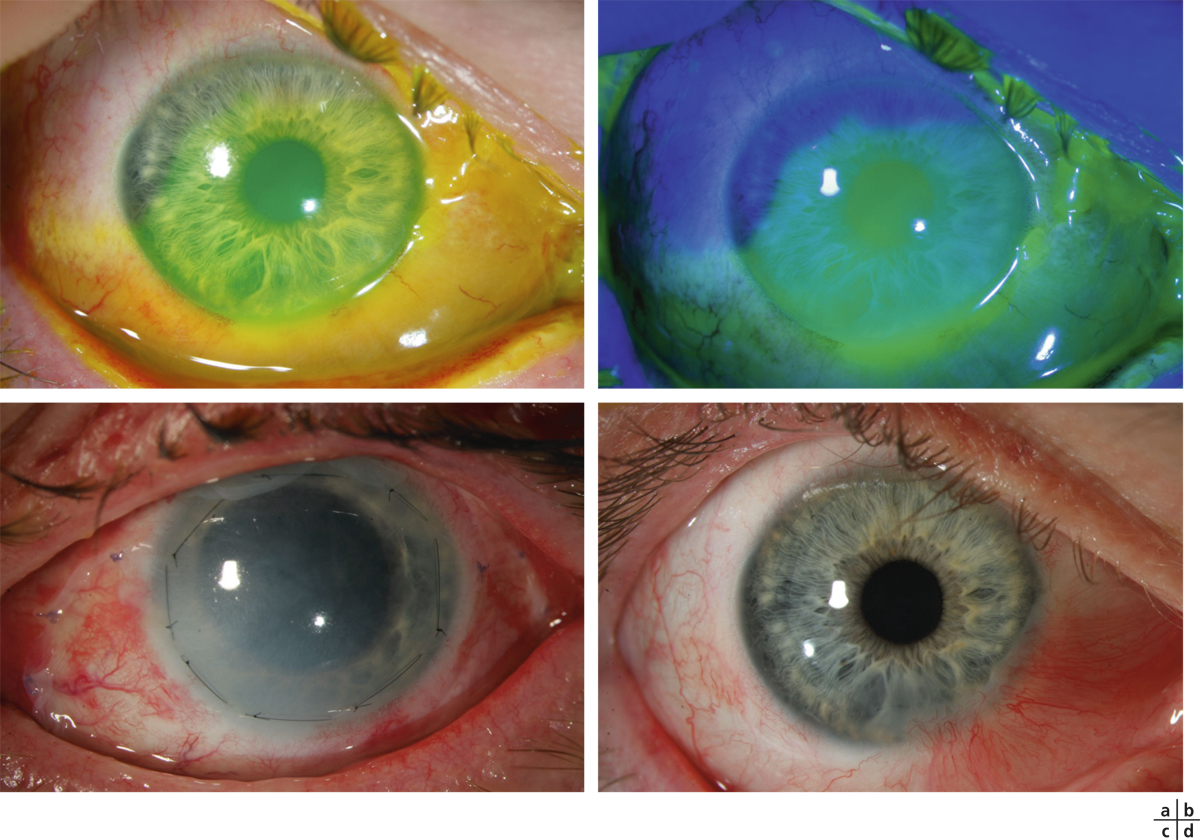
Fig. 18-7 Brûlure chimique par base.
a, b. Aspect le jour de l’accident, noter l’ischémie limbique inférieure. c. Aspect postopératoire à J5 après une greffe de membrane amniotique en patch recouvrant l’ensemble de la cornée et la zone de conjonctive ischémique réséquée. d. Aspect à 1 an.
En cas de déficit en cellules souches épithéliales avec une néovascularisation majeure, la greffe de membrane amniotique ne peut pas reconstituer un épithélium conjonctivocornéen de qualité. Elle est alors surtout intéressante dans les cas de destruction focale du limbe ou d’hypofonction limbique comme la kératopathie aniridique [51]. Le principe chirurgical est de retirer le pannus vasculaire sans toucher aux zones épithéliales saines qu’elles soient centrales ou périphériques et la membrane amniotique est appliquée en patch [51, 52]. Il semble donc que la membrane amniotique ait un effet bénéfique sur les cellules souches encore viables à la surface de la cornée. En cas d’échec de la greffe amniotique ou d’emblée, il sera nécessaire de reconstruire le limbe en apportant un pool suffisant de cellules souches limbiques (auto- ou allogreffe), éventuellement associée à une greffe amniotique [52, 53].
De nouveaux espoirs sont apparus dans le traitement des destructions de la surface oculaire lors des premiers cas rapportés de greffes d’expansions cellulaires de cellules souches épithéliales de cornée [54, 55]. La membrane amniotique permet en effet un environnement stromal favorable pour l’expansion des cellules qui établissent alors des structures d’adhésion proches de l’épithélium cornéen normal [56]. Les cellules épithéliales cornéennes semblent pousser rapidement quand l’épithélium amniotique est retiré, moins rapidement si la membrane amniotique est laissée intacte et encore plus lentement quand les cellules sont positionnées sur la face choriale de la membrane amniotique [10]. La reconstruction de la surface oculaire à partir de cellules souches prélevées au niveau de l’épithélium jugal et cultivées sur membrane amniotique semble constituer une alternative [57].
La greffe amniotique peut être proposée au stade aigu de l’infection pour réduire celle-ci ainsi que l’inflammation associée. Ce type de traitement a été proposé pour la première fois par Gicquel et al. en 2007 [17]. En l’absence de groupe de comparaison, il est difficile de tirer de véritables conclusions mais la réduction avérée de la douleur, pendant la période allant de la pose de la membrane jusqu’à sa dissolution, confirme son effet antalgique [8]. Tseng et al. [58] ont proposé la mise en place du dispositif Prokera® sans sutures lors de trois cas de kératites microbiennes. Au cours de cette série non comparative, les auteurs rapportent une diminution importante de la douleur ainsi qu’une réduction rapide de l’inflammation et une cicatrisation épithéliale rapide dans deux cas sur trois. En cas de résistance d’une kératite bactérienne, l’objectif est de stopper au plus vite l’évolution d’une ulcération stromale vers la perforation. La greffe de membrane est alors utile en limitant les indications des greffes de cornée à chaud de mauvais pronostic. Il faut au préalable réaliser une détersion de l’ensemble de l’abcès et suturer ou coller à l’aide de colle de fibrine (Tissucol®, Baxter) la membrane amniotique en greffe simple ou en multicouches. Un certain nombre d’études ont montré que l’utilisation d’une membrane amniotique humaine pouvait accélérer la cicatrisation épithéliale et réduire l’inflammation stromale lors d’une kératite herpétique nécrosante (fig. 18-8) [8, 59, 60]. Les kératites fongiques sont une bonne indication au stade aigu car il n’est pas rare de les voir résister au traitement antifongique et d’être confronté à un abcès de taille importante (fig. 18-9) [37]. Au stade de kératite infectieuse stérilisée, le recours à une greffe de membrane amniotique peut être rendu nécessaire en cas d’ulcération cornéenne persistante, le plus souvent trophique (en particulier dans les cas d’herpès et d’amibes), ou toxique après un traitement local prolongé [61].
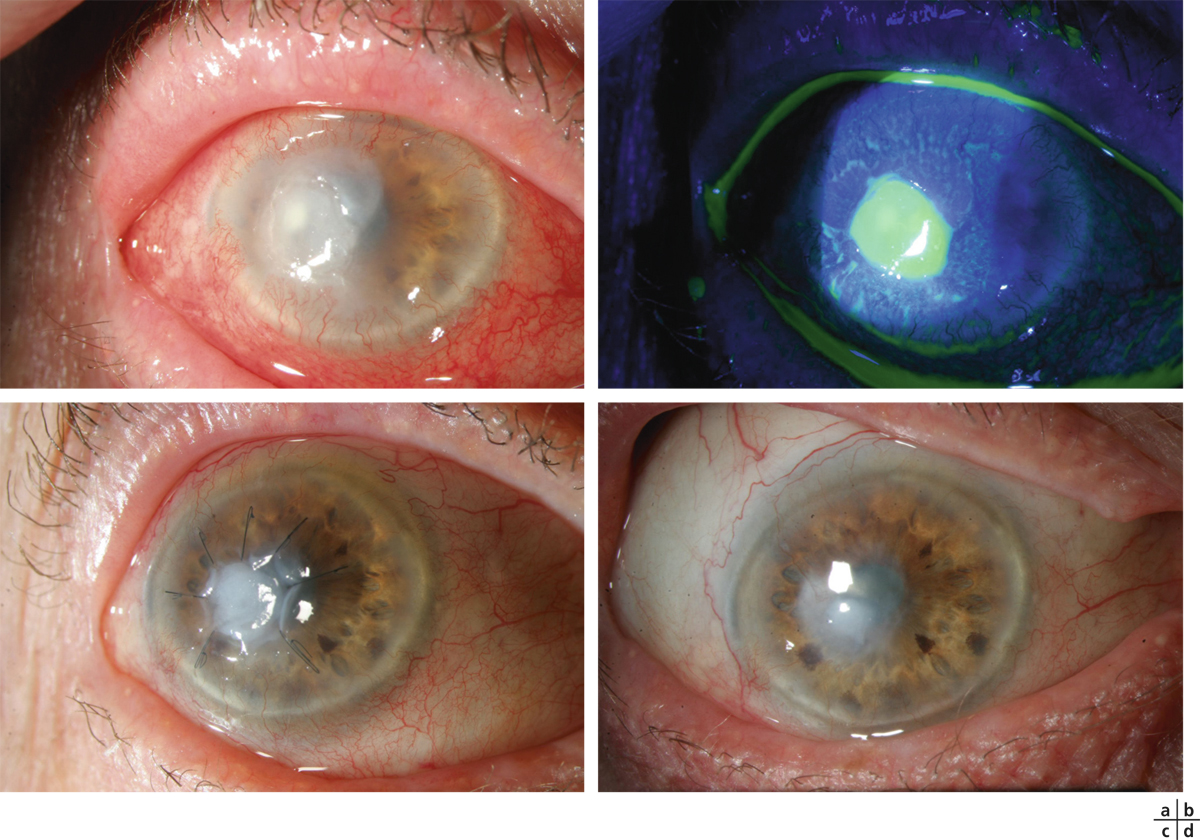
Fig. 18-8 Kératite herpétique nécrosante à HSV-1.
a. Évolution défavorable malgré un traitement maximal par valaciclovir et l’arrêt des collyres épithéliotoxiques. b. Aspect après instillation de fluorescéine. c. Aspect à J7 après greffe de membrane amniotique en multicouches. d. Aspect à 12 mois sous traitement d’entretien par valaciclovir.

Fig. 18-9 Kératite à Fusarium sp. associée au port de lentilles souples.
a. Stagnation clinique de l’abcès malgré la mise en route du voriconazole par voie générale. b. Aspect après détersion au bloc opératoire et mise en place d’un bouchon de membrane amniotique maintenu par de la colle de fibrine et une lentille thérapeutique à J1. c. Aspect à J7 ; il existe une épithélialisation complète. d. Aspect à 2 ans ; l’acuité visuelle corrigée est à 8/10 et il persiste une taie cornéenne paracentrale.
La greffe amniotique est une technique chirurgicale simple et facile d’accès qui doit faire partie de l’arsenal thérapeutique des pathologies oculaires de surface. Ses indications et surtout ses limites doivent néanmoins être bien connues car la greffe amniotique ne peut, à elle seule, corriger les pathologies secondaires à la destruction du limbe. Elle fait désormais partie de l’arsenal thérapeutique des atteintes sévères de la surface oculaire même s’il n’existe pas d’études randomisées démontrant sa supériorité par rapport aux autres alternatives existantes.
[1] De Rötth A. Plastic repair of conjonctival defects with fetal membrane. Arch Ophthalmol 1940 ; 23 : 522-5.
[2] Kim JC, Tseng SC. Transplantation of preserved human amniotic membrane for surface reconstruction in severely damaged rabbit corneas. Cornea 1995 ; 14 : 473-84.
[3] Lee SH, Tseng SC. Amniotic membrane transplantation for persistent epithelial defects with ulceration. Am J Ophthalmol 1997 ; 123 : 303-12.
[4] Shimazaki J, Yang HY, Tsubota K. Amniotic membrane transplantation for ocular surface reconstruction in patients with chemical and thermal burns. Ophthalmology 1997 ; 104 : 2068-76.
[5] Koizumi NJ, Inatomi TJ, Sotozono CJ, et al. Growth factor mRNA and protein in preserved human amniotic membrane. Curr Eye Res 2000 ; 20 : 173-7.
[6] Choi TH, Tseng SC. In vivo and in vitro demonstration of epithelial cell-induced myofibroblast differentiation of keratocytes and an inhibitory effect by amniotic membrane. Cornea 2001 ; 20 : 197-204.
[7] Kim JS, Kim JC, Na BK, et al. Amniotic membrane patching promotes healing and inhibits proteinase activity on wound healing following acute corneal alkali burn. Exp Eye Res 2000 ; 70 : 329-37.
[8] Kim JS, Kim JC, Hahn TW, et al. Amniotic membrane transplantation in infectious corneal ulcer. Cornea 2001 ; 20 : 720-6.
[9] Hao Y, Ma DH, Hwang DG, et al. Identification of antiangiogenic and antiinflammatory proteins in human amniotic membrane. Cornea 2000 ; 19 : 348-52.
[10] Dua HS, Gomes JA, King AJ, et al. The amniotic membrane in ophthalmology. Surv Ophthalmol 2004 ; 49 : 51-77.
[11] Kim JC, Tseng SC. The effects on inhibition of corneal neovascularization after human amniotic membrane transplantation in severely damaged rabbit corneas. Korean J Ophthalmol 1995 ; 9 : 32-46.
[12] Güell J, Gris O, Manero F, et al. Indications for and uses of amniotic membrane. In : Krachmer J, Mannis M, Holland E. Eds. Cornea. St-Louis : Mosby/Elsevier ; 2011.
[13] Grueterich M, Espana EM, Tseng SC. Ex vivo expansion of limbal epithelial stem cells : amniotic membrane serving as a stem cell niche. Surv Ophthalmol 2003 ; 48 : 631-46.
[14] Dua HS, IRahman I, Miri A, et al. Variations in amniotic membrane : relevance for clinical applications. Br J Ophthalmol 2010 ; 94 : 963-4.
[15] Gicquel JJ, Dua HS, Brodie A, et al. Epidermal growth factor variations in amniotic membrane used for ex vivo tissue constructs. Tissue Eng Part A 2009 ; 15 : 1919-27.
[16] Hopkinson A, McIntosh RS, Tighe PJ, et al. Amniotic membrane for ocular surface reconstruction : donor variations and the effect of handling on TGF-beta content. Invest Ophthalmol Vis Sci 2006 ; 47 : 4316-22.
[17] Gicquel JJ, Bejjani RA, Ellies P, et al. Amniotic membrane transplantation in severe bacterial keratitis. Cornea 2007 ; 26 : 27-33.
[18] Akle CA, Adinolfi M, Welsh KI, et al. Immunogenicity of human amniotic epithelial cells after transplantation into volunteers. Lancet 1981 ; 2 : 1003-5.
[19] Rodriguez-Ares MT, Lopez-Valladares MJ, Tourino R, et al. Effects of lyophilization on human amniotic membrane. Acta Ophthalmol 2009 ; 87 : 396-403.
[20] Nakamura T, Inatomi T, Sekiyama E, et al. Novel clinical application of sterilized, freeze-dried amniotic membrane to treat patients with pterygium. Acta Ophthalmol Scand 2006 ; 84 : 401-5.
[21] Allen CL, Clare G, Stewart EA, et al. Augmented dried versus cryopreserved amniotic membrane as an ocular surface dressing. PLoS One 2013 ; 8 : e78441.
[22] Connon CJ, Doutch J, Chen B, et al. The variation in transparency of amniotic membrane used in ocular surface regeneration. Br J Ophthalmol 2010 ; 94 : 1057-61.
[23] Spoerl E, Wollensak G, Reber F, et al. Cross-linking of human amniotic membrane by glutaraldehyde. Ophthalmic Res 2004 ; 36 : 71-7.
[24] Kruse FE, Rohrschneider K, Volcker HE. Multilayer amniotic membrane transplantation for reconstruction of deep corneal ulcers. Ophthalmology 1999 ; 106 : 1504-10 ; discussion 1511.
[25] Suri K, Kosker M, Raber IM, et al. Sutureless amniotic membrane ProKera for ocular surface disorders : short-term results. Eye Contact Lens 2013 ; 39 : 341-7.
[26] Kheirkhah A, Casas V, Raju VK, et al. Sutureless amniotic membrane transplantation for partial limbal stem cell deficiency. Am J Ophthalmol 2008 ; 145 : 787-94.
[27] Gris O, Guell JL, Lopez-Navidad A, et al. Application of the amniotic membrane in ocular surface pathology. Ann Transplant 1999 ; 4 : 82-4.
[28] Tseng SC, Prabhasawat P, Lee SH. Amniotic membrane transplantation for conjunctival surface reconstruction. Am J Ophthalmol 1997 ; 124 : 765-74.
[29] Prabhasawat P, Tseng SC. Impression cytology study of epithelial phenotype of ocular surface reconstructed by preserved human amniotic membrane. Arch Ophthalmol 1997 ; 115 : 1360-7.
[30] Solomon A, Espana EM, Tseng SC. Amniotic membrane transplantation for reconstruction of the conjunctival fornices. Ophthalmology 2003 ; 110 : 93-100.
[31] Tseng SC, Di Pascuale MA, Liu DT, et al. Intraoperative mitomycin C and amniotic membrane transplantation for fornix reconstruction in severe cicatricial ocular surface diseases. Ophthalmology 2005 ; 112 : 896-903.
[32] Prabhasawat P, Barton K, Burkett G, et al. Comparison of conjunctival autografts, amniotic membrane grafts, and primary closure for pterygium excision. Ophthalmology 1997 ; 104 : 974-85.
[33] Azuara-Blanco A, Pillai CT, Dua HS. Amniotic membrane transplantation for ocular surface reconstruction. Br J Ophthalmol 1999 ; 83 : 399-402.
[34] Budenz DL, Barton K, Tseng SC. Amniotic membrane transplantation for repair of leaking glaucoma filtering blebs. Am J Ophthalmol 2000 ; 130 : 580-8.
[35] Ti SE, Tow SL, Chee SP. Amniotic membrane transplantation in entropion surgery. Ophthalmology 2001 ; 108 : 1209-17.
[36] Muraine M, Descargues G, Franck O, et al. La greffe de membrane amniotique dans les pathologies oculaires de surface. J Fr Ophtalmol 2001 ; 24 : 798-812.
[37] Chen HC, Tan HY, Hsiao CH, et al. Amniotic membrane transplantation for persistent corneal ulcers and perforations in acute fungal keratitis. Cornea 2006 ; 25 : 564-72.
[38] Vasseneix C, Toubeau D, Brasseur G, et al. Prise en charge chirurgicale des perforations cornéennes non traumatiques : étude rétrospective sur 8 ans. J Fr Ophtalmol 2006 ; 29 : 751-62.
[39] Hanada K, Shimazaki J, Shimmura S, et al. Multilayered amniotic membrane transplantation for severe ulceration of the cornea and sclera. Am J Ophthalmol 2001 ; 131 : 324-31.
[40] Su CY, Lin CP. Combined use of an amniotic membrane and tissue adhesive in treating corneal perforation : a case report. Ophthalmic Surg Lasers 2000 ; 31 : 151-4.
[41] Hick S, Demers PE, Brunette I, et al. Amniotic membrane transplantation and fibrin glue in the management of corneal ulcers and perforations : a review of 33 cases. Cornea 2005 ; 24 : 369-77.
[42] Sridhar MS, Sangwan VS, Bansal AK, et al. Amniotic membrane transplantation in the management of shield ulcers of vernal keratoconjunctivitis. Ophthalmology 2001 ; 108 : 1218-22.
[43] Espana EM, Grueterich M, Sandoval H, et al. Amniotic membrane transplantation for bullous keratopathy in eyes with poor visual potential. J Cataract Refract Surg 2003 ; 29 : 279-84.
[44] Meller D, Pires RT, Mack RJ, et al. Amniotic membrane transplantation for acute chemical or thermal burns. Ophthalmology 2000 ; 107 : 980-9 ; discussion 990.
[45] Kobayashi A, Shirao Y, Yoshita T, et al. Temporary amniotic membrane patching for acute chemical burns. Eye (Lond) 2003 ; 17 : 149-58.
[46] Joseph A, Dua HS, King AJ. Failure of amniotic membrane transplantation in the treatment of acute ocular burns. Br J Ophthalmol 2001 ; 85 : 1065-9.
[47] Clare G, Suleman H, Bunce C, et al. Amniotic membrane transplantation for acute ocular burns. Cochrane Database Syst Rev 2012 ; 9 : CD009379.
[48] Gregory DG. Treatment of acute Stevens-Johnson syndrome and toxic epidermal necrolysis using amniotic membrane : a review of 10 consecutive cases. Ophthalmology 2011 ; 118 : 908-14.
[49] Shammas MC, Lai EC, Sarkar JS, et al. Management of acute Stevens-Johnson syndrome and toxic epidermal necrolysis utilizing amniotic membrane and topical corticosteroids. Am J Ophthalmol 2010 ; 149 : 203-13.e2.
[50] Ciralsky JB, Sippel KC, Gregory DG. Current ophthalmologic treatment strategies for acute and chronic Stevens-Johnson syndrome and toxic epidermal necrolysis. Curr Opin Ophthalmol 2013 ; 24 : 321-8.
[51] Anderson DF, Ellies P, Pires RT, et al. Amniotic membrane transplantation for partial limbal stem cell deficiency. Br J Ophthalmol 2001 ; 85 : 567-75.
[52] Tseng SC, Prabhasawat P, Barton K, et al. Amniotic membrane transplantation with or without limbal allografts for corneal surface reconstruction in patients with limbal stem cell deficiency. Arch Ophthalmol 1998 ; 116 : 431-41.
[53] Shimazaki J, Shinozaki N, Tsubota K. Transplantation of amniotic membrane and limbal autograft for patients with recurrent pterygium associated with symblepharon. Br J Ophthalmol 1998 ; 82 : 235-40.
[54] Ti SE, Anderson D, Touhami A, et al. Factors affecting outcome following transplantation of ex vivo expanded limbal epithelium on amniotic membrane for total limbal deficiency in rabbits. Invest Ophthalmol Vis Sci 2002 ; 43 : 2584-92.
[55] Nakamura T, Koizumi N, Tsuzuki M, et al. Successful regrafting of cultivated corneal epithelium using amniotic membrane as a carrier in severe ocular surface disease. Cornea 2003 ; 22 : 70-1.
[56] Grueterich M, Tseng SC. Human limbal progenitor cells expanded on intact amniotic membrane ex vivo. Arch Ophthalmol 2002 ; 120 : 783-90.
[57] Nakamura T, Kinoshita S. New hopes and strategies for the treatment of severe ocular surface disease. Curr Opin Ophthalmol 2011 ; 22 : 274-8.
[58] Sheha H, Liang L, Li J, et al. Sutureless amniotic membrane transplantation for severe bacterial keratitis. Cornea 2009 ; 28 : 1118-23.
[59] Heiligenhaus A, Li H, Hernandez Galindo EE, et al. Management of acute ulcerative and necrotising herpes simplex and zoster keratitis with amniotic membrane transplantation. Br J Ophthalmol 2003 ; 87 : 1215-9.
[60] Shi W, Chen M, Xie L. Amniotic membrane transplantation combined with antiviral and steroid therapy for herpes necrotizing stromal keratitis. Ophthalmology 2007 ; 114 : 1476-81.
[61] Bourcier T, Patteau F, Borderie V, et al. Intérêt de la greffe de membrane amniotique dans le traitement des kératites amibiennes sévères. Can J Ophthalmol 2004 ; 39 : 621-31.
