Surface oculaire et lentilles
G. Boulanger, M.-N. George
Les lentilles de contact interagissent avec la surface oculaire. Il est important de différencier les changements physiologiques qui sont acceptables de ceux qui sont pathologiques et qui peuvent être source de potentiels effets indésirables ou d’éventuelles complications. Par ailleurs, les lentilles de contact permettent dans certains cas de préserver, protéger ou restaurer la surface oculaire. De nombreuses innovations récentes visent à toujours mieux respecter la surface oculaire et ainsi à améliorer le confort des porteurs de lentilles. Cependant, encore et toujours, il faut insister sur la nécessité d’éduquer les patients afin de limiter les risques liés au mauvais entretien et au mauvais usage des lentilles.
Le rôle de l’épithélium cornéen est de former une barrière défensive entre le milieu extérieur et le stroma cornéen.
Les lentilles en hydrogel à faible coefficient de perméabilité en oxygène étaient connues pour leurs effets hypoxiques sur l’épithélium cornéen : hypercapnie, diminution de métabolisme épithélial, altération de la barrière épithéliale, modifications morphologiques des cellules épithéliales, acidose lactique pouvant provoquer un œdème épithélial microkystique et une néovascularisation cornéenne [1, 2]. L’essor des lentilles souples à haute perméabilité à l’oxygène, les lentilles en silicone hydrogel, a permis de s’affranchir des effets de l’hypoxie sur l’épithélium cornéen [1, 3, 4].
Le port journalier de lentilles de contact souples n’entraîne pas de modification de l’épaisseur de l’épithélium cornéen, à l’inverse du port continu qui provoque un amincissement de l’épithélium cornéen [5]. Concernant les lentilles en silicone hydrogel à forte perméabilité à l’oxygène, l’étude de l’épithélium cornéen au microscope confocal montre que le port continu entraîne un amincissement moindre contrairement aux lentilles hydrogel à faible perméabilité à l’oxygène [6]. En ce qui concerne les lentilles rigides perméables aux gaz (LRPG) à forte perméabilité à l’oxygène, celles-ci entraînent un petit amincissement de l’épithélium cornéen en port journalier. En cas de port continu, cet amincissement central augmente nettement initialement. Puis les cellules épithéliales s’adaptent et retrouvent au bout d’un an une épaisseur similaire au port journalier [7]. À noter que toutes les lentilles de contact induisent une augmentation de la surface des cellules épithéliales après un an de port continu [7, 8].
Le renouvellement cellulaire permet le maintien de la barrière épithéliale, ce qui protège le stroma de l’invasion par des micro-organismes. Le port de lentilles de contact, quel que soit le degré de perméabilité à l’oxygène ou le matériau souple ou rigide, entraîne un effet mécanique de ralentissement du renouvellement de l’épithélium cornéen. En effet, la prolifération des cellules épithéliales est plus lente et la desquamation des cellules superficielles est diminuée [7, 8].
Le port de lentille de contact induit des microtraumatismes de l’épithélium cornéen source d’un certain degré de réaction de cicatrisation. Les lentilles de contact à forte perméabilité à l’oxygène, utilisées parfois comme lentilles thérapeutiques, protègent l’épithélium cornéen du frottement des paupières et favorisent ainsi la cicatrisation cornéenne.
Le stroma cornéen assure la résistance mécanique de la cornée. Sa transparence, son renouvellement constant et ses facultés de cicatrisation sont des propriétés indispensables à l’homéostasie cornéenne.
Par le passé, les lentilles rigides en polyméthylméthacrylate (PMMA) et les lentilles souples peu perméables à l’oxygène étaient connues pour induire une déformation de la cornée d’origine à la fois mécanique et hypoxique appelée corneal warpage [9] qu’on ne devrait plus observer de nos jours.
Le port de lentilles, souples ou rigides, à haute perméabilité à l’oxygène n’entraîne pas de modification de la densité globale des kératocytes chez des patients normaux. Cependant, un remodelage stromal peut être observé au niveau de la répartition des kératocytes dans le stroma cornéen. En effet, le port de lentilles de contact induirait une diminution de densité des kératocytes dans le stroma antérieur pour les lentilles rigides à haute perméabilité à l’oxygène et dans le stroma postérieur pour les lentilles souples en silicone hydrogel [10]. Ce remodelage stromal ne serait pas lié à l’hypoxie [11] mais il serait secondaire à une production de médiateurs de l’inflammation tels que l’interleukine 8 (IL-8) et à la production d’epidermal growth factor (EGF) qui induiraient une apoptose plus précoce des kératocytes [10].
Toute lentille de contact induit un certain degré d’œdème cornéen corrélé au degré d’hypoxie induit. Avec les nouvelles générations de lentilles en silicone hydrogel à très haute perméabilité à l’oxygène, l’effet est négligeable : l’augmentation de l’épaisseur cornéenne induite est de moins de 1 % en port journalier [12] et de moins de 3 à 4,5 % en port continu sur 30 jours [13, 14].
Le rôle de l’endothélium est d’assurer une bonne transparence cornéenne. L’effet sur l’endothélium cornéen des lentilles de contact actuellement utilisées est très minime. La seule modification notable est une augmentation du polymégatisme endothélial. Le port journalier de lentille de contact est sans effet sur la densité endothéliale et sur les fonctions de barrière et de pompe endothéliales [15]. Seules les lentilles rigides en PMMA, aujourd’hui disparues en raison de l’hypoxie cornéenne qu’elles provoquaient, avaient montré une baisse notable de la densité cellulaire endothéliale et une altération de la pompe endothéliale [16].
Il est à noter que le port de lentille de contact induit un phénomène d’adaptation de l’endothélium cornéen. En effet, des « bulles endothéliales », visibles en microscopie confocale, apparaissent initialement quelques minutes après la pose des lentilles. Ces « bulles endothéliales » diminuent au bout de quelques minutes et seules quelques-unes persistent au long cours [17]. Ce phénomène d’adaptation, très faiblement observé avec les lentilles de haut Dk/e [18, 19], reste asymptomatique et semble n’avoir aucun retentissement clinique à long terme.
L’analyse au microscope confocal de porteurs de lentilles souples hydrogel met en évidence une augmentation du nombre de cellules de Langerhans à proximité du limbe [20] ainsi qu’un accroissement de la taille des cellules basales épithéliales [21]. Il existe encore peu d’études sur l’impact à long terme sur le limbe des lentilles en silicone hydrogel à haute perméabilité à l’oxygène. Les lentilles rigides, qui sont classiquement de petit diamètre et ne recouvrent pas le limbe, n’ont donc a priori pas d’interaction avec la physiologie du limbe, à condition d’être perméables à l’oxygène.
Les empreintes conjonctivales et l’analyse au microscope confocal de la conjonctive bulbaire des porteurs de lentilles souples asymptomatiques mettent en évidence plusieurs modifications cellulaires : amincissement des cellules épithéliales, augmentation de la densité des cellules épithéliales [21], métaplasie pavimenteuse fréquente [22]. Par ailleurs, la majorité des études constatent une diminution des mucocytes [23], mais cela reste controversé [21].
Le rôle du film lacrymal est d’assurer la nutrition de la surface cornéenne en lui apportant oxygène et nutriments, de lubrifier et protéger la surface oculaire contre les agents pathogènes, et de garantir une surface de qualité optique optimale.
Le port de lentille accroît l’évaporation du film lacrymal [24, 25] et réduit le temps de rupture du film lacrymal [25]. Le mécanisme en cause semble être une modification de la composition de la phase lipidique du film lacrymal, ce qui augmente son instabilité. La lentille de contact, en clivant le film lacrymal en deux, provoque un amincissement de la couche lipidique précornéenne située en arrière de la lentille et modifie la dynamique du film lacrymal. La stagnation des lipides derrière la lentille prolonge leur exposition à l’oxydation. De plus, les lipides peuvent se fixer sur la surface antérieure de la lentille, ce qui majore leur dégradation et diminue leur renouvellement. Les produits de cette dégradation diminuent la mouillabilité de la lentille, ce qui peut la rendre moins confortable [26]. Par ailleurs, après clignement des paupières, l’épaisseur du film lacrymal diminue lentement par évaporation ainsi que par d’autres mécanismes tels que la déshydratation et le gradient de tension de surface notamment [27]. Étant donné cette évaporation accélérée des larmes, le port de lentille de contact a tendance à majorer l’osmolarité du film lacrymal [28, 29].
De multiples événements peuvent détériorer la barrière anti-infectieuse que constitue naturellement la surface oculaire et favoriser la survenue d’une kératite infectieuse : altération de la barrière épithéliale ou de la qualité du film lacrymal, contamination des lentilles par un entretien inadapté ou insuffisant, augmentation de l’adhésion des germes aux cellules épithéliales, hypoxie, etc.
À l’inverse du port de LRPG, le port de lentilles souples quel que soit leur degré de perméabilité à l’oxygène, augmente significativement l’adhérence du Pseudomonas aeruginosa aux cellules épithéliales desquamées et réduit le renouvellement des cellules épithéliales. Cette adhérence est encore plus marquée en cas de port continu [30]. Cela explique pourquoi les lentilles en silicone hydrogel, même si elles ont permis de résoudre les complications hypoxiques, n’ont pas permis de diminuer l’incidence des kératites infectieuses et ne permettent pas un port continu dans de bonnes conditions de sécurité [31].
De plus, certaines solutions multifonctions utilisées pour l’entretien des lentilles en silicone hydrogel ont une action toxique sur la surface oculaire et notamment sur les cellules épithéliales cornéennes. En effet, elles induisent elles aussi une augmentation de l’adhérence du Pseudomonas aeruginosa aux cellules épithéliales desquamées. Cependant, l’utilisation de solutions d’entretien sans conservateur, tels que certains produits oxydants à base de peroxyde d’hydrogène, n’augmente pas l’adhérence du Pseudomonas aeruginosa aux cellules épithéliales desquamées [30, 32]. Le choix du couple lentille en silicone hydrogel et solution d’entretien est donc déterminant. La sécurité du porteur de lentille dépend de leur biocompatibilité.
Ces effets indésirables ne menacent pas l’avenir visuel du patient, mais peuvent être source d’inconfort. Il est important d’en connaître les signes et symptômes afin de les identifier et les traiter de façon appropriée. Le confort et la sécurité du port de lentille de contact sont les objectifs d’une adaptation réussie.
La kératite ponctuée superficielle ou corneal staining peut présenter des tableaux cliniques variés dont les particularités permettent d’évoquer des causes spécifiques à traiter.
Les principales formes cliniques sont détaillées ci-après.
Ce piqueté épithélial, de forme diffuse (fig. 10-1) ou en anneau périphérique, souvent bilatéral, évoque une atteinte toxique et/ou allergique liée à l’association entre le produit d’entretien et le matériau de lentille utilisé : produit inadéquat ou utilisé de façon inappropriée, mauvaise compatibilité entre la solution multifonction et la lentille. Il a été démontré que l’association lentilles en silicone hydrogel et solution oxydante à base de peroxyde d’hydrogène était de loin la moins pourvoyeuse de SICS [33].
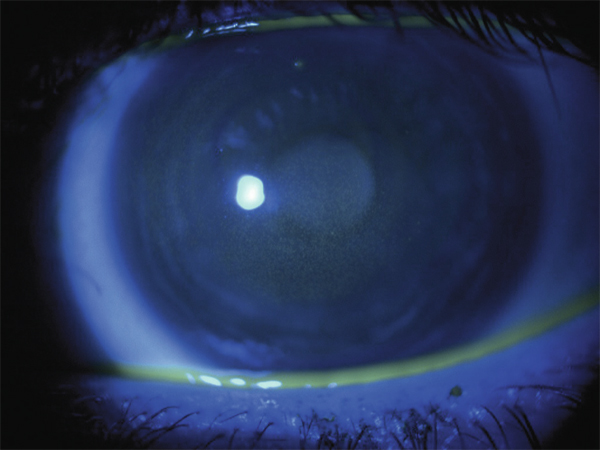
Fig. 10-1 Solution induced corneal staining (SICS).
Piqueté épithélial de forme diffuse évoquant une mauvaise compatibilité entre la solution multifonction et la lentille de contact.
Ce piqueté cornéen localisé, lié au port de lentille rigide, nécessite de rechercher un corps étranger collé à la face postérieure de la lentille ou un appui localisé en regard du piqueté épithélial, notamment sur les cornées irrégulières (au sommet d’un kératocône en particulier). Il est alors nécessaire de changer de rayon de courbure ou de géométrie de lentille afin de faire disparaître l’appui et d’obtenir une bonne clairance lacrymale dans la zone concernée.
Ce piqueté cornéen forme un demi-cercle inférieur (fig. 10-2). Il est évocateur d’une insuffisance de renouvellement des larmes sous la lentille. Il faut évaluer la qualité des larmes (break-up time, Schirmer, recherche de blépharite, etc.) et traiter en conséquence. On peut aussi se poser la question du rôle de la géométrie de la lentille dans ce tableau clinique.
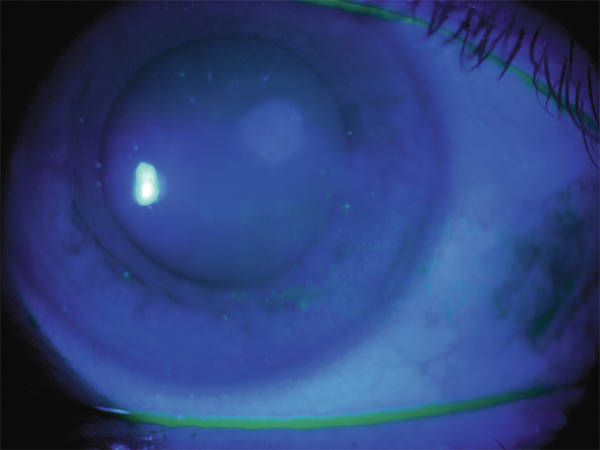
Fig. 10-2 Smile staining.
Piqueté épithélial inférieur arciforme évocateur d’une insuffisance de renouvellement des larmes sous la lentille.
Cet effet indésirable, souvent asymptomatique, est lié au port de lentilles souples le plus souvent en silicone hydrogel à fort module de rigidité [34]. En effet, le clignement de la paupière supérieure entraîne une pression plus marquée dans la partie supérieure de la cornée. Certaines cornées développent une kératite ponctuée superficielle supérieure arciforme assez caractéristique par sa forme et sa proximité du limbe. Pour mettre en évidence ce SEAL, il faut retirer la lentille et utiliser de la fluorescéine. Une hyperhémie conjonctivale supérieure y est le plus souvent associée. Pour traiter ce problème, il faut changer de matériau de lentille et favoriser un silicone hydrogel de faible module de rigidité. En cas de nouvel échec, il est parfois nécessaire de revenir à une lentille en hydrogel.
Cette kératite ponctuée superficielle périphérique située sur l’axe de 3 heures et 9 heures est caractéristique d’un moindre renouvellement des larmes sous la lentille rigide dans l’aire de la fente palpébrale. Le patient présente fréquemment une hyperhémie conjonctivale en regard ainsi qu’une sensation de corps étranger augmentant au fil de la journée. S’il existe un appui marqué sur un axe d’astigmatisme cornéen horizontal, il est recommandé de passer à une lentille rigide torique postérieure afin d’améliorer l’alignement de la lentille sur la forme de la cornée. Sinon, il est conseillé de modifier la lentille rigide en changeant de diamètre ou en aplatissant la périphérie de la lentille. Si, en revanche, l’adaptation de la lentille est satisfaisante, ce syndrome 3 heures-9 heures est souvent constaté en présence d’une fréquence insuffisante de clignements. Des substituts lacrymaux peuvent alors être utilisés de façon très occasionnelle.
Le patient se plaint soit d’un simple inconfort, soit d’une sensation d’irritation ou de corps étranger. Ces érosions de cornée d’origine mécanique, plus fréquentes avec les lentilles rigides, ont la particularité d’être le plus souvent striées et superficielles. À l’examen à la lampe à fente, il est important d’examiner la lentille portée. Il faut alors rechercher un corps étranger sous la lentille (qui est parfois collée), un bord de lentille ébréché ou une lentille fendue (fig. 10-3) ou déchirée. L’arrêt du port de lentille pendant quelques jours et son remplacement, associé à un agent hydratant, permettent de résoudre le problème. En cas d’érosion cornéenne marquée, une couverture par antibiothérapie topique en cure brève peut être nécessaire. Il est important de prévenir les porteurs de lentilles rigides de ce problème qu’ils doivent savoir prévenir et gérer en particulier grâce aux mesures suivantes : porter des lunettes protectrices en ambiance poussiéreuse ; porter des lunettes de soleil par-dessus les lentilles pour les sports d’extérieur à risque ; au moindre doute, retirer une lentille qui gêne si le simple clignement et le larmoiement réflexe ne permettent pas de résoudre le problème.

Fig. 10-3 Lentille rigide fendue et érosion épithéliale en regard.
Si de petites bulles d’air restent captives sous la lentille rigide, celles-ci laissent leur empreinte dans l’épithélium cornéen (fig. 10-4 et 10-5). Cette empreinte, appelée frooth, est visualisable après instillation de fluorescéine, mais reste fluo-lavable car la barrière épithéliale est intacte. Ce phénomène, qui est le plus souvent périphérique supérieur, s’explique par un défaut d’alignement de la lentille par rapport à la cornée. Le patient est parfois gêné par une sensation d’inconfort qui s’explique par la dessiccation de l’épithélium en regard. Si le frooth atteint la zone optique de la lentille, il peut être source de gêne visuelle. Pour remédier au frooth, il faut réadapter la lentille : choisir une lentille plus cambrée et/ou plus petite, refermer les dégagements périphériques.

Fig. 10-4 Frooth sous lentille rigide.
De petites bulles d’air restent captives sous la lentille rigide, laissant leur empreinte dans l’épithélium cornéen.

Fig. 10-5 Frooth central sous lentille rigide de grand diamètre.
L’empreinte des bulles d’air captives est colorée à la fluorescéine.
Ce phénomène est observable principalement avec les lentilles rigides, mais aussi parfois avec les lentilles souples. Si une lentille rigide est trop serrée, elle perd de la mobilité puis finit par rester immobile et complètement ventousée. Les porteurs de lentilles rigides se plaignent peu de ce phénomène initialement, car la lentille étant peu mobile, elle est plutôt confortable. Cependant, au fil de la journée, le confort diminue et une forte hyperhémie conjonctivale peut apparaître. En effet, il n’y a plus de possibilité de renouvellement du film lacrymal et un certain degré d’hypoxie existe. À la lampe à fente, on peut observer des zones de kératite ponctuée superficielle là où le renouvellement des larmes est insuffisant ainsi qu’en cas de frottement répété des bords de la lentille (fig. 10-6). Parfois, la fluorescéine ne passe plus du tout sous la lentille (fig. 10-7). Le retrait de la lentille peut être difficile étant donné l’adhérence forte à la cornée. La lentille laisse une empreinte visible sur la surface oculaire (fig. 10-8). Si la lentille reste totalement immobile et décentrée, le clignement des paupières ne permet pas d’hydrater correctement la cornée située à proximité de la lentille ; on peut alors observer une ulcération épithéliale par effet dellen (fig. 10-9).
Ce problème survient plus fréquemment avec des lentilles rigides de grand diamètre ou lorsqu’une lentille se décentre et se retrouve alors dans une zone de la cornée qui n’est plus en adéquation avec la géométrie de la lentille. Il convient d’aplatir la lentille et d’ouvrir les dégagements périphériques. Parfois, un changement de diamètre ou de géométrie est nécessaire. Dans tous les cas, une lentille rigide bien adaptée doit être mobile.
Concernant les lentilles souples adaptées trop serrées, le patient se plaint là aussi d’un inconfort en fin de journée. À l’examen à la lampe à fente, la lentille est peu mobile, comprime et mobilise les vaisseaux conjonctivaux en se déplaçant. Par ailleurs, une hyperhémie conjonctivale apparaît en fin de journée. Au retrait de la lentille, il existe une empreinte conjonctivale et parfois une kératite ponctuée superficielle associée, toutes deux bien visualisées après instillation de fluorescéine. Il est nécessaire d’augmenter le rayon de courbure de la lentille souple pour traiter ce problème.

Fig. 10-6 Kératite ponctuée superficielle en bordure de lentille rigide trop serrée due à un moindre renouvellement des larmes ainsi qu’au frottement répété des bords de la lentille.

Fig. 10-7 Lentille rigide ventousée.
La fluorescéine passe difficilement dessous la lentille

Fig. 10-8 Empreinte laissée par une lentille rigide décentrée et ventousée.

Fig. 10-9 Ulcération épithéliale par effet dellen.
Comme la lentille reste totalement immobile et décentrée, le clignement des paupières ne permet pas d’hydrater correctement la cornée située à proximité de la lentille.
Il s’agit d’une irritation chronique de l’épithélium de la conjonctive tarsale située à proximité du bord libre de la paupière supérieure, appelée par les Anglo-Saxons lid wiper epitheliopathy (LWE), ou « épithéliopathie en essuie-glace ». Après éversion de la paupière supérieure, on peut constater que la conjonctive tarsale est le siège d’un piqueté conjonctival, coloré par la fluorescéine et le vert de lissamine, formant une ligne horizontale le long du bord libre. Ce phénomène serait très fréquemment observé chez les porteurs de lentille souples ayant une sensation d’œil sec sans pour autant avoir d’altération du temps de rupture du film lacrymal ou du test de Schirmer [35]. Le clignement incomplet, en détériorant l’hydratation de la lentille et de la surface oculaire, favoriserait ensuite le microtraumatisme répété du bord libre palpébral [26]. Pour remédier à cet inconfort, il faut améliorer le clignement et utiliser des substituts lacrymaux si nécessaire.
Il s’agit de plis au niveau de la conjonctive bulbaire visualisables à proximité du limbe. Ceux-ci sont témoins d’un certain degré d’altération de la qualité des larmes et apparaissent fréquemment chez les porteurs de lentilles souples ressentant une sensation d’œil sec. La friction répétée de la lentille sur la conjonctive provoque ces petits plis conjonctivaux. Ce phénomène est significativement corrélé à la LWE [36], ce qui peut refléter leur origine commune : la friction excessive de la lentille exercée sur la conjonctive bulbaire et tarsale en cas de clignement incomplet ou insuffisant.
Par rapport au tableau clinique précédent (lentille ventousée ou trop serrée), le syndrome de serrage sous lentille est un tableau beaucoup plus aigu. Il survient au réveil après que le patient a dormi avec ses lentilles. Ce dernier présente un œil rouge, très douloureux et larmoyant. À l’examen à la lampe à fente, la lentille est totalement immobile et paraît très serrée, la conjonctive est très hyperhémiée, de petits infiltrats cornéens périphériques sont fréquents. Au retrait de la lentille, on constate que la lentille souple a laissé une empreinte très forte sur la conjonctive, et la cornée est le siège d’une kératite ponctuée superficielle d’origine hypoxique. Dans cette situation, il faut rééquiper en lentille souple en silicone hydrogel moins serrée et proscrire le port permanent. Une lentille souple bien adaptée doit être mobile.
Ces dépôts à la surface des lentilles sont source de flou visuel et d’inconfort, notamment en fin de journée, car ils majorent l’hydrophobie de la lentille et diminuent donc sa mouillabilité [37]. Ils peuvent induire des réactions inflammatoires immuno-allergiques provoquées par les protéines dénaturées fixées à la surface des lentilles, source d’intolérance aux lentilles. Parfois cependant, ces dépôts restent asymptomatiques. Il faut savoir les traiter car ceux-ci sont un substrat à l’adhésion bactérienne sur les lentilles, notamment au Pseudomonas aeruginosa [38].
Concernant les lentilles souples, les lentilles en hydrogel sont plus pourvoyeuses de dépôts protéiques alors que les lentilles en silicone hydrogel entraînent plus de dépôts lipidiques.
Les dépôts sont dus à une adhésion des lipides produits par les glandes de Meibomius ou des protéines des larmes à la surface des lentilles (fig. 10-10). Il peut parfois s’agir de particules de maquillage, notamment en cas de maquillage du bord libre. Un entretien insuffisant et inadéquat des lentilles est souvent en cause : absence de massage des lentilles le soir, non-respect du renouvellement des lentilles dont il faut augmenter la fréquence de renouvellement, trop longue durée de port, voire port continu, mauvaise compatibilité entre la lentille et la solution d’entretien. Il faut donc modifier le couple lentille–solution d’entretien, proposer une déprotéinisation active pour les lentilles dont la fréquence de renouvellement est supérieure à 1 mois, traiter une blépharite et proscrire le maquillage du bord libre.
Concernant les lentilles rigides, les dépôts peuvent être lipidiques ou protéiques. Ces derniers sont parfois plus faciles à visualiser si l’on maintient les paupières afin d’empêcher le clignement, ce qui permet d’assécher la lentille. Il apparaît alors à la surface de la lentille un film blanchâtre relativement opaque et parfois craquelé (fig. 10-11). La déprotéinisation des lentilles rigides a pour but de dissoudre les dépôts protéiques. La plupart des déprotéinisants vendus dans le commerce sont à utiliser de façon hebdomadaire. Les lentilles rigides à très haut coefficient de perméabilité à l’oxygène sont plus pourvoyeuses de dépôts que les autres. Il est alors parfois nécessaire de diminuer le Dk/e des lentilles pour résoudre le problème. Les lentilles rigides se renouvellent habituellement tous les 1 ou 2 an(s) suivant l’altération de la surface de la lentille. Une lentille dont la surface est abîmée ou rayée fixe plus rapidement les dépôts. Un clignement palpébral insuffisant favorise le séchage des larmes sur la lentille et donc son encrassement.
Le port de lentilles de contact rigides de façon prolongée peut induire fréquemment un abaissement minime de 0,5 mm en moyenne de la paupière supérieure. Cependant, plus rarement, de véritables ptosis acquis peuvent être consécutifs au port de lentilles de contact rigides [39]. Ce serait même la cause la plus fréquente de ptosis acquis chez le sujet jeune [40]. La traction répétée du releveur de la paupière supérieure au retrait des lentilles serait en lien avec une désinsertion précoce de l’aponévrose du releveur. Le traitement est chirurgical.
La conjonctive tarsale peut être le siège de volumineuses papilles (fig. 10-12) entraînant une sensation de prurit et de corps étranger associée à une forte sécrétion muqueuse. La physiopathologie est complexe, à la fois d’origine mécanique et immuno-allergique [41]. L’inflammation peut être très importante. Les facteurs de risque sont : l’atopie, l’âge jeune, le port prolongé ou permanent, la présence de dépôts sur les lentilles, une lentille rigide de grand diamètre, un renouvellement insuffisant des lentilles, un entretien mal conduit. Un petit syndrome sec et une dysfonction meibomienne sont souvent associés. Ce phénomène concerne aussi bien les lentilles souples (hydrogel et silicone hydrogel) que les LRPG.
Le traitement est multiple et vise à diminuer les facteurs mécaniques et immuno-allergiques.
Lentilles souples : accélérer le renouvellement des lentilles et passer si possible aux lentilles jetables journalières, ce qui permet de supprimer le produit d’entretien de surcroît. Favoriser les lentilles ayant un faible module de rigidité afin de limiter l’irritation mécanique.
Lentilles rigides : modifier le diamètre, changer de matériau, préférer un Dk/e moyen afin de limiter les dépôts protéiques.
Proscrire le port continu, éviter le port prolongé.
Améliorer l’entretien : les solutions oxydantes permettent de limiter au maximum les risques d’allergie. Sinon, préférer une solution multifonction sans conservateur. Masser et rincer les lentilles souples tous les jours, pour éviter les dépôts. Certains préconisent de rincer les lentilles au sérum physiologique avant la pose.
Traiter la surface oculaire : traiter la blépharite associée, faire des lavages oculaires abondants au sérum physiologique à l’ablation de la lentille afin de bien rincer les culs-de-sac. Utiliser des collyres anti-allergiques antihistaminiques et/ou antidégranulants mastocytaires de préférence sans conservateur. L’usage des corticoïdes locaux est très discuté, principalement à cause de ses effets secondaires et de la forte corticodépendance induite.
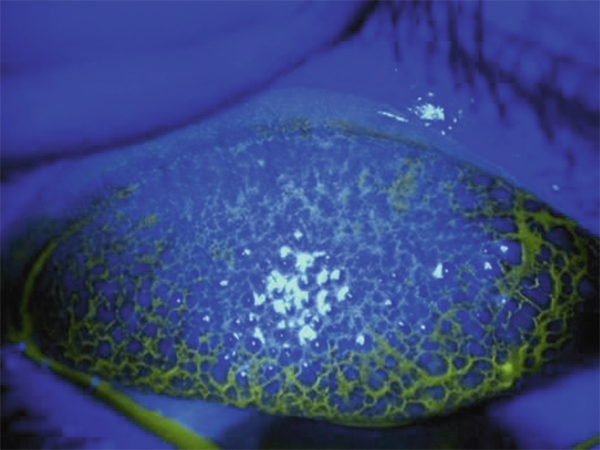
Fig. 10-12 Conjonctivite gigantopapillaire.
La conjonctive tarsale est le siège de volumineuses papilles entraînant une sensation de prurit et de corps étranger.
Il s’agit d’une kératoconjonctivite induite par les lentilles de contact. Le tableau est aigu : œil rouge douloureux au réveil chez un patient ayant porté ses lentilles la nuit en port continu.
En effet, pendant le port nocturne des lentilles, les paupières sont fermées et la sécrétion active des larmes ainsi que leur renouvellement cessent. Il en découle une diminution de certains agents antibactériens tels que le lysozyme et la lactoferrine ainsi qu’une augmentation des médiateurs de l’inflammation. La colonisation bactérienne des lentilles est donc favorisée, notamment par certaines bactéries à Gram négatif telles que le Pseudomonas aeruginosa. Celui-ci relargue des endotoxines qui engendrent une très forte réaction inflammatoire d’hypersensibilité au niveau de la surface oculaire [42].
Le patient se réveille avec une sensation de corps étranger, voire une forte douleur, un larmoiement et une photophobie marquée. À l’examen, on observe un cercle périkératique associé le plus souvent à des infiltrats sous-épithéliaux focaux ou diffus. Ceux-ci ne fixent habituellement pas la fluorescéine et disparaissent rapidement à l’arrêt du port de lentilles associé à un traitement lubrifiant. Une vigilance accrue est de mise durant les 24 premières heures, afin de confirmer le diagnostic. Ne pas hésiter à ajouter une couverture antibiotique topique au moindre doute [43].
Ces infiltrats sont sous-épithéliaux, parfois situés dans le stroma antérieur. Ils sont le plus souvent périphériques à proximité du limbe. Plus rarement, ils sont situés plus au centre de la cornée. Ils peuvent être solitaires ou multiples (fig. 10-13). Ils provoquent souvent une irrégularité épithéliale en regard et fixent rarement la fluorescéine. Une petite réaction conjonctivo-limbique en regard est fréquente. Ils cicatrisent en quelques jours en laissant le plus souvent une petite cicatrice stromale. Ces infiltrats peuvent être parfaitement asymptomatiques ou au contraire être source d’une sensation d’irritation. Ils sont favorisés par le port continu, mais sont aussi fréquemment retrouvés chez les porteurs diurnes.
Sur le plan physiopathologique, il s’agit d’une réaction inflammatoire d’hypersensibilité contre des exotoxines sécrétées par des bactéries à Gram positif telles que Staphylococcus spp. et Streptococcus spp. présents notamment au niveau du bord libre palpébral, et parfois par des bactéries à Gram négatif [43, 44]. Ces infiltrats seraient plus fréquemment retrouvés chez les porteurs de lentilles souples car ces exotoxines peuvent imprégner les lentilles de contact et être retrouvées à de grandes concentrations au contact de la cornée.
L’interruption du port des lentilles jusqu’à résolution complète de l’infiltrat est de mise. Des lubrifiants cornéens pourront y être associés. Une surveillance attentive sera nécessaire pendant les 24 premières heures afin de vérifier l’absence de surinfection. Une couverture antibiotique est souhaitable au moindre doute. Certains auteurs proposent une corticothérapie locale afin de traiter la réaction inflammatoire. Une grande prudence s’impose devant le risque de favoriser le développement d’une infection microbienne non diagnostiquée [45]. Il est important d’y adjoindre un traitement de toute pathologie du bord libre pouvant favoriser l’accumulation de bactéries à Gram positif : blépharite, chalazion, orgelet, etc. Il est important de jeter la lentille, le boîtier et le produit d’entretien utilisés afin de réduire le risque de contamination, de favoriser le port diurne et le renouvellement fréquent. Un entretien par oxydant semble moins pourvoyeur d’infiltrats que la plupart des solutions multifonctions [46].

Fig. 10-13 Infiltrats stériles sous-épithéliaux sous lentille provoquant une irrégularité épithéliale en regard et fixant discrètement la fluorescéine.
Il s’agit d’une lésion épithéliale supérieure proche du limbe d’origine mécanique. Au retrait de la lentille, une fine ligne arciforme aux bords irréguliers est visible et fixe la fluorescéine. Quelques petits infiltrats sous-épithéliaux peuvent y être associés. Cette irritation mécanique est souvent asymptomatique. Parfois, les patients ressentent une sensation d’irritation après le retrait des lentilles. Ce phénomène, même s’il a été observé avec différents types de lentilles souples, est plus fréquemment lié aux lentilles en silicone hydrogel de première génération. En effet, leur rigidité est relativement plus importante que les lentilles en hydrogel. Il est conseillé d’interrompre le port des lentilles quelques jours et de rééquiper avec des lentilles en silicone hydrogel possédant un module d’élasticité plus important. Un changement de rayon peut aussi améliorer la situation [34, 43].
Certains patients peuvent présenter une réaction immuno-allergique au produit d’entretien utilisé. Cette hypersensibilité peut être de type retardé ou immédiat. Elle survient généralement après plusieurs semaines d’utilisation. Un terrain atopique est fréquemment retrouvé. Le patient présente un prurit oculaire marqué, un larmoiement, une photophobie, une rougeur oculaire et parfois un gonflement des paupières. À l’examen, on retrouve une forte hyperhémie conjonctivale bilatérale avec parfois un petit chémosis. Plus rarement, une kératite ponctuée superficielle ou quelques infiltrats inflammatoires sous-épithéliaux y sont associés.
L’arrêt du port de lentille pendant quelques jours entraîne une normalisation de la symptomatologie. L’utilisation ultérieure d’un système oxydant présente l’avantage d’exclure le conservateur. On peut aussi recourir à des lentilles jetables journalières afin de supprimer totalement la solution d’entretien des lentilles.
Il faut savoir distinguer ce tableau clinique d’une réaction de toxicité chronique liée à la solution d’entretien (SICS), réaction le plus souvent asymptomatique. Le tableau est alors moins aigu, présent peu de temps après la pose des lentilles, avec une kératite ponctuée superficielle diffuse ou en anneau périphérique au premier plan.
Grâce à la disponibilité de lentilles hautement perméables à l’oxygène, les complications hypoxiques ne devraient plus être d’actualité aujourd’hui. En effet, depuis la seconde moitié des années 1970, des LRPG sont disponibles sur le marché et les premières lentilles souples en silicone hydrogel datent de 1999. Les gammes de lentilles souples en silicone hydrogel s’élargissent petit à petit, avec plus récemment l’apparition de lentilles jetables journalières.
Cette complication est devenue très rare aujourd’hui, en raison de la haute perméabilité à l’oxygène des lentilles actuelles. Elle peut néanmoins survenir en cas de port inadapté. En effet, le port nocturne d’une lentille souple de bas DK/e, surtout si elle est épaisse (lentille d’aphake ou d’hypermétrope fort), peut provoquer une hypoxie aiguë. Actuellement, cela peut être observé lors du port nocturne de lentilles cosmétiques dites « festives » ou à « effets spéciaux ». Ces lentilles étant bien souvent portées sans aucune surveillance médicale ni aucune recommandation particulière, il n’est pas rare que les patients dorment avec. Ces lentilles en HEMA (méthacrylate d’hydroxyéthyle) ont bien souvent un taux de perméabilité à l’oxygène extrêmement bas, allant de 8 à 14. Le tableau clinique est celui d’un œil rouge douloureux avec baisse d’acuité visuelle. À l’examen, on observe des érosions cornéennes multiples sur toute la surface cornéenne, associées souvent à un œdème stromal avec plis de Descemet (fig. 10-14 et 10-15). L’œdème cornéen disparaît en règle générale quelques heures après l’ablation de la lentille [47].

Fig. 10-14 Hypoxie aiguë après port continu de lentille cosmétique peu perméable à l’oxygène.

Fig. 10-15 Hypoxie aiguë après port continu de lentille cosmétique peu perméable à l’oxygène.
Au retrait de la lentille, on observe une érosion cornéenne centrale, un œdème stromal avec plis de Descemet ainsi qu’une forte hyperhémie conjonctivale.
Plusieurs signes sont évocateurs d’hypoxie chronique : les microkystes épithéliaux, les micro-opacités cornéennes, les néovaisseaux cornéens.
Visibles en microscopie confocale, les microkystes épithéliaux, de petite taille, sont situés en moyenne périphérie cornéenne dans les couches profondes de l’épithélium. Il s’agit de zones localisées d’apoptose cellulaire. La réadaptation en lentilles de haut Dk/e peut entraîner une augmentation transitoire de ces microkystes régressant au bout de 3 mois [48, 49].
Visibles à la lampe à fente, les micro-opacités cornéennes sont situées dans le stroma profond central. Elles sont rares et seraient liées à l’acidose et à l’hypoxie chronique engendrées par le port prolongé depuis de nombreuses années de lentilles non perméables à l’oxygène [50]. Elles sont généralement asymptomatiques mais peuvent provoquer une baisse d’acuité visuelle si elles sont nombreuses. L’arrêt du port de lentilles ou le rééquipement en LRPG peut parfois permettre de diminuer l’opacité cornéenne.
Actuellement, les néovaisseaux cornéens périphériques sont le plus souvent retrouvés chez des porteurs de lentilles en hydrogel de bas Dk/e depuis plus de 15 ans, notamment chez les patients forts myopes équipés en lentilles souples peu perméables à l’oxygène (fig. 10-16 et 10-17). Les bords épais de ces lentilles de myope fort limitent la transmission de l’oxygène au niveau du limbe. Un facteur de risque supplémentaire est le port extensif voire continu car il aggrave l’hypoxie. Si la néovascularisation cornéenne progresse, une baisse d’acuité visuelle est possible par perte de la transparence cornéenne. Des cas de déficits en cellules souches limbiques ont été décrits par le passé, uniquement avec des lentilles souples, mais sont aujourd’hui très rares [51].
À l’inverse, les lentilles en silicone hydrogel, grâce à leurs Dk/e plus élevés, assurent une oxygénation limbique bien supérieure et n’induisent donc pas de néovascularisation cornéenne périphérique [52]. À noter qu’en plus de l’hypoxie chronique, une réaction inflammatoire au niveau du limbe est souvent en cause dans l’apparition des néovaisseaux cornéens périphériques. En effet, l’augmentation des lentilles souples à renouvellement fréquent a permis de faire diminuer de façon importante les cas de néovaisseaux cornéens périphériques. Il est probable qu’en augmentant la fréquence de renouvellement des lentilles, cela diminue l’inflammation réactionnelle aux dépôts de protéines dénaturées sur les lentilles.
Les néovaisseaux cornéens sont extrêmement rares chez les porteurs de LRPG, car dans la majorité des cas celles-ci ne recouvrent pas le limbe et permettent donc une bonne oxygénation du limbe [53]. Il est donc important de rééquiper ces patients en lentilles à haute perméabilité à l’oxygène de type souple ou rigide, afin de faire régresser cette néovascularisation cornéenne, ainsi que l’hyperhémie limbique qui lui est souvent associée [54, 55] : au bout d’un mois, ces néovaisseaux commencent déjà à régresser [56]. Il est aussi recommandé de diminuer la durée de port. Il est à noter que les patients myopes forts présentant une néovascularisation cornéenne associée à des lentilles souples de faible Dk/e sont facilement rééquipables en LRPG de hauts Dk/e. En effet, leur inconfort avec les lentilles souples est tel qu’ils retrouvent très vite un réel confort aussi bien du point de vue visuel que du point de vue de la tolérance. La période d’accoutumance aux lentilles rigides est alors particulièrement courte.

Fig. 10-16 Néovaisseaux cornéens périphériques chez un patient myope fort porteur de lentilles souples hydrogel depuis 20 ans.

Fig. 10-17 Néovaisseaux cornéens périphériques signes d’hypoxie chronique et/ou d’inflammation sous lentille souple.
Cette complication ne devrait plus être constatée de nos jours : il s’agit d’une déformation de la cornée d’origine principalement hypoxique mais aussi mécanique. Le rôle des lentilles rigides non perméables à l’oxygène en PMMA est bien connu, mais il faut savoir que le corneal warpage peut aussi être lié à des lentilles souples peu perméables à l’oxygène. Le diagnostic est topographique. La déformation cornéenne est assez polymorphe. Elle dépend de la position de repos de la lentille rigide ou des appuis cornéens d’une lentille rigide mal adaptée. La forme topographique la plus connue est le classique bombement inférieur pouvant faire évoquer à tort un kératocône débutant. L’arrêt du port de lentille ou le rééquipement en lentilles perméables à l’oxygène permet de faire diminuer la déformation cornéenne en quelques semaines.
Si les lentilles en silicone hydrogel ont permis de faire disparaître les complications hypoxiques, elles n’ont pas permis pour autant de diminuer l’incidence des kératites infectieuses. Cependant, la sévérité des kératites infectieuses survenues avec des lentilles en silicone hydrogel est significativement moins importante que celles survenues avec des lentilles hydrogels [31, 57, 58]. Le port nocturne des lentilles reste associé à un risque nettement plus grand de kératites infectieuses puisqu’il est estimé à 20 cas par an pour 10 000 porteurs en port continu, au lieu de 2 à 4 cas par an pour 10 000 porteurs en port journalier [31, 59, 60]. Les LRPG sont les moins pourvoyeuses de kératites infectieuses. Le sexe masculin et le tabagisme sont associés à une recrudescence des kératites infectieuses. De plus, un entretien inadapté des lentilles de contact est plus que jamais facteur de risque [31].
L’éducation des patients porteurs de lentille est donc toujours d’actualité : se laver les mains avant de manipuler les lentilles, masser et rincer les lentilles souples après la dépose, nettoyer les boîtiers à lentilles avec la solution d’entretien, les renouveler le plus souvent possible, respecter le rythme de renouvellement des lentilles, pas de contact entre les lentilles, le boîtier et l’eau douce notamment.
Les différents tableaux cliniques de kératites infectieuses ont été détaillés dans le . Voici néanmoins quelques spécificités liées au port de lentilles de contact.
Les bactéries les plus pourvoyeuses de kératites infectieuses sous lentilles sont les bactéries à Gram négatif, avec pour chef de file le Pseudomonas aeruginosa [61, 62] (fig. 10-18 et 10-19).
Les kératites bactériennes sous lentilles sont quasi systématiquement provoquées par l’association de facteurs favorisant l’invasion stromale, tels que notamment les microlésions épithéliales associées à la pose, la dépose ou le port des lentilles, ainsi que le contact prolongé avec des bactéries potentiellement pathogènes : entretien inadapté, défaut d’hygiène, etc.

Fig. 10-18Kératite bactérienne à Pseudomonas aeruginosa sous lentille souple.

Fig. 10-19Taie séquellaire de la kératite bactérienne à Pseudomonas aeruginosa du patient de la figure 10-18 traitée par collyres antibiotiques renforcés.
Le facteur de risque principal des kératites amibiennes (fig. 10-20) est le port de lentilles associé au contact avec l’eau : baignade avec les lentilles, lavage des lentilles ou du boîtier à l’eau du robinet ou à l’eau minérale, principalement. Ces kératites doivent être évoquées chez tout porteur de lentilles présentant un tableau de kératite infectieuse, car la rapidité de la mise en route du traitement en diminue la sévérité.

Fig. 10-20Kératite amibienne sévère sous lentille.
Ces champignons sont des germes opportunistes. Une effraction de la barrière épithéliale préexiste à l’infection fongique. Les germes les plus fréquents sont les Fusarium suivis des Aspergillus [63] (fig. 10-21). L’épidémiologie est variable selon la situation géographique : les kératites fongiques sont fréquentes dans les régions chaudes et humides comme l’Inde et bien plus rares dans les régions tempérées comme l’Europe.
Les principaux facteurs de risque d’infection fongique liée aux lentilles sont : l’absence de renouvellement quotidien du produit d’entretien dans le boîtier (topping off), l’absence de massage des lentilles souples, l’absence d’entretien et de renouvellement du boîtier favorisant la présence d’un biofilm, l’absence de lavage des mains avant la manipulation des lentilles [64].

Fig. 10-21 Kératite fongique sous lentille.
Les pathologies de la surface oculaire sont classiquement une contre-indication au port de lentilles. Il ne faut cependant pas méconnaître l’aide essentielle qu’elles peuvent apporter dans certains cas pour restaurer la surface oculaire ou préserver le confort de certains patients. Les propriétés bénéfiques des lentilles de contact sur la surface oculaire sont multiples.
L’effet protecteur des lentilles de contact peut être un traitement d’appoint dans les situations où la cornée est continuellement irritée par le clignement des paupières :
érosions cornéennes récidivantes par entropion et/ou cils trichiasiques ;
kératoconjonctivite vernale avec ulcère vernal [65] ;
après chirurgie palpébrale avec suture de la conjonctive tarsale (chirurgie de ptosis de Müller par exemple) afin de protéger la cornée contre le frottement des fils de suture ;
après greffe de membrane amniotique afin d’en retarder la résorption.
Les lentilles utilisées sont des lentilles souples en silicone hydrogel en port continu sous couvert d’une antibiothérapie préventive.
En protégeant l’épithélium cornéen, la lentille de contact guide et accélère la migration des cellules épithéliales dans les situations suivantes :
érosions épithéliales non infectieuses : ulcérations cornéennes traumatiques, kératalgies récidivantes post-traumatiques, après chirurgie réfractive par laser Excimer de surface, après crosslinking du collagène, etc. ;
plaies cornéennes de petites tailles comme alternative à la chirurgie lorsque la plaie est centrale et que la suture cornéenne risque de provoquer une baisse d’acuité visuelle ;
fistules conjonctivales après chirurgie filtrante : les lentilles souples de grand diamètre utilisées dans cette indication permettent de mieux coapter les berges conjonctivales et de favoriser la cicatrisation.
La lentille de contact protège les terminaisons nerveuses, isole la cornée de l’effet abrasif des paupières lors du clignement, accélère la cicatrisation épithéliale, ce qui permet de nettement diminuer l’intensité et la durée des douleurs en cas d’ulcération cornéenne [66]. Cette propriété antalgique est très utilisée dans les indications suivantes : dystrophies cornéennes épithéliales congénitales dont la dystrophie de Cogan, dystrophies bulleuses acquises, ulcérations traumatiques, kératalgies récidivantes post-traumatiques, après chirurgie réfractive par laser Excimer de surface, après crosslinking du collagène, etc.
Par ailleurs, cette propriété antalgique de la lentille de contact souple est très utile en cas d’intolérance aux lentilles de contact rigides. L’équipement en lentilles jumelées de type piggy-back consiste à interposer une lentille souple en silicone hydrogel entre la cornée et la lentille rigide. Cet équipement a l’avantage d’améliorer nettement le confort du patient et la stabilité de la lentille rigide, et de limiter l’irritation cornéenne liée aux passages de poussières sous la lentille rigide. Il faut veiller à ce que chaque lentille (souple et rigide) soit mobile et que l’entretien des lentilles soit optimal afin de limiter au maximum les risques d’infection chez ces patients aux cornées souvent vulnérables.
En cas de lagophtalmie nocturne, le port nocturne de lentilles de contact en silicone hydrogel peut aider à traiter les kératites ponctuées superficielles inférieures induites par l’exposition répétée des larmes à l’évaporation.
Par ailleurs, les verres scléraux perméables à l’oxygène permettent de maintenir constamment un film lacrymal au contact de la cornée tout en limitant son évaporation. Ces atouts sont très utiles dans les atteintes sévères de la surface oculaire [67] :
syndromes secs majeurs : réaction de rejet du greffon contre l’hôte (ou graft versus host [GVH] syndrome), syndrome de Gougerot-Sjögren sévère, kératites neurotrophiques, etc. ;
destruction de la surface oculaire : syndrome de Lyell, syndrome de Stevens-Johnson, brûlure oculaire, pemphigoïde oculaire notamment ;
lagophtalmie sévère avec forte exposition cornéenne : paralysie faciale.
L’orthokératologie, ou technique du remodelage cornéen utilisée pour réduire ou corriger la myopie par le port nocturne de lentilles rigides de géométrie spécifique réalisées dans des matériaux à haute perméabilité à l’oxygène, induit des modifications épithéliales et stromales. Les lentilles utilisées ont un rayon de courbure central plus plat que le rayon cornéen, et produiraient, selon les auteurs, deux types d’effets :
une modification de la courbure cornéenne, qui tend à en diminuer l’excentricité [68] ;
une redistribution du tissu cornéen antérieur, avec modification de l’épaisseur de l’épithélium [69], qui présente un amincissement progressif central et un épaississement progressif périphérique, sans migration des cellules épithéliales ni atteinte des desmosomes. Le stroma est lui aussi modifié, en regard de la zone de traitement, et présente un épaississement en moyenne périphérie, jouxtant la zone centrale d’aplatissement [70].
Ces modifications sont réversibles à l’arrêt du traitement.
Les lentilles de contact peuvent rendre d’immenses services, dans un certain nombre de cas, pour préserver, protéger ou restaurer la surface oculaire, mais dans tous les cas elles interagissent avec celle-ci. De nombreuses innovations récentes visent à toujours mieux respecter la surface oculaire et à améliorer ainsi le confort des porteurs de lentilles :
lentilles silicone hydrogel hautement perméables à l’oxygène ;
développement du renouvellement fréquent : élargissement des gammes disponibles de lentilles jetables journalières, bimensuelles et mensuelles ;
amélioration des produits d’entretien : utilisation de conservateurs moins toxiques et d’agents hydratants, utilisation d’ions argentiques dans le boîtier à lentille afin de lutter contre la formation du biofilm ;
amélioration des matériaux de lentille : recherches sur la possibilité d’intégrer un antibactérien dans la lentille.
Cependant, encore et toujours, il faut insister sur la nécessité d’éduquer les patients afin de limiter les risques liés au mauvais entretien et au mauvais usage des lentilles.
[1] Fonn D, MacDonald KE, Richter D, Pritchard N. The ocular response to extended wear of a high Dk silicone hydrogel contact lens. Clin Exp Optom J Aust Optom Assoc 2002 ; 85 : 176-82.
[2] Liesegang TJ. Physiologic changes of the cornea with contact lens wear. CLAO J Off Publ Contact Lens Assoc Ophthalmol Inc 2002 ; 28 : 12-27.
[3] Lin MC, Graham AD, Polse KA, et al. The effects of one-hour wear of high-Dk soft contact lenses on corneal pH and epithelial permeability. CLAO J Off Publ Contact Lens Assoc Ophthalmol Inc 2000 ; 26 : 130-3.
[4] Stapleton F, Stretton S, Papas E, et al. Silicone hydrogel contact lenses and the ocular surface. Ocul Surf 2006 ; 4 : 24-43.
[5] Bourne WM. The effect of long-term contact lens wear on the cells of the cornea. CLAO J Off Publ Contact Lens Assoc Ophthalmol Inc 2001 ; 27 : 225-30.
[6] Jalbert I, Stapleton F. The corneal stroma during contact lens wear. Contact Lens Anterior Eye J Br Contact Lens Assoc 2005, 28 : 3-12.
[7] Ladage PM, Yamamoto K, Li L, et al. Corneal epithelial homeostasis following daily and overnight contact lens wear. Contact Lens Anterior Eye J Br Contact Lens Assoc 2002 ; 25 : 11-21.
[8] Cavanagh HD. The effects of low- and hyper-Dk contact lenses on corneal epithelial homeostasis. Ophthalmol Clin N Am ; 2003, 16 : 311-25.
[9] Schornack M. Hydrogel contact lens-induced corneal warpage. Contact Lens Anterior Eye J Br Contact Lens Assoc 2003 ; 26 : 153-9.
[10] Kallinikos P, Efron N. On the etiology of keratocyte loss during contact lens wear. Invest Ophthalmol Vis Sci 2004 ; 45 : 3011-20.
[11] Efron N, Perez-Gomez I, Morgan PB. Confocal microscopic observations of stromal keratocytes during extended contact lens wear. Clin Exp Optom J Aust Optom Assoc 2002 ; 85 : 156-60.
[12] Efron N. Contact lens-induced changes in the anterior eye as observed in vivo with the confocal microscope. Prog Retin Eye Res 2007 ; 26 : 398-436.
[13] Fonn D, du Toit R, Simpson TL, et al. Sympathetic swelling response of the control eye to soft lenses in the other eye. Invest Ophthalmol Vis Sci 1999 ; 40 : 3116-21.
[14] Yeniad B, Adam YS, Bilgin LK, Gözüm N. Effect of 30-day continuous wear of silicone hydrogel contact lenses on corneal thickness. Eye Contact Lens 2004 ; 30 : 6-9.
[15] Bourne WM. The effect of long-term contact lens wear on the cells of the cornea. CLAO J Off Publ Contact Lens Assoc Ophthalmol Inc 2001 ; 27 : 225-30.
[16] McMahon TT, Polse KA, McNamara N, Viana MA. Recovery from induced corneal edema and endothelial morphology after long-term PMMA contact lens wear. Optom Vis Sci Off Publ Am Acad Optom 1996 ; 73 : 184-8.
[17] Liesegang TJ. Physiologic changes of the cornea with contact lens wear. CLAO J Off Publ Contact Lens Assoc Ophthalmol Inc 2002 ; 28 : 12-27.
[18] Inagaki Y, Akahori A, Sugimoto K, et al. Comparison of corneal endothelial bleb formation and disappearance processes between rigid gas-permeable and soft contact lenses in three classes of dk/l. Eye Contact Lens 2003 ; 29 : 234-37.
[19] Brennan NA, Coles M-LC, Connor HRM, et al. Short-term corneal endothelial response to wear of silicone-hydrogel contact lenses in East Asian eyes. Eye Contact Lens 2008 ; 34 : 317-21.
[20] Rong B, Yan XM. Changes of corneal limbus in long-term soft contact lens wearers by using laser confocal microscope. Zhonghua Yan Ke Za Zhi Chin J Ophthalmol 2007 ; 43 : 514-8.
[21] Efron N, Al-Dossari M, Pritchard N. Confocal microscopy of the bulbar conjunctiva in contact lens wear. Cornea 2010 ; 29 : 43-52.
[22] Doughty MJ. Objective assessment of contact lens wear-associated conjunctival squamous metaplasia by linear measures of cell size, shape and nucleus-to-cytoplasm ratios. Curr Eye Res 2011 ; 36 : 599-606.
[23] Doughty MJ. Contact lens wear and the goblet cells of the human conjunctiva-A review. Contact Lens Anterior Eye J Br Contact Lens Assoc 2011 ; 34 : 157-63.
[24] Thai LC, Tomlinson A, Doane MG. Effect of contact lens materials on tear physiology. Optom Vis Sci Off Publ Am Acad Optom 2004 ; 81 : 194-204.
[25] Rohit A, Willcox M, Stapleton F. Tear lipid layer and contact lens comfort : a review. Eye Contact Lens 2013 ; 39 : 247-53.
[26] Panaser A, Tighe BJ. Function of lipids − their fate in contact lens wear : an interpretive review. Contact Lens Anterior Eye J Br Contact Lens Assoc 2012 ; 35 : 100-11.
[27] Nichols JJ, Mitchell GL, King-Smith PE. Thinning rate of the precorneal and prelens tear films. Invest Ophthalmol Vis Sci 2005 ; 46 : 2353-61.
[28] Mann A, Tighe B. Contact lens interactions with the tear film. Exp Eye Res 2013 ; 117 : 88-98.
[29] Iskeleli G, Karakoc Y, Ozkok A, et al. Comparison of the effects of first and second generation silicone hydrogel contact lens wear on tear film osmolarity. Int J Ophthalmol 2013 ; 6 : 666-70.
[30] Robertson DM. The effects of silicone hydrogel lens wear on the corneal epithelium and risk for microbial keratitis. Eye Contact Lens 2013 ; 39 : 67-72.
[31] Stapleton F, Keay L, Edwards K, Holden B. The epidemiology of microbial keratitis with silicone hydrogel contact lenses. Eye Contact Lens 2013 ; 39 : 79-85.
[32] Robertson DM, Petroll WM, Cavanagh HD. The effect of nonpreserved care solutions on 12 months of daily and extended silicone hydrogel contact lens wear. Invest Ophthalmol Vis Sci 2008 ; 49 : 7-15.
[33] Carnt NA, Evans VE, Naduvilath TJ, et al. Contact lens-related adverse events and the silicone hydrogel lenses and daily wear care system used. Arch Ophthalmol 2009 ; 127 : 1616-23.
[34] Holden BA, Stephenson A, Stretton S, et al. Superior epithelial arcuate lesions with soft contact lens wear. Optom Vis Sci Off Publ Am Acad Optom 2001 ; 78 : 9-12.
[35] Yeniad B, Beginoglu M, Bilgin LK. Lid-wiper epitheliopathy in contact lens users and patients with dry eye. Eye Contact Lens 2010 ; 36 : 140-3.
[36] Berry M, Pult H, Purslow C, Murphy PJ. Mucins and ocular signs in symptomatic and asymptomatic contact lens wear. Optom Vis Sci Off Publ Am Acad Optom 2008 ; 85 : E930–8.
[37] Panaser A, Tighe BJ. Function of lipids − their fate in contact lens wear : an interpretive review. Contact Lens Anterior Eye J Br Contact Lens Assoc 2012 ; 35 : 100-11.
[38] Butrus SI, Klotz SA. Contact lens surface deposits increase the adhesion of Pseudomonas aeruginosa. Curr Eye Res 1990 ; 9 : 717-24.
[39] Van den Bosch WA, Lemij HG. Blepharoptosis induced by prolonged hard contact lens wear. Ophthalmology 1992 ; 99 : 1759-65.
[40] Kersten RC, de Conciliis C, Kulwin DR. Acquired ptosis in the young and middle-aged adult population. Ophthalmology 1995 ; 102(6) : 924-8.
[41] Elhers WH, Donshik PC. Giant papillary conjunctivitis. Curr Opin Allergy Clin Immunol 2008 ; 8 : 445-9.
[42] Holden BA, La Hood D, Grant T, et al. Gram-negative bacteria can induce contact lens related acute red eye (CLARE) responses. CLAO J Off Publ Contact Lens Assoc Ophthalmol Inc 1996 ; 22 : 47-52.
[43] Dumbleton K. Adverse events with silicone hydrogel continuous wear. Contact Lens Anterior Eye J Br Contact Lens Assoc 2002 ; 25 : 137-46.
[44] Sankaridurg PR, Sharma S, Willcox M, et al. Bacterial colonization of disposable soft contact lenses is greater during corneal infiltrative events than during asymptomatic extended lens wear. J Clin Microbiol 2000 ; 38 : 4420-4.
[45] Baum J, Dabezies OH Jr. Pathogenesis and treatment of “sterile” midperipheral corneal infiltrates associated with soft contact lens use. Cornea 2000 ; 19 : 777-81.
[46] Carnt NA, Evans VE, Naduvilath TJ, et al. Contact lens-related adverse events and the silicone hydrogel lenses and daily wear care system used. Arch Ophthalmol 2009 ; 127 : 1616-23.
[47] Sarver MD, Baggett DA, Harris MG, Louie K. Corneal edema with hydrogel lenses and eye closure : effect of oxygen transmissibility. Am J Optom Physiol Opt 1981 ; 58 : 386-92.
[48] Keay L, Jalbert I, Sweeney DF, Holden BA. Microcysts : clinical significance and differential diagnosis. Optom St Louis Mo 2001 ; 72 : 452-60.
[49] Keay L, Sweeney DF, Jalbert I, et al. Microcyst response to high Dk/t silicone hydrogel contact lenses. Optom Vis Sci Off Publ Am Acad Optom 2000 ; 77 : 582-5.
[50] Remeijer L, van Rij G, Beekhuis WH, et al. Deep corneal stromal opacities in long-term contact lens wear. Ophthalmology 1990 ; 97 : 281-5.
[51] Martin R. Corneal conjunctivalisation in long-standing contact lens wearers. Clin Exp Optom J Aust Optom Assoc 2007 ; 90 : 26-30.
[52] Dumbleton KA, Chalmers RL, Richter DB, Fonn D. Vascular response to extended wear of hydrogel lenses with high and low oxygen permeability. Optom Vis Sci Off Publ Am Acad Optom 2001 ; 78 : 147-51.
[53] Papas E. Corneal vascularisation and contact lenses. Arch Soc Esp Oftalmol 2006 ; 81 : 309-12.
[54] Dumbleton KA, Chalmers RL, Richter DB, Fonn D. Vascular response to extended wear of hydrogel lenses with high and low oxygen permeability. Optom Vis Sci Off Publ Am Acad Optom 2001 ; 78 : 147-51.
[55] Chalmers RL, Dillehay S, Long B, et al. Impact of previous extended and daily wear schedules on signs and symptoms with high Dk lotrafilcon A lenses. Optom Vis Sci Off Publ Am Acad Optom 2005 ; 82 : 549-54.
[56] Long B, McNally J. The clinical performance of a silicone hydrogel lens for daily wear in an Asian population. Eye Contact Lens 2006 ; 32 : 65-71.
[57] Efron N, Morgan PB. Rethinking contact lens associated keratitis. Clin Exp Optom J Aust Optom Assoc 2006 ; 89 : 280-98.
[58] Morgan PB, Efron N, Hill EA, et al. Incidence of keratitis of varying severity among contact lens wearers. Br J Ophthalmol 2005 ; 89 : 430-6.
[59] Poggio EC, Glynn RJ, Schein OD, et al. The incidence of ulcerative keratitis among users of daily-wear and extended-wear soft contact lenses. N Engl J Med 1989 ; 321 : 779-83.
[60] Cheng KH, Leung SL, Hoekman HW, et al. Incidence of contact-lens-associated microbial keratitis and its related morbidity. Lancet 1999 ; 354 : 181-5.
[61] Konda N, Motukupally SR, Garg P, et al. Microbial analyses of contact lens-associated microbial keratitis. Optom Vis Sci Off Publ Am Acad Optom 2014 ; 91 : 47-53.
[62] Hoddenbach JG, Boekhoorn SS, Wubbels R, et al. Clinical presentation and morbidity of contact lens-associated microbial keratitis : a retrospective study. Graefes Arch Clin Exp Ophthalmol Albrecht Von Graefes Arch Klin Exp Ophthalmol 2013. doi : 10.1007/s00417-013-2514-1.
[63] Gopinathan U, Sharma S, Garg P, Rao GN. Review of epidemiological features, microbiological diagnosis and treatment outcome of microbial keratitis : experience of over a decade. Indian J Ophthalmol 2009 ; 57 : 273-9.
[64] Ahearn DG, Zhang S, Stulting RD, et al. Fusarium keratitis and contact lens wear : facts and speculations. Med Mycol 2008 ; 46 : 397-410.
[65] Quah SA, Hemmerdinger C, Nicholson S, Kaye SB. Treatment of refractory vernal ulcers with large-diameter bandage contact lenses. Eye Contact Lens 2006 ; 32 : 245-7.
[66] Gilad E, Bahar I, Rotberg B, Weinberger D. http://sciencepapers.sanofi.us/keepersTherapeutic contact lens as the primary treatment for traumatic corneal erosions. Isr Med Assoc J 2004 ; 6 : 28-9.
[67] Schornack MM, Pyle J, Patel SV. Scleral lenses in the management of ocular surface disease. Ophthalmology 2014 ; 14. pii : S0161-6420(14)00087-6.
[68] Swarbrick HA. Orthokeratology review and update. Clin Exp Optom 2006 ; 89 : 123-43.
[69] Choo JD, Caroline PJ, Harlin DD, et al. Morphologic changes in cat epithelium following continuous wear of orthokeratology lenses : a pilot study. Contact Lens & Anterior Eye 2008 ; 31 : 29-37.
[70] Malet F. Les lentilles de contact. Rapport de la Société française d’ophtalmologie. Paris : Masson ; 2009. p. 780-790.

