Pathologies spécifiques
C. Baudouin, E. Brasnu-de-Cenival
L’examen de la surface oculaire et du segment antérieur doit être systématique chez tout patient glaucomateux ou hypertone à la recherche de signes de sécheresse ou d’inflammation de la surface oculaire. Un traitement jusqu’alors bien toléré peut être responsable d’effets secondaires décalés dans le temps ou initialement méconnus en raison de leur discrétion. En cas d’atteinte de la surface oculaire, une réduction des conservateurs et un traitement spécifique de la surface oculaire pourront être proposés afin d’améliorer la tolérance et l’observance du traitement, et de réduire le risque de fibrose postopératoire en cas de chirurgie ultérieure. Cependant la suppression ou la réduction du facteur causal (stratégie de soustraction) sera toujours plus efficace qu’une stratégie d’addition consistant à ajouter des thérapeutiques pour compenser les effets secondaires d’autres traitements.
Les progrès de la pharmacologie oculaire moderne ont mis à la disposition des ophtalmologistes un grand nombre de médicaments topiques efficaces et globalement bien tolérés, éliminant progressivement les produits les plus toxiques ou allergisants, comme les dérivés adrénergiques, le mercure ou la chlorhexidine. Il est vrai qu’à l’exception de quelques cas d’allergie aiguë, survenant dans les heures ou les jours suivant l’instauration d’un traitement, la plupart des médicaments de l’ophtalmologie moderne sont apparemment bien tolérés, même en utilisation prolongée. Des accidents aigus peuvent survenir chez n’importe quel patient, avec n’importe quel produit. Même en utilisation chronique, comme c’est le cas dans les sécheresses oculaires, les allergies ou le glaucome, les picotements, brûlures ou autres signes d’intolérance sont souvent mis sur le compte de la maladie initiale ou jugés trop accessoires pour faire reconsidérer le traitement.
Pourtant, pour peu que l’on y prête plus d’attention ou que l’on utilise des outils d’évaluation plus fins, la surface oculaire et par là même le confort des patients sont souvent beaucoup plus touchés par les traitements locaux. Une étude estimait à 24 % la fréquence des maladies de la surface oculaire consécutives à des problèmes iatrogènes nécessitant un avis en milieu spécialisé [1]. Outre les simples problèmes de confort, des anomalies graves peuvent en effet se développer à bas bruit et ne se manifester que très tardivement, parfois de manière totalement inattendue. Ainsi, comment établir le lien entre une fibrose progressive de la surface oculaire et un traitement local banal et bien toléré, entrepris dix ou quinze années auparavant ? Que faut-il penser du rôle des traitements antiglaucomateux dans le développement des échecs de la chirurgie du glaucome par fibrose du site de filtration ? Ces quelques exemples soulèvent de nouveaux problèmes pharmacologiques, notamment sur l’identification des composants responsables (qui ne sont pas obligatoirement les médicaments eux-mêmes) et sur le développement d’alternatives plus sûres à long terme.
Les réactions d’intolérance aux médicaments ayant un substrat immunologique représentent en moyenne 3 à 10 % des prescriptions, mais le mécanisme immunologique est souvent très difficile à identifier, car il peut être primitif ou secondaire, et souvent indiscernable d’une réponse inflammatoire non spécifique. Malgré le terme d’allergie habituellement utilisé, ces réactions répondent rarement à un mécanisme d’hypersensibilité immédiate de type I, mais plutôt à celui d’une hypersensibilité retardée de type IV avec eczéma de contact, même si des combinaisons entre les différents mécanismes peuvent exister [2].
La plupart des médicaments ont un poids moléculaire faible, compris entre 500 et 1000 Da, et ne sont pas immunogènes directement. Pour le devenir, ils doivent former avec les protéines du sujet des conjugués stables qui seront alors sensibilisants : ils se comportent ainsi comme des haptènes. Parfois, c’est un métabolite ou un produit de dégradation du médicament, voire une impureté, qui constituent l’haptène sensibilisant. Les manifestations dans ces cas sont essentiellement palpébrales, créant ou aggravant des blépharites souvent discrètes ou décalées dans le temps, ce qui les rend d’autant plus difficiles à différencier de la pathologie sous-jacente.
L’allergie aux collyres se manifeste cliniquement par des symptômes variés : œdème palpébral, eczéma, hyperhémie conjonctivale, larmoiement, sensations de brûlure ou démangeaisons, pouvant aller jusqu’à la conjonctivite gigantopapillaire qui, en général, fait évoquer le diagnostic et motive un arrêt du traitement (fig. 12-1). Les signes peuvent également être plus discrets (chémosis isolé, discrètes papilles conjonctivales), sans eczéma palpébral systématique, rendant le diagnostic parfois plus difficile, surtout lorsque le traitement était initialement bien toléré et que les manifestations sont apparues progressivement (fig. 12-2). Il est important de rappeler que la bonne tolérance apparente à un traitement pendant des mois ou même des années n’exclut pas le rôle de celui-ci dans les manifestations observées cliniquement.

Fig. 12-1 Allergie de contact chez un patient glaucomateux multitraité.

Fig. 12-2 Blépharite allergique apparue 1 an après le début d’un traitement antiglaucomateux.
Certains médicaments, et en particulier les conservateurs, sont avant tout irritants [2, 3], par un effet cytotoxique pur, le pH, l’osmolarité de la solution ou même une photosensibilisation. Certaines substances peuvent être allergisantes à faible concentration et irritantes à fortes doses. La toxicité du produit peut entraîner la nécrose des cellules cornéoconjonctivales ou induire une cascade de mécanismes actifs aboutissant à leur dégénérescence par apoptose. Dans les deux cas, les tissus de la surface oculaire ainsi agressés vont induire des réactions inflammatoires réactionnelles, sur un mode de réponse cicatricielle plutôt qu’immunologique (fig. 12-3a). Les médiateurs de l’inflammation sont cependant très similaires, quel qu’en soit le mode de déclenchement, et les infiltrats inflammatoires sont peu différents. Toutefois, le mode souvent chronique de ces effets irritatifs conduit à long terme à une infiltration permanente par des cellules inflammatoires et des fibroblastes.
Théoriquement, à la différence des réactions immunologiques qui demandent une sensibilisation préalable, les effets toxiques peuvent se manifester dès le premier contact. Bien souvent, cependant, ils n’apparaissent qu’après une dose cumulée, ce qui peut demander plusieurs semaines, mois ou même années, ou n’apparaître que sur des surfaces oculaires déjà malades, comme dans le cas d’un syndrome sec oculaire. À l’arrêt des agents toxiques responsables, ces lésions sont en général réversibles (fig. 12-3b).

Fig. 12-3 Toxicité des collyres et des conservateurs.
a. Kératoconjonctivite toxique chez un patient traité par trois médicaments antiglaucomateux. b. Amélioration après arrêt de l’un deux et utilisation de collyres sans conservateur.
La toxicité de certains médicaments peut s’exercer de manière indirecte [3]. C’est le cas par exemple des antibiotiques, des antiviraux et des corticoïdes qui entraînent une modification de la flore microbienne conjonctivopalpébrale. Certains effets passent par une altération du film lacrymal qui va indirectement perturber la surface oculaire. Une toxicité directe des conservateurs pour les mucocytes conjonctivaux ou goblet cells, une diminution de la sécrétion lacrymale aqueuse principale (parasympatholytiques, vasoconstricteurs) ou un effet détergent pour la phase lipidique du film (en particulier avec les ammoniums quaternaires qui constituent la classe actuelle principale des conservateurs) sont autant d’effets toxiques très fréquemment rencontrés avec les collyres contenant un conservateur (fig. 12-4).
L’obstruction des voies lacrymales par des mécanismes inflammatoires et/ou immunologiques peut également constituer un mécanisme perturbateur important pour la surface oculaire, avec des modifications du drainage lacrymal et de la flore microbienne. Dans ces conditions, le larmoiement induit devient très difficile à interpréter.
Enfin, il ne faut pas oublier toutes les combinaisons possibles entre divers mécanismes qui rendent extrêmement complexes les tableaux clinico-biologiques et difficiles leur diagnostic et leur traitement. Les conservateurs administrés sur des yeux secs vont ainsi être cytotoxiques pour les cellules épithéliales déjà fragilisées, détruire les mucocytes survivants et dissoudre un film lacrymal déjà pathologique [4]. Comment interpréter alors la part respective de la pathologie initiale, qui touche elle-même le film lacrymal et ses constituants, et des effets aggravants d’une partie de son traitement, venant paradoxalement annihiler l’effet thérapeutique du principe actif ou du lubrifiant ?
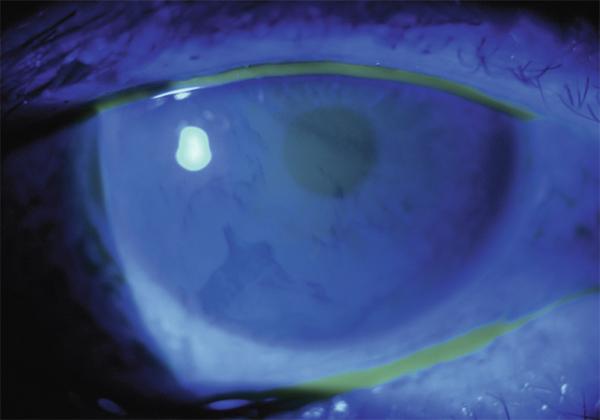
Fig. 12-4 Altération du film lacrymal avec instabilité marquée par une rupture rapide du film lacrymal après ouverture palpébrale.
Aujourd’hui, la plupart des patients glaucomateux bénéficient d’un traitement médical, proposé en première intention dans la majorité des cas, comme cela est préconisé d’ailleurs dans les directives de l’European Glaucoma Society (EGS) [5]. Ainsi, le traitement médical est administré sur de longues périodes, le plus souvent à vie, avec passage à une multithérapie lorsque la cible pressionnelle n’est pas atteinte, excepté en cas de recours à la chirurgie ou au laser.
D’après les données des études cliniques prospectives randomisées, la tolérance des traitements antiglaucomateux semble satisfaisante, avec seulement une faible proportion de patients exclus en raison d’une intolérance locale ou d’une allergie oculaire. Dans l’étude de Van der Valk et al., méta-analyse de 28 études cliniques randomisées, le pourcentage global de patients exclus était de 0 à 16 %, la plupart des études ayant un taux d’exclusion inférieur à 8 % [6]. Ainsi, nous pensons que les effets indésirables des collyres sur la surface oculaire sont le plus souvent sous-estimés dans ces études, et ce pour plusieurs raisons. Tout d’abord, les études cliniques sur le traitement du glaucome sont rarement réalisées sur de longues périodes, en général sur quelques mois seulement, ce qui est éloigné de la réalité de la vie des patients glaucomateux [4]. En effet, les effets de composés toxiques peuvent mettre plusieurs années avant de s’accumuler au point de s’exprimer cliniquement, et sont ainsi probablement largement sous-estimés par les études cliniques randomisées réalisées sur des durées courtes. De plus, pour des raisons éthiques de méthodologie, les patients présentant une hypersensibilité connue au principe actif d’un collyre ou d’un conservateur, ou les patients présentant une pathologie associée de la surface oculaire (sécheresse oculaire sévère, blépharite, allergie chronique) ne sont pas inclus dans ces études afin d’éviter des biais potentiels. Or, 15 à 34 % des patients de plus de 65 ans (glaucomateux ou non) présenteraient une sécheresse oculaire [7] pouvant majorer les effets indésirables liés au collyre et réduisant les capacités de défense de la cornée et de la conjonctive vis-à-vis du toxique. Enfin, en pratique clinique, plusieurs traitements concomitants sont souvent prescrits, une large proportion de patients nécessitant une multithérapie. Cela est bien illustré par les données de l’Ocular Hypertension Treatment Study (OHTS), dans laquelle environ 40 % des patients présentant une hypertonie oculaire initialement bénéficiaient d’une bithérapie à 5 ans, et 9 % de trois traitements ou plus, avec une proportion plus élevée encore chez les Afro-Américains [8]. Il est facile de comprendre qu’une multithérapie est susceptible de majorer les effets secondaires de chaque composé pris individuellement, soit par l’existence d’interactions médicamenteuses, soit par un effet additif. Cela est particulièrement vrai pour les conservateurs qui sont susceptibles d’être instillés jusqu’à 4 ou 5 fois/jour en fonction du traitement prescrit.
Ainsi, les essais cliniques randomisés ne sont pas toujours révélateurs de la réalité pour toutes les raisons citées précédemment. Or, les effets secondaires des collyres antiglaucomateux prescrits au long cours, souvent sous-estimés par ces études, sont réels, pouvant aller des classiques réactions allergiques au plus fréquent syndrome sec, jusqu’à la pseudo-pemphigoïde toxique.
Pour les raisons expliquées plus haut, les signes cliniques et symptômes en rapport avec la surface oculaire contrastent avec les données des études prospectives chez les patients traités pour un glaucome. Ainsi, dans une étude européenne portant sur 9 658 patients, plus de 40 % des patients traités pour un glaucome ou une hypertonie oculaire présentaient des symptômes d’atteintes de la surface oculaire comme des douleurs ou un inconfort à l’instillation, des sensations de corps étranger, des brûlures ou démangeaisons, des sensations d’œil sec, et plus de 20 % des signes cliniques à type de blépharites, d’hyperhémies conjonctivales ou de kératites [9]. Plus récemment, Leung et al. ont analysé, aux États-Unis, l’impact de la surface oculaire dans la prise en charge de patients atteints de glaucome primitif à angle ouvert (GPAO) ou d’hypertonie oculaire (HTO) chez 101 patients [10]. Dans cette étude utilisant le questionnaire OSDI (Ocular Surface Disease Index), plus de la moitié des patients (59 %) ont rapporté des symptômes dans un œil au moins, avec une atteinte sévère chez 27 % d’entre eux. Le test de Schirmer a révélé une diminution de la production lacrymale chez 61 % des patients sur un œil au moins, avec 35 % d’atteinte sévère. Le test au vert de lissamine était positif sur la conjonctive et/ou la cornée dans 22 % des cas, et le temps de rupture du film lacrymal diminué chez 78 % des patients, sévèrement dans 65 % des cas. Une autre étude observationnelle multicentrique, réalisée sur 20 506 patients glaucomateux en Allemagne, a retrouvé une sécheresse oculaire chez près de la moitié des patients, la prévalence étant plus élevée chez les femmes (56,9 versus 45,7 %) [11]. Ces résultats étaient concordants avec ceux de l’étude multicentrique américaine plus récente de Fechtner et al. chez 630 patients traités, où 48,4 % d’entre eux présentaient des symptômes de sécheresse oculaire [12]. De plus, dans cette étude, le score OSDI était plus élevé chez les patients multitraités, par rapport aux patients n’utilisant qu’une monothérapie.
Ces résultats ont été confirmés par ceux d’une autre étude observationnelle multicentrique française réalisée récemment sur 516 patients traités pour un GPAO ou une HTO qui visait à déterminer la prévalence des pathologies de la surface oculaire chez les patients glaucomateux traités et à identifier des facteurs de risque chez ces patients [13]. Une atteinte de la surface oculaire a été retrouvée chez 51 % des 516 patients, dont 21 % évalués comme étant modérés à sévères. Aucun symptôme particulier ne s’est distingué des autres et, comme on pouvait s’y attendre, la sécheresse oculaire, les brûlures et la sensation de corps étranger dans l’œil ont été les symptômes les plus fréquemment signalés. Le signe oculaire le plus notablement observé a été un temps de rupture du film lacrymal réduit, révélateur d’une instabilité du film lacrymal. Une hyperhémie oculaire ou péri-oculaire a également fréquemment été observée, tandis que la coloration de la cornée et de la conjonctive constituait un indicateur fiable de sévérité. Comme on pouvait s’y attendre, les patients les plus âgés, ceux dont les durées de traitement étaient les plus longues et ceux atteints d’un glaucome plus sévère étaient les plus susceptibles de présenter une atteinte plus importante de la surface oculaire. La sévérité de la maladie s’est avérée être un facteur indépendant dans les analyses multivariées, tout comme une pression oculaire plus élevée au moment de l’examen. Ces patients étaient probablement traités avec un nombre plus important de médicaments, et la sévérité de la maladie pourrait avoir nécessité des valeurs cibles de pression plus basses et, par conséquent, un collyre supplémentaire. Un lien net a ainsi été observé entre les altérations de la surface oculaire et le nombre de médicaments : 38 % dont 13 % de sévères en cas de monothérapie ; 54 % dont 23 % de sévères en cas de bithérapie ; 71 % dont 33 % de sévères en cas de trithérapie et plus. Même avec une monothérapie, une forte proportion de patients a donc présenté des modifications de la surface oculaire, proportion bien plus élevée que ce que laissent présager les essais randomisés de courte durée.
De plus, 40 % de la population de l’étude avait signalé des antécédents de modification de traitement liée à des problèmes de surface oculaire. Ces antécédents pouvaient comprendre l’arrêt d’un traitement mal toléré, le changement pour un autre médicament, une trabéculoplastie au laser ou une intervention chirurgicale en raison d’une intolérance au niveau de la surface oculaire, ou l’ajout d’un traitement symptomatique afin de soulager les signes ou symptômes de la surface oculaire, tels des substituts lacrymaux ou des médicaments contre l’allergie.
L’utilisation de traitements antiglaucomateux au long cours a aussi été incriminée dans le développement d’une fibrose conjonctivale, entraînant une rétraction conjonctivale avec cicatrisation conjonctivale excessive pouvant être à l’origine d’une pseudo-pemphigoïde ou évoluer vers une rétraction conjonctivale avec atteinte cornéenne (fig. 12-5) [14]. Sur le plan histologique, cette fibrose est vraisemblablement la conséquence d’une augmentation de la densité fibroblastique dans la substantia propria, en rapport avec une augmentation du nombre de cellules inflammatoires [15–17]. Dans une série de 145 patients présentant une pseudo-pemphigoïde, publiée par Thorne et al., la première cause de pseudo-pemphigoïde était l’exposition aux collyres antiglaucomateux [18].
L’échec de la chirurgie filtrante du glaucome, quelle que soit la technique utilisée (trabéculectomie perforante ou non), est dans la majorité des cas la résultante d’une cicatrisation conjonctivale excessive au niveau de la bulle de filtration dans les mois suivant la chirurgie. Cela se caractérise par une prolifération fibroblastique anormale et une inflammation conjonctivale accrue associées à une fibrose excessive qui vient bloquer la sortie d’humeur aqueuse au niveau de l’espace sous-conjonctival. Aux classiques facteurs de risque de fibrose – patients mélanodermes, contexte inflammatoire, jeune âge, reprise chirurgicale, etc. – vient s’ajouter l’inflammation préopératoire conjonctivale, conséquence d’un traitement au long cours par les collyres antiglaucomateux [19, 20]. Broadway et al., notamment, ont montré une relation significative entre le risque d’échec de la chirurgie et le nombre de collyres utilisés d’une part, et la durée du traitement d’autre part [19]. Cela a fait l’objet, pendant la même période et par la suite, à la fois d’études histopathologiques sur des biopsies ou empreintes conjonctivales (fig. 12-6 et 12-7), et d’études cliniques prospectives ou observationnelles qui ont incriminé notamment les conservateurs. Ce n’est que récemment que le rôle supposé des conservateurs a été confirmé avec la démonstration épidémiologique d’un lien entre le taux d’échec et le nombre de collyres contenant du chlorure de benzalkonium (BAK) utilisés avant la chirurgie [21].
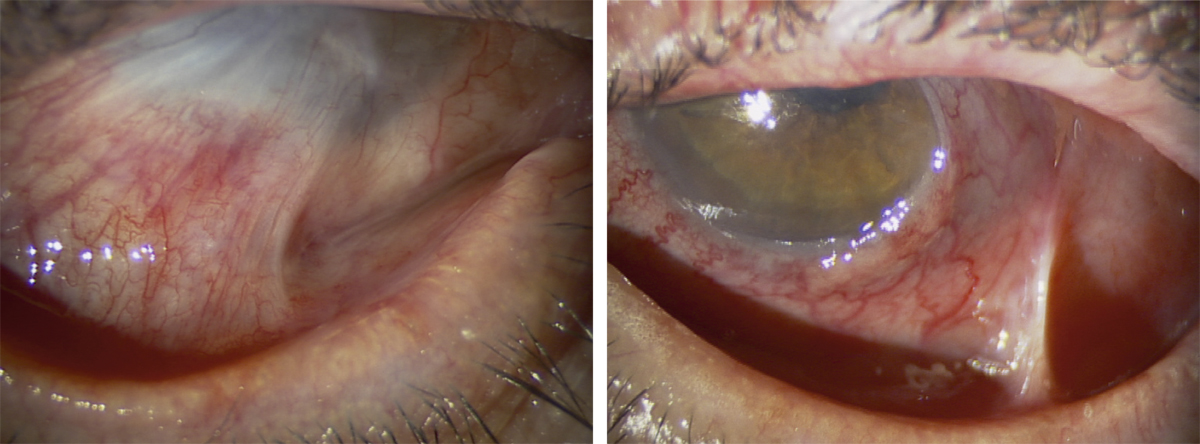
Fig. 12-5 Photographies cliniques des deux yeux d’un patient présentant une pseudo-pemphigoïde oculaire suite à l’utilisation de collyres antiglaucomateux.
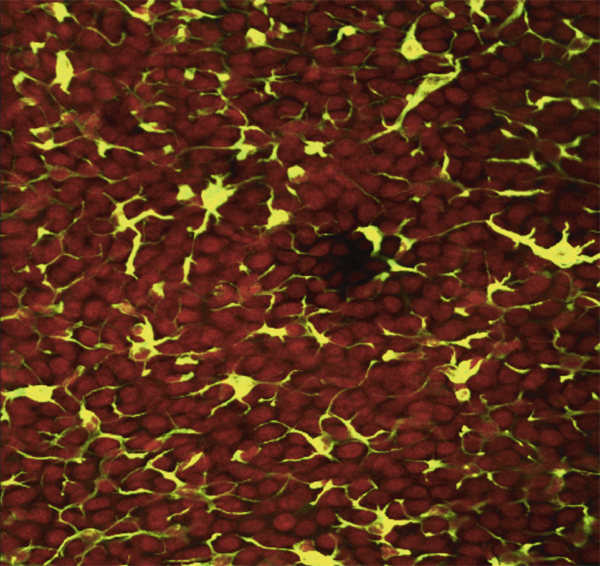
Fig. 12-6 Empreinte conjonctivale montrant une densité anormale en cellules inflammatoires chez un glaucomateux.

Fig. 12-7 Aspect similaire dans les différentes couches de la conjonctive sur une biopsie conjonctivale prélevée au moment de la chirurgie filtrante.
La réglementation exige que tout flacon de collyre contienne un conservateur pour éviter, ou plutôt retarder, la contamination de la solution après son ouverture. Ces conservateurs doivent tuer les germes susceptibles de devenir pathogènes lors d’une éventuelle introduction à la surface de l’œil, mais sans altérer les tissus oculaires, ce qui constitue une gageure que l’industrie pharmaceutique tente de résoudre depuis des décennies, en cherchant le moins mauvais compromis entre toxicité pour les germes et non-toxicité pour les tissus.
Il existe un grand nombre de conservateurs utilisés en association avec un ou plusieurs principes actifs dans les collyres. On les distingue habituellement par leur mode d’action : chimique, anti-oxydant ou complexant. Les ammoniums quaternaires, conservateurs chimiques dont le chef de file est le chlorure de benzalkonium (BAK), sont les plus utilisés [4, 22], ils agissent par altération des membranes cellulaires en induisant une lyse cellulaire. Le BAK, dont la toxicité est pourtant connue depuis 1944, est devenu le principal conservateur des collyres modernes en raison de son taux assez faible d’allergies à court terme. Sa concentration varie entre 0,004 et 0,02 %. C’est une molécule toxique non seulement pour les germes contre lesquels il est chargé de lutter mais également pour la surface oculaire. Or les effets délétères d’un traitement au long cours par collyres contenant du BAK sont actuellement bien connus, ils ont été démontrés sur plusieurs modèles in vivo ou in vitro, chez l’animal, chez l’homme et sur les cellules conjonctivales ou trabéculaires (fig. 12-8) : effet détergent ; effets pro-apoptotiques, pro-nécrotiques, pro-oxydants et pro-inflammatoires directs sur les cellules de la surface oculaire et du trabéculum ; effets indirects d’activation immuno-inflammatoire et de neurotoxicité [4, 23–27 ].
Le BAK est directement cytotoxique pour les cellules épithéliales, même à très faible concentration (celle des collyres actuellement commercialisés), et il possède également des propriétés surfactantes par lesquelles il dissout la phase lipidique du film lacrymal et induit donc une sécheresse oculaire qualitative. À une concentration aussi faible que 0,004 %, il réduit significativement le break-up time (BUT). À 0,005 %, il peut entraîner une toxicité directe pour les cellules superficielles, avec des érosions épithéliales. À la concentration de 0,007 %, le temps nécessaire pour entraîner la lyse de 50 % de cellules d’une culture d’épithélium conjonctival n’est que de 90 à 100 secondes ! À la concentration de 0,01 %, qui est celle de la plupart des collyres, le BAK altère de manière importante l’épithélium, stimule l’infiltration du limbe et de la conjonctive par des cellules inflammatoires, et à 0,02 %, il retarde la cicatrisation cornéenne. Ces manifestations sont assez peu souvent spectaculaires cliniquement, notamment en monothérapie, mais elles sont associées à de profondes altérations de la surface oculaire, comme en témoignent de nombreuses études immuno-histologiques [4, 15, 16]. La plupart du temps, les tissus oculaires se défendent et les effets toxiques n’apparaissent cliniquement qu’en cas de pathologies associées, comme dans les sécheresses oculaires, d’associations thérapeutiques ou d’utilisations accidentelles ou excessives.
Labbé et al. ont retrouvé également une relation entre l’augmentation de l’osmolarité des larmes et le nombre de collyres instillés chez les patients glaucomateux, en corrélation avec la fréquence accrue de sécheresse oculaire chez les glaucomateux [28]. In vitro, il est d’ailleurs intéressant d’observer que le BAK est plus toxique sur des cellules soumises préalablement à un stress osmotique, donc à une sécheresse oculaire, que sur des cellules normales [29]. Ce modèle expérimental reproduit ainsi l’observation clinique qu’un œil sec tolère mal et très rapidement les collyres conservés, mais qu’un œil normal est plus résistant. Cependant le BAK en s’accumulant, surtout en cas de multithérapie, va créer lui-même une sécheresse oculaire et donc les conditions de sa propre toxicité.
Toutes les études cliniques, associées aux données histopathologiques rapportées dans la littérature [4], soulignent l’effet délétère des collyres antiglaucomateux au long cours sur la surface oculaire, cet effet augmentant avec le nombre de collyres et la durée du traitement. Plusieurs études observationnelles prospectives ont ainsi été réalisées au cours des quinze dernières années dans le but de mettre en évidence le rôle des conservateurs, notamment des études évaluant la surface oculaire de patients traités par des collyres avec et sans conservateur. Dans ces études, les symptômes d’irritation de la surface oculaire et les signes cliniques étaient plus fréquents chez les patients traités avec des collyres conservés par rapport aux patients traités avec des produits sans conservateur [4, 9, 30, 31].
Des études plus récentes ont par ailleurs retrouvé une diminution de la sensibilité cornéenne chez les patients glaucomateux traités, avec des modifications du nombre et/ou de la morphologie des nerfs cornéens en microscopie confocale in vivo, ce rôle du BAK pouvant expliquer la relative et apparemment bonne tolérance des collyres contenant du BAK chez certains patients traités au long cours par des collyres en contenant [25, 27].
Des études de substitution, moins nombreuses, ont également été réalisées afin d’examiner l’évolution des symptômes à l’arrêt des conservateurs, retrouvant une diminution de l’incidence des symptômes et des signes cliniques après réduction de la quantité de conservateurs, soit par réduction des collyres en contenant, soit par passage à une forme sans conservateur [31–33].
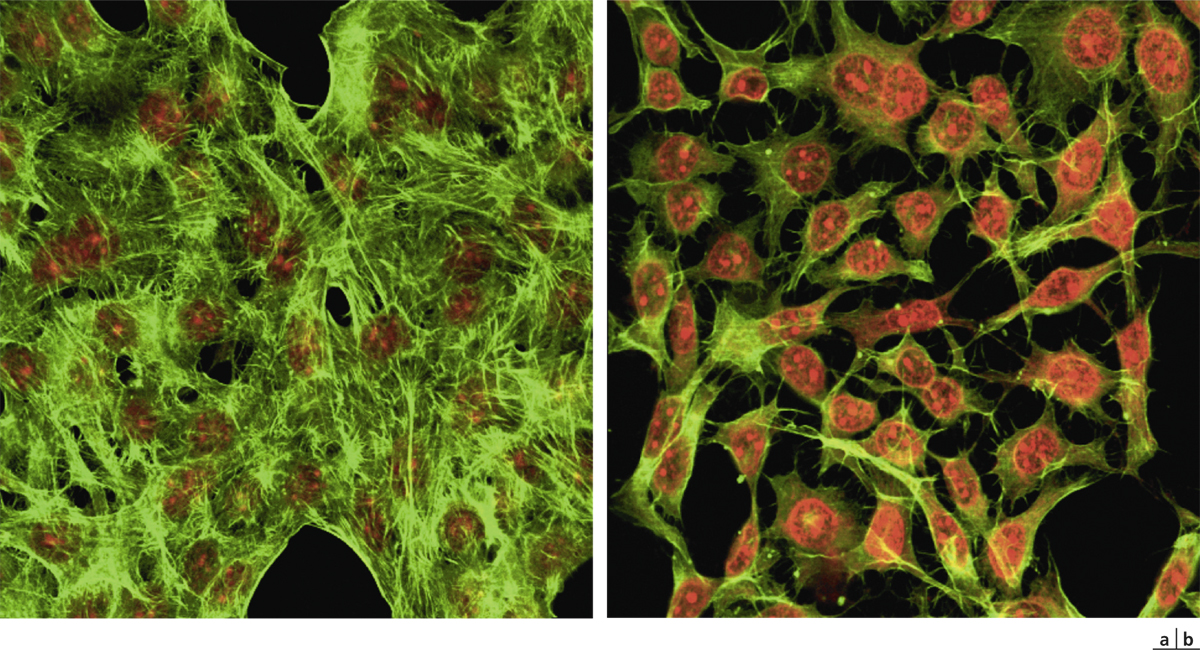
Fig. 12-8 Effets toxiques in vitro du chlorure de benzalkonium.
a. Cellules conjonctivales normales en culture. b. Rétraction cellulaire et apoptose après 15 minutes de contact.
La toxicologie oculaire a ainsi connu de profonds développements depuis quelques années, tant sur le plan physiopathologique que thérapeutique. Une meilleure connaissance des mécanismes de la toxicité des médicaments et de leurs excipients, la mise en évidence d’effets toxiques plus qu’allergiques, parfois très discrets mais susceptibles d’entraîner des complications tardives sévères, et surtout le développement progressif de collyres sans conservateur sont donc des progrès indéniables dans un domaine jusqu’à présent marginalisé aux quelques cas d’allergie de contact.
[1] Bernauer W. Ocular surface problems following topical medication. Klin Monatsbl Augenheilkd 2002 ; 219 : 240-2.
[2] Wilson FM. Adverse external ocular effects of topical ophthalmic medications. Surv Ophthalmol 1979 ; 24 : 57-88.
[3] Burnstein NL. Corneal cytotoxicity of topically applied drugs, vehicles and preservatives. Surv Ophthalmol 1980 ; 25 : 15-30.
[4] Baudouin C, Labbé A, Liang H, et al. Preservatives in eyedrops : the good, the bad and the ugly. Prog Retin Eye Res 2010 ; 29 : 312-34.
[5] European Glaucoma Society. Terminology and guidelines for glaucoma. Savona, Italy : DOGMA ; 2008.
[6] Van Der Valk R, Webers CA, Schouten JS, et al. Intraocular pressure-lowering effects of all commonly used glaucoma drugs : a meta-analysis of randomized clinical trials. Ophthalmology 2005 ; 112 : 1177-85.
[7] The epidemiology of dry eye disease : report of the Epidemiology Subcommittee of the International Dry Eye WorkShop. Ocul Surf 2007 ; 5 : 93-107.
[8] Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study : a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol 2002 ; 120 : 701-13.
[9] Jaenen N, Baudouin C, Pouliquen P, et al. Ocular symptoms and signs with preserved and preservative-free glaucoma medications. Eur J Ophthalmol 2007 ; 17 : 341-9.
[10] Leung EW, Medeiros FA, Weinreb RN. Prevalence of ocular surface disease in glaucoma patients. J Glaucoma 2008 ; 17 : 350-5.
[11] Erb C, Gast U, Schremmer D. German register for glaucoma patients with dry eye. I. Basic outcome with respect to dry eye. Graefes Arch Clin Exp Ophthalmol 2008 ; 246 : 1593-601.
[12] Fechtner RD, Godfrey DG, Budenz D, et al. Prevalence of ocular surface complaints in patients with glaucoma using topical intraocular pressure-lowering medications. Cornea 2010 ; 29 : 618-21.
[13] Baudouin C, Renard JP, Nordmann JP, et al. Prevalence and risk factors for ocular surface disease among patients treated over the long term for glaucoma or ocular hypertension. Eur J Ophthalmol 2012 ; 0.
[14] Schwab IR, Linberg JV, Gioia VM, et al. Foreshortening of the inferior conjunctival fornix associated with chronic glaucoma medications. Ophthalmology 1992 ; 99 : 197-202.
[15] Baudouin C, Pisella PJ, Fillacier K, et al. Ocular surface inflammatory changes induced by topical antiglaucoma drugs : human and animal studies. Ophthalmology 1999 ; 106 : 556-63.
[16] Broadway DC, Grierson I, O’Brien C, Hitchings RA. Adverse effects of topical antiglaucoma medication. I. The conjunctival cell profile. Arch Ophthalmol 1994 ; 112 : 1437-45.
[17] Sherwood MB, Grierson I, Millar L, Hitchings RA. Long-term morphologic effects of antiglaucoma drugs on the conjunctiva and Tenon’s capsule in glaucomatous patients. Ophthalmology 1989 ; 96 : 327-35.
[18] Thorne JE, Anhalt GJ, Jabs DA. Mucous membrane pemphigoid and pseudopemphigoid. Ophthalmology 2004 ; 111 : 45-52.
[19] Broadway DC, Chang LP. Trabeculectomy, risk factors for failure and the preoperative state of the conjunctiva. J Glaucoma 2001 ; 10 : 237-49.
[20] Broadway DC, Grierson I, O’Brien C, Hitchings RA. Adverse effects of topical antiglaucoma medication. II. The outcome of filtration surgery. Arch Ophthalmol 1994 ; 112 : 1446-54.
[21] Boimer C, Birt CM. Preservative exposure and surgical outcomes in glaucoma patients : The PESO study. J Glaucoma 2013 ; 22 : 730-5.
[22] Vaede D, Baudouin C, Warnet JM, Brignole-Baudouin F. Les conservateurs des collyres : vers une prise de conscience de leur toxicité. J Fr Ophtalmol 2010 ; 33 : 505-24.
[23] Baudouin C, Denoyer A, Desbenoit N, et al. In vitro and in vivo experimental studies on trabecular meshwork degeneration induced by benzalkonium chloride [an American Ophthalmological Society thesis]. Trans Am Ophthalmol Soc 2012 ; 110 : 40-63.
[24] Brignole-Baudouin F, Desbenoit N, Hamm G, et al. A new safety concern for glaucoma treatment demonstrated by mass spectrometry imaging of benzalkonium chloride distribution in the eye, an experimental study in rabbits. PLoS One 2012 ; 7 : e50180.
[25] Labbé A, Alalwani H, Van Went C, et al. The relationship between subbasal nerve morphology and corneal sensation in ocular surface disease. Invest Ophthalmol Vis Sci 2012 ; 53 : 4926-31.
[26] Liang H, Baudouin C, Labbé A, et al. Conjunctiva-associated lymphoid tissue [CALT] reactions to antiglaucoma prostaglandins with or without BAK-preservative in rabbit acute toxicity study. PLoS One 2012 ; 7 : e33913.
[27] Martone G, Frezzotti P, Tosi GM, et al. An in vivo confocal microscopy analysis of effects of topical antiglaucoma therapy with preservative on corneal innervation and morphology. Am J Ophthalmol 2009 ; 147 : 725-35e1.
[28] Labbé A, Terry O, Brasnu E, et al. Tear film osmolarity in patients treated for glaucoma or ocular hypertension. Cornea 2012 ; 31 : 994-9.
[29] Clouzeau C, Godefroy D, Riancho L, et al. Hyperosmolarity potentiates toxic effects of benzalkonium chloride on conjunctival epithelial cells in vitro. Mol Vis 2012 ; 18 : 851-63.
[30] Ishibashi T, Yokoi N, Kinoshita S. Comparison of the short-term effects on the human corneal surface of topical timolol maleate with and without benzalkonium chloride. J Glaucoma 2003 ; 12 : 486-90.
[31] Pisella PJ, Pouliquen P, Baudouin C. Prevalence of ocular symptoms and signs with preserved and preservative free glaucoma medication. Br J Ophthalmol 2002 ; 86 : 418-23.
[32] Bron A, Chiambaretta F, Pouliquen P, et al. Intérêt de la substitution d’un traitement journalier de deux instillations de timolol par une instillation quotidienne de bêtabloquant non conservé chez des patients présentant un glaucome chronique ou une hypertonie oculaire. J Fr Ophtalmol 2003 ; 26 : 668-74.
[33] Uusitalo H, Chen E, Pfeiffer N, et al. Switching from a preserved to a preservative-free prostaglandin preparation in topical glaucoma medication. Acta Ophthalmol 2010 ; 88 : 329-36.
E. Barreau, A. Rousseau, M. M’Garrech, L. Bonin, M. Labetoulle
Il ne faut jamais oublier la possibilité d’une atteinte iatrogène devant l’apparition d’une pathologie de la surface oculaire. L’amélioration avec l’éviction du produit et éventuellement la récidive lors de la réintroduction sont des arguments forts d’imputabilité. L’atteinte cornéenne la plus fréquente est la cornea verticillata liée à la prise d’amiodarone. L’atteinte conjonctivosclérale la plus fréquente est liée à la prise de biphosphonates. La plupart du temps, les symptômes ressentis par les patients sont liés à une sécheresse oculaire. Les médicaments responsables de sécheresse sont très nombreux. Anticholinergiques, traitement hormonaux et rétinoïdes sont les traitements le plus souvent incriminés. La polymédication augmente le risque de sécheresse de façon importante. L’association à une sécheresse buccale est fréquente et n’implique pas forcément la présence d’une maladie auto-immune.
La pharmacopée s’enrichit régulièrement de nouvelles molécules qui sont autant de sources potentielles d’effets indésirables pour l’œil et, en particulier, pour sa surface. Il est donc utile pour tous les ophtalmologistes de maintenir à jour les connaissances sur ce type d’événements potentiels. De façon complémentaire, il est primordial de ne pas oublier la possibilité d’une atteinte iatrogénique devant un tableau clinique dont l’étiologie n’est pas évidente. Dans ce cas, l’imputabilité peut être suspectée par l’amélioration des signes cliniques après l’arrêt du traitement (plus ou moins rapidement en fonction du type de toxicité). La preuve définitive serait apportée par la réapparition des signes lors de la reprise du traitement, mais pour des raisons éthiques évidentes, il n’est pas licite d’exposer le patient à un tel risque.
Le principal responsable de ce type d’atteinte est l’amiodarone, traitement anti-arythmique de classe III découvert en Belgique dans les années 1960. Son caractère amphiphile (une extrémité polaire, une autre apolaire) explique en grande partie son affinité pour les membranes cellulaires et sa capacité à former des complexes avec les lipides.
Les premières publications concernant ses effets secondaires sur la surface oculaire apparaissent en 1968 [1–5]. Il est le traitement dont la fréquence d’atteinte épithéliale est la plus importante, notamment pour la cornée, puisque les plus grandes séries retrouvent une prévalence proche de 100 % [6–8]. Quelques séries plus modestes ont cependant noté des atteintes moins systématiques, de l’ordre de 35 % pour Nielsen et 68 % pour Kaplan [9, 10].
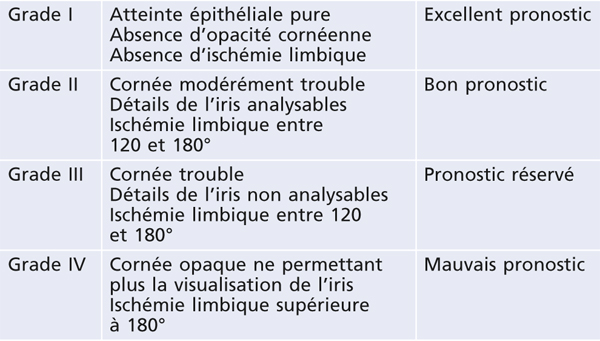
Son aspect caractéristique, dénommé cornea verticillata, est dû à des dépôts de couleur brun doré, débutant en partie médiane et inférieure de la cornée pour s’étendre progressivement vers le haut et l’extérieur. Trois stades ont été décrits : quelques dépôts linéaires inférieurs au stade 1 ; aspect en moustaches de chat au stade 2 ; aspect tourbillonnant occupant la majeure partie de la cornée au stade 3 [10, 11].
Cette atteinte pourtant évidente sur le plan anatomique n’entraîne que très peu de signes fonctionnels, au plus une vision de halos colorés, dont l’incidence est faible (moins de 3 % dans la plupart des séries [6, 8, 9, 12], rarement plus [7, 13]). L’inconfort, la douleur ou la baisse de vision sont exceptionnels. Un cas d’un œdème épithélial apparu lors d’une augmentation rapide de posologie de l’amiodarone a été décrit [14].
Le délai d’apparition des dépôts est habituellement de quelques semaines après le début du traitement, mais rarement inférieur à 1 mois [11]. À l’arrêt du traitement, la disparition est observée en quelques semaines à quelques mois (jusqu’à 20 mois). Ce délai important est essentiellement dû à l’imprégnation systémique du patient en amiodarone, dont la demi-vie est longue et variable [6, 15]. À l’inverse, la transplantation d’une cornée porteuse de dépôts chez un patient n’ayant jamais reçu ce traitement perd ses opacités en 2 semaines [16].
Les analyses en microscopie électronique [17] et en microscopie confocale laser [18–22] ont montré que l’atteinte n’est pas uniquement épithéliale. Des inclusions lysosomiales ont, en effet, été observées non seulement dans les cellules épithéliales cornéennes, mais aussi dans l’épithélium conjonctival, les kératocytes, les cellules endothéliales cornéennes, le cristallin, l’iris, le corps ciliaire, la rétine, la choroïde, les cellules endothéliales vasculaires [23]. Ces inclusions lysosomiales sont de nature lipidique, l’amiodarone étant une molécule amphiphile ; elles ont été décrites comme comparables à celles retrouvées dans la maladie de Fabry ou à une sphyngolipidose.
La microscopie confocale in vivo peut montrer des inclusions hyperréflectives dans l’épithélium, principalement au niveau de la couche cellulaire basale. Ces inclusions sont aussi visibles dans le stroma antérieur, le stroma postérieur et l’endothélium pour les stades 2 et 3. Là encore, une étude n’a pas trouvé de différences notables entre les images obtenues chez les patients traités par amiodarone et ceux atteints d’une maladie de Fabry [21] ; une autre a toutefois noté une plus grosse taille et une brillance plus importante des dépôts liés à l’amiodarone [22].
D’autres produits avec des propriétés amphiphiles peuvent entraîner une cornea verticillata.
C’est le cas notamment des dérivés de l’amino-4-quinoléine : la chloroquine et l’amodiaquine sont utilisées dans le traitement du paludisme, et l’hydroxychloroquine est employée dans le traitement de pathologies inflammatoires chroniques (polyarthrite rhumatoïde, lupus, etc.). Parmi ces molécules, la chloroquine est celle qui entraîne le plus volontiers des dépôts cornéens [24]. Là encore, l’atteinte est peu symptomatique, les patients se plaignant parfois de halos colorés et de photophobies. Lors de la prise d’hydroxychloroquine à dose inférieure à 6,5 mg/kg/jour (dose d’ailleurs recommandée pour limiter le risque d’atteinte rétinienne), une infiltration cornéenne est observée dans moins de 5 % des cas selon Easterbrook [24], et même moins de 1 % selon Grierson [25]. Logiquement, le risque augmente avec la posologie [26] et la présence de dépôts cornéens (en l’absence d’une autre cause potentielle) est considérée comme un facteur de risque de rétinopathie car signe d’un probable surdosage [27–29]. Des inclusions lysosomiales sont alors présentes au niveau des cellules basales de l’épithélium [30, 31]. La microscopie confocale in vivo a aussi montré la présence de microdépôts dans la couche basale de l’épithélium cornéen et au niveau du stroma antérieur, même en dehors de toute atteinte clinique [32, 33].
Comme avec les dépôts liés à l’amiodarone, l’atteinte cornéenne aux amino-4-quinoléines est réversible à l’arrêt du traitement, ce qui n’est pas le cas des complications iatrogènes rétiniennes, malheureusement.
Le tamoxifène, un antagoniste des œstrogènes utilisé en cancérologie, peut aussi être responsable d’une kératopathie épithéliale. La première description date de 1978 [34]. Les premiers cas rapportés concernaient des patients traités avec de fortes doses (40 mg/j). Avec des doses plus faibles (20 mg/j), la fréquence de l’atteinte cornéenne est très diversement observée. Certains notent une fréquence nulle ou très faible [35–38], d’autres indiquent une incidence de 10 % [39], voire 70 % [40]. Dans cette étude, l’analyse en microscopie confocale ne retrouvait pas d’anomalies notables, alors que des anomalies stromales ont été décrites dans une publication à propos d’un cas [41]. Une analyse histologique et en microscopie électronique de la biopsie cornéenne d’une patiente avec une atteinte clinique franche, et baisse modérée de l’acuité visuelle, a montré des dépôts denses autour du noyau des cellules basales de l’épithélium cornéen. Ces rares atteintes cornéennes sont réversibles et n’imposent pas l’arrêt du traitement.
La chlorpromazine, neuroleptique de la famille des phénotiazines, peut aussi entraîner des dépôts cornéens dans l’épithélium, le stroma et l’endothélium, de même d’ailleurs que dans le cristallin [42]. Là encore, la microscopie confocale permet d’observer les dépôts épithéliaux in vivo [43]. D’autres phénothiazines ont été associées à des dépôts du même type.
Enfin, et sans pour autant être exhaustifs, citons la possibilité de cornea verticillata dans le cadre de traitement par l’atovaquone (antiparasitaire utilisé dans le traitement des pneumocystoses [44]), le naproxène [45], l’indométhacine [46] et l’ibuprofène [47] (trois anti-inflammatoires non stéroïdiens), la clofazimine (utilisé dans les traitements des lèpres résistantes).
La cytarabine, utilisée en chimiothérapie dans le cadre des leucémies aiguës myéloblastiques et lymphoblastiques, peut être responsable d’une atteinte épithéliale cornéenne avec rougeur, larmoiement, sensation de corps étranger et baisse de vision [48]. Le risque est plus important lors de traitements par fortes doses. Le produit est retrouvé dans l’humeur aqueuse et les larmes [49]. L’examen clinique retrouve la présence de multiples kystes épithéliaux de petites tailles. L’évolution spontanée est favorable en quelques jours à l’arrêt du traitement. Il a été proposé d’utiliser des collyres aux corticoïdes à titre préventif pour les patients devant être traités par fortes doses de cytarabine [50], mais le traitement par larmes artificielles, qui diminue mécaniquement la concentration du produit à la surface de l’œil, semble être aussi efficace que les corticoïdes [49].
Ce type d’atteinte peut être retrouvé après une cure d’immunoglobulines administrées par voie intraveineuse, et les anomalies observées sont logiquement semblables à celles retrouvées chez des patients atteints de gammapathie monoclonale [51].
Les dépôts cristallins peuvent intéresser l’ensemble de la surface cornéenne, ils sont principalement localisés dans l’épithélium et le stroma antérieur [52]. Les signes fonctionnels peuvent associer baisse de vision et photophobie, mais toutes les anomalies sont réversibles à l’arrêt du traitement. Chez certains patients, les dépôts prédominent dans le stroma avec une disposition annulaire épargnant le centre de la cornée, l’acuité visuelle est alors conservée [53].
L’amantadine, utilisée dans la maladie de Parkinson et à titre prophylactique dans les grippes à virus influenza A, peut entraîner des dépôts cornéens sous-épithéliaux et de kératites ponctuées superficielles, avec baisse de vision [54, 55]. L’atteinte est réversible à l’arrêt du traitement.
Enfin, la capécitabine, précurseur métabolique du 5-fluoro-uracile, est un anticancéreux potentiellement responsable de kératite ponctuée avec dépôts sous-épithéliaux, irritation sévère et baisse de vision [56, 57]. L’atteinte est réversible en quelques semaines à l’arrêt du traitement.
Nous avons cité précédemment la chlorpromazine, antidépresseur de la famille des phénothiazines, pour sa capacité à induire des dépôts dans la cornée, la conjonctive et le cristallin [43, 58]. Les dépôts intracornéens sont bruns, granulaires et situés dans le stroma postérieur. L’atteinte est asymptomatique mais dose-dépendante et affecte la partie cornéenne exposée à la lumière. Les anomalies disparaissent à l’arrêt du traitement, mais cela peut prendre plusieurs années [59].
La clofazimine, antilépreux déjà décrit précédemment pour les dépôts dans les épithéliums cornéens et conjonctivaux, peut aussi s’accumuler sous forme de complexes cristallins dans le stroma cornéen antérieur chez la moitié des patients traités [60]. L’atteinte est asymptomatique et réversible à l’arrêt du traitement.
L’isotrétinoïne, utilisée dans les formes sévères d’acné, peut induire la formation de dépôts cornéens dans le stroma antérieur sur toute la surface de la cornée. L’incidence est cependant faible, estimée à 5 % des cas. L’atteinte est asymptomatique et réversible à l’arrêt du traitement [61].
Récemment, le nicorandil, un médicament anti-angoreux, a été impliqué dans des cas d’atteinte stromale avec ulcération cornéenne, pouvant aller jusqu’à la perforation [62–64]. Ce médicament est aussi connu pour donner des ulcérations cutanées et digestives parfois graves. La physiopathogénie est mal connue. Deux métabolites, la nicotinamide et l’acide nicotinique, sont impliqués en raison de leurs effets sur la vascularisation et la trophicité épithéliale [65].
La rifabutine, traitement des infections à mycobactéries atypiques (Mycobacterium avium complex ou MAC), a largement été décrite dans les années 1990 comme pourvoyeur d’uvéites antérieures avec hypopion (rapidement réversibles à l’arrêt du traitement). En dehors de toute inflammation, des dépôts cornéens endothéliaux sont aussi possibles [66, 67]. Ils sont fins, stellaires, débutent en périphérie de la cornée, mais n’induisent aucun trouble visuel. Leur fréquence globale, d’environ 20 %, augmente en réalité avec la durée du traitement.
La chlorpromazine (phénothiazine déjà décrite pour les dépôts épithéliaux et intrastromaux) peut aussi entraîner des dépôts endothéliaux [43, 68].
De même, l’amantadine, décrite ci-dessus pour le stroma, a été associée à des cas de d’œdème cornéen sans inflammation, mais responsable d’une baisse sévère de la vision [69–71]. La microscopie confocale a confirmé l’origine endothéliale de l’atteinte. Certains cas peuvent être irréversibles malgré l’arrêt du traitement [70, 71], imposant alors la réalisation d’une greffe de cornée transfixiante [70] ou d’une greffe endothéliale (Descemet’s stripping automated endothelial keratoplasty ou DSAEK) [71]. Dans ce dernier cas, l’analyse histologique des tissus prélevés montre une raréfaction des cellules endothéliales.
Pour information, l’encadré 12-1 rappelle les différentes classes thérapeutiques et/ou molécules actuellement retirées du marché et connues pour être responsables d’atteintes cornéennes [72].
Cornea verticillata
• Sels d’or
• Sels d’argent
• Mépacrine
• Maléate de perhexiline
• Suramine
• Hydrochloride de tilorone
• Monobenzone
Atteinte stromale
• Sels d’or
• Sels d’argent
Cette classe thérapeutique, qui a fait l’actualité il y a quelques années avec le retrait du marché du rofécoxib (Vioxx®) en raison d’effets indésirables vasculaires, comporte désormais cinq substances disponibles en France : le célécoxib, le parécoxib (prodrogue du valdécoxib), l’étoricoxib, l’étodolac et la nimésuline. Ils sont tous utilisés comme anti-inflammatoire en rhumatologie, sauf le parécoxib dont l’indication est l’analgésie postopératoire. Ils peuvent être responsables de conjonctivites, sans signes spécifiques, rapidement réversibles à l’arrêt du traitement [73]. Bien que le mécanisme n’en soit pas élucidé, le passage de produit dans les larmes pourrait expliquer cette irritation. Les anti-COX-2 peuvent aussi induire une myopisation, comme certaines autres substances, probablement aussi par œdème du corps ciliaire d’origine immuno-allergique [74].
Ils sont utilisés dans l’ostéoporose, la maladie de Paget, l’hypercalcémie maligne, l’ostéolyse maligne et le myélome. Leur utilisation à grande échelle dans les années 2000 a rapidement conduit à la constatation d’effets indésirables oculaires d’ordre inflammatoire [75, 76], notamment des uvéites, sclérites, épisclérites et conjonctivites. Les atteintes conjonctivales ont été rapportées avec de nombreux biphosphonates (pamidronate, alendronate, étidronate, risédronate et acide zolédronique). Elles apparaissent dans les 48 heures après la prise du médicament et se manifestent par une rougeur, un larmoiement, une photophobie et parfois un brouillard visuel. Si le traitement est arrêté, la conjonctivite est résolutive en quelques jours. Elle peut récidiver si le traitement est repris, mais souvent de façon moins importante. Il ne semble d’ailleurs pas indispensable d’arrêter le traitement devant un premier épisode de conjonctivite sous biphosphonate, si elle est bien tolérée et qu’elle tend à se résoudre [76].
Des formes plus sévères cliniquement peuvent cependant être observées. Des épisclérites ont principalement été décrites avec le pamidronate ; elles sont moins fréquentes que les conjonctivites. Des sclérites peuvent apparaître également avec la prise de pamidronate, d’alendronate et de risédronate. Elles prennent le plus souvent une forme antérieure et restent unilatérales, mais peuvent être associées à une uvéite. Ce type d’épisode inflammatoire important impose l’arrêt du biphosphonate et un traitement anti-inflammatoire local et/ou général [75]. Toutefois, rapportées à la fréquence des prescriptions, les atteintes iatrogènes sclérales par biphosphonate sont rares (environ 0,6 %, soit un cas sur 170 patients) [77].
Cette classe est indiquée dans le traitement des troubles érectiles en raison de son action sur des enzymes des cellules des muscles lisses des parois vasculaires des corps caverneux. En France, trois molécules sont disponibles (sildénafil, vardénafil et tadalafil). Si les effets indésirables visuels (sensation de flou, photophobie et vision bleutée ou cyanopsie) sont classiques et dose-dépendants, la iatrogénie sur la surface oculaire est plus rare [78]. Il s’agit principalement d’une hyperhémie conjonctivale isolée, réversible spontanément, et rarement associée à des douleurs oculaires. En revanche, la rougeur de la face et la congestion nasale sont fréquentes après une telle prise médicamenteuse. Une douleur oculaire peut être présente.
Les phénothiazines et la clofazimine, déjà citées dans les molécules responsables de troubles cornéens, peuvent aussi entraîner des dépôts conjonctivaux, d’ailleurs non symptomatiques.
La prise au long cours de minocycline, antibiotique de la classe des cyclines, peut induire une coloration sclérale, gris-bleu, disposée en bandes de quelques millimètres de haut depuis le limbe, dans l’aire palpébrale [79]. Sa disparition à l’arrêt du traitement n’est pas systématique.
Les médicaments donnés par voie systémique et responsables de sécheresse oculaire sont très divers. La Beaver Dam Study, fondée sur l’observation de 3 700 personnes, a donné des chiffres de risque relatif concernant différentes classes thérapeutiques [80].
Des études transversales ont aussi montré la relation entre traitement par voie générale et sécheresse oculaire [81–83].
Compte tenu des mécanismes en jeu dans ce type d’effet iatrogène, il n’est pas surprenant de constater que la polymédication augmente le risque de sécheresse, puisque les effets indésirables peuvent malheureusement s’additionner. Ainsi, Schein et al. ont montré sur 2 500 patients de plus de 65 ans que le risque relatif de sécheresse oculaire, par rapport à la population non traitée, est de 1,8 si l’ordonnance ne comprend qu’un seul médicament par voie générale, de 2,9 avec deux médicaments et de 7 avec cinq médicaments [82]. De plus, la moitié des patients atteints de sécheresse oculaire présentait aussi une sécheresse buccale. L’association des deux sites d’insuffisance de sécrétion est donc fréquente même en cas d’origine iatrogène et ne doit pas orienter systématiquement vers la recherche à tout prix d’une pathologie auto-immune.
La sécrétion lacrymale étant sous contrôle des systèmes parasympathique et sympathique (la glande lacrymale est directement innervée par les fibres autonomes issues du ganglion sphénopalatin), tous les médicaments à action anticholinergique sont susceptibles de provoquer une réduction du réflexe lacrymal et à terme des symptômes de sécheresse.
Les principaux produits et classes thérapeutiques ayant une action anticholinergique sont indiqués dans l’encadré 12-2.
• Antispasmodiques : tiémonium, clinidium, dihexyvérine, oxybutynine, trospium, toltérodine, solifénacine
• Anti-histaminiques anti-H1 : alimémazine, bromphéniramine, cyproheptadine, dexchlorphéniramine, hydroxyzine, isothipendyl, méquitazine, prométhazine, dimenhydrinate, diphenhydramine, carbinoxamine, piméthixène, oxomémazine, doxylamine
• Analgésique : néfopam
• Anti-arythmique : disopyramide
• Bronchodilatateurs : ipratropium, tiotropium
• Antiparkinsoniens : rihexyphénidyle, tropatépine, bipéridène
• Antidépresseurs imipraminiques : imipramine, clomipramine, dosulépine, amitriptyline, doxépine, amoxapine, trimipramine, maprotiline
• Neuroleptiques : chlorpromazine, lévopromazine, cyamémazine, propériciazine, fluphénazine, pipotiazine
Les médicaments anti-histaminiques de seconde génération, pourtant classés comme n’ayant pas de propriétés anticholinergiques propres, peuvent néanmoins diminuer la sécrétion lacrymale. À titre d’exemple, des sujets situés dans un environnement adverse mais contrôlé quant aux niveaux d’humidité, de vent et de température, et qui ont recu de la loratadine ou de la cétirizine ont effectivement développé des symptômes de sécheresse, avec en outre augmentation du temps de rupture des larmes et marquage de la conjonctive après coloration [84].
Les 15 β-bloquants actuellement disponibles par voie générale composent une classe médicamenteuse largement utilisée dans la population générale en raison de leurs multiples indications : hypertension artérielle, insuffisance coronaire, certaines arythmies, et même insuffisance cardiaque pour certaines molécules. Un de leurs effets indésirables les plus classiques est justement la diminution de sécrétion de la composante hydrique des larmes. Ils pourraient aussi induire une réduction de la sécrétion de lysozyme et des immunoglobulines A dans les larmes [85]. Ils peuvent donc déclencher ou aggraver un syndrome sec.
Les agonistes des récepteurs α2 centraux ont une action de diminution de sécrétion des larmes et de la salive. Dans cette classe, la clonidine est principalement responsable de sécheresse oculaire, alors que la méthyldopa, la moxonidine et la rilménidine entraînent plutôt une sécheresse buccale.
Les diurétiques thiazidiques (en particulier l’hydrochlorothiazide, la ciclétanine et l’indapamide) diminuent la sécrétion aqueuse lacrymale [86].
On sait qu’un nombre important de pathologies hormonales, ou même de simples dysfonctionnements, peuvent s’accompagner d’une sécheresse oculaire. Une modification hormonale d’origine thérapeutique représente donc aussi un facteur de risque de sécheresse.
Concernant le traitement hormonal substitutif (THS) de la ménopause, le suivi d’une large cohorte d’environ 25 000 femmes a montré qu’il est un facteur de risque d’apparition d’une sécheresse oculaire symptomatique [87]. Le risque relatif est d’ailleurs plus important dans le cadre d’un traitement par œstrogènes seuls comparé à une association œstroprogestative. Une des explications du rôle du THS dans l’origine du syndrome sec est qu’il aggrave le déséquilibre entre œstroprogestatifs et androgènes, ces derniers devenant de fait proportionnellement encore plus insuffisants, alors qu’on sait leur rôle dans l’homéostasie de l’unité fonctionnelle lacrymale [88].
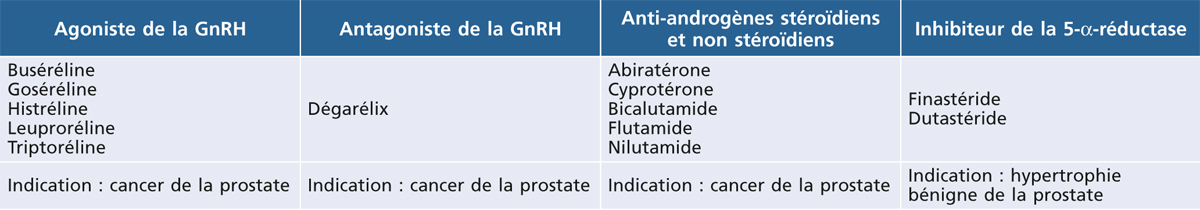
Il a été également clairement montré que les traitements anti-androgènes induisent une sécheresse oculaire, notamment par altération de la composante lipidique sécrétée par les glandes de Meibomius [89]. Cela a en particulier été démontré à propos de patients traités par des agonistes de l’hormone de libération des gonadotrophines (gonadotropin-releasing hormone ou GnRH), entraînant une diminution de la testostérone circulante, ou par des anti-androgènes non stéroïdiens, inhibant la liaison de la testostérone à son récepteur, ou encore par le finastéride, inhibiteur de la 5-α-réductase, qui elle-même diminue la conversion de la testostérone en un métabolite actif. Tous ces patients présentaient des symptômes de sécheresse oculaire accompagnés d’anomalies des glandes de Meibomius, dont les sécrétions, analysées en chromatographie, étaient modifiées dans leur composition lipidique (augmentation de la quantité relative de cholestérol par rapport aux di- et triglycérides, aux esters de cholestérol et aux esters cireux). Les principaux médicaments à action anti-androgène actuellement disponibles sont présentés dans le tableau 12-1.
L’isotrétinoïne est indiquée dans les formes sévères d’acné résistante aux traitements classiques bien conduits (c’est-à-dire associant une antibiothérapie systémique, à visée antibiotique et anti-inflammatoire, et un traitement topique). L’acitrétine et l’alitrétinoïne sont prescrites pour leur action kératolytique dans des cas sévères de psoriasis ou d’eczéma. Par un mécanisme incomplètement élucidé, les rétinoïdes induisent une diminution de production du sébum et ainsi une diminution de prolifération bactérienne au sein du follicule pileux.
Les effets indésirables oculaires reportés sont de plusieurs ordres : sécheresse, kératite, blépharoconjonctivite, trouble visuel, héméralopie, hypertension intracrânienne bénigne [61, 90–93]. Les effets sur la surface sont liés aux modifications de sécrétion des glandes de Meibomius. Le volume de sécrétion est diminué et la meibographie montre un certain degré d’atrophie des glandes [94]. La conséquence est une augmentation de l’évaporation des larmes avec augmentation de l’osmolarité sans modification du test de Schirmer [94]. L’atteinte semble dose-dépendante. Une étude a comparé des patients traités avec moins de 0,5 mg/kg/jour à des patients recevant des doses supérieures. Le test de Schirmer était équivalent dans les deux groupes mais le temps de rupture des larmes (break-up time ou BUT) était diminué dans le groupe recevant les doses les plus fortes [95]. Toutefois, les principaux signes de sécheresse oculaire induits par l’isotrétinoïne sont réversibles dans le mois suivant l’arrêt du traitement [95, 96].
La plupart des antimitotiques ont pour principal mode d’action de bloquer ou réduire la réplication ou la croissance des cellules à renouvellement rapide, ce qui explique leur effet sur les cellules cancéreuses. L’effet connexe est aussi une atteinte des épithéliums sains mais dont le taux de renouvellement est majeur, ce qui est le cas des épithéliums cornéens et conjonctivaux. Il est donc logique d’observer chez nombre de patients soumis à un traitement antimitotique agressif des signes d’atteinte des muqueuses et donc, pour l’œil, des signes de kératoconjonctivite sèche. À titre d’exemple, mais sans viser l’exhaustivité, le busulfan, la mitomycine C, le fluoro-uracile et le méthotrexate sont classiquement associés à ce type d’effet indésirable [97].
Certaines classes plus modernes d’anticancéreux semblent induire des effets indésirables particuliers sur la surface oculaire. Ainsi, les anticorps monoclonaux inhibiteurs du récepteur de croissance épidermique dits epidermal growth factor receptor ou EGFR (cétuximab, panitumumab et trastuzumab) et les inhibiteurs des tyrosines kinases (erlotinib, géfitinib et lapatinib) sont indiqués dans les tumeurs composées de cellules exprimant l’EGFR à leur surface (certains cancers du sein, cancer non à petites cellules des bronches, cancer du côlon, cancer du pancréas, cancer gastrique, cancer épidermoïde de la tête et du cou). Environ 3 semaines après le début du traitement, peuvent apparaître des blépharites, meibomites, syndromes secs avec diminution du BUT, conjonctivites, kératite et trichomégalie des cils et sourcils [98]. Le mécanisme précis de ces effets secondaires n’est pas connu. On doit toutefois remarquer que les mécanismes biologiques visés par les inhibiteurs des tyrosines kinases sont tellement distribués dans la plupart des voies de signalisation cellulaire qu’il n’est pas surprenant qu’un certain nombre de dysmétabolismes soient observés chez les patients.
La « médecine par les plantes » n’est évidemment pas dénuée de tout risque, puisque, lorsqu’elle repose sur l’absorption de produits ayant des effets pharmacologiques réels, ces derniers peuvent être tout aussi délétères que dans un médicament allopathique. Ainsi, la niacine (famille du nicorandil), aussi appelée acide nicotinique, ou encore vitamine B3 ou vitamine PP, est utilisée comme complément alimentaire anticholestérol. Elle peut être responsable de kératite épithéliale avec sécheresse oculaire [99]. Elle peut aussi induire un œdème palpébral, une décoloration des paupières, une perte des cils, un ptosis, et même des œdèmes maculaires cystoïdes responsables de baisse visuelle mais réversibles à l’arrêt du traitement.
Les autres plantes ou dérivés susceptibles d’entraîner une sécheresse oculaire sont le kava (proposé dans la lutte contre l’anxiété et la dépression), l’Echinacea (proposé dans les syndromes grippaux) et évidemment tous les produits contenant des alcaloïdes anticholinergiques tels que les extraits de datura, la belladone et la mandragore (proposés dans les bronchites et syndromes grippaux) [100].
En plus de dépôts épithéliaux, l’amiodarone peut être responsable de sécheresse [23].
D’autres médicaments sont incriminés [100–102]. Plusieurs molécules de la classe des anti-inflammatoires non stéroïdiens (aspirine, ibuprofène, kétoprofène, diclofénac) ont été associées à l’apparition d’une sécheresse oculaire (possiblement par le biais d’une toxicité épithéliale), de même que tous les opioïdes et les benzodiazépines, certains antiviraux (dont l’aciclovir) probablement par leur effet sur le renouvellement cellulaire, certains anti-histaminiques anti-H2 (traitement des ulcères gastriques) de première génération par leur effet anticholinergique, les antithyroïdiens comme le carbimazole et le propylthiouracile.
L’attribution d’un symptôme à un médicament précis n’est pas toujours aisée du fait d’une polymédication, voire d’une automédication, de plus en plus fréquente en raison à la fois du vieillissement de la population et de son accès aux sources de savoir médical. Par ailleurs, l’existence d’un terrain sous-jacent, comme une sécheresse oculaire préexistante, peut faciliter la survenue d’événements iatrogéniques. L’amélioration des symptômes à l’arrêt du médicament et la réapparition du symptôme à la reprise (éventuelle) du médicament sont des arguments majeurs pour incriminer de façon certaine le produit. Dans la vie courante, le doute persiste souvent.
De plus, les données de pharmacovigilance ne sont pas toujours aisément disponibles, et il est probable que certains effets indésirables soient sous-estimés ou, à l’inverse, surestimés car pas attribués au médicament réellement en cause.
Dans tous les cas, la solution idéale pour limiter les effets indésirables des médicaments est de toujours chercher à « déprescrire », c’est-à-dire alléger autant que possible les ordonnances aux seuls médicaments réellement indispensables pour le patient.
[1] François J. Cornea verticillata. Bull Soc Belge Ophtalmol 1968 ; 150 : 656-70.
[2] Watillon M, Lavergne G, Weekers JF. Corneal lesions during treatment with cordarone (amiodarone hydrochloride). Bull Soc Belge Ophtalmol 1968 ; 150 : 715-26.
[3] Toussaint D, Pohl S. Histologic aspect and ultrastructure of corneal deposits due to amiodarone hydrochloride. Bull Soc Belge Ophtalmol 1969 ; 153 : 675-86.
[4] Thilges V. Cordarone, a cause of micro-precipitates of corneal epithelium similar to those in chloroquine poisoning. Ann Ocul 1970 ; 203 : 151-7.
[5] Brini A, Porte A, Flament J. Corneal lesions caused by cordarone (amiodarone). Electron microscopy study. Bull Soc Ophtalmol Fr 1972 ; 72 : 83-7.
[6] Ingram DV, Jaggarao NS, Chamberlain DA. Ocular changes resulting from therapy with amiodarone. Br J Ophthalmol 1982 ; 66 : 676-9.
[7] Greene HL, Graham EL, Werner JA, et al. Toxic and therapeutic effects of amiodarone in the treatment of cardiac arrhythmias. J Am Coll Cardiol 1983 ; 2 : 1114-28.
[8] Harris L, Mckenna WJ, Rowland E, Krikler DM. Side effects and possible contraindications of amiodarone use. Am Heart J 1983 ; 106 : 916-23.
[9] Nielsen CE, Andreasen F, Bjerregaard P. Amiodarone induced cornea verticillata. Acta Ophthalmol (Copenh) 1983 ; 61 : 474-80.
[10] Kaplan LJ, Cappaert WE. Amiodarone keratopathy. Correlation to dosage and duration. Arch Ophthalmol 1982 ; 100 : 601-2.
[11] Orlando RG, Dangel ME, Schaal SF. Clinical experience and grading of amiodarone keratopathy. Ophthalmology 1984 ; 91 : 1184-7.
[12] Raeder EA, Podrid PJ, Lown B. Side effects and complications of amiodarone therapy. Am Heart J 1985 ; 109 : 975-83.
[13] Duff GR, Fraser AG. Impairment of colour vision associated with amiodarone keratopathy. Acta Ophthalmol (Copenh) 1987 ; 65 : 48-52.
[14] Dovie JM, Gurwood AS. Acute onset of halos and glare : bilateral corneal epithelial edema with cystic eruptions--atypical presentation of amiodarone keratopathy. Optom St Louis Mo 2006 ; 77 : 76-81.
[15] Dolan BJ, Flach AJ, Peterson JS. Amiodarone keratopathy and lens opacities. J Am Optom Assoc 1985 ; 56 : 468-70.
[16] Garrett SN, Waterhouse WJ, Parmley VC. Amiodarone keratopathy in the donor cornea. Am J Ophthalmol 1988 ; 105 : 425-7.
[17] D’Amico DJ, Kenyon KR, Ruskin JN. Amiodarone keratopathy : drug-induced lipid storage disease. Arch Ophthalmol 1981 ; 99 : 257-61.
[18] Ciancaglini M, Carpineto P, Zuppardi E, et al. In vivo confocal microscopy of patients with amiodarone-induced keratopathy. Cornea 2001 ; 20 : 368-73.
[19] Uçakhan OO, Kanpolat A, Ylmaz N, Ozkan M. Amiodarone keratopathy : an in vivo confocal microscopy study. Eye Contact Lens 2005 ; 31 : 148-57.
[20] Erdurmus M, Selcoki Y, Yagci R, Hepsen IF. Amiodarone-induced keratopathy : full-thickness corneal involvement. Eye Contact Lens 2008 ; 34 : 131-2.
[21] Falke K, Büttner A, Schittkowski M, et al. The microstructure of cornea verticillata in Fabry disease and amiodarone-induced keratopathy : a confocal laser-scanning microscopy study. Graefes Arch Clin Exp Ophthalmol 2009 ; 247 : 523-34.
[22] Wasielica-Poslednik J, Pfeiffer N, Reinke J, Pitz S. Confocal laser-scanning microscopy allows differentiation between Fabry disease and amiodarone-induced keratopathy. Graefes Arch Clin Exp Ophthalmol 2011 ; 249 : 1689-96.
[23] Mäntyjärvi M, Tuppurainen K, Ikäheimo K. Ocular side effects of amiodarone. Surv Ophthalmol 1998 ; 42 : 360-6.
[24] Easterbrook M. The ocular safety of hydroxychloroquine. Semin Arthritis Rheum 1993 ; 23 : 62-7.
[25] Grierson DJ. Hydroxychloroquine and visual screening in a rheumatology outpatient clinic. Ann Rheum Dis 1997 ; 56 : 188-90.
[26] Shearer RV, Dubois EL. Ocular changes induced by long-term hydroxychloroquine (plaquenil) therapy. Am J Ophthalmol 1967 ; 64 : 245-52.
[27] Easterbrook M. Is corneal deposition of antimalarial any indication of retinal toxicity ? Can J Ophthalmol J Can Ophtalmol 1990 ; 25 : 249-51.
[28] Neubauer AS, Samari-Kermani K, Schaller U, et al. Detecting chloroquine retinopathy : electro-oculogram versus colour vision. Br J Ophthalmol 2003 ; 87 : 902-8.
[29] Bernstein HN. Ophthalmologic considerations and testing in patients receiving long-term antimalarial therapy. Am J Med 1983 ; 75 : 25-34.
[30] Hirst LW, Sanborn G, Green WR, et al. Amodiaquine ocular changes. Arch Ophthalmol 1982 ; 100 : 1300-4.
[31] Pülhorn G, Thiel HJ. Ultrastructural aspects of chloroquin-keratopathy (author’s transl). Albrecht Von Graefes Arch Klin Exp Ophthalmol 1976 ; 201 : 89-99.
[32] Slowik C, Somodi S, Von Gruben C, et al. Detection of morphological corneal changes caused by chloroquine therapy using confocal in vivo microscopy. Ophthalmol Z Dtsch Ophthalmol Ges 1997 ; 94 : 147-51.
[33] Ma X, He L, He D, Xu J. Chloroquine keratopathy of rheumatoid arthritis patients detected by in vivo confocal microscopy. Curr Eye Res 2012 ; 37 : 293-9.
[34] Kaiser-Kupfer Mi, Lippman ME. Tamoxifen retinopathy. Cancer Treat Rep 1978 ; 62 : 315-20.
[35] Heier JS, Dragoo RA, Enzenauer RW, Waterhouse WJ. Screening for ocular toxicity in asymptomatic patients treated with tamoxifen. Am J Ophthalmol 1994 ; 117 : 772-5.
[36] Parkkari M, Paakkala AM, Salminen L, Holli K, Finnish Breast Cancer Group. Ocular side-effects in breast cancer patients treated with tamoxifen and toremifene : a randomized follow-up study. Acta Ophthalmol Scand 2003 ; 81 : 495-9.
[37] Pavlidis Na, Petris C, Briassoulis E, et al. Clear evidence that long-term, low-dose tamoxifen treatment can induce ocular toxicity. A prospective study of 63 patients. Cancer 1992 ; 69 : 2961-4.
[38] Therssen R, Jansen E, Leys A, et al. Screening for tamoxifen ocular toxicity : a prospective study. Eur J Ophthalmol 1995 ; 5 : 230-4.
[39] Noureddin BN, Seoud M, Bashshur Z, et al. Ocular toxicity in low-dose tamoxifen : a prospective study. Eye Lond Engl 1999 ; 13 : 729-33.
[40] Muftuoglu O, Uçakhan OO, Kanpolat A. Clinical and in vivo confocal microscopy findings in patients receiving tamoxifen citrate. Eye Contact Lens 2006 ; 32 : 228-32.
[41] Tarafdar S, Lim LT, Collins CE, Ramaesh K. Tamoxifen keratopathy as seen with in-vivo confocal microscopy. Semin Ophthalmol 2012 ; 27 : 27-8.
[42] Johnson AW, Buffaloe WJ. Chlorpromazine epithelial keratopathy. Arch Ophthalmol 1966 ; 76 : 664-7.
[43] Toshida H, Uesugi Y, Ebihara N, Murakami A. In vivo observations of a case of chlorpromazine deposits in the cornea using an HRT II Rostock corneal module. Cornea 2007 ; 26 : 1141-3.
[44] Shah GK, Cantrill HL, Holland EJ. Vortex keratopathy associated with atovaquone. Am J Ophthalmol 1995 ; 120 : 669-71.
[45] Szmyd L Jr, Perry HD. Keratopathy associated with the use of naproxen. Am J Ophthalmol 1985 ; 99 : 598.
[46] Burns CA. Indomethacin, reduced retinal sensitivity, and corneal deposits. Am J Ophthalmol 1968 ; 66 : 825-35.
[47] Fitt A, Dayan M, Gillie RF. Vortex keratopathy associated with ibuprofen therapy. Eye Lond Engl 1996 ; 10 : 145-6.
[48] Hopen G, Mondino BJ, Johnson BL, Chervenick PA. Corneal toxicity with systemic cytarabine. Am J Ophthalmol 1981 ; 91 : 500-4.
[49] Higa GM, Gockerman JP, Hunt AL, et al. The use of prophylactic eye drops during high-dose cytosine arabinoside therapy. Cancer 1991 ; 68 : 1691-3.
[50] Lass JH, Lazarus HM, Reed MD, Herzig RH. Topical corticosteroid therapy for corneal toxicity from systemically administered cytarabine. Am J Ophthalmol 1982 ; 94 : 617-21.
[51] Steinberg J, Eddy MT, Katz T, et al. Bilateral crystalline corneal deposits as first clinical manifestation of monoclonal gammopathy : a case report. Case Rep Ophthalmol 2011 ; 2 : 222-7.
[52] Erdem E, Kocabas E, Taylan Sekeroglu H, et al. Crystalline-like keratopathy after intravenous immunoglobulin therapy with incomplete kawasaki disease : case report and literature review. Case Rep Ophthalmol Med 2013 ; 2013 : 621952.
[53] Budde M, Gusek-Schneider GC, Mayer U, Seitz B. Annular crystalline keratopathy in association with immunoglobulin therapy for pyoderma gangrenosum. Cornea 2003 ; 22 : 82-5.
[54] Fraunfelder FT, Meyer SM. Amantadine and corneal deposits. Am J Ophthalmol 1990 ; 110 : 96-7.
[55] Nogaki H, Morimatsu M. Superficial punctate keratitis and corneal abrasion due to amantadine hydrochloride. J Neurol 1993 ; 240 : 388-9.
[56] Waikhom B, Fraunfelder FT, Henner WD, Walkhom B. Severe ocular irritation and corneal deposits associated with capecitabine use. N Engl J Med 2000 ; 343 : 740-1.
[57] Zarfoss M, Bentley E, Milovancev M, et al. Histopathologic evidence of capecitabine corneal toxicity in dogs. Vet Pathol 2007 ; 44 : 700-2.
[58] Delong SL, Poley BJ, Mcfarlane JR Jr. Ocular changes associated with long term chlorpromazine therapy. Arch Ophthalmol 1965 ; 73 : 611-7.
[59] Lal S, Bloom D, Silver B, et al. Replacement of chlorpromazine with other neuroleptics : effect on abnormal skin pigmentation and ocular changes. J Psychiatry Neurosci JPN 1993 ; 18 : 173-7.
[60] Kaur I, Ram J, Kumar B, et al. Effect of clofazimine on eye in multibacillary leprosy. Indian J Lepr 1990 ; 62 : 87-90.
[61] Fraunfelder FT, Labraico JM, Meyer SM. Adverse ocular reactions possibly associated with isotretinoin. Am J Ophthalmol 1985 ; 100 : 534-7.
[62] Trechot F, Batta B, Petitpain N, et al. A case of nicorandil-induced unilateral corneal ulceration. Int Wound J 2014 ; 11 : 238-9.
[63] Campolmi N, Guy C, Cinotti E, et al. Corneal perforation : another side effect of nicorandil. Cutan Ocul Toxicol 2014 ; 33 : 96-8.
[64] Fraunfelder FW, Fraunfelder FT. Conjunctival and corneal ulceration associated with nicorandil. Cutan Ocul Toxicol 2014 ; 33 : 120-1.
[65] Trechot P, Jouzeau JY, Brouillard C, et al. Role of nicotinic acid and nicotinamide in nicorandil-induced ulcerations : from hypothesis to demonstration. Int Wound J 2013 Sep 13.
[66] Holland SP, Chang CW, Vagh M, Courtright P. Corneal endothelial deposits in patients with HIV infection or AIDS : epidemiologic evidence of the contribution of rifabutin. Can J Ophthalmol J Can Ophtalmol 1999 ; 34 : 204-9.
[67] Smith JA, Mueller BU, Nussenblatt RB, Whitcup SM. Corneal endothelial deposits in children positive for human immunodeficiency virus receiving rifabutin prophylaxis for Mycobacterium avium complex bacteremia. Am J Ophthalmol 1999 ; 127 : 164-9.
[68] Phua YS, Patel DV, Mcghee CNJ. In vivo confocal microstructural analysis of corneal endothelial changes in a patient on long-term chlorpromazine therapy. Graefes Arch Clin Exp Ophthalmol 2005 ; 243 : 721-3.
[69] Hughes B, Feiz V, Flynn SB, Brodsky MC. Reversible amantadine-induced corneal edema in an adolescent. Cornea 2004 ; 23 : 823-4.
[70] Jeng BH, Galor A, Lee MS, et al. Amantadine-associated corneal edema potentially irreversible even after cessation of the medication. Ophthalmology 2008 ; 115 : 1540-4.
[71] Hood CT, Langston RHS, Schoenfield LR, Dupps WJ Jr. Amantadine-associated corneal edema treated with descemet’s stripping automated endothelial keratoplasty. Ophthalmic Surg Lasers Imaging 2010 ; 41 Online : 1-4.
[72] Hollander DA, Aldave AJ. Drug-induced corneal complications. Curr Opin Ophthalmol 2004 ; 15 : 541-8.
[73] Fraunfelder FW, Solomon J, Mehelas TJ. Ocular adverse effects associated with cyclooxygenase-2 inhibitors. Arch Ophthalmol 2006 ; 124 : 277-9.
[74] Rousseau A, Labetoulle M. Atteintes ophtalmologiques d’origine médicamenteuse. Encycl Méd Chir (Elsevier, Paris). Ophtalmologie. 2012, 9 : 1-9.
[75] Fraunfelder FW, Fraunfelder FT. Bisphosphonates and ocular inflammation. N Engl J Med 2003 ; 348 : 1187-8.
[76] Fraunfelder FW, Fraunfelder FT, Jensvold B. Scleritis and other ocular side effects associated with pamidronate disodium. Am J Ophthalmol 2003 ; 135 : 219-22.
[77] Etminan M, Forooghian F, Maberley D. Inflammatory ocular adverse events with the use of oral bisphosphonates : a retrospective cohort study. CMAJ 2012 ; 184 : E431-434.
[78] Lasudry J. The pathology of ocular syndromes caused by toxicity. Bull Soc Belge Ophtalmol 2007 ; 304 ; 155-78.
[79] Fraunfelder FT, Randall JA. Minocycline-induced scleral pigmentation. Ophthalmology 1997 ; 104 : 936-8.
[80] Moss SE, Klein R, Klein BE. Long-term incidence of dry eye in an older population. Optom Vis Sci 2008 ; 85 : 668-74.
[81] Moss SE, Klein R, Klein BE. Prevalence of and risk factors for dry eye syndrome. Arch Ophthalmol 2000 ; 118 : 1264-8.
[82] Schein OD, Hochberg MC, Muñoz B, et al. Dry eye and dry mouth in the elderly : a population-based assessment. Arch Intern Med 1999 ; 159 : 1359-63.
[83] Schaumberg DA, Dana R, Buring JE, Sullivan DA. Prevalence of dry eye disease among US men : estimates from the Physicians’ Health Studies. Arch Ophthalmol 2009 ; 127 : 763-8.
[84] Ousler GW, Wilcox KA, Gupta G, Abelson MB. An evaluation of the ocular drying effects of 2 systemic antihistamines : loratadine and cetirizine hydrochloride. Ann Allergy Asthma Immunol 2004 ; 93 : 460-4.
[85] Bartlett JD. Ophthalmic toxicity by systemic drugs. In : Chiou GCY. Ed. Ophthalmic toxicology. Philadelphia : Taylor & Francis ; 1999.
[86] Bergmann MT, Newman BL, Johnson NC Jr. The effect of a diuretic (hydrochlorothiazide) on tear production in humans. Am J Ophthalmol 1985 ; 99 : 473-5.
[87] Schaumberg DA, Buring JE, Sullivan DA, Dana MR. Hormone replacement therapy and dry eye syndrome. JAMA 2001 ; 286 : 2114-9.
[88] Sullivan DA, Sullivan BD, Evans JE, et al. Androgen deficiency, Meibomian gland dysfunction, and evaporative dry eye. Ann N Y Acad Sci 2002 ; 966 : 211-22.
[89] Krenzer KL, Dana MR, Ullman MD, et al. Effect of androgen deficiency on the human meibomian gland and ocular surface. J Clin Endocrinol Metab 2000 ; 85 : 4874-82.
[90] Fraunfelder FT, Fraunfelder FW, Edwards R. Ocular side effects possibly associated with isotretinoin usage. Am J Ophthalmol 2001 ; 132 : 299-305.
[91] Denis P, Nordmann JP, Saiag P, et al. Chronic blepharoconjunctivitis during a treatment with acitretin (Soriatane). J Fr Ophtalmol 1993 ; 16 : 191-4.
[92] Katz HI, Waalen J, Leach EE. Acitretin in psoriasis : an overview of adverse effects. J Am Acad Dermatol 1999 ; 41 : S7-S12.
[93] Labetoulle M, Offret H, Bournerias I, Frau E. Rapid improvement of chronic interstitial keratitis with acitretin. Br J Ophthalmol 2002 ; 86 : 1445-6.
[94] Mathers WD, Shields WJ, Sachdev MS, et al. Meibomian gland morphology and tear osmolarity : changes with Accutane therapy. Cornea 1991 ; 10 : 286-90.
[95] Cumurcu T, Sezer E, Kilic R, Bulut Y. Comparison of dose-related ocular side effects during systemic isotretinoin administration. Eur J Ophthalmol 2009 ; 19 : 196-200.
[96] Aragona P, Cannavo SP, Borgia F, Guarneri F. Utility of studying the ocular surface in patients with acne vulgaris treated with oral isotretinoin : a randomized controlled trial. Br J Dermatol 2005 ; 152 : 576-8.
[97] Maino DM, Tran S, Mehta F. Side effects of chemotherapeutic oculo-toxic agents : a review. Clin Eye Vis Care 2000 ; 12 : 113-7.
[98] Fraunfelder FT, Fraunfelder FW. Trichomegaly and other external eye side effects associated with epidermal growth factor. Cutan Ocul Toxicol 2012 ; 31 : 195-7.
[99] Fraunfelder FW. Ocular side effects from herbal medicines and nutritional supplements. Am J Ophthalmol 2004 ; 138 : 639-47.
[100] Askeroglu U, Alleyne B, Guyuron B. Pharmaceutical and herbal products that may contribute to dry eyes. Plast Reconstr Surg 2013 ; 131 : 159-67.
[101] Fraunfelder FT, Sciubba JJ, Mathers WD. The role of medications in causing dry eye. J Ophthalmol 2012 ; 2012 : 285851.
[102] Wong J, Lan W, Ong LM, Tong L. Non-hormonal systemic medications and dry eye. Ocul Surf 2011 ; 9 : 212-26.
T. Bury, F. De Blay, T. Bourcier
Les manifestations oculaires en lien éventuel avec la pollution peuvent revêtir de multiples aspects : simple irritation, véritable conjonctivite ou kératoconjonctivite, décompensation d’un syndrome sec ou d’une allergie, intolérance aux lentilles de contact. L’expression « allergie oculaire urbaine » a même été employée.
La pollution est définie par « l’émission d’une substance d’origine naturelle ou produite par l’homme à une concentration telle qu’elle ne peut être absorbée par l’environnement ». On distingue la pollution extérieure (chimique, sonore, lumineuse, radioactive, aérobiologique) de la pollution intérieure. Les effets de la pollution extérieure chimique sur l’environnement sont bien connus et parfaitement détaillés par les médias. La pollution est un problème mondial plus que jamais d’actualité.
Un rapport établi par l’Organisation mondiale de la santé (OMS) publié en 2014 indique que la pollution est responsable d’un décès sur huit dans le monde. Ainsi sept millions de personnes seraient mortes en 2012 en raison de la pollution de l’air. Cette mortalité est attribuée à l’accroissement de pathologies cardiovasculaires et la décompensation d’insuffisances respiratoires chroniques. Il a également été démontré que les différents polluants ont un effet irritant sur la peau et les muqueuses, notamment respiratoires. Ils seraient aussi pour partie responsables de l’augmentation de la sensibilité aux allergènes mais aussi du nombre exponentiel de patients allergiques.
L’œil et, en particulier, la surface oculaire directement influencée par les conditions environnementales constituent une cible privilégiée pour la pollution.
Quelques études expérimentales ont confirmé le caractère toxique de certains polluants vis-à-vis de la surface oculaire.
Plusieurs études cliniques et épidémiologiques réalisées ces dernières années permettent de conclure que la pollution peut être un des modes d’entrée dans le cercle vicieux des pathologies de la surface oculaire ou un facteur d’aggravation chez des sujets déjà prédisposés.
Il n’existe pas de traitement spécifique pour l’heure, les substituts lacrymaux et les collyres anti-allergiques peuvent être proposés en fonction de l’aspect clinique.
S’il existe un lien prouvé entre pollution et surface oculaire, des études prospectives restent nécessaires afin de déterminer la part exacte de ces différentes conditions environnementales sur l’incidence des pathologies oculaires.
Un nombre croissant de patients vivant principalement en milieu urbain consultent pour des conjonctivites qui ne sont pas véritablement allergiques, infectieuses ou sèches, mais qui ont la particularité de survenir ou d’être exacerbées lorsque la qualité de l’air est mauvaise. Au-delà de notre expérience quotidienne, des études cliniques ont confirmé l’existence d’une relation directe de cause à effet entre des symptômes irritatifs de surface oculaire et certains paramètres environnementaux. S’agit-il d’une véritable entité nosologique ou de phénomènes mineurs mis excessivement en avant dans une société devenue de plus en plus attentive et sensible aux problèmes environnementaux ?
Il est classique de distinguer la pollution extérieure – qui peut être chimique (due à l’activité humaine ou d’origine naturelle), sonore, lumineuse (éclairages artificiels), radioactive (nuage de Tchernobyl), aérobiologique (dispersion des poils foliaires des jeunes feuilles, désagrégation des capitules du platane à feuilles d’érable) – de la pollution intérieure.
Pour mémoire, rappelons qu’une entité, le sick building syndrome, a été décrite ainsi que d’autres pathologies liées à la pollution de l’environnement intérieur et que l’on distingue parmi les divers polluants intérieurs – les polluants particulaires tels que la poussière, les fibres minérales synthétiques (matériaux d’isolation), le tabac. Parmi les polluants chimiques figurent les aldéhydes (peintures, bois aggloméré), les composés organiques volatils (matériaux de construction, colles, revêtements, moisissures), l’oxyde de carbone (CO) et la fumée de tabac (CO, nicotine, composés organiques volatils). Les polluants biologiques sont avant tout les moisissures : Stachybotrys chartarum, Aspergillus, Fusarium, Alternaria [1].
Le nombre sans cesse croissant de voitures et camions, l’intensification du trafic de ces véhicules générateurs d’émissions de particules de combustion des carburants, les modifications des conditions climatiques altèrent la qualité de l’air. Les effets de la pollution extérieure chimique sur l’environnement sont bien connus et parfaitement détaillés par les médias : pluies acides, brouillards photochimiques, déplétion de la couche d’ozone, accroissement de l’effet de serre. Les conséquences à court terme sur les êtres humains sont toutes aussi nombreuses et commencent à être bien connues des médecins, des scientifiques et de certains patients « à risque » [2]. Ce sous-chapitre a pour objectif d’effectuer une revue de la littérature sur le sujet.
La variété et les concentrations des polluants chimiques sont en augmentation ces dernières années dans la plupart des grandes métropoles de la planète (fig. 12-9). Ce phénomène est dû principalement à l’intensification du trafic automobile et au pourcentage croissant de véhicules Diesel. Il faut y associer le rôle important de la pollution industrielle qui génère des « cocktails » de polluants atmosphériques en concentrations parfois très élevées (fig. 12-10).

Fig. 12-9 La pollution parisienne.
Fig. 12-10 Les différents polluants atmosphériques.
Les polluants primaires sont ceux émis directement dans l’atmosphère par une source déterminée fixe, mobile ou naturelle. Les émissions toxiques les plus importantes sont représentées par le CO (monoxyde de carbone) et le CO2 (dioxyde de carbone) dont les concentrations croissantes sont dues à l’excès de production des gaz d’échappement et la diminution de leur résorption liée à la déforestation. D’autres polluants tels que les oxydes de soufre (SO, SO2), le dioxyde d’azote (NO2), le monoxyde d’azote (NO), le plomb, les hydrocarbures, certaines particules (PM) résultent de la combustion des moteurs. Les polluants secondaires sont issus de la transformation des polluants primaires à la suite de réactions photochimiques et d’interaction des polluants primaires entre eux. C’est le cas de l’ozone (O3) qui résulte de la dégradation des oxydes d’azote (NO, NO2) et de carbone (CO, CO2) sous l’influence des rayons UV. L’O3 de la troposphère est en revanche détruit par les rejets industriels, les gaz aérosols (CCL3F, CCL2F2) et les perfluorocarbones (CLFCs), créant ainsi les fameux « trous » dans la couche d’ozone.
La pollution est un problème mondial qui est plus que jamais d’actualité. Un rapport établi par l’Organisation mondiale de la santé (OMS) a été publié en 2014 et ses conclusions sont sans appel. Le seuil maximum fixé par l’OMS de 20 μg/m3 pour la concentration moyenne annuelle de particules fines PM10 (particulate matter [PM], particules d’un diamètre inférieur ou égal à 10 microns) a été largement dépassé dans de nombreuses grandes métropoles. Ainsi à Paris lors des récents pics de pollution en mars 2014, on a atteint un niveau de concentration de 100 μg/m3. Dans la ville de Peshawar, dans le nord-est du Pakistan, on note un niveau de concentration de 540 μg/m3. Globalement dans le monde, les chiffres de concentration de particules fines PM10 se sont accrus de 6 % au cours des trois dernières années, confirmant les rapports précédents. Ce même rapport de l’OMS indique que la pollution est responsable d’un décès sur huit dans le monde. Ainsi sept millions de personnes seraient mortes en 2012 en raison de la pollution de l’air [3].
Plusieurs études épidémiologiques ont permis de mettre en évidence une relation à court terme entre pollution atmosphérique, mortalité et pathologies cardiovasculaires (angor, infarctus du myocarde, accidents vasculaires cérébraux) [4–6]. Il a également été démontré que les différents polluants générés par la circulation automobile ou par les industries ont un effet irritant sur la peau, les muqueuses, notamment respiratoires. Ainsi, des relations directes entre crises d’asthme, bronchites, décompensation d’insuffisances respiratoires chroniques et pollution atmosphérique ont été décrites [7]. Les polluants atmosphériques pourraient avoir des effets sur les grains de pollen. Ces effets peuvent être indirects par modification de la croissance des plantes et arbres ou directs par contamination des pollens aéroportés. Des modifications de structure, d’ultrastructure, de composition chimique des pollens ont en effet été rapportées dans les zones polluées. Les pollens pollués ont ainsi un plus fort potentiel allergénique que les pollens non pollués en conditions expérimentales. Polluants et pollens ont un effet synergique d’augmentation du stress oxydant au niveau des muqueuses et peuvent induire des allergies respiratoires (mais aussi probablement des conjonctivites), chez des sujets sensibilisés en abaissant le seuil de sensibilité aux allergènes. L’O3, les PM et SO2 ont des effets inflammatoires par augmentation de la perméabilité vasculaire dès la pénétration des allergènes dans les muqueuses et augmentation des interactions avec les cellules immunitaires. Les particules Diesel (diesel exhaust particles ou DEP) favorisent la synthèse d’IgE chez les sujets atopiques. Une étude récente a montré que la pollution augmente à long terme la sensibilisation atopique chez les enfants lorsque ceux-ci vivent en zone urbaine par rapport aux enfants habitant la campagne [8, 9]. Récemment, il a été montré que l’administration par voie intranasale, chez des sujets atopiques, d’un allergène seul provoque une augmentation de deux à trois fois de la production d’IgE spécifiques, alors qu’elle est multipliée par seize en cas d’administration conjointe de particules Diesel [10]. Enfin, la proportion des sujets allergiques devrait atteindre 50 % entre 2035 et 2050. Les deux raisons majeures incriminées sont environnementales : réchauffement climatique et pollution [11].
Les effets de la pollution extérieure sur l’œil sont en revanche moins bien connus. L’œil constitue pourtant une cible privilégiée pour la pollution. Le film lacrymal et la surface cornéoconjonctivale sont en contact direct avec l’environnement extérieur et peuvent ainsi être directement influencés par les conditions environnementales. Les manifestations oculaires peuvent revêtir de multiples aspects :
patients souffrant de signes fonctionnels à type d’irritations, picotements, prurit, lourdeur, photophobie, sensation de corps étranger, brûlures oculaires mais ayant un examen clinique normal ;
patients souffrant des mêmes symptômes mais ayant à l’examen une hyperhémie conjonctivale, une kératite ponctuée superficielle (test à la fluorescéine, test au vert de lissamine), une altération du film lacrymal (break-up time [BUT] écourté, test de Schirmer diminué) ;
aggravation des signes et symptômes d’une sécheresse oculaire ou d’une allergie oculaire connue et jusqu’alors stable ;
intolérance au port de lentilles de contact.
Ces manifestations surviennent en période de forte pollution et dans certaines situations météorologiques particulières (fortes températures, vitesses du vent faibles). Elles ne sont pas sans conséquences sur la qualité de vie, la productivité et les dépenses de santé.
Les termes ou concepts de « conjonctivite » ou d’« hyperréactivité conjonctivale non spécifique », de « syndrome d’inconfort oculaire », de « conjonctivite perannuelle non allergique », de « conjonctivite pseudo-allergique », de « kératoconjonctivite liée à la pollution », d’« allergie oculaire urbaine » ont été employés [12–14].
Quelques études expérimentales mettant en présence des volontaires sains ou des animaux avec des concentrations anormalement élevées de polluants ont confirmé le caractère toxique de certains polluants vis-à-vis de la surface oculaire.
Aucune donnée n’existe dans la littérature concernant l’incidence et la prévalence de ces conjonctivites engendrées ou majorées par la pollution. En revanche, quelques études épidémiologiques concernant les relations entre pathologies oculaires et pollution extérieure sont disponibles à ce jour.
Une étude épidémiologique concernant les relations entre pathologies oculaires et pollution extérieure a été réalisée au centre hospitalier national d’ophtalmologie des Quinze-Vingts à Paris en collaboration avec Météo France et Air Parif entre le 1er janvier et le 31 décembre 1999. Elle a permis de déterminer l’existence de relations directes à court terme entre le nombre d’urgences ophtalmologiques (patients consultant pour des pathologies de surface oculaire), l’exposition à certains polluants atmosphériques (O3, SO2, NO) et les conditions météorologiques (température de l’air, force du vent) enregistrées le jour même ou la veille à Paris [15].
D’autres investigations ont démontré que les polluants atmosphériques NO, NO2, O3, SO2, et PM10 majorent les symptômes d’allergie oculaire, tout comme ils majorent l’allergie nasale et respiratoire pendant la période pollinique.
Les divers paramètres météorologiques influencent également le niveau de pollution en modifiant l’exposition aux différents polluants et allergènes présents dans l’atmosphère [10]. L’association entre forte chaleur d’été ou temps clair d’hiver et pollution à l’ozone, l’effet synergique des polluants et des aéro-allergènes en sont des exemples bien connus. En outre, une faible humidité, un fort vent peuvent affecter la stabilité du film lacrymal et augmenter la survenue de pathologies de surface oculaire (voir fig. 12-9).
Le stress oxydant est le mécanisme le plus souvent invoqué pour expliquer les effets de la pollution atmosphérique sur l’asthme et la rhinoconjonctivite allergique. Les DEP et les polluants gazeux sont des oxydants puissants qui produisent des radicaux libres et de l’oxygène aboutissant à la production de cytokines pro-inflammatoires et à la modification des protéines cellulaires. L’augmentation de l’inflammation génère ensuite plus de ROS (reactive oxygen species) qui débordent les capacités anti-oxydantes locales. Il existe en outre une modification de la réponse immunitaire innée et adaptative : altération de la fonction des macrophages, augmentation de la production d’IgE.
Au niveau de la surface oculaire, des changements de pH lacrymal (acidification des larmes) dus au pouvoir oxydatif de NO, NO2, SO2 pourraient exercer un effet irritant sur la surface oculaire (stimulation des chimio-récepteurs de la cornée et de la conjonctive). D’autres phénomènes incluant une réduction de la couche lipidique du film lacrymal, une solubilisation des polluants dans le film lacrymal, une augmentation des cellules inflammatoires dans les larmes, une hyperplasie des cellules à mucus ont été décrits. Récemment, une étude a montré une aggravation ou une augmentation du nombre de blépharites corrélée à des niveaux élevés de particules (PM10) ou de NO2 [16]. Des sujets sains exposés à de forts taux de pollution au quotidien, bien qu’asymptomatiques, ont leur nombre de cellule à mucus tarsales et bulbaires augmenté. La concentration d’ARNm de MUC5AC (mucine oculaire) est également corrélée à de forts taux particulaires ou de NO2, ce qui suggère la possibilité d’un phénomène d’adaptation de la surface oculaire à la pollution [17].
Ainsi, les patients souffrant de manifestations oculaires liées à la pollution ne sont probablement par allergiques aux polluants, car il n’est pas possible de mettre en évidence d’IgE vis-à-vis de ces molécules. En revanche, les polluants stimulent les terminaisons nerveuses et le système immunitaire muqueux qui en retour produit une réaction de type inflammatoire interprétée comme « allergique ».
Au vu de ces résultats, on peut conclure que la pollution représente une source possible d’agression de la surface oculaire ou un facteur d’aggravation chez des sujets déjà prédisposés (fig. 12-11) [18].
Fig. 12-11 Cycle inflammatoire de la surface oculaire et de la pollution extérieure, modifié d’après DEWS [18].
L’utilisation de larmes artificielles ou de solutions de lavage oculaire constitue une approche logique en protégeant l’épithélium cornéoconjonctival et permettant le lavage et la dilution des polluants, allergènes et substances pro-inflammatoires présents à la surface oculaire. L’utilisation de molécules destinées à combattre le stress oxydant tels que les anti-inflammatoires non stéroïdiens (AINS) serait envisageable mais, du fait de leur mécanisme d’action, ceux-ci ne traiteraient qu’une partie des phénomènes inflammatoires. Les collyres anti-allergiques « double action » ou « multiple action » (azélastine, épinastine, kétotifène, olopatadine) ont été proposés et pourraient être l’objet d’évaluations cliniques en attendant le développement de molécules à action plus spécifique.
Il existe un lien prouvé entre pollution environnementale et surface oculaire. Cependant, même si les manifestations oculaires (conjonctivite, blépharite, kératite, altération du film lacrymal) dues à une mauvaise qualité de l’air sont bien réelles, elles ne peuvent pas être considérées comme spécifiques car elles partagent des caractéristiques communes avec l’allergie, la sécheresse et les conjonctivites toxiques. Des études prospectives sont nécessaires afin de déterminer la part exacte des différentes conditions environnementales (pollution extérieure, pollution intérieure, paramètres météorologiques, allergènes) sur l’incidence des pathologies de surface oculaire. D’autres travaux destinés à modéliser les relations entre l’œil et son environnement devraient permettre d’améliorer la prise en charge de nos patients en créant un système efficace de surveillance et de prévision permettant d’envisager des traitements spécifiques et/ou préventifs pour les personnes « à risque ». Enfin, les effets à long terme de ces facteurs environnementaux sur la surface oculaire demeurent mal connus.
[1] Dumon MC, Auger R. Pollution biologique urbaine par le platane à feuilles d’érable. Bull Soc Pharm Bordeaux 2005 ; 144 : 279-300.
[2] Thielebeule U, Pelech L. Epidemiological studies regarding the effects of air pollution. J Hyg Epidemiol Microbiol Immunol 1985 ; 29 : 353-62.
[3] Van Eeckhout L. La pollution de l’air touche neuf citadins sur dix dans le monde. Le Monde, 2014, 07 mai.
[4] Samet JM, Dominici F, Curriero FC, Coursac I, Zeger SL. Fine particulate air pollution and mortality in 20 U.S. cities, 1987-1994. N Engl J Med 2000 ; 343 : 1742-49.
[5] Medina S, Le Tertre A, Quenel P, et al. Air pollution and doctors’ house calls : results from the ERPURS system for monitoring the effects of air pollution on public health in Greater Paris, France, 1991–1995. Évaluation des risques de la pollution urbaine pour la santé. Environmental Research 1997 ; 75 : 73-84.
[6] Atkinson RW, Anderson HR, Sunyer J, et al. Acute effects of particulate air pollution on respiratory admissions : results from APHEA 2 project. Air pollution and health : a European approach. Am J Respir Crit Care Med 2001 ; 164 : 1860-6.
[7] Heinrich J, Wichmann HE. Traffic-related pollutants in Europe and their effect on allergic disease. Curr Opin Allergy Clin Immunol 2004 ; 4 : 341-8.
[8] Majkowska-Wiojciechowska B, Pelka J, Korzon L, et al. Prevalence of allergy, patterns of allergy sensitization and allergy risk factors in rural and urban children. Allergy 2007 ; 62 : 1044-50.
[9] Annesi-Maesano I, Moreau D, Caillaud D, et al. Residential proximity fine particles related to allergic sensitisation and asthma in primary school children. Respir Med 2007 ; 101 : 1721-9.
[10] Tsicopoulos A, Ying C, Wallaert B. Effet de la pollution environnementale sur le développement des maladies allergiques. Mécanismes immunologiques impliqués. Air Pur 2007 ; 71 : 5-9.
[11] Gozlan M. Riou-Millot S. Allergies. L’épidémie mondiale a commencé. Science et Avenir 2014 ; 807 : 32-7.
[12] Altshuller AP. Eye irritation as an effect of photochemical air pollution. J Air Pollut Control Assoc 1977 ; 27 : 1125-6.
[13] Versura P, Profazio V, Cellini M, Torreggiani A, Caramazza R. Eye discomfort and air pollution. Ophthalmologica 1999 ; 213 : 103-9.
[14] Leonardi A, Lanier B. Urban eye allergy syndrome : a new clinical entity ? Curr Med Res Opin 2008 ; 24 : 2295-302.
[15] Bourcier T, Viboud C, Cohen JC, et al. Effects of air pollution and climatic conditions on the number of ophthalmic emergency examinations. Br J Ophthalmol 2003 ; 87 : 809-11.
[16] Malerbi FK, Martins LC, Saldiva PHN, Braga ALF. Ambient levels of air pollution induce clinical worsening of blepharitis. Environ Res 2012 ; 112 : 199-203.
[17] Torricelli AAM, Matsuda M, Novaes, P, et al. Effects of ambient levels traffic-derived air pollution on the ocular surface: analysis of symptoms, conjunctival goblet cell count and mucin 5AC gene expression. Environ Res 2014 ; 131 : 59-63.
[18] Torricelli AAM, Matsuda M, Novaes, et al. Ocular surface adverse effects of ambient levels of air pollution. Arq Braz Oftalmol 2011 ; 74 : 377-82.
P. Fournié, F. Malecaze
Les remaniements de surface sont surtout secondaires à la dénervation cornéenne, aux complications liées aux sutures et aux conservateurs des collyres. La principale manifestation est la kératite ponctuée superficielle. La kératite neurotrophique post-chirurgicale, souvent à un stade d’épithéliopathie après greffe, diminue la trophicité épithéliale et la boucle réflexe de sécrétion lacrymale. La prise en charge est surtout préventive par gestion des sutures et cicatrisation dirigée. Les greffes de cornée endothéliales sont préférées dans les décompensations endothéliales pour préserver la surface cornéenne antérieure du receveur et limiter les remaniements de surface.
Greffes de cornée et remaniements de surface sont indissociables en raison du remplacement, dans la plupart des cas, de la surface cornéenne et de la iatrogénie surtout secondaire à la dénervation cornéenne, aux sutures et aux collyres. Ces remaniements de surface sont donc observés dans les techniques de greffe qui intéressent l’épithélium cornéen : greffes de cornée transfixiantes et lamellaires antérieures. Ils sont importants à prendre en compte en raison du retentissement visuel qu’ils peuvent avoir et des conséquences possibles pour le greffon de rejet et d’échec de greffe.
En postopératoire de greffe de cornée, l’intégrité épithéliale est indispensable à la bonne cicatrisation du greffon, à sa transparence ainsi qu’à sa survie en protégeant le stroma de la nécrose et de l’infection. La greffe de cornée, par la section des nerfs cornéens, constitue un tableau de kératite neurotrophique iatrogène (fig. 12-12). La dénervation cornéenne entraîne une hypo-anesthésie cornéenne qui diminue les réflexes de clignement et de larmoiement à l’origine d’une diminution de la lubrification de surface. L’innervation cornéenne assure également une fonction trophique sur l’épithélium cornéen par libération de neuropeptides. La dénervation cornéenne post-greffe joue donc un rôle sur la prolifération épithéliale cornéenne qui, associée à la mauvaise lubrification de surface, contribue à affaiblir la cicatrisation et le renouvellement de l’épithélium. En général, les manifestations sont celles d’une sécheresse oculaire par épithéliopathie neurotrophique avec différents degrés de remaniements épithéliaux et de kératites ponctuées superficielles (fig. 12-13). Une kératite filamenteuse, une hurricane kératopathie avec un aspect en spirale, un défect épithélial, un œdème épithélial microkystique (fig. 12-14) ou des bulles sous-épithéliales peuvent également s’observer. Des facteurs de risque préopératoires favorisant la survenue de pathologies de surface ont été recherchés. Mannis et al. [1] sur 100 greffes transfixiantes rapportent 33 % de patients qui présentaient une atteinte de la surface, surtout une kératite ponctuée superficielle (voir fig. 12-13). Le seul facteur de risque était l’âge du receveur, en moyenne 68,7 ans dans le groupe avec anomalies de surface contre 52,6 ans dans le groupe indemne. Ils ne notaient pas de lien avec le diagnostic préopératoire, l’âge du donneur ou la durée de conservation du greffon. Feiz et al. [2] sur 80 greffes transfixiantes retrouvent une probabilité accrue d’anomalies de surface en cas d’âge élevé du receveur, de la présence d’une blépharite antérieure et d’une diminution de la sensibilité cornéenne préopératoire. Soixante-trois pour cent des patients présentaient une anomalie épithéliale 3 mois après la greffe. La réinnervation du greffon est souvent incomplète avec une hypoesthésie résiduelle qui peut expliquer les remaniements épithéliaux chroniques de certains greffons [3]. Il faut attendre : 7 mois pour observer, par microscopie confocale, les premiers nerfs au niveau du stroma moyen et superficiel ; 2 ans pour la réinnervation de l’épithélium basal central (voir fig. 12-12) [4]. La première sensation de la cornée centrale mesurée à l’esthésiomètre de Cochet-Bonnet est retrouvée 18 mois après la greffe [5].
Le pronostic initial d’une greffe dépend de la réépithélialisation qui nécessite en général 3 à 5 jours. Un retard de cicatrisation épithéliale (fig. 12-15) peut compromettre le pronostic fonctionnel de la greffe avec une nécrose stromale parfois rapide, laissant au mieux une cicatrice fibreuse centrale plus ou moins opaque et diminuant l’acuité visuelle. Ce retard sera prévisible en cas de pathologies de surface préalables à la greffe telles que notamment : syndrome sec, kératite neurotrophique, syndromes de Lyell et de Stevens-Johnson, brûlures caustiques, pemphigoïde oculaire cicatricielle ou affections palpébrales. Dans ces cas et si une greffe est indiquée, la prévention des troubles cicatriciels sera systématique, et si possible préalable à la greffe, par chirurgie palpébrale de trichiasis, d’entropion ou d’ectropion, traitement de blépharite, traitement d’insuffisance en cellules souches limbiques par exemple. Il n’est par ailleurs pas rare d’observer un retard de cicatrisation épithéliale ou des anomalies épithéliales secondaires isolées [6, 7]. La prévention du traumatisme chirurgical au moment de la greffe permet de réduire ce risque et consiste à éviter une dessiccation épithéliale ainsi qu’une effraction de la membrane basale épithéliale ou du stroma du donneur ou du receveur notamment par « morsure » par les pinces lors de la manipulation ou de la suture. La qualité de l’épithélium du donneur n’intervient pas dans les remaniements épithéliaux ultérieurs. La conservation des greffons en organo-culture à + 31 °C utilisée en France entraîne une desquamation épithéliale où seule persiste la couche basale de l’épithélium cornéen. L’épithélium du donneur est ensuite rapidement remplacé par celui du receveur, même s’il persiste un chimérisme cellulaire pendant quelques mois [8]. Cette persistance de cellules du donneur au sein de l’épithélium explique les rejets de greffe épithéliaux possibles pendant les premiers mois postopératoires.
L’hurricane kératopathie décrite après greffe de cornée a d’abord été rattachée à la combinaison de dexaméthasone à des antibiotiques (néomycine et polymyxine) et à du chlorure de benzalkonium [7]. L’aspect clinique correspond à un « tourbillon épithélial » central finalement décrit après greffe mais aussi après port de lentilles rigides perméables au gaz et correspond à une augmentation du turn-over épithélial [9, 10]. La résolution est le plus souvent spontanée au bout de quelques semaines mais peut se compliquer d’un défect épithélial central, d’une hyperplasie épithéliale ou d’une discrète opacité centrale.
Les défects épithéliaux (fig. 12-16) sont à risque, au-delà de 3 semaines d’évolution, de surinfection (fig. 12-17), de néovascularisation, de nécrose stromale avec perforation, de fibrose cicatricielle et de rejet de greffe. Ils prennent un aspect d’ulcères chroniques, de forme arrondie et de localisation centrale ou paracentrale (voir fig. 12-16). Leurs causes comprennent la sécheresse oculaire, la kératite neurotrophique par dénervation cornéenne, les traumatismes, les anomalies palpébrales (blépharite et troubles de la statique), la toxicité épithéliale de certains collyres (conservateurs, ciclosporine, anti-inflammatoires non stéroïdiens, antiviraux topiques), la maladie primitive (brûlures caustiques, syndromes de Lyell et de Stevens-Johnson, pemphigoïde oculaire cicatricielle). L’âge et le diabète sont des facteurs favorisants ainsi que toutes les autres causes de mauvaise réinnervation du greffon. Les infections herpétiques du greffon tiennent une place à part. Cohen et al. [11] rapportent, sur une série de 107 greffes transfixiantes pour kératite herpétique, un risque général de récidive herpétique de 19 %. Le contexte et l’indication peuvent dans ce cas être évocateurs d’une kératite herpétique dont l’aspect sur le greffon peut être atypique, d’autant plus qu’une kératite herpétique peut survenir sans antécédent herpétique [12, 13]. La possibilité d’une infection active à herpèsvirus doit toujours être évoquée en cas de défect épithélial résistant au traitement. Une recherche virologique par prélèvement cornéen doit être systématique en cas de doute.
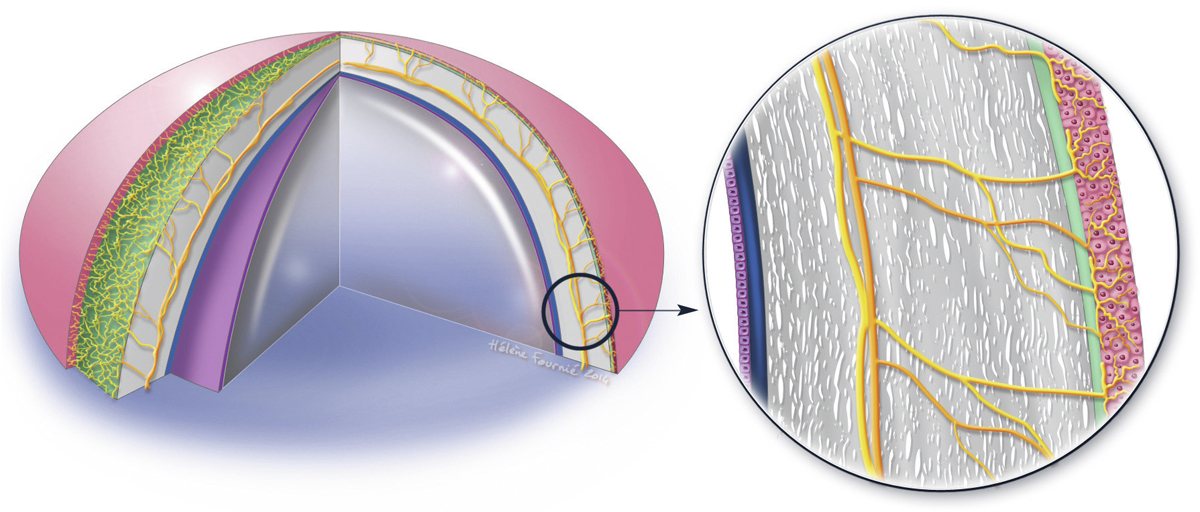
Fig. 12-12 La cornée présente une innervation sensitive, en provenance de la branche ophtalmique du nerf trijumeau, 300 à 600 fois supérieure à l’innervation cutanée, ainsi qu’une innervation sympathique en provenance du ganglion cervical supérieur. Les nerfs cornéens abordent la cornée par sa périphérie de façon radiaire et cheminent parallèlement à la surface. Le stroma postérieur ainsi que la membrane de Descemet sont très faiblement innervés. Les nerfs émettent des branches vers la surface qui traversent la couche de Bowman et forment un plexus nerveux sous-épithélial qui projette des terminaisons nerveuses dans l’épithélium. La trépanation de la cornée réceptrice au cours de la greffe sectionne les gros troncs nerveux radiaires en provenance du limbe.
(Dessin d’Hélène Fournié.)
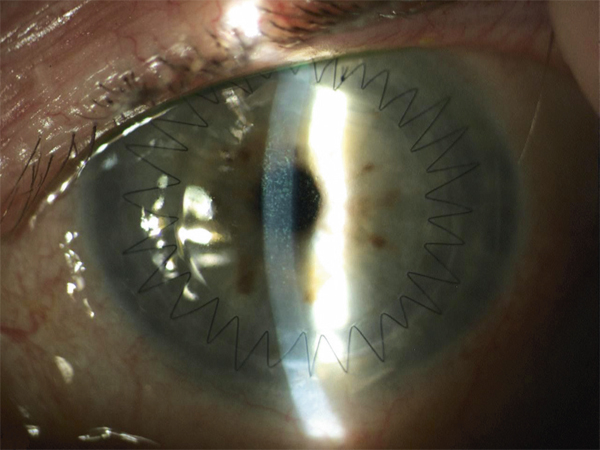
Fig. 12-13 Kératite ponctuée superficielle sur greffe de cornée transfixiante à 3 mois postopératoires.
Les remaniements de surface ont une conséquence optique tout d’abord en altérant l’acuité visuelle. La surface oculaire est la première surface optique qui, si elle est altérée, limite la récupération visuelle. Le patient voit « à travers un verre dépoli ». Ces remaniements de surface peuvent ensuite, par le biais de l’inflammation induite, favoriser la survenue de complications telles qu’un rejet de greffe.
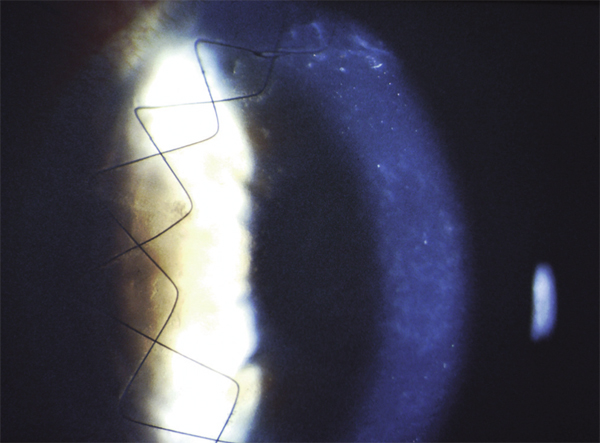
Fig. 12-14 Œdème épithélial microkystique avec zones centrales d’hyperplasie de l’épithélium cornéen.
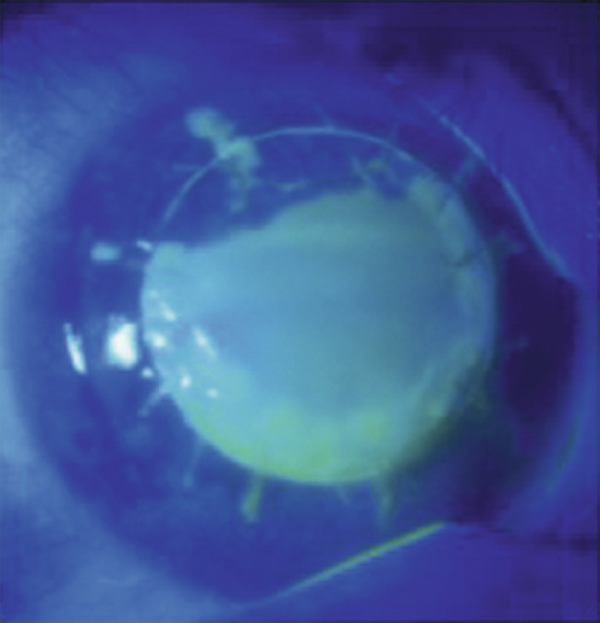
Fig. 12-15 Retard de cicatrisation épithéliale après greffe. Bourgeon épithélial supérieur de début de cicatrisation.

Fig. 12-16 Défect épithélial central torpide avec berges de l’ulcère festonnées surélevées.
Le fond de l’ulcère est fibreux.
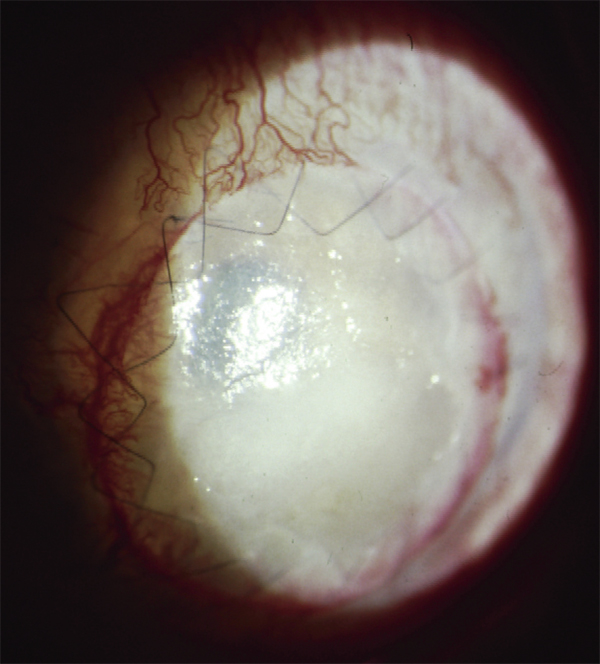
Fig. 12-17 Défect épithélial étendu du greffon surinfecté avec fond nécrotique et berges néovascularisées.
La suture du greffon peut être réalisée par des points séparés, par un surjet seul, par un double surjet ou par une combinaison de points séparés et d’un surjet. Il n’y a pas de différence d’astigmatisme selon les techniques de suture [14]. Les points séparés sont préférés chez l’enfant, en cas de néovascularisation cornéenne ou de greffe thérapeutique. Ils ont l’avantage de pouvoir être retirés sélectivement si nécessaire en cas de complications. Quelle que soit la technique, il convient de réaliser des points profonds (80 à 90 % de l’épaisseur cornéenne), non transfixiants et d’affronter les couches de Bowman du donneur et du receveur. Un mauvais affrontement des berges avec un décalage vertical engendre un astigmatisme mais également une anomalie de répartition du film lacrymal et peut favoriser un inconfort par conflit entre surface oculaire et paupières ainsi que des remaniements épithéliaux. La tension des sutures doit permettre d’apposer les berges. Un nœud enfoui dans la cornée du receveur favorise un appel néovasculaire sur un terrain à risque. Un nœud enfoui dans la cornée du donneur est par contre plus à risque de déhiscence du greffon par traction lors de son retrait. Il faut distinguer ce mauvais affrontement peropératoire des berges de certains tableaux observés à distance d’une greffe pour kératocône qui donnent l’impression d’un décalage de la cicatrice (fig. 12-18). Dans certains cas, 15 à 20 ans après une greffe pour kératocône, la progression de l’amincissement de la cornée réceptrice peut donner cet aspect de « déchapage » du greffon (voir fig. 12-18). On parle parfois à tort de « récidive du kératocône » du fait de la déformation du greffon secondaire à l’amincissement de l’anneau limitant. La protrusion inférieure du greffon par rapport à l’amincissement en regard de la cornée réceptrice peut générer un inconfort. Sa prise en charge chirurgicale est toujours compliquée et peut aller jusqu’au remplacement de la greffe par un greffon de plus large diamètre.
Une exposition d’un fil de suture peut se voir en cas de suture trop lâche, empêchant son épithélialisation. Le nœud peut être également désenfoui et la suture cassée. Un point trop serré, en plus de générer un astigmatisme, peut cisailler le tissu et être à l’origine d’un défect épithélial. Toute exposition de suture (voir fig. 12-19) peut entraîner une impression de corps étranger, de douleur, un larmoiement, une photophobie, une accumulation de mucus et de débris de larmes, une conjonctivite gigantopapillaire, des érosions et ulcères cornéens, la formation de dellen et d’un granulome conjonctival ainsi qu’une intolérance aux lentilles de contact. Il en résulte souvent un appel néovasculaire (fig. 12-19 et 12-20) et une inflammation qui augmentent le risque de rejet de greffe. Une suture lâche, cassée ou désenfouie devra être retirée et refaite selon le délai par rapport à la greffe et le risque de déhiscence du greffon (voir fig. 12-19). Christo et al. [15] rapportent une reprise chirurgicale nécessaire dans 8,3 % des cas de sutures lâches sur une série de 361 greffes. Une infection sur suture est favorisée par une suture desserrée, le port de lentilles de contact et l’utilisation de corticoïdes locaux. Elle est rapportée dans 3,3 % des cas par Christo et al. [15], mais reste de mauvais pronostic en raison de l’accès direct au stroma cornéen profond avec un risque de déhiscence du greffon, de fonte stromale avec cicatrice et astigmatisme induits, de rejet et d’échec de greffe, voire d’endophtalmie. Sonavane et al. [16] rapportent, sur une série de 105 infections cornéennes sur greffe transfixiante, 35 % de cas en rapport avec une infection sur point de suture, avec une médiane de survenue de 81 jours. Quatre-vingt-six pour cent des infections étaient à bactérie à Gram positif contre 8 % à Gram négatif et 5 % à champignons. Sur une série de 18 infections sur suture, Leahey et al. [17] rapportent après traitement 67 % de greffons clairs, 17 % de cicatrice à l’origine d’une baisse d’acuité visuelle et 16 % de décompensation du greffon. Le point de suture au départ de l’infection devra être retiré et mis en culture. En cas de survenue sur un surjet, son retrait dépend du risque de déhiscence du greffon. Le traitement par collyres antibiotiques et/ou antifongiques renforcés doit être rapide, débuté avant les résultats microbiologiques. Les collyres corticoïdes seront interrompus en cas d’infections fongiques et remplacés par de la ciclosporine en collyre à 2 %. Une infection sur suture devra être différenciée des infiltrats inflammatoires immuns observés dans 10 % des cas environ [15] et qui sont le plus souvent multiples, situés du côté receveur de la jonction greffon–receveur, et sans défect épithélial en regard. Ils disparaissent en général après intensification de la corticothérapie locale.
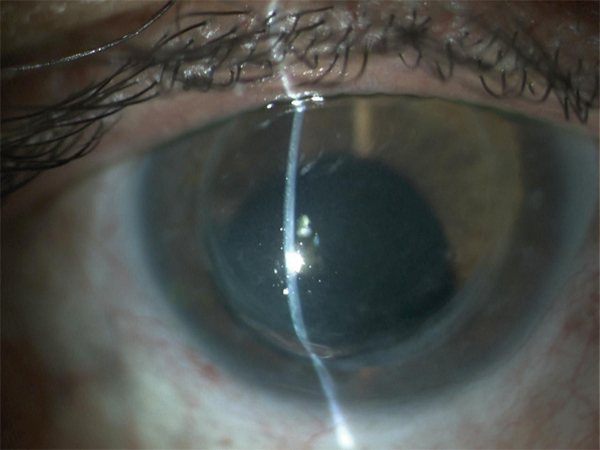
Fig. 12-18 Greffe de cornée sur kératocône à 20 ans postopératoires.
Aspect de déhiscence inférieure du greffon par amincissement de la collerette réceptrice sur kératocône évolutif, à l’origine de la protrusion inférieure et de l’astigmatisme irrégulier par déformation de la surface optique.
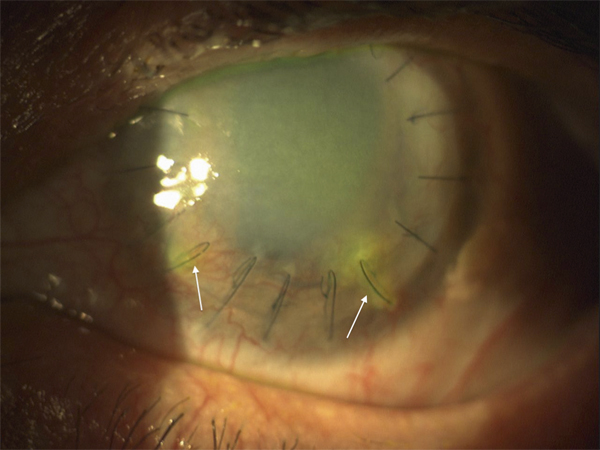
Fig. 12-19 Sutures lâches (flèches) avec néovascularisation du greffon dans un contexte d’insuffisance en cellules souches limbiques et de greffon décompensé.
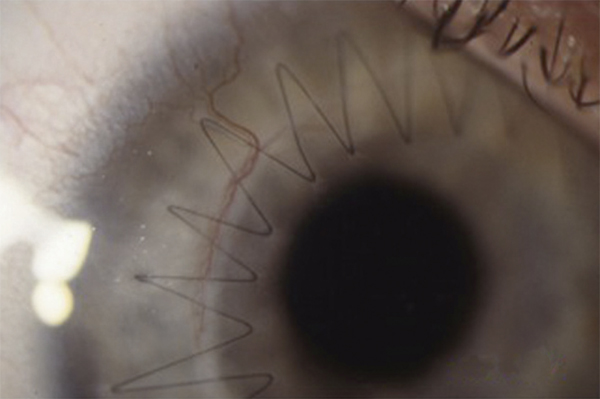
Fig. 12-20 Appel néovasculaire sur l’anneau limitant d’une greffe de cornée transfixiante suturée par un surjet simple de monofilament en Nylon 10/0.
Il convient de limiter l’utilisation de conservateurs dans les collyres. Cela concerne les corticoïdes antirejets, nécessaires au long cours, mais également les lubrifiants oculaires ainsi que les collyres antiglaucomateux, souvent nécessaires en raison notamment des glaucomes secondaires cortisoniques (fig. 12-21). Les collyres anti-inflammatoires non stéroïdiens sont utilisés en cas de greffe chez un patient diabétique ou à l’occasion de chirurgie intra-oculaire associée : cataracte ou implantation secondaire notamment. Leur utilisation devra être limitée au strict nécessaire et toujours sous surveillance en raison des risques épithéliaux possibles. Enfin, en cas de kératite herpétique avérée associée ou en prévention d’une récidive, un agent anti-herpétique per os sera préféré à la forme topique, davantage épithéliotoxique. L’utilisation d’un antiviral per os après greffe pour kératite herpétique permet de réduire le risque de récidive herpétique et d’allonger la durée de vie du greffon [18].
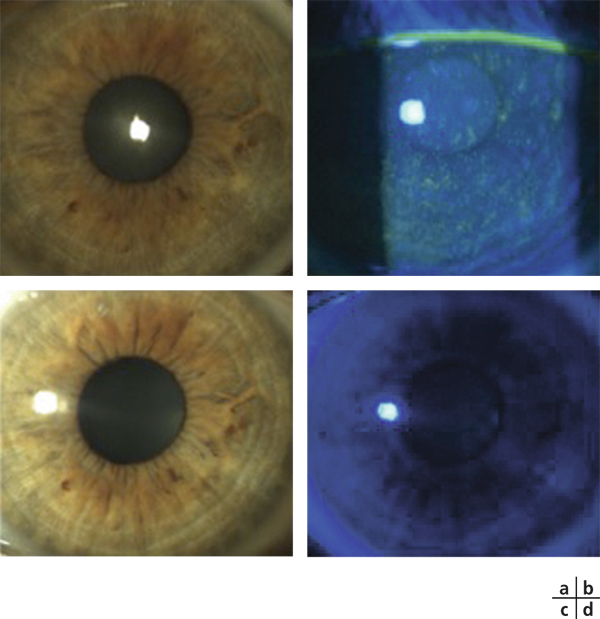
Fig. 12-21 Kératite ponctuée superficielle observée sous collyre corticoïde conservé au chlorure de benzalkonium et à l’origine d’un dépoli cornéen (a) avec kératite ponctuée superficielle (b) et flou visuel, cédant sous collyre corticoïde sans conservateurs (c, d).
La suppléance lacrymale est quasi systématique après greffe de cornée, sans conservateurs, pour favoriser la cicatrisation épithéliale initiale puis lutter contre la sécheresse oculaire. Selon le degré de sécheresse, la viscosité du lubrifiant sera adaptée (pommades > gels > gouttes). Des lubrifiants de principes actifs différents seront combinés. L’utilisation de bouchons méatiques est possible en s’assurant de leur bon placement, sans abrasion de surface par frottement, et en les remplaçant tous les 6 mois en raison du risque de colonisation bactérienne.
Elle est systématique en postopératoire précoce en s’assurant de l’absence de clignement sous l’occlusion. Elle limite l’évaporation des larmes et évite le frottement palpébral sur la surface oculaire et son « effet rabot ». Elle peut se faire à l’aide de compresses ou de Steri-Strip® ou, dans certains cas rebelles ou d’indications à risque de retard de cicatrisation ou de troubles cicatriciels, par blépharorraphie ou injection de toxine botulique dans le muscle releveur de la paupière supérieure.
Une lentille thérapeutique « pansement » peut être utilisée notamment en cas de retard de réépithélialisation pour protéger la surface du clignement palpébral. Le matériau silico-hydrogel en port continu sera préféré avec une surveillance à 1 semaine, puis hebdomadaire. La lentille sera à remplacer à 1, 2, 3 ou 4 semaines selon les dépôts. Une antibioprophylaxie, souvent combinée à la corticothérapie, est prescrite. Les lentilles à visée optique peuvent être souples toriques ou rigides perméables aux gaz en l’absence de sutures desserrées. Les verres scléraux sont indiqués à visée réfractive pour corriger un astigmatisme géant mais peuvent également être intéressants dans certaines altérations sévères de la surface oculaire, telles que brûlures caustiques, syndromes de Lyell et de Stevens-Johnson ou pemphigoïde oculaire cicatricielle, en l’absence de comblements des culs-de-sac conjonctivaux.
En l’absence de complications, les sutures sont retirées autant que possible. En général, sur une greffe transfixiante, les sutures sont retirées entre le 12e et le 24e mois après la greffe. Les greffes pédiatriques représentent une exception avec un retrait des sutures plus précoce sur les 3 premiers mois, parfois jusqu’à 6 mois. Chez l’adulte, il est possible de retirer sélectivement certains points séparés astigmatogènes à partir du 6e mois. Une rotation de surjet peut être réalisée à partir du 3e mois pour gérer un astigmatisme géant et au bloc opératoire en raison du risque de rupture et donc de nécessité de réfection. Il se retire en totalité dans les mêmes délais que pour les points séparés. Le retrait des sutures, parfois même dans les délais habituels après la greffe, peut se compliquer de déhiscence du greffon nécessitant une reprise chirurgicale. Un décalage vertical du greffon, sans ouverture de la cicatrice, peut également s’observer et générer un astigmatisme, parfois irrégulier, qui peut compromettre le résultat fonctionnel du greffon. Une chirurgie d’astigmatisme résiduel, incisions relaxantes, Lasik (laser in situ keratomileusis), peut être nécessaire. Il n’est alors pas rare de voir s’aggraver, souvent transitoirement, la sécheresse de surface par nouvelle section des nerfs cornéens. Des sutures « bien tolérées » non détendues et non néovascularisées, avec un astigmatisme convenable et une récupération visuelle satisfaisante, peuvent être maintenues. Elles ne contre-indiquent pas non plus le port de lentilles de contact à visée optique, rigides notamment. Les sutures de monofilament en Nylon 10/0 ou 11/0 finissent, plus ou moins rapidement, par se déliter et se résorber. Si elles se cassent, il faut prévenir le patient des signes fonctionnels (impression de corps étranger, larmoiement, photophobie) qui doivent l’amener à consulter pour les retirer et éviter les complications inflammatoires ou infectieuses. Il faut noter que la cicatrice ne récupère jamais la résistance d’une cornée normale et qu’un traumatisme, même très à distance de la greffe, peut entraîner la déhiscence du greffon.
Un défect épithélial torpide peut bénéficier de traitement ponctuel classique par collyres substitutifs ou pommade cicatrisante ou dans un cadre de protocole par collyre de sérum autologue à 20 %, neuropeptides ou facteurs de croissance, ou de thérapie matricielle à base d’agents de régénération. La ciclosporine collyre est plutôt utilisée à 2 % dans les greffes de cornée en prévention de rejet dans les indications à risque ou en cas d’antécédents de rejet sur greffes itératives.
La tarsorraphie externe reste un excellent traitement de défect épithélial réfractaire en deuxième intention en cas d’échec des traitements médicaux lorsque le pronostic cicatriciel du greffon est en jeu. La greffe de membrane amniotique peut également être bénéfique dans certains cas.
Cela concerne essentiellement les greffes de cornée endothéliales, DSAEK (Descemet’s stripping automated endothelial keratoplasty) et DMEK (Descemet membrane endothelial keratoplasty), qui conservent la cornée antérieure du receveur. Les principales complications épithéliales sont donc absentes. Il n’est pas rare d’observer un défect épithélial initial postopératoire en raison de la fragilité épithéliale secondaire à la décompensation endothéliale qui indique la greffe. L’épithélium, au cours des manipulations peropératoires, vient parfois « en lambeau » selon le stade de décompensation endothéliale. Une lentille thérapeutique pansement est souvent nécessaire dans les suites opératoires pendant 2 ou 3 jours. Le rétablissement d’une pompe endothéliale fonctionnelle après la greffe permet ensuite rapidement de s’affranchir de toute complication épithéliale. Il n’y a notamment ni kératite neurotrophique, en raison de l’absence de section des nerfs cornéens, ni complications liées aux sutures qui ne ferment que les incisions et sont retirées précocement dès le premier mois. La conservation du dioptre optique cornéen antérieur permet en outre et surtout de maintenir la réfraction préopératoire du patient et d’éviter les risques d’astigmatisme géant postopératoire. Les greffes de cornée lamellaires antérieures sont par contre soumises aux mêmes risques que les greffes de cornée transfixiantes. Les complications épithéliales de surface sont identiques. Après greffe lamellaire antérieure profonde, il est classique de préconiser un retrait plus précoce des sutures qu’après greffe transfixiante, dès le 6e mois. Il n’est cependant pas rare d’observer une déhiscence du greffon en cas de retrait trop précoce, ce qui peut inciter à maintenir les sutures plus longtemps. Après greffe lamellaire antérieure superficielle par contre, les sutures sont retirées entre 1 et 6 mois selon la profondeur du stroma remplacé.
Les remaniements et altérations de la surface oculaire sont prévisibles après greffe de cornée et doivent être anticipés. Ils seront au mieux évités en préférant des techniques de greffes lamellaires endothéliales qui permettent de conserver la surface oculaire du receveur et l’intégrité de l’innervation cornéenne notamment. Sinon, dans tous les cas, ils seront pris en charge, préventivement si possible, après en avoir analysé les causes, pour en limiter les conséquences qui peuvent engager le pronostic de la greffe.
[1] Mannis MJ, Zadnik K, Miller MR, Marquez M. Preoperative risk factors for surface disease after penetrating keratoplasty. Cornea 1997 ; 16 : 7-11.
[2] Feiz V, Mannis MJ, Kandavel G, et al. Surface keratopathy after penetrating keratoplasty. Trans Am Ophthalmol Soc 2001 ; 99 : 159-68 (discussion 168-170).
[3] Rao GN, John T, Ishida N, Aquavella JV. Recovery of corneal sensitivity in grafts following penetrating keratoplasty. Ophthalmology 1985 ; 92 : 1408-11.
[4] Richter A, Slowik C, Somodi S, Vick HP, Guthoff R. Corneal reinnervation following penetrating keratoplasty--correlation of esthesiometry and confocal microscopy. Ger J Ophthalmol 1996 ; 5 : 513-7.
[5] Mathers WD, Jester JV, Lemp MA. Return of human corneal sensitivity after penetrating keratoplasty. Arch Ophthalmol 1988 ; 106 : 210-1.
[6] Rotkis WM, Chandler JW, Forstot SL. Filamentary keratitis following penetrating keratoplasty. Ophthalmology 1982 ; 89 : 946-9.
[7] Mackman GS, Polack FM, Sydrys L. Hurricane keratitis in penetrating keratoplasty. Cornea 1983 ; 2 : 31-4.
[8] Tsubota K, Mashima Y, Murata H, et al. Corneal epithelium following penetrating keratoplasty. Br J Ophthalmol 1995 ; 79 : 257-60.
[9] Dua HS, Watson NJ, Mathur RM, Forrester JV. Corneal epithelial cell migration in humans : ‘hurricane and blizzard keratopathy’. Eye (Lond) 1993 ; 7 : 53-8.
[10] Dua HS, Gomes JA. Clinical course of hurricane keratopathy. Br J Ophthalmol 2000 ; 84 : 185-8.
[11] Cohen EJ, Laibson PR, Arentsen JJ. Corneal transplantation for herpes simplex keratitis. Am J Ophthalmol 1983 ; 95 : 645-50.
[12] Mannis MJ, Plotnik RD, Schwab IR, Newton RD. Herpes simplex dendritic keratitis after keratoplasty. Am J Ophthalmol 1991 ; 111 : 480-4.
[13] Remeijer L, Doornenbal P, Geerards AJ, et al. Newly acquired herpes simplex virus keratitis after penetrating keratoplasty. Ophthalmology 1997 ; 104 : 648-52.
[14] Filatov V, Alexandrakis G, Talamo JH, Steinert RF. Comparison of suture-in and suture-out postkeratoplasty astigmatism with single running suture or combined running and interrupted sutures. Am J Ophthalmol 1996 ; 122 : 696-700.
[15] Christo CG, van Rooij J, Geerards AJ, et al. Suture-related complications following keratoplasty : a 5-year retrospective study. Cornea 2001 ; 20 : 816-9.
[16] Sonavane A, Sharma S, Gangopadhyay N, Bansal AK. Clinico-microbiological correlation of suture-related graft infection following penetrating keratoplasty. Am J Ophthalmol 2003 ; 135 : 89-91.
[17] Leahey AB, Avery RL, Gottsch JD, et al. Suture abscesses after penetrating keratoplasty. Cornea 1993 ; 12 : 489-92.
[18] Barney NP, Foster CS. A prospective randomized trial of oral acyclovir after penetrating keratoplasty for herpes simplex keratitis. Cornea 1994 ; 13 : 232-6.
S. Resnikoff
Deux maladies fréquemment rencontrées sous les tropiques sont responsables de lésions sévères de la surface oculaire, susceptibles d’entraîner la cécité. Le trachome est dû à une infection par Chlamydia trachomatis qui évolue vers une fibrose conjonctivale progressive responsable d’environ 90 millions de cas de sécheresse oculaire dont 2 millions de cas de perte de la vision par opacification cornéenne totale. La xérophtalmie par carence en vitamine A reste très répandue en Asie du Sud-Est et en Afrique intertropicale où elle rend aveugles 250 000 à 500 000 enfants par an. Seul le traitement préventif précoce est susceptible d’éviter les complications de ces deux maladies.
L’onchocercose, la limbo-conjonctivite endémique des tropiques et la kératopathie climatique sont trois autres pathologies tropicales relativement moins importantes.
On désigne par pathologies tropicales les maladies et manifestations observées dans les pays intertropicaux. Si certaines maladies – essentiellement parasitaires – sont effectivement directement déterminées par l’environnement climatique, ce sont essentiellement les conditions socio-économiques défavorables qui représentent les véritables déterminants de ces pathologies. Ainsi, les deux maladies responsables de dizaines de millions de cas de sécheresse oculaire grave – le trachome et l’avitaminose A – étaient autrefois répandues sur l’ensemble de la planète, y compris en Europe. Leur disparition des zones tempérées est due au développement économique et non pas à de quelconques variations climatiques.
Outre ces deux entités nosologiques qui constituent l’essentiel de ce sous-chapitre, trois pathologies méritent aussi d’être mentionnées : l’onchocercose, la limbo-conjonctivite endémique des tropiques et la kératopathie climatique.
L’onchocercose est une parasitose cutanéodermique à fort tropisme oculaire due à un nématode (Onchocerca volvulus) transmis par un moucheron (simulie) qui se reproduit dans les cours d’eau en zone tropicale, ce qui lui a valu le nom de « cécité des rivières ». Les microfilaires d’O. volvulus affectent non seulement la choriorétine mais aussi la cornée au sein de laquelle ils migrent provoquant des infiltrats surmontés d’une kératite ponctuée superficielle. Ces infiltrats s’accumulent et évoluent vers une kératite sclérosante, semi-lunaire inférieure d’abord, puis totale [1]. Autrefois cause majeure de cécité en Afrique, l’onchocercose est aujourd’hui en voie d’élimination grâce à des programmes de traitement de masse par l’ivermectine. Les cas cliniques évolutifs sont donc devenus rarissimes.
La limbo-conjonctivite endémique des tropiques (LCET), ainsi dénommée par J. Diallo, est en fait une forme clinique de kératoconjonctivite vernale rencontrée dans les pays « où le printemps est éternel », c’est-à-dire où l’exposition aux allergènes est continue. Très fréquentes à l’âge scolaire – environ 5 % des enfants de 5 à 9 ans en zone sahélienne –, elles sont souvent sévères, accompagnées des kératites ponctuées superficielles étendues et d’infiltrats inflammatoires aussi bien au niveau du limbe que de la conjonctive bulbaire (grains de Trantas) (fig. 12-22). Des ulcérations conjonctivales existent dans environ 50 % des cas. Le plus souvent punctiformes, elles peuvent aussi être très vastes, alors recouvertes de fausses membranes. L’envahissement de la cornée par un voile néovasculaire ou la constitution d’une plaque vernale sont des complications observées beaucoup plus fréquemment que dans les kératoconjonctivites vernales. Les signes fonctionnels sont généralement très intenses, responsables d’échecs scolaires et d’automédication par des corticoïdes. Un terrain familial est observé chez 25 % des patients [2]. La prise en charge thérapeutique est la même que celle des kératoconjonctivites vernales.
La kératopathie climatique en gouttelettes s’observe chez des adultes fortement exposés aux rayons ultraviolets, notamment dans les zones tropicales arides. Elle est caractérisée par des amas sous-épithéliaux, sphériques, pouvant atteindre 1 mm de diamètre, de couleur ambrée, disposés exactement dans l’aire de la fente palpébrale (fig. 12-23). Au cours de l’évolution, l’épithélium peut s’altérer au sommet des amas sphériques, provoquant des micro-ulcérations à l’origine parfois de surinfections. Les amas constitués de protéines sont situés au niveau de la membrane de Bowman et du stroma antérieur [3].
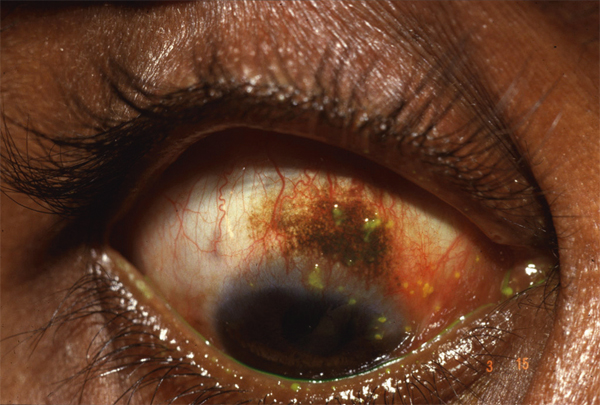
Fig. 12-22 Limbo-conjonctivite endémique des tropiques avec grains de Trantas.
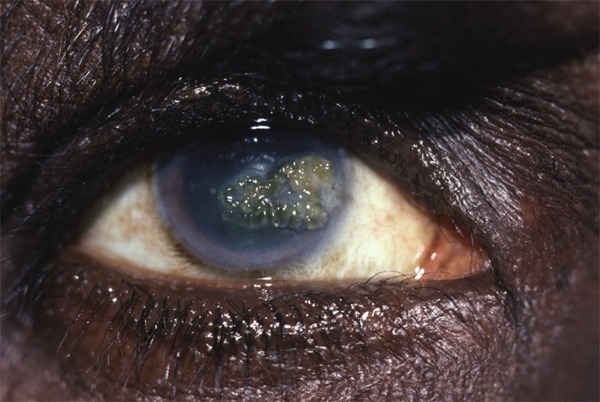
Fig. 12-23 Kératopathie climatique.
Bien que le trachome ait disparu des pays industrialisés, il est encore responsable de lésions de la surface oculaire chez une centaine de millions de personnes en Afrique, en Asie et en Amérique latine.
Les cas importés sont surtout observés chez les travailleurs migrants originaires d’Afrique et leurs familles. Le risque de contagion au cours d’un voyage peut être considéré comme nul.
L’histoire du trachome se heurte à la définition de la maladie et de sa dénomination dans les différentes langues, le terme de trachome étant relativement récent. C’est donc en s’appuyant sur les symptômes que les historiens ont tenté de définir l’histoire du trachome dans le monde. Les documents les plus anciens décrivant ce qui semble être le trachome sont chinois et datent de 2600 ans av. J.-C. En Égypte, le papyrus Ebers en fait mention au xvie siècle av. J.-C., notamment en ce qui concerne le traitement de ses complications palpébrales. Le trachome était aussi connu dans la Grèce antique comme en témoignent les nombreuses descriptions dans les traités de cette époque, en particulier dans le Corpus hippocratique (ve siècle avant J.-C.). C’est dans Materia Medica, publié vers l’an 60 de notre ère, que Dioscoride a le premier utilisé le terme de « trachome » (rugueux en grec) en raison de l’aspect granuleux de la conjonctive tarsale. C’est pourtant sous le nom d’ophtalmia que le trachome a surtout été désigné, terme qui incluait probablement d’autres entités nosologiques. À cet égard, c’est surtout l’ophtalmie d’Égypte qui a marqué les esprits et suscité de nombreux débats dans les milieux scientifiques de l’époque. Affectant un grand nombre de soldats français et anglais revenant de la campagne d’Égypte (1798–1803), l’ophtalmie d’Égypte a ensuite contaminé les populations urbaines parisiennes et londoniennes. Le problème était devenu si important que de nombreux hôpitaux ophtalmologiques ont été fondés à cette époque pour lutter contre ce fléau, tels le Moorfields Eye Hospital à Londres ou le Massachusetts Eye Infirmary à Boston. Le thème du premier congrès international d’ophtalmologie en 1857 était aussi le trachome car c’était de loin le principal problème auquel les ophtalmologistes avaient à faire face. Le trachome était systématiquement recherché chez les immigrants à leur arrivée aux États-Unis et tous ceux qui en étaient porteurs étaient immédiatement renvoyés dans leur pays d’origine [4, 5].
La définition proposée par l’Organisation mondiale de la santé (OMS) en 1962 reste d’actualité : « Le trachome est une kératoconjonctivite transmissible, due à Chlamydia trachomatis, d’évolution généralement chronique, caractérisée par la formation de follicules, une hyperplasie papillaire, un pannus cornéen, et entraînant des lésions cicatricielles typiques. » On notera cependant que cette définition ne précise pas la nature des lésions cicatricielles qui font pourtant toute la gravité de la maladie, pouvant aller jusqu’à la perte de la vision [6].
L’agent pathogène est Chlamydia trachomatis, une bactérie intracellulaire obligatoire. Sa survie dans les vacuoles cytoplasmiques de la cellule parasitée est rendue possible par sa capacité à inhiber le complexe de fusion phagosome–lysosome. Les Chlamydiae existent sous deux formes caractéristiques :
le corps élémentaire (CE), forme infectieuse, extracellulaire, incapable de multiplication ;
le corps réticulé (CR), intracellulaire, non infectieux.
Le cycle de développement comprend cinq étapes :
attachement et entrée du CE dans la cellule hôte ;
différenciation du CE en CR ;
multiplication du CR dans inclusion cytoplasmique ;
différenciation des CR en CE ;
sortie des CE par éclatement de la cellule.
Seuls les CR sont sensibles aux antibiotiques. Dans certaines conditions, en particulier en présence de cytokines comme l’interféron, le cycle de développement est altéré. Chlamydia trachomatis persiste au sein de la cellule dans un état anormal. La bactérie ne peut plus se multiplier mais sa persistance contribuerait à une stimulation antigénique chronique responsable des séquelles cicatricielles.
Le réservoir de C. trachomatis est strictement humain.
C. trachomatis comprend 19 sérovars groupés en deux biovars, trachoma et LGV (lymphogranuloma venereum). Le biovar trachoma comprend 15 sérovars : A, B, Ba et C impliqués dans le trachome ; D, Da, E, F, G, Ga, H, I, Ia, J et K impliqués dans les infections urogénitales et oculaires (conjonctivites à inclusions du nouveau-né et de l’adulte). Le biovar LGV comprend quatre sérovars : L1, L2, L2a et L3.
La différenciation des sérovars s’étant produite entre 0,8 et 1,8 million d’années on peut penser que le trachome a affecté l’espèce humaine très tôt dans son évolution.
Les enfants trachomateux hébergent C. trachomatis au niveau des conjonctives mais aussi du rhinopharynx.
La contamination et les réinfections se font par transmission directe à partir de sécrétions oculaires et nasales ainsi que par contact direct avec divers objets porteurs d’agents infectieux, comme des serviettes ou des gants de toilette. Les mouches – spécifiquement de l’espèce Musca sorbens – peuvent jouer le rôle de vecteurs passifs en transportant C. trachomatis d’un individu à l’autre. Cette espèce a un tropisme particulier pour les sécrétions oculaires et se reproduit exclusivement sur les matières fécales humaines, donc dans des endroits où l’assainissement est déficient.
La distribution géographique du trachome n’est pas homogène, même si, globalement, elle correspond à la « ceinture de pauvreté » du globe. En zone d’endémie, la situation peut être extrêmement contrastée d’un village à l’autre : on peut observer des communautés où la prévalence dépasse 30 %, alors que dans d’autres, très proches, le trachome est quasiment absent. En fait, la distribution communautaire du trachome varie en fonction de la prévalence : plus la maladie est répandue et sévère, plus elle débute tôt. Dans les communautés les plus fortement touchées, la plupart des enfants sont infectés dès l’âge de 1 ou 2 ans. Ils constituent donc un réservoir d’autant plus vaste qu’ils représentent une proportion importante de la population. Dans les communautés moins atteintes, l’apparition de la maladie se fait généralement plus tardivement et son évolution est souvent moins grave.
Malgré des progrès constants, ces « poches » épidémiologiques, plus ou moins étendues, se rencontrent dans une aire qui englobe l’Afrique du Nord, l’Afrique subtropicale, le Moyen-Orient, le sous-continent indien, l’Asie du Nord-Est, l’Australie, certaines îles du Pacifique et l’Amérique latine. En fait, il n’y a que le continent européen qui est complètement épargné.
L’urbanisation fait généralement reculer le trachome. Cependant, les quartiers défavorisés et les bidonvilles, au même titre que les camps de réfugiés, peuvent constituer des foyers actifs. C’est dire que seule une véritable investigation épidémiologique, basée sur l’examen d’échantillons représentatifs de la population, est susceptible de mettre en évidence le problème que peut poser le trachome dans une région : les trachomateux, appartenant aux couches les plus défavorisées de la population, ne viennent guère consulter les ophtalmologistes ni même les centres de santé. Des protocoles d’enquête ont été développés par l’OMS et sont actuellement utilisés par un programme international, le global trachoma mapping project qui vise à cartographier le trachome dans 30 pays où les données disponibles sont insuffisantes. Les résultats sont immédiatement rendus disponibles sur le site Internet de l’Atlas mondial du trachome [7].
Les progrès réalisés dans l’investigation épidémiologique ont permis d’affiner l’estimation du nombre de personnes : vivant dans les zones d’endémie ; présentant une forme active ; ayant des séquelles graves (entropion–trichiasis trachomateux). Ces données, périodiquement mises à jour par l’OMS, montrent qu’en 2013 le trachome cécitant était endémique dans 53 pays (fig. 12-24) et qu’il y aurait 229 millions de personnes vivant dans les zones d’endémie et donc soumises au risque de contamination [8].
Selon la dernière estimation de l’OMS, il y aurait environ 21,4 millions de personnes présentant une forme active et 7,2 millions de personnes ayant une complication grave (entropion–trichiasis trachomateux) [9]. Il est à noter qu’il s’agit très probablement de surestimations car l’Inde et la Chine contribuent respectivement pour 4,4 et 1,3 millions de cas actifs, alors que des enquêtes en cours semblent montrer que le trachome n’existe plus en Chine et a considérablement reculé en Inde. Quoi qu’il en soit, le nombre de cas actifs baisse régulièrement en raison du développement socio-économique notamment en Asie, des programmes de lutte en Afrique et aussi de statistiques de plus en plus précises (fig. 12-25). Il en est de même en ce qui concerne le nombre de personnes ayant perdu la vue en raison du trachome. Alors que le trachome représentait la troisième cause de cécité en 1990 (6 millions d’aveugles), il est passé au 7e rang en 2002 pour ne représenter plus que 1,4 à 3 % des aveugles en 2010 selon les sources [10–14]. Ici aussi, les données diffèrent en fonction des approches méthodologiques utilisées pour produire les estimations (tableau 12-2). Quoi qu’il soit, le nombre de déficiences visuelles dues au trachome dans le monde serait de l’ordre de 1,8 à 2,2 millions, essentiellement en Afrique.
L’OMS n’a jamais élaboré d’estimations sur le nombre de personnes présentant un trachome cicatriciel, indépendamment des cas d’entropion–trichiasis. La modélisation, à partir de la prévalence du trachome actif d’une part et de la prévalence du trachome cicatriciel en fonction des différentes tranches d’âge d’autre part, permet cependant d’estimer qu’il y aurait à l’heure actuelle environ 80 millions de personnes ayant un trachome cicatriciel, c’est-à-dire ayant une dégénérescence conjonctivale entraînant une sécheresse oculaire.
Fig. 12-24 Pays où le trachome est endémique.
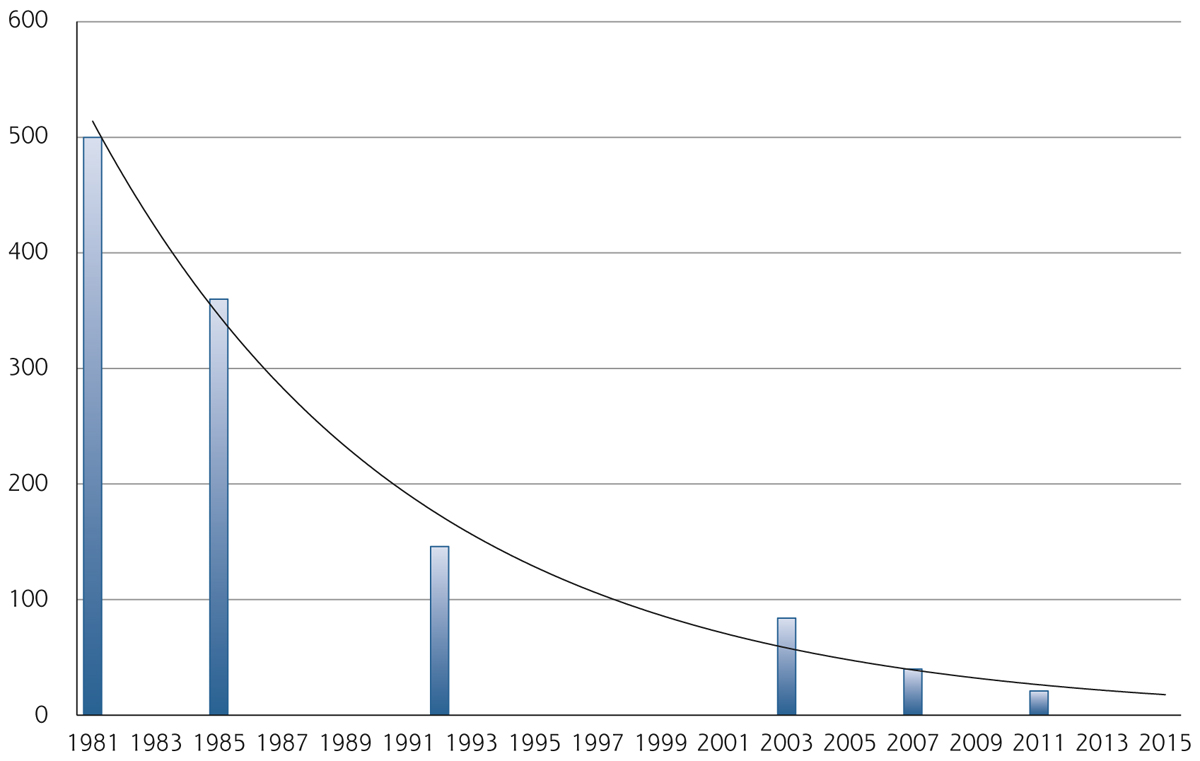
Fig. 12-25 Évolution du nombre de cas de trachome actif dans le monde depuis 1981 (millions).
Tableau 12-2 Évolution du nombre de cécités et de déficiences visuelles dues au trachome (1990–2010).
AV : acuité visuelle.
Le trachome commence généralement tôt dans l’enfance. Il est alors caractérisé par une inflammation chronique de la conjonctive tarsale supérieure, avec envahissement de la cornée par un voile vasculaire qui descend du limbe vers le centre de la cornée (pannus). Ce stade inflammatoire représente la phase active et contagieuse de la maladie.
L’inflammation trachomateuse, en milieu endémique, persiste quelques années avant d’évoluer vers la cicatrisation qui peut se faire selon deux modalités :
soit l’inflammation est restée modérée et l’évolution se fait vers la guérison spontanée, au prix de quelques cicatrices conjonctivales : c’est le trachome cicatriciel bénin ;
soit l’inflammation conjonctivale a été intense et prolongée du fait de nombreuses réinfections et la cicatrisation peut alors dépasser son but et entraîner une fibrose rétractile de la paupière supérieure. Il s’agit d’un trachome cicatriciel grave, susceptible d’aboutir à un entropion–trichiasis. Le frottement des cils à chaque clignement et surtout un syndrome sec aboutissent à une érosion cornéenne, souvent surinfectée, qui évolue vers une cécité complète et irréversible.
C’est donc la durée et surtout l’intensité de la stimulation antigénique qui déterminent le risque d’évolution vers la cécité.
De nombreux facteurs de risque ont été identifiés. Tous sont liés à la fréquence des réinfections et à l’intensité de l’inflammation conjonctivale.
Le trachome est généralement plus grave dans le sexe féminin (surtout en termes de fréquence de l’entropion–trichiasis), probablement en raison d’une plus grande exposition à l’agent infectieux. En effet, ce sont les femmes, qui tout au long de leur vie, sont davantage au contact des enfants trachomateux. Les autres facteurs de risque identifiés sont de nature socio-économique : défaut d’hygiène collective, manque d’eau et surtout promiscuité et saleté du visage. Par contre, la malnutrition n’est pas, en soi, un facteur de risque. Au total, ce sont donc surtout l’absence d’hygiène et l’exposition répétée à C. trachomatis qui aggravent la maladie en favorisant les réinfections.
L’infection par C. trachomatis est limitée aux cellules épithéliales. La réponse immunitaire humorale est peu importante et se traduit par l’apparition d’anticorps dans le sérum et dans les larmes. L’immunité cellulaire est marquée par la formation, dans la couche sous-épithéliale de la conjonctive, de follicules lymphoïdes. Ceux-ci sont essentiellement composés de lymphocytes B au centre et de lymphocytes T (CD8+) en périphérie. Entre les follicules, on trouve des infiltrats inflammatoires contenant des plasmocytes, de polynucléaires, des cellules dendritiques ainsi que des macrophages. L’épithélium conjonctival s’amincit et les cellules à mucus disparaissent rapidement.
Sous l’épithélium atrophié, des travées de tissu cicatriciel dense remplacent le stroma normal. Ce tissu cicatriciel est essentiellement constitué de collagène de type V, avec du collagène de type IV le long de la membrane basale remplaçant les collagènes plus lâches de type I et III qui sont normalement présents dans le stroma. Les biopsies pratiquées montrent l’existence d’infiltrats inflammatoires dans lesquels les lymphocytes T (surtout CD4+) sont plus nombreux que les lymphocytes B et les macrophages.
Les expérimentations animales chez les primates ont montré que 6 à 8 semaines après son inoculation dans la conjonctive C. trachomatis n’est plus décelable et que la stimulation antigénique qui persiste serait due à la principale protéine de la membrane externe (mitochondrial outer membrane permeabilization [MOMP]) du genre Chlamydia libérée par la bactérie vivante lors de sa réplication. Ces expérimentations ont aussi montré qu’une inoculation isolée ne provoque qu’un trachome bénin, guérissant rapidement, spontanément et sans séquelles. À l’inverse, de multiples réinfestations par C. trachomatis entraînent une inflammation sévère cliniquement comparable au trachome grave.
Les facteurs qui entraînent et aggravent le processus cicatriciel restent cependant mal connus : ainsi, pourquoi une partie seulement des patients présentant une fibrose cicatricielle développent un entropion–trichiasis et pourquoi une partie seulement de ceux-là développe une opacité cornéenne majeure ? L’intensité de l’inflammation et la durée cumulée de l’infection chlamydienne chez l’enfant augmentent le risque de fibrose conjonctivale grave. Par contre, C. trachomatis n’est que très rarement isolé chez l’adulte, même en zone d’hyperendémie, ce qui laisse penser que ce n’est pas le seul facteur qui influence la progression du processus cicatriciel. Les infections bactériennes non chlamydienne jouent aussi un rôle très important. Ces infections sont associées à des niveaux élevés d’interleukine-1β et du rapport matrix métalloprotéinase 1/tissue inhibitor métalloprotéinase-9. Cela laisse penser que les infections bactériennes non chlamydiennes peuvent induire ou intensifier une réponse cicatricielle au sein de la conjonctive. Il est à noter que, chez les patients trachomateux, cet effet a été constaté non seulement avec des germes pathogènes mais aussi avec des germes commensaux (staphylocoques à coagulase négative, Streptococcus viridans, Corynebacterium spp., Bacillus spp.), même si c’est à un moindre degré [15].
Au cours de la phase inflammatoire, les signes fonctionnels sont discrets : gêne oculaire, picotements, sensation de sable dans les yeux. Lors de la phase cicatricielle, les signes subjectifs sont ceux de la sécheresse oculaire. Dans les cas sévères, et notamment lorsqu’il existe un entropion–trichiasis associé, on note un larmoiement et une photophobie dus aux érosions cornéennes. La baisse d’acuité visuelle est tardive, contemporaine de l’opacification du centre de la cornée.
Le trachome actif, encore appelé trachome inflammatoire ou trachome floride, est caractérisé par la présence de trois signes très évocateurs sans être pathognomoniques, les papilles, les follicules et le pannus :
l’hyperplasie papillaire se présente comme un semis de points rouges microscopiques. Au biomicroscope, les papilles apparaissent comme des saillies polygonales centrées par un bouquet néovasculaire. La conjonctive est œdémateuse et cet épaississement estompe plus ou moins le réseau vasculaire sous-jacent ;
les follicules sont des formations sphériques, translucides, jaunâtres, de la taille d’une tête d’épingle soit environ 0,5 mm de diamètre. Ils sont encerclés de vaisseaux à leur périphérie ; le centre par contre est avasculaire. À la pression, ils éclatent en libérant un liquide gélatineux ;
le pannus cornéen est constitué d’un voile opalescent et vascularisé qui descend du limbe supérieur vers le centre de la cornée. Il est précédé d’une kératite superficielle caractérisée par des micro-ulcérations épithéliales et des infiltrats sous-épithéliaux. Au niveau du limbe, on peut observer des nodules grisâtres, saillants, d’environ 0,5 mm de diamètre, appelés follicules limbiques (fig. 12-26).
Dans le trachome cicatriciel, il n’y a plus ni follicules ni papilles ; par contre, la conjonctive tarsale est parcourue de cicatrices linéaires plus ou moins ramifiées qui convergent vers le bord libre de la paupière en déterminant un sillon (ligne d’Arlt). Le tarse est déformé, bosselé, parfois recouvert de concrétions jaunâtres. Lorsque la rétraction cicatricielle est intense, il se forme un entropion–trichiasis avec déformation du bord libre de la paupière supérieure « en accent circonflexe » et déviation des cils vers le globe oculaire.
Au niveau de la cornée, la cicatrisation du pannus laisse une opacité en croissant de lune ou des opacités brunes, rondes, en pointillé au niveau du limbe (ocelles limbiques ou fossettes de Herbert), pathognomoniques, qui correspondent à la cicatrisation des follicules limbiques. Par contre, lorsqu’il existe un entropion–trichiasis, l’opacification cornéenne peut être très étendue et affecter l’axe visuel (fig. 12-27). Tous les stades de la sécheresse oculaire peuvent se rencontrer, jusqu’au xérosis complet.
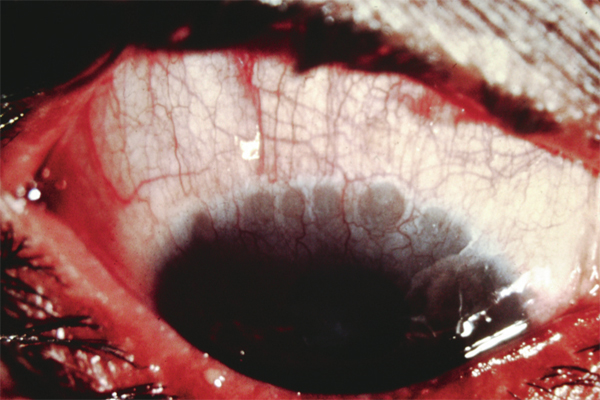
Fig. 12-26 Follicules limbiques et pannus trachomateux.
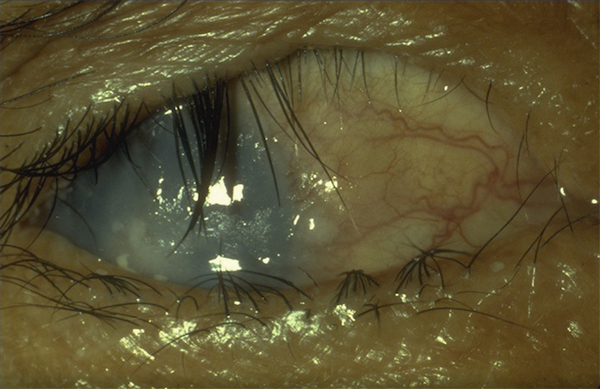
Fig. 12-27 Trichiasis trachomateux, opacité cornéenne et xérosis.
Plusieurs systèmes de classification ont été proposés. À l’heure actuelle, c’est la « codification simplifiée », recommandée par l’OMS, qui est la plus utilisée en raison de sa simplicité et de sa reproductibilité [16].
Cette méthode consiste simplement à noter la présence ou l’absence de cinq signes, indépendamment les uns des autres :
TF (trachome folliculaire) : inflammation trachomateuse folliculaire ; présence d’au moins cinq follicules au niveau des deux tiers inférieurs de la conjonctive tarsale supérieure. Les follicules proches du cul-de-sac conjonctival, non pathognomoniques, ne sont pas pris en considération (fig. 12-28) ;
TI (trachome intense) : inflammation trachomateuse intense ; épaississement inflammatoire prononcé de la conjonctive tarsale (papilles) tel que plus de la moitié des vaisseaux conjonctivaux profonds sont rendus invisibles (fig. 12-29) ;
TS (trachomatous scarring ou trachome cicatriciel) = cicatrices conjonctivales trachomateuses ; présence de cicatrices linéaires ou stellaires sur la conjonctive tarsale supérieure (fig. 12-30) ;
TT (trichiasis trachomateux) : un cil au moins frotte sur le globe oculaire ;
CO (corneal opacity ou opacité cornéenne) : une partie au moins du bord de la pupille apparaît trouble à travers la zone opaque.
Plusieurs signes peuvent coexister chez un même patient : par exemple, TF + TS chez un trachomateux présentant un début de cicatrisation conjonctivale. Il ne s’agit donc pas d’une classification au sens strict du terme, mais plutôt d’un système de codification permettant d’analyser la situation épidémiologique au sein d’une communauté. Le taux de trachome inflammatoire folliculaire (TF) renseigne sur le potentiel de transmission du trachome, alors que le taux de trachome inflammatoire intense (TI) permet d’évaluer le risque d’évolution vers la cécité. Des critères ont été établis pour définir les niveaux d’endémie et le type d’interventions nécessaire [17].
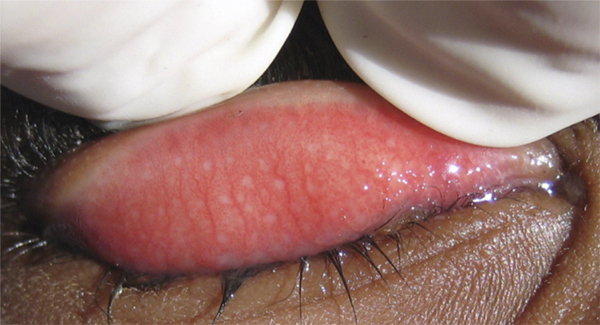
Fig. 12-28 Inflammation trachomateuse folliculaire (TF).
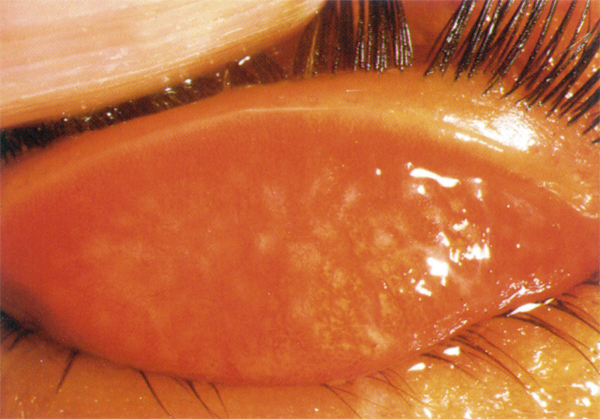
Fig. 12-29 Inflammation trachomateuse intense (TI).
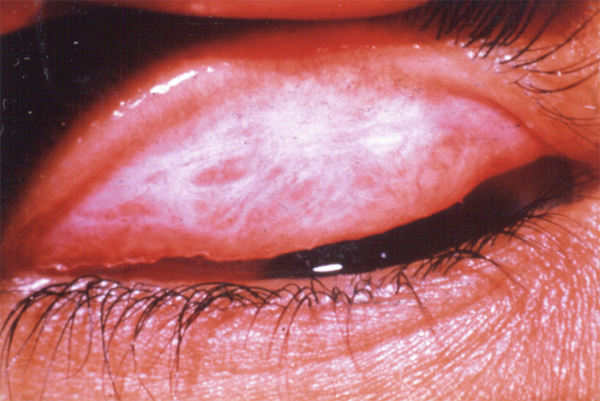
Fig. 12-30 Cicatrices conjonctivales trachomateuses (TS).
En zone d’endémie, le diagnostic clinique est généralement évident. Dans les cas isolés ou douteux, le diagnostic de trachome sera retenu s’il existe au moins deux des quatre signes suivants :
follicules sur la conjonctive tarsale supérieure ;
follicules limbiques ou leurs séquelles (fossettes d’Herbert) ;
pannus vasculaire au niveau du limbe supérieur ;
cicatrisation conjonctivale caractéristique (ligne d’Arlt).
Ces critères permettent d’éliminer sans difficulté les conjonctivites bactériennes et virales. Par contre, la conjonctivite vernale dans ses formes tropicales peut revêtir des aspects particulièrement trompeurs.
Le diagnostic biologique est peu utilisé en zone d’endémie. Les examens sérologiques ne sont ni spécifiques ni sensibles. L’isolement de C. trachomatis sur culture de tissus est un procédé spécifique mais inutilisable en routine.
L’amplification génique par réaction de polymérisation en chaîne (polymerase chain reaction ou PCR) est actuellement la méthode de choix pour détecter et/ou quantifier C. trachomatis. Le séquençage de gènes codant pour l’ARN ribosomal et pour des protéines structurales est utilisé pour distinguer les différentes souches impliquées dans le trachome.
La corrélation entre la clinique et le résultat de la PCR n’est pas parfaite : le test peut être positif en l’absence de tout signe clinique ou au contraire le test peut être négatif chez des patients présentant un trachome actif cliniquement patent. Ces situations sont le reflet de l’histoire naturelle du trachome. L’apparition, puis la disparition des signes cliniques peuvent être décalées dans le temps par rapport au début et à la fin de la période de positivité du test biologique. En effet, le trachome actif ne devient cliniquement apparent que plusieurs semaines après l’infection. De même, il s’écoule plusieurs semaines entre la disparition du micro-organisme – par traitement, par exemple – et la guérison clinique marquée par la disparition des follicules. La contamination du prélèvement ou la persistance des possibles formes latentes de C. trachomatis sont deux autres explications possibles.
Tous les antibiotiques actifs sur C. trachomatis peuvent être utilisés. Cependant le traitement du trachome a été littéralement révolutionné par l’usage de l’azithromycine. Les cures prolongées de pommade tétracycline (6 semaines) ont été avantageusement remplacées par des traitements uniques annuels d’azithromycine per os ou en collyre [17, 18].
Le traitement des cas individuels, notamment du trachome d’importation, ne présente aucune difficulté. Une cure unique de 3 jours d’azithromycine collyre pour le cas et ses contacts familiaux est généralement suffisante. La disparition des follicules prenant plusieurs semaines, un contrôle est effectué après 3 mois. Si les follicules persistent, une deuxième cure peut être prescrite selon les mêmes modalités, en recherchant d’autres contacts qui pourraient être source de réinfection.
En zone d’endémie, le choix de la stratégie thérapeutique repose sur l’analyse de la situation épidémiologique. Celle-ci est généralement réalisée en utilisant la méthodologie d’enquête préconisée par l’OMS, qui permet de mesurer la prévalence du trachome actif (TF) chez les enfants de moins de 10 ans et celle de l’entropion–trichiasis chez les femmes de plus de 14 ans sur un échantillon représentatif de la population concernée [19].
Si plus de 30 % des enfants de moins de 10 ans présentent un trachome actif, l’ensemble de la population est traité une fois par an pendant 5 ans. Si la prévalence est comprise entre 10 et 30 % le traitement de masse n’est institué que pour une période de 3 ans. À l’issue de la période de traitement, une enquête épidémiologique de contrôle est réalisée, permettant de décider de la suite à donner.
Lorsque la prévalence de TF chez les enfants de moins de 10 ans est comprise entre 5 et 10 %, il est recommandé de rechercher s’il existe des foyers de trachome actif (villages, écoles, hameaux, etc.) dont tous les membres seront traités une fois par an pendant 3 ans.
Au-dessous de 5 % de prévalence, aucun traitement collectif n’est requis, seul le traitement des cas et de leurs contacts est indiqué selon le schéma décrit ci-dessus.
Le trachome cicatriciel bénin peut nécessiter une prise en charge pour sécheresse oculaire. Le traitement de l’entropion–trichiasis trachomateux est exclusivement chirurgical. Les trois méthodes les plus employées sont la rotation bilatérale du tarse, la tarsotomie horizontale basse par voie conjonctivale (procédé de Trabut) et la résection cunéiforme du tarse par voie cutanée (procédé de Cuenod et Nataf).
Ces interventions chirurgicales sont généralement pratiquées au cours de campagnes de dépistage. Si elles ont un effet sur les signes fonctionnels, elles ne permettent pas toujours d’éviter la progression des lésions cornéennes qui sont davantage liées à la pathologie de la surface oculaire qu’aux déformations du bord palpébral. Par ailleurs, le taux de récidive est souvent très élevé, pouvant dépasser 30 %, notamment lorsque les conditions chirurgicales laissent à désirer et que le processus cicatriciel demeure évolutif.
Les opacités cornéennes nécessitent une kératoplastie dont les conditions sont cependant très rarement réunies en zone d’endémie. Leurs résultats sont généralement très modestes.
L’OMS a mis en place une alliance dont l’objectif est de parvenir à l’élimination du trachome cécitant sur toute la planète d’ici 2020. Cette alliance connue sous le nom de GET 2020 coordonne depuis 1997 les activités des différentes parties prenantes (pays endémiques, organisations non gouvernementales, centres de recherche et industrie pharmaceutique). Ces activités consistent essentiellement dans la mise en œuvre de la stratégie « CHANCE » partout où le trachome est identifié. Cet acronyme désigne les quatre composantes de la lutte contre le trachome : CHirurgie de l’entropion trichiasis, Antibiothérapie, Nettoyage du visage et Changement de l’Environnement. En effet, la transmission du trachome et donc les réinfections qui en font la gravité ne peuvent être réduites qu’à travers une amélioration de l’hygiène individuelle et collective. C’est d’ailleurs grâce à l’amélioration des conditions d’hygiène que le trachome a disparu des zones les plus développées. Cependant, même si la réduction de la transmission est une condition nécessaire, elle n’est cependant pas suffisante car il faut aussi traiter les infections existantes. Le traitement de masse est donc indispensable pour atteindre des résultats rapides et surtout pour éviter que les enfants ne développent, à terme, des complications graves. Grâce à la générosité des laboratoires Pfizer, la disponibilité des antibiotiques nécessaires n’est plus un problème. En effet, ce laboratoire fait don du nombre de doses que les programmes de traitement sont en mesure de distribuer. Le facteur limitant n’est donc pas la disponibilité du médicament mais bien les systèmes de santé et leurs partenaires qui ont à faire face à un grand nombre de problèmes. En 2013, environ 42 millions de personnes ont été traitées dans le monde, ce qui représente un progrès constant depuis que la donation a été créée en 1999. Cependant, pour atteindre la cible de l’élimination du trachome d’ici 2020, il faudrait quadrupler le nombre de personnes traitées chaque année, ce qui semble être un objectif difficile à atteindre (fig. 12-31). L’analyse de la courbe montre d’ailleurs que depuis 2010 on observe une stagnation, due notamment aux problèmes de sécurité que traversent plusieurs pays endémiques. La disponibilité récente de ressources financières nouvelles incite à l’optimisme car elles permettront d’étendre les programmes de traitement à de nouveaux pays.
Cependant, même dans l’hypothèse d’une élimination du trachome actif d’ici 2020, le nombre de personnes affectées d’un trachome cicatriciel, et donc d’une pathologie de la surface oculaire, restera très élevé pendant des années : 60 millions en 2030 et encore 16 millions en 2050. En effet, même si l’infection est interrompue et qu’il n’y a plus de nouveaux cas, tous les cas qui étaient affectés avant le début des programmes de lutte continueront d’être soumis au risque de progression des processus cicatriciels et dégénératifs, même s’il est possible que ce risque soit réduit du fait de l’absence de réinfections.
Pour ces mêmes raisons, le dépistage et la prise en charge des cas d’entropion–trichiasis trachomateux devront se prolonger des années après l’élimination du trachome actif.
Fig. 12-31 Nombre de personnes traitées par azithromycine entre 1999 et 2013 et prévisions pour la période 2010–2020.
On désigne sous le terme de xérophtalmie l’ensemble des manifestations cliniques provoquées par un déficit en vitamine A. Outre les lésions oculaires, la carence en vitamine A (rétinol) provoque des anomalies au niveau de tous les épithéliums de l’organisme et entraîne donc un risque vital.
L’OMS estime qu’environ un tiers des enfants de moins de 5 ans dans le monde sont victimes d’une carence en vitamine A de degrés divers. On considère que cette avitaminose est responsable du décès de 670 000 enfants de moins de 5 ans dans le monde chaque année. Elle rendrait aussi aveugle 250 000 à 500 000 enfants dans les pays en développement, essentiellement en Afrique et dans le Sud-Est asiatique. Des progrès significatifs ont cependant été réalisés du fait d’une augmentation régulière des taux de couverture de la supplémentation souvent combinée avec la vaccination ou à d’autres campagnes de santé publique.
L’OMS maintien à jour une base de données, accessible en ligne, qui indique pour chaque pays le risque de déficience en vitamine A et donc la nécessité ou non de procéder à une supplémentation systématique [20].
Dans ces zones, une supplémentation à raison de 100 000 UI une fois par an chez les nourrissons de 6 à 11 mois et 200 000 UI deux fois par an chez les enfants de 1 à 5 ans permet de réduire sensiblement la mortalité et le risque de cécité.
Du fait de leur croissance, ce sont les enfants d’âge préscolaire qui ont les besoins de base les plus élevés en μg/kg/jour. Ils sont, en outre, exposés aux infections fréquentes qui majorent ces besoins et peuvent rapidement décompenser un équilibre fragile si les apports sont insuffisants. Le sevrage constitue une autre période critique, surtout si le lait maternel était pauvre en vitamine A du fait d’une faible teneur vitaminique de l’alimentation de la mère.
La vitamine A intervient au niveau de la différenciation des cellules épithéliales et de la multiplication des cellules sécrétoires ; elle permet ainsi de maintenir l’intégrité des tissus épithéliaux. Le déficit en vitamine A entraîne donc une atteinte des tissus épithéliaux.
Les lésions cliniques observées au cours du déficit en vitamine A sont essentiellement ophtalmologiques. Elles sont regroupées sous le terme de xérophtalmie et évoluent en deux phases, non nécessairement successives :
une phase réversible, associant une héméralopie (par diminution de la synthèse de la rhodopsine) et des altérations des tissus épithéliaux entraînant :
le dessèchement progressif des cellules épithéliales de la conjonctive bulbaire ;
la formation d’une tache de Bitot (fig. 12-32) : classiquement triangle jaunâtre ou grisâtre, d’aspect spumeux ou caséeux, non mouillable par les larmes, situé au niveau de la fente palpébrale le plus souvent du côté temporal ;
le xérosis cornéen : dessèchement de la cornée qui devient terne, dépolie, non mouillable. Des zones spumeuses ou caséeuses peuvent apparaître dans l’aire de la fente palpébrale, comme pour la tache de Bitot. Ces lésions régressent en 2 à 5 jours après supplémentation, sauf en ce qui concerne la tache de Bitot dont des traces peuvent persister plusieurs mois même après le rétablissement du statut vitaminique.
une phase irréversible, avec une double atteinte de la cornée : une ulcération superficielle et une nécrose profonde désignée par le terme de kératomalacie qui aboutit rapidement – en quelques heures – à la perforation.
Si l’enfant survit, l’évolution se fait vers une atrophie du globe ou bien vers une cicatrice cornéenne souvent accompagnée de staphylome (fig. 12-33).
Ces lésions sont le plus souvent bilatérales.
Dans certains cas, notamment lorsque les réserves de vitamine A s’effondrent brutalement (rougeole, marasme, etc.), la kératomalacie peut apparaître d’emblée, sans être précédée d’héméralopie ou de xérosis.
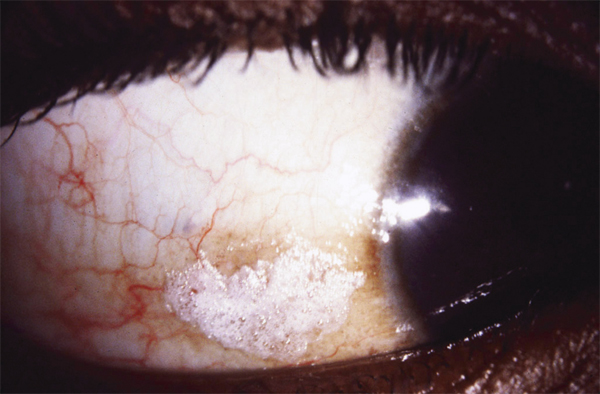
Fig. 12-32 Tache de Bitot (X1B).
Aspect clinique de la cornée de forme triangulaire jaunâtre ou grisâtre évocatrice d’avitaminose A.
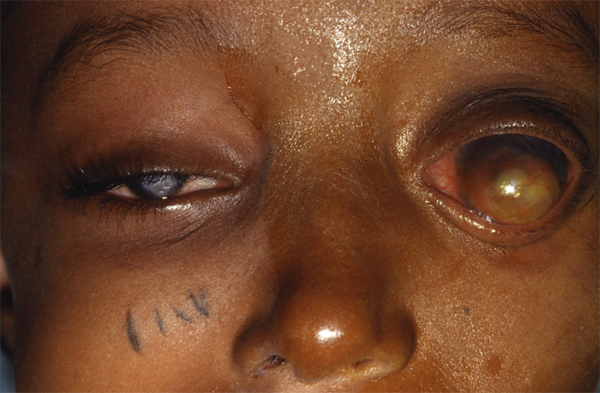
Fig. 12-33 Séquelles d’avitaminose A (XS®). Opacité cornéenne et staphylome.
Le diagnostic est essentiellement clinique, reposant principalement sur le caractère « non mouillable » des lésions. Le dosage du rétinol plasmatique manque de sensibilité, car le taux ne baisse de façon significative que lorsque les réserves hépatiques sont très faibles.
Des épaississements pigmentés dans l’aire de la fente palpébrale sont fréquents dans les kératoconjonctivites allergiques chroniques en milieu tropical.
Quel que soit le stade de la xérophtalmie, le traitement doit être administré d’urgence car l’évolution vers la kératomalacie peut être très rapide. On administre 200 000 UI de rétinol au moment du diagnostic, puis la même dose le lendemain. Une troisième dose peut être administrée 15 jours plus tard, notamment en cas de malnutrition associée. Chez les nourrissons de moins de 1 an, la dose est réduite de moitié [21].
Le découverte d’un cas de xérophtalmie doit systématiquement entraîner la recherche de facteurs de risque dans la collectivité dont est issu le cas, afin d’entreprendre éventuellement un traitement préventif collectif.
[1] WHO. Onchocerciasis and its control. Techincal report series no 852. En ligne : http://apps.who.int/iris/bitstream/10665/37346/1/WHO_TRS_852.pdf?ua=1
[2] Resnikoff S, Cornand G. Limbo-conjonctivite tropicale. Rev Int Trach 1988 ; 65 : 21-52.
[3] Menegay M, Lee DM, Tabbara KF, et al. Proteomic analysis of climatic keratopathy droplets. Invest Ophthalmol Vis Sci 2008 ; 49 : 2829-37.
[4] Mabey DCW, Solomon AW, Foster A. Trachoma. Lancet 2003 ; 362 : 223-9.
[5] Schlosser K. History of trachoma. En ligne : http://trachoma.org/sites/default/files/guidesandmanuals/History%20of%20Trachoma%20by%20Katherine%20Schlosser.pdf
[6] WHO. Expert committee on trachoma. Third report. Geneva : WHO ; 1962.
[7] International Trachoma Initiative. Global Atlas of trachoma. En ligne : http://www.trachomaatlas.org
[8] WHO. Weekly Epidemiological Record 2013 ; no 24 : 242-51.
[9] WHO. Weekly Epidemiological Record 2012 ; no 17 : 161-8.
[10] Bourne RA, Stevens GA, White RA, et al. Causes of vision loss worldwide, 1990–2010 : a systematic analysis. Lancet Glob Health 2013 ; 1 : e339-49.
[11] Stevens G, White R, Flaxman SR, et al. Global Prevalence of vision impairment and blindness : magnitude and temporal trends, 1990–2010. Ophthalmology 2013 ; 120 : 2377-84.
[12] Resnikoff S, Pascolini D, Etya’ale D, et al. Global data on visual impairment in the year 2002. Bull World Health Organ 2004 ; 82 : 844-51.
[13] Pascolini D, Mariotti SP. Global estimates of visual impairment: 2010. Br J Ophthalmol 2012 ; 96 : 614-8.
[14] Thylefors B, Négrel AD, Pararajasegaram R, Dadzie KY. Global data on blindness. Bull World Health Organ 1995 ; 73 : 115-21.
[15] Hu VH, Harding-Esch EM, Burton MJ et al. Epidemiology and control of trachoma : systematic review. Trop Med Int Health 2010 ; 15 : 673-91.
[16] Thylefors BT, et al. A simple system for the assessment of trachoma and its complications. Bulletin of the World Health Organization 1987 ; 65 : 477-83.
[17] WHO. Report of the third global scientific meeting on trachoma, 2010. En ligne : http://www.who.int/blindness/publications/WORLDHEALTHORGANIZATIONGSMmtgreportFINALVERSION.pdf?ua=1
[18] Cochereau I, Goldschmidt P, Goepogui A, et al. Efficacy and safety of short duration azithromycin eye drops versus azithromycin single oral dose for the treatment of trachoma in children: a randomised, controlled, double-masked clinical trial. Br J Ophthalmol 2007 ; 91 : 667-72.
[19] WHO. Trachoma : a guide for programme managers, 2006. En ligne : http://whqlibdoc.who.int/publications/2006/9241546905_eng.pdf?ua=1
[20] WHO. Global database on vitamin a deficiency, 2014. En ligne : http://www.who.int/vmnis/database/vitamina/en/
[21] WHO. Guideline : vitamin A supplementation in infants 1–5 months of age. Geneva : WHO ; 2011.
B. Cochener
La surface oculaire est une préoccupation d’importance ; elle peut être la source de résultats imparfaits (impact fonctionnel et visuel) dans la chirurgie réfractive. L’altération de la surface oculaire préopératoire prédispose à un syndrome sec postopératoire. Les facteurs de risque sont : l’intolérance au port de lentilles de contact, une allergie, un dysfonctionnement meibomien, etc. La physiopathologie de ce syndrome sec résulte d’un mécanisme à la fois neurogène (section des terminaisons nerveuses : photoablation, volet, incision), inflammatoire (réponse cicatricielle) et mécanique (modifications de forme). La réparation se fait en 1 à 3 mois ; au-delà, le processus pathologique chronique est engagé (ocular surface disease [OSD]).
Au-delà des tests classiques et questionnaires de vie, les explorations suivantes sont à mener : esthésiométrie, osmolarité, vidéotopographie, aberrométrie et scatter, OCT de segment antérieur, kératographe, meibographie, interférométrie, etc.
La prise en charge doit être optimisée en : prévenant grâce à la détection au stade préopératoire ; protégeant la surface oculaire durant la procédure ; traitant en postopératoire pour une réparation accélérée.
La chirurgie réfractive regroupe toutes les techniques visant à offrir l’indépendance aux lunettes aux patients amétropes. Ce chapitre de l’ophtalmologie a été ouvert dans les années 1990, il a connu depuis sa naissance de prodigieux progrès dans ses deux approches cornéennes et intra-oculaires. Ces affinements ont permis d’élever le niveau de prétention du gain d’acuité visuelle à celui d’une optimisation des performances visuelles en termes de qualité de vision.
Or, c’est en s’intéressant à cet aspect de la qualité de vie et en exigeant une haute précision de résultats que la surface oculaire a été intégrée comme un facteur d’importance dans ce domaine de la chirurgie fonctionnelle. En premier lieu, à l’heure où les affinements des techniques garantissent sécurité et précision, il peut demeurer une source d’insatisfaction représentée par les pathologies de la surface oculaire inductrices d’une gêne parfois invalidante voire d’une dégradation visuelle. De plus, une anomalie du film lacrymal pourra retentir sur l’évaluation des paramètres préopératoires en étant responsable de mesures erronées compromettant l’exactitude de la programmation chirurgicale.
C’est en identifiant récemment ce rôle majeur joué par la surface oculaire que son évaluation renforcée s’est imposée dans l’arsenal des explorations paracliniques de la chirurgie réfractive et que les efforts de la recherche se sont concentrés sur le développement d’outils de quantification des éléments qui caractérisent cette surface oculaire et de traitements ajustés sur la cause du dysfonctionnement.
Ce sous-chapitre propose de démontrer toute l’importance de la surface oculaire dans ce domaine de la chirurgie réfractive, d’en exposer les causes, d’en décrire les méthodes de mesures spécifiques et d’en évoquer la stratégie de prise en charge.
Quelle que soit la procédure de chirurgie réfractive, la description de signes fonctionnels est communément rapportée. C’est leur persistance à distance de l’opération qui sera à considérer comme une complication vraie de l’opération. En effet, un syndrome sec traînant et rebelle pourra invalider le quotidien d’un patient en dépit d’un 10/10 sans correction retrouvé grâce à l’opération ; il a été rapporté comme sévère dans 3,7 % des cas dans une étude américaine récente conduite à Cleveland et ayant porté sur le suivi prospectif de 1067 candidats à la chirurgie réfractive quelle que soit la procédure [1]. C’est pourquoi il est crucial de procéder à une évaluation préopératoire de la surface oculaire, car il est établi que le principal facteur de risque d’œil sec postopératoire est une surface oculaire altérée, et ce volontiers de façon latente ne se révélant qu’après l’opération.
Par le principe même de la chirurgie qui travaille directement sur la cornée, il est obligatoire d’induire en postopératoire un inconfort dont la durée dépendra du type de procédure mais également des capacités de cicatrisation et de la qualité du film lacrymal du patient opéré.
Il consiste à pratiquer le remodelage excimer sous un volet cornéen préalablement découpé mécaniquement à l’aide d’un microkératome ou par laser femtoseconde. Durant la première semaine qui suit le geste, les symptômes d’un œil sec sont habituels : ils sont rapportés par plus de 50 % des opérés [2] en dépit d’une récupération visuelle qui peut se faire en 2 jours. Il faut cependant souligner que l’insuffisance lacrymale et les signes objectifs ne sont pas toujours retrouvés, supposant que dans la majorité des cas le processus repose surtout sur une forme de neuropathie cornéenne plutôt que sur un vrai syndrome sec.
La photoablation de surface ou plus exactement « les ablations » de surface demeurent la référence et le chef de file même si des variantes se sont ajoutées selon le mode du retrait de l’épithélium cornéen. Il faut ainsi distinguer la PRK conventionnelle, qui repose sur un débridement épithélial mécanique manuel ou à la brosse, du Lasek (laser sub-epithelial keratectomy), où l’exposition à l’alcool permet un détachement chimique de l’épithélium sur sa basale, et de l’epi-Lasik (epithelial laser sub-epithelial keratectomy) qui recourt à un microkétatome spécifique assurant une séparation de l’épithélium de son ancrage au niveau des hémi-desmosomes d’attachement. En vérité, si les deux dernières ont revendiqué leur capacité à faciliter la réparation de surface et à améliorer le confort postopératoire par la réapplication du volet épithélial, il est aujourd’hui admis qu’un néo-épithélium doit se constituer dans tous les cas comme dans la PRK et que c’est l’application d’une lentille pansement qui contribue en fait au soulagement de la douleur aiguë postopératoire.
En vérité, du fait du principe de cette approche en surface, qui interfère directement avec la barrière épithéliale et sectionne les nerfs cornéens sous-jacents contenus dans le volume de stroma retiré pour la correction réfractive, il existe constamment, à des intensités variables et selon la sensibilité individuelle, une phase algique liée à la mise à nu de la surface d’environ 4 à 8 jours selon l’importance de la surface traitée ; elle est associée à des fluctuations visuelles et à une impression de corps étranger qui s’atténueront progressivement. Cette symptomatologie d’altération de la surface oculaire d’un degré supérieur au Lasik évolue de règle favorablement sur 1 mois [3].
C’est une option nouvelle spécifique de la plate-forme femtoseconde Zeiss® qui a développé la capacité de remplacer l’ablation excimer par la découpe d’une lenticule intrastromale dont l’épaisseur et la forme dépendront de l’importance de l’amétropie (myopie avec ou sans astigmatisme combiné). À la naissance du concept, cette pastille tissulaire était retirée par soulèvement d’un volet préalablement découpé avec le même laser femtoseconde (femtosecond laser assisted lenticule extraction ou Flex). Les affinements de la procédure ont transformé le capot cornéen en une poche offrant l’avantage de diminuer la taille de l’effraction de la surface oculaire dans le but de diminuer la quantité de nerfs cornéens sectionnés et de mieux respecter l’intégrité de l’épithélium comparé à un Lasik [4]. Il s’y ajouterait des avantages potentiels concernant le maintien d’une biomécanique cornéenne prémunissant plus efficacement la cornée d’une ectasie secondaire [5]. Vérifier ce bénéfice apporté exigera un recul au long cours de séries élargies.
Les lenticules intracornéennes ou inlays synthétiques sont placés dans le tiers antérieur du stroma cornéen (entre 130 à 200 μ selon les modèles) et dessinés pour compenser la presbytie avec une implantation sur l’œil non directeur privilégié pour la vision de près. Trois concepts sont actuellement disponibles : le Kamra Acufocus® apparaissant sous la forme d’un iris peint travaillant tel un trou sténopéïque ; le Flexivue Presbia® transparent et bifocal ; le Raindrop® (RVO) fait d’un hydrogel très hydrophile et d’un profil hyperasphérique induisant un changement de courbures cornéennes (fig. 12-34). Sachant qu’ils se glissent dans la cornée de règle sous un volet cornéen pratiqué au femtoseconde, leur retentissement sur la surface oculaire sera alors superposable à celle d’un Lasik (auquel du reste il peut être combiné en cas d’amétropie associée) si ce n’est que la réalisation de cette chirurgie à un âge plus avancé et les modifications de la face antérieure de la cornée induite par le discret relief de l’inlay seront pourvoyeurs d’un taux plus significatif de syndrome sec symptomatique et durable retrouvé à l’issue des essais d’évaluation contrôlés (évalué de 20 à 40 %) et justifiant sa prévention par la prescription systématique d’un traitement lubrifiant prolongé [6]. Plus récemment, a été proposée la réalisation d’une poche intrastromale ajustée aux dimensions de la lenticule dans le but, en particulier, de minimiser le traumatisme cornéen et donc l’impact secondaire sur la surface oculaire en plus de favoriser le centrage de la lentille.
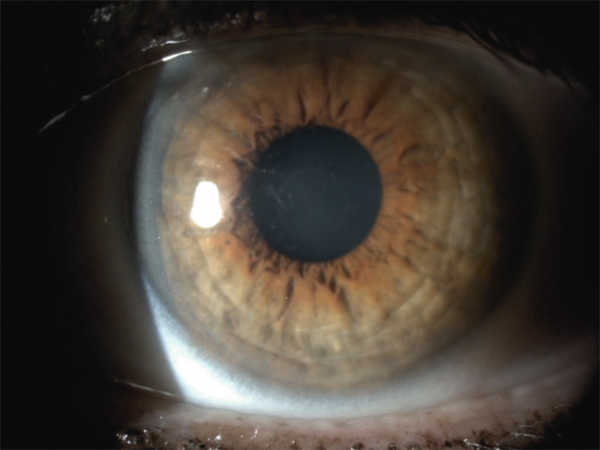
Fig. 12-34 Inlay intracornéen Raindrop® (RVO) en hydrogel inducteur d’un changement d’asphéricité cornéenne.
Les anneaux intrastromaux (fig. 12-35) sont destinés à remodeler une cornée kératoconique afin d’aplanir l’ectasie et de diminuer l’astigmatisme irrégulier. Faits d’un matériau rigide, il est recommandé de placer ces segments aux deux tiers de la cornée, ce qui de règle ne devrait pas être source d’une déformation en surface sauf cependant en cas de tunnel réalisé trop superficiellement et/ou de cornée fine à l’élasticité très altérée. Il faut ajouter que l’atopie constitue souvent le terrain de cette dystrophie et par conséquent est volontiers pourvoyeuse de signes fonctionnels de l’allergie plutôt que d’une sécheresse ; les anneaux étant de leur côté le plus fréquemment responsables de halos et d’éblouissement.
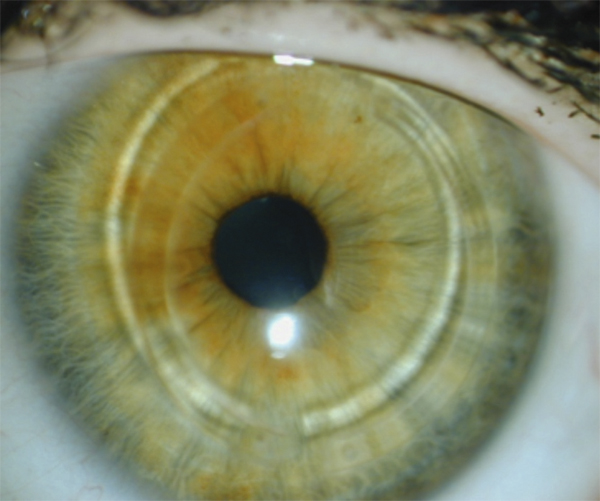
Fig. 12-35 Segments cornéens intrastromaux remodelant la cornée en cas de petite myopie et surtout de kératocône (volontiers associé à l’atopie).
Quelle que soit la méthode, il s’agit de travailler à l’intérieur du segment antérieur à partir d’une incision dont la taille et la qualité de la surface oculaire conditionneront le retentissement fonctionnel sous la forme d’une irritation, d’une sensibilité au contact voire d’une sécheresse favorisée par la section des nerfs cornéens en cas d’abord en cornée claire. Cette symptomatologie n’atteindra certes jamais l’intensité de celle induite par l’abord direct de la cornée au laser excimer.
Indiquée de règle dans les fortes amétropies, elle s’adresse à des patients qui ont généralement été des porteurs de lentilles au long cours et présentent souvent un appel vasculaire voire un pannus et une conjonctivite papillaire, signes d’une intolérance amorcée et source d’un syndrome sec que la chirurgie viendra en partie soulager [7].
La place de la surface oculaire conditionnant les résultats de cette chirurgie la plus pratiquée dans le monde est aujourd’hui bien établie. Elle a été finement identifiée grâce aux progrès de la technique, miniaturisant les incisions et optimisant la sécurité du geste, et par les affinements des implants permettant d’atteindre l’emmétropie très vite après l’opération. Or, la sensation d’un œil sec, de fluctuations visuelles ou de larmoiements est communément (jusqu’à 55 %) rapportée au décours de l’intervention, ce qui est révélateur d’une altération de la surface oculaire souvent préexistante à un âge où le film lacrymal est le plus souvent déficitaire, en particulier par une modification physiologique de l’élasticité des paupières et un dysfonctionnement meibomien, qui représente la première cause (très fréquente chez le sujet vieillissant) de syndrome sec par évaporation [8]. Il existerait de plus une diminution des cellules souches observée après l’opération [9]. Aussi, il est très important de préparer la surface oculaire avant l’opération [10].
À l’heure actuelle, chacune des méthodes chirurgicales de correction réfractive peut prétendre atteindre un très haut niveau de précision permettant de faire naître le concept de « supervision » dont la définition repose plus sur une notion de qualité de vision que d’un niveau d’acuité visuelle dépassant 20/20. C’est ce degré d’affinement qui a permis de mettre en exergue la place importante de la surface oculaire en expliquant beaucoup d’effets secondaires et complications induites par son altération.
Comme évoqué précédemment, il est constant après une photoablation, fréquent après une chirurgie cornéenne et non rare après une chirurgie intra-oculaire de voir rapporter des symptômes illustrant la perte de l’intégrité épithéliale et la sécheresse induite : sensation de corps étranger, de photophobie, de kératalgies, de brûlures et de lourdeur palpébrale, etc. Si ce tableau appartient au cortège opératoire habituel dont il faut informer le patient, sa persistance au-delà de 3 mois pose la question d’un processus pathologique enclenché.
Dans le domaine tout spécifique du Lasik [11], il est des complications redoutées dont la survenue est due ou favorisée par une surface anormale. Il en est ainsi de l’invasion épithéliale correspondant à un passage des cellules épithéliales de la surface sous le volet ou à la capture d’îlots cellulaires dans l’interface (fig. 12-36) [12]. Cette migration de cellules est activée par un défect épithélial à proximité du volet tel qu’on l’observe en cas de capot malmené ou d’épithéliopathie préopératoire méconnue (voir chapitre 20-I). Le retraitement d’un Lasik pour amétropie résiduelle par soulèvement mécanique du volet augmente considérablement ce risque. L’introduction du laser femtoseconde a permis en revanche d’éliminer quasiment l’invasion épithéliale dont la gestion est si délicate, avec un risque de récidive important même après un lavage soigneux [13]. L’autre complication sévère favorisée par une surface oculaire pathologique est le syndrome inflammatoire de l’interface, ou SOS syndrome pour « sand of Sahara », en raison de l’aspect en dunes irrégulières de cette kératite lamellaire diffuse qui s’installe dans les 15 jours suivant la chirurgie Lasik et évolue en quatre stades de gravité pouvant conduire à la fonte nécrotique de la cornée (fig. 12-37). Son origine reste mystérieuse, mais divers facteurs tels que des particules exogènes issues des instruments, des produits détergents de nettoyage jouant un rôle toxique, des endotoxines bactériennes et un syndrome sec important ont été mis en cause.
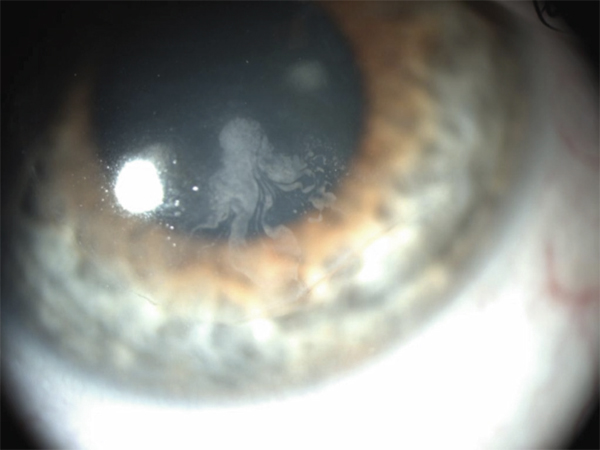
Fig. 12-36 Invasion épithéliale post-Lasik favorisée par l’altération de la couche épithéliale.
Fig. 12-37 Kératite lamellaire diffuse post-Lasik.
SOS syndrome par inflammation de l’interface favorisée notamment par la sécheresse oculaire.
Au-delà des fluctuations visuelles qu’une surface non intègre induit, une simple kératite ponctuée superficielle pourra entraîner une diminution significative de l’acuité visuelle jusqu’à sa disparition. Ainsi, la récupération progressive de la photoablation de surface n’offrira une vision optimale qu’après réparation ad integrum de l’épithélium, comblant en 4 jours environ l’ulcère initial par migration confluente et métaplasie cellulaire, suivie d’une régularisation et d’un lissage de sa surface. Par ailleurs, un film lacrymal imparfait en préopératoire sera source de mesures erronées des topographies, voire de la réfraction avec en particulier une estimation impropre de l’astigmatisme conduisant à une mauvaise programmation chirurgicale, qu’elle soit cornéenne ou intra-oculaire.
Il a été préalablement souligné dans cet ouvrage le retentissement péjoratif d’un syndrome sec symptomatique et chronicisé dans le quotidien d’un patient, qui se trouve aliéné par la maladie pénalisant l’ensemble de ses activités quotidiennes. Si un tel tableau s’installe au décours d’une chirurgie réfractive, le ressenti du patient sera d’autant plus lourd et vindicatif que ce dernier aura payé pour une chirurgie visant à soulager son quotidien de tout problème visuel et que jusqu’à l’heure de l’opération en dehors de l’équipement optique, il ne connaissait aucune gêne spécifique. C’est ainsi que certains opérés ont pu sombrer dans une véritable dépression en dépit d’un résultat visuel atteint mais en raison de symptômes fonctionnels rebelles et obsédants.
Nous nous concentrerons ici sur la physiopathologie du syndrome sec décrit dans le Lasik qui est le mieux analysé, d’une part parce qu’il s’agit de la chirurgie réfractive la plus pratiquée et de l’effet secondaire le plus commun de cette procédure, d’autre part parce que de cette étude physiopathologique peuvent être déduits les mécanismes impliqués dans l’apparition d’une sécheresse oculaire après tout autre type d’opération réfractive.
Ainsi, un dysfonctionnement lacrymal survient chez la quasi-totalité des opérés et se résout dans la majorité des cas. Mais les plaintes et l’inconfort sont variables, car ils ne relèvent pas d’une seule entité mais d’un éventail de causes englobant : trouble neurotrophique transitoire ou non ; instabilité lacrymale ; déficit aqueux vrai ; neuropathie douloureuse [14].
Nous allons ainsi évoquer l’action séparée ou en combinaison synergique, en plus du changement attendu de la forme de la cornée, de la cause neurogène liée à la section des nerfs cornéens, de la cause inflammatoire relative au mécanisme de réparation ainsi que de la cause plus discutée de l’altération des cellules souches limbiques.
La composante de la régulation nerveuse dans l’équilibre cornéen et lacrymal est bien établie. Par conséquent, la section des terminaisons nerveuses sous l’action du laser excimer ou la découpe d’un volet Lasik entraînent une perturbation de la boucle réflexe : cornée–glande lacrymale–clignement (glande de Meibomius). Il a longtemps été évoqué une corrélation potentielle entre la quantité de nerfs cornéens sectionnés et l’importance de la diminution de la sensibilité cornéenne et de la sévérité de la sécheresse induite, donnant ainsi la préférence à la charnière large et nasale. Mais les méta-analyses de la littérature remettent en doute ce lien [15]. Il en est également ainsi de l’épaisseur du volet Lasik dont l’affinement n’a pas fait la preuve d’un moindre taux de syndrome sec induit. Il n’existerait enfin pas de différence significative entre le Lasik réalisé par microkératome comparé au femtoseconde à 3 mois, à 6 mois ou au long cours [16].
La première conséquence de l’altération de l’innervation est bien sûr la diminution de la sensibilité cornéenne qui accompagne systématiquement et durant environ 3 mois tous les gestes de chirurgie cornéenne au laser (Lasik, SMILE et a fortiori ablations de surface) [17], ce qui correspond au délai moyen de repousse des terminaisons nerveuses. Cependant, en cas de dommage persistant, une défaillance de la cicatrisation épithéliale en découle pouvant conduire à des érosions récurrentes, un ulcère trophique et une fonte cornéenne pouvant aller jusqu’à une perforation. Dans ce cas, une véritable épithéliopathie neurotrophique s’est organisée, dont la première description a été faite par Ambrosio en 2008 [18] et baptisée « LINE » syndrome (Lasik induced neurotrophic epitheliopathy). Il existerait probablement dans ce processus l’interaction de facteurs déclenchés par le dommage épithélial : PEDF (pigment epithelium derived factor) libérée par les cellules épithéliales agressées ; DHA (docosahexaenoic acid), de production également cellulaire, dont la combinaison diminuerait la production de leucotriènes (LTB4) à chimiotactisme neutrophile et par là même diminuerait la réponse inflammatoire. Le DHA stimulerait la biosynthèse d’un facteur NPD1 (neuroprotectin D1) favorable à la régénération nerveuse. La mise en évidence de ces facteurs ouvre des espoirs thérapeutiques dans la modulation future de la réponse tissulaire secondaire à la chirurgie réfractive cornéenne [19].
Cependant, selon la théorie du « membre fantôme » décrit après l’amputation d’un membre, il a pu être évoqué la « cornée fantôme » [20] liée une stimulation lors du Lasik des fibres sensitives qui innervent richement ce tissu. Cela conduit à une perception consciente d’œil sec, d’inconfort et de douleur. Le dommage des nerfs cornéens altère l’expression des canaux membranaires ioniques induisant un influx nerveux spontané aberrant et accru. Ces décharges sensorielles pourraient être interprétées par le cerveau comme une sensation de sécheresse. Cela pourrait expliquer la forte incidence d’impression d’œil sec après PRK, notamment en dépit d’une modeste perturbation de la sécrétion lacrymale, d’où l’intérêt de rechercher des principes actifs capables de réduire l’activité anormale des nerfs traumatisés comme alternative à la diminution du syndrome sec secondaire à la chirurgie réfractive.
Toute chirurgie correspond à une agression oculaire déclenchant une réponse réparatrice mettant en jeu les acteurs de l’inflammation. Si corticoïdes et anti-inflammatoires non stéroïdiens sont de longue date manipulés dans les suites opératoires pour leur capacité à diminuer la réponse cicatricielle, de multiples travaux se sont concentrés sur l’identification plus précise de la cascade d’événements en cause et sur la modulation de cette réaction postopératoire dans le domaine tout particulier de la photoablation. Ainsi, ont pu être étudiées les protéines des larmes telles que l’Apa4A qui semblerait accélérer la réparation de surface après Lasik et PRK [21].
Le Lasik représente la chirurgie réfractive la plus pourvoyeuse de sécheresse oculaire ; cette dernière est rapportée dans 50 % des cas au cours du 1er mois et sera source d’un inconfort sévère dans environ 5 à 10 % des cas. Si l’effet neurotrophique est le mécanisme dominant, il s’y ajoute le changement de la forme de la cornée affectant la dynamique lacrymale, cause d’un assèchement de la surface cornéenne [22].
L’incrimination de modifications de la conjonctive périlimbique a également été évoquée, elles seraient relatives au traumatisme induit par l’anneau de succion mis en place dans le Lasik. Une diminution des cellules souches a été ainsi mesurée au moins 1 mois après la mise en place d’un microkératome pouvant contribuer à une sécheresse oculaire. Ce paramètre ne semble pas avoir été étudié en cas de recours au femtoseconde pour un Lasik ou une phako-excérèse, qui fait appel à une succion près de 3 à 5 fois moindre.
L’existence d’une sécheresse préopératoire sera source d’un syndrome sec aggravé, justifiant qu’une attention particulière soit portée au dépistage préopératoire des anomalies de la surface oculaire. Son exploration s’est approfondie et est devenue plus systématique depuis que l’importance de la sécheresse oculaire a été comprise dans les suites indésirables de la chirurgie réfractive, quelle que soit la méthode [23].
Il est des prédispositions à la sécheresse oculaire qui ont été bien établies telles que le diabète, l’allergie oculaire dans un décor d’atopie ou par intolérance aux lentilles de contact source d’une conjonctivite papillaire, la prise de médicaments asséchant les muqueuses comme les somnifères et antidépresseurs. Mais c’est sûrement l’âge qui constitue le terrain à risque essentiel sachant qu’au-delà de 50 ans, le dysfonctionnement meibomien, source d’un syndrome sec par évaporation, constitue le mécanisme principal (et s’associe ainsi volontiers aux chirurgies de la presbytie et de la cataracte). Chez la femme de cette catégorie d’âge, les changements hormonaux de la ménopause induisent également une diminution des sécrétions des muqueuses de l’organisme dont en particulier celle de la conjonctive responsable d’un œil sec.
Cette approche qualitative, comme précédemment soulignée, est devenue indispensable à l’évaluation de la chirurgie réfractive en particulier et reflète indirectement la qualité de la surface oculaire.
Ils sont importants à considérer puisque c’est leur ressenti qui définit le caractère symptomatique de la sécheresse oculaire et par là même la source de gêne et d’insatisfaction du patient. La liste n’est pas exhaustive mais elle associe essentiellement : picotements, brûlures, sensations de corps étrangers, lourdeur des paupières voire retentissement visuel avec halos, éblouissement, photophobie, fluctuations et même baisse de vision. La fréquence de ces symptômes (de 5 à 20 % selon les séries) s’accroît en cas d’altération de la surface oculaire préexistante [24].
Ils sont proposés au patient dans le but de recenser les signes fonctionnels et surtout de les grader selon leur intensité. De nombreux questionnaires ont été publiés portant sur :
la qualité de vie : VF14 (Visual Fonction Index), NEI-VFQ25 (National Eye Institute Visual Function Questionnaire) ;
la qualité de surface : OSDI (Ocular Surface Disease Index), SPEED (Standard Patient Evaluation of Eye Dryness) dont la nature des questions posées est plus ou moins adaptée à une procédure chirurgicale donnée et dont le nombre conditionnera la commodité de la mise en pratique [25].
De règle, ils donnent lieu à un score de significativité en relation avec la gravité du retentissement de la sécheresse oculaire sur le quotidien du patient, mais très inconstamment corrélé à la gravité des lésions induites sur la surface oculaire. Il peut être pertinent de les proposer en préopératoire en cas de signes d’alerte et très sûrement en postopératoire pour le suivi d’une chirurgie et l’évaluation du confort patient.
Elle est admise de longue date comme une quantification cruciale de la qualité de vision. Elle est mesurée avec ou sans éblouissement et s’intéresse en particulier aux conditions mésopiques mais également photopiques qui en cas de kératite ponctuée sèche seront perturbées par la photophobie. Si l’échelle des gris demeure l’approche conventionnelle, c’est souvent la mesure du MTF (modulation transfert function), fournie par l’aberrométrie et par certains topographes, qui est la plus communément utilisée pour refléter la sensibilité des contrastes. Parmi les étiologies fréquentes de dégradation des contrastes, l’instabilité d’un film lacrymal et l’altération de la surface cornéenne peuvent en être responsables [26].
Elle représente sans nul doute une avancée spectaculaire de la chirurgie réfractive en particulier dans la quantification de la qualité de vision. Mesurant les aberrations optiques du système optique, elle a permis d’accéder à l’identification des aberrations d’ordre élevé telles que : les aberrations sphériques liées notamment à l’asphéricité géométrique des dioptres oculaires (cornée, cristallin) et influençant la vision nocturne ainsi que la profondeur de champ ; le coma et le trefoil volontiers induits par le décentrement d’une chirurgie réfractive ; la déformation cornéenne ou une bascule par implant. Rappelons de plus que l’aberrométrie est une bonne méthode de mesure de la réfraction (aberrations d’ordre faible) et du facteur MTF (fig. 12-38).
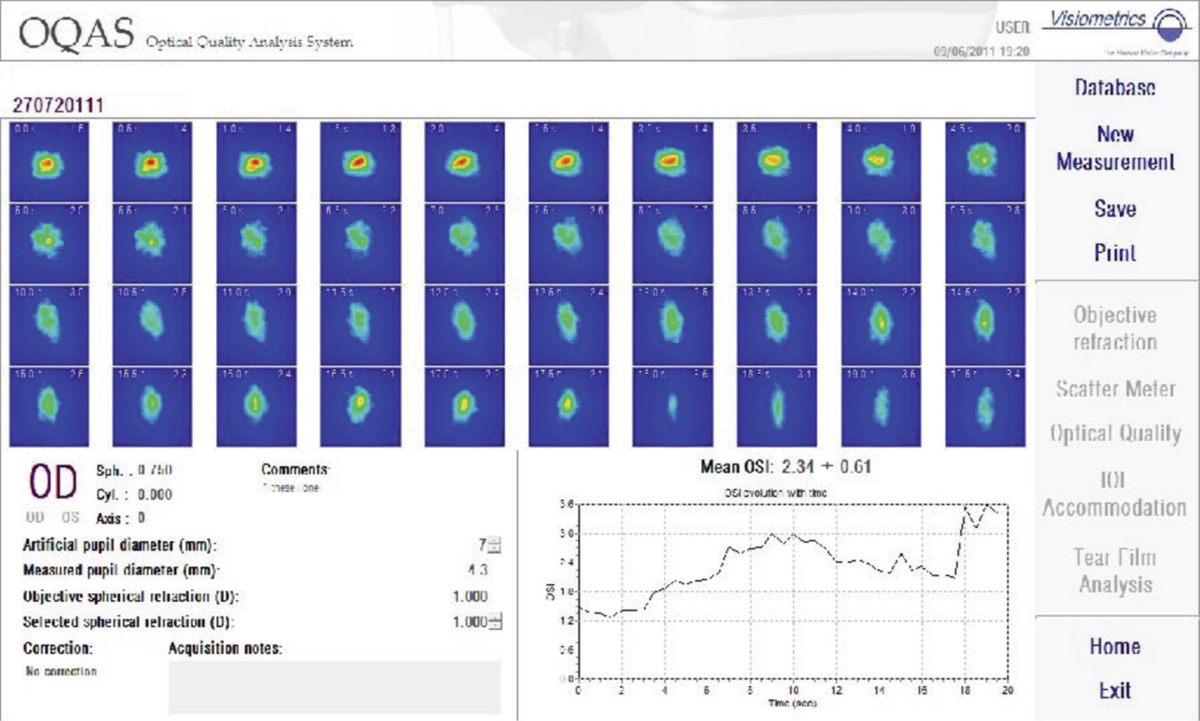
Fig. 12-38 Aberrométrie : labilité des images par altération du film lacrymal.
Dans un souci de mieux détecter un dysfonctionnement de la surface oculaire et surtout de tout faire pour en déterminer l’origine, la sévérité et le pronostic, les efforts de la recherche se concentrent depuis une décennie sur le développement de tests capables de quantifier et de contourner les limites auxquelles se heurtent l’évaluation clinique de la surface oculaire quant à son imprécision et sa non-corrélation avec la symptomatologie rapportée par le patient.
Ils font appel à la séquence traditionnelle qui combine dans une chronologie à respecter afin de ne pas créer d’interférence qui fausserait les résultats :
examen biomicroscopique de la cornée et des annexes recherchant par exemple les conséquences d’un port prolongé de lentilles (conjonctivite papillaire, pannus), les signes de l’inflammation ou les troubles de la transparence ;
test aux colorants (fluorescéine et vert de lissamine) dont la quantification, comme il a été détaillé ailleurs dans cet ouvrage, est certes codifiée mais demeure subjective car dépendante de l’appréciation de l’observateur ;
break-up time (BUT) systématiquement mesuré en préopératoire d’une chirurgie réfractive ; il révèle ainsi régulièrement une instabilité du film lacrymal en cas d’intolérance avérée aux lentilles de contact. Là aussi, son comptage est dépendant de l’examinateur. Une plate-forme récente développée par Oculus (Keratograph®) permet de chiffrer automatiquement le BUT (fig. 12-39) ;
test de Schirmer : il n’est pas, en pratique, systématiquement proposé avant une chirurgie réfractive mais ne devrait pas être omis en cas de signe d’alerte.
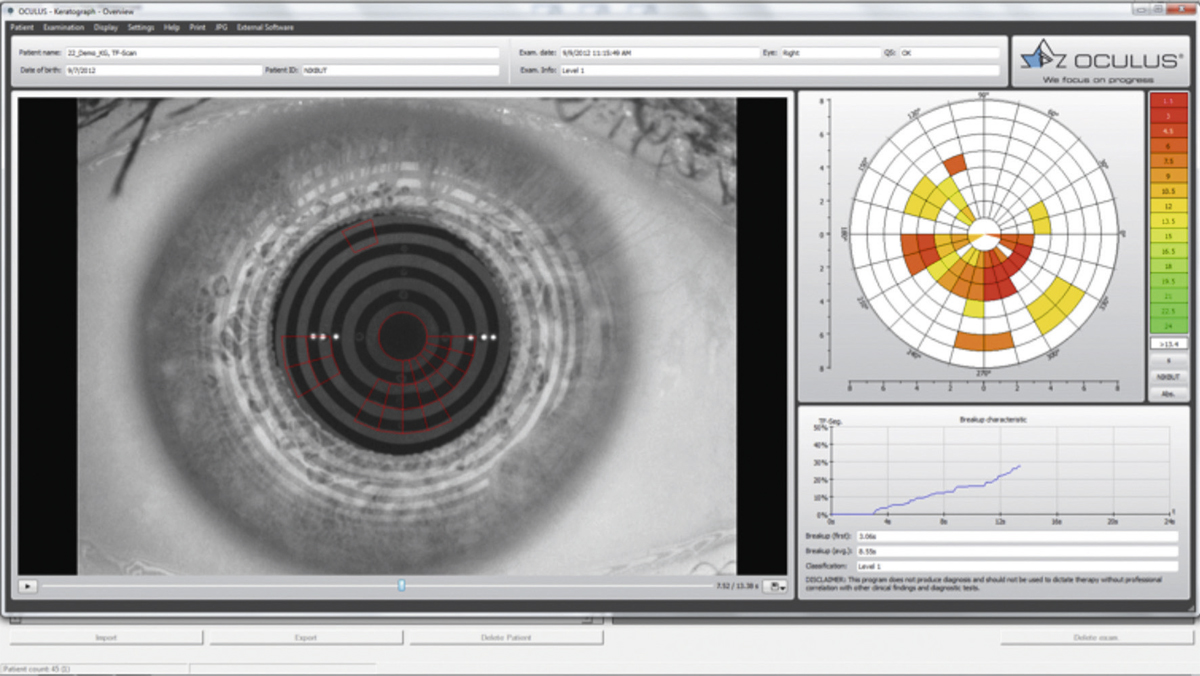
Fig. 12-39 Quantification automatisée du BUT avec le Keratograph® (Oculus).
Reposant sur le classique test de Cochet-Bonnet ou faisant appel à un esthésiomètre novateur réalisant automatiquement cette mesure, cette évaluation trouve toute sa place dans l’étude de la réparation cornéenne faisant suite aux chirurgies photoablatives qui impliquent une section des terminaisons nerveuses et dont la repousse peut être objectivée par la récupération de cette sensibilité généralement aux alentours des 3 mois postopératoires.
Par sa capacité à réaliser une histologie in vivo, elle permet notamment de suivre la repousse des terminaisons nerveuses, la réorganisation stromale normale ou pathologique, d’apprécier l’activité des kératocytes et l’épithélium dans son intégrité et dans la qualité de son organisation pluristratifiée.
Qu’elle soit de Placido ou d’élévation, la topographie vise à mesurer la régularité et la symétrie de la cornée. Dans tous les cas, celles-ci se trouveront altérées en cas de perturbations de la surface oculaire, source d’une déformation des images apparaissant souvent sous la forme d’une mosaïque de couleurs labile d’un examen à l’autre et liée à une cassure du film lacrymal et/ou une altération de la surface cornéenne. Il s’agit du reste d’un diagnostic différentiel avec un astigmatisme irrégulier vrai de la cornée qu’il faudra dépister en vérifiant la qualité de la capture de l’image et/ou en renouvelant l’exploration après l’instillation d’une goutte de lubrifiant (fig. 12-40).
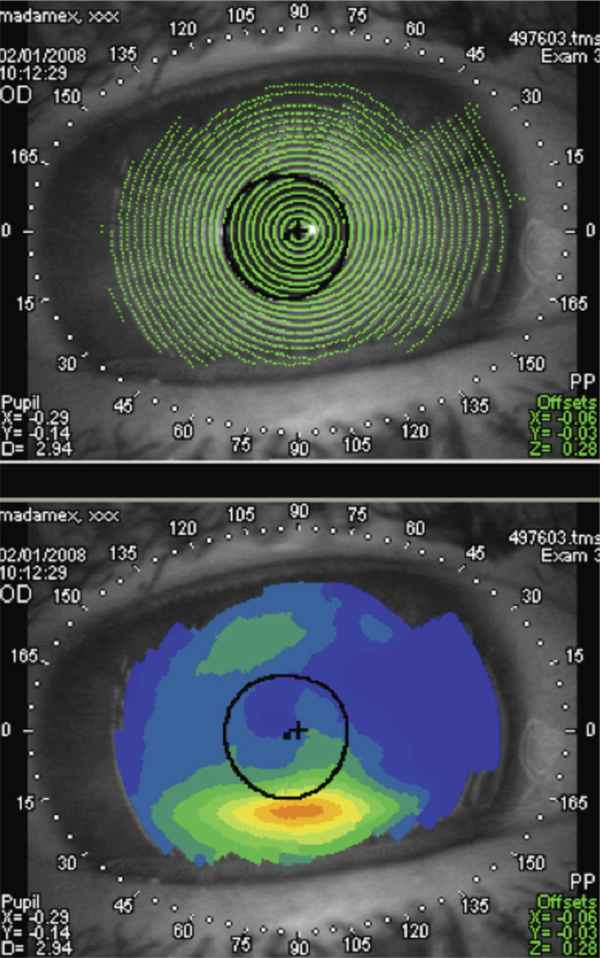
Fig. 12-40 Topographie : déformation des images par rupture du film lacrymal exposant à une lecture erronée des images.
Il ne peut être en tant que tel considéré comme une exploration de la surface oculaire. Lui aussi est en mesure, dans sa version à haute définition, d’évaluer la cornée dans chacune de ses couches et de déterminer par exemple la profondeur d’une cicatrice postopératoire ou du volet d’une découpe lamellaire. Il peut par ailleurs montrer la diminution du ménisque lacrymal en cas de sécheresse oculaire. La hauteur du ménisque de larmes pourra du reste être également quantifiée par le Keratograph® (Oculus) (fig. 12-41).
Fig. 12-41 Quantification du ménisque lacrymal par le Keratograph® (Oculus).
Il est établi que l’inflammation oculaire, composante importante de la sécheresse et secondaire à la chirurgie, est directement liée à l’osmolarité qu’il est par conséquent intéressant de mesurer comme reflet indirect de la réponse inflammatoire. Ce paramètre était uniquement accessible en laboratoire jusqu’à l’avènement du dispositif TearLab® capable par capillarité à partir d’un faible échantillon d’au moins 50 nl de larmes de quantifier l’osmolarité lacrymale avec un seuil de 308 mmol/l au-dessus duquel la sécheresse oculaire est reconnue patente. Dans le décor de la chirurgie réfractive, cette mesure de l’osmolarité a montré une spécificité et une sensibilité supérieures aux tests conventionnels pour le dépistage préopératoire d’un syndrome sec. En revanche, le coût de chaque embout, non pris en charge actuellement, est un facteur limitant qui ne permet le recours à cet examen que dans le cadre de la recherche clinique en particulier des essais comparatifs de traitements lubrifiants (fig. 12-42 ; voir aussi fig. 4-26a, b et fig. 22-1a, b) [27].
Fig. 12-42 Plateforme d’analyse du dysfonctionnement meibomien (LipiView®, TearSciences) et de traitement (LipiFlow®, TearSciences).
a. Expression des glandes de Meibomius. b. LipiView®. c. LipiFlow® : coque pneumatique chauffante.
La diffusion de la lumière, ou mesure du « scatter light », qui se trouve altérée en cas de trouble des milieux est devenue un paramètre d’intérêt à deux titres : celui de la détection d’une modification de la transparence cristallinienne pouvant ainsi affiner le diagnostic précoce d’une cataracte et celui de l’altération du film lacrymal. Il est bien sûr important de s’assurer dans l’interprétation des données recueillies qu’il n’existe pas de cause associée telle qu’une pathologie de la surface oculaire combinée à une cataracte. Deux plates-formes actuellement approchent cette mesure :
le C-Quant® (Oculus) qui évalue à proprement parler la diffusion de la lumière traversant le système optique ;
l’Optical Quality Analysing System ou OQAS (Visiometrics), de manipulation plus aisée, qui est en fait un aberromètre à double passage s’intéressant à la quantification du pic de la fonction d’étalement du point (point spread function [PSF]) comme un reflet indirect de la qualité de la diffusion lumineuse au sein de l’œil. Le résultat s’exprime en index OSI (Ocular Scattering Index) qui est considéré anormal au-delà de 2 et pathologique au-delà de 4 [28, 29].
Elle connaît un regain d’intérêt depuis qu’a été démontrée la fréquence du dysfonctionnement meibomien comme origine principale des syndromes obstructifs représentant plus de 50 % des tableaux de sécheresse oculaire par évaporation qui accompagnent en particulier le processus du vieillissement oculaire. La recherche de l’expression des glandes de Meibomius par pression en éversion des paupières inférieures, l’appréciation de la qualité du meibum dans sa couleur et consistance, tout comme l’examen soigneux des paupières à la recherche d’une blépharite par inflammation chronique devraient systématiquement être effectués avant toute chirurgie réfractive, et ce d’autant plus que le patient est âgé de plus de 45 ans. Nous avons assisté au cours de ces dernières années au développement d’appareils de quantification de cette couche lipidique et de la fonctionnalité des glandes représentés par la meibogaphie Topcon et Oculus (fig. 12-43) et le LipiView® (TearSciences). Ce dernier, comme évoqué dans le chapitre 4 consacré à la meibomite, peut se combiner avec le LipiFlow® qui assure un traitement par coque thermique pneumatique agissant en une étape selon l’action également visée par les soins d’hygiène des paupières à l’eau bouillie tiédie ou par masque ou lunettes chauffantes. Cet appareil quantifie également les clignements des paupières dans leur vitesse et leur efficacité. C’est ainsi que bon nombre de kératites ponctuées superficielles en bandes inférieures sont régulièrement attribuées à des clignements incomplets méritant des exercices de rééducation à proposer au patient [30].
Fig. 12-43 Visualisation des arborescences glandulaires de Meibomius en transillumination (Keratograph®, Oculus).
L’importance de la surface oculaire dans la chirurgie réfractive, quelles que soient les procédures, venant d’être démontré, il paraît crucial désormais de ne pas la négliger tant dans le dépistage préopératoire que dans la prise en charge postopératoire [31]. Il sera ainsi nécessaire de considérer avec soin chaque étape de l’opération.
Il apparaît clairement que la seule mesure de la réfraction associée à l’évaluation morphologique de la cornée n’est plus suffisante au bilan préopératoire de toute chirurgie du segment antérieur. Il convient de questionner sur les signes fonctionnels et de procéder à une évaluation plus spécifique de la surface oculaire au moins par les tests conventionnels. La découverte d’une instabilité du film lacrymal, d’une altération de la surface cornéenne, d’une inflammation des paupières ou, plus précisément encore, la mesure d’indices pathologiques avec les divers outils d’exploration précédemment évoqués doivent conduire à traiter ce patient de façon symptomatique et de ne décider la chirurgie réfractive qu’après amélioration de la surface oculaire incluant l’état des paupières. Ainsi, l’altération de ces dernières n’est qu’exceptionnellement une contre-indication à l’opération mais impose une préparation préopératoire, une vigilance particulière concernant les informations exhaustives à délivrer et le renforcement annoncé du suivi. En matière de chirurgie photoablative, un laser excimer de surface pourra être préféré au Lasik en cas de syndrome sec patent compte tenu du risque majoré d’induire une aggravation et une chronicité par la présence d’un volet cornéen.
Il est important d’avoir soin de respecter tout au long d’une opération oculaire en général et d’une chirurgie réfractive en particulier la surface oculaire. Parmi les recommandations pratiques à souligner, peuvent être mentionnés : l’arrosage régulier de la surface oculaire au cours de la procédure, le non-excès d’application de la solution antiseptique et du collyre anesthésiant pouvant conduire à une kératite toxique favorisant notamment les complications du volet et de l’interface Lasik et le soin requis en cas de chirurgie lamellaire (Lasik, inlay, anneaux) quant au lavage soigneux et efficace de la surface oculaire dans le but d’éliminer les particules contaminant le film lacrymal et de minimiser le risque d’infection et d’inflammation.
La survenue d’une sécheresse postopératoire par modification de la surface oculaire et par le processus de réparation cicatricielle induit est la règle et justifie par conséquent que soit systématiquement proposé un traitement lubrifiant d’une durée moyenne de 2 à 4 semaines. Au-delà de ce délai, les besoins de le prolonger dépendent de chaque patient et en particulier de leur état préopératoire. Le choix des collyres s’orientera de préférence vers les formules sans conservateur associées à une solution de lavage et, selon le type de procédure, à un collyre anti-inflammatoire (stéroïdien) en postopératoire immédiat pour la majorité des opérations en dehors des débridements de surface (ablations de surface, crosslinking) qui exigeront d’attendre, avec un anti-inflammatoire non stéroïdien antalgique et un antibiotique de sécurité, la repousse épithéliale complète avant l’introduction éventuelle de la cortisone locale. La survenue d’un haze cornéen ou d’une inflammation exubérante peut conduire à moduler le traitement par l’introduction d’une corticothérapie renforcée à doses prudemment régressives, voire à l’utilisation de mitomycine 0,2 mg/ml appliquée après photoablation thérapeutique en cas de cicatrice rebelle pénalisant la vision [32]. Le type de collyre lubrifiant dépendra des habitudes et convictions du prescripteur mais de règle suivra la cascade habituelle allant des substituts lacrymaux jusqu’aux formules enrichies de carbomères et acide hyaluronique. Il pourra être proposé, en cas de sécheresse préopératoire détectée ou de syndrome sec postopératoire rebelle, d’associer au traitement local la mise en place de bouchons lacrymaux (permanents ou résorbables) avec l’objectif de diminuer la fréquence des gouttes en retardant l’évacuation du film lacrymal. Le recours à l’utilisation de la micronutrition n’a pas fait ses preuves dans ce chapitre spécifique de la chirurgie réfractive [33], alors que le recours au sérum autologue ne devrait pas trouver sa place dans ce chapitre à moins d’une complication grave relevant de règle d’une mauvaise sélection du patient. En revanche, la place de la ciclosporine à faible concentration (0,05 ou 0,01 %) a été tout à fait démontrée comme favorable à la réparation de surface. Elle est réservée sur notre continent, où elle n’est disponible que sur autorisation temporaire d’utilisation (ATU), aux sécheresses persistantes et invalidantes [34]. Le rôle enfin des thérapies matricielles est actuellement en évaluation concernant la repousse épithéliale après débridement (PRK, crosslinking). Soulignons cependant qu’à la condition d’une grande vigilance préopératoire dans le choix des indications et la préparation du patient, la majorité des opérés ne seront que transitoirement gênés, efficacement soulagés par les simples substituts et connaîtront un retour à la normale dans le mois qui suit la chirurgie.
Ce sous-chapitre consacré à la chirurgie réfractive et la surface oculaire pourra paraître anecdotique au sein de la pathologie oculaire large et variée de ce carrefour oculaire dont l’intégrité conditionne la performance visuelle et la qualité de vie du patient. Or la chirurgie réfractive peut prétendre être au service de la surface oculaire en ayant permis de mieux comprendre les mécanismes physiopathologiques de la réparation cornéenne normale ou anormale et de stimuler les efforts de la recherche pour la découverte de nouveaux outils d’exploration. De son côté, la surface oculaire a révélé toute son importance dans la quête de résultats optimisés en démontrant qu’elle conditionnait la récupération de la vision et expliquait la majorité des complications potentielles. C’est pourquoi son exploration se doit désormais d’être systématique avant toute chirurgie dont elle guidera le choix et la prise en charge postopératoire.
En d’autres termes le domaine de la surface oculaire doit une bonne partie de ses progrès à la chirurgie réfractive qui, pour sa part, doit une amélioration de ses performances à la prise en considération de la surface oculaire.
[1] Toricelli AA, Bechara SJ, Wilson SE. Screening of refractive surgery candidates for Lasik and PRK. Cornea 2014 ; 33 : 1051-5.
[2] Garcia-Zalisnak D, Nash D, Yeu E. Ocular surface diseases and corneal refractive surgery. Curr Opin Ophthalmol 2014 ; 25 : 264-9.
[3] Skevas C, Katz T, Wagenfeld L, et al. Subjective pain, visual recovery and visual quality after LASIK, epiLASIK (flap off) and PRK – a consecutive, non randomized study. Graefes Arch Clin Exp Ophthalmol 2013 ; 25 : 1175-83.
[4] Demirok A, Ozgurhan EB, Agca A, et al. Corneal sensation after corneal refractive surgery with small incision lenticule extraction. Optom Vis Sci 2013 ; 90 : 1040-7.
[5] Xu Y, Yang Y. Dry eye after small incision lenticule extraction and LASIK for myopia. J Refract Surg 2014 ; 30 : 186-90.
[6] Tonita M, Kanamori T, Waring Go 4th, et al. Simultaneous corneal inlay implantation and laser in situ keratomileusis for presbyopia in patients with hyperopia, myopia and emmetropia : 6 month results. J Cataract Refract Surg 2012 ; 38 : 495-506.
[7] Zaldivar R, Oscherow S, Piezzi V. Bioptics in phakic and pseudophakic intraocular lens with the Nidek EC-5000 excimer laser. J Refract Surg 2002 ; 18 : S336-9.
[8] Zeev MS, Miller DD, Latkany R. Diagnosis of dry eye disease and emerging technologies. Clin Ophthalmol 2014 ; 20 : 581-90.
[9] Rodriguez-Prats JL, Hamdi IM, Rodriguez AE, et al. Effect od suction ring application during LASIK on goblet cell density. J Refract Surg 2007 ; 23 : 559-62.
[10] Gayton JL. Etiology, prevalence, and treatment of dry eye disease. Clin Ophthalmol 2009 ; 3 : 405-12.
[11] Nettune GR, Pflugfelder SC. Post-LASIK tear dysfunction and dysesthesia. Ocul Surf 2010 ; 8 : 135-45.
[12] Toda I. LASIK and the ocular surface. Cornea 2008 ; 27 : S70-6.
[13] Salomao MO, Ambrosio R Jr, Wilson SE. Dry eye associated with laser in situ keratomileusis : Mechanical microkeratome versus femtosecond laser. J Cataract Refract Surg 2009 ; 35 : 1756-60.
[14] Quinto GG, Camacho W, Berhens A. Postoperative surgery dry eye. Curr Opin Ophthalmol 2008 ; 19 : 335-41.
[15] Mian SI, Li AY, Dutta S, et al. Dry eyes and corneal sensation after laser in situ keratomileusis with femtosecond laser flap creation. Effect of hinge position, hinge angle, and flap thickness. J Cataract Refract Surg 2009 ; 35 : 2092-8.
[16] Sun CC, Chang CK, Ma DH, et al. Dry eye after LASIK with a femtosecond laser or a mechanical microkeratom. Optom Vis Sci 2013 ; 90 : 1048-56.
[17] Mian SI, Shtein RM, Nelson A, Musch DC. Effect of hinge position on corneal sensation and dry eye after laser in situ keratomileusis using a femtosecond laser. J Cataract Refract Surg 2007 ; 33 : 1190-4.
[18] Ambrosio R Jr, Tervo T, Wilson SE. LASIK-associated dry eye and neurotrophic epitheliopathy : pathophysiology and strategies for prevention and treatment. J Refract Surg 2008 ; 24 : 396-407.
[19] Kenchegowda S, He J, Bazan HE. Involvement of pigment epithelium-derived factor, docosahexaenoïc acid and neuroprotectin D1 in corneal inflammation and nerve integrity after refractive surgery. Prostaglandins Leukot essent Fatty Acids 2013 ; 88 : 27-31.
[20] Belmonte C. Eye dryness sensations after refractive surgery : impaired tear secretion or « phantom » cornea ? J Refract Surg 2007 ; 23 : 598-602.
[21] D’Souza S, Petznick A, Tong L, et al. Comparative analysis of two femtosecond lASIK platforms using iTRAQ quantitative proteomics. Invest Ophthalmol Vis Sci 2014 ; 55 : 3396-402.
[22] Qazi Y, Aggarwal S, Hamrah P. Image-guided evaluation and monitoring of treatment response in patients with dry eye disease. Graefes Arch Clin Exp Ophthalmol 2014 ; 252 : 857-72.
[23] Bron AJ, Tomlinson A, Foulks GN, et al. Rethinking dry eye disease : a perspective on clinical implications. Ocul Surf 2014 ; 12 : S1-31.
[24] Kinard K, Jarstad A, olson RJ. Correlation of visual quality with satisfaction and function in a normal cohort of pseudophakic patients. J cataract Refract Surg 2013 ; 39 : 590-7.
[25] Li XM, Hu L, Hu J, Whang W. Investigation of dry eye disease and analysis of the pathogenic factors in patients after cataract surgery. Cornea 2007 ; 26 : S16-20.
[26] Patel S, Alio JL, Artola A, Martinez MJ. Tear volume and stability after LASIK. J Refract Surg 2007 ; 23 : 290-8.
[27] Hassan Z, Szalai E, Berta A, et al. Assessment of tear osmolarity and other dry eye parameters in post-Lasik eyes. Cornea 2013 ; 32 : e 142-5.
[28] Habay T, Majzoub S, Perrault O, et al. Objective assessment of the functional impact of dry eye severity on the quality of vision by double pass aberrometry. J Fr Ophthalmol 2014 ; 37 : 188-94.
[29] Rzemyk V, Cochener B. Quality of vision studied by comparative measurement of light scattering. J Fr Ophthalmol 2014 ; 37 : 540-7.
[30] Bauman A, Cochener B. Meibomial gland dysfunction : a comparative study of modern treatment. J Fr Ophthalmol 2014 ; 37 : 303-12.
[31] Lemp MA. Advances in understanding and managing dry eye disease. Am J Ophthalmol 2008 ; 146 : 350-6.
[32] Farahi A, Hashemi H, Mehravaran S. The effects of mitomycin C on tear function after photorefractive keratectomy : a controlateral comprative study. J Refract Surg 2013 ; 29 : 260-4.
[33] Ong NH, Purcell TL, Roch-Levecq AC, et al. Epithelial healing and visual outcomes of patients using omega-3 oral nutritional supplements before and after photorefractive heratectmy : a pilot study. Cornea 2013 ; 32 : 761-5.
[34] Lee HS, Jang JY, Lee SH, et al. Clinical effectiveness of topical cyclosporine a 0.05 % after laser epithelial keratomileusis. Cornea 2013 ; 32 : e150-5.
B. Mathieu, M. Muraine
Le ptérygion est une lésion fibrovasculaire conjonctivale bénigne relativement répandue, empiétant progressivement sur la cornée et pouvant devenir invalidante. L’exposition au rayonnement ultraviolet représente le principal facteur de risque. La localisation limbique est expliquée par l’effet Coroneo, correspondant à la focalisation sur le limbe nasal des rayons réfléchis provenant de la région temporale. L’excision suivie d’une autogreffe conjonctivale est actuellement le traitement de référence et permet d’obtenir un faible taux de récidive dans la plupart des cas. L’apport récent des colles biologiques a permis de rendre l’intervention plus simple et moins invalidante pour le patient en postopératoire.
Le ptérygion est une lésion fibrovasculaire conjonctivale bénigne relativement répandue empiétant progressivement sur la cornée [1]. Le terme ptérygion provient du grec pteros faisant référence à son aspect triangulaire en « aile » de papillon (fig. 12-44) [2]. Son évolution est en général très lente et dirigée vers le centre de la cornée (fig. 12-45).
L’origine de cette affection multifactorielle n’est pas à l’heure actuelle totalement élucidée mais la plupart des études s’accordent sur un rôle majeur des rayonnements ultraviolets (UV) et de la concentration de ceux-ci sur la région limbique nasale. Le ptérygion est caractérisé par un front de migration de cellules épithéliales altérées partant du limbe, le plus souvent nasal, et se dirigeant vers le centre de la cornée. Celui-ci s’accompagne d’une métaplasie conjonctivale avec présence de cellules à mucus, tandis que la matrice extracellulaire stromale sous-jacente devient le siège d’une prolifération fibroblastique et d’une néovascularisation avec afflux de cellules inflammatoires [3].
Cette affection représente un problème de santé publique dans de nombreux pays en voie de développement mais pas seulement [4]. Ainsi en Australie, le traitement du ptérygion représente une dépense annuelle de 8,3 millions de dollars australiens chaque année [5].
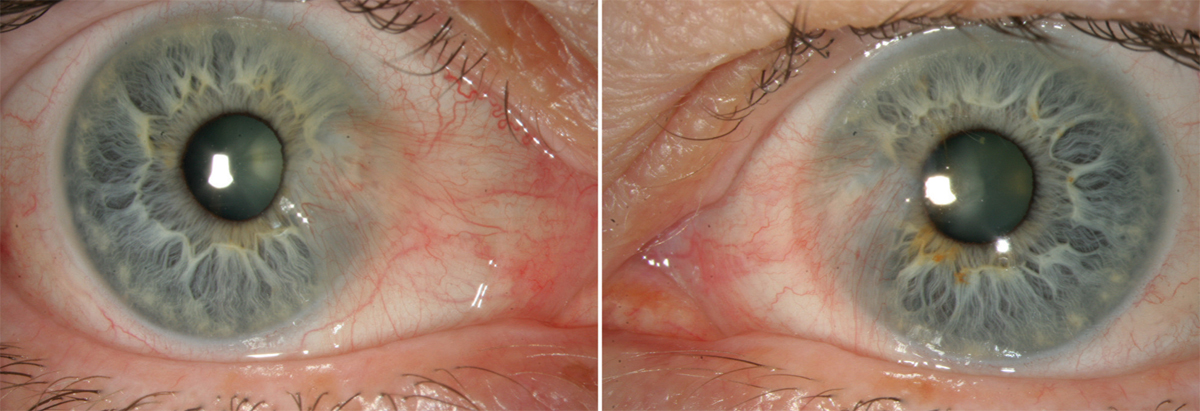
Fig. 12-44 Aspect triangulaire bilatéral caractéristique du ptérygion.
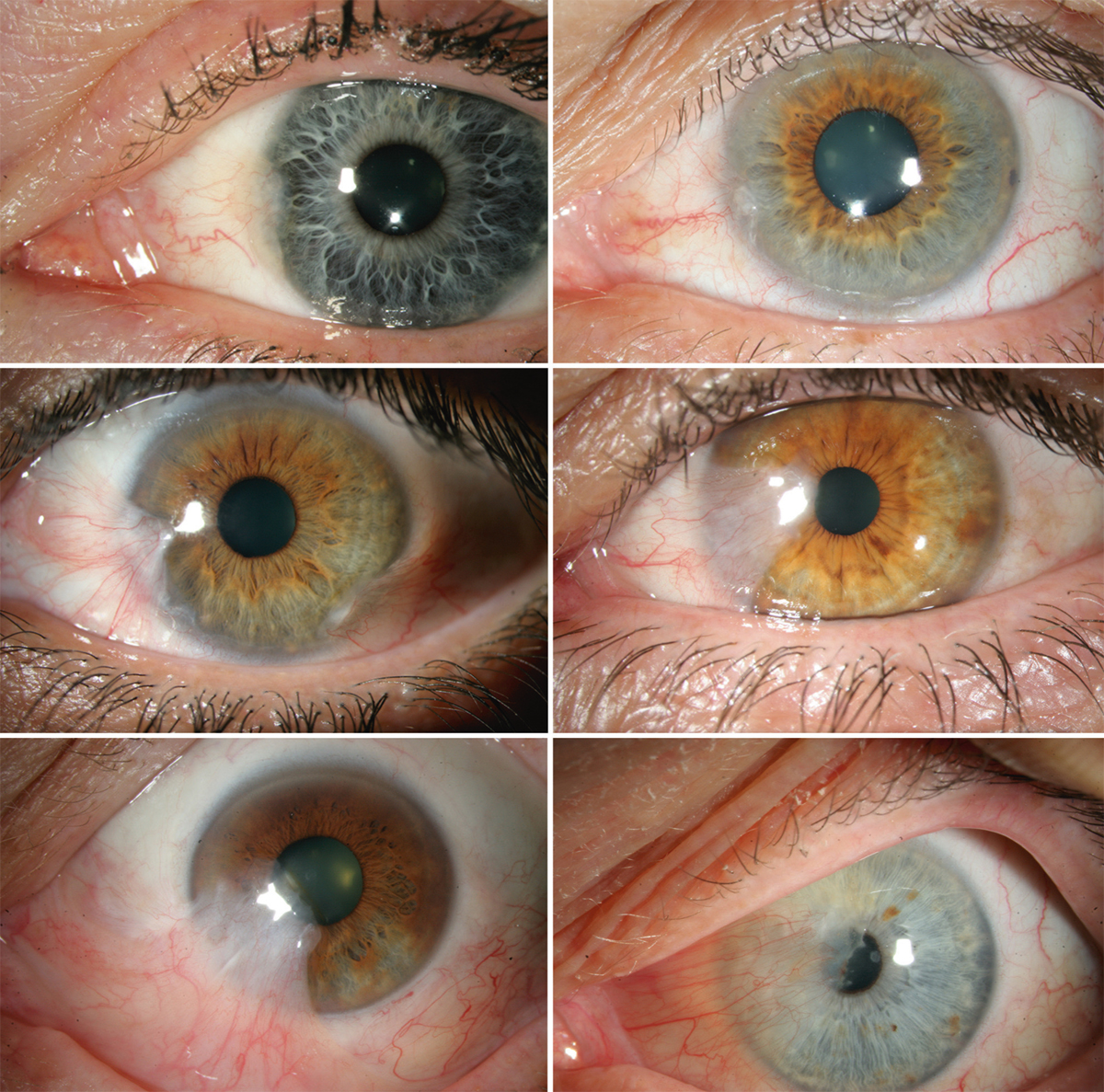
Fig. 12-45 Stades évolutifs du ptérygion, du moins évolué en haut à gauche au plus évolué en bas et à droite.
Noter la localisation limbique des formes toutes débutantes avant une extension centripète vers le centre de la cornée et vers le cantus interne.
La prévalence du ptérygion est extrêmement variable d’une région à l’autre. Elle va de 1,2 % dans les populations caucasiennes vivant en région tempérée à 19,6 % pour les populations asiatiques [6].
Les populations vivant en milieu chaud, désertique, situées dans les régions péri-équatoriales aux latitudes de 37° au nord et au sud de l’Équateur et fortement exposées aux rayonnements ultraviolets sont plus à risque de développer cette affection [7]. Pour exemple, une étude australienne a mis en évidence une prévalence du ptérygion chez 15 % des aborigènes vivant au nord contre 4,5 % pour ceux vivant au sud du pays [8]. Cependant d’autres régions situées en dehors du 40e parallèle présentent des prévalences du ptérygion élevées. Ainsi une prévalence du ptérygion de 8 % environ a été rapportée à 65° de latitude nord chez les Inuits au Groenland et dans les populations vivants en haute altitude [9–11]. Cette constatation peut être expliquée par l’importance de la réflexion des UV sur la neige comme facteur de risque majeur dans la genèse du ptérygion [12].
D’autres facteurs de risque sont reconnus tels que le sexe masculin, les patients vivant en milieu rural, ainsi que certaines professions à risque (agriculteurs, soudeurs, marins). L’environnement sec et chaud, la poussière et tous les processus responsables d’une irritation chronique de la surface oculaire sont également reconnus comme des facteurs de risque [13].
Le ptérygion est nasal dans 90 % des cas.
La physiopathologie du ptérygion reste encore incomplètement élucidée. Cependant, il est certain que le rayonnement ultraviolet joue un rôle majeur dans la genèse du ptérygion associé à de multiples autres facteurs contribuant à son développement.
La relation entre le niveau d’ensoleillement et le ptérygion est connue depuis les travaux de Talbo en 1948 et de Cameron en 1965 [14]. Dès lors, de nombreuses études épidémiologiques sont venues confirmer l’effet de l’exposition chronique aux UV dans le développement du ptérygion. La quantité de lumière ultraviolette absorbée par l’être humain dépend de la latitude, du terrain réfléchissant et du temps passé à l’extérieur. Lors de périodes de fort ensoleillement, l’arcade sourcilière et la paupière supérieure protègent la cornée du rayonnement solaire incident, c’est donc principalement le rayonnement solaire réfléchi par la surface de l’environnement qui atteint la cornée (mer, sable, neige, etc.). On définit ainsi l’albédo qui correspond à la fraction réfléchie d’un rayonnement incident. Celui-ci permet de décrire le caractère plus ou moins réfléchissant d’une surface donnée. À titre d’exemple, le gazon réfléchit 1 % des UVB, l’asphalte 8 %, le sable 15 %, l’eau 25 à 30 % des UVB contre près de 90 % pour la neige. Cela explique que les populations Inuits vivant sur la neige reçoivent une quantité d’UV réfléchie identique à d’autres populations vivant dans des régions intertropicales pourtant nettement plus ensoleillées.
L’explication selon laquelle le ptérygion se développait préférentiellement au niveau de la région nasale du limbe dans la fente palpébrale a été décrite par l’Australien Coroneo [15].
En effet, lors de l’exposition de l’œil à une source lumineuse latérale déplacée en temporal d’avant en arrière, un point lumineux est observé au niveau du limbe nasal lorsque l’angle de la source lumineuse et du plan sagittal atteint 100 à 110° (vidéo 12-1). Cet effet Coroneo est d’autant mieux mis en évidence en ambiance scotopique, car l’obscurité permet de s’affranchir des innombrables interfaces réfléchissantes de l’environnement. Ce point lumineux au niveau du limbe nasal correspond à une concentration des rayonnements latéraux par la cornée en cet endroit précis (fig. 12-46). La plupart des autres zones du limbe étant protégées des rayons latéraux par le nez, l’arcade sourcilière ou la pommette, le phénomène Coroneo ne se manifeste qu’en nasal sauf lorsque l’œil est en extrême abduction.
Ce même phénomène se produit avec le rayonnement ultraviolet. L’intensité du rayonnement UVB concentré au niveau du limbe nasal est alors 20 fois supérieure à celle du rayonnement temporal incident et occasionne des dommages au niveau de l’ADN des cellules souches limbiques et des fibroblastes [15, 16]. La perte de leurs rôles de barrière entre les épithéliums conjonctivaux et cornéens contribuerait ainsi au développement du ptérygion [17, 18].
Les cellules épithéliales limbiques et les cellules fibroblastiques, dont l’ADN subirait des dommages sous l’action des UVB, migreraient de façon centrifuge le long des membranes basales du limbe, de la cornée et de la conjonctive. Enfin la migration se ferait préférentiellement vers la région cornéenne en s’accompagnant de la sécrétion de métalloprotéinases qui détruiraient la couche de Bowman, de phénomènes de fibrose, et d’angiogenèse aboutissant finalement au développement du ptérygion.
Vidéo 12-1 Effet Coroneo permettant de comprendre la localisation limbique nasale du ptérygion.
Fig. 12-46 Effet Coroneo permettant de comprendre la localisation limbique nasale du ptérygion.
Ce n’est que lorsque la lumière vient du côté temporal, en arrière du plan bicantal, que les rayons lumineux sont clairement focalisés et concentrés sur la région limbique nasale (flèche).
Plusieurs voies permettent d’expliquer le développement du ptérygion sous l’effet des rayonnements UV.
Les rayonnements UV sont capables d’induire un stress oxydant au niveau cellulaire avec pour conséquence la production de nombreux radicaux libres au premier rang desquels le monoxyde d’azote (NO) ou le peroxyde d’hydrogène. Ce stress oxydant altère les matrices extracellulaires, la synthèse de collagène et d’élastine. Il est également impliqué dans l’activation des métalloprotéinases, la néoangiogenèse, la prolifération et la migration des cellules endothéliales et la production d’espèces réactives pour l’oxygène (reactive oxygen species ou ROS) au cours du développement du ptérygion [19].
Les métalloprotéinases (MMP) sont des endopeptidases dépendantes du zinc, sécrétées par les cellules épithéliales et les fibroblastes, dont le rôle est de dégrader les composants de la matrice extracellulaire et les connexions intercellulaires. Il existe à l’état naturel un équilibre entre ces dernières et leurs inhibiteurs (tissue inhibitors of metalloproteinase [TIMP]). Lors de la rupture de cet équilibre, les MMP vont être impliquées dans le processus inflammatoire (prolifération, migration, angiogenèse) [20]. La surexpression de ces MMP induites par le rayonnement UV ainsi que les cytokines inflammatoires et les facteurs de croissance contribuent au caractère invasif du ptérygion vers la région cornéenne par dégradation de la couche de Bowman.
Une augmentation de la production de cytokines inflammatoires (IL-2, TNF-α) résultant de l’exposition aux UV a également été retrouvée au cours du développement du ptérygion. Ces cytokines vont contribuer au recrutement de cellules immunitaires (lymphocytes T, macrophages) responsables du développement et de l’entretien de la réaction inflammatoire locale au sein du ptérygion [21, 22], ainsi qu’à l’augmentation de facteurs de croissance tels que le VEGF (vascular endothelial cell growth factor) favorisant l’angiogenèse.
Bien que l’environnement joue un rôle indéniable dans la genèse du ptérygion, l’hérédité semble aussi influencer son développement.
Des formes autosomiques dominantes ont été décrites, ainsi que le polymorphisme de certains gènes dont le Ku70 susceptibles d’influencer la prolifération du ptérygion [23, 24].
Certains virus dont le human papilloma virus (HPV) et l’herpes simplex virus (HSV) ont été impliqués dans la genèse du ptérygion avec cependant des résultats très discordants entre les différentes études [25].
Le mécanisme par lequel HPV pourrait être impliqué dans le processus de développement du ptérygion serait l’inactivation du gène p53. Ce dernier est impliqué à l’état naturel dans l’apoptose cellulaire et subirait en présence de HPV des modifications menant à son inactivation qui conduirait à l’accumulation de dommages au niveau de l’ADN cellulaire et au développement du ptérygion [26]. L’expression anormale de p53 reste là aussi très variable et controversée avec des valeurs s’étalant de 7 à 100 % au sein des différentes études [27].
Toutes les hypothèses préalablement citées ne suffisent pas à expliquer certains aspects du développement du ptérygion tel son profil de croissance centripète lui donnant son aspect en forme d’aile si caractéristique.
La région limbique siège de l’épithélium limbique, de vaisseaux sanguins et d’un plexus nerveux peut être endommagée par l’exposition aux UV.
La réponse neurogène consécutive à l’exposition solaire peut constituer une voie intéressante dans l’explication mécanistique du processus de genèse et de croissance du ptérygion. Sous l’action des UV, la libération de neuropeptides comme la substance P peut participer au processus inflammatoire par leurs rôles dans le chimiotactisme des cellules immunitaires, l’augmentation de la production de cytokines, la migration des fibroblastes [28, 29].
Le ptérygion est donc une affection dont le développement dépend de multiples facteurs de risque parmi lesquels, en premier lieu, l’exposition aux UV.
Le patient consulte, en général, pour une gêne de nature esthétique, une symptomatologie à type d’irritation oculaire, ou parfois en raison d’une baisse d’acuité visuelle progressive.
La sécheresse oculaire, l’inflammation locale, le flou visuel secondaire à l’astigmatisme direct induit sont fréquemment retrouvés chez les patients porteurs de ptérygion.
Un élément à ne pas méconnaître est le type d’astigmatisme rencontré au cours du ptérygion. Il s’agit le plus souvent d’un astigmatisme direct, conforme à la règle (axe le plus plat situé à 0°) et asymétrique. Cet astigmatisme est rarement secondaire à une traction générée par le ptérygion. Le plus souvent, l’analyse topographique permet de mettre en évidence un aplatissement nasal localisé entre la tête du ptérygion et l’apex cornéen, aplatissement dû à la constitution d’un lac de larmes en cet endroit. L’analyse topographique permet d’ailleurs de confirmer la normalité de l’hémiméridien temporal opposé (fig. 12-47). Cette accumulation lacrymale est responsable d’un effet prismatique dont la base est orientée vers la tête du ptérygion et le sommet vers l’apex cornéen. Cet effet du film lacrymal est mis en évidence par une différence significative de l’astigmatisme cornéen avant et après tamponnement des larmes [30].
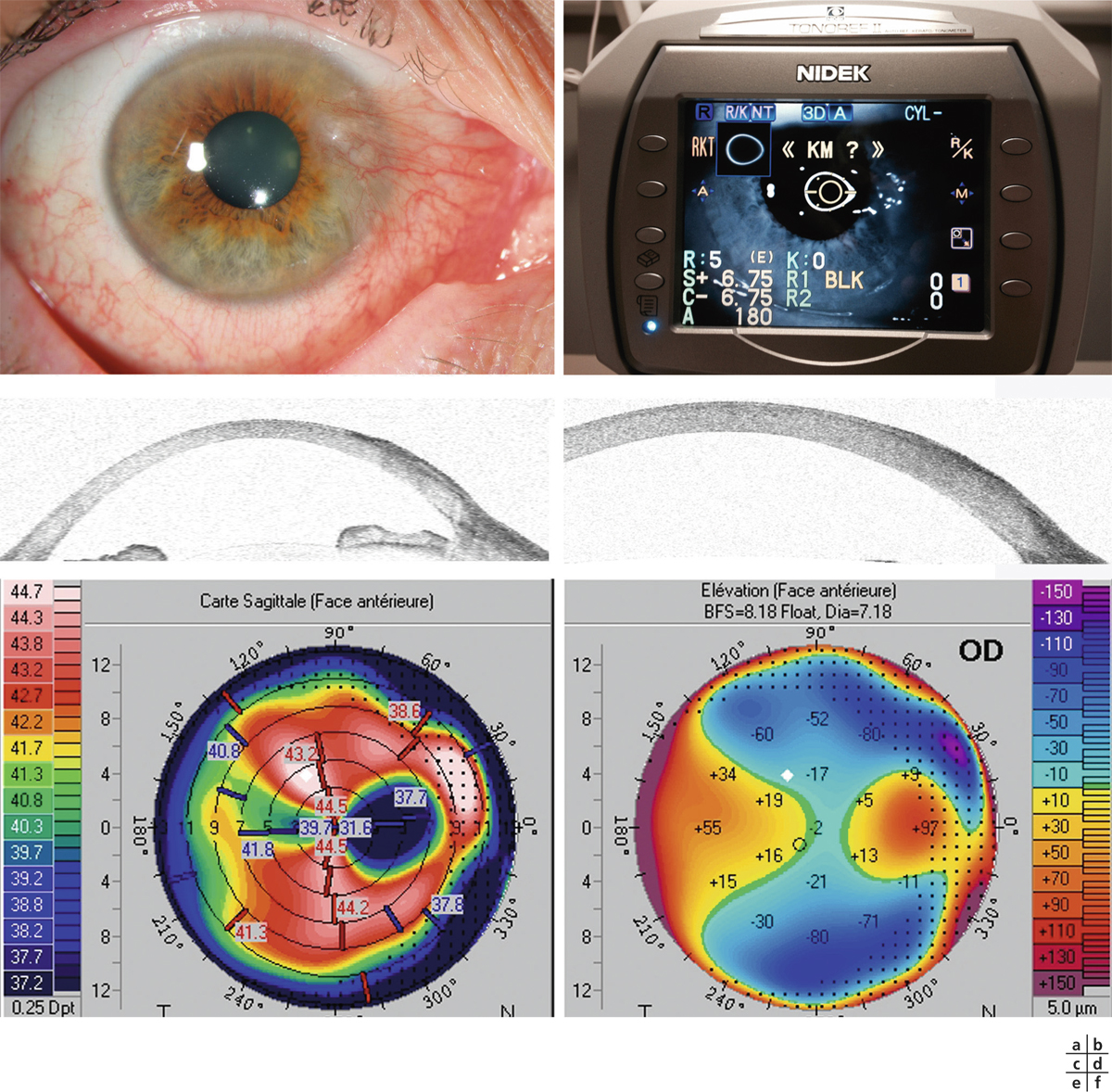
Fig. 12-47 Principe de l’astigmatisme lors d’un ptérygion.
a, b. Noter la réfraction de (180° −6,75, + 6,75) sur l’écran du réfractomètre automatique. Dans ce ptérygion nasal, la mire du kératomètre n’est déformée que sur le versant nasal, siège d’un lac de larmes stagnant entre l’apex cornéen et la tête du ptérygion surélevée. c, d. Analyse en OCT de segment antérieur aux faible et fort grossissements mettant en évidence l’épaississement épithélial en regard entre l’apex et la tête du ptérygion. e, f. Analyse topographique sagittale à gauche. Noter la kératométrie à 31,6 D sur l’hémiméridien nasal alors qu’elle est à 39,7 D sur l’hémiméridien temporal. À droite, topographie d’élévation. Noter l’élévation de 97 μm par rapport à la sphère de référence en nasal, alors qu’elle n’est que de 55 μm en temporal.
Classiquement, le ptérygion se présente sous la forme d’une lésion fibrovasculaire, localisée préférentiellement au niveau de la conjonctive bulbaire dans la partie nasale du limbe, dans l’aire de la fente palpébrale, et d’extension cornéenne. Il est le plus souvent bilatéral et asymétrique (voir fig. 12-44). La localisation temporale est relativement rare (fig. 12-48) [31].
Anatomiquement, le ptérygion peut être subdivisé en trois parties :
la tête adhérente à la cornée et évoluant progressivement vers l’apex cornéen (évolution centripète) ;
le corps recouvrant la sclère adhère à la conjonctive et s’étend en forme d’éventail du limbe vers le repli semi-lunaire ;
le col situé entre la tête et le corps et recouvrant le limbe cornéen.
En lampe à fente, on peut observer des îlots grisâtres sous-épithéliaux appelés îlots de Fuchs en avant de la tête du ptérygion et constituant les parties les plus avancées du ptérygion (fig. 12-49) [32]. La ligne de Stocker, correspondant à des dépôts de fer au sein de l’épithélium cornéen, peut être retrouvée au niveau de la partie apicale de la tête du ptérygion.
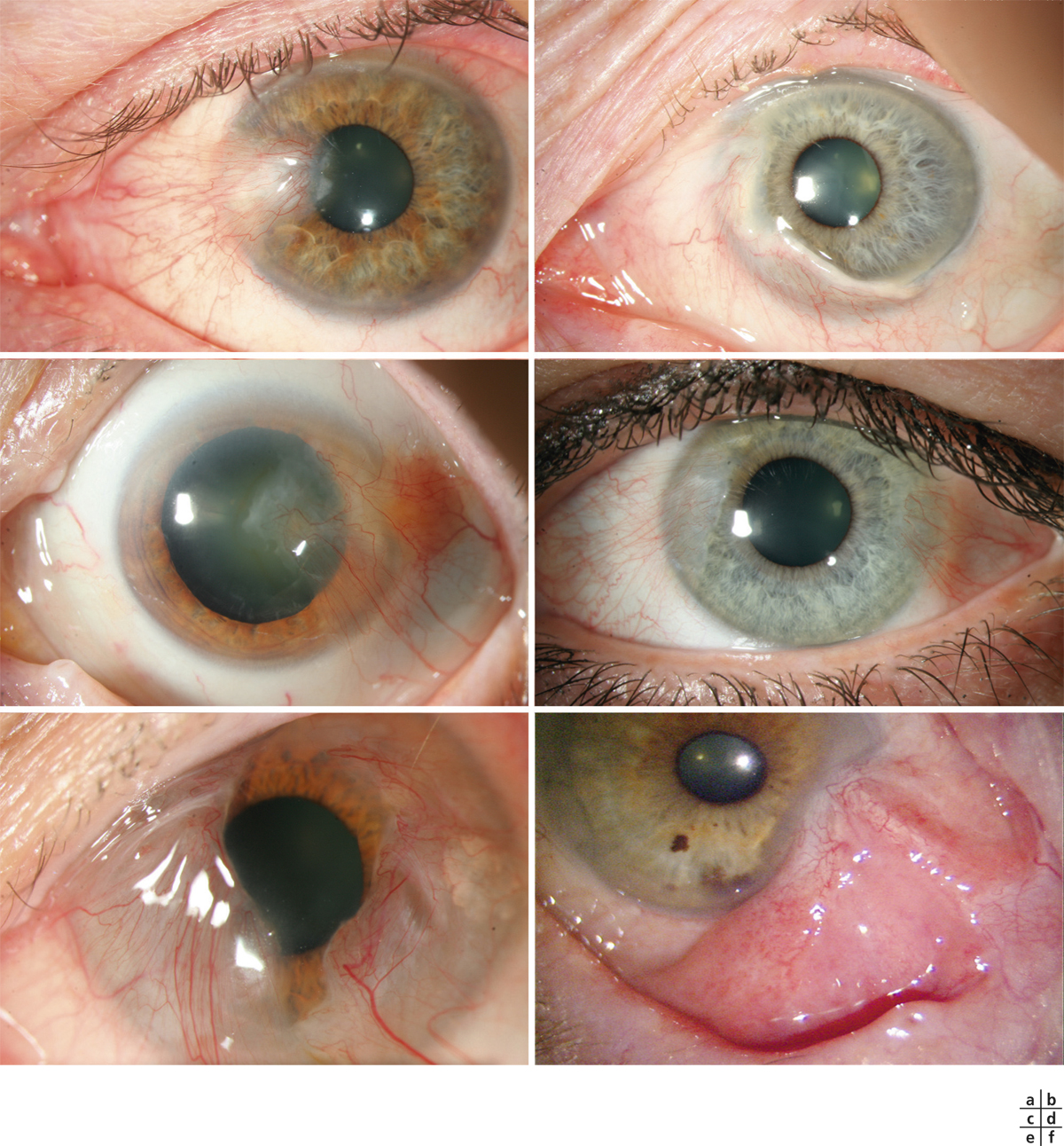
Fig. 12-48 Formes topographiques de ptérygions.
a. Localisation nasale classique. b. Localisation limbique étendue. c. Localisation temporale. d. Localisation nasale et temporale. e. Forme étendue à toute la cornée. f. Forme récidivante grave avec symblépharon et limitation de l’abduction.
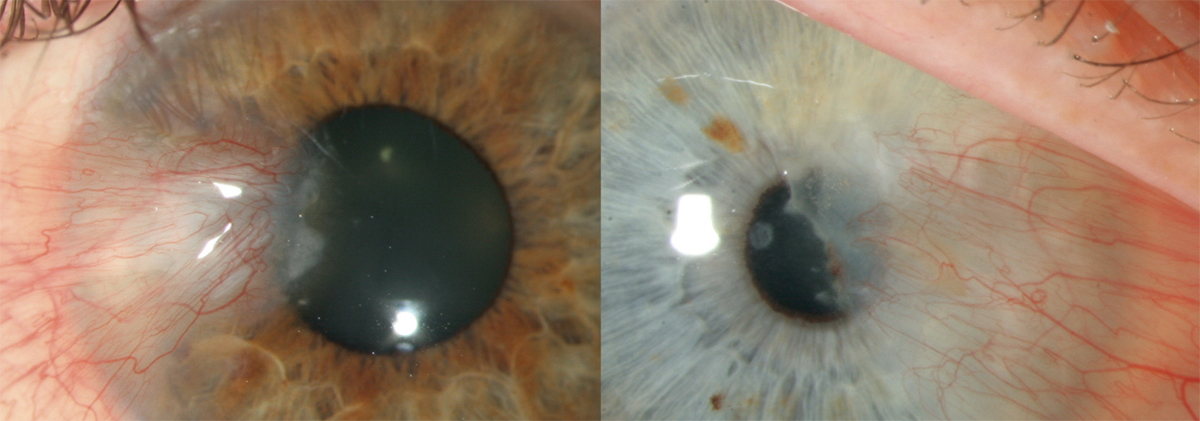
Fig. 12-49 Îlots de Fuchs (îlots grisâtres en avant de la tête du ptérygion).
Le diagnostic clinique du ptérygion est en général relativement simple. Parmi les diagnostics différentiels, on retiendra la pinguécula, les tumeurs du limbe, les ptérygoïdes et les kystes dermoïdes du limbe (fig. 12-50).
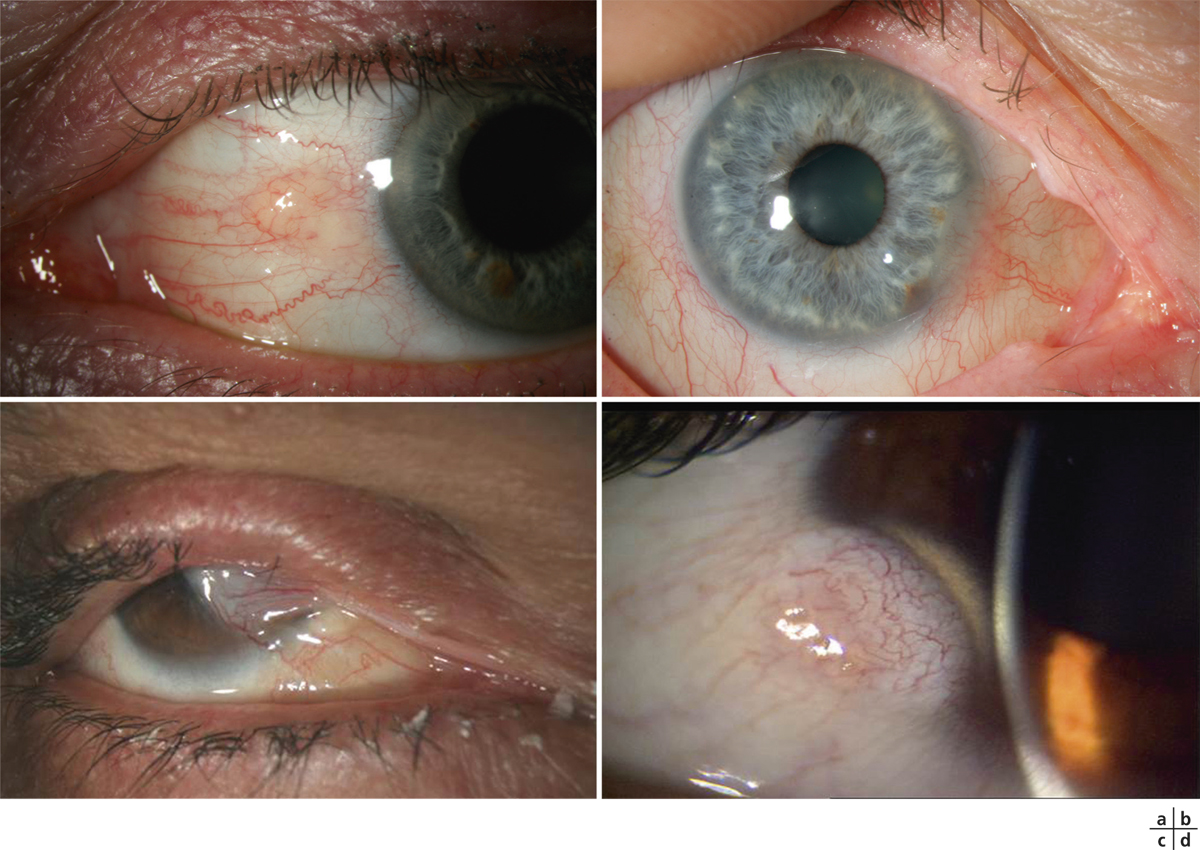
Fig. 12-50 Diagnostics différentiels du ptérygion.
a. Pinguécula. b. Carcinome épidermoïde du limbe. c. Ptérygoïde suite à une brûlure chimique. d. Dermoïde du limbe.
Il s’agit d’une lésion dégénérative conjonctivale jaunâtre adjacente au limbe nasal ou temporal n’envahissant pas la cornée. Cette dernière présente la même origine physiopathologique que le ptérygion et certaines d’entre elles peuvent évoluer vers un authentique ptérygion [33].
Les tumeurs bénignes et malignes peuvent parfois être confondues avec un ptérygion. Suivant les cas, il peut s’agir de papillomes, de lymphomes, de nævi ou de mélanomes, de carcinomes épidermoïdes du limbe [34].
Il s’agit de proliférations fibroconjonctivales d’aspect proche mais présentant toujours une cause évidente (kératoconjonctivite atopique, brûlure oculaire, etc.). Leur localisation peut se faire sur toute la périphérie du limbe.
Il s’agit de lésions conjonctivales kystiques localisées en région supérotemporale près du rebord orbitaire pouvant s’étendre vers la conjonctive et dans l’orbite. Ces kystes peuvent s’agrandir du fait de la sécrétion de produits glandulaires ou par croissance lente des composés situés à l’intérieur de la lésion. Le kyste épidermoïde est seulement revêtu d’un épithélium kératinisé à la différence du kyste dermoïde qui peut comporter de nombreuses annexes (sébacées, sudoripares, lacrymales, etc.) et peut être associé à des malformations congénitales du premier arc branchial. La localisation limbique est classique.
Le premier traitement est préventif et consiste à se protéger des rayonnements ultraviolets pour les populations exposées. Le simple fait de porter des lunettes, de soleil ou non, ne protège en rien l’œil car le rayonnement dangereux est latéropostérieur. Le plus important est donc de se protéger du soleil avec des branches de lunettes larges, un foulard ou un chapeau de façon à bloquer les rayonnements à l’origine de l’effet Coroneo.
L’exérèse chirurgicale du ptérygion constitue le seul traitement curatif. Réalisée sous anesthésie locale avec de la lidocaïne non adrénalinée par voie sous-conjonctivale, l’excision doit être complète sur une zone de 4 à 6 mm en arrière du limbe afin d’éviter les rétractions secondaires [35]. L’objectif est d’obtenir une surface parfaitement lisse et régulière après une hémostase soigneuse.
Les indications chirurgicales sont le plus souvent la gêne esthétique mais aussi la baisse d’acuité visuelle induite par l’astigmatisme ou l’envahissement de l’axe optique, la diplopie et l’inflammation locale récidivante.
Il n’existe actuellement aucun consensus quant à la technique de choix à utiliser même si l’excision associée à une autogreffe conjonctivale dans le même temps opératoire semble faire l’unanimité dans le cadre de la prise en charge du ptérygion en première intention.
Enfin, il faut garder à l’esprit que lorsque l’indication chirurgicale est posée, le risque de récidive existe et ce, quelle que soit la technique employée.
Quatre techniques peuvent être utilisées pour la prise en charge chirurgicale du ptérygion :
excision pure avec mise à nu de la sclère ;
excision avec fermeture–transposition conjonctivale ;
excision associée à des traitements d’appoint antimitotiques ;
excision associée à des techniques de greffe de la surface oculaire.
La technique de l’excision de la tête et du corps du ptérygion jusqu’à la région cantale nasale en laissant le lit scléral nu pour qu’il se réépithélialise a été décrite pour la première fois en 1948 par d’Ombrain [36].
Plusieurs interventions décrivant la fermeture de la plaie conjonctivale du lit du ptérygion ont été rapportées. La fermeture de la plaie peut être une simple approximation des marges conjonctivales décollées. Il est également possible d’effectuer une transposition conjonctivale au moyen d’un lambeau pédiculaire supérieur ou inférieur ayant fait l’objet d’une rotation pour fermer le lit du ptérygion (fig. 12-51).

Fig. 12-51 Greffe de rotation.
a, b. Aspect préopératoire puis postopératoire avec greffon de rotation à 3 mois postopératoires. c, d. Ptérygion bilatéral à gauche. Aspect à 1 mois avec greffe de rotation en temporal et greffe conjonctivale libre en nasal. e, f. Même patient à 2 mois au fort grossissement.
Un certain nombre de traitements d’appoint ont été décrits pour réduire le risque de récidive après excision chirurgicale du ptérygion. Chacun a ses avantages, mais ses inconvénients également.
La bêta-thérapie postopératoire inhibe la mitose des cellules qui se divisent rapidement et les tissus proliférant activement sont donc les plus sensibles. Les rayonnements ionisants dont le strontium-90 ont été utilisés à des doses allant de 1 000 à 7 000 Gy.
Les événements indésirables associés aux rayonnements bêta sont fonction de la dose et comprennent des complications graves : cataracte sectorielle, atrophie de l’iris, nécrose sclérale et/ou cornéenne, formation de plaques sclérales calcifiées, endophtalmie [37]. Étant donné les complications graves potentielles et l’existence d’autres stratégies thérapeutiques efficaces, l’utilisation conjointe de rayonnements bêta n’est actuellement plus pratiquée.
La mitomycine C (MMC) est un antibiotique cytotoxique à propriété antimitotique faisant partie des agents alkylants. Le produit est utilisé comme traitement d’appoint de la chirurgie du glaucome et du ptérygion, où elle induit l’inhibition localisée et prolongée des fibroblastes de la capsule de Tenon. Cela réduit le processus de cicatrisation exagérée associé à la trabéculectomie et la récidive du ptérygion. Les effets indésirables de la MMC topique peuvent être associés à des complications importantes et cécitantes, telles que l’iritis, l’ischémie et l’insuffisance limbique, la formation de plaques calcifiées, la décompensation cornéenne, la perforation sclérale et/ou cornéenne (fig. 12-52), le glaucome secondaire et la cataracte [38–40]. Afin de réduire la toxicité et les complications associées à l’utilisation de collyres de MMC, plusieurs études recommandent maintenant une seule application peropératoire de MMC (comme elle est utilisée dans la chirurgie filtrante du glaucome) [41, 42]. La MMC appliquée en peropératoire constitue un traitement efficace dans la prévention des récidives du ptérygion primaire ou récidivant [43, 44].
Le 5-fluorouracil (5-FU) est un antimétabolite bloquant l’activité de la thymidylate synthétase au niveau de la synthèse de l’ADN. Il est utilisé, tout comme la MMC, dans la chirurgie du glaucome. Il a montré son efficacité en traitement adjuvant local peropératoire ainsi que par voie sous-conjonctivale postopératoire en diminuant le taux de récidives du ptérygion [45].
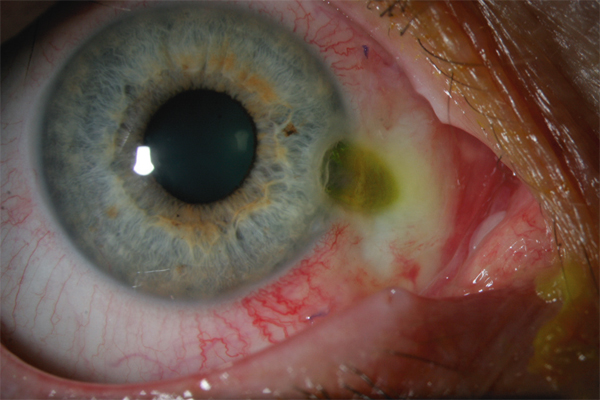
Fig. 12-52 Formation de dellen 10 jours après exérèse, application de mitomycine et autogreffe conjonctivale.
L’exérèse du ptérygion peut être associée suivant les cas à une autogreffe conjonctivale, une autogreffe limbo-conjonctivale ou à une greffe de membrane amniotique (GMA).
Actuellement, la technique chirurgicale préférentielle pour le traitement du ptérygion primaire reste l’excision de la lésion associée dans le même temps opératoire à une autogreffe conjonctivale. Cette technique décrite pour la première fois par Tagle en 1947 est devenue par la suite la technique la plus populaire pour la prise en charge du ptérygion.
Il s’agit d’une technique sûre, efficace et simple à réaliser si le chirurgien y est habitué un minimum.
L’intervention débute par l’exérèse du ptérygion dans sa partie cornéenne et conjonctivale. Celui-ci doit être excisé sans effraction si possible de la couche de Bowman au niveau de la partie cornéenne. Au niveau de la partie conjonctivale, il faut respecter la gaine du muscle droit interne afin d’éviter une fibrose secondaire.
L’exérèse associée de la capsule de tenon sous-jacente au ptérygion reste controversée, certains auteurs suggérant son ablation systématique car cette dernière augmenterait le risque de récidive [46, 47].
Après cautérisation sélective du site de résection, les dimensions de la zone dénudée sont repérées, afin de prélever un autogreffon conjonctival de taille identique. Celui-ci est prélevé habituellement au niveau de la conjonctive bulbaire supérotemporale du même œil, sauf si ce dernier nécessite la préservation de cette dernière en vue d’une chirurgie filtrante future. On s’aidera au mieux d’une injection sous-conjonctivale superficielle de sérum physiologique ou de solution anesthésique afin de décoller la conjonctive de la capsule de Tenon. Il est alors possible d’isoler délicatement, aux ciseaux de Vannas, le greffon conjonctival libre et sans perforation centrale.
Lors du prélèvement du greffon, le plus grand soin est apporté quant à laisser la capsule de Tenon sous-jacente intacte en vue de permettre la bonne réépithélialisation de la zone. Le greffon libre est ensuite placé au sommet de la cornée, face épithéliale contre la cornée, avant son transfert vers la sclère nasale.
La suture du greffon doit être soigneuse et fine ou peut être remplacée par de la colle biologique qui en plus de l’avantage de raccourcir la procédure opératoire aurait pour certains la propriété de diminuer le risque de récidive [48].
Les premières observations rapportées depuis 2004 ont décrit l’intérêt de l’utilisation de la colle de fibrine dans la chirurgie du ptérygion lors d’études non comparatives ou lors d’études comparatives randomisées (fig. 12-54) [49, 50].
Dans cette indication, la colle est utilisée pour permettre l’adhésion de l’autogreffon conjonctival après exérèse du ptérygion tout en évitant les sutures. Une goutte de la solution de fibrinogène est posée sur la sclère à nu, puis étalée avec une canule. La solution de thrombine est appliquée séparément sur la face ténonienne du lambeau conjonctival libre. Le greffon est ensuite transféré, puis retourné contre la zone de sclère dénudée en respectant la position limbique du greffon et en veillant bien à ne pas l’inverser. Le contact des deux solutions au moment du positionnement du greffon conjonctival entraîne la formation de fibrine et l’adhésion en quelques secondes.
Le greffon doit être rapidement étalé par pression de façon à chasser la fibrine en formation sur les côtés ; la fibrine extériorisée est réséquée au ciseau. Il est alors possible de retirer le blépharostat.
Dans la mesure où l’utilisation de colle de fibrine facilite le geste opératoire, elle pourrait également diminuer la courbe d’apprentissage et être corrélée à de meilleurs résultats postopératoires.
Au total, les colles de fibrine paraissent très intéressantes dans la chirurgie du ptérygion en améliorant significativement le confort postopératoire des patients et en facilitant le geste chirurgical [50].
Vidéo 12-1 Technique chirurgicale d’autogreffe conjonctivale collée par colle de fibrine.
Fig. 12-53 Technique chirurgicale d’autogreffe conjonctivale collée par colle de fibrine.
a, b. Exérèse du ptérygion. c. Prélèvement d’un autogreffon conjonctival en temporal supérieur. d, e. Positionnement du greffon sur la cornée face ténonienne vers le haut. f. Application de la solution 1 de colle de fibrine sur la sclère à nu (fibrinogène). g. Application de la solution 2 (thrombine) sur la face ténonienne de l’autogreffon. h, i. Renversement du greffon conjonctival de façon à mettre en contact les deux solutions et positionnement du greffon afin de recouvrir la zone à nu.
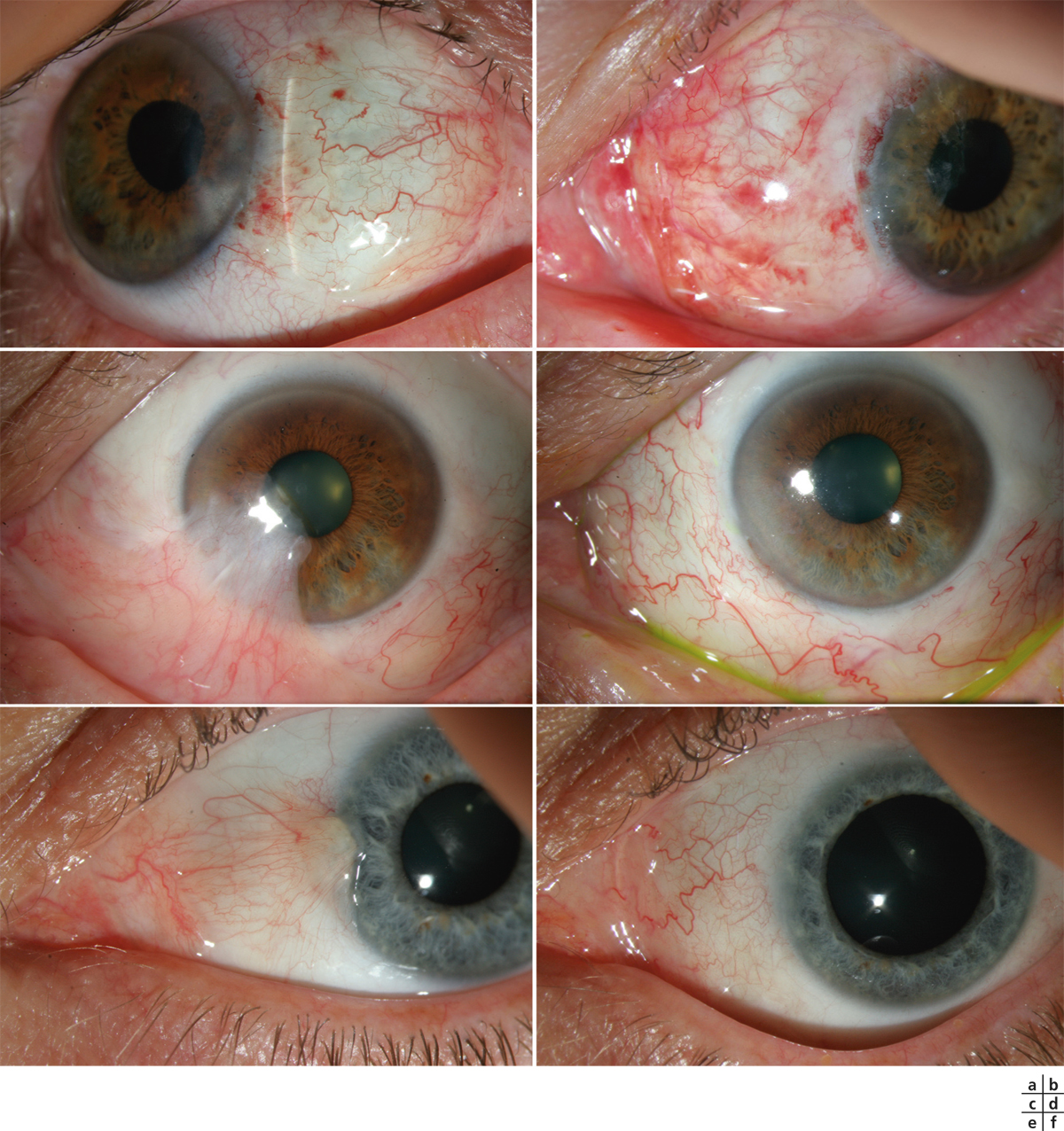
Fig. 12-54 Technique chirurgicale d’autogreffe conjonctivale collée par colle de fibrine.
a, b. Aspect de deux autogreffons conjonctivaux à 1 semaine postopératoire. c-f. Aspects préopératoires puis postéropératoires à 3 mois.
L’objectif de cette technique est de recréer une barrière en apportant un fragment de limbe avec des cellules limbiques viables. En effet, le développement du ptérygion serait consécutif à la dégradation très localisée des cellules souches limbiques en région nasale du limbe sous l’effet des rayons UV. Cette technique est le plus souvent proposée en cas de récidive.
L’intervention débute par le retrait du ptérygion de façon classique. Il est ensuite nécessaire de prélever un fragment de limbe de 5 mm de long par dissection lamellaire ainsi qu’un fragment de conjonctive avoisinante. En général, le limbe pathologique va être également retiré de la même manière en nasal afin de préparer le lit pour le positionnement du greffon limbique. Le greffon limbique est suturé à l’aide de fils de Nylon 10/0 à la cornée, tandis que la conjonctive est habituellement suturée à l’aide de fils résorbables de Vicryl 8/0 (fig. 12-55 et vidéo 12-3).
Lorsqu’il s’agit d’une multiple reprise, il peut être nécessaire d’avoir recours à une autogreffe de muqueuse buccale afin de remplacer la conjonctive pathologique et dans certains cas d’avoir recours à un allogreffon limbique provenant d’un donneur décédé (fig. 12-56 et 12-57).
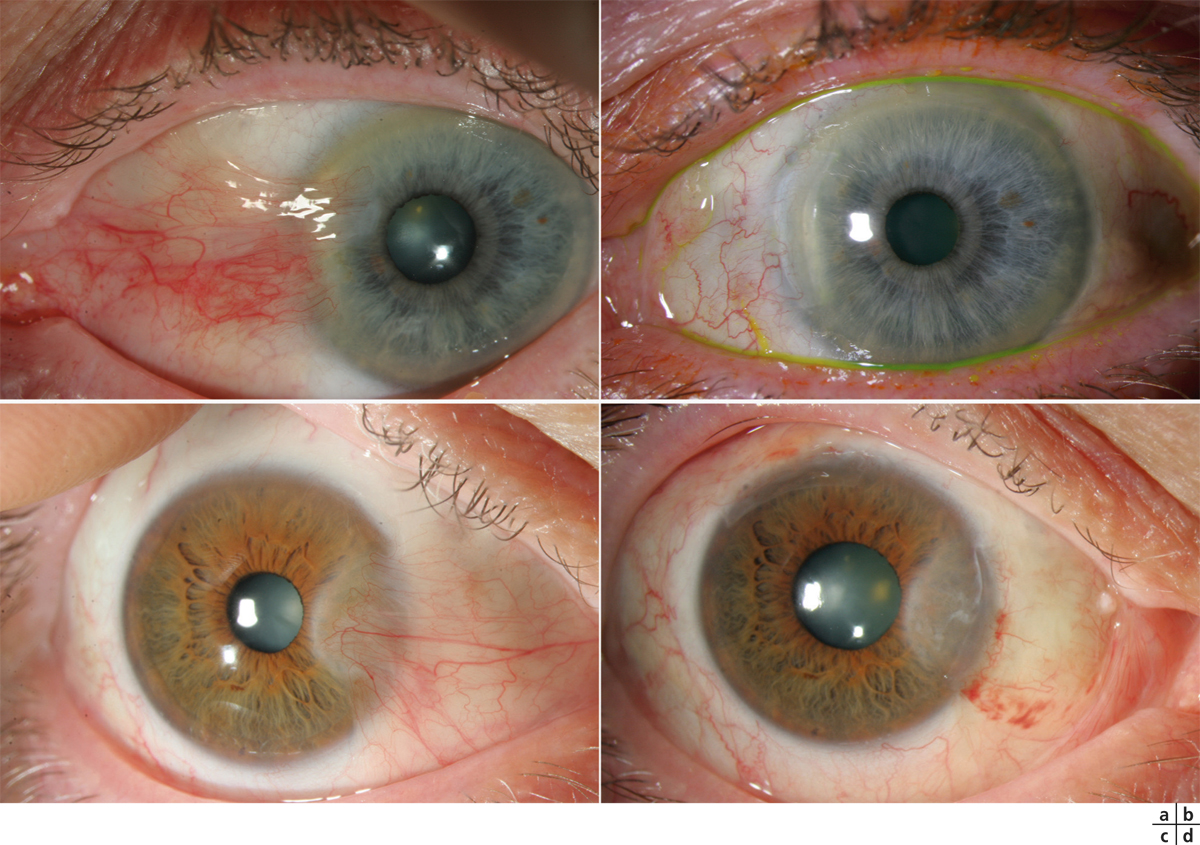
Fig. 12-55 a–d. Technique chirurgicale d’autogreffe limbique dans deux cas de ptérygion récidivants.
Aspect postopératoire à droite 2 mois après autogreffe limbique. Remarquer la zone de prélèvement de l’autogreffon en temporal supérieur chez le patient du bas.
Vidéo 12-3 Technique chirurgicale d’autogreffe limbique dans un cas de ptérygion récidivant.
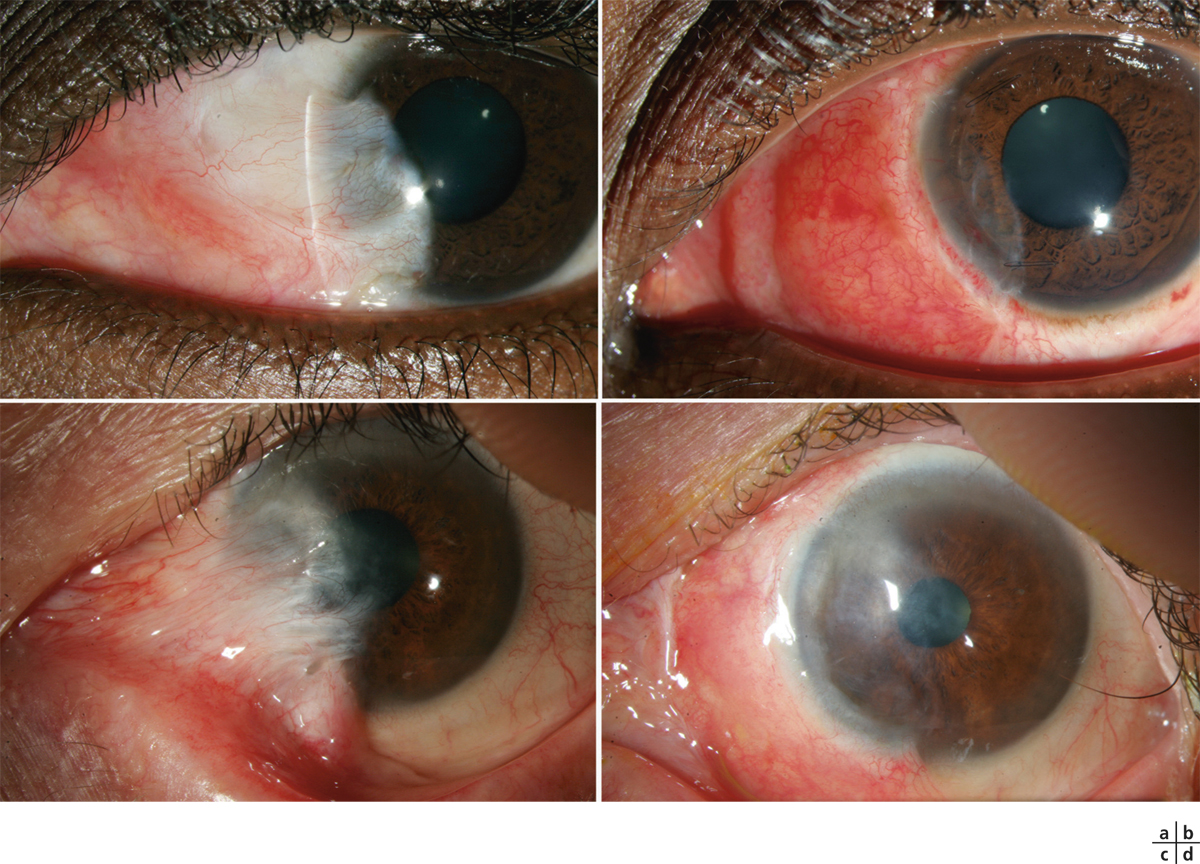
Fig. 12-56 a–d. Technique chirurgicale d’allogreffe limbique associée à une greffe de muqueuse buccale dans deux cas de récidive avec fibrose importante.
Aspect postopératoire à droite à 3 mois chez le premier patient et aspect postopératoire à 1 an chez le second patient.
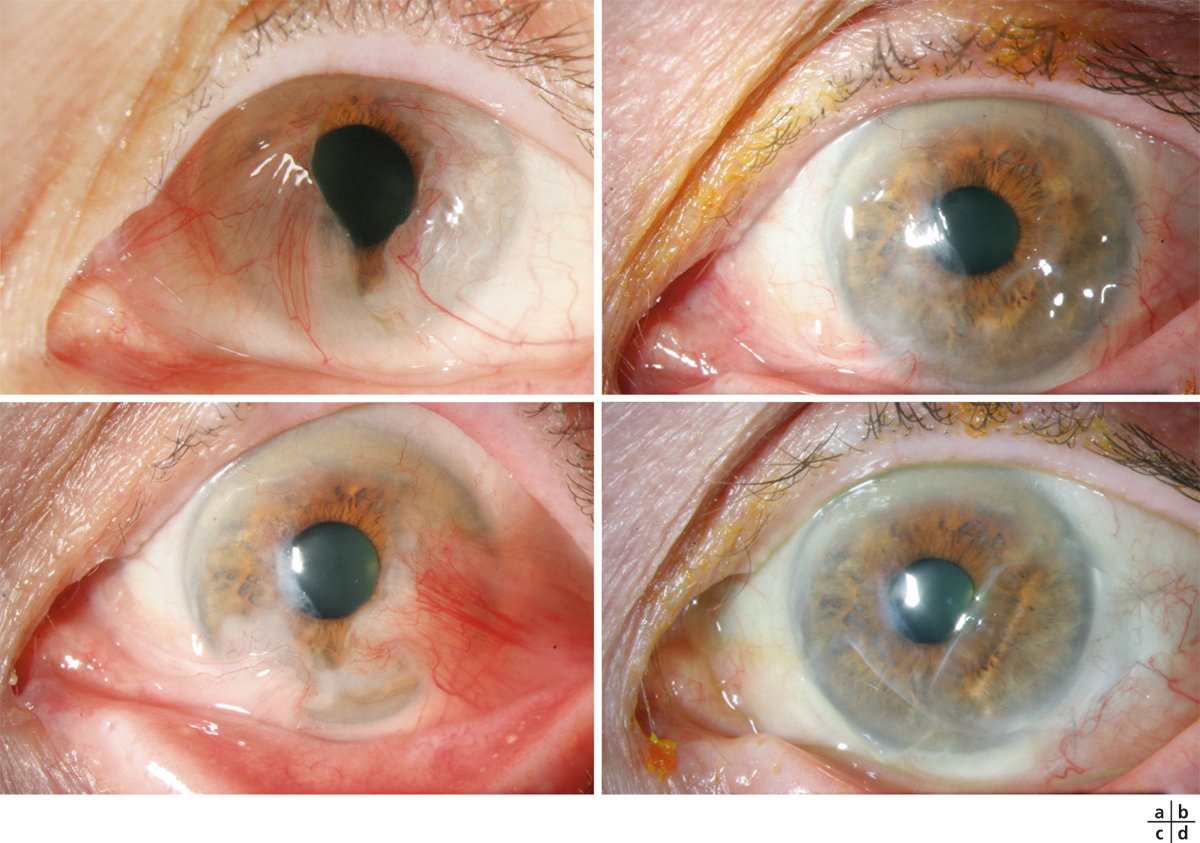
Fig. 12-57 Technique de greffe sclérocornéenne dans un cas de ptérygion évolué.
a. Aspect préopératoire. b. Aspect 2 mois après exérèse et autogreffe conjonctivale collée. c. Récidive avec fibrose 6 mois plus tard. d. Aspect 1 an après réalisation de deux greffes sclérocornéennes en nasal et en temporal.
La membrane amniotique humaine préservée peut être aussi utilisée comme substrat de la membrane basale dans la chirurgie du ptérygion avec une réduction du risque de récidive [51, 52]. La membrane amniotique permet de réduire la cicatrisation et la fibrose associées à la chirurgie de la surface oculaire. Elle offre certains avantages par rapport à l’autogreffe conventionnelle, car la conjonctive supérieure n’est pas utilisée et elle permet donc la préservation de cette dernière en cas de chirurgie filtrante ancienne ou à venir [35]. Enfin l’intervention est relativement simple à réaliser. Les principaux désavantages sont le coût et l’accessibilité de la greffe de membrane amniotique.
Cette greffe de membrane amniotique est le plus souvent proposée en cas d’exérèse étendue, bilatérale ou multiple ou en cas de chirurgie filtrante ancienne ou à venir [53].
La principale complication de la chirurgie du ptérygion est le risque de récidive important durant la première année postopératoire puisque 97 % des ptérygions qui récidivent le font durant cette période [54].
Les taux de récidive diffèrent selon la technique employée avec cependant de grandes disparités en fonction des études.
La technique d’excision simple avec mise à nu de la sclère est associée à un taux élevé de récidives (24 à 89 %). Elle n’est pour cette raison plus recommandée pour le traitement du ptérygion primitif ou récidivant [55, 56].
Lorsque l’excision est associée à une fermeture bord à bord de la conjonctive ou à une transposition conjonctivale, le taux de récidive ne semble pas être significativement plus faible que pour l’excision simple. En effet, deux études récentes utilisant la fermeture simple ou un lambeau supérieur ayant fait l’objet d’une rotation montrent un taux élevé de récidive de respectivement 37 % et 29 % [57].
La technique associant excision et autogreffe conjonctivale semble présenter en revanche le moins de récidives avec des taux de 2 à 39 % pour les ptérygions primaires [58, 59]. Le risque de récidive du ptérygion après utilisation de la colle biologique a été également évalué au cours de nombreuses études avec des résultats contradictoires [48, 49, 60].
La technique d’autogreffe limbo-conjonctivale expose quant à elle à des risques de récidives similaires à ceux de l’autogreffe conjonctivale simple en cas de ptérygion primaire. En revanche, cette technique donne de bien meilleurs résultats que toutes les autres techniques en cas de ptérygions récidivants [61]. L’allogreffe limbo-conjonctivale exposerait en outre le patient au risque de rejet.
Bien que l’utilisation de la greffe de membrane amniotique dans la prise en charge du ptérygion rapporte d’excellents résultats sur le plan esthétique, l’utilisation de cette dernière semble moins efficace dans la prévention des récidives en comparaison à l’autogreffe conjonctivale. En effet, le taux de récidive est de près de 15 % après greffe de membrane amniotique contre 5 % environ après autogreffe conjonctivale [62].
Le ptérygion est une pathologie conjonctivale bénigne relativement fréquente et pouvant être invalidante. L’exposition au rayonnement ultraviolet représente le principal facteur de risque. La localisation limbique est expliquée par l’effet Coroneo, correspondant à la focalisation sur le limbe nasal des rayons réfléchis provenant de la région temporale. Parmi les nombreuses méthodes pour traiter cette affection, l’excision suivie d’une autogreffe conjonctivale est actuellement le traitement de référence et permet d’obtenir un faible taux de récidive dans la plupart des cas.
[1] Duke-Elder S. Diseases of the outer eye. Part 1. In : Duke-Elder S. Ed. System of ophthalmology. Vol. 8 : diseases of the outer eye. London : Kimpton UK ; 1965, p. 569-85.
[2] Murube J. Pterygium : descriptive nomenclature of the past. Ocul Surf 2008 ; 6 : 104-7.
[3] Di Girolamo N, Chui J, Coroneo MT, et al. Pathogenesis of pterygia : role of cytokines, growth factors, and matrix metalloproteinases. Prog Retin Eye Res 2004 ; 23 : 195-228.
[4] Ramke J, Brian G, du Toit R. Eye disease and care at hospital clinics in Cook Islands, Fiji, Samoa and Tonga. Clin Exp Ophthalmol 2007 ; 35 : 627-34.
[5] Wlodarczyk J, Whyte P, Cockrum P, et al. Pterygium in Australia : a cost of illness study. Clin Exp Ophthalmol 2001 ; 29 : 370-5.
[6] Durkin SR, Abhary S, Newland HS, et al. The prevalence, severity and risk factors for pterygium in central Myanmar : the Meiktila Eye study. Br J Ophthalmol 2008 ; 92 : 25-9.
[7] Karai I, Horiguchi S. Pterygium in welders. Br J Ophthalmol 1984 ; 68 : 347-9.
[8] Moran DJ, Hollows FC. Pterygium and ultraviolet radiation : a positive correlation. Br J Ophthalmol 1984 ; 68 : 343-6.
[9] Norn MS. Spheroid degeneration of cornea and conjunctiva. Prevalence among Eskimos in Greenland and caucasians in Copenhagen. Acta Ophthalmol (Copenh) 1978 ; 56 : 551-62.
[10] Lu P, Chen X, Kang Y, et al. Pterygium in Tibetans : a population based study in China. Clin Exp Ophthalmol 2007 ; 35 : 828-33.
[11] Lu J, Wang Z, Lu P, et al. Pterygium in an aged Mongolian population : a population-based study in China. Eye 2009 ; 23 : 421-7.
[12] Taylor HR, West SK, Rosenthal FS, et al. Corneal changes associated with chronic UV irradiation. Arch Ophthalmol 1989 ; 107 : 1481– 4.
[13] MacKenzie FD, Hirst LW, Battistutta D, Green A. Risk analysis in the development of pterygia. Ophthalmology. 1992 ; 99 : 1056–1061.
[14] Chui J, Coroneo MT, Tat LT, et al. Ophthalmic pterygium a stem cell disorder with premalignant features. Am J Pathol 2011 ; 178 : 817-27.
[15] Coroneo MT, Müller-Stolzenburg NW, Ho A. Peripheral light focusing by the anterior eye and the ophthalmohelioses. Ophthalmic Surg 1991 ; 22 : 705-11.
[16] Kwok LS, Kuznetsov VA, Ho A, Coroneo MT. Prevention of the adverse photic effects of peripheral light-focusing using. UV-blocking contact lenses. Invest Ophthalmol Vis Sci 2003 ; 44 : 1501-7.
[17] Dushku N, Reid TW. Immunohistochemical evidence that human pterygia originate from an invasion of vimentin-expressing altered limbal epithelial basal cells. Curr Eye Res 1994 ; 13 : 473-81.
[18] Coroneo MT. Pterygium as an early indicator of ultraviolet insolation : a hypothesis. Br J Ophthalmol 1993 ; 77 : 734-9.
[19] Lee DH, Cho HJ, Kim JT, et al. Expression of vascular endothelial growth factor and inducible nitric oxide synthase in pterygia. Cornea 2001 ; 20 : 738-42.
[20] Wong TT, Sethi C, Daniels JT, et al. Matrix metalloproteinases in disease and repair processes in the anterior segment. Surv Ophthalmol 2002 ; 47 : 239-56.
[21] Chui J, Di Girolamo N, Wakefield D, et al. The pathogenesis of pterygium : current concepts and their therapeutic implications. Ocul Surf 2008 ; 6 : 24-43.
[22] Dushku N, John MK, Schultz GS, Reid TW. Pterygia pathogenesis : corneal invasion by matrix metalloproteinase expressing altered limbal epithelial basal cells. Arch Ophthalmol 2001 ; 119 : 695-706.
[23] Zhang JD. An investigation of a etiology and heredity of pterygium. Report of 11 cases in a family. Acta Ophthalmol (Copenh) 1987 ; 65 : 413-6.
[24] Tsai YY, Bau DT, Chiang CC, et al. Pterygium and genetic polymorphism of DNA double strand break repair gene Ku70. Mol Vis 2007 ; 13 : 1436-40.
[25] Detorakis ET, Sourvinos G, Spandidos DA. Detection of herpes simplex virus and human papilloma virus in ophthalmic pterygium. Cornea 2001 ; 20 : 164-7.
[26] Dushku N, Reid TW. P53 expression in altered limbal basal cells of pingueculae, pterygia, and limbal tumors. Curr Eye Res 1997 ; 16 : 1179-92.
[27] Tsai YY, Chang KC, Lin CL, et al. p53 expression in pterygium by immunohistochemical analysis : a series report of 127 cases and review of the literature. Cornea 2005 ; 24 : 583-6.
[28] Chui J, Di Girolamo N, Coroneo MT, et al. The role of substance P in the pathogenesis of pterygia. Invest Ophthalmol Vis Sci 2007 ; 48 : 4482-9.
[29] Benrath J, Eschenfelder C, Zimmerman M, et al. Calcitonin generelated peptide, substance P and nitric oxide are involved in cutaneous inflammation following ultraviolet irradiation. Eur J Pharmacol 1995 ; 293 : 87-96.
[30] Yasar T, Ozdemir M, Cinal A, et al. Effects of fibrovascular traction and pooling of tears on corneal topographic changes induced by pterygium. Eye 2003 ; 17 : 492-6.
[31] Dolezalova V. Is the occurrence of a temporal pterygium really so rare ? Ophthalmologica 1977 ; 174 : 88-91.
[32] Denion E, Dalens PH, Petitbon J, et al. Primary pterygium : some biomicroscopic aspects. J Fr Ophthalmol 2007 ; 30 : 772-4.
[33] Fuchs E. Ueber das Pterygium. Graefes Arch for Ophthalmol 1892 ; 38 : 1-89.
[34] Hirst LW, Axelsen RA, Schwab I. Pterygium and associated ocular surface squamous neoplasia. Arch Ophthalmol 2009 ; 127 : 31-2.
[35] Ang LP, Chua JL, Tan DT. Current concepts and techniques in pterygium treatment. Curr Opin Ophthalmol 2007 ; 18 : 308-13.
[36] King JH. The pterygium - Brief review and evaluation of certain methods of treatment. Arch Ophthalmol 1950 ; 44 : 854-69.
[37] Moriarty AP, Crawford GJ, McAllister IL, Constable IJ. Severe corneoscleral infection : a complication of beta irradiation scleral necrosis following pterygium excision. Arch Ophthalmol 1993 ; 111 : 947-51.
[38] Rubinfeld RS, Pfister RR, Stein RM, et al. Serious complications of topical mitomycin-c after pterygium surgery. Ophthalmology 1992 ; 99 : 1647-54.
[39] Dunn JP, Seamone CD, Ostler HB, et al. Development of scleral ulceration and calcification after pterygium excision and mitomycin therapy. Am J Ophthalmol 1991 ; 112 : 343-4.
[40] Frucht-Pery J, Siganos CS, Ilsar M. Intraoperative application of topical mitomycin C for pterygium surgery. Ophthalmology 1996 ; 103 : 674-7.
[41] Cardillo JA, Alves MR, Ambrosio LE, et al. Single intraoperative application versus postoperative mitomycin C eye drops in pterygium surgery. Ophthalmology 1995 ; 102 : 1949-52.
[42] Yanyali AC, Talu H, Alp BN, et al. Intra-operative mitomycin C in the treatment of pterygium. Cornea 2000 ; 19 : 471-3.
[43] De la Hoz F, Montero JA, Alio JL, et al. Efficacy of mitomycin C associated with direct conjunctival closure and sliding conjunctival graft for pterygium surgery. Br J Ophthalmol 2008 ; 92 : 175-8.
[44] Gupta VP, Saxena T. Comparison of single-drop mitomycin C regime with other mitomycin C regimes in pterygium surgery. Indian J Ophthalmol 2003 ; 51 : 59-65.
[45] Bekibele CO, Baiyeroju AM, Olusanya BA, et al. Pterygium treatment using 5-FU as adjuvant treatment compared to conjunctiva autograft. Eye 2008 ; 22 : 31-4.
[46] Hirst LW. Prospective study of primary pterygium surgery using pterygium extended removal followed by extended conjunctival transplantation. Ophthalmology 2008 ; 115 : 1663-72.
[47] Hirst LW. Recurrent pterygium surgery using pterygium extended removal followed by extended conjunctival transplant : recurrence rate and cosmesis. Ophthalmology 2009 ; 116 : 1278-86.
[48] Koranyi G, Seregard S, Kopp ED. Cut and paste : a no suture, small incision approach to pterygium surgery. Br J Ophthalmol 2004 ; 88 : 911-4.
[49] Bahar I, Weinberger D, Dan G, Avisar R. Pterygium surgery : fibrin glue versus vicryl sutures for conjunctival closure. Cornea 2006 ; 25 : 1168-72.
[50] Marticorena J, Rodriguez-Ares MT, Tourino R, et al. Pterygium surgery : conjunctival autograft using a fibrin adhesive. Cornea 2006 ; 25 : 34-6.
[51] Shimazaki J, Shinozaki N, Tsubota K. Transplantation of amniotic membrane and limbal autograft for patients with recurrent pterygium associated with symblepharon. Br J Ophthalmol 1998 ; 82 : 235-40.
[52] Lee S, Tseng S. Amniotic membrane transplantation for persistent epithelial defects with ulceration. Am J Ophthalmol 1997 ; 123 : 303-12.
[53] Luanratanakorn P. Randomized controlled study of conjunctival autograft versus amniotic membrane graft in pterygium excision. Br J Ophthalmol 2006 ; 90 : 1476-80.
[54] Hirst LW. The treatment of pterygium. Surv ophthalmol 2003 ; 48 : 145-80.
[55] Chen PP, Ariyasu RG, Kaza V, et al. A randomized trial comparing mitomycin C and conjunctival autograft after excision of primary pterygium. Am J Ophthalmol 1995 ; 120 : 151-60.
[56] Lewallen S. A randomized trial of conjunctival autografting for pterygium in the tropics. Ophthalmology 1989 ; 96 : 1612-4.
[57] Cardillo JA, Alves MR, Ambrosio LE, et al. Single intraoperative application versus postoperative mitomycin C eye drops in pterygium surgery. Ophthalmology 1995 ; 102 : 1949-52.
[58] Frucht-Pery J, Raiskup F, Ilsar M, et al. Conjunctival autografting combined with low-dose mitomycin C for prevention of primary pterygium recurrence. Am J Ophthalmol 2006 ; 141 : 1044-50.
[59] Lewallen S. A randomized trial of conjunctival autografting for pterygium in the tropics. Ophthalmology 1989 ; 96 : 1612-4.
[60] Uy HS, Reyes JM, Flores JD, Lim-Bon-Siong R. Comparison of fibrin glue and sutures for attaching conjunctival autografts after pterygium excision. Ophthalmology 2005 ; 112 : 667-71.
[61] Al Fayez MF. Limbal versus conjunctival autograft transplantation for advanced and recurrent pterygium. Ophthalmology 2002 ; 109 : 1752-5.
[62] Prabhasawat P, Barton K, Burkett G, Tseng SCG. Comparison of conjunctival autografts, amniotic membrane grafts, and primary closure for pterygium excision. Ophthalmology 1997 ; 104 : 974-85.
J.-J. Gicquel, H. Dua
Les brûlures de la surface oculaire ont une prévalence élevée parmi les urgences en ophtalmologie. Le plus souvent d’origine chimique, elles vont entraîner des atteintes conjonctivales, cornéennes et limbiques variables en fonction de la nature de l’agent en cause, de sa concentration au niveau de l’œil et de la rapidité et de la qualité de la prise en charge. Les séquelles les plus sévères incluent notamment le syndrome d’insuffisance limbique. La prise en charge urgente passe toujours par un lavage abondant le plus rapide possible. Le pronostic de ces atteintes, dans les formes sévères, a été amélioré notamment par l’utilisation précoce de la membrane amniotique.
Les brûlures de la surface oculaire sont une pathologie fréquente [1].
Lorsqu’elles sont d’origine chimique, elles sont souvent bilatérales et initient nombre de lésions de l’épithélium cornéen et conjonctival. Les formes sévères conduisent à une conjonctivalisation, une néovascularisation de la cornée ainsi qu’à des érosions cornéennes récidivantes [2]. Ces stigmates d’insuffisance limbique peuvent s’accompagner de destructions plus ou moins étendues du stroma cornéen, provoquant la formation de taies. Les lésions conjonctivales présentes notamment au niveau des culs-de-sac peuvent, elles aussi, engendrer des séquelles majeures particulièrement à type de symblépharon. Le pronostic des formes graves a été amélioré au cours de la dernière décennie grâce au développement des techniques de greffe de membrane amniotique (GMA) [3, 4], ainsi qu’à l’utilisation des autogreffes [5] ou allogreffes [6] de cellules souches limbiques.
Les brûlures chimiques représentent 7,7 à 18 % des traumatismes oculaires [7–9]. Dans les pays industrialisés, elles touchent principalement des hommes jeunes (66,7–86 %) [12]. Les enfants sont relativement peu atteints (7 %) [13]. Les accidents du travail représentent 73 % des cas en Allemagne, 71 % en Australie et 50 % au Royaume-Uni [10]. Les accidents domestiques (37 %) ainsi que les agressions sont moins fréquents (10 %). Un département français d’outre-mer présente cependant des statistiques hors normes : la Martinique. Les accidents du travail ne représentent que 30 % des cas, alors que 45,5 % des brûlures sont causées par des agressions. Les femmes trompées ont pour coutume de projeter de l’alcali (solution d’ammoniaque à 15,3 %/pH 12,8) au visage des hommes infidèles, afin de « chasser les mauvais esprits » [14]. Merle et al. expliquent cette particularité martiniquaise par un faible niveau d’industrialisation de l’île. Klein et al. [15] puis Beare et al. [11] ont mis en évidence aussi de forts taux d’agression par des bases fortes au sein de populations défavorisées de zones urbaines. En France, du fait de l’absence de dispositif comptabilisant de manière systématique les brûlures oculaires, l’incidence réelle à l’échelle du territoire national est difficilement évaluable. Au Royaume-Uni, bien qu’un tel dispositif existe déjà, l’incidence enregistrée est très probablement aussi inférieure à la réalité [10].
Pour expliquer le renouvellement de l’épithélium, l’hypothèse la plus classiquement admise est celle dite XYZ (X + Y = Z) échafaudée par Thoft (fig. 12-58) [16] :
X représente la migration antérieure de cellules à partir de l’épithélium basal ;
Y correspond à la migration centripète de cellules à partir du limbe ;
Z représente la perte de cellules de la surface.
Elle fait du limbe la source cellulaire indispensable au renouvellement cellulaire cornéen.
Les cellules souches limbiques ont un cycle cellulaire long. Elles donnent naissance aux cellules amplificatrices transitoires, possédant un pouvoir de prolifération augmenté et répondant après une blessure par une migration centripète de la profondeur du limbe vers la superficie de la cornée. Après plusieurs divisions, les cellules perdent leur pouvoir mitotique et donnent naissance aux cellules épithéliales cornéennes différenciées [17].
La biologie moléculaire ainsi que l’immuno-histochimie ont permis de caractériser ces cellules souches et de les localiser avec précision au sein du limbe. Chez l’adulte, celles-ci se trouvent au niveau de cryptes épithéliales (fig. 12-59) [18, 19].
Le caractère « souche » de ces cellules présentes au niveau des cryptes a été défini par la mise en évidence chez celles-ci de marqueurs spécifiques : ces cellules expriment la protéine de transport ABCG2 et l’isoforme ΔNp63α du gène P63. À l’inverse, elles n’expriment pas la desmogléine (molécule d’adhésion). La connexine 43, protéine des « jonctions communicantes », est absente des cellules basales du limbe en général, mais elle est exprimée par certaines cellules des cryptes épithéliales ou adjacentes aux cryptes [20].
La matrice extracellulaire du limbe est différente de celle de la cornée centrale. On y retrouve une expression spécifique de l’intégrine β1 et de la ténacine C [19].
Chez l’enfant, c’est le limbe tout entier qui présente des caractéristiques semblables à celles des cryptes épithéliales. Les cryptes n’apparaîtraient donc que plus tard au cours du développement de l’individu [21].
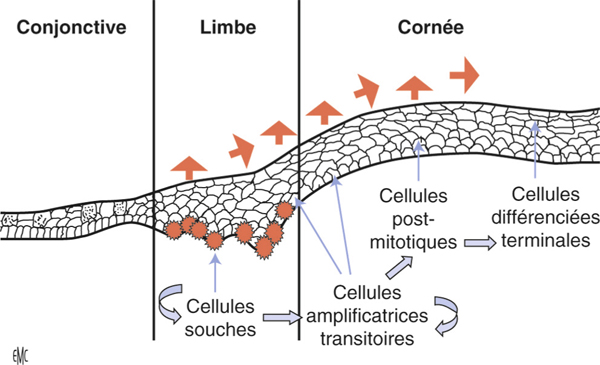
Fig. 12-58 Schéma illustrant l’hypothèse XYZ de Thoft.
Les cellules souches basales du limbe se divisent pour donner naissance aux cellules amplificatrices transitoires, qui entament un mouvement centripète (XY) et de la profondeur vers la surface (Z), pour finalement donner naissance aux cellules post-mitotiques ayant perdu la capacité à proliférer.
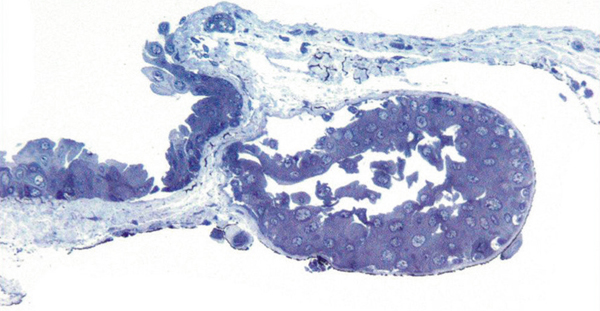
Fig. 12-59 Coupe histologique d’une crypte épithéliale.
La niche dans laquelle se situent les cellules souches épithéliales trouve son origine sous une palissade de Vogt, son extrémité s’étend au sein de la substancia propria.
En cas de désépithélialisation centrale de la cornée sans atteinte limbique, la cicatrisation s’effectue par migration cellulaire centripète (fig. 12-60) [22].
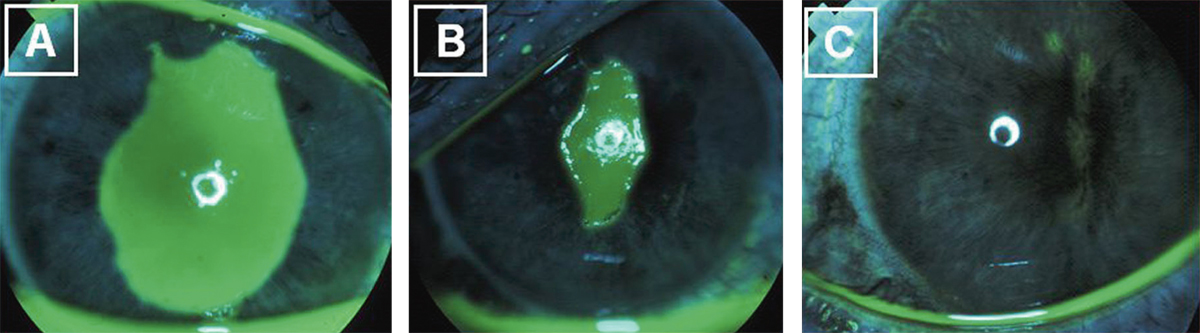
Fig. 12-60 Cicatrisation cornéenne par migration cellulaire centripète en l’absence d’atteinte du limbe.
a. Ulcération isolée de l’épithélium cornéen central. b, c. L’épithélium cicatrise par migration centripète des cellules.
(Source : Dua HS, Forrester HS. Clinical patterns of corneal epithelial wound healing. Am J Ophthalmol 1987 ; 104 : 481-9.)
S’il y a une atteinte localisée du limbe, celui-ci cicatrise par migration circonférentielle de cellules adjacentes, puis la cornée centrale cicatrise dans un second temps (fig. 12-61).
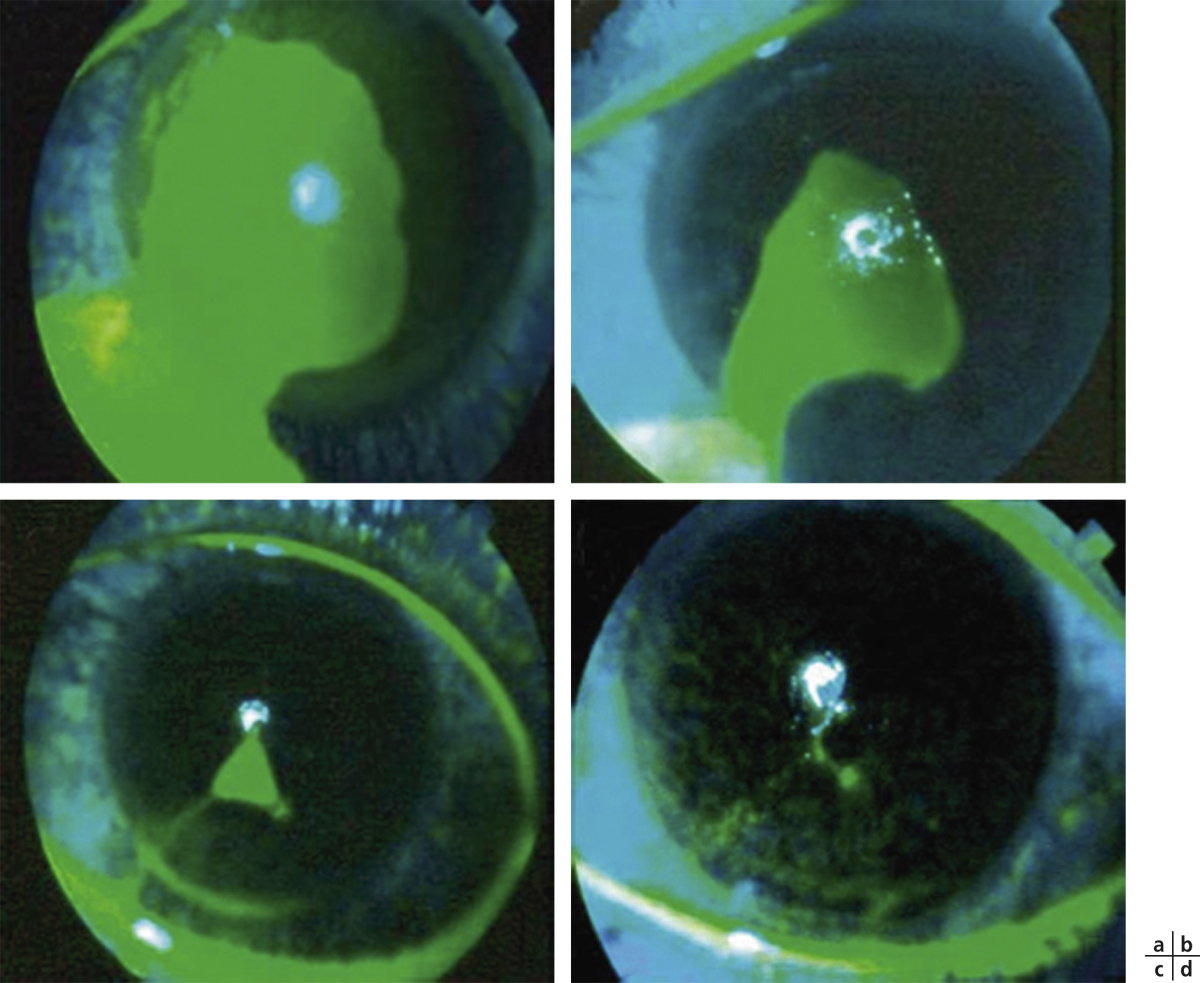
Fig. 12-61 Cicatrisation cornéenne par migration cellulaire circonférentielle lors d’une atteinte limbique localisée en inférieur.
a. Brûlure de grade III selon la classification de Dua (4 heures et demie de limbe lésé + 30 % de la conjonctive), b, c. L’épithélium limbique survivant migre de manière circonférentielle. d. L’épithélium limbique survivant migre de manière circonférentielle.
(Source : Dua HS, Forrester HS. The corneoscleral limbus in human corneal epithelial wound healing. Am J Ophthalmol 1990 ; 110 : 646-56.)
Si le limbe ne joue plus son rôle de barrière et que de l’épithélium conjonctival envahit la cornée, il en résulte une insuffisance limbique partielle [17]. Les deux épithéliums, cornéen et conjonctival, peuvent ainsi coexister presque indéfiniment [23, 24].
L’hypothèse de Thoft et al. [16] a pendant longtemps été considérée comme un dogme et ce d’autant plus que la clinique l’a confirmée. Cependant, des publications récentes démontrent que les mécanismes de réparation de l’épithélium cornéen après une agression ne sont probablement pas les mêmes que ceux liés au renouvellement physiologique de l’épithélium cornéen. Certains patients présentant une insuffisance limbique sur 360° peuvent malgré tout conserver une cornée centrale claire, avec un épithélium de bonne qualité pendant plusieurs années [25]. Ces îlots centraux d’épithélium cornéen semblent être capables de se renouveler sans avoir recours aux cellules du limbe. Cette hypothèse, déjà démontrée chez l’animal [26, 27], a été confirmée chez l’homme ex vivo par une étude pratiquée sur des cornées en culture. Après destruction totale du limbe, par ablation au laser excimer à une profondeur de 80 μm, on assiste à une cicatrisation à partir de cellules de l’épithélium central [28].
La réparation du stroma cornéen après une brûlure chimique s’effectue en deux phases : détersion, puis réparation. Après une phase de sidération pouvant durer de quelques minutes à quelques heures, la phase de détersion commence. Les cellules détruites libèrent des radicaux libres, de l’histamine, des prostaglandines et des leucotriènes. Ces derniers engendreront un afflux de cellules inflammatoires (polynucléaires et cellules mononucléées) [29].
Les brûlures caustiques libèrent par hydrolyse des protéines, la N-acétyl-proline-glycine-proline (Ac-PGP) et la méthyl-proline-glycine-proline (Me-PGP). Ces deux molécules sont le déclencheur de la réaction inflammatoire initiale, entraînant l’afflux et la prolifération des polynucléaires neutrophiles [30].
Parmi les protéines sécrétées par les polynucléaires neutrophiles lors de la phase de détersion, les métalloprotéinases matricielles (MMP) jouent un rôle particulièrement important, en dégradant le collagène lors de la phase de détersion [2, 31]. Elles sont sécrétées sous forme latente puis activées par protéolyse [2, 29, 31]. Elles comportent un ion métallique dans leur structure chimique (ion métallique zinc le plus souvent). Il y a cinq classes différentes :
les collagénases (MMP-1, 4 et 8) ;
les gélatinases (MMP-2 et 9) ;
les stromélysines (MMP-3, 10 et 11) ;
les « membranes types » protéinases (MMP-14 et 17) ;
la matrilysine (MMP-7).
MMP-1, collagénase de type I, n’est habituellement pas détectable dans la cornée normale car l’épithélium cornéen sain synthétise du TGF (transforming growth factor) β2 qui inhibe sa synthèse par les kératocytes [2, 32]. Elle est exprimée uniquement en cas de réparation cornéenne. Sa présence peut être détectée jusqu’à 9 mois après le traumatisme initial. Il s’agit de la seule enzyme capable de cliver le collagène de type I à un pH neutre.
Les polynucléaires neutrophiles produisent quant à eux une autre collagénase de type I, la MMP-8.
La MMP-2, collagénase de type IV, est synthétisée par les kératocytes. Elle peut être détectée physiologiquement dans la cornée. Elle est augmentée dans le kératocône et participe au remodelage du stroma cornéen après brûlure. La MMP-9 est une gélatinase produite par l’épithélium cornéen et en moindre concentration par les kératocytes, les monocytes et les polynucléaires. MMP-9 dégrade notamment la membrane basale de collagène [2].
Pour qu’il y ait ulcération stromale, il faut que l’épithélium cornéen et sa basale aient disparu (action de la MMP-9). Après une brûlure caustique, la production de MMP-1, normalement inhibée par les cytokines produite par l’épithélium, augmente. Les cellules mononucléées synthétisent à leur tour des cytokines et la plasmine stimulant cette synthèse de MMP-1 par les kératocytes. MMP-1 est inhibée par l’inhibiteur tissulaire des métalloprotéinases (tissue inhibitors of metalloproteinase [TIMP]), produit par toutes les cellules sauf les polynucléaires [2, 29, 31].
MMP-7 a une action anti-angiogénique en détruisant la membrane basale des vaisseaux [29]. Si la phase de détersion est trop importante, il y a un risque de perforation.
À l’inverse, si elle est incomplète, la persistance de tissu nécrotique constitue un risque d’infection.
Une fois la phase de détersion terminée, la phase de cicatrisation débute. Les kératocytes y participent en synthétisant le collagène de type I. Cette synthèse de collagène nécessite comme cofacteur l’ascorbate, présent dans la chambre antérieure (déplété en cas de brûlure caustique). Le stroma cornéen va initialement cicatriser grâce à des fibroblastes indifférenciés qui sécrètent du collagène de type III et de l’élastine (rétractile). À long terme, la matrice extracellulaire de la cornée se remodèlera, le collagène de type III étant progressivement remplacé par du collagène de type I, pour tenter de lui rendre sa forme et sa transparence [29].
La cicatrisation épithéliale se fera selon les modèles décrits précédemment avec un épithélium de phénotype cornéen ou conjonctival en fonction de la gravité de l’atteinte limbique. Des facteurs de croissances mitogènes pour les cellules épithéliales tels que l’epidermal growth factor (EGF), naturellement présent dans les larmes et le fibroblast growth factor (FGF), stimulant la synthèse de la membrane basale, participent également à cette régénération de l’épithélium cornéen.
La gravité des lésions rencontrées sera fonction de l’agent causal et de la durée d’exposition. Dans le cas des brûlures chimiques, les dommages seront corrélés au pH mais aussi au pouvoir de pénétration au sein du segment antérieur (bases fortes).
Les acides forts (pH < 4), présents notamment dans le liquide de batterie (acide sulfurique), les produits d’entretien des piscines (acide chlorhydrique) ou encore dans certaines lessives (acide sulfureux), coagulent les protéines des tissus qui jouent un rôle de tampon chimique. Les lésions sont souvent d’emblée maximales et la pénétration du produit est stoppée au niveau des couches tissulaires superficielles.
Les bases fortes (pH > 10), telles que la soude ou l’ammoniaque, lipophiles, réalisant une saponification des acides gras des membranes cellulaires, vont détruire les cellules de l’épithélium, puis du stroma et de l’endothélium [8]. Les ions hydroxyles formés seront responsables de la dénaturation de la trame collagène et des glycosaminoglycanes. Ainsi, la pénétration de la solution va se poursuivre après l’exposition : les bases fortes peuvent atteindre la chambre antérieure en 5 à 15 minutes endommageant l’iris, le cristallin, l’angle irido-cornéen et le corps ciliaire. On observe une diminution de la sécrétion et de la quantité d’ascorbate dans l’humeur aqueuse. Des protéases sont libérées par la cornée lésée par les bases fortes. Celles-ci participent au processus d’ulcération et de nécrose tissulaire. Les MMP-2 et 9 sont notamment impliquées [31]. Les cytokines inflammatoires dont l’IL-6 participent aussi à cette réponse [33].
L’acide fluorhydrique, acide faible retrouvé dans les antirouilles, est un cas à part. Tant qu’il se trouve sous une forme non ionisée, il est capable de pénétrer rapidement les membranes cellulaires et de provoquer une nécrose tissulaire semblable à celle rencontrée dans les brûlures par bases. Cliniquement, les accidents d’exposition à l’acide fluorhydrique sont caractérisés par de violentes douleurs oculaires : sous forme ionisée (ions fluoride), il va se combiner au calcium et au magnésium intracellulaires et former ainsi des complexes insolubles [34]. Cette complexation du calcium conduit à une stimulation nerveuse via des mouvements de l’ion potassium. Des signes gastro-intestinaux, neurologiques, cardiovasculaires, respiratoires peuvent apparaître secondairement lors du passage systémique des ions fluorides associés à une hypocalcémie sévère [35].
Les signes fonctionnels sont le plus souvent bruyants : douleur, sensation de corps étranger, blépharospasme, photophobie, larmoiement, rougeur oculaire et baisse de l’acuité visuelle.
Un examen clinique minutieux est réalisé une fois que le lavage de la surface, des culs-de-sac et des voies lacrymales aura été effectué. Au niveau des paupières, on recherche des malpositions (ectropion, entropion, malposition des cils). Le chiffrage de l’atteinte conjonctivocornéenne (kératite, ulcérations, nécroses) est indispensable pour la classification initiale en grades de gravité croissante. On s’aide de colorants vitaux (fluorescéine). On mesure la tension intra-oculaire (possible hypo- ou hypertonie) en se méfiant d’un éventuel œdème du stroma cornéen pouvant fausser la mesure au tonomètre à applanation de Goldmann.
On cote l’inflammation de chambre antérieure et on recherche une éventuelle atteinte de l’endothélium ou une cataracte. Chez l’enfant, on a parfois recours à un examen sous anesthésie générale afin de mieux apprécier l’étendue des lésions.
Passée la phase aiguë, en cas d’atteinte limbique majeure, on recherche l’apparition d’un pannus cornéen conjonctivovasculaire signant l’insuffisance limbique. L’épithélium cornéen est remplacé par des cellules épithéliales conjonctivales provenant du fornix. On prend soin de repérer les signes précoces d’insuffisance limbique. La ligne de contact entre l’épithélium conjonctival et l’épithélium cornéen normal se caractérise par une ligne ondulée et de petites projections prenant la fluorescéine. Le stroma cornéen est le siège d’opacités. Au niveau de la conjonctive bulbaire, on peut retrouver une kératinisation. Une atteinte palpébrale associée est possible dans les formes sévères : fibrose tarsale, entropion, dystrichiasis.
La finalité des différentes classifications est d’évaluer de façon simple et reproductible le pronostic fonctionnel de l’œil atteint en fonction de l’étendue des lésions constatées lors de l’examen initial. Ainsi, le protocole thérapeutique le mieux adapté pourra être mis en route.
La plus utilisée à l’heure actuelle est celle de Ballen [36] modifiée par Roper-Hall [37].
Elle classe les lésions en quatre grades de gravité croissante. Elle est principalement basée sur l’aspect de la cornée et l’étendue de l’ischémie limbique.
Tableau 12-3 Classification de Roper-Hall.
L’éventail thérapeutique s’étant considérablement élargi, notamment grâce à l’apparition de nouveaux outils permettant une reconstruction chirurgicale de la surface oculaire, la classification de Roper-Hall n’est plus suffisamment précise pour établir de façon reproductible le pronostic oculaire. Les discordances entre les études publiées pour l’utilisation d’une même technique (GMA, greffe limbique ou les deux combinés) ne proviennent pas de la non-reproductibilité des techniques employées, mais plutôt de l’imprécision de la stadification initiale des lésions. Cela s’applique surtout aux grades IV de la classification de Roper-Hall (atteinte limbique comprise entre 50 et 100 %). Grâce aux techniques modernes de reconstruction, on peut espérer un résultat satisfaisant pour une destruction limbique comprise entre 50 et 75 %, alors qu’un limbe détruit à 100 % augure toujours d’un pronostic sombre. De plus, l’ancienne classification ne tient pas compte de l’atteinte conjonctivale. Lorsque le limbe est détruit à 100 %, si la conjonctive l’est aussi, il n’y aura pas de réépithélialisation et le risque de perforation est majeur. Par contre, s’il persiste de la conjonctive saine, un recouvrement de la surface cornéenne par celle-ci évitera la fonte du stroma et permettra une reconstruction par apport de cellules limbiques dans un deuxième temps. La nouvelle classification de Dua [38], élaborée à partir d’une série de 67 patients, tient compte de la destruction des cellules souches du limbe, mais aussi de la conjonctive.
Elle comporte six grades. Le limbe est divisé en 12 quadrants horaires. La notion d’ischémie limbique jugée trop réductrice est abandonnée au profit d’une « atteinte limbique ». En effet, il est possible d’avoir une destruction d’une portion de limbe de pleine épaisseur sans ischémie et, à l’inverse, une ischémie transitoire du limbe n’entraîne pas forcément une destruction des cellules souches. La destruction conjonctivale est exprimée en pourcentage de surface. Cette classification en grades peut aussi être exprimée de façon « analogique » permettant une précision plus grande à l’intérieur de chaque grade lors du premier examen ainsi qu’un suivi au cours du temps. Le premier chiffre représente alors le nombre d’« heures de limbe » détruites de 0 à 12 et le deuxième le pourcentage de la surface conjonctivale atteinte. Dans les formes sévères, Dua [38] propose une réévaluation quotidienne ou tous les deux jours de l’état du patient :
le grade I de la nouvelle classification est caractérisé par l’absence d’atteinte limbique ou conjonctivale. Le pronostic est excellent ;
le grade II est caractérisé par une atteinte de moins de trois quadrants horaires de limbe ainsi que de moins de 30 % de la conjonctive. Le pronostic reste bon. Les grades I et II de la nouvelle classification sont globalement superposables à ceux de celle de Roper-Hall ;
le grade III, défini par une atteinte limbique de 3 à 6 h et conjonctivale de 30 à 50 %, reste de bon pronostic. L’état du patient doit être réévalué régulièrement. En cas de passage au grade IV, il pourra bénéficier d’un traitement chirurgical complémentaire (GMA) ;
le grade IV est défini par une atteinte de 6 à 9 heures de limbe et 50 à 75 % de la conjonctive. Le pronostic va de bon à réservé ;
le grade V est synonyme de mauvais pronostic. Il se définit par une destruction subtotale du limbe supérieure à 9 h mais inférieure à 12 h et de 75 à 99,9 % de la conjonctive. Malgré tout, un sauvetage de l’œil est encore envisageable par la chirurgie ;
le grade VI implique une atteinte limbique sur 360°, ainsi qu’une destruction de 100 % de la conjonctive. Le pronostic est très mauvais quel que soit le traitement utilisé.
Tableau 12-4 Classification de Dua.
Le lavage oculaire est effectué le plus rapidement possible. L’irrigation doit être abondante, l’œil étant maintenu largement ouvert, au besoin à l’aide d’écarteurs, après instillation préalable d’une goutte d’oxybuprocaïne ou de tétracaïne. On prend soin de bien rincer les culs-de-sac. D’éventuels corps étrangers sont retirés lors du lavage, leur persistance pouvant être à la source d’ulcérations profondes.
La solution employée pour le lavage est préférentiellement une solution saline tamponnée à pH 7,4 par du bicarbonate de sodium [39]. Cette irrigation, hormis en cas de produits simplement irritants, doit être maintenue durant au moins une demi-heure [40].
En cas de brûlure par base, on peut substituer au sérum physiologique une solution de chélateur amphotère (Diphotérine®) [41]. À volume identique utilisé, la Diphotérine® permettrait une réépithélialisation plus rapide, pour les grades I et II de Roper-Hall, par rapport au sérum physiologique [14]. Cette solution, disponible sous la forme de kits prêts à l’emploi est déjà largement utilisée dans l’industrie.
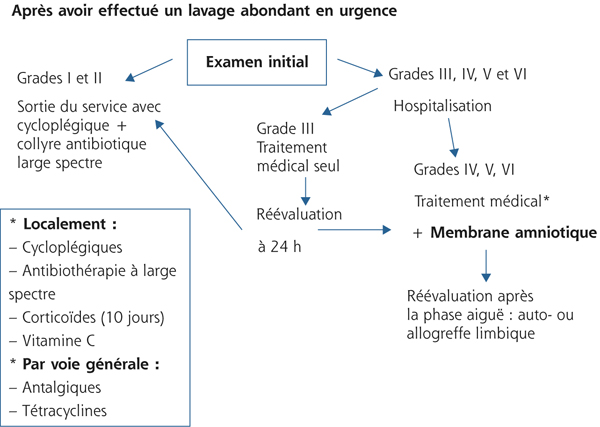
Fig. 12-62 Schéma de la prise en charge guidée par la nouvelle classification de Dua.
(D’après [23].)
Les patients atteints de brûlures de grade I ou II sont traités par :
des substituts lacrymaux non conservés à volonté : ils favorisent la réépithélialisation dans un contexte où le film lacrymal est anormal du fait de la destruction des cellules à mucus. Ils sont poursuivis une fois la réépithélialisation obtenue [42] ;
un collyre cycloplégique (atropine 1 %) : il possède une activité antalgique propre et minimise le risque de synéchies iridocristalliniennes ;
un collyre antibiotique à large spectre ;
un antalgique per os (paracétamol seul ou associé au dextropropoxyphène).
Les patients atteints de brûlures de grade III à VI doivent être hospitalisés afin d’optimiser l’observance des traitements locaux administrés de façon répétée au cours du nycthémère.
Le traitement médical des patients présentant un grade III à VI comporte :
les mêmes médications que pour les grades I et II ;
des antalgiques : par voie intraveineuse ; ils doivent être largement prescrits, les lésions des nerfs cornéens engendrant des douleurs violentes ;
des collyres mucomimétiques : le hyaluronate de sodium augmente la mouillabilité de la surface et l’adhérence du film lacrymal. En outre, il préviendrait la fibrose conjonctivale [42, 43] ;
des corticoïdes locaux : en administration initialement horaire, ils évitent une destruction secondaire des tissus en limitant les phénomènes inflammatoires, en diminuant le chimiotactisme pour les cellules inflammatoires et en stabilisant les membranes cellulaires et lysosomiales des polynucléaires [42]. Ils ont longtemps été considérés comme responsables potentiels de perforations cornéennes [44]. Des données plus récentes remettent en question cette responsabilité [45, 46]. Après la phase aiguë, les corticoïdes risquant de ralentir la réépithélialisation, ainsi que la réparation de la trame collagène, il convient de les arrêter en moins de 10 jours. Leur réintroduction est licite après la 6e semaine pour lutter contre l’inflammation chronique [42] ;
de la vitamine C topique : elle possède une action anti-oxydante limitant l’action des radicaux libres libérés durant une agression cornéenne chimique. Elle agit comme cofacteur de la synthèse du collagène. La vitamine C intra-oculaire naturellement sécrétée dans l’humeur aqueuse par le corps ciliaire est rapidement consommée en cas de brûlure chimique sévère. L’usage de vitamine C en topique est recommandé à partir du grade III [47]. Les fortes doses de vitamine C administrée par voie générale ne semblent pas apporter de bénéfice en adjonction de la vitamine C administrée localement [42] ;
des tétracyclines : elles possèdent une action inhibitrice sur les collagénases. On privilégie l’administration par voie générale plutôt qu’en topique [42, 46, 48] ;
de l’acétylcystéine : celle-ci posséderait une action anticollagénase, mais son efficacité est controversée [42] ;
le port de lentilles de contact : les lentilles souples hydrophiles à haut Dk/e permettant une bonne oxygénation de la cornée peuvent être utilisées comme « pansement ». Elles présentent un effet antalgique et amélioreraient l’épithélialisation, mais ne sont pas dénuées de risques infectieux dans ce contexte [42]. On leur préférera dans cette indication la GMA [4, 48–51].
À partir du grade IV, le patient bénéficie d’une greffe de membrane amniotique (GMA) [48, 50]. Cette membrane correspond à la fois au feuillet tissulaire le plus interne du sac chorial (accolé au chorion) et à celui recouvrant le placenta. Avasculaire et acellulaire, elle facilite la cicatrisation épithéliale en se comportant comme une membrane basale (elle possède les mêmes isoformes de collagène que la membrane basale conjonctivale) [49].
Elle est riche en facteurs de croissance tels que TGF-β2, TGF-β1, HGF (hepatocyte growth factor) et EGF. Ceux-ci sont responsables par leur action conjuguée avec de nombreuses autres cytokines d’une stimulation de l’épithélialisation et d’une inhibition de la fibrose [49, 52–54].
La GMA est réalisée sous anesthésie topique. En cas de pannus conjonctival majeur, celui-ci est préalablement réséqué sous anesthésie sous-tenonienne. Le greffon est mis en place en patch, face épithéliale vers le bas afin que les facteurs de croissance épithéliotrophiques tels que l’EGF, liés à la membrane des cellules de l’épithélium de la membrane amniotique, soient en contact direct avec les cellules limbiques restées encore vivantes [49, 54]. Ce patch agit aussi comme une barrière vis-à-vis des cellules immunitaires [55, 56], en diminuant la réponse immunitaire, en inhibant l’expression de l’IL-1β et de l’IL-8 [57], et en produisant des protéines antiangiogéniques [58]. La GMA seule peut permettre de restaurer la surface cornéenne et conjonctivale en cas de brûlure modérée [4]. Dans les grades plus sévères, elle ne suffit pas à assurer une cicatrisation de l’épithélium cornéen [59]. Cependant, elle aide à préparer un terrain favorable pour la greffe de limbe. Elle a le mérite de posséder un effet antalgique puissant [50, 60], indispensable surtout chez l’enfant.
La greffe de limbe est déconseillée à la phase aiguë, mais un traitement chirurgical précoce à type d’« épithéliectomie séquentielle sectorielle » est indiqué en cas de brûlure modérée à sévère. Cette technique vise à limiter le développement d’une insuffisance limbique [23]. Elle consiste à débrider, de manière répétée sous anesthésie topique, l’épithélium conjonctival qui, à partir d’une zone d’atteinte limbique, a tendance à recouvrir plus rapidement la surface cornéenne que l’épithélium cornéen sain (fig. 12-63 et 12-64).
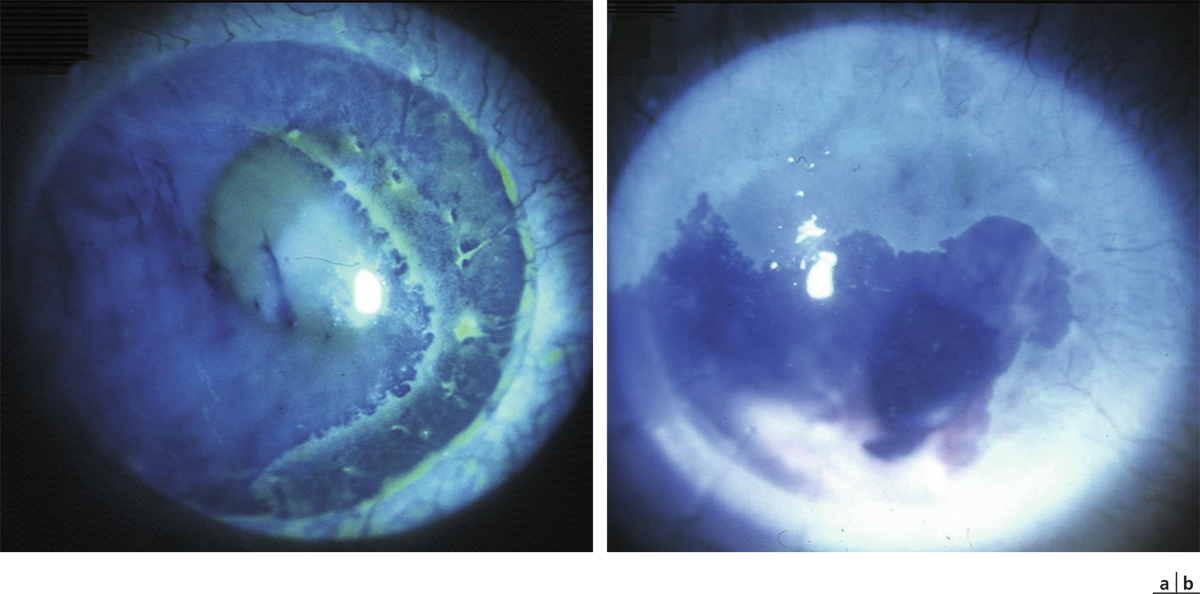
Fig. 12-63 Conjonctivalisation superficielle de la surface cornéenne persistante 2 ans (a) et 5 ans (b) après la brûlure initiale.
Technique d’épithéliectomie sectorielle séquentielle (b).
(Source : Dua HS et al. Corneal epithelial wound healing. Br J Ophthalmol 1994 ; 78 : 401-8.)
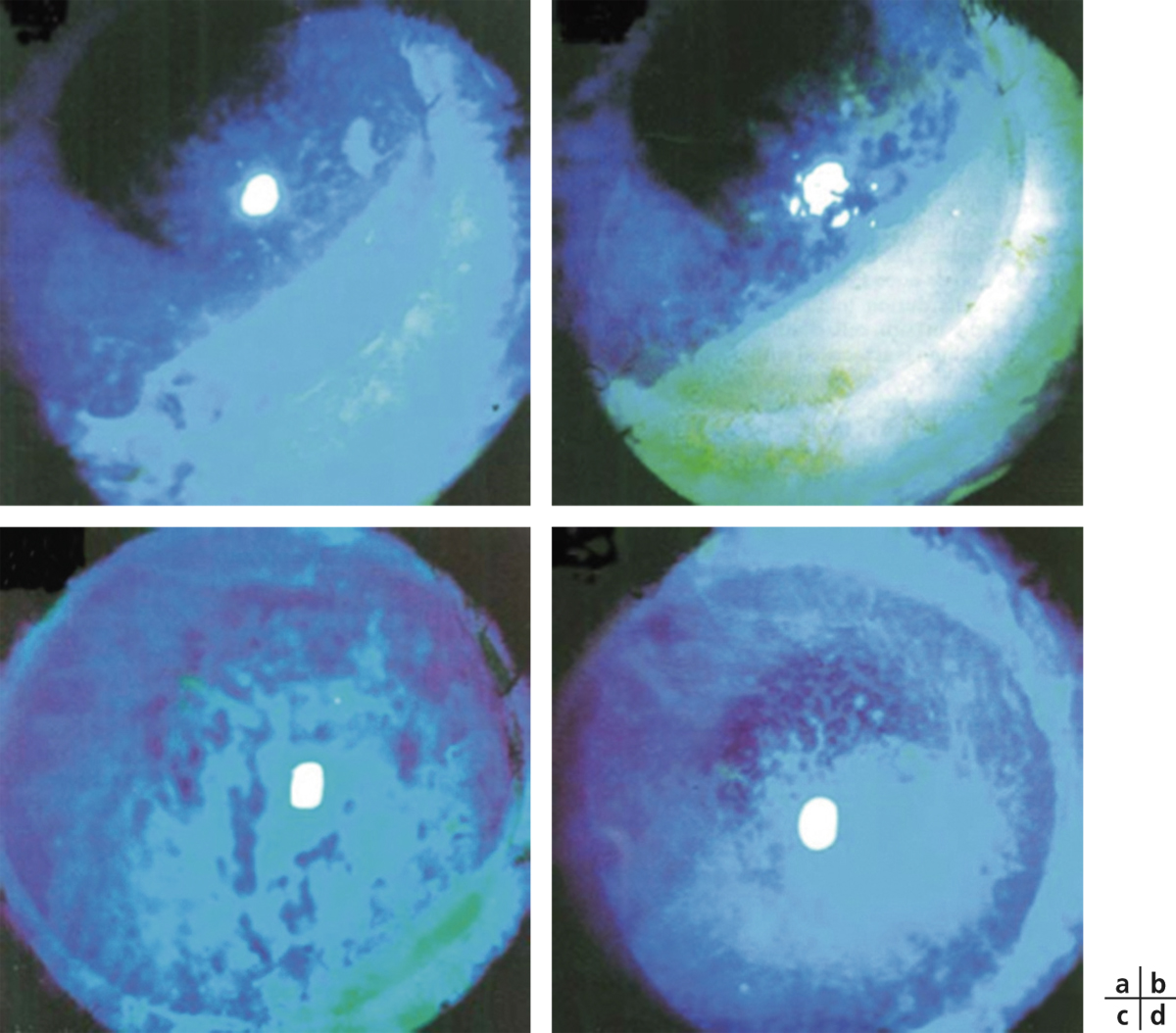
Fig. 12-64 Technique d’autogreffe conjonctivo-limbique.
a. Conjonctivalisation inférotemporale. b. Aspect après ablation de l’épithélium conjonctival. c. Aspect 24 heures plus tard. d. Aspect 1 semaine après (la zone préablablement conjonctivalisée est maintenant recouverte par de l’épithélium cornéen).
(Source : Dua HS et al. Corneal epithelial wound healing. Br J Ophthalmol 1994 ; 78 : 401-8.)
En cas de nécrose conjonctivale étendue, dans les grades V et VI de Dua, on peut effectuer un rapprochement au limbe de lambeaux ténoniens, après parage de la conjonctive nécrotique. Cette technique vise à rétablir une vascularisation pour éviter la perforation sclérale [61]. Elle n’empêchera pas la constitution d’une insuffisance limbique, mais permettra de réaliser secondairement une greffe de limbe.
En cas d’insuffisance limbique avérée, atteignant l’axe optique, la greffe de cellules souches limbique (auto- ou allogreffe de limbe) est alors nécessaire [3, 62]. En cas d’apport de fragments de limbe entiers, à partir desquels des cellules vont coloniser la cornée lésée, on parle d’expansion in vivo. Lorsque ce sont des progéniteurs limbiques ou des cellules de muqueuse buccales cultivées qui sont greffés, on parle d’expansion ex vivo.
Dans tous les cas, la préparation du lit du receveur reste la même. Une péritomie conjonctivale est réalisée sur 360° à 4–5 mm du limbe. Le pannus conjonctival est excisé en évitant toute effraction du stroma cornéen profond (vidéo 12-4).
En cas de forme unilatérale, l’autogreffe conjonctivolimbique est la technique de choix [63]. Deux greffons limbiques sont prélevés sur l’œil adelphe, sur 12 h et 6 h, sous forme de croissants d’arc de 3 à 4 h (jamais plus de 8 h). Le risque d’apparition d’une insuffisance limbique induite par le prélèvement est faible. Malgré tout trois cas de conjonctivalisation progressive de l’œil prélevé après autogreffe ont été rapportés [64]. Aussi il faut s’assurer que l’atteinte initiale est strictement unilatérale et récuser tout patient présentant des signes a minima d’insuffisance limbique sur l’œil adelphe.
En cas d’atteinte bilatérale, on aura le plus souvent recours à une allogreffe. Deux techniques sont possibles : l’allogreffe kératolimbique provenant de donneurs décédés ou la greffe conjonctivolimbique à partir de donneur apparenté (voir vidéo 12-4).
En cas de greffe kératolimbique provenant d’un donneur décédé, l’idéal est que le donneur soit le plus jeune possible. Les greffons pédiatriques contiennent des cellules dont la viabilité est optimale, mais posent des difficultés sur le plan éthique [65]. Lors du prélèvement, on prend soin de ne pas endommager l’épithélium et de conserver une collerette conjonctivale de 4 à 5 mm. La cornée centrale du donneur est excisée au trépan de 7,5 mm. La collerette cornéolimbique ainsi obtenue est ensuite coupée en deux, puis on procède à une ablation des deux tiers postérieurs par dissection lamellaire. En plus de l’ablation du pannus conjonctival et de la réalisation de la péritomie, on procède chez le receveur à une dissection lamellaire de la sclère visant à une meilleure adaptation du greffon.
Lorsque cela est possible, on privilégie la greffe conjonctivolimbique à partir d’un donneur vivant apparenté (voir vidéo 12-4). Cette technique est identique à l’autogreffe, à ceci près que les greffons sont prélevés chez un membre de la famille. Elle se heurte à deux problèmes principaux : la nécessité de réaliser chez le donneur un bilan sérologique (hépatites, virus de l’immunodéficience humaine ou VIH, syphilis, etc.), souvent mal accepté, et le risque pour celui-ci de développer à son tour une insuffisance limbique. Les deux avantages principaux sont le moindre risque de rejet et le meilleur potentiel régénératif du tissu (donneur vivant) [66].
Vidéo 12-4 Greffe conjonctivo-limbique à partir d’un donneur apparenté.
Comme alternative à la greffe de limbe, il est possible de cultiver ex vivo des cellules souches limbiques à partir d’un microprélèvement de limbe (1 mm × 3 mm) [67, 68]. Cela rend virtuellement nul le risque d’insuffisance limbique induite. Cette technique permet parfois d’éviter le recours à l’allogreffe même si l’atteinte est bilatérale (un prélèvement limbique de petite taille restant envisageable sur un œil ayant subi une brûlure modérée).
Les cellules sont cultivées soit sur un substrat de fibrine [69], soit sur une membrane amniotique dénudée, agissant alors comme une membrane basale [67, 68]. On privilégie des milieux de culture « humanisés », sans sérum de veau fœtal ni recours aux fibroblastes murins inactivés (composants interdits en France par l’Agence nationale de sécurité du médicament et des produits de santé [ANSM]) [70]. La membrane amniotique permet une manipulation et un transfert aisé des cellules. Une fois recouverte uniformément des progéniteurs limbiques, elle est mise en place sur la cornée et suturée au limbe [67]. La membrane peut aussi être fixée par de la colle de fibrine [70].
Afin de s’affranchir de tout risque de rejet, en cas d’insuffisance limbique bilatérale sur 360°, certaines équipes proposent déjà de remplacer le prélèvement limbique par une biopsie de muqueuse buccale [71, 72]. Après digestion enzymatique du tissu biopsié, les cellules épithéliales séparées de leur muqueuse sont cultivées sur membrane amniotique. On obtient ainsi un épithélium aux propriétés proches de celles de l’épithélium cornéen [72]. Récemment, des cellules souches provenant de pulpe dentaire humaine, cultivées ex vivo, ont permis une cicatrisation cornéenne dans un modèle d’insuffisance limbique chez le lapin [73]. L’épithélium ainsi obtenu présentait une bonne transparence et exprimait les principaux marqueurs communs aux cellules souches limbiques, tels que ABCG2, l’intégrine β1, la vimentine, la protéine du gène p63, la connexine 43 et les cytokératines 3 et 12 [73, 74].
Pour toutes ces techniques de greffe de limbe, on peut adjoindre au montage final une GMA, en patch, à visée épithéliotrophique et anti-inflammatoire [54, 70].
Une fois l’épithélium cornéen stable restauré, il est souvent nécessaire de procéder à une kératoplastie pour rétablir la transparence cornéenne. En fonction de la profondeur de l’opacification stromale, on procède soit à une kératoplastie lamellaire profonde (à condition que l’endothélium soit sain) [75, 76], soit à une kératoplastie transfixiante [65, 77, 78]. En théorie, si la greffe de cellules souches limbiques (allogreffe) et la greffe de cornée sont réalisées en même temps, la « charge immunitaire » (en cas de donneur identique) est moindre, ainsi que le risque de rejet [77, 78]. En pratique, la plupart des auteurs préfèrent attendre entre 3 mois [65] et 1 an [75, 79], le risque de rejet de la greffe de cornée étant plus important si le lit du receveur est inflammatoire et hypervascularisé [80, 81].
Le but du traitement postopératoire d’une greffe de cellules souches limbiques tient en cinq points :
1. prévenir le rejet (à la différence de la cornée, avasculaire, le limbe ne possède pas de privilège immunologique ; sa vascularisation permet un afflux rapide des cellules immunitaires, surtout en cas d’inflammation sous-jacente) ;
2. prévenir l’infection (indispensable surtout lorsque l’on a recours aux immunosuppresseurs) ;
3. maintenir l’intégrité du film lacrymal ;
4. diminuer l’inflammation de la surface oculaire ;
5. promouvoir l’épithélialisation du greffon à partir du greffon.
Le traitement topique, commun aux auto- et allogreffes de limbe, comprend des antibiotiques de préférence non conservés (chloramphénicol unidose, non disponible en France). Celui-ci sera maintenu jusqu’à épithélialisation complète. La dexaméthasone collyre en unidose est administrée à forte dose initialement, puis diminuée rapidement afin de ne pas retarder l’épithélialisation [82]. Elle est maintenue au long cours afin de limiter toute inflammation chronique, délétère pour la survie du greffon, en prenant garde de contrôler régulièrement la pression intra-oculaire. Afin de maintenir la qualité du film lacrymal, on utilise abondamment les substituts lacrymaux non conservés [80, 81, 83]. Le sérum autologue peut être employé pour ses propriétés anti-inflammatoires et épithéliotrophiques [84]. En cas d’allogreffe, la ciclosporine A en collyre peut être utilisée comme traitement adjuvant de l’immunosuppression par voie générale [75, 83].
Le traitement immunosuppresseur per os est indispensable en cas d’allogreffe. Selon les auteurs, il comporte la ciclosporine A, le cyclophosphamide, l’azathioprine, le tacrolimus, le méthotrexate en association avec la prednisolone [67, 80, 83]. Le tacrolimus serait aussi efficace [85] et mieux toléré que la ciclosporine A, traitement de référence [86].
L’atteinte cornéenne au cours d’une exposition à de hautes températures est rare (1–5 %). Il s’agit le plus souvent d’accidents domestiques [87, 88]. L’atteinte cornéenne lors d’une exposition à de très basses températures est essentiellement rencontrée lors d’une cryothérapie [89].
Les brûlures thermiques sont provoquées soit à distance par la chaleur dégagée par une combustion, soit par le contact avec un liquide, un gaz, un métal en fusion ou encore de la poudre à canon projetée lors de la manipulation de feux d’artifice. La gravité dépendra de la température et de la durée d’exposition [87, 88]. Les très basses températures entraînent une atteinte de l’endothélium cornéen responsable d’œdème cornéen et de plis descemétiques [89].
Les lésions du globe oculaire sont le plus souvent limitées à l’épithélium. Le réflexe de clignement rapide et le phénomène de Charles Bell permettent le plus souvent de préserver le globe oculaire [87]. Les paupières sont par contre fréquemment le siège de lésions sévères pouvant aboutir à des brides, rétractions, trichiasis, entropion ou ectropion, mettant en danger l’intégrité de la surface cornéenne et nécessitant une prise en charge par un oculoplasticien [88].
En cas de lésion superficielle, on se contente d’un collyre antibiotique, de substituts lacrymaux non conservés associés parfois à un collyre cycloplégique. En cas d’atteinte plus sévère, il est superposable à celui des brûlures chimiques [88].
C’est l’exposition aux rayons ultraviolets (290–400 nm) qui est la plus fréquemment responsable de brûlures par rayonnements. Celles-ci se produisent souvent lors des vacances (ophtalmie des neiges, des mers). Les accidents du travail sont essentiellement représentés par la kératite du soudeur (l’accident survenant le plus souvent lors de l’allumage de l’arc, alors que le patient n’a pas encore mis en place ses lunettes de protection). Les brûlures par rayonnements infrarouges (900–1 000 nm) sont plus rares. Elles surviennent lors d’explosions ou d’accidents industriels [88].
Les rayons ultraviolets, provenant de la réverbération du soleil chez des sujets dépourvus de protection par verres filtrants ou de la lumière intense de l’arc chez un ouvrier qui ne porte pas son masque de soudeur, sont presque totalement absorbés par la cornée. Ils réagissent avec les acides nucléiques et les protéines cellulaires. Il s’ensuit un détachement des cellules épithéliales et un œdème stromal.
La physiopathologie des lésions rencontrées lors des expositions aux infrarouges est à rapprocher de celle des brûlures thermiques [88].
Environ 12 heures après l’exposition, le patient présente une douleur intense, un blépharospasme, un larmoiement et une photophobie. En lampe à fente, on note une kératite ponctuée superficielle associée à une hyperhémie conjonctivale et peu ou pas de réaction en inflammatoire en chambre antérieure. La guérison survient au bout de 48 heures [88].
Il consiste en une antibiothérapie locale pour prévenir l’infection, et est associé à l’occlusion à titre antalgique [88] et des antalgiques per os.
L’état inflammatoire de la surface oculaire joue un rôle majeur dans les chances de succès d’une greffe de cellules souches limbiques. Son évaluation est cruciale en cas d’autogreffe ou de greffe réalisée à partir d’un donneur apparenté [4, 90–95]. La persistance d’une inflammation chronique au niveau du stroma, du limbe et de la conjonctive constitue un facteur de mauvais pronostic [91]. Des médiateurs de l’inflammation, tels que le TGF-β1, le TNF-α ou l’interféron γ, interfèrent avec le fonctionnement interne des cellules souches limbiques. Ceux-ci entraînent des anomalies de la prolifération, de la migration et de l’adhérence cellulaire, aboutissant à l’apoptose [94]. En l’absence d’un traitement anti-inflammatoire bien conduit à la phase aiguë, les populations de cellules souches résiduelles déclinent progressivement [4]. De même, l’inflammation conjonctivolimbique affecte la survie des cellules souches transplantées [95].
Gicquel et al. ont comparé l’expression de HLA-DR en cytométrie de flux (marqueur non spécifique de l’activation du système immunitaire, indiquant une exposition à certaines cytokines pro-inflammatoires, exprimées par les cellules de la conjonctive) [96, 97] chez des patients atteints de brûlures oculaires graves (grades III à VI de Dua), sur une période de 24 mois, à des volontaires sains [51]. Les auteurs ont relevé un pic d’expression de HLA-DR entre le 2e et le 6e mois suivi d’une décroissance à partir du 12e mois, pour finalement aboutir à un niveau minimal au bout de 24 mois. À partir du 24e mois, il persiste malgré tout un niveau d’inflammation significativement plus élevé que chez les volontaires sains, y compris chez les patients n’ayant pas développé d’insuffisance limbique, dont l’examen en lampe à fente semble « normal ». L’expression de HLA-DR était significativement plus élevée en cas de grade IV–V par rapport au grade III. Dans cette même étude, les auteurs ont tenté d’établir une corrélation entre l’expression de HLA-DR et les modifications cytopathologiques de la surface oculaire classées selon les grades définis par Nelson [98]. Il s’agit d’une méthode utilisant les empreintes conjonctivales en microscopie optique, avec une coloration standard (periodic acid Schiff ou PAS). Le degré de métaplasie cellulaire et le déficit en cellules à mucus varient avec l’inflammation de surface, mais il n’y a pas de corrélation au-delà de 6 mois. L’aspect de l’épithélium conjonctival en microscopie optique redevient normal passé ce délai, alors que l’expression de HLA-DR demeure élevée.
L’ophtalmologiste dispose désormais d’un panel varié d’outils permettant d’améliorer la régénération de la surface oculaire en cas de brûlure cornéenne sévère. La prise en charge des patients doit être guidée par une classification précise et reproductive telle que celle proposée par Dua [38]. La GMA permet d’améliorer efficacement l’épithélialisation. Elle doit être utilisée dès la phase aiguë, ce d’autant plus qu’elle possède un effet antalgique puissant. Le recours à la greffe de cellules souches limbiques n’est indiqué que secondairement, une fois l’inflammation de surface contrôlée. Le recours aux techniques d’expansion cellulaire ex vivo [68, 69, 71] devrait améliorer à l’avenir le pronostic des formes sévères bilatérales et ouvre la voie au traitement des insuffisances limbiques d’origine génétique [99, 100]. Cependant, il convient de ne pas négliger pour autant la prévention en amont : respect des règles de sécurité ; port de lunettes de protection ; kits de lavage des yeux à portée de main dans tous les environnements potentiellement accidentogènes.
[1] Saini JS, Sharma A. Ocular chemical burns--clinical and demographic profile. Burns 1993 ; 19 : 67-9.
[2] Wagoner MD. Chemical injuries of the eye : current concepts in pathophysiology and therapy. Surv Ophthalmol 1997 ; 41 : 275-13.
[3] Tseng SC, Prabhasawat P, Barton K, et al. Amniotic membrane transplantation with or without limbal allografts for corneal surface reconstruction in patients with limbal stem cell deficiency. Arch Ophthalmol 1998 ; 116 : 431-41.
[4] Meller D, Pires RT, Mack RJ, et al. Amniotic membrane transplantation for acute chemical or thermal burns. Ophthalmology 2000 ; 107 : 980-9, discussion 990.
[5] Kenyon KR. Limbal autograft transplantation for chemical and thermal burns. Dev Ophthalmol 1989 ; 18 : 53-8.
[6] Tsubota K, Toda I, Saito H, et al. Reconstruction of the corneal epithelium by limbal allograft transplantation for severe ocular surface disorders. Ophthalmology 1995 ; 102 : 1486-96.
[7] Jones NP, Hayward JM, Khaw PT, et al. Function of an ophthalmic « accident and emergency » department : results of a six month survey. Br Med J (Clin Res Ed) 1986 ; 292 : 188-90.
[8] Pfister RR. Chemical injuries of the eye. Ophthalmology 1983 ; 90 : 1246-53.
[9] Liggett PE, Pince KJ, Barlow W, et al. Ocular trauma in an urban population. Review of 1132 cases. Ophthalmology 1990 ; 97 : 581-4.
[10] Macdonald EC, Cauchi PA, Azuara-Blanco A, Foot B. Surveillance of severe chemical corneal injuries in the UK. Br J Ophthalmol 2009 ; 93 : 1177-80.
[11] Beare JD. Eye injuries from assault with chemicals. Br J Ophthalmol 1990 ; 74 : 514-8.
[12] Morgan SJ. Chemical burns of the eye : causes and management. Br J Ophthalmol 1987 ; 71 : 854-7.
[13] Kuckelkorn R, Luft I, Kottek AA, et al. Chemical and thermal eye burns in the residential area of RWTH Aachen. Analysis of accidents in 1 year using a new automated documentation of findings. Klin Monbl Augenheilkd 1993 ; 203 : 34-42.
[14] Merle H, Donnio A, Ayeboua L, et al. Alkali ocular burns in Martinique (French West Indies) Evaluation of the use of an amphoteric solution as the rinsing product. Burns 2005 ; 31 : 205-11.
[15] Klein R, Lobes LA, Jr. Ocular alkali burns in a large urban area. Ann Ophthalmol 1976 ; 8 : 1185-9.
[16] Thoft RA, Friend J. The X, Y, Z hypothesis of corneal epithelial maintenance. Invest Ophthalmol Vis Sci 1983 ; 24 : 1442-3.
[17] Dua HS, Forrester JV. The corneoscleral limbus in human corneal epithelial wound healing. Am J Ophthalmol 1990 ; 110 : 646-56.
[18] Dua HS, Shanmuganathan VA, Powell-Richards AO, et al. Limbal epithelial crypts : a novel anatomical structure and a putative limbal stem cell niche. Br J Ophthalmol 2005 ; 89 : 529-32.
[19] Yeung AM, Schlotzer-Schrehardt U, Kulkarni B, et al. Limbal epithelial crypt : a model for corneal epithelial maintenance and novel limbal regional variations. Arch Ophthalmol 2008 ; 126 : 665-9.
[20] Shanmuganathan VA, Foster T, Kulkarni BB, et al. Morphological characteristics of the limbal epithelial crypt. Br J Ophthalmol 2007 ; 91 : 514-9.
[21] Yeung AM, Tint NL, Kulkarni BB, et al. Infant limbus : an immunohistological study. Exp Eye Res. 2009 ; 88 : 1161-4.
[22] Dua HS, Forrester JV. Clinical patterns of corneal epithelial wound healing. Am J Ophthalmol 1987 ; 104 : 481-9.
[23] Dua HS, Gomes JA, Singh A. Corneal epithelial wound healing. Br J Ophthalmol 1994 ; 78 : 401-8.
[24] Dua HS. The conjunctiva in corneal epithelial wound healing. Br J Ophthalmol 1998 ; 82 : 1407-11.
[25] Dua HS, Miri A, Alomar T, et al. The role of limbal stem cells in corneal epithelial maintenance : testing the dogma. Ophthalmology 2009 ; 116 : 856-63.
[26] Majo F, Hoang-Xuan T, Barrandon Y. Limbal stem cell can contribute to both the cornea and the conjunctiva in mouse. Invest Ophthalmol Vis Sci 2002 ; 43 : E-Abstract 1979.
[27] Majo F, Rochat A, Nicolas M, Jaoude GA, Barrandon Y. Oligopotent stem cells are distributed throughout the mammalian ocular surface. Nature 2008 ; 456 : 250-4.
[28] Chang CY, Green CR, McGhee CN, Sherwin T. Acute wound healing in the human central corneal epithelium appears to be independent of limbal stem cell influence. Invest Ophthalmol Vis Sci 2008 ; 49 : 5279-86.
[29] Renard G. Physiopathology of eye burns. J Fr Ophtalmol 2004 ; 27 : 1164-9.
[30] Pfister RR, Haddox JL, Sommers CI, Lam KW. Identification and synthesis of chemotactic tripeptides from alkali-degraded whole cornea. A study of N-acetyl-proline-glycine-proline and N-methyl-proline-glycine-proline. Invest Ophthalmol Vis Sci 1995 ; 36 : 1306-16.
[31] Rigal-Sastourne JC, Tixier JM, Renard JP, et al. Corneal burns and matrix metalloproteinases (MMP-2 and -9) : the effects of human amniotic membrane transplantation. J Fr Ophtalmol 2002 ; 25 : 685-93.
[32] Strissel KJ, Rinehart WB, Fini ME. A corneal epithelial inhibitor of stromal cell collagenase synthesis identified as TGF-beta 2. Invest Ophthalmol Vis Sci 1995 ; 36 : 151-62.
[33] Berry M, Jeffreys D. Ocular injuries from household chemicals : early signs as predictors of recovery. In Vitr Mol Toxicol 2001 ; 14 : 5-13.
[34] Beiran I, Miller B, Bentur Y. The efficacy of calcium gluconate in ocular hydrofluoric acid burns. Hum Exp Toxicol 1997 ; 16 : 223-8.
[35] Chan KM, Svancarek WP, Creer M. Fatality due to acute hydrofluoric acid exposure. J Toxicol Clin Toxicol 1987 ; 25 : 333-9.
[36] Ballen PH. Treatment of chemical burns of the eye. Eye Ear Nose Throat Mon 1964 ; 43 : 57-61.
[37] Roper-Hall MJ. Thermal and chemical burns. Trans Ophthalmol Soc UK 1965 ; 85 : 631-53.
[38] Dua HS, King AJ, Joseph A. A new classification of ocular surface burns. Br J Ophthalmol 2001 ; 85 : 1379-83.
[39] Herr RD, White GL, Jr, Bernhisel K, et al. Clinical comparison of ocular irrigation fluids following chemical injury. Am J Emerg Med 1991 ; 9 : 228-31.
[40] Burns FR, Paterson CA. Prompt irrigation of chemical eye injuries may avert severe damage. Occup Health Saf 1989 ; 58 : 33-6.
[41] Gerard M, Josset P, Louis V, et al. Is there a delay in bathing the external eye in the treatment of ammonia eye burns ? Comparison of two ophthalmic solutions : physiological serum and Diphoterine. J Fr Ophtalmol 2000 ; 23 : 449-58.
[42] Hoang-Xuan T, Hannouche D. Medical treatment of ocular burns. J Fr Ophtalmol 2004 ; 27 : 1175-8.
[43] Reim M. A new treatment concept in severe caustic injuries and burns of the eye. Fortschr Ophthalmol 1989 ; 86 : 722-6.
[44] Pfister RR. The effects of chemical injury on the ocular surface. Ophthalmology 1983 ; 90 : 601-9.
[45] Oether A. Topical steroid use in the treatment of ocular alkali burns. Br J Ophthalmol 2000 ; 84 : 124.
[46] Graffan R, Riss I, Colin J. Traitement des brûlures cornéennes par base. Réflexions Ophtalmologiques 2001 ; 43 : 17-9.
[47] Brodovsky SC, McCarty CA, Snibson G, et al. Management of alkali burns : an 11-year retrospective review. Ophthalmology 2000 ; 107 : 1829-35.
[48] Gicquel JJ. Prise en charge des brûlures oculaires en 2003. Réflexions Ophtalmologiques 2003.
[49] Dua HS, Gomes JA, King AJ, Maharajan VS. The amniotic membrane in ophthalmology. Surv Ophthalmol 2004 ; 49 : 51-77.
[50] Kobayashi A, Shirao Y, Yoshita T, et al. Temporary amniotic membrane patching for acute chemical burns. Eye (Lond) 2003 ; 17 : 149-58.
[51] Gicquel JJ, Navarre R, Langman ME, et al. The use of impression cytology in the follow-up of severe ocular burns. Br J Ophthalmol 2007 ; 91 : 1160-4.
[52] Zito E, Borderie V, Touzeau O, et al. Amniotic membrane transplantation in severe corneal epithelial diseases. Preliminary results. J Fr Ophtalmol 2002 ; 25 : 879-88.
[53] Hopkinson A, McIntosh RS, Tighe PJ, et al. Amniotic membrane for ocular surface reconstruction : donor variations and the effect of handling on TGF-beta content. Invest Ophthalmol Vis Sci 2006 ; 47 : 4316-22.
[54] Gicquel JJ, Dua HS, Brodie A, et al. Epidermal growth factor variations in amniotic membrane used for ex vivo tissue constructs. Tissue Eng Part A. 2009 ; 15 : 1919-27.
[55] Heiligenhaus A, Bauer D, Meller D, et al. Improvement of HSV-1 necrotizing keratitis with amniotic membrane transplantation. Invest Ophthalmol Vis Sci 2001 ; 42 : 1969-74.
[56] Avila M, Espana M, Moreno C, Pena C. Reconstruction of ocular surface with heterologous limbal epithelium and amniotic membrane in a rabbit model. Cornea 2001 ; 20 : 414-20.
[57] Solomon A, Rosenblatt M, Monroy D, et al. Suppression of interleukin 1alpha and interleukin 1beta in human limbal epithelial cells cultured on the amniotic membrane stromal matrix. Br J Ophthalmol 2001 ; 85 : 444-9.
[58] Hao Y, Ma DH, Hwang DG, et al. Identification of antiangiogenic and antiinflammatory proteins in human amniotic membrane. Cornea 2000 ; 19 : 348-52.
[59] Joseph A, Dua HS, King AJ. Failure of amniotic membrane transplantation in the treatment of acute ocular burns. Br J Ophthalmol 2001 ; 85 : 1065-9.
[60] Gicquel JJ, Bejjani RA, Ellies P, et al. Amniotic membrane transplantation in severe bacterial keratitis. Cornea 2007 ; 26 : 27-33.
[61] Kuckelkorn R, Kottek A, Schrage N, et al. Long-term results of Tenon-plasty in treatment of severe chemical eye burns. Ophthalmologe 1995 ; 92 : 445-51.
[62] Stoiber J, Ruckhofer J, Muss W, Grabner G. Amniotic membrane transplantation with limbal stem cell transplantation as a combined procedure for corneal surface reconstruction after severe thermal or chemical burns. Ophthalmologe 2002 ; 99 : 839-48.
[63] Kenyon KR, Tseng SC. Limbal autograft transplantation for ocular surface disorders. Ophthalmology 1989 ; 96 : 709-22 ; discussion 22-3.
[64] Basti S, Mathur U. Unusual intermediate-term outcome in three cases of limbal autograft transplantation. Ophthalmology 1999 ; 106 : 958-63.
[65] Croasdale CR, Schwartz GS, Malling JV, Holland EJ. Keratolimbal allograft : recommendations for tissue procurement and preparation by eye banks, and standard surgical technique. Cornea 1999 ; 18 : 52-8.
[66] Fernandes M, Sangwan VS, Rao SK, et al. Limbal stem cell transplantation. Indian J Ophthalmol 2004 ; 52 : 5-22.
[67] Shimazaki J, Aiba M, Goto E, et al. Transplantation of human limbal epithelium cultivated on amniotic membrane for the treatment of severe ocular surface disorders. Ophthalmology 2002 ; 109 : 1285-90.
[68] Grueterich M, Espana EM, Touhami A, et al. Phenotypic study of a case with successful transplantation of ex vivo expanded human limbal epithelium for unilateral total limbal stem cell deficiency. Ophthalmology 2002 ; 109 : 1547-52.
[69] Rama P, Bonini S, Lambiase A, et al. Autologous fibrin-cultured limbal stem cells permanently restore the corneal surface of patients with total limbal stem cell deficiency. Transplantation 2001 ; 72 : 1478-85.
[70] Zakaria N, Koppen C, Van Tendeloo V, et al. Standardized limbal epithelial stem cell graft generation and transplantation. Tissue Eng Part C Methods 2010 ; 16 : 921-7.
[71] Nakamura T, Endo K, Cooper LJ, et al. The successful culture and autologous transplantation of rabbit oral mucosal epithelial cells on amniotic membrane. Invest Ophthalmol Vis Sci 2003 ; 44 : 106-16.
[72] Nakamura T, Inatomi T, Cooper LJ, et al. Phenotypic investigation of human eyes with transplanted autologous cultivated oral mucosal epithelial sheets for severe ocular surface diseases. Ophthalmology 2007 ; 114 : 1080-8.
[73] Gomes J, Monteiro BG, Melo GB, et al. Corneal reconstruction with tissue-engineered cell sheets composed of human immature dental pulp stem cells. Invest Ophthalmol Vis Sci 2010 ; 51 : 1408-14.
[74] Monteiro BG, Serafim RC, Melo GB, et al. Human immature dental pulp stem cells share key characteristic features with limbal stem cells. Cell Prolif 2009 ; 42 : 587-94.
[75] Ilari L, Daya SM. Long-term outcomes of keratolimbal allograft for the treatment of severe ocular surface disorders. Ophthalmology 2002 ; 109 : 1278-84.
[76] Yao YF, Zhang B, Zhou P, Jiang JK. Autologous limbal grafting combined with deep lamellar keratoplasty in unilateral eye with severe chemical or thermal burn at late stage. Ophthalmology 2002 ; 109 : 2011-7.
[77] Theng JT, Tan DT. Combined penetrating keratoplasty and limbal allograft transplantation for severe corneal burns. Ophthalmic Surg Lasers 1997 ; 28 : 765-8.
[78] Rao SK, Rajagopal R, Sitalakshmi G, Padmanabhan P. Limbal allografting from related live donors for corneal surface reconstruction. Ophthalmology 1999 ; 106 : 822-8.
[79] Daya SM, Ilari FA. Living related conjunctival limbal allograft for the treatment of stem cell deficiency. Ophthalmology 2001 ; 108 : 126-33, discussion 133-4.
[80] Tsubota K. Ocular surface management in corneal transplantation, a review. Jpn J Ophthalmol 1999 ; 43 : 502-8.
[81] Liang L, Sheha H, Tseng SC. Long-term outcomes of keratolimbal allograft for total limbal stem cell deficiency using combined immunosuppressive agents and correction of ocular surface deficits. Arch Ophthalmol 2009 ; 127 : 1428-34.
[82] Holland EJ, Croasdale CR. Epithelial transplantation for management of severe ocular surface disease. In : Brightbill FS. Ed. Corneal surgery : theory, technique, and tissue. 3rd ed. Mosby ; 1999, p. 488-99.
[83] Solomon A, Ellies P, Anderson DF, et al. Long-term outcome of keratolimbal allograft with or without penetrating keratoplasty for total limbal stem cell deficiency. Ophthalmology 2002 ; 109 : 1159-66.
[84] Lagnado R, King AJ, Donald F, Dua HS. A protocol for low contamination risk of autologous serum drops in the management of ocular surface disorders. Br J Ophthalmol 2004 ; 88 : 464-5.
[85] Sloper CM, Powell RJ, Dua HS. Tacrolimus (FK506) in the management of high-risk corneal and limbal grafts. Ophthalmology 2001 ; 108 : 1838-44.
[86] Artz MA, Boots JM, Ligtenberg G, et al. Conversion from cyclosporine to tacrolimus improves quality-of-life indices, renal graft function and cardiovascular risk profile. Am J Transplant 2004 ; 4 : 937-45.
[87] Bouchard CS, Morno K, Perkins J, et al. Ocular complications of thermal injury : a 3-year retrospective. J Trauma 2001 ; 50 : 79-82.
[88] Merle H, Gerard M, Schrage N. Ocular burns. J Fr Ophtalmol 2008 ; 31 : 723-34.
[89] Lagoutte F. Traumatismes et brûlures. L’épithélium cornéen. Rapport de la Société française d’ophtalmologie. Paris : Masson ; 1993, p. 203-15.
[90] Dua HS, Saini JS, Azuara-Blanco A, Gupta P. Limbal stem cell deficiency : concept, aetiology, clinical presentation, diagnosis and management. Indian J Ophthalmol 2000 ; 48 : 83-92.
[91] Tsai RJ, Tseng SC. Effect of stromal inflammation on the outcome of limbal transplantation for corneal surface reconstruction. Cornea 1995 ; 14 : 439-49.
[92] Schultz G, Khaw PT, Oxford K, et al. Growth factors and ocular wound healing. Eye (Lond) 1994 ; 8 : 184-7.
[93] Samson CM, Nduaguba C, Baltatzis S, Foster CS. Limbal stem cell transplantation in chronic inflammatory eye disease. Ophthalmology 2002 ; 109 : 862-8.
[94] Brignole F, De Saint-Jean M, Goldschild M, et al. Expression of Fas-Fas ligand antigens and apoptotic marker APO2.7 by the human conjunctival epithelium. Positive correlation with class II HLA DR expression in inflammatory ocular surface disorders. Exp Eye Res 1998 ; 67 : 687-97.
[95] Puangsricharern V, Tseng SC. Cytologic evidence of corneal diseases with limbal stem cell deficiency. Ophthalmology 1995 ; 102 : 1476-85.
[96] Baudouin C, Brignole F, Becquet F, et al. Flow cytometry in impression cytology specimens. A new method for evaluation of conjunctival inflammation. Invest Ophthalmol Vis Sci 1997 ; 38 : 1458-64.
[97] Brignole F, Pisella PJ, Goldschild M, et al. Flow cytometric analysis of inflammatory markers in conjunctival epithelial cells of patients with dry eyes. Invest Ophthalmol Vis Sci 2000 ; 41 : 1356-63.
[98] Nelson JD, Havener VR, Cameron JD. Cellulose acetate impressions of the ocular surface. Dry eye states. Arch Ophthalmol 1983 ; 101 : 1869-72.
[99] Gicquel JJ, Lami MC, Catier A, et al. Limbal stem cell deficiency associated with KID syndrome, about a case. J Fr Ophtalmol 2002 ; 25 : 1061-4.
[100] Dellambra E, Pellegrini G, Guerra L, et al. Toward epidermal stem cell-mediated ex vivo gene therapy of junctional epidermolysis bullosa. Hum Gene Ther 2000 ; 11 : 2283-7.
M. Cassagne, P. Fournié, F. Malecaze
Le kératocône, maladie bilatérale et progressive de la cornée antérieure, va concerner la surface oculaire à plusieurs titres.
Sur le plan physiopathologique, des facteurs environnementaux tels que le frottement oculaire et l’allergie sur un terrain génétique prédisposant vont déclencher des modifications : déséquilibre des protéinases de surface, changement de l’insertion des fibres de collagène, mise en jeu de la voie de signalisation du monoxyde d’azote et de cytokines inflammatoires. Le mécanisme exact conduisant à l’observation de toutes ces modifications n’est pas encore élucidé mais se situe vraisemblablement au carrefour interactif de la surface oculaire.
Le retentissement clinique se caractérise essentiellement par une diminution du BUT, une fréquence élevée de kératite ponctuée superficielle et une hypoesthésie cornéenne, qui apparaissent dès les stades de kératocône fruste et sont d’autant plus sévères que la maladie est évoluée. Ces atteintes peuvent être étayées par l’observation de modifications des empreintes conjonctivales et de la morphologie des nerfs en microscopie confocale.
Les différentes options de prise en charge vont intervenir sur la surface oculaire à tous les stades de la maladie, des lentilles rigides à la kératoplastie lamellaire antérieure profonde en passant par la pose d’anneaux intracornéens ou la réalisation d’un crosslinking du collagène cornéen, même si les dernières avancées tentent d’être moins délétères sur la surface en proposant des techniques transépithéliales.
Le kératocône est une pathologie cornéenne étroitement liée à la surface oculaire du fait de l’ensemble des pistes physiopathologiques suspectées, de l’aspect clinique, mais aussi des différentes techniques utilisées pour sa prise en charge qui vont retentir sur cette surface.
Malgré des recherches considérables, le kératocône reste une maladie mystérieuse dont la physiopathogénie exacte n’a pas encore été élucidée. Les facteurs environnementaux comme le frottement des yeux [1] ou l’allergie [2] jouent vraisemblablement un rôle important. L’implication de la génétique ne fait aucun doute, comme en témoigne la fréquence des formes familiales [3]. Le kératocône est donc probablement une maladie multifactorielle.
L’anatomopathologie du kératocône est en revanche connue. Plusieurs observations histologiques ont démontré notamment une dégradation de la membrane basale de l’épithélium cornéen et un amincissement du stroma cornéen (fig. 12-65). L’épithélium cornéen est lui aussi modifié. Le nombre de couches cellulaires qui le composent varie de l’apex à la base du cône en sorte de compenser, au moins partiellement, l’irrégularité stromale. Il est de fait aminci en regard du sommet du cône et épaissi sur les bases [4].
Les études expérimentales physiopathologiques, menées pour tenter de comprendre la genèse du kératocône peuvent schématiquement être classées en quatre groupes.
La première approche est morphologique. Meek et al. [5], utilisant la diffraction des rayons X, suggèrent un déroulement des fibres de collagène et un glissement des lamelles entre elles. D’autres travaux, utilisant la microscopie de génération de seconde harmonique, incriminent l’insertion des faisceaux de collagène dans la couche de Bowman [6].
Une deuxième approche expérimentale de biochimie et de biologie cellulaire a consisté à incriminer certaines protéines « candidates » dont le rôle physiologique laissait supposer leur implication. L’amincissement stromal pourrait être le fruit d’une perte des constituants structurels (collagènes de types XIII [7], XV, XVIII et des protéoglycanes) ou la conséquence d’une dégradation excessive du stroma par une augmentation des enzymes protéolytiques (métalloprotéinases) [8] et une diminution de leurs inhibiteurs [9]. Une étude récente suggère une corrélation entre le taux de certaines protéinases et le stade topographique du kératocône [10]. Néanmoins, les études sur ce sujet donnent des résultats souvent contradictoires.
D’autres travaux plus récents suggèrent une dérégulation de la réponse au stress oxydant via la voie de signalisation du monoxyde d’azote (NO) [11].
Certains ont évoqué le rôle possible de cytokines inflammatoires, faisant reconsidérer le caractère non inflammatoire historique de la maladie. Les modifications moléculaires concernent l’expression de médiateurs de l’inflammation tels que les cytokines pro-inflammatoires et les molécules de l’adhésion cellulaire [10].
La troisième approche globale, dite « omique », est intéressante car elle a l’ambition d’identifier la cause du kératocône sans qu’il soit nécessaire d’avoir une idée préconçue sur sa physiopathologie. Le principe est de comparer les cornées atteintes à des cornées saines, à l’un des stades de la « machinerie cellulaire » : ADN (génomique), ARN (transcriptomique), ou protéine (protéomique). En utilisant cette stratégie, nous avons récemment montré que le kératocône pourrait être lié à une dérégulation des voies de la prolifération et de la différenciation cellulaire. Il a également été observé une différence d’expression de certaines protéines (composant de la matrice, cytokératine, etc.) tant au niveau épithélial que stromal [12, 13] ou dans les larmes (déséquilibre enzymatique [14], augmentation de produits de dégradation du collagène [15]).
La quatrième approche est l’étude d’un modèle animal expérimental. Même si le plus séduisant est un modèle d’invalidation génique d’une protéine de la matrice extracellulaire, on ne dispose pas à l’heure actuelle d’un modèle animal pertinent de kératocône.
Ces différentes approches expérimentales classiques, certes intéressantes, n’ont cependant pas permis d’élucider les mécanismes moléculaires à l’origine du kératocône, mais les dernières avancées s’orientent vers une interaction cornée/surface oculaire, carrefour intéressant pouvant faire la jonction entre les causes environnementales et le développement d’anomalies du stroma cornéen sous-jacent.
Fig. 12-65 Représentation schématique de l’histologie de la cornée normale (à gauche) et des événements observés dans une cornée de patient atteint de kératocône (à droite).
Sur le plan fonctionnel et en dehors des symptômes réfractifs, les patients atteints d’un kératocône se plaignent d’irritation, de fatigue oculaire ou de sensation de corps étrangers dans plus de 80 % des cas [16].
À l’interrogatoire, le praticien doit s’efforcer de rechercher les facteurs environnementaux favorisants tels que le frottement oculaire, l’atopie et l’allergie oculaire afin d’y sensibiliser le patient et d’en réduire le retentissement sur la progression du kératocône.
Sur le plan physique, des altérations de la surface oculaire peuvent être observées dans le kératocône.
Le break-up time (BUT) est abaissé chez les patients kératocôniques (6,8 secondes en moyenne) par rapport aux sujets normaux (14,5 secondes en moyenne). Soixante-dix pour cent des sujets atteints présentent un BUT anormal (< 10 secondes) versus aucun des patients contrôles [16].
Les scores de prise de fluorescéine et de rose Bengale sont plus élevés chez les porteurs d’un kératocône. Quarante-six pour cent des patients kératocôniques présentent une kératite ponctuée superficielle (diffuse dans 57 % des cas et interpalpébrale dans 43 % des cas) alors qu’aucune prise de colorant n’est observée dans une population contrôle de même âge [16].
Ces anomalies peuvent par ailleurs gêner la réalisation des topographies cornéennes diagnostiques ou de suivi de bonne qualité, qu’il faudra alors savoir répéter, notamment après amélioration de la prise en charge de la surface oculaire.
La sensibilité cornéenne est diminuée chez les patients atteints de kératocône mais aussi chez ceux porteurs d’un kératocône fruste [16–18]. Cette hyposensibilité est retrouvée en moyenne chez un patient sur deux. Plus le kératocône est avancé, plus l’atteinte de la sensibilité cornéenne est sévère [16]. Cette hyposensibilité n’est pas liée au port de lentilles de contact car la différence reste statistiquement significative entre une population de patients kératocôniques équipés en lentilles de contact et une population « contrôle » également porteuse de lentilles [19].
Les études sur le test de Schirmer sont contradictoires : certaines rapportent un test de Schirmer II plus bas dans le kératocône (6,9 ± 5,3 mm) et le kératocône fruste (7,6 ± 4,9 mm) par rapport à des sujets témoins (11,8 ± 7 mm) [17], alors que d’autres ne constatent pas de différence statistiquement significative avec une population contrôle (14,6 ± 5,4 mm versus 16,6 ± 5,1 mm, p>0,001) [16].
Cependant, plus le kératocône est avancé, plus l’atteinte de la surface oculaire est sévère [16].
Sur le plan des explorations complémentaires, les anomalies relevées sur les empreintes conjonctivales sont là aussi d’autant plus importantes que le stade du kératocône est avancé [17]. Une métaplasie squameuse de la conjonctive et une diminution des cellules à mucus sont constatées dans le kératocône et le kératocône fruste [16].
En revanche, l’osmolarité des larmes ne serait pas modifiée dans le kératocône [17]. Les patients porteurs d’un kératocône ne présentent pas davantage de blépharite, de dysfonctionnement des glandes de Meibomius ou de conjonctivite par rapport à une population dite normale du même âge [16].
Enfin, la microscopie confocale a permis de mettre en évidence in vivo une diminution de la densité des nerfs au centre, sous la membrane basale et dans le stroma. De plus, la morphologie de ces nerfs est anormale : ils sont plus épais, plus tortueux et présentent des boucles au sommet du cône [19].
La prise en charge du kératocône dépend du stade et de l’évolutivité de cette pathologie (fig. 12-66). En l’absence de progression et aux stades les moins avancés (stades 1 à 3 de la classification de Krumeich [20]) dans lesquels la transparence cornéenne est encore préservée et l’acuité visuelle corrigée acceptable, seront privilégiés la réhabilitation optique, la prévention des facteurs aggravants (tels que le frottement oculaire et l’allergie) et le traitement des anomalies de la surface oculaire (par agents mouillants non conservés essentiellement). La réhabilitation optique se fait par lentilles rigides perméables aux gaz (LRPG) le plus souvent, mais elle est possible en lentilles souples (aux stades précoces), en piggy-back ou encore en verres scléraux. La tolérance des lentilles de contact est d’autant meilleure que la sensibilité cornéenne est diminuée [19]. Une excellente adaptation est indispensable afin d’éviter des zones d’appui et de conflit, source d’aggravation du kératocône et de fibrose. L’analyse de la surface oculaire et de l’image fluoroscopique sous LRPG est donc primordiale et sera développée dans un chapitre dédié.
Quand l’acuité visuelle corrigée devient insuffisante, la prise en charge reposera sur des techniques plus invasives telles que la pose d’anneaux intracornéens (AIC) ou d’implants intra-oculaires phaques. L’introduction de tels implants, pour des astigmatismes réguliers au centre, ne va concerner que peu de patients, avec un retentissement négligeable sur la surface et ne sera donc pas développée ici. Aux stades les plus avancés (stade 4 de la classification de Krumeich) au cours desquels la transparence de la cornée n’est plus conservée, le traitement reposera sur la réalisation de greffe de cornée.
Enfin, quel que soit le stade et si la cornée reste transparente et suffisamment épaisse, une progression avérée du kératocône devra faire réaliser un crosslinking du collagène cornéen (CXL).
Or, la plupart de ces techniques vont pouvoir retentir sur la surface oculaire et en modifier les caractéristiques.
Fig. 12-66 Schématisation de la prise en charge du kératocône.
AV : acuité visuelle ; CXL : crosslinking du collagène cornéen ; LRPG : lentilles rigides perméables aux gaz ; IOL : implant intra-oculaire.
La pose d’AIC est une technique qui permet d’aplanir le sommet du cône et donc de diminuer l’astigmatisme irrégulier et les aberrations de haut degré. Elle est proposée quand la transparence cornéenne est toujours conservée et si l’épaisseur cornéenne sur le trajet de l’anneau est supérieure à 400 µm. L’amélioration de la qualité visuelle repose donc sur un remodelage mécanique de la cornée qui peut être complété par une adaptation en lentille. Les résultats retrouvent en moyenne un gain d’acuité visuelle dans 80 % des cas avec une diminution de l’équivalent sphérique de trois dioptries et de la kératométrie de quatre dioptries [21, 22].
Les complications observées après la pose d’AIC sont le reflet de leur retentissement sur la surface oculaire. Les principales complications postopératoires sont représentées par un œdème stromal péri-incisionnel, l’extrusion ou la migration des AIC (fig. 12-67), une kératite infectieuse ou encore des dépôts autour de l’AIC. La nécrose ou kératite aseptique stromale en regard des AIC ainsi que les douleurs chroniques liées au contact des AIC avec les nerfs cornéens sont réversibles à l’ablation du matériel [23, 24].
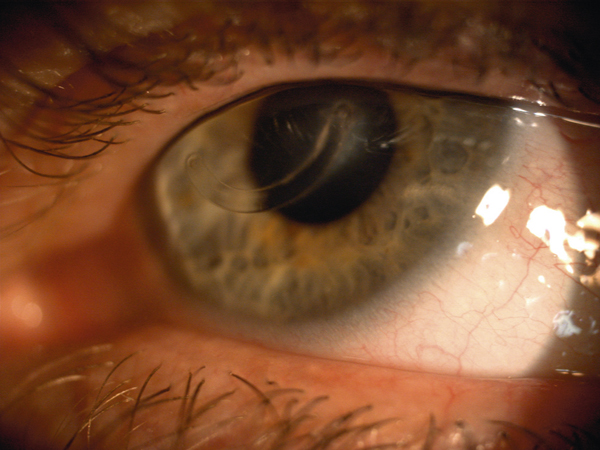
Fig. 12-67 Extrusion d’un anneau intracornéen sur nécrose stromale chez un patient atteint de kératocône.
En dehors de la réhabilitation visuelle, la prise en charge repose sur la stabilisation du kératocône. Le seul traitement actuellement efficace pour stopper la progression est le CXL, qui permettrait ainsi de diminuer le recours à la greffe [25]. Le dépistage des formes évolutives est donc essentiel pour proposer un traitement précoce par CXL. De plus, le CXL peut être combiné avec les techniques de réhabilitation visuelle telles que la pose d’AIC.
Après un traitement par CXL, des médiateurs des larmes sont modifiés : Kolozsvári et al. [26] ont montré en postopératoire précoce que l’IL-6 et l’IL-8 sont augmentées alors que l’IL-13, l’IL-17A, le NGF, l’EGF, l’INF-γ sont diminués. Après 6 mois, il existe une corrélation entre le taux de ces médiateurs et les modifications des topographies cornéennes. En revanche, le CXL n’aurait pas d’influence sur le syndrome sec clinique [27].
Après CXL, il existe une aggravation de l’hypoesthésie cornéenne avec un retour progressif aux valeurs préopératoires en 3 mois [28]. La microscopie confocale a permis de confirmer une disparition immédiate des nerfs dans le stroma antérieur après un CXL conventionnel, mais l’aspect est beaucoup plus controversé après un CXL transépithélial [19].
Le taux d’échec, défini par une augmentation de plus d’une dioptrie de la kératométrie maximale sur un an, est en moyenne de 8 à 10 % [29].
Le taux d’effets indésirables est d’environ 3 % (1 à 10 % selon les études) [29, 30]. La majorité des complications sont liées à la désépithélialisation, étape pourtant indispensable à la pénétration de la riboflavine. Les principales sont le pseudo-haze, cicatrice cornéenne antérieure transitoire (fig. 12-68) responsable d’une baisse d’acuité visuelle réversible dans les trois premiers mois [31], et les kératites infectieuses [32].
Une technique de CXL préservant l’épithélium permettrait d’éviter la majorité de ces complications de surface. Actuellement, la plupart des études pour améliorer la procédure vise donc soit à s’affranchir de la désépithélialisation, soit à modifier le temps ou le profil d’irradiation par les UVA.
Les premières tentatives pour faire pénétrer la riboflavine à travers l’épithélium en modifiant sa formulation ou en y associant des molécules « facilitatrices » (enhancers) ont donné des résultats contradictoires et globalement avec une moindre pénétration. Une autre procédure de CXL transépithélial en cours d’évaluation est la iontophorèse durant laquelle le faible courant électrique appliqué facilite la pénétration de la riboflavine ionisée à travers la cornée.
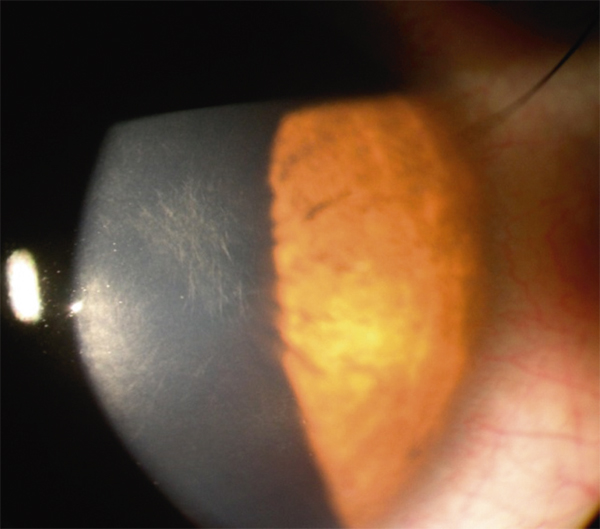
Fig. 12-68 Pseudo-haze après un crosslinking du collagène cornéen pour kératocône évolutif.
En dernier recours, lorsque la transparence cornéenne n’est plus préservée et/ou la meilleure acuité visuelle corrigée (MAVC) trop faible malgré toutes les autres techniques de réhabilitation, une greffe de cornée peut être proposée. Cette greffe sera, en première intention, lamellaire antérieure profonde et convertie en greffe transfixiante seulement en cas d’échec. L’impact sur la surface oculaire est donc majeur, tant par les complications épithéliales potentielles que par la iatrogénie médicamenteuse introduite en postopératoire ou encore par la zone de fragilité que représente la transition donneur/receveur. Cette relation entre greffe de cornée et surface oculaire fait donc l’objet d’un chapitre à part entière et ne sera pas développée ici.
En conclusion, le rôle de la surface oculaire est important à prendre en compte à tous les stades du kératocône, que ce soit à l’étape diagnostique ou lors des diverses méthodes de prise en charge thérapeutique, mais également dans le domaine de la recherche afin de mieux en identifier la physiopathologie. En effet, préserver cette surface oculaire intervient probablement favorablement dans l’évolution de la maladie.
[1] McMonnies CW, Boneham GC. Keratoconus, allergy, itch, eye-rubbing and hand-dominance. Clin Exp Optom 2003 ; 86 : 376-84.
[2] Harrison RJ, Klouda PT, Easty DL, et al. Association between keratoconus and atopy. Br J Ophthalmol 1989 ; 73 : 816-22.
[3] Tuft SJ, Hassan H, George S, et al. Keratoconus in 18 pairs of twins. Acta Ophthalmologica 2012 ; 90 : e482-6.
[4] Sandali O, El Sanharawi M, Temstet C, et al. Fourier-domain optical coherence tomography imaging in keratoconus : a corneal structural classification. Ophthalmology 2013 ; 120 : 2403-12.
[5] Meek KM, Tuft SJ, Huang Y, et al. Changes in collagen orientation and distribution in keratoconus corneas. Invest Ophthalmol Vis Sci 2005 ; 46 : 1948-56.
[6] Morishige N, Wahlert AJ, Kenney MC, et al. Second-harmonic imaging microscopy of normal human and keratoconus cornea. Invest Ophthalmol Vis Sci 2007 ; 48 : 1087-94.
[7] Maatta M, Vaisanen T, Vaisanen MR, et al. Altered expression of type XIII collagen in keratoconus and scarred human cornea : Increased expression in scarred cornea is associated with myofibroblast transformation. Cornea 2006 ; 25 : 448-53.
[8] Zhou L, Sawaguchi S, Twining SS, et al. Expression of degradative enzymes and protease inhibitors in corneas with keratoconus. Invest Ophthalmol Vis Sci 1998 ; 39 : 1117-24.
[9] Sawaguchi S, Twining SS, Yue BY, et al. Alpha 2-macroglobulin levels in normal human and keratoconus corneas. Invest Ophthalmol Vis Sci 1994 ; 35 : 4008-14.
[10] Kolozsvari BL, Petrovski G, Gogolak P, et al. Association between mediators in the tear fluid and the severity of keratoconus. Ophthalmic Res 2014 ; 51 : 46-51.
[11] Arnal E, Peris-Martinez C, Menezo JL, et al. Oxidative stress in keratoconus ? Invest Ophthalmol Vis Sci 2011 ; 52 : 8592-7.
[12] Joseph R, Srivastava OP, Pfister RR. Differential epithelial and stromal protein profiles in keratoconus and normal human corneas. Exp Eye Res 2011 ; 92 : 282-98.
[13] Chaerkady R, Shao H, Scott SG, et al. The keratoconus corneal proteome : loss of epithelial integrity and stromal degeneration. J Proteomics 2013 ; 87 : 122-31.
[14] Balasubramanian SA, Wasinger VC, Pye DC, Willcox MD. Preliminary identification of differentially expressed tear proteins in keratoconus. Molecular Vision 2013 ; 19 : 2124-34.
[15] Abalain JH, Dossou H, Colin J, Floch HH. Levels of collagen degradation products (telopeptides) in the tear film of patients with keratoconus. Cornea 2000 ; 19 : 474-6.
[16] Dogru M, Karakaya H, Ozcetin H, et al. Tear function and ocular surface changes in keratoconus. Ophthalmology 2003 ; 110 : 1110-8.
[17] Cho KJ, Mok JW, Choi MY, et al. Changes in corneal sensation and ocular surface in patients with asymmetrical keratoconus. Cornea 2013 ; 32 : 205-10.
[18] Zabala M, Archila EA. Corneal sensitivity and topogometry in keratoconus. CLAO J 1988 ; 14 : 210-2.
[19] Spadea L, Salvatore S, Vingolo EM. Corneal sensitivity in keratoconus : a review of the literature. ScientificWorldJournal 2013 ; 2013 : 683090.
[20] Krumeich JH, Daniel J, Knulle A. Live-epikeratophakia for keratoconus. J Cataract Refract Surg 1998 ; 24 : 456-63.
[21] Ferrara G, Torquetti L, Ferrara P, Merayo-Lloves J. Intrastromal corneal ring segments : visual outcomes from a large case series. Clin Experiment Ophthalmol 2012 ; 40 : 433-9.
[22] Ertan A, Kamburoglu G. Intacs implantation using a femtosecond laser for management of keratoconus : Comparison of 306 cases in different stages. J Cataract Refract Surg 2008 ; 34 : 1521-6.
[23] Randleman JB, Dawson DG, Larson PM, et al. Chronic pain after Intacs implantation. J Cataract Refract Surg 2006 ; 32 : 875-8.
[24] McAlister JC, Ardjomand N, Ilari L, et al. Keratitis after intracorneal ring segment insertion for keratoconus. J Cataract Refract Surg 2006 ; 32 : 676-8.
[25] Arne JL, Fournie P. [Keratoconus, the most common corneal dystrophy. Can keratoplasty be avoided ?]. Bull Acad Natil Mede 2011 ; 195 : 113-29.
[26] Kolozsvari BL, Berta A, Petrovski G, et al. Alterations of tear mediators in patients with keratoconus after corneal crosslinking associate with corneal changes. PloS one 2013 ; 8 : e76333.
[27] Taneri S, Oehler S, Asimellis G, Kanellopoulos AJ. Influence of corneal cross-linking for keratoconus on several objective parameters of dry eye. J Refract Surg 2013 ; 29 : 612-6.
[28] Lago Ade M, Nassaralla BR, Stival LR, Nassaralla Junior JJ. Changes in corneal sensitivity following cross-linking for progressive early-stage keratoconus. Arq Bras Oftalmol 2014 ; 77 : 84-7.
[29] Sloot F, Soeters N, van der Valk R, Tahzib NG. Effective corneal collagen crosslinking in advanced cases of progressive keratoconus. J Cataract Refract Surg 2013 ; 39 : 1141-5.
[30] Koller T, Mrochen M, Seiler T. Complication and failure rates after corneal crosslinking. J Cataract Refract Surg 2009 ; 35 : 1358-62.
[31] Greenstein SA, Fry KL, Bhatt J, Hersh PS. Natural history of corneal haze after collagen crosslinking for keratoconus and corneal ectasia : Scheimpflug and biomicroscopic analysis. J Cataract Refract Surg 2010 ; 36 : 2105-14.
[32] Sharma N, Maharana P, Singh G, Titiyal JS. Pseudomonas keratitis after collagen crosslinking for keratoconus : case report and review of literature. J Cataract Refract Surg 2010 ; 36 : 517-20.
- Chapitre 12
Pathologies spécifiques- I - Surface oculaire et glaucome
- II - Iatrogénie des traitements systémiques
- III - Pollution extérieure et surface oculaire
- IV - Surface oculaire et greffes de cornée
- V - Pathologies tropicales et surface oculaire
- VI - Surface oculaire et chirurgie réfractive
- VII - Le ptérygion
- IX - Surface oculaire et kératocône