Œdème maculaire et pathologies de l’interface vitréomaculaire
Coordonné par J.-F. Korobelnik
J.-P. Berrod
➤ L’association d’un œdème maculaire (OM) à une membrane épimaculaire est fréquente ; elle va du simple épaississement diffus à la présence de kystes intrarétiniens et d’un décollement séreux rétinien.
➤ L’OM peut être initial ou apparaître secondairement après la vitrectomie.
➤ La présence de kystes intrarétiniens doit faire éliminer une pathologie associée (dégénérescence maculaire liée à l’âge compliquée de néovaisseaux, occlusion de branche veineuse par exemple).
➤ La présence d’un OM préopératoire ne semble pas assombrir le pronostic fonctionnel postopératoire.
➤ Un OM peut apparaître après la vitrectomie ; il régresse spontanément dans la majorité des cas. S’il se chronicise, il peut être traité par injections sous-conjonctivales ou intravitréennes de corticoïdes.
L’œdème microkystique de la macula (OMM) est défini par la présence de microkystes localisés préférentiellement au niveau de la couche nucléaire interne [1]. Les espaces optiquement vides sont de forme carrée ou rectangulaire avec au moins un côté concave (fig. 13-1a). N’ayant pas de paroi évidente, ils justifient le qualificatif de « pseudo-kyste » [2].
Les membranes épimaculaires (MEM) sont des proliférations fibrocellulaires non vascularisées se développant à la surface de la rétine maculaire. Elles sont idiopathiques ou associées aux déchirures rétiniennes, à la rétinopathie diabétique, aux occlusions veineuses, à la dégénérescence maculaire ou aux uvéites. Selon la sévérité de la prolifération et de la traction, les MEM entraînent des plis et une déformation limitée à la rétine interne ou étendue à la rétine externe induisant un décollement par traction (fig. 13-2a et 13-3a).
L’aspect ophtalmoscopique des MEM varie de la maculopathie cellophane avec reflet à peine visible à la striation ondulée et étendue de la rétine interne accompagnée d’une tortuosité vasculaire.
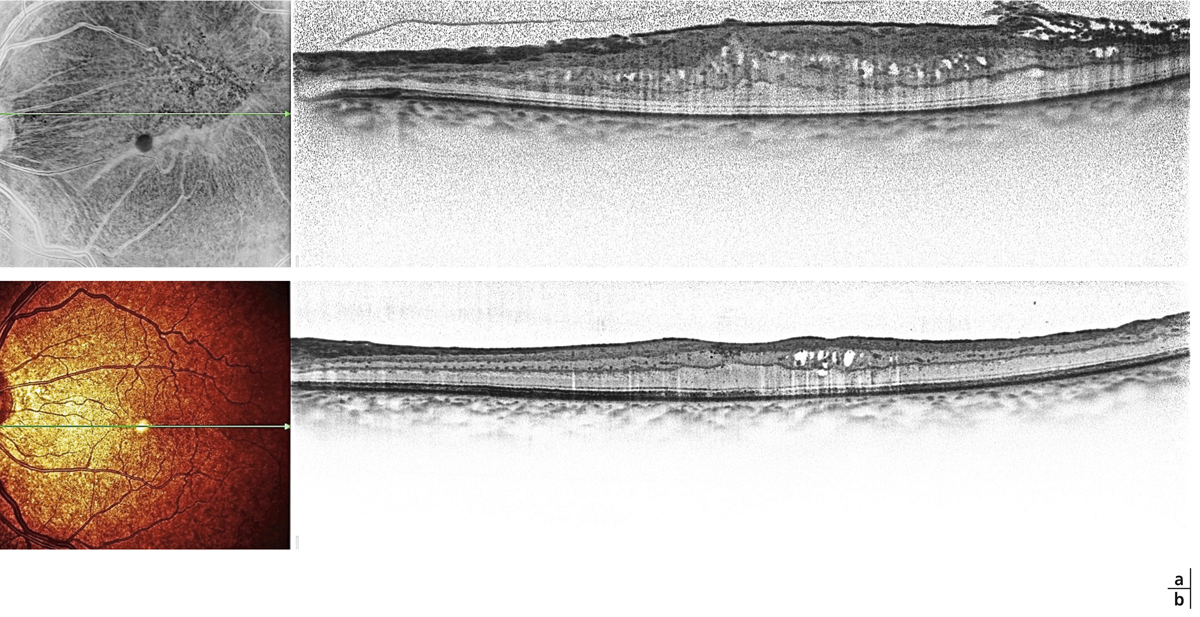
Fig. 13-1 Membrane épimaculaire épaisse avec plis de pleine épaisseur en temporal inférieur.
a. Aspect préopératoire objectivant des cavités pseudo-kystiques dans la couche nucléaire interne. b. Aspect postopératoire montrant un déplissement de la rétine avec disparition des microkystes dans la portion interpapillomaculaire. Les kystes persistent en temporal dans la zone épaissie par la membrane.

Fig. 13-2 Membrane épimaculaire épaisse avec pseudo-trou maculaire.
a. Pli de pleine épaisseur en temporal et cavités kystiques de la couche nucléaire externe en interpapillomaculaire. b. Aspect postopératoire montrant la régression du pseudo-trou maculaire et des kystes de la nucléaire externe.
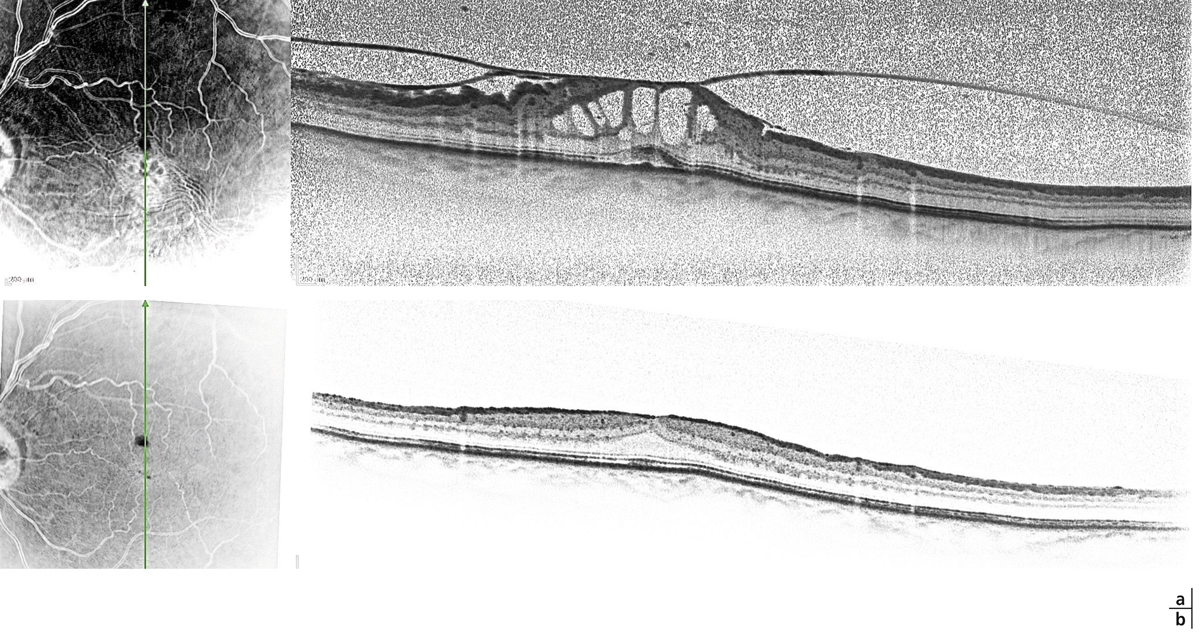
Fig. 13-3 Membrane avec traction vitréomaculaire.
a. Adhérence vitréomaculaire avec membrane épimaculaire et plissement de la limitante interne. On note de volumineuses cavités kystiques périfovéolaires (œdème cystoïde) associées à un décollement séreux sous-fovéolaire avec interruption de la ligne ellipsoïde. b. Aspect post-vitrectomie–pelage montrant une disparition complète de l’œdème cystoïde et une diminution de l’épaisseur maculaire. La continuité de la ligne ellipsoïde est rétablie.
L’œdème maculaire des membranes peut être initial ou secondaire au pelage. Les membranes les plus actives sont responsables d’un épaississement rétinien visible et mesurable en tomographie à cohérence optique (optical coherence tomography ou OCT) qui peut être assimilé à un œdème intrarétinien diffus lorsqu’il dépasse 300 µ en spectral-domain optical coherence tomography (SD-OCT). La contraction d’une MEM entourant la fovéa modifie ses contours, formant un pseudo-trou éventuellement associé à des cavités kystiques de la nucléaire interne ou externe objectivées en OCT (fig. 13-2). Il est difficile de préciser si l’œdème est la cause de la membrane ou la conséquence de la traction exercée sur la limitante interne [3]. La MEM peut être associée à des hémorragies, ou à des nodules cotonneux témoignant d’une altération du flux axoplasmique dans les fibres optiques. Dans les formes marquées d’œdème, on retrouve sur l’OCT des pseudo-kystes dans la couche nucléaire interne (fig. 13-1) pouvant se propager à la couche nucléaire externe ou s’associer à un décollement séreux rétinien témoignant d’un œdème avancé (fig. 13-3 et 13-4) [4].
On distingue les MEM présentant un œdème initial visible en OCT, sous la forme de kystes des couches internes ou de schisis tractionnel de la nucléaire externe (fig. 13-1 à 13-3), des membranes qui se compliquent d’un œdème post-pelage (fig. 13-4). Compte tenu de la multiplicité des présentations et en l’absence de définition univoque, le tableau de l’œdème maculaire cliniquement significatif représente une forme clinique à rechercher lors de l’évaluation des résultats du pelage. Il s’agit d’une baisse d’acuité visuelle objective ou subjective associée à un épaississement rétinien et à la présence de cavités kystiques visibles en OCT au niveau des couches internes ou externes de la rétine [5].
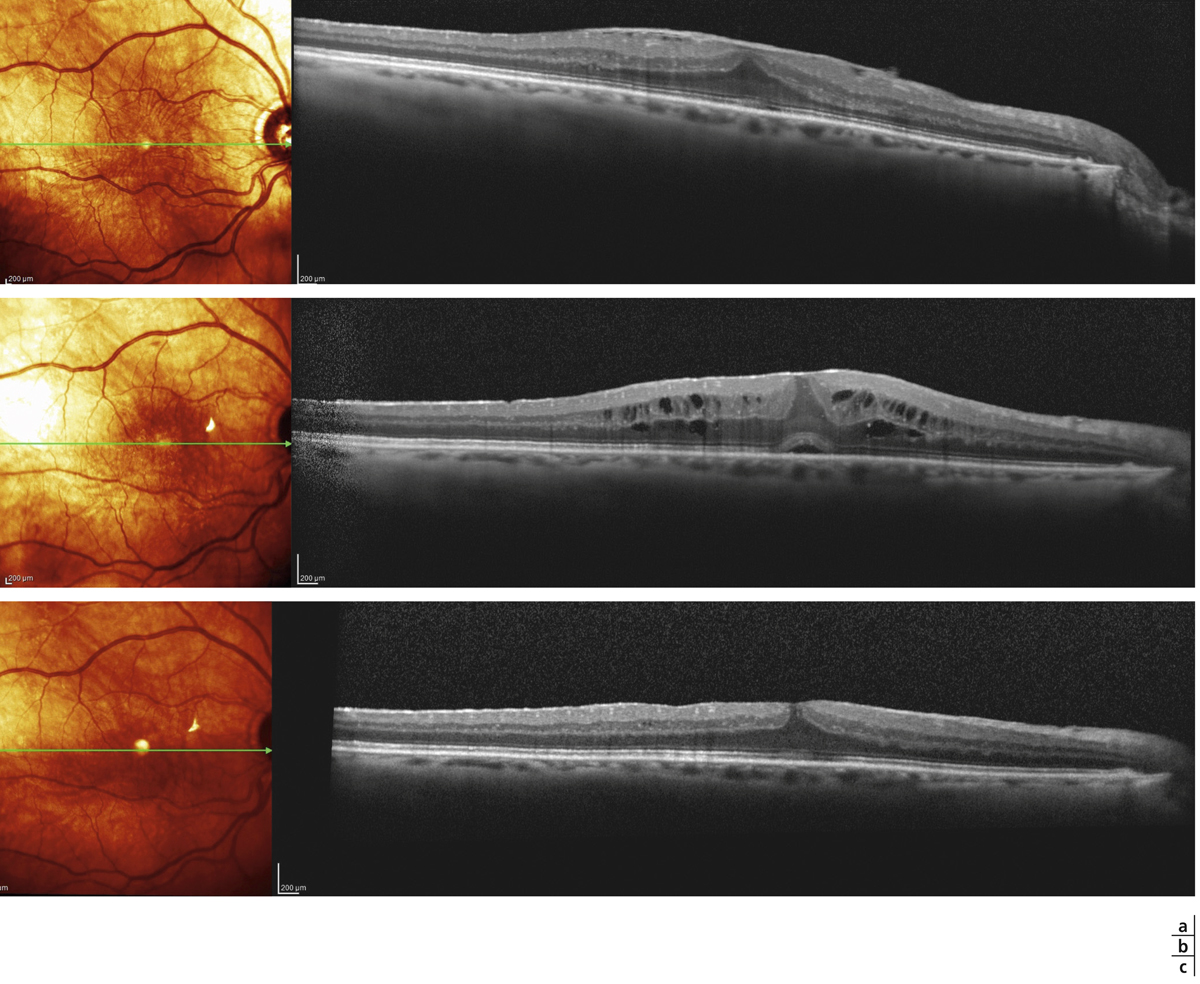
Fig. 13-4 Membrane épimaculaire peu évoluée débutant sur la fovéa.
a. Épaississement diffus à 420 µ avec plis de la surface sans œdème microkystique. b. Aspect post-vitrectomie objectivant à M1 un important œdème microkystique de la nucléaire interne et externe avec début de décollement séreux fovéolaire. c. Récupération anatomique et fonctionnelle satisfaisante 2 mois après injection sous-conjonctivale de 8 mg d’acétate de triamcinolone.
Peu d’études renseignent sur la fréquence de l’œdème maculaire initial ou postopératoire dans les MEM. Cela tient au fait qu’il n’y a pas de définition unique concernant l’œdème des MEM, ni de recommandations pour le rechercher et l’évaluer. L’angiographie à la fluorescéine objective chez certains patients des zones de diffusion, mais elle ne fait pas partie du bilan standard des MEM. L’OCT réalisée en cas de syndrome maculaire permet d’objectiver la MEM, d’apprécier le profil fovéolaire et de mesurer l’épaisseur des différentes couches ainsi que l’épaisseur totale de la macula. L’œdème est généralement défini par un gonflement de la macula associé à un effacement ou une inversion de la dépression fovéolaire. Dans une étude prospective sur l’incidence de l’œdème maculaire postopératoire, la définition reposait sur un épaississement rétinien supérieur à 272 µ en time-domain optical coherence tomography (TD-OCT) [6], alors que dans des études plus récentes les auteurs recherchaient la présence de pseudo-kystes de la nucléaire interne en SD-OCT [7], ou l’épaississement total de la rétine associé à une modification subjective ou objective de l’acuité visuelle [5]. Cette variabilité dans les définitions et dans les types d’études explique que la fréquence de l’œdème postopératoire dans les membranes idiopathiques varie de 100 à 13,63 % [6–8]. Une étude de cohorte à propos de 1303 patients ayant bénéficié d’un OCT avant toute intervention a retrouvé un OMM initial chez 10 % des patients. L’OMM était secondaire à une membrane chez 1,88 % des patients de la cohorte [4].
L’œdème est le résultat de l’accumulation de fluide dans les couches rétiniennes au sein de la fovéa. Il est responsable d’un épaississement rétinien qui caractérise également la membrane épirétinienne. Il peut être lié à la traction induite par la membrane sur les capillaires rétiniens responsables d’une rupture de la barrière hémato-rétinienne interne, mais également à une souffrance des cellules bipolaires ou des photorécepteurs, secondaire à la prolifération gliale induite par l’inflammation, l’ischémie ou la traction. Il s’agit donc le plus souvent d’un œdème extracellulaire. Les tractions chroniques sur les cellules bipolaires ou ganglionnaires peuvent engendrer un œdème intracellulaire conduisant à une dégénérescence kystique de la couche nucléaire interne [9].
L’œdème peut également compliquer le pelage de la membrane limitante interne. Des kystes apparaissent au niveau des couches internes et externes dans les suites immédiates de la vitrectomie ou de manière retardée vers le 3e mois postopératoire (fig. 13-4) [9]. L’œdème peut également être secondaire à une pathologie vasculaire comme le diabète, l’occlusion veineuse, la dégénérescence maculaire néovasculaire ou compliquer une uvéite, toutes ces affections s’associant fréquemment aux membranes épimaculaires. Enfin l’œdème complique fréquemment toutes les formes de traction vitréomaculaire.
L’œdème des membranes épimaculaires entraîne une baisse d’acuité visuelle évolutive associée à des métamorphopsies et à un scotome central relatif. La baisse d’acuité initialement lente et progressive s’aggrave rapidement en quelques mois, surtout à la lecture de près avec, chez certains patients, l’apparition d’une diplopie. Le diagnostic de MEM est initialement biomicroscopique. Au fond d’œil, la membrane est visible au niveau de la macula sous la forme d’un voile transparent qui déforme les vaisseaux. Les plis rétiniens sont induits par la contraction de la membrane et peuvent être le siège d’une opacification blanchâtre correspondant à des ruptures du transport axoplasmique, réalisant des nodules cotonneux comprimant les fibres optiques. L’aspect de la fovéa est un indicateur du degré de constriction maculaire. L’épaississement de la rétine est le signe le plus constant des MEM ayant entraîné une baisse d’acuité visuelle. Il est particulièrement visible en biomicroscopie lorsqu’il est accompagné de pseudo-kystes témoignant de l’œdème rétinien associé. Cependant dans la majorité des cas, c’est l’OCT qui permet de le constater et de le cartographier.
La survenue d’une baisse d’acuité dans le mois suivant un pelage de membrane doit faire rechercher sur l’OCT la présence de cavités microkystiques au niveau des couches nucléaires (voir fig. 13-1 à 13-3).
Les rétinophotographies en couleurs, ainsi que les photographies du fond d’œil en lumière bleue mettent au mieux en évidence la membrane, les constrictions, l’étirement et le déplacement du pigment xanthophylle.
L’OCT permet de confirmer le diagnostic de MEM, de préciser son étendue, sa localisation ainsi que l’existence de nœuds de rétraction. Elle apporte des précisions anatomiques sur l’épaisseur et le volume de la macula. L’OCT peut objectiver des microkystes de la couche nucléaire interne, des altérations de la limitante interne ou de la ligne de l’article externe des photorécepteurs. L’OCT permet aussi de mettre en évidence des connexions entre membrane et hyaloïde postérieure ainsi que l’existence d’une traction vitréomaculaire [10]. Son rôle est important pour porter les indications thérapeutiques en fonction de l’altération des différentes structures [11]. L’OCT a montré que la disparition complète de l’œdème maculaire peut être très lente, les fluides sous- et intrarétiniens pouvant persister jusqu’à 12 mois après le pelage [12].
L’angiographie à la fluorescéine ne fait pas partie du bilan systématique des MEM. Elle objective les anomalies des trajets vasculaires sous forme d’étirement ou de tortuosité, ainsi que la présence de zones de diffusion du colorant.
L’œdème diffus par hyperperméabilité des parois capillaires est responsable d’une fluorescence mal délimitée aux temps tardifs, alors que l’œdème cystoïde est associé à la présence de cavités hyperfluorescentes bien délimitées au niveau de la couche nucléaire interne ou de la plexiforme interne. Dans les œdèmes intracellulaires, l’angiographie n’objectivera ni remplissage cystoïde ni diffusion, et sera peu contributive au diagnostic étiologique ainsi qu’au pronostic.
Les critères habituellement retenus pour opérer une MEM sont la baisse d’acuité récente et progressive avec aggravation du scotome relatif et des métamorphopsies. Il est habituel d’intervenir dès que l’acuité visuelle s’approche de 5/10 surtout si la baisse visuelle est symptomatique.
La découverte de cavités kystiques sur l’OCT doit faire rechercher une pathologie vasculaire ou inflammatoire associée qui doit être prise en charge avant de poser une indication opératoire (e-cas cliniques 13-1 et 13-2
et 13-2 ) [13]. Si la membrane est idiopathique, il faut évaluer l’intégrité de la membrane limitante élastique externe ainsi que celle de la jonction des segments internes et externes des photorécepteurs qui sont des facteurs prédictifs de récupération fonctionnelle après pelage [14]. L’existence de cavités kystiques au niveau des couches nucléaires serait un facteur de moindre récupération fonctionnelle et également d’œdème postopératoire. Bien que les résultats soient variables selon les études, la présence de logettes kystiques ne constitue pas une contre-indication au pelage de la membrane ni de la limitante interne, mais il manque toutefois des données sur ce dernier point [15].
) [13]. Si la membrane est idiopathique, il faut évaluer l’intégrité de la membrane limitante élastique externe ainsi que celle de la jonction des segments internes et externes des photorécepteurs qui sont des facteurs prédictifs de récupération fonctionnelle après pelage [14]. L’existence de cavités kystiques au niveau des couches nucléaires serait un facteur de moindre récupération fonctionnelle et également d’œdème postopératoire. Bien que les résultats soient variables selon les études, la présence de logettes kystiques ne constitue pas une contre-indication au pelage de la membrane ni de la limitante interne, mais il manque toutefois des données sur ce dernier point [15].
L’intervention pratiquée en ambulatoire est réalisée sous anesthésie locorégionale par injection péribulbaire ou sous-ténonienne d’un mélange un tiers Xylocaïne® et deux tiers Naropeïne® afin d’obtenir une akinésie complète sans chémosis.
La vitrectomie est réalisée en transconjonctival 23, 25 ou 27 G après décontamination soigneuse des culs-de-sac par lavage à la povidone iodine (Bétadine®) 5 % pendant 2 minutes. Le système panoramique associé au microscope opératoire permet de contrôler les tractions sur la périphérie rétinienne et de faciliter la manipulation du colorant (Brillant Blue G) pendant la chirurgie.
Le pelage de la membrane est étendu à toute l’aire maculaire en essayant par une prise superficielle débutée en sous-fovéolaire de ne peler que la membrane. La limitante interne est ensuite colorée une seconde fois et la décision de son ablation totale ou partielle est discutée au cas par cas selon la sévérité de la rétraction et le type d’œdème diffus ou cystoïde. En cas de logette rétrofovéale, il est préférable de conserver un patch fovéolaire de limitante interne afin de prévenir l’évolution vers un trou maculaire. La membrane limitante interne est une structure identifiable et clivable de 2,5 µ d’épaisseur séparant le vitré des pieds des cellules de Müller, ce qui suggère qu’elle dérive des cellules gliales [16].
Il est recommandé chez les patients phaques de plus de 60 ans d’associer une phaco-émulsification du cristallin afin d’éviter d’opérer secondairement la cataracte qui survient dans l’année suivant l’opération chez 70 % des patients. Il a été prouvé par plusieurs études que ce geste n’aggrave pas l’œdème maculaire [17], alors que la chirurgie de la cataracte sur un œil vitrectomisé présente un risque élevé d’œdème maculaire [18].
Le décollement de rétine était la complication la plus redoutée avec une fréquence qui allait jusqu’à 5 %. Les techniques transconjonctivales associées à la visualisation panoramique de la périphérie rétinienne ont réduit le taux de décollement aux alentours de 1 à 2 %.
L’endophtalmie, avec un taux qui allait jusqu’à 1 %, reste la complication la plus grave. Elle peut être réduite à moins de 0,1 % par la décontamination soigneuse des culs-de-sac et en évitant tout contact entre les gants du chirurgien et l’extrémité des instruments.
L’œdème maculaire postopératoire dont la fréquence varie de 1 à 64 % est la complication la plus fréquente et la moins évaluée [6, 7, 19]. La moitié des œdèmes est transitoire et régresse vers le 3e mois sans séquelles fonctionnelles. L’autre moitié a une évolution chronique avec persistance au-delà de 6 mois et un retentissement négatif sur la récupération fonctionnelle. Enfin, il a été décrit chez 1 % des patients un œdème sous forme de kystes allongés au niveau de la nucléaire interne survenant au 3e mois postopératoire. L’absence d’hyperfluorescence ou de diffusion angiographique est en faveur d’une souffrance cellulaire qui pourrait être liée au pelage de la membrane limitante interne [9].
Le traitement préventif est fondé sur la diminution des facteurs inflammatoires liés à la chirurgie en réduisant les traumatismes peropératoires ainsi que l’utilisation d’épinéphrine, de colorants toxiques ou l’excès de photocoagulation laser [20]. Le traitement postopératoire associe anti-inflammatoires non stéroïdiens (AINS) et stéroïdiens locaux (collyres) pendant un minimum de 4 semaines. Une étude a montré que l’utilisation du dorzolamide 3 fois par jour pendant 3 mois réduisait le flare de l’humeur aqueuse ainsi que le risque d’OMM postopératoire [21]. En cas de non-réponse, une injection sous-conjonctivale de 8 mg d’acétate de triamcinolone peut être proposée ainsi qu’une injection intravitréenne d’un implant de dexaméthasone [22]. Par contre, l’injection d’anti-vascular endothelial growth factor ou anti-VEGF (bévacizumab) dans la cavité vitréenne ne semble pas avoir d’effet positif sur l’évolution de l’OMM [23].
La chirurgie des MEM, même en présence d’un OMM, donne des résultats satisfaisants avec progression selon l’acuité initiale de 2 à 4 lignes ETDRS (Early Treatment Diabetic Retinopathy Study) chez 80 % des patients [15]. On observe également une régression des métamorphopsies chez plus de la moitié des patients. La rapidité de la récupération après pelage est variable, les meilleurs cas récupérant en 1 mois [24], alors qu’en présence d’œdème le délai peut-être supérieur à 6 mois [12]. Le pelage spécifique des membranes épirétiniennes compliquées d’OMM n’a toutefois pas fait l’objet d’études récentes confirmant les résultats anatomiques et fonctionnels.
[1] Gelfand JM, Nolan R, Schwartz DM, et al. Microcystic macular oedema in multiple sclerosis is associated with disease severity. Brain 2012 ; 135 : 1786-93.
[2] Querques G, Coscas F, Forte R, et al. Cystoid macular degeneration in exudative age-related macular degeneration. Am J Ophthalmol 2011 ; 152 : 100-107 e2.
[3] Koo HC, Rhim WI, Lee EK. Morphologic and functional association of retinal layers beneath the epiretinal membrane with spectral-domain optical coherence tomography in eyes without photoreceptor abnormality. Graefes Arch Clin Exp Ophthalmol 2012 ; 250 : 491-8.
[4] Burggraaff MC, Trieu J, de Vries-Knoppert WA, et al. The clinical spectrum of microcystic macular edema. Invest Ophthalmol Vis Sci 2014 ; 55 : 952-61.
[5] Henderson BA, Kim JY, Ament CS, et al. Clinical pseudophakic cystoid macular edema. Risk factors for development and duration after treatment. J Cataract Refract Surg 2007 ; 33 : 1550-8.
[6] Kim SJ, Martin DF, Hubbard GB 3rd, et al. Incidence of postvitrectomy macular edema using optical coherence tomography. Ophthalmology 2009 ; 116 : 1531-7.
[7] Frisina R, Pinackatt SJ, Sartore M, et al. Cystoid macular edema after pars plana vitrectomy for idiopathic epiretinal membrane. Graefes Arch Clin Exp Ophthalmol 2015 ; 253 : 47-56.
[8] Poliner LS, Olk RJ, Grand MG, et al. Surgical management of premacular fibroplasia. Arch Ophthalmol 1988 ; 106 : 761-4.
[9] Sigler EJ, Randolph JC, Charles S. Delayed onset inner nuclear layer cystic changes following internal limiting membrane removal for epimacular membrane. Graefes Arch Clin Exp Ophthalmol 2013 ; 251 : 1679-85.
[10] Koizumi H, Spaide RF, Fisher YL, et al. Three-dimensional evaluation of vitreomacular traction and epiretinal membrane using spectral-domain optical coherence tomography. Am J Ophthalmol 2008 ; 145 : 509-517.
[11] Do DV, Cho M, Nguyen QD, et al. Impact of optical coherence tomography on surgical decision making for epiretinal membranes and vitreomacular traction. Retina 2007 ; 27 : 552-6.
[12] Uchino E, Uemura A, Doi N, Ohba N. Postsurgical evaluation of idiopathic vitreomacular traction syndrome by optical coherence tomography. Am J Ophthalmol 2001 ; 132 : 122-3.
[13] Brar M, Yuson R, Kozak I, et al. Correlation between morphologic features on spectral-domain optical coherence tomography and angiographic leakage patterns in macular edema. Retina 2010 ; 30 : 383-9.
[14] Chhablani JK, Kim JS, Cheng L, et al. External limiting membrane as a predictor of visual improvement in diabetic macular edema after pars plana vitrectomy. Graefes Arch Clin Exp Ophthalmol 2012 ; 250 : 1415-20.
[15] Ma SS, Barloon S, Maberley AL, Kestle J. Effect of macular edema on surgical visual outcome in eyes with idiopathic epiretinal membrane. Can J Ophthalmol 1996 ; 31 : 183-6.
[16] Abdelkader E, Lois N. Internal limiting membrane peeling in vitreo-retinal surgery. Surv Ophthalmol 2008 ; 53 : 368-96.
[17] Dugas B, Ouled-Moussa R, Lafontaine PO, et al. Idiopathic epiretinal macular membrane and cataract extraction: combined versus consecutive surgery. Am J Ophthalmol 2010 ; 149 : 302-6.
[18] Mylonas G, Sacu S, Deak G, et al. Macular edema following cataract surgery in eyes with previous 23-gauge vitrectomy and peeling of the internal limiting membrane. Am J Ophthalmol 2013 ; 155 : 253-259e2.
[19] Savastano A, Savastano MC, Barca F, et al. Combining cataract surgery with 25-gauge high-speed pars plana vitrectomy: results from a retrospective study. Ophthalmology 2014 ; 121 : 299-304.
[20] Tognetto D, Haritoglou C, Kampik A, Ravalico G. Macular edema and visual loss after macular pucker surgery with ICG-assisted internal limiting membrane peeling. Eur J Ophthalmol 2005 ; 15 : 289-91.
[21] Suzuki T, Hayakawa K, Nakagawa Y, et al. Topical dorzolamide for macular edema in the early phase after vitrectomy and epiretinal membrane removal. Clin Ophthalmol 2013 ; 7 : 549-53.
[22] Taney LS, Baumal CR, Duker JS. Sustained-release dexamethasone intravitreal implant for persistent macular edema after vitrectomy for epiretinal membrane. Ophthalmic Surg Lasers Imaging Retina 2015 ; 46 : 224-8.
[23] Chen CH, Wu PC, Liu YC. Intravitreal bevacizumab injection therapy for persistent macular edema after idiopathic macular epiretinal membrane surgery. J Ocul Pharmacol Ther 2011 : 27 : 287-92.
[24] Kim J, Rhee KM, Woo SJ, et al. Long-term temporal changes of macular thickness and visual outcome after vitrectomy for idiopathic epiretinal membrane. Am J Ophthalmol 2010 ; 150 : 701-709e1.
C. Zech
➤ La classification des anomalies de l’interface vitréomaculaire distingue les adhérences vitréomaculaires, les tractions vitréomaculaires et les trous maculaires.
➤ L’adhérence vitréomaculaire correspond au stade initial du décollement postérieur du vitré et évolue le plus souvent vers un décollement postérieur du vitré complet sans complication.
➤ La traction vitréomaculaire (TVM) est caractérisée par la persistance d’une adhérence vitréomaculaire et d’un épaississement rétinien maculaire associés à des modifications intrarétiniennes. L’adhérence peut être focale (< 1 500 µ) ou étendue (≥ 1 500 µ).
➤ Une vitrectomie est indiquée en cas de TVM associée à une baisse d’acuité visuelle sévère.
➤ La meilleure indication de la vitréolyse est une TVM localisée associée à une baisse visuelle modérée, et sans membrane épirétinienne associée.
Le syndrome de traction vitréomaculaire (STVM) correspond à un décollement incomplet du vitré associé à la persistance d’une adhérence vitréenne sur la macula, à l’origine d’une déformation anatomique, d’un œdème maculaire et d’un retentissement fonctionnel.
Le décollement postérieur du vitré (DPV) correspond à la séparation entre la hyaloïde postérieure et la couche rétinienne la plus interne, la limitante interne. Le DPV débute au pôle postérieur de chaque côté de la fovéa et se complète progressivement jusqu’au collapsus vitréen. Uchino a proposé une classification en quatre stades correspondant à l’évolution chronologique du DPV [1]. L’apport de la tomographie à cohérence optique (OCT) a été considérable pour la compréhension des phénomènes localisés au niveau de l’interface vitréorétinien et surtout pour la compréhension de la formation des trous maculaires [2].
Il n’y a pas de signe clinique spécifique en rapport avec le STVM. Il s’agit d’un syndrome maculaire habituel, associant une baisse de l’acuité visuelle et des métamorphopsies évoluant progressivement depuis plusieurs mois. La baisse de l’acuité visuelle est variable. Elle dépend de la durée d’évolution du STVM et de l’importance de l’atteinte rétinienne. Les métamorphopsies dépendent également de ces deux facteurs. Il est intéressant de noter que la baisse de l’acuité visuelle évolue de façon parallèle avec l’importance des métamorphopsies. Il n’est pas classique d’observer par exemple une petite baisse de l’acuité visuelle avec des métamorphopsies importantes ou l’inverse comme on peut le voir parfois pour les membranes épirétiniennes. Ici en effet, l’importance des métamorphopsies est directement liée à l’importance de l’atteinte rétinienne et donc l’importance de la dégradation de l’acuité visuelle. Il est utile de rappeler la nécessité d’un interrogatoire clinique bien conduit qui permettra de mesurer le retentissement fonctionnel. En effet, au stade très précoce, on peut voir parfois des patients se plaindre d’un trouble visuel central modéré avec une acuité visuelle parfaitement conservée. La plainte visuelle peut correspondre à une lettre qui s’efface lors de la lecture correspondant à une atteinte centrée sur la fovéa.
Au fond d’œil, l’aspect est très variable. À un stade débutant comme ci-dessus, on ne retrouve pas d’anomalie visible au niveau maculaire, tout au plus une perte du reflet fovéolaire. À un stade plus évolué, on notera un œdème centré sur la macula avec parfois plusieurs logettes cystoïdes visibles. Le vitré est non décollé et on n’observe pas d’anneau prépapillaire.
On peut visualiser une condensation vitréenne en avant de la fovéa correspondant à l’adhérence du vitré sur la macula. Il existe parfois aussi une brillance sur le pôle postérieur traduisant la présence d’une membrane épirétinienne.
Avant l’apparition de l’OCT, le STVM était considéré comme le point de départ de l’évolution vers le trou maculaire avec la description d’une classification biomicroscopique des anomalies maculaires [3]. On parlait alors de menace de trou maculaire. Dans la nouvelle classification, on parle maintenant de traction vitréomaculaire (TVM) focale ou étendue.
Grâce à l’évolution de la technologie, l’OCT est devenu l’examen de référence par sa facilité d’utilisation, sa précision et sa reproductibilité. Il est heureusement maintenant accessible à tous. Il permet l’analyse précise de l’interface vitréorétinienne et de ses différentes anomalies.
Un groupe international d’experts (International Vitreomacular Traction Study Group) a présenté récemment une nouvelle classification des anomalies de l’interface vitréomaculaire distinguant les adhérences vitréomaculaires (AVM), les TVM et les trous maculaires [4]. Cette classification internationale a secondairement été adaptée pour notre utilisation en France [5].
Lorsqu’on analyse cette nouvelle classification, on note qu’elle décrit une évolution chronologique d’un DPV qui se déroule de façon anormale. Tout d’abord, sont décrites les AVM (fig. 13-5). Il s’agit d’un premier stade du DPV, DPV incomplet, où l’on constate que le vitré est décollé de chaque côté de la macula avec cependant la persistance d’une adhérence fovéolaire. Il n’existe à ce stade aucune force mécanique de traction sur la macula et il n’y a donc aucune modification anatomique de la fovéa en OCT. On ne peut pas encore parler d’évolution pathologique du DPV. En effet, il s’agit en général d’une découverte systématique faisant souvent suite à une atteinte maculaire de l’autre œil. Il n’y a aucune modification de l’acuité visuelle ni métamorphopsie.
L’évolution est en rapport avec la poursuite du décollement postérieur du vitré. Normalement, le vitré se détache et tout rentre dans l’ordre. C’est l’évolution habituelle, celle-ci se fait dans la grande majorité des cas de façon très discrète et est souvent accompagnée par la perception de myodésopsies.
Si le vitré reste adhérent à la fovéa, on constate la poursuite du DPV et on peut alors observer le stade de TVM. L’OCT montre dans ce cas une hyaloïde postérieure très réflective tirant sur la fovéa et induisant un épaississement maculaire. Le retentissement maculaire est très variable et dépend de la durée d’évolution (fig. 13-6). L’épaississement de la macula est variable. S’il est important, il peut alors exister une désorganisation d’un tissu rétinien externe avec de nombreuses logettes d’œdèmes cystoïdes (fig. 13-7a et b).
Avec la nouvelle classification, un nouveau paramètre est à prendre en compte et à mesurer, c’est la largeur du contact entre le vitré et la surface rétinienne. Ici, on parle de TVM focale ou étendue si cette zone de contact est inférieure ou supérieure à 1 500 µ (fig. 13-7c). Elle peut être isolée ou associée à une membrane épirétinienne.
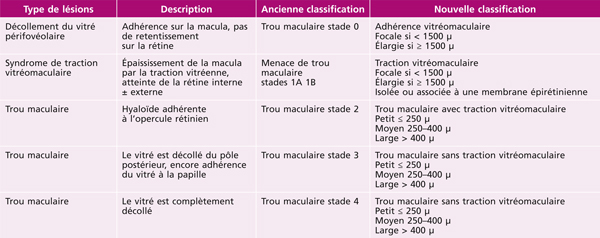
Tableau 13-1 Correspondance entre l’ancienne et la nouvelle classification.
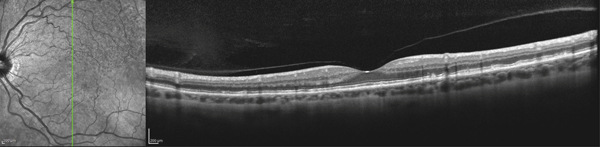
Fig. 13-5 Adhérence vitréomaculaire.
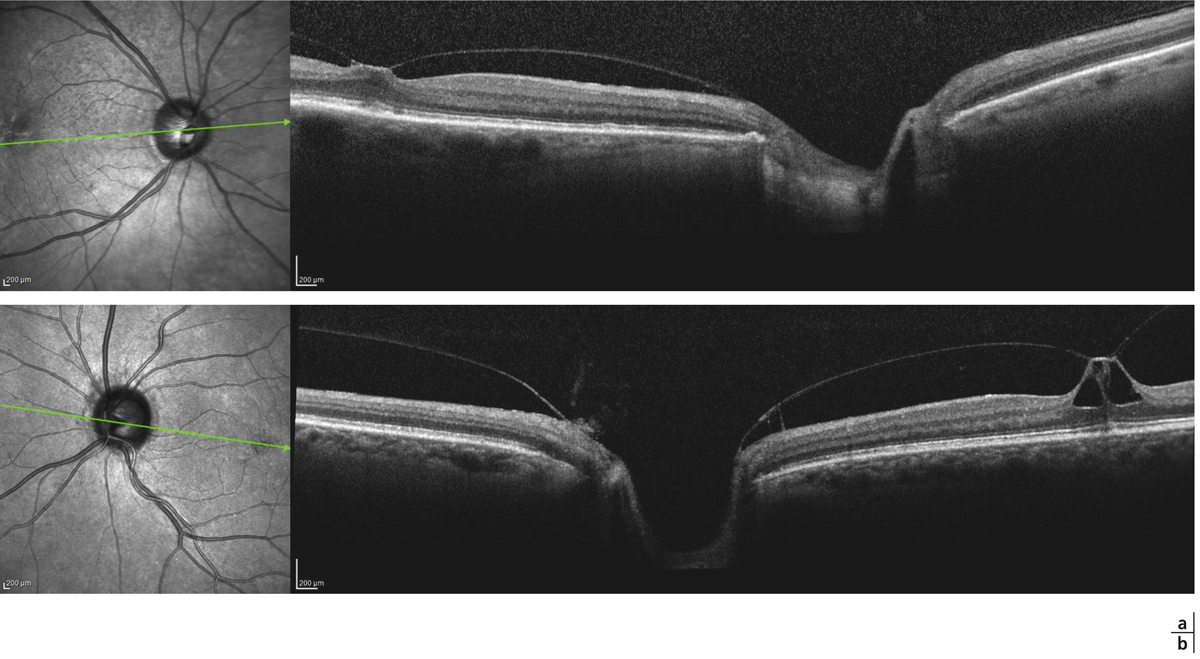
Fig. 13-6 Traction vitréomaculaire (TVM) focale.
a. La rétine externe est intacte. b. La TVM est plus marquée, la rétine externe reste intacte.
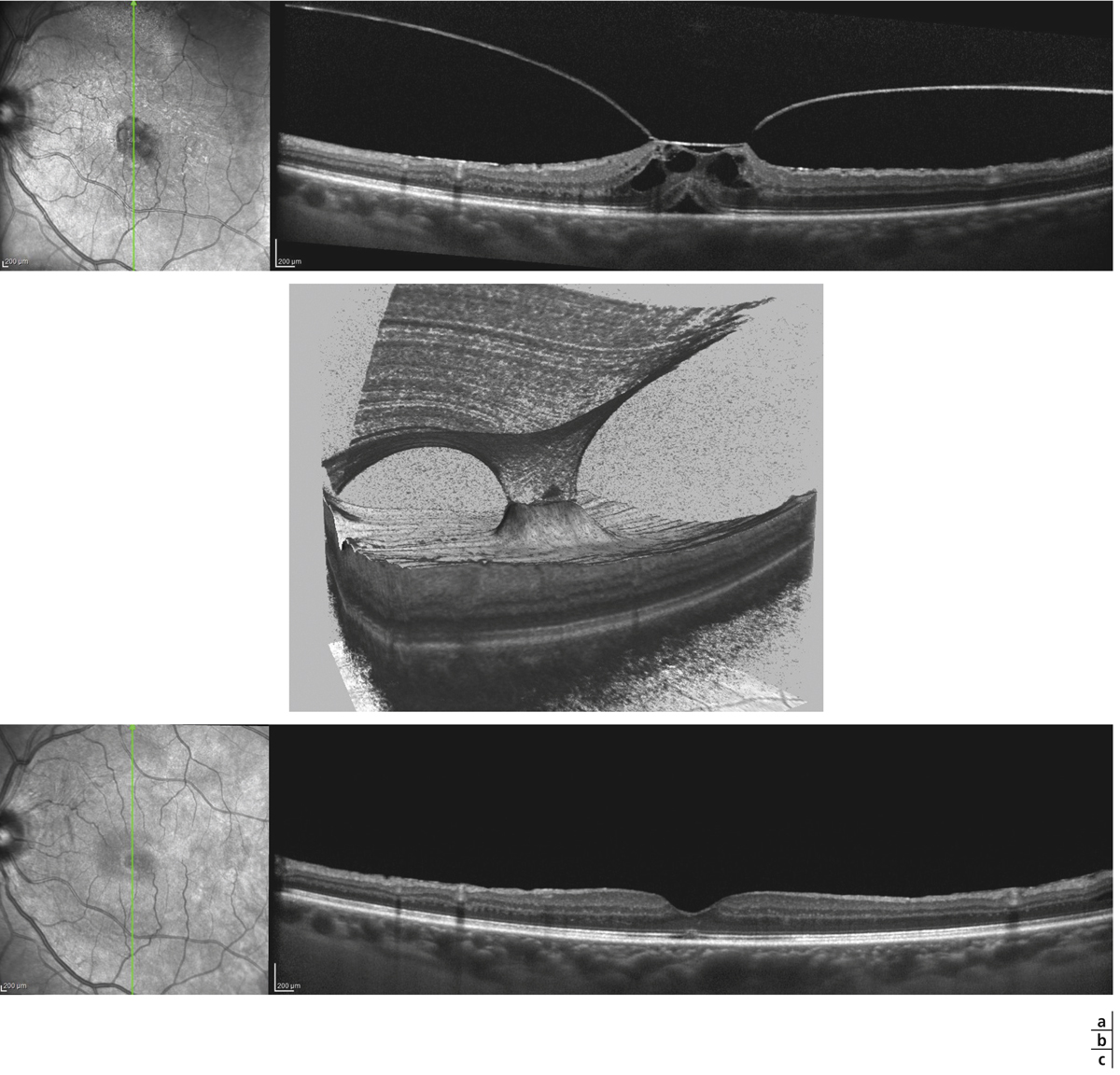
Fig. 13-7 Traction vitréomaculaire focale évoluée.
a. Traction vitréomaculaire focale évoluée, retentissement sur la rétine interne et externe. b. Aspect en 3D, l’adhérence hyaloïdienne reste focalisée sur la macula qui est soulevée. c. Résultat après la chirurgie associant vitrectomie et pelage.
L’avantage de la nouvelle classification est une approche simplifiée des anomalies de l’interface vitréorétinien qui permet d’aider à la prise de décision thérapeutique. Concernant les AVM, elles sont considérées comme une évolution logique du DPV, il n’y a donc pas de traitement spécifique à envisager. Il s’agit en général d’une découverte systématique et il n’y a pas de surveillance particulière, sauf si l’autre œil a présenté une pathologie de l’interface. On demandera alors au patient de rester vigilant et de consulter en cas de baisse de l’acuité visuelle et/ou de métamorphopsies.
Dans le cas des TVM, il faut savoir être patient si la baisse de l’acuité visuelle n’est pas trop importante et si la gêne fonctionnelle reste faible. En effet, on peut observer parfois une amélioration spontanée avec une traction qui cède spontanément (fig. 13-8 et 13-9a). Le retentissement maculaire localisé seulement au niveau de la rétine interne ou la réalisation d’injections intravitréennes en cas de DMLA associée sont des facteurs favorisant le détachement spontané de la traction [6].
Cependant, en cas de baisse importante de l’acuité visuelle, il faut alors savoir proposer le traitement chirurgical [7]. Celui-ci comportera une vitrectomie et l’ablation d’une éventuelle membrane épirétinienne et/ou limitante interne. On pourra éventuellement y associer l’injection d’une bulle d’air ou de gaz pour lisser la rétine et limiter le risque de passage vers un trou maculaire de pleine épaisseur. Sur le plan fonctionnel, les résultats sont variables et dépendent essentiellement de l’état préopératoire de la rétine et donc de la durée d’évolution de la traction. Les meilleurs résultats sont obtenus lorsque la souffrance de la rétine n’a pas été trop importante (fig. 13-9b).
La vitréolyse enzymatique est une nouvelle possibilité de traitement. Il s’agit d’une injection intravitréenne d’une protéase recombinante, l’ocriplasmine (Jetrea®). À la dose de 125 mg en injection unique, elle est active sur la lyse de la fibronectine et de la laminine qui compose l’interface vitréorétinien [8]. La publication de l’étude de phase III en 2012 a permis de susciter beaucoup d’espoir pour le traitement médical des TVM et des trous maculaires. Les premiers résultats ont indiqué que ce traitement était plus efficace que l’injection de placebo [9]. Cette étude a aussi montré que l’efficacité du traitement était meilleure en l’absence de membrane épirétinienne et lorsqu’il existait une AVM inférieure à 1 500 µ. De plus, il a été montré que les yeux myopes forts étaient moins réactifs et que les yeux aphakes avaient de meilleures chances d’avoir une traction qui cède. Depuis cette première publication, une étude européenne prospective de phase IV, multicentrique, intégrant 400 patients injectés avec ocriplasmine et suivis pendant 6 mois est en cours, elle va permettre d’affiner les résultats. Les indications de traitement sont limitées aux TVM. Les critères d’exclusion sont la présence d’une membrane épirétinienne, d’une AVM supérieure à 1 500 µ et d’un trou maculaire dont la largeur est supérieure à 400 µ. Le critère d’analyse principal est la proportion des patients présentant une TVM qui a cédé 1 mois après une injection intravitréenne unique de 125 mg d’ocriplasmine. L’inclusion des patients s’est terminée en février 2015 et les résultats de cette étude seront connus début 2016. Cependant, les résultats préliminaires à mi-parcours sur les 202 premiers patients donnent les résultats suivants : sur le plan démographique, il existe une prédominance féminine importante de 80 %. Parmi les 202 patients présentant une TVM, 36 (18 %) présentaient un trou maculaire associé. Concernant les résultats, 1 mois après l’injection, la traction a cédé dans 42,7 % des cas (fig. 13-10). Parmi les patients présentant un trou maculaire, celui-ci s’est fermé dans 28,6 % des cas. Ces résultats suggèrent que l’efficacité de l’ocriplasmine est améliorée par une sélection précise des patients pouvant bénéficier du traitement. Les résultats définitifs permettront certainement de pouvoir définir la place de ce nouveau traitement dans l’arsenal thérapeutique des TVM.
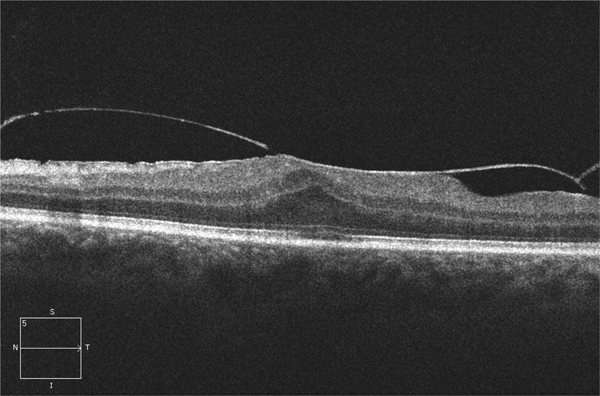
Fig. 13-8 Traction vitréomaculaire étendue car supérieure à 1 500 µ (ici 1 595 µ) avec épaississement hyaloïdien suggérant une membrane épirétinienne associée.
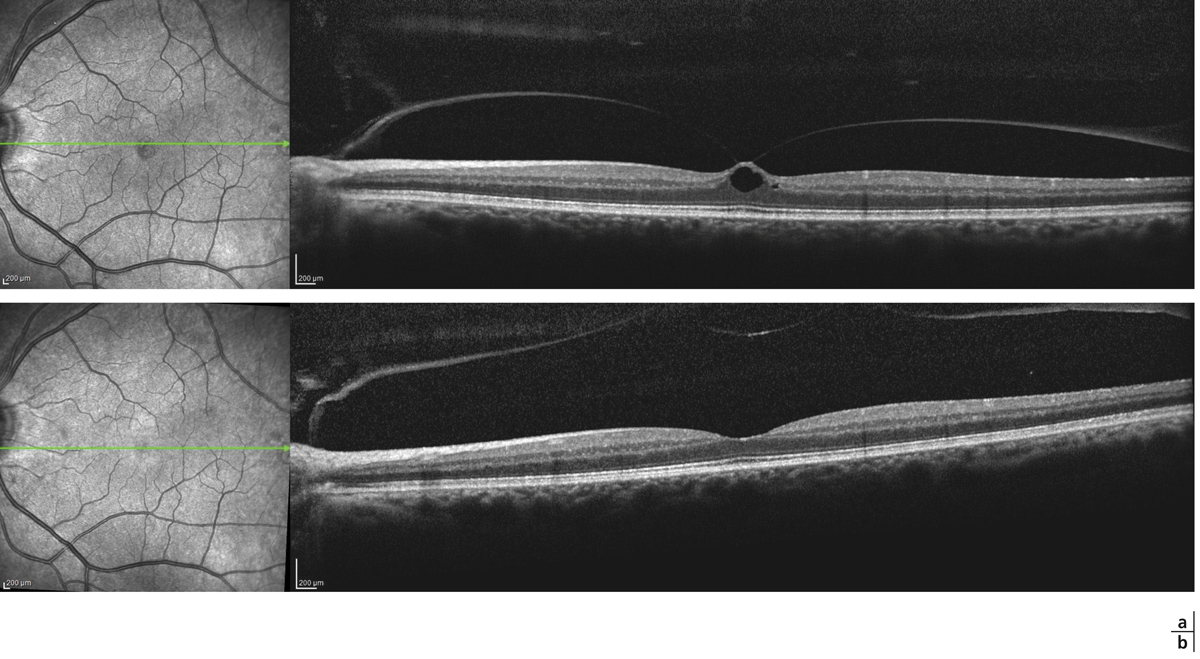
Fig. 13-9 Amélioration spontanée d’une traction vitréomaculaire focale.
a. Traction vitréomaculaire focale. b. Amélioration spontanée, la traction cède après 1 an, la macula redevient normale.

Fig. 13-10 Traction vitréomaculaire traitée par ocriplasmine.
a. Traction vitréomaculaire focale, avant l’injection intravitréenne d’ocriplasmine (Jetrea®). b. Disparition de la traction vitréomaculaire 1 mois après l’injection intravitréenne d’ocriplasmine (Jetrea®).
Ce chapitre bénéficie de nouveautés importantes autant sur le plan clinique que thérapeutique. La nouvelle classification des anomalies rétiniennes liées au DPV permet d’identifier les AVM qui correspondent à une évolution normale du DPV. Lorsque le DPV se poursuit et que le vitré reste adhérent à la fovéa, on observe le stade de TVM avec un retentissement fonctionnel sur l’acuité visuelle et anatomique en OCT. Il faut savoir alors distinguer la présence ou non d’une membrane épirétinienne et mesurer la largeur d’adhérence du vitré sur la rétine, inférieure ou supérieure à 1 500 µ. Le nouveau traitement de vitréolyse avec l’ocriplasmine (Jetrea®) est utile pour les patients présentant une TVM avec un retentissement fonctionnel modéré ne nécessitant pas encore de traitement chirurgical. Ce traitement administré par une injection intravitréenne unique permet de faire céder la TVM dans 42 % des cas et d’éviter ainsi la chirurgie.
[1] Uchino E, Uemura A, Ohba N. Initial stages of posterior vitreous detachment in healthy eyes of older persons evaluated by optical coherence tomography. Arch Ophthalmol 2001 ; 119 : 1475-9.
[2] Gaudric A, Haouchine B, Massin P, et al. Macular hole formation : new data provided by optical coherence tomography. Arch Ophthalmol 1999 ; 117 : 744-751.
[3] Gass JDM. Idiopathic senile macular hole : its early stages and development. Arch Ophthalmol 1988 ; 106 : 629-39.
[4] Duker JS, Kaiser PK, Binder S, et al. The international Vitreomacular Traction Study Group classification of vitreomacular adhesion, raction and macular hole. Ophthalmology 2013 ; 120 : 2611-9.
[5] Le Mer Y, Korobelnik JF, Kodjikian L, et al. Classification of vitreomacular adhesion and macular holes. J Fr Ophtalmol 2015 ; 38 : 357-64.
[6] Almeida DR, Chin EK, Rahim K, et al. Factors associated with spontaneous release of vitreomacular traction. Retina 2015 ; 35 : 492-7.
[7] Massin P, Erginay A, Haouchine B, et al. Results of surgery of vitreomacular traction syndromes. J Fr Ophtalmol 1997 ; 20 : 539-47.
[8] Zhao F, Gandorfer A, Haritoglou C, et al. Epiretinal cell proliferation in macular pucker and vitreomacular traction syndrome : analysis of flat-mounted internal limiting membrane specimens. Retina 2013 ; 33 : 77-88.
[9] Stalmans P, Benz MS, Gandorfer A et al., MIVI-TRUST Study Group. Enzymatic vitreolysis with ocriplasmin for vitreomacular traction and macular holes. N Engl J Med 2012 ; 367 : 606-15.
M.-N. Delyfer
➤ Le trou maculaire touche préférentiellement la femme après 65 ans. Il se bilatéralise dans environ 11 % des cas.
➤ Avant la constitution du trou maculaire de pleine épaisseur, la résolution spontanée complète reste possible dans environ un tiers des cas. Une fois le trou maculaire constitué, la résolution spontanée est rare, constatée dans 5 à 10 % des cas dans les trous maculaires de petite taille de stade II.
➤ Les patients présentant un trou maculaire de stades IA et IB peu symptomatique, conservant une bonne acuité visuelle et peu demandeurs peuvent être surveillés. Les patients présentant un trou maculaire de stades IA et IB symptomatique, invalidant malgré une acuité visuelle supérieure ou égale à 5/10, peuvent bénéficier de l’injection d’ocriplasmine.
➤ Les petits trous maculaires de pleine épaisseur de stade II peuvent également bénéficier soit de la vitréolyse enzymatique, soit de la chirurgie. Les trous maculaires de stade II de plus de 250 µm et les stades III et IV relèvent de la vitrectomie.
On désigne par « trou maculaire » la survenue d’une déhiscence rétinienne arrondie, de pleine épaisseur, localisée dans la région centrofovéolaire. Sur le plan fonctionnel, le trou maculaire induit un syndrome maculaire clinique qui associe de manière variable métamorphopsies, micropsie, microscotome et baisse d’acuité visuelle.
Si le premier cas de trou maculaire a été décrit par Knapp en 1869 [1], il a fallu attendre les travaux de Gass en 1988 pour comprendre que le trou maculaire idiopathique est la conséquence de tractions vitréomaculaires anormales [2]. Le rôle de ce « conflit » vitréomaculaire dans la constitution et/ou l’aggravation des trous maculaires est aujourd’hui parfaitement observé in vivo grâce aux explorations tomographiques en cohérence optique de type spectral domain (SD-OCT). Les classifications actuelles des trous maculaires reposent, de fait, sur l’analyse en OCT du profil maculaire du patient permettant ainsi de poser au mieux les indications thérapeutiques [3, 4]. Les progrès techniques pharmacologiques et chirurgicaux disponibles à l’heure actuelle permettent en effet de proposer, le plus souvent, une solution simple et efficace, adaptée à chaque patient, en fonction du stade de trou maculaire et de son retentissement fonctionnel.
La prévalence des trous maculaires dans la population générale est faible, variant selon les études de 0,02 à 0,8 % [5] ; l’incidence des trous maculaires a été évaluée à 7,8 pour 100 000 personnes dans une population nord-américaine [5]. Une bilatéralisation du trou maculaire est possible s’il persiste sur l’œil adelphe une attache vitréofovéolaire. Cette atteinte de l’œil controlatéral est observée dans environ 11 % des cas [5, 6].
Les deux seuls facteurs de risques de trous maculaires idiopathiques retrouvés de manière constante dans la littérature sont l’âge supérieur à 65 ans et le sexe féminin (avec une sex-ratio de 3,3 pour 1) [5]. Les trous maculaires peuvent dans certains cas être secondaires et surviennent alors le plus couramment dans les suites soit d’un traumatisme (trou maculaire post-contusif), soit au cours de l’évolution d’une myopie forte.
La baisse d’acuité visuelle associée aux trous maculaires est très variable et fonction du stade du trou maculaire. Classiquement, au stade de menace de trou maculaire, elle reste supérieure à 5/10 mais elle peut chuter si la traction vitréomaculaire se prolonge dans le temps. Aux stades de trou de pleine épaisseur, l’acuité visuelle est abaissée en raison du microscotome central et, hormis certains trous maculaires de très petite taille, est classiquement inférieure à 5/10.
Les métamorphopsies et la micropsie associées aux trous maculaires sont difficiles à quantifier de manière objective. Elles traduisent la distorsion mécanique de la région fovéolaire. Leur présence ainsi que leur retentissement sur les activités du patient doivent être évalués afin de moduler l’indication à intervenir dans les cas où l’acuité visuelle est supérieure à 5/10.
Le microscotome est secondaire à la perte de la continuité du tissu neurosensoriel de la région maculaire et à l’écartement des berges fovéolaires. Il est plus ou moins large selon la taille du trou maculaire lui-même. C’est un signe inconstant qui peut être recherché cliniquement en réalisant le test de la ligne de Watzke qui consiste à projeter un faisceau lumineux fin – lumière du biomicroscope ou scanning laser ophthalmoscopy (SLO) – et à demander au patient s’il voit la ligne interrompue ou rétrécie à un endroit.
Au fond d’œil, le trou maculaire apparaît typiquement comme une lésion unique, arrondie, plus sombre que la rétine adjacente, à bords nets et le plus souvent épaissis (du fait de l’œdème microkystique des berges) (fig. 13-11a). Des lésions punctiformes blanc jaunâtre peuvent être présentes au centre du trou et correspondent à des proliférations focales de l’épithélium pigmentaire à nu, dont le nombre et l’aspect varient dans le temps (fig. 13-11b et c). Un opercule peut être visible en avant du trou maculaire, de même qu’un reflet cellophane sur les bords du trou témoignant de la présence d’une membrane épimaculaire associée. La présence d’un anneau prépapillaire de Weiss visible, signant un décollement postérieur du vitré, doit être recherchée.
La taille du trou maculaire et la confirmation du statut du vitré sont établies de manière précise grâce à l’examen OCT. La taille du trou maculaire est évaluée en OCT au centre du trou maculaire, parallèlement à la ligne de l’épithélium pigmentaire, au niveau le plus étroit du trou correspondant à l’intervalle entre les deux extrémités des photorécepteurs soulevés [4] (fig. 13-12). Un trou de petite taille mesure moins de 250 µm, un trou de grande taille plus de 400 µm. Le statut précis du décollement postérieur du vitré sera évalué sur une coupe de grande longueur passant à la fois par la région fovéolaire et par le nerf optique (fig. 13-13). La réalisation d’un cube OCT centré sur le nerf optique peut également être utile pour évaluer au mieux l’attache papillaire résiduelle.
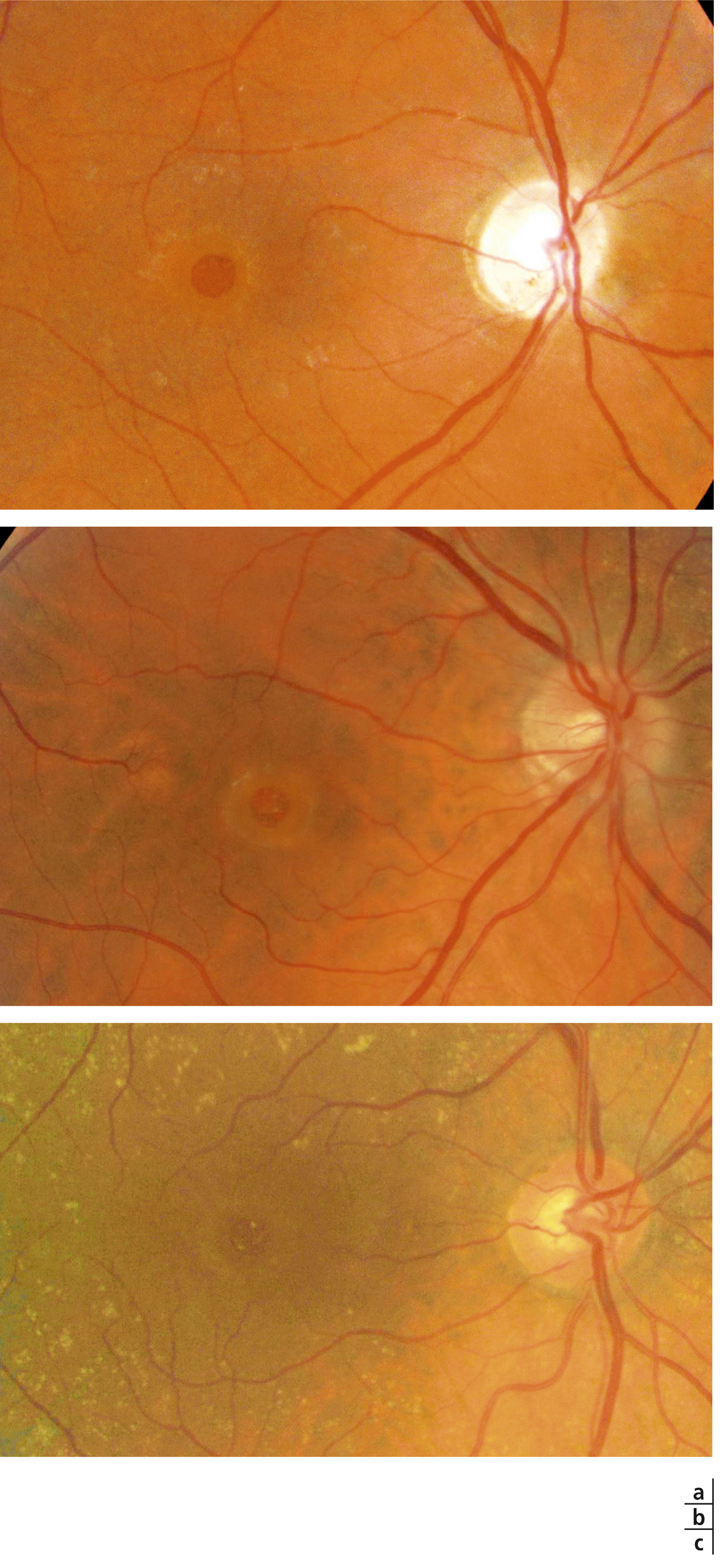
Fig. 13-11 Aspects biomicroscopiques de trous maculaires de pleine épaisseur.
a. Lésion arrondie à bords nets et épaissis. b, c. Des lésions punctiformes blanc jaunâtre en nombre variable peuvent être présentes au centre du trou maculaire et correspondent à des proliférations focales de l’épithélium pigmentaire.
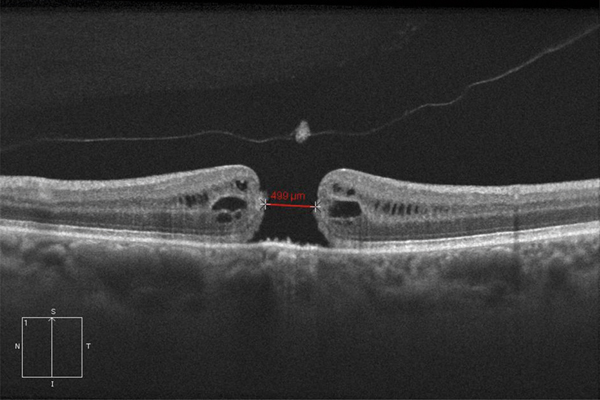
Fig. 13-12 Mesure de la taille du trou maculaire en OCT.
La coupe doit passer par le centre du trou maculaire et la mesure doit être effectuée parallèlement à la ligne de l’épithélium pigmentaire, au niveau le plus étroit du trou correspondant à l’intervalle entre les deux extrémités des photorécepteurs soulevés (croix blanches).
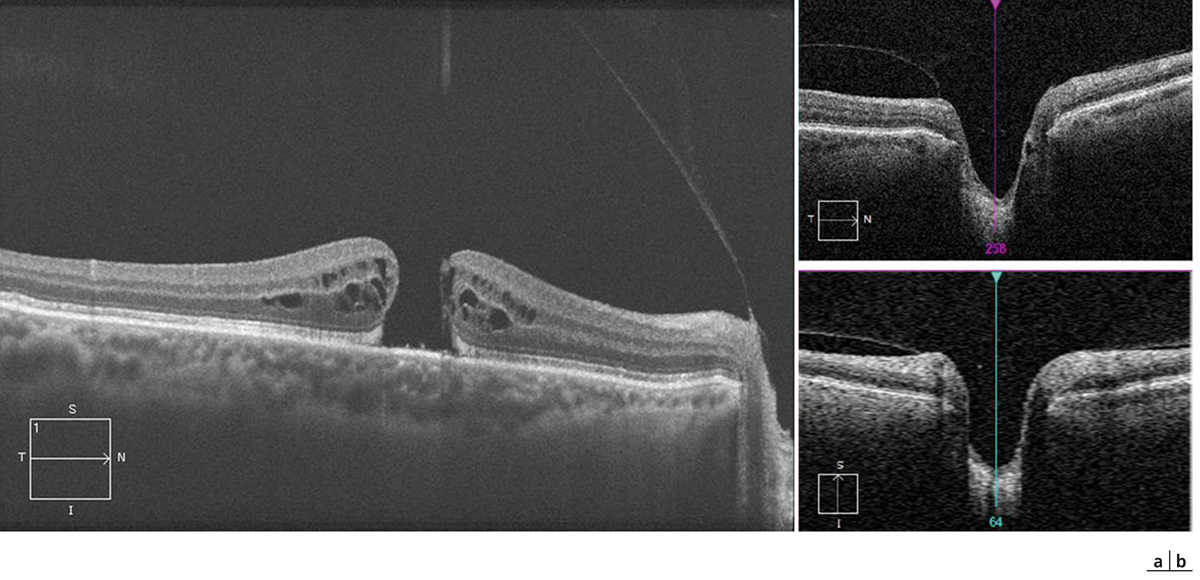
Fig. 13-13 Évaluation du décollement de la hyaloïde postérieure en OCT sur une coupe de grande longueur (9 mm) passant à la fois par la région fovéolaire et par le nerf optique (a) ou à l’aide de la réalisation d’un cube OCT centré sur le nerf optique (b).
a. La hyaloïde est détachée de l’aire maculaire mais reste attachée à la papille (trou maculaire de stade III). b. Sur le cube centré sur le nerf optique, l’attache papillaire est également bien visible, ici sur les coupes horizontale (en haut) et verticale (en bas).
À la classification purement biomicroscopique initiale proposée avec beaucoup de clairvoyance par Gass en 1988 [1], ont succédé les classifications OCT proposées par Alain Gaudric en 1999 [3] puis par l’International Vitreomacular Traction Study Group (IVTSG) [4]. La classification de Gaudric en « stades » est assez facile à utiliser en pratique quotidienne, notamment pour l’analyse des trous maculaires. La classification de l’IVTSG, quant à elle, a pour principale qualité de replacer la survenue des trous maculaires dans le contexte physiopathogénique plus général des anomalies de l’interface vitréomaculaire et est détaillée dans le chapitre 13.2 sur les tractions vitréomaculaires.
Dans la classification de Gaudric, au stade I de trou maculaire, il n’y a pas encore de trou maculaire de pleine épaisseur constitué, mais une « menace de trou maculaire » par traction vitréomaculaire. Selon l’importance de cette traction à l’OCT, le stade I est divisé en stade IA et IB. Au stade IA, la hyaloïde postérieure reste attachée à la région maculaire où elle prend un aspect hyper-réflectif. La fovéa en regard est surélevée et microkystique ; le kyste fovéolaire reste limité à la rétine interne et la rétine externe est intacte ou de simples micro-altérations des segments externes peuvent être présentes. Au stade IB, le toit du kyste maculaire en regard de la traction est toujours présent, mais le kyste est associé à une ouverture franche des couches externes de la rétine et l’acuité visuelle chute (fig. 13-14).
Les stades II, III et IV correspondent à des trous maculaires de pleine épaisseur. Au stade II, la coupe OCT montre la rupture du toit du kyste, avec une adhérence toujours présente de la hyaloïde postérieure sur le bord du trou. Les bords du trou maculaire sont épaissis avec des kystes hyporéflectifs (fig. 13-14).
Au stade III, la hyaloïde postérieure est détachée des bords du trou maculaire réalisant un aspect d’opercule. Le vitré n’est pas encore détaché de la papille (fig. 13-14). Enfin, au stade IV, la hyaloïde postérieure est complètement détachée de la région maculaire et du nerf optique (fig. 13-14). Au fond d’œil, l’anneau de Weiss peut être visible.
À noter qu’un stade « 0 » de trou maculaire est également décrit et désigne les adhérences vitréomaculaires détaillées dans le chapitre 13.2 [7].
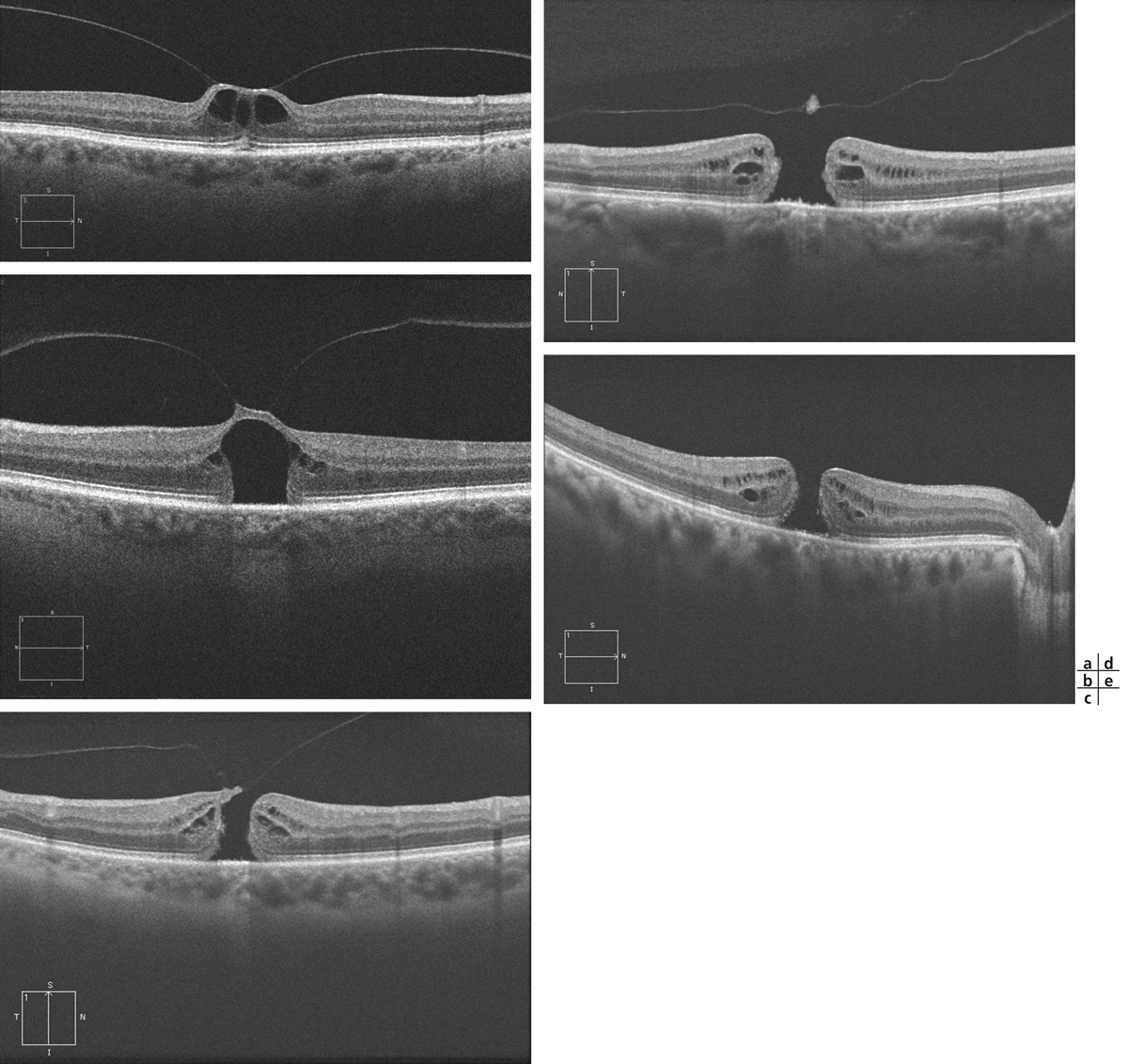
Fig. 13-14 Classification OCT des trous maculaires en stades.
Au stade I de trou maculaire (a, b), il n’y a pas encore de trou maculaire de pleine épaisseur constitué mais une « menace de trou maculaire » par traction vitréomaculaire. Selon l’importance de cette traction à l’OCT, le stade I est divisé en stades IA et IB. a. Au stade IA, la hyaloïde postérieure reste attachée à la région maculaire où elle prend un aspect hyper-réflectif. La fovéa en regard est surélevée et microkystique, le kyste fovéolaire reste limité à la rétine interne, la rétine externe est intacte ou de simples micro-altérations des segments externes peuvent être présentes. b. Au stade IB, le toit du kyste maculaire en regard de la traction est toujours présent, mais le kyste est associé à une ouverture franche des couches externes de la rétine. Les stades II, III et IV correspondent à des trous maculaires de pleine épaisseur. c. Au stade II, le toit du kyste est rompu, avec une adhérence toujours présente de la hyaloïde postérieure sur le bord du trou. Les bords du trou maculaire sont épaissis avec des kystes hyporéflectifs. d. Au stade III, la hyaloïde postérieure est détachée des bords du trou maculaire réalisant un aspect d’opercule. Le vitré n’est pas encore détaché de la papille. e. Au stade IV, la hyaloïde postérieure est complètement détachée de la région maculaire et du nerf optique.
La généralisation en pratique clinique de l’OCT a grandement facilité le diagnostic positif formel de trou maculaire. La notion de « pseudo-trou maculaire » faisant référence à un aspect de lésion arrondie maculaire pouvant, au seul fond d’œil, en imposer pour un trou maculaire vrai est donc devenue presque obsolète. Les deux principaux diagnostics différentiels des trous maculaires sont les membranes épimaculaires associées à une contraction concentrique de la région maculaire et les trous lamellaires. L’examen OCT ne retrouve pas de trou de pleine épaisseur et donne des arguments en faveur de l’une ou l’autre étiologie (fig. 13-15).
Rappelons également pour mémoire que, au fond d’œil, un kyste rétinien d’œdème maculaire cystoïde (diabète, occlusions veineuses, causes inflammatoires), de télangiectasies maculaires de type 2 ou un rétinoschisis juvénile lié à l’X peuvent donner un aspect de faux trou maculaire. L’examen OCT permet là encore de redresser le diagnostic.
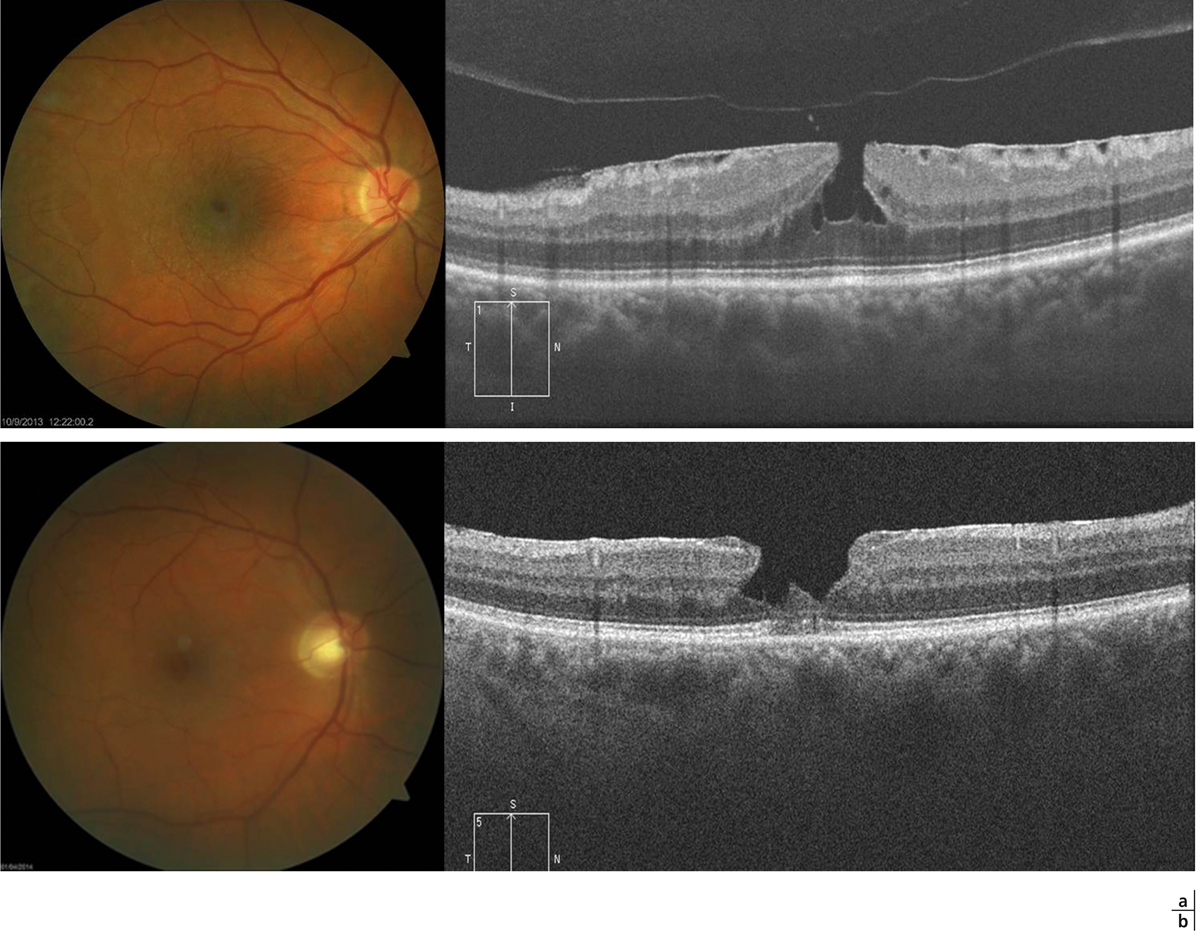
Fig. 13-15 Diagnostics différentiels des trous maculaires.
a. Membrane épimaculaire donnant un aspect de pseudo-trou au fond d’œil. La coupe OCT ne retrouve pas de trou de pleine épaisseur mais une ligne hyper-réflective sur la surface maculaire avec des plis rétiniens superficiels. Les bords de l’entonnoir fovéolaire sont verticalisés expliquant l’aspect de pseudo-trou au fond d’œil. La hyaloïde postérieure est décollée. b. Trou lamellaire avec, en OCT, une irrégularité de la fovéola qui apparaît amincie par endroits et un clivage caractéristique en angle aigu entre la rétine externe et la rétine interne sur le bord fovéolaire.
Avant la constitution du trou maculaire de pleine épaisseur, la résolution spontanée complète reste possible dans environ un tiers des cas [8]. L’évolution observée à 2 ans peut se faire vers un trou maculaire de pleine épaisseur (14 %), vers un trou lamellaire (18 %), ou persister en l’état (36 %). Une fois le trou maculaire constitué, la résolution spontanée est rare, constatée dans 5 à 10 % des cas dans les trous maculaires de petite taille de stade II. Dans les autres cas, l’évolution se fait donc vers les stades III et IV.
Avec le temps, le trou maculaire a tendance à augmenter en taille avec pour conséquence un élargissement du scotome central et une baisse de l’acuité visuelle qui finit par se stabiliser en général aux alentours de 1/10 [9]. Une membrane épimaculaire est également plus fréquemment observée sur les bords du trou [10]. Après plusieurs années d’évolution, un anneau pigmenté de démarcation peut devenir visible [9].
Le risque d’atteinte de l’œil controlatéral n’est pas à négliger. Il est observé dans environ 11 % des cas [5, 6]. Ce risque n’est présent que si le décollement postérieur du vitré n’a pas encore eu lieu et majoré s’il existe des modifications anatomiques maculaires sur les coupes OCT (adhésion ou traction vitréomaculaire).
Le trou maculaire résulte d’un conflit mécanique entre le vitré postérieur et la rétine maculaire. Son traitement a donc pour but de lever les tractions antéropostérieures et tangentielles qui s’exercent sur les berges du trou afin de permettre sa fermeture et la restitution de la continuité du tissu neurosensoriel maculaire.
Le traitement chirurgical du trou maculaire idiopathique remonte au début des années 1990 [11]. Il consiste en la réalisation d’une vitrectomie avec décollement du vitré postérieur (lorsqu’il n’est pas encore totalement décollé), associée au pelage d’une membrane épimaculaire (lorsqu’elle est présente) et à la mise en place d’un tamponnement interne par gaz. Le pelage de la limitante interne reste un temps non réalisé par tous les chirurgiens et le positionnement face vers le sol est discuté pour les petits trous maculaires.
La vitrectomie doit supprimer la traction vitréomaculaire résiduelle dans les stades II et supprimer l’attache papillaire dans les stades III. Le décollement postérieur du vitré est donc essentiel. Il est réalisé le plus couramment au vitréotome par l’aspiration des fibres vitréennes insérées sur les berges papillaires qui constituent les bords de l’anneau de Weiss. Au besoin, l’injection intravitréenne de triamcinolone peut faciliter le geste en permettant une visualisation indirecte des fibres vitréennes par le dépôt des cristaux de triamcinolone (fig. 13-16). Le décollement de la hyaloïde postérieure est étendu jusqu’à l’équateur. La vitrectomie est ensuite poursuivie jusqu’en périphérie de manière à permettre un tamponnement gazeux suffisamment important. L’utilisation des systèmes de visualisation grand champ permet de réaliser une vitrectomie rapide et presque complète sans indentation épisclérale.
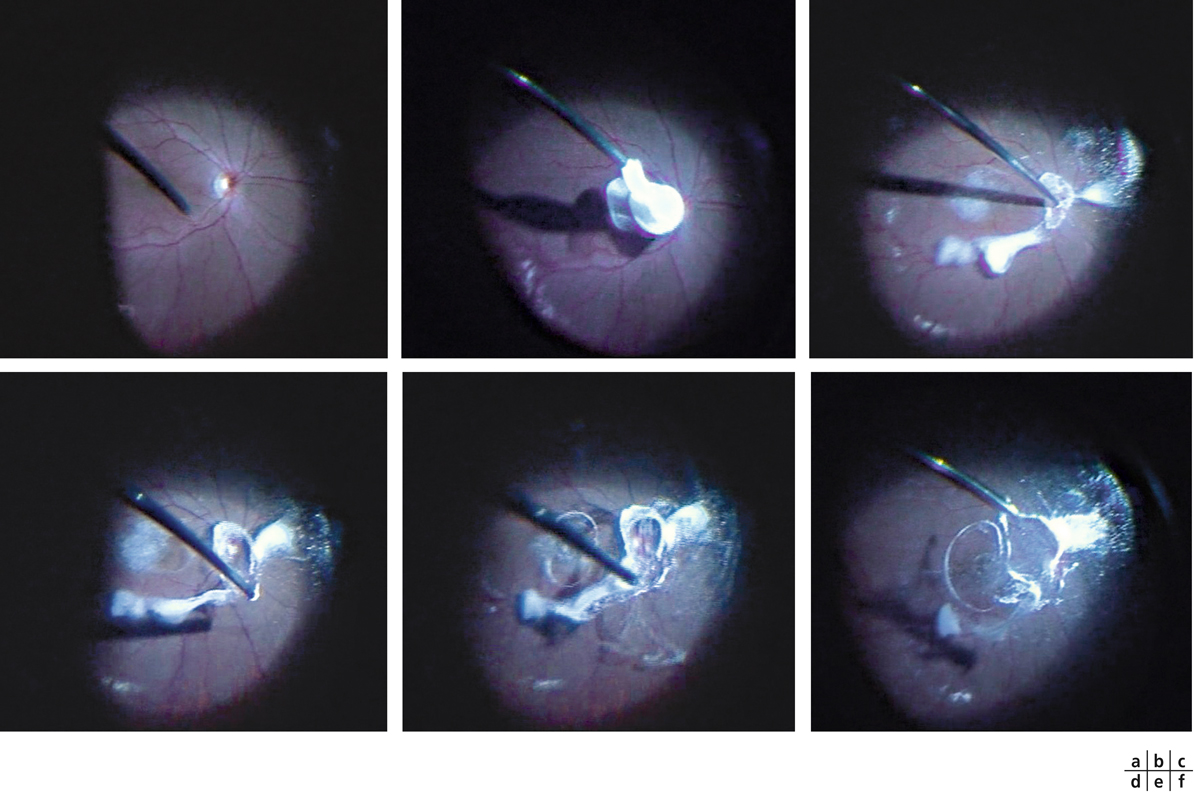
Fig. 13-16 Visualisation du vitré par cristaux de triamcinolone.
a, b. Injection de triamcinolone en avant du nerf optique. c. Aspiration progressive du centre du nerf optique vers la périphérie nasale. d-f. Détachement progressif de l’anneau prépapillaire et du vitré postérieur.
Le pelage d’une membrane épimaculaire, lorsqu’elle est présente sur les bords d’un trou maculaire, est important. Il peut être associé ou pas au pelage de la limitante interne. Il peut être facilité par l’utilisation soit de triamcinolone dont les cristaux, en se déposant la surface, vont permettre à l’opérateur de suivre la progression de la dissection, soit de colorants. Ces derniers peuvent avoir une affinité soit pour la membrane elle-même (bleu de trypan), soit pour la limitante interne (voir plus loin) et dans ce cas la membrane apparaîtra en « négatif », c’est-à-dire non colorée sur un fond coloré. Il est à noter qu’il est aussi possible d’utiliser tous ces colorants précocement en cours de vitrectomie à la place de la triamcinolone, avant de réaliser la dissection maculaire, afin de faciliter la visualisation du décollement postérieur du vitré grâce aux turbulences fluidiques intracavitaires colorées (fig. 13-17).
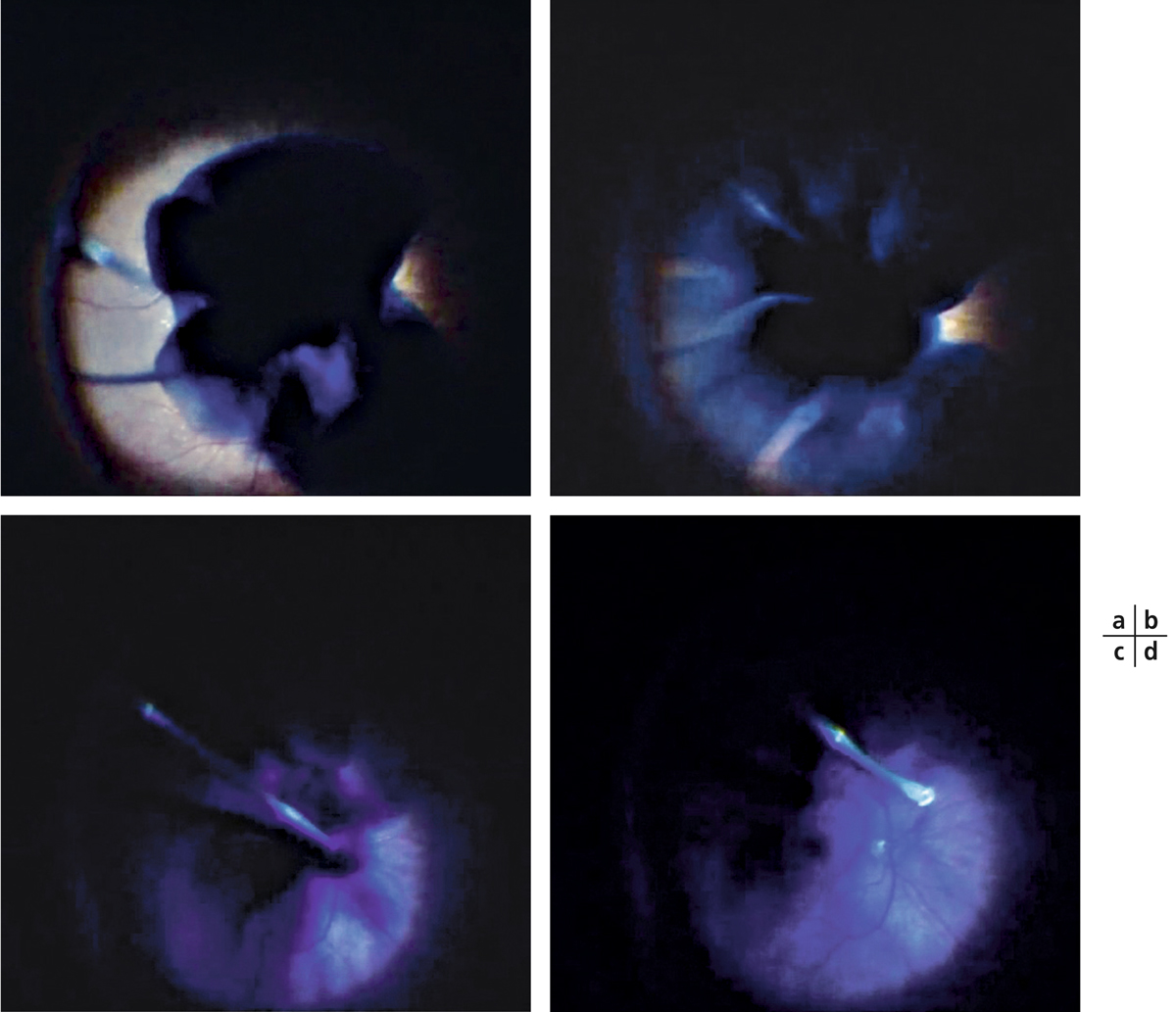
Fig. 13-17 Utilisation d’un colorant dès le début de la vitrectomie afin de visualiser de manière indirecte le vitré postérieur.
a. Injection d’une combinaison de Brilliant Blue et de bleu de trypan (Membrane Blue Dual®, DORC, Pays-Bas) dans la cavité vitréenne. b. Le colorant ne tombe pas au fond de la cavité vitréenne, mais se concentre en prépapillaire entre les plis du vitré postérieur non décollé. c. Aspiration à partir des berges papillaires vers la périphérie nasale. d. Décollement postérieur du vitré visualisé grâce aux turbulences du colorant.
Le pelage de la limitante interne est réalisé à la pince après avoir effectué une micro-ouverture du plan de la limitante interne ; les pincements itératifs de la couche des fibres optiques sont évidemment à éviter de manière à ne pas induire des microscotomes secondaires. Lors de la dissection de la limitante interne, la rétine typiquement « blanchie » et des pétéchies peuvent apparaître. L’étendue du pelage de la limitante interne reste débattue, il est classiquement recommandé de ne pas dépasser deux diamètres papillaires autour de la fovéa lors d’une première chirurgie.
La dissection peut être grandement facilitée par l’utilisation de colorants dont l’affinité pour la limitante interne peut être soit :
spécifique : vert d’infracyanine (indocyanine green [ICG]), bleu de Coomassie (Brilliant Blue) ou violet acide ;
mixte : mélange de Brilliant Blue et de bleu de trypan colorant à la fois une membrane épimaculaire et la limitante interne (fig. 13-18).
La coloration ICG est très efficace et induit une rigidification de la limitante interne qui facilite la dissection des limitantes internes très adhérentes, mais elle pourrait être toxique pour le tissu neurosensoriel et l’épithélium pigmentaire ; son utilisation est donc très controversée et donc non recommandée [12, 13]. Si le pelage de la limitante interne ne se discute pas dans la prise en charge chirurgicale des trous maculaires larges (> 400 µm), chez les myopes forts (où le pelage permet de retirer les reliquats de hyaloïde postérieure toujours présents) ou après échec d’une première chirurgie, il reste très discuté notamment dans la prise en charge initiale des trous maculaires de moins de 400 µm. Ce pelage induit en effet une dissociation des fibres optiques bien visible en OCT (aspect de dissociation of optic nerve fiber layer ou DONFL) et un amincissement de l’épaisseur rétinienne périmaculaire (fig. 13-19) [14]. Sur le plan fonctionnel, le pelage de la limitante interne dans les petits trous maculaires pourrait être associé à une moins bonne récupération et à des altérations fonctionnelles mesurables en électrophysiologie (hyposensibilité en micropérimétrie et modification de l’onde b sur l’électrorétinogramme multifocal) [15, 16].
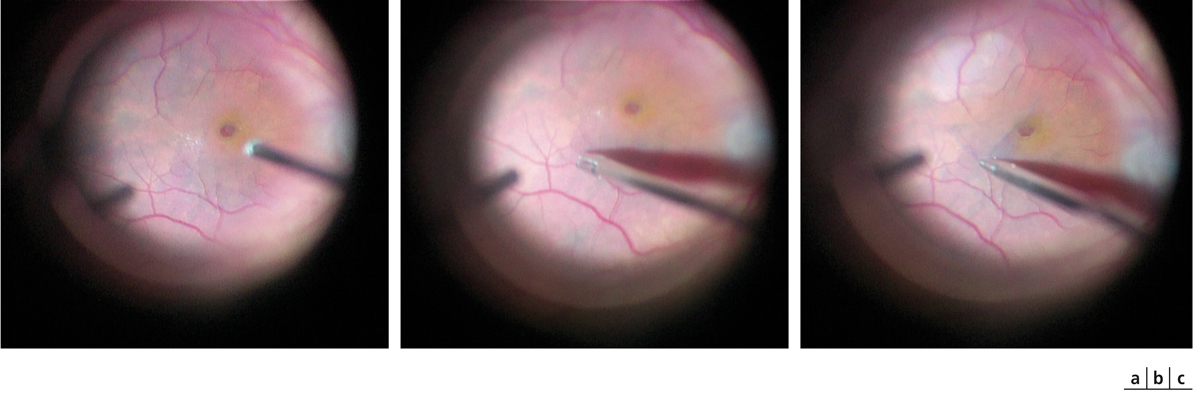
Fig. 13-18 Coloration combinée de la membrane limitante interne et d’une membrane épimaculaire par une combinaison de Brilliant Blue et de bleu de trypan (Membrane Blue Dual®, DORC, Pays-Bas).
a. Après aspiration, une coloration bleu claire apparaît sur les berges du trou maculaire. b. Amorçage du pelage : la limitante interne est colorée et son pelage induit un blanchiment immédiat du tissu sous-jacent. c. Progression du pelage de la limitante interne.
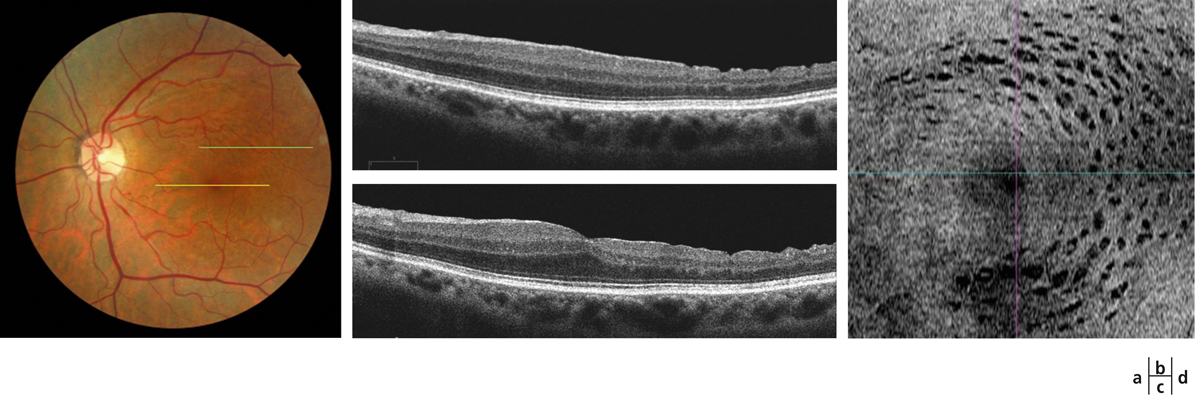
Fig. 13-19 Aspect postopératoire de dissociated optic nerve fiber layer (DONFL).
Sur le cliché en couleurs, on observe en temporomaculaire un aspect alvéolé de dissociation des fibres optiques témoignant d’un pelage étendu de la limitante interne (a). Sur la coupe OCT horizontale centrée sur la région maculaire (c), ces aspects alvéolés correspondent à des lacunes au niveau de la surface de la couche des fibres optiques, encore plus nettement visibles sur la coupe OCT horizontale en région temporomaculaire supérieure (b). Ces lacunes sont très nettement mises en évidence par l’OCT « en face » (d).
Le type de tamponnement le plus couramment utilisé est le tamponnement interne par gaz. Le mécanisme d’action par lequel le gaz participe à la résolution du trou maculaire reste controversé. Il pourrait agir en déshydratant les berges du trou et en prévenant les mouvements liquidiens susceptibles d’interférer avec le processus de cicatrisation. Le choix du type de gaz dépend de la durée de tamponnement souhaitée. Le plus couramment, un mélange gazeux comprenant soit 20–25 % de SF6, soit 17 % de C2F6 semble efficace. Mais certains chirurgiens utilisent un tamponnement plus court (air) ou plus long (C3F8). Le but principal étant de maintenir la région maculaire déshydratée le temps de la cicatrisation, la bulle de gaz doit donc être suffisamment importante pour assurer entre 3 et 7 jours de déshydratation maculaire. L’utilisation de gaz à résorption courte (air, SF6) devra donc être associée à un positionnement plus strict que les gaz à résorption plus longue (C2F6, C3F8). La durée de cicatrisation étant fonction de la taille du trou maculaire, il a été démontré dans plusieurs études que l’observance d’un positionnement « face vers le sol » strict ne modifiait pas significativement le taux de succès de fermeture des petits trous maculaires contrairement aux trous maculaires larges [17].
Enfin, dans certains cas, un tamponnement par silicone pourra être proposé : chirurgie de deuxième intention, transport aérien ne pouvant être différé, décollement de rétine inflammatoire avec déhiscences périphériques multiples et trou maculaire associé, etc.
Le traitement du trou maculaire n’a longtemps reposé que sur la vitrectomie qui reste le traitement de référence. La vitréolyse enzymatique apparaît cependant aujourd’hui comme une alternative intéressante à la chirurgie pour le traitement des menaces de trou maculaire et de certains petits trous maculaires de pleine épaisseur de taille inférieure à 400 µm. Elle repose sur l’injection intravitréenne d’ocriplasmine (Jetrea®, Alcon, Fort Worth, Texas, États-Unis), une protéase recombinante qui agit sur la fibronectine et la laminine présentes à l’interface vitréorétinienne et rompt ces adhérences, permettant ainsi le détachement de la hyaloïde postérieure (fig. 13-20). Il est important de noter que l’efficacité de la vitréolyse enzymatique est nettement meilleure en l’absence de membrane épimaculaire associée [18]. L’administration d’ocriplasmine peut induire un certain nombre d’effets secondaires, notamment corps flottants et photopsie, le plus souvent transitoires [18].
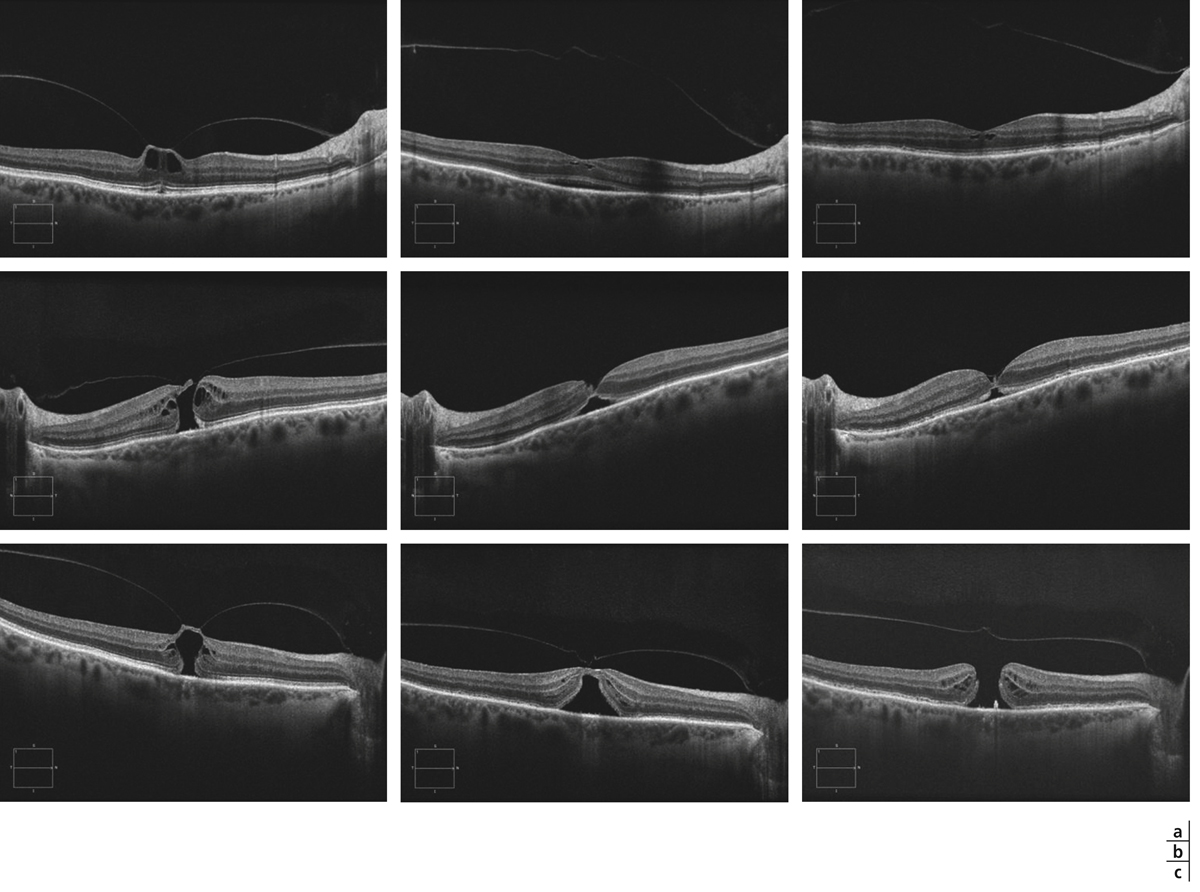
Fig. 13-20 Évolution du profil maculaire en SD-OCT chez trois patients ayant bénéficié d’une injection d’ocriplasmine.
a. Patient présentant une menace de trou maculaire (stade IA). L’attache vitréomaculaire est rompue au 8e jour et le profil fovéolaire tend vers la normalisation à 1 mois. L’attache papillaire persiste cependant. b. Patient présentant un petit trou maculaire de pleine épaisseur de stade II. La hyaloïde postérieure est complètement détachée au 8e jour et la continuité du tissu rétinien maculaire restaurée. Il persiste des altérations architecturales avec un kyste rétrofovéolaire qui tend à diminuer entre le 8e jour et le 1er mois. c. Patient présentant une menace de trou maculaire (stade IB). L’attache vitréomaculaire persiste au 8e jour et un trou maculaire de pleine épaisseur de stade 3 est observé au contrôle à 1 mois. Le patient a ensuite été traité avec succès par vitrectomie.
En pratique, les patients présentant un trou maculaire de stade IA et IB peu symptomatique, conservant une bonne acuité visuelle et peu demandeurs, continueront à être surveillés (tableau 13-2). Les patients présentant un trou maculaire de stade IA et IB symptomatique, invalidant malgré une acuité visuelle supérieure ou égale à 5/10 et demandeurs d’un traitement, pourront bénéficier de l’injection d’ocriplasmine. En cas d’échec, la vitrectomie reste toujours possible. Pour les tractions associées à une vision inférieure à 5/10, les deux options thérapeutiques sont possibles et seront à discuter au cas par cas. Les petits trous maculaires de pleine épaisseur de stade II pourront également bénéficier soit de la vitréolyse enzymatique, soit de la chirurgie. Les trous maculaires de stade II de plus de 250 µm et les stades III et IV restent purement chirurgicaux. Enfin, les trous maculaires anciens ne tirent peu ou pas de bénéfice fonctionnel de la chirurgie et, dans ces cas, l’abstention thérapeutique sera recommandée [19].
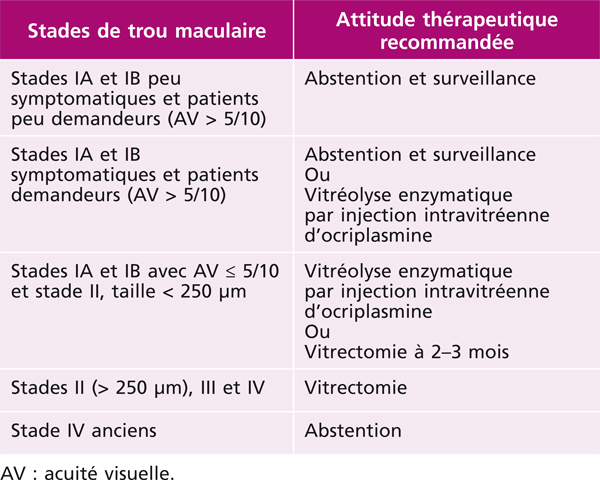
Tableau 13-2 Attitude thérapeutique en fonction du stade de trou maculaire et des symptômes associés.
L’efficacité de la vitréolyse enzymatique a été évaluée par deux études de phase III randomisées contre placebo (injection intravitréenne du solvant), conduites par le MIVI-TRUST (Microplasmin for IntraVitreous Injection–Traction Release withoUt Surgical Treatment) Study Group, qui ont montré que l’injection intravitréenne d’ocriplasmine permet de fermer les trous maculaires de moins de 400 µm dans 40,6 % des cas (10,6 % dans le groupe placebo, p < 0,001) [18], avec un taux de fermeture allant presque jusqu’à 60 % pour le sous-groupe des trous maculaires de moins de 250 µm, l’efficacité étant moins bonne au-delà (fig. 13-20).
En ce qui concerne la vitrectomie, le perfectionnement des techniques opératoires et de l’instrumentation a permis la généralisation d’une chirurgie standardisée et rapide associée à un taux élevé de fermeture des trous maculaires, supérieur à 85–90 % tous stades confondus [20]. Néanmoins, comme pour la vitréolyse, la taille du trou maculaire influence fortement le pronostic chirurgical individuel de chaque patient, un trou de taille supérieure à 400 µm a moins de chance de fermeture après chirurgie qu’un trou de moins de 250 µm.
Sur le plan de l’anatomie, la fermeture du trou maculaire correspond à la restitution de la continuité du tissu neurosensoriel. Le processus de cicatrisation prend plusieurs mois, classiquement de un à six, mais parfois davantage [21]. Si une dépression fovéolaire est le plus souvent retrouvée, il persiste fréquemment des altérations de la région maculaire sous la forme d’une interruption de la ligne de jonction IS-OS (inner and outer segment) – zone ellipsoïde –, d’un amincissement fovéolaire avec, parfois, un aspect de tissu cicatriciel rétrofovéolaire correspondant à une probable prolifération des cellules gliales (fig. 13-21) [22, 23].
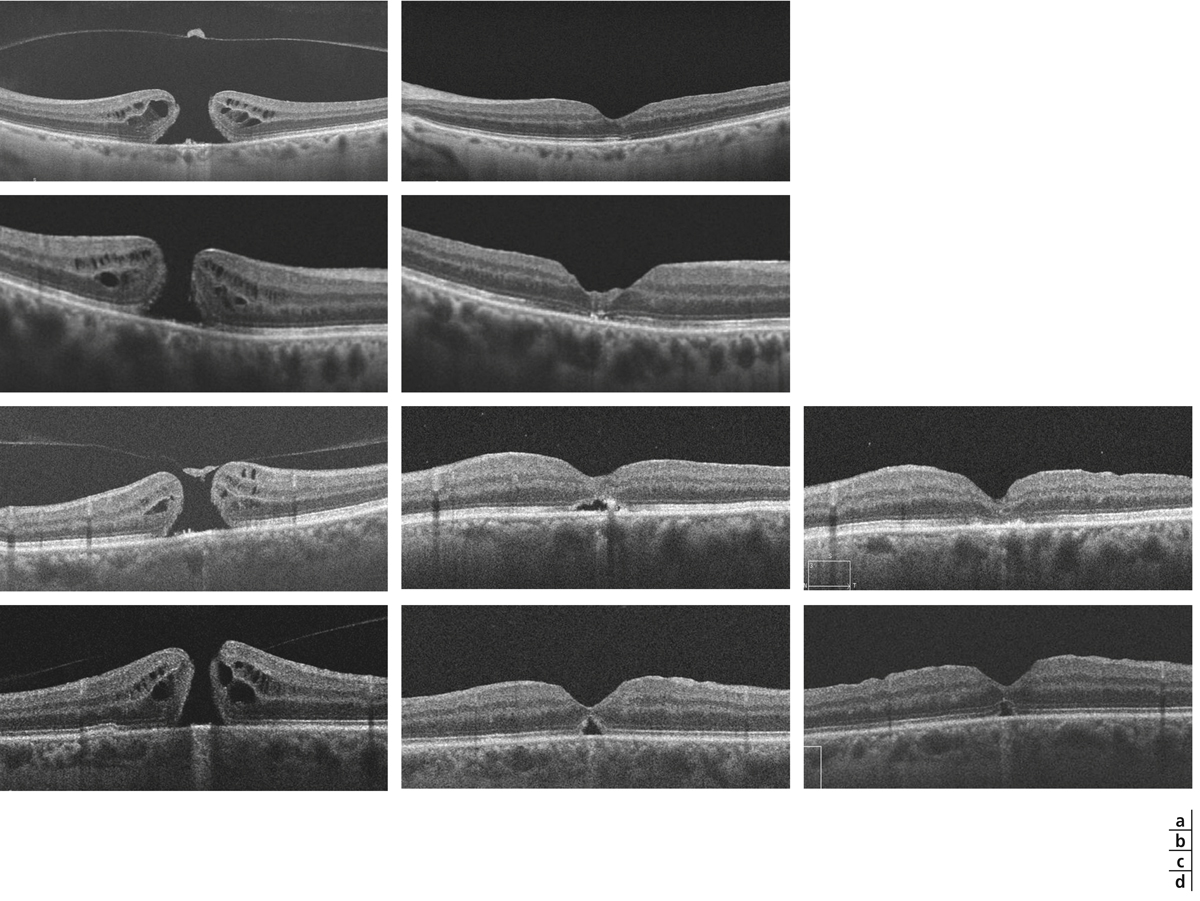
Fig. 13-21 Différents aspects anatomiques postopératoires en SD-OCT après fermeture chirurgicale de trous maculaires.
a. Patient présentant un trou maculaire de stade III. À 1 mois postopératoire, le profil fovéolaire est quasi normalisé. b. Patient présentant un trou maculaire de stade IV. À 3 mois postopératoires, la dépression fovéolaire est retrouvée, mais il existe un aspect cicatriciel rétrofovéolaire correspondant à une probable prolifération des cellules gliales. c. Patient présentant un trou maculaire de stade III. À 1 mois postopératoire, la continuité du tissu rétinien est retrouvée, mais il persiste un soulèvement rétrofovéolaire qui disparaît à 2 mois, mais on note alors un amincissement fovéolaire associé à une altération de la ligne de jonction IS-OS (zone ellipsoïde). d. Patient présentant un trou maculaire de stade II. À 1 mois postopératoire, il existe un microsoulèvement rétrofovéolaire. À 2 mois, il persiste une interruption de la ligne ellipsoïde.
L’amélioration des signes fonctionnels et de l’acuité visuelle est quasi constante après fermeture du trou maculaire. Selon Haritoglou [20], 92 % des patients ont une amélioration de leur acuité visuelle corrigée qui passe en moyenne de 20/100 en préopératoire à 20/32 après la chirurgie (du trou maculaire et de la cataracte, en un ou plusieurs temps). La rapidité de récupération visuelle est un facteur de bon pronostic, mais l’acuité visuelle peut continuer à s’améliorer plusieurs mois ou années après la chirurgie [20, 21]. Cette récupération fonctionnelle reste cependant limitée par deux principaux facteurs : la taille du trou maculaire ainsi que son ancienneté [19].
L’injection d’ocriplasmine est assortie des mêmes risques que toute autre injection intravitréenne (endophtalmie, décollement de rétine, cataracte, etc.). Des risques spécifiques à l’ocriplasmine ont cependant été rapportés, décrits comme étant transitoires et régressifs : corps flottants, photopsie, vision trouble, baisse d’acuité visuelle, dyschromatopsie, etc. Un risque de fragilisation zonulaire secondaire à l’administration répétée d’ocriplasmine a été observé chez l’animal et a conduit à la non-recommandation à réaliser une seconde injection du produit en cas d’échec. Enfin, quelques cas d’altérations de la jonction IS-OS (zone ellipsoïde) ont été observés en OCT suite à l’administration d’ocriplasmine [24].
Les complications liées à la chirurgie n’ont rien de spécifique (cataracte, déchirure iatrogène, décollement de rétine, endophtalmie, etc.), hormis le risque de réouverture du trou maculaire estimé entre 5 à 9 % à 5 ans [25], ce risque semble cependant être quasi éliminé si un pelage de la limitante interne a été réalisé [20].
Les trous maculaires constituent une pathologie du vieillissement maculaire secondaire à la décompensation de tractions vitréomaculaires. Les moyens diagnostiques actuels, au premier rang desquels le SD-OCT, permettent de mieux appréhender le conflit vitréorétinien en cause et de poser les indications thérapeutiques dans l’intérêt de chaque patient. Les progrès techniques (vitrectomie transconjonctivale de petit calibre, instruments chirurgicaux, colorants, OCT peropératoire) et pharmacologiques (ocriplasmine) permettent aujourd’hui de proposer un traitement ambulatoire efficace associé à des risques maîtrisés.
[1] Knapp H. Ueber Isolirte zerreissungen der aderhaut infolge von traumen auf augapfel. Arch Augenheilkd 1869 ; 1 : 6-29.
[2] Gass JD. Idiopathic senile macular hole. Its early stages and pathogenesis. Arch Ophthalmol 1988 ; 106 : 629-39.
[3] Gaudric A, Haouchine B, Massin P, et al. Macular hole formation : new data provided by optical coherence tomography. Arch Ophthalmol 1999 ; 117 : 744-51.
[4] Duker JS, Kaiser PK, Binder S, et al. The International Vitreomacular Traction Study Group classification of vitreomacular adhesion, traction, and macular hole. Ophthalmology 2013 ; 120 : 2611-9.
[5] McCannel CA, Ensminger JL, Diehl NN, Hodge DN. Population-based incidence of macular holes. Ophthalmology 2009 ; 116 : 1366-9.
[6] Niwa H, Terasaki H, Ito Y, Miyake Y. Macular hole development in fellow eyes of patients with unilateral macular hole. Am J Ophthalmol 2005 ; 140 : 370-5.
[7] Chan A, Duker JS, Schuman JS, Fujimoto JG. Stage 0 macular holes : observations by optical coherence tomography. Ophthalmology 2004 ; 111 : 2027-32.
[8] Haouchine B, Massin P, Gaudric A. Foveal pseudocyst as the first step in macular hole formation: a prospective study by optical coherence tomography. Ophthalmology 2001 ; 108 : 15-22.
[9] Casuso LA, Scott IU, Flynn HW Jr, et al. Long-term follow-up of unoperated macular holes. Ophthalmology 2001 ; 108 : 1150-5.
[10] Cheng L, Freeman WR, Ozerdem U, et al. Prevalence, correlates, and natural history of epiretinal membranes surrounding idiopathic macular holes. Virectomy for Macular Hole Study Group. Ophthalmology 2000 ; 107 : 853-9.
[11] Kelly NE, Wendel RT. Vitreous surgery for idiopathic macular holes. Results of a pilot study. Arch Ophthalmol 1991 ; 109 : 654-9.
[12] Gandorfer A, Haritoglou C, Kampik A. Toxicity of indocyanine green in vitreoretinal surgery. Dev Ophthalmol 2008 ; 42 : 69-81.
[13] Farah ME, Maia M, Rodrigues EB. Dyes in ocular surgery : principles for use in chromovitrectomy. Am J Ophthalmol 2009 ; 148 : 332-40.
[14] Balducci N, Morara M, Veronese C, et al. Retinal nerve fiber layer thickness modification after internal limiting membrane peeling. Retina 2014 ; 34 : 655-63.
[15] Tadayoni R, Svorenova I, Erginay A, et al. Decreased retinal sensitivity after internal limiting membrane peeling for macular hole surgery. Br J Ophthalmol 2012 ; 96 : 1513-6.
[16] Terasaki H, Miyake Y, Nomura R, et al. Focal macular ERGs in eyes after removal of macular ILM during macular hole surgery. Invest Ophthalmol Vis Sci 2001 ; 42 : 229-34.
[17] Solebo AL, Lange CA, Bunce C, Bainbridge JW. Face-down positioning or posturing after macular hole surgery. Cochrane Database Syst Rev 2011 ; (12) : CD008228.
[18] Stalmans P, Benz MS, Gandorfer A, et al. Enzymatic vitreolysis with ocriplasmin for vitreomacular traction and macular holes. N Engl J Med 2012 ; 367 : 606-15.
[19] Thompson JT, Sjaarda RN, Lansing MB. The results of vitreous surgery for chronic macular holes. Retina 1997 ; 17 : 493-501.
[20] Haritoglou C, Reiniger IW, Schaumberger M, et al. Five-year follow-up of macular hole surgery with peeling of the internal limiting membrane: update of a prospective study. Retina 2006 ; 26 : 618-22.
[21] Purtskhvanidze K, Treumer F, Junge O, et al. The long-term course of functional and anatomical recovery after macular hole surgery. Invest Ophthalmol Vis Sci 2013 ; 54 : 4882-91.
[22] Haritoglou C, Neubauer AS, Reiniger IW, et al. Long-term functional outcome of macular hole surgery correlated to optical coherence tomography measurements. Clin Experiment Ophthalmol 2007 ; 35 : 208-13.
[23] Funata M, Wendel RT, de la Cruz Z, Green WR. Clinicopathologic study of bilateral macular holes treated with pars plana vitrectomy and gas tamponade. Retina 1992 ; 12 : 289-98.
[24] Kim JE. Safety and complications of ocriplasmin : ocriplasmin, ocriplasmin ; oh, how safe art thou ? JAMA Ophthalmol 2014 ; 132 : 379-80.
[25] Kumagai K, Ogino N, Demizu S, et al. Incidence of reopening and variables that influence reopening after macular hole surgery. Jpn J Ophthalmol 2001 ; 45 : 112-3.