Thérapeutique générale
Coordonné par M. Weber
M. Weber
Si la justification du traitement de l’œdème maculaire est évidente eu égard aux conséquences fonctionnelles d’un œdème et aux séquelles fonctionnelles d’un œdème maculaire non traité, le choix du traitement entre un traitement physique (laser, photothérapie dynamique), un traitement pharmacologique (général ou local) et un traitement chirurgical se fera en fonction de l’étiologie de cette maculopathie œdémateuse et en fonction des éléments scientifiques du moment.
Pendant de nombreuses décennies, en dehors des modalités thérapeutiques spécifiques de l’étiologie, seuls les traitements physiques par laser ou pharmacologiques par acétazolamide, anti-inflammatoires non stéroïdiens (AINS) ou en péri-oculaire pour les corticoïdes, étaient disponibles. Les progrès de la vitrectomie ont ensuite permis l’émergence de stratégies chirurgicales notamment dans le cadre de syndromes de l’interface vitréomaculaire, qu’ils s’agissent des membranes épirétiniennes, des syndromes de traction vitréomaculaire ou des trous maculaires.
Plus récemment, des traitements pharmacologiques soit innovants (anti-vascular endothelial growth factor ou anti-VEGF), soit revisités par leur modalité d’injection intravitréenne (corticoïdes) sont venus bouleverser le paysage thérapeutique des œdèmes maculaires au détriment partiel voire total du laser, de la chirurgie ou des autres modalités pharmacologiques. Ces traitements sont une véritable révolution thérapeutique tant leur profil efficacité/risque est performant. Pour autant, l’inconvénient majeur de ces traitements est leur caractère suspensif et surtout leur courte durée d’efficacité. Raison pour laquelle la recherche s’oriente vers des dispositifs à durée d’efficacité prolongée pour limiter la lourdeur des traitements et de leur suivi. Les nouvelles classes thérapeutiques sont l’autre versant des recherches afin de viser, non seulement la disparition durable de fluide dans l’aire maculaire mais également la survie plus efficace des cellules neuronales et gliales de la rétine. Parmi les modalités thérapeutiques à durée d’action prolongée, présentées dans ce chapitre, il est difficile de prédire laquelle deviendra prépondérante entre les dispositifs intravitréens à durée d’action prolongée ou les stratégies par thérapie génique dont la durée d’action est en théorie définitive. Si le laser est en perte de vitesse, il n’est pas improbable que de nouvelles modalités physiques ou des modes d’application différents ne lui permettent un regain d’intérêt, notamment dans un positionnement plus prophylactique que curatif. Si la chirurgie conserve aujourd’hui une place de choix dans notre arsenal thérapeutique, notamment dans la gestion des syndromes de l’interface vitréomaculaire compliqués d’œdème maculaire, rien ne nous permet de dire quel sera son positionnement futur avec l’avènement de la vitréolyse pharmacologique. Il y a fort à parier qu’outre de nouvelles modalités de traitements (physique, pharmacologique voire à un moindre degré chirurgicale), le positionnement de ces traitements ne se déplace plus en amont pour ne pas dire en prophylaxie des œdèmes maculaires afin de conserver au maximum la meilleure fonction visuelle, qu’elle soit centrale ou péricentrale.
F. Behar-Cohen
➤ Du fait des barrières oculaires, l’œil est un organe clos, considéré comme séparé du reste de l’organisme sur le plan pharmacocinétique.
➤ Les injections péri-oculaires n’épargnent pas le passage systémique mais les injections intra-oculaires assurent un traitement local vrai.
➤ La fenêtre thérapeutique doit être connue et prise en compte pour éviter les risques toxiques et les fluctuations d’efficacité lors des injections intra-oculaires.
➤ Un des plus gros défis de l’ophtalmologie est de trouver des méthodes permettant une libération contrôlée et très prolongée de principe actif (en particulier des protéines) dans le globe oculaire.
De nombreux composés possèdent des propriétés anti-œdémateuses et/ou vaso-actives potentiellement utiles pour traiter les œdèmes maculaires (OM) mais un nombre très restreint de molécules franchit toutes les étapes du développement d’un médicament. Parmi ces obstacles, le choix d’un modèle animal pertinent est un facteur limitant majeur, car il n’en existe pas pour l’OM. Il peut cependant être contourné par l’utilisation de plusieurs modèles qui récapitulent certains aspects pathogéniques. Les autres obstacles relèvent de la pharmacocinétique et de la biodisponibilité oculaire. Inversement, certaines molécules, connues de longue date, peuvent renaître dans une nouvelle indication car formulées de façon optimisée pour l’utilisation oculaire. Le principal exemple est celui de la dexaméthasone, corticostéroïde générique bien connu pour ses effets anti-inflammatoires et anti-œdémateux, dangereux par voie systémique chez le diabétique du fait des risques métaboliques majeurs des corticoïdes, mais efficace et sans effet systémique quand il est formulé dans un implant à usage intra-oculaire. C’est la formulation, la voie d’administration et l’optimisation galénique qui font la différence et permettent de transformer une ancienne molécule en un médicament innovant. Il s’agit d’un processus multidisciplinaire qui utilise les compétences des chimistes, pharmacologues, galénistes, biomatérialistes et ophtalmologistes. Nous aborderons brièvement ces différents aspects dans ce sous-chapitre en insistant plus spécifiquement sur les connaissances fondamentales requises à la compréhension de la problématique.
La description complète des barrières oculaires est disponible aux chapitres 4.2 à 4.4 et ne sera donc pas reprise en détail ici. Nous aborderons plus spécifiquement les différentes barrières à la pénétration des principes actifs (PA) dans le globe oculaire.
La barrière cornéenne s’oppose à la pénétration dans le globe oculaire de nombreux PA instillés du fait des jonctions serrées des cellules épithéliales (poids moléculaire limite 500 D, résistance 5 000–7 000 Ohm.cm2) et du fait de sa structure « sandwich » d’un stroma hydrophile pris entre un épithélium et un endothélium hydrophobes. Seules les molécules de petit poids moléculaire amphiphiles, les acides et bases faibles qui ont un pH physiologique sont en équilibre entre formes ionisée et non ionisée franchissent la barrière cornéenne (par exemple le dexaméthasone sodium phosphate, le timolol et la pilocarpine). Des excipients, considérés comme des conservateurs (par exemple le chlorure de benzalkonium), qui déstabilisent les jonctions, favorisent la pénétration de nombreuses autres molécules. Après instillation, environ 5 à 10 % du PA instillé se distribue dans l’humeur aqueuse et les tissus du segment antérieur. Certaines molécules affines pour les pigments de l’iris et/ou du corps ciliaire peuvent s’y accumuler et être libérées ensuite progressivement. Les PA pénètrent également dans la cavité vitréenne mais du fait de leur dilution et de leur élimination par les voies d’élimination naturelle de l’humeur aqueuse, la concentration atteinte est très faible, en général en dessous des seuils thérapeutiques. Des molécules actives à très faibles doses comme les corticoïdes (doses de l’ordre des nanomètres) ont montré une efficacité limitée sur l’OM même après instillation de formulation optimisée [1]. En théorie, des composés très actifs (dont l’efficacité peut atteindre le picomètre) pourraient, administrés par voie topique, atteindre des taux thérapeutiques anti-œdémateux dans le segment postérieur. Par exemple, les effets bénéfiques observés sur le flux rétinien et de la tête du nerf optique sont corrélés aux taux d’inhibiteurs de l’anhydrase carbonique, administrés par voie topique et indiqués dans le traitement du glaucome [2]. Une étude récente rapporte que pour les OM compliquant les dystrophies rétiniennes héréditaires, les inhibiteurs de l’anhydrase carbonique sont plus fréquemment efficaces en instillation qu’en administration par voie orale, démontrant que la voie topique peut permettre de traiter une pathologie de la rétine [3]. Il est fréquent de voir l’annonce et la publication de résultats montrant que des molécules administrées par voie topique sont efficaces pour cibler des maladies de la rétine même si aucun produit n’a, à ce jour, atteint la phase de mise sur le marché. Ceci tient au fait que la plupart des composés efficaces par voie topique sur des modèles animaux de laboratoire ne donnent pas des résultats similaires chez le primate et chez l’homme, car la pharmacocinétique oculaire diffère selon les espèces. Cependant, plusieurs produits sont actuellement en phase III et pourraient venir détruire ce dogme (la squalamine par exemple, etc.).
La conjonctive et la sclère sont des barrières de faibles résistances (1 000 à 2 000 Ohm.cm2) pour la pénétration de molécules par voie trans-sclérale jusqu’à des poids moléculaires de 40 kDa pour la conjonctive et de 150 kDa pour la sclère. Les molécules hydrophobes ne sont pas de bons candidats, car la sclère est fortement hydrophile. Ainsi, même des protéines ou des peptides hydrophiles ou amphiphiles peuvent passer ces barrières [4]. Le passage trans-scléral antérieur de molécules de faible poids moléculaire, mais aussi de peptides et de protéines, a été démontré et pourrait être une voie préférentielle pour cibler le segment postérieur. Mais après instillation, le temps de résidence à la surface de l’œil est souvent insuffisant pour atteindre des taux thérapeutiques dans le segment postérieur. Par ailleurs, il n’est pas certain que les molécules qui ont franchi la barrière trans-sclérale antérieure diffusent ensuite vers le pôle postérieur, souvent site de la pathologie (fig. 6-1a). L’injection sous-conjonctivale est alors une option intéressante, concentrant localement le PA et favorisant sa diffusion trans-sclérale, comme démontré pour des peptides [5].

Fig. 6-1 Barrières oculaires et limites de poids moléculaires franchissant les différentes barrières.
a. Section longitudinale schématique du globe oculaire et limite supérieure des poids moléculaires (en kDa) des PI franchissant les différentes barrières. Les flèches jaunes indiquent la voie de passage trans-sclérale antérieure. Sur la coupe histologique de rétine : CG : cellules ganglionnaires, NI : nucléaire interne, NE : nucléaire externe, LE : limitante externe, SI : segment interne, SE : segment externe, EPR : épithélium pigmentaire de la rétine. b. Représentation schématique des jonctions entre les expansions des cellules gliales de Müller (en jaune) et des segments internes des photorécepteurs (ici un cône en bleu). TJ : tight junction (jonction serrée), ZO : zonula occudens, JAM : junction associated membrane, AJ : jonctions adhérentes. c. Épithélium pigmentaire de la rétine jointif par des jonctions serrées (TJ) et des jonctions adhérentes (AJ), équipé de multiples transporteurs ioniques et aqueux qui assurent un transport sélectif. Des villosités apicales permettent un contact étroit avec les segments externes des photorécepteurs. À droite, un montage à plat de l’épithélium pigmentaire de la rétine met en évidence la structure hexagonale des cellules liées par des jonctions serrées, marquées ici par l’occludine.
Il occupe une situation stratégique entre les photorécepteurs et la choriocapillaire et son intégrité est fondamentale pour le fonctionnement normal de la rétine, en particulier des photorécepteurs. Les jonctions serrées sont un obstacle aux passages passifs de molécules de part et d’autre de l’épithélium dont la résistance est cependant faible (environ 80 Ohm.cm2) (fig. 6-1c). Le principal obstacle à la pénétration des molécules de la choroïde vers la rétine est plus volontiers l’apanage des transports actifs et sélectifs. Le flux de protéines est sortant de façon physiologique afin de maintenir une pression oncotique élevée et un flux hydro-ionique sortant de la rétine vers la choroïde. Celui-ci fluctue cependant avec l’activité métabolique des photorécepteurs et les conditions d’illumination. Les mécanismes qui régulent les transports transépithéliaux ne sont pas parfaitement connus mais leur régulation est un élément essentiel au maintien du privilège immunologique de l’espace sous-rétinien [6, 7].
Il existe plusieurs barrières physiques à la diffusion de molécules dans la rétine. À partir du vitré, la membrane limitante interne constitue une barrière relative puisque des protéines de haut poids moléculaires (150 kDa) et des systèmes particulaires (jusqu’à 300 nm) peuvent la franchir (fig. 6-1). La limitante externe, formée de jonctions adhérentes et tight-like entre les photorécepteurs et les cellules gliales de Müller (CGM), constitue également une limitation à la diffusion passive de molécules de haut poids moléculaires (fig. 6-1b) [8]. C’est toutefois la structure très hydrophobe et très cellulaire de la rétine et les transports actifs des CGM qui sont les facteurs limitants principaux à la diffusion de PA de part et d’autre de la neurorétine. Ainsi, la pénétration dans le vitré n’est pas synonyme de pénétration transrétinienne et d’atteinte d’une cible neuronale précise.
Les capillaires rétiniens sont formés de cellules endothéliales à jonctions serrées sur une épaisse membrane basale, entourée de péricytes, de cellules microgliales et des extensions des CGM, formant ainsi la barrière hémato-rétinienne interne. Cette dernière contrôle de façon très efficace la pénétration de molécules de la circulation systémique vers la rétine. Des protéines d’efflux, présentes sur les cellules endothéliales, rejettent les substances potentiellement toxiques, en particulier les P-gp. La voie systémique n’est, de ce fait, pas adaptée au traitement des maladies de la rétine sauf en cas de rupture des barrières [9, 10]. La choroïde vascularise de façon indirecte la rétine externe. C’est un tissu de 300 à 500 µm d’épaisseur chez l’homme, limité par la membrane de Bruch en avant et adhérente à la sclère en arrière. Entre la sclère et la choroïde, un vaste espace virtuel, facilement clivable, est identifié comme l’espace suprachoroïdien, facilement accessible et utilisé depuis peu comme voie d’administration de PA ou de polymère, pour la libération contrôlée de PA. La choroïde comporte des cellules pigmentées (mélanocytes) et trois types de vaisseaux : les capillaires (choriocapillaire), les vaisseaux moyens et les gros vaisseaux. Le débit choroïdien est l’un des plus importants de l’organisme puisqu’il est supérieur à celui mesuré dans la substance cérébrale grise, le cœur ou le rein. Il est estimé à 800 ml/min, ce qui représente environ 85 % du débit oculaire. Ce débit entraîne un « lavage » de toute substance qui franchit la sclère et, sans système de réservoir ou de polymère permettant une libération prolongée, la pénétration rétinienne est faible par cette voie. Les capillaires choroïdiens mesurent entre 15 et 30 µm de diamètre, soit 3à 4 fois plus que celui des capillaires rétiniens. Les capillaires sont formés d’une couche de cellules endothéliales comportant de larges fenestrations (60 à 90 nm), dont on sait aujourd’hui qu’elles sont dépendantes du vascular endothelial growth factor (VEGF). Il existe également des protéines d’efflux au niveau des cellules endothéliales de la choriocapillaire. La choriocapillaire est organisée en lobules fonctionnels irrigués par des artérioles indépendantes, sans anastomoses évidentes. Ces unités fonctionnelles ont une taille de 300 µm à 1 mm, les lobules les plus grands étant localisés en rétine périphérique, les plus petits au niveau du pôle postérieur [11–13].
Il est important de considérer les spécificités maculaires quand il s’agit de traiter des pathologies qui l’atteignent. La macula est composée d’un nombre restreint de couche et d’un enrichissement en cônes et en CGM, beaucoup plus nombreuses et disposées en Z (fig. 6-2a à d). Les CGM ont une forme, une structure, une densité et des fonctions différentes au niveau maculaire. Des protéines jonctionnelles de type zonula occludens (ZO-1) assurent des jonctions entre les prolongements des cônes et les cellules de Müller dans la couche de Henlé (fig. 6-2e). La macula est dépourvue de vaisseaux dans la région fovéolaire et bordée d’une membrane limitante interne épaissie d’environ 25 000 Å au pôle postérieur mais très amincie au niveau de la fovéola où elle ne fait plus qu’environ 250 Å (fig. 6-2f et g). Enfin, la bourse prémaculaire forme un réservoir de principe actif juste en avant de la fovéa. Ceci peut expliquer que certaines molécules, même de très haut poids moléculaire comme le bévacizumab, puissent traverser la macula et atteindre ainsi la choroïde. En cas d’œdème, la pénétration de PA est encore augmentée du fait de la perte des barrières physiologiques.

Fig. 6-2 Structure de la macula.
a. Coupe de la macula ne passant pas par la fovéa (dont la direction est indiquée par la flèche). La coloration rouge est spécifique de la glutamine synthétase qui marque les cellules gliales de Müller formant une structure en « Z » et une couche dense au niveau de la couche de Henlé. MLI : membrane limitante interne, MLE : membrane limitante externe. b. Représentation de la structure en « Z » des cellules gliales de Müller maculaires. c, d. Montage à plat d’une macula humaine à faible et fort grossissement montrant l’organisation radiaire des cellules gliales de Müller marquées en rouge par la glutamine synthétase. e. Des jonctions entre les cellules de Müller et avec les axones des photorécepteurs, sont marquées par zonula occludens 1 (ZO-1), une protéine des jonctions serrées. f, g. Photographies en microscopie électronique de la limitante interne de la rétine au pôle postérieur et au niveau de la fovéa, montrant l’amincissement de la limitante au niveau de la fovéa.
(Source : images de M. Savoldelli.)
La pharmacocinétique est la caractérisation des mouvements d’une drogue de l’extérieur vers l’organisme et inversement ainsi qu’à l’intérieur de l’organisme. Elle comporte quatre phases : l’absorption, la distribution, le métabolisme et l’élimination (ADME). L’œil étant un organe isolé et relativement clos, on considère que la pharmacocinétique oculaire peut être analysée de façon indépendante de la pharmacocinétique générale. De plus, comme le passage de molécules du segment antérieur vers le segment postérieur est faible, voire marginale, on a pu étudier de façon indépendante la pharmacocinétique du segment antérieur avec des équations modélisables et vérifiées par l’expérience. Concernant la pharmacocinétique du segment postérieur, la phase d’absorption varie selon la voie d’administration et dépend fortement des barrières oculaires, de la structure physicochimique du principe actif et de sa forme galénique. Après la phase d’absorption, les phases de distribution, de métabolisme et d’élimination n’ont pas pu être modélisées et à ce jour, aucune équation n’a pu être vérifiée expérimentalement de façon satisfaisante. Il est admis qu’une fois dans le vitré, les molécules de haut poids moléculaire, plutôt hydrophobes suivront une élimination par voie transrétinienne, alors que des petites molécules hydrophiles suivront d’avantage une élimination antérieure par la chambre postérieure puis les voies de l’humeur aqueuse. La diffusion d’un PA à partir du vitré dépend de plusieurs facteurs : sa concentration en solution ; sa vitesse de biodégradation ; sa stabilité en solution.
Les mécanismes par lesquels des protéines traversent la rétine ne sont pas complétement élucidés. Une diffusion simple semble peu probable et le suivi de protéines marquées suggère un transport trans-glial par les CGM. De ce fait, la demi-vie des protéines thérapeutiques comprises entre 40 et 150 kDa varie entre 5 et 9 jours selon les espèces et n’est pas influencée par l’état de liquéfaction du vitré ni même par la vitrectomie, qui n’a pas d’effet sur le passage transrétinien des molécules.
Quand la voie d’administration n’est pas directement intravitréenne, des taux thérapeutiques de molécules actives peuvent être atteints dans les tissus oculaires sans que des seuils efficaces soient mesurés dans les milieux oculaires, pouvant conduire à tort à l’inadéquation de cette voie d’administration. Après injection rétrobulbaire de cortisone radioactive, à 5 minutes, 90 % de la dose injectée étaient mesurés dans l’uvée et la rétine et seulement 9 % dans le vitré. Après 5 heures, 18 % étaient encore mesurables dans l’uvée et la rétine et rien dans le vitré. Il est en effet peu fréquent que la cible thérapeutique soit dans le vitré, elle est plutôt dans la choroïde ou dans la rétine dans lesquels il n’est pas possible de réaliser des mesures de concentrations chez l’homme. Dans ces conditions, l’étude pharmacodynamique est essentielle, car elle permet de juger, non pas de la concentration en fonction du temps, mais d’un paramètre d’efficacité clinique objectif comme l’épaisseur maculaire.
Enfin, les études pharmacocinétiques du segment postérieur sont peu nombreuses et complexes car :
les modèles animaux habituels ne sont pas transposables simplement à l’homme. Si les lapins sont utilisés, il est important de choisir une race pigmentée ;
il est difficile de réaliser des mesures longitudinales dans le vitré sans induire des biais expérimentaux (la microdialyse peut être une solution acceptable) ;
la séparation des différents tissus est complexe et la contamination par les liquides habituelle, nécessitant le recours à des dissections sur des globes congelés ;
les volumes sont faibles et les concentrations généralement basses, nécessitant des méthodes analytiques sensibles sur des petits échantillons.
Nous ne détaillerons pas les voies d’administration peu ou pas utilisées à ce jour pour traiter des pathologies rétiniennes, comme l’instillation, dont il a été déjà question précédemment.

Fig. 6-3 Représentation des différentes voies d’administration habituellement utilisées.
IV : injection intraveineuse ; IVT : injection intravitréenne.
En fonction de la profondeur d’introduction de l’aiguille, l’injection est censée atteindre des espaces sous-conjonctivaux, sous-ténoniens, péribulbaires, latérobulbaires ou rétrobulbaire. Intuitivement, on imagine que plus l’aiguille est postérieure, plus de PA atteint facilement la rétine. Peu d’études pharmacocinétiques ont effectivement mesuré les taux de PA dans les milieux et tissus oculaires après différentes voies d’administration. Ces résultats ne sont applicables que chez l’homme car chez l’animal de laboratoire (lapin ou rat), les tissus péri-oculaires sont différents. Chez l’homme, les concentrations de dexaméthasone phosphate disodique atteignent un pic vitréen à 13 ng/ml à 6 heures après injection péribulbaire de 5 mg et un pic vitréen de 72 ng/ml à 3 heures après injection sous-conjonctivale de 2,5 mg. Ainsi, la concentration vitréenne est environ 10 fois supérieure après injection sous-conjonctivale qu’après injection péribulbaire. Cependant, quelle que soit la voie d’administration péri-oculaire, les taux de dexaméthasone circulants sont identiques à ceux observés après une administration de la même dose per os (60 ng/ml pour 5 mg de dexaméthasone), confirmant que les voies péri-oculaires ne sont pas des voies locales vraies, mais permettent une meilleure biodisponibilité oculaire que la voie orale du fait du passage trans-scléral surajouté. Nous avons réalisé des expériences similaires visant à mesurer les concentrations non seulement dans les milieux mais également dans les tissus oculaires chez des lapins pigmentés, après injection sous-conjonctivale de Solumédrol®. Nos résultats confirment que la voie sous-conjonctivale permet d’obtenir des concentrations de Solumédrol® plus de 150 fois supérieures dans la rétine et la choroïde qu’un flash de Solumédrol® à quantité de PA identique (fig. 6-4).
L’injection sous-ténonienne de triamcinolone acétonide est pratiquée régulièrement pour éviter les effets secondaires toxiques potentiels de l’injection intravitréenne. Comme les autres voies péri-oculaires, la voie sous-ténonienne induit une exposition systémique dans 100 % des cas après quelques heures qui se poursuit pendant 3 à 4 jours à des taux significatifs (entre 10 et 30 ng/ml), susceptibles de réduire la production endogène de cortisol et d’induire des désordres métaboliques chez les patients à risque [14, 15]. Des taux vitréens, de l’ordre de 35 ng/ml, se maintiennent en plateau pendant au moins 1 mois, après un pic 3 fois plus élevé observé 3 jours après l’injection de 40 mg.
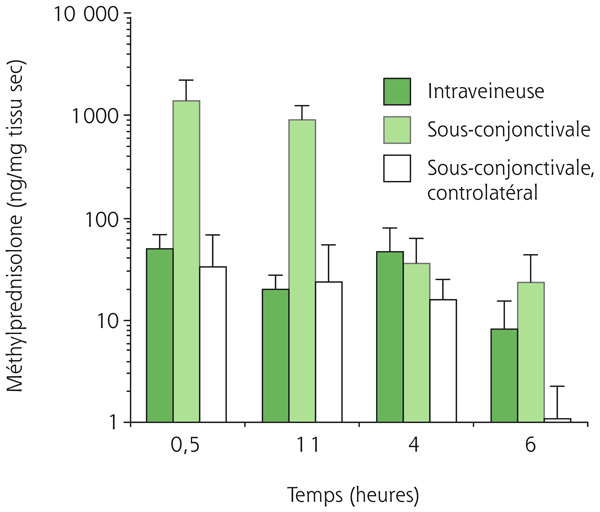
Fig. 6-4 Pharmacocinétique de la méthylprednisolone dans les tissus du segment postérieur (épithélium pigmentaire et choroïde) après injection sous-conjonctivale (dans un seul œil) ou intraveineuse de Solumédrol® (10 mg/kg).
Contrairement aux voies péri-oculaires, la voie intravitréenne est une voie locale vraie, car les taux systémiques sont négligeables et rarement cliniquement significatifs. Après injection de 4 mg de triamcinolone dans le vitré de lapin, les taux maximaux sont de 3 mg/ml, soit 100 fois supérieurs à ceux obtenus après une injection sous-ténonienne d’une dose 10 fois supérieure (40 mg). Les concentrations décroissent jusqu’à 90 jours [16]. Chez l’homme, les taux vitréens étaient également significativement supérieurs après injection intravitréenne qu’après injection sous-ténonienne [17].
Bien que composée de plus 90 % d’eau, la structure physico-chimique du vitré se modifie avec l’âge et dans certaines conditions pathologiques pouvant influer sur la distribution et la diffusion des PA injectés. Le vitré peut apparaître comme un réservoir de drogues qui subissent trois types de force : la pression hydrostatique ; la diffusion ; la convection. La diffusion est plus importante pour des molécules de petit poids moléculaire que pour des macromolécules d’autant plus que le vitré est fibrillaire. La convection affecte plus spécifiquement le mouvement de molécules dont le poids moléculaire excède 40 kDa.
La charge des molécules est importante à considérer dans la formulation d’un PA injectable dans le vitré. D’une manière générale, les PA cationiques interagissent avec les charges négatives du vitré et risquent d’induire des réactions inflammatoires. Il est donc préférable de choisir des formulations anioniques. Le pH et l’osmolarité doivent être respectés et seuls les excipients reconnus dans la pharmacopée pour l’administration intra-oculaire peuvent être utilisés. Toute substance non biodégradable, habituellement éliminée par le rein après injection systémique, risque de s’accumuler dans les cellules de l’épithélium pigmentaire tel le polysorbate. Une fois dans le vitré, le PA s’élimine soit par :
voie antérieure, pour les molécules hydrophiles de faible poids moléculaire comme la fluorescéine glucuronide, les aminoglycosides et la vancomycine avec une demi-vie généralement courte de 4 à 6 heures ;
voie postérieure, pour les molécules comme la céfazoline, la ticarcilline, la clindamycine, la dexaméthasone et les protéines thérapeutiques avec une demi-vie plus longue de 24 heures à plusieurs jours (fig. 6-5a).
Les concentrations rétiniennes de PA dépendent du site d’injection. Plus le site d’injection est postérieur, plus la concentration rétinienne est élevée. La diffusion antérieure augmente quand le site d’injection est rétrocristallinien, même pour les substances hydrophobes, comme cela peut être observé avec la triamcinolone. Les variations des sites d’injection peuvent expliquer des variations pharmacodynamiques et réduisent la reproductibilité des injections [18].
Lors d’injection de systèmes particulaires ou de cristaux dans le vitré, des concentrations focales très importantes peuvent être observées in situ dans la rétine. Les fenêtres thérapeutiques doivent être assez larges pour éviter dans ce cas d’atteindre des seuils toxiques (fig. 6-5b).
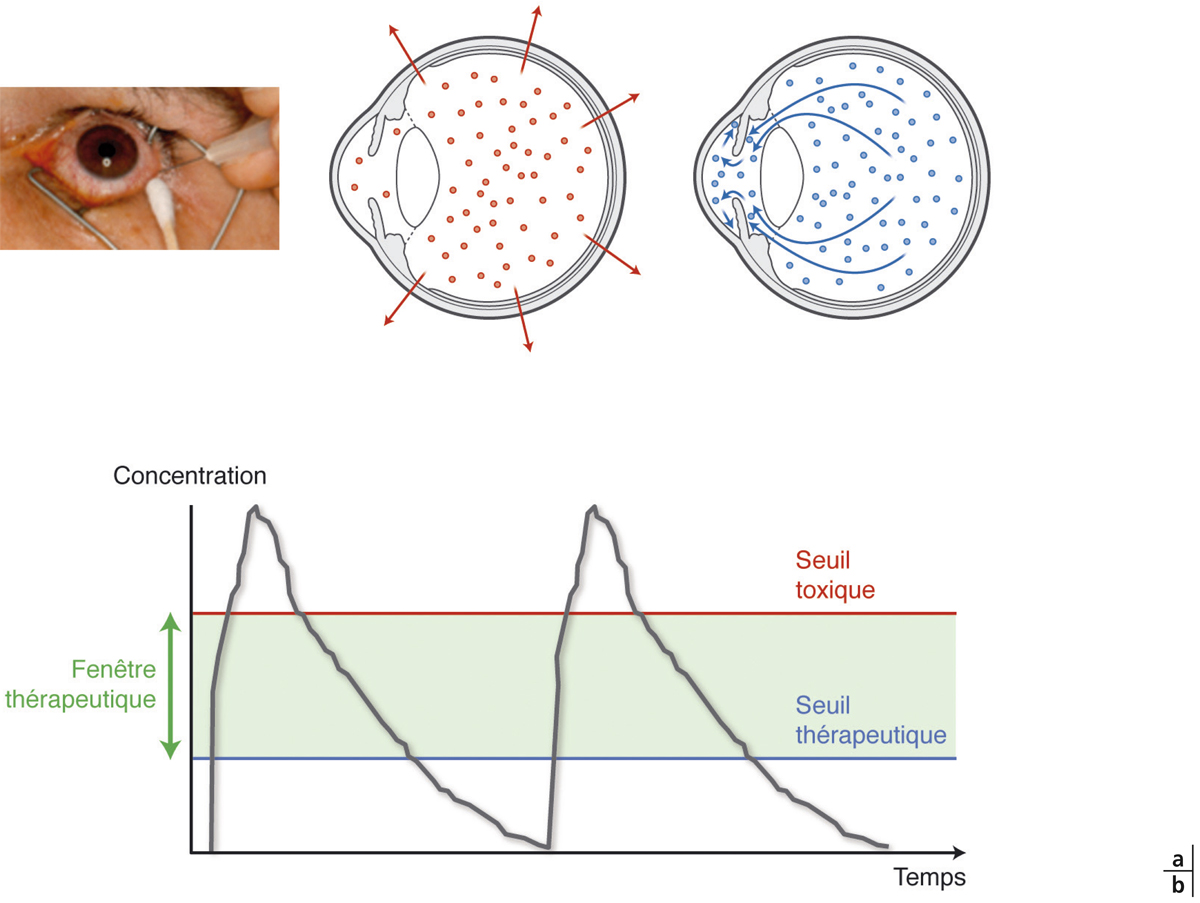
Fig. 6-5 Élimination d’un principe actif injecté dans la cavité vitréenne.
a. Représentation schématique des voies d’élimination : par voie postérieure transrétinienne pour les molécules de haut poids moléculaire et/ou faiblement chargées ; par voie antérieure par les voies d’élimination de l’humeur aqueuse pour les molécules de petit poids moléculaire et/ou fortement chargées. b. Effet pic et vallées. Après injection intravitréenne (flèche) un pic de concentration est obtenu, parfois au-dessus de la fenêtre thérapeutique avec le risque d’atteindre le seuil de toxicité. La concentration vitréenne décroît jusqu’à la prochaine injection en atteignant, à la fin de l’intervalle entre les deux injections, une concentration inférieure à la fenêtre thérapeutique. Une concentration maintenue constante dans la fenêtre thérapeutique permet d’assurer un effet pharmacologique continu et d’éviter les risques de toxicité.
L’espace suprachoroïdien offre un réservoir potentiel de drogues pour le segment postérieur et a été récemment exploré pour cibler les tissus du segment postérieur. Les avantages de cette voie sont un accès simple, un large espace de diffusion, pas d’interférence avec la vision, un ciblage direct de la choroïde et des cellules de l’épithélium pigmentaire. Des systèmes guidés par la lumière ont permis de cibler le pôle postérieur par l’espace suprachoroïdien afin d’y déposer des PA mais leur clairance a été très rapide du fait de la circulation choroïdienne. Plus intéressantes sont les stratégies de systèmes à libération prolongée dans l’espace suprachoroïdien. À ce jour, aucun système d’administration suprachoroïdienne n’est commercialisé. D’autres voies sont en développement, telles que des injections ciblées intrasclérales par micro-aiguilles ou des voies sclérales lamellaires.
La fenêtre thérapeutique définit les zones de concentration de PA pour lesquelles un effet thérapeutique est observé sans effet indésirable (fig. 6-5b). Elle se situe entre seuils d’efficacité et toxicité. Plus la fenêtre thérapeutique est étroite, plus le contrôle des doses est important. Pour prolonger la durée d’efficacité d’un PA injecté dans le vitré, il est classique d’augmenter les doses administrées mais cela comporte deux risques :
celui d’effets off target, c’est-à-dire des effets indépendants de la cible et liés à un surdosage ;
celui d’effets toxiques, à plus ou moins long terme.
Les injections intravitréennes entraînent aussi inévitablement des effets peak and valleys, c’est-à-dire des variations importantes de concentrations médicamenteuses au-dessous et parfois au-dessus de la fenêtre thérapeutique.
Cette question mérite qu’on s’y attarde car en cas d’injection locale, seule la toxicité locale est pertinente. Si les critères de toxicité sont la fonction électrorétinographique ou la vision, seules des toxicités aiguës et massives seront mises en évidence. Les lésions microscopiques ou les signes inflammatoires peuvent être masqués quand les médicaments testés sont anti-inflammatoires. Enfin, les marqueurs classiques de mort cellulaire, comme ceux qui identifient l’apoptose dépendante des caspases, sont souvent négatifs malgré une mort cellulaire importante dans la rétine, car les tissus du système nerveux sont très résistants à l’activation des caspases [19, 20]. Ainsi, d’autres tests et des suivis au long cours doivent être utilisés quand les médicaments ont des demi-vies très longues.
Un des principaux enjeux de la thérapie des maladies de la rétine est la réduction de la fréquence des injections intravitréennes, devenues la voie d’administration principale depuis 10 ans. Plusieurs options sont possibles, le choix dépend des caractéristiques physico-chimiques du PA, de la cible thérapeutique, de la cinétique recherchée et de la fenêtre thérapeutique, des limites techniques et de stérilisation des systèmes et des contraintes liées à la réglementation. De nombreux systèmes sont proposés et il ne sera pas possible d’en faire une revue exhaustive mais des revues générales sur le sujet peuvent être consultées [4, 21, 22]. Nous limiterons cette revue aux systèmes qui sont en cours de développement clinique ou déjà approuvés.
Plusieurs méthodes sont employées pour stabiliser des PA dans le vitré. La pégylation en est un exemple. La conjugaison de molécules de polyéthylène glycol de différentes tailles à un PA, le plus souvent un acide nucléique (comme un apatmère) ou une molécule de nature peptidique, permet d’augmenter le poids moléculaire et de réduire la dégradation enzymatique, assurant ainsi meilleures stabilité et demi-vie [23, 24]. Le pegaptanib (Macugen®, Pfizer) est un oligoaptamère pégylé dont la demi-vie dans le vitré est de 10 ± 4 jours.
La mise en solution de PA très hydrophobe conduit à la formation d’agrégats ou de cristaux solides à partir desquels le PA passe très lentement en solution avec une cinétique de libération non contrôlée, comme c’est le cas pour la triamcinolone acétonide. Un des risques de ces formulations est un dépassement des seuils toxiques à l’endroit où les agrégats ou cristaux sont en contact avec les tissus, et ce d’autant plus que les tissus sont aussi hydrophobes comme c’est le cas pour la rétine [25].
Pour ce qui concerne les protéines, le couplage avec une immunoglobuline permet également d’augmenter le poids moléculaire et la stabilité comme c’est le cas pour l’aflibercept, molécule chimérique qui résulte du couplage de fragments des récepteurs solubles au VEGF à une IgG [26–28]. La demi-vie vitréenne de l’aflibercept est ainsi d’environ 4 jours.
Certaines formulations permettent non seulement d’augmenter le temps de résidence mais aussi d’améliorer la biodisponibilité des PA. C’est le cas des émulsions anioniques, des formulations liposomales et micellaires constituée de substances et de lipides biologiques [29–31].
Les polymères biodégradables présentent l’avantage de disparaître spontanément et ne nécessitent donc pas de retrait. Ils doivent avoir une grande capacité de charge, être de préférence injectables, être bien tolérés et se dégrader en molécules connues dont la tolérance est également assurée. Les étapes de validation réglementaires sont très contraignantes, car le polymère et tous ses produits de dégradation doivent démontrer une innocuité générale et oculaire avant toute tentative d’utilisation chez l’homme. C’est pourquoi très peu de polymères sont actuellement utilisés en médecine humaine [32]. Les systèmes polymériques offrent cependant une grande flexibilité et de multiples variantes ont été envisagées jusqu’à des systèmes complexes assurant un contrôle précis et inductible de la libération de PA mais ils sont encore au stade de développement préclinique [33].
En fonction du type de polymère, la libération d’un PA se fera par diffusion simple au fur et à mesure que des molécules d’eau pénètrent dans les mailles du polymère ou par érosion quand l’hydrolyse de surface libère le PA. La diffusion conduit à une cinétique en trois phases (burst, plateau, burst), alors que l’érosion est plus propice à une libération linéaire avec une cinétique d’ordre zéro et une dégradation complète du polymère avec la libération du PA.
Les acides polylactiques (PLA), polyglycoliques (PGA) et polylactique-co-glycoliques (PLGA) sont les principaux polymères couramment utilisés, ils se dégradent en acide lactique qui acidifie le milieu mais est en général bien toléré, particulièrement dans le vitré car il y a dilution des molécules d’acide. La synthèse des polymères de PLA et de PLGA est effectuée par condensation à haute température. Une fois implantés, ils subissent une érosion massive occasionnant un burst de libération puis une phase de diffusion (dépendante de la vitesse de dégradation du polymère, de la surface du dispositif, de la solubilité aqueuse du PA) et une phase de burst final. Cette cinétique de libération n’est pas idéale, car il persiste souvent du polymère vide en fin de libération. L’Ozurdex® est un exemple d’implant en PLGA libérant de la dexaméthasone phosphate, suffisamment petit pour être injecté et libérer le PA pendant au moins 3 mois (fig. 6-7a). La présence de glucocorticoïdes permet de contrôler d’éventuelles réactions inflammatoires fréquemment observées avec le PLGA.
D’autres polymères ont été utilisés pour la libération de principes actifs dans le vitré. Le polycaprolactone (PCL), synthétisé à haute température par polymérisation de monomères d’ε-caprolactone, est semi-cristallin et hydrophobe. La dégradation très lente permet des libérations avec des cinétiques d’ordre zéro sur plusieurs années et la tolérance est excellente dans le vitré, mais sa dégradation peut libérer des petits fragments polymériques. Aucun produit en PCL n’est actuellement commercialisé pour une indication oculaire.
Les poly-ortho-esters (POE) sont des polymères hydrophobes, dégradés par érosion de surface, selon une cinétique d’ordre zéro lorsqu’ils sont dans un environnement biologique. Les POE peuvent former un gel translucide dans lequel des PA peuvent être mixés sans solvants ce qui permet l’incorporation de protéines et peptides. Les cinétiques de libération peuvent être modulées par l’ajout de sels acides ou basiques. Injecté dans la cavité vitréenne, le POE forme une bulle translucide mobile dont la tolérance est excellente mais la fabrication difficile des POE n’a pas, à ce jour, permis leur industrialisation [34].
D’autres polymères comme les polyanhydrides ou des co-polymères peuvent être conçus mais leur biocompatibilité oculaire doit être démontrée avant toute tentative d’essai chez l’homme.
Les systèmes polymériques dégradables peuvent être utilisés pour la fabrication d’implants injectables ou implantables et de systèmes dispersés comme des nano- ou microparticules (voir fig. 6-13).
Les nanoparticules sont de taille inférieure à 1 µm et comprennent :
les nanosphères où les PA sont enchâssés dans la matrice polymérique ou adsorbées à leur surface ;
les nanocapsules qui possèdent une cavité centrale circonscrite par une enveloppe polymérique.
Les microparticules de taille plus grande agissent comme un réservoir après injection intravitréenne et diffusent peu dans le gel vitréen. Leurs avantages sont : une large surface de diffusion, la possibilité d’injection par des aiguilles de faible diamètre, la vectorisation de molécules de poids moléculaires variables y compris des protéines ou des peptides (voir fig. 6-16) [35].
En revanche, les nanoparticules, quand leur taille est inférieure à 300 nm, traversent la limitante interne et sont internalisées dans les CGM, puis transportées jusqu’à l’épithélium pigmentaire dans lequel elles peuvent s’accumuler [36]. Injectées dans le vitré, les nanoparticules sont donc davantage des systèmes de ciblage cellulaire que des réservoirs de PA (fig. 6-6a) [37].
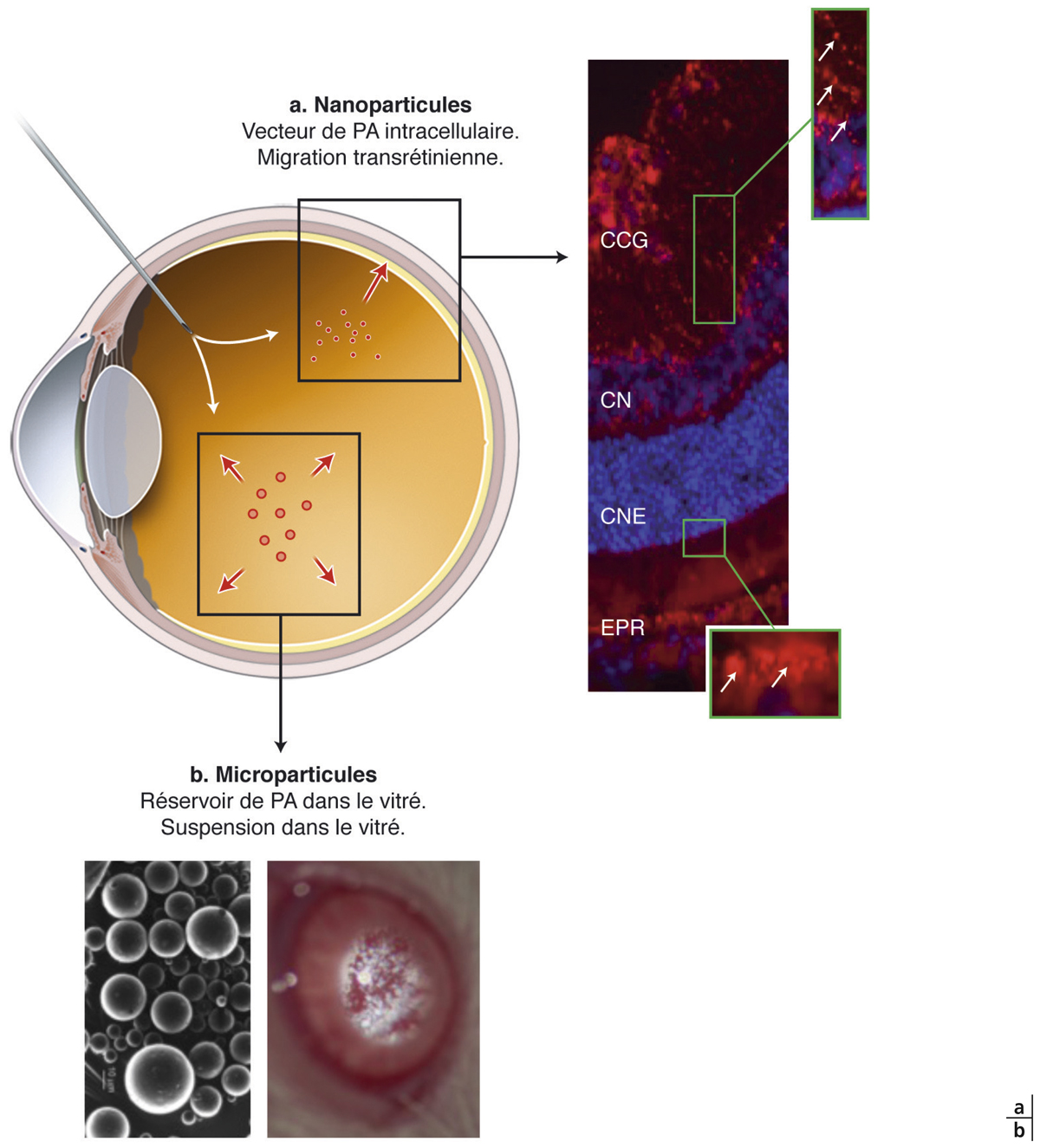
Fig. 6-6 Systèmes particulaires pour la formulation de principe actif dans la cavité vitréenne.
a. Les nanoparticules (< 300 nm) injectées dans la cavité vitréenne (marquées dans cette expérience en rouge) suivent un transport transrétinien et sont internalisées par les cellules de l’épithélium pigmentaire de la rétine (EPR). Les noyaux sont marqués en bleu et les nanoparticules, marquées en rouge, sont visibles dans les cellules gliales de Müller sur le grossissement dans la couche de cellules ganglionnaires (CCG) et dans l’EPR sur le grossissement de gauche, barre = 20 µm. CNI : couche nucléaire interne, CNE : couche nucléaire externe. b. Les microsphères restent en suspension dans la cavité vitréenne comme observé après injection dans la cavité d’un rat.
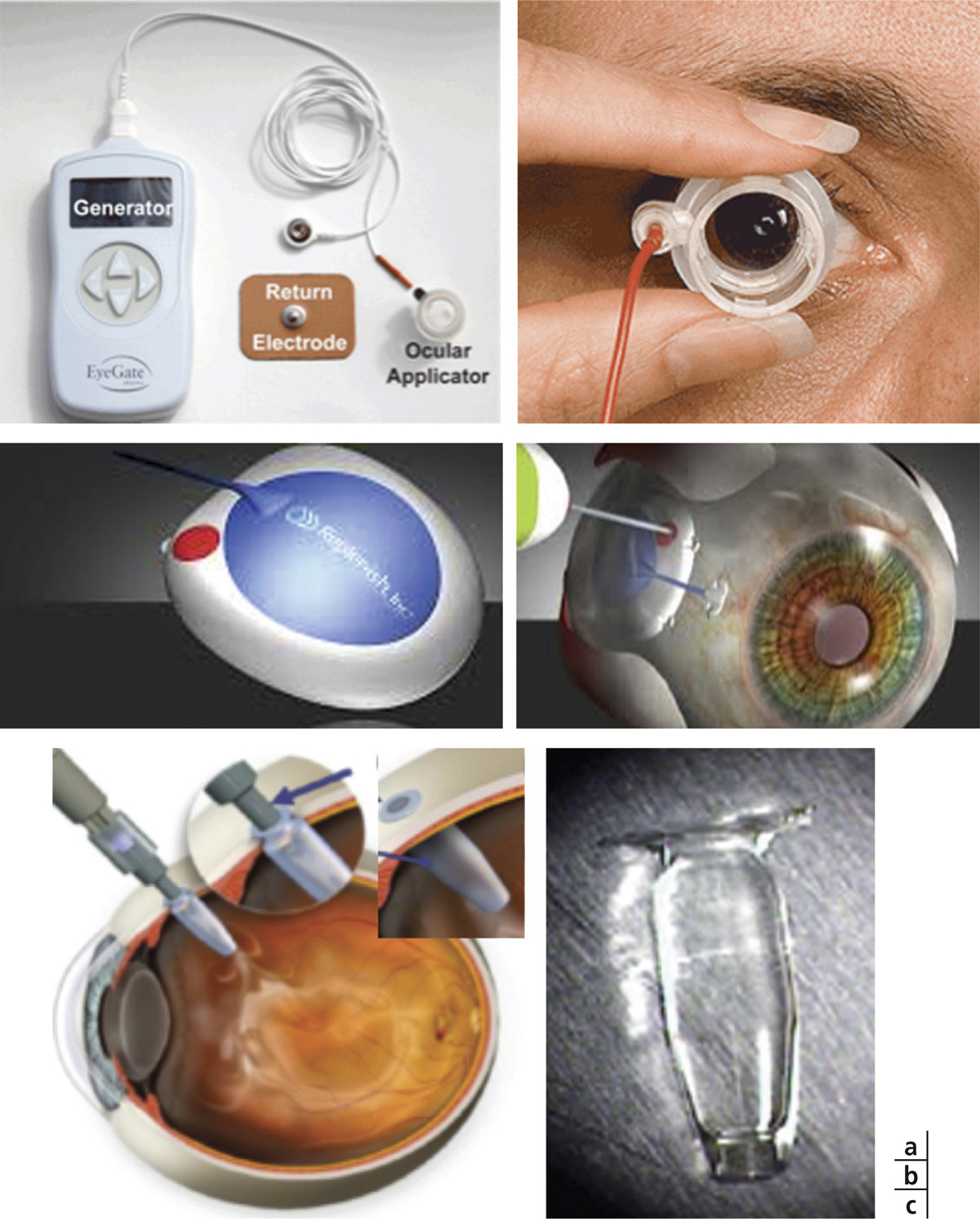
Fig. 6-7 Représentation des différents systèmes d’administration de PA dans le segment postérieur (en cours d’essais cliniques).
a. Eyegate® (Eyegate Pharma, États-Unis), générateur et applicateur d’iontophorèse trans-sclérale pour la libération de dexaméthasone, posé sur la surface d’un œil. b. Replenish® (Alcon, États-Unis), micopompe sclérale, rechargeable pour la libération prolongée de PA dans le vitré. c. ForSight® (Genentech, États-Unis), réservoir rechargeable non biodégradable, intravitréen pour la libération prolongée de ranibizumab.
Fig. 6-13 Implant libérant de la dexaméthasone (Ozurdex®) et visibilité de la matrice dans la cavité vitréenne.

Fig. 6-16 Injecteur permettant de délivrer un implant de 190 μg d’acétonide de fluocinolone (Iluvien®) (a) et visibilité de l’implant (b).
Les implants non biodégradables présentent l’inconvénient de devoir être retirés ou de persister dans le vitré en permanence, même vides. L’avantage de ces implants est un contrôle de la libération du PA et des durées de libération très prolongées pendant plusieurs années. Cependant, la possibilité de retrait peut dans certaines conditions être souhaitable. Si les premières versions de ce type d’implant étaient associées à des taux de complications importants, leur miniaturisation permet d’envisager une utilisation plus large. Reste à définir quelle sera la tolérance à très long terme de ces réservoirs vides, accumulés dans la cavité vitréenne. Les implants actuellement utilisés sont formés d’un copolymère d’alcool polyvinylique – acétate de vinyl-éthylène (polyvinyl alcohol-ethylene-vinyl acetate [PVA-EVA]). Le mécanisme d’action de ces polymères est fondé sur la diffusion d’un fluide (l’eau) au travers du dispositif, dissolvant le médicament granulaire contenu et créant une solution saturée diffusant alors hors du dispositif dans le milieu environnant. Tant que la solution interne au dispositif est saturée, le taux de libération médicamenteux est constant. Des libérations durables très longues (supérieures à 3 ans) ont pu être obtenues avec ce type d’implants. Les implants PVA-EVA Vitrasert®, Retisert® ont évolué vers des implants beaucoup plus petits comme l’Iluvien® dont l’efficacité a été récemment démontrée dans l’œdème maculaire diabétique sévère (fig. 6-7b) [38].
Des systèmes utilisant des méthodes physiques (courants électriques ou ultrasons) permettent de favoriser la pénétration trans-sclérale de molécules de petits poids moléculaire. Un dispositif trans-scléral d’iontophorèse a démontré son efficacité dans plusieurs essais cliniques pour l’administration de corticoïdes (Eyegate Pharma, Boston, États-Unis) (fig. 6-7a). Ce système permet en quelques minutes, sans aucune injection, de faire pénétrer le corticoïde dans les tissus péri-oculaires assurant une libération sur plus de 8 jours [39].
Ces systèmes sont également explorés par plusieurs industriels. Récemment, un nouveau système de micropompe rechargeable très sophistiqué a été développé et est en cours d’évaluation chez l’homme par la société Alcon – Texas, États-Unis (fig. 6-7b) [40].
Des réservoirs implantables dans la cavité vitréenne, non dégradables permettent d’être chargés avec une dose de protéines thérapeutiques suffisante pour une libération contrôlée sur au moins 4 mois. L’implant ForSight Vision® (Menlo Park, Californie, États-Unis) est en cours de développement pour la libération prolongée de ranibizumab (fig. 6-7c).
Pour la production de protéines thérapeutiques dans le segment postérieur du globe oculaire, la thérapie génique est l’option en théorie idéale. Le gène codant pour la protéine est introduit localement dans des cellules qui deviennent les bioréacteurs internes endogènes capables de la produire in situ. Plusieurs types de vecteurs sont disponibles pour apporter le gène thérapeutique dans les cellules productrices. Le choix du vecteur va déterminer la cible cellulaire transfectée, la durée de production et la voie d’administration du vecteur. La figure 6-8 résume les différentes options.
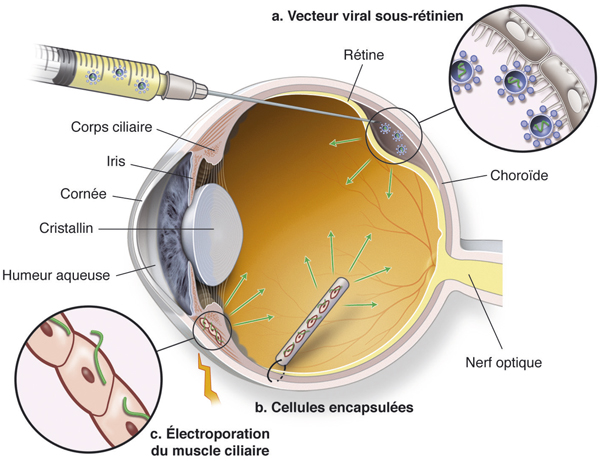
Fig. 6-8 Différentes options pour la production intra-oculaire locale de protéines thérapeutiques secrétées.
a. Induction d’un soulèvement rétinien pour l’injection sous-rétinienne d’un vecteur viral, transfectant les cellules de l’épithélium pigmentaire de la rétine (EPR) pour produire des agents protéiques anti-angiogéniques (développé par Regeneron, États-Unis et Genesight, France). b. Technologie des cellules encapsulées développée par Neurotech, États-Unis. Le plasmide contenant le transgène de la protéine thérapeutique est transfecté par une méthode non virale ex vivo dans des cellules EPR humaines immortalisées, cultivées dans des cellules contenues dans un réservoir non biodégradable, implanté dans la cavité vitréenne et suturé à la sclère (fait 11 mm × 3 mm pour la technologie anti-VEGF). c. Électroporation du muscle ciliaire (Eyevensys, France) : la technique utilise un dispositif mini-invasif pour transfecter in vivo le plasmide contenant le transgène de la protéine thérapeutique dans les cellules du muscle ciliaire qui produit ensuite la protéine dans le vitré.
Les virus adéno-associés (adeno associated virus [AAV]) et les lentivirus sont actuellement testés dans des essais cliniques de thérapie génique oculaire chez l’homme. Ces vecteurs sont très efficaces, ils transfectent, selon les sérotypes et leurs voies d’administration, des cellules rétiniennes et permettent une production très prolongée, voire permanente. Leur tolérance est bonne mais le contrôle de la dose de protéine produite est difficile et l’arrêt de sa production impossible. Actuellement, la société Avalanche (Californie, États-Unis) a testé chez l’homme un vecteur AAV pour produire un récepteur soluble piégeant le VEGF pour traiter les néovaisseaux de la dégénérescence maculaire liée à l’âge (DMLA ; fig. 6-8a). Son rachat par la société Regeneron (États-Unis) promet des nombreux développements dans le domaine. Les sociétés Genzyme (États-Unis) et Oxford Biomedica (Royame-Uni) sont également en cours d’évaluation de cette approche par thérapie génique dans la DMLA humide.
De très nombreux systèmes non viraux ont été développés pour transfecter des cellules rétiniennes. Ils ne pourront être décrits dans ce sous-chapitre mais pour plus de précisions des revues sur le sujet sont disponibles [4, 41–43]. Pour la production de protéines thérapeutiques, l’électroporation du muscle ciliaire est une option séduisante. Un dispositif jetable posé à la surface de l’œil sans chirurgie, permet l’introduction d’un plasmide codant une protéine thérapeutique dans les cellules du muscle ciliaire. Une production allant jusqu’à 9 mois a été démontrée après un traitement de quelques minutes. La société Eyevensys (France) qui développe cette stratégie devrait débuter des essais cliniques prochainement (fig. 6-8c).
Dans cette technologie, la production de protéines thérapeutiques est faite par des cellules de l’épithélium pigmentaire immortalisées et encapsulées dans un réservoir vitréen qui les protègent d’une attaque immunitaire et permet un certain de degré de filtration de produits synthétisés grâce à des filtres. La production de protéine peut être bien contrôlée pendant plusieurs années mais l’exact contenu des substances libérées par ces cellules stimulées dans une cavité vitréenne d’un œil pathologique ne peut pas être contrôlé. Le dispositif peut être retiré ce qui assure une bonne sécurité. La société Neurotech (États-Unis) produit ces implants qui ont été déjà utilisés dans plusieurs essais cliniques pour la production de facteurs neurotrophiques et plus récemment de récepteurs solubles au VEGF pour traiter les néovaisseaux de la DMLA (fig. 6-8b) [44, 45]. Pour cette dernière indication, et afin d’atteindre les taux thérapeutiques, un réservoir contenant plusieurs implants cellulaires est requis, conduisant à un réservoir plus volumineux (2 mm × 9 mm). Des essais de phase III sont attendus avec ces systèmes.
En 10 ans, ce qui semblait futuriste est devenu réalité : des implants injectables biodégradables, des implants miniaturisés non biodégradables, des micropompes rechargeables et des essais de thérapie génique. Il nous est donc permis de parier que d’ici 10 ans, des systèmes contrôlables à distance permettant une médecine personnalisée seront utilisés. Entre-temps, il appartient au thérapeute de bien connaître les avantages et les inconvénients de chaque médicament, de chaque voie d’administration et de chaque système à libération prolongée afin de choisir au mieux le traitement le plus adapté pour un patient donné et sa pathologie en fonction de son évolution. Les systèmes à libération très prolongée, voire permanente exposent à des risques encore inconnus et devront donc être utilisés avec prudence et uniquement quand les autres systèmes ne pourront plus répondre aux besoins thérapeutiques.
[1] Tanito M, Hara K, Takai Y, et al. Topical dexamethasone-cyclodextrin microparticle eye drops for diabetic macular edema. Invest Ophthalmol Vis Sci 2011 ; 52 : 7944-8.
[2] Kadam RS, Jadhav G, Ogidigben M, Kompella UB 14. Ocular pharmacokinetics of dorzolamide and brinzolamide after single and multiple topical dosing : implications for effects on ocular blood flow. Drug Metab Dispos 2011 ; 39 : 1529-37.
[3] Liew G, Moore AT, Webster AR, Michaelides M. Efficacy and prognostic factors of response to carbonic anhydrase inhibitors in management of cystoid macular edema in retinitis pigmentosa. Invest Ophthalmol Vis Sci 2015 ; 56 : 1531-6.
[4] El Sanharawi M, Kowalczuk L, Touchard E, et al. Protein delivery for retinal diseases : from basic considerations to clinical applications. Prog Retin Eye Res 2010 ; 29 : 443-65.
[5] Beydoun T, Deloche C, Perino J, et al. Subconjunctival injection of XG-102, a JNK inhibitor peptide, in patients with intraocular inflammation : a safety and tolerability study. J Ocul Pharmacol Ther 2015 ; 31 : 93-9.
[6] Reichhart N, Strauss O. Ion channels and transporters of the retinal pigment epithelium. Exp Eye Res 2014 ; 126 : 27-37.
[7] Rizzolo LJ, Peng S, Luo Y, Xiao W. Integration of tight junctions and claudins with the barrier functions of the retinal pigment epithelium. Prog Retin Eye Res 2011 ; 30 : 296-323.
[8] Omri S, Omri B, Savoldelli M, et al. The outer limiting membrane (OLM) revisited : clinical implications. Clin Ophthalmol 2010 ; 4 : 183-95.
[9] Hosoya K, Tachikawa M.The inner blood-retinal barrier : molecular structure and transport biology. Adv Exp Med Biol 2012 ; 763 : 85-104.
[10] Cunha-Vaz J, Bernardes R, Lobo C Blood-retinal barrier. Eur J Ophthalmol 2011 ; 21 Suppl 6 : S3-9.
[11] Yu DY, Yu PK, Cringle SJ, et al. Functional and morphological characteristics of the retinal and choroidal vasculature. Prog Retin Eye Res 2014 ; 40 : 53-93.
[12] Kur J, Newman EA, Chan-Ling T. Cellular and physiological mechanisms underlying blood flow regulation in the retina and choroid in health and disease. Prog Retin Eye Res 2012 ; 31 : 377-406.
[13] Nickla DL, Wallman J. The multifunctional choroid. Prog Retin Eye Res 2010 ; 29 : 144-68.
[14] Kovacs K, Wagley S, Quirk MT, et al. Pharmacokinetic study of vitreous and serum concentrations of triamcinolone acetonide after posterior sub-tenon’s injection. Am J Ophthalmol 2012 ; 153 : 939-48.
[15] Nan K, Sun S, Li Y, et al. Characterisation of systemic and ocular drug level of triamcinolone acetonide following a single sub-Tenon injection. Br J Ophthalmol 2010 ; 94 : 654-8.
[16] Ye YF, Gao YF, Xie HT, Wang HJ. Pharmacokinetics and retinal toxicity of various doses of intravitreal triamcinolone acetonide in rabbits. Mol Vis 2014 ; 20 : 629-36.
[17] Inoue M, Takeda K, Morita K, et al. Vitreous concentrations of triamcinolone acetonide in human eyes after intravitreal or subtenon injection Am J Ophthalmol 2004 ; 138 : 1046-8.
[18] Laude A, Tan LE, Wilson CG, et al. Intravitreal therapy for neovascular age-related macular degeneration and inter-individual variations in vitreous pharmacokinetics. Prog Retin Eye Res 2010 ; 29 : 466-75.
[19] Torriglia A, Valamanesh F, Behar-Cohen F. On the retinal toxicity of intraocular glucocorticoids. Biochem Pharmacol 2010 ; 80 : 1878-86.
[20] Onodera H, Sasaki S, Otake S, et al. General considerations in ocular toxicity risk assessment from the toxicologists’viewpoints. J Toxicol Sci 2015 ; 40 : 295-307.
[21] Yasukawa T, Ogura Y, Tabata Y, et al. Drug delivery systems for vitreoretinal diseases. Prog Retin Eye Res 2004 ; 23 : 253-81.
[22] Kim YC, Chiang B, Wu X, Prausnitz MR. Ocular delivery of macromolecules. J Control Release. 2014 ; 190 : 172-81.
[23] Pfister D, Morbidelli M. Process for protein PEGylation. J Control Release 2014 ; 180 : 134-49. Review.
[24] Vllasaliu D, Fowler R, Stolnik S. PEGylated nanomedicines : recent progress and remaining concerns. Expert Opin Drug Deliv 2014 ; 11(1) : 139-54. Review.
[25] Valamanesh F, Torriglia A, Savoldelli M, et al. Glucocorticoids induce retinal toxicity through mechanisms mainly associated with paraptosis. Mol Vis 2007 ; 13 : 1746-57.
[26] Shi S. Biologics : an update and challenge of their pharmacokinetics. Curr Drug Metab 2014 ; 15 : 271-90.
[27] Ezan E. Pharmacokinetic studies of protein drugs : past, present and future. Adv Drug Deliv Rev 2013 ; 65 : 1065-73.
[28] Chong V. Biological, preclinical and clinical characteristics of inhibitors of vascular endothelial growth factors. Ophthalmologica 2012 ; 227 Suppl 1 : 2-10.
[29] Patel A, Cholkar K, Agrahari V, Mitra AK. Ocular drug delivery systems : an overview. World J Pharmacol 2013 ; 2 : 47-64.
[30] Bochot A, Lajavardi L, Camelo S, et al. of liposomes for the intravitreal injection of therapeutic molecules. Ann Pharm Fr 2011 ; 69 : 100-7.
[31] Bourges JL, Touchard E, Kowalczuk L, et al. Drug delivery systems for intraocular applications. J Fr Ophtalmol 2007 ; 30 : 1070-88.
[32] Bourges JL, Bloquel C, Thomas A, et al. Intraocular implants for extended drug delivery : therapeutic applications.Adv Drug Deliv Rev 2006 ; 58 : 1182-202.
[33] Yasin MN, Svirskis D, Seyfoddin A, Rupenthal ID. Implants for drug delivery to the posterior segment of the eye : a focus on stimuli-responsive and tunable release systems. J Control Release 2014 ; 196 : 208-21.
[34] Einmahl S, Capancioni S, Schwach-Abdellaoui K, et al. Gurny Therapeutic applications of viscous and injectable poly(ortho esters). Adv Drug Deliv Rev 2001 ; 53 : 45-73.
[35] Herrero-Vanrell R, Bravo-Osuna I, Andrés-Guerrero V, et al. The potential of using biodegradable microspheres in retinal diseases and other intraocular pathologies. Prog Retin Eye Res 2014 ; 42 : 27-43.
[36] Zhou HY, Hao JL, Wang S, et al. Nanoparticles in the ocular drug delivery. Int J Ophthalmol 2013 ; 6 : 390-6.
[37] Bourges JL, Gautier SE, Delie F, et al. Ocular drug delivery targeting the retina and retinal pigment epithelium using polylactide nanoparticles. Invest Ophthalmol Vis Sci 2003 ; 44 : 3562-9.
[38] Soubrane G, Behar-Cohen F. Fluocinolone acetonide (ILUVIEN®) micro-implant for chronic diabetic macular edema. J Fr Ophtalmol 2015 ; 38 : 159-67.
[39] Cohen AE, Assang C, Patane MA, et al. ; Avion Study Investigators. Evaluation of dexamethasone phosphate delivered by ocular iontophoresis for treating noninfectious anterior uveitis. Ophthalmology 2012 ; 119 : 66-73.
[40] Humayun M, Santos A, Altamirano JC, et al. Implantable micropump for drug delivery in patients with diabetic macular edema. Transl Vis Sci Technol 2014 ; 3 : 5. eCollection 2014 Oct.
[41] Bloquel C, Bourges JL, Touchard E, et al. Non-viral ocular gene therapy : potential ocular therapeutic avenues. Adv Drug Deliv Rev 2006 ; 58 : 1224-42.
[42] Tamboli V, Mishra GP, Mitrat AK. Polymeric vectors for ocular gene delivery. Ther Deliv 2011 ; 2 : 523-36.
[43] Bejjani RA, Andrieu C, Bloquel C, et al. Electrically assisted ocular gene therapy. Surv Ophthalmol 2007 ; 52 : 196-208.
[44] Pilli S, Zawadzki RJ, Telander DG.The dose-dependent macular thickness changes assessed by fd-oct in patients with retinitis pigmentosa treated with ciliary neurotrophic factor. Retina 2014 ; 34 : 1384-90.
[45] Kauper K, McGovern C, Sherman S, et al. Two-year intraocular delivery of ciliary neurotrophic factor by encapsulated cell technology implants in patients with chronic retinal degenerative diseases. Invest Ophthalmol Vis Sci 2012 ; 53 : 7484-91.
A. Darugar, M. Weber
➤ Les corticostéroïdes demeurent depuis leur découverte une pierre angulaire du traitement des inflammations et sont devenus ces dernières années des drogues essentielles à la gestion de nombreux œdèmes maculaires.
➤ Ils sont souvent délivrés localement et assez volontiers par l’intermédiaire de dispositifs à libération prolongée.
➤ Le choix du traitement corticoïde dépendra de l’effet attendu avec une sélection selon sa puissance, sa pharmacocinétique, ses effets indésirables et selon la voie d’administration souhaitée (collyre ; pommade ; injections péri-oculaire, intravitréenne, orale ou intraveineuse).
➤ Les corticoïdes sont de puissants anti-œdémateux et des anti-inflammatoires utiles pour traiter la part inflammatoire de nombreux œdèmes maculaires.
➤ Leur grande efficacité ne fera pas oublier leurs potentiels effets indésirables, généraux et locaux, et particulièrement le risque de glaucome et/ou de cataracte cortico-induite.
➤ L’avènement probable de stéroïdes dépourvus d’effets indésirables, notamment oculaires, sera une nouvelle grande avancée thérapeutique.
Les corticoïdes ont commencé à être utilisés en ophtalmologie à la fin des années 1940. Il s’agit en réalité de traitements par hormone pituitaire (adrenocorticotrophic hormone [ACTH]) dont les effets anti-inflammatoires ont été décrits par Hench en 1949 [1]. Les premières utilisations de l’ACTH en ophtalmologie sont rapportées dans l’uvéite, l’épisclérite ou la rétinite hémorragique [2–5].
Les injections péri-oculaires de corticoïdes et l’utilisation topique apparaissent très rapidement et sont décrites par Gordon en 1955 [6, 7]. Les injections intravitréennes de cortisone sont rapportées pour la première fois en 1977. Un dermatologue a injecté de façon involontaire de la cortisone par un dispositif appelé Dermojet® qui a perforé le globe. Les auteurs rapportent l’absence d’effet secondaire délétère [8].
Les effets des corticoïdes sont médiés par :
leur fixation sur l’ADN cellulaire qui modifie la transcription de différents gènes ; ceux-ci vont altérer la synthèse protéique à l’origine des différents effets thérapeutique bénéfiques mais aussi délétères ;
l’inhibition de la phospholipase A2 de la cascade de l’acide arachidonique diminuant ainsi la synthèse de prostaglandines et de leucotriènes.
Ils ont différents effets.

Fig. 6-9 Mode d’action des stéroïdes.
Les corticoïdes entraînent une diminution de la réaction inflammatoire tant le plan du recrutement des cellules qui interviennent dans l’inflammation que sur la production des médiateurs de l’inflammation.
Les corticoïdes induisent :
une séquestration des lymphocytes T, notamment des T helpers, d’où une diminution du recrutement des cellules immunologiques sur le site inflammatoire ;
une diminution du nombre des monocytes, éosinophiles et basophiles circulants ;
la production de neutrophiles par la moelle osseuse ;
une inhibition de la sécrétion de médiateurs de l’inflammation, notamment par les macrophages, de cytokines pro-inflammatoires et de molécules d’adhésion favorisant notamment la diapédèse.
Au niveau cellulaire, on observe à la fois des effets anti-inflammatoires et immunosuppresseurs comprenant une diminution de l’activité bactéricide, de la réaction d’hypersensibilité, de la production de lymphokines. La balance inflammatoire est modulée sur le versant anti-inflammatoire par la production de cytokines freinant le processus inflammatoire [9].
L’effet anti-inflammatoire est différent d’une molécule à l’autre. La puissance anti-inflammatoire de chaque molécule administrée par voie générale est bien connue. Son action anti-inflammatoire peut être quantifiée par rapport au cortisol (tableau 6-1).

Tableau 6-1 Action anti-inflammatoire des corticoïdes : puissance des différents corticostéroïdes.
Les mécanismes d’action par lesquels les corticoïdes réduisent une maculopathie œdémateuse sont en partie élucidés, faisant intervenir à des degrés divers :
leur capacité à réduire la rupture des barrières hémato-oculaires notamment en augmentant l’activité et/ou la densité des systèmes de jonction intercellulaire (ZO-1, occludine) [10 ,11] et en diminuant la synthèse de VEGF et des prostaglandines ;
leur rôle dans la stabilité de la perméabilité cellulaire de l’épithélium pigmenté de la rétine ;
leur rôle dans la régulation de l’homéostasie sous l’influence de la microglie et des cellules de Müller en agissant notamment sur les canaux aquaporines AQP4 et KIR4.1 [12].
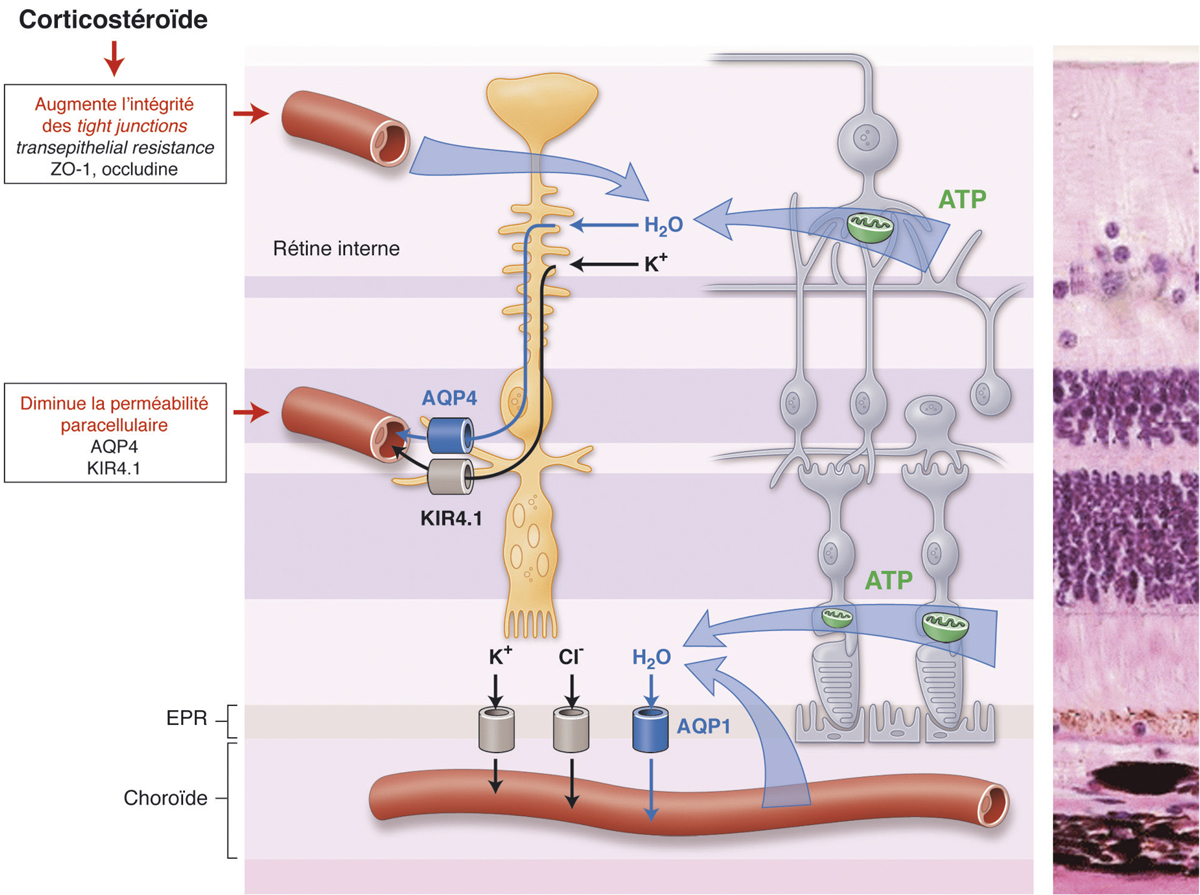
Fig. 6-10 Activité anti-œdémateuse des corticostéroïdes à la fois en augmentant l’intégrité des tights junctions et en diminuant la perméabilité paracellulaire au niveau des canaux aquaporines et KIR4.1 présents au niveau des cellules de Müller.
Par ailleurs, les corticoïdes ont un effet anti-angiogénique lié, notamment, à l’inhibition de facteurs de croissance néovasculaires (dont le VEGF) et des métalloprotéinases avec pour conséquence une diminution de la migration des cellules endothéliales.
La pénétration dans l’œil, la concentration intra-oculaire et la durée de présence des corticoïdes dépendent de nombreux facteurs :
l’état de l’œil : la pénétration est augmentée en cas d’inflammation intra-oculaire par altération des barrières hémato-oculaires ou par altération de l’épithélium cornéen ;
la galénique : les gels et pommades augmentent le temps de résidence du principe actif. Les suspensions permettent d’augmenter le temps de contact avec la cornée. Les dispositifs à libération prolongée (implant de dexaméthasone et implant de fluocinolone) permettent des libérations de stéroïdes sur plusieurs mois à plusieurs années ;
la voie d’administration :
la voie topique par collyre ou pommade : elle permet d’obtenir des concentrations généralement inférieures aux autres voies d’administration notamment chez le patient phake,
les injections péri-oculaires (sous-conjonctivale, latérobulbaire ou sous-ténonienne) : la justification de l’administration péri-oculaire de corticoïde tient au fait que la concentration intravitréenne de corticoïde est quinze fois plus élevée après une injection sous-conjonctivale de 2,5 mg de dexaméthasone qu’après la prise de 50 mg de prednisone par voie orale depuis plusieurs jours [13–15]. Certains éléments, notamment en regard du gradient de concentration dans l’œil et de données d’imagerie par corticoïde marqué au gadolinium, plaident en faveur d’une pénétration intra-oculaire par le limbe plutôt que par voie trans-sclérale [16]. La pénétration des corticoïdes dans l’humeur aqueuse est plus importante lors d’une injection sous-conjonctivale que par voie topique,
les injections intravitréennes : la concentration de corticoïdes dans le vitré après injection intravitréenne est près de 100 fois supérieure à celle obtenue après injection sous-ténonienne [17] ;
du rythme d’administration : pour la prednisolone 1 % en collyre, la pénétration est multipliée par cinq en cas d’instillation d’une goutte toutes les heures et par six en cas d’administration toutes les 5 minutes par rapport à une administration toutes les 4 heures [18] ;
du choix du corticoïde – entre un stéroïde à effet immédiat ou retard (triamcinolone) – et de sa concentration.
Le choix du corticoïde devra tenir compte de(s) :
la puissance du corticoïde (tableau 6-1) ;
la solubilité des corticoïdes : la solubilité dans l’eau est de ≈ 100 µg/ml pour la dexaméthasone, ≈ 20–30 µg/ml pour l’acétonide de triamcinolone et ≈ 4 µg/ml pour l’acétonide de fluocinolone ;
la forme galénique : collyre, pommade, soluté pour injection péri-oculaire ou intravitréenne, dispositif biodégradable ou non injecté dans le vitré, dispositif non biodégradable inséré chirurgicalement dans la cavité vitréenne ;
la durée d’action obtenue : de quelques heures à quelques années ;
l’effet thérapeutique attendu, en termes de bénéfices fonctionnels et anatomiques pour des OM de différentes étiologies ;
effets indésirables potentiels.
L’utilisation par voie topique est extrêmement fréquente. Les collyres ou pommades corticoïdes sont des acides et sont donc souvent associés à des acétates (hydrocortisone) ou des phosphates (dexaméthasone). Ils peuvent être combinés à une molécule d’antibiotique. Les formes sans conservateur sont peu nombreuses actuellement. Les formes en suspension doivent être bien agitées avant utilisation au risque d’avoir un dépôt au fond du flacon et une diminution de la concentration du principe actif délivré [19].

Tableau 6-2 Différents corticoïdes ayant une AMM en ophtalmologie.
La dexaméthasone a la particularité d’avoir un effet anti-inflammatoire puissant et un effet immédiat. Le pic de concentration maximale est atteint au bout de 10 minutes avec une concentration moyenne encore disponible de près de la moitié du pic à 24 heures [20]. La dexaméthasone sous forme de phosphate sodique de dexaméthasone est commercialisée sous le nom de Ozurdex® et est disponible à concentrations de 4 mg/ml ou 20 mg/5 ml. Si ce corticoïde est choisi, il devra être réinjecté de façon fréquente compte tenu de sa courte durée d’action.
La bétaméthasone est un autre stéroïde aussi puissant que la dexaméthasone, utilisable pour injection péri-oculaire, à durée d’action courte, sous la forme de phosphate bisodique de bétaméthasone sous le nom de Célestène® disponible à la concentration de 4 mg/ml.
La triamcinolone est un corticoïde à efficacité anti-inflammatoire puissant, mais moindre que la dexaméthasone dont la durée d’action est plus prolongée à la même dose. La forme commerciale disponible en France est dénommée Kénacort retard® (acétonide de triamcinolone sous la forme de cristaux blancs + excipient) à 40 mg/ml dont la caractéristique est d’être un corticoïde à effet retardé. La concentration intravitréenne de triamcinolone met 24 heures pour atteindre un pic puis décroît progressivement. À noter que le pic de concentration maximum est atteint en 1 heure dans l’humeur aqueuse mais également dans le plasma [21]. Il est important de rappeler que la partie active de la solution se trouve dans les cristaux blancs et qu’il est donc indispensable de bien agiter la seringue avant d’injecter le produit pour ne pas diminuer l’efficacité du produit. La triamcinolone injectée par voie sous-conjonctivale, à raison de 300 ml, est présente, sous la forme d’un dépôt blanchâtre des cristaux contenant le corticoïde, pendant une durée d’environ 3 mois (fig. 6-11).

Fig. 6-11 Injection sous-conjonctivale de stéroïde (a) et présence de cristaux d’acétonide de triamcinolone (b).

Fig. 6-12 Injections sous-ténonienne (a) et latérobulbaire (b).
Les corticoïdes disponibles pour les injections intravitréennes (IVT) rassemblent des solutions et des dispositifs, biodégradables ou pas :
la dexaméthasone injectée directement dans la cavité vitréenne a une durée d’action très courte, du fait de sa solubilité, ce qui n’en fait pas un traitement de choix dans le traitement des OM ;
la triamcinolone est la molécule qui a été longtemps utilisée notamment dans le traitement de l’œdème maculaire diabétique. Dans une étude française chez des patients diabétiques, la demi-vie de la triamcinolone injectée sous forme de Kénacort retard® à la dose de 4 mg était estimée à 15,4 ± 1,9 jours avec une durée moyenne de l’effet de 140 jours [22]. Dans les yeux vitrectomisés, la demi-vie de la triamcinolone serait presque 6 fois plus courte [23]. Dans une autre série de six patients ayant bénéficié d’une injection unique de 4 mg de triamcinolone, la molécule restait détectable dans le vitré jusqu’à 2,75 mois après l’injection [24] ;
des dispositifs à libération prolongée sont récemment apparus sur le marché :
l’implant biodégradable contenant 700 µg de dexaméthasone est le premier à avoir obtenu une autorisation de mise sur le marché (AMM) (Ozurdex® ; fig. 6-13). L’implant est composé d’un mélange de polymères d’acide polylactique et polyglycolique dont l’érosion spontanée libère progressivement la dexaméthasone [25, 26]. Le dispositif est mis en place par une IVT à la pars plana. Au cours d’études expérimentales, après injection d’Ozurdex® chez des primates, la concentration maximale moyenne de dexaméthasone dans le liquide sous-rétinien atteignait 1110 ng/g, soit près de 100 fois la concentration susceptible d’être obtenue chez l’homme après administration per os et plus de 10 fois celle obtenue après injection péribulbaire. Leur intérêt réside dans la délivrance prolongée de corticoïde (fig. 6-14) et dans la limitation des effets secondaires (effets toxiques rétiniens observés de façon expérimentale et risque d’hypertonie) par rapport à la triamcinolone [27, 28],
les dispositifs non biodégradables libérant de l’acétonide de fluocinolone :
le premier en date est le Retisert® (fig. 6-15) qui n’est pas disponible en France compte tenu de ses effets secondaires (notamment le fort risque d’hypertonie nécessitant le recours à une chirurgie) [29] et de son prix élevé. Il s’agit d’un dispositif en polyvinyl alcool de 5 mm de longueur, 2 mm de largeur et 3 mm d’épaisseur libérant 0,3 à 0,4 mg/jour d’acétonide de fluocinolone pendant environ 2 ans et demi. Ce dispositif est introduit par une sclérotomie de 3,5 mm à la pars plana et suturé à la sclère [30],
l’Iluvien® est un autre dispositif non biodégradable contenant 190 μg d’acétonide de fluocinolone (fig. 6-16). Il est administré par IVT à la pars plana par l’intermédiaire d’un injecteur 25 gauges. Sur le plan pharmacocinétique, la libération du principe actif est linéaire sur une période de 36 mois (fig. 6-17) [31] permettant un effet thérapeutique sur une période de 2 à 3 ans.
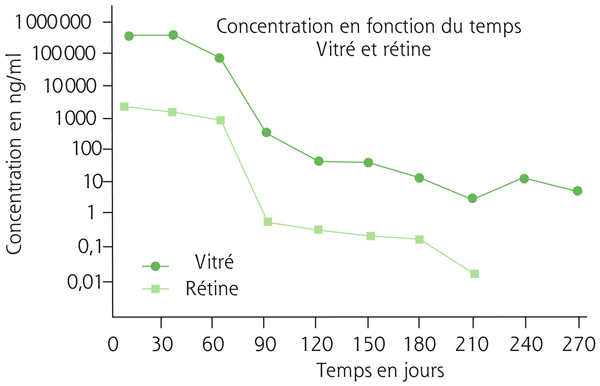
Fig. 6-14 Pharmacocinétique de l’implant de dexamétahsone (DXM) 700 μg (Ozurdex®).
Concentration en fonction du temps de dexaméthasone dans le vitré (en vert foncé) et dans la rétine (en vert clair) en ng/ml.
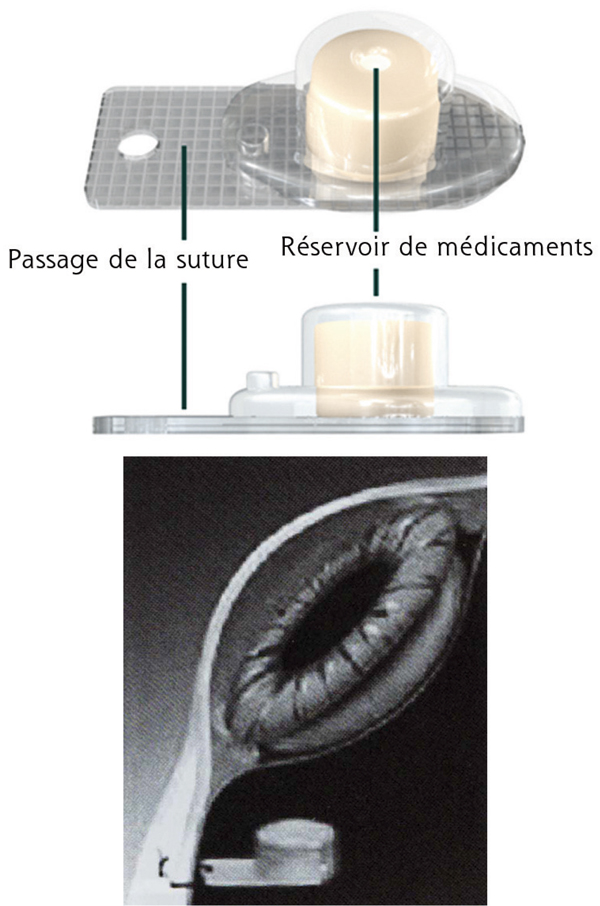
Fig. 6-15 Implant libérant de l’acétonide de fluocinolone (Retisert®) et visualisation dans l’œil après implantation chirurgicale.
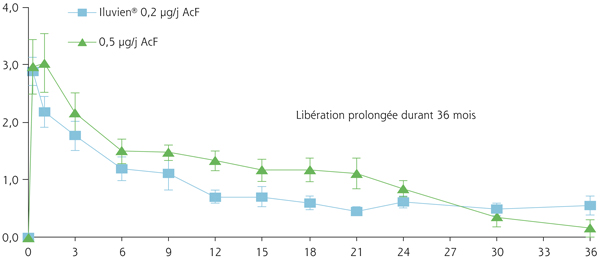
Fig. 6-17 Pharmacocinétique de libération de l’acétonide de fluocinolone en mg dans l’humeur aqueuse, notamment pour l’implant libérant 0,2 µg/j de l’Iluvien® (courbe bleue) et 0,5 µg/j d’acétonide de fluocinolone (courbe verte).
0,2 µg/j d’acétonide de fluocinolone ou AcF (Iluvien®) : dose ayant l’AMM.
Les corticoïdes oraux sont habituellement administrés sous forme de prednisone (Cortancyl®) en raison de sa meilleure biodisponibilité, à une posologie initiale de 1 mg/kg. Leur usage concerne principalement les patients porteurs d’uvéite, plus ou moins compliquée d’œdème maculaire. La posologie est ensuite diminuée par paliers très progressifs afin de déterminer un éventuel seuil de cortico-dépendance, caractérisée par une recrudescence de l’inflammation oculaire et éventuellement la réapparition de signes de gravité. Pour un adulte de poids moyen, on procède à la décroissance suivante : 60 mg/jour, 40 mg/jour, 30 mg/jour, 25 mg/jour, 20 mg/jour ; puis décroissance par paliers de 2 mg jusqu’à 10 mg/jour puis par paliers de 1 mg. Les paliers ont une durée de 8 à 30 jours selon la gravité de l’uvéite et les réponses aux traitements antérieurs. Dans le cas d’une uvéite cortico-sensible avec un seuil de cortico-dépendance inférieur à 10 mg/jour, une corticothérapie à la dose minimale efficace peut être poursuivie pendant plusieurs mois à plusieurs années. Si ce seuil est supérieur à 10 mg/jour, un traitement immunosuppresseur et/ou immunomodulateur peut être associé à la corticothérapie. Il est indispensable d’associer à la prescription des corticostéroïdes au long cours, les mesures préventives des complications systémiques.
Les bolus intraveineux de méthylprednisolone sont parfois utilisés, notamment dans certaines uvéites postérieures sévères, afin d’obtenir une activité anti-inflammatoire intense et rapide. Les bolus de 250 mg à 1 g (selon l’état général) de méthylprednisolone par voie intraveineuse lente (IVL) 3 jours de suite sont utilisés à la phase aiguë des rétinochoroïdites non infectieuses sévères menaçant le pronostic visuel dans les situations suivantes : lésions à proximité de la fovéa, OM ou décollement de l’épithélium pigmentaire majeur, vasculite ou papillite sévères a fortiori s’ils compliquent une entité clinique d’évolution connue défavorable (choroïdite serpigineuse, ophtalmie sympathique, maladie de Vogt-Koyanagi-Harada, rétinochoroïdopathie de type Birdshot ou choroïdite multifocale très inflammatoire) et/ou si les lésions sont bilatérales, récidivantes, ou surviennent sur un œil fonctionnellement unique.
Les effets secondaires oculaires les plus fréquents sont l’hypertonie ou le glaucome cortisoné.
Les stéroïdes augmentent la pression intra-oculaire (PIO) par diminution de l’excrétion de l’humeur aqueuse secondaire à une modification de la matrice extracellulaire du trabéculum notamment chez des patients prédisposés génétiquement. Armaly et al. ont rapporté que 30 à 40 % des patients de la population générale, exposés à un traitement local topique, ont une élévation modérée de la PIO [32, 33]. Ce chiffre s’élève à 90 % chez des patients glaucomateux [34]. L’hypertonie oculaire survient en moyenne entre 2 et 6 semaines après le début du traitement [32, 33]. Le plus souvent, la tension oculaire revient à sa valeur habituelle à l’arrêt de l’effet thérapeutique. De nombreuses études suggèrent le rôle de la susceptibilité génétique à l’élévation pressionnelle, notamment au niveau des gènes codant pour la myocilline [35–37]. Le test de provocation par collyre de dexaméthasone, visant à identifier les patients répondant par une hypertonie oculaire, n’est généralement pas retenu en clinique du fait de sa mauvaise prédictibilité avec un certain nombre de faux négatifs.
Ce risque d’hypertonie cortisonée dépendra du corticoïde utilisé (acétonide de fluocinolone > acétonide de triamcinolone > dexaméthasone), de sa dose, du lieu d’injection (à proximité ou non du trabéculum).
Le développement d’une cataracte de localisation sous-capsulaire postérieure lors d’un traitement corticoïde, oral ou topique, est une complication connue depuis le début de son utilisation [38, 39]. Le mécanisme exact de sa formation reste encore sujet à débat de nos jours. Ont été évoquées des voies impliquant ou non des récepteurs spécifiques aux glucocorticoïdes. Ces derniers pourraient se lier à des protéines cristalliniennes (alpha-cristalline notamment) dont ils modifieraient la structure formant ainsi des opacités [40–44]. Ce risque de cataracte dépendra du type de corticoïde utilisé, de la voie d’administration et de la durée du traitement. Les injections péri-oculaires et intravitréennes, dès lors qu’elles sont répétées dans la durée, finiront toujours par induire une cataracte cortisonique.
Ce risque de cataracte cortisonée est fonctions de la puissance du stéroïde utilisé, de la dose, de la voie d’administration (IVT > péri-oculaire > collyre > intraveineuse > per os) et de la durée de présence du stéroïde. L’expérience montre que la cataracte cortisonée apparaît immanquablement après quelques mois d’un traitement intravitréen continu.
Les corticoïdes employés localement, collyres y compris, ont un passage systémique et ils peuvent conduire à des effets indésirables sur certains terrains : enfants et patients diabétiques notamment. Les effets secondaires extra-ophtalmologiques de la cortisone sont nombreux notamment lors de la prise orale et prolongée. Ces effets secondaires sont moins fréquents lors d’une administration oculaire bien que le traitement locorégional n’ait rien d’un traitement strictement local. Parmi ceux-ci, citons : diabète, hypercorticisme iatrogène, hyperlipidémie, hypercatabolisme protidique, troubles hydro-électriques, ostéoporose cortisonique, ostéonécrose aseptique de la tête fémorale, retard ou arrêt de croissance, myopathie cortisonique, pathologies cutanées (acné, folliculite bactérienne). Le sevrage d’une corticothérapie orale peut également poser quelques problèmes : insuffisance surrénale aiguë, syndrome de sevrage (anxiété, stress, algies diffuses) et hypertension intracrânienne bénigne chez l’enfant [45].
Voies péribulbaires :
plaie du globe (risque plus faible en temporal) ;
dans les sclérites, inhibition de la formation du collagène pouvant occasionner une perforation du globe ;
ptosis (risque de 2,5 à 3,5 %) ;
diplopie par fibrose des muscles oculomoteurs ;
occlusion vasculaire choroïdienne ou rétinienne.
Voie intravitréenne :
endophtalmie soit bactérienne, soit aseptique chez 0,1 à 0,5 % des patients injectés dans le vitré. Ces endophtalmies apparaissent durant les 7 premiers jours et se caractérisent plus par une baisse d’acuité visuelle ± une rougeur oculaire que par une douleur oculaire ou un hypopion. Il semblerait que les endophtalmies stériles soient plus fréquentes chez le patient pseudophake ;
Décollement de rétine 1,8 % ;
Risque de réactivation herpétique et nécrose rétinienne.
Les corticoïdes ont été une vraie révolution dans la prise en charge des pathologies inflammatoires en général et en ophtalmologie en particulier, depuis leur découverte il y a 60 ans. La corticothérapie locale, notamment par voie intravitréenne, est devenue une modalité thérapeutique de choix dans de nombreux œdèmes maculaires.
[1] Hench PS, Slocumb CH. The effects of the adrenal cortical hormone 17-hydroxy-11-dehydrocorticosterone (Compound E) on the acute phase of rheumatic fever; preliminary report. Proc Staff Meet Mayo Clin 1949 ; 24 : 277-97.
[2] Theodore FH. Use of cortisone in severe bilateral uveitis. Eye Ear Nose Throat Mon 1950 ; 29 : 314-5.
[3] Posner A. Cortisone in the treatment of recurrent iritis associated with Marie-Struempell spondylitis. Eye Ear Nose Throat Mon 1950 ; 29 : 316-7 ; passim.
[4] Steffensen EH, Olson JA, Margulis RR, et al. The experimental use of cortisone in inflammatory eye disease. Am J Ophthalmol 1950 ; 33 : 1033-40.
[5] Woods AC. Clinical and experimental observation on the use of ACTH and cortisone in ocular inflammatory disease. Am J Ophthalmol 1950 ; 33 : 1325-49.
[6] Gordon DM. Ocular therapy with the topical application of hydrocortisone. Ann N Y Acad Sci 1955 ; 61 : 549-60.
[7] Gordon DM. Prednisone and prednisolone in ocular disease. Am J Ophthalmol 1956 ; 41 : 593-600.
[8] Perry HD, Nauheim JS, Cameron CD. Intravitreal injections by a Dermojet syringe. Ann Ophthalmol 1977 ; 9 : 737-40.
[9] Tamura H, Miyamoto K, Kiryu J, et al. Intravitreal injection of corticosteroid attenuates leukostasis and vascular leakage in experimental diabetic retina. Investig Opthalmology Vis Sci 2005 ; 46 : 1440.
[10] Antonetti DA, Wolpert EB, DeMaio L, et al. Hydrocortisone decreases retinal endothelial cell water and solute flux coincident with increased content and decreased phosphorylation of occludin. J Neurochem 2002 ; 80 : 667-77.
[11] Felinski EA, Cox AE, Phillips BE, Antonetti DA. Glucocorticoids induce transactivation of tight junction genes occludin and claudin-5 in retinal endothelial cells via a novel cis-element. Exp Eye Res 2008 ; 86 : 867-78.
[12] Pannicke T, Iandiev I, Wurm A, et al. Diabetes alters osmotic swelling characteristics and membrane conductance of glial cells in rat retina. Diabetes 2006 ; 55 : 633-9.
[13] Weijtens O, Schoemaker RC, Romijn FPHTM, et al. Intraocular penetration and systemic absorption after topical application of dexamethasone disodium phosphate. Ophthalmology 2002 ; 109 : 1887-91.
[14] Weijtens O, Feron EJ, Schoemaker RC, et al. High concentration of dexamethasone in aqueous and vitreous after subconjunctival injection. Am J Ophthalmol 1999 ; 128 : 192-7.
[15] Weijtens O, Schoemaker RC, Lentjes EG, et al. Dexamethasone concentration in the subretinal fluid after a subconjunctival injection, a peribulbar injection, or an oral dose. Ophthalmology 2000 ; 107 : 1932-8.
[16] Kim H, Robinson MR, Lizak MJ, et al. Controlled drug release from an ocular implant : an evaluation using dynamic three-dimensional magnetic resonance imaging. Invest Ophthalmol Vis Sci 2004 ; 45 : 2722-31.
[17] Inoue M, Takeda K, Morita K, et al. Vitreous concentrations of triamcinolone acetonide in human eyes after intravitreal or subtenon injection. Am J Ophthalmol 2004 ; 138 : 1046-8.
[18] Sirbat D, Marchal-Heussler L, Hoffman M, Maincent P. Ways to improve ocular bioavailability for topical applications. J Fr Ophtalmol 2000 ; 23 : 505-9 ; quiz 523.
[19] Diestelhorst M, Kwon KA, Süverkrup R. Dose uniformity of ophthalmic suspensions. J Cataract Refract Surg 1998 ; 24 : 672-7.
[20] Jain MR, Srivastava S. Ocular penetration of hydrocortisone and dexamethasone into the aqueous humour after subconjunctival injection. Trans Ophthalmol Soc U K 1978 ; 98 : 63-5.
[21] Shen L, You Y, Sun S, et al. Intraocular and systemic pharmacokinetics of triamcinolone acetonide after a single 40-mg posterior subtenon application. Ophthalmology 2010 ; 117 : 2365-71.
[22] Audren F, Tod M, Massin P, et al. Pharmacokinetic-pharmacodynamic modeling of the effect of triamcinolone acetonide on central macular thickness in patients with diabetic macular edema. Invest Ophthalmol Vis Sci 2004 ; 45 : 3435-41.
[23] Beer PM, Bakri SJ, Singh RJ, et al. Intraocular concentration and pharmacokinetics of triamcinolone acetonide after a single intravitreal injection. Ophthalmology 2003 ; 110 : 681-6.
[24] Mason JO, Somaiya MD, Singh RJ. Intravitreal concentration and clearance of triamcinolone acetonide in nonvitrectomized human eyes. Retina Phila Pa 2004 ; 24 : 900-4.
[25] Hainsworth DP, Pearson PA, Conklin JD, Ashton P. Sustained release intravitreal dexamethasone. J Ocul Pharmacol Ther Off J Assoc Ocul Pharmacol Ther 1996 ; 12 : 57-63.
[26] Morita Y, Ohtori A, Kimura M, Tojo K. Intravitreous delivery of dexamethasone sodium m-sulfobenzoate from poly(DL-lactic acid) implants. Biol Pharm Bull 1998 ; 21 : 188-90.
[27] Valamanesh F, Torriglia A, Savoldelli M, et al. Glucocorticoids induce retinal toxicity through mechanisms mainly associated with paraptosis. Mol Vis 2007 ; 13 : 1746-57.
[28] Torriglia A, Valamanesh F, Behar-Cohen F. On the retinal toxicity of intraocular glucocorticoids. Biochem Pharmacol 2010 ; 80 : 1878-86.
[29] Pearson PA, Comstock TL, Ip M, et al. Fluocinolone acetonide intravitreal implant for diabetic macular edema : a 3-year multicenter, randomized, controlled clinical trial. Ophthalmology 2011 ; 118 : 1580-7.
[30] Jaffe GJ, Yang CH, Guo H, et al. Safety and pharmacokinetics of an intraocular fluocinolone acetonide sustained delivery device. Invest Ophthalmol Vis Sci 2000 ; 41 : 3569-75.
[31] Campochiaro PA, Hafiz G, Shah SM, et al. sustained ocular delivery of fluocinolone acetonide by an intravitreal insert. Ophthalmology 2010 ; 117 : 1393-9.e3.
[32] Armaly MF. Effect of corticosteroids on intraocular pressure and fluid dynamics. I. THE effect of dexamethasone in the normal eye. Arch Ophthalmol 1963 ; 70 : 482-91.
[33] Armaly MF, Becker B. Intraocular pressure response to topical corticosteroids. Fed Proc 1965 ; 24 : 1274-8.
[34] Tripathi RC, Parapuram SK, Tripathi BJ, et al. Corticosteroids and glaucoma risk. Drugs Aging 1999 ; 15 : 439-50.
[35] Polansky JR, Nguyen TD. The TIGR gene, pathogenic mechanisms, and other recent advances in glaucoma genetics. Curr Opin Ophthalmol 1998 ; 9 : 15-23.
[36] Lo WR, Rowlette LL, Caballero M, et al. Tissue differential microarray analysis of dexamethasone induction reveals potential mechanisms of steroid glaucoma. Invest Ophthalmol Vis Sci 2003 ; 44 : 473-85.
[37] Liu Y. Reversal of mutant myocilin non-secretion and cell killing : implications for glaucoma. Hum Mol Genet 2004 ; 13 : 1193-204.
[38] Black RL, Oglesby RB, Von Sallmann L, Bunim JJ. Posterior subcapsular cataracts induced by corticosteroids in patients with rheumatoid arthritis. JAMA 1960 ; 174 : 166-71.
[39] Williamson J, Paterson RW, McGavin DD, et al. Posterior subcapsular cataracts and glaucoma associated with long-term oral corticosteroid therapy. In patients with rheumatoid arthritis and related conditions. Br J Ophthalmol 1969 ; 53 : 361-72.
[40] Gupta V, Wagner BJ. Expression of the functional glucocorticoid receptor in mouse and human lens epithelial cells. Invest Ophthalmol Vis Sci 2003 ; 44 : 2041-6.
[41] James ER, Robertson L, Ehlert E, et al. Presence of a transcriptionally active glucocorticoid receptor alpha in lens epithelial cells. Invest Ophthalmol Vis Sci 2003 ; 44 : 5269-76.
[42] Jobling AI, Stevens A, Augusteyn RC. Binding of dexamethasone by alpha-crystallin. Invest Ophthalmol Vis Sci 2001 ; 42 : 1829-32.
[43] Bucala R, Manabe S, Urban RC, Cerami A. Nonenzymatic modification of lens crystallins by prednisolone induces sulfhydryl oxidation and aggregate formation: in vitro and in vivo studies. Exp Eye Res 1985 ; 41 : 353-63.
[44] Bucala R, Gallati M, Manabe S, et al. Glucocorticoid-lens protein adducts in experimentally induced steroid cataracts. Exp Eye Res 1985 ; 40 : 853-63.
[45] Godeau P, Herson S, Piette JC. Traité de médecine. 3e éd. Paris : Flammarion ; 1998.
A. Blériot, M. Weber
➤ Les anti-inflammatoires non stéroïdiens (AINS), en inhibant de la cyclo-oxygénase, diminuent la synthèse des prostaglandines dont on connaît les rôles inflammatoire, vasodilatateur et algogène.
➤ Parmi les AINS en collyre, on distingue les indoliques (indométacine), les acides acétiques (diclofénac, kétorolac, bronfénac et népafénac) et les acides propioniques (flurbiprofène).
➤ Les AINS se différencient par leurs effets plus moins sélectifs sur les deux isoformes des cyclo-oxygénases (COX-1 et COX-2), leurs pharmacocinétiques et leurs effets secondaires.
➤ À côté des effets secondaires systémiques potentiels des AINS oraux, on retiendra le risque d’ulcération cornéenne des AINS topiques notamment sur des cornées fragiles.
➤ Les AINS en collyre permettent de réduire l’inflammation après chirurgie de la cataracte liée à l’âge autant qu’un collyre corticostéroïde.
➤ Les collyres AINS permettent de réduire l’incidence du syndrome d’Irvine-Gass.
Les anti-inflammatoires non stéroïdiens (AINS) regroupent l’ensemble des médicaments, inhibiteurs de la synthèse des prostaglandines, qui ont un rôle majeur dans la physiopathologie de la fièvre, de la douleur et de l’inflammation. Ils ciblent de nombreuses situations cliniques (inflammations notamment en rhumatologie et traumatologie, fièvre, douleur). Les prostaglandines sont des éicosanoïdes synthétisées à partir de l’acide arachidonique (lui-même issu des phospholipides membranaires) par l’intermédiaire de la cyclo-oxygénase (COX), dont il existe deux principales iso-enzymes COX-1 et COX-2. Le mode d’action, commun à tous les AINS, est d’inhiber les cyclo-oxygénases.
En ophtalmologie, les AINS sont couramment utilisés soit par voie locale dans le traitement d’inflammations locales et en postopératoire, soit par voie générale pour la gestion de certaines situations inflammatoires.
Après administration orale, les AINS ont une bonne biodisponibilité (de l’ordre de 70 à 80 %). Ils sont absorbés par l’épithélium gastro-intestinal et le pic de concentration sérique est atteint en 1 à 3 heures. Ils vont diffuser dans la plupart des tissus et fluides de l’organisme. De même, ils diffusent dans le lait maternel mais à des concentrations trop faibles pour qu’elles soient cliniquement significatives lors de traitements à court terme. Par ailleurs, la diffusion de ces substances est facilitée dans les tissus inflammatoires.
Les AINS sont transportés essentiellement (de 60 à 100 %) sous forme liée aux protéines plasmatiques, l’albumine le plus souvent. Leur volume de distribution avoisine donc celui du plasma.
Ces médicaments subissent un métabolisme hépatique avant d’être éliminés pour un tiers dans les selles et pour deux tiers dans les urines sous forme inactive.
La plupart des AINS sont des acides faibles qui subissent une ionisation au pH lacrymal. De ce fait, la perméabilité cornéenne est limitée avec un point iso-éléctrique de 3,2 [5]. Diminuer le pH de la solution augmente la fraction non ionisée de la molécule, ce qui améliore la diffusion cornéenne. Du fait de leur nature acide, les AINS sont irritants et la diminution du pH de la solution majore ce caractère irritant. De plus, la nature anionique des AINS provoque la formation de complexes insolubles en présence d’une solution conservatrice à base d’ammonium quaternaire, tel le chlorure de benzalkonium [5]. Aussi, la formulation d’une solution d’AINS en collyre avec une bonne diffusion cornéenne et une bonne tolérance est assez complexe.
Après instillation d’une goutte d’AINS en collyre (flurbiprofène 0,03 % et diclofénac 0,1 %), la concentration maximale dans l’humeur aqueuse est atteinte après respectivement 2,0 et 2,4 heures (pic respectivement à 60 ng/ml et 82 ng/ml) [6]. Après 4 heures, la concentration de diclofénac est à 20 ng/ml et reste détectable après 24 heures. En revanche, le flurbiprofène n’est plus détectable après 7 heures.
Le népafénac est une prodrogue qui est transformé en amfénac par des hydrolases intra-oculaires. En raison de son caractère non chargé, sa perméabilité cornéenne semble meilleure que celle des autres AINS. Une expérience in vitro a montré que le passage cornéen du népafénac était 6 fois meilleur que celui du diclofénac [7]. Dans une étude comparative, après une seule dose de 0,1 % de népafénac, le pic de concentration dans l’humeur aqueuse était atteint en 30 minutes versus 60 minutes pour le kétorolac 0,4 % et 240 minutes pour le bromfénac 0,09 % [8]. Dans une autre étude animale [9], après instillation d’une goutte de bromfénac 0,1 %, diclofénac 0,1 %, ou népafénac 0,1 %, la concentration diminuait rapidement pour le népafénac (temps nécessaire pour atteindre la concentration maximale, Tmax : 0,5 heure) et moins rapidement pour le bromfénac (Tmax : 2 heures).
Si les concentrations en chambre antérieure permettent un effet certain sur les corps ciliaires et l’iris, la concentration dans le segment postérieur après instillation d’une goutte de collyre est moins bien déterminée. Cette incertitude pose la question de l’efficacité des AINS en collyre sur l’inhibition des cyclo-oxygénases des tissus rétinien et choroïdien. Dans les études animales, après administration d’AINS topique en collyre, la concentration de kétorolac 0,5 % intravitréenne n’était pas détectable. En revanche, l’administration topique d’indométhacine 2 % et de diclofénac 0,1 % entraînait une diminution minime de la production de prostaglandines dans le tissu rétinochoroïdien [2].
Dans une étude de 2014, Kida et al. ont déterminé la concentration de bromfénac, diclofénac et népafénac dans le tissu rétinochoroïdien de lapin après instillation d’une goutte d’AINS en collyre (dosé à 0,1 % pour les trois molécules) [9]. Le népafénac était rapidement transformé en amfénac et l’amfénac atteignait rapidement le tissu rétinochoroïdien (Tmax : 0,5 heure). La concentration maximale de diclofénac, bromfénac et amfénac dans le tissu rétinochoroïdien était respectivement de 38,2 ng/g à 1 heure, 15,8 ng/g à 30 minutes, et 12,5 ng/g à 30 minutes. Ces concentrations étaient suffisantes pour inhiber COX-2. L’élimination du diclofénac était rapide (T1/2 = 1,89 heure), tandis que l’élimination du bromfénac et de l’amfénac était plutôt lente (respectivement T1/2 = 4,69 heures et 4 heures).
Des voies d’administration oculaires alternatives au collyre ont été expérimentées chez l’animal. Dans un modèle animal d’uvéite expérimentale, une injection péri-oculaire de kétorolac permettait d’atteindre une meilleure concentration intravitréenne que l’administration topique ou par voie générale [10]. De la même façon, l’injection péri-oculaire de célecoxib permettait d’atteindre une concentration intrarétinienne 54 fois supérieure à une administration systémique. Cette injection permettait une réduction efficace de la sécrétion de PGE2, de la production de VEGF et de la perméabilité de la barrière hémato-rétinienne dans un modèle animal de diabète [11, 12].
L’IVT d’AINS permet d’obtenir une concentration plus importante que les autres voies d’administration, avec une bonne pénétration rétinochoroïdienne et une clairance rapide. Dans un modèle animal d’uvéite, induite par IVT d’endotoxine, une injection intravitréenne de 3 mg de kétorolac et de 0,3 mg de diclofénac a diminué significativement la concentration de leucocytes dans l’humeur aqueuse et la synthèse de PGE2. Les pics de concentration vitréenne de 234 µg/ml et 73 µg/ml étaient obtenus respectivement 15 minutes et 1 heure après l’IVT, et la concentration dans le tissu rétinochoroïdien était respectivement de 280,0 µg/g à 2 heures et 4,1 µg/g à 4 heures [13]. La sécurité des IVT de diclofénac et de kétorolac a été démontrée [14–16].
Les AINS en collyre ont démontré leur efficacité pour :
diminuer les symptômes liés à l’inflammation associée aux phénomènes allergiques et/ou irritatifs (conjonctivite saisonnière, perannuelle ou vernale, épisclérite) [17] ;
maintenir une mydriase peropératoire lors de la chirurgie de la cataracte [18, 19] ; le diclofénac, le flurbiprofène, l’indométacine et le népafénac ont l’AMM dans la prévention du myosis peropératoire ;
diminuer l’inflammation post-chirurgie de la cataracte, post-caspulotomie ou post-iridotomie au laser YAG ; il est même désormais démontré que les collyres AINS en postopératoire de cataracte permettent une diminution de l’inflammation équivalente à celle obtenue avec un traitement par anti-inflammatoires stéroïdiens, voire une efficacité plus importante que les stéroïdes topiques [20], autorisant ainsi un traitement postopératoire par AINS en remplacement ou en complément des corticoïdes topiques [21–23] ; le diclofénac, le flurbiprofène, l’indométacine, le népafénac et le bronfénac ont ainsi l’AMM dans la prévention de l’inflammation après chirurgie de la cataracte ;
diminuer l’inflammation et la douleur postopératoires dans la chirurgie du strabisme, dans la chirurgie filtrante et la chirurgie réfractive ; le diclofénac et l’indométacine ont une AMM dans la prévention de douleurs après chirurgie réfractive ;
prévenir et traiter l’œdème maculaire après chirurgie de la cataracte [24–28] ; si tous les AINS en collyre sont prescrits dans cette indication, seuls le flurbiprofène et le népafénac (chez le diabétique) ont une AMM dans la prévention du syndrome d’Irvine-Gass.
Plusieurs études recensent les effets indésirables oculaires liés à une administration topique d’AINS [29, 30]. Les effets indésirables vont de l’ulcération épithéliale à la perforation cornéenne. Il est à noter que de nombreux patients présentant un effet indésirable lié à la prise d’AINS ont un terrain favorisant : polyarthrite rhumatoïde connue, sécheresse connue (syndrome de Sjögren), troubles de la surface (rosacée). Une prescription particulièrement prudente doit être respectée chez ces patients à cornée fragile ou présentant un syndrome sec marqué. Néanmoins, l’utilisation d’AINS topiques ne semble pas associée à un risque plus important d’effet indésirable que les stéroïdes en post-chirurgie de la cataracte [20]. Ce risque potentiel est retrouvé pour chacun des différents collyres AINS.
Par voie générale, les effets indésirables (EI) les plus fréquents sont les troubles fonctionnels digestifs (dyspepsie, gastralgies, nausées). Les EI digestifs graves sont notamment favorisés par les fortes doses, l’association de plusieurs AINS (contre-indiquée), leur utilisation prolongée et l’âge supérieur à 65 ans. Le risque hémorragique est accru par l’association aux anticoagulants, aux anti-agrégants plaquettaires et, dans une moindre mesure, aux inhibiteurs de la recapture de la sérotonine (IRS).
Les EI cutanéomuqueux sont fréquents : prurit, éruption cutanée, rhinite. Les AINS, particulièrement les oxicams, peuvent, par ailleurs, entraîner de très exceptionnelles mais gravissimes nécrolyses épidermiques toxiques (NET ; Stevens-Johnson, Lyell) dont la mortalité avoisine les 40 %. Ils peuvent aussi être à l’origine d’une rétention hydrosodée, d’une élévation tensionnelle ou de la décompensation d’une cardiopathie. Les EI rénaux (insuffisance rénale, hyperkaliémie, protéinurie) sont majorés en cas de cardiopathie ou de néphropathie préexistantes, d’hypovolémie ou de traitement par diurétiques, inhibiteurs de l’enzyme de conversion (IEC) ou sartans.
L’accessibilité de certains AINS en automédication est susceptible d’accroître les risques d’associations méconnues et de mésusage, notamment chez les personnes âgées. Elle doit être systématiquement recherchée par l’interrogatoire du patient et de ses proches, et prise en compte. Les femmes doivent également être informées des risques liés à leur utilisation, notamment en fin de grossesse.
Le célécoxib est contre-indiqué dès le 1er trimestre et chez la femme en âge de procréer en raison d’un effet tératogène montré chez l’animal.
Tous les AINS sont formellement contre-indiqués, même en prise ponctuelle, à partir du début du 6e mois de grossesse, en raison du risque de constriction du canal artériel qui peut conduire à une insuffisance cardiaque droite fœtale ou néonatale, voire à une mort fœtale in utero.
La prise pendant le 2e trimestre (entre 12 et 24 semaines d’aménorrhée), en particulier si elle est prolongée, est fortement déconseillée car elle peut entraîner une atteinte fonctionnelle rénale (in utero, oligoamnios souvent réversible à l’arrêt du traitement, voire anamnios ; à la naissance, insuffisance rénale d’autant plus à craindre que l’exposition est tardive et prolongée).
La prise d’AINS pendant le 1er trimestre n’est pas à risque tératogène (excepté pour le célécoxib et l’étoricoxib, contre-indiqués dès le 1er trimestre) mais ne doit être envisagée que si nécessaire.
En raison du faible passage systémique des collyres AINS, leur utilisation n’est pas formellement contre-indiquée lors de la grossesse [31]. Néanmoins devant le risque de toxicité fœtale et néonatale, leur prescription au-delà du 6e mois de grossesse doit être évitée au maximum.
Deux AINS ont une AMM dans les douleurs modérées à partir de 3 mois : ibuprofène suspension et acide acétylsalicylique par voie orale.
Deux AINS ont une AMM dans la douleur inflammatoire en ORL et stomatologie : l’acide tiaprofénique en comprimé sécable à partir de 15 kg (environ 4 ans), et l’acide niflumique en gélule à partir de 12 ans et en suppositoire (morniflumate) à partir de 6 mois.
Six AINS ont l’AMM dans l’arthrite juvénile chronique (acide acétylsalicylique, acide tiaprofénique, acide niflumique, diclofénac, ibuprofène, naproxène).
Trois AINS, l’aspirine, l’ibuprofène et le kétoprofène, ont une AMM dans la fièvre de l’enfant au même titre que le paracétamol. La recommandation de la Société française de pédiatrie (octobre 2004) est de privilégier le paracétamol.
Outre leurs contre-indications générales, les AINS sont déconseillés en cas de lésions de la peau et des tissus mous, en particulier lors de la varicelle, car ils pourraient favoriser les complications infectieuses (fasciites nécrosantes). Ils sont également déconseillés en cas de déshydratation, en raison du risque d’insuffisance rénale. L’aspirine est également à éviter en cas de virose (en particulier varicelle et épisodes d’allure grippale) en raison du risque de syndrome de Reye (encéphalopathie et stéatose hépatique).
Les AINS sont une classe médicamenteuse efficace mais non dénués de risque quand à leur utilisation. Les références médicales opposables (RMO) rappellent certaines règles de prescription [32] :
il n’y a pas lieu d’associer un anti-ulcéreux à un AINS à dose anti-inflammatoire sans avoir évalué le risque digestif individuel (âge > 65 ans, antécédents d’ulcère gastroduodénal, antécédents d’intolérance aux AINS). Chez les malades à risque digestif (> 65 ans, traitement prolongé, antécédent d’ulcère gastroduodénal), une protection gastrique est nécessaire ;
il n’y a pas lieu, car dangereux et contre-indiqué, de prescrire un AINS à partir du 6e mois de la grossesse, sauf utilisations obstétricales très limitées ;
il n’y a pas lieu de prescrire un AINS à des doses supérieures aux doses recommandées ;
il n’y a pas lieu d’associer deux AINS par voie générale, y compris l’aspirine (sauf lorsque celle-ci est prescrite à visée anti-agrégante à des doses < 500 mg). Cette recommandation concerne toute la classe des AINS, qu’ils soient prescrits comme antalgiques, antipyrétiques ou anti-inflammatoires ;
il n’y a pas lieu, en raison du risque hémorragique, de prescrire un AINS chez un patient sous anti-vitamine K, sous héparine ou ticlopidine ;
il n’y a pas lieu, particulièrement chez le sujet âgé, en raison du risque d’insuffisance rénale aiguë, de prescrire un AINS chez un patient recevant un traitement par inhibiteur de l’enzyme de conversion, diurétique ou antagoniste des récepteurs de l’angiotensine II, sans prendre les précautions nécessaires.
Tous les AINS sont ainsi contre-indiqués en cas d’ulcère gastroduodénal, d’insuffisance cardiaque ou rénale sévère et à partir du 6e mois de grossesse. L’interrogatoire doit systématiquement rechercher les effets indésirables survenus lors d’une utilisation antérieure. Le risque est considéré comme élevé dans des situations liées au patient, aux médicaments associés (risque rénal des diurétiques, IEC et sartans, risque hémorragique des anticoagulants, anti-agrégants plaquettaires et, à un moindre degré, des IRS), et à l’indication de l’AINS (traitement prolongé, doses élevées).
Concernant l’utilisation de la forme collyre des AINS, les effets indésirables potentiellement sévères doivent rendre très prudente l’utilisation des AINS collyres sur les yeux à risque (fragilité cornéenne).
Les effets anti-inflammatoires puissants et anti-œdémateux des AINS en font une thérapeutique de choix fréquemment utilisée en ophtalmologie dont l’efficacité est établie dans certaines situations. Leur prescription doit respecter certaines règles afin de limiter les risques d’effets indésirables. La progression des connaissances dans le domaine de l’inflammation pourrait ouvrir des perspectives novatrices de traitement.
[1] Chin MS, Nagineni CN, Hooper LC, et al. Cyclooxygenase-2 gene expression and regulation in human retinal pigment epithelial cells. Invest Ophthalmol Vis Sci 2001 ; 42 : 2338-46.
[2] Kim SJ, Flach AJ, Jampol LM. Nonsteroidal anti-inflammatory drugs in ophthalmology. Surv Ophthalmol 2010 ; 55 : 108-33.
[3] Vidal Recos. Recommandation en pratique 2014 – 175 stratégies thérapeutiques. 5e éd. Vidal.
[4] Avis du 19 février 2014 de la Commission de la transparence, HAS.
[5] Ahuja M, Dhake AS, Sharma SK, Majumdar DK. Topical ocular delivery of NSAIDs. Aaps J 2008 ; 10 : 229-41.
[6] Ellis PP, Pfoff DS, Bloedow DC, Riegel M. Intraocular diclofenac and flurbiprofen concentrations in human aqueous humor following topical application. J Ocul Pharmacol 1994 ; 10 : 677-82.
[7] Ke TL, Graff G, Spellman JM, Yanni JM. Nepafenac, a unique nonsteroidal prodrug with potential utility in the treatment of trauma-induced ocular inflammation : II. In vitro bioactivation and permeation of external ocular barriers. Inflammation 2000 ; 24 : 371-84.
[8] Walters T, Raizman M, Ernest P, et al. In vivo pharmacokinetics and in vitro pharmacodynamics of nepafenac, amfenac, ketorolac, and bromfenac. J Cataract Refract Surg 2007 ; 33 : 1539-45.
[9] Kida T, Kozai S, Takahashi H, et al. Pharmacokinetics and efficacy of topically applied nonsteroidal anti-inflammatory drugs in retinochoroidal tissues in rabbits. Plos One 2014 ; 9 : e96481.
[10] Rabiah PK, Fiscella RG, Tessler HH. Intraocular penetration of periocular ketorolac and efficacy in experimental uveitis. Invest Ophthalmol Vis Sci 1996 ; 37 : 613-8.
[11] Amrite AC, Ayalasomayajula SP, Cheruvu NPS, Kompella UB. Single periocular injection of celecoxib-PLGA microparticles inhibits diabetes-induced elevations in retinal PGE2, VEGF, and vascular leakage. Invest Ophthalmol Vis Sci 2006 ; 47 : 1149-60.
[12] Ayalasomayajula SP, Kompella UB. Retinal delivery of celecoxib is several-fold higher following subconjunctival administration compared to systemic administration. Pharm Res 2004 ; 21 : 1797-804.
[13] Barañano DE, Kim SJ, Edelhauser HF, et al. Efficacy and pharmacokinetics of intravitreal non-steroidal anti-inflammatory drugs for intraocular inflammation. Br J Ophthalmol 2009 ; 93 : 1387-90.
[14] Kim SJ, Adams NA, Toma HS, et al. Safety of intravitreal ketorolac and diclofenac : an electroretinographic and histopathologic study. Retina Phila Pa 2008 ; 28 : 595-605.
[15] Margalit E, Kugler LJ, Brumm MV, et al. The safety of intraocular ketorolac in rabbits. Invest Ophthalmol Vis Sci 2006 ; 47 : 2093-9.
[16] Shen WY, Constable IJ, Chelva E, Rakoczy PE. Inhibition of diclofenac formulated in hyaluronan on angiogenesis in vitro and its intraocular tolerance in the rabbit eye. Graefes Arch Clin Exp Ophthalmol 2000 ; 238 : 273-82.
[17] Mishra GP, Tamboli V, Jwala J, Mitra AK. Recent patents and emerging therapeutics in the treatment of allergic conjunctivitis. Recent Patents Inflamm Allergy Drug Discov 2011 ; 5 : 26-36.
[18] Stark WJ, Fagadau WR, Stewart RH, et al. Reduction of pupillary constriction during cataract surgery using suprofen. Arch Ophthalmol 1986 ; 104 : 364-6.
[19] Donnenfeld ED, Perry HD, Wittpenn JR, et al. Preoperative ketorolac tromethamine 0.4% in phacoemulsification outcomes : pharmacokinetic-response curve. J Cataract Refract Surg 2006 ; 32 : 1474-82.
[20] Kessel L, Tendal B, Jørgensen KJ, et al. Post-cataract prevention of inflammation and macular edema by steroid and nonsteroidal anti-inflammatory eye drops : a systematic review. Ophthalmology 2014 ; 121 : 1915-24.
[21] Hirneiss C, Neubauer AS, Kampik A, Schönfeld CL. Comparison of prednisolone 1%, rimexolone 1% and ketorolac tromethamine 0.5% after cataract extraction: a prospective, randomized, double-masked study. Graefes Arch Clin Exp Ophthalmol 2005 ; 243 : 768-73.
[22] Laurell CG, Zetterström C. Effects of dexamethasone, diclofenac, or placebo on the inflammatory response after cataract surgery. Br J Ophthalmol 2002 ; 86 : 1380-4.
[23] Missotten L, Richard C, Trinquand C. Topical 0.1% indomethacin solution versus topical 0.1% dexamethasone solution in the prevention of inflammation after cataract surgery. The Study Group. Ophthalmologica 2001 ; 215 : 43-50.
[24] Henderson BA, Kim JY, Ament CS, et al. Clinical pseudophakic cystoid macular edema. Risk factors for development and duration after treatment. J Cataract Refract Surg 2007 ; 33 : 1550-8.
[25] Warren KA, Fox JE. Topical nepafenac as an alternate treatment for cystoid macular edema in steroid responsive patients. Retina Phila Pa 2008 ; 28 : 1427-34.
[26] Miyake K, Ota I, Maekubo K, et al. Latanoprost accelerates disruption of the blood-aqueous barrier and the incidence of angiographic cystoid macular edema in early postoperative pseudophakias. Arch Ophthalmol 1999 ; 117 : 34-40.
[27] Miyake K, Nishimura K, Harino S, et al. The effect of topical diclofenac on choroidal blood flow in early postoperative pseudophakias with regard to cystoid macular edema formation. Invest Ophthalmol Vis Sci 2007 ; 48 : 5647-52.
[28] Wolf EJ, Braunstein A, Shih C, Braunstein RE. Incidence of visually significant pseudophakic macular edema after uneventful phacoemulsification in patients treated with nepafenac. J Cataract Refract Surg 2007 ; 33 : 1546-9.
[29] Congdon NG, Schein OD, von Kulajta P, et al. Corneal complications associated with topical ophthalmic use of nonsteroidal antiinflammatory drugs. J Cataract Refract Surg 2001 ; 27 : 622-31.
[30] Guidera AC, Luchs JI, Udell IJ. Keratitis, ulceration, and perforation associated with topical nonsteroidal anti-inflammatory drugs. Ophthalmology 2001 ; 108 : 936-44.
[31] Centre de référence sur les agents tératogènes. En ligne : www.lecrat.org.
[32] Arrêté du 13 novembre 1998 portant règlement conventionnel minimal applicable aux médecins en l’absence de convention médicale.
M.-N. Delyfer
➤ Le vascular endothelial growth factor (VEGF) est un facteur de croissance impliqué dans de nombreuses pathologies vasculaires rétiniennes.
➤ Dans la rétine, la principale voie de signalisation engagée dans l’angiogenèse oculaire implique le VEGF-A et l’activation du récepteur VEGF-R2.
➤ Les anti-VEGF disponibles actuellement empêchent l’activation du VEGF-R2 par le VEGF libre soit par le biais d’un oligonucléotide ou d’un anticorps qui se fixe au VEGF et le rend incapable de se lier à son récepteur (pegaptanib, bévacizumab, ranibizumab), soit par le biais d’un récepteur « leurre » qui se substitue au VEGF-R2 et se lie durablement au VEGF libre (aflibercept).
➤ Le ranibizumab (Lucentis®, Genentech, Novartis) est constitué du fragment Fab d’un anticorps monoclonal recombinant humanisé qui présente une haute affinité pour le VEGF-A. Il ne possède pas de fragment Fc.
➤ Le bévacizumab (Avastin®, Genentech, Roche) est un anticorps monoclonal recombinant humanisé complet de type immunoglobuline G1 qui se lie à toutes les isoformes du VEGF-A humain.
➤ L’aflibercept est une protéine de fusion recombinante comprenant un fragment du site de liaison du VEGF-R1 et un fragment du site de liaison du VEGF-R2, fusionnés à un fragment Fc d’IgG1 humaine. Il se lie non seulement à toutes les isoformes du VEGF-A, mais également au VEGF-B et au PlGF.
➤ Les données disponibles dans la littérature sur l’affinité du VEGF pour les trois anti-VEGF les plus utilisés (ranibizumab, bévacizumab et aflibercept) retrouvent une affinité du VEGF pour le bévacizumab inférieure à celle pour le ranibizumab et l’aflibercept.
➤ Il existe une équivalence de puissance entre l’aflibercept et le ranibizumab.
➤ Les effets secondaires oculaires spécifiques aux anti-VEGF administrés par voie intravitréenne sont l’inflammation de chambre antérieure, la rétraction des membranes néovasculaires, l’hypertonie prolongée par altération du trabéculum, la modification de la perfusion vasculaire, une altération possible du tissu neurosensoriel (cellules ganglionnaires et des cellules de Müller).
➤ Les effets secondaires systémiques potentiels des anti-VEGF sont l’hypertension artérielle, les accidents thrombo-emboliques, les hémorragies, la protéinurie, la neutropénie, les infections et les perforations gastro-intestinales. Néanmoins, en pratique quotidienne, ils sont exceptionnellement observés après administration intravitréenne d’anti-VEGF.
➤ Le VEGF est essentiel pendant l’embryogenèse et l’utilisation des anti-VEGF, même localement à faibles doses, pose un problème chez la femme enceinte (néovaisseaux du sujet jeune, diabète) et le prématuré (rétinopathie des prématurés). Des publications semblent démontrer un réel bénéfice oculaire à les utiliser, mais aucune étude à large échelle n’a évalué leur innocuité dans ces populations.
Le vascular endothelial growth factor (VEGF) est un facteur de croissance qui a été identifié de manière relativement récente, en 1989 [1, 2]. Son implication dans de nombreuses pathologies oculaires est maintenant bien établie avec, pour conséquences, une augmentation de la perméabilité vasculaire (dans certains œdèmes maculaires notamment) et/ou une néovascularisation qu’elle soit prérétinienne (rétinopathie diabétique, occlusions veineuses, décollement de rétine chronique, rétinopathie des prématurés) ou sous-rétinienne (DMLA, myopie, néovascularisation sur cicatrices choriorétiniennes). L’utilisation des anti-VEGF en ophtalmologie s’applique donc à de nombreuses pathologies vasculaires rétiniennes.
La famille du VEGF comporte différents membres : le VEGF-A, le plus étudié, est une protéine glycosylée homo-dimérique de 36–46 kDa, très conservée à travers les espèces, qui présente une séquence amino-terminale et un domaine de liaison à l’héparine [2–4]. Il en existe six principales isoformes obtenues par épissage alternatif. Certaines de ces isoformes conservent le site de liaison à l’héparine tandis que d’autres non, ce qui modifie leurs propriétés et leur caractère diffusible. L’isoforme VEGF165 serait le principal médiateur de l’angiogenèse [5]. Les autres membres de la famille du VEGF chez l’homme sont les VEGF-B, C, D et E et le placenta growth factor (PlGF) [3, 5].
Au niveau rétinien, le VEGF peut être synthétisé par de nombreuses cellules : cellules endothéliales, péricytes, épithélium pigmentaire, cellules gliales de Müller (CGM), astrocytes et cellules ganglionnaires. Leur action est médiée via l’activation de trois récepteurs tyrosine kinase : VEGF-R1, VEGF-R2 et VEGF-R3 (fig. 6-18). Ces récepteurs sont avant tout localisés au niveau des cellules endothéliales [2]. Le VEGF-A a une affinité préférentielle pour le VEGF-R2 qui est principalement impliqué dans les phénomènes de perméabilité vasculaire et d’angiogenèse. Le VEGF-R1 est activé par le VEGF-B et le PlGF, pour lequel ils ont une très grande affinité, et dans une moindre mesure par le VEGF-A. Le VEGF-R1 jouerait un rôle dans la modulation de l’activation du VEGF-R2 [4]. Le VEGF-R3 serait activé par le VEGF-C et D, son rôle potentiel dans la rétine restant mal défini.
Dans la rétine, la principale voie de signalisation impliquée dans l’angiogenèse oculaire implique donc le VEGF-A et l’activation du récepteur VEGF-R2. L’activation du VEGF-R2 au niveau de la cellule endothéliale, induit la prolifération cellulaire (voie des MAP-kinases Erk 1 et 2), stimule la survie et la migration des cellules endothéliales (par activation de la phosphatidyl-inositol 3-kinase impliquée dans la lutte anti-apoptotique et le remodelage cellulaire) et augmente la perméabilité vasculaire par un double mécanisme associant vasodilation (secondaire à la production d’oxyde nitrique via la NO-synthase endothéliale) et relâchement des jonctions serrées (par phosphorylation des VE-cadhérines). En conditions physiologiques, l’activation de cette voie de signalisation est essentielle pendant l’embryogenèse oculaire. À l’âge adulte, le VEGF participe à l’homéostasie vasculaire, en particulier celle de la choriocapillaire [3]. En cas d’hypoperfusion et d’ischémie, la production de VEGF est accrue, ce qui aurait pour intérêt de limiter l’apoptose neuronale [2, 3, 6]. Toutefois, les propriétés, avant tout fortement pro-angiogéniques de la molécule, sont responsables de la prolifération des cellules endothéliales et d’une augmentation de la perméabilité vasculaire [2, 3]. L’inhibition de cette voie de signalisation du VEGF/VEGF-R2 est devenue un moyen thérapeutique essentiel dans la prise en charge de la plupart des affections oculaires de nature vasculaire.
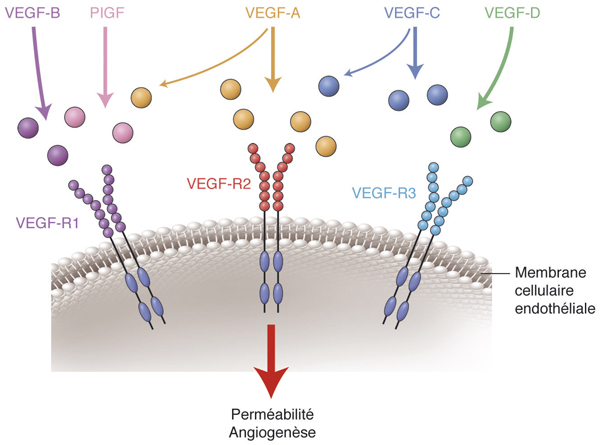
Fig. 6-18 Les récepteurs des VEGF.
L’action des différents VEGF est médiée par l’activation de trois récepteurs tyrosine kinase : VEGF-R1, VEGF-R2 et VEGF-R3. Ces récepteurs sont avant tout localisés au niveau des cellules endothéliales. Le VEGF-A a une affinité préférentielle pour le VEGF-R2 qui est principalement impliqué dans les phénomènes de perméabilité vasculaire et d’angiogenèse. Le VEGF-R1 est activé par le VEGF-B et le PlGF, pour lequel il a une très grande affinité, et dans une moindre mesure par le VEGF-A. Le VEGF-R1 jouerait un rôle dans la modulation de l’activation du VEGF-R2. Le VEGF-R3 serait activé par le VEGF-C et D, son rôle potentiel dans la rétine reste mal défini.
La cascade pro-angiogénique VEGF/VEGF-R2 peut être interrompue à différents niveaux :
en amont, la synthèse du VEGF – ou de ses récepteurs – peut être inhibée en empêchant l’expression de leur gène en utilisant des siRNA (small interfering RNA). Il s’agit de petits acides ribonucléiques (ARN ; ribonucleic acid [RNA]) qui peuvent se lier de manière spécifique à une séquence d’ARN messager et le cliver, le rendant inefficace. Des siRNA dirigés contre le VEGF (bévasiranib) ou ses récepteurs (AGN211745) ont été développés [7] ;
l’action du VEGF peut également être inhibée directement au stade de la protéine VEGF en empêchant sa liaison au récepteur (c’est le mécanisme des anti-VEGF utilisés actuellement en clinique, voir ci-après) ;
enfin, la cascade tyrosine kinase dépendante de l’angiogenèse peut également être inhibée après la liaison du VEGF à son récepteur VEGF-R2 par des modulateurs des différentes voies de signalisation impliquées dans l’angiogenèse (vatalanib, TG100801, pazopanib, AG013958, AL39324, ad-PEDF, etc.) [7].
Les anti-VEGF disponibles actuellement utilisent la stratégie d’inhibition directe et empêchent donc l’activation du VEGF-R2 par le VEGF libre par deux mécanismes :
soit par le biais d’un oligonucléotide ou d’un anticorps qui se fixe au VEGF et le rend incapable de se lier à son récepteur (pegaptanib, bévacizumab, ranibizumab) ;
soit par le biais d’un récepteur « leurre » qui se substitue au VEGF-R2 et se lie durablement au VEGF libre (aflibercept).
Dans les deux cas, le résultat est une diminution du VEGF libre et une diminution ou une absence d’activation du VEGF-R2 au niveau de la cellule endothéliale.
Le pegaptanib (Macugen®, OSI-Eyetech Pharmaceuticals, Pfizer) a été le premier anti-VEGF disponible pour la prise en charge des néovaisseaux choroïdiens. Il s’agit d’un aptamère, c’est-à-dire un oligonucléotide de synthèse, qui se lie de manière spécifique à l’isoforme VEGF165 considérée comme principalement responsable des processus néovasculaires au niveau oculaire [8]. Les aptamères sont nettement moins immunogènes et beaucoup plus stables que les anticorps. Il comprend 28 bases d’acide ribonucléique (ARN) avec deux branches de polyéthylène glycol de 20 kDa afin d’augmenter sa demi-vie dans la cavité vitréenne (limitation de sa dégradation par les endo- et exonucléases). Son poids moléculaire est de 50 kDa (tableau 6-4) [5].

Tableau 6-4 Caractéristiques pharmacologiques et pharmacocinétiques des différents anti-VEGF utilisés en ophtalmologie.
Le ranibizumab (Lucentis®, Genentech, Novartis) a été mis en point et développé de manière spécifique pour une administration oculaire. Il est constitué du fragment Fab d’un anticorps monoclonal, recombinant humanisé, qui présente une haute affinité pour le VEGF-A. Il ne possède pas de fragment Fc (fig. 6-19). L’absence de fragment Fc a été pensée à la fois pour faciliter sa pénétration dans le tissu rétinien mais également, pour diminuer la demi-vie systémique de la molécule. Il se lie de manière non sélective à une chaîne d’acides aminés commune à toutes les isoformes de VEGF-A les rendant inactives (fig. 6-20). Son poids moléculaire est de 48 kDa (tableau 6-4). Après administration intravitréenne, sa diffusion dans le tissu rétinien et sous-rétinien a été mesurée et est importante dans les modèles animaux [5].
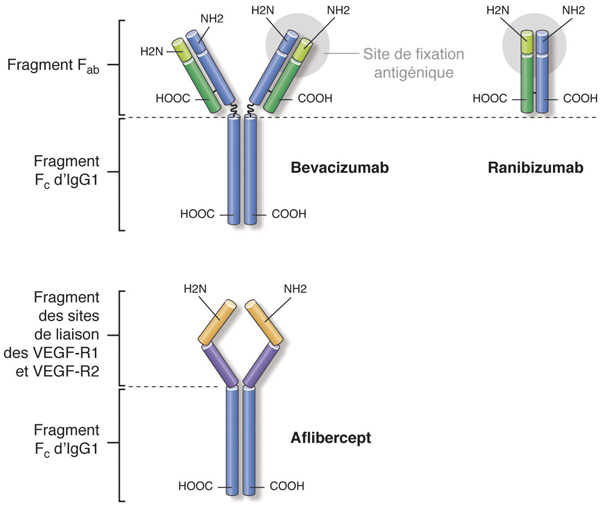
Fig. 6-19 Structure des trois principaux anti-VEGF utilisés en ophtalmologie.
Le bévacizumab est un anticorps complet de type immunoglobuline G1 comprenant un domaine constant (Fc) glycosylé et deux sites de liaison antigénique (Fab). Le ranibizumab n’est composé que du fragment Fab. L’aflibercept est une protéine de fusion comprenant un fragment du site de liaison du VEGF-R1 et un fragment du site de liaison du VEGF-R2, fusionnés à un fragment Fc d’IgG1 humaine.

Fig. 6-20 Mode d’action des anti-VEGF disponibles en pratique clinique.
Le pegaptanib est un aptamère qui se lie de manière spécifique à l’isoforme VEGF165. Il ne bloque pas l’action des autres isoformes du VEGF-A. Le ranibizumab se lie de manière non sélective à une chaîne d’acides aminés commune à toutes les isoformes de VEGF-A, les rendant inactives. Le bévacizumab se lie à toutes les isoformes du VEGF-A humain, il possède deux sites de liaison antigénique, chaque molécule de bévacizumab peut donc bloquer deux molécules de VEGF-A libre. L’aflibercept agit comme un leurre de récepteur et se lie non seulement à toutes les isoformes du VEGF-A, mais également au VEGF-B et au PlGF avec une affinité supérieure à celle de leurs récepteurs naturels.
Le bévacizumab (Avastin®, Genentech, Roche) a été mis au point et développé pour traiter par voie systémique l’angiogenèse associée aux tumeurs solides. C’est un anticorps monoclonal recombinant humanisé de type immunoglobuline G1 qui se lie à toutes les isoformes du VEGF-A humain (fig. 6-19). Contrairement au ranibizumab, il s’agit d’un anticorps monoclonal complet, comprenant un domaine constant (Fc) glycosylé et deux sites de liaison antigénique (Fab). Chaque molécule de bévacizumab peut donc fixer – et bloquer – deux molécules de VEGF-A libre (fig. 6-20). Son poids moléculaire est de 149 kDa (tableau 6-4). Sa diffusion dans le tissu rétinien n’est pas établie clairement.
L’aflibercept a été développé à la fois pour une utilisation par voie systémique en oncologie (Zaltrap®, Regeneron, Sanofi-Aventis) et pour la voie intra-oculaire (Eyléa®, Regeneron, Bayer). Il s’agit d’une protéine de fusion recombinante de 115 kDa (tableau 6-4), comprenant un fragment du site de liaison du VEGF-R1 et un fragment du site de liaison du VEGF-R2, fusionnés à un fragment Fc d’IgG1 humaine (fig. 6-19). Il agit comme un leurre de récepteur, se lie non seulement à toutes les isoformes du VEGF-A, mais également au VEGF-B et au PlGF avec une affinité supérieure à celle de leurs récepteurs naturels (fig. 6-20) [7].
L’affinité d’un ligand pour son récepteur est définie par sa constante de dissociation ou KD. Plus la valeur de KD est faible et plus l’affinité est élevée. Néanmoins la détermination de cette constante se heurte à différentes limitations expérimentales, notamment celle de la température d’expérimentation et celle du modèle choisi. Les données disponibles dans la littérature sur l’affinité du VEGF pour les trois anti-VEGF les plus utilisés (ranibizumab, bévacizumab et aflibercept) retrouvent une affinité du VEGF pour le bévacizumab inférieure à celle pour le ranibizumab et l’aflibercept [9, 10]. En revanche, les données concernant l’affinité du VEGF pour l’aflibercept et le ranibizumab sont contradictoires. Pour Yang et al. (Genentech), selon les modèles choisis, le KD du VEGF pour le ranibizumab varie de < 9,2 à 67 pM contre 1,8 à 9263 pM pour l’alibercept [10]. Pour Papadopoulos et al. (Regeneron), le KD du VEGF-A165 pour le ranibizumab est de 46 pM contre 1 pM pour l’aflibercept [9]. Les résultats de ces études démontrent l’extrême variabilité des mesures de KD, obtenues en fonction des conditions expérimentales, toujours très éloignées des conditions physiologiques, et imposent de ce fait une grande prudence quant à leur extrapolation à la pratique clinique.
La notion de puissance pharmacologique s’appuie sur celle de l’affinité : plus l’affinité d’un ligand pour son récepteur est grande et plus sa puissance est élevée. L’analyse de la prolifération VEGF-dépendante des cellules BREC (bovine retinal microvascular endothelial cells) tend à confirmer une équivalence de puissance entre l’aflibercept et le ranibizumab. Les cellules BREC sont des cellules endothéliales cultivées in vitro, dont la prolifération est favorisée par la présence de VEGF. L’analyse de leur prolifération VEGF-induite peut être bloquée par la présence d’un anti-VEGF. Les résultats de plusieurs études sont concordants et retrouvent une inhibition similaire de la prolifération cellulaire par le ranibizumab et l’aflibercept, toujours supérieure à celle du bévacizumab [10].
Les demi-vies intravitréennes varient fortement entre les modèles (tableau 6-4). La demi-vie intravitréenne de pegaptanib chez le singe est de 3,9 jours, elle n’est pas connue chez l’homme [5]. Celle du ranibizumab est évaluée entre 2 et 3 jours chez le lapin, environ 3 jours chez le singe et un peu plus de 7 jours chez l’homme [5]. Celle du bévacizumab a été mesurée entre 4 et 6 jours chez le lapin, environ 3 jours chez le singe et entre 6 et 10 jours chez l’homme. Enfin, celle de l’aflibercept est évaluée entre 4 et 5 jours chez le lapin, mais n’a pas été directement mesurée chez l’homme [5].
Une analyse mathématique intégrant les paramètres pharmacologiques et pharmacocinétiques du ranibizumab et de l’aflibercept soutiendrait l’hypothèse d’une action prolongée de l’aflibercept au niveau oculaire. Dans ce modèle, la capacité d’inhibition du VEGF libre par l’aflibercept (2 mg), après une seule injection intravitréenne, reste jusqu’à 83 jours après l’injection supérieure ou équivalente à celle du ranibizumab (0,5 mg) à 30 jours [11]. Ces résultats semblent être corroborés par une étude récente qui a mesuré le taux de VEGF dans l’humeur aqueuse après injection d’aflibercept et a retrouvé une durée moyenne d’inhibition du VEGF de 71 jours [12].
La demi-vie systémique du pegaptanib chez l’homme est de 10 jours [5]. Celle du ranibizumab est de quelques heures (environ 2 heures) [5, 13]. Cette clairance systémique rapide, liée à l’absence de fragment Fc, est avancée comme un facteur permettant de limiter en théorie les effets secondaires extra-oculaires [13]. La demi-vie systémique du bévacizumab et de l’aflibercept est prolongée par la présence d’un fragment Fc qui prévient le catabolisme protéolytique rapide et prolonge leur demi-vie systémique (via FcRn, le récepteur néonatal pour le fragment Fc des IgG), elle a été évaluée à 18 jours pour l’aflibercept et 21 jours pour le bévacizumab (tableau 6-4) [5, 13].
Après trois injections mensuelles consécutives, aucun phénomène d’accumulation de l’anti-VEGF n’a été mis en évidence dans le sang circulant avec le ranibizumab, alors qu’avec l’aflibercept et surtout le bévacizumab un phénomène d’accumulation a été mesuré (la recommandation d’utilisation thérapeutique de l’aflibercept est une injection tous les 2 mois) [13].
Suite à l’injection intravitréenne d’anti-VEGF, les taux plasmatiques de VEGF libre ne sont que très peu modifiés par le ranibizumab et de manière transitoire, même après trois injections consécutives. En revanche, une diminution du VEGF circulant a été observée avec le bévacizumab et l’aflibercept, celle consécutive à l’administration de l’aflibercept étant plus importante, et probablement due à la plus grande affinité du VEGF pour l’aflibercept que pour le bévacizumab [13–15].
L’administration répétée d’une molécule thérapeutique immunogène conduit à la formation d’anticorps dirigés contre cette molécule, anticorps qui peuvent diminuer la durée et/ou l’intensité de la réponse attendue au traitement. L’immunogénicité des différents anti-VEGF varie du fait de leur nature et leur mode de production. Le pegaptanib en tant qu’aptamère synthétique est considéré comme peu immunogène, à l’inverse le bévacizumab (anticorps complet Fc et Fab) et le ranibizumab ou l’aflibercept (comprenant tous deux des fractions d’anticorps, Fab pour le ranibizumab et Fc pour l’aflibercept) sont théoriquement plus immunogènes. Des anticorps antibévacizumab, antiranibizumab et anti-aflibercept ont été retrouvés dans le sérum de patients traités par anti-VEGF intravitréen. Afin de conserver une activité thérapeutique en cas de phénomène de tachyphylaxie, il faut soit augmenter les doses de traitement, soit effectuer une fenêtre thérapeutique, soit changer de molécule thérapeutique (switch pouvant être suivi de switch back), soit combiner plusieurs traitements [16]. En pratique, actuellement en ophtalmologie, c’est le changement de molécule thérapeutique qui est recommandé.
L’extension des indications des anti-VEGF en ophtalmologie rend nécessaire la bonne connaissance de leurs effets secondaires potentiels au niveau local comme au niveau général, pour une population de patients aussi bien âgés que jeunes, bénéficiant d’injections isolées ou répétées.
Certains risques sont non spécifiques et sont seulement liés au geste de l’injection elle-même. Il s’agit, rapidement, de l’hémorragie sous-conjonctivale, de l’hypertonie transitoire, de la cataracte traumatique, de déhiscences rétiniennes périphériques iatrogènes, de l’hémorragie intravitréenne, du décollement de rétine et de l’endophtalmie bactérienne. Le plus fréquent reste l’irritation oculaire de surface liée à l’antisepsie conjonctivale répétée à la povidone iodée.
Ils sont résumés dans l’encadré 6-1
• Uvéite antérieure.
• Élévation prolongée de la pression intra-oculaire.
• Rétraction de membranes néovasculaires :
déchirure de l’épithélium pigmentaire en cas de membrane néovasculaire sous-rétinienne ou décollement de l’épithélium pigmentaire néovascularisé ;
décollement de rétine tractionnel en cas de voiles néovasculaires prérétiniens ;
trous maculaires.
• Modification de la circulation vasculaire oculaire :
neuropathie optique ischémique antérieure non artéritique ;
occlusions veineuses ;
occlusions artérielles ;
infarcissement maculaire ;
syndrome oculaire ischémique.
• Majoration de l’atrophie choriorétinienne après injections répétées.
.
Une inflammation de chambre antérieure a pu être observée chez l’animal et lors des essais cliniques après injection de ranibizumab, de bévacizumab et d’aflibercept, mais pas avec le pegaptanib [3, 17]. Le taux d’uvéites iatrogènes observées est très variable selon les études, il reste inférieur à 3 % dans les grandes séries et le plus souvent même inférieur à 1 % [3, 17].
L’action anti-angiogénique qui suit l’injection d’anti-VEGF induit une rétraction du tissu néovasculaire parfois brutale à l’origine, selon les cas, de :
déchirures de l’épithélium pigmentaire lors de membranes néovasculaires sous-rétiniennes étendues et, en particulier, de décollement de l’épithélium pigmentaire néovascularisé ;
décollements de rétine tractionnels dans les rétinopathies diabétiques proliférantes, avec voiles néovasculaires prérétiniens étendus, ou dans les rétinopathies du prématuré.
Des cas de trou maculaire ont également été rapportés [3].
L’hypertonie oculaire parfois constatée immédiatement après l’injection, quel que soit l’anti-VEGF, est considérée comme non liée à la molécule elle-même mais à la procédure d’injection elle-même. De rares cas d’hypertonies prolongées ont été rapportés [3, 18]. Ces hypertonies chroniques pourraient être dues à l’altération du trabéculum consécutive à la répétition d’injections trop rapides de volumes supérieurs à ceux recommandés [18].
L’analyse de la perfusion vasculaire après injection intravitréenne de ranibizumab ou de bévacizumab a montré une réduction du flux sanguin ciliaire et une vasoconstriction artériolaire rétinienne [3]. Sur des terrains vasculaires, il a également été décrit un certain nombre d’épisodes ischémiques après injection : neuropathie optique non artéritique, occlusions veineuses, occlusions artérielles, infarcissement maculaire, apparition d’un syndrome oculaire ischémique [3]. Ceux-ci sont probablement la conséquence du blocage complet de l’action du VEGF qui exerce un rôle trophique essentiel sur la microcirculation rétinienne et la choriocapillaire.
Du fait de son rôle neuroprotecteur, un blocage prolongé complet de VEGF a pu induire expérimentalement une dégénérescence des cellules ganglionnaires et des cellules de Müller chez l’animal [3]. Ces résultats n’ont cependant pas été confirmés en clinique [19]. Par ailleurs, le VEGF exerce également un rôle trophique sur la choriocapillaire, un blocage prolongé pourrait de ce fait théoriquement induire une souffrance de l’épithélium pigmentaire et de la rétine externe. Les résultats des études CATT et IVAN tendent à confirmer cela, puisqu’une majoration de l’atrophie choriorétinienne a été démontrée en cas d’injections systématiques mensuelles d’anti-VEGF (ranibizumab ou bévacizumab) comparées à un traitement moins soutenu sur un mode pro renata, à la demande [14, 20].
Contrairement au pegaptanib et au ranibizumab, employés uniquement en ophtalmologie, le bévacizumab et l’aflibercept sont utilisés par voie générale en oncologie. Leurs effets secondaires systémiques potentiels sont donc bien identifiés et résumés dans l’encadré 6-2
• Effets cardiovasculaires :
hypertension artérielle ;
accidents thrombo-emboliques : accident vasculaire cérébral, infarctus du myocarde ;
accidents hémorragiques systémiques (cérébral, pulmonaire, gastro-intestinal, etc.).
• Protéinurie.
• Neutropénie.
• Infections :
rhino-pharyngites ;
infection des voies urinaires ;
autres.
• Perforations gastro-intestinales.
• Troubles gastro-intestinaux (nausées, vomissements, etc.).
• Arthralgies.
• Céphalées.
• Décès.
. Il s’agit principalement d’hypertension artérielle, d’accidents thrombo-emboliques, d’hémorragies, de protéinurie, de neutropénie, d’infections et de perforations gastro-intestinales. En ophtalmologie, bien que les doses administrées dans la cavité vitréenne soient très faibles comparées au volume de distribution général, le passage systémique des anti-VEGF administrés par voie intravitréenne est constant (voir plus haut, Pharmacocinétique). Une action anti-VEGF a même été décrite sur des yeux controlatéraux à des yeux traités par anti-VEGF (DMLA, rétinopathie diabétique, œdème maculaire d’occlusion veineuse), même si cela reste très controversé [3]. La rupture de la barrière hémato-rétinienne associée à certaines pathologies vasculaires oculaires actuellement traitées par anti-VEGF, notamment la rétinopathie et la maculopathie diabétiques, est également suspectée d’augmenter le passage systémique des anti-VEGF. Néanmoins, les effets systémiques observés en pratique quotidienne après administration intravitréenne d’anti-VEGF restent rares.
Les effets indésirables cardiovasculaires sont les plus redoutés. Selon les critères d’évaluation prédéfinis de l’Anti-Platelet Trialists’Collaboration (APTC), les effets secondaires cardiovasculaires graves regroupent : les décès d’origine cardiovasculaire, l’infarctus du myocarde non mortel et l’accident vasculaire cérébral (ischémique ou hémorragique) non mortel.
L’étude pivotale VISION examinant l’efficacité et la tolérance du pegaptanib dans la DMLA exsudative pendant 3 ans n’a pas mis en évidence d’effets secondaires systémiques évidents APTC ou autres. Aucune variation de pression artérielle, aucun accident thrombo-embolique ni décès liés au traitement n’ont été observés [3]. Il reste à noter cependant que les antécédents thrombo-emboliques récents étaient des critères de non-inclusion (problème cardiaque de moins de 6 mois, accident vasculaire cérébral de moins de 12 mois). Une très bonne tolérance cardiovasculaire et systémique a également été retrouvée chez les patients diabétiques [21].
Les études pivotales sur le ranibizumab dans la DMLA exsudative (MARINA et ANCHOR, prolongées par l’étude SAILOR) ont retrouvé une tendance non significative à l’augmentation des effets secondaires systémiques chez les patients présentant une DMLA exsudative traitée par ranibizumab, notamment des complications hémorragiques et thrombo-emboliques (accidents vasculaires cérébraux). Une méta-analyse regroupant les données issues de ces études a cependant mis en évidence une association significative entre l’administration intra-oculaire de ranibizumab et la survenue d’accident vasculaire cérébral (p = 0,045) mais pas d’infarctus du myocarde [3]. Lors de l’utilisation du ranibizumab dans le traitement de l’œdème maculaire diabétique [22] et au cours des occlusions veineuses [23], aucune majoration du risque cardiovasculaire n’a été observée.
Il est cependant à noter qu’un effet « âge » est associé fortement à la survenue de ces effets indésirables graves APTC : les patients de plus de 85 ans ont en effet un risque presque doublé par rapport à ceux de moins de 85 ans de faire ce type de complications, qu’ils soient traités par anti-VEGF ou non traités. Ceci incite à une surveillance particulière lors de l’indication et de l’administration du traitement chez les plus de 85 ans voire, peut-être, à éviter les injections bilatérales concomitantes dans ce cas particulier.
Les études prospectives sur la tolérance systémique du bévacizumab ont été conduites de manière comparative à l’administration de ranibizumab (études de non-infériorité). Il n’y a pas eu davantage d’APTC avec le bévacizumab qu’avec le ranibizumab [14, 20]. Une légère tendance à avoir davantage d’effets secondaires systémiques a été constatée avec le bévacizumab [14, 20]. Une revue analytique récente de l’ensemble des études comparant bévacizumab et ranibizumab n’a pas retrouvé de majoration du risque de décès avec le bévacizumab par rapport au ranibizumab, ni du risque d’effets systémiques graves, hormis pour les troubles gastro-intestinaux [24].
Les études VIEW-1 et VIEW-2 sur l’efficacité et la tolérance systémique de l’aflibercept dans la DMLA ont été conduites de manière comparative à l’administration de ranibizumab (études de non-infériorité). Elles n’ont pas objectivé de différences en termes de survenue d’effets systémiques APTC ou autres [15]. Les études VIVID/VISTA conduites dans l’œdème maculaire diabétique et GALILEO/COPERNICUS dans l’occlusion de la veine centrale de la rétine n’ont pas mis en évidence de survenue d’effets systémiques significatifs par rapport aux contrôles [25].
Une étude récente du Diabetic Retinopathy Clinical Research Network, le protocole T, a comparé l’efficacité et la tolérance des trois anti-VEGF utilisés actuellement dans le traitement de l’œdème maculaire diabétique : le bévacizumab, le ranibizumab (à la dose de 0,3 mg non disponible en Europe) et l’aflibercept. Les résultats initiaux en termes de tolérance systémique n’ont pas retrouvé de différences significatives sur le taux de survenue d’événements indésirables graves (p = 0,40), d’hospitalisations (p = 0,51), de décès (p = 0,72) ou d’accidents cardiovasculaires graves (p = 0,56) [26].
Le VEGF est essentiel pendant l’embryogenèse et l’utilisation des anti-VEGF, même localement à faibles doses, pose un problème chez la femme enceinte (néovaisseaux du sujet jeune, diabète) et le prématuré (rétinopathie des prématurés). Des publications semblent démontrer un réel bénéfice oculaire à les utiliser, mais aucune étude à large échelle n’a évalué leur innocuité dans ces populations.
L’administration d’anti-VEGF au niveau oculaire est associée au passage systémique de la molécule qui va transitoirement, de manière plus ou moins prolongée, diminuer le taux de VEGF libre dans le flux sanguin. Les conséquences sur le placenta et l’embryon sont difficilement évaluables. À ce jour, des cas isolés et deux séries de quatre patientes ont été publiés (tableau 6-5) [27–33]. Dans une première série, il s’agissait d’administrations uniques précoces alors que les grossesses n’étaient pas encore identifiées, sans conséquence évidente imputable aux anti-VEGF sur le déroulement des grossesses et les nouveau-nés [27]. Dans la seconde série, une administration volontaire et répétée de bévacizumab intravitréen a été réalisée au cours de quatre grossesses chez des patientes présentant des néovaisseaux sur cicatrices de pseudo-histoplasmose ou sarcoïdose. Une moyenne de 2,6 ± 2,3 injections (intervalle 1–6) a été réalisée avec un recul de 14 ± 2,9 mois [28], là encore sans conséquence évidente constatée. Néanmoins, même si l’ensemble des données disponibles est rassurant, en l’absence de série de cas suffisante, aucune conclusion sur la tolérance des anti-VEGF pendant la grossesse ne peut être établie et l’indication des anti-VEGF en cours de grossesse ne pourra être retenue qu’après avoir discuté des risques et des bénéfices avec l’équipe obstétrico-pédiatrique et la patiente.
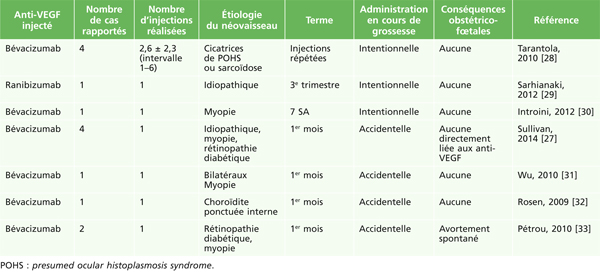
Tableau 6-5 Cas publiés d’administration intravitréenne d’anti-VEGF en cours de grossesse.
Différentes publications rapportent l’intérêt thérapeutique des anti-VEGF (bévacizumab surtout, mais aussi pegaptanib, ranibizumab et aflibercept) dans la prise en charge de la rétinopathie des prématurés [34]. Aucun effet secondaire imputable aux anti-VEGF n’a été rapporté à ce jour. Mais les études disponibles manquent de puissance statistique et de recul sur le long terme pour évaluer la réelle tolérance systémique des anti-VEGF administrés par voie intravitréenne, imposant une grande prudence. Les organes qui pourraient être particulièrement vulnérables aux anti-VEGF sont ceux dont le développement est tardif, notamment le système nerveux central et le rein [34].
Les anti-VEGF constituent une famille thérapeutique largement utilisée pour traiter les pathologies vasculaires rétiniennes. Leur efficacité et leur bonne tolérance en font le traitement de référence dans de nombreuses pathologies. Les développements thérapeutiques à venir chercheront à améliorer leur efficacité thérapeutique (association synergique avec d’autres classes thérapeutiques tels les anti-platelet-derived growth factors, etc.), à augmenter l’intervalle entre deux injections (augmentation de la demi-vie oculaire, système de relargage prolongé, etc.) et à faciliter leur administration (collyres, etc.).
[1] Ferrara N, Henzel WJ. Pituitary follicular cells secrete a novel heparin-binding growth factor specific for vascular endothelial cells. Biochem Biophys Res Commun 1989 ; 161 : 851-8.
[2] Miller JW, Adamis AP, Aiello LP. Vascular endothelial growth factor in ocular neovascularization and proliferative diabetic retinopathy. Diabetes Metab Rev 1997 ; 13 : 37-50.
[3] Tolentino M. Systemic and ocular safety of intravitreal anti-VEGF therapies for ocular neovascular disease. Surv Ophthalmol 2011 ; 56 : 95-113.
[4] Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med 2003 ; 9 : 669-76.
[5] Stewart MW. Pharmacokinetics, pharmacodynamics and pre-clinical characteristics of ophthalmic drugs that bind VEGF. Expert Rev Clin Pharmacol 2014 ; 7 : 167-80.
[6] Nishijima K, Ng YS, Zhong L, et al. Vascular endothelial growth factor-A is a survival factor for retinal neurons and a critical neuroprotectant during the adaptive response to ischemic injury. Am J Pathol 2007 ; 171 : 53-67.
[7] Chappelow AV, Kaiser PK. Neovascular age-related macular degeneration : potential therapies. Drugs 2008 ; 68 : 1029-36.
[8] Apte RS, Modi M, Masonson H, et al. ; Macugen AMD Study Group. Pegaptanib 1-year systemic safety results from a safety-pharmacokinetic trial in patients with neovascular age-related macular degeneration. Ophthalmology 2007 ; 114 : 1702-12.
[9] Papadopoulos N, Martin J, Ruan Q, et al. Binding and neutralization of vascular endothelial growth factor (VEGF) and related ligands by VEGF Trap, ranibizumab and bevacizumab. Angiogenesis 2012 ; 15 : 171-85.
[10] Yang J, Wang X, Fuh G, et al. Comparison of binding characteristics and in vitro activities of three inhibitors of vascular endothelial growth factor A. Mol Pharm 2014 ; 11 : 3421-30.
[11] Stewart MW, Rosenfeld PJ. Predicted biological activity of intravitreal VEGF Trap. Br J Ophthalmol. 2008 ; 92 : 667-8.
[12] Fauser S, Schwabecker V, Muether PS. Suppression of intraocular vascular endothelial growth factor during aflibercept treatment of age-related macular degeneration. Am J Ophthalmol 2014 ; 158 : 532-6.
[13] Avery RL, Castellarin AA, Steinle NC, et al. Systemic pharmacokinetics following intravitreal injections of ranibizumab, bevacizumab or aflibercept in patients with neovascular AMD. Br J Ophthalmol 2014 ; 98 : 1636-41.
[14] Chakravarthy U, Harding SP, Rogers CA, et al. ; IVAN study investigators. Alternative treatments to inhibit VEGF in age-related choroidal neovascularisation : 2-year findings of the IVAN randomised controlled trial. Lancet 2013 ; 382 : 1258-67.
[15] Lanzetta P, Mitchell P, Wolf S, Veritti D. Different antivascular endothelial growth factor treatments and regimens and their outcomes in neovascular age-related macular degeneration : a literature review. Br J Ophthalmol 2013 ; 97 : 1497-507.
[16] Binder S. Loss of reactivity in intravitreal anti-VEGF therapy : tachyphylaxis or tolerance ? Br J Ophthalmol 2012 ; 96 : 1-2.
[17] Hahn P, Kim JE, Stinnett S, et al. ; American Society of Retina Specialists Therapeutic Surveillance Committee. Aflibercept-related sterile inflammation. Ophthalmology 2013 ; 120 : 1100-1.
[18] Yannuzzi NA, Patel SN, Bhavsar KV, et al. Predictors of sustained intraocular pressure elevation in eyes receiving intravitreal anti-vascular endothelial growth factor therapy. Am J Ophthalmol 2014 ; 158 : 319-27.
[19] Shin HJ, Shin KC, Chung H, Kim HC. Change of retinal nerve fiber layer thickness in various retinal diseases treated with multiple intravitreal antivascular endothelial growth factor. Invest Ophthalmol Vis Sci 2014 ; 55 : 2403-11.
[20] CATT Research Group, Martin DF, Maguire MG, Ying GS, et al. Ranibizumab and bevacizumab for neovascular age-related macular degeneration. N Engl J Med 2011 ; 364 : 1897-908.
[21] Virgili G, Parravano M, Menchini F, Evans JR. Anti-vascular endothelial growth factor for diabetic macular oedema. Cochrane Database Syst Rev 2014 ; 10 : CD007419.
[22] Schmidt-Erfurth U, Lang GE, Holz FG, et al. ; RESTORE Extension Study Group. Three-year outcomes of individualized ranibizumab treatment in patients with diabetic macular edema : the RESTORE extension study. Ophthalmology. 2014 ; 121 : 1045-53.
[23] Campochiaro PA, Sophie R, Pearlman J, et al. ; RETAIN Study Group. Long-term outcomes in patients with retinal vein occlusion treated with ranibizumab : the RETAIN study. Ophthalmology 2014 ; 121 : 209-19.
[24] Moja L, Lucenteforte E, Kwag KH, et al. Systemic safety of bevacizumab versus ranibizumab for neovascular age-related macular degeneration. Cochrane Database Syst Rev 2014 ; 9 : CD011230.
[25] Ogura Y, Roider J, Korobelnik JF, et al. ; GALILEO Study Group. Intravitreal aflibercept for macular edema secondary to central retinal vein occlusion : 18-month results of the phase 3 GALILEO study. Am J Ophthalmol 2014 ; 158 : 1032-8.
[26] The Diabetic Retinopathy Clinical Research Network. Aflibercept, bevacizumab, or ranibizumab for diabetic macular edema. N Engl J Med 2015 ; 372 : 1193-203.
[27] Sullivan L, Kelly SP, Glenn A, et al. Intravitreal bevacizumab injection in unrecognised early pregnancy. Eye (Lond) 2014 ; 28 : 492-4.
[28] Tarantola RM, Folk JC, Boldt HC, Mahajan VB. Intravitreal bevacizumab during pregnancy. Retina 2010 ; 30 : 1405-11.
[29] Sarhianaki A, Katsimpris A, Petropoulos IK, et al. Intravitreal administration of ranibizumab for idiopathic choroidal neovascularization in a pregnant woman. Klin Monbl Augenheilkd 2012 ; 229 : 451-3.
[30] Introini U, Casalino G, Cardani A, et al. Intravitreal bevacizumab for a subfoveal myopic choroidal neovascularization in the first trimester of pregnancy. J Ocul Pharmacol Ther 2012 ; 28 : 553-5.
[31] Wu Z, Huang J, Sadda S. Inadvertent use of bevacizumab to treat choroidal neovascularisation during pregnancy : a case report. Ann Acad Med Singapore 2010 ; 39 : 143-5.
[32] Rosen E, Rubowitz A, Ferencz JR. Exposure to verteporfin and bevacizumab therapy for choroidal neovascularization secondary to punctate inner choroidopathy during pregnancy. Eye (Lond) 2009 ; 23 : 1479.
[33] Petrou P, Georgalas I, Giavaras G, et al. Early loss of pregnancy after intravitreal bevacizumab injection. Acta Ophthalmol 2010 ; 88 : e136.
[34] Mintz-Hittner HA. Treatment of retinopathy of prematurity with vascular endothelial growth factor inhibitors. Early Hum Dev 2012 ; 88 : 937-41.
I. Audo
➤ Les inhibiteurs de l’anhydrase carbonique (IAC) agiraient principalement par leur action ciblée sur les anhydrases carboniques (AC) membranaires de l’épithélium pigmentaire de la rétine (EPR).
➤ Les IAC sont le traitement de référence de l’œdème maculaire des rétinopathies pigmentaires et apparentées.
➤ Ils sont employés principalement per os, sous la forme d’acétazolamide (Diamox®) à la dose journalière de 500 mg ; une certaine efficacité a aussi été démontrée en application topique (dorzolamide 2 %, brinzolamide) à raison d’une instillation, trois fois par jour.
➤ Ils peuvent être également proposés pour traiter d’autres kystes maculaires héréditaires comme le rétinoschisis lié à l’X, le syndrome d’augmentation des cônes bleus ou pour traiter les télangiectasies maculaires et le syndrome d’Irvine-Gass. En revanche, ils ne sont pas efficaces pour traiter les œdèmes maculaires d’origine vasculaire.
Les anhydrases carboniques (AC) sont des métallo-enzymes ubiquitaires impliqués dans différentes fonctions cellulaires, essentiellement l’homéostasie ionique, le maintien du pH, le transport de CO2 et de bicarbonate (voir pour revue [1]). Ces diverses actions physiologiques découlent de l’effet catalyseur des AC sur une simple réaction chimique : la transformation de CO2 en acide carbonique et proton (CO2 + H2O ↔ HCO3− + H+), dépendante d’un ion Zn2+ au niveau du site actif de l’enzyme. La plupart des inhibiteurs des AC exercent leur action par liaison à Zn2+ [1]. Dans la rétine normale, les AC seraient présentes essentiellement dans les cellules endothéliales, les cellules de Müller et dans les cônes L et M sous leur forme intracellulaire (iso-enzyme II) [2–4] alors que l’épithélium pigmenté rétinien (EPR) exprimerait plutôt la forme transmembranaire (isoforme IV) avec une localisation préférentiellement apicale [5].
En ophtalmologie, outre leur emploi pour leurs effets hypotonisants [6], les inhibiteurs de l’anhydrase carbonique (IAC) de la classe des sulfamides sont largement employés dans le traitement de l’œdème maculaire de la rétinopathie pigmentaire, présent dans près de 49 % des cas [7], pour lequel ils restent le traitement de référence. Ils ont été également utilisés plus récemment dans les modifications kystiques de certaines dystrophies rétiniennes telles que le rétinoschisis lié à l’X [8] ou le syndrome d’augmentation des cônes bleus/syndrome de Goldman-Favre [9]. Ils ont aussi montré une certaine efficacité dans nombre de causes d’œdème maculaire incluant le syndrome d’Irvine-Gass [10, 11], les uvéites chroniques [11, 12], les télangiectasies maculaires [11], pour certains la rétinopathie diabétique [13] ou d’autres causes de maculopathie kystique. Employés initialement per os, essentiellement sous la forme d’acétazolamide (Diamox®) en général à la dose journalière de 500 mg, et plus rarement de méthazolamide à 100 mg/jour, une certaine efficacité a maintenant aussi été démontrée en application topique (dorzolamide 2 %, brinzolamide) à raison d’une instillation trois fois par jour.
Les mécanismes d’action des IAC sur l’œdème maculaire restent mal connus. Ils agiraient principalement par leur action ciblée sur les AC membranaires de l’EPR [5], induisant une acidification de l’espace sous-rétinien, une diminution du potentiel transépithélial et un accroissement de l’adhésion rétinienne avec une augmentation du transport liquidien actif vers la choroïde (voir pour revue [14]). Certains auteurs ont suggéré que l’œdème maculaire s’accompagnait d’une altération de la répartition de l’AC IV à la membrane de l’EPR avec une plus grande densité en basolatéral qu’en apical. Comme les IAC ont un accès prédominant à la portion basolatérale de l’EPR, leur pouvoir inhibiteur permettrait de restaurer le déséquilibre de l’activité enzymatique. Ceci permettrait d’améliorer la polarité de l’EPR et favoriserait les échanges liquidiens de la rétine vers la choroïde [11, 15, 16]. D’autres études ont montré une diminution de la fuite de fluorescéine par les capillaires périfovéolaires après traitement par IAC, avec une amélioration de la circulation rétinienne et de l’oxygénation suggérant également une action directe sur les capillaires rétiniens [17–19].
Cox et al. ont été parmi les premiers à étudier les effets des IAC de la classe des sulfamides dans différentes étiologies d’œdème maculaire cystoïde (OMC) et à démontrer leur effet sur l’amélioration de l’acuité visuelle et la réduction de l’œdème en biomicroscopie et en angiographie à la fluorescéine, dans plus de 50 % des cas de dystrophies de type bâtonnet–cône ou rétinopathies pigmentaires (RP), et d’uvéites chroniques. Cet effet n’était en revanche pas retrouvé dans les œdèmes associés à des altérations vasculaires rétiniennes comme les œdèmes secondaires aux occlusions veineuses [11]. Leurs travaux ont conclu à l’intérêt des IAC en cas de dysfonction de l’EPR mais pas dans le cadre des pathologies vasculaires primitives. De plus, la même équipe a montré, dans un cas de RP, que l’action sur l’œdème maculaire s’accompagnait d’une amélioration de l’acuité visuelle mais également, lors d’un traitement prolongé, d’une augmentation de la sensibilité rétinienne extrafovéolaire scotopique et photopique [20].
Les travaux suivants (revus par Salvatore et al. en 2013 [21]), notamment ceux de l’équipe de G. Fishman, ont confirmé l’intérêt des IAC dans les modifications kystiques des dystrophies type RP et apparentées, dont ils constituent la première indication parmi les différentes causes d’OMC (fig. 6-21) [17]. En effet, en 1989 dans une étude randomisée en double insu et croisée contre placebo, Fishman et al. ont retrouvé une amélioration de l’acuité visuelle d’une ligne ou plus, dans au moins un œil, chez dix patients sur douze atteints de RP compliquée d’OMC après 2 semaines de traitement par 500 mg/jour d’acétazolamide ; au moins cinq d’entre eux présentaient une diminution de l’œdème en angiographie [17]. Dans la même étude, la dose de 500 mg/jour était plus efficace que 250 mg/jour ou bien qu’une administration un jour sur deux. Une amélioration de l’acuité visuelle et de la sensibilité maculaire photopique a ensuite été mise en évidence après traitement prolongé par acétazolamide [22]. Cependant, un effet d’échappement partiel (récidive de l’œdème sans modification majeure de l’acuité visuelle) a été retrouvé après 6 à 12 semaines de traitement par méthazolamide chez trois patients [23]. Le même effet d’échappement a été rapporté après 8 à 12 semaines de traitement par acétazolamide pour trois patients six [24]. L’arrêt du traitement pendant 1 à 6 mois, puis sa réintroduction, pourrait réinitialiser son efficacité [25]. Stanga et al. ont été parmi les premiers à rapporter l’effet significatif d’un mois de traitement par acétazolamide sur le profil retrouvé en tomographie à cohérence optique (optical coherence tomography [OCT]), marqueur plus pertinent que l’angiographie dans la RP dans laquelle certains œdèmes n’ont pas de traduction angiographique [26]. Cet effet anatomique a été confirmé par d’autres études [21, 24, 27]. L’utilisation d’IAC en topique a été suggérée par l’équipe de G. Fishman [28–30] ; les auteurs recommandaient une instillation de trois gouttes par jour de dorzolamide 2 % (inhibiteur plutôt spécifique de l’AC II) pendant 4 à 8 semaines, avant de définir une absence d’efficacité. D’après la plus grande série rapportée, le traitement topique par dorzolamide diminuerait l’épaisseur de l’œdème dans 67 % des cas [31]. Le traitement topique permettrait également d’améliorer la sensibilité rétinienne [32]. Quelques études ont comparé le traitement per os avec le traitement topique avec des résultats variables : Grover et al., dans une étude prospective croisée, en double insu, ont mis en évidence une efficacité supérieure de l’acétazolamide par rapport au traitement topique par dorzolamide (100 % d’efficacité contre 40 % respectivement) [28], alors que Liew et al., dans une étude rétrospective non randomisée avec un nombre plus important de patients, retrouvent l’inverse (40 % de cas répondeurs pour le traitement topique versus 28 % pour le traitement per os) [33]. Cette dernière étude dégage également certains facteurs pronostiques : ainsi une hérédité autosomique récessive (versus dominante) ou une épaisseur maculaire avant traitement plus élevée seraient des facteurs de meilleure réponse au traitement topique [33]. En pratique, les différentes études sur les IAC utilisent une méthodologie différente, tant sur la sélection des patients que sur les critères d’analyse d’efficacité du traitement, et sont donc difficilement comparables entre elles. Par ailleurs, la variabilité des résultats qu’elles rapportent pourrait refléter l’hétérogénéité des mécanismes physiopathologiques impliqués dans l’OMC des RP (voir chapitre 14.4). Les IAC restent cependant le traitement de première intention de l’OMC dans les RP à côté des corticoïdes par voie sous-ténonienne ou intravitréenne. L’efficacité anatomique de ces derniers semble être limitée dans le temps avec un effet sur l’acuité visuelle qui reste à démontrer. De même, les anti-VEGF n’ont pas prouvé leur effet que ce soit sur le plan anatomique ou fonctionnel (voir revue [21]).
L’effet des IAC a également été étudié dans d’autres causes de kystes maculaires héréditaires comme le rétinoschisis lié à l’X (fig. 6-22) [8, 34–37], le syndrome d’augmentation des cônes bleus (fig. 6-23) [9, 38] ou les bestrophinopathies récessives [39] avec des résultats plus contrastés que dans les RP. Si l’absence d’études sur de grandes séries avec des résultats à long terme peut expliquer cette différence, il est possible que les mécanismes physiopathologiques soient distincts. En attendant ce type d’études, il semble légitime de tenter un traitement topique (exemple trois instillations/jour de dorzolamide) pendant 4 à 8 semaines dans ces indications avec évaluation de l’acuité visuelle et OCT à l’issue de cette période.
L’effet thérapeutique des IAC a également été étudié sur d’autres causes d’OMC. Une étude récente sur les télangiectasies maculaires de type 2 portant sur huit patients a montré une diminution des kystes et de l’épaisseur maculaire après traitement par acétazolamide sans toutefois noter d’amélioration de l’acuité visuelle [40]. Les effets bénéfiques fonctionnel et anatomique des IAC ont aussi été rapportés dans l’OMC associé aux uvéites où ils pourraient jouer un rôle d’adjuvant au traitement par corticoïdes [11, 12, 41–43]. De même, leur intérêt thérapeutique a été rapporté dans le syndrome d’Irvine-Gass [10, 11] ou dans l’OMC survenant après cerclage [44]. Enfin, une étude pilote a suggéré également une action bénéfique de l’acétazolamide dans l’œdème maculaire de la rétinopathie diabétique non proliférante [13]. Toutefois, aucune étude randomisée n’a évalué l’effet des IAC, per os ou en topique, sur l’œdème maculaire diabétique. Leur prescription per os chez le diabétique devra donc être prudente en raison d’effets secondaires potentiels de ces molécules sur le métabolisme glucidique.

Fig. 6-21 Homme de 62 ans atteint d’une forme sporadique de dystrophie rétinienne de type bâtonnet–cône avec œdème maculaire bilatéral.
Après 6 mois de traitement par 250 mg/jour d’acétazolamide, les kystes maculaires ont disparu à droite (a), avec un effet stable au cours du temps avec amélioration objective et subjective de l’acuité visuelle (de 20/32 avant traitement à 20/20 après traitement). (b) En revanche, à gauche, on observe la persistance de kystes maculaires malgré l’augmentation de la posologie à 500 mg/jour d’acétazolamide avec une acuité visuelle stable à 20/32.
Fig. 6-22 Garçon de 7 ans atteint de rétinoschisis lié à l’X.
Le traitement par dorzolamide collyre (trois instillations par jour dans les deux yeux) permet une discrète réduction des kystes avec une acuité visuelle inchangée.
Fig. 6-23 Œil droit d’un garçon de 12 ans atteint de syndrome d’augmentation des cônes bleus traités par dorzolamide collyre (trois instillations par jour), sans disparition des modifications kystiques et une acuité visuelle inchangée.
Les effets secondaires des IAC sont essentiellement l’apanage des traitements oraux et résultent principalement de l’inhibition des AC au niveau systémique. Ils incluent paresthésies, faiblesse musculaire, asthénie, perte d’appétit, troubles digestifs, hypokaliémie, acidose métabolique, hypo- ou hyperglycémie, hyperuricémie avec risque de lithiase rénale [45]. Ces effets secondaires sont minimisés avec les traitements topiques qui occasionnent essentiellement une irritation locale ou peuvent entraîner un flou visuel. Ces médicaments sont par ailleurs déconseillés pendant la grossesse et l’allaitement, même si aucun effet tératogène n’a été mis en évidence. Par ailleurs, comme tous les sulfamides, les IAC de cette classe peuvent exceptionnellement déclencher une anaphylaxie avec des tableaux sévères de syndrome de Stevens-Johnson [46] : une hypersensibilité aux sulfamides devra donc systématiquement être recherchée à l’interrogatoire de même qu’une information adéquate fournie aux patients en cas d’éruption cutanée.
Au total, le traitement par IAC est le traitement de référence pour l’OMC des rétinopathies pigmentaires et apparentés ; il est possible d’utiliser ce traitement par voie topique pour limiter les effets secondaires systémiques de l’administration per os. Toutefois, des essais randomisés comparant l’efficacité de ces deux voies d’administration sont nécessaires. Les IAC pourraient avoir un intérêt pour les autres causes d’OMC impliquant une dysfonction de l’EPR mais les études à long terme manquent pour documenter leur effet sur la préservation de la fonction maculaire. Enfin, aucune étude n’a démontré leur effet en cas d’atteinte vasculaire primitive comme l’œdème maculaire des occlusions veineuses.
[1] Supuran CT. Carbonic anhydrases : novel therapeutic applications for inhibitors and activators. Nature Reviews Drug Discovery 2008 ; 7 : 168-81.
[2] Lutjen-Drecoll E, Lonnerholm G, Eichhorn M. Carbonic anhydrase distribution in the human and monkey eye by light and electron microscopy. Graefe’s Arch Clin Exp Ophthalmol 1983 ; 220 : 285-91.
[3] Wistrand PJ, Schenholm M, Lonnerholm G. Carbonic anhydrase isoenzymes CA I and CA II in the human eye. Invest Ophthalmol Vis Sci 1986 ; 27 : 419-28.
[4] Musser GL, Rosen S. Localization of carbonic anhydrase activity in the vertebrate retina. Exp Eye Res 1973 ; 15 : 105-19.
[5] Wolfensberger TJ, Mahieu I, Jarvis-Evans J, et al. Membrane-bound carbonic anhydrase in human retinal pigment epithelium. Invest Ophthalmol Vis Sci 1994 ; 35 : 3401-7.
[6] Becker B. Decrease in intraocular pressure in man by a carbonic anhydrase inhibitor, diamox ; a preliminary report. Am J Ophthalmol 1954 ; 37 : 13-5.
[7] Adackapara CA, Sunness JS, Dibernardo CW, et al. Prevalence of cystoid macular edema and stability in oct retinal thickness in eyes with retinitis pigmentosa during a 48-week lutein trial. Retina 2008 ; 28 : 103-10.
[8] Apushkin MA, Fishman GA. Use of dorzolamide for patients with X-linked retinoschisis. Retina 2006 ; 26 : 741-5.
[9] Iannaccone A, Fung KH, Eyestone ME, Stone EM. Treatment of adult-onset acute macular retinoschisis in enhanced s-cone syndrome with oral acetazolamide. Am J Ophthalmol 2009 ; 147 : 307-12.e2.
[10] Minnella AM, Savastano MC, Zinzanella G, et al. Spectral-domain optical coherence tomography in Irvine-Gass syndrome. Retina 2012 ; 32 : 581-7.
[11] Cox SN, Hay E, Bird AC. Treatment of chronic macular edema with acetazolamide. Arch Ophthalmol 1988 ; 106 : 1190-5.
[12] Farber MD, Lam S, Tessler HH, et al. Reduction of macular oedema by acetazolamide in patients with chronic iridocyclitis : a randomised prospective crossover study. Br J Ophthalmol 1994 ; 78 : 4-7.
[13] Giusti C, Forte R, Vingolo EM, Gargiulo P. Is acetazolamide effective in the treatment of diabetic macular edema ? A pilot study. Int Ophthalmol 2001 ; 24 : 79-88.
[14] Wolfensberger TJ. The role of carbonic anhydrase inhibitors in the management of macular edema. Doc Ophthalmol 1999 ; 97 : 387-97.
[15] Wolfensberger TJ, Dmitriev AV, Govardovskii VI. Inhibition of membrane-bound carbonic anhydrase decreases subretinal pH and volume. Doc Ophthalmol 1999 ; 97 : 261-71.
[16] Moldow B, Sander B, Larsen M, et al. The effect of acetazolamide on passive and active transport of fluorescein across the blood-retina barrier in retinitis pigmentosa complicated by macular oedema. Graefe’s Arch Clin Exp Ophthalmol 1998 ; 236 : 881-9.
[17] Fishman GA, Gilbert LD, Fiscella RG, et al. Acetazolamide for treatment of chronic macular edema in retinitis pigmentosa. Arch Ophthalmol 1989 ; 107 : 1445-52.
[18] Pedersen DB, Koch Jensen P, la Cour M, et al. Carbonic anhydrase inhibition increases retinal oxygen tension and dilates retinal vessels. Graefe’s Arch Clin Exp Ophthalmol 2005 ; 243 : 163-8.
[19] Reber F, Gersch U, Funk RW. Blockers of carbonic anhydrase can cause increase of retinal capillary diameter, decrease of extracellular and increase of intracellular pH in rat retinal organ culture. Graefe’s Arch Clin Exp Ophthalmol 2003 ; 241 : 140-8.
[20] Chen JC, Fitzke FW, Bird AC. Long-term effect of acetazolamide in a patient with retinitis pigmentosa. Invest Ophthalmol Vis Sci 1990 ; 31 : 1914-8.
[21] Salvatore S, Fishman GA, Genead MA. Treatment of cystic macular lesions in hereditary retinal dystrophies. Surv Ophthalmol 2013 ; 58 : 560-84.
[22] Orzalesi N, Pierrottet C, Porta A, Aschero M. Long-term treatment of retinitis pigmentosa with acetazolamide. A pilot study. Graefe’s Arch Clin Exp Ophthalmol 1993 ; 231 : 254-6.
[23] Fishman GA, Glenn AM, Gilbert LD. Rebound of macular edema with continued use of methazolamide in patients with retinitis pigmentosa. Arch Ophthalmol 1993 ; 111 : 1640-6.
[24] Apushkin MA, Fishman GA, Grover S, Janowicz MJ. Rebound of cystoid macular edema with continued use of acetazolamide in patients with retinitis pigmentosa. Retina 2007 ; 27 : 1112-8.
[25] Thobani A, Fishman GA. The use of carbonic anhydrase inhibitors in the retreatment of cystic macular lesions in retinitis pigmentosa and X-linked retinoschisis. Retina 2011 ; 31 : 312-5.
[26] Stanga PE, Downes SM, Ahuja RM, et al. Comparison of optical coherence tomography and fluorescein angiography in assessing macular edema in retinal dystrophies : preliminary results. Int Ophthalmol 2001 ; 23 : 321-5.
[27] Apushkin MA, Fishman GA, Janowicz MJ. Monitoring cystoid macular edema by optical coherence tomography in patients with retinitis pigmentosa. Ophthalmology 2004 ; 111 : 1899-904.
[28] Grover S, Fishman GA, Fiscella RG, Adelman AE. Efficacy of dorzolamide hydrochloride in the management of chronic cystoid macular edema in patients with retinitis pigmentosa. Retina 1997 ; 17 : 222-31.
[29] Grover S, Apushkin MA, Fishman GA. Topical dorzolamide for the treatment of cystoid macular edema in patients with retinitis pigmentosa. Am J Ophthalmol 2006 ; 141 : 850-8.
[30] Fishman GA, Apushkin MA. Continued use of dorzolamide for the treatment of cystoid macular oedema in patients with retinitis pigmentosa. Br J Ophthalmol 2007 ; 91 : 743-5.
[31] Genead MA, Fishman GA. Efficacy of sustained topical dorzolamide therapy for cystic macular lesions in patients with retinitis pigmentosa and usher syndrome. Arch Ophthalmol 2010 ; 128 : 1146-50.
[32] Ikeda Y, Hisatomi T, Yoshida N, et al. The clinical efficacy of a topical dorzolamide in the management of cystoid macular edema in patients with retinitis pigmentosa. Graefe’s Arch Clin Exp Ophthalmol 2012 ; 250 : 809-14.
[33] Liew G, Moore AT, Webster AR, Michaelides M. Efficacy and prognostic factors of response to carbonic anhydrase inhibitors in management of cystoid macular edema in retinitis pigmentosa. Invest Ophthalmol Vis Sci 2015 ; 56 : 1531-6.
[34] Ghajarnia M, Gorin MB. Acetazolamide in the treatment of X-linked retinoschisis maculopathy. Arch Ophthalmol 2007 ; 125 : 571-3.
[35] Walia S, Fishman GA, Molday RS, et al. Relation of response to treatment with dorzolamide in X-linked retinoschisis to the mechanism of functional loss in retinoschisin. Am J Ophthalmol 2009 ; 147 : 111-5.e1.
[36] Genead MA, Fishman GA, Walia S. Efficacy of sustained topical dorzolamide therapy for cystic macular lesions in patients with X-linked retinoschisis. Arch Ophthalmol 2010 ; 128 : 190-7.
[37] Gurbaxani A, Wei M, Succar T, et al. Acetazolamide in retinoschisis : a prospective study. Ophthalmology 2014 ; 121 : 802-3.e3.
[38] Genead MA, Fishman GA, McAnany JJ. Efficacy of topical dorzolamide for treatment of cystic macular lesions in a patient with enhanced S-cone syndrome. Doc Ophthalmol 2010 ; 121 : 231-40.
[39] Fung AT, Yzer S, Goldberg N, et al. New best1 mutations in autosomal recessive bestrophinopathy. Retina 2015 ; 35 : 773-82.
[40] Chen JJ, Sohn EH, Folk JC, et al. Decreased macular thickness in nonproliferative macular telangiectasia type 2 with oral carbonic anhydrase inhibitors. Retina 2014 ; 34 : 1400-6.
[41] Zierhut M, Thiel HJ, Schlote T. Treatment of uveitic macular edema with acetazolamide. Doc Ophthalmol 1999 ; 97 : 409-13.
[42] Ossewaarde-van Norel J, Berg EM, Sijssens KM, Rothova A. Subfoveal serous retinal detachment in patients with uveitic macular edema. Arch Ophthalmol 2011 ; 129 : 158-62.
[43] Steinmetz RL, Fitzke FW, Bird AC. Treatment of cystoid macular edema with acetazolamide in a patient with serpiginous choroidopathy. Retina 1991 ; 11 : 412-5.
[44] Weene LE. Cystoid macular edema after scleral buckling responsive to acetazolamide. Ann Ophthalmol 1992 ; 24 : 423-4.
[45] Kass MA, Kolker AE, Gordon M, et al. Acetazolamide and urolithiasis. Ophthalmology 1981 ; 88 : 261-5.
[46] Her Y, Kil MS, Park JH, et al. Stevens-Johnson syndrome induced by acetazolamide. J Dermatol 2011 ; 38 : 272-5.
C. Couret, B. Bodaghi
➤ La prise en charge de l’œdème maculaire uvéitique n’est pas consensuelle.
➤ Immunosuppresseurs, biothérapies et interféron α sont indiqués lorsque les traitements classiques anti-inflammatoires stéroïdiens ne suffisent plus.
➤ L’effet des immunosuppresseurs sur l’œdème maculaire uvéitique est retardé, parfois de 6 mois. Il doit être poursuivi suffisamment longtemps (au moins 8 à 12 semaines) avant d’être considéré comme inefficace.
➤ Les anti-tumor necrosis factors (anti-TNF-α) ont démontré une efficacité rapide et durable dans la maladie de Behçet sévère et/ou réfractaire, et leur utilisation a été étendue à d’autres causes d’uvéites sévères (arthrite juvénile idiopathique, uvéites antérieures sévères associées au HLA-B27, maladie de Vogt-Koyanagi-Harada, sarcoïdose). Ils sont proposés dans les uvéites réfractaires aux corticoïdes et aux immunosuppresseurs, et sont habituellement utilisés en traitement de troisième ligne.
➤ Ces traitements peuvent avoir des effets indésirables nombreux et potentiellement graves. Le traitement doit donc être mené en collaboration avec un interniste.
La prise en charge de l’œdème maculaire uvéitique n’est pas consensuelle. Néanmoins, il est admis d’utiliser immunosuppresseurs, biothérapies et interféron α lorsque les traitements classiques anti-inflammatoires stéroïdiens ne suffisent plus.
Sreekatam a évalué les pratiques expertes des membres de l’International Uveitis Study Group face à l’œdème maculaire uvéitique [1]. Après la corticothérapie orale, administrée dans 87 % des cas, les traitements de deuxième ligne étaient : le méthotrexate (39 %), suivi de la ciclosporine (24 %), de l’azathioprine (17 %) et du mycophénolate mofétil (7 %). Quel que soit l’immunosuppresseur utilisé, son effet sur l’œdème maculaire uvéitique est retardé, parfois jusqu’au 6e mois de traitement. Il doit être poursuivi suffisamment longtemps (au moins 8 à 12 semaines) avant d’être considéré comme inefficace. Ses effets indésirables sont nombreux et potentiellement graves. Il est donc préférable de collaborer avec un interniste pour leur prescription. Kempen a montré que le risque de décès global et par cancer était le même que celui de la population américaine non traitée par immunosuppresseurs pour l’azathrioprine, le mycophénolate mofétil, le méthotrexate et la ciclosporine [2].
Il s’agit d’un antimétabolite interférant avec la synthèse et le métabolisme des purines. Elle inhibe ainsi la multiplication des lymphocytes B et T activés, des macrophages, de même que la synthèse d’anticorps, et réduit l’activité des cellules natural killer (NK) et la production d’interleukine 2. Elle est plus active sur les lymphocytes B que sur les lymphocytes T. Il n’existe pas d’autorisation de mise sur le marché ophtalmologique pour l’azathioprine mais elle s’est montrée modérément efficace dans le contrôle de l’inflammation oculaire et le degré d’épargne cortisonique [3]. Elle est largement utilisée pour traiter l’œdème maculaire associé aux uvéites intermédiaires ou aux uvéites postérieures non infectieuses réfractaires telles que la choroïdite serpigineuse, la rétinochoroïdite de type Birdshot et l’uvéoméningite de Vogt-Koyanagi-Harada.
Il s’agit également d’un antimétabolite inhibant la synthèse des purines et la prolifération lymphocytaire B et T. Le mycophénolate mofétil peut être utilisé en lieu et place de l’azathioprine avec une bonne efficacité en association avec une corticothérapie inférieure ou égale à 8 mg/jour. Il a été utilisé avec succès dans le traitement des uvéites, notamment la rétinochoroïdite de type Birdshot [4]. Neri a évalué son efficacité sur l’œdème maculaire uvéitique avec des résultats anatomiques et fonctionnels encourageants alors que Doycheva a retrouvé des résultats mitigés [5]. Neri et al. ont retrouvé que le mycophénolate mofétil était efficace à visée d’épargne cortisonée et qu’il n’entraînait que peu d’effets indésirables [6]. Il n’a pas été retrouvé de différence significative entre le mycophénolate mofétil et le méthotrexate en termes d’épargne cortisonique sur les uvéites intermédiaires, postérieures et panuvéites [7].
Inhibiteur de la calcineurine, la ciclosporine agit principalement sur les lymphocytes T, notamment les CD4+ (cluster of differentiation) dont elle réduit l’activation. Le contrôle de l’inflammation oculaire avec la ciclosporine s’est révélé modeste [8]. Elle est bien tolérée par la majorité des patients mais sa toxicité chez les patients de plus de 55 ans doit lui faire préférer d’autres agents immunosuppresseurs ou immunomodulateurs. Les indications ophtalmologiques exactes de l’autorisation de mise sur le marché de la ciclosporine sont les uvéites intermédiaires ou postérieures sévères, menaçant la vision en cas d’échec thérapeutique. La dose utilisée est adaptée au cas par cas ; elle est en moyenne proche de 3 mg/kg/jour.
Il s’agit d’un antimétabolite analogue de l’acide folique administré par voie générale, orale ou sous-cutanée, utilisé le plus souvent à visée d’épargne cortisonique. Gangaputra et al. ont montré que le méthotrexate était modérément efficace dans le traitement des uvéites non infectieuses et qu’il avait très peu d’effets indésirables [9]. Galor et al. ont comparé l’efficacité du méthotrexate, de l’azathioprine et du mycophénolate mofétil à visée d’épargne cortisonique dans les uvéites non infectieuses : leurs résultats suggéraient que le mycophénolate mofétil était le plus rapidement efficace et que l’azathioprine était la molécule qui entraînait le plus d’effets indésirables [10]. En pratique, le méthotrexate est surtout utilisé à visée d’épargne cortisonique, dans les uvéites postérieures de la sarcoïdose, ou dans les uvéites antérieures de l’arthrite juvénile idiopathique et des spondylarthropathies, pouvant se compliquer d’œdème maculaire.
Le méthotrexate a également été utilisé pour la prise en charge de l’œdème maculaire uvéitique, dans de petites séries, par voie intravitréenne et il s’est alors avéré efficace et bien toléré [11, 12]. Ces résultats sont intéressants mais ne concernent qu’un nombre limité de patients ; ils ne permettent pas de généraliser la pratique des injections intravitréennes de méthotrexate pour traiter l’œdème maculaire uvéitique. Son utilisation devient de plus en plus limitée par sa toxicité.
Compte tenu de ses effets indésirables, le cyclophosphamide, agent alkylant, ne doit être envisagé qu’après échec des antimétabolites (azathioprine, mycophénolate mofétil, méthotrexate) et probablement après un traitement immunomodulateur. En effet, le cyclophosphamide augmente le risque global de décès [13]. En cas de rémission, après trois premières perfusions réalisées à 15 jours d’intervalle puis espacées toutes les 3 à 4 semaines, le relais est pris par un autre immunosuppresseur moins toxique (azathioprine ou mycophénolate mofétil).
Les immunoglobulines intraveineuses (Ig IV) ont été utilisées dans un certain nombre de maladies auto-immunes systémiques et disposent de l’autorisation de mise sur le marché en ophtalmologie pour le traitement des rétinochoroïdites de type Birdshot depuis 1996. Elles ont été étudiées dans le modèle animal de l’uvéite auto-immune chez le rat Lewis immunisé contre l’antigène S rétinien. Dans cette uvéite expérimentale, l’administration d’Ig IV protégeait le rat de l’apparition de l’uvéite, en induisant une anergie des lymphocytes CD4+ spécifiques de l’antigène, avec diminution de la synthèse d’interleukine 2 par les lymphocytes stimulés in vivo par l’antigène S rétinien [14]. Les analogies qui existent entre l’uvéite auto-immune expérimentale et la rétinochoroïdite de type Birdshot ont conduit à expérimenter l’efficacité des Ig IV dans le traitement de ce type d’affection [15].
Le mode d’action des immunomodulateurs sur l’œdème maculaire uvéitique n’est pas totalement élucidé. Le caractère réfractaire de certains œdèmes maculaires uvéitiques aux traitements anti-inflammatoires et immunosuppresseurs usuels laisse penser que le mécanisme sous-jacent de l’œdème maculaire uvéitique chronique n’est pas seulement inflammatoire mais qu’il est également probablement lié à des altérations plus diffuses des barrières hémato-rétiniennes.
Le tumoral necrosis factor α (TNF-α), cytokine pro-inflammatoire produite par les cellules T et les macrophages activés, induit la synthèse d’autres cytokines pro-inflammatoires, stimule la prolifération de certaines cellules inflammatoires et déclenche l’expression de molécules d’adhésion sur les cellules endothéliales. Il participe ainsi à la rupture des barrières hémato-rétiniennes et est responsable d’œdème maculaire dans certains modèles animaux. L’implication du TNF-α dans la pathogénie de l’œdème maculaire uvéitique suggère l’intérêt potentiel des anti-TNF-α dans leur prise en charge thérapeutique. La démonstration de la rapidité d’efficacité de l’infliximab et de l’adalimumab dans la maladie de Behçet, même sévère et/ou réfractaire, a permis d’élargir leur utilisation aux autres causes d’uvéites pourvoyeuses d’œdème maculaire dont l’arthrite juvénile idiopathique, les uvéites antérieures sévères associées à HLA-B27, la maladie de Vogt-Koyanagi-Harada, la sarcoïdose et d’autres uvéites postérieures. Ils se sont avérés efficaces, rapidement et durablement, sur l’œdème maculaire uvéitique réfractaire (tableau 6-6) [16, 17]. Certaines études rétrospectives et méta-analyses montrent une supériorité des anticorps monoclonaux (infliximab et adalimumab) par rapport au récepteur soluble (étanercept). Les anti-TNF-α représentent, en troisième voire deuxième ligne, une alternative intéressante aux anti-inflammatoires stéroïdiens et immunosuppresseurs usuels ; ils peuvent même être utilisés en première intention dans les uvéites sévères associées à la maladie de Behçet [18]. Cependant, ils doivent être employés avec prudence : certains effets indésirables peuvent être graves ; les risques de décès global et par cancer semblent augmentés mais ces données restent à confirmer ; le récent éditorial de Kempen sur le risque de cancer, spécifiquement dans les pathologies inflammatoires oculaires, ne permet pas de conclure [2, 13]. Ils induisent une plus grande susceptibilité aux infections, notamment tuberculeuses, respiratoires et gastro-intestinales, comme la réactivation d’une hépatite B. Ils sont également responsables de pathologies dysimmunitaires : dermatite atopique, rash cutané, hypersensibilités de type I, II et III, réaction lupus-like et exacerbation de sclérose en plaques. Ils peuvent plus rarement être à l’origine de pathologies thrombo-emboliques, cardiaques et tumorales, notamment lymphomateuses et cutanées.

Tableau 6-6 Anti-TNF-α et œdème maculaire dans la littérature.
D’autres thérapies ciblées contre les voies impliquées dans la genèse de l’uvéite non infectieuse ont démontré leur efficacité (tableau 6-7).
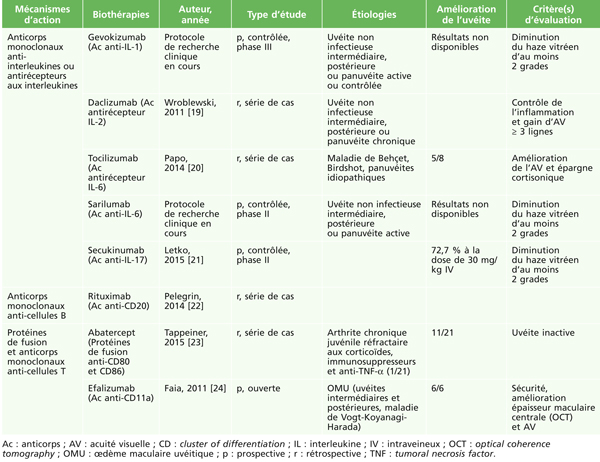
Tableau 6-7 Biothérapies (autres que anti-TNF-α) et uvéites non infectieuses (dont œdème maculaire) dans la littérature.
Les interférons (IFN) de type I, notamment l’IFN-α, inhibent la réplication virale, augmentent la capacité lytique des cellules NK, augmentent l’expression des molécules de classe I du complexe majeur d’histocompatibilité sur les cellules infectées par des virus et stimulent le développement des lymphocytes TH1, en particulier chez l’homme [25]. En plus d’une forte activité antivirale, ils ont des effets pro- ou anti-apoptotiques, antiprolifératifs et immunomodulateurs. Aucun IFN n’a l’autorisation de mise sur le marché dans une indication ophtalmologique. Néanmoins, quelques études, détaillées dans le tableau 6-8, montrent son efficacité sur le traitement de l’œdème maculaire uvéitique réfractaire aux corticoïdes voire aux immunosuppresseurs, compliquant notamment la maladie de Behçet, la rétinochoroïdite de type Birdshot et l’uvéite intermédiaire chronique. Rapidement efficaces (en quelques semaines voire quelques jours), à faibles doses, et pour de courtes durées (quelques mois), les IFN-α n’ont qu’un effet suspensif (en dehors de la maladie de Behçet) et ne sont pas dénués d’effets indésirables. Ils sont majoritairement bénins mais doivent être pris en compte car invalidants : syndrome pseudogrippal et asthénie principalement. Rarement, ils peuvent induire un syndrome dépressif sévère, une cytolyse hépatique, une pancytopénie ou une pathologie dysimmunitaire notamment thyroïdienne.
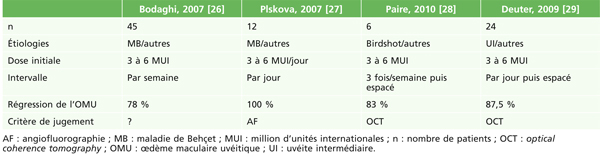
Tableau 6-8 Interférons α et œdème maculaire dans la littérature.
Il s’agit d’une perspective thérapeutique actuellement en cours d’évaluation. Les études chez l’animal ont montré l’importance des lymphocytes T régulateurs comme modulateurs de la réaction inflammatoire. Leur déplétion entraîne une inflammation plus rapide et plus intense dans le modèle expérimental [30]. Une étude de phase I/II est actuellement en cours chez l’homme afin d’évaluer la tolérance d’une injection intravitréenne de lymphocytes T régulateurs autologues chez les patients atteints d’uvéite non infectieuse avec baisse visuelle majeure. Un autre essai clinique portera sur des lymphocytes T régulateurs injectés par voie systémique au cours des uvéites non infectieuses sévères. Les résultats de ces études pourraient ouvrir de nouvelles perspectives pour la prise en charge des uvéites réfractaires.
Les indications des immunosuppresseurs, biothérapies et interférons α sont résumées dans les tableaux 6-9 et 6-10.

Tableau 6-9 Principales indications des immunosuppresseurs, biothérapies et interférons α.
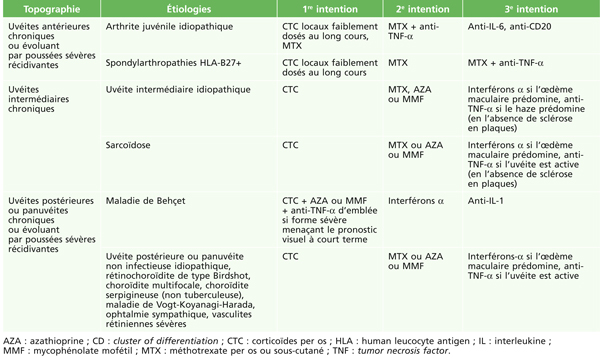
Tableau 6-10 Immunosuppresseurs et biothérapies quand les anti-inflammatoires stéroïdiens ne peuvent être maintenus ou ne suffisent plus à traiter un œdème maculaire uvéitique.
De concert avec l’ophtalmologiste et l’interniste, la surveillance des œdèmes maculaires uvéitiques est au cœur de la prise en charge, quelle que soit la stratégie thérapeutique adoptée, afin qu’une relation de confiance s’instaure, garante de l’observance. Pour l’interniste, il est parfois difficile d’ajuster les doses d’un traitement dont il connaît les effets indésirables généraux, sans en appréhender l’efficacité s’il n’a pas accès aux données ophtalmologiques. Les données évolutives de chaque examen ophtalmologique doivent donc être transmises avec précision à l’interniste.
Le rythme de surveillance est adapté à :
l’évolution prévisible en fonction de l’étiologie, si elle est connue ;
l’efficacité des traitements entrepris ;
la tolérance ophtalmologique et générale des thérapeutiques ;
la qualité de vie du patient.
Ce rythme est généralement mensuel jusqu’à la rémission, trimestriel une fois les lésions stabilisées et la décroissance thérapeutique entreprise, puis semestriel voire, à terme, annuel à la phase cicatricielle.
En cas d’inefficacité d’un traitement corticoïde, immunosuppresseur et/ou immunomodulateur, l’observance doit être vérifiée, surtout s’il s’agit d’un traitement par voie orale au long cours entraînant des effets indésirables gênants. Une étiologie infectieuse ou tumorale doit systématiquement être éliminée. En cas de doute sur l’observance, un traitement oral peut être remplacé par une molécule sous-cutanée ou intraveineuse. Par ailleurs, si une infection est suspectée, un traitement anti-infectieux d’épreuve peut être mis en place.
La surveillance extra-ophtalmologique et les mesures associées à la prescription des immunosuppresseurs et des immunomodulateurs sont résumées dans le tableau 6-11.
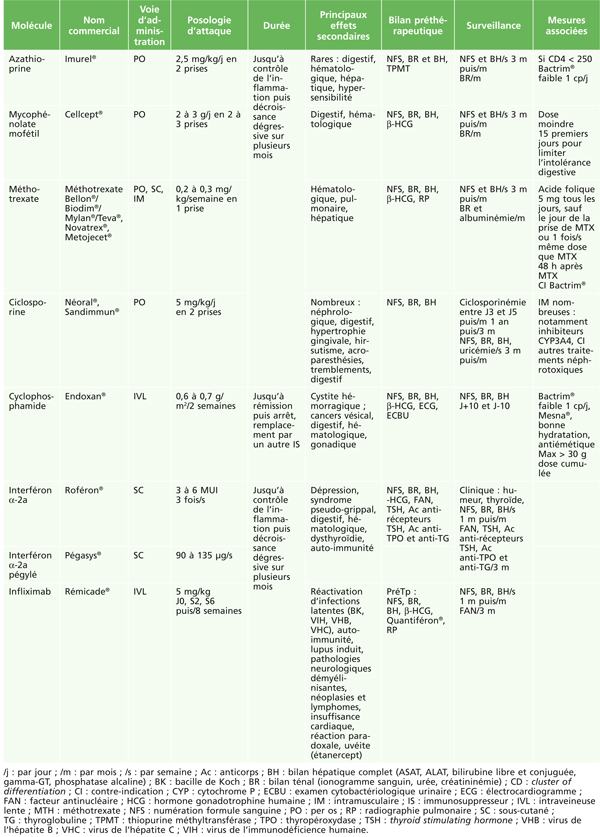
Tableau 6-11 Immunosuppresseurs, biothérapies et interféron α : posologies, effets indésirables et surveillance.
Immunosuppresseurs, biothérapies et interférons α assurent la prise en charge de l’œdème maculaire inflammatoire lorsqu’il devient réfractaire aux traitements anti-inflammatoires usuels. Il est impossible de standardiser le choix thérapeutique tant les causes d’œdème maculaire inflammatoire et leur profil évolutif sont variés. Cependant, le respect de grandes lignes de conduite permet d’avoir une attitude fiable et efficace au profit de la fonction visuelle, de l’état général et de la qualité de vie des patients.
[1] Sreekantam S, Denniston AKO, Murray PI. Survey of expert practice and perceptions of the supporting clinical evidence for the management of uveitis-related cataract and cystoid macular oedema. Ocul Immunol Inflamm 2011 ; 19 : 353-7.
[2] Khachatryan N, Kempen JH. Immunosuppressive therapy and cancer risk in ocular inflammation patients : fresh evidence and more questions. Ophthalmology 2015 ; 122 : 219-21.
[3] Pasadhika S, Kempen JH, Newcomb CW, et al. Azathioprine for ocular inflammatory diseases. Am J Ophthalmol 2009 ; 148 : 500-509.e2.
[4] Siepmann K, Huber M, Stübiger N, et al. Mycophenolate mofetil is a highly effective and safe immunosuppressive agent for the treatment of uveitis : a retrospective analysis of 106 patients. Graefe’s Arch Clin Exp Ophthalmol 2006 ; 244 : 788-94.
[5] Doycheva D, Zierhut M, Blumenstock G, et al. Mycophenolate mofetil in the therapy of uveitic macular edema--long-term results. Ocul Immunol Inflamm 2012 ; 20 : 203-11.
[6] Neri P, Mariotti C, Cimino L, et al. Long-term control of cystoid macular oedema in noninfectious uveitis with Mycophenolate Mofetil. Int Ophthalmol 2009 ; 29 : 127-33.
[7] Rathinam SR, Babu M, Thundikandy R, et al. A randomized clinical trial comparing methotrexate and mycophenolate mofetil for noninfectious uveitis. Ophthalmology 2014 ; 121 : 1863-70.
[8] Kaçmaz RO, Kempen JH, Newcomb C, et al. Cyclosporine for ocular inflammatory diseases. Ophthalmology 2010 ; 117 : 576-84.
[9] Gangaputra S, Newcomb CW, Liesegang TL, et al. Methotrexate for ocular inflammatory diseases. Ophthalmology 2009 ; 116 : 2188-2198.e1.
[10] Galor A, Jabs DA, Leder HA, et al. Comparison of antimetabolite drugs as corticosteroid-sparing therapy for noninfectious ocular inflammation. Ophthalmology 2008 ; 115 : 1826-32.
[11] Taylor SRJ, Habot-Wilner Z, Pacheco P, Lightman SL. Intraocular methotrexate in the treatment of uveitis and uveitic cystoid macular edema. Ophthalmology 2009 ; 116 : 797-801.
[12] Taylor SRJ, Habot-Wilner Z, Pacheco P, Lightman S. Intravitreal methotrexate in uveitis. Ophthalmology 2012 ; 119 : 878-9.
[13] Kempen JH, Daniel E, Dunn JP, et al. Overall and cancer related mortality among patients with ocular inflammation treated with immunosuppressive drugs : retrospective cohort study. BMJ 2009 ; 339 : b2480.
[14] Saoudi A, Hurez V, de Kozak Y, et al. Human immunoglobulin preparations for intravenous use prevent experimental autoimmune uveoretinitis. Int Immunol 1993 ; 5 : 1559-67.
[15] Cassoux N, Goichot-Bonnat L, Karmochkine M, et al. Efficacy of intravenous immunoglobulin in the treatment of Birdshot retinochoroiditis. J Français Ophtalmol 2002 ; 25 : 23-30.
[16] Markomichelakis NN, Theodossiadis PG, Pantelia E, et al. Infliximab for chronic cystoid macular edema associated with uveitis. Am J Ophthalmol 2004 ; 138 : 648-50.
[17] Schaap-Fogler M, Amer R, Friling R, et al. Anti-TNF-α agents for refractory cystoid macular edema associated with noninfectious uveitis. Graefe’s Arch Clin Exp Ophthalmol 2014 ; 252 : 633-40.
[18] Zierhut M, Abu El-Asrar AM, Bodaghi B, Tugal-Tutkun I. Therapy of ocular Behçet disease. Ocul Immunol Inflamm 2014 ; 22 : 64-76.
[19] Wroblewski K, Sen HN, Yeh S, et al. Long-term daclizumab therapy for the treatment of noninfectious ocular inflammatory disease. Can J Ophthalmol J Can Ophtalmol 2011 ; 46 : 322-8.
[20] Papo M, Bielefeld P, Vallet H, et al. Tocilizumab in severe and refractory non-infectious uveitis. Clin Exp Rheumatol 2014 ; 32(4 Suppl 84) : S75-79.
[21] Letko E, Yeh S, Foster CS, et al. Efficacy and safety of intravenous secukinumab in noninfectious uveitis requiring steroid-sparing immunosuppressive therapy. Ophthalmology 2015 ; 122 : 939-48.
[22] Pelegrin L, Jakob E, Schmidt-Bacher A, et al. Experiences with rituximab for the treatment of autoimmune diseases with ocular involvement. J Rheumatol 2014 ; 41 : 84-90.
[23] Tappeiner C, Miserocchi E, Bodaghi B, et al. Abatacept in the treatment of severe, longstanding, and refractory uveitis associated with juvenile idiopathic arthritis. J Rheumatol 2015 ; 42 : 706-11.
[24] Faia LJ, Sen HN, Li Z, et al. Treatment of inflammatory macular edema with humanized anti-CD11a antibody therapy. Invest Ophthalmol Vis Sci 2011 ; 52 : 6919-24.
[25] Abbas AK, Litchman AH. Les bases de l’immunologie fondamentale et cliniques. Issy-les-Moulineaux : Elsevier ; 2008.
[26] Bodaghi B, Gendron G, Wechsler B, et al. Efficacy of interferon alpha in the treatment of refractory and sight threatening uveitis : a retrospective monocentric study of 45 patients. Br J Ophthalmol 2007 ; 91 : 335-9.
[27] Plskova J, Greiner K, Forrester JV. Interferon-alpha as an effective treatment for noninfectious posterior uveitis and panuveitis. Am J Ophthalmol 2007 ; 144 : 55-61.
[28] Paire V, Lebreton O, Weber M. Effectiveness of interferon alpha in the treatment of uveitis macular edema refractory to corticosteroid and/or immunosuppressive treatment. J Français Ophtalmol 2010 ; 33 : 152-62.
[29] Deuter CME, Kötter I, Günaydin I, et al. Efficacy and tolerability of interferon alpha treatment in patients with chronic cystoid macular oedema due to non-infectious uveitis. Br J Ophthalmol 2009 ; 93 : 906-13.
[30] Terrada C, Fisson S, De Kozak Y, et al. Regulatory T cells control uveoretinitis induced by pathogenic Th1 cells reacting to a specific retinal neoantigen. J Immunol 2006 ; 176 : 7171-9.
T. Desmettre
➤ La photocoagulation utilise la lumière (caractérisée par sa longueur d’onde, la durée du pulse) qui, absorbée par la mélanine de l’épithélium pigmentaire à l’origine d’une augmentation de température, induit un effet biologique dont les conséquences restent encore mal élucidées.
➤ Suite à l’évolution des pratiques et en particulier de l’avènement des traitements pharmacologiques des OM, les indications de la photocoagulation laser de la région maculaire ont beaucoup diminué mais gardent encore une place de choix dans le traitement de la composante focale d’un œdème maculaire diabétique (OMD) et des OM sur occlusions de branche veineuse rétinienne (OBVR).
➤ L’avènement de nouveaux lasers à durée de pulse raccourci, de l’ordre de quelques millisecondes (micropulses) voire nanosecondes (nanopulses), et de lasers couplés à une imagerie, offrant un confinement du dommage thermique et une plus grande facilité de réalisation, permettra peut-être un regain d’intérêt pour ces traitements physiques.
➤ La thérapie photodynamique (photodynamic therapy [PDT]), fondée sur l’activation d’un photosensibilisant par un laser non thermique, garde une place de choix dans le traitement des vasculopathies polypoïdales (avec AMM), des hémangiomes choroïdiens (sans AMM) et de la choriorétinite séreuse centrale (CRSC) chronique (sans AMM).
➤ La PDT est plutôt réalisée en pleine fluence dans le cadre des vasculopathies polypoïdales en association ou non avec les injections intravitréennes d’anti-VEGF, et plutôt en demi-fluence ou demi-dose dans les CRSC chroniques.
L’ophtalmologie a été la première spécialité à utiliser la photocoagulation, en particulier pour traiter la rétinopathie proliférante des diabétiques. Les ophtalmologistes ont ainsi été les premiers médecins à observer que la technique dépend de nombreux paramètres. La photocoagulation utilise la lumière (caractérisée par sa longueur d’onde, la durée du pulse, etc.) qui est absorbée par la mélanine de l’épithélium pigmentaire (EP). Cette absorption induit la formation d’un gradient de température de part et d’autre de l’EP [1]. L’élévation de température induit à son tour un effet biologique, le dommage thermique. La dénaturation des protéines de la neurorétine explique son blanchiment, comparable à celui de la cuisson de l’albumine du blanc d’œuf [2]. Ainsi le blanchiment de la neurorétine, observé au fond d’œil lors de la séance de photocoagulation, est depuis une cinquantaine d’années le marqueur du traitement, implicitement lié à l’effet thérapeutique attendu [3].
Depuis quelques années, on assiste finalement à deux phénomènes : d’une part les indications de la photocoagulation ont reculé drastiquement, au profit des injections intravitréennes d’anti-VEGF ; d’autre part les techniques de la photocoagulation ont été progressivement modifiées, en privilégiant un dommage thermique confiné aux photorécepteurs et à l’EP et bien mieux contrôlé. Pour les techniques les plus récentes (PDT, micropulse retinal rejuvenation therapy ou 2RT), le blanchiment n’est plus le paramètre qui témoigne de l’efficacité thérapeutique. Déjà il y a une vingtaine d’années, on distinguait les photocoagulations blanches intenses visant à occlure les néovaisseaux choroïdiens de la DMLA, les photocoagulations modérées réalisées en périphérie pour traiter la rétinopathie diabétique et enfin les photocoagulations légères, à peine visibles utilisées pour traiter l’OMD. C’est l’évolution technique mais aussi la meilleure compréhension de la pathogénie des affections traitées qui ont permis d’évoluer vers un dommage thermique plus contrôlé à l’échelon cellulaire.
Malgré cette évolution, les indications des traitements par laser sont maintenant relativement limitées pour les pathologies rétiniennes en dehors peut-être, et pour quelque temps encore, de la photocoagulation de la rétinopathie périphérique des diabétiques.
La photocoagulation utilise un gradient de température initié au niveau des pigments rétiniens et choroïdiens (principalement la mélanine de l’épithélium pigmentaire) [2]. On distingue tout d’abord une étape optique qui comporte des phénomènes de diffusion de transmission, de réflexion et finalement d’absorption de la lumière laser. Dans un deuxième temps, l’étape thermique correspond à la transformation de la lumière absorbée en chaleur avec la création d’un gradient de température. Une élévation de température de l’ordre de 20 à 30° au-dessus de la température basale détermine une dénaturation des protéines tissulaires avec un effet seuil. Cette dénaturation des protéines qui correspond au blanchiment est l’élément caractéristique de la photocoagulation. Enfin, la photocoagulation laisse une cicatrice intéressant la neurorétine et la choriocapillaire, de part et d’autre de l’épithélium pigmentaire.
Pour les photocoagulations périphériques de la rétinopathie diabétique comme pour les rares photocoagulations des néovaisseaux choroïdiens qui sont encore réalisées, les niveaux d’énergie sont importants avec des temps relativement longs en particulier pour les néovaisseaux. Au niveau de l’épithélium pigmentaire, ces niveaux d’énergie sont largement au-dessus du seuil de la photocoagulation (fig. 6-24). Le réglage des paramètres du laser n’est probablement pas d’une haute importance en raison du niveau d’énergie élevé.
Fig. 6-24 Effet tissulaire de la photocoagulation au laser thermique [37].
a. L’importance du dommage thermique est déterminée par la time-temperature history, c’est-à-dire l’aire sous la courbe d’élévation de température. Le schéma correspond à une photocoagulation intense de type « photocoagulation périphérique » ou « photocoagulation de néovaisseaux choroïdiens » avec une élévation de température bien au-delà du seuil de photocoagulation. b. La courbe sigmoïde correspond au dommage thermique induit par l’élévation de température. En clinique, l’aspect de la brûlure est celle d’un blanchiment important. On note que le dommage apparaît de façon décalée par rapport à l’élévation de température.
Depuis les premiers lasers argon « bleu-vert » utilisés dans les études pour démontrer l’efficacité de la méthode, les progrès techniques ont permis l’avènement d’appareils plus compacts, refroidis par air et utilisant une alimentation électrique standard. On utilise le plus souvent actuellement un laser vert (Nd:YAG à fréquence doublée émettant à 532 nm), respectant davantage le pigment xanthophylle maculaire que les lasers argon. Pour les indications maculaires qui persistent, on peut utiliser un laser rouge (de type krypton) qui facilite les tirs à travers les hémorragies intrarétiniennes ou les troubles des milieux [4].
Le traitement de l’œdème maculaire du diabétique a longtemps reposé sur des photocoagulations maculaires [3], soit en quinconce (grid), soit avec des impacts de plus longue durée sur les micro-anévrismes diffusants. Les niveaux d’énergie utilisés pour ces photocoagulations sont bien moindres que pour les photocoagulations périphériques ou pour les photocoagulations des néovaisseaux choroïdiens (fig. 6-25). C’est justement parce qu’on utilise des niveaux d’énergie proches du seuil de la photocoagulation que les paramètres du laser sont importants.
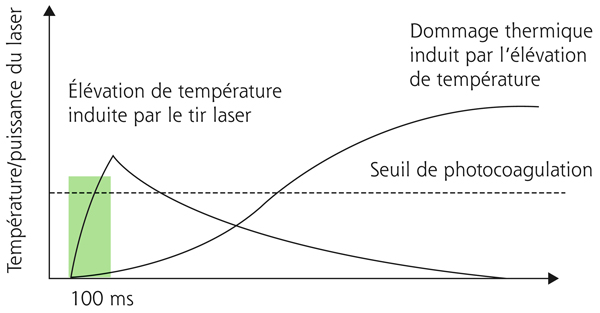
Fig. 6-25 Photocoagulation de type « grid maculaire » [37].
La température maximale dépasse faiblement le seuil de photocoagulation, ce qui implique une grande importance des paramètres de tir. Le dommage thermique est encore davantage décalé dans le temps par rapport au tir laser. La majeure partie de ce dommage se produit une fois le pulse terminé pendant le retour de la température vers la valeur basale.
En pratique clinique, l’utilisation des anti-VEGF associés à des photocoagulations immédiates (prompt) ou retardées (deferred) a montré depuis quelques années sa supériorité sur les photocoagulations utilisées seules pour le traitement de l’œdème maculaire sévère [5–7]. Les anti-VEGF, parfois précédés d’un traitement laser pour une composante d’œdème maculaire focal, sont devenus la base des traitements de l’œdème maculaire du diabétique. Les modalités d’utilisation du laser restent cependant discutées. Les études qui ont évalué l’efficacité du laser pour l’OMD sont à interpréter et utiliser avec prudence parce que leurs résultats dépendent des paramètres utilisés. Les résultats obtenus en pratique clinique dépendent aussi des matériels employés. Ainsi, la lumière des lasers jaunes est davantage absorbée par l’hémoglobine que la lumière verte, ce qui permet à certains opérateurs d’utiliser un laser jaune pour traiter spécifiquement les micro-anévrismes diffusants de la région maculaire. D’autres praticiens, employant un laser vert, utiliseront probablement moins souvent cette technique. La population traitée influence aussi les résultats : les œdèmes des patients observés dans la pratique quotidienne peuvent être différents des cas traités dans les études.
Les variations des paramètres de tir (longueur d’onde, durée des impacts, mode continu ou pulsé, etc.) ont un rôle important sur l’effet tissulaire et le résultat clinique. Les lasers argon bleus et bleu-vert ont été progressivement abandonnés en raison du risque d’absorption par le pigment maculaire xanthophyle (420 à 500 nm). Ils ont été remplacés depuis les années 1990 par les lasers verts (495 à 570 nm) ou jaunes (570 à 590 nm). Ces deux longueurs d’onde sont bien absorbées par la mélanine et par l’hémoglobine, ce qui permet une absorption au niveau de l’épithélium pigmentaire et des structures vasculaires. En théorie, le jaune présente moins d’interactions que le vert avec le cristallin et pénètre de façon un peu plus profonde vers les structures qui sont visées. Pourtant cet avantage théorique n’a pas été validé par des études cliniques. Les auteurs d’une méta-analyse récente ont montré une tendance à de meilleurs résultats visuels avec le laser jaune mais ce résultat n’a pas été confirmé dans les autres groupes [8]. Il est donc difficile en pratique de déterminer si l’utilisation d’une des deux longueurs d’onde apporte un réel bénéfice aux patients.
La réalisation de photocoagulations à proximité de la fovéola est parfois rendue difficile par le repérage des lésions ou les discrets mouvements du patient. L’expérience aide à compenser ces deux éléments. Toutefois, pour des lésions visibles surtout en angiographie telles que les micro-anévrismes diffusants d’un œdème focal du diabétique, le point de fuite d’une CRSC ou pour des télangiectasies maculaire idiopathiques de type I, le repérage précis, comparant l’aspect du fond d’œil sur la lampe à fente du laser avec un cliché d’angiographie, est parfois long et peut manquer de précision. On peut citer ici le système Navilas® d’aide au positionnement des impacts [9]. Le système laser intègre un système d’imagerie qui permet d’acquérir des clichés d’angiographie et des clichés sans préparation. L’appareil permet également d’importer des images externes telles qu’un cliché d’angiographie au vert d’indocyanine (indocyanine green [ICG]) ou un mapping réalisé sur un OCT. L’opérateur défini sur l’écran de l’ordinateur du système les zones à éviter (la papille, la fovéola) et celles à traiter. Les tirs lasers peuvent alors être réalisés avec des verres contact ou non contact.
La durée du pulse laser est un paramètre qui prend toute son importance pour les photocoagulations peu dosées de la région maculaire. Jusqu’aux années 1980, lorsqu’on utilisait un laser bleu-vert pour créer un dommage thermique important au niveau de la rétine périphérique, la durée du pulse était habituellement de 100 à 200 ms et l’opérateur faisait peu varier ce paramètre. L’extension du gradient de température vers les branches des nerfs ciliaires dans la choroïde expliquait les douleurs parfois importantes ressenties par les patients. Cette étendue du dommage thermique explique aussi l’extension progressive de la taille des cicatrices de photocoagulation observée même plusieurs années après la séance de photocoagulation. Les études qui ont validé l’utilisation du laser PASCAL® ont au contraire montré la possibilité d’un confinement du dommage thermique aux couches externes de la rétine en réduisant la durée du pulse à 10 ou 20 ms [10]. Cette notion avait d’ailleurs déjà été montrée par Mainster dans les années 1970 (fig. 6-26) [1].
Actuellement, pour des photocoagulations maculaires conventionnelles, la plupart des opérateurs utilisent des durées de pulse qui excèdent rarement 50 ms. Le laser PASCAL® utilise des temps courts, de 10 à 20 ms, permettant un certain confinement du dommage thermique. L’utilisation d’une procédure de tir automatisée avec une rafale de tirs suivant un schéma choisi au préalable (pattern) diminue le temps de la procédure. En outre, le confinement du dommage thermique permet de diminuer l’échauffement de la choroïde et donc les douleurs. De nombreuses études ont validé l’intérêt de ce type de lasers pour les photocoagulations de la rétine périphérique. Plusieurs auteurs ont cependant fait remarquer que la réduction du temps des pulses pouvait expliquer un manque d’efficacité vis-à-vis de la prévention des complications ischémiques et vis-à-vis de l’OM [10, 11].
Luttrul et Dorin ont proposé une représentation de l’effet des photocoagulations (fig. 6-27) [12]. Selon cette représentation, l’efficacité des photocoagulations au laser vert de type argon serait en partie liée aux modifications de l’EP dans une frange bordant les impacts. Le confinement du dommage caractérisant le laser PASCAL® serait alors associé à une réduction de cet « effet de bord ». Il faudra bien sûr attendre d’avoir davantage de recul pour juger complètement de la place du laser PASCAL® dans le traitement de l’OMD. Ce type d’appareils peut d’ailleurs être utilisé en mode conventionnel lorsque l’opérateur le souhaite.
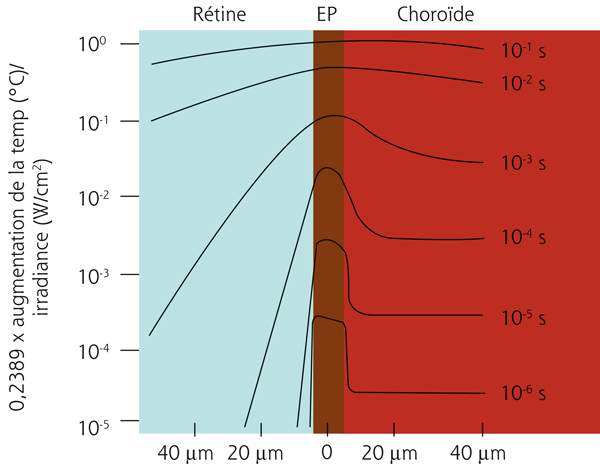
Fig. 6-26 Augmentation de la température au centre d’un impact de 200 µm [1].
Vers le bas de la figure, la réduction de la durée du pulse permet de confiner l’élévation de température et le dommage thermique qu’elle produit. EP : épithélium pigmentaire.

Fig. 6-27 Représentation de l’effet des différents modes de traitements laser.
a. Laser vert (type argon). b. Laser vert (dosage important). c. Laser vert (faible dosage). d. Laser PASCAL®. e. Laser micropulse de faible densité. f. Laser micropulse à densité élevée.
En orange : rétine saine entre les impacts ; en brun : zones de destruction de l’épithélium pigmentaire (EP) ; en crème : zones où l’EP a été traité visant à la restitution d’une expression normale de certaines cytokines ; en jaune : au bord des zones de destruction de l’EP, on figure des zones où l’EP n’a pas été complètement détruit. La modulation de l’expression de certaines cytokines participerait à l’effet thérapeutique du laser.
(Source : Luttrull JK, Dorin G. Subthreshold diode micropulse laser photocoagulation (SDM) as invisible retinal phototherapy for diabetic macular edema : a review. Curr Diabetes Rev 2012 ; 8 : 274-84. Reproduction autorisée.)
Les lasers micropulse représentent un pas supplémentaire vers un confinement du dommage thermique. On notera que cette technique n’a pas été évaluée dans les études pivots comparant les anti-VEGF aux photocoagulations. Leur mode d’action reste mal précisé, il est probablement très différent de la photocoagulation classique.
L’intérêt du laser micropulse infrarouge pour l’OMD a été illustré en 2005. Une étude a rapporté les résultats positifs de photocoagulations au laser diode 810 nm infraliminaire en mode micropulse pour le traitement de l’OMD [13]. Il s’agissait de 95 yeux chez 69 patients consécutifs, présentant un œdème focal. Les auteurs montraient une stabilisation ou une amélioration de l’acuité visuelle des patients traités, une diminution (96 % des cas) ou une résolution (79 %) des cas de l’œdème en biomicroscopie. Les impacts n’étaient pas visibles en biomicroscopie. De même, l’angiographie à la fluorescéine réalisée chez tous ces patients n’avait pas montré de rupture de la barrière hémato-rétinienne. L’étude ne comportait pas d’examens par OCT qui auraient mieux validé la diminution de l’œdème. Elle montrait en revanche la résolution de l’œdème focal dans la plupart des cas, sans cicatrice visible ni en biomicroscopie, ni en angiographie. Plusieurs autres études réalisées par des équipes différentes, utilisant le laser micropulse 810 nm avec des impacts infraliminaires, ont confirmé l’intérêt de ce type d’impacts pour l’œdème maculaire [12, 14–16]. Plus récemment, Vusojevic a comparé des mesures en micropérimétrie et les clichés en autofluorescence du pôle postérieur chez des patients traités soit par photocoagulations « Early Treatment Diabetic Retinopathy Study (ETDRS) » modifiées soit par micropulse infraliminaires [17]. Dans cette étude l’absence de cicatrice au niveau de l’EP, même après 1 an, a facilité les indications des retraitements s’ils étaient nécessaires. D’autres études, souvent sur de petits effectifs, ont aussi confirmé l’intérêt de cette technique (fig. 6-28) [18–20].
Le principe des photocoagulations micropulse infraliminaires déborde le domaine de la photocoagulation (fig. 6-29). La photocoagulation implique un blanchiment qui en est le marqueur observable au fond d’œil. Au contraire, l’effet biologique recherché avec les impacts infraliminaires serait une modulation des propriétés de l’épithélium pigmentaire avec expression de cytokines, permettant de favoriser la résorption de l’œdème maculaire sans destruction des photorécepteurs [12]. Il persiste cependant de nombreuses inconnues concernant ces traitements. L’utilisation du vert, du jaune ou de l’infrarouge en micropulse par des équipes différentes ne facilite pas la comparaison des techniques.
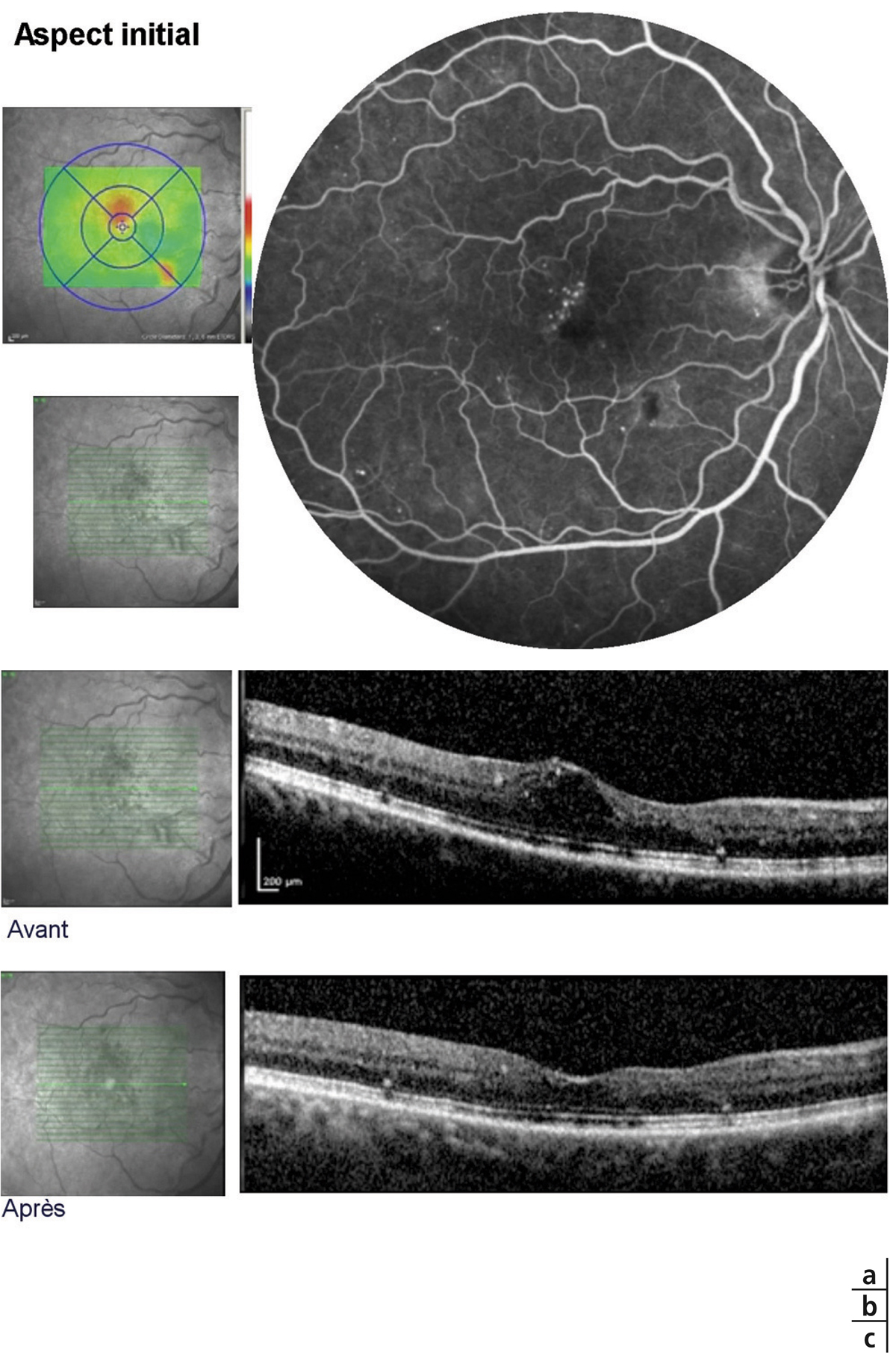
Fig. 6-28 Œdème maculaire diabétique avant et après traitement par laser micropulse (100 µm, 200 ms – Duty Cycle 5 % : 0,1 ms ON et 1,9 ms OFF/enveloppe de 2 ms).
a. Aspect initial. b. Avant. c. Après.
(Remerciements au Dr Victor Chong, Eye Hospital, Oxford, Royaume-Uni.)
Fig. 6-29 Schématisation des techniques de laser infraliminaires, micropulse et nanopulse.
La retinal rejuvenation therapy (2RT) constitue un pas supplémentaire vers une diminution et surtout un confinement du dommage thermique à l’échelon des cellules de l’EP.
On pensait initialement que l’effet du laser sur l’œdème maculaire passait uniquement par une absorption de l’énergie laser à l’intérieur des capillaires rétiniens avec un effet direct sur les fuites à partir des micro-anévrismes. Il a ensuite été observé que les effets thérapeutiques pouvaient être associés à des altérations des cellules de l’épithélium pigmentaire. Ce concept a amené l’idée des traitements en grid (ou quinconce). La libération d’enzymes (métalloprotéinases matricielles [MPM]) par les cellules de l’EP faciliterait la détersion des débris de membrane de Bruch et les processus de transport [21]. La division de cellules de l’EP est elle-même associée à la libération de cytokines qui déclenchent la division des cellules endothéliales des capillaires. On expliquerait ainsi qu’une hyperexpression des MPM faciliterait la résorption des fluides rétiniens. Comme énoncé plus haut, les cliniciens ont progressivement diminué le niveau d’énergie et la durée des tirs des lasers à visée maculaire pour induire des brûlures minimales, tendant à respecter les photorécepteurs et limiter l’effet thermique aux cellules de l’EP [22].
Le système 2RT utilisé dans l’étude de Pelosini en 2013 [23] repose sur deux éléments importants : une durée de l’impulsion laser de 3 nanosecondes visant à provoquer des dommages de cavitation au niveau de l’EP plutôt qu’un effet thermique avec extension du dommage à distance ; un rapport signal/bruit réduit afin de limiter le nombre de « points chauds » dans le faisceau laser pour ne léser qu’un faible nombre de cellules de l’EP. Chaque cellule détruite reste bordée de cellules non affectées par l’impulsion laser. Cette notion vise à permettre la survie des photorécepteurs sus-jacents tout en « stimulant » globalement l’EP.
Les auteurs ont observé un effet bénéfique d’un traitement laser chez des patients présentant un OMD sans les effets secondaires classiques de la photocoagulation. L’efficacité de ce système par rapport aux photocoagulations habituelles devra certainement faire l’objet d’évaluations complémentaires. D’autres auteurs envisagent l’utilisation de ce type de traitement aux stades précoces de la DMLA [24, 25].
La thérapie photodynamique (photodynamic therapy [PDT]) utilise l’énergie lumineuse d’un laser du proche infrarouge pour activer un photosensibilisant en présence d’oxygène [26]. Il s’agit d’un effet photochimique, différent des effets du laser utilisés auparavant en ophtalmologie tels que l’effet thermique de la photocoagulation ou l’effet mécanique du laser Nd:YAG.
La PDT a été proposée au début des années 2000 pour le traitement des formes rétrofovéales des néovaisseaux choroïdiens. Elle permettait une réduction de la baisse d’acuité visuelle des patients, mais nécessitait un suivi régulier trimestriel pour d’éventuels retraitements. Au milieu des années 2000, l’utilisation d’injections intravitréennes (IVT) de triamcinolone associée à la PDT permettait une amélioration des résultats visuels. L’arrivée des traitements anti-VEGF a fait passer la PDT au second plan. Elle garde néanmoins encore quelques indications.
Le traitement par PDT débute par l’injection intraveineuse du photosensibilisant, la vertéporfine (Visudyne®) encapsulée dans des liposomes. Ceux-ci vont former des complexes dans le secteur vasculaire avec les low density lipids (LDL) qui viennent se fixer au niveau de récepteurs aux LDL sur les cellules de l’endothélium des néovaisseaux choroïdiens. La vertéporfine est ensuite activée par une lumière du proche infrarouge (690 nm), peu intense. La réaction photochimique ainsi produite libère des radicaux libres provoquant une lésion de la paroi des néovaisseaux choroïdiens et des phénomènes de thrombose. L’intérêt de la PDT repose sur la sélectivité du traitement des néovaisseaux choroïdiens sans lésion de la rétine sensorielle. Toutefois, cet intérêt doit être relativisé. En effet, la fixation des liposomes n’est pas complètement sélective et peut varier au cours du temps, au niveau des différents tissus. Une partie de la vertéporfine peut se fixer, par exemple, au niveau de l’épithélium pigmentaire, pouvant expliquer la formation progressive de zones d’atrophie au pourtour de la zone traitée. Par ailleurs, les phénomènes de thrombose des néovaisseaux choroïdiens induits par une première séance de traitement ne sont ni complets, ni définitifs et des retraitements sont parfois nécessaires. Ceux-ci peuvent être à l’origine d’effets indésirables au niveau des tissus environnant les néovaisseaux choroïdiens.
La présence d’oxygène est nécessaire à la formation d’espèces oxydantes sur lesquelles repose l’effet photochimique. L’occlusion des néovaisseaux et la diminution du lit vasculaire choroïdien en regard de la lésion observées après la première séance de PDT peuvent ainsi expliquer l’efficacité moindre des séances suivantes.
Lors du traitement des choriorétionpathies séreuses centrales chroniques par PDT, a été notée l’apparition en angiographie à la fluorescéine d’une zone hypofluorescente en regard de la macula pouvant correspondre à des occlusions vasculaires choroïdiennes, évoquant un possible surdosage [27].
Un traitement par PDT demi-dose (en réduisant la dose de Visudyne® injectée) ou demi-fluence (en réduisant la dose de la lumière du laser infrarouge activant le photosensibilisant) a été proposé. Zhao a montré que 30 % de la dose standard de Visudyne® (1,8 mg/m2) représentait la limite de la dose minimale efficace [28].
La diminution de la dose de lumière est l’autre façon de diminuer le risque de surdosage. La dose standard est de 50 J/cm2. L’irradiance est la puissance divisée par la surface à traiter (I (w/cm²) = P/S) et la fluence est l’irradiance multipliée par la durée d’irradiation (F (J/cm²) = I × t). Ainsi, on retrouve les paramètres affichés sur les lasers de thérapie photodynamique :
dose standard : 50 J/cm2 = 600 mW/cm2 × 83 s ;
demi-fluence : 25 J/cm2 = 300 mW/cm2 × 83 s.
Suivant les appareils utilisés, il conviendra de régler soit simplement la fluence, soit la fluence et l’irradiance. Plusieurs auteurs ont montré l’intérêt d’utiliser une fluence réduite pour traiter les CRSC chroniques [29–31]. En revanche, Kim a montré la possibilité de survenue d’une déchirure de l’épithélium pigmentaire, même avec cette réduction de la fluence [30].
Les deux techniques de PDT à fluence réduite ou à demi-dose de Visudyne® semblent aussi efficaces. La seconde méthode aurait un intérêt économique [28].
Deux études randomisées multicentriques ont démontré l’efficacité de la thérapie photodynamique utilisant la Visudyne®. Dans l’étude TAP (Treatment of Age related macular degeneration with Photodynamic therapy) ont été inclus des patients présentant des néovaisseaux rétrofovéaux comportant un contingent visible (classic) [32, 33] et dans l’étude VIP (Verteporfin In Photodynamic therapy) des patients ayant des néovaisseaux compliquant une DMLA (VIP-AMD) ou une myopie forte [34, 35]. Les néovaisseaux devaient occuper plus de 50 % de la surface de la lésion. Ainsi les patients présentant une hémorragie de grande taille ou un décollement de l’épithélium pigmentaire (DEP) étaient exclus de ces études.
Le critère de jugement principal était la proportion d’yeux ayant une baisse de l’acuité visuelle de 15 lettres ou plus sur l’échelle ETDRS. Un retraitement à 3 mois était proposé en présence de diffusions en angiographie à la fluorescéine. L’étude VIO (Visudyne in Occult choroidal neovascularization), plus récente a inclus des patients présentant des néovaisseaux choroïdiens occultes [36].
Les résultats de ces études ont montré que la PDT était d’autant plus efficace que les néovaisseaux visibles prédominaient au sein de la lésion. Ainsi, à 24 mois, la probabilité par rapport au groupe placebo de ne pas présenter de baisse d’acuité visuelle était multipliée par 1,9 pour les néovaisseaux à prédominance visible, par 2,4 pour les néovaisseaux purement visibles et par 1,4 pour les néovaisseaux purement occultes. Cette probabilité était de 2,1 pour les néovaisseaux purement occultes, de petite taille et associés à une acuité visuelle inférieure ou égale à 4/10.
La PDT garde une AMM dans la DMLA où elle est indiquée en cas d’inefficacité des anti-VEGF, en cas de refus des IVT par le patient ou plus souvent en association thérapeutique avec les anti-VEGF ou la triamcinolone.
Elle est indiquée en cas de néovaisseaux majoritairement visibles (classics) de la DMLA en situation rétrofovéale. Les indications font intervenir la taille du contingent visible (au moins 50 % de la lésion) et la surface totale des néovaisseaux (surface des néovaisseaux visibles additionnée à celle des néovaisseaux occultes représentant au moins 50 % de la surface totale de la lésion). En outre, la dimension linéaire maximale de la lésion totale doit être inférieure à neuf surfaces papillaires et l’acuité visuelle corrigée doit être comprise entre 1/10 et 5/10 inclus. Une acuité visuelle inférieure n’empêche pas la prise en charge si l’œil est unique, s’il existe une autre cause de baisse d’acuité visuelle ou si la baisse d’acuité est très récente, inférieure à 1 mois.
Dans quelques cas de DMLA, la PDT peut être une alternative aux anti-VEGF :
lésions évoluées avec perte de la fixation centrale ;
lésions évoluées avec perte progressive de l’acuité visuelle malgré des retraitements réguliers par anti-VEGF.
En dehors de la DMLA, certaines pathologies restent régulièrement traitées par PDT :
les hémangiomes choroïdiens (avec une PDT demi-fluence mais protocoles de traitements variés) ;
les CRSC (PDT demi-fluence ou demi-dose de photosensibilisant) ;
les vasculopathies polypoïdales choroïdiennes (le plus souvent en fluence standard, en combinaison avec un anti-VEGF).
Ces cas correspondent à des indications de PDT, non couvertes par une éventuelle AMM mais relevant d’un certain consensus. Ces indications doivent être posées avec soin, en informant le patient de l’absence d’AMM.
En 20 ans, les indications des photocoagulations maculaires, initialement déterminées par l’expérience de quelques praticiens et appuyées sur de rares études incluant de petits effectifs, ont été remplacées par les anti-VEGF, avec des indications et un rythme d’administration guidés par des essais randomisés sur de grands effectifs réalisés par les laboratoires commercialisant les anti-VEGF. Cette description un peu orwellienne des choses ne doit cependant pas occulter qu’en 20 ans, le nombre des patients traités a bien augmenté et, surtout, que leur pronostic visuel est bien meilleur. On peut toutefois regretter que de grandes études randomisées, similaires à celles réalisées pour évaluer l’efficacité des anti-VEGF, n’aient pas été mises en place par les sociétés commercialisant les lasers pour développer de nouvelles technologies et modalités de traitements.
[1] Mainster MA, White TJ, Tips JH, Wilson PW. Retinal-temperature increases produced by intense light sources. J Opt Soc Am 1970 ; 60 : 264-70.
[2] Mordon S. Actions thermiques des lasers. In : SFLM. Ed. Encyclopédie des lasers en médecine et en chirurgie : bases physiques et principes fondamentaux. Padoue : Piccin ; 1995, p. 199-214.
[3] Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study report number 1. Early Treatment Diabetic Retinopathy Study research group. Arch Ophthalmol 1985 ; 103 : 1796-806.
[4] Yannuzzi LA. Krypton red laser photocoagulation for subretinal neovascularization. Retina 1982 ; 2 : 29-46.
[5] Elman MJ, Aiello LP, Beck RW, et al. Randomized trial evaluating ranibizumab plus prompt or deferred laser or triamcinolone plus prompt laser for diabetic macular edema. Ophthalmology 2010 ; 117 : 1064-77.e35.
[6] Mitchell P, Bandello F, Schmidt-Erfurth U, et al. The RESTORE study : ranibizumab monotherapy or combined with laser versus laser monotherapy for diabetic macular edema. Ophthalmology 2011 ; 118 : 615-25.
[7] Elman MJ, Ayala A, Bressler NM, et al. Intravitreal Ranibizumab for diabetic macular edema with prompt versus deferred laser treatment : 5-year randomized trial results. Ophthalmology 2015 ; 122 : 375-81.
[8] Bressler SB, Almukhtar T, Aiello LP, et al. Green or yellow laser treatment for diabetic macular edema : exploratory assessment within the Diabetic Retinopathy Clinical Research Network. Retina 2013 ; 33 : 2080-8.
[9] Kozak I, Kim JS, Oster SF, et al. Focal navigated laser photocoagulation in retinovascular disease : clinical results in initial case series. Retina 2012 ; 32 : 930-5.
[10] Blumenkranz MS, Yellachich D, Andersen DE, et al. Semiautomated patterned scanning laser for retinal photocoagulation. Retina 2006 ; 26 : 370-6.
[11] Chappelow AV, Tan K, Waheed NK, Kaiser PK. Panretinal photocoagulation for proliferative diabetic retinopathy : pattern scan laser versus argon laser. Am J Ophthalmol 2012 ; 153 : 137-42.
[12] Luttrull JK, Dorin G. Subthreshold diode micropulse laser photocoagulation (SDM) as invisible retinal phototherapy for diabetic macular edema : a review. Curr Diabetes Rev 2012 ; 8 : 274-84.
[13] Luttrull JK, Musch DC, Mainster MA. Subthreshold diode micropulse photocoagulation for the treatment of clinically significant diabetic macular oedema. Br J Ophthalmol 2005 ; 89 : 74-80.
[14] Laursen ML, Moeller F, Sander B, Sjoelie AK. Subthreshold micropulse diode laser treatment in diabetic macular oedema. Br J Ophthalmol 2004 ; 88 : 1173-9.
[15] Figueira J, Khan J, Nunes S, et al. Prospective randomised controlled trial comparing sub-threshold micropulse diode laser photocoagulation and conventional green laser for clinically significant diabetic macular oedema. Br J Ophthalmol 2009 ; 93 : 1341-4.
[16] Ohkoshi K, Yamaguchi T. Subthreshold micropulse diode laser photocoagulation for diabetic macular edema in Japanese patients. Am J Ophthalmol 2010 ; 149 : 133-9.
[17] Vujosevic S, Bottega E, Casciano M, et al. Microperimetry and fundus autofluorescence in diabetic macular edema: subthreshold micropulse diode laser versus modified early treatment diabetic retinopathy study laser photocoagulation. Retina 2010 ; 30 : 908-16.
[18] Luttrull JK, Sinclair SH. Safety of transfoveal subthreshold diode micropulse laser for fovea-involving diabetic macular edema in eyes with good visual acuity. Retina 2014 ; 34 : 2010-20.
[19] Nicolo M, Musetti D, Traverso CE. Yellow micropulse laser in diabetic macular edema: a short-term pilot study. Eur J Ophthalmol 2014 ; 24 : 885-9.
[20] Othman IS, Eissa SA, Kotb MS, Sadek SH. Subthreshold diode-laser micropulse photocoagulation as a primary and secondary line of treatment in management of diabetic macular edema. Clin Ophthalmol 2014 ; 8 : 653-9.
[21] Marshall J CG, Rothery S. Some new findings on retinal irradiation by krypton and argon lasers. Doc Ophthalmol Proc Ser 1984 ; 36 : 21-7.
[22] Roider J, Michaud NA, Flotte TJ, Birngruber R. Response of the retinal pigment epithelium to selective photocoagulation. Arch Ophthalmol 1992 ; 110 : 1786-92.
[23] Pelosini L, Hamilton R, Mohamed M, et al. Retina rejuvenation therapy for diabetic macular edema : a pilot study. Retina 2013 ; 33 : 548-58.
[24] Hussain AA, Lee Y, Zhang JJ, Marshall J. Disturbed matrix metalloproteinase activity of Bruch’s membrane in age-related macular degeneration. Invest Ophthalmol Vis Sci 2011 ; 52 : 4459-66.
[25] Guymer RH, Brassington KH, Dimitrov P, et al. Nanosecond-laser application in intermediate AMD : 12-month results of fundus appearance and macular function. Clin Experiment Ophthalmol 2014 ; 42 : 466-79.
[26] Richter AM, Cerruti-Sola S, Sternberg ED, et al. Biodistribution of tritiated benzoporphyrin derivative (3H-BPD-MA), a new potent photosensitizer, in normal and tumor-bearing mice. J Photochem Photobiol B 1990 ; 5 : 231-44.
[27] Cardillo Piccolino F, Eandi CM, Ventre L, et al. Photodynamic therapy for chronic central serous chorioretinopathy. Retina 2003 ; 23 : 752-63.
[28] Zhao MW, Zhou P, Xiao HX, et al. Photodynamic therapy for acute central serous chorioretinopathy : the safe effective lowest dose of verteporfin. Retina 2009 ; 29 : 1155-61.
[29] Inoue R, Sawa M, Tsujikawa M, Gomi F. Association between the efficacy of photodynamic therapy and indocyanine green angiography findings for central serous chorioretinopathy. Am J Ophthalmol 2010 ; 149 : 441-6.
[30] Kim SW, Oh J, Oh IK, Huh K. Retinal pigment epithelial tear after half fluence PDT for serous pigment epithelial detachment in central serous chorioretinopathy. Ophthalmic Surg Lasers Imaging 2009 ; 40 : 300-3.
[31] Reibaldi M, Cardascia N, Longo A, et al. Standard-fluence versus low-fluence photodynamic therapy in chronic central serous chorioretinopathy : a nonrandomized clinical trial. Am J Ophthalmol 2010 ; 149 : 307-15.
[32] Photodynamic therapy of subfoveal choroidal neovascularization in age-related macular degeneration with verteporfin : one-year results of 2 randomized clinical trials--TAP report. Treatment of age-related macular degeneration with photodynamic therapy (TAP) Study Group. Arch Ophthalmol 1999 ; 117 : 1329-45.
[33] Bressler NM ; Treatment of Age-Related Macular Degeneration with Photodynamic Therapy (TAP) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization in age- related macular degeneration with verteporfin : two-year results of 2 randomized clinical trials-tap report 2. Arch Ophthalmol 2001 ; 119 : 198-207.
[34] Harding S. Photodynamic therapy in the treatment of subfoveal choroidal neovascularisation. Eye 2001 ; 15(Pt 3) : 407-12.
[35] Verteporfin In Photodynamic Therapy Study Group. Verteporfin therapy of subfoveal choroidal neovascularization in age-related macular degeneration : two-year results of a randomized clinical trial including lesions with occult with no classic choroidal neovascularization--verteporfin in photodynamic therapy report 2. Am J Ophthalmol 2001 ; 131 : 541-60.
[36] Kaiser PK. Verteporfin PDT for subfoveal occult CNV in AMD : two-year results of a randomized trial. Curr Med Res Opin 2009 ; 25 : 1853-60.
[37]
Y. Lemer
➤ Une traction du vitré sur la rétine centrale a pour conséquence une diminution de pression hydrostatique dans son épaisseur et la constitution d’un œdème intrarétinien par extravasation à partir des capillaires rétiniens.
➤ L’OM tractionnel est diagnostiqué par un aspect caractéristique en OCT.
➤ La vitrectomie est indiquée en cas d’OM tractionnel.
➤ L’effet de la vitrectomie sur l’OM, en l’absence de traction, est plus aléatoire. Il pourrait s’expliquer par l’amélioration de l’oxygénation de la rétine, la levée d’éventuelles barrières de diffusion ou le lavage peropératoire des cytokines favorisant la perméabilité vasculaire.
Le traitement chirurgical des OM est probablement l’un des sujets les plus controversés en pathologie rétinienne. Dans les années 1980 et au début des années 1990, les indications étaient d’ordre « mécaniste », ayant été prouvé que la suppression de tractions vitréennes sur la macula pouvait faire disparaître certains œdèmes ; elles se sont par la suite élargies à des cas plus disparates, le plus souvent sans décollement postérieur du vitré (mais pas toujours), avec ou sans membrane épirétinienne (MER) associée. Les mécanismes supposés d’action de la vitrectomie sur les OM restent discutés, comme ceux de la photocoagulation.
Une traction du vitré sur la rétine centrale a pour conséquence une diminution de pression hydrostatique interstitielle avec constitution d’un œdème intrarétinien par extravasation à partir des capillaires rétiniens (équation de Starling).
Dans cette équation Jv = Kf ([Pc − Pi]) − σ [πc − πi], Jv représente le flux entre les différents compartiments. Il est donc proportionnel à la différence entre les pressions hydrostatiques capillaires (Pc) et interstitielles (Pi), et à la différence entre les pressions oncotiques capillaires (πc) et interstitielles (πi). Kf et σ sont des coefficients de filtration et de réflexion qui peuvent eux-mêmes varier selon les tissus et les pathologies.
Sans traction, il faut une augmentation de la pression hydrostatique capillaire – comme dans l’hypertension artérielle (HTA) – pour voir apparaître un œdème. En cas de traction, la pression hydrostatique interstitielle diminue, favorisant l’œdème même si la pression capillaire reste constante. Que ce soit par traction ou par HTA, les lésions des capillaires rétiniens vont favoriser l’accumulation de liquide dans l’espace interstitiel en modifiant le coefficient de filtration Kf. Dans la configuration tractionnelle, il n’y a pas besoin de médiateurs chimiques pour expliquer cet œdème qui est complètement réversible en supprimant la traction responsable. Selon les causes, il peut y avoir, en outre, une augmentation de l’adhérence de la hyaloïde postérieure à la limitante interne ou une fragilité anormale de la paroi des capillaires rétiniens. Décrit initialement au début des années 1980 [1] pour expliquer les œdèmes compliquant les syndromes de tractions vitréomaculaires « idiopathiques », ce mécanisme a ensuite été évoqué, au moins partiellement, dans la constitution des œdèmes du pseudophaque dans la même décennie [2]. C’est au début des années 1990 que la même explication a été donnée dans certains OM chez le diabétique, associés à la visualisation clinique d’une hyaloïde postérieure tendue devant le pôle postérieur, attaché uniquement à la macula [3]. En l’absence d’examen par OCT, seule l’évaluation clinique aidée par l’angiographie fluorescéinique permettait le diagnostic en trouvant un aspect de l’œdème dit « en rayons de miel », évocateur de traction diffuse.
Les succès de la vitrectomie dans cette indication « tractionnelle » dans plusieurs étiologies [1–6] ont ensuite confirmé cette théorie.
En OCT, cet aspect tractionnel est caractéristique avec une hyaloïde postérieure attachée plus ou moins largement, mais seulement au sommet de l’œdème, exerçant une traction verticale de part et d’autre de la zone centrale d’attache sur les différentes coupes (fig. 6-30) [7]. Pour être certain de l’origine tractionnelle, il faut que l’orientation verticalisée de la hyaloïde postérieure soit bien visualisée, s’éloignant de la rétine de chaque côté de l’attache centrale sans « retomber » de part et d’autre du sommet. L’existence d’une membrane épirétinienne ne change rien à cette condition anatomique pour affirmer la traction. Dans toutes les autres configurations de la hyaloïde postérieure, on ne peut plus considérer la théorie mécanique tractionnelle comme seule cause de l’œdème.
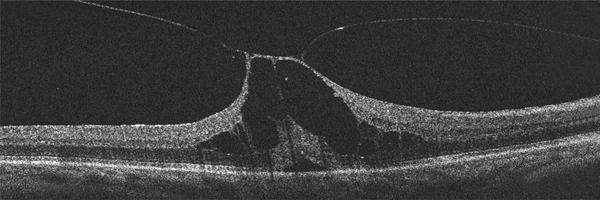
Fig. 6-30 Syndrome de traction vitréomaculaire.
La hyaloïde postérieure est attachée au sommet de l’œdème et se dirige vers le haut de part et d’autre de sa zone d’attache sur les différentes coupes.
Sont inclus dans cette définition des œdèmes maculaires de causes variées, avec ou sans décollement postérieur du vitré (DPV) en OCT. Ces cas regroupent donc aussi les situations sans DPV, dans lesquels la hyaloïde postérieure n’est pas clairement verticalisée par rapport à sa zone d’attache persistante centrale sur les différentes coupes (fig. 6-31).
La vitrectomie a pourtant été proposée également dans ce type d’œdèmes. Plusieurs théories pourraient expliquer son action, elles se fondent sur des études faites essentiellement sur les œdèmes liés à une vasculopathie, que ce soit dans la rétinopathie diabétique ou les occlusions veineuses.
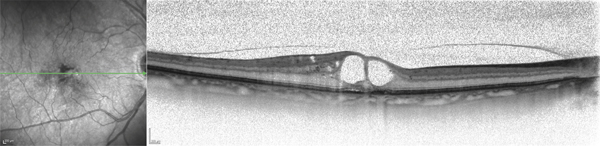
Fig. 6-31 Œdème maculaire cystoïde associé à un décollement partiel du vitré sans traction.
La hyaloïde postérieure partiellement décollée, non épaissie, retombe de part et d’autre du sommet de l’œdème : le mécanisme invoqué, dans la genèse de cet œdème, n’est pas tractionnel.
C’est Stefansson qui en 1981 [8] a démontré le premier, chez le chat, que la vitrectomie protégeait de l’ischémie induite par une occlusion veineuse expérimentale par comparaison avec des yeux non vitrectomisés. De là, sont nées les théories sur les modifications de transport de l’oxygène qui serait augmenté du segment antérieur vers le segment postérieur dans les yeux sans vitré [9]. L’oxygène étant une molécule très diffusible, on comprenait mal comment l’état du vitré, composé essentiellement d’eau, pouvait conditionner sa diffusion. Une deuxième publication [10] a montré qu’en fait, sur des yeux post mortem récents, le vitré consommait de l’oxygène de façon active, cette consommation disparaissant quelques heures après la mort. La vitrectomie améliorerait l’oxygénation rétinienne à partir de la partie antérieure de l’œil, non pas par amélioration de la diffusion au travers de la cavité vitréenne, mais par suppression de la consommation d’oxygène par le vitré.
D’autres études ont cependant montré une amélioration de la concentration postérieure d’oxygène après vitréolyse enzymatique reposant la question du mécanisme exact de ce phénomène avec une possible action de la vitréolyse sur les hyalocytes [11]. Ces résultats suggèrent que la vitrectomie, comme le DPV, pourrait améliorer l’oxygénation postérieure.
L’augmentation de la diffusion de l’oxygène pourrait d’ailleurs en partie expliquer la cataracte compliquant les vitrectomies et celle des myopes forts à vitré très liquéfié.
Cette hypothèse mécanistique reste toutefois très discutée car d’autres études montrent au contraire que la vitrectomie n’aurait aucun effet sur la diffusion prérétinienne de l’oxygène à partir de la partie antérieure de la cavité vitréenne. Une éventuelle amélioration du transport du gaz ne serait en fait expliqué que par le remplacement du vitré par un liquide favorisant les courants de convection et ainsi l’arrivée d’oxygène au niveau rétinien [12].
On sait que les facteurs comme le VEGF, l’interleukine 6 (IL-6), le platelet-derived growth factor (PDGF), les molécules d’adhésion comme l’intercellular adhesion molecule 1 (ICAM-1) et plus généralement tout produit provoquant une perméabilité vasculaire accrue, sont présents en concentrations anormalement élevées dans les rétinopathies vasoprolifératives et en cas d’œdème maculaire associé à la rétinopathie diabétique et aux occlusions veineuses [13–16]. Les taux seraient proportionnels à la sévérité de la rétinopathie et à l’épaisseur fovéolaire. La vitrectomie servirait à la fois à supprimer ces facteurs et à améliorer leur diffusion vers la chambre antérieure où ils pourraient être évacués avec l’humeur aqueuse. Ce phénomène expliquerait d’ailleurs le risque de néovascularisation irienne et de glaucome néovasculaire dans les yeux présentant une rétinopathie ischémique non traitée. Dans l’uvéite, s’associe probablement, outre cette diminution des facteurs inflammatoires, une décroissance de la production d’antigène ou du moins la disparition de leur réservoir vitréen, comme dans la maladie de Behçet.
Quelques études suggèrent également que le pelage de la limitante interne au cours de la vitrectomie serait indispensable pour obtenir un effet thérapeutique durable sur les OM. Il semble que cette limitante interne, composée surtout de laminine, de fibronectine et de fibres de collagène, soit anormalement épaissie dans les œdèmes maculaires. Elle constituerait une barrière aux échanges entre la rétine et le vitré, favorisant la rétention d’eau intrarétinienne [17]. Par ailleurs, peler la limitante interne serait également la seule solution pour retirer complètement la hyaloïde postérieure, parfois dissociée sous forme d’un vitréoschisis notamment chez le diabétique. Ce pelage permet d’éviter d’abandonner des fragments vitréens, chargés de facteurs de croissance au contact de la rétine.
Si la levée d’une action mécanique du vitré sur la rétine peut être invoquée pour expliquer l’efficacité de la chirurgie lors d’un syndrome de traction vitréomaculaire typique, les mécanismes d’action supposés de la vitrectomie dans les autres cas sans traction restent totalement hypothétiques.
L’amélioration de l’oxygénation de la rétine et la levée d’éventuelles barrières de diffusion pourraient être des mécanismes séduisants car définitifs ; le lavage peropératoire des cytokines favorisant la perméabilité vasculaire ne serait que transitoire mais permettrait d’améliorer l’homéostasie rétinienne rapidement, les autres mécanismes évoqués prenant le relais pour entretenir l’effet de la chirurgie.
[1] Baikoff G, Mouilleau D, Garnier B. Œdème maculaire idiopathique par traction vitréomaculaire. Traitement chirurgical. Bull Soc Ophtalmol Fr 1982 ; 12 : 1571-3.
[2] Fung WE. Vitrectomy for chronic aphakic cystoid macular edema. Results of a national, collaborative, prospective, randomized investigation. Ophthalmology 1985 ; 92 : 1102-11.
[3] Lewis H, Abrams GW, Blumenkranz MS, Campo RV. Vitrectomy for diabetic macular traction and edema associated with posterior hyaloidal traction. Ophthalmology 1992 ; 99 : 753-9.
[4] Van Effenterre G, Guyot Argenton CL, Guiberteau B, et al. Œdèmes maculaires induits par la contraction de la hyaloïde postérieure. J Fr Ophtalmol 1993 ; 16 : 602-10.
[5] Harbour W, Smiddy WE, Flynn HW Jr, Rubsamen PE. Vitrectomy for diabetic macular edema associated with posterior hyaloid thickening and contraction. Am J Ophthalmol 1996 ; 121 : 405-13.
[6] Kaiser PK, Riemann CD, Sears JE, Lewis H. Macular traction detachment and diabetic macular edema associated with posterior hyaloidal traction. Am J Ophthalmol 2001 ; 131 : 44-49.
[7] Massin P, Duguid G, Erginay A, et al. Optical coherence tomography for evaluating diabetic macular edema before and after vitrectomy. Am J Ophthalmol 2003 ; 135 : 169-77.
[8] Stefansson E, Landers MB 3rd, Wolbarsht ML. Increased retinal oxygen supply following pan-retinal photocoagulation and vitrectomy and lensectomy. Trans Am Ophthalmol Soc 1981 ; 79 : 307-34.
[9] Holekamp NM, Shui YB, Beebe DC. Vitrectomy surgery increases oxygen exposure to the lens : a possible mechanism for nuclear cataract formation. Am J Ophthalmol 2005 ; 139 : 302-10.
[10] Holekamp NM. The vitreous gel : more than meets the eye. Am J Ophthalmol 2010 ; 149 : 32-6.
[11] Giblin FJ, Quiram PA, Leverenz VR, et al. Enzyme-induced posterior vitreous detachment in the rat produces increased lens nuclear pO2 levels. Exp Eye Res 2009 ; 88 : 286-92.
[12] Petropoulos IK, Pournaras JA, Stangos AN. Pournaras CJ. Preretinal partial pressure of oxygen gradients before and after experimental pars plana vitrectomy. Retina 2013 ; 33 : 170-8.
[13] Poulaki V. Hypoxia in the pathogenesis of retinal disease. In : Joussen AM, Gardner TW, Kirchhof B, Ryan Retinal SJ. Eds. Vascular Disease. Berlin Heidelberg New York : Springer-Verlag ; 2007, p. 121-38.
[14] Funatsu H, Yamashita H, Ikeda T, et al. Vitreous levels of interleukin-6 and vascular endothelial growth factor are related to diabetic macular edema. Ophthalmology 2003 ; 110 : 1690-6.
[15] Funatsu H, Yamashita H, Nakamura S, et al. Vitreous levels of pigment epithelium-derived factor and vascular endothelial growth factor are related to diabetic macular edema. Ophthalmology 2006 ; 113 : 294-301.
[16] Noma H, Funatsu H, Mimura T, Hori S. Changes of vascular endothelial growth factor after vitrectomy for macular edema secondary to retinal vein occlusion. Eur J Ophthalmol 2008 ; 18 : 1017-9.
[17] Matsunaga N, Ozeki H, Hirabayashi Y, et al. Histopathologic evaluation of the internal limiting membrane surgically excised from eyes with diabetic maculopathy. Retina 2005 ; 25 : 311-6.
S. Bonnin, M. Weber
➤ La photocoagulation au laser garde probablement un intérêt dans le traitement de l’œdème, et ce à la faveur de l’avènement de nouveaux dispositifs à durée de pulse raccourci et de lasers couplés à une imagerie, permettant d’améliorer sécurité et efficacité.
➤ La part mécanique des OM nécessite une prise en charge spécifique, qu’elle soit réalisée par une chirurgie ou par une vitréolyse enzymatique.
➤ De nouvelles approches anti-VEGF (anticorps anti-VEGF à durée d’action prolongée inhibiteurs de tyrosine kinase, collyre anti-VEGF notamment) devraient prochainement venir compléter la pharmacopée dédiée au traitement de l’OM.
➤ Les produits ciblant l’inhibition d’autres facteurs de croissance : anti-PDGF, anti-intégrines, squalamine, activation Tie2, etc. constitueront certainement les prochaines grandes lignes thérapeutiques de l’OM.
➤ On assiste également à l’arrivée de nouvelles modalités thérapeutiques pour les OM uvéitiques : anti-TNF-α, sirolimus en IVT, inhibiteurs du complément, inhibiteur CD28, antagonistes du récepteur IL-6.
➤ Les nouveaux dispositifs intravitréens à libération prolongée, la thérapie génique et la thérapie cellulaire élargiront dans l’avenir nos possibilités thérapeutiques.
➤ Les stratégies s’orientent vers un traitement plus précoce des maladies génératrices d’OM afin d’en limiter l’apparition.
Au cours de la dernière décennie, la mise en évidence de l’efficacité des anti-VEGF et des corticoïdes par voie intravitréenne a révolutionné la prise en charge de l’OM et permis d’établir de nouveaux arbres décisionnels de prise en charge. Pourtant, il ne s’agit que d’un début et les recherches actuelles proposeront demain de nouvelles molécules, de nouveaux modes de délivrance.
Les fondamentaux persistent et ne doivent pas être oubliés : il est ainsi indispensable d’équilibrer au mieux un diabète et une hypertension artérielle dans la prise en charge de l’OMD ; par ailleurs, une composante microvasculaire bien individualisée, à distance du centre, responsable d’un œdème maculaire focal devra être traitée par laser focal ; enfin, une maladie systémique, compliquée d’une atteinte rétinienne avec OM, nécessitera une prise en charge générale de la maladie causale.
Comment envisagerons-nous demain le traitement de l’OM ?
Des thérapeutiques puissantes existent déjà et doivent être utilisées au mieux.
Depuis la publication de l’ETDRS en 1985, les indications de laser focal dans l’OMD ont évolué et se sont associées aux thérapeutiques intravitréennes : l’indication de laser focal est maintenant limitée aux patients présentant une composante focale lorsque les anomalies microvasculaires responsables de cette exsudation se situent à distance du centre de la macula. Si cette indication est limitée, elle ne doit pas être oubliée et il convient de la rechercher à tout moment. Même si les injections intravitréennes d’anti-VEGF seules sont parfois efficaces, elles doivent être répétées tant que la cause n’est pas traitée. Un traitement associé adapté de la composante focale peut permettre d’améliorer la prise en charge de l’œdème maculaire. Une étude récente du Diabetic Retinopathy Clinical Research Network montrait que l’association des anti-VEGF au laser avait permis de réduire le nombre des injections par rapport aux anti-VEGF seuls [1–3].
De la même façon, au décours des occlusions veineuses, les mécanismes de reperfusion sont à l’origine d’anomalies microvasculaires voire de macro-anévrismes qu’il convient de traiter par laser pour assécher plus rapidement et efficacement l’OM [4].
La crainte d’une atteinte de la fovéa lors du traitement ciblé des micro-anévrismes sera peut-être réduite par l’avènement de nouveaux lasers, comme le laser Navilas® semi-automatique, guidé par l’imagerie ou le laser micropulsé. La place des angiographies à large champ pour détecter des zones d’ischémie reste à définir : il semble que l’identification et le traitement de zones d’ischémie en extrême périphérie, en complément d’un traitement anti-angiogénique, ne permettent pas d’améliorations fonctionnelle et anatomique dans le traitement de l’OM associé à une rétinopathie diabétique proliférante (étude DAVE) [5]. Il reste à confirmer le rôle joué par des zones mal identifiées jusqu’alors par les angiographes classiques tant dans le diabète que dans les occlusions veineuses.
Enfin, des injections intravitréennes mensuelles d’anti-VEGF sont proposées pour traiter la rétinopathie ischémique lorsqu’elle est associée à un OM afin d’éviter la photocoagulation panrétinienne (voir chapitre 8, Protocole S). Le problème de traitements itératifs par anti-angiogéniques sans pouvoir arrêter le traitement ou du moins la surveillance de la rétinopathie diabétique (RD) va se poser. L’analyse médico-économique, et particulièrement des QALY (quality-adjusted life year), sera nécessaire pour faire le choix entre un traitement définitif, parfois délétère, et un traitement à administration régulière qu’on n’est pas certain de pouvoir arrêter.
Toujours controversée, la chirurgie dans l’OM garde une place en cas de composante tractionnelle [6] et parfois en dernière intention en cas d’échec des autres traitements. Toutefois, de récentes publications ne semblent pas mettre en avant cette option comme traitement du futur de l’OM. En revanche, la vitréolyse enzymatique, par microplasmine ou d’autres agents, pourrait ouvrir de nouveaux champs thérapeutiques.
Le VEGF est un facteur puissant de vasoperméabilité, et de multiples études ont montré son taux élevé en cas d’OM. Plusieurs molécules anti-VEGF ont été développées et sont actuellement utilisées en première intention de façon courante (ranibizumab, bévacizumab, aflibercept) [7].
Cependant, certains patients ne répondent pas de façon optimale à ces traitements : la résolution du fluide est parfois incomplète et/ou transitoire, s’accompagnant de l’absence d’amélioration visuelle. De plus, même en présence d’une réponse anatomique complète, on peut observer des lésions neuronales comme la perte des cellules ganglionnaires [8], irréversibles et responsables de la perte d’acuité visuelle. L’OM s’accompagne aussi d’ischémie maculaire et/ou d’exsudats qui altèrent la récupération visuelle. Le challenge pour l’ophtalmologiste sera de sélectionner au mieux le traitement, le moment optimal pour traiter son patient, la finalité étant que le patient ait la meilleure acuité visuelle finale possible.
Les études publiées montrent un gain maximal d’acuité visuelle quand les injections sont répétées de façon systématique et mensuelle que ce soit dans l’OMD [9] ou en cas de DMLA [10], mais aussi quand les patients ont une bonne acuité visuelle initiale (supérieure à 5/10) [11]. Ces études interrogent donc sur la nécessité de traiter plus précocement, avant que l’œdème n’entraîne des lésions neuronales et gliales irréversibles. La durée de l’œdème influence évidemment la récupération de l’acuité visuelle et cela aussi bien dans l’OMD [9], la DMLA [10] que dans les œdèmes maculaires sur occlusions veineuses rétiniennes [12, 13]. Cela est d’autant plus vrai que les altérations rétiniennes semblent survenir avant l’œdème, notamment en cas de rétinopathie diabétique [14, 15].
La recherche de facteurs prédictifs de bonne réponse aux traitements oriente vers une meilleure compréhension des patients « bons ou mauvais » répondeurs : ainsi l’épaisseur de la rétine interne a été montrée comme un bon facteur pronostique [16]. Ces facteurs de bon pronostic pourraient encourager à traiter de façon plus systématique, avant que la rétine ne soit encore endommagée.
En cas d’absence de réponse à une première ligne de traitement bien conduite, une deuxième molécule doit être proposée. Ainsi, les patients non répondeurs à un premier anti-VEGF ou à un corticoïde intravitréen pourront être traités par un autre anti-VEGF ou par un traitement corticoïde. L’OM étant souvent lié à un taux élevé de VEGF mais aussi de cytokines inflammatoires, des lignes thérapeutiques combinant stéroïdes et anti-VEGF pourraient être proposées. Si aucun traitement pharmacologique disponible n’est efficace, il faudrait sans aucun doute ne pas retarder un autre traitement chirurgical ou physique.
S’il est facile d’envisager théoriquement de traiter les patients plus tôt et/ou plus souvent, la pratique rend la mise en œuvre de telles considérations parfois utopique. Améliorer le traitement de l’OM consiste aussi à réduire le temps passé en consultation pour le patient sans altérer la qualité des soins. Rappelons qu’un patient présentant un OMD, présente aussi très souvent une néphropathie, des facteurs de risque cardiovasculaires. Il est donc souvent suivi en parallèle par un néphrologue, un cardiologue, un nutritionniste et, bien sûr, un diabétologue. Les patients âgés ont parfois des difficultés à se déplacer. De même un patient uvéitique est parfois pris en charge par un médecin interniste. Il est donc souhaitable de rapprocher au mieux la consultation de contrôle et l’injection intravitréenne : les patients sont examinés par l’ophtalmologiste (acuité visuelle, OCT) et l’injection intravitréenne est réalisée au besoin juste après. De la même façon, on pourrait imaginer des formes de consultations multidisciplinaires associant nutritionniste et/ou infirmière spécialisée le jour de l’injection intravitréenne afin d’optimiser l’équilibre glycémique. De même, l’amélioration du parcours de soins des patients uvéitiques pourrait optimiser leur temps passé à l’hôpital en combinant suivi ophtalmologiste et interniste afin d’assurer le suivi des traitements généraux.
Les injections intravitréennes restent à ce jour le traitement de référence de l’OM mais ne doivent pas faire oublier les fondamentaux tels que l’équilibre des facteurs de risque, le laser en cas de composante microvasculaire focale accessible, ou la vitrectomie en cas de composante tractionnelle, les traitements anti-inflammatoires, immunosuppresseurs et/ou immunomodulateurs systémiques en cas d’uvéite. Les études nous encouragent à traiter l’OM plus tôt et sans doute, bientôt, de façon plus ou moins préventive, avant que des dommages irréversibles de la rétine ne surviennent, et cela de façon plus systématique.
De multiples molécules sont actuellement étudiées afin d’enrichir l’arsenal thérapeutique de l’OM. Dans la continuité des traitements actuels, d’autres molécules anti-VEGF ou ayant pour cibles d’autres facteurs de croissance, d’autres stéroïdes, d’autres biothérapies ciblant différentes cytokines, des stratégies de tolérance immunitaire sont étudiées. Les recherches visent aussi à améliorer la durée d’action des molécules. Outre des dispositifs de relargage prolongé, de nouvelles formulations et des stratégies par thérapie génique font entrevoir des avancées spectaculaires dans le traitement de nombreuses maladies rétiniennes compliquées d’OM.
Conformément au succès des anti-VEGF déjà utilisés de façon courante, d’autres molécules inhibant le VEGF et réduisant ainsi la perméabilité vasculaire sont en cours de développement. Les études pilotes sont souvent réalisées chez des patients présentant une DMLA mais les résultats bénéfiques profiteront de la même façon aux patients traités pour un OM sur occlusion veineuse rétinienne ou un OMD. Nous ne parlerons pas du conbercept qui est une molécule très proche d’aflibercept, leurre des récepteurs aux VEGF, développé par une compagnie chinoise et évaluée au travers de deux études : Aurore et Phoenix.
Le RTH258, aussi connu sous le nom de ESBA 1008 ou de brolucizumab, est un agent anti-VEGF de longue durée d’action. Cet anticorps, se liant avec une forte affinité à toutes les isoformes du VEGF-A, a un poids moléculaire plus petit que les molécules anti-VEGF actuellement disponibles. Cette particularité lui donne une meilleure pénétration dans les tissus d’où une meilleure concentration dans la rétine, avec une moindre exposition systémique. Une étude pilote a montré une meilleure et plus longue efficacité du RTH258 par rapport au ranibizumab chez des patients présentant une DMLA. Une étude de phase 3 est en cours visant à comparer ce traitement à l’aflibercept.
Les DARPins (designed ankyrin repeat proteins) sont des protéines développées à partir de protéines ankyrin naturelles, ayant une forte spécificité et une forte affinité pour leur cible protéique. MP0112, le premier candidat thérapeutique des DARPins, est un inhibiteur du VEGF. Les nouvelles protéines DARPins anti-VEGF (intravitréennes et topiques) ont montré, sur des modèles animaux, une bonne efficacité par rapport aux molécules anti-VEGF couramment utilisées. La demi-vie des DARPins est plus longue, prolongeant la suppression du VEGF avec probablement moins d’injections nécessaires. Une étude de phase 2 a montré que ce médicament fournit l’équivalent ou un meilleur gain de vision avec moins d’injections que les anti-VEGF classiques dans l’OMD [17] et dans la DMLA [18]. En termes d’effets indésirables oculaires, la molécule semble bien tolérée, avec néanmoins quelques cas rapportés d’inflammation oculaire. Deux études de phase 3 randomisées, en double insu, comparant les DARPins au ranibizumab dans le traitement de néovaisseaux choroïdiens secondaires à une DMLA (REACH Study et CEDAR Study) ont montré des résultats préliminaires encourageants. Une étude de phase 2 est en cours dans le diabète et une étude de phase 3 consacrée à l’OMD devrait démarrer fin 2016.
Inhibiteur de tyrosine kinase :
l’X82, inhibiteur des tyrosines kinases du VEGF et PDGF, administré par voie orale, a fait l’objet d’une étude de phase 1 avec escalade de doses chez des patients réfractaires aux IVT d’anti-VEGF. Compte tenu de résultats intéressants, une étude de phase 2 va démarrer ;
le régofarénib (Bayer), autre inhibiteur de tyrosine kinase anti-VEGF et anti-PDGF, administré lui par collyre est en cours d’évaluation dans une étude de phase 2 ;
le DE-120 (Santen) évalue également un inhibiteur double de tyrosine kinase anti-VEGF et anti-PDGF dans une étude de phase 1.
Un collyre anti-VEGF, LHA510 (Novartis), est en cours d’évaluation dans une étude de phase 1. Ce collyre, administré après un traitement d’induction par IVT de ranibizumab, vise à réduire le nombre d’IVT nécessaires au cours de la phase d’entretien.
Le long acting anti-VEGF anticorps (LAVA) est une fusion d’un fragment Fab anti-VEGF à un peptide de liaison hyaluronane augmentant la demi-vie de l’anti-VEGF dans la cavité vitréenne. Une étude LMG324 dans la DMLA humide a démarré pour confirmer la preuve de concept.
Un nouvel anti-VEGF à durée d’action prolongée LMG-324 (Novartis) fait l’objet d’un essai de phase 1 dans la DMLA humide.
Le PDGF régule le fonctionnement des péricytes en augmentant leur couverture à la surface du néovaisseau [19]. Les péricytes sécrètent du VEGF et d’autres facteurs, et protègent le néovaisseau en induisant une « résistance » aux anti-VEGF. En présence d’un anti-PDGF, les néovaisseaux deviennent plus sensibles aux anti-VEGF. Plusieurs produits anti-PDGF sont actuellement développés et notamment le Pegpleranib – Fovista® (E10030) développé par les laboratoires Ophtotech. Il s’agit d’un aptamer pégylé permettant le décollement des péricytes du néovaisseau et, en combinaison avec l’anti-VEGF, une régression des néovaisseaux choroïdiens. L’inhibition simultanée du PDGF et du VEGF dans les études de phase 2 sur la DMLA humide a permis à la fois d’améliorer l’acuité visuelle par rapport aux anti-VEGF seuls, mais également de diminuer efficacement la taille des lésions néovasculaires et de réduire les cicatrices et la fibrose liées à la lésion néovasculaire. Une triple étude de phase 3 associant le pegpleranib au ranibizumab versus monothérapie par ranibizumab (études OPH1002 et OPH1003) est sur le point de livrer ses données en termes d’efficacité et de tolérance et devrait conduire en cas de succès à une demande d’autorisation de mise sur le marché.
Un anti-PDGF développé par Regeneron associé à l’aflibercept dans une même seringue de 50 mL (REGN 2176-3) est en cours d’évaluation dans une étude de phase 2.
Les anti-intégrines constituent une classe de protéines qui servent de récepteurs à la surface cellulaire, à la matrice extracellulaire et aux immunoglobulines. Elles interagissent avec les récepteurs des facteurs de croissance et régulent leurs fonctions, jouant un rôle clé dans la signalisation cellulaire et la régulation de l’adhérence et de la migration cellulaires. La leucostase, augmentée dans la rétinopathie diabétique, dépend d’intégrines spécifiques contenant la chaîne β2. L’ALG 1001 est un antagoniste des intégrines qui a été évalué chez des patients présentant une DMLA exsudative et un OMD. Dans l’étude de phase 1 de patients présentant un OMD, une amélioration significative de l’acuité visuelle et une diminution de l’épaisseur maculaire ont été retrouvées après trois injections intravitréennes mensuelles d’ALG 1001 (2 mg). Tout en ciblant les récepteurs des intégrines impliqués dans la signalisation cellulaire, cette molécule semble induire un détachement postérieur du vitré et une vitréolyse. L’étude de phase 2 avec Luminate® (ALG 1001) chez des patients présentant un OMD compare l’ALG 1001 et le bévacizumab associé au laser focal [20]. Dans l’étude de phase 1/2 sur la DMLA humide, la dose de 3,2 mg injecté en intravitréen à trois reprises a permis une amélioration de l’acuité visuelle de 8 lettres en moyenne, 2 mois après ces IVT.
La squalamine est une petite molécule anti-angiogénique inhibant de multiples facteurs de croissance : le VEGF, le PDGF et le basic fibroblast growth factor (bFGF). Des études précliniques ont montré une bonne tolérance des gouttes de squalamine. Une étude de phase 2 randomisée multicentrique contre placebo évalue actuellement l’effet des gouttes de squalamine chez des patients présentant un OMD. Dans une autre étude de phase 2, l’association du ranibizumab à la squalamine en collyre 2 fois/jour permettait de doubler le nombre de patients présentant un gain de plus de 3 lignes d’acuité visuelle par rapport à un traitement simple par ranibizumab dans la DMLA [21]. Compte tenu des bons résultats de cette phase 2 dans la DMLA humide, une phase 3 est prévue.
L’activation de Tie2 est une autre piste pour réduire l’OMD. Tie2 est un récepteur tyrosine kinase, spécifique des cellules endothéliales dont il contribue à assurer la stabilité. Il est inhibé par l’angiopoïétine 2, libérée en cas d’hypoxie rétinienne. Le vascular endothelial-protein tyrosine phosphatase (VE-PTP) est un régulateur négatif de Tie2 ; AKB-9778 inhibe VE-PTP qui permet d’activer Tie2. Une étude de phase 1/2 d’activation de Tie2 par des injections sous-cutanées d’AKB-9778 a été réalisée avec des résultats intéressants, justifiant ainsi la poursuite des investigations.
L’érythropoïétine (Novartis) fait l’objet d’études de phase 1/2 dans l’OMD en monothérapie ou en combinaison d’un traitement par ranibizumab.
Les anti-TNF-α sont des molécules qui viennent inhiber le TNF-α qui est l’un des médiateurs les plus importants de la réponse inflammatoire et de la leucostase rétinienne, participant à la rupture de la barrière hémato-rétinienne. L’infliximab (anti-TNF-α) est toxique par voie intravitréenne mais des injections intraveineuses permettent de diminuer l’épaisseur maculaire et d’améliorer la vision [20]. Des études cliniques plus larges pourraient confirmer l’efficacité des anti-TNF systémiques dans le traitement de l’OMD. Les anti-TNF sont également évalués dans la DMLA humide. L’adalilumab en injection sous-cutanée a été évalué dans les études de phase 3 VISUAL, portant sur les uvéites intermédiaires et postérieures non infectieuses. Ces études ont démontré une efficacité statistiquement significative en termes de réduction de l’inflammation du vitré dans les uvéites actives, malgré un traitement corticoïde ± immunosupresseur systémique, et de délai de récidive de la hyalite pour les uvéites non actives.
Le sirolimus (ou rapamycine) est un agent immunosuppresseur et antiprolifératif qui inhibe le VEGF et des gènes associés à l’inflammation (IL-8, cyclo-oxygénase 1 et 2). Une étude de phase 1 examinant une injection sous-conjonctivale ou intravitréenne de sirolimus, chez des patients présentant un OMD, a montré une amélioration modérée de la vision et de l’épaisseur maculaire [22]. Cette molécule a démontré en injection intravitréenne, dans l’étude de phase 3 SAKURA, son intérêt dans la réduction de l’inflammation du vitré au cours des uvéites intermédiaires ou postérieures non infectieuses. Une demande d’autorisation de mise sur le marché a été déposée auprès de l’Agence européenne du médicament.
Des inhibiteurs C3 ou C5 de la cascade du complément sont également évalués : le LFG316 (Novartis), un anticorps antifacteur C5 du complément, a été évalué dans une étude de phase 2 en IVT dans la DMLA humide (résultats non connus à ce jour) et dans une autre étude sur des uvéites intermédiaires ou postérieures non infectieuses.
D’autres molécules ou stratégies sont en phase 2 d’évaluation dans les uvéites postérieures non infectieuses : un inhibiteur du CD28 (abatacept), des antagonistes du récepteur IL-6 (tocilizumab, sarilumab), une stratégie de tolérance (lymphocytes T régulateurs en IVT ou en sous-cutané, peptide B27PD par voie orale).
Les progéniteurs des cellules endothéliales (endothelial progenitor cell [EPC]) sont des cellules circulantes qui jouent un rôle dans la promotion de la réparation des vaisseaux sanguins et dans la reperfusion des zones ischémiques. Ces cellules ont pour origine les cellules souches hématopoïétiques de la moelle osseuse et des cellules souches vasculaires, spécialisées dans les parois vasculaires ou à l’intérieur de l’endothélium.
Des résultats variables utilisant les EPC ont été rapportés dans des études cliniques et précliniques [23]. De nombreux défis restent à résoudre avant l’application clinique. La sélection de cellules souches bien définies et efficaces, la dose correcte (le nombre de cellules), la voie d’administration ainsi que le moment du traitement doivent être déterminés pour un effet optimal de ce traitement potentiel. Il faudra sans doute aussi imaginer, pour être efficace, des thérapies cellulaires de plusieurs couches cellulaires (par exemple : photorécepteurs + épithélium pigmentaire de la rétine).
Une autre stratégie potentielle pour améliorer la délivrance des anti-VEGF est l’injection de virus recombinants. La transfection d’un tel virus modifié permet la synthèse par le noyau de la cellule d’une protéine ayant une action pharmacologique, en l’occurrence ici, une inhibition du VEGF. Cette thérapie génique a l’avantage théorique de permettre une expression prolongée pour ne pas dire définitive de la protéine d’intérêt, ce qui permet immédiatement de comprendre sa supériorité par rapport aux multiples IVT du traitement actuel. Un virus particulièrement adapté à cette stratégie est l’adeno-associated virus (AAV). Il fait l’objet des premiers essais cliniques de phase 1 par les laboratoires Genzyme/Sanofi et Avalanche (études AVA-101 et AVA-102). Le gène apporté par l’AAV code pour sFLT01, un inhibiteur puissant des tyrosines kinases, qui inhibe la cascade du VEGF [24]. Des injections intravitréennes de ce virus, réalisées dans des modèles animaux, résultent en l’expression du gène dans l’humeur aqueuse et la diminution des lésions néovasculaires (sur un modèle de néovascularisation choroïdienne). Une autre approche consiste à injecter le virus sous la rétine, permettant une meilleure transfection. Les études chez l’animal ont montré que la transfection virale était efficace jusqu’à 1 an et demi après l’injection, avec une bonne tolérance. Dans une étude chez quelques patients, la transfection virale a permis d’observer une diminution de l’épaisseur maculaire par rapport aux anti-VEGF classiques avec un faible recours à des IVT d’anti-VEGF complémentaires, et ce pendant plus de 1 an. Une étude de phase 2 devrait commencer prochainement. Le laboratoire Oxford Biomedica a également réalisé une étude de phase 1 dans la DMLA humide avec un vecteur lentiviral injecté en sous-rétinien RetinoStat® montrant l’absence d’effet indésirable, une diminution de la fuite du néovaisseau choroïdien et une stabilisation de l’acuité visuelle sur 1 an. Ces données préliminaires sont intéressantes mais doivent être confirmées par des études de phase 2b pour préciser l’efficacité, la tolérance et la voie d’administration la plus adaptée (intravitréenne ou sous-rétinienne).
Les injections mensuelles sont une charge pour le patient et alourdissent les consultations au quotidien. Tout système permettant d’allonger le temps de délivrance des molécules est donc intéressant. Différents implants délivrant des anti-VEGF ont été étudiés :
un implant rechargeable non biodégradable, délivrant des anti-VEGF (port delivery system [PDS]) a été étudié chez 20 patients traités pour une DMLA (lors d’un essai de phase 1). L’implant est placé sous la conjonctive au niveau de la pars plana grâce à une incision sclérale de 3,2 mm sans suture. Il est ensuite rempli au besoin grâce à une procédure peu invasive. Les résultats d’une étude de phase 1 ont montré une bonne tolérance et une amélioration d’environ 10 lettres de l’acuité visuelle maintenue à 1 an. Une étude de phase 2 ayant prévu d’inclure 220 patients est planifiée ;
de nouveaux systèmes de délivrance de corticoïdes (en dehors de l’Ozurdex®, du Retisert® et de l’Iluvien®) sont en cours de développement et notamment un nouvel insert intravitréen délivrant de l’acétonide de fluocinolone, avec une étude de phase 3 en cours dans les uvéites postérieures non infectieuses (pSivida) ;
un dispositif de cellules encapsulées pouvant synthétiser des protéines thérapeutiques sur une période de 2 ans, implanté chirurgicalement à travers une incision sclérale de 3 mm est également en développement. Les cellules encapsulées pourront synthétiser au choix différentes protéines : anticorps anti-VEGF, autres anticorps, DARPins, cytokines, facteurs de croissance, Tie2. Une étude de phase 1/2 a déjà démarré dans la DMLA humide avec des cellules sécrétant des anticorps anti-VEGF et anti-PDGF.
Le traitement de l’OM repose aujourd’hui sur des injections répétées intravitréennes d’anti-VEGF et/ou de corticoïdes. Des nouvelles molécules viendront, dans les prochaines années, compléter l’arsenal thérapeutique et permettront soit d’améliorer la réponse anatomique et fonctionnelle, soit de diminuer la lourdeur du suivi et du traitement. Simultanément, la mise au point de techniques, permettant une libération prolongée de produits actifs, améliorera la qualité de prise en charge des OM ainsi que la qualité de vie des patients. L’enjeu reste la mise en évidence de facteurs prédictifs fiables de réponse aux traitements afin d’optimiser les schémas thérapeutiques. Dans le futur, un traitement idéal, individualisé, fondé sur le profil génétique ou des tests pharmacogénétiques, améliorera probablement l’efficacité des traitements avec une potentielle réduction de la charge thérapeutique pour le patient ou, encore mieux, limitera la prévalence de cette complication œdémateuse.
[1] Diabetic Retinopathy Clinical Research Network, Elman MJ, Aiello LP, et al. Randomized trial evaluating ranibizumab plus prompt or deferred laser or triamcinolone plus prompt laser for diabetic macular edema. Ophthalmology 2010 ; 117 : 1064-77.e35.
[2] Shin JY, Byeon SH, Kwon OW. Optical coherence tomography-guided selective focal laser photocoagulation : a novel laser protocol for diabetic macular edema. Graefes Arch Clin Exp Ophthalmol 2015 ; 253 : 527-35.
[3] Lee SN, Chhablani J, Chan CK, et al. Characterization of microaneurysm closure after focal laser photocoagulation in diabetic macular edema. Am J Ophthalmol 2013 ; 155 : 905-12.
[4] Bourhis A, Girmens JF, Boni S, et al. Imaging of macroanevrysms occuring during retinal vein occlusion and diabetic retinopathy by indocyanine green angiography and high resolution optical coherence tomography. Graefes Arch Clin Exp Ophthalmol 2010 ; 248 : 161-6.
[5] Brown DM. Étude DAVE. Communication orale, American Academy of Ophthalmology 2015.
[6] Diabetic Retinopathy Clinical Research Network Writing Committee, Haller JA, Qin H, et al. Vitrectomy outcomes in eyes with diabetic macular edema and vitreomacular traction. Ophthalmology 2010 ; 117 : 1087-93.e3.
[7] Jampol LM, Bressler NM, Glassman AR. Revolution to a new standard treatment of diabetic macular edema. JAMA 2014 ; 311 : 2269-70.
[8] Bonnin S, Tadayoni R, Erginay A, et al. Correlation between ganglion cell layer thinning and poor visual function after resolution of diabetic macular edema. Invest Ophthalmol Vis Sci 2015 ; 56 : 978-82.
[9] Boyer DS, Nguyen QD, Brown DM, et al. ; RISE Research Group. Outcomes with as-needed ranibizumab after initial monthly therapy: long-term outcomes of the phase III RIDE and RISE trials. Ophthalmology 2015 ; 122 : 2504-13.
[10] Singer MA, Awh CC, Sadda S, et al. HORIZON : an open-label extension trial of ranibizumab for choroidal neovascularization secondary to age-related macular degeneration. Ophthalmology 2012 ; 119 : 1175-83.
[11] Diabetic Retinopathy Clinical Research Network, Wells JA, Glassman AR, et al. Aflibercept, bevacizumab, or ranibizumab for diabetic macular edema. N Engl J Med 2015 ; 372 : 1193-203.
[12] Haller JA, Bandello F, Belfort R, et al. Dexamethasone intravitreal implant in patients with macular edema related to branch or central retinal vein occlusion twelve-month study results. Ophthalmology 2011 ; 118 : 2453-60.
[13] Heier JS, Campochiaro PA, Yau L, et al. Ranibizumab for macular edema due to retinal vein occlusions : long-term follow-up in the HORIZON trial. Ophthalmology 2012 ; 119 : 802-9.
[14] van Dijk HW, Verbraak FD, Kok PHB, et al. Early neurodegeneration in the retina of type 2 diabetic patients. Invest Ophthalmol Vis Sci 2012 ; 53 : 2715-9.
[15] Simó R, Hernández C, European Consortium for the Early Treatment of Diabetic Retinopathy (EUROCONDOR). Neurodegeneration is an early event in diabetic retinopathy : therapeutic implications. Br J Ophthalmol 2012 ; 96 : 1285-90.
[16] Pelosini L, Hull CC, Boyce JF, et al. Optical coherence tomography may be used to predict visual acuity in patients with macular edema. Invest Ophthalmol Vis Sci 2011 ; 52 : 2741-8.
[17] Campochiaro PA, Channa R, Berger BB, et al. Treatment of diabetic macular edema with a designed ankyrin repeat protein that binds vascular endothelial growth factor : a phase I/II study. Am J Ophthalmol 2013 ; 155 : 697-704.e1-e2.
[18] Souied EH, Devin F, Mauget-Faÿsse M, et al. Treatment of exudative age-related macular degeneration with a designed ankyrin repeat protein that binds vascular endothelial growth factor : a phase I/II study. Am J Ophthalmol 2014 ; 158 : 724-32.e2.
[19] Jain RK. Normalization of tumor vasculature : an emerging concept in antiangiogenic therapy. Science 2005 ; 307 : 58-62.
[20] Sfikakis PP, Grigoropoulos V, Emfietzoglou I, et al. Infliximab for diabetic macular edema refractory to laser photocoagulation : a randomized, double-blind, placebo-controlled, crossover, 32-week study. Diabetes Care 2010 ; 33 : 1523-8.
[21] Slakter JS, Ciulla TA, Elman MJ, et al. Final results from a phase 2 study of squalamine lactate ophthalmic solution 0.2 % (OHR-102) in the Treatment of neovascular age-related macular degeneration (AMD). Invest Ophthalmol Vis Sci 2015 ; 56 : 4805.
[22] Dugel PU, Blumenkranz MS, Haller JA, et al. A randomized, dose-escalation study of subconjunctival and intravitreal injections of sirolimus in patients with diabetic macular edema. Ophthalmology 2012 ; 119 : 124-31.
[23] Lois N, McCarter RV, O’Neill C, et al. Endothelial progenitor cells in diabetic retinopathy. Front Endocrinol 2014 ; 5 : 44.
[24] Pechan P, Rubin H, Lukason M, et al. Novel anti-VEGF chimeric molecules delivered by AAV vectors for inhibition of retinal neovascularization. Gene Ther 2009 ; 16 : 10-6.