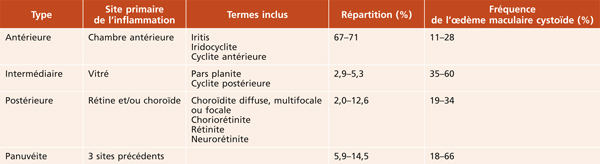
Œdème maculaire inflammatoire
Coordonné par M. Weber
D. Monnet
➤ L’uvéite a une incidence annuelle comprise entre 17 et 52 nouveaux cas pour 100 000, et une prévalence estimée entre 58 et 115/100 000 selon les études.
➤ L’âge moyen des patients ayant une uvéite est de 46 ± 21 ans.
➤ L’uvéite représente en moyenne près de 10 % des causes de cécité légale dans les pays développés.
➤ La principale cause de baisse visuelle au cours des uvéites est l’œdème maculaire (OM). Environ un tiers des patients atteints d’uvéite développent un OM, et 40 % des baisses visuelles au cours de l’uvéite sont dues à un OM.
➤ Les principaux facteurs de risque d’OM au cours d’une uvéite sont le caractère chronique de l’uvéite, l’importance de l’activité inflammatoire, le tabagisme, la présence d’une membrane épirétinienne et l’étiologie de l’uvéite.
➤ L’OM représente un facteur décisionnel majeur dans le choix et le traitement des uvéites.
Le terme d’uvéite est synonyme d’inflammation intra-oculaire, et correspond à une variété très hétérogène d’étiologies pouvant survenir tant chez l’adulte que chez l’enfant. L’uvéite comprend près d’une trentaine de maladies inflammatoires caractérisées par une inflammation intra-oculaire et reste une cause majeure de perte d’acuité visuelle notamment parmi une population en âge de travailler. L’uvéite a une incidence annuelle admise comprise entre 17 et 52 nouveaux cas pour 100 000, et une prévalence estimée entre 58 et 115/100 000 selon les études [1, 2]. L’âge moyen des patients qui développent une uvéite est de 46 ± 21,4 ans. L’uvéite représente en moyenne près de 10 % des causes de cécité légale dans les pays développés. Aux États-Unis, les uvéites sont responsables d’environ 30 000 nouveaux cas de cécité légale par an et de 2,8 à 10 % des cas de cécité légale. De même, l’uvéite représente de 10 à 15 % de l’ensemble des causes de cécité parmi une population en âge de travailler dans les pays développés [3]. Enfin, en pédiatrie, l’œdème maculaire (OM) inflammatoire représente la troisième cause de baisse de vision chez les enfants [4].
Les uvéites sont classées en fonction de leur localisation anatomique – antérieure, intermédiaire ou postérieure – et de leur durée d’évolution – aiguë si cette durée est inférieure à 3 mois et chronique au-delà (tableau 10-1) [5]. Tous les types d’uvéites sont susceptibles de se compliquer d’œdème maculaire cystoïde (OMC). L’OM est toutefois plus fréquent en cas d’uvéites postérieures ou intermédiaires, mais peut tout à fait compliquer une uvéite antérieure aiguë ou chronique, par propagation de l’inflammation au segment postérieur de l’œil.
Il n’existe pas de définition spécifique de l’OM inflammatoire ou compliquant les uvéites. La fréquence de l’OM dépend du moyen destiné à le mettre en évidence. L’OM peut être diagnostiqué cliniquement, notamment en cas d’épaississement maculaire franc. Toutefois, l’angiographie à la fluorescéine et/ou la tomographie par cohérence optique (optical coherence tomography [OCT]) permettent des diagnostics plus précoces comme pour les autres causes d’atteinte maculaire.
L’angiographie à la fluorescéine détecte des diffusions vasculaires, tandis que l’OCT met en évidence un épaississement anatomique. Toutefois, ces deux examens mesurent des désordres physiopathologiques différents. L’angiographie, dans le contexte inflammatoire, permet de détecter des signes d’uvéite postérieure, par l’existence de vascularites, de papillites, de foyers choriorétiniens. Leur comportement angiographique, lors de la séquence angiographique, est un élément important qui permet d’orienter vers différentes entités (fig. 10-1). L’OCT est sans conteste l’examen le plus sensible pour mettre en évidence un œdème maculaire (voir chapitre 5). Toutefois, dans les OM d’origine inflammatoire, l’épaisseur rétinienne semble mieux corrélée à l’acuité visuelle que les diffusions visibles à l’angiographie. De plus, l’OCT est un examen beaucoup moins invasif et il est de fait plus fréquemment utilisé pour documenter et suivre un OM au cours des uvéites.
Le mécanisme principal de l’OM inflammatoire est une rupture de la barrière hémato-rétinienne (BHR) interne par les cytokines inflammatoires, à l’origine d’une fuite de liquide dans l’espace extracellulaire ; ce liquide s’accumule principalement dans la couche plexiforme externe et dans la couche nucléaire interne autour de la fovéa. La persistance d’un OM peut par ailleurs conduire à : une destruction définitive du réseau neuronal, une gliose ou une atrophie maculaire appréciée au mieux par l’examen en OCT [6].
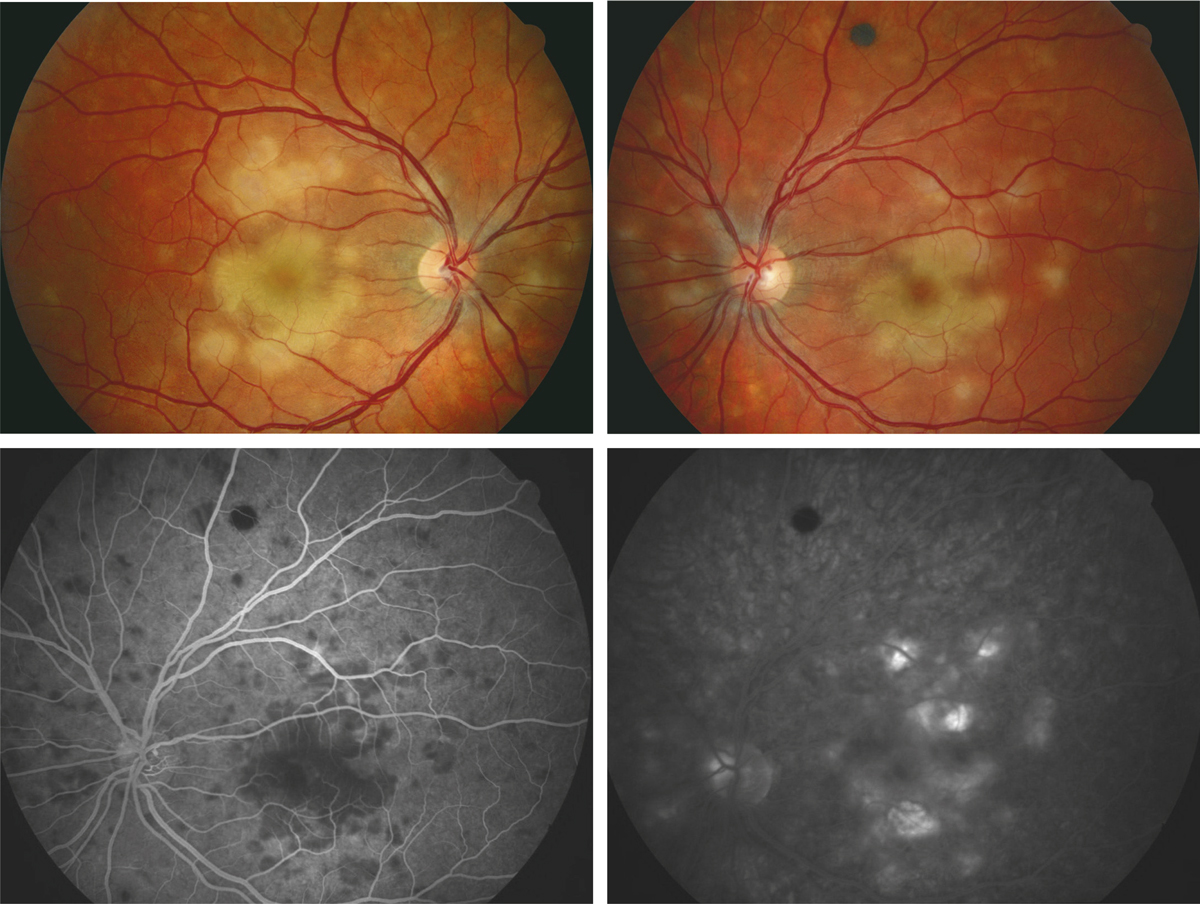
Fig. 10-1 Épithéliopathie en plaques.
Atteinte maculaire au cours d’une épithéliopathie en plaques. Noter l’atteinte bilatérale, le caractère typique angiographique avec hypofluorescence des lésions au temps précoce et hyperfluorescence au temps tardif.
Une perte sévère d’acuité visuelle est notée dans 10 à 25 % des yeux en fin de suivi pour uvéite, toutes étiologies confondues, la principale cause de baisse d’acuité visuelle définitive étant la présence d’un OMC [7]. Une large revue de la littérature indique que 31 % des patients ayant une uvéite développent un OMC, et que 40 % des baisses d’acuité visuelle au cours des uvéites unilatérales sont liées à un OMC. Parmi tous les patients atteints d’uvéite, 9 % ont une baisse d’acuité visuelle bilatérale inférieure à 3/10 sur le meilleur œil, liée dans 50 % des cas à un OMC.
Dans une étude rétrospective réalisée dans deux centres de référence au début des années 1990, 41 % des patients souffrant d’uvéite intermédiaire, 28 % ayant une uvéite postérieure et 53 % ayant une panuvéite présentaient un OMC responsable de 41 % des baisses d’acuité visuelle définitives et de 29 % des cécités observées dans cette cohorte de patients atteints d’uvéite [3]. Plus récemment, dans l’essai multicentrique sur le traitement par corticoïdes des uvéites (multicenter uveitis steroid treatment [MUST]), l’œdème maculaire était présent dans 36 % des yeux avec uvéite, avec une fréquence identique pour les patients souffrant d’uvéite intermédiaire ou postérieure [8].
Dans d’autres études, l’OM a été retrouvé dans 85 % des cas d’uvéite intermédiaire, 35 % des cas de panuvéite et 20 % des cas d’uvéite postérieure, responsable de plus de 30 % des pertes définitives d’acuité visuelle [9–11]. Par ailleurs, l’acuité visuelle ne serait pas le moyen le plus sensible pour détecter le retentissement fonctionnel de l’OM, y compris après sa résolution. Lorsqu’un OM survient, l’acuité visuelle diminue, sauf chez certains jeunes patients où elle est conservée sur les échelles habituelles utilisées en clinique courante. En revanche, la micropérimétrie ou la vision des contrastes ont montré un déficit fonctionnel chez ces mêmes patients. Ces discordances ont pu notamment être mises en évidence chez des patients souffrant d’uvéite associée aux arthrites juvéniles idiopathiques, à une épithéliopathie en plaques ou une maladie de Vogt-Koyanagi-Harada [12].
Lorsque l’œdème est insuffisamment traité, ou récidive sur de nombreuses années, il finit par occasionner des dommages irréversibles des photorécepteurs maculaires, responsables d’une perte de l’acuité visuelle centrale plus ou moins prononcée [13]. De même, un OM peut passer à la chronicité et persister, en dépit du contrôle de l’uvéite. Il évolue alors pour son propre compte, sans être associé à d’autres signes d’uvéite postérieure active, et peut être qualifié d’OM de nature dégénérative avec un aspect caractéristique à l’OCT (voir chapitre 10.4).
En cas d’altération de la neurorétine, la baisse d’acuité visuelle est définitive et ce malgré une régression de l’œdème après traitement en OCT (disparition des kystes, épaisseur maculaire normale). À l’inverse, un OM d’apparition récente répond mieux au traitement et a un meilleur pronostic visuel [14].
Des facteurs de risque indépendants de la cause des uvéites ont été identifiés et rapportés dans la littérature.
Dans une large revue multicentrique menée aux États-Unis, la prévalence de l’OM augmentait avec le caractère chronique de l’uvéite. Ainsi, la prévalence de l’OM était de 17 % à 1 an, augmentant à 30 % après 5 ans d’évolution [15].
Le fait d’être fumeur augmenterait le risque de récidive inflammatoire, et est associé à un risque plus important de développer un OM en cas d’uvéite [16, 17].
La présence d’un OM inflammatoire est corrélée à l’activité inflammatoire et notamment à l’importance de la hyalite.
L’existence d’une membrane épirétinienne, plus fréquente dans le contexte d’une uvéite, favorise la survenue d’un OM et gêne sa résolution après traitement. L’épaississement maculaire est également plus important en cas de présence d’une membrane épirétinienne [18, 19].
De même, des facteurs pronostiques de moins bonne récupération visuelle après traitement ont été mis en évidence à plusieurs reprises et sont principalement : l’âge, une plus longue durée d’évolution, un décollement incomplet du vitré, une ischémie maculaire, un OMC initial sévère [7].
Toute uvéite, à tout moment de son évolution, peut se compliquer d’OMC. L’incidence des OM au cours des uvéites dépend en premier lieu de leurs causes. Cette relation entre l’étiologie de l’uvéite et le développement d’un OM est pourtant peu documentée, et très variable dans la littérature (tableau 10-2). Il est impossible de détailler toutes les causes d’uvéite et leur risque potentiel d’OM. Nous ne rapporterons que quelques cas illustratifs pour chaque localisation d’uvéite et des cas où l’OM participe à la définition de l’entité.
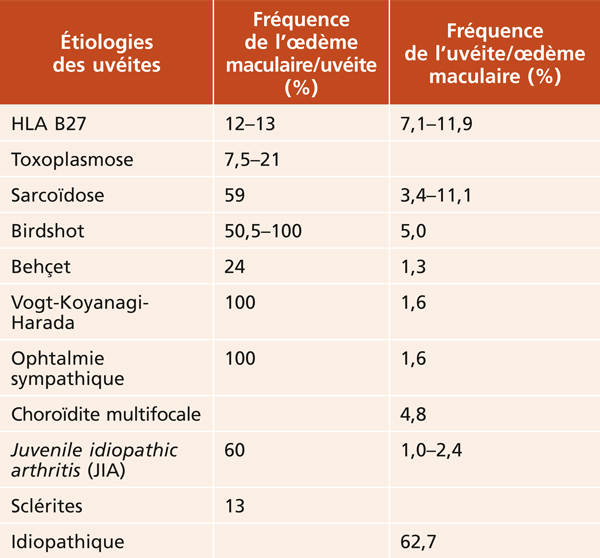
Tableau 10-2 Principales étiologies d’uvéite et fréquence de l’œdème maculaire cystoïde [7–11, 13, 14, 20].
Un OM complique fréquemment les uvéites antérieures aiguës récidivantes ou les uvéites antérieures chroniques. L’OM est particulièrement fréquent dans les formes liées à l’antigène human leukocyte antigen (HLA) B27+, qui représentent approximativement la moitié des causes d’uvéite antérieure. Certaines séries rapportent une fréquence d’OM atteignant 30 % (tableau 10-2). Les autres causes d’uvéites antérieures aiguës se compliqueraient plus rarement d’OMC. La localisation initialement antérieure de l’uvéite est, en soi, un facteur de meilleur pronostic visuel en cas d’OM comparé aux œdèmes des uvéites intermédiaires ou postérieures [14, 20]. De même, la résolution ou l’absence de récidive de l’OM sont hautement corrélées à la rupture de la barrière hémato-aqueuse du segment antérieur évaluée au mieux par le Tyndall protéique ou flare. L’existence de synéchies iridocristalliniennes, ainsi que le caractère hypotonisant des uvéites antérieures seraient des facteurs de risque spécifiques de la survenue d’un OM [14, 20].
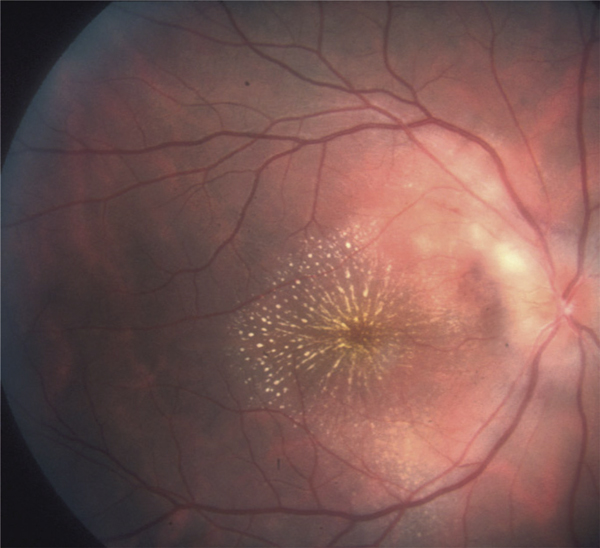
Le terme d’uvéite intermédiaire est utilisé pour le sous-groupe des uvéites où le vitré est le site principal de l’inflammation [5]. L’uvéite intermédiaire touche préférentiellement les enfants et adultes jeunes. La présence d’engainements vasculaires périphériques et/ou l’existence d’un OM sont des signes fréquemment associés à la hyalite et classiques au cours des uvéites intermédiaires (fig. 10-2). L’OMC est donc fréquent en cas d’uvéite intermédiaire et s’associe volontiers à un œdème papillaire et à une hyalite. L’incidence de l’OMC au cours des uvéites intermédiaires varie de 28 à 52 % (tableau 10-2). Il est à noter que la présence d’une banquise (définissant anciennement les pars planites) représente un risque de résistance au traitement de l’OM, ainsi qu’un risque accru de baisse d’acuité visuelle définitive. À l’inverse, les condensations inflammatoires vitréennes seules (œufs de fourmi, boule de neige ou snowballs) ne sont pas associées à un risque accru d’OM et ne sont pas un facteur de mauvais pronostic [14].
L’OM est un critère décisionnel majeur dans la prise en charge thérapeutique des uvéites intermédiaires. En effet alors qu’une hyalite, signe cardinal de cette entité, peut être tolérée et surveillée, l’avénement d’un OM impose le recours à une corticothérapie par voie locale ou systémique. La survenue d’une complication maculaire est donc particulièrement recherchée dans les uvéites intermédiaires par des examens OCT réguliers.
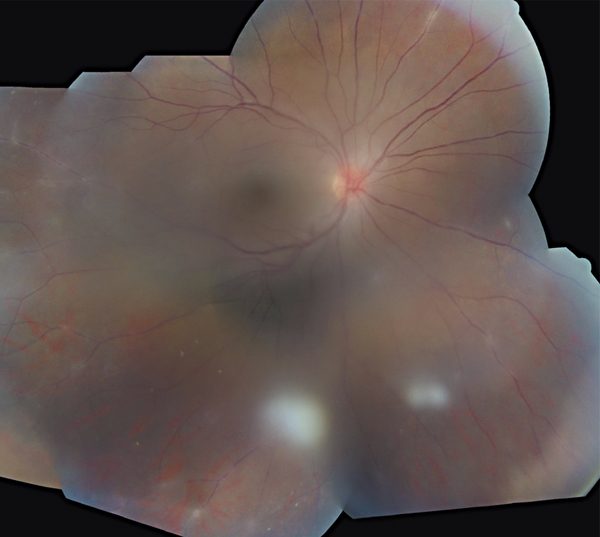
Fig. 10-2 Uvéite intermédiaire.
Noter les condensations vitréennes (snowballs) et les engainements vasculaires périphériques (périphlébites).
La localisation postérieure de l’inflammation est prédictive d’un moins bon pronostic visuel que les autres uvéites. En effet, au cours des uvéites postérieures, les OM sont plus fréquents et d’évolution plus souvent chronique. Paradoxalement, la cause d’uvéite postérieure la plus fréquente, représentée par la choriorétinite toxoplasmique, se complique très rarement d’OM inflammatoire. À l’inverse, une localisation maculaire du foyer parasitaire n’est pas exceptionnelle [21, 22] (voir chapitre 10). Parfois, l’aspect ou la fréquence de l’OM au cours d’uvéites postérieures aident au diagnostic étiologique. Nous détaillerons quelques cas en exemple.
La choriorétinopathie de type Birdshot est une uvéite postérieure bilatérale qui peut être considérée comme une uvéite postérieure modèle. Bien que rare, sa présentation clinique est caractérisée par l’existence de taches dépigmentées qui prédominent en rétine nasale [23]. La survenue d’un OM est particulièrement fréquente dans ce contexte et est rapportée dans plus de la moitié des cas [24, 25]. De plus, l’OM fait partie des critères confortant le diagnostic de la maladie [26]. Là encore, la survenue d’un OM est un critère décisionnel majeur dans la prise en charge thérapeutique de ces patients (fig. 10-3).
La maladie de Vogt-Koyanagi-Harada (VKH) est une uvéite postérieure avec décollements de rétine exsudatifs, associée à une pleïocytose du liquide céphalorachidien (LCR), des dépigmentations localisées (vitiligo, poliose) et une hypoacousie de perception. La survenue d’un décollement séreux rétinien maculaire pouvant être bulleux fait partie des critères diagnostiques révisés de la maladie. À la phase aiguë de la maladie, de nombreux points hyperfluorescents apparaissent en angiographie au niveau de l’épithélium pigmentaire et sont le point de départ de diffusions dans l’espace sous-rétinien. L’imagerie en OCT a mis en évidence des images de décollements séreux rétiniens assez caractéristiques avec des murs verticaux, formant des espaces sous-rétiniens kystiques. Des images en OCT similaires sont rencontrées au cours de la phase aiguë des épithéliopathies en plaques mais avec une présentation clinique et angiographique très différente [27].
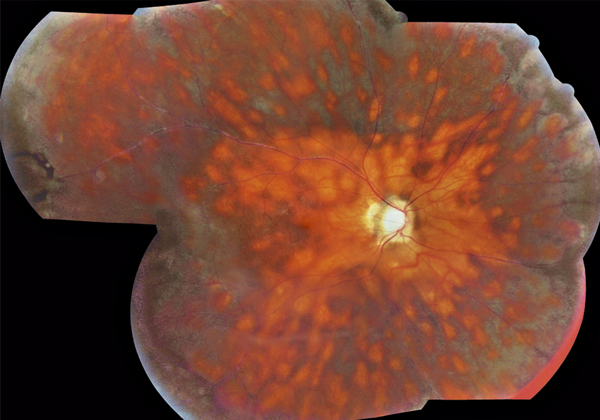
Le tableau de neurorétinite stellaire de Leber est caractérisé par l’association d’un œdème papillaire à une étoile maculaire (fig. 10-4). Ce tableau doit faire rechercher une cause infectieuse : en premier lieu une infection par Bartonella henselae (maladie des griffes du chat) mais aussi la leptospirose, une toxoplasmose et d’autres étiologies infectieuses plus rares. La régression des exsudats maculaires est assez lente et s’effectue sur 6 à 12 mois.
L’uvéite de reconstitution immune (URI) est la manifestation inflammatoire la plus fréquente lors d’une reconstitution immunitaire après traitement antirétroviral, hautement actif, chez des patients immunodéprimés par le virus de l’immunodéficience humaine (VIH) et ayant présenté une rétinite à cytomégalovirus (CMV). L’URI est corrélée à l’augmentation rapide des CD4, notamment lorsque ces derniers sont à nouveau supérieurs à 100/mm3. Le syndrome de restitution immune est associé à des complications inflammatoires rétiniennes, notamment à l’apparition quasi systématique d’un OM et d’une membrane épirétininenne. L’OM est une cause majeure de perte d’acuité visuelle chez les patients VIH+. Dans l’étude rapportée par Kempen et al., les patients présentant un syndrome de reconstitution immune avaient un risque 20 fois supérieur de développer un OMC [28, 29].
La présence d’un OM confirme en quelque sorte la nature inflammatoire de l’uvéite. Ainsi, un tableau d’uvéite ne se compliquant pas ou jamais d’OM doit faire évoquer un masquerade syndrome.
Deux tableaux cliniques particulièrement illustratifs peuvent ainsi être rappelés :
-
le tableau clinique d’une uvéite antérieure avec de nombreux précipités rétrodescemétiques d’aspect étoilé, parfois associée à une hyalite ou pseudo-hyalite de contiguïté sans formation de synéchie iridocristallinienne ou d’OM, et ce malgré de nombreuses années d’évolution, doit faire évoquer une cyclite hétérochromique de Fuchs ;
-
un tableau d’uvéite intermédiaire avec une hyalite à gros grains chez une personne dite âgée sans OM doit faire redouter un lymphome intra-oculaire (fig. 10-5).
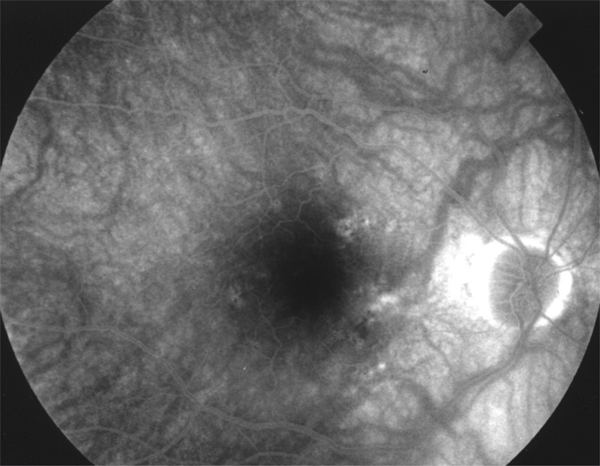
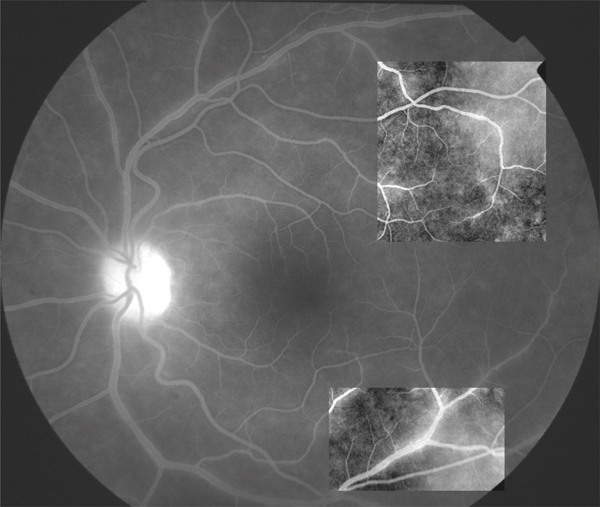
Fig. 10-5 Angiographie à la fluorescéine d’un patient souffrant de lymphome intra-oculaire avec hyalite sans aucun signe d’uvéite postérieure ni diffusion maculaire.
L’OM au cours des uvéites est la principale complication mettant en jeu le pronostic fonctionnel visuel. L’OM est un facteur décisionnel majeur dans le choix et l’intensité des traitements des uvéites. Pourtant, la fréquence de l’OM au cours des uvéites est assez mal connue et souvent variable d’une série à l’autre, dépendant de nombreux facteurs associés. De manière schématique, on peut retenir que plus l’inflammation est antérieure et plus le risque d’OM est faible et le pronostic favorable. De même, les OM associés à une uvéite active sur le plan inflammatoire ont un meilleur pronostic et de meilleures chances de récupération après traitement, comparés aux OM évoluant de façon chronique associés ou non à une inflammation. La détection, le suivi de l’OM inflammatoire ont largement bénéficié des progrès de l’imagerie (OCT), et leur traitement évolue rapidement. Ces sujets seront développés dans les sous-chapitres suivants.
[1] Gritz DC, Wong IG. Incidence and prevalence of uveitis in Northern California, the Northern California Epidemiology of Uveitis Study. Ophthalmology 2004 ; 111 : 491-500.
[2] Bajwa A, Osmanzada D, Osmanzada S, et al. Epidemiology of uveitis in the mid-Atlantic United States. Clin Ophthalmol 2015 ; 9 : 889-901.
[3] Suttorp-Schulten MS, Rothova A. The possible impact of uveitis in blindness : a literature survey. Br J Ophthalmol 1996 ; 80 : 844-8.
[4] de Boer J, Wulffraat N, Rothova A. Visual loss in uveitis of childhood. Br J Ophthalmol 2003 ; 87 : 879-84.
[5] Jabs DA, Nussenblatt RB, Rosenbaum JT, Standardization of Uveitis Nomenclature (SUN) Working Group. Standardization of uveitis nomenclature for reporting clinical data. Results of the First International Workshop. Am J Ophthalmol 2005 ; 140 : 509-16.
[6] Kempen JH, Sugar EA, Jaffe GJ, et al. Fluorescein angiography versus optical coherence tomography for diagnosis of uveitic macular edema. Ophthalmology 2013 ; 120 : 1852-9.
[7] Tomkins-Netzer O, Talat L, Bar A, et al. Long-term clinical outcome and causes of vision loss in patients with uveitis. Ophthalmology 2014 ; 121 : 2387-92.
[8] The Multicenter Uveitis Steroid Treatment Trial Research Group. The Multicenter Uveitis Steroid Treatment (MUST) Trial : rationale, design, and baseline characteristics. Am J Ophthalmol 2010 ; 149 : 550-61.
[9] Durrani OM, Tehrani NN, Marr JE, et al. Degree, duration, and causes of visual loss in uveitis. Br J Ophthalmol 2004 ; 88 : 1159-62.
[10] Mitkova-Hristova VT, Konareva-Kostianeva MI. Macular edema in uveitis. Folia Med (Plovdiv) 2012; 54: 14-21.
[11] Okada AA. Cystoid macular edema in uveitis. Dev Ophthalmol 2010; 54 : 14-21.
[12] Tomkins-Netzer O, Ismetova F, Bar A, et al. Functional outcome of macular edema in different retinal disorders. Prog Retin Eye Res 2015 ; 48 : 119-36.
[13] Lardenoye CW, van Kooij B, Rothova A. Impact of macular edema on visual acuity in uveitis. Ophthalmology 2006 ; 113 : 1446-9.
[14] Levin MH, Pistilli M, Daniel E, et al. ; Systemic Immunosuppressive Therapy for Eye Diseases Cohort Study. Incidence of visual improvement in uveitis cases with visual impairment caused by macular edema. Ophthalmology 2014 ; 121 : 588-95.
[15] Smith JA, Mackensen F, Sen HN, et al. Epidemiology and course of disease in childhood uveitis. Ophthalmology 2009 ; 116 : 1544-51.
[16] Roesel M, Ruttig A, Schumacher C, et al. Risk factors for the development of macular edema in noninfectious uveitis. Eur J Ophthalmol 2011 ; 21 : 625-30.
[17] Thorne JE, Daniel E, Jabs DA, et al. Smoking as a risk factor for cystoid macular edema complicating intermediate uveitis. Am J Ophthalmol 2008 ; 145 : 841-6.
[18] Domalpally A, Altaweel MM, Kempen JH, et al. ; MUST Trial Research Group. Optical coherence tomography evaluation in the Multicenter Uveitis Steroid Treatment (MUST) trial. Ocul Immunol Inflamm 2012 ; 20 : 443-7.
[19] Lehpamer B, Moshier E, Pahk P, et al. Epiretinal membranes in uveitic macular edema : effect on vision and response to therapy. Am J Ophthalmol 2014 ; 157 : 1048-55.
[20] Monnet D, Breban M, Hudry C, et al. Ophthalmic findings and frequency of extraocular manifestations in patients with HLA-B27 uveitis : a study of 175 cases. Ophthalmology 2004 ; 111 : 802-9.
[21] Holland GN. Ocular toxoplasmosis : a global reassessment. Part II : disease manifestations and management. Am J Ophthalmol 2004 ; 137 : 1-17.
[22] Ouyang Y, Pleyer U, Shao Q, et al. Evaluation of cystoid change phenotypes in ocular toxoplasmosis using optical coherence tomography. PLoS One 2014 ; 9 : e86626.
[23] Levinson RD, Monnet D. Imaging in birdshot chorioretinopathy. Int Ophthalmol Clin 2012 ; 52 : 191-8.
[24] Shah KH, Levinson RD, Yu F, et al. Birdshot chorioretinopathy. Surv Ophthalmol 2005 ; 50 : 519-41. Review.
[25] Monnet D, Levinson RD, Holland GN, et al. Longitudinal cohort study of patients with birdshot chorioretinopathy. III. Macular imaging at baseline. Am J Ophthalmol 2007 ; 144 : 818-28.
[26] Levinson RD, Brezin A, Rothova A, et al. Research criteria for the diagnosis of birdshot chorioretinopathy : results of an international consensus conference. Am J Ophthalmol 2006 ; 141 : 185-7.
[27] Lin D, Chen W, Zhang G, et al. Comparison of the optical coherence tomographic characters between acute Vogt-Koyanagi-Harada disease and acute central serous chorioretinopathy. BMC Ophthalmology 2014 ; 14 : 87.
[28] Jabs DA, Ahuja A, Van Natta M, et al., for the Studies of the Ocular Complications of AIDS Research Group S. Course of Cytomegalovirus retinitis in the era of highly active antiretroviral therapy : five-year outcomes. Ophthalmology 2010 ; 117 : 2152-2161.e2.
[29] Kempen JH, Min YI, Freeman WR, et al. Studies of ocular complications of AIDS Research Group. Risk of immune recovery uveitis in patients with AIDS and cytomegalovirus retinitis. Ophthalmology 2006 ; 113 : 684-94.
M.-D. De Smet
➤ L’OM inflammatoire est le résultat de nombreux facteurs, dont la nature et l’importance varient en fonction de la durée, de l’étiologie de l’inflammation et de l’état fonctionnel de la rétine.
➤ Une infection, un stress endogène ou exogène vont provoquer l’activation de différents récepteurs qui conduisent, par l’intermédiaire de l’activation du nuclear factor-kappa B (NF-κB), à une réponse immunitaire innée à l’origine d’une altération de l’homéostasie rétinienne.
➤ La composante cytotoxique de l’œdème provient principalement du dysfonctionnement des canaux potassiques et aqueux présents à la surface des cellules de Müller et au niveau de l’épithélium pigmenté rétinien à l’origine d’œdèmes intra- et sous-rétiniens.
➤ La composante vasogène de l’œdème qui fait suite à l’inflammation mène les cellules de Müller et les cellules microgliales à sécréter des facteurs inflammatoires responsables de la perte d’étanchéité de la BHR interne. La BHR externe au niveau de l’épithélium pigmentaire de la rétine est également influencée par des facteurs inflammatoires causant une augmentation de sa perméabilité.
➤ D’autres facteurs peuvent contribuer à la présence et à l’importance d’un OM inflammatoire : une traction vitréomaculaire, une ischémie maculaire, des séquelles d’un OM chronique avec apoptose des cellules de Müller.
L’OM inflammatoire est une des causes les plus fréquentes d’une baisse permanente de la vision chez les patients atteints d’uvéite. Elle est présente selon certaines études chez plus de 60 % des patients atteints de maladie de Birdshot, de sarcoïdose ou d’uvéite intermédiaire dont la durée est supérieure à 1 an [1–4]. Chez l’enfant, sa prévalence augmente en fonction de la chronicité de l’inflammation, l’OM inflammatoire étant présent dans 17 % des cas à 1 an et 35 % à 5 ans [5]. L’OM inflammatoire est donc plus souvent la conséquence d’une inflammation chronique que d’une inflammation aiguë. La chronicité implique également des altérations structurelles et donc une susceptibilité accrue aux phénomènes tractionnels et aux effets d’une ischémie parafovéolaire.
L’OM inflammatoire est le résultat de nombreux facteurs dont l’importance varie en fonction de la durée, de l’étiologie de l’inflammation et de l’état fonctionnel de la rétine. Le contrôle de l’inflammation, important en phase aiguë, n’est pas forcément aussi critique dans des formes chroniques où les séquelles cicatricielles peuvent avoir des effets tout aussi sévères, nécessitant une modification de l’approche thérapeutique.
Comprendre l’OM inflammatoire implique de comprendre le rôle de l’inflammation au niveau de la rétine, de la réponse tissulaire qu’elle induit, des influences externes qui l’affectent, et des éventuelles séquelles générées. C’est grâce à ces notions et aux acteurs de l’homéostasie rétinienne qu’il est possible d’élaborer les pistes menant à des stratégies thérapeutiques.
La réponse immunitaire se caractérise par deux mécanismes principaux :
-
une réponse innée primaire, rapide et programmée mais dépourvue de mémoire ;
-
une réponse adaptative, plus lente et dirigée vers des éléments spécifiques locaux. Cette dernière est capable d’éliminer un élément pathogène de façon précise, efficace et permet si nécessaire de générer une réponse immunitaire rapide et spécifique lors d’un rappel ultérieur.
Le système immunitaire inné est principalement responsable de l’homéostasie et fonctionne à travers trois principaux types de récepteurs ou mécanismes :
-
des lectines et les protéines C réactives qui activent le complément ;
-
des récepteurs endocytiques tels que les récepteurs tolls (toll-like receptors [TLR]) captant directement des antigènes et activant les cellules immunitaires ;
-
la reconnaissance d’alarmines, molécules endogènes produites par des cellules endommagées ou nécrotiques [6–9]. Ces dernières permettent au système immunitaire inné d’intervenir en l’absence d’infection sur des tissus stressés ou endommagés et de favoriser dans la mesure du possible leur guérison et un retour à l’homéostasie. Leur sécrétion est augmentée en présence de radicaux libres, de monoxyde d’azote et d’hyperglycémie. Les alarmines peuvent se lier aux TLR, au récepteur de l’interleukine 1 (IL-1) et induisent l’activation du nuclear factor-kappa B ou NF-κB (fig. 10-6).
L’infection et le traumatisme tissulaire sont deux conditions extrêmes, capables d’activer le système immunitaire inné mais à divers degrés selon la sévérité de l’agression. Les éléments constitutifs de la réponse immunitaire ont été décrits au chapitre 4.7. Il existe une réponse immunologique commune aux stress endogènes ou exogènes. La réponse est modulée en fonction de la sévérité de l’agression, le processus réparateur (para-inflammatoire) causant des altérations passagères ou permanentes, en fonction de sa durée et de son intensité. Plus le stress tissulaire oxydatif est important, plus la réponse immunitaire est stimulée. Dans le cas de la rétine et du cerveau, cette réponse mène à l’altération d’un équilibre très fin de l’homéostasie qui est nécessaire à sa fonction.
Du point de vue clinique, le phénotype observé dépendra du degré de l’agression et de sa nature. L’OM peut se limiter à la zone nucléaire interne, s’étendre vers les couches plus superficielles de la rétine avant d’impliquer la rétine complète [10]. Elle peut affecter principalement l’épithélium pigmentaire rétinien (EPR) causant un décollement séreux associé à plus ou moins d’œdème rétinien [11, 12]. Elle peut prendre des formes plus particulières, par exemple dans la sclérose en plaques, où une inflammation microkystique diffuse est visible au niveau de la plexiforme interne [13]. Dans tous les cas, le phénotype résulte de l’addition des effets cytotoxiques et vasogènes résultant de l’agression immunitaire.
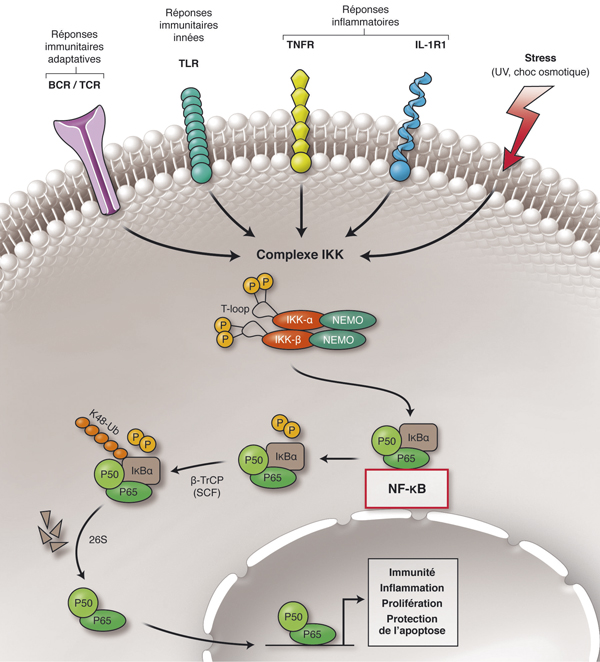
Fig. 10-6 Mécanismes par lesquels la stimulation de différents récepteurs au cours d’une uvéite conduit à l’activation du NF-κB (nuclear factor-kappa B) impliqué dans la réponse immunitaire à l’origine de la dérégulation de l’homéostasie rétinienne.
BCR : B cell receptor ; IKK : inhibitor of nuclear factor kappa kinase ; IL-R : interleukin receptor ; NEMO : nuclear factor kappa B essential modulator ; TCR : T cell receptor ; TNFR : tumor necrosis factor receptor.
La rétine est composée d’unités neurovasculaires dont l’activité optimale dépend d’une homéostasie propice à la neurotransmission. Elle requiert une capacité rapide d’adaptation liée à une grande variabilité de l’activité neuronale, ce qui implique des flux importants en eau et en ions. La dépolarisation, menant à un signal nerveux, implique une rapide migration d’ions sodium et calcium vers l’intérieur des neurones activés, alors que le potassium sort de ceux-ci. Le tampon permettant de limiter les variations extracellulaires du potassium est assuré par les cellules de Müller, où des canaux rectifiant du potassium, Kir4.1 (bidirectionnel) et Kir2.1 (dirigé vers la cellule), se chargent du transfert rapide des ions vers le milieu intracellulaire. Dans un état non enflammé, les K+-inwardly rectifying channels 2.1 (Kir2.1) s’expriment à proximité des cellules d’origine neuronale, alors que les Kir4.1 se retrouvent principalement à proximité des capillaires rétiniens où ils favorisent, avec les aquaporines 4, l’extrusion de l’eau et des ions K+ vers la circulation sanguine [14]. Ainsi dans des conditions normales, le flux ionique et aqueux est surtout dirigé vers les capillaires rétiniens. Il dépend d’un processus actif et adénosine 5'-triphosphate (ATP) dépendant [15].
Dans un contexte inflammatoire, la localisation des récepteurs Kir4.1 change avec une distribution uniforme à la surface de la cellule de Müller ou, plus souvent, à proximité de la membrane limitante externe de la rétine. On note alors également une diminution de la synthèse des canaux [16, 17]. Ces altérations favorisent la formation d’œdème intracellulaire et l’accumulation de liquide sous-rétinien, toutes deux observées dans l’OM inflammatoire [12]. Cette altération fonctionnelle des cellules de Müller est perçue comme étant un des mécanismes fondamentaux du développement de l’OM cytotoxique. À l’état pur, ce type d’œdème est caractérisé par une absence de fuite à l’angiographie en fluorescence malgré la présence d’œdème sur l’OCT. Cette anomalie fonctionnelle est plus fréquente chez les patients âgés, possiblement en raison d’une perte progressive de la conductance du potassium liée à l’âge, indiquant une diminution la capacité des cellules de Müller à excréter l’eau et les ions potassium [18].
Les autres éléments de l’unité neurovasculaire sont les cellules microgliales et les vaisseaux rétiniens. Au chapitre 4.7, nous avons évoqué le rôle des cellules microgliales dans la surveillance immunologique et l’homéostasie cellulaire de la rétine. Bien que surtout dirigées vers le maintien d’un état non inflammatoire, elles peuvent développer un profil pro-inflammatoire [19]. L’expression d’HLA de classe II, de CD45 et CD68 les rend présentatrices d’antigènes, alors que la sécrétion d’IL-1, IL-8, chemokine ligand 2 (CCL2) et CX3C chemokine receptor 1 (CX3CR1) permettent le recrutement d’autres cellules inflammatoires et l’altération de l’activité des cellules de Müller [20–24]. L’altération du passage de ces cellules à travers l’EPR favorise leur accumulation dans l’espace sous-rétinien où la sécrétion de facteurs inflammatoires entraîne une aggravation de l’inflammation, de la dysfonction des cellules de Müller mais aussi de l’EPR [25].
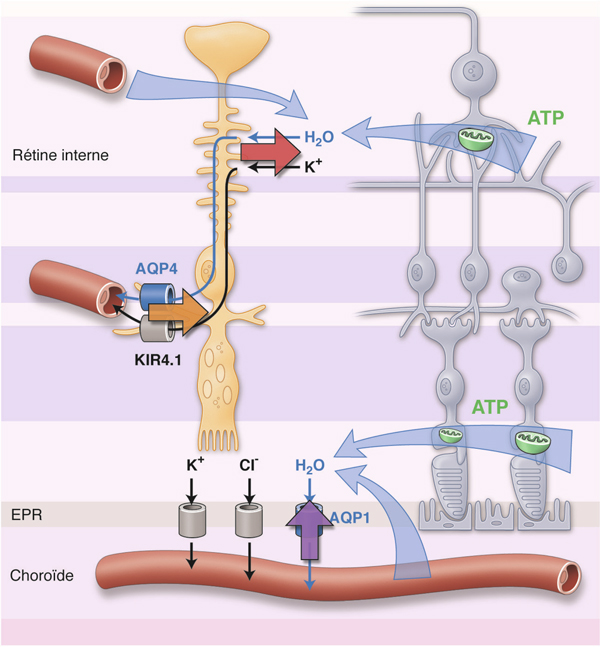
Fig. 10-7 Composante cytotoxique de l’œdème.
Elle provient principalement du dysfonctionnement des canaux potassiques et aqueux (Kir4-1 et aquaporines) présents à la surface des cellules de Müller et au niveau de l’épithélium pigmenté rétinien (EPR) à l’origine : d’un œdème intrarétinien par non-absorption de l’eau intercellulaire (flèche rouge) et non-élimination de l’eau présente dans les cellules de Müller vers les capillaires rétiniens (flèche orange) par le biais des canaux Kir4.1 et aquaporines ; d’un œdème sous-rétinien par non-réabsorption de l’H2O par les canaux aquaporines présents au niveau de l’EPR (flèche violette).
Dans la plupart des cas d’OM inflammatoire, une importante composante vasogène est présente. L’inflammation conduit les cellules de Müller et les cellules microgliales à sécréter différentes substances, dont le vascular endothelial growth factor (VEGF), du tumor necrosis factor α (TNF-α), des IL-1β et des prostaglandines responsables de la perte d’étanchéité des BHR interne et externe [26–30]. D’autres protéines dérivées du complément ou de la cascade de coagulation ont également un effet sur l’œdème, en particulier la thrombine et la fibrinogène [31, 32]. En réponse aux lésions tissulaires générées par exemple par une traction vitréomaculaire, ces protéines favorisent, dans l’espace extracellulaire, la formation d’interstices dans la BHR et la sécrétion du VEGF [33].
D’un point de vue anatomique, les capillaires rétiniens sont entourés par une gaine formée par les cellules de Müller. Une rupture de la BHR lors d’une atteinte ischémique ou inflammatoire entraîne une rapide activation des cellules de Müller [21]. Normalement, à l’état de repos, les astrocytes rétiniens, les cellules microgliales et les cellules de Müller sécrètent des facteurs qui favorisent le maintien de la BHR tels que le glial cell line-derived neurotrophic factor (GDNF), la thrombospondine 1, le transforming growth factor (TGF-β) et le pigment epithelium-derived factor (PEDF) [34, 35]. Le PEDF exprimé par les cellules neuronales et gliales réduit l’expression du VEGF et du basic fibroblast growth factor (bFGF) dans les cellules de Müller [36]. Le PEDF est lui-même régulé par des facteurs solubles produits par les cellules endothéliales tels que l’acide rétinoïque et le 17β-estradiol [37]. Une baisse de la sécrétion de PEDF, en présence d’inflammation, entraîne une augmentation de la sécrétion de VEGF [37, 38] et donc de la perméabilité des capillaires. L’inflammation conduit les cellules de Müller à sécréter d’autres facteurs tels que des métalloprotéases matricielles (MMP), en particulier MMP-9, qui causent une perte de l’étanchéité de la barrière par une dégradation des jonctions entre les cellules, plus particulièrement par une protéolyse de l’occludine [39–41]. Cette sécrétion des métalloprotéases est aussi stimulée par le TNF et le bFGF également issus de l’activation des cellules de Müller.
L’étanchéité de la BHR externe est également influencée par des facteurs inflammatoires. En présence d’IL-1, IL-2 et du TNF-α, la synthèse de cyclo-oxygénases (COX), en particulier le COX-2, est stimulée. Cette dernière est responsable de la synthèse des prostaglandines PGE2 et PGF2-α, impliquées dans l’OM inflammatoire [42]. Le TNF-α et l’interféron γ (IFN-γ) également présents en cas d’inflammation causent une augmentation de la perméabilité de l’EPR [43, 44]. Un autre facteur contribuant à l’hyperperméabilité est l’augmentation des taux d’oxyde d’azote inductible accompagnant l’inflammation [45, 46]. Une baisse de la transmigration des médiateurs cellulaires de l’inflammation augmente la sévérité de l’inflammation et diminue la fonction de la pompe épithéliale [44, 45, 47].
Les membranes épirétiniennes par leur effet tractionnel peuvent contribuer à l’aggravation de l’œdème. Le stress mécanique concentré sur un nombre restreint de cellules de Müller peut induire la sécrétion de facteurs inflammatoires ou vasogènes [48]. On sait que l’inflammation contribue à la formation de membranes [32], alors que celles-ci ne progressent pas lorsque l’inflammation est contrôlée [49]. Les membranes inflammatoires contiennent un nombre important de cellules microgliales, de macrophages ainsi que des extensions des cellules de Müller [50, 51]. La présence de ces cellules les distingue des autres membranes épirétiniennes. Des facteurs inflammatoires sont souvent associés : ils comprennent le TNF-α, du complément activé (classique et alternatif), du fibrinogène, ainsi que d’autres éléments constitutifs de la réponse immunitaire innée [31, 52]. L’inflammation peut donc mener à la formation de membranes épirétiniennes tractionelles [53]. Le fibrinogène et le TNF-α ont un rôle particulièrement important dans ce processus [52–54]. La présence, mais surtout la croissance ou l’aggravation des membranes épirétiniennes peuvent donc être interprétées comme des signes d’une inflammation active, nécessitant un traitement adéquat d’ordre médical ou chirurgical.
L’ischémie maculaire est souvent présente dans les OM inflammatoires [4, 55], en particulier dans la maladie de Behçet, les collagénopathies (lupus et autres), l’uvéite granulomateuse et la sarcoïdose oculaire [4, 55, 56]. L’ischémie rétinienne cause une augmentation du taux extracellulaire de glutamate. Dans un premier temps, le volume des cellules ganglionnaires s’accroît sous l’effet du glutamate, alors que dans la phase chronique, ce sont les cellules de Müller qui deviennent œdémateuses contribuant ainsi à l’expansion de la couche nucléaire interne et de l’épaisseur de la rétine [57, 58]. Une altération du transport des solutés et de l’eau est à la base de ce phénomène qui peut être inhibé en réduisant l’expression des aquaporines 4 et des canaux Kir 4.1 [58, 59], notamment par des corticostéroïdes. Il en résulte une normalisation de l’apparence des cellules de Müller [60, 61]. La réponse thérapeutique dans ce contexte n’est pas liée à un effet anti-inflammatoire mais à un mécanisme direct au niveau de ces cellules. Il permet une amélioration du transfert des fluides vers les capillaires rétiniens (surtout au niveau du plexus profond) ou une efficacité accrue de la pompe de l’EPR [62].
Au-delà des effets sur la vascularisation rétinienne et sur l’interface vitréomaculaire, l’œdème chronique engendre des modifications importantes dans la structure même de la rétine. Yanoff avait observé, dans des cas d’OM chronique, de larges kystes maculaires et un gonflement massif des cellules endothéliales obstruant ainsi la presque totalité de la lumière capillaire [63]. La perte d’étanchéité du réseau capillaire, malgré l’absence d’inflammation rétinienne, a été observée par angiographie en fluorescence dans un certain nombre de cas, souvent accompagnée par une diffusion au niveau de la tête du nerf optique [4, 64]. La perte des cellules de Müller par apoptose conduit à la formation de larges kystes intrarétiniens, souvent associés à un œdème intracellulaire des cellules de Müller environnantes [65]. La densité des cellules de Müller résiduelles visibles sur des OCT transversaux permettrait de prédire la fonction visuelle résiduelle [66]. Même à ce stade, il est possible d’augmenter l’acuité visuelle en traitant l’œdème résiduel en améliorant le fonctionnement de la pompe de l’EPR ou l’étanchéité de la barrière hémato-oculaire même en l’absence d’inflammation [4].
[1] Lardenoye CWTA, van Kooij B, Rothova A. Impact of macular edema on visual acuity in uveitis. Ophthalmol 2006 ; 113 : 1446-9.
[2] Monnet D, Levinson RD, Holland GN, et al. Longitudinal cohort study of patients with birdshot chorioretinopathy. III. Macular imaging at baseline. Am J Ophthalmol 2007 ; 144 : 818-28.e812.
[3] Johnson MW. Etiology and treatment of macular edema. Am J Ophthalmol 2009 ; 147 : 11-21.e11.
[4] de Smet MD, Okada AA. Cystoid macular edema in uveitis. Dev Ophthalmol 2010 ; 47 : 136-47.
[5] Smith JA, Mackensen F, Sen HN, et al. Epidemiology and course of disease in childhood uveitis. Ophthalmol 2009 ; 116 : 1544-51.
[6] Oppenheim JJ, Dong HF, Plotz P, et al. Autoantigens act as tissue-specific chemoattractants. J Leukoc Biol 2005 ; 77 : 854-61.
[7] Medzhitov R, Janeway CA Jr. Decoding the patterns of self and nonself by the innate immune system. Science 2002 ; 296 : 298-300.
[8] Chovatiya R, Medzhitov R. Stress, inflammation, and defense of homeostasis. Mol Cell 2014 ; 54 : 281-8.
[9] Dumitriu IE, Baruah P, Manfredi AA, et al. HMGB1 : guiding immunity from within. Trends Immunol 2005 ; 26 : 381-7.
[10] Munk MR, Ram R, Rademaker A, et al. Influence of the vitreomacular interface on the efficacy of intravitreal therapy for uveitis-associated cystoid macular oedema. Acta Ophthalmol 2015 ; 93 : 561-7.
[11] Ouyang Y, Pleyer U, Shao Q, et al. Evaluation of cystoid change phenotypes in ocular toxoplasmosis using optical coherence tomography. PLoS One 2014 ; 9 : e86626.
[12] Tran THC, de Smet MD, Bodaghi B, et al. Uveitic macular oedema : correlation between optical coherence tomography patterns with visual acuity and fluorescein angiography. Brit J Ophthalmol 2008 ; 92 : 922-7.
[13] Gelfand JM, Nolan R, Schwartz DM, et al. Microcystic macular oedema in multiple sclerosis is associated with disease severity. Brain 2012 ; 135 : 1786-93.
[14] Kofuji P, Biedermann B, Siddharthan V, et al. Kir potassium channel subunit expression in retinal glial cells: implications for spatial potassium buffering. Glia 2002 ; 39 : 292-303.
[15] Kusaka S, Puro DG. Intracellular ATP activates inwardly rectifying K+ channels in human and monkey retinal Müller (glial) cells. J Physiol 1997 ; 500 : 593-604.
[16] Pannicke T, Uckermann O, Iandiev I, et al. Ocular inflammation alters swelling and membrane characteristics of rat Muller glial cells. J Neuroimmunol 2005 ; 161 : 145-54.
[17] Liu XQ, Kobayashi H, Jin ZB, et al. Differential expression of Kir4.1 and aquaporin 4 in the retina from endotoxin-induced uveitis rat. Mol Vis 2007 ; 13 : 309-17.
[18] Bringmann A, Kohen L, Wolf S, et al. Age-related decrease in potassium currents in human retinal glial (Müller) cells. Can J Ophthalmol 2003 ; 38 : 464-8.
[19] Forrester JV, Xu H, Kuffová L, et al. Dendritic cell physiology and function in the eye. Immunol Rev 2010 ; 234 : 282-304.
[20] Zeng HY, Green WR, Tso MOM. Microglial activation in human diabetic retinopathy. Arch Ophthalmol 2008 ; 126 : 227-32.
[21] Rungger-Brändle E, Dosso AA, Leuenberger PM. Glial reactivity, an early feature of diabetic retinopathy. Invest Ophthalmol Vis Sci 2000 ; 41 : 1971-80.
[22] Rangasamy S, McGuire PG, Franco Nitta C, et al. Chemokine mediated monocyte trafficking into the retina : role of inflammation in alteration of the blood-retinal barrier in diabetic retinopathy. PLOS One 2014 ; 9 : e108508.
[23] Zhang W, Rojas M, Lilly B, et al. NAD(P)H oxidase-dependent regulation of CCL2 production during retinal inflammation. Invest Ophthalmol Vis Sci 2009 ; 50 : 3033-40.
[24] Zhang M, Xu GT, Liu W, et al. Role of fractalkine/CX3CR1 interaction in light-induced photoreceptor degeneration through regulationg retinal microglial activation and migration. PLOS One 2012 ; 7 : e35446.
[25] Mori S, Behar-Cohen F, De Kozak Y, et al. Microglia/macrophages migrate through retinal epithelium barrier by a transcellular route in diabetic retinopathy. Role of PKC in the gotokakizaki rat model. Am J Pathol 2011 ; 179 : 942-53.
[26] Wang JJ, Zhu M, Le YZ. Functions of Muller cell-derived vascular endothelial growth factor in diabetic retinopathy. W J Diabetes 2015 ; 6 : 726-33.
[27] Wang J, Xu X, Elliott MH, et al. Muller cell-derived VEGF is essential for diabetes – induced retinal inflammation and vascular leakage. Diabetes 2010 ; 59 : 2297-305.
[28] Claudio L, Martiney LA, Brosnan CF. Ultrastructural studies of the blood-retina barrier after exposure to interleukin-1 beta or tumor necrosis factor-alpha. Lab Invest 1994 ; 70 : 850-61.
[29] Luna JD, Chan CC, Derevjanik NL, et al. Blood-retinal barrier (BRB) breakdown in experimental autoimmune uveoretinitis : comparison with vascular endothelial growth factor, tumor necrosis factor α, and interleukin-1β-mediated breakdown. J Neurosci Res 1997 ; 49 : 268-80.
[30] Derevjanik NL, Vinores SA, Xiao WH, et al. Quantitative assessment of the integrity of the blood-retinal barrier in mice. Invest Ophthalmol Vis Sci 2002 ; 43 : 2462-7.
[31] Pollreisz A, Funk M, Breitwieser FP, et al. Quantitative proteomics of aqueous and vitreous fluid from patients with idiopathic epiretinal membranes. Exp Eye Res 2013 ; 108 : 48-58.
[32] Joshi M, Agrawal S, Christoforidis JB. Inflammatory mechanisms of idiopathic epiretinal membrane formation. Mediat Inflam 2013 ; 2013 : 192582.
[33] Bian ZM, Elner SG, Elner VM. Thrombin-induced VEGF expression in human retinal pigment epithelial cells. Invest Ophthalmol Vis Sci 2007 ; 48 : 2738-46.
[34] Igarashi Y, Chiba H, Utsumi H, et al. Expression of receptors for glial cell line-derived nerotrophic factor (GNDF) and neurturin in the inner blood-retinal barrier of rats. Cell Struct Funct 2000 ; 25 : 237-41.
[35] Yafai Y, Iandiev I, Lange J, et al. Basic fibroblast growth factor contributes to a shift in the angioregulatory activity of retinal glial (Muller) cells. PLoS One 2013 ; 8 : e68773.
[36] Aymerich MS, Alberdi EM, Martinez A, Becerra SP. Evidence for pigment epitheliumderived factor receptors in the neural retina. Invest Ophthalmol Vis Sci 2001 ; 42 : 3287-93.
[37] Yafai Y, Lange J, Wiedemann P, et al. Pigment epithelium-derived factor acts as an opponent of growth-stimulatory factors in retinal glial-endothelial cell interactions. Glia 2007 ; 55 : 642-51.
[38] Zhang SX, Wang JJ, Gao GP, et al. Pigment epithelium-derived factor (PEDF) is an endogenous antiinflammatory factor. FASEB J 2006 ; 20 : 323-5.
[39] Behzadian MA, Wang XL, Windsor LJ, et al. TGF-β increases retinal endothelial cell permeability by increasing MMP-9 : possible role of glial cells in endothelial barrier function. Invest Ophthalmol Vis Sci 2001 ; 42 : 853-9.
[40] Giebel SJ, Menicucci G, McGuire PG, Das A. Matrix metalloproteinases in early diabetic retinopathy and their role in the alteration of the blood-retinal barrier. Lab Invest 2005 ; 85 : 597-607.
[41] De Groef L, Salinas-Navarro M, Van Imschoot G, et al. Decreased TNF levels and improved retinal ganglion cell survival in MMP-2 null mice suggest a role for MMP-2 as TNF Sheddase. Mediat Inflam 2015 ; 2015 : 108617.
[42] Chin MS, Nagineni CN, Hooper LC, et al. Cyclooxygenase-2 gene epression and regulation in human retinal pigment epithelial cells. Invest Ophthalmol Vis Sci 2001 ; 42 : 2338-46.
[43] Zech JC, Pouvreau I, Cotinet A, et al. Effect of cytokines and nitric oxide on tight junctions in cultured rat retinal pigment epithelium. Invest Ophthalmol Vis Sci 1998 ; 39 : 1600-8.
[44] Peng S, Gan G, Rao VS, Adelman RA, Rizzolo LJ. Effects of proinflammatory cytokines on the claudin-19 rich tight junctions of human retinal pigment epithelium. Invest Ophthalmol Vis Sci 2012 ; 53 : 5016-28.
[45] Holtkamp GM, Kijlstra A, Peek R, de Vos AF. Retinal pigment epithelium-immune system interactions: cytokine production and cytokine-induced changes. Prog Ret Eye Res 2001 ; 20 : 29-48.
[46] Goureau O, Hicks D, Courtois Y. Human retinal pigmented peithelial cells produce nitric oxide in response to cytokines. Biochem Biophys Res Comm 1994 ; 198 : 120-6.
[47] Abe T, Sugano E, Saigo Y, Tamai M. Interleukin-1 beta and barrier function of retinal pigment epithelial cells (ARPE-19) : aberrant expression of junctional complex molecules. Invest Ophthalmol Vis Sci 2003 ; 44 : 4097-104.
[48] Schubert H. Cystoid macular edema : the apparent role of mechanical factors. Prog Clin Biol Res 1989 ; 312 : 277-91.
[49] Nazari H, Rao N. Longitudinal morphometric analysis of epiretinal membrane in patients with uveitis. Ocul Immunol Inflamm 2013 ; 21 : 2-7.
[50] Snead DR, James S, Snead MP. Pathological changes in the vitreoretinal junction 1: epiretinal membrane formation. Eye (Lond) 2008 ; 22 : 1310-7.
[51] Sheybani A, Harocopos GJ, Rao PK. Immunohistochemical study of epiretinal membranes in patients with uveitis. J Ophthalmol Inflam Infect 2012 ; 2 : 243-8.
[52] Harada C, Mitamura Y, Harada T. The role of cytokines and trophic factors in epiretinal membranes : involvement of signal transduction in glial cells. Prog Retin Eye Res 2006 ; 25 : 149-64.
[53] Theocharis IP. Fibrinogen and rhegmatogenous retinal detachment : a pilot prospective study. Clin Ophthalmol 2010 ; 4 : 73-6.
[54] Wynn TA, Ramalingam TR. Mechanisms of fibrosis : therapeutic translation for fibrotic disease. Nat Med 2012 ; 18 : 1028-40.
[55] Forooghian F, Yeh S, Faia LJ, Nussenblatt RB. Uveitis foveal atrophy. Arch Ophthalmol 2009 ; 127 : 179-86.
[56] Bentley CR, Stanford MR, Shilling JS, et al. Macular ischemia in posterior uveitis. Eye 1993 ; 7 : 411-4.
[57] Kaur C, Sivakumar V, Yong Z, et al. Blood-retinal barrier disruption and ultrastructural changes in the hypoxic retina in adult rats : the beneficial effect of melatonin administration. J Pathol 2007 ; 212 : 429-39.
[58] Da T, Verkman AS. Aquaporin-4 gene disruption in mice protects against impaired retinal function and cell death after ischemia. Invest Ophthalmol Vis Sci 2004 ; 45 : 4477-83.
[59] Rehak M, Hollborn M, Iandiev I, et al. Retinal gene expression and Müller cell responses after branch retinal vein occlusion in the rat. Invest Ophthalmol Vis Sci 2009 ; 50 : 2359-67.
[60] Uckermann O, Kutzera F, Wolf A, et al. The glucocorticoid triamcinolone acetonide inhibits osmotic swelling of retinal glial cells via stimulation of endogenous adenosine signaling. J Pharmacol Exp Ther 2005 ; 315 : 1036-45.
[61] Zhao M, Bousquet E, Valamanesh F, et al. Differential regulations of AQP4 and Kir4.1 by triamcinolone acetonide and dexamethasone in the healthy and inflamed retina. Invest Ophthalmol Vis Sci 2011 ; 52 : 6340-7.
[62] Reichenbach A, Bringmann A. Müller cells in the diseased retina. Müller cells in the heatlhy and diseased retina. Heidelberg : Springer ; 2010, p. 215-301.
[63] Yanoff M, Fine BS, Brucker AJ, Eagle RC, Jr. Pathology of human cystoid macular edema. Surv Ophthalmol 1984 ; 28 : 505-11.
[64] Pelitli Gürlü V, Alimgil ML, Esgin H. Fluorescein angiographic findings in cases with ntermediate uveitis in the inactive phase. Can J Ophthalmol 2007 ; 42 : 107-9.
[65] Wolter JR. The histopathology of cystoid macular edema. Arch Clin Exp Ophthalmol 1981 ; 216 : 85-101.
[66] Pelosini L, Hull CC, Boyce JF, et al. Optical coherence tomography may be used to predict visual acuity in patients with macular edema. Invest Ophthalmol Vis Sci 2011 ; 52 : 2741-8.
E. Champion, N. Massamba, C. Fardeau, P. LeHoang, B. Bodaghi
➤ L’OM peut compliquer les uvéites antérieures, intermédiaires ou postérieures, qui relèvent d’étiologies très diverses, infectieuses ou auto-immunes. La rupture des BHR interne ou externe contribue à la genèse de l’OM inflammatoire.
➤ Le diagnostic est avant tout clinique et nécessite l’examen minutieux de toutes les structures oculaires afin de réaliser le bilan d’extension et d’orienter l’analyse étiologique de l’œdème. Il sera confirmé par la tomographie en cohérence optique qui s’est imposée par ses qualités d’examen non invasif, reproductible et sensible, notamment dans cette indication.
➤ L’angiographie rétinienne à la fluorescéine complétée par l’infracyanine permet, en plus de l’analyse maculaire, le dépistage des vasculites associées, leur éventuel caractère occlusif, le diagnostic d’une papillite associée, de granulomes choroïdiens, de complications néovasculaires prérétiniennes, prépapillaires ou choroïdiennes. Elle fournit des arguments étiologiques et peut être nécessaire pour apprécier la réponse thérapeutique.
➤ Le traitement de l’OM inflammatoire relève de traitements spécifiques en cas d’étiologies infectieuses qui pourraient nécessiter l’adjonction d’anti-inflammatoire en cas de persistance de l’OM.
➤ Il est important de dépister précocement cette complication car elle grève fortement le pronostic visuel. Sa prise en charge précoce a pour but d’éviter le passage à la chronicité de l’œdème, dont le pronostic fonctionnel après plusieurs mois d’évolution est médiocre.
L’OM est un épaississement rétinien dans l’aire maculaire par rupture des BHR interne et/ou externe. Le liquide extracellulaire s’accumule en logettes intrarétiniennes ou dans l’espace sous-rétinien. Les médiateurs pro-inflammatoires jouent un rôle majeur dans l’apparition de l’œdème [1].
L’OM inflammatoire peut compliquer les uvéites antérieures, intermédiaires ou postérieures ou a fortiori totales (fig. 10-8). Celles-ci relèvent d’étiologies très variées, infectieuses, auto-immunes ou demeurent idiopathiques malgré des bilans extensifs [2–4]. La prévalence de l’OM uvéitique a été évaluée à 33 % sur au moins un œil d’une cohorte de 529 patients [5]. Les panuvéites et les uvéites intermédiaires sont les plus pourvoyeuses d’OM avec la présence de cette complication dans 66 et 65 % des cas respectivement ; viennent ensuite la sarcoïdose, la rétinochoroïdopathie de Birdshot, la sclérose en plaques, les rétinites herpétiques, la maladie de Behçet [6] et l’arthrite juvénile idiopathique [3, 5, 7]. Les infections peuvent également se compliquer d’OM soit lors de la phase réplicative, soit en rapport avec un phénomène auto-immun secondaire [8].
L’OM est un facteur majeur de baisse d’acuité visuelle au cours des uvéites [2, 9, 10]. Au cours des formes postérieures, 45 % des patients ont une baisse d’acuité visuelle et 28 % d’entre eux un OM [9]. En présence d’OM, le pronostic visuel dépend, notamment, de l’atteinte des couches externes rétiniennes, de son ancienneté ainsi que du type et de l’étiologie de l’uvéite. En effet, une acuité visuelle basse inférieure à 0,3 a été retrouvée chez 64 % des patients atteints de panuvéite et rapportée à l’OM dans 59 % des yeux. En revanche, une telle baisse de vision n’était retrouvée que dans 28 % des cas d’uvéite intermédiaire, et rattachée à l’OM dans 85 % des yeux [9].
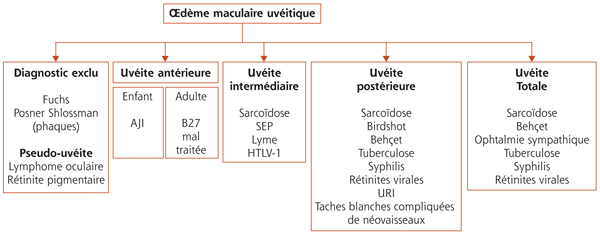
Fig. 10-8 Algorithme diagnostique de l’œdème maculaire uvéitique en fonction du type anatomique.
AJI : arthrite juvénile idiopathique ; HTLV : human T-lymphotropic virus ; SEP : sclérose en plaques ; URI : uvéite de reconstitution immune.
Le bilan étiologique est tout d’abord clinique, en commençant par un interrogatoire précis qu’il convient de renouveler régulièrement au cours du suivi afin d’orienter la recherche d’une affection systémique associée (tableau 10-3).
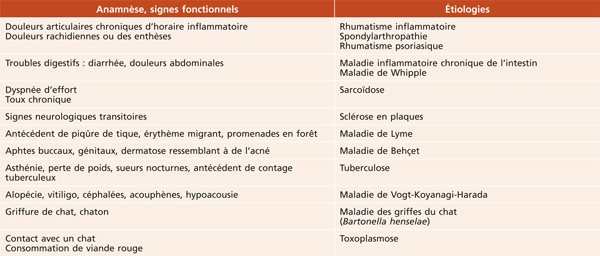
Tableau 10-3 Orientation étiologique en fonction des signes fonctionnels systémiques.
L’anamnèse retrouve fréquemment une baisse d’acuité visuelle d’abord sensible en vision de près. Un syndrome maculaire peut y être associé à type de micropsies, métamorphopsies et scotome relatif positif. La baisse d’acuité visuelle est très variable. En cas de chronicité, une dégénérescence de la rétine externe peut entraîner de lourdes séquelles visuelles. Lorsqu’elle s’accompagne d’une ischémie maculaire aiguë, comme au cours de la maladie de Behçet, la baisse d’acuité visuelle peut rester définitive malgré un traitement approprié effectué en urgence.
Les autres signes fonctionnels de l’uvéite à rechercher sont une douleur avec photophobie, une rougeur avec cercle périkératique et des myodésopsies. Cependant, l’atteinte antérieure est relativement rare chez les patients atteints d’OM, même si les uvéites rhumatismales de l’adulte et de l’enfant peuvent se compliquer ainsi, et tout particulièrement en cas de retard ou d’insuffisance thérapeutique [11, 12].
Le bilan clinique des signes inflammatoires est primordial et résumé dans le tableau 10-4.
À l’examen, on recherchera des signes d’uvéite antérieure : Tyndall cellulaire et protéique (intérêt du tyndallomètre laser pour le quantifier), précipités rétrocornéens et synéchies iridocristalliniennes.
En cas d’uvéite intermédiaire ou postérieure, on recherchera une hyalite, dont le grade sera côté selon les critères du SUN (Standardization Uveitis Nomenclature) [13, 14], des œufs de fourmis ou banquises, des vascularites rétiniennes veineuses et/ou artérielles, un œdème papillaire. L’œdème peut être visible au fond d’œil par une perte du reflet fovéolaire, la visualisation des logettes intrarétiniennes en cas de volumineux OM ou d’un décollement séreux rétinien (DSR) associé. Toutefois, la hyalite et/ou l’inflammation antérieure rendent souvent l’examen précis de la macula délicat.
On recherchera également les autres complications fréquentes de l’uvéite telles que la cataracte et le glaucome. Plus rarement, l’examen clinique retrouvera des hémorragies liées à des altérations vasculaires ou une néovascularisation rétinienne ou choroïdienne.
Devant toute uvéite ou toute suspicion d’un œdème maculaire inflammatoire, il est important de réaliser un OCT maculaire de type spectral domain (SD-OCT) pour identifier un œdème infraclinique ou confirmer un œdème clinique. L’examen permettra d’en préciser son type, son importance, son étendue et sa localisation par rapport à la fovéa. Il peut exister différents types d’œdèmes maculaires au cours des uvéites qui peuvent plus ou moins coexister :
-
épaississement périfovéal (sans fluide) ;
-
épaississement maculaire diffus (sans fluide) ;
-
œdème intrarétinien caractérisé par la présence de fluide dans les couches internes de la rétine soit dans la zone fovéale, soit à distance de la fovéa ;
-
décollement séreux rétinien ;
-
œdème maculaire cystoïde.
L’œdème périfovéolaire caractérisé par un épaississement isolé ou associé à la présence de fluide, n’entraîne ni baisse d’acuité visuelle (BAV) ni syndrome maculaire. Cet œdème périfovéolaire, sans fluide, n’est visible en OCT que sur la cartographie, avec un épaississement de la première et/ou deuxième couronne péricentrale, et par une diffusion périmaculaire sur l’angiographie à la fluorescéine. Il est synonyme, le plus souvent, d’une inflammation chronique active pouvant évoluer vers un œdème central ou l’apparition d’une membrane épirétinienne (MER) secondaire. L’imagerie par angiographie complétera l’OCT pour préciser les signes associés (vasculite, papillite, etc.) pouvant orienter la recherche étiologique [15, 16]. Il sera enfin capital de rechercher des arguments en faveur d’un œdème ischémique ou d’une dégénérescence maculaire œdémateuse qui guideront le traitement.
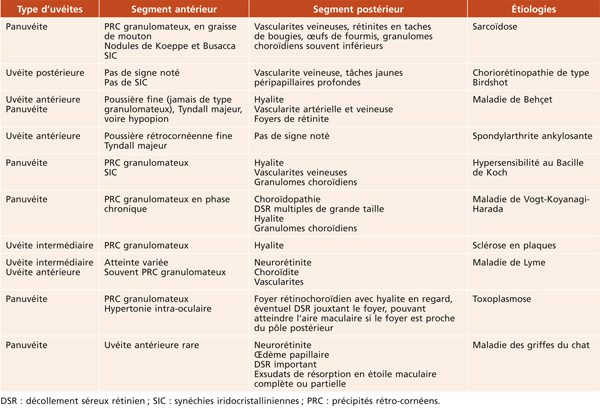
Tableau 10-4 Orientation étiologique en fonction de l’atteinte oculaire.
Un œdème associé à une uvéite peut avoir de multiples mécanismes.
L’œdème maculaire inflammatoire peut être associé à des vasculites rétiniennes veineuses dont les principales étiologies sont :
-
dysimmunité systémique : sarcoïdose (granulomatose systémique ; fig. 10-9 et 10-10) [17, 18], maladie de Behçet (vascularite systémique ; fig. 10-11), sclérose en plaques, collagénoses (lupus érythémateux disséminé, sclérodermie, polychondrite atrophiante), connectivite avec vascularite nécrosante (granulomatose avec polyangéite, périartérite noueuse) ;
-
dysimmunité oculaire : choriorétinopathie de type Birdshot (fig. 10-12 et 10-13), uvéite intermédiaire, pars planite, choroïdite multifocale, ophtalmie sympathique, syndrome d’Irvine-Gass ;
-
infections : virales (en particulier Herpes virus), bactériennes, parasitaires ou mycotiques. Il faut noter que les infections aiguës sont rarement responsables d’OM franc mais l’utilisation de l’OCT a permis de mettre en évidence des logettes œdémateuses au cours de certaines affections parasitaires comme la toxoplasmose [19] ;
-
idiopathiques (pas de cause retrouvée et aucune atteinte extra-oculaire).
L’œdème maculaire associé à une vasculite artérielle fait évoquer des étiologies particulières et plus rares comme les connectivites, le syndrome d’IRVAN (idiopathic retinitis, vasculitis, aneurysms and neuroretinitis) ou plus rarement la maladie de Behçet ou le syndrome de Susac. Il est intéressant de noter que le vitré est souvent calme dans cette situation.
L’OM inflammatoire peut être secondaire à une sclérite, une choroïdite ou des atteintes aiguës de la choriocapillaire par rupture de la BHR externe. Il peut être associé à une sclérite postérieure dont les principales étiologies sont : des vasculites systémiques (granulomatose avec polyangéite, polyarthrite rhumatoïde, maladie de Behçet, périartérite noueuse), certaines connectivites (polychondrite atrophiante, lupus), des spondylarthropathies et les maladies inflammatoires chroniques de l’intestin (MICI) en particulier la maladie de Crohn. La sclérite peut être également secondaire à la sarcoïdose ou liée à une infection herpétique, tuberculeuse ou par spirochètes (syphilis, maladie de Lyme) [20, 21].
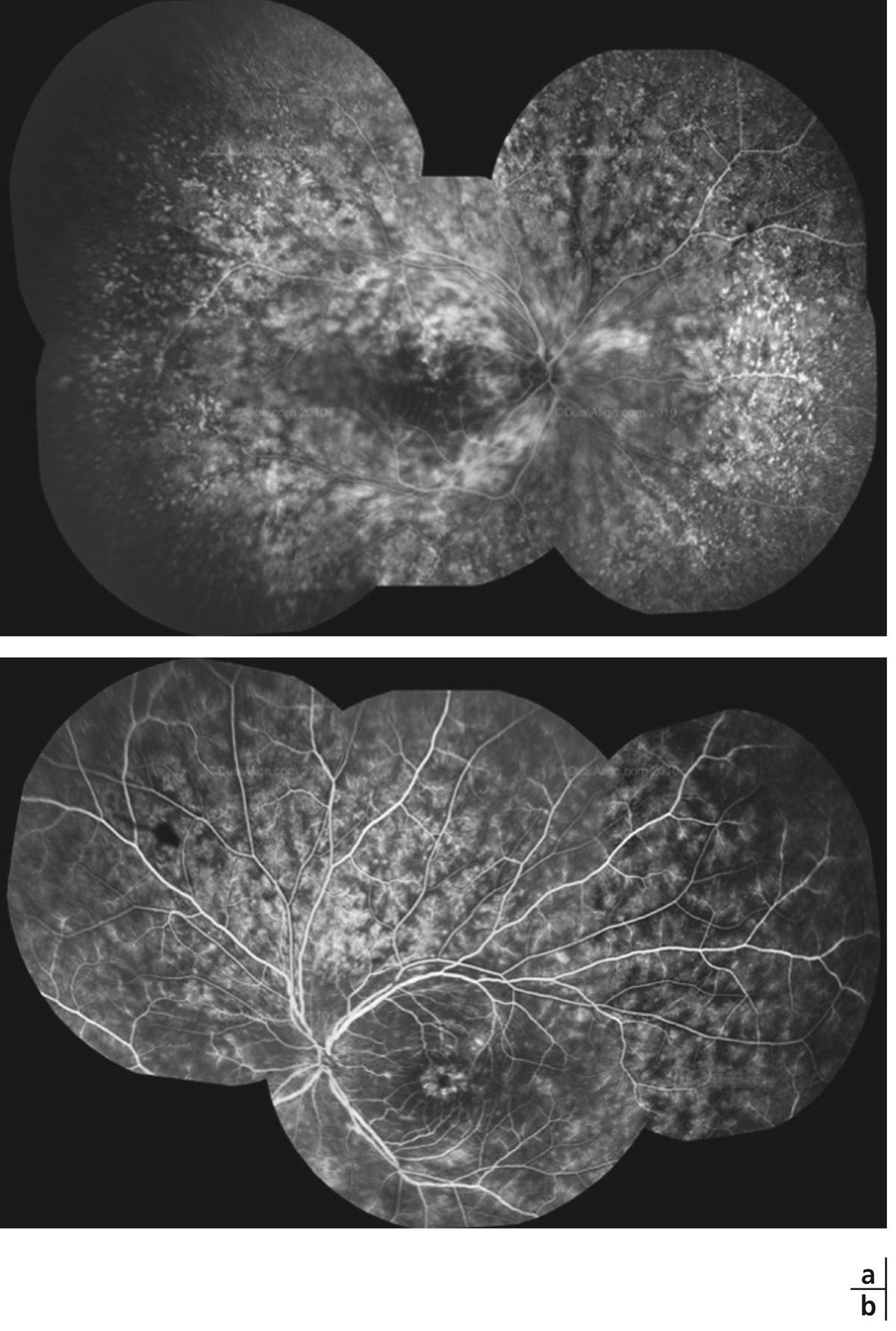
Fig. 10-9 Angiographie à la fluorescéine OD (a) et OG (b) montrant une choriocapillaropathie associée à un œdème maculaire au cours d’une sarcoïdose.
Noter la présence de lésions périphériques atrophiques dans l’œil droit (a).
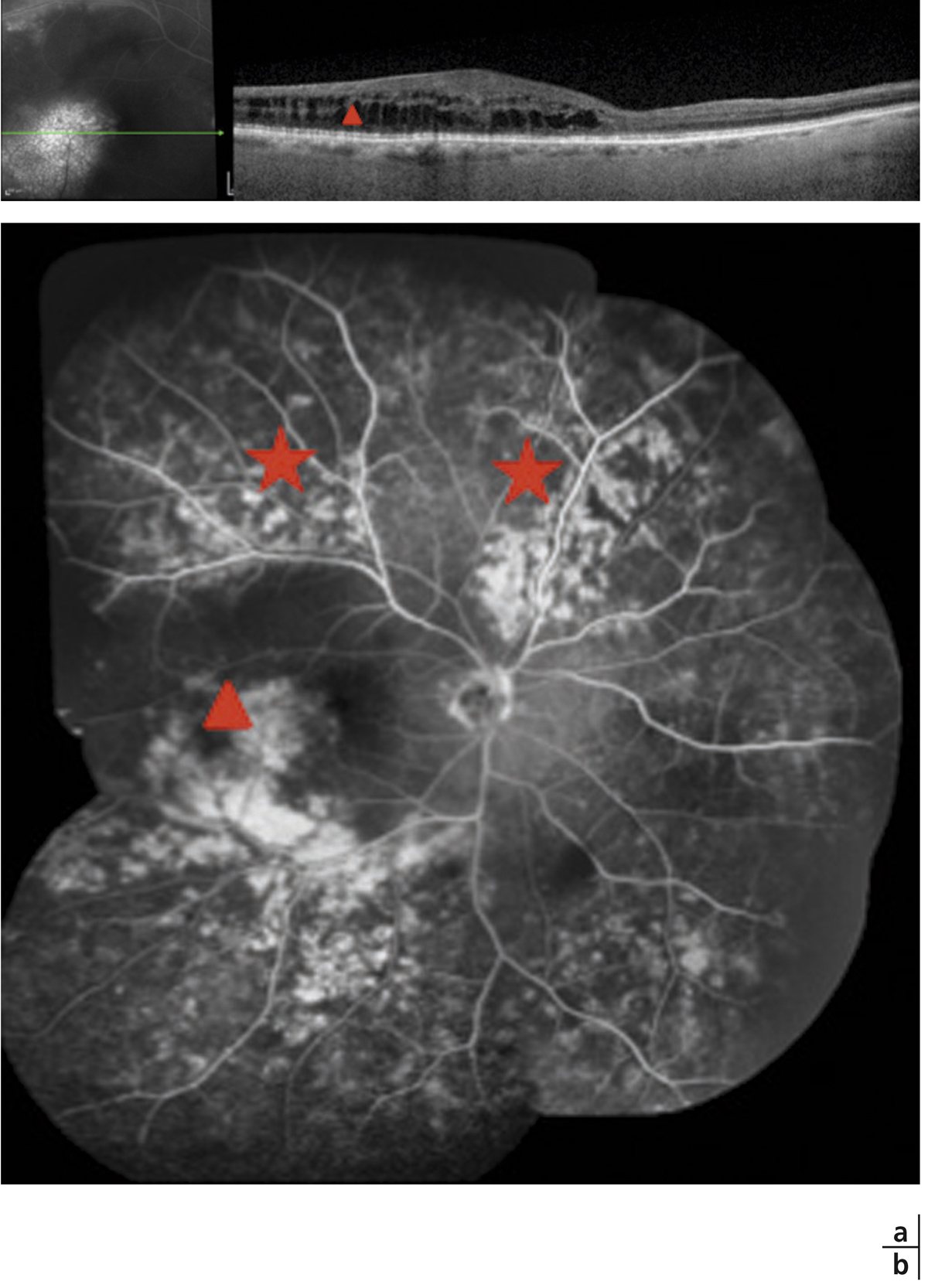
Fig. 10-10 Patiente atteinte de choroïdopathie sarcoïdosique.
a. SD-OCT : logettes dans la rétine interne et externe parafovéolaire (temporomaculaire ; tête de flèche) associées à un amincissement de la rétine nasale et de l’épaisseur choroïdienne. b. Séquence tardive de l’angiographie à la fluorescéine : diffusion inhomogène parafovéolaire (temporomaculaire ; tête de flèche) associée à une capillaropathie diffuse (étoile).
Fig. 10-11 Maladie de Behçet avec atteinte postérieure prédominante.
a. Rétinophotographie en couleurs de l’OG montrant des lésions nécrotico-hémorragiques de petite taille au niveau du pôle postérieur. Noter la présence d’une hyalite dense. b-d. Séquence angiographique avec temps précoces, intermédiaires et tardifs dévoilant une choriocapillaropathie diffuse associée aux lésions de rétinite et un OMC.
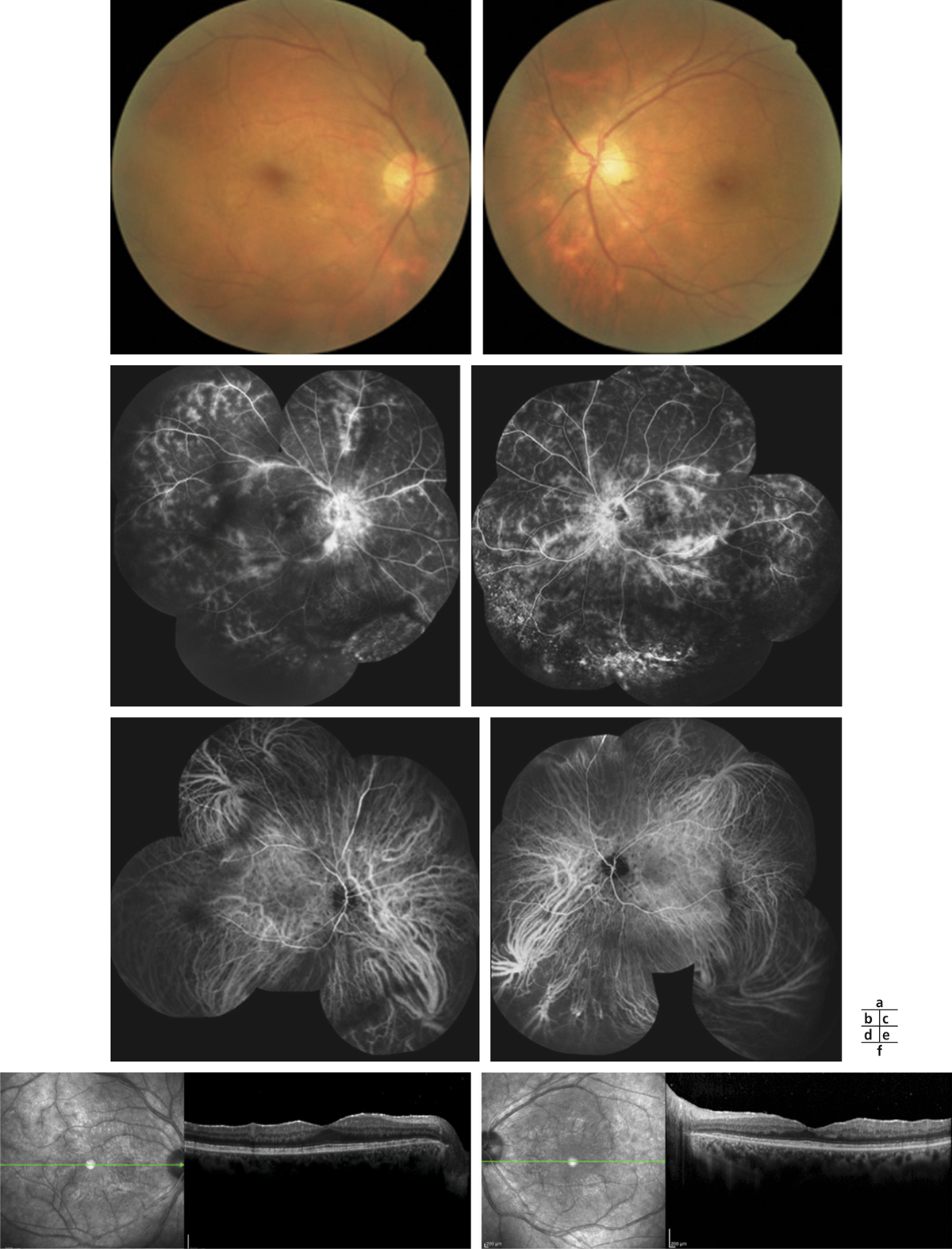
Fig. 10-12 Rétinochoroïdopathie de type Birdshot.
a. Rétinophotographies en couleurs (OD et OG). Les taches périnasales sont surtout visibles au niveau de l’OG. Angiographie à la fluorescéine (b, c) et au vert d’indocyanine (d, e) (OD et OG) démontrant la discordance entre l’atteinte rétinienne sévère majeure et l’atteinte choroïdienne plus modérée et limitée. f. SD-OCT mettant en évidence un épaississement rétinien diffus non cystoïde, faussement rassurant.
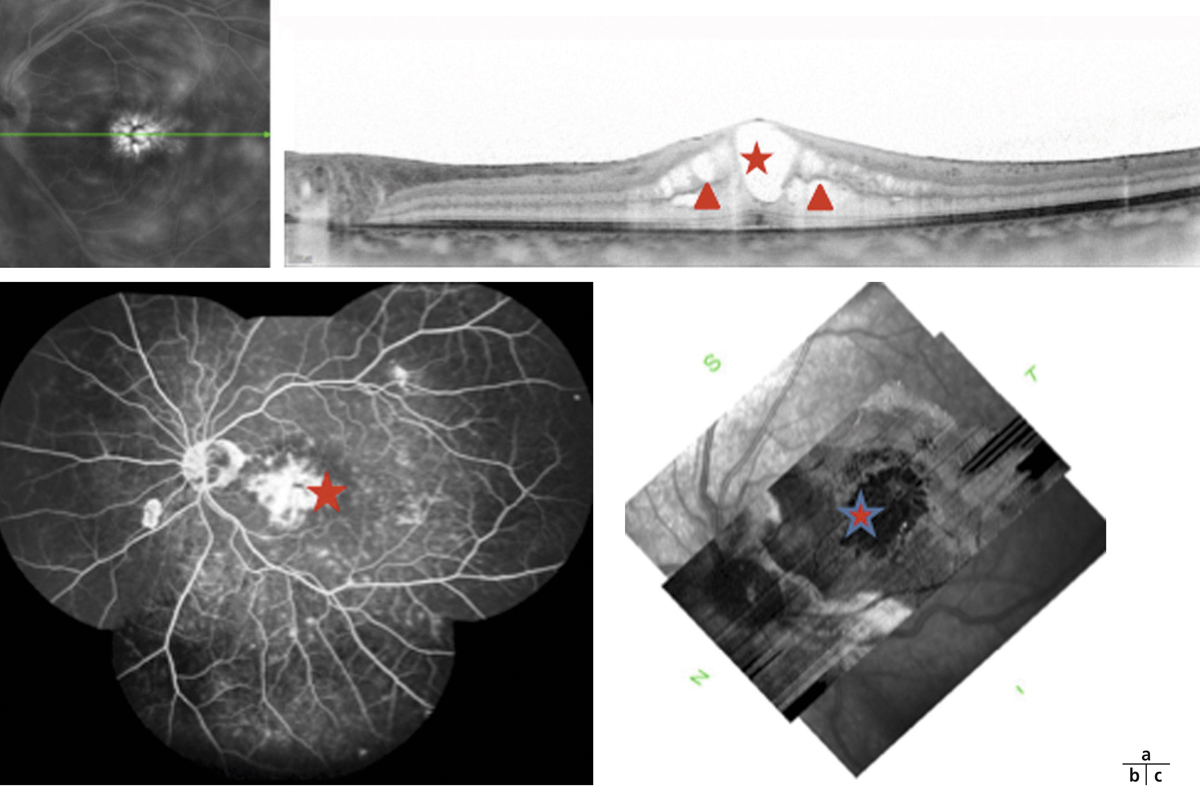
Fig. 10-13 Rétinochoroïdopathie de type Birdshot.
a. SD-OCT : OMC avec logettes dans la rétine interne et externe (têtes de flèche) et logette centrale (étoile). b. Séquence tardive de l’angiographie à la fluorescéine : diffusion inhomogène rétrofovéolaire (étoile) avec vascularite associée. c. OCT « en face » (C-SCAN) : coupe frontale montrant de nombreuses cavités pétaloïdes (étoile) dans la rétine interne témoin de logettes maculaires cystoïdes.
C’est une complication de certaines choroïdites : choroïdite multifocale, choroïdite ponctuée interne (punctual internal choroidite [PIC]), serpigineuse et rétinochoroïdites (sarcoïdose, tuberculose). Elle peut compliquer toute cicatrice rétinienne atrophique.
On recherchera au fond d’œil le néovaisseau grisâtre, une hémorragie rétinienne, un DSR, plus rarement un décollement de l’épithélium pigmentaire (DEP).
Le diagnostic sera posé par l’OCT maculaire et l’angiographie à la fluorescéine (néovaisseau de type visible dans la grande majorité des cas) ou l’angio-OCT.
Un œdème tractionnel sera évoqué devant un OMC associé à une MER ou à une traction vitréomaculaire (TVM), qui persiste ou s’aggrave après contrôle de l’inflammation. Le fond d’œil et surtout l’analyse OCT permettent de visualiser la MER ou la TVM. La chirurgie sera discutée après un contrôle strict de l’inflammation et selon la gêne visuelle. Toute dérogation à cette règle expose au risque d’échec de la procédure chirurgicale.
L’OMC postopératoire est plus fréquent lors des uvéites (12 %). L’usage d’une corticothérapie périopératoire diminue la survenue d’OMC, ainsi que le bon contrôle préopératoire (au moins 3 mois avant) de l’inflammation [22].
L’apparition d’un DSR uni- ou bilatéral fera toujours évoquer une choriorétinopathie séreuse centrale (CRSC) lors d’un traitement par corticothérapie. L’OCT retrouve une bulle de DSR associée à un DEP de plus petite taille. Le diagnostic sera confirmé par l’angiographie à la fluorescéine qui retrouvera un ou plusieurs points de fuite et l’angio-OCT éliminera un néovaisseau choroïdien. Dans ce cas, la corticothérapie doit être réduite au minimum, voire arrêtée si possible (selon l’importance et la gravité respectives de l’inflammation et de la CRSC) [23].
L’œdème papillaire est la conséquence d’une exsudation majeure au niveau de la papille. L’examen du fond d’œil retrouvera un œdème papillaire important avec bulle de DSR interpapillomaculaire. Une « demi-étoile maculaire » peut être visible en cas d’hypertension intracrânienne, par exemple au cours d’un neuro-Behçet. Un bilan de l’œdème papillaire devra être effectué (hypertension intracrânienne, hypertension artérielle maligne).
Certaines drogues comme les agents biologiques ou les anticancéreux pourraient être associés à des OM [24]. Il faudra différencier ces complications des syndromes paranéoplasiques pouvant toucher le segment postérieur.
Le bilan paraclinique devant un OM inflammatoire doit être large mais néanmoins ciblé.
On réalisera de façon systématique :
-
numération formule sanguine (NFS), ionogramme sanguin ;
-
enzyme de conversion de l’angiotensine, lyzozyme ;
-
HLA B27 en cas d’atteinte non granulomateuse uniquement ;
-
quantiféron, intradermoréaction à la tuberculine ;
-
treponema pallidum haemagglutinations assay – venereal disease research laboratory (TPHA-VDRL) ;
-
radiographie thoracique complétée si besoin par une tomodensitométrie.
On réalisera en fonction des orientations :
-
imagerie par résonance magnétique (IRM) cérébrale : en cas de suspicion de sclérose en plaques (SEP), lymphome vitréorétinien primitif, neurosarcoïdose, Behçet ;
-
biopsie des glandes salivaires accessoires : sarcoïdose ;
-
épreuves fonctionnelles respiratoires (EFR) : sarcoïdose ;
-
fibroscopie bronchique et lavage bronchioloalvéolaire (LBA) : sarcoïdose avec scanner anormal ;
-
ponction de chambre antérieure (PCA) en cas de suspicion d’atteinte virale, parasitologique, bactériologique ou de lymphome oculaire (IL-10) ;
-
radiographie du rachis, du bassin voire IRM des articulations sacro-iliaques si doute sur une atteinte rhumatismale.
L’état de perméabilité des barrières hémato-oculaires est très bien reflété par l’humeur aqueuse et se traduit par la présence de cellules et de protéines en cas de rupture des barrières. Les cellules apparaissent à l’examen à la lampe à fente comme des corps brillants dans le faisceau lumineux, alors que les protéines sont responsables de l’effet Tyndall décrit par Tyndall en 1869, correspondant à une traînée opalescente. La quantité et la taille des protéines contenues dans l’humeur aqueuse sont directement proportionnelles à l’importance de la rupture des barrières hémato-oculaires. L’évaluation par l’œil humain en donne une évaluation subjective et qualitative, alors que la photométrie automatisée du Tyndall permet de donner une mesure objective et quantitative de l’inflammation intra-oculaire depuis 1988.
Le principe physique du tyndallomètre laser est l’évaluation du niveau de rupture de la barrière hémato-aqueuse à l’aide d’un faisceau de laser hélium-néon (He-Ne) projeté au niveau de la chambre antérieure. Le rayon peut être réfléchi et détecté par un photomultiplicateur après déviation par des particules protéiques (moins précisément des cellules inflammatoires). L’ensemble est transmis à un ordinateur qui évaluera le niveau d’inflammation protéique qui sera exprimé en photons/milliseconde. Cet outil non invasif existe depuis près d’une trentaine d’années. Il permet d’obtenir des indications précises, objectives, reproductibles et quantitatives. Une mesure du flare par le tyndallomètre laser est utile en cas d’atteinte antérieure (uvéite antérieure ou panuvéite) afin de surveiller l’efficacité du traitement.
La corrélation entre le flare et l’épaisseur maculaire n’est pas constante. Un flare normal n’élimine pas la survenue éventuelle d’un OMC, notamment en cas d’uvéite postérieure isolée [25]. Dans certaines pathologies, comme la spondylarthrite ou l’arthrite juvénile idiopathique, un bon contrôle de l’inflammation avec un flare normalisé permettra souvent de prévenir la formation d’un OMC [11, 12, 26]. Des données ont été publiées concernant la maladie de Behçet et la surveillance oculaire au tyndallomètre laser [27, 28].
[1] van Kooij B, Rothova A, Rijkers GT, de Groot-Mijnes JD. Distinct cytokine and chemokine profiles in the aqueous of patients with uveitis and cystoid macular edema. Am J Ophthalmol 2006 ; 142 : 192-4.
[2] de Smet MD, Taylor SR, Bodaghi B et al. Understanding uveitis : the impact of research on visual outcomes. Prog Retin Eye Res 2011 ; 30 : 452-70.
[3] Bodaghi B, Cassoux N, Wechsler B, et al. Chronic severe uveitis : etiology and visual outcome in 927 patients from a single center. Medicine (Baltimore) 2001 ; 80 : 263-70.
[4] Fardeau C, Champion E, Massamba N, LeHoang P. Uveitic macular edema. J Fr Ophtalmol. 2015 ; 38 : 74-81.
[5] Lardenoye CW, van Kooij B, Rothova A. Impact of macular edema on visual acuity in uveitis. Ophthalmology 2006 ; 113 : 1446-9.
[6] Zeghidi H, Saadoun D, Bodaghi B. Ocular manifestations in Behcet’s disease. Rev Med Interne 2014 ; 35 : 97-102.
[7] Hildebrandt AL, Mackensen F. Uveitis in multiple sclerosis : overview and perspectives. Ophthalmologe 2014 ; 111 : 733-9.
[8] Schrier RD, Song MK, Smith IL, et al. Intraocular viral and immune pathogenesis of immune recovery uveitis in patients with healed cytomegalovirus retinitis. Retina 2006 ; 26 : 165-9.
[9] Rothova A, Suttorp-van Schulten MS, Frits Treffers W, Kijlstra A. Causes and frequency of blindness in patients with intraocular inflammatory disease. Br J Ophthalmol 1996 ; 80 : 332-6.
[10] Levin MH, Pistilli M, Daniel E, et al. Incidence of visual improvement in uveitis cases with visual impairment caused by macular edema. Ophthalmology 2014 ; 121 : 588-95.
[11] Liang F, Terrada C, Ducos de Lahitte G, et al. Foveal serous retinal detachment in juvenile idiopathic arthritis-associated uveitis. Ocul Immunol Inflamm 2015 ; 19 : 1-6.
[12] Uy HS, Christen WG, Foster CS. HLA-B27-associated uveitis and cystoid macular edema. Ocul Immunol Inflamm 2001 ; 9 : 177-83.
[13] Jabs DA, Nussenblatt RB, Rosenbaum JT. Standardization of uveitis nomenclature for reporting clinical data. Results of the First International Workshop. Am J Ophthalmol 2005 ; 140 : 509-16.
[14] Trusko B, Thorne J, Jabs D, et al. The Standardization of Uveitis Nomenclature (SUN) Project. Development of a clinical evidence base utilizing informatics tools and techniques. Methods Inf Med 2013 ; 52 : 259-65, S1-6.
[15] Tugal-Tutkun I, Herbort CP, Khairallah M. Scoring of dual fluorescein and ICG inflammatory angiographic signs for the grading of posterior segment inflammation (dual fluorescein and ICG angiographic scoring system for uveitis). Int Ophthalmol 2010 ; 30 : 539-52.
[16] Kempen JH, Sugar EA, Jaffe GJ, et al. Fluorescein angiography versus optical coherence tomography for diagnosis of uveitic macular edema. Ophthalmology 2013 ; 120 : 1852-9.
[17] Herbort CP, Rao NA, Mochizuki M, et al. International criteria for the diagnosis of ocular sarcoidosis : results of the first International Workshop On Ocular Sarcoidosis (IWOS). Ocul Immunol Inflamm 2009 ; 17 : 160-9.
[18] Jamilloux Y, Kodjikian L, Broussolle C, Seve P. Sarcoidosis and uveitis. Autoimmun Rev 2014 ; 13 : 840-9.
[19] Ouyang Y, Pleyer U, Shao Q, et al. Evaluation of cystoid change phenotypes in ocular toxoplasmosis using optical coherence tomography. PLoS One 2014 ; 9 : e86626.
[20] Hodson KL, Galor A, Karp CL, et al. Epidemiology and visual outcomes in patients with infectious scleritis. Cornea 2013 ; 32 : 466-72.
[21] Pavesio CE, Meier FM. Systemic disorders associated with episcleritis and scleritis. Curr Opin Ophthalmol 2001 ; 12 : 471-8.
[22] Belair ML, Kim SJ, Thorne JE, et al. Incidence of cystoid macular edema after cataract surgery in patients with and without uveitis using optical coherence tomography. Am J Ophthalmol 2009 ; 148 : 128-135.e122.
[23] Khairallah M, Kahloun R, Tugal-Tutkun I. Central serous chorioretinopathy, corticosteroids, and uveitis. Ocul Immunol Inflamm 2012 ; 20 : 76-85.
[24] Guedj M, Queant A, Funck-Brentano E, et al. Uveitis in patients with late-stage cutaneous melanoma treated with vemurafenib. JAMA Ophthalmol 2014 ; 132 : 1421-5.
[25] Akduman L. Can we be more objective in determining the response to treatment in uveitis patients aside from recording anterior chamber reaction ? Ocul Immunol Inflamm 2009 ; 17 : 265-6.
[26] Balaskas K, Ballabeni P, Guex-Crosier Y. Retinal thickening in HLA-B27-associated acute anterior uveitis : evolution with time and association with severity of inflammatory activity. Invest Ophthalmol Vis Sci 2012 ; 53 : 6171-7.
[27] Tugal-Tutkun I, Cingu K, Kir N, et al. Use of laser flare-cell photometry to quantify intraocular inflammation in patients with Behcet uveitis. Graefes Arch Clin Exp Ophthalmol 2008 ; 246 : 1169-77.
[28] Yang P, Fang W, Huang X, et al. Alterations of aqueous flare and cells detected by laser flare-cell photometry in patients with Behcet’s disease. Int Ophthalmol 2010 ; 30 : 485-9.
M.-B. Rougier
La place de la photographie en couleurs dans la gestion d’un OM est ambiguë. En effet, elle est à la fois utile et inutile.
Elle est utile car elle permet de garder en mémoire, et de localiser par rapport à la macula, tous les signes d’accompagnement de l’OM : hémorragies, exsudats, vascularites, taches et foyers. De plus, l’analyse d’une photographie en couleurs permet bien souvent de mettre en évidence des lésions non vues lors de l’examen du fond d’œil. En effet, l’acquisition d’une photographie ne prend qu’une seconde et peut s’examiner aussi longtemps que nécessaire, alors qu’un examen du fond d’œil, plus long et inconfortable pour le patient, ne permet pas toujours une analyse fine. Ceci est particulièrement vrai dans les cas de syndrome des taches blanches ou de rétinochoroïdite de Birdshot (voir aussi fig. 10-3, 10-12 et 10-13). De plus, la numérisation permet également un traitement de l’image qui enrichit les données et facilite le suivi du patient (grossissement, mesures). Les photographies en couleurs permettent toutefois un suivi précieux de l’aspect du fond d’œil tant pour évaluer les séquelles (fig. 10-14) qu’identifier d’éventuelles complications (fig. 10-15).
Elle est inutile car depuis l’utilisation de l’OCT, le diagnostic de l’OM repose presque exclusivement sur cet examen. Une étude récente a d’ailleurs montré combien l’utilisation des photographies en couleurs (ainsi que de l’angiographie à la fluorescéine) a considérablement diminué durant ces dix dernières années [1]. L’un des signes les plus caractéristiques est la disparition de la photographie en couleurs en stéréo dans les critères d’analyse des études multicentriques.
[1] Schneider EW, Mruthyunjaya P, Talwar N, et al. Reduced fluorescein angiography and fundus photography use in the management of neovascular macular degeneration and macular edema during the past decade. Invest Ophthalmol Vis Sci 2014 ; 55 : 542-9.
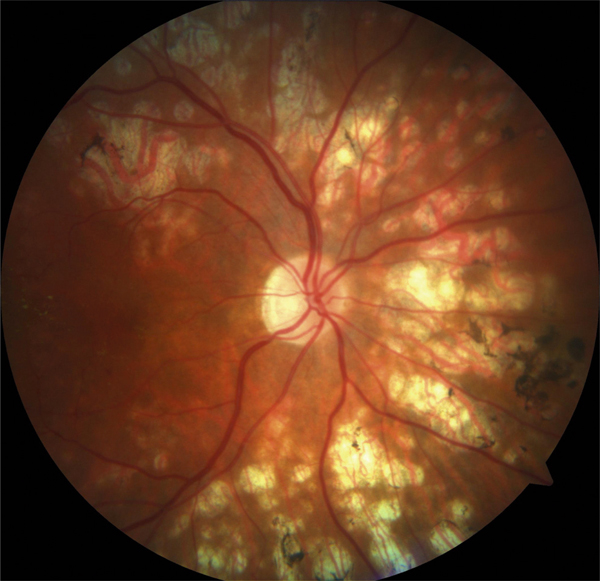
Fig. 10-14 Multiples zones d’atrophie séquellaires d’une maladie de Birdshot.
(Remerciements au Dr A. Bron.)
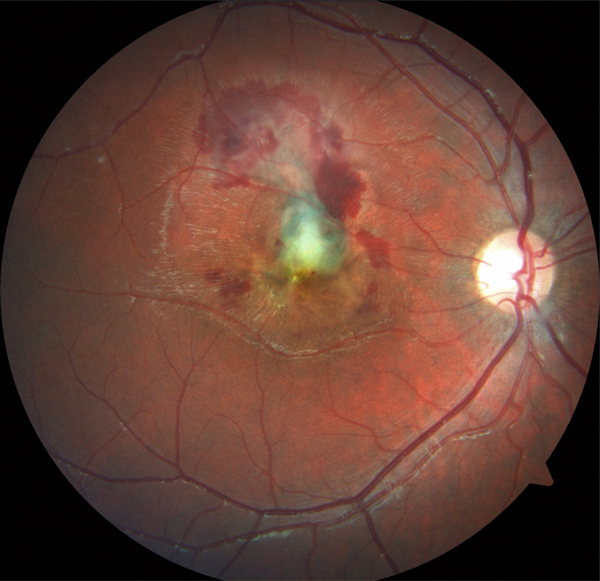
Fig. 10-15 Néovaisseau développé à partir d’une cicatrice de toxoplasmose rétrofovéolaire.
On identifie bien les hémorragies sous-rétiniennes ainsi que l’œdème et le décollement séreux associé à la complication néovasculaire.
(Remerciements au Dr A. Bron.)
J.-B. Ducloyer, M. Weber
➤ L’angiographie à la fluorescéine (AF) permet d’appréhender l’ensemble des éléments qui caractérisent une uvéite : vascularite, capillarite, papillite, rétinite, choriorétinite, choroïdite. Elle a un rôle essentiel pour démasquer des atteintes infracliniques.
➤ L’AF est utile pour le diagnostic étiologique des uvéites et la gestion thérapeutique au cours du suivi.
➤ L’AF permet également de visualiser la diffusion des capillaires fovéolaires à l’origine des OM.
➤ La corrélation entre l’importance de la diffusion de l’AF des capillaires fovéolaires, l’importance de l’épaississement maculaire et de la baisse d’acuité visuelle est bonne si les diffusions angiographiques sont marquées.
➤ À l’inverse, l’AF peut méconnaître un OM débutant et ne donne pas autant d’informations qualitatives et quantitatives que la tomographie en cohérence optique (SD-OCT).
L’angiographie à la fluorescéine (AF) est un outil incontournable dans l’évaluation et la gestion des uvéites du segment postérieur à l’origine d’œdèmes inflammatoires. Elle s’avère utile pour le diagnostic positif des vascularites, papillites, choriorétinites et des capillaropathies parfois à l’origine d’OM, et pour éventuellement orienter le diagnostic étiologique.
La molécule de fluorescéine non liée est très petite et diffuse à travers les parois des vaisseaux, même les plus petits et les moins inflammatoires. Cette particularité confère à l’AF une forte sensibilité pour mettre en évidence une inflammation rétinienne ; ce n’est pas le cas de l’angiographie au vert d’indocyanine (indocyanine green [ICG]) où 98 % du colorant forme un complexe macromoléculaire avec les protéines intravasculaires qui ne diffusent pas à travers les parois vasculaires. Cette diffusion vasculaire sera particulièrement intéressante à rechercher devant tout tableau d’uvéite intermédiaire ou postérieure, sans atteinte vasculaire clinique visible, pour mettre en évidence une vascularite infraclinique. L’AF sera également indiquée devant tout tableau d’œdème apparaissant dans les suites d’une chirurgie, réfractaire au traitement de première intention (acétazolamide + collyre anti-inflammatoire non stéroïdien ± anti-inflammatoire stéroïdien), pour vérifier l’absence de vascularite infraclinique et ainsi l’absence d’uvéite.
L’OMC est la cause la plus fréquente de baisse d’acuité visuelle chez les patients atteints d’uvéite. Il peut être détecté par l’examen biomicroscopique mais l’AF et l’OCT sont bien supérieurs pour sa détection, son évaluation quantitative, sa caractérisation et son suivi.
L’OMC est secondaire à la diffusion à partir des capillaires de l’aire maculaire, objectivée par la diffusion de colorant en AF. L’aspect d’OMC à l’AF inclut les dilatations des capillaires périfovéolaires avec diffusion progressive et accumulation de colorant dans des espaces cystoïdes au niveau de la fovéa. Il s’y associe souvent une diffusion au niveau de la papille. L’aspect « pétaloïde » de l’hyperfluorescence maculaire est lié à l’anatomie particulière de la rétine périfovéolaire. En effet, les couches internes de la rétine sont absentes de l’aire fovéolaire. Les cellules présentes (photorécepteurs, cellules bipolaires et cellules de Müller) sont orientées plus horizontalement dans le plan de la rétine et s’étendent de façon radiaire autour du centre de la fovéola. Le fluide en excès se collecte dans les espaces intercellulaires de façon radiaire [1] et forme en AF l’aspect typique en « pétales de fleur ». Il faudra toutefois toujours vérifier que l’aspect pétaloïde s’accompagne bien d’un épaississement maculaire en OCT.
L’OMC a été classé en quatre grades angiofluorographiques par Miyake [2] en 1977 :
-
grade 0 : pas de diffusion ;
-
grade I : légère diffusion dans des espaces cystoïdes mais insuffisante pour occuper toute la rétine fovéolaire ;
-
grade II : accumulation complète et circulaire de colorant dans des espaces cystoïdes mais de diamètre inférieur à 2,0 mm ;
-
grade III : accumulation circulaire de plus de 2,0 mm de diamètre.
En 1984, Yanuzzi [3] a proposé une classification légèrement différente (fig. 10-16) :
Un certain degré de corrélation a été retrouvé entre l’importance de l’hyperfluorescence fovéaire selon la classification de Yanuzzi, l’épaisseur maculaire en OCT et l’acuité visuelle, en particulier pour les atteintes sévères (fig. 10-17) [4]. L’AF est nécessaire dans l’évaluation de l’OMC mais peut être prise en défaut pour des stades débutants d’OM, raison pour laquelle elle est aujourd’hui avantageusement remplacée par l’OCT. Celui-ci permet de dépister des OM plus précocement, de confirmer l’épaississement maculaire, d’en faire une analyse qualitative et quantitative, et il objective la présence d’éventuelles membranes épirétiniennes ou tractions vitréomaculaires associées. L’angiofluorographie permet en revanche la reconnaissance des autres composantes de l’uvéite évoquées ci-dessous.
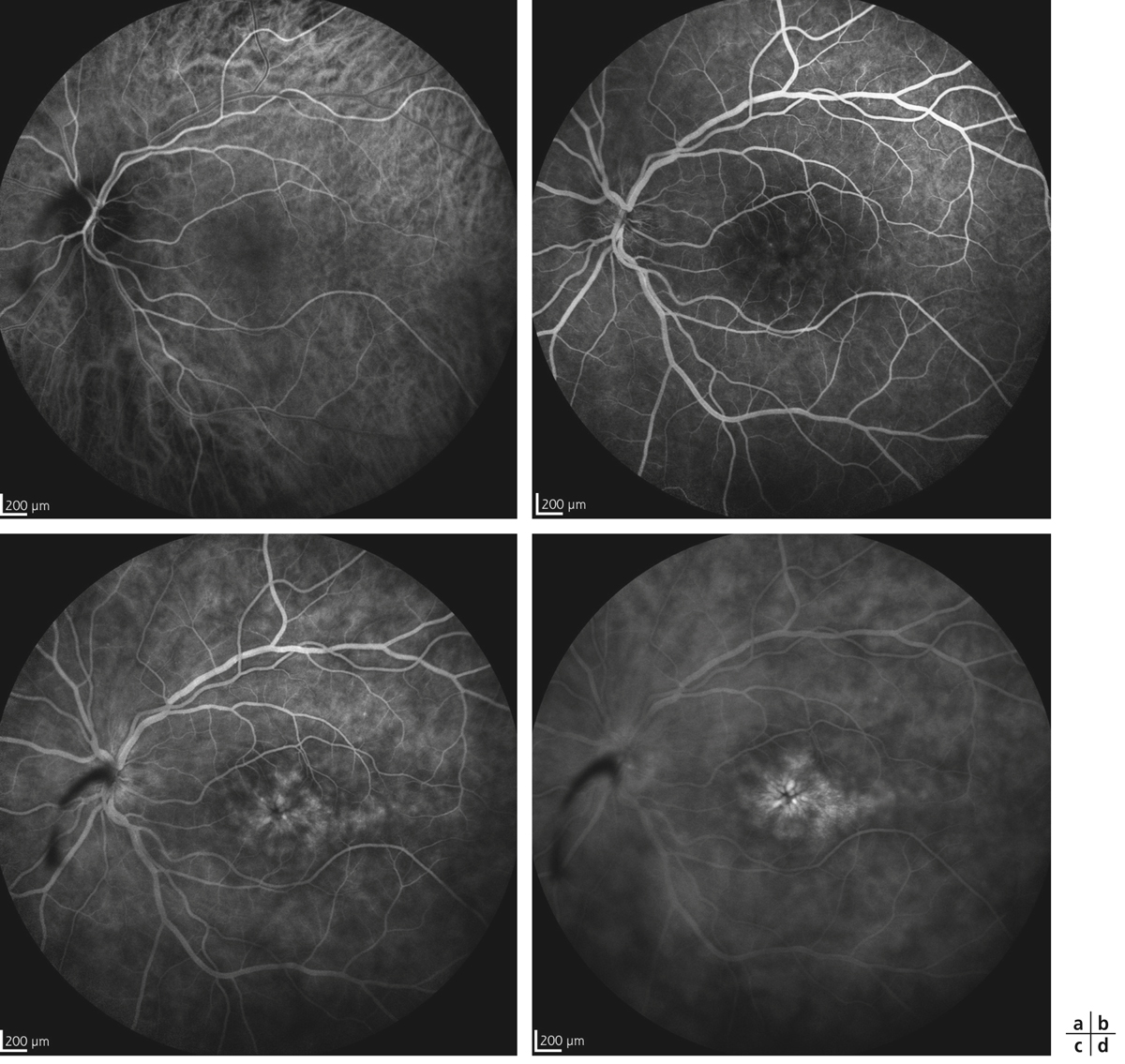
Fig. 10-16 Œdème maculaire inflammatoire classé grade 4 selon la classification de Yanuzzi.
a. Temps précoce 0'26'', pas d’atteinte choroïdienne associée détectée. b. Temps intermédiaire 1'13'', dilatations des capillaires périfovéolaires et début de diffusion de colorant. c. Temps tardif 3'37'', diffusion du colorant dans des espaces cystoïdes fovéolaires et aspect de capillarite diffuse périmaculaire. d. Temps tardif 9'17'', persistance du colorant dans les espaces cystoïdes et aspect d’hyperfluorescence « pétaloïde » très marquée en fin d’examen.
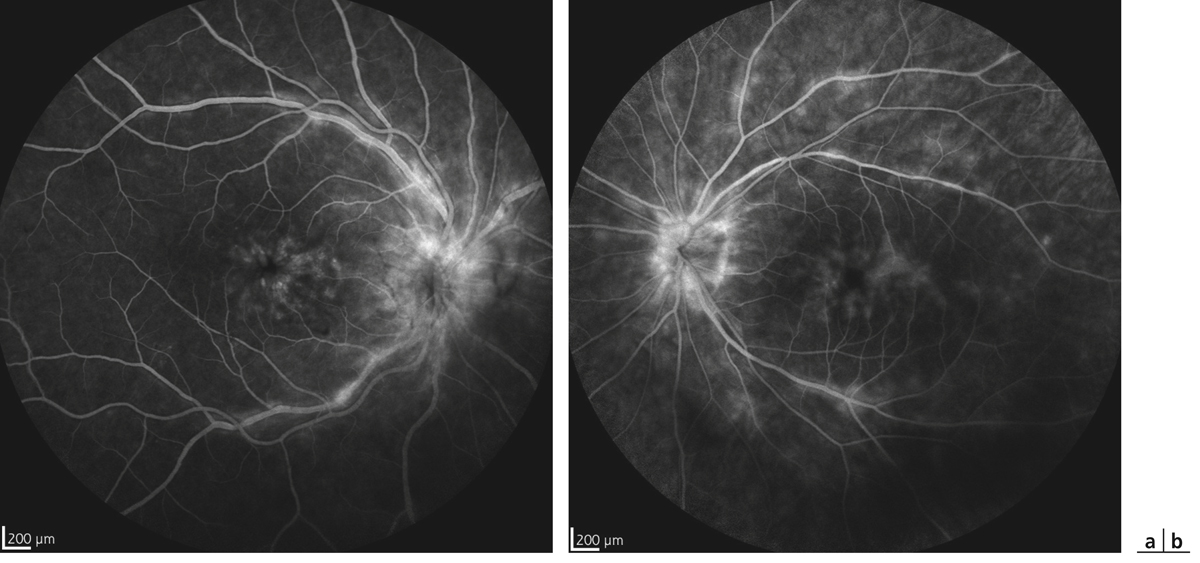
Fig. 10-17 Choriorétinopathie de Birdshot compliquée d’un œdème maculaire.
a. Temps intermédiaire 3'57'' de l’angiographie. OMC classé grade 3 selon la classification de Yanuzzi associé à une papillite et des périphlébites avec hyperfluorescence des parois veineuses et diffusions de colorant. b. Temps intermédiaire 4'37'' de l’angiographie. OMC classé grade 2 selon la classification de Yanuzzi associé à une papillite, des vascularites artérielles, veineuses et des capillarites diffuses.
La vascularite rétinienne est révélée au fond d’œil par des engainements vasculaires focaux ou diffus. L’AF montre une imprégnation des parois du vaisseau ou une diffusion du colorant à partir de celles-ci (fig. 10-18 et voir aussi fig. 5-49). On différencie les vascularites veineuses (périphlébites), les vascularites artérielles (artérites) et capillaires (capillarites).
L’AF offre une bien meilleure sensibilité que l’examen clinique pour la détection des vascularites et s’avère particulièrement utile pour l’évaluation des vascularites et/ou capillarites infracliniques. Elle permet une meilleure adaptation des traitements. C’est par exemple le cas dans la maladie de Behçet et la choriorétinopathie de Birdshot où l’AF est l’examen de choix pour le suivi.
On classe les diffusions et imprégnations vasculaires en « focale, multifocale ou diffuse », avec atteinte du pôle postérieur et/ou de la périphérie dans un à quatre quadrants. Des diffusions généralisées sont retrouvées dans la choriorétinopathie de Birdshot où elles produisent une imprégnation et un œdème diffus de la rétine. L’importance de la diffusion capillaire dans la choriorétinopathie de Birdshot est parfois si profuse que, lors du temps précoce, les grands axes veineux sont très peu marqués par le colorant, ce qui avait été interprété comme un retard de perfusion par Gass [5]. L’examen de la circulation artérioveineuse en ICG montre que le temps de transit est parfaitement normal. Les veines sont bien marquées au temps normal de 18 à 20 secondes car l’indocyanine ne diffuse pas à travers les parois vasculaires. On peut parler de pseudo-retard de perfusion, dû au manque de colorant dans les veines aux temps précoces de l’AF.
L’AF permet d’évaluer d’autres atteintes rétiniennes associées aux uvéites comme :
-
les altérations de l’épithélium pigmentaire ;
-
les occlusions vasculaires et zones de non-perfusion rétinienne : les occlusions de branche peuvent compliquer une vascularite. Une non-perfusion rétinienne peut découler directement d’une occlusion artérielle d’origine inflammatoire. Les territoires ischémiques pourront faire l’objet d’une photocoagulation pour éviter l’apparition d’une néovascularisation prérétinienne (fig. 10-19) ;
-
les macro-anévrismes observés dans la sarcoïdose et le syndrome d’IRVAN ;
-
les néovascularisations rétiniennes. Les cicatrices de foyers choriorétiniens entraînent un aspect de plage atrophique qui se traduit par un effet fenêtre avec visualisation de la fluorescence choroïdienne, à distinguer d’une néovascularisation secondaire sur un foyer ancien. Cette situation doit être particulièrement évoquée dans les uvéites d’origine toxoplasmique, les choroïdites multifocales, les choroïdites serpigineuses et plus secondairement dans la choriorétinopathie de type Birdshot ;
-
les zones d’hypofluorescence observées dans les syndromes des taches blanches qui vont évoluer vers des zones d’atrophie avec effet fenêtre au stade cicatriciel.
L’AF permet une quantification de l’activité inflammatoire des choriorétinites toxoplasmiques. Elle montre une hypofluorescence précoce du foyer de choriorétinite puis une hyperfluorescence débutant en périphérie de la lésion, et progressant de façon centripète vers le centre du foyer (fig. 10-20). Les foyers inflammatoires papillaires et juxtapapillaires sont aisément diagnostiqués par AF. La papillite est identifiée par une dilatation des capillaires épipapillaires dès les temps précoces avec diffusion progressive du colorant et aspect flou des bords de la papille.
L’AF permet de visualiser un DSR qui se remplit au temps tardif de l’angiographie, notamment dans la toxoplasmose ou dans le syndrome de Vogt-Koyanagi-Harada, mais le DSR est au mieux diagnostiqué par l’OCT.
L’AF permet, dans une moindre mesure, l’étude de la choroïde en mettant en évidence des plages de non-perfusion choroïdiennes lors du temps précoce, ainsi que des plis choroïdiens ou une néovascularisation choroïdienne. Elle est très utile pour déterminer si une lésion choroïdienne est active.
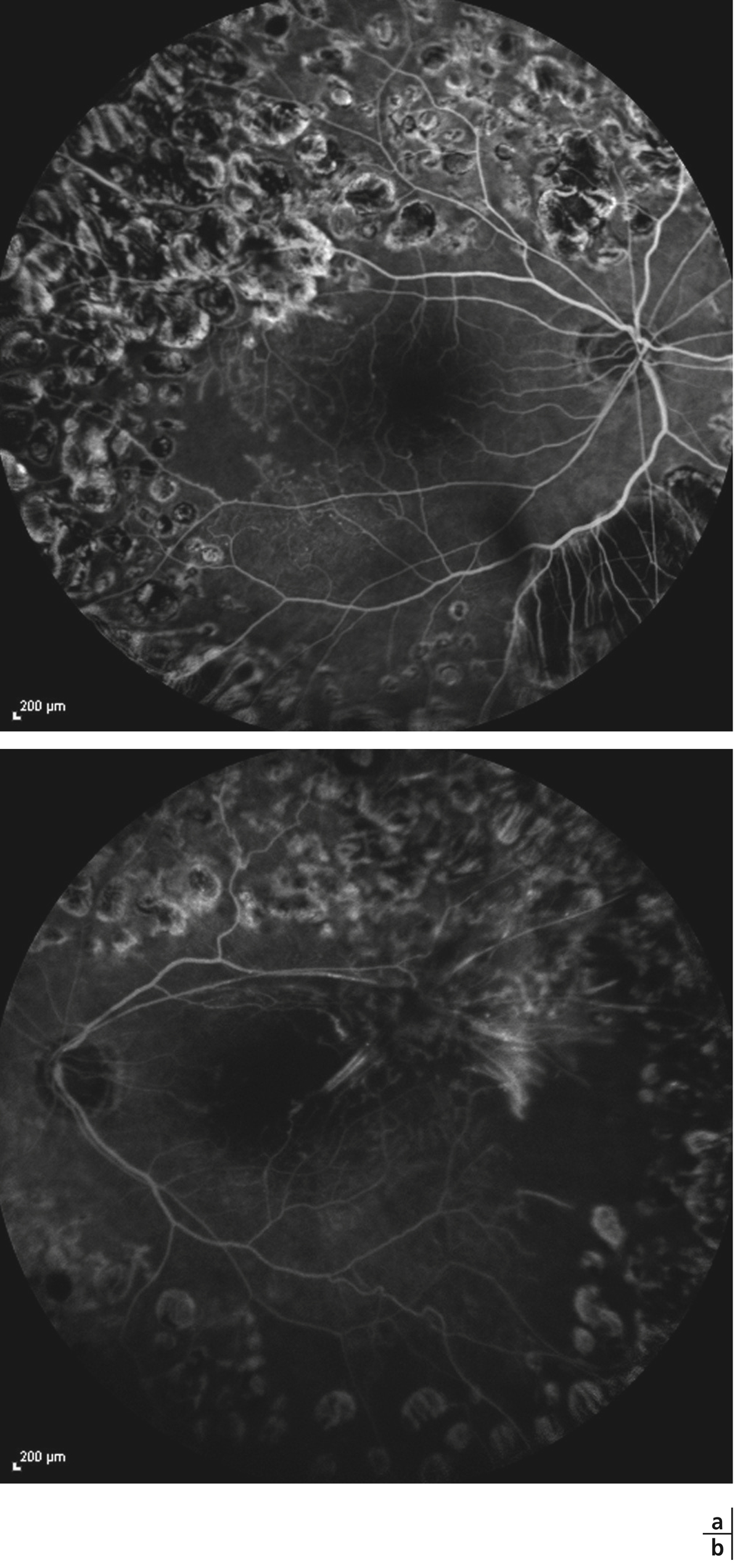
Fig. 10-19 Lupus érythémateux disséminé.
a. Ischémie temporomaculaire temporale sur un œil traité par laser. b. Néovaisseaux prérétiniens dans l’autre œil de la même patiente.
(Remerciements au Dr A. Bron.)
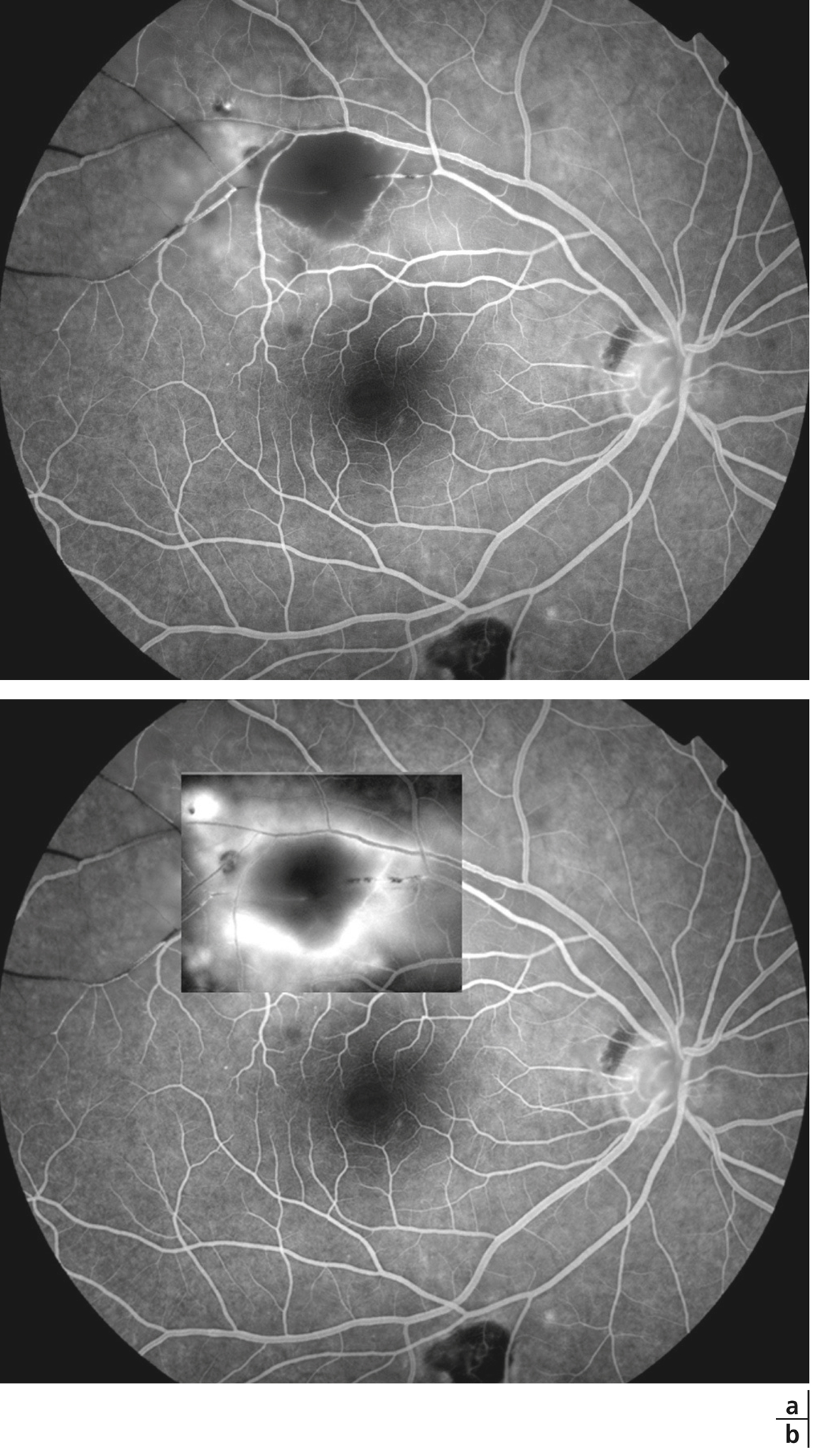
Fig. 10-20 Foyer de toxoplasmose associé à une vascularite.
a. Temps artérioveineux de l’angiographie. Hypofluorescence du foyer, associée à une occlusion de l’artère passant par le foyer (artérite de Kyrielis). a. Temps tardif. Hyperfluorescence périphérique du foyer de toxoplasmose, associée à une hyperfluorescence de la paroi de la veine adjacente témoignant d’une vascularite veineuse associée, et occlusions vasculaires bien visibles.
(Remerciements au Dr A. Bron.)
[1] De Laey JJ. Fluorescein angiography in posterior uveitis. International Ophthalmology Clinics 1995 ; 35 : 33-58.
[2] Miyake K. Prevention of cystoid macular edema after lens extraction by topical indomethacin (I). A preliminary report. Albrecht Von Graefes Arch Klin Expe Ophthalmol 1977 ; 203 : 81-8.
[3] Yannuzzi LA. A perspective on the treatment of aphakic cystoid macular edema. Survey of Ophthalmology 1984 ; 28 Suppl : 540-53.
[4] Tran TH, de Smet MD, Bodaghi B, et al. Uveitic macular oedema : correlation between optical coherence tomography patterns with visual acuity and fluorescein angiography. Br J Ophthalmol 2008 ; 92 : 922-7.
[5] Gass JD. Vitiliginous chorioretinitis. Arch Ophthalmol 1981 ; 99 : 1778-87.
C. Terrada
➤ L’angiographie au vert d’indocyanine n’est pas un examen déterminant pour le diagnostic de l’OM inflammatoire.
➤ Cet examen identifie les lésions, apporte des informations complémentaires qui permettent d’établir un diagnostic précis des pathologies rétiniennes et choroïdiennes, le plus souvent inflammatoires.
➤ Dans ces conditions, il est recommandé de pratiquer cet examen pour établir un diagnostic et pour guider la prise en charge thérapeutique, le suivi et la progression de la pathologie.
L’angiographie au vert d’indocyanine (indocyanine green [ICG]) n’est pas considérée comme un moyen de détection efficace de l’OM inflammatoire. Cependant, l’angiographie ICG peut être utile pour orienter le diagnostic positif, le diagnostic différentiel et étiologique, par la présence ou, a contrario, l’absence des signes angiographiques recherchés.
Le vert d’indocyanine est une molécule hydrosoluble de 775 Da qui se fixe fortement aux protéines (98–99 %) après l’injection intraveineuse. L’élimination de la molécule se fait par voie biliaire sans métabolisation. Le spectre d’absorption maximale de la molécule de vert d’indocyanine dans le plasma se situe aux environs de 800 nm et elle émet un rayonnement fluorescent à ± 830 nm, longueurs d’ondes situées dans le spectre infrarouge. À ces niveaux de longueurs d’ondes, la couche de l’épithélium pigmentaire n’est plus un écran pour la lumière fluorescente émise [1]. Les conséquences physiopathogéniques au niveau rétinien et choroïdien sont les suivantes :
-
l’ICG n’exsude pas au travers des vaisseaux rétiniens normaux ou modérément inflammatoires ;
-
l’ICG exsude lentement à partir des capillaires fenêtrés de la choriocapillaire et diffuse progressivement avec imprégnation lente du stroma choroïdien (fig. 10-21).
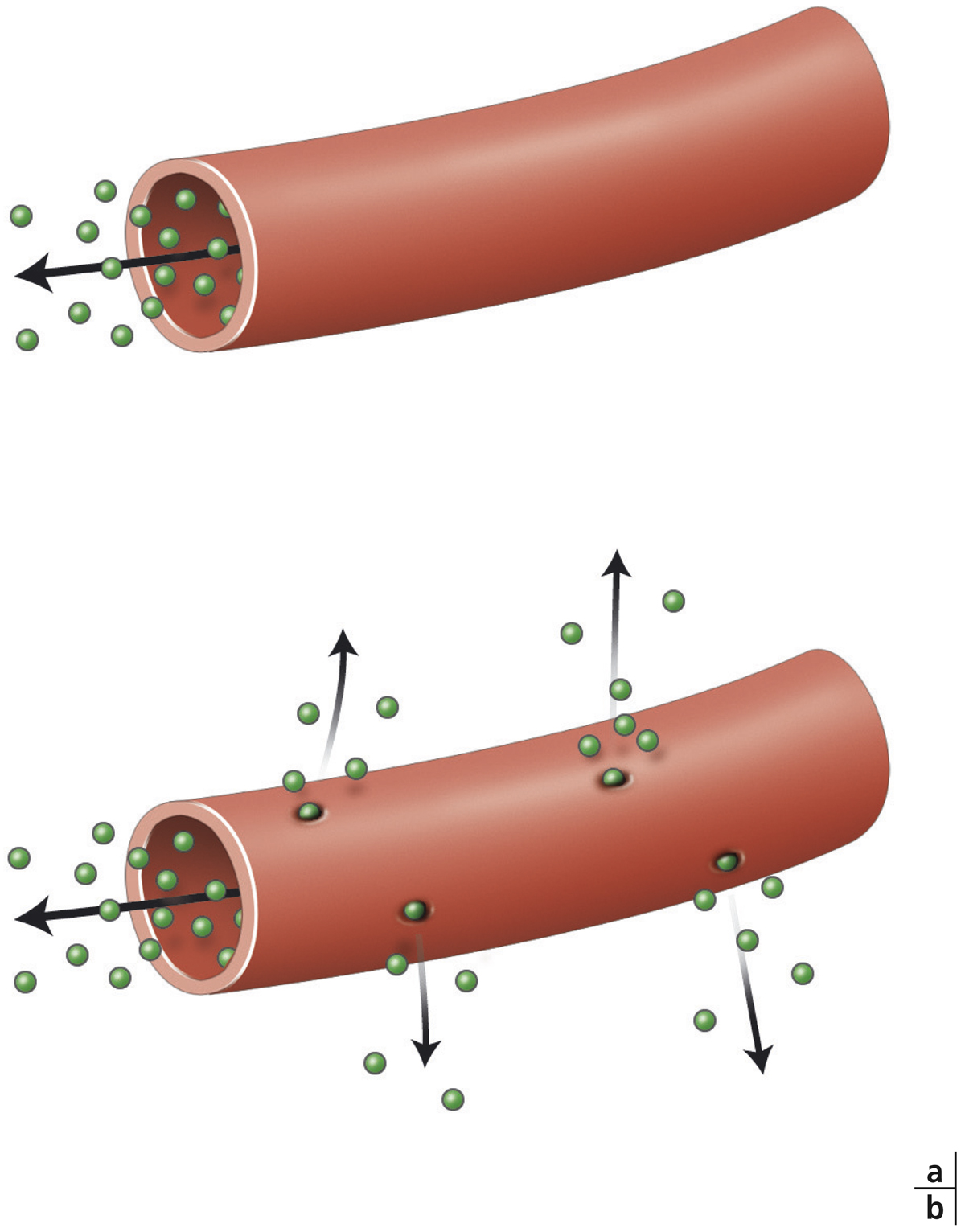
Fig. 10-21 Comportement de la molécule d’ICG en fonction de l’état inflammatoire vasculaire.
a. Vaisseau rétinien modérément inflammatoire ; la molécule d’ICG, fixée à 99 % aux protéines reste intraluminale. b. Au niveau de la choriocapillaire, le vert d’indocyanine sort librement des capillaires. L’ICG est retenue et imprègne le compartiment choroïdien.
L’hypofluorescence en angiographie au vert d’indocyanine peut résulter d’un effet masque, d’une non-perfusion vasculaire ou d’un effet de masse (fig. 10-22). L’hyperfluorescence en angiographie au vert d’indocyanine peut résulter d’une hyperperméabilité vasculaire, d’une imprégnation tissulaire ou rétention du colorant dans une cavité et enfin d’une fixation tissulaire (fig. 10-23).
L’hypofluorescence par effet masque concerne les lésions épaisses et pigmentées. L’hypofluorescence par non-perfusion vasculaire concerne la perfusion de la choriocapillaire. L’hypofluorescence par effet de masse peut être due à des infiltrats inflammatoires choroïdiens empêchant la diffusion du complexe macromoléculaire protéine – ICG.
L’hyperfluorescence par hyperperméabilité vasculaire indique que le colorant s’échappe anormalement des vaisseaux. Cette fuite concerne les gros vaisseaux choroïdiens normalement imperméables au complexe protéine – ICG, ainsi que les vaisseaux rétiniens et papillaires en cas d’inflammation sévère. L’hyperfluorescence par imprégnation tissulaire ou rétention du colorant dans une cavité fait suite à une fuite de colorant dans soit : un tissu, la rétine, la choroïde ou une cavité. L’hyperfluorescence par fixation tissulaire représente une hyperfluorescence tissulaire focale ou vasculaire segmentaire.
L’analyse de la séquence d’une angiographie au vert d’indocyanine a pour but de rechercher une hyperfluorescence ou une hypofluorescence anormale. Les taches hypofluorescentes sont subdivisées en taches hypofluorescentes de type 1 selon qu’elles deviennent iso- ou hyperfluorescentes aux temps tardifs et en taches hypofluorescentes de type 2 lorsqu’elles restent hypofluorescentes aux temps tardifs [2]. Le mécanisme physiopathogénique est déterminé en fonction des signes angiographiques : une vasculite choroïdienne des gros troncs vasculaire avec hyperfluorescence par hyperperméabilité et une vasculite occlusive des artérioles responsable d’une hypofluorescence par non-perfusion de la choriocapillaire.
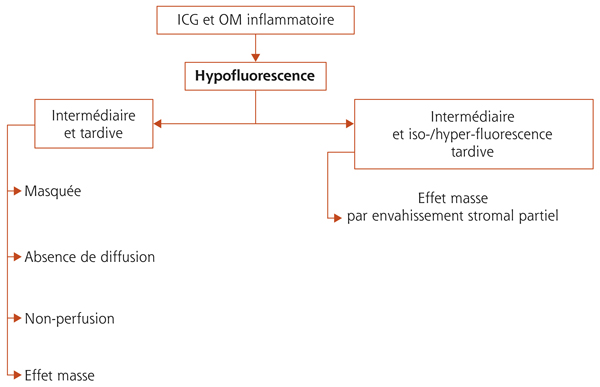
Fig. 10-22 Algorithme d’interprétation clinique de l’angiographie en ICG : hypofluorescence.
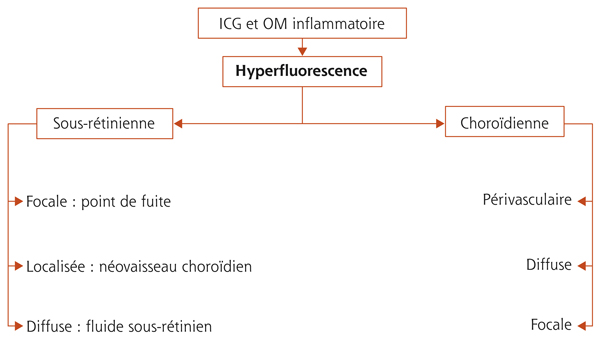
Fig. 10-23 Algorithme d’interprétation clinique de l’angiographie en ICG : hyperfluorescence.
L’OM est une complication non spécifique de toutes les formes d’uvéites, antérieures, intermédiaires, postérieures et panuvéites. L’angiographie en ICG fait partie des investigations paracliniques à réaliser devant tout OM inflammatoire [3]. Elle ne sera pas prescrite à « titre systématique » mais en fonction de la présentation de l’uvéite et de sa compatibilité avec l’étiologie recherchée. L’angiographie en ICG est un examen particulièrement utile pour étudier les néovaisseaux choroïdiens inflammatoires. Ce sous-chapitre a été organisé de façon anatomique, de la superficie vers la profondeur, c’est-à-dire la neurorétine, le complexe épithélium pigmentaire–choriocapillaire et la choroïde. Il est entendu que les pathologies inflammatoires oculaires peuvent intéresser de façon non exclusive un, deux ou les trois compartiments. Ce sous-chapitre est non exhaustif et privilégie l’interprétation sémiologique au cours de certaines pathologies inflammatoires.
L’atteinte inflammatoire au cours de la maladie de Behçet touche la rétine et se manifeste par une vasculite rétinienne. L’angiographie au vert d’indocyanine permet d’identifier une atteinte inflammatoire choroïdienne sous la forme d’une hyperfluorescence focale sous un fond d’hyperfluorescence diffuse, apparaissant sur les temps intermédiaires et se maintenant sur les temps tardifs de la séquence [4].
Cette pathologie rare a été décrite par Susac en 1994. Elle atteint préférentiellement des femmes jeunes. Elle associe une surdité de perception et des troubles confusionnels. L’IRM encéphalique montre des hypersignaux dans la substance blanche, le cortex cérébral, le corps calleux et les noyaux gris centraux. L’angiographie à la fluorescéine met en évidence des occlusions artériolaires rétiniennes labiles et récidivantes. Les travaux réalisés sur la choroïde ne retrouvent pas d’inflammation des vaisseaux ou de retard circulatoire. L’hypofluorescence tardive en ICG intéresse le territoire rétinien non perfusé et l’œdème ischémique des couches externes qui en résulte (fig. 10-24) [5].
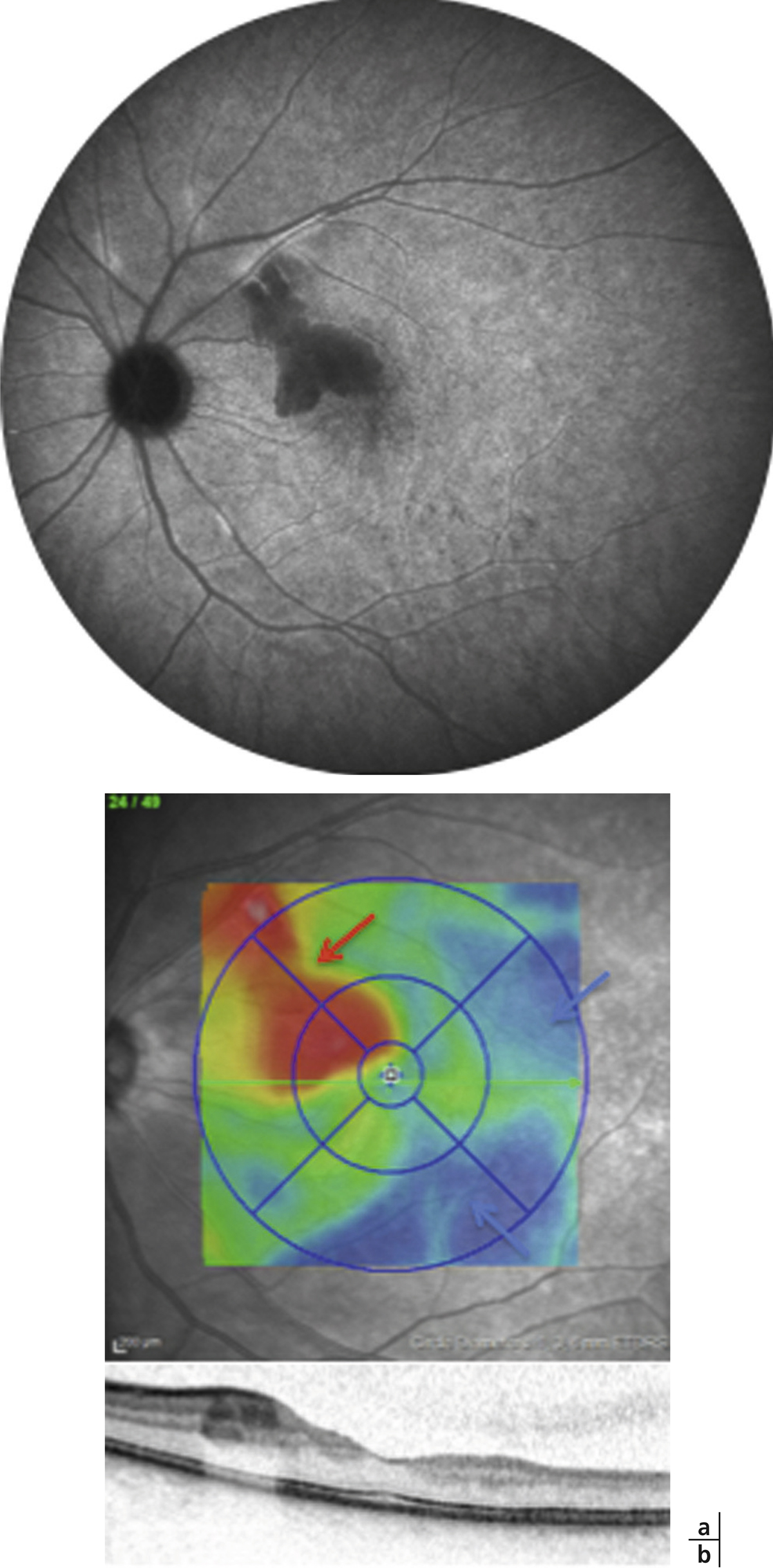
Fig. 10-24 Œdème maculaire et hypofluorescence tardive en ICG par effet masque d’origine rétinienne au cours d’un syndrome de SICRET.
a. ICG aux temps tardifs. Territoire hypofluorescent maculaire en aval de l’occlusion artériolaire, hyperfluorescence pariétale segmentaire et focale des parois artérielles inflammatoires. b. SD-OCT maculaire : œdème rétinien ischémique de la rétine interne (flèche rouge) et atrophie rétinienne périmaculaire (flèche bleue), témoin d’infarctus ischémiques anciens de la rétine interne.
Le syndrome d’IRVAN est une maladie très rare, sans cause connue, bilatérale, affectant des sujets jeunes y compris des enfants, non associée à une maladie systémique. Elle est caractérisée par : une artérite rétinienne ; des dilatations anévrismales principalement dans les fourches artérielles ; une neurorétinite paravasculaire ; une non-perfusion capillaire périphérique pouvant entraîner des complications néovasculaires, des exsudats lipidiques dans la macula témoignant d’un OM par exsudation.
L’angiographie au vert d’indocyanine montre la dispersion des ectasies hyperfluorescentes sur tout l’arbre artériel et l’hypofluorescence des exsudats maculaires et péripapillaires (fig. 10-25) [6].
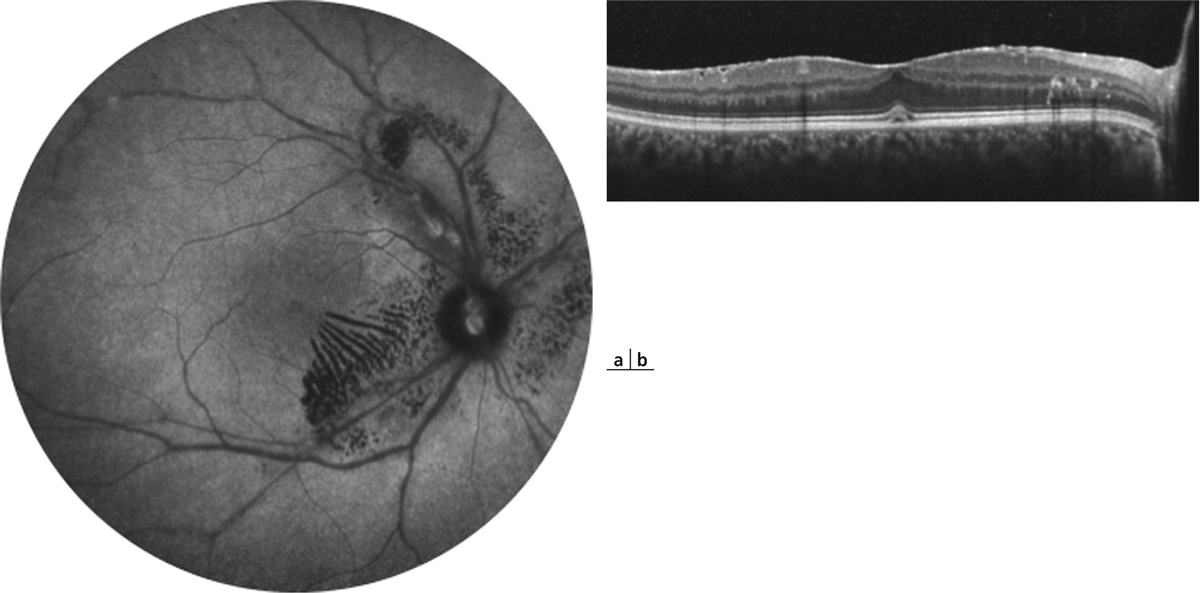
Fig. 10-25 Œdème maculaire et hypofluorescence tardive en ICG par effet masque d’origine rétinienne au cours d’un syndrome d’IRVAN.
a. ICG aux temps tardifs. Hypofluorescence par effet masque des exsudats rétiniens péripapillaires et maculaires. Hyperfluorescence des anévrismes artériels par rétention ou fixation pariétale du complexe protéine–ICG. b. Coupe OCT fovéolaire : hyporéflectivité sous-rétinienne rétrofovéale et hyperréflectivité focale des exsudats rétiniens au sein de la couche plexiforme externe.
Les néovaisseaux choroïdiens qui compliquent les choroïdites inflammatoires, dans leur phase inaugurale, récidivante ou cicatricielle, sont des néovaisseaux choroïdiens visibles, proliférant sous la rétine (fig. 10-26). Le réseau néovasculaire est individualisable dès les temps précoces de l’angiographie au vert d’indocyanine. Par la suite, l’hyperfluorescence se maintient et diffuse. L’angiographie au vert d’indocyanine permet une analyse concomitante de la choroïde dans son ensemble. Au cours des épithéliopathies en plaques, elle révèle la présence de taches hypofluorescentes (phases précoce, intermédiaire et tardive) traduisant une non-perfusion de la choriocapillaire. L’atteinte est focale, de localisation prépondérante au pôle postérieur et en péripapillaire. Les taches sont de tailles moyennes, confluentes avec aspect géographique (fig. 10-27) [7].
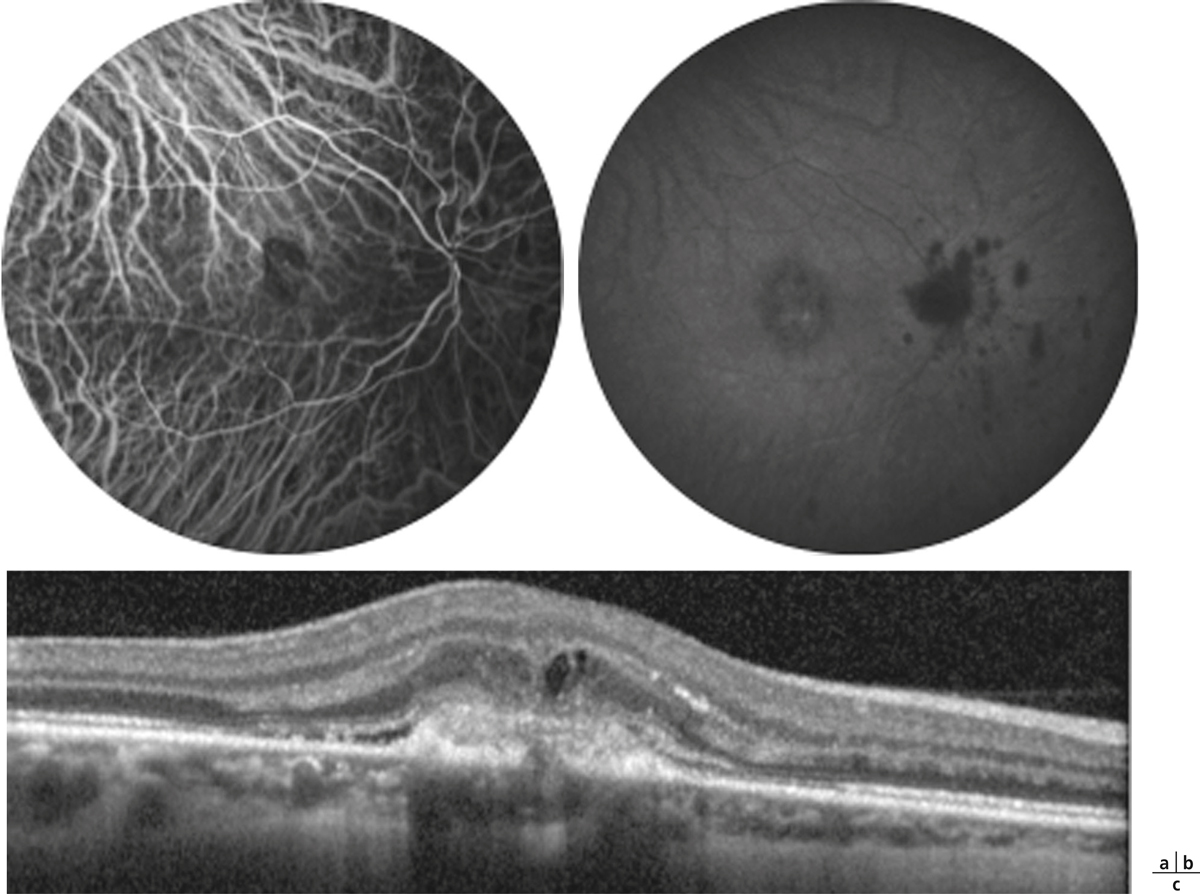
Fig. 10-26 Œdème maculaire et hypofluorescence tardive en ICG par effet masse d’origine choroïdienne au cours d’une choroïdite multifocale compliquée de néovaisseau choroïdien visible rétrofovéolaire.
a. Membrane néovasculaire visible rétrofovéale hyperfluorescente sur les temps précoces de l’ICG et taches choroïdiennes péripapillaires hypofluorescentes. b. L’hyperfluorescence maculaire persiste et diffuse sur les temps tardifs. Les taches choroïdiennes restent hypofluorescentes et paraissent plus nombreuses comparées aux temps précoces de l’ICG. c. Hyper-réflectivité rétrofovéale de la membrane néovasculaire surmontée par des signes exsudatifs intra- et sous-rétiniens.
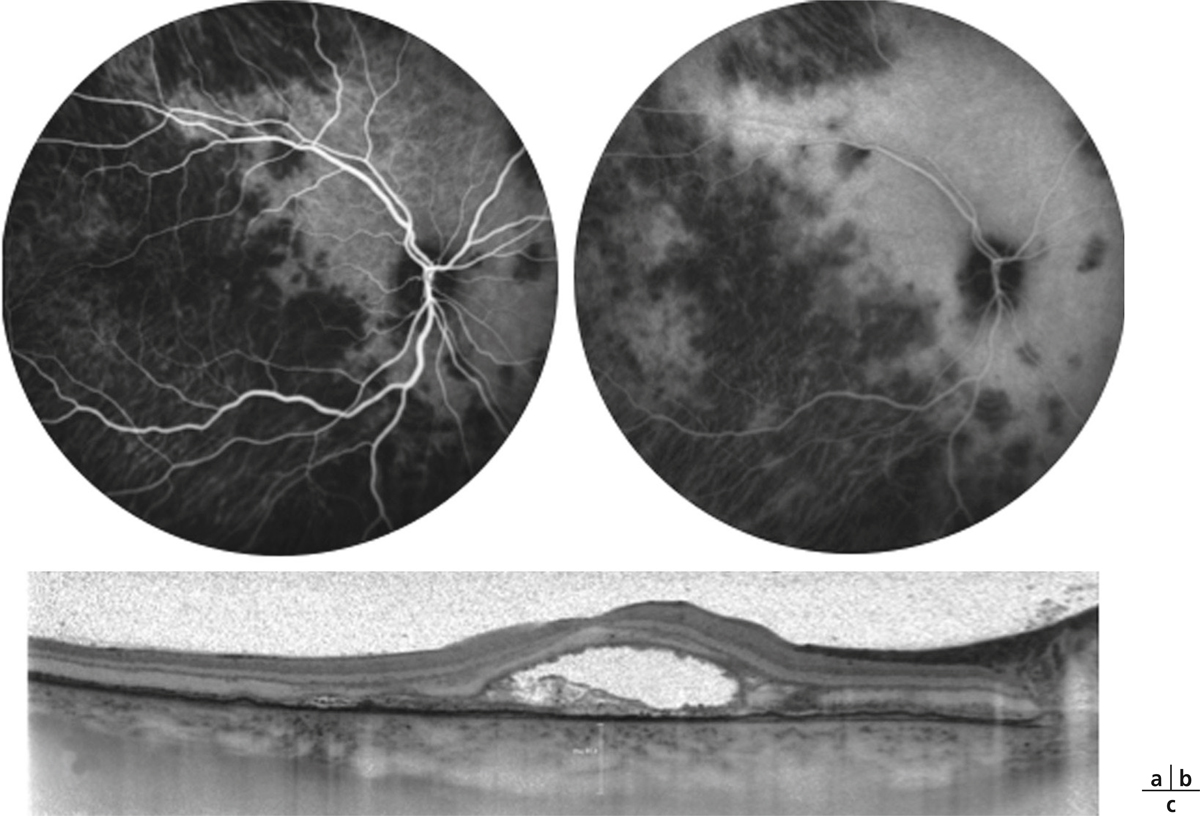
Fig. 10-27 Œdème maculaire et angiographie en ICG au cours d’une épithéliopathie en plaques.
a. L’importante hypofluorescence du pôle postérieur traduit une hypoperfusion capillaire. Les gros vaisseaux choroïdiens sont visibles et perfusés. b. L’hypofluorescence persiste sur les temps intermédiaires et tardifs (non montré). Kyste intrarétinien centromaculaire. c. Hyper-réflectivité de la couche nucléaire externe, interruption de la membrane limitante externe, interruption de la couche ellipsoïde et de la zone des interdigitations.
An cours de la maladie de Vogt-Koyanagi-Harada, l’angiographie au vert d’indocyanine retrouve de façon constante :
-
un retard circulatoire choroïdien précoce ;
-
de nombreuses taches sombres périphériques hypofluorescentes correspondant probablement à des granulomes inflammatoires dans la choroïde (fig. 10-28) ;
-
une hyperfluorescence et une hyperperméabilité des gros vaisseaux choroïdiens ;
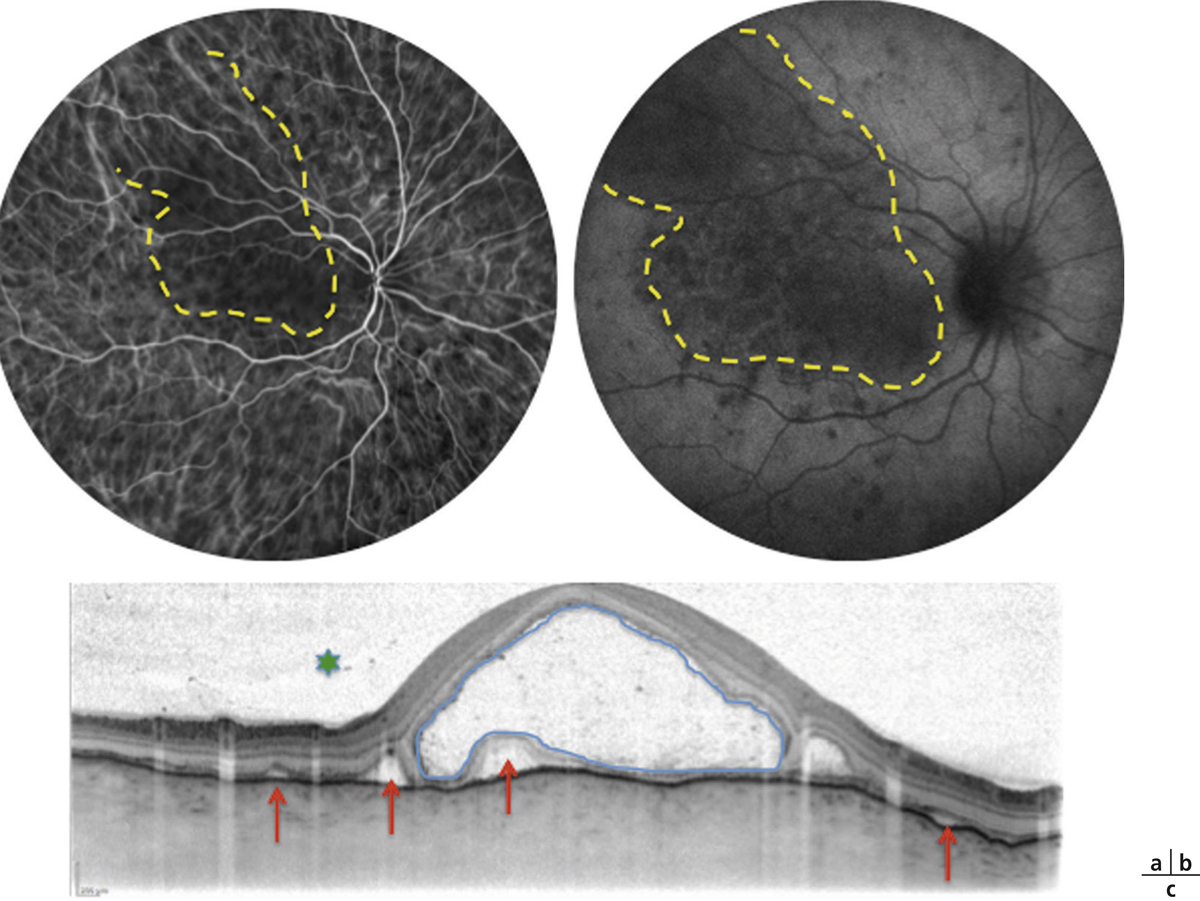
Fig. 10-28 Œdème maculaire et angiographie en ICG au cours de la maladie de Vogt-Koyanagi-Harada.
a. L’hypofluorescence du pôle postérieur traduit une hypoperfusion capillaire. Les nombreuses taches sombres périphériques correspondent probablement à des granulomes inflammatoires dans la choroïde. La dilatation et l’hyperfluorescence de certaines veines choroïdiennes peuvent traduire l’inflammation ou la stase veineuse choroïdienne. Dans les limites de cette zone d’hypoperfusion capillaire, les gros vaisseaux choroïdiens sont perfusés (ligne en pointillés jaunes) mais pas la choriocapillaire. b. Au temps tardif, la plage hypofluorescente centrale a la même topographie que l’hypofluorescence précoce. Elle témoigne d’un dysfonctionnement de l’épithélium pigmentaire dans cette zone. c. Coupe OCT passant par la fovéa. Grand « kyste » intrarétinien centromaculaire (ligne bleue) et petits décollements séreux annexes (flèches rouges). Hyalite postérieure (étoile verte) et points hyper-réflectifs au sein du décollement séreux rétinien.
L’OM fait le pronostic visuel de la rétinochoroïdopathie de type Birdshot. Lors de la phase aiguë, la totalité des patients présente des taches choroïdiennes hypofluorescentes aux temps intermédiaires de l’angiographie. Selon l’activité inflammatoire des taches, la fluorescence de ces dernières est différente sur les temps tardifs. Elles restent hypofluorescentes en cas de faible activité inflammatoire. Elles disparaissent en devenant isofluorescentes en cas de forte activité métabolique. Les deux autres signes sont une hyperfluorescence des gros vaisseaux choroïdiens et une hyperfluorescence choroïdienne tardive diffuse. À la phase chronique, les taches restent hypofluorescentes tout le long de la séquence par atrophie de la choriocapillaire ou persistance de granulomes choroïdiens [10].
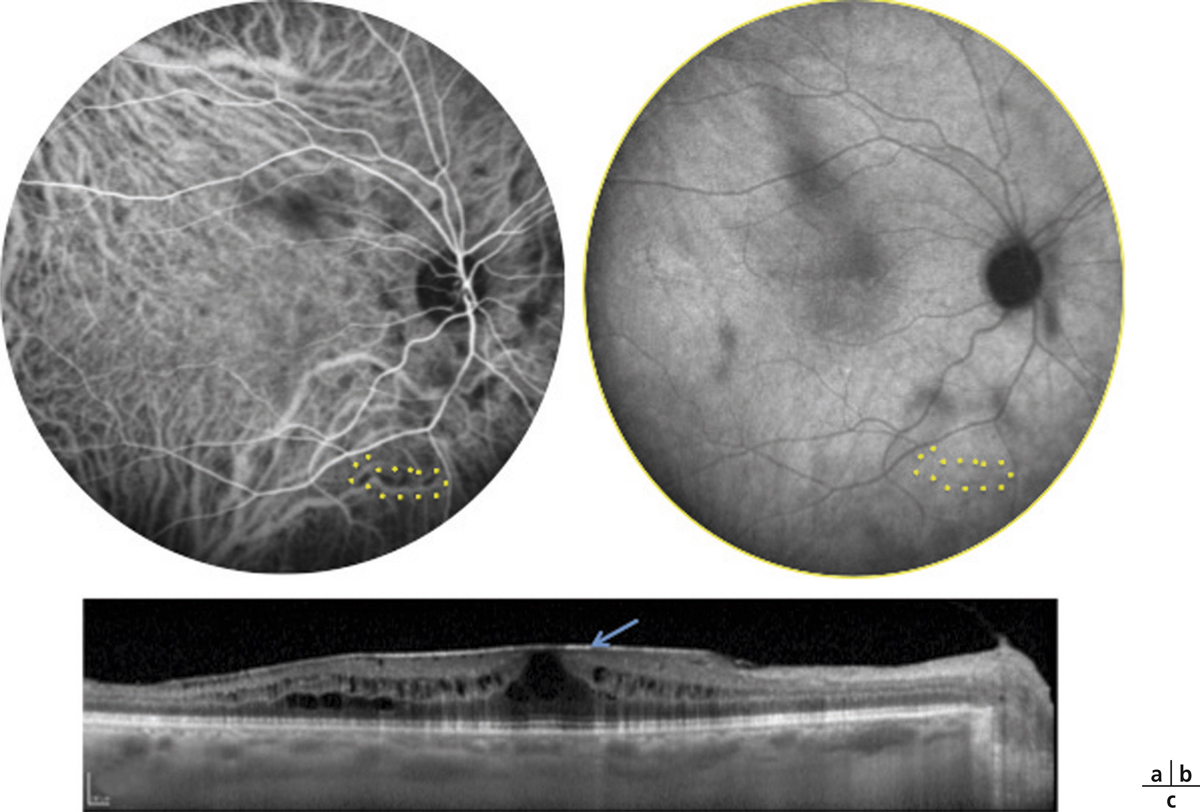
Fig. 10-29 Œdème maculaire et angiographie en ICG au cours de la rétinochoroïdite de type Birdshot.
a. Hypofluorescence des taches choroïdiennes sur les temps intermédiaires. Granulomes choroïdiens situés autour des gros vaisseaux choroïdiens masquant en partie les gros vaisseaux choroïdiens (pointillés jaunes). b. Les taches deviennent isofluorescentes aux temps tardifs. c. SD-OCT. OM inflammatoire étendu avec logettes microkystiques intrarétiniennes et membrane épimaculaire (flèche bleue).
[1] Desmettre T, Devoiselle JM, Soulte-Begu S, Mordon S. Propriétés de la fluorescence et particularités métaboliques du vert d’indocyanine. J Fr Ophtalmol 1999 ; 22 : 1003-6.
[2] Herbort CP, Bodaghi B, LeHoang P. Angiographie au vert d’indocyanine au cours des maladies inflammatoires : principes, interprétation schématique, sémiologie et intérêt clinique. J Fr Ophtalmol 2001 ; 24 : 423-47.
[3] Johnson MW. Etiology and treatment of macular edema. Am J Ophthalmol 2009 ; 147 : 11-21.
[4] Matsuo T, Sato Y, Shiraga F, et al. Choroidal abnormalities in Behçet’s disease observed by simultaneous indocyanine green and fluorescein angiography with scanning laser ophthalmoscopy. Ophthalmology 1999 ; 106 : 295-300.
[5] Martinet N, Fardeau C, Adam R, et al. Fluorescein and indocyanin angiographies in SUSAC syndrome. Retina 2007 ; 27 : 1238-42.
[6] Chang TS, Aylward GW, Davis JL, et al. Idiopathic retinal vasculitis, aneurysms, and neuro-retinitis. Retinal Vasculitis Study. Ophthalmology 1995 ; 102 : 1089-97.
[7] Kotsolis AI, Killian FA, Ladas ID, Yannuzzi LA. Fluorescein angiography and optical coherence tomography concordance for choroidal neovascularisation in multifocal choroiditis. Br J Ophthalmol 2010 ; 94 : 1506-8.
[8] Fardeau C, Tran TH, Gharbi B, et al. Retinal fluorescein and indocyanine green angiography and optical coherence tomography in successive stages of Vogt-Koyanagi-Harada disease. Int Ophthalmol 2007 ; 27 : 163-72.
[9] Oshima Y, Harino S, Hara Y, Tano Y. Indocyanine green angiographic findings in Vogt-Koyanagi-Harada disease. Am J Ophthalmol 1996 ; 122 : 58-66.
[10] Fardeau CL, Herbort CP, Kullmann N, et al. Indocyanine green angiography in birdshot chorioretinopathy. Ophthalmology 1999 ; 106 : 1928-34.
C. Bonnet, D. Monnet
➤ L’OCT permet la reconnaissance et le suivi des OM inflammatoires.
➤ L’OCT précise le type d’OM (épaississement périfovéal, épaississement maculaire diffus, œdème intrarétinien, OMC et/ou décollement séreux rétinien) et permet de le quantifier et d’identifier des signes associés (syndrome de l’interface vitréomaculaire, perte des photorécepteurs, néovaisseau choroïdien, épaississement choroïdien, inflammation du vitré prémaculaire).
➤ Il permet ainsi d’adapter le traitement en précisant le traitement médical nécessaire ou l’éventuel traitement chirurgical pour diminuer les conséquences fonctionnelles de cette complication.
➤ Il ne peut pas à l’inverse identifier une capillarite, une vascularite et/ou une papillite détectables par l’angiographie à la fluorescéine.
L’OM est une cause fréquente de baisse d’acuité visuelle au cours des uvéites [1–3]. Il peut survenir lors d’une atteinte inflammatoire primitive de la macula ou par contiguïté, de vascularites du pôle postérieur, d’une inflammation vitréenne ou même d’une uvéite antérieure souvent chronique avec rupture importante de la barrière hémato-aqueuse [4].
En cas d’uvéite, la baisse de l’acuité visuelle est secondaire dans la majorité des cas à l’apparition d’un OM, par libération de cytokines et de chimiokines qui provoquent une rupture de la BHR interne. Le liquide s’accumule préférentiellement dans les couches plexiformes externes de la rétine pour donner une image faisant évoquer la présence de kystes intrarétiniens [5, 6].
La définition de l’OM en tomographie à cohérence optique (optical coherence tomography [OCT]) est l’augmentation de l’épaisseur maculaire (épaisseur des 1 000 μm centraux au-delà de 250 à 300 μm selon la machine utilisée). L’OCT permet également d’estimer le volume maculaire (exprimé en mm3) dans les 6 mm centraux, moins sensible au décentrement de la fixation lors de l’examen (fréquent chez les patients ayant une acuité visuelle basse).
Outre la mesure quantitative de l’épaisseur rétinienne maculaire, une analyse qualitative de la macula est indispensable. Au vu de la littérature sur les données OCT de l’OM inflammatoire [7, 8], on peut distinguer cinq aspects d’œdème en OCT (fig. 10-30) :
-
épaississement péricentral (EPC) (eFig. 10-1
 ) caractérisé par un épaississement de la rétine maculaire périfovéale avec une épaisseur dans les quadrants périfovéaux (dans l’aire comprise entre le diamètre des 1 000 μm centraux et des 3 000 μm centraux) supérieure à 300 μm pour un time-domain – optical coherence tomography (TD-OCT) Stratus® (Zeiss) ou supérieure à 370 μm pour un spectral-domain optical coherence tomography (SD-OCT) Spectralis® (Heidelberg). Cet épaississement déterminé à partir d’une base normative [9] pourra facilement être méconnu si l’on ne regarde que les coupes ne présentant pas d’anomalie et que l’on omet de regarder la cartographie maculaire et les valeurs d’épaisseur rétinienne au niveau de la couronne péricentrale ;
) caractérisé par un épaississement de la rétine maculaire périfovéale avec une épaisseur dans les quadrants périfovéaux (dans l’aire comprise entre le diamètre des 1 000 μm centraux et des 3 000 μm centraux) supérieure à 300 μm pour un time-domain – optical coherence tomography (TD-OCT) Stratus® (Zeiss) ou supérieure à 370 μm pour un spectral-domain optical coherence tomography (SD-OCT) Spectralis® (Heidelberg). Cet épaississement déterminé à partir d’une base normative [9] pourra facilement être méconnu si l’on ne regarde que les coupes ne présentant pas d’anomalie et que l’on omet de regarder la cartographie maculaire et les valeurs d’épaisseur rétinienne au niveau de la couronne péricentrale ; -
épaississement maculaire diffus (EMD) (eFig. 10-2
 ) qui se caractérise par une augmentation de l’épaisseur rétinienne maculaire centrale et péricentrale ;
) qui se caractérise par une augmentation de l’épaisseur rétinienne maculaire centrale et péricentrale ; -
œdème maculaire diffus (eFig. 10-3
 ) qui se caractérise par une augmentation de l’épaisseur rétinienne maculaire centrale et péricentrale avec la présence de fluide intrarétinien hyporéflectif ;
) qui se caractérise par une augmentation de l’épaisseur rétinienne maculaire centrale et péricentrale avec la présence de fluide intrarétinien hyporéflectif ; -
œdème maculaire cystoïde (OMC) (eFig. 10-4
 ) caractérisé par la présence de fluide intrarétinien et de logettes cystoïdes bien délimitées dans la couche plexiforme externe (couche de Henlé) ;
) caractérisé par la présence de fluide intrarétinien et de logettes cystoïdes bien délimitées dans la couche plexiforme externe (couche de Henlé) ; -
décollement séreux rétinien (DSR) (eFig. 10-5
 ) défini comme une séparation de la rétine sensorielle de la jonction épithélium pigmentaire/choriocapillaire. Le DSR est associé à 30,8 % des OM diffus, 15 % des OMC et il est isolé dans 11,7 % des cas [6].
) défini comme une séparation de la rétine sensorielle de la jonction épithélium pigmentaire/choriocapillaire. Le DSR est associé à 30,8 % des OM diffus, 15 % des OMC et il est isolé dans 11,7 % des cas [6].
L’OCT permet par ailleurs d’identifier :
-
la présence de lésions associées : membranes épirétiniennes (fig. 10-31), syndromes de tractions vitréomaculaires ;
-
une interruption de la ligne ellipsoïde (bande hyper-réflective correspondant aux jonctions articles externes/internes des photorécepteurs ou jonction IS-OS), facteur péjoratif de pronostic fonctionnel [10] ;
-
une atrophie maculaire (fig. 10-32), souvent associée à une disparition de la ligne ellipsoïde, pouvant masquer un OM d’origine inflammatoire.
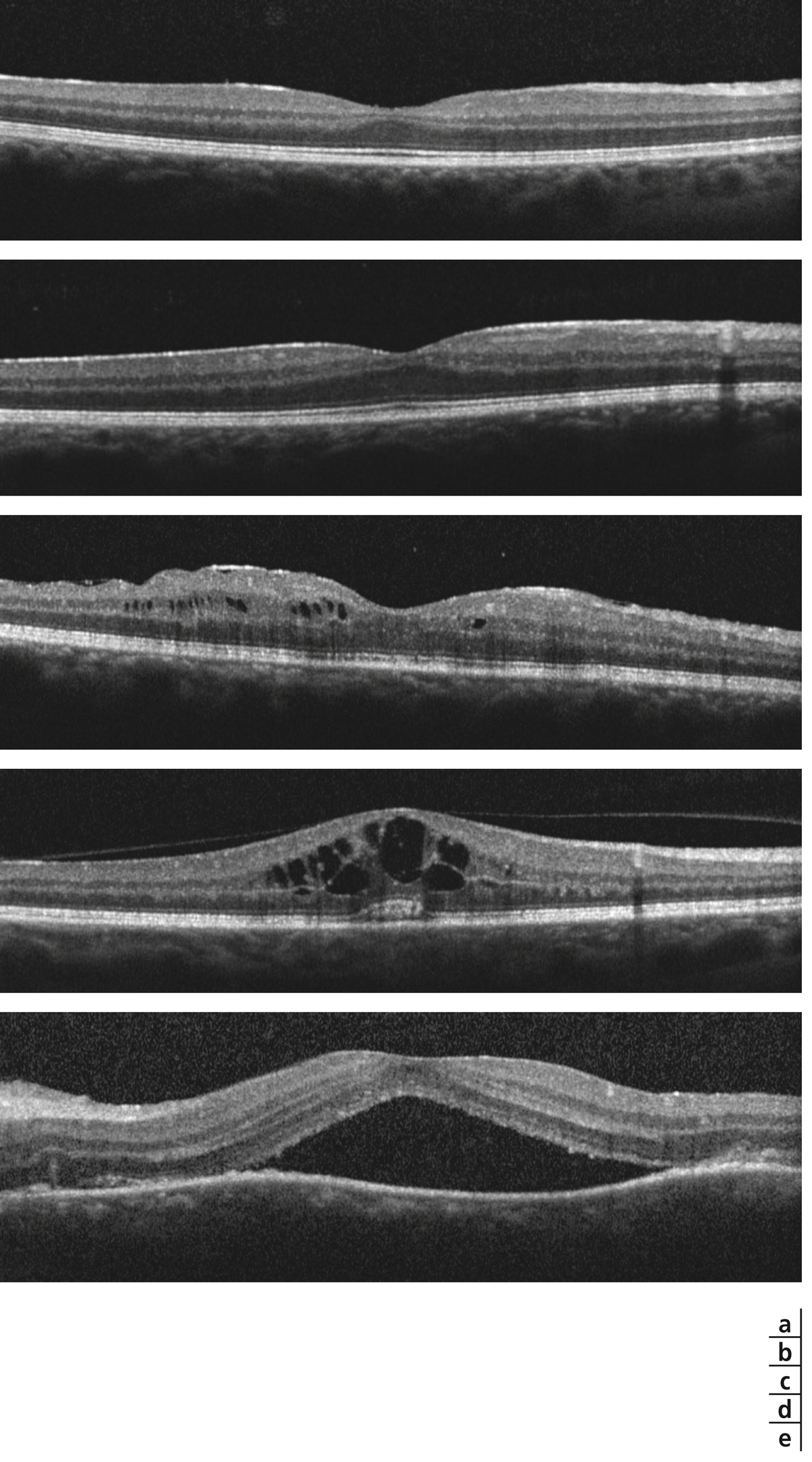
Fig. 10-30 Différents types d’œdèmes maculaires.
a. Épaississement périfovéaire. b. Épaississement maculaire diffus. c. Œdème maculaire diffus. d. Œdème maculaire cystoïde. e. Décollement séreux rétinien.
(Source : photographies du Dr M. Weber.)
eFig. 10-1 Épaississement périfovéaire en lien avec une uvéite intermédiaire (acuité visuelle : 1,0, Parinaud 2).
eFig. 10-2 Épaississement maculaire diffus se caractérisant par un profil d’apparence normale, l’absence de fluide intra- ou sous-rétinien mais la présence d’une épaisseur centrale et péricentrale augmentée.
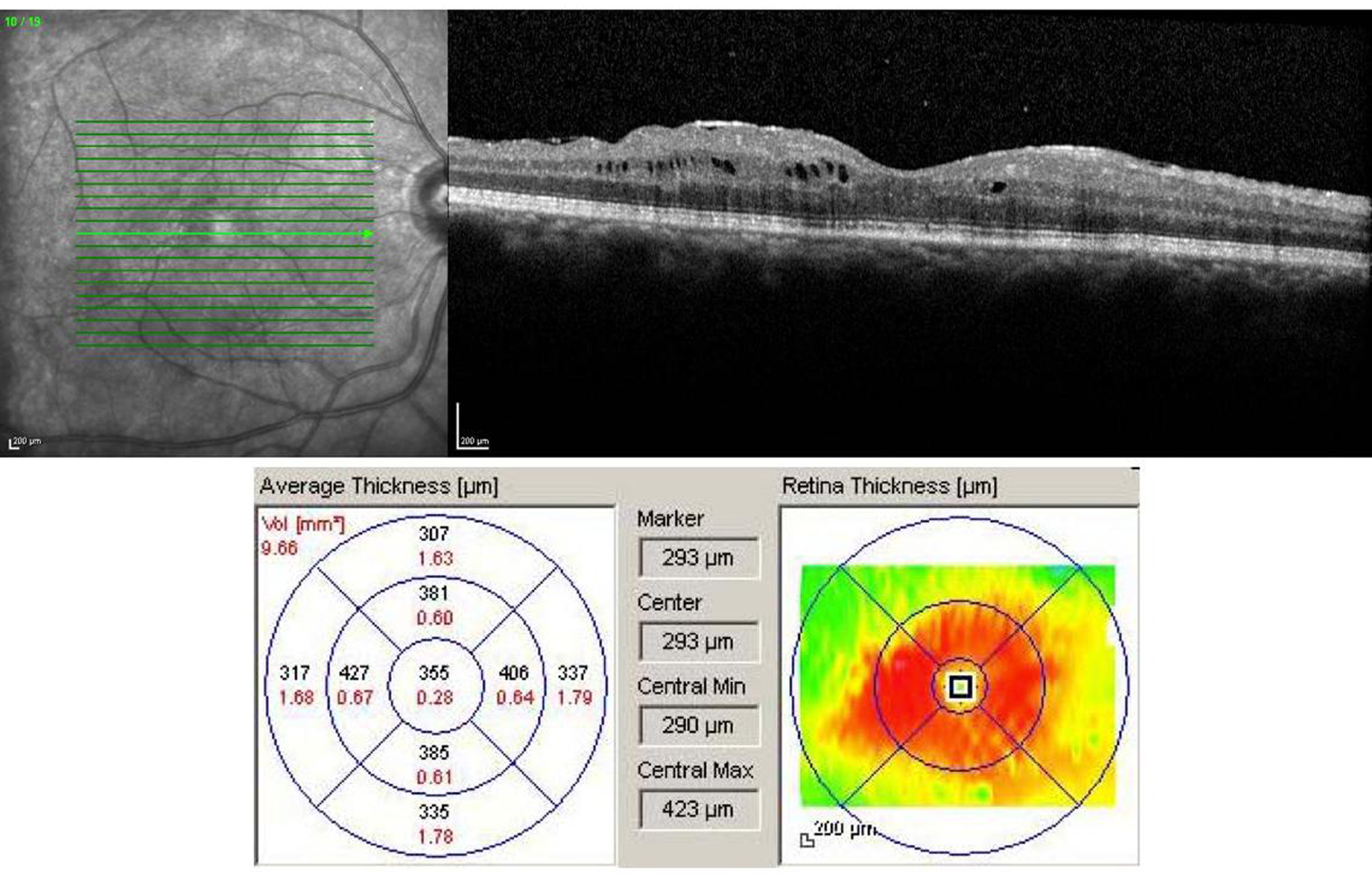
eFig. 10-3 Œdème maculaire diffus caractérisé par la présence de fluide intrarétinien et un épaississement anormal de la rétine.
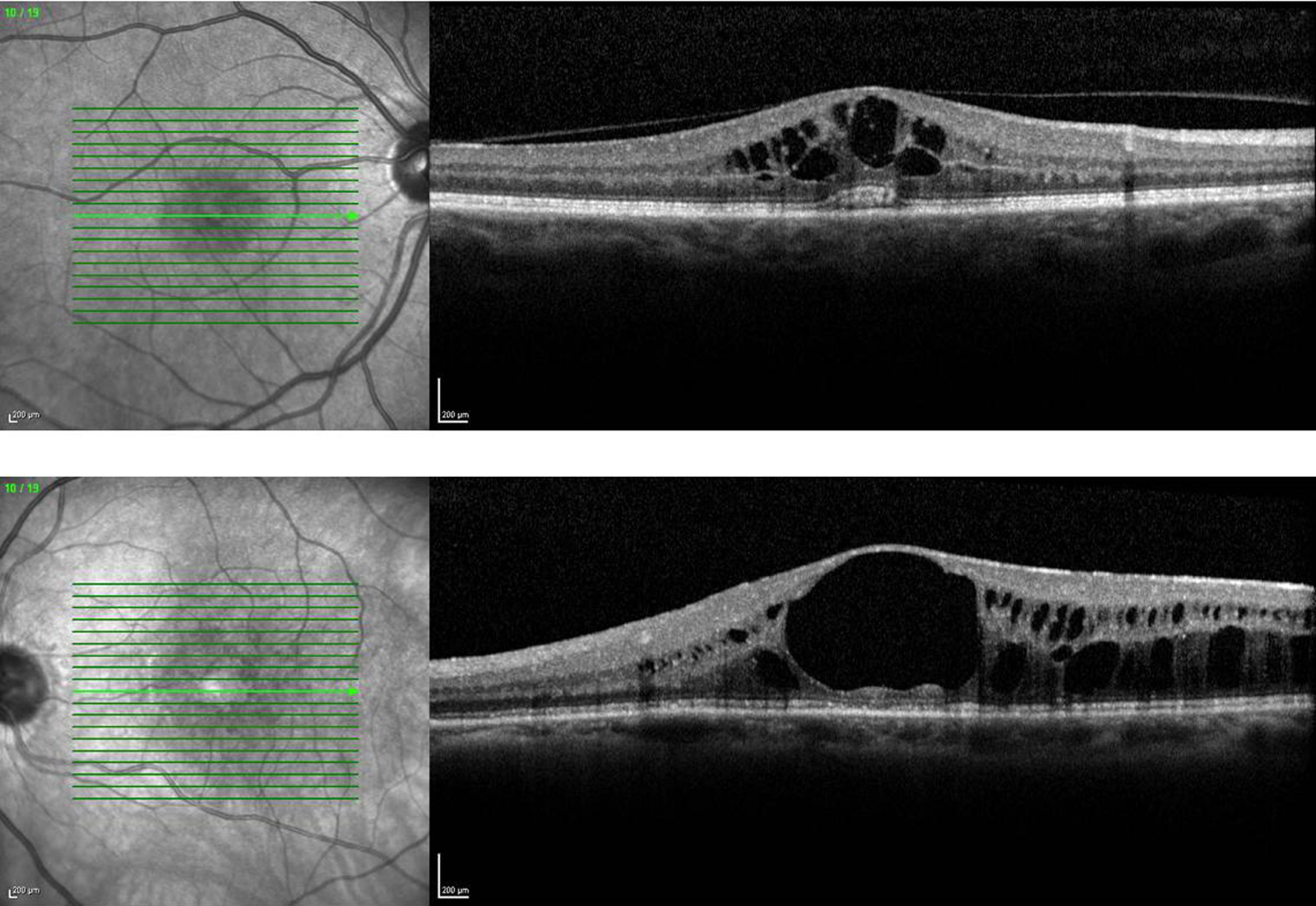
eFig. 10-4 Œdèmes maculaires cystoïdes avec œdème intra-rétinien et logettes cystoïdes compliquant une uvéite intermédiaire.
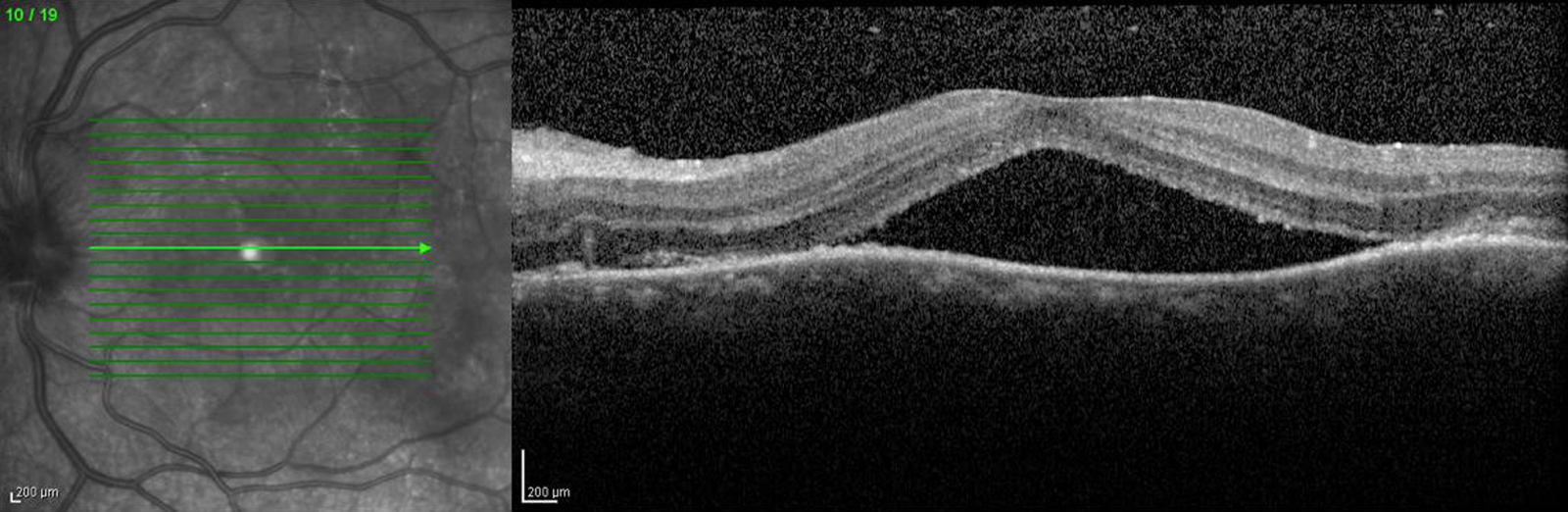
eFig. 10-5 Décollement séreux rétinien chez une patiente ayant une rétinochoroïdite de Birdshot.
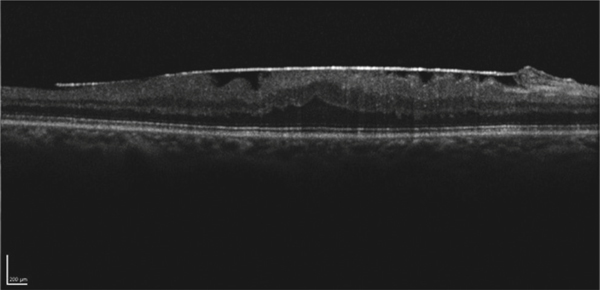
Fig. 10-31 Membrane épirétinienne.
(Source : photographie du Dr M. Weber.)
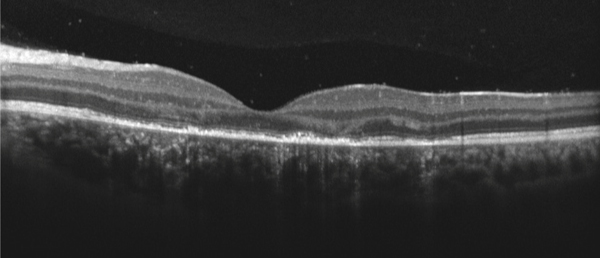
Fig. 10-32 Atrophie maculaire débutante, avec rupture de la ligne ellipsoïde.
Avant l’avènement de l’OCT, l’OM était quantifié indirectement sur l’angiographie à la fluorescéine par l’importance des diffusions maculaires. Une classification en quatre stades des diffusions maculaires a été proposée (tableau 10-5). Cependant, même s’il n’existe pas de classification analogue de l’OM en OCT, le diagnostic et le suivi des OM inflammatoires ont largement bénéficié de l’usage de l’OCT qui est la méthode de référence pour détecter et quantifier de façon reproductible et non invasive l’épaisseur rétinienne maculaire. De plus, l’OCT permet d’apprécier précisément la répartition de la distribution du liquide intrarétinien, alors que les diffusions angiographiques se superposent et ne permettent pas ce type d’analyse (tableau 10-6). En effet, l’augmentation de l’épaisseur rétinienne en OCT a une définition anatomique et apparaît mieux corrélée à la baisse de l’acuité visuelle que les diffusions observées en angiographie à la fluorescéine. Ainsi des diffusions observées à l’angiographie peuvent ne pas avoir de traduction à l’OCT et ne pas être associées à un épaississement rétinien en OCT [11–13] ; inversement un OM rétinien à l’OCT peut n’avoir aucune traduction angiographique. Par ailleurs, l’OCT est largement supérieur à l’angiographie pour l’analyse des rapports vitréorétiniens (membrane épirétinienne, syndrome de traction vitréomaculaire), des pathologies maculaires (trou lamellaire, trou maculaire). Enfin plus récemment l’enhanced depth imaging – optical coherence tomography (EDI-OCT) et le swept-source OCT permettent d’analyser la choroïde en quantifiant son épaisseur et objectivent un élément important dans la compréhension physiopathogénique de certaines uvéites postérieures (maladie de Vogt-Koyanagi-Harada, épithéliopathie en plaques, etc.).
L’angiographie garde toutefois une place importante dans le diagnostic des maladies inflammatoires rétiniennes, car c’est le seul examen permettant d’analyser la vascularisation rétinienne et choroïdienne, et ainsi de mettre en évidence des diffusions à partir des vaisseaux rétiniens (vascularites, périphlébites), de la papille (papillite), ou une ischémie maculaire. L’angiographie est beaucoup moins utilisée dans le cadre du suivi des OM et de l’évaluation des résultats des traitements depuis l’avènement de l’OCT [5, 11, 14].

Tableau 10-5 Classification des diffusions maculaires en angiographie à la fluorescéine d’après Spaide et al., 1993.

Tableau 10-6 Principaux critères d’analyse de l’œdème maculaire inflammatoire en OCT.
La diminution de l’épaisseur maculaire rétinienne par atrophie maculaire peut être l’aboutissement de tout processus inflammatoire chronique intéressant le pôle postérieur [15]. À un OM inflammatoire peut faire suite une atrophie maculaire, constituant une séquelle fréquemment observée à la phase post-inflammatoire. Il s’agit de la deuxième complication et cause de baisse d’acuité visuelle définitive après l’OM. Cette atrophie est associée à un pronostic visuel défavorable, avec une chute irréversible de l’acuité visuelle, correspondant à des dégâts structurels définitifs au niveau de la macula et la perte quasiment systématique de la ligne ellipsoïde. L’OCT est un examen adapté et particulièrement sensible pour mettre en évidence une atrophie maculaire. Elle peut être définie par une diminution franche de l’épaisseur fovéolaire centrale (inférieure à 200 μm, limite inférieure dépendante des modèles d’OCT), une augmentation de la largeur de la dépression fovéolaire. L’atrophie maculaire peut également faire suite à une ischémie maculaire d’origine inflammatoire (maladie de Behçet).
La néovascularisation choroïdienne maculaire est une complication potentielle de certaines étiologies d’uvéite postérieure. Elle est essentiellement rencontrée dans les uvéites postérieures avec une fréquence très variable dépendante de l’étiologie : les néovaisseaux choroïdiens s’observent de manière occasionnelle au cours de la choriorétinopathie de type Birdshot (2 à 3 % des cas, série personnelle), alors qu’il s’agit d’une complication très fréquente des choroïdites ponctuées internes (punctual internal choroidite [PIC]) [16]. Des uvéites de causes infectieuses, dont la plus fréquente est la toxoplasmose, peuvent occasionnellement se compliquer de néovascularisation. L’OCT permet d’objectiver et de détecter précocement cette néovascularisation choroïdienne, ainsi que de juger de l’efficacité du traitement au cours du suivi.
L’inflammation intravitréenne et/ou rétinienne prolongée constitue un important facteur de risque de développement d’une membrane épirétinienne (MER). Les uvéites intermédiaires chroniques sont l’une des formes d’uvéites pour laquelle cette complication est le plus fréquemment observée. La présence d’une MER peut rendre difficile l’évaluation de l’OM en OCT ou masquer une atrophie rétinienne. Par ailleurs, les MER peuvent, par elles-mêmes, pérenniser un OM et/ou des diffusions périfovéolaires, même après la résolution de la phase inflammatoire d’une uvéite. La présence d’une membrane épirétinienne augmente la fréquence de survenue d’un OM et complique sa prise en charge thérapeutique. L’angiographie à la flurorescéine est un examen complémentaire utile pour juger de l’activité inflammatoire d’une uvéite postérieure (vascularite, papillite, etc.) dans ce contexte de MER.
L’atteinte du segment postérieur au cours des uvéites antérieures se fait par contiguïté de l’inflammation du segment antérieur et se manifeste sous forme d’hyalite, de papillite ou d’OMC (fig. 10-33), tableau que l’on peut retrouver dans n’importe quelle situation d’inflammation intra-oculaire. Toutefois, la survenue de cette complication ne remet pas en cause la localisation de l’uvéite qui reste définie comme « antérieure », correspondant au site primitif de l’inflammation.
La fréquence de l’OM est estimée entre 6 et 13 % [17]. Il s’agit du principal élément conditionnant le pronostic visuel des uvéites antérieures. Sa détection précoce est facilitée par un examen de la macula en OCT, il est généralement de bonne évolution mais impose le recours à une injection péri-oculaire de corticoïdes (fig. 10-33). Les collyres anti-inflammatoires ont un excellent effet sur l’inflammation du segment antérieur, mais n’atteignent pas le segment postérieur, et sont donc insuffisants dans la prise en charge d’un œdème maculaire [18].
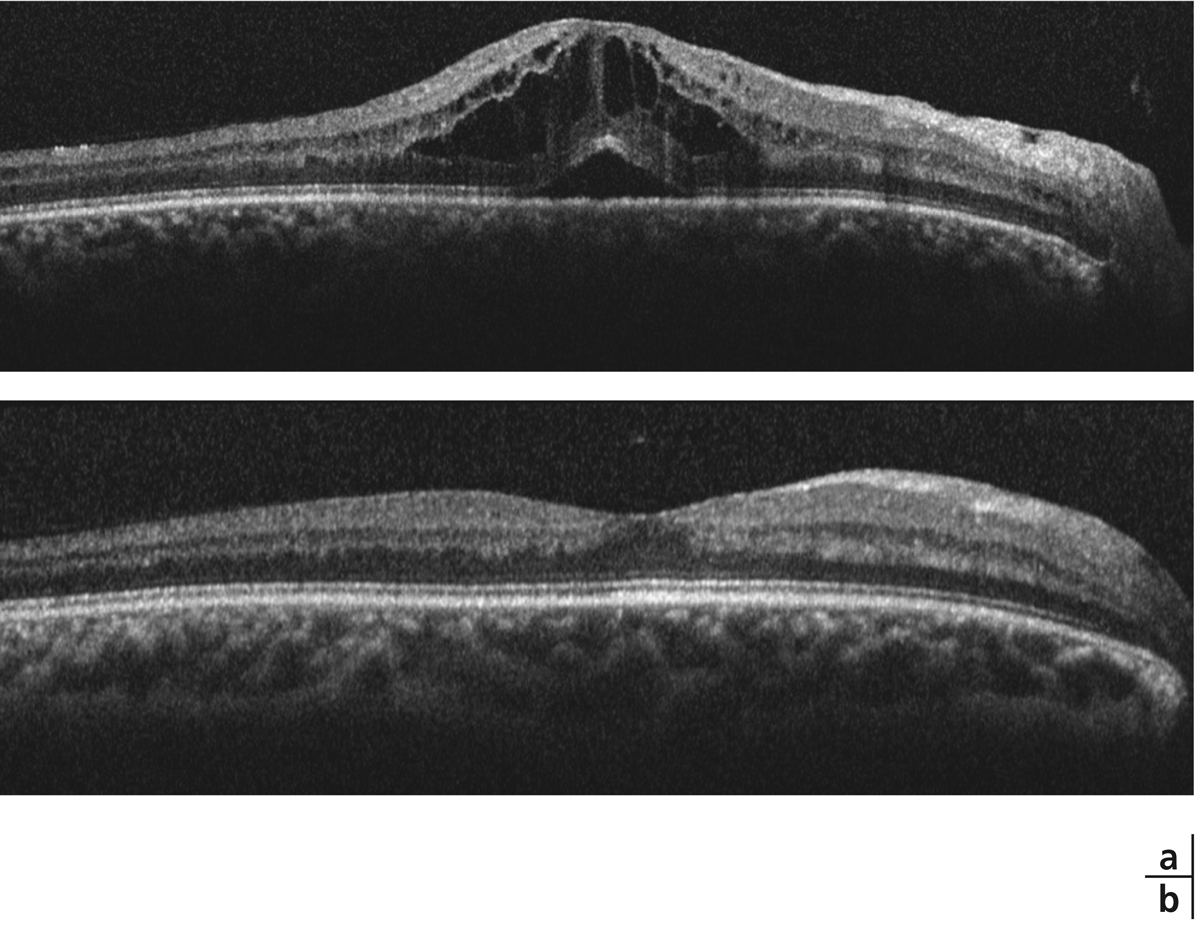
Fig. 10-33 OCT dans le cadre d’une uvéite antérieure HLA B27 compliquée d’œdème maculaire.
a. OMC avec décollement séreux rétinien. b. Un mois après l’injection sous-ténonienne de corticoïdes : résorption de l’OM et du DSR, profil fovéolaire normal.
Dans sa forme typique, la maladie de Vogt-Koyanagi-Harada (VKH) est une panuvéite bilatérale granulomateuse associée à des manifestations extra-oculaires, méningées, cutanées et de l’oreille interne. Sa prévalence est inégalement répartie dans le monde, constituant une cause rare d’uvéite dans les populations européennes mais très fréquente en Asie, autour du bassin méditerranéen et chez les Amérindiens. Lors de la phase aiguë de la maladie, les DSR et l’œdème papillaire constituent des critères diagnostiques indispensables. Une dépigmentation au fond d’œil est également fréquemment observée mais d’apparition plus tardive au cours de la maladie de VKH.
L’imagerie en OCT a permis d’observer les DSR caractéristiques de la maladie et leur réapplication après traitement [19]. Des images de murs verticaux fins, formant des espaces sous-rétiniens kystiques, sont en rapport avec le caractère multilobulaire et non confluent des DSR observés au cours de la maladie de VKH (fig. 10-34). Ces images permettent de formuler des hypothèses concernant la physiopathogénie de la maladie. Dans un premier temps, l’inflammation choroïdienne est responsable d’une rupture de la BHR interne. Cette inflammation choroïdienne est également visualisable en EDI-OCT sous la forme d’une augmentation de l’épaisseur choroïdienne [20, 21] et conduit à une accumulation de fluides sous-rétiniens. Des membranes fibrineuses se forment alors sur l’épithélium pigmentaire. L’afflux de liquide sous-rétinien pousse cette membrane fibrineuse qui, en se détachant, forme des septa, lesquels divisent l’espace sous-rétinien en compartiments donnant ces images assez caractéristiques.
Le pronostic de la maladie est généralement favorable, si la prise en charge de la maladie est précoce et si un traitement suffisamment intense (corticothérapie locale pour l’inflammation du segment antérieur, recours au bolus de corticoïdes pour le traitement des DSR) est prescrit [3]. Sous traitement, l’évolution est marquée par une réapplication des DSR. Toutefois, plusieurs complications peuvent influencer le pronostic : 11 % de néovascularistation choroïdienne et 6 % de fibrose sous-rétinienne sont rapportés [22]. Cependant, malgré cette fibrose sous-rétinienne, l’acuité visuelle reste supérieure à 5/10 dans 35 % des cas. Des manifestations à type de plis choroïdiens ont également été décrites et sont le témoin de la réapplication de DSR importants [23].
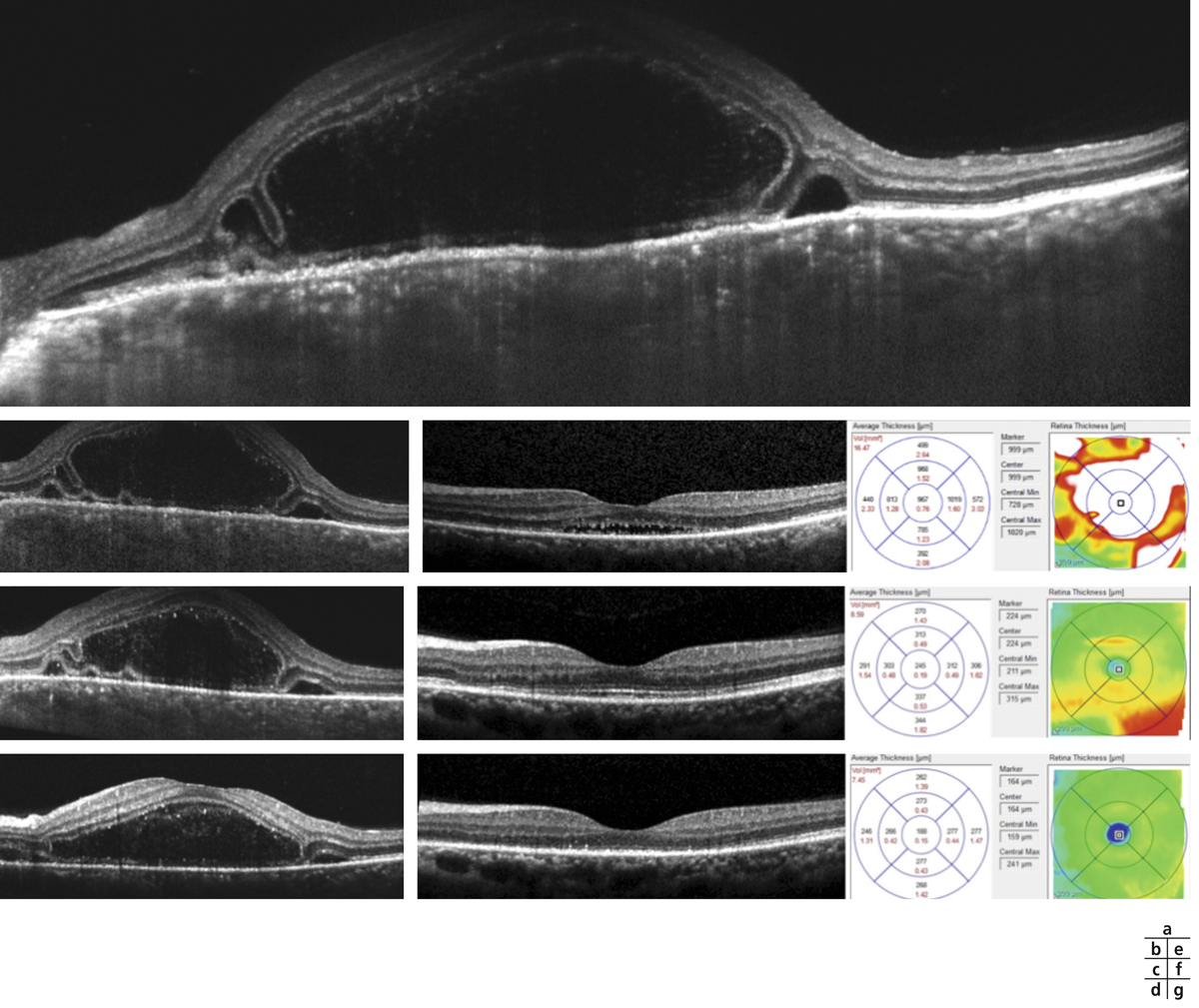
Fig. 10-34 OCT maculaire chez un patient atteint de maladie de Vogt-Koyanagi-Harada.
a. OCT initial, volumineux DSR polylobulés avec septums et contenus hétérogènes hyper-réflectifs. b à e. Évolution du DSR à l’OCT au cours des 6 mois suivants, patient traité (bolus de corticoïdes par voie intraveineuse et corticothérapie orale) : diminution progressive du DSR jusqu’à résorption complète. f. OCT à 6 mois : disparition du DSR, profil maculaire conservé. g. OCT à 8 mois : disparition du DSR mais perte de la ligne ellipsoïde.
Il s’agit d’un tableau clinique et angiographique caractéristique, qui touche l’adulte jeune en bonne santé, présentant une baisse visuelle bilatérale indolore. Au fond d’œil, on observe des lésions blanc jaunâtre profondes, multiples, de moins d’un diamètre papillaire, disséminées au pôle postérieur. Après quelques jours, les taches blanches commencent à cicatriser en leur centre, puis au niveau de la lésion entière, pouvant laisser des remaniements pigmentaires cicatriciels.
L’angiographie à la fluorescéine est assez caractéristique et montre une hypofluorescence précoce des lésions, suivi d’une hyperfluorescence tardive, avec parfois une imprégnation des bords rétiniens avec un liseré hyperfluorescent plus marqué. L’ICG retrouve un retard de remplissage et une hypoperfusion choroïdienne, dont la surface est plus étendue que les lésions visibles au fond d’œil. L’OCT permet de visualiser une augmentation de la réflectivité de la couche des photorécepteurs, avec un déplacement antérieur de la neurorétine, qui s’accompagne d’un épaississement périfovéolaire, sans réel OM (fig. 10-35). À la phase cicatricielle, on observe une résolution de ce déplacement antérieur, avec une normalisation du profil maculaire, mais les remaniements de la couche des photorécepteurs persistent, avec des altérations de l’épithélium pigmentaire (surtout lorsqu’il existe une plaque maculaire lors de la phase initiale). À la phase aiguë, en cas de DSR associé, le diagnostic différentiel avec une maladie de VKH peut être difficile, et repose sur l’angiographie et l’existence de signes associés dans le cas de celle-ci.
Le pronostic visuel est spontanément favorable avec une récupération de l’acuité visuelle après 6 mois de 8/10 à 10/10 en moyenne, mais avec persistance possible de petits scotomes. Les complications observées sont rares et dominées par l’apparition de néovaisseaux choroïdiens, à l’origine d’une exsudation rétinienne visible à l’OCT [14, 16].
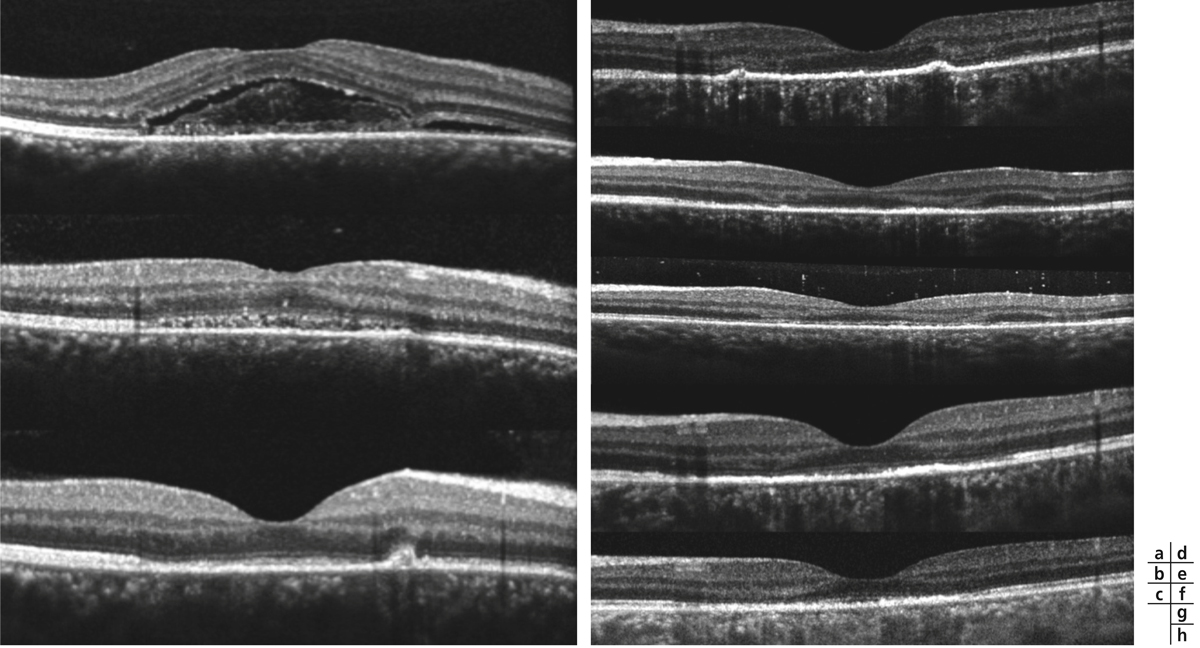
Fig. 10-35 Épithéliopathie en plaques : évolution en OCT.
a-c. Premier cas avec plaque maculaire, hyper-réflectivité des couches externes rétiniennes et épaississement rétinien en regard. DSR associé. Le diagnostic différentiel avec une maladie de Vogt-Koyanagi-Harada peut être difficile à ce stade à l’OCT. Au cours du temps, en l’absence de traitement, le DSR disparaît, la rétine se réapplique. À la phase cicatricielle, il persiste des interruptions focales de la ligne ellipsoïde. L’épithélium pigmentaire apparaît irrégulier et cicatriciel. d-h. Second cas avec plaque maculaire, une augmentation de la réflectivité des couches externes rétiniennes, sans épaississement rétinien en regard. Déplacement antérieur de la ligne des photorécepteurs avec interruption focale de la troisième ligne. L’évolution au cours du temps est marquée par la disparition de ce déplacement antérieur, la persistance de l’interruption focale de la ligne ellipsoïde, un amincissement des couches rétiniennes nucléaires externes, une hyper-réflectivité des couches externes par atrophie de l’épithélium pigmentaire.
Le terme d’uvéite intermédiaire est utilisé pour le sous-groupe des uvéites où le vitré est le site principal de l’inflammation. La présence d’engainements vasculaires périphériques et/ou l’existence d’un OM sont les signes les plus fréquemment associés à la hyalite et classiques au cours des uvéites intermédiaires, ne remettant pas en cause leur définition. Le terme de pars planite était réservé au groupe d’uvéites intermédiaires où l’on retrouvait une banquise inférieure ou la formation de condensations vitréennes (snowballs) survenant en l’absence de toutes étiologies infectieuses ou systémiques, il est désormais inclus dans la définition des uvéites intermédiaires.
L’OCT permet la détection précoce de l’OM. Il permet également de suivre son évolution et de guider les indications thérapeutiques d’injections péri- et intra-oculaires de corticoïdes (eFig. 10-6 ) [4]. La limite de son utilisation dans cette indication est la présence d’une hyalite importante, provoquant des interférences dans la captation du signal, bien que les progrès des dernières générations d’OCT permettent de faire reculer ces limites [24].
) [4]. La limite de son utilisation dans cette indication est la présence d’une hyalite importante, provoquant des interférences dans la captation du signal, bien que les progrès des dernières générations d’OCT permettent de faire reculer ces limites [24].
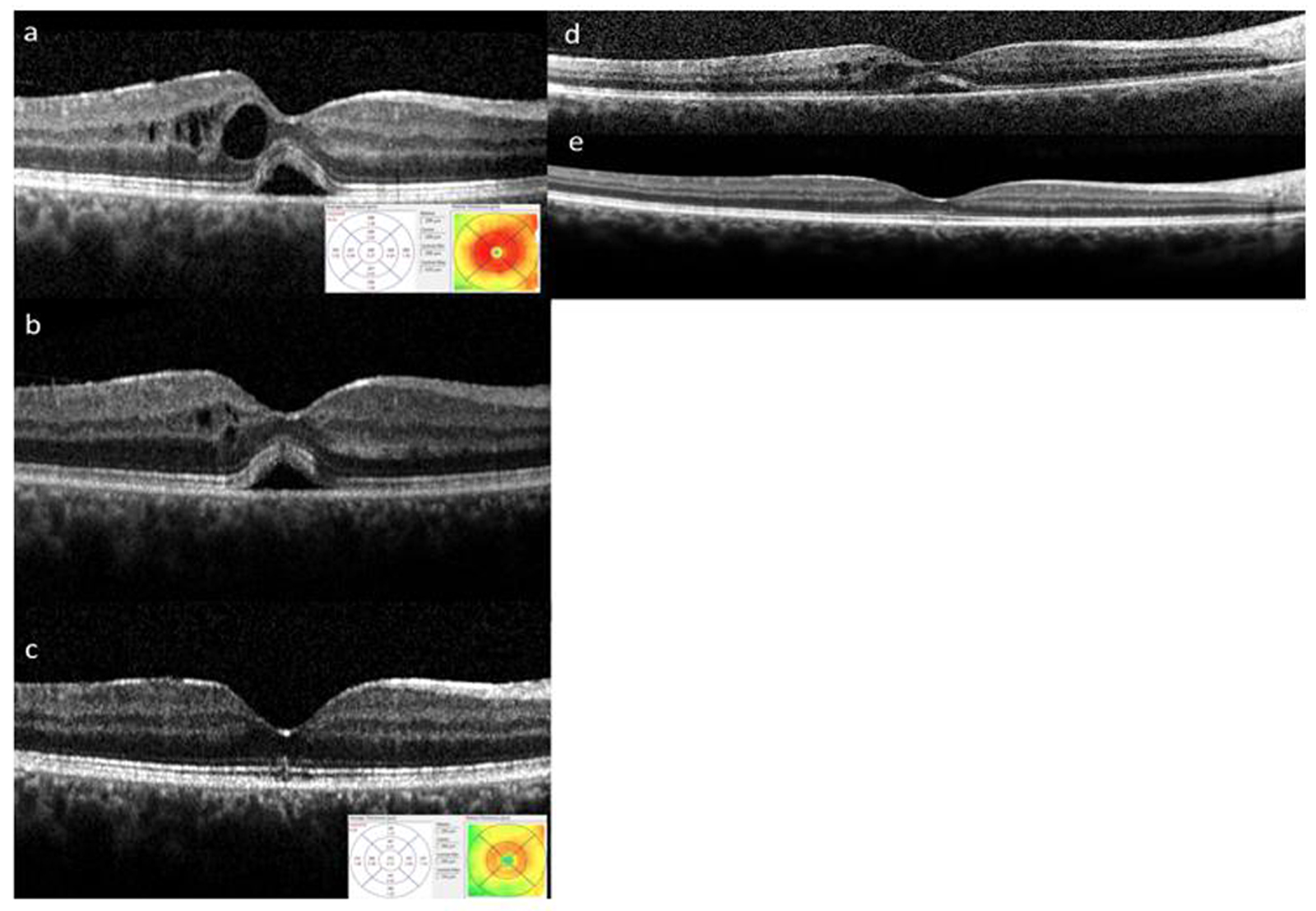
eFig. 10-6 OCT dans le cadre d’une uvéite intermédiaire chronique.
La maladie de Birdshot est une uvéite postérieure bilatérale, caractérisée par des lésions blanchâtres au fond d’œil, multiples, disséminées avec une prédominance en moyenne périphérie nasale, évoquant des impacts de chevrotine qui ont donné le nom à la maladie. L’âge moyen de survenue est de 53 ans. Un œdème papillaire est fréquent, ainsi que la survenue d’un OMC qui touche de 35 à 84 % des patients selon les séries [25, 26]. Une inflammation des veines rétiniennes du pôle postérieure est habituelle, évaluée au mieux par l’angiographie à la fluorescéine. La choriorétinopathie de Birdshot est la maladie la plus fréquemment associée à un antigène human leukocyte antigen (HLA) de classe 1 avec près de 100 % de patients porteurs de l’allèle HLA A29. Dans les formes compliquées d’OM, l’association de ciclosporine ou de mycophénolate mofétil avec une corticothérapie per os est le traitement le plus utilisé [27, 28].
L’OCT est particulièrement utile dans le suivi des uvéites postérieures en permettant de classer schématiquement la macula des patients atteints en trois types : aspect normal, œdémateux ou atrophique. Cette analyse permet de renseigner au mieux sur la cause de la baisse visuelle et son pronostic. Il existe une corrélation entre l’épaisseur maculaire mesurée en OCT et l’acuité visuelle des patients, qui chute en cas d’OM ou d’atrophie [29]. Une baisse visuelle peut être observée en cas d’épaisseur maculaire normale, correspondant souvent alors à une séquelle d’œdème ou d’atrophie rétinienne marquée par la perte de la ligne ellipsoïde.
L’OM en cas de maladie de Birdshot peut prendre un aspect très varié, du plus diffus au plus localisé, associé ou non à des diffusions en angiographie (fig. 10-36) [30].
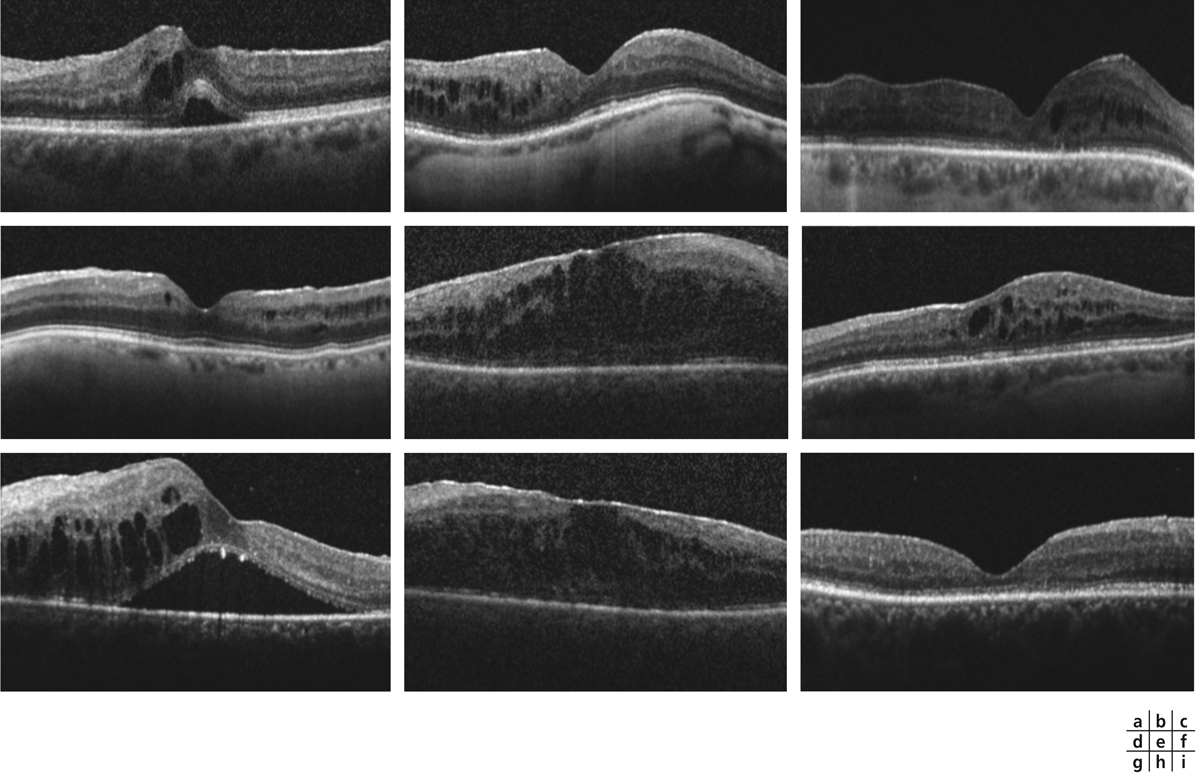
Fig. 10-36 Différents types d’œdèmes dans le cadre d’une choriorétinopathie de type Birdshot.
a. Œdème rétinien associé à un décollement de l’épithélium pigmentaire. b. Œdème rétinien diffus prédominant en nasal. c, f. Œdème rétinien prédominant en temporal associé à une membrane épirétinienne adhérente. d. Œdème rétinien diffus minime. e, h. Œdème rétinien diffus sévère. g. Œdème rétinien prédominant en nasal associé à un volumineux DSR. i. Atrophie rétinienne avec perte de la ligne ellipsoïde.
L’uvéite postérieure de la maladie de Behçet est la manifestation inflammatoire la plus fréquente et la plus grave, menaçant le pronostic visuel, car elle réalise souvent une uvéopapillite avec un risque de vascularites rétiniennes occlusives. Une hyalite d’importance variée et des plages multiples de rétinite hémorragique peuvent s’y associer. Les manifestations vaso-occlusives rétiniennes récidivantes qui en découlent, conditionnent pour une très grande part le pronostic fonctionnel visuel de cette maladie, qui peut évoluer vers une atrophie de la rétine, des vaisseaux, du nerf optique et de l’épithélium pigmentaire [31, 32].
La complication la plus fréquente est l’OMC (50 % des cas). L’évolution se fait soit vers une résolution sous traitement adapté (eFig. 10-7 ), soit vers la chronicité et des modifications structurelles, dont parfois l’apparition d’un trou maculaire lamellaire ou de pleine épaisseur. Le risque d’ischémie maculaire brutale secondaire à des occlusions artériolaires est particulièrement redouté. L’angiographie à la fluorescéine reste le seul examen capable de mettre en évidence des vascularites occlusives, tandis que l’analyse maculaire et le pronostic visuel (œdème, atrophie maculaire post-ischémie, etc.) est mieux apprécié par l’OCT.
), soit vers la chronicité et des modifications structurelles, dont parfois l’apparition d’un trou maculaire lamellaire ou de pleine épaisseur. Le risque d’ischémie maculaire brutale secondaire à des occlusions artériolaires est particulièrement redouté. L’angiographie à la fluorescéine reste le seul examen capable de mettre en évidence des vascularites occlusives, tandis que l’analyse maculaire et le pronostic visuel (œdème, atrophie maculaire post-ischémie, etc.) est mieux apprécié par l’OCT.

eFig. 10-7 Vascularites occlusives du pôle postérieur dans le cadre d’une maladie de Behçet.
La toxoplasmose oculaire est la cause la plus fréquente d’inflammation du segment postérieur d’origine infectieuse [16]. Sous la forme de kystes, le parasite Toxoplasma gondii peut se maintenir de manière quiescente et prolongée dans les tissus humains. L’œil constitue le principal organe cible des manifestations symptomatiques de l’infection, qui peut être congénitale ou acquise. Le pronostic est sévère en cas d’atteinte maculaire. L’OCT permet d’observer in vivo des lésions de toxoplasmose oculaire, aide au diagnostic et guide le traitement en particulier anti-inflammatoire (eFig. 10-8 ). Les foyers actifs sont caractérisés en OCT par une lésion hyper-réflective avec fréquemment la mise en évidence en regard du foyer d’un décollement partiel de la hyaloïde postérieure, infiltrée de cellules inflammatoires. Les foyers cicatriciels sont, quant à eux, caractérisés par une atrophie rétinienne au site des lésions et rendent inutiles tout traitement. L’OCT est également utile pour objectiver et quantifier un DSR compliquant une toxoplasmose active et/ou une néovascularisation rendant nécessaire un traitement par corticoïdes à forte dose.
). Les foyers actifs sont caractérisés en OCT par une lésion hyper-réflective avec fréquemment la mise en évidence en regard du foyer d’un décollement partiel de la hyaloïde postérieure, infiltrée de cellules inflammatoires. Les foyers cicatriciels sont, quant à eux, caractérisés par une atrophie rétinienne au site des lésions et rendent inutiles tout traitement. L’OCT est également utile pour objectiver et quantifier un DSR compliquant une toxoplasmose active et/ou une néovascularisation rendant nécessaire un traitement par corticoïdes à forte dose.
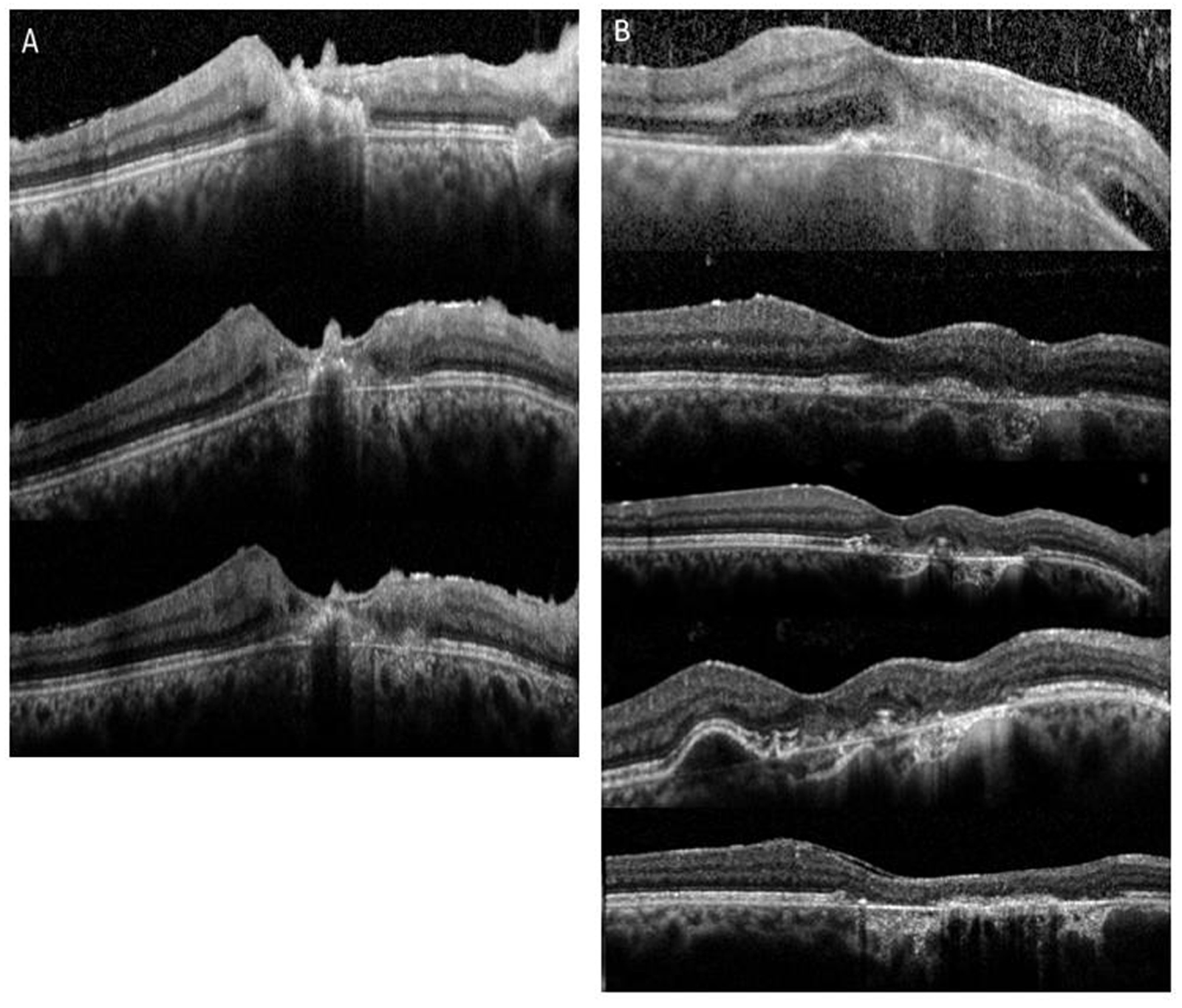
eFig. 10-8 Toxoplasmose maculaire.
À travers ce chapitre et ces quelques exemples d’uvéites caractéristiques, nous avons pu montrer que l’OCT permet la détection précoce d’un OM, même minime, non détectable au fond d’œil pouvant compliquer toutes les causes d’uvéites. L’OCT permet également de déterminer le type d’OM et la localisation précise des fluides rétiniens : OM avec ou sans logettes cystoïdes, associé ou non à un DSR. L’OCT est particulièrement utile dans la recherche des anomalies associées, qui peuvent notamment gêner l’effet des traitements, qu’il s’agisse de membrane épirétinienne, d’un syndrome de traction vitréomaculaire, de trou lamellaire ou maculaire.
L’OCT est désormais un examen indispensable pour guider le traitement des uvéites et suivre ces effets sur l’OM. Enfin, l’OCT renseigne sur le pronostic visuel des patients souffrant d’uvéite, à travers notamment l’interruption de la ligne ellipsoïde ou l’apparition d’une dégénérescence kystique de la rétine.
[1] Lardenoye CWTA, van Kooij B, Rothova A. Impact of macular edema on visual acuity in uveitis. Ophthalmology 2006 ; 113 : 1446-9.
[2] Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Measurement in patients with cystoid macular edema. Ophthalmology 1987 ; 94 : 1134-9.
[3] Taylor SRJ, Lightman SL, Sugar EA, et al. The impact of macular edema on visual function in intermediate, posterior, and panuveitis. Ocul Immunol Inflamm 2012 ; 20 : 171-81.
[4] Rothova A. Medical treatment of cystoid macular edema. Ocul Immunol Inflamm 2002 ; 10 : 239-46.
[5] Ouyang Y, Keane PA, Sadda SR, Walsh AC. Detection of cystoid macular edema with three-dimensional optical coherence tomography versus fluorescein angiography. Invest Ophthalmol Vis Sci 2010 ; 51 : 5213-8.
[6] Tran TH, de Smet MD, Bodaghi B, et al. Uveitic macular oedema : correlation between optical coherence tomography patterns with visual acuity and fluorescein angiography. Br J Ophthalmol 2008 ; 92 : 922-7.
[7] Chan A, Duker JS. A standardized method for reporting changes in macular thickening using optical coherence tomography. Arch Ophthalmol 2005 ; 123 : 939-43.
[8] Markomichelakis NN, Halkiadakis I, Pantelia E, et al. Patterns of macular edema in patients with uveitis : qualitative and quantitative assessment using optical coherence tomography. Ophthalmology 2004 ; 111 : 946-53.
[9] Grover S, Murthy RK, Brar VS, Chalam KV. Normative data for macular thickness by high-definition spectral-domain optical coherence tomography (Spectralis). Am J Ophthalmol 2009 ; 148 : 266-71.
[10] Roesel M, Henschel A, Heinz C. Fundus autofluorescence and spectral domain optical coherence tomography in uveitic macular edema. Graefes Arch Clin Exp Ophthalmol 2009 ; 247 : 1685-9.
[11] Ossewaarde-van Norel J, Camfferman LP, Rothova A. Discrepancies between fluorescein angiography and optical coherence tomography in macular edema in uveitis. Am J Ophthalmol 2012 ; 154 : 233-9.
[12] Regatieri CV, Alwassia A, Zhang JY, et al. Use of optical coherence tomography in the diagnosis and management of uveitis. Int Ophthalmol Clin 2012 ; 52 : 33-43.
[13] Brar M, Yuson R, Kozak I, et al. Correlation between morphological features on spectral domain optical coherence tomography and angiographic leakage patterns in macular edema. Retina 2010 ; 30 : 383-9.
[14] Sugar EA, Jabs DA, Altaweel MM, et al. Identifying a clinically meaningful threshold for change in uveitic macular edema evaluated by optical coherence tomography. Am J Ophthalmol 2011 ; 152 : 1044-52.e5.
[15] Rothova A, Suttorp-van Schulten MS, Frits Treffers W, Kijlstra A. Causes and frequency of blindness in patients with intraocular inflammatory disease. Br J Ophthalmol 1996 ; 80 : 332-6.
[16] Jabs DA, Nussenblatt RB, Rosenbaum JT, Standardization of Uveitis Nomenclature (SUN) Working Group. Standardization of uveitis nomenclature for reporting clinical data. Results of the First International Workshop. Am J Ophthalmol 2005 ; 140 : 509-16.
[17] Loh AR, Acharya NR. Incidence rates and risk factors for ocular complications and vision loss in HLA-B27-associated iveitis. Am J Ophthalmol 2010 ; 150 : 534-42.e2.
[18] Braakenburg AMD, de Valk HW, de Boer J, Rothova A. Human leukocyte antigen-B27 – associated uveitis : long-term follow-up and gender differences. Am J Ophthalmol 2008 ; 145 : 472-9.
[19] Baltmr A, Lightman S, Tomkins-Netzer O. Examining the choroid in ocular inflammation : a focus on enhanced depth imaging. J Ophthalmol 2014 ; 2014 : 459136.
[20] Géhl Z, Kulcsár K, Kiss HJ, et al. Retinal and choroidal thickness measurements using spectral domain optical coherence tomography in anterior and intermediate uveitis. BMC Ophthalmol 2014 ; 14 : 103.
[21] Mrejen S, Spaide RF. Optical coherence tomography : imaging of the choroid and beyond. Surv Ophthalmol 2013 ; 58 : 387-429.
[22] Read RW, Yu F, Accorinti M, et al. Evaluation of the effect on outcomes of the route of administration of corticosteroids in acute Vogt-Koyanagi-Harada disease. Am J Ophthalmol 2006 ; 142 : 119-24.
[23] Read RW, Rechodouni A, Butani N, et al. Complications and prognostic factors in Vogt-Koyanagi-Harada disease. Am J Ophthalmol 2001 ; 131 : 599-606.
[24] Keane PA, Karampelas M, Sim DA, et al. Objective Measurement of vitreous inflammation using optical coherence tomography. Ophthalmology 2014 ; 121 : 1706-14.
[25] Monnet D, Brézin AP, Holland GN, et al. Longitudinal cohort study of patients with birdshot chorioretinopathy. I. Baseline clinical characteristics. Am J Ophthalmol 2006 ; 141 : 135-42.
[26] Monnet D, Levinson RD, Holland GN, et al. Longitudinal cohort study of patients with birdshot chorioretinopathy. III. Macular imaging at baseline. Am J Ophthalmol 2007 ; 144 : 818-28.
[27] Baarsma GS, Kijlstra A, Oosterhuis JA, et al. Association of birdshot retinochoroidopathy and HLA-A29 antigen. Doc Ophthalmol Adv Ophthalmol 1986 ; 61(3-4) : 267-9.
[28] Becker MD, Wertheim MS, Smith JR, Rosenbaum JT. Long-term follow-up of patients with birdshot retinochoroidopathy treated with systemic immunosuppression. Ocul Immunol Inflamm 2005 ; 13 : 289-93.
[29] Monnet D, Levinson RD, Holland GN, et al. Longitudinal cohort study of patients with birdshot chorioretinopathy. III. Macular imaging at baseline. Am J Ophthalmol 2007 ; 144 : 818-28.
[30] Brézin AP, Monnet D, Cohen JHM, Levinson RD. HLA-A29 and birdshot chorioretinopathy. Ocul Immunol Inflamm 2011 ; 19 : 397-400.
[31] Ando K, Fujino Y, Hijikata K, et al. Epidemiological features and visual prognosis of Behçet’s disease. Jpn J Ophthalmol 1999 ; 43 : 312-7.
[32] Yoshida A, Kawashima H, Motoyama Y, et al. Comparison of patients with Behçet’s disease in the 1980s and 1990s. Ophthalmology 2004 ; 111 : 810-5.
M. Mauget-Faÿsse, F. De Bats, B. Wolff
➤ L’OCT « en face » apporte des éléments concernant l’étendue, la présence de logettes de l’OM et l’atteinte des couches externes de la rétine ainsi que d’éventuels éléments associés à l’OM : syndrome de l’interface vitréomaculaire, défaut de perfusion de la choriocapillaire, ou éventuel néovaisseau choroïdien.
L’analyse OCT, qu’elle soit en B-scan ou en « en face », fait partie intégrante du bilan des inflammations oculaires, d’autant plus que le patient accuse une baisse de l’acuité visuelle ou une modification de la vision des contrastes ou de la vision des couleurs. Lors du bilan, outre l’analyse fonctionnelle de l’œil, une imagerie complète et multimodale est souvent nécessaire pour apprécier s’il existe une papillite ou une vascularite associée à l’OM et aussi déceler par l’angiographie au vert d’indocyanine certains signes susceptibles d’apporter un élément diagnostique à l’inflammation (exemple des taches hypofluorescentes dans l’uvéite de Birdshot). Nous décrivons ici l’apport et les limites de l’OCT « en face » dans l’OM inflammatoire.
L’analyse de la rétine dans le plan frontal permet de cartographier l’œdème et de définir son étendue focale ou diffuse. De plus, il existe une classification des OM liés aux uvéites, selon la présence ou non de logettes intrarétiniennes et/ou de liquide sous-rétinien (fig. 10-37). Ces éléments peuvent être bien visualisés en OCT « en face » en fonction de la profondeur de la coupe dans l’épaisseur des couches rétiniennes. Enfin, l’évolution anatomique de cet œdème avec ou sans traitement est très bien appréciée (fig. 10-38).

Fig. 10-37 Coupe OCT « en face » passant par la couche nucléaire externe : visualisation des logettes d’œdème intrarétinien (flèche blanche) et du liquide sous-rétinien associé (flèche jaune).
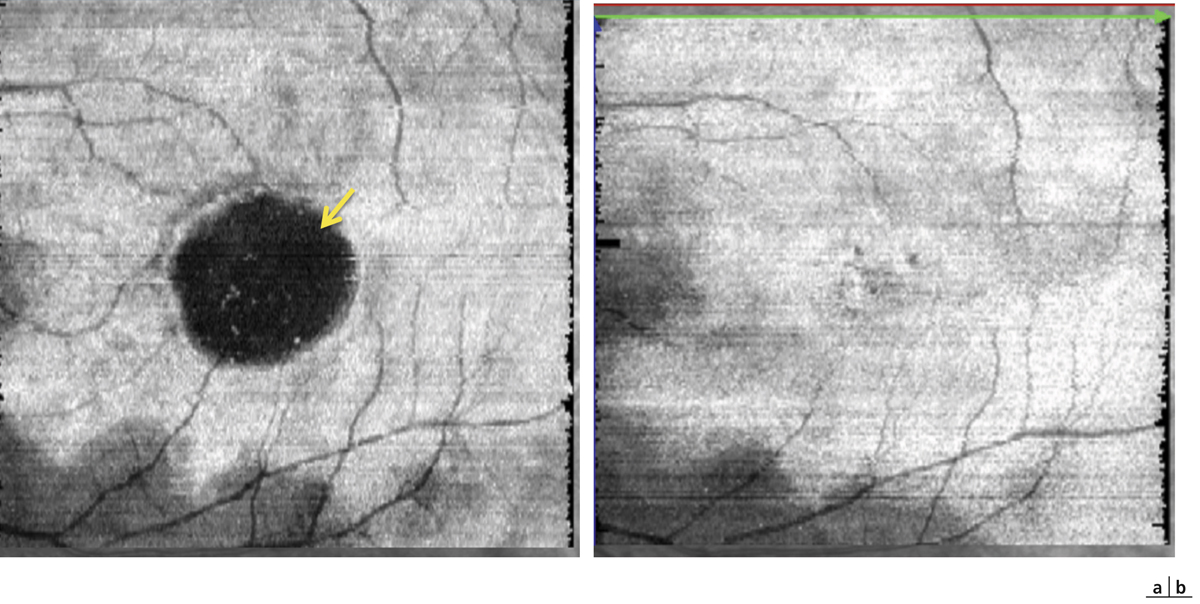
Fig. 10-38 Suivi évolutif sous traitement d’un œdème inflammatoire d’un patient atteint d’une maladie de Birdshot en OCT « en face » passant par la coupe de l’ellipsoïde.
a. Présence de liquide sous-rétinien (flèche jaune). b. Disparition complète du liquide sous-rétinien après 1 an de traitement.
En cas de pathologie de l’interface vitréomaculaire, l’OCT « en face » permet de très bien visualiser les plis rétiniens d’une membrane épirétinienne pouvant expliquer la présence de métamorphopsies (fig. 10-39) [1].
Une néovascularisation choroïdienne associée ou responsable de cet OM peut également être détectée. Cette néovascularisation est visualisée comme un faisceau arborescent hyper-réflectif, encore mieux vu en angiographie-OCT.
Un œdème papillaire associé peut être diagnostiqué sous la forme d’un élargissement aux bords flous des contours de la papille.
L’ischémie secondaire aux vascularites occlusives pourra être visualisée en OCT « en face » sous la forme d’espaces hyporéflectifs liés à une raréfaction des capillaires. Cet aspect sera mieux détecté en angiographie-OCT.
En cas d’atteinte de la rétine externe, l’étendue de l’atrophie des photorécepteurs parfois associée à l’œdème est mieux appréciée en OCT « en face » et peut expliquer l’atteinte fonctionnelle sévère des patients (fig. 10-40) [2].
Comme dans la dégénérescence maculaire liée à l’âge, des tubulations rétiniennes externes ont été décrites dans les pathologies inflammatoires. L’OCT « en face » permet de les différencier des logettes d’œdème intrarétinien exsudatives en montrant leurs interconnexions et leurs bordures hyper-réflectives caractéristiques.
Enfin, une inflammation choroïdienne associée se traduira par la présence de points hyperréflectifs sur les coupes de la choroïde [3].

Fig. 10-39 OCT « en face » passant par la coupe de la membrane limitante interne montrant les plis rétiniens superficiels hyper-réflectifs liés à la membrane épirétinienne (flèche jaune).
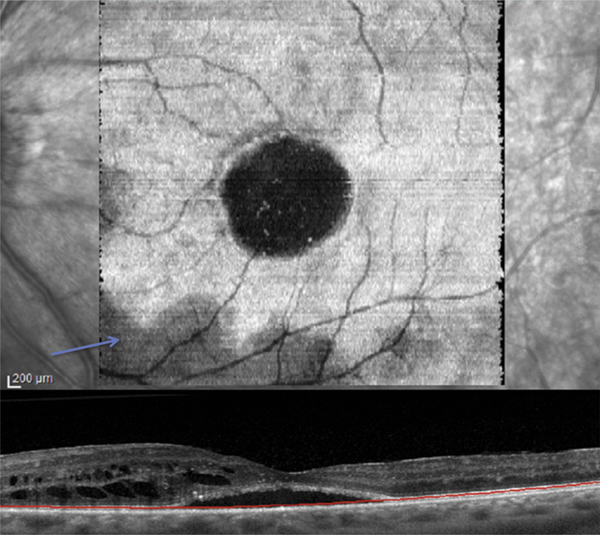
Fig. 10-40 OCT « en face » passant par la coupe de la couche ellipsoïde montrant les limites nettes de l’interruption des photorécepteurs (flèche bleue).
Dans les uvéites, le trouble des milieux reste souvent un frein à l’obtention d’images de bonne qualité.
Contrairement à l’analyse en OCT B-scan, l’OCT « en face » ne permet ni d’apprécier ni de quantifier l’épaississement rétinien.
De plus, comme en B-scan, l’image d’un OM obtenue n’est jamais pathognomonique d’une étiologie. C’est plutôt l’analyse des signes associés décrits ci-dessus qui permet d’apporter des orientations diagnostiques.
[1] Rispoli M, Le Rouic JF, Lesnoni G, et al. Retinal surface en face optical coherence tomography : a new imaging approach in epiretinal membrane surgery. Retina 2012 ; 32 : 2070-6.
[2] Wanek J, Zelkha R, Lim JI, Shahidi M. Feasibility of a method for en face imaging of photoreceptor cell integrity. Am J Ophthalmol 2011 ; 152 : 807-14.
[3] A Sohrab M, A Fawzi A. Review of en-face choroidal imaging using spectral-domain optical coherence tomography. Med Hypothesis Discov Innov Ophthalmol 2013 ; 2 : 69-73.
A.-P. Brézin
➤ Les uvéites sont des affections hétérogènes ; leur traitement dépend de leur étiologie et de leur présentation. Si l’uvéite s’inscrit dans le contexte d’une maladie systémique, la décision thérapeutique peut être guidée en premier lieu par les manifestations extra-oculaires. Si l’uvéite est une manifestation isolée, la décision thérapeutique est conditionnée par la présentation de l’inflammation oculaire.
➤ Le traitement de l’uvéite dépend de l’étiologie de l’uvéite, de la sévérité de l’OM, de son mode évolutif, des réponses observées lors de tentatives thérapeutiques précédentes éventuelles, du terrain, de l’évaluation du rapport bénéfice/risque.
➤ Les traitements systémiques comprennent la corticothérapie, les immunosuppresseurs, les interférons, les biothérapies et anticorps monoclonaux, et les inhibiteurs de l’anhydrase carbonique. Les traitements locaux comprennent les traitements topiques par corticoïdes ou anti-inflammatoires non stéroïdiens, les injections péri-oculaires et intravitréennes de corticoïdes.
➤ Dans les cas d’OM compliquant par contiguïté une uvéite antérieure, la base du traitement est le contrôle de l’inflammation du segment antérieur, habituellement obtenu par une corticothérapie topique d’intensité adaptée.
➤ En cas d’OM associé à une uvéite intermédiaire, le premier choix thérapeutique est fréquemment celui d’une injection sous-conjonctivale ou sous-ténonienne de corticoïdes.
➤ En cas d’OM associé à une uvéite postérieure, le traitement dépend de la cause de l’uvéite, en privilégiant la voie locale en l’absence de manifestations extra-oculaires associées.
Les uvéites représentent environ 10 % des causes de cécité légale dans les pays de l’hémisphère Nord et l’OM en est la cause la plus fréquente [1]. En effet, 40 % des causes de baisse d’acuité visuelle irréversible au cours des uvéites seraient liées à un OM [2]. Traiter l’OM est donc un objectif essentiel pour préserver la fonction visuelle dans le contexte d’une inflammation intra-oculaire.
Les uvéites sont des affections hétérogènes d’étiologies et de présentations diverses. À cette hétérogénéité des contextes inflammatoires répond une diversité des approches thérapeutiques. Lorsque l’uvéite s’inscrit dans le contexte d’une maladie systémique, les décisions thérapeutiques sont parfois dictées en premier lieu par les manifestations extra-oculaires. À l’inverse, lorsque l’uvéite est une manifestation isolée, les décisions thérapeutiques sont exclusivement conditionnées par la présentation de l’inflammation oculaire. Lorsqu’une inflammation est liée à une étiologie infectieuse, le traitement anti-infectieux doit être la première phase thérapeutique, avant une deuxième phase ciblée sur l’inflammation et sur l’OM. Par ailleurs, les décisions thérapeutiques sont aussi fondées sur la sévérité de l’OM, sur sa localisation uni- ou bilatérale, sur son ancienneté et le cas échéant sur sa réponse à de précédentes tentatives thérapeutiques.
La physiopathologie des OM secondaires à une uvéite comporte une inflammation associée à une rupture de la BHR, avec participation des prostaglandines et cytokines pro-inflammatoires (TNF, IL-1). L’action des corticoïdes sur l’OM comporte un effet diminuant la concentration de médiateurs de l’inflammation (IL-5, IL-6 et IL-8, prostaglandines, IFN-γ et/ou TNF) et la production de VEGF, donc la perméabilité vasculaire. Une action sur les canaux calciques favorisant la diffusion des fluides pour diminuer l’œdème serait également en cause. Enfin, les corticoïdes améliorent l’intégrité de la barrière hémato-oculaire.
Aucun traitement efficace n’est dénué d’effet secondaire, quel que soit le choix thérapeutique, que celui-ci soit local ou par voie générale. De nombreuses options de traitement sont désormais disponibles. Les voies locales peuvent être topiques, péri-oculaires ou intra-oculaires. En ce qui concerne les thérapeutiques systémiques, outre les corticoïdes, divers traitements d’épargne cortisonée, des immunosuppresseurs aux biothérapies, sont utilisés pour le traitement des OM uvéitiques. Outre les manifestations oculaires et le diagnostic étiologique, l’âge du patient, son état général, un éventuel désir de procréation, ainsi que, le cas échéant, l’observation de précédentes complications constituent autant de paramètres pris en compte dans les décisions thérapeutiques.
Les uvéites sont globalement des maladies rares. Cette rareté et l’hétérogénéité de leur présentation sont sans doute la cause du peu de données fondées sur des preuves permettant de guider les décisions thérapeutiques. Ainsi, le traitement de l’OM uvéitique n’est pas le premier critère d’étude habituel des essais randomisés contrôlés prospectifs s’intéressant à l’inflammation intra-oculaire. Un grand nombre de décisions thérapeutiques sont donc fondées sur l’expérience et restent teintées d’un certain empirisme. Dans ce contexte, les adaptations thérapeutiques sont fréquentes, un traitement pouvant se substituer ou s’additionner à un autre, selon l’évolution de l’OM uvéitique.
La corticothérapie par voie générale est le socle de base des traitements anti-inflammatoires. Cependant, ses effets secondaires (encadré 10-1
• Risque d’insuffisance surrénale à l’arrêt des corticoïdes
• Ostéoporose
• Ostéonécroses aseptiques
• Retard de croissance (enfants)
• Diabète
• Effet excitateur responsable parfois de troubles du comportement et/ou du sommeil, effet orexigène
• Obésité facio-tronculaire et prise de poids
• Aspect lunaire du visage, bosse de bison dans le bas de la nuque, comblement des creux sus-claviculaires
• Hypertrophie du tissu adipeux
• Hyperpilosité (hirsutisme)
• Fonte musculaire – amyotrophie
• Rétention hydrosodée, hypertension artérielle
• Hypokaliémie avec crampes, voire troubles du rythme cardiaque
• Dyslipidémie, majoration des lésions d’athérosclérose
• Atrophie et sécheresse cutanée, plaies superficielles itératives, retard à la cicatrisation
• Tachycardie
• Possible polyglobulie, augmentation des polynucléaires neutrophiles circulants par démargination, diminution précoce du taux de monocytes, d’éosinophiles et/ou de lymphocytes
• Augmentation du risque d’infections
) rendent son utilisation prolongée par voie générale délicate, particulièrement lorsque les doses sont supérieures à 5 à 10 mg/jour. La prescription d’une corticothérapie par voie générale doit donc toujours faire l’objet d’une analyse raisonnée de son rapport bénéfice/risque. Dans les cas d’inflammation les plus sévères, la corticothérapie peut être débutée sous forme de bolus par voie intraveineuse (IV) de méthylprednisolone, habituellement pendant 3 jours consécutifs à une posologie de 500 mg/jour. Dans les autres cas, la corticothérapie est prescrite per os, avec une posologie de prednisone habituellement débutée entre 0,5 et 1 mg/kg/jour, selon la gravité de l’inflammation. Au cours des formes chroniques d’inflammation, la décroissance recommandée des posologies est de − 10 % par paliers de 1 à 2 semaines. Dans certaines affections, telle que la maladie de Behçet, une dose résiduelle à 5 mg/jour reste régulièrement prescrite au long cours.
En raison des effets secondaires de la corticothérapie au long cours et/ou pour utiliser un mécanisme complémentaire d’action anti-inflammatoire conjuguée, les immunosuppresseurs font partie de l’arsenal des méthodes thérapeutiques disponibles pour le traitement des pathologies inflammatoires intra-oculaires, dont les OM uvéitiques. Parmi ces immunosuppresseurs, les plus utilisés sont désormais l’azathioprine, le méthotrexate et le mycophénolate (tableau 10-7). Chacun de ces immunosuppresseurs est susceptible d’entraîner des complications immédiates ou à long terme. Parmi celles-ci, une augmentation du risque des néoplasies secondaires fait partie de la liste des effets indésirables et doit donc être au premier plan de l’analyse bénéfice/risque. La ciclosporine et le tacrolimus appartiennent à une classe différente des immunosuppresseurs classiques cytotoxiques. Le principal effet secondaire de la ciclosporine est sa toxicité rénale et son action hypertensive.
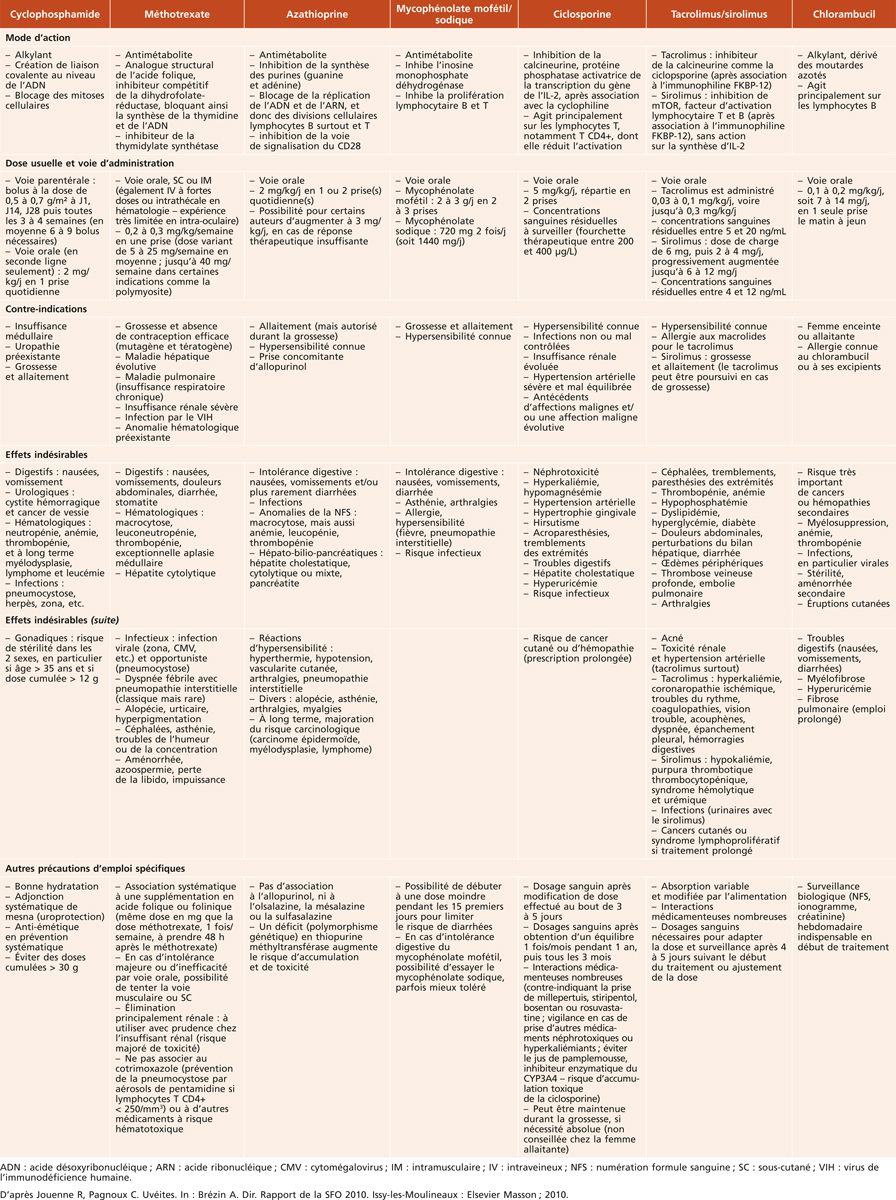
Tableau 10-7 Principales caractéristiques, modalités d’administration et précautions d’emploi des immunosuppresseurs.
Les interférons sont des cytokines ayant des actions multiples, tant pour les défenses antivirales que pour la communication entre cellules du système immunitaire. L’IFN-α a été utilisé pour le traitement des uvéites et particulièrement l’OM uvéitique. Leurs effets secondaires principaux comprennent une asthénie secondaire, des phénomènes dépressifs et des syndromes pseudo-grippaux. Une étude chez six patients ayant présenté des OM uvéitiques, dont deux au cours d’une choriorétinopathie de Birdshot et quatre au cours d’uvéites d’origine idiopathique, réfractaires au traitement anti-inflammatoire et/ou immunosuppresseur et traités par IFN-α, notait une diminution moyenne de l’épaisseur maculaire centrale de 189,7 ± 67 μm [3]. Dans une autre étude chez 24 patients présentant un OM uvéitique chronique, le traitement par IFN-α permettait une résolution complète de l’œdème dans 62,5 % des cas et une résolution partielle dans 25 % des cas, tandis qu’une inefficacité était observée chez 12,5 % des patients [4].
Ces traitements viennent bloquer, de manière ciblée, un composant de la réponse immunitaire. Leur dénomination est en partie déterminée selon une nomenclature prenant en compte leur cible et le degré d’« humanisation » de l’anticorps (tableau 10-8). Les plus utilisés sont de loin les anticorps monoclonaux dirigés contre le TNF-α, mais d’autres cibles, dont plusieurs interleukines ou leurs récepteurs, émergent parmi l’arsenal des molécules utilisées dans le domaine des uvéites (tableau 10-9). Les principaux effets secondaires des biothérapies sont infectieux. Un dépistage préthérapeutique de la tuberculose est indispensable, avec prescription d’un traitement antituberculeux en cas de doute quant à une infection même ancienne. D’autres risques comprennent des atteintes neurologiques démyélinisantes et des néoplasies secondaires (encadré 10-2
• Patients atteints de tuberculose ou d’autres infections sévères telles que sepsis, abcès et infections opportunistes
• Patients atteints d’insuffisance cardiaque modérée ou sévère (de classe III/IV dans la classification New York Heart Association [NYHA])
• Patients ayant des antécédents d’hypersensibilité à l’infliximab, aux autres protéines murines ou à l’un des excipients
• Antécédent d’infections, y compris la tuberculose
• Insuffisance cardiaque (classe I/II de la NYHA)
• Antécédent personnel ou familial d’atteintes neurologiques démyélinisantes
• Tumeurs malignes et troubles lymphoprolifératifs
• Infection par le virus de l’hépatite B
• Processus auto-immuns de type lupus érythémateux systémique
• Vaccinations avec des vaccins vivants
D’après Seror R, Pagnoux C. Uvéites. In : Brézin A. Dir. Rapport de la SFO 2010. Issy-les-Moulineaux : Elsevier Masson ; 2010.
).
Tableau 10-8 Nomenclature des anticorps monoclonaux.
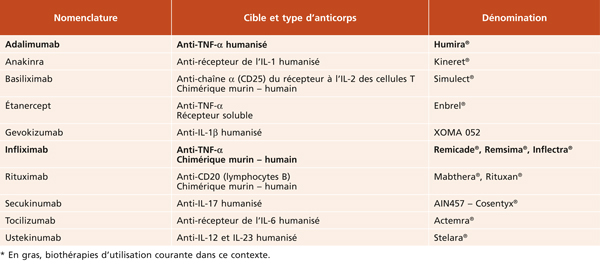
Tableau 10-9 Biothérapies ayant fait l’objet d’essais pour le traitement des uvéites*.
L’effet de l’acétazolamide per os sur l’OM uvéitique n’a pas été démontré. Une première étude randomisée, en double insu, croisée, a comporté 37 patients présentant un OM uvéitique traités par 500 mg d’acétazolamide toutes les 12 heures pendant 4 semaines, puis par placebo [5]. Une autre étude a comporté 30 patients présentant une OM uvéitique compliquant par contiguïté une uvéite antérieure chronique et traités par acétazolamide [6]. Enfin, l’effet de l’acétazolamide a également été testé dans le contexte spécifique de l’OM uvéitique compliquant la maladie de Behçet [7]. La méthodologie de ces études est ancienne, avec une analyse de l’OM fondée sur les résultats d’angiographie fluorescéinique. La méta-analyse de ces essais selon la méthodologie Cochrane permet de conclure à une absence d’efficacité de l’acétazolamide administré per os pour le traitement de l’OM uvéitique [8].
De manière générale, la diffusion insuffisante des traitements topiques jusqu’au pôle postérieur limite leur potentiel d’activité pour le traitement des OM uvéitiques. Cependant, certaines équipes proposent néanmoins l’utilisation des collyres anti-inflammatoires non stéroïdiens ou corticoïdes, en tant que traitement adjuvant ou pour un bref test thérapeutique avant l’utilisation d’un traitement par d’autres voies. Les traitements topiques anti-inflammatoires non stéroïdiens ont l’avantage d’avoir peu d’effets secondaires. L’indométhacine en collyre à 0,5 % a fait l’objet d’une étude randomisée en double insu contre placebo pour évaluer son efficacité sur l’OM uvéitique dans une série de 46 yeux traités par quatre instillations par jour pendant 6 mois [9]. Dans cette étude, un effet statistiquement significatif du traitement par indométhacine a été observé sur l’épaisseur fovéolaire centrale et sur l’acuité visuelle.
Les collyres corticoïdes topiques se compliquent, chez les sujets répondeurs, d’hypertonies oculaires. Ces hypertonies cortico-induites sont particulièrement fréquentes chez les enfants, ce qui est susceptible de limiter leur utilisation en cas d’OM compliquant par contiguïté une uvéite antérieure chronique dans un contexte d’arthrite idiopathique juvénile. De manière similaire, l’utilisation chronique d’une corticothérapie topique entraîne l’apparition d’opacités cristalliniennes.
Les différentes voies d’injection péri-oculaires comprennent les injections latérobulbaires, sous-conjonctivales ainsi que sous-ténoniennes. Dans le contexte d’OM uvéitique, les produits utilisés en injection péri-oculaire sont les corticoïdes. Le choix est habituellement celui de corticoïdes à action immédiate (dexaméthasone) pour la voie latérobulbaire et à action prolongée (triamcinolone) pour la voie d’injection sous-ténonienne, tandis que l’un ou l’autre type de corticoïde peut être utilisé par voie sous-conjonctivale. La voie d’injection sous-ténonienne nécessite l’utilisation d’une canule spécifique et l’injection est effectuée après réalisation d’une boutonnière conjonctivale à distance du limbe. Bien que très utilisée pour des injections sous-conjonctivales ou sous-ténoniennes, la triamcinolone n’a pas d’autorisation de mise sur le marché (AMM) dans cette indication. L’avantage principal de l’injection sous-conjonctivale sous-ténonienne est son absence de risque des complications associées aux injections intra-oculaires. Des dépôts de cristaux, parfois inesthétiques, peuvent être visibles dans le secteur de l’injection. Un ptosis peut également compliquer une injection sous-ténonienne. La voie dite latérobulbaire est aujourd’hui moins utilisée.
Le mode d’injection par voie sous-conjonctivale ou sous-ténonienne des corticoïdes n’évite pas les deux principales complications associées aux injections intravitréennes que sont l’accélération de l’apparition d’opacités cristalliniennes et le risque d’hypertonie oculaire. Chez les sujets répondeurs aux corticoïdes, le risque d’hypertonie cortico-induite est présent quel que soit le mode d’administration, topique, par voie péri- ou intra-oculaire, mais ce risque semble néanmoins un peu moindre en cas d’injection sous-ténonienne. La survenue d’une hypertonie oculaire après injection sous-ténonienne de corticoïdes est retrouvée dans 30 % des cas par Helm et Holland (43 injections pour 20 yeux) et dans 17,2 % cas par Levin et al. (64 injections pour 64 yeux) [10, 11]. Dans la série de Bui Quoc et al., l’hypertonie complique l’injection sous-ténonienne dans 21,3 % des cas, 15 jours après l’injection (étude sur 83 injections chez 61 patients) [12].
Les corticoïdes restent de loin la principale famille de molécules utilisées par voie d’injection intravitréennes pour le traitement des OM uvéitiques (tableau 10-10).
Tableau 10-10 Formulations de corticoïdes à effet prolongé utilisés par voie intravitréenne pour le traitement des uvéites.
Si la triamcinolone reste utilisée dans de nombreux pays, celle-ci n’a pas d’AMM en France pour cette voie d’administration, tandis que d’autres formes de corticoïdes à effet prolongé ont été spécialement conçues pour une utilisation par voie intravitréenne. Sous la marque Kenalog® comprenant 4 mg d’acétonide de triamcinolone, celle-ci est largement utilisée dans de nombreux pays. La durée de son effet, ne dépassant pas au maximum 2 à 3 mois, est réputée plus brève que celle des implants libérant de manière prolongée un corticoïde dans le vitré.
L’Ozurdex® est un implant à biodégradation spontanée, destiné à une administration par injection intravitréenne et contenant 700 μg de dexaméthasone (fig. 10-41). L’implant est composé d’un mélange de polymères d’acide polylactique et polyglycolique dont l’érosion spontanée libère progressivement la dexaméthasone. Au cours d’études expérimentales après injection d’Ozurdex® chez des primates, la concentration maximale moyenne de dexaméthasone dans le liquide sous-rétinien atteignait 1 110 ng/g, soit près de 100 fois la concentration susceptible d’être obtenue chez l’homme après administration per os, et plus de 10 fois celle obtenue après injection péribulbaire. L’étude prospective randomisée HURON avait pour objectif principal l’analyse de l’effet de l’Ozurdex® sur le haze vitréen et a inclus 229 patients présentant une uvéite intermédiaire ou postérieure d’origine non infectieuse. L’effet de l’Ozurdex® sur l’OM constituait un objectif secondaire de l’étude, qui a également été démontré. Huit semaines après injection d’Ozurdex®, l’épaisseur maculaire centrale était significativement réduite par rapport à l’état initial avec une diminution moyenne de − 91,0 μm. Toutefois, la réduction de l’épaisseur maculaire centrale devenait non significative à la 26e semaine après l’injection. L’effet le plus important sur la pression intra-oculaire était noté entre 3 et 12 semaines après l’injection. Pour les patients ayant reçu un implant de 700 μg de dexaméthasone, jusqu’à 4 % présentaient une pression intra-oculaire (PIO) supérieure à 35 mmHg et 8 % une PIO supérieure à 25 mmHg. Une cataracte était rapportée au cours de l’étude chez 12 % des patients.
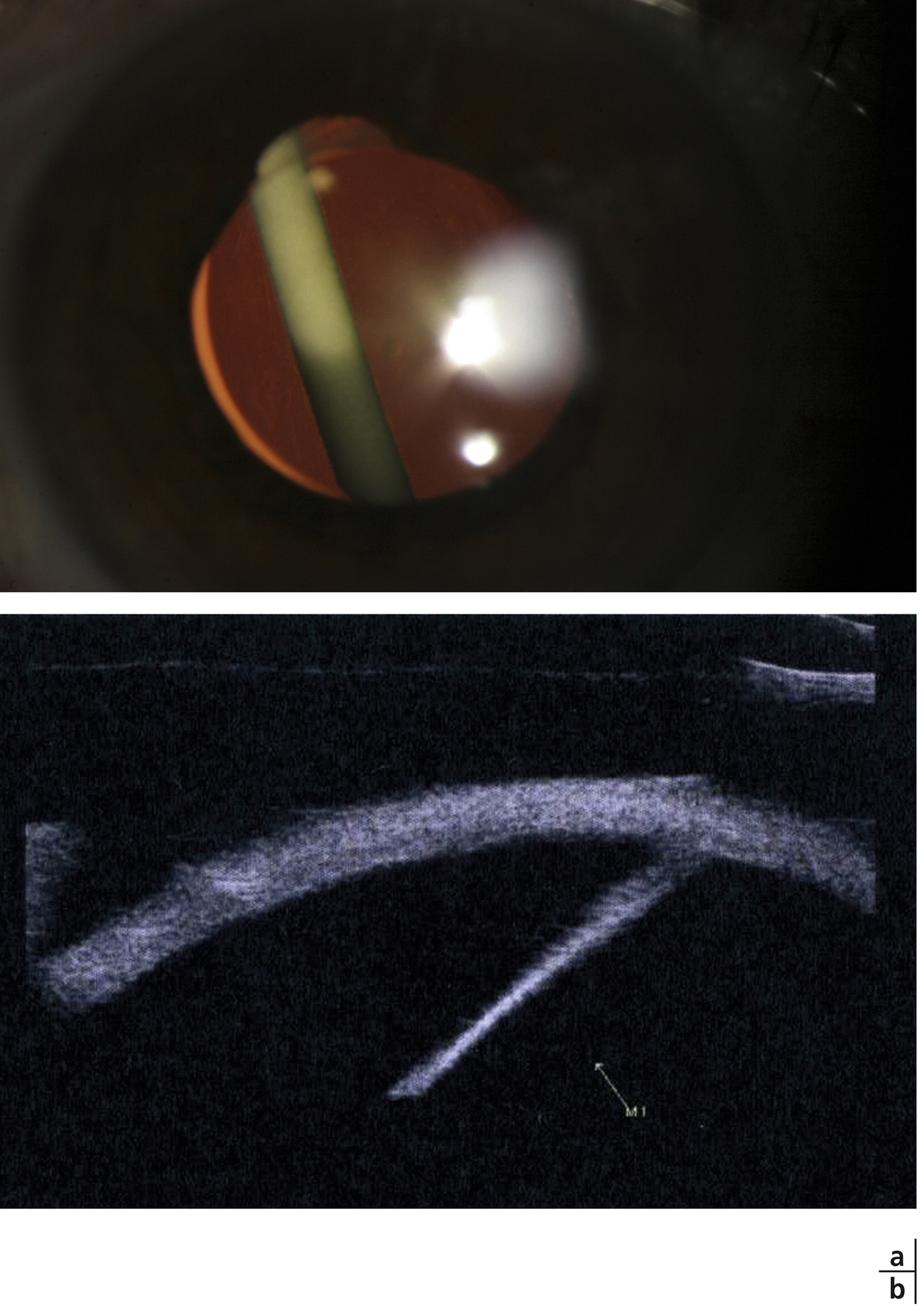
Fig. 10-41 Implant Ozurdex® visible en rétro-illumination chez un patient pseudophaque (a) et en échographie (b).
L’implant Retisert®, qui comprend de l’acétonide de fluocinolone (590 μg) relargué au long cours, nécessite une implantation chirurgicale. Son efficacité sur les uvéites a été étudiée au cours de l’étude MUST portant sur 479 yeux de 255 patients, dont la moitié était traitée par mise en place de l’implant et l’autre moitié par corticothérapie per os [13]. Les résultats sur la fonction visuelle étaient similaires entre les deux groupes. En ce qui concerne l’OM, 6 mois après l’injection, seuls 20 % des patients ayant reçu un implant Retisert® gardaient un OM, contre 34 % dans le groupe traité per os (p < 0,001). Toutefois, 2 ans après l’injection, le taux d’OM était similaire entre les deux groupes. La fréquence des effets secondaires liés à la mise en place de l’implant Retisert® a sans doute été à l’origine de son absence d’AMM en France. En effet, 17 % des patients ayant reçu l’implant Retisert® dans l’étude MUST ont développé un glaucome et 80 % ont dû être opérés de cataracte. En outre, la pose de l’implant a entraîné une hémorragie intravitréenne dans 16 % des cas.
L’implant Iluvien®, non biodégradable, contient également de l’acétonide de fluorocinolone (190 μg) injectable par voie intravitréenne. La dose quotidienne délivrée est plus faible (0,2 à 0,5 μg/jour) que celle de l’implant Retisert®, avec une durée d’action de l’implant pouvant aller jusqu’à 3 ans.
L’injection intra-oculaire d’anti-inflammatoires non stéroïdiens n’a été étudiée que dans des séries très limitées. Une étude de phase I comportant 10 yeux de patients présentant des uvéites a analysé l’effet d’une injection intravitréenne de 4 mg de kétorolac [14]. Pour la moitié des yeux avec un œdème maculaire, une réduction transitoire de l’œdème a été notée.
Les inhibiteurs du VEGF ont un potentiel pour le traitement de l’OM uvéitique, en raison du lien entre perméabilité vasculaire augmentée et inflammation. Des études rétrospectives ont évalué l’effet du bévacizumab et du ranibizumab sur l’OM uvéitique, le premier ayant été le plus utilisé. Un effet favorable sur la réduction de l’épaisseur maculaire centrale a été observé mais les études ne suggèrent pas de bénéfice significatif sur l’acuité visuelle. Trois études ont comparé l’effet des injections intravitréennes d’anti-VEGF à celui d’injections de triamcinolone et ont montré la supériorité de la triamcinolone tant en ce qui concerne l’épaisseur maculaire que l’acuité visuelle [15]. L’absence d’effet des anti-VEGF sur la transparence cristallinienne et sur la pression intra-oculaire aurait pu constituer un avantage significatif par rapport aux injections intravitréennes de corticoïdes. Toutefois, leur efficacité limitée, notamment dans la durée, rend leur utilisation pour le traitement princeps de l’OM uvéitique exceptionnelle, avec peut-être quelques indications particulières dans des situations avec rupture majeure de la barrière hémato-oculaire.
Le sirolimus ou rapamycine et un immunosuppresseur inhibiteur de la protéine mTOR. Son action est obtenue par adhésion à la protéine FKBP-12, entraînant une interruption de la cascade inflammatoire aboutissant à l’activation et à la prolifération des cellules T. Une action inhibitrice sur les cytokines IL-2, IL-4, et IL-15 est également observée. L’étude SAVE (sirolimus as therapeutic approach uveitis study) a étudié l’effet du sirolimus, tant en injection sous-conjonctivale, qu’en injection intravitréenne chez des patients présentant des uvéites intermédiaires, postérieures ou des panuvéites d’étiologie non infectieuse [16]. La dose administrée était de 352 μg par voie intravitréenne ou 1 320 μg par voie sous-conjonctivale. Dans cette étude portant sur 30 patients, une absence d’effet significatif sur l’OM était notée, après 6 et 12 mois de suivi, quelle que soit la voie d’administration.
Les injections intra-oculaires de méthotrexate ont été utilisées d’assez longue date pour le traitement des lymphomes intra-oculaires associés aux lymphomes cérébraux. Cependant, son emploi a également été évalué chez des patients présentant une uvéite, avec un effet favorable sur la hyalite et sur l’OM. Taylor et al. ont étudié les effets de l’injection intravitréenne de 400 μg de méthotrexate dans les yeux de 15 patients présentant 15 cas d’uvéite intermédiaire, postérieure ou de panuvéite d’étiologie non infectieuse [17]. Chez les 10 patients évaluables en OCT, l’effet sur l’OM était celui d’une réduction d’une moyenne de 425 ± 57 μm avant l’injection, à 299 ± 53 μm à 2 mois, avec une pérennisation de ce bénéfice jusqu’au 6e mois après l’injection. Globalement, l’effet du méthotrexate n’a cependant été évalué que dans une série limitée de cas. Celui-ci n’a pas d’autorisation dans cette indication thérapeutique et son utilisation reste tout à fait exceptionnelle pour le traitement des OM uvéitiques.
L’effet d’injections intravitréennes d’anti-TNF n’a été étudié que dans des études comportant des effectifs restreints de patients [18]. Une étude chez dix patients traités par injection intravitréenne de 1,5 mg d’infliximab, suivis pendant 4 semaines, a montré une amélioration de l’acuité visuelle, avec une diminution du haze vitréen et de l’épaisseur maculaire centrale. Toutefois, dans deux autres études pilotes pour lesquels l’infliximab était utilisé par voie intravitréenne, chez des patients présentant une OM diabétique ou une dégénérescence maculaire liée à l’âge (DMLA) néovascularisée, une réaction inflammatoire majeure a été observée dans 42 à 75 % des cas. Étant donné ces éléments, un moratoire a été recommandé quant à l’utilisation d’infliximab par voie intravitréenne, en attendant d’éventuelles études conduites selon des critères approuvés.
L’injection intravitréenne d’adalimumab a été testée chez huit patients présentant un OM uvéitique réfractaire [19]. Ces injections n’ont pas entraîné d’amélioration de l’acuité visuelle ni de réduction de l’épaisseur maculaire centrale.
L’hétérogénéité des situations responsables d’OM uvéitique peut rendre délicat le choix des modalités thérapeutiques à proposer. Les facteurs influençant la décision thérapeutique sont récapitulés dans l’encadré 10-3
• Évolution :
■ récent ou chronique (> 3 mois)
■ premier épisode ou récidive
• Uni- ou bilatéralité
• Localisation de l’uvéite (site primaire de l’inflammation) : segment antérieur (œdème maculaire par contiguïté) ou segment postérieur
• Étiologie de l’uvéite
• Sévérité de l’œdème maculaire :
■ épaisseur maculaire
■ critères d’analyse OCT de l’intégrité des photorécepteurs
■ acuité visuelle
• Facteurs anatomiques associés :
■ membrane épimaculaire
■ vascularites du pôle postérieur
■ ischémie rétinienne
• Effet sur l’œdème maculaire d’éventuelles modalités thérapeutiques précédentes :
■ réponse anatomique (évolution de l’épaisseur maculaire)
■ réponse fonctionnelle (évolution de l’acuité visuelle)
• Effets secondaires d’éventuelles modalités thérapeutiques précédentes :
■ complications des traitements par voie générale
■ complications des traitements intra- ou péri-oculaires : hypertonie, opacités cristalliniennes, autres
• Terrain :
■ sujet jeune à cristallin clair ou sujet âgé
■ pseudo-phaque ou phaque
■ désir de procréation (si thérapeutique par voie générale)
. Ces critères de décision sont complexes comprenant des éléments liés à l’étiologie de l’uvéite, à la sévérité de l’OM, à son mode évolutif, aux réponses observées lors de tentatives thérapeutiques précédentes éventuelles ainsi qu’au terrain.
Certaines étiologies d’uvéite, telles que la maladie de Behçet, imposent de manière quasi systématique un traitement par voie générale. Dans ces cas, le traitement systémique peut parfois être associé à un traitement local, si la sévérité de l’œdème le justifie. Cette association d’un traitement par voie générale à un traitement local peut également être dictée par une tolérance imparfaite à un traitement par voie générale imposant une réduction des posologies.
Chez les sujets jeunes et phaques, les effets de l’administration intravitréenne de corticoïdes sur le cristallin doivent faire soigneusement peser le rapport bénéfice/risque de cette modalité thérapeutique. L’apparition quasi systématique d’opacités cristalliniennes après ces injections, dans un délai de quelques mois à quelques années, peut être responsable d’indications de chirurgie précoce de la cataracte, source de perte de l’accommodation. L’effet des injections sous-ténoniennes de corticoïdes sur le cristallin est moindre que celui des injections intravitréennes, mais néanmoins observable.
La sévérité de la réponse pressionnelle intra-oculaire à la corticothérapie topique ou à de précédentes injections intra- ou péri-oculaires conditionne également les indications thérapeutiques. De manière générale, lorsque l’hypertonie cortico-induite n’a pas pu être contrôlée par un traitement hypotonisant tolérable et/ou lorsqu’une neuropathie glaucomateuse secondaire est observée, ces éléments constituent une contre-indication à des réinjections locales de corticoïdes. Dans des cas exceptionnels, lorsque l’indication de ces traitements locaux est indispensable, notamment en cas d’effets secondaires majeurs des traitements par voie systémique, une chirurgie filtrante peut être nécessaire. Celle-ci autorise alors la poursuite d’injections péri-oculaires ou intra-oculaires de corticoïdes malgré une hypertonie cortico-induite.
Cette situation est habituellement une des plus simples sur le plan thérapeutique, sauf dans le contexte d’arthrite idiopathique juvénile. Un OM ne complique une uvéite antérieure que dans les cas où celle-ci est chronique et/ou d’intensité majeure. De manière évidente dans cette situation, la base du traitement est le contrôle de l’inflammation du segment antérieur, habituellement obtenu par une corticothérapie topique d’intensité adaptée. Toutefois, dans certains cas, comme les récidives fréquentes d’uvéite antérieure, particulièrement lorsque celles-ci sont insuffisamment traitées, un traitement préventif de fond peut être indiqué. La survenue d’un OM compliquant l’uvéite antérieure constitue alors un critère supplémentaire d’indication de ce traitement de fond. Les anti-TNF ont un effet démontré pour la prévention des récidives d’uvéite antérieure dans le contexte des spondylarthrites liées à l’HLA B27. Parmi ceux-ci, l’efficacité des anticorps anti-TNF (infliximab et adalimumab) est supérieure à celle des récepteurs solubles du TNF (étanercept) [20]. En outre, quelques cas d’uvéite paradoxale déclenchée par étanercept ont été rapportés. Dans une étude rétrospective chez 46 patients traités par anti-TNF, le nombre moyen de poussées d’uvéite par anti-TNF diminuait de manière significative de 51,8 poussées par patients-années avant traitement, à 21,4 poussées par patients-années [21]. Dans ce contexte, la prévention des récidives de poussée d’uvéite, grâce au traitement de fond, permet de réduire le risque d’OM par contiguïté.
De l’adolescence à l’âge de 20 ans, l’uvéite intermédiaire idiopathique ou pars planite est une des causes les plus fréquente d’uvéite et reste d’étiologie non identifiée dans environ 80 % des cas. Les étiologies associées aux autres cas sont essentiellement la sarcoïdose, la sclérose en plaques et de rares cas d’origine infectieuse. L’OM est la principale complication responsable de baisse d’acuité visuelle au cours des uvéites intermédiaires. Dans une série de 32 cas pédiatriques suivis à long terme, un OM était observé dans 44 % des cas [22]. Dans ce contexte, le choix de la modalité thérapeutique adaptée doit particulièrement prendre en compte le terrain jeune du patient et l’impact d’une corticothérapie par voie générale sur la croissance. De même, les conséquences d’injections intravitréennes sur le cristallin sont à prendre en compte. En l’absence d’OM, une abstention thérapeutique est régulièrement proposée au cours des uvéites intermédiaires idiopathiques du sujet jeune. En présence d’un OM, le premier choix thérapeutique est fréquemment celui d’une injection sous-conjonctivale ou sous-ténonienne de triamcinolone.
La diversité des causes d’uvéite postérieure ne permet pas d’établir un schéma thérapeutique applicable quelle que soit l’étiologie. Cependant, le diagnostic étiologique dicte dans certains cas une conduite thérapeutique, notamment lorsque des manifestations extra-oculaires imposent les indications thérapeutiques. Ainsi, le traitement de fond d’une maladie de Behçet compliquée de manifestations neurologiques ou d’une sarcoïdose avec complications cardiaques ne dépend que de manière partielle des manifestations oculaires associées. Cependant, ces traitements de fond ont généralement une action tant sur les manifestations extra-oculaires que sur l’inflammation intra-oculaire.
Parmi les étiologies d’uvéite postérieure, la maladie de Behçet est l’une de celle pour laquelle le plus de données sont disponibles pour fonder une stratégie thérapeutique étayée par des preuves. Une méta-analyse portant sur des études ayant inclus un total de 369 patients atteints de maladie de Behçet et traités par anti-TNF montrait qu’une réduction significative du nombre de poussées d’uvéite était obtenue dans 89 % des cas [23]. Selon les recommandations d’un panel d’experts, les anticorps anti-TNF peuvent être utilisés en première intention, ou en deuxième intention après échec d’un traitement avec immunosuppresseurs conventionnels, au cours de la maladie de Behçet [24]. Outre le traitement de fond, l’OM compliquant une uvéite postérieure dans ce contexte peut nécessiter un traitement additionnel par injections péri- ou intra-oculaire de corticoïdes.
La sarcoïdose constitue une autre étiologie d’uvéite susceptible de se compliquer d’OM. Cependant, à l’opposé de la maladie de Behçet, l’indication d’un traitement par voie générale n’est pas systématique : selon les différentes études, entre 20 et 70 % des patients présentant une sarcoïdose doivent être traités [25]. Les manifestations de la sarcoïdose sont généralement particulièrement cortico-sensibles ; toutefois, la corticothérapie per os ne peut constituer qu’une option thérapeutique à court terme. Les immunosuppresseurs classiques, dont particulièrement le méthotrexate, sont régulièrement utilisés dans ce contexte diagnostique. Le traitement des manifestations oculaires peut être isolé ou s’intégrer avec celui des manifestations générales de la maladie. Lorsque l’uvéite est la seule indication de traitement, la voie locale est régulièrement celle choisie en première intention : topique pour l’uvéite antérieure, péri- ou intra-oculaire pour l’uvéite postérieure compliquée d’OM.
La choriorétinopathie de type Birdshot représente l’uvéite auto-immune postérieure modèle, non associée à des manifestations extra-oculaires. Parmi 80 patients, dont une majorité était déjà en cours de traitement, un OM était observé dans 34 % des cas [26]. La survenue d’un OM est un élément déclenchant pour l’indication d’un traitement de fond, généralement en première intention, par l’association d’un traitement par un immunosuppresseur tel que le mycophénolate et d’une corticothérapie per os débutée entre 0,5 et 1,0 mg/kg/jour selon l’intensité de l’inflammation (fig. 10-42). Toutefois, un OM peut justifier un traitement additionnel par injection péri- ou intra-oculaire de corticoïdes.
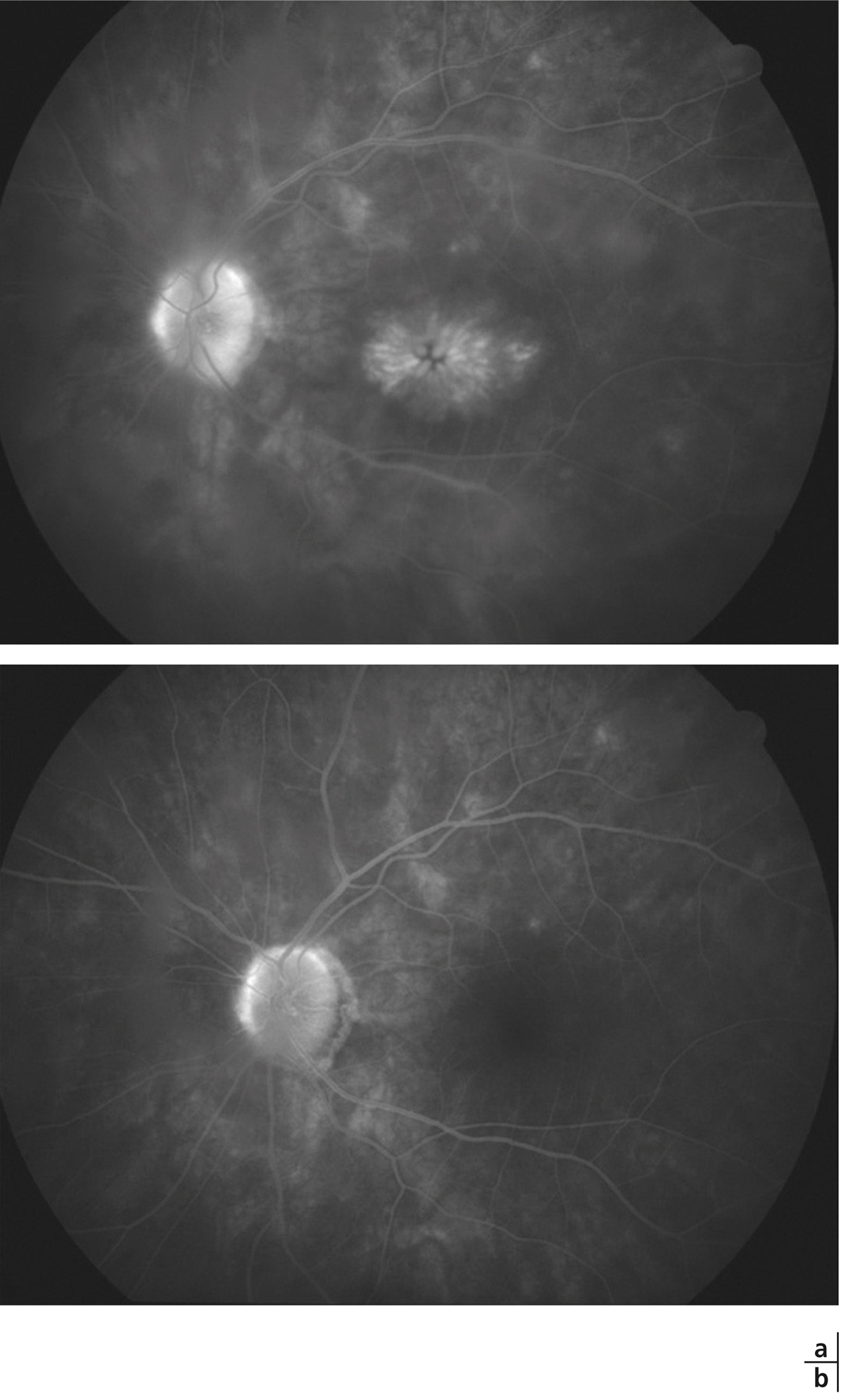
Fig. 10-42 Temps tardifs d’une angiographie fluorescéinique chez une patiente présentant une choriorétinopathie de type Birdshot.
a. Avant traitement. b. Après 1 an de traitement sous immunosuppresseurs et corticothérapie per os débutée à 0,5 mg/kg/jour avec décroissance progressive.
Une prise en charge adaptée et précoce est généralement efficace pour traiter l’OM uvéitique et éviter ainsi une baisse d’acuité visuelle irréversible (fig. 10-43). Une étude rétrospective multicentrique comportant 1 510 yeux présentant un OM uvéitique responsable d’acuité visuelle inférieure à 20/40 montrait qu’une amélioration d’au moins deux lignes d’acuité était obtenue chez 52 % des patients en 6 mois [27].
Le traitement doit prendre en compte l’étiologie de l’uvéite, l’intensité de l’inflammation intra-oculaire et faire l’objet d’une analyse systématique du rapport bénéfice/risque de la stratégie proposée.
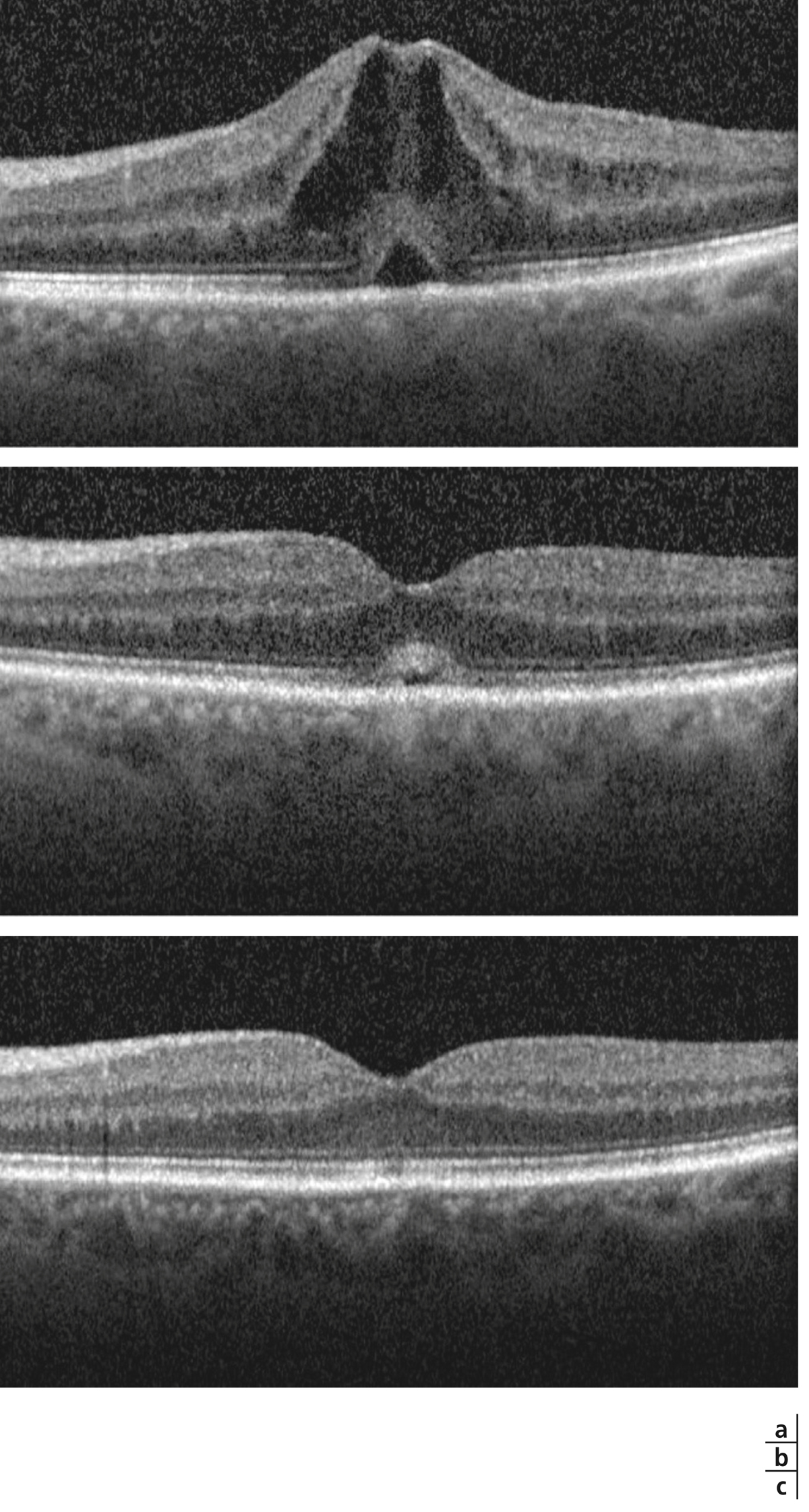
Fig. 10-43 Évolution d’un œdème maculaire uvéitique après injection sous-ténonienne de triamcinolone.
a. Avant traitement. b. Une semaine après injection. c. Un mois après injection.
[1] Suttorp-Schulten MSA, Rothova A. The possible impact of uveitis in blindness : a literature survey. Br J Ophthalmol 1996 ; 80 : 844-8.
[2] Rothova A, Suttorp-van Schulten MS, Frits Treffers W, Kijlstra A. Causes and frequency of blindness in patients with intraocular inflammatory disease. Br J Ophthalmol 1996 ; 80 : 332-6.
[3] Paire V, Lebreton O, Weber M. Efficacité de l’interféron alpha dans le traitement des œdèmes maculaires uvéitiques réfractaires au traitement corticoïde et/ou immunosupresseur. J Fr Ophtalmol 2010 ; 33 : 152-62.
[4] Deuter CM, Kotter I, Gunaydin I, et al. Efficacy and tolerability of interferon alpha treatment in patients with chronic cystoid macular oedema due to non-infectious uveitis. Br J Ophthalmol 2009 ; 93 : 906-13.
[5] Whitcup SM, Csaky KG, Podgor MJ, et al. A randomized, masked, cross-over trial of acetazolamide for cystoid macular edema in patients with uveitis. Ophthalmology 1996 ; 103 : 1054-62.
[6] Farber MD, Lam S, Tessler HH, et al. Reduction of macular oedema by acetazolamide in patients with chronic iridocyclitis : a randomised prospective crossover study. Br J Ophthalmol 1994 ; 78 : 4-7.
[7] Lashay AR, Rahimi A, Chams H, et al. Evaluation of the effect of acetazolamide on cystoid macular oedema in patients with Behcet’s disease. Eye (Lond) 2003 ; 17 : 762-6.
[8] Karim R, Sykakis E, Lightman S, Fraser-Bell S. Interventions for the treatment of uveitic macular edema : a systematic review and meta-analysis. Clinical Ophthalmology 2013 ; 7 : 1109-44.
[9] Allegri P, Murialdo U, Peri S, et al. Randomized, double-blind, placebo-controlled clinical trial on the efficacy of 0.5 % indomethacin eye drops in uveitic macular edema. Invest Ophthalmol Vis Sci 2014 ; 55 : 1463-70.
[10] Helm CJ, Holland GN. The effects of posterior subtenon injection of triamcinolone acetonide in patients with intermediate uveitis. Am J Ophthalmol 1995 ; 120 : 55-64.
[11] Levin DS, Han DP, Dev S, et al. Subtenon’s depot corticosteroid injections in patients with a history of corticosteroid-induced intraocular pressure elevation. Am J Ophthalmol 2002 ; 133 : 196-202.
[12] Bui Quoc E, Bodaghi B, Adam R, et al. Hypertonie cortisonique après injection sous-ténonienne de triamcinolone acétonide au cours de l’uvéite J Fr Ophtalmol 2002 ; 25 : 1048-56.
[13] Multicenter Uveitis Steroid Treatment (MUST) Trial Research Group, Kempen JH, Altaweel MM, Holbrook JT, et al. Randomized comparison of systemic anti-inflammatory therapy versus fluocinolone acetonide implant for intermediate, posterior, and panuveitis : the multicenter uveitis steroid treatment trial. Ophthalmology 2011 ; 118 : 1916-26.
[14] Kim SJ, Doherty TJ, Cherney EF. Intravitreal ketorolac for chronic uveitis and macular edema : a pilot study. Arch Ophthalmol 2012 ; 130 : 456-60.
[15] Hazirolan D, Pleyer U. Think global--act local : intravitreal drug delivery systems in chronic noninfectious uveitis. Ophthalmic Res 2013 ; 49 : 59-65.
[16] Ibrahim MA, Sepah YJ, Watters A, et al. One-year Ooutcomes of the SAVE Study : Sirolimus as a Therapeutic Approach for UVEitis. Transl Vis Sci Technol 2015 ; 4 : 4.
[17] Taylor SR, Habot-Wilner Z, Pacheco P, Lightman SL. Intraocular methotrexate in the treatment of uveitis and uveitic cystoid macular edema. Ophthalmology 2009 ; 116 : 797-801.
[18] Tempest-Roe S, Joshi L, Dick AD, Taylor SR. Local therapies for inflammatory eye disease in translation : past, present and future. BMC Ophthalmol 2013 ; 13 : 39.
[19] Androudi S, Tsironi E, Kalogeropoulos Cet al. Intravitreal adalimumab for refractory uveitis-related macular edema. Ophthalmology 2010 ; 117 : 1612-6.
[20] Galor A, Perez VL, Hammel JP, Lowder CY. Differential effectiveness of etanercept and infliximab in the treatment of ocular inflammation. Ophthalmology 2006 ; 113 : 2317-23.
[21] Guignard S, Gossec L, Salliot C, et al. Efficacy of tumour necrosis factor blockers in reducing uveitis flares in patients with spondylarthropathy : a retrospective study Ann Rheum Dis 2006 ; 65 : 1631-4.
[22] De Boer J, Berendschot TJM, Van Der Does P, Rothova A. Long-term follow-up of intermediate uveitis in children. Am J Ophthalmol 2006 ; 141 : 616-21.
[23] Arida A, Fragiadaki K, Giavri E, Sfikakis PP. Anti-TNF agents for Behçet’s disease : analysis of published data on 369 patients. Semin Arthritis Rheum 2011 ; 41 : 61-70.
[24] Levy-Clarke G, Jabs DA, Read RW, et al. Expert panel recommendations for the use of anti-Tumor Necrosis Factor biologic agents in patients with ocular inflammatory disorders. Ophthalmology 2014 ; 121 : 785-96.
[25] Valeyre D, Prasse A, Nunes H, et al. Sarcoidosis. Lancet 2014 ; 383 : 1155-67.
[26] Monnet D, Levinson RD, Holland GN, et al. Longitudinal cohort study of patients with birdshot chorioretinopathy. III. Macular imaging at baseline. Am J Ophthalmol 2007 ; 144 : 818-28.
[27] Levin MH, Pistilli M, Daniel E, et al. ; Systemic Immunosuppressive Therapy for Eye Diseases Cohort Study. Incidence of visual improvement in uveitis cases with visual impairment caused by macular edema. Ophthalmology 2014 ; 121 : 588-95.
M. Weber
Les OM uvéitiques sont fréquents (retrouvés dans 30 % des uvéites) et graves (responsables de 40 à 50 % des baisses d’acuité visuelle en lien avec des uvéites).
Ils sont responsables d’une baisse d’acuité (par fréquence décroissante d’entité étiologique) dans :
-
100 % des choriorétinopathies de Birdshot actives ou des nécroses rétiniennes aiguës ;
-
60 % des uvéites intermédiaires idiopathiques et des uvéites dans un contexte d’arthrite juvénile idiopathique (AJI), de sarcoïdose ou de maladie de Behçet ;
-
20 % des choriorétinites toxoplasmiques ;
-
14 % des hétérochromies de Fuchs ;
-
12 % des uvéites antérieures aiguës HLA B27.
Le diagnostic positif repose sur le SD-OCT qui doit être demandé systématiquement dans : toute uvéite antérieure aiguë avec baisse d’acuité visuelle ; toute uvéite antérieure chronique sur AJI ; toute uvéite intermédiaire, postérieure et totale.
L’OCT permet de préciser :
-
le type d’OM : épaississement périfovéolaire, épaississement maculaire diffus (sans fluide), œdème intrarétinien, OM cystoïde, décollement séreux rétinien ;
-
l’importance de l’OM (évalué par le mapping) ;
-
l’existence de signes associés : MER, traction vitréomaculaire (TVM), etc.
L’angiographie à la fluorescéine permet d’appréhender la rupture de la BHR notamment maculaire mais elle peut être prise en défaut pour des OM débutants ; en revanche, elle est indispensable pour identifier vascularite, capillarite ou papillite notamment infracliniques et elle est très utile à la reconnaissance des choriorétinites, des non-perfusions rétiniennes et des néovaisseaux prérétiniens ou prépapillaires. Elle fournit des éléments d’orientation étiologique et des éléments de réponse au traitement.
L’angiographie au vert d’indocyanine peu utile à la reconnaissance de l’OM est indispensable à l’identification des défauts de perfusion choroïdienne (choriocapillarite), des granulomes choroïdiens (Birdshot, Harada, etc.) ou des néovaisseaux choroïdiens.
Une prise en charge thérapeutique adaptée et précoce est généralement efficace pour traiter l’OM uvéitique et éviter ainsi une baisse d’acuité visuelle irréversible.
Le traitement doit prendre en compte :
-
l’étiologie de l’uvéite ;
-
l’intensité de l’inflammation intra-oculaire ;
-
le caractère isolé ou systémique :
-
de l’atteinte oculaire ;
-
du terrain (âge, cristallin clair, antécédent d’hypertonie oculaire mal contrôlée ou de glaucome avéré, intolérance à tel ou tel traitement),
-
de la réponse au traitement précédent.
-
Une analyse systématique du rapport bénéfice/risque de la stratégie proposée est indispensable et doit être renouvelée (fig. 10-44 et 10-45). Les recommandations thérapeutiques dans le domaine des uvéites reposent plus sur des expériences de cliniciens et des données rétrospectives que sur des faits issus d’études randomisées prospectives, encore peu nombreuses dans ce cadre pathologique.
Les différentes modalités thérapeutiques sont récapitulées dans la figure 10-46. Ces traitements reposent sur des traitements systémiques ou des traitements locaux. Le choix entre l’une ou l’autre de ces modalités dépendra de tous les éléments précités et est résumé dans la figure 10-47.
Dans le cadre de maladie systémique ou d’uvéite bilatérale, le traitement systémique est privilégié, basé le plus souvent sur une corticothérapie orale associée en cas de cortico-résistance ou de cortico-dépendance à un seuil supérieur ou égal à 10 mg/jour, à un traitement immunosuppresseur ou immunomodulateur. Le traitement local viendra si besoin en complément de ces traitements systémiques pour réduire l’inflammation et faire disparaître l’OM.
Dans le cadre de maladies purement oculaires ou d’uvéites unilatérales ou très asymétriques, on pourra privilégier un traitement local en tenant compte des éventuels effets indésirables de ces traitements locaux. Les voies péri- et intra-oculaires sont principalement utilisées afin de limiter les effets indésirables généraux des anti-inflammatoires stéroïdiens systémiques et de limiter l’usage des traitements immunosuppresseurs et immunomodulateurs systémiques.
Ces traitements bénéficieront à l’avenir de données d’études randomisées prospectives en cours (adalilumab en sous-cutanée, sirolimus en intravitréen) et à venir : dispositif de libération prolongée de stéroïde, biothérapies avec inhibiteur du CD28 (abatacept), antagonistes du récepteur de l’IL-6 (tocilizumab, sarilumab) ; stratégie de tolérance (lymphocytes T régulateurs en injection intravitréenne ou en sous-cutané, peptide B27PD par voie orale).
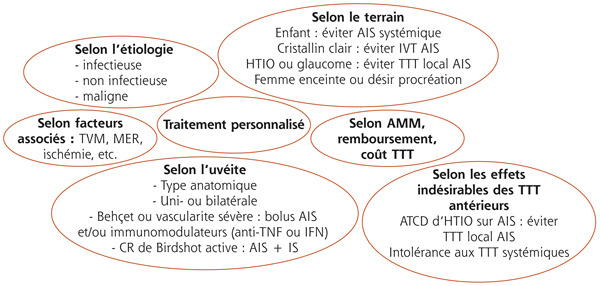
Fig. 10-44 Facteurs influençant les décisions de traitement d’un œdème maculaire uvéitique.
AIS : anti-inflammatoire stéroïdien ; AMM : autorisation de mise sur le marché ; ATCD : antécédent ; CR : choriorétinopathie ; HTIO : hypertonie intra-oculaire ; IFN : interféron ; IS : immunosuppresseur ; IVT : injection intravitréenne ; MER : membrane épirétinienne ; TNF : tumor necrosis factor ; TTT : traitement ; TVM : traction vitréomaculaire.
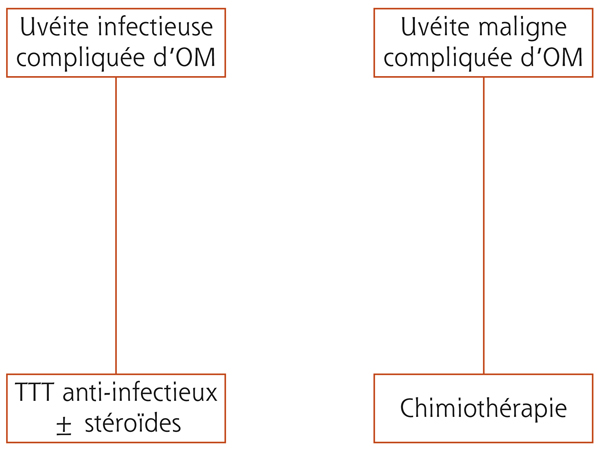
Fig. 10-45 Traitement de l’œdème maculaire dans le cadre d’uvéite infectieuse ou de pseudo-uvéite maligne.
OM : œdème maculaire ; TTT : traitement.
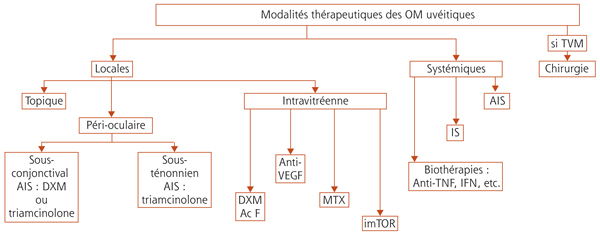
Fig. 10-46 Différentes modalités thérapeutiques disponibles pour traiter un œdème maculaire uvéitique.
Ac : anticorps ; AIS : anti-inflammatoire stéroïdien ; DXM : dexaméthasone ; IFN : interféron ; imTOR : inhibiteur de mTOR (sirolimus) ; IS : immunosuppresseur ; MTX : méthotrexate ; OM : œdème maculaire ; TNF : tumor necrosis factor ; TVM : traction vitréomaculaire ; VEGF : vascular endothelial growth factor.
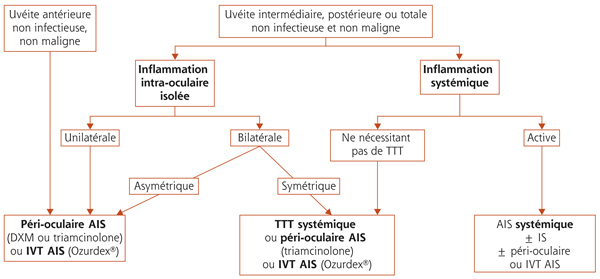
Fig. 10-47 Algorithme de traitement des œdèmes maculaires compliquant une uvéite antérieure, intermédiaire, postérieure ou totale non infectieuse et selon l’atteinte purement oculaire ou au contraire systémique et selon l’unilatéralité, la bilatéralité et la symétrie ou l’asymétrie de l’atteinte.
AIS : anti-inflammatoire stéroïdien ; DXM : dexaméthasone ; IS : immunosuppresseur ; IVT : injection intravitréenne ; TTT : traitement.
Source : algorithme proposé par un groupe d’experts français en uvéites.