Anatomie microscopique de la rétine et anatomopathologie des œdèmes maculaires
B. Kantelip, E. Frouin
➤ Le support morphologique de la barrière hémato-rétinienne est constitué par les jonctions cellulaires serrées situées sur les membranes cellulaires : des cellules épithéliales de l’épithélium pigmentaire et des cellules endothéliales des capillaires intrarétiniens.
➤ L’œdème maculaire cystoïde est caractérisé par la présence d’un matériel amorphe ou finement granuleux dans la couche plexiforme externe et la couche nucléaire interne de la rétine.
➤ L’œdème maculaire a une disposition radiaire oblique de la macula vers la rétine périphérique, du fait de l’orientation des fibres de Henlé.
➤ La présence d’un œdème maculaire histologique ne permet pas d’en prédire la cause. D’autres éléments (thromboses vasculaires, hémorragies, exsudats, néovascularisation rétinienne, etc.) sont nécessaires au diagnostic étiologique.
La rétine forme la tunique la plus interne du globe oculaire. Elle tapisse la choroïde et recouvre toute la surface interne du globe depuis la papille jusqu’à l’ora serrata. Elle est transparente et l’influx lumineux traverse les trois couches de cellules nerveuses pour générer une impulsion électrique dans les photorécepteurs. Le signal électrique se transmet des photorécepteurs aux cellules bipolaires puis aux cellules ganglionnaires et au cerveau.
Elle s’étend de la papille à l’ora serrata et adhère fortement à ces deux zones. La rétine est une fine membrane en relation sur son versant externe avec la choroïde par l’intermédiaire de l’épithélium pigmentaire (EP) et sur son versant interne avec le vitré par l’intermédiaire de la membrane limitante interne de la rétine (fig. 2-1).
À l’extrême périphérie, l’ora serrata est une zone de transition entre la rétine et les corps ciliaires. À la base du vitré, près de l’ora serrata, rétine et vitré contractent d’importantes adhérences.
En postérieur (fig. 2-2), toutes les couches rétiniennes s’interrompent à l’exception de la couche des fibres nerveuses pour former la tête du nerf optique. L’épithélium pigmentaire se termine juste avant la membrane de Bruch [1–3].
La rétine peut être subdivisée en deux grandes parties : la rétine centrale et la rétine périphérique.

Fig. 2-1 La rétine repose sur la choroïde (C), dont elle est séparée par la membrane de Bruch (flèche noire). Elle est bordée à sa partie interne par la membrane limitante interne (flèche blanche) la séparant du vitré (V).

Fig. 2-2 Papille.
Toutes les couches de la rétine s’interrompent (1). La couche des fibres nerveuses (2) traverse la lame criblée puis forme le nerf optique. L’épithélium pigmentaire (3) se termine juste avant la membrane de Bruch (4).
La partie centrale mesure 5 à 6 mm et renferme la macula, la fovéa et la fovéola (fig. 2-3).
La macula est une zone elliptique de 1,5 mm de large pour 1 mm de hauteur. Elle est située quasiment au centre de la rétine, en temporal par rapport au nerf optique. Elle est centrée par la fovéa. La fovéola, dépression centrale de la fovéa, est située à deux diamètres papillaires en dehors du bord temporal de la papille. Elle a un diamètre de 350 µm. Le clivus borde latéralement la dépression fovéolaire. L’aspect légèrement jaunâtre de la fovéola est dû à la présence d’un pigment xanthophylle. Les capillaires rétiniens s’arrêtent à 200 µ du centre de la fovéola, limitant ainsi une aire avasculaire centrale de 400 µ de diamètre.
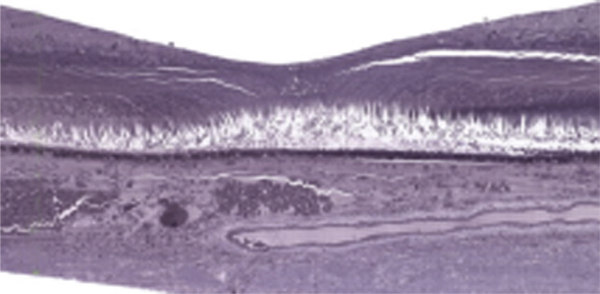
Fig. 2-3 Coupe histologique centrée sur la macula. La dépression centrale constitue la fovéa.
(Source : Curcio CA, Messinger JD, Sloan KR, et al. Human chorioretinal layer thicknesses measured in macula-wide, high-resolution histologic sections. Invest Ophthalmol Vis Sci 2011 ; 52 : 3943-54. The Association for Research in Vision and Ophthalmology Copyright © 2015. Reproduction autorisée.)
La partie périphérique est classiquement divisée en quatre zones :
la périphérie proche, au contact du pôle postérieur, qui s’étend sur 1,5 mm ;
la périphérie moyenne qui mesure 3 mm ;
la périphérie éloignée qui s’étend sur 9 à 10 mm du côté temporal et 16 mm du côté nasal ;
l’ora serrata ou extrême périphérie qui mesure 2,1 mm en temporal et 0,8 mm en nasal.
L’anatomie microscopique permet de décrire dix couches rétiniennes (fig. 2-4) [4, 5].

Fig. 2-4 Coupe de la rétine, qui est constituée de dix couches.
1 : épithélium pigmentaire ; 2 : photorécepteurs ; 3 : membrane limitante externe ; 4 : couche nucléaire externe ; 5 : couche plexiforme externe ; 6 : couche nucléaire interne ; 7 : couche plexiforme interne ; 8 : couche des cellules ganglionnaires ; 9 : couche des fibres ; 10 : membrane limitante interne.
L’épithélium pigmentaire de la rétine est une couche monocellulaire de cellules hexagonales s’étendant de l’ora serrata au nerf optique. Il est continu avec l’épithélium du corps ciliaire. Il est séparé de la choriocapillaire par la membrane de Bruch. La choriocapillaire est formée de fins capillaires fenêtrés qui nourrissent la couche des photorécepteurs.
La membrane de Bruch (colorée positivement par le periodic acid Schiff ou PAS) ne se limite pas à une membrane basale. En microscopie électronique, elle comprend : la membrane basale des capillaires de la choriocapillaire, une couche de collagène externe, une couche irrégulière de fibres élastiques, une couche de collagène interne et la membrane basale de l’épithélium pigmentaire.
Les cellules hexagonales de l’EP sont reparties sur une seule couche et possèdent un noyau arrondi situé dans la partie basale de la cellule. Ainsi, les drusen se déposent entre l’EP et la couche élastique de la membrane de Bruch.
Au pôle basal et sur les faces latérales des cellules de l’EP, la membrane cellulaire décrit de nombreux replis ou interdigitations. Des desmosomes sont parfois observés le long de la membrane latérale. Près du pôle apical, la présence de zonulae occludens, ou jonctions occlusives, entraîne une « soudure » membranaire avec disparition de l’espace intercellulaire, assurant l’imperméabilité, support morphologique de la barrière hémato-rétinienne externe.
La membrane apicale décrit des microvillosités qui entourent le tiers externe des articles externes des photorécepteurs. L’espace compris entre les microvillosités et les photorécepteurs contient une substance riche en mucopolysaccharides.
Le cytoplasme des cellules de l’EP contient, outre les organites usuels, de nombreux grains de mélanine situés dans les parties apicale et médiane des cellules et des phagosomes. Les grains de mélanine étant synthétisés par la cellule de l’épithélium pigmentaire, ils peuvent être observés à tous les stades de leur synthèse (prémélanosome, mélanosome et granule mature).
Les phagosomes correspondent à la phagocytose par la cellule épithéliale pigmentaire d’un groupe de disques des articles externes des photorécepteurs.
Les rôles de l’EP sont multiples : phagocytose des articles externes des photorécepteurs, rôle d’écran avec sécrétion de la mélanine responsable de la réflexion de la lumière, métabolisme de la vitamine A, sécrétion de la matrice extracellulaire entourant les photorécepteurs, transport actif entre la choriocapillaire et l’espace sous-rétinien.

Fig. 2-5 Aspect de l’épithélium pigmentaire (EP) en microscopie électronique.
Il est séparé de la choriocapillaire (CC) par la membrane de Bruch qui apparaît plus complexe en microscopie électronique. À leur partie apicale, les cellules de l’EP émettent des digitations qui vont phagocyter les articles externes des photorécepteurs (PR). Les articles externes apparaissent sous forme d’un empilement de feuillets membranaires.
La neurorétine est organisée en neuf couches (fig. 2-4).
Deux types de photorécepteurs sont distingués : les bâtonnets et les cônes. Les photorécepteurs sont formés de deux segments, un article externe et un article interne. L’article externe est formé par un empilement de feuillets membranaires (fig. 2-5) contenant les pigments visuels. Sa partie distale est logée dans les expansions cytoplasmiques des cellules de l’EP. Les articles externes sont renouvelés régulièrement par synthèse membranaire à leur base et phagocytose de leur extrémité distale. L’article interne contient les organites cytoplasmiques. Les deux segments sont réunis par une structure ciliaire. Leurs noyaux sont situés dans la couche nucléaire externe appelée aussi couche granuleuse externe (fig. 2-6).
Quatre types de photorécepteurs sont décrits dans la rétine humaine en fonction du photopigment contenu dans leur article externe. Chaque photopigment est caractérisé par un spectre d’absorption caractéristique. La rhodopsine (500 nm) est le photopigment des bâtonnets, et il existe trois types de cônes en fonction du photopigment qu’ils contiennent. Le photopigment est désigné par la couleur de la lumière qu’il absorbe : bleu (440 nm), vert (540 nm) et rouge (570 nm). Par convention, les cônes sont définis en cônes « S », s’ils contiennent en majorité le pigment sensible au bleu, en cônes « M » s’ils présentent une concentration plus importante en pigments sensibles au vert et enfin en cônes « L » porteurs du pigment sensible au rouge. Les lettres conventionnelles S, M et L proviennent des mots anglais Short, Medium et Long wavelenght, qui correspondent respectivement aux courtes, moyennes et grandes longueurs d’onde.
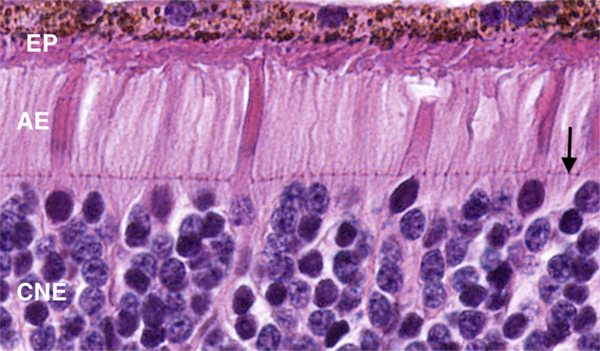
Fig. 2-6 Coupe de la rétine centrée sur les photorécepteurs.
Ils reposent sur l’épithélium pigmentaire (EP) et comportent un article externe (AE) et un noyau situé dans la couche nucléaire externe (CNE). La membrane limitante externe (flèche) limite l’espace sous-rétinien (au-dessus) et constitue une barrière à la diffusion des grosses molécules.
On identifie à la base du segment externe des photorécepteurs une fine membrane qui correspond en microscopie électronique à des desmosomes entre les articles internes des photorécepteurs et les cellules de Müller qui sont des cellules de soutien. La membrane limitante externe limite l’espace sous-rétinien et constitue une barrière à la diffusion des grosses molécules (barrière hémato-rétinienne).
Elle contient les corps cellulaires des photorécepteurs avec leur cytoplasme et leur noyau. L’axone des photorécepteurs se poursuit jusqu’à la couche plexiforme externe pour former les synapses (fig. 2-6). Il est difficile en microscopie optique de différencier les noyaux des bâtonnets de ceux des cônes.
La couche plexiforme externe (CPE) correspond à la première synapse, zone de transmission entre les photorécepteurs et le premier neurone. Elle se présente comme un réseau dense d’expansions cellulaires des cellules bipolaires, des cellules horizontales et des cellules de Müller.
La CPE est plus épaisse dans la région maculaire : les axones des cônes et des bâtonnets sont orientés radiairement à partir de la fovéa et constituent les fibres de Henlé.
La CPE peut être divisée en trois zones :
externe contenant l’extrémité des photorécepteurs et de nombreuses expansions des cellules de Müller ;
médiane correspondant à l’extrémité distale des bâtonnets (sphérule) et des cônes (pédicule) ;
interne constituée de l’imbrication des dendrites des cellules bipolaires et des cellules horizontales.
La synapse (fig. 2-7) avec les photorécepteurs est caractérisée par la présence, dans une invagination des pieds des bâtonnets et des cônes, d’un ruban synaptique entouré de nombreuses vésicules synaptiques. Elle a un arrangement en triade avec un ruban synaptique et trois éléments post-synaptiques : deux dendrites des cellules horizontales constituant les éléments latéraux et une ou deux dendrites des cellules bipolaires correspondant à l’élément central.
Dans cette couche, s’observent les synapses entre les photorécepteurs et les cellules bipolaires et les cellules horizontales. Chaque sphérule contient une seule triade tandis que chaque pédicule contient plusieurs triades. De plus, les pédicules des cônes présentent à leur surface des petites synapses dépourvues de ruban synaptique correspondant à une synapse avec une cellule bipolaire « OFF ».
Enfin, il est également décrit des contacts entre la base des pédicules des cônes et les dendrites des cellules bipolaires, ainsi que des jonctions « desmosome-like » entre les dendrites des cellules bipolaires et/ou des cellules horizontales.
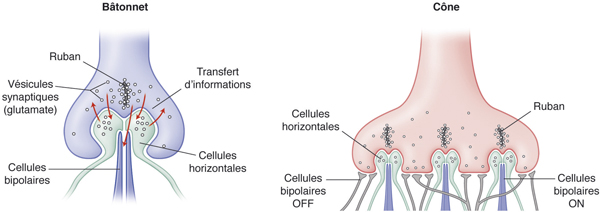
Fig. 2-7 Connexions synaptiques des cônes et des bâtonnets avec les cellules bipolaires et horizontales.
Les corps cellulaires de cinq cellules différentes sont situés dans cette zone : cellules bipolaires, cellules horizontales, cellules amacrines, cellules interplexiformes et cellules de Müller. Ces cellules peuvent être identifiées en immuno-histochimie avec des marqueurs spécifiques.
La couche nucléaire interne peut être divisée en plusieurs sous-couches.
La couche la plus externe, adjacente à la CPE, contient les cellules horizontales. Leur cytoplasme ressemble à celui des cellules bipolaires à l’exception de la présence du cristalloïde de Kolmer. Trois types de cellules horizontales ont été individualisés dans la rétine humaine :
les cellules H1, les plus grandes, reçoivent leurs informations des bâtonnets et des cônes L et M ;
les cellules H2 sont plus petites et reçoivent des informations des trois types de cônes ;
les cellules H3 ressemblent aux cellules H1, mais avec des dendrites plus larges. Elles reçoivent leur information des cônes L et M.
La couche intermédiaire externe contient les cellules bipolaires, qui sont les premiers neurones. Les cellules bipolaires reçoivent les informations des cônes et des bâtonnets et transmettent les signaux vers les cellules amacrines et les cellules ganglionnaires.
Il existe un seul type de cellules bipolaires pour les bâtonnets, c’est une cellule « ON » dont la partie terminale de l’axone est située dans la partie la plus interne de la couche plexiforme interne.
Pour les cônes, on distingue :
des cellules bipolaires « ON » qui forment une synapse invaginante avec un pédicule du cône et dont l’axone se termine dans la partie la plus interne de la couche plexiforme interne ;
des cellules bipolaires « OFF » caractérisées par une synapse non invaginante et dont l’axone se termine dans la partie la plus externe de la couche plexiforme interne.
Cette ambivalence « ON/OFF » se poursuit lors de la connexion cellules bipolaire/ganglionnaire de la couche plexiforme interne.
Enfin, les cellules bipolaires sont divisées en cellules bipolaires diffuses qui se connectent à plusieurs cônes et en cellules bipolaires « midget », qui ne se connectent qu’à un seul cône.
La couche intermédiaire interne contient :
les cellules de Müller qui ont un rôle de support et de nutrition (voir chapitre 4.4, « Cellules de soutien ») ;
les cellules amacrines qui ont de longs prolongements formant des synapses avec les cellules bipolaires et les cellules ganglionnaires.
On décrit environ 40 types de cellules amacrines qui diffèrent par leur aspect morphologique et leur transmetteur. Les cellules amacrines sont connectées latéralement entre elles. Ces cellules ne possèdent pas d’axone. Elles sont classées en fonction des caractéristiques morphologiques de leur arbre dendritique et de leur localisation dans la couche plexiforme interne. Elles sont responsables de la modulation latérale de la transmission du signal en établissant des synapses avec les cellules bipolaires mais aussi entre elles.
Les cellules interplexiformes sont considérées comme une troisième variété de cellules d’association. Elles mettent en relation des cellules de la couche plexiforme interne avec des cellules de la couche plexiforme externe. Elles pourraient jouer un rôle dans la modulation du signal entre les deux couches plexiformes.
Cette couche correspond à la zone de jonction entre les deux premiers neurones. Elle est formée par les nombreuses expansions des cellules de la couche nucléaire interne et des cellules ganglionnaires auxquelles se mêlent les expansions des cellules de soutien (astrocytes et cellules de Müller). Cette couche est le site des synapses entre les cellules bipolaires, les cellules amacrines et les cellules ganglionnaires.
L’épaisseur de la couche plexiforme interne varie selon la localisation. Elle est absente au centre de la fovéa.
Cette couche contient les corps cellulaires des cellules ganglionnaires qui correspondent aux deuxièmes neurones (fig. 2-8). Elles sont de plusieurs types non distinguables en morphologie. Leurs dendrites sont situées dans la couche plexiforme interne et leurs axones forment les fibres nerveuses et le nerf optique. La densité des cellules ganglionnaires est maximale en périfovéolaire.
D’un point de vue fonctionnel, les cellules ganglionnaires qui font synapse avec les cellules bipolaires « ON » sont dites cellules ganglionnaires de type « ON » et celles qui font synapse avec les cellules bipolaires « OFF » sont dites « OFF ».
De plus, grâce notamment aux cellules horizontales, chacune des cellules ganglionnaires (« ON » ou « OFF ») est en relation indirecte avec d’autres cellules sous-jacentes.

Fig. 2-8 Coupe centrée sur les cellules ganglionnaires.
Ce sont des cellules avec un noyau central, dans un cytoplasme éosinophile avec un aspect « d’œuf sur le plat » (flèche). Cette couche sépare la couche plexiforme interne (CPI) de la couche des fibres nerveuses (CFN). La rétine est séparée du vitré par la membrane limitante interne (flèche en pointillés). En interne, présence des noyaux de la couche nucléaire interne (CNI) et de la couche plexiforme externe (CPE).
Cette couche contient les axones non myélinisés des cellules ganglionnaires qui se prolongent pour former le nerf optique. Les axones sont entourés par les cellules de Müller et les cellules gliales.
La membrane limitante interne recouvre la surface rétinienne et correspond à une membrane basale, elle est associée aux pieds des cellules de Müller et aux fibrilles de collagène du vitré. Elle est colorée par le PAS.
Les cellules de Müller occupent toute l’épaisseur de la rétine, mais leur noyau est situé dans la couche nucléaire interne (fig. 2-9). Elles entourent, grâce à leurs nombreuses expansions cellulaires, les neurones et leurs expansions (dendrites et axones) des deux couches plexiformes, et les cellules ganglionnaires (et leurs axones). Les seuls endroits où les cellules nerveuses sont en contact les unes avec les autres correspondent aux synapses.
Les cellules de Müller ont un rôle métabolique et de maintien de l’architecture rétinienne. Elles expriment en immuno-histochimie la glial fibrillary acidic protein ou GFAP (fig. 2-10).
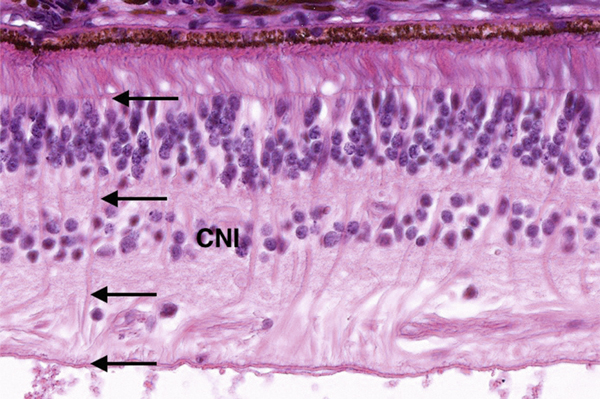
Fig. 2-9 Les noyaux des cellules de Müller sont situés dans la couche nucléaire interne (CNI) et leurs expansions s’étendent sur toute l’épaisseur de la rétine (flèches).

Fig. 2-10 Marquage par la GFAP (brun) des cellules de Müller et des astrocytes.
Comme dans le cerveau, il s’agit de cellules stellaires à noyau ovale. Ils sont surtout abondants dans la couche des fibres nerveuses et autour des vaisseaux. Ils expriment aussi la GFAP (fig. 2-10).
Il s’agit de macrophages tissulaires (exprimant le CD45). Ces cellules sont présentes à l’interface entre les fibres nerveuses et les cellules ganglionnaires, dans les couches plexiformes et autour des vaisseaux. Elles sont absentes dans la fovéa.
Il existe un double système vasculaire dans la rétine : un système extrarétinien et un système intrarétinien.
La choriocapillaire vascularise les couches externes et notamment les photorécepteurs. Ce réseau capillaire joue un rôle fondamental dans la vascularisation fovéolaire.
Les branches de l’artère centrale de la rétine prennent en charge l’apport artériel aux couches internes de la rétine. La couche nucléaire interne de la rétine et des cellules ganglionnaires est irriguée par un réseau capillaire constitué de capillaires étanches (jonctions serrées entre les cellules endothéliales réalisant la barrière hémato-rétinienne interne) (fig. 2-11). À ce réseau, peuvent s’ajouter des artères surnuméraires comme les artères ciliorétiniennes.
Le réseau veineux correspond aux veines cheminant parallèlement aux artères et se drainant dans la veine centrale de la rétine. Ces veines ont un diamètre plus important.
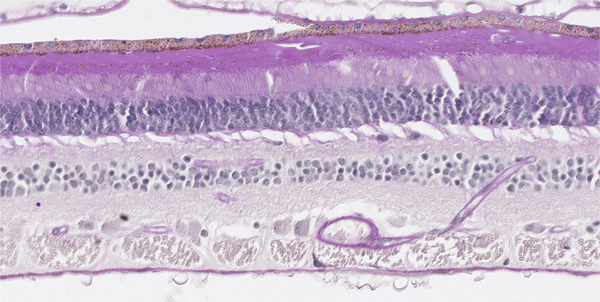
Fig. 2-11 Réseau capillaire dans la rétine marqué par le PAS.
La rétine centrale, d’un diamètre de 1,5 mm, présente des limites histologiquement bien définies qui sont représentées par :
des photorécepteurs uniquement de type cône ;
l’épaisseur diminuée des couches nucléaires ;
l’orientation des fibres dans la couche plexiforme externe : les axones des cônes et des bâtonnets sont orientés radiairement à partir de la fovéa et constituent les fibres de Henlé ;
la limite périphérique de la macula correspondant à la zone où les cellules ganglionnaires sont réparties sur une seule couche.
La zone maculaire se divise en fovéa, parafovéa et périfovéa.
La fovéa est une dépression de la rétine et comprend la fovéola au centre et le clivus qui borde latéralement la dépression fovéolaire. Sur le plan histologique, les photorécepteurs sont tous des cônes.
L’ora serrata représente la zone de jonction entre le corps ciliaire et la rétine. Cette transition est abrupte, l’épithélium pigmentaire étant en continuité directe avec les cellules pigmentaires de l’épithélium ciliaire, tandis que la neurorétine se poursuit avec la couche des cellules claires de l’épithélium du corps ciliaire. En augmentant en âge, des espaces cystoïdes se forment dans les couches plexiformes. Ces espaces sont remplis de mucopolysaccharides et bordés par les cellules de Müller (fig. 2-12).

Fig. 2-12 À l’ora serrata, des espaces cystoïdes bordés par les corps cytoplasmiques des cellules de Müller se forment, avec l’âge, dans les couches plexiformes.
La papille (ou tête du nerf optique ou disque optique) est l’origine du nerf optique. Elle est constituée par la convergence des fibres nerveuses issues des cellules ganglionnaires. Dépourvue de cellules photoréceptrices, la zone papillaire est « aveugle ». La lame criblée se caractérise par la présence de fibroblastes provenant de la sclère, les fibres nerveuses forment un bombement lorsqu’elles pénètrent la zone prélaminaire. Sa vascularisation, indépendante de l’artère et de la veine centrale de la rétine qui la traversent, est assurée par des capillaires particulièrement sensibles à l’équilibre entre pression oculaire et pression artérielle. Les axones amyéliniques dans la rétine se myélinisent après la papille et forment le nerf optique.
L’œdème maculaire est défini par l’accumulation de liquide dans la rétine maculaire. L’œdème maculaire cystoïde (OMC) correspond à la formation de cavités (logettes) essentiellement au sein de la couche rétinienne plexiforme externe (couche des fibres de Henlé) et de la couche rétinienne nucléaire interne (fig. 2-13). L’œdème maculaire prend une disposition en rayon de roue, à centre maculaire et à périphérie externe. À l’examen histologique, il se présente sous forme de vastes espaces à contours ronds ou ovalaires, remplis d’une substance optiquement vide ou comportant un matériel finement granuleux éosinophile.
Dans une étude en microscopie électronique publiée en 1982, Tso avait analysé 35 cas d’OM ; il avait montré que les kystes étaient localisés dans des couches de la rétine différentes en fonction de l’étiologie de l’OM [6]. Dans l’OM du pseudophaque, les kystes étaient plutôt localisés dans les couches internes de la rétine ; dans les occlusions veineuses rétiniennes, ils pouvaient s’étendre dans toutes les couches de la rétine, et dans l’OM diabétique, ils étaient plutôt localisés dans les couches externes de la rétine.
Fine et Brucker [7], puis Yanoff et al. [8] ont examiné en microscopie électronique trois cas d’OMC. Ils suggèrent que l’OM serait initialement intracellulaire : ils ont retrouvé un gonflement cytoplasmique des cellules de Müller, sans augmentation de taille des espaces intercellulaires (fig. 2-14). L’augmentation progressive de ce gonflement cytoplasmique conduirait à la nécrose cellulaire et à une dégénérescence neuronale. Le liquide deviendrait extracellulaire avec la mort de ces cellules ; il s’accumulerait dans le tissu intrarétinien, traversé de « piliers cellulaires » constitués de cellules bipolaires et de cellules de Müller compactées donnant l’aspect de kystes en OCT (fig. 2-15 et 2-16) [9].
Si le liquide semble s’accumuler préférentiellement entre les couches plexiformes externes et internes, leur localisation varie selon l’étiologie de l’OM. D’autres lésions histologiques peuvent être retrouvées en fonction de l’étiologie de l’OM.

Fig. 2-13 Coupe passant par le centre de la fovéa. L’œdème est présent dans toutes les couches de la rétine, mais prédomine dans la couche des fibres de Henlé, où un petit kyste s’est développé (flèche). (Paraphénylènediamine, × 60, AF1P Neg.81-11576.)
(Source : Yanoff M, et al. Pathology of human cistoid macular edema. Surv Ophthalmol 1984 ; 28 : 505. Reproduction autorisée.)

Fig. 2-14 Une coupe au niveau de la couche des fibres de Henlé montre le gonflement des cellules de Müller (MC) témoignant de l’œdème intrarétinien.
Les espaces intercellulaires sont bien visibles et ne sont pas élargis. On observe en plusieurs endroits une rupture de la membrane plasmique de la MC (flèches).
(Source : Yanoff M, et al. Pathology of human cistoid macular edema. Surv Ophthalmol 1984 ; 28 : 505. Reproduction autorisée.)
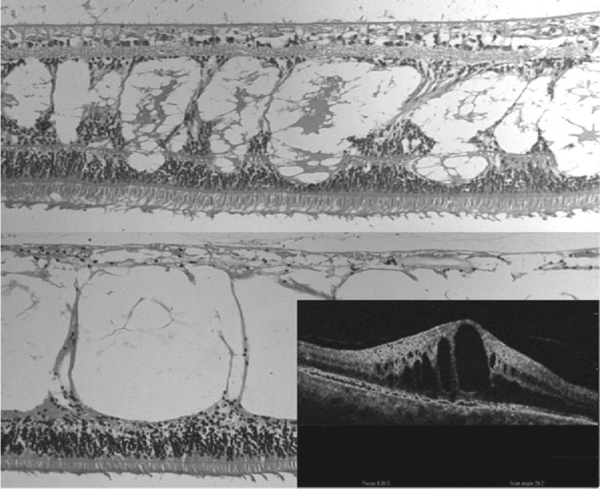
Fig. 2-15 Microscopie optique et OCT (OCT/scanning laser ophthalmoscopy ou SLO ; OTI, Toronto, ONT, Canada) : images de rétine humaine atteinte d’œdème maculaire cystoïde.
Exemples d’OM récent (en haut) et tardif (en bas). Le liquide intrarétinien semble être contenu dans des espaces kystiques intrarétiniens séparés par des piliers.
(Source : Pelosini L, Hull CC, Boyce JF, et al. Optical coherence tomography may be used to predict visual acuity in patients with macular edema invest. Ophthalmol Vis Sci 2011 ; 52, 5 : 2741-8. Association for Research in Vision and Ophthalmology Copyright © 2015. Reproduction autorisée.)
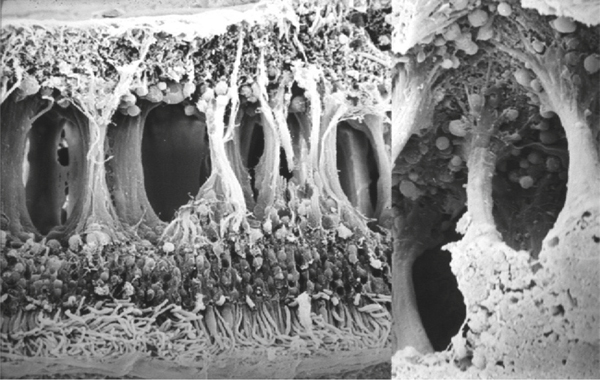
Fig. 2-16 Image en microscopie électronique d’OMC.
Des colonnes de tissu rétinien sont présentes au sein d’un espace continu de liquide intrarétinien. Elles sont constituées par les axones des cellules bipolaires et des cellules de Müller (collection de John Marshall). À droite : détail à fort grossissement.
(Source : Pelosini L, Hull CC, Boyce JF, et al. Optical coherence tomography may be used to predict visual acuity in patients with macular edema invest. Ophthalmol Vis Sci 2011 ; 52, 5 : 2741-48. Association for Research in Vision and Ophthalmology Copyright © 2015. Reproduction autorisée.)
[1] Hogan MJ, Alvarado JA, Weddel JE. Histology of the human eye. An atlas and textbook. Philadelphia, London, Toronto : W.B. Saundres Company ; 1971.
[2] Krstic RV. Human microscopic anatomy. Berlin-Heildeberg : Springer-Verlag ; 1991.
[3] Lee WR. Ophthalmic histopathology. 2nd ed. London : Springer-Verlag ; 2002.
[4] Eagle RC. Eye pathology : an atlas and text. 2nd ed. Philadelphia : Lippincott Williams & Wilkins ; 2011.
[5] Yanoff M, Sassani JW. Ocular pathology. 6th ed. Mosby Elsevier ; 2009.
[6] Tso MO. Pathology of cystoid macular edema. Ophthalmology 1982 ; 89 : 902-15.
[7] Fine BS, Brucker AJ. Macular edema and cystoid macular edema. Am J Ophthalmol 1981 ; 92 : 466-81.
[8] Yanoff M, Fine BS, Brucker AJ, Eagle RC. Pathology of human cystoid macular edema. Surv Ophthalmol 1984 ; 28 (suppl) : 505-11.
[9] Pelosini L, Hull CC, Boyce JF, et al. Optical coherence tomography may be used to predict visual acuity in patients with macular edema. Invest Ophthalmol Vis Sci 2011 ; 52 : 2741-8.