Autres causes d’œdème maculaire
Coordonné par C. Creuzot-Garcher
C. Deschasse, Y. Kauffmann
➤ Des phénomènes exsudatifs rétiniens ont été décrits en association avec l’ischémie choroïdienne de type multifocal.
➤ L’ischémie choroïdienne du « syndrome triangulaire » ne s’accompagne classiquement pas d’œdème rétinien.
➤ Des décollements séreux peuvent compliquer la phase aiguë. Les taches d’Elschnig apparaissent secondairement au niveau des zones ischémiques.
➤ Rare dans la toxémie gravidique, une ischémie choroïdienne multifocale peut survenir en cas d’atteinte de la choriocapillaire.
Des phénomènes exsudatifs rétiniens ont été décrits en association avec l’ischémie choroïdienne de type multifocal par obstruction au niveau de la choriocapillaire ou des petits vaisseaux pré- et post-capillaires. Par opposition, l’ischémie choroïdienne du « syndrome triangulaire », résultant de l’occlusion d’une artère ciliaire postérieure, ne s’accompagne classiquement pas d’œdème rétinien. Plusieurs étiologies sont associées aux formes multifocales telles que l’hypertension artérielle maligne, la toxémie gravidique ou encore le syndrome de Vogt-Koyanagi-Harada [1–3]. À la phase aiguë, des décollements séreux rétiniens plurilobés associés à de petites taches jaunâtres réparties sur tout le pôle postérieur peuvent être retrouvés au fond d’œil. La baisse d’acuité visuelle est variable selon leur localisation [4, 5]. Quelques jours après le début des symptômes, des taches d’Elschnig, correspondant à des plages d’atrophie de l’épithélium pigmentaire arrondies et plus ou moins pigmentées, peuvent apparaître (fig. 14-1). Ces dernières sont superposables aux zones d’ischémie initiales et traduisent un phénomène de cicatrisation de l’épithélium pigmentaire (EP) nécrosé [6]. L’optical coherence tomography (OCT) est utile à la phase aiguë pour quantifier les phénomènes exsudatifs. À la phase tardive, les taches d’Elschnig apparaissent sous la forme de dépôts sous-rétiniens ou d’épaississements focaux de l’EP (fig. 14-2). L’angiographie à la fluorescéine et au vert d’indocyanine montre de nombreuses zones de retard de remplissage choroïdien. Disposées en mosaïque, elles ne sont pas systématisées à la manière d’une occlusion ciliorétinienne mais peuvent avoir tendance à souligner les contours des lobules de la choriocapillaire (fig. 14-3). Des points de diffusion à l’origine du remplissage des décollements séreux rétiniens sont classiques à la phase aiguë [4, 5]. Dans la majorité des cas, les symptômes sont améliorés après le traitement étiologique bien que les taches d’Elschnig restent visibles au fond d’œil.

Fig. 14-1 Décollement de rétine exsudatif par ischémie choroïdienne durant une toxémie gravidique.
a. Cliché anérythre œil droit. Vaste décollement séreux rétinien du pôle postérieur s’étendant en rétine supérieure, associé à des taches jaunes sous-rétiniennes. L’œil gauche est également atteint de décollement de rétine exsudatif. b. Cliché angiographique au temps artérioveineux précoce montrant un retard de perfusion majeur et irrégulier de la choriocapillaire. c. Cliché angiographique au temps tardif montrant un remplissage en mosaïque de la choriocapillaire encore incomplet. Diffusion massive de colorant à travers l’épithélium pigmentaire, remplissant le décollement rétinien exsudatif. d. Ischémie choroïdienne en périphérie rétinienne.
(Source : clichés de la collection du Dr Stéphane Dumas.)
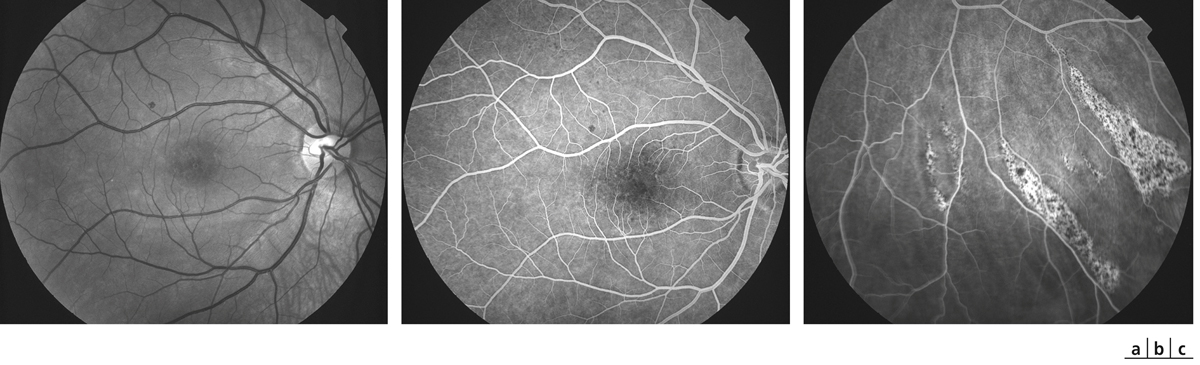
Fig. 14-2 Aspect du fond d’œil 4 semaines après accouchement.
a. L’aspect du fond d’œil s’est normalisé. b. On observe des cicatrices pigmentées au pôle postérieur et en rétine supérieure correspondant aux taches d’Elschnig. c. En périphérie rétinienne, on observe des stries de Siegrist, séquellaires de l’ischémie rétinienne.
(Source : clichés de la collection du Dr Stéphane Dumas.)
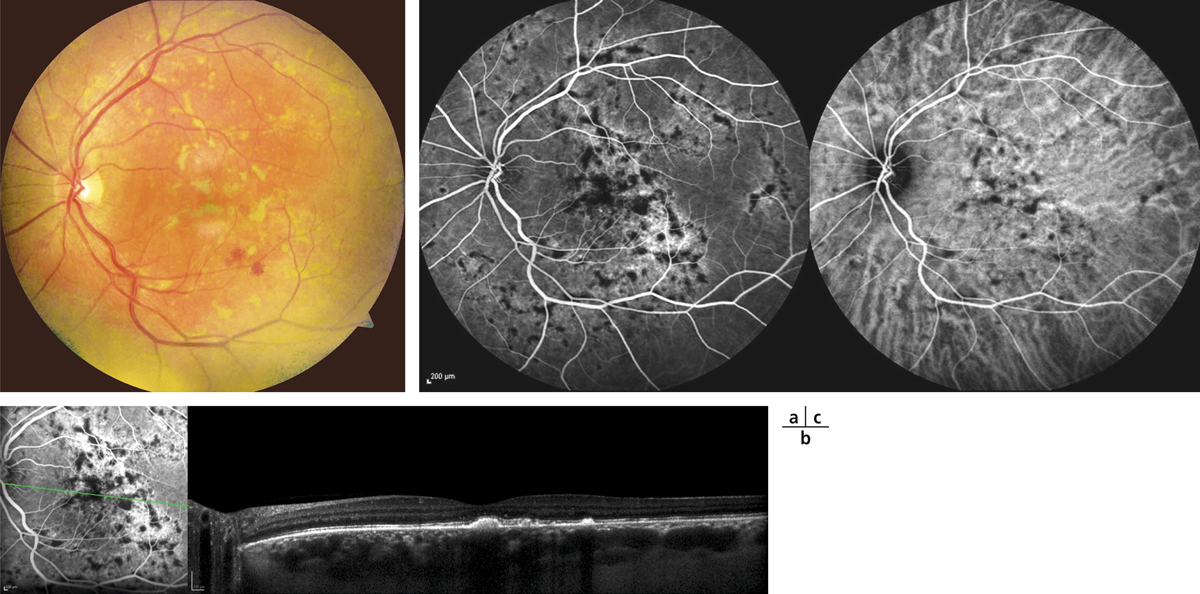
Fig. 14-3 Taches d’Elschnig.
a. Photographie couleur. Taches pigmentées correspondant aux taches d’Elschnig. b. OCT : les taches d’Elschnig apparaissent sous la forme de dépôts sous-rétiniens ou d’épaississements focaux de l’EP. c. Aspect en angiographie à la fluorescéine et au vert d’indocyanine.
La toxémie gravidique, encore appelée prééclampsie, est un syndrome associant hypertension artérielle sévère et protéinurie survenant en général au 3e trimestre de la grossesse. Le terme d’éclampsie est quant à lui réservé aux formes convulsives. La toxémie concerne environ 5 % des femmes enceintes et est causée par une ischémie placentaire chronique responsable de la libération de nombreux médiateurs vasculaires à l’origine des effets systémiques [7]. Les atteintes rétiniennes retrouvées sont surtout celles liées à la rétinopathie hypertensive (angiospasme, hémorragies, nodules cotonneux et œdème papillaire) [7, 8]. Des signes d’ischémie choroïdienne associés à un spasme artériel ou artériolaire sont retrouvés dans 1 à 2 % des cas de prééclampsie et peuvent concerner jusqu’à 10 % des femmes en cas d’éclampsie [7]. L’aspect du fond d’œil et des examens d’imagerie est alors identique à celui d’une ischémie choroïdienne multifocale s’il existe une atteinte de la choriocapillaire ou d’un syndrome triangulaire si l’occlusion concerne une ou plusieurs artères ciliaires postérieures [3, 6, 7, 9].
Bien que les manifestations rétiniennes des formes sévères de purpura soient principalement de nature hémorragique, la thrombopénie et la fragilité vasculaire qui en résulte peuvent, dans de rares cas, être associées à des phénomènes exsudatifs rétiniens (œdèmes ou décollements séreux). Ces signes sont en règle générale transitoires et s’améliorent rapidement après la normalisation du taux de plaquettes [10, 11].
[1] Fardeau C, Tran TH, Gharbi B, et al. Retinal fluorescein and indocyanine green angiography and optical coherence tomography in successive stages of Vogt-Koyanagi-Harada disease. Int Ophthalmol 2007 ; 27 : 163-72.
[2] Klien BA. Ischemic infarcts of the choroid (Elschinig spots). A cause of retinal separation in hypertensive disease with renal insufficiency. A clinical and histopathologic study. Am J Ophthalmol 1968 ; 66 : 1069-74.
[3] Saito Y, Tano Y. Retinal pigment epithelial lesions associated with choroidal ischemia in preeclampsia. Retina 1998 ; 18 : 103-8.
[4] Gaudric A. Ischémie choroïdienne aiguë. Encycl Med Chir (Elsevier, Paris). 21-235-B-18. 2009.
[5] Gaudric A, Sterkers M, Coscas G. Retinal detachment after choroidal ischemia. Am J Ophthalmol 1987 ; 104 : 364-72.
[6] Gaudric A, Binaghi M, Coscas G. Acute choriocapillary occlusion and Elschnig’s bodies in the course of pregnancy toxemias. J Fr Ophtalmol 1981 ; 4 : 440-1.
[7] Sunness JS. The pregnant woman’s eye. Surv Ophthalmol 1988 ; 32 : 219-38.
[8] Fastenberg DM, Fetkenhour CL, Choromokos E, Shoch DE. Choroidal vascular changes in toxemia of pregnancy. Am J Ophthalmol 1980 ; 89 : 362-8.
[9] Larcan A, Lambert H, Laprevote-Heully MC, et al. Acute choriocapillaris occlusion in pregnancy and puerperium. Toxemias, thrombotic microangiopathies. J Mal Vasc 1985 ; 10 : 213-9.
[10] Titah C, Abisror N, Affortit A, Coppo P. Bilateral serous detachment of retina : an unusual mode of revelation of thrombotic thrombocytopenic purpura of favorable outcome with plasma exchange. Graefes Arch Clin Exp Ophthalmol 2014 ; 252 : 181-3.
[11] Nanayakkara P, Gans RO, Reichert-Thoen J, ter Wee PM. Serous retinal detachment as an early presentation of thrombotic thrombocytopenic purpura. Eur J Intern Med 2000 ; 11 : 286-8.
S.-Y. Cohen
➤ L’hypertension artérielle (HTA) sévère peut entraîner l’apparition d’hémorragies rétiniennes, de nodules cotonneux, de lipides intrarétiniens.
➤ L’HTA peut se compliquer d’une ischémie rétinienne ou choroïdienne.
➤ Le traitement des complications de l’HTA passe par la normalisation de la tension artérielle.
➤ Les macro-anévrismes (MA) constituent un marqueur de morbi-mortalité liée aux facteurs de risque vasculaires associés.
➤ Souvent asymptomatiques, les MA peuvent entraîner un œdème intrarétinien à l’origine d’une baisse de vision s’il atteint le centre de la macula.
➤ Un MA compliqué d’une hémorragie intravitréenne peut s’occlure secondairement.
➤ Le traitement repose avant tout sur le laser pour occlure le MA et/ou les anti-VEGF pour traiter l’œdème.
L’hypertension est l’une des affections la plus fréquemment observée dans les pays développés. Elle peut avoir de nombreuses conséquences générales dont une majoration importante du risque de mort cardiovasculaire. Elle est définie par une pression artérielle systolique supérieure à 14 mmHg et/ou une tension diastolique supérieure à 90 mmHg. L’hypertension sévère est définie par une hypertension systolique supérieure à 180 mmHg ou une tension diastolique supérieure à 110 mmHg. L’hypertension artérielle peut avoir de nombreuses conséquences au niveau des différents organes. Elle atteint en particulier le cerveau, le cœur, les reins.
Au niveau de la rétine, l’hypertension peut s’accompagner d’hémorragies rétiniennes, de nodules cotonneux, de l’accumulation de lipides intrarétiniens et d’occlusions vasculaires rétiniennes ou choriocapillaires [1]. Un retentissement artériolaire peut également être observé correspondant à un amincissement des artères. Des hémorragies ou un œdème peuvent être également observés au niveau de la tête du nerf optique. Les hypertensions sévères peuvent s’accompagner d’un retard de perfusion choriocapillaire en angiographie.
L’angiographie peut également mettre en évidence une raréfaction capillaire ainsi que des points hyperfluorescents correspondant à des souffrances aiguës de la choriocapillaire entraînant des petites zones de soulèvement de la rétine centrale. L’hypertension peut également participer à la constitution de complications rétiniennes qui peuvent elles-mêmes se compliquer d’œdème : occlusion de la veine centrale de la rétine ou de ses branches, macro-anévrismes artériels.
Un décollement séreux rétinien maculaire peut être observé de même qu’un œdème intrarétinien. Ces anomalies sont liées à la rupture de la barrière hémato-rétinienne externe. L’ischémie se traduit également au fond d’œil par la présence de nombreux nodules cotonneux à disposition péripapillaire associés à des hémorragies (fig. 14-4).
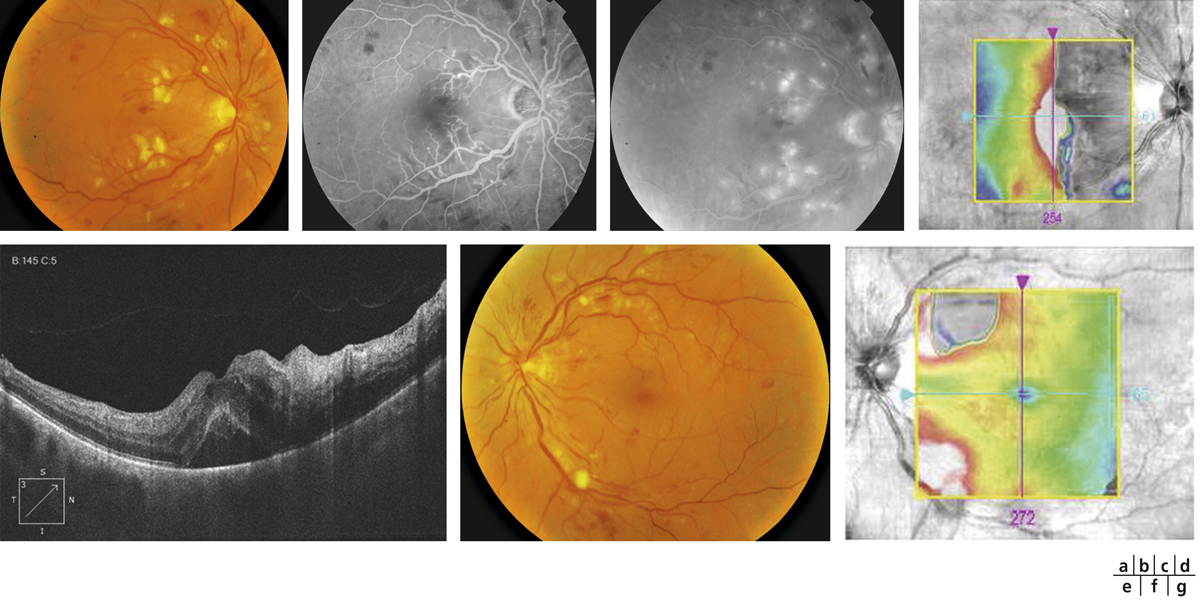
Fig. 14-4 Rétinopathie hypertensive.
Œil droit et œil gauche d’un patient de 42 ans chez qui des anomalies du fond d’œil ont été diagnostiquées. Le jour de l’examen, la tension artérielle est mesurée à 210/145 mmHg. L’examen du fond d’œil met en évidence de nombreux nodules cotonneux, à disposition péripapillaire, associés à des hémorragies en flammèches (a). L’angiographie à la fluorescéine montre une raréfaction capillaire de la zone inter-papillo-maculaire associée à des ponctuatios hyperfluorescentes tardives (b, c). La cartographie de l’OCT montre une désorganisation de la rétine inter-papillo-maculaire (d). Les coupes passant à ce niveau montrent un décollement séreux rétinien, associé à un œdème intrarétinien (e). L’atteinte de l’œil gauche est moins sévère, avec un œdème localisé au voisinage des vaisseaux temporaux supérieurs, n’atteignant pas la macula (f, g).
Le traitement de ces œdèmes repose exclusivement sur la normalisation de la pression artérielle. Cette normalisation va s’accompagner d’une disparition progressive des phénomènes exsudatifs. Lorsque les manifestations ischémiques sont au premier plan, un amincissement séquellaire de la rétine interne peut être observé.
Les macro-anévrismes artériels correspondent à des dilatations de la paroi des artérioles rétiniennes. Ils sont observés en règle après 60 ans chez des patients hypertendus. Une prédominance féminine est notée dans la littérature [2–4]. Les macro-anévrismes peuvent être considérés comme un marqueur de morbi-mortalité liée aux facteurs de risque vasculaires associés.
Souvent asymptomatiques, les macro-anévrismes sont habituellement révélés par une baisse d’acuité visuelle liée à un œdème intrarétinien, des hémorragies, parfois des hémorragies intravitréennes révélatrices. Différents examens complémentaires permettent la mise en évidence du macro-anévrisme : la localisation péri-artérielle de l’hémorragie peut évoquer le diagnostic dès l’examen du fond d’œil (fig. 14-5 et 14-6). L’angiographie à la fluorescéine ou au vert d’indocyanine révèle en général le macro-anévrisme sous la forme d’une dilatation pariétale artérielle localisée donnant lieu à une hyperfluorescence [4, 5]. Les hémorragies compliquant les macro-anévrismes sont fréquemment situées dans plusieurs couches, elles peuvent être prérétiniennes, intrarétiniennes, sous-rétiniennes et souvent les trois à la fois [5, 6]. Elles peuvent masquer la lésion causale. Un œdème intrarétinien peut être associé. Il est habituellement mieux visualisé sur l’OCT.
Des formes particulières ont été individualisées : formes multiples associées à la sarcoïdose [7], formes compliquant des macrovaisseaux [8].
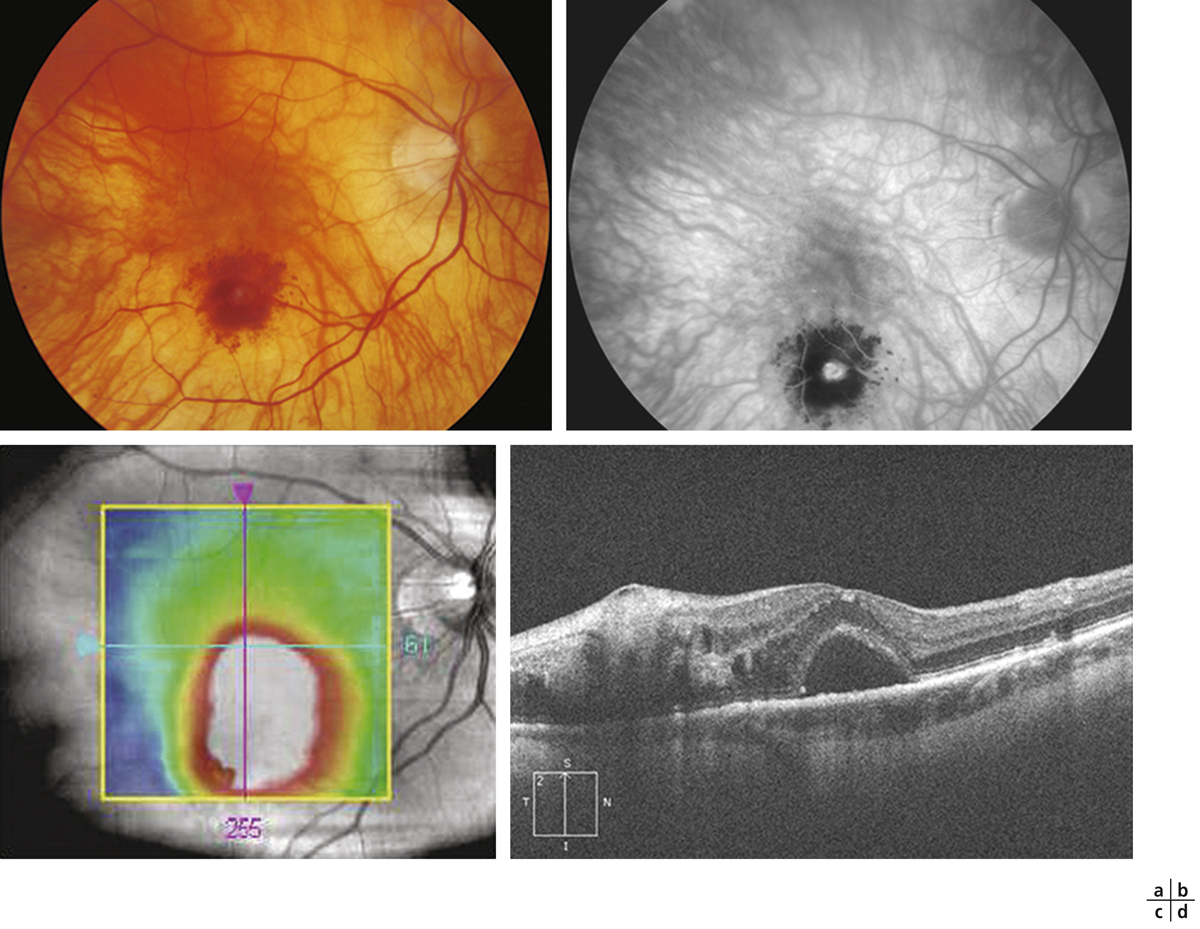
Fig. 14-5 Macro-anévrisme artériel développé sur un œil présentant une choroïdose myopique.
Le cliché en couleurs met en évidence des hémorragies centrées par une dilation vasculaire située sur la paroi d’une artère (a). L’angiographie confirme la dilatation anévrismale de la paroi de l’artère temporale inférieure (b). La cartographie de l’OCT montre une surélévation localisée à la partie inférieure de la macula impliquant la fovéola elle-même (c). La coupe verticale correspondante met en évidence le macro-anévrisme sous la forme d’une surélévation superficielle de la rétine associée à un cône d’ombre relatif. On note un œdème intrarétinien et un décollement séreux rétinien maculaire (d).
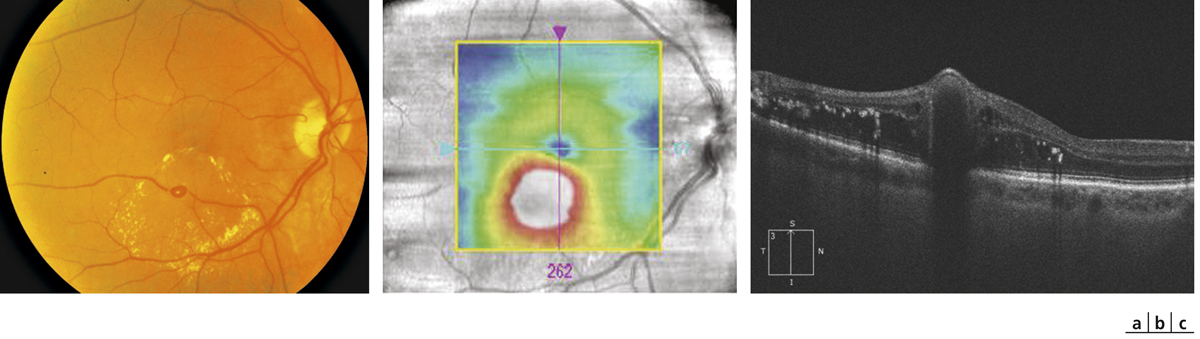
Fig. 14-6 Macro-anévrisme artériel centré par des exsudats.
Le cliché en couleurs met en évidence la dilatation macro-anévrismale située sur la paroi de l’artère temporale inférieure (a). On note des exsudats en couronne situés autour de la dilatation. La cartographie de l’OCT montre un œdème localisé à la partie temporale inférieure de la macula (b). La coupe verticale passant par le macro-anévrisme retrouve la dilation sous la forme d’une surélévation pointue, localisée de la rétine, associée à un cône d’ombre. On note un œdème intrarétinien au sein duquel on observe des lésions hyper-réflectives correspondant à l’accumulation d’exsudats lipidiques (c).
Le traitement des macro-anévrismes repose sur la simple observation, l’hémorragie ayant pu favoriser la fibrose spontanée des parois du macro-anévrisme. La photocoagulation peut être très efficace à condition d’utiliser des impacts faiblement dosés, de durée longue. Ce traitement expose cependant à un risque d’occlusion artériolaire. Il est donc important de s’assurer de l’absence de vascularisation de la macula par les branches de l’artère sur laquelle se situe le macro-anévrisme. L’application d’impacts infracliniques (subthreshold) a également été proposée pour éviter cette complication [9]. Les injections intravitréennes d’anti-VEGF ont également été proposées. Elles ont pour but de diminuer l’exsudation associée et de favoriser la résorption de l’hémorragie [10–12]. Le traitement des formes hémorragiques peut nécessiter une vitrectomie. L’injection de recombinant tissue plasminogen activator (rTPa) a également été proposée [13, 14].
[1] Dellacroce JT, Vitale AT. Hypertension and the eye. Curr Opin Ophthalmol 2008 ; 19 : 493-8.
[2] Pitkänen L, Tommila P, Kaarniranta K, et al. Retinal arterial macroaneurysms. Acta Ophthalmol 2014 ; 92 : 101-4.
[3] Takahashi K, Kishi S. Serous macular detachment associated with retinal arterial macroaneurysm. Jpn J Ophthalmol 2006 ; 50 : 460-4.
[4] Moosavi RA, Fong KC, Chopdar A. Retinal artery macroaneurysms : clinical and fluorescein angiographic features in 34 patients. Eye 2006 ; 20 : 1011-20.
[5] Deschasse C, Isaico R, Creuzot-Garcher C, Bron AM. Retinal macroaneurysms and macular hemorrhages : report of five cases. J Fr Ophtalmol 2014 ; 37 : 347-52.
[6] Goldenberg D, Soiberman U, Loewenstein A, Goldstein M. Heidelberg spectral-domain optical coherence tomographic findings in retinal artery macroaneurysm. Retina 2012 ; 32 : 990-5.
[7] Yokoi K, Oshita M, Goto H. Retinal macroaneurysm associated with ocular sarcoidosis. Jpn J Ophthalmol 2010 ; 54 : 392-5.
[8] Koizumi H, Iida T, Mori T, et al. Retinal arteriolar macroaneurysm and congenital retinal macrovessel. Ophthalmic Surg Lasers Imaging 2009 ; 40 : 513-5.
[9] Battaglia Parodi M, Iacono P, Pierro L, et al. Subthreshold laser treatment versus threshold laser treatment for symptomatic retinal arterial macroaneurysm. Invest Ophthalmol Vis Sci 2012 ; 53 : 1783-6.
[10] Kishore K. Intravitreal bevacizumab for symptomatic retinal arterial macroaneurysm. Am J Ophthalmol 2014 ; 157 : 260.
[11] Zweifel SA, Tönz MS, Pfenninger L, et al. Intravitreal anti-VEGF therapy for retinal macroaneurysm. Klin Monbl Augenheilkd 2013 ; 230 : 392-5.
[12] Cho HJ, Rhee TK, Kim HS, et al. Intravitreal bevacizumab for symptomatic retinal arterial macroaneurysm. Am J Ophthalmol 2013 ; 155 : 898-904.
[13] Inoue M, Shiraga F, Shirakata Y, et al. Subretinal injection of recombinant tissue plasminogen activator for submacular hemorrhage associated with ruptured retinal arterial macroaneurysm. Graefes Arch Clin Exp Ophthalmol 2015 ; 253 : 1663-9.
[14] Van Zeeburg EJ, Cereda MG, Van Meurs JC. Recombinant tissue plasminogen activator, vitrectomy, and gas for recent submacular hemorrhage displacement due to retinal macroaneurysm. Graefes Arch Clin Exp Ophthalmol 2013 ;251 : 733-4.
L. Lumbroso-Le Rouic
➤ La rétinopathie radique (RR) est une complication souvent tardive d’une irradiation oculaire ou péri-orbitaire.
➤ La RR se caractérise par l’apparition de phénomènes ischémiques et exsudatifs rétiniens.
➤ La maculopathie radique est souvent l’un des premiers signes de RR, car les signes prédominent au pôle postérieur.
➤ L’OCT et l’angiographie sont utiles pour détecter et suivre les complications œdémateuses et ischémiques.
➤ Les corticoïdes et les anti-vascular endothelial growth factors (anti-VEGF) constituent les principaux traitements de la RR et de ses complications.
➤ Un suivi régulier systématique des patients à risque permet de dépister précocement les complications et discuter de leur prise en charge.
La rétinopathie radio-induite ou rétinopathie radique (RR) est une pathologie occlusive des vaisseaux rétiniens qui apparaît après irradiation du globe oculaire, réalisée soit pour une tumeur intra-oculaire (radiothérapie externe, curiethérapie), soit pour le traitement d’une néoplasie des structures avoisinantes (orbite, base du crâne, cavités aériennes de la face, encéphale, etc.). Cette atteinte se déclare de façon retardée (parfois de plusieurs années) par rapport au traitement. Elle consiste en une occlusion des capillaires rétiniens puis des gros vaisseaux pouvant aboutir à une baisse de l’acuité visuelle en cas d’atteinte maculaire, une néovascularisation rétinienne et éventuellement même à l’énucléation secondaire pour glaucome néovasculaire hyperalgique. Cette vasculopathie a été décrite dès 1933 par Stallard dans les suites d’un traitement par aiguilles de radon [1, 2].
Les premiers signes cliniques consistent en l’apparition, au fond d’œil, d’une dilatation des capillaires rétiniens, de malformations vasculaires (micro-anévrismes, télangiectasies) et d’hémorragies intra- ou prérétiniennes. Des exsudats secs peuvent aussi être présents. Les occlusions capillaires entraînent des petites zones d’ischémie (se traduisant cliniquement par des nodules cotonneux) fugaces et peu fréquentes [2–4]. Des phénomènes exsudatifs peuvent ensuite apparaître avec un œdème rétinien, le plus souvent maculaire. Les zones d’ischémie capillaire peuvent s’étendre et, dans certains cas, une néovascularisation rétinienne ou du nerf optique peut se développer. Ces néovaisseaux peuvent entraîner des hémorragies intravitréennes voire un glaucome néovasculaire [5]. Ces altérations vasculaires et les phénomènes exsudatifs qui les accompagnent peuvent être observés sur toute la surface rétinienne mais prédominent au pôle postérieur [3]. La maculopathie est d’ailleurs souvent l’un des premiers signes de rétinopathie radique [4, 6]. Le diagnostic des RR est clinique, il doit être complété par un examen en OCT et éventuellement une angiographie pour vérifier l’absence de territoires ischémiques étendus.
Cet examen est devenu l’outil essentiel pour le dépistage et le suivi des maculopathies radiques. Les altérations en OCT précédent souvent de plusieurs mois l’atteinte cliniquement visible [7].
Une classification « OCT » en cinq grades a été proposée pour décrire l’œdème dans les atteintes maculaires post-radiques en fonction de l’atteinte fovéolaire ou pas et de la présence de logettes kystiques [6]. Cette classification est bien corrélée à l’épaisseur rétinienne mais surtout à la baisse de vision.
L’angiographie à la fluorescéine est proposée en cas d’atteinte rétinienne clinique étendue.
Elle permet d’affirmer l’occlusion capillaire, la rupture de la maille périfovéolaire, de mieux apprécier les dilatations anévrismales, d’évaluer l’étendue des territoires ischémiques et l’éventuelle hyperperméabilité capillaire (fig. 14-7 à 14-9). Ces atteintes peuvent être de sévérité variable [8]. L’angiographie au vert d’indocyanine n’est pas faite de façon régulière, elle peut montrer une altération de la circulation vasculaire choroïdienne associée aux anomalies rétiniennes [9].
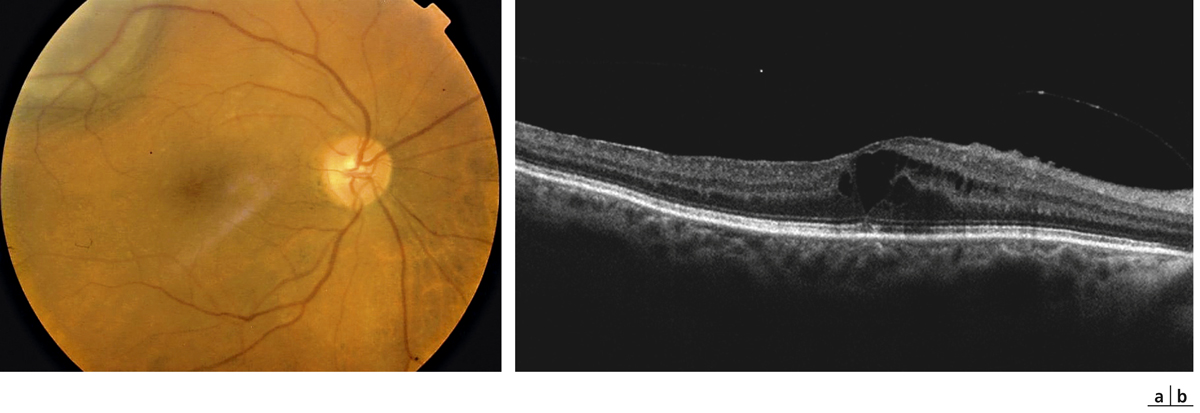
Fig. 14-7 Mélanome choroïdien postérieur traité par faisceau de protons.
Aspect en rétinographie en couleurs (a) et OCT (b) : apparition d’un œdème maculaire avec présence de logettes kystiques.
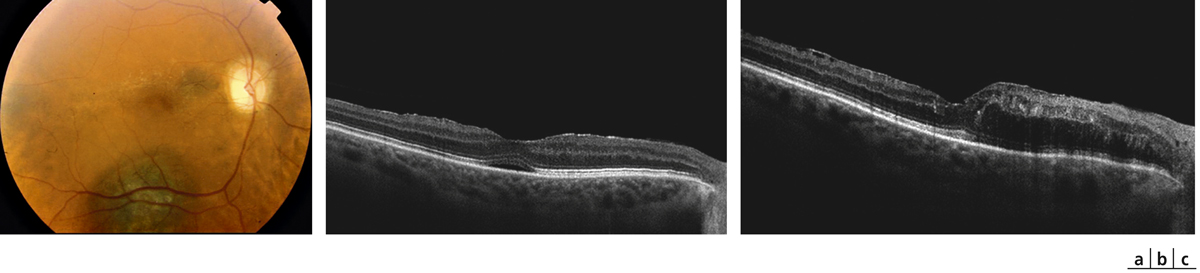
Fig. 14-8 Mélanome choroïdien postérieur traité par faisceau de protons.
Aspect en rétinographie en couleurs (a) et OCT (b) au diagnostic : décollement séreux rétinien (DSR) lié à l’exsudation tumorale. Résorption du DSR et apparition secondaire d’un œdème rétinien, en rapport avec la maculopathie radique débutante, 9 mois après irradiation (c).

Fig. 14-9 Mélanome choroïdien dans la région temporale supérieure du pôle postérieur traité par faisceau de protons. Apparition d’une rétinopathie radique 5 ans plus tard.
a. Cliché anérythre ; micro-anévrismes, anomalies microvasculaires intrarétiniennes (AMIR) du pôle postérieur ; œdème maculaire cystoïde. b. Cliché angiographique montrant une dilatation et une raréfaction des capillaires maculaires, associées à des micro-anévrismes et des AMIR. c. Temps tardif de l’angiographie montrant des diffusions et deux logettes centrales d’œdème maculaire. d. Coupe OCT objectivant l’œdème maculaire cystoïde avec deux logettes centrales.
(Source : clichés de la collection du Dr Stéphane Dumas.)
Le tableau clinique et paraclinique de la RR est très proche de celui de la rétinopathie diabétique. Ce qui doit faire évoquer le diagnostic est la notion d’irradiation possible du globe oculaire. L’étude du dossier du patient ainsi que le planning de thérapie peut aider à déterminer si la rétine a reçu des doses d’irradiation pouvant expliquer les manifestations cliniques.
L’incidence de la rétinopathie dépend des modalités de l’irradiation (dose totale, fractionnement, volume oculaire irradié et nature du rayonnement) [10]. En cas d’irradiation conventionnelle d’une pathologie non oculaire, et bien qu’il n’y ait pas de dose « seuil » minimale, les rétinopathies radiques sont rares pour des doses totales de moins de 45 Gy délivrées avec des fractionnements classiques autour de 2 Gy et pour une surface rétinienne irradiée inférieure à 50–60 % [11].
En cas de traitement de tumeurs intra-oculaires, les deux principales techniques utilisées sont la curiethérapie (disque) sus-sclérale et l’irradiation par particules chargées lourdes (protons, ions hélium). Dans les deux cas, il existe une réelle différence sur l’incidence des maculopathies radiques lorsque le traitement est réalisé pour une tumeur postérieure à l’équateur par rapport aux lésions antérieures [4, 12–15].
L’apparition de la RR est toujours retardée par rapport à l’irradiation. Ce délai est compris entre 1 et 8,5 ans après irradiation externe conventionnelle. Après faisceau de protons, le délai peut être compris entre 5 mois et 15 ans (moyenne 40 mois) [3, 4, 10, 11].
Une amélioration spontanée peut se produire mais elle est rare (moins de 5 %).
La baisse de l’acuité visuelle est fréquente, les patients conservent malgré tout souvent une acuité visuelle ambulatoire s’il n’y a pas d’atteinte du nerf optique associée [4, 14].
Les traitements proposés sont nombreux et ont évolué au cours du temps [6, 17].
La photocoagulation en grille de la macula a été l’une des premières modalités thérapeutiques. Ce traitement a permis une stabilisation de l’acuité visuelle dans près de la moitié des cas traités, bien que le bénéfice visuel ne persiste pas après 2 ans de suivi [18, 19]. Un traitement par laser focal d’éventuelles anomalies vasculaires peut entraîner une résorption des exsudats et une amélioration visuelle [8].
Quelques patients ont été traités par photothérapie dynamique, avec diminution des phénomènes exsudatifs et amélioration visuelle [20].
L’administration de médicaments par voie intravitréenne a par la suite été étudiée : la triamcinolone puis les anti-VEGF, voire l’association des deux. La triamcinolone a un effet positif chez une majorité des patients, mais qui ne persiste pas à long terme [21]. Les anti-VEGF ont été largement utilisés, il existe une efficacité sur la résolution de l’œdème, parfois après de multiples injections, la récupération visuelle étant par contre médiocre dans la plupart des cas [17, 22, 23]. De la même façon, l’utilisation d’implant intravitréen de dexaméthasone (0,7 mg) a montré des résultats intéressants [24]. L’association d’un corticoïde aux anti-VEGF pourrait être plus efficace chez les patients ayant une forme sévère [25].
Enfin une surveillance simple peut être aussi proposée en cas de vision conservée. Cependant, dans ces cas il faut garder à l’esprit que les meilleurs résultats après traitement de l’œdème sont obtenus lorsque l’acuité visuelle initiale n’est pas trop basse et qu’il n’existe pas de modifications cystiques chroniques rétiniennes [25]. Plusieurs études sont en cours pour l’évaluation des différents anti-VEGF et de la triamcinolone, ainsi que de leurs modalités d’administration, dans le traitement de la maculopathie radique.
En cas de rétinopathie proliférante associée, une photocoagulation panrétinienne des territoires ischémiques doit être réalisée pour contrôler les néovaisseaux.
La rétinopathie radique pouvant apparaître avec de faibles doses d’irradiation, la solution idéale serait de ne pas irradier le globe oculaire. Il est donc important d’évaluer au mieux les risques du traitement et de ne proposer une irradiation, même à faibles doses, qu’avec précaution dans les pathologies bénignes. Mais la plupart du temps, l’irradiation est indiquée pour le traitement d’une pathologie néoplasique dont c’est souvent la seule modalité thérapeutique.
Dans ces cas, la prévention repose essentiellement sur la diminution des doses et des volumes irradiés.
L’intérêt de l’administration systématique de triamcinolone en péri-oculaire ou des anti-VEGF dans la prévention de la maculopathie radique a été étudié après irradiation de tumeurs oculaires. Dans les deux cas, les patients traités présentaient moins de maculopathies [26, 27]. Ce type d’approche n’est pas couramment utilisé.
Les patients traités par irradiation des régions oculaires et/ou péri-oculaires, quelles que soient les modalités, doivent être toujours prévenus des retentissements fonctionnels oculaires potentiels. Il est aussi important d’insister sur la latence de ces effets tardifs et la nécessité d’un suivi ophtalmologique régulier au long cours, seul garant d’un dépistage et du traitement rapide.
[1] Lumbroso L, Dendale R, Fourquet A, Desjardins L. Radiation-induced retinopathy. Cancer Radiother 2002 ; 6 : 289-95.
[2] Maguire A, Schachat AP. Radiation retinopathy. In : Ryan SJ. Dir. Retina. St-Louis : Mosby ; 2000, p. 1509-15.
[3] Brown GC, Shields JA, Sanborn G, et al. Radiation retinopathy. Ophthalmology 1982 ; 89 : 1494-501.
[4] Guyer DR, Mukai S, Egan KM, et al. Radiation maculopathy after proton beam irradiation for choroidal melanoma. Ophthalmology 1992 ; 99 : 1278-85.
[5] Kinyoun JL, Lawrence BS, Barlow WE. Proliferative radiation retinopathy. Arch Ophthalmol 1996 ; 114 : 1097-100.
[6] Horgan N, Shields CL, Mashayekhi A, Shields JA. Classification and treatment of radiation maculopathy. Curr Opin Ophthalmol 2010 ; 21 : 233-8.
[7] Horgan N, Shields CL, Mashayekhi A, et al. Early macular morphological changes following plaque radiotherapy for uveal melanoma. Retina 2008 ; 28 : 263-73.
[8] Amoaku WM, Archer DB. Fluorescein angiographic features, natural course and treatment of radiation retinopathy. Eye 1990 ; 4 : 657-67.
[9] Takahashi K, Kishi S, Muraoka K, et al. Radiation choroidopathy with remodeling of the choroidal venous system. Am J Ophthalmol 1998 ; 125 : 367-73.
[10] Parsons JT, Fitzgerald CR, Hood CI, et al. The effects of irradiation on the eye and optic nerve. Int J Radiat Oncol Biol Phys 1983 ; 9 : 609-22.
[11] Takeda A, Shigematsu N, Suzuki S, et al. Late retinal complications of radiation therapy for nasal and paranasal malignancies: relationship between irradiated-dose area and severity. Int J Radiat Oncol Biol Phys 1999 ; 44 : 599-605.
[12] Finger PT. Tumour location affects the incidence of cataract and retinopathy after ophthalmic plaque radiation therapy. Br J Ophthalmol 2000 ; 84 : 1068-70.
[13] Lumbroso-Le Rouic L, Charif Chefchaouni M, Levy C, et al. 125I plaque brachytherapy for anterior uveal melanomas. Eye 2004 ; 18 : 911-6.
[14] Gragoudas ES, Li W, Lane AM, et al. Risk factors for radiation maculopathy and papillopathy after intraocular irradiation. Ophthalmology 1999 ; 106 : 1571-7 ; discussion 1577-8.
[15] Lumbroso L, Levy C, Plancher C, et al. Results of proton beam irradiation for treatment of choroidal melanoma. J Fr Ophtalmol 2002 ; 25 : 290-7.
[16] Gunduz K, Shields CL, Shields JA, et al. Radiation retinopathy following plaque radiotherapy for posterior uveal melanoma. Arch Ophthalmol 1999 ; 117 : 609-14.
[17] Singh AD, Pabon S, Aronow ME. Management of radiation maculopathy. Ophthalmic Res 2012 ; 1 : 26-31.
[18] Hykin PG, Shields CL, Shields JA, Arevalo JF. The efficacy of focal laser therapy in radiation-induced macular edema. Ophthalmology 1998 ; 105 : 1425-9.
[19] Kinyoun JL, Zamber RW, Lawrence BS, et al. Photocoagulation treatment for clinically significant radiation macular oedema. Br J Ophthalmol 1995 ; 79 : 144-9.
[20] Bakri SJ, Beer PM. Photodynamic therapy for maculopathy due to radiation retinopathy. Eye 2005 ; 19 : 795-9.
[21] Shields CL, Demirci H, Dai V, et al. Intravitreal triamcinolone acetonide for radiation maculopathy after plaque radiotherapy for choroidal melanoma. Retina 2005 ; 25 : 868-74.
[22] Finger PT. Radiation retinopathy is treatable with anti-vascular endothelial growth factor bevacizumab (Avastin). Int J Radiat Oncol Biol Phys 2008 ; 70 : 974-7.
[23] Mason JO 3rd, Albert MA Jr., Persaud TO, Vail RS. Intravitreal bevacizumab treatment for radiation macular edema after plaque radiotherapy for choroidal melanoma. Retina 2007 ; 27 : 903-7.
[24] Baillif S, Maschi C, Gastaud P, Caujolle JP. Intravitreal dexamethasone 0.7 mg implant for radiation macular edema after proton beam therapy for choroidal melanoma. Retina 2013 ; 33 : 1784-90.
[25] Shah NV, Houston SK, Markoe A, Murray TG. Combination therapy with triamcinolone acetonide and bevacizumab for the treatment of severe radiation maculopathy in patients with posterior uveal melanoma. Clin Ophthalmol 2013 ; 7 : 1877-82.
[26] Horgan N, Shields CL, Mashayekhi A, et al. Periocular triamcinolone for prevention of macular edema after plaque radiotherapy of uveal melanoma : a randomized controlled trial. Ophthalmology 2009 ; 116 : 1383-90.
[27] Shah SU, Shields CL, Bianciotto CG, et al. Intravitreal bevacizumab at 4-month intervals for prevention of macular edema after plaque radiotherapy of uveal melanoma. Ophthalmology 2014 ; 121 : 269-7.
V. Krivosic
➤ Les hémangiomes capillaires rétiniens (HCR) de taille moyenne et de grande taille peuvent être associés à un œdème maculaire (OM). Le traitement des HCR repose sur leur destruction. Le traitement habituel est une photocoagulation laser, associée à des injections intravitréennes d’anti-VEGF et une surveillance rapprochée. Le traitement des HCR associés à un OM est plus délicat. La thérapie photodynamique combinée avec des injections intravitréennes d’anti-VEGF peut être proposée en cas de baisse d’acuité visuelle marquée.
➤ Les tumeurs vasoprolifératives rétiniennes (TVPR) peuvent être associées à un OM dans 30 % des cas. Le traitement repose sur la destruction des anomalies vasculaires périphériques. En cas de persistance de l’OM malgré une destruction complète de celles-ci, les injections intravitréennes de corticoïdes ou d’anti-VEGF peuvent être proposées.
➤ L’OM est rare dans la maladie de Coats. Quand il est présent, on retrouve souvent des télangiectasies maculaires associées. Le traitement repose sur la destruction au laser des télangiectasies. Les exsudats secs lipidiques qui s’accumulent dans la macula ont pour origine les anomalies vasculaires périphériques. Le traitement de celles-ci permet la régression de l’exsudation.
Les hémangiomes capillaires rétiniens (HCR) sont des tumeurs vasculaires bénignes. Les lésions de petite taille n’entraînent habituellement pas de retentissement visuel mais doivent être traitées en raison de leur évolutivité. Les lésions de taille moyenne et de grande taille peuvent s’associer à une exsudation intra- et sous-rétinienne, telle qu’un décollement séreux rétinien (DSR), une accumulation d’exsudats secs ou un œdème maculaire cystoïde (OMC). Certains HCR périphériques et, surtout, certains hémangiomes capillaires de la papille s’accompagnent d’un OMC (fig. 14-10). Le traitement de cet œdème repose sur la destruction de l’hémangiome.
Les HCR peuvent être sporadiques ou associés à une maladie de von Hippel-Lindau (VHL). Leurs manifestations cliniques et leur traitement sont les mêmes dans les deux cas de figure [1]. La probabilité qu’un HCR isolé, en l’absence d’histoire familiale, soit lié à une maladie de VHL est de 50 % [2]. La maladie de VHL est une maladie autosomique dominante due à une mutation du gène VHL qui est un gène suppresseur de tumeur [3]. Les mutations entraînent ainsi une prédisposition à l’apparition de tumeurs vasculaires, endocrines et malignes pluriviscérales qui sont énumérées dans le tableau 14-1 [4]. Le diagnostic génétique de maladie de VHL permet à l’heure actuelle d’identifier 100 % des mutations causales [5].

Fig. 14-10 Hémangiome capillaire de la papille chez un patient de 47 ans. L’AV est à 1,6/10.
Cliché en couleurs (a) : lésion rouge-rosé appendue au bord nasal inférieur de la papille. En angiographie à la fuorescéine (b, c), l’hémangiome s’imprègne précocement et intensément au cours de la séquence. L’OCT (d) retrouve un OMC.
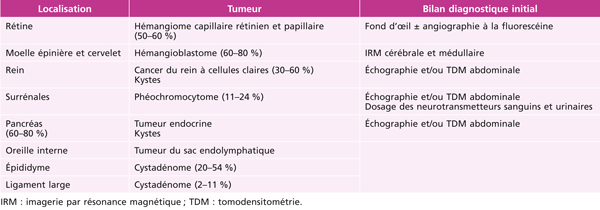
Tableau 14-1 Localisations, fréquences et bilan diagnostic initial de la maladie de von Hippel-Lindau.
La maladie de VHL est une maladie rare (1 pour 36 000 naissances) [6] qui affecte un peu moins de 1000 familles en France.
Les HCR sont retrouvés chez 50 % des patients atteints de la maladie de VHL. Ils correspondent ainsi à une des manifestations cliniques les plus fréquentes. Ils sont multiples et bilatéraux dans plus de la moitié des cas [7]. Le risque cumulé de perte visuelle par HCR a été estimé à 35 % chez les patients porteurs de mutation VHL et à 55 % chez les patients présentant un HCR à l’âge de 50 ans [8]. La baisse de l’acuité visuelle est liée à l’exsudation secondaire des volumineux HCR (que ce soit un DSR maculaire, des exsudats maculaires ou un OMC).
Les HCR se présentent comme des lésions le plus souvent rouge-rosé du fond d’œil, bien limitées. On les retrouve le plus souvent en périphérie rétinienne. Les vaisseaux nourriciers et de drainage sont dilatés dans les lésions de grande taille. Le diagnostic peut habituellement être fait à l’examen du fond d’œil. L’angiographie à la fluorescéine permet de mieux visualiser la lésion. Le remplissage est rapide, dès les temps précoces. La fluorescence augmente ensuite au sein de la tumeur et devient très intense aux temps tardifs. Une diffusion du colorant au niveau de l’HCR et des vaisseaux nourriciers et de drainage peut être observée. Les lésions de taille moyenne et de grande taille sont habituellement associées à une exsudation intrarétinienne qui peut s’étendre jusque dans la macula. Le bilan doit alors être complété par un examen en OCT (fig. 14-10).
Les HCR de petite taille (< 1 diamètre papillaire), sans retentissement maculaire, sont habituellement assez facilement traitables par photocoagulation au laser [9]. Les HCR de taille moyenne et de grande taille qui s’accompagnent d’une exsudation maculaire, avec au maximum un décollement de rétine localisé, peuvent également être détruits par le laser. Il est nécessaire dans ces cas de réaliser plusieurs séances au cours des 48 premières heures et de surveiller de très près l’évolution de l’exsudation, en particulier au décours de la première séance. Cette surveillance s’effectue grâce à des angiographies à la fluorescéine qui permettent de contrôler l’occlusion de l’hémangiome et guident les retraitements. Il peut être utile dans un second temps de réaliser une séance de cryoapplication transsclérale afin de geler la partie profonde de la lésion (fig. 14-11). Les formes plus sévères peuvent nécessiter une prise en charge chirurgicale [10]. Les hémangiomes capillaires de la papille associés à un OM et une baisse de l’acuité visuelle peuvent être traités par injection intravitréenne (IVT) d’anti-VEGF éventuellement combinée à une photothérapie dynamique (photodynamic therapy ou PDT) à la Visudyne®. Les anti-VEGF entraînent en effet une diminution de l’exsudation rétinienne associée aux hémangiomes [11]. Ils sont en revanche sans effet sur la taille de ceux-ci. La PDT entraîne quant à elle une occlusion plus ou moins complète des hémangiomes. Du fait du risque de lésions du nerf optique, elle est à réserver aux formes évoluées, associées à une baisse significative de l’acuité visuelle [12]. La surveillance de l’OM doit bien sûr être réalisée par des OCT répétés avant traitement et au cours du suivi.

Fig. 14-11 Hémangiome capillaire rétinien chez une jeune patiente de 17 ans. L’AV est de 1/10.
Cliché en couleurs avant traitement (a) : l’HCR siège en périphérie temporale supérieure. L’artère et les deux veines de drainage sont dilatées (flèches). On retrouve également un DSR périlésionnel ainsi que l’accumulation d’exsudats secs le long des vaisseaux dilatés et au pôle postérieur. En angiographie à la fluorescéine (insert dans a), l’hémangiome ainsi que deux petites lésions accessoires s’imprègnent rapidement et intensément. L’OCT (b) montre l’extension maculaire du DSR, un OM et des hyper-réflectivités intrarétiniennes correspondant aux exsudats. Cliché en couleurs 18 mois après traitement par photocoagulation laser et une séance de cryoapplication (c). L’hémangiome est fibrosé. Le calibre des vaisseaux est redevenu normal. L’OCT (d) montre la résorption du DSR, de l’OM et des exsudats. La macula est atrophique.
Les tumeurs vasoprolifératives rétiniennes (TVPR) sont des tumeurs bénignes rares qui se caractérisent par l’association d’une masse solide fibreuse à des télangiectasies de la vascularisation rétinienne périphérique et une exsudation intrarétinienne. Elles ont été décrites pour la première fois par Schields et al. en 1983. Ils ont rapporté une série de 12 cas qu’ils ont appelés « presumed acquired nonfamilial retinal hemangioma » [13]. Plusieurs autres appellations ont été proposées, en particulier, le terme de « masse télangiectasique périphérique ». En 1995, ces lésions ont été renommées « vasoproliferative tumor of the fundus » que l’on peut traduire par tumeur rétinienne vasoproliférative. C’est le terme qui est actuellement utilisé pour les décrire [14].
Les TVPR sont composées d’une masse fibreuse, composée de cellules gliales et de vaisseaux ectasiques, dilatés, à la paroi hyalinisée à leur surface [15]. La rupture de la barrière hémato-rétinienne résulte en une exsudation intrarétinienne massive.
On distingue les formes idiopathiques (74 % des cas), en l’absence d’autre anomalie associée du fond d’œil, et les formes secondaires (26 %) qui surviennent sur un terrain de pathologie préexistante (une rétinite pigmentaire ou une uvéite le plus souvent) [16].
À l’examen du fond d’œil, les TVPR se présentent comme des masses rouge blanchâtre, dont les vaisseaux nourriciers et de drainage ne sont pas ou peu dilatés. Ces masses s’accompagnent d’une exsudation intrarétinienne plus ou moins étendue (DSR, exsudats secs lipidiques, œdème maculaire cystoïde). Les TVPR surviennent le plus souvent au niveau de la périphérie temporale et temporale inférieure. Elles s’accompagnent d’une exsudation intrarétinienne à type de DSR et d’accumulation d’exsudats secs lipidiques autour de la tumeur, qui peuvent s’étendre jusqu’au pôle postérieur avec un décollement maculaire, un placard d’exsudats maculaires ou un OMC responsable d’une baisse de l’acuité visuelle. L’angiographie à la fluorescéine permet de visualiser les anomalies vasculaires sur les temps précoces en révélant un réseau de capillaires anormalement dilatés associés à des dilatations télangiectasiques (fig. 14-12). Les anomalies sont noyées dans la diffusion du colorant aux temps plus tardifs. L’angiographie au vert d’indocyanine peut permettre de s’amender de cette diffusion et de mieux visualiser les anomalies rétiniennes. Elle permet d’autre part d’éliminer une lésion choroïdienne. L’échographie permet d’éliminer une masse tumorale maligne, en particulier en cas de remaniement pigmenté important au niveau de la lésion.

Fig. 14-12 Tumeur vasoproliférative idiopathique chez une patiente de 45 ans. L’AV est de 4/10.
Cliché en couleurs avant traitement (a) : les anomalies vasculaires sont localisées en extrême périphérie inférieure (flèches). On retrouve à ce niveau une hémorragie rétinienne, des exsudats périlésionnels et des remaniements pigmentés. Il existe également une membrane épimaculaire. Les télangiectasies sont révélées par l’angiographie à la fluorescéine (insert). L’OCT (b) retrouve la membrane et permet de mettre en évidence un OM. Cliché en couleurs, 1 an après traitement par photocoagulation laser des anomalies vasculaires, réalisé en même temps que la chirurgie de la membrane (c) : les exsudats se sont résorbés. Il persiste une fibrose séquellaire et des remaniements de l’épithélium pigmentaire. Les anomalies vasculaires ont été détruites au laser. L’AV est de 10/10. L’OCT (d) montre la disparition de l’OM et l’absence de reliquat membranaire.
Le traitement n’est pas encore bien codifié. Plusieurs techniques ont été évaluées, en particulier, la cryoapplication [17], la photocoagulation laser [18] et la radiothérapie [19]. Par ailleurs, on retrouve dans la littérature quelques cas de résection tumorale [20], de photothérapie dynamique [21] et d’IVT d’anti-VEGF [22]. L’objectif du traitement devrait être de détruire les anomalies vasculaires responsables de l’exsudation intrarétinienne. Cela peut être obtenu avec efficacité et une bonne tolérance par la photocoagulation laser. Dans une série de cas, il a en effet été possible d’obtenir une régression de l’OM dans 90 % des cas [18]. Quand cela est possible, il est préférable de réaliser le laser à la lampe à fente, les anomalies à traiter étant localisées à la surface de la rétine. Plusieurs séances rapprochées sont souvent nécessaires. Les TVPR peuvent se compliquer d’hémorragie du vitré, de membranes épirétiniennes (MER) ou de décollement de rétine exsudatif étendu, nécessitant un traitement chirurgical. La photocoagulation peut alors être réalisée à l’endolaser en peropératoire. Une seule séance est suffisante car le traitement des anomalies vasculaires peut être plus intense (pas de douleur) et plus complet (meilleure visualisation et meilleur accès aux anomalies vasculaires par indentation) (fig. 14-12) [18]. La cryothérapie présente un risque de surdosage car pour atteindre les anomalies vasculaires à la surface de la rétine, il est nécessaire de geler la masse fibreuse et un éventuel décollement de rétine exsudatif.
La masse fibreuse persiste habituellement une fois que l’exsudation rétinienne s’est résorbée. Il peut également persister un OM malgré une destruction complète des anomalies vasculaires. Bien qu’il y ait peu de données dans la littérature, il est probable que les injections intravitréennes de corticoïdes ou d’anti-VEGF puissent être efficaces dans ces cas.
La maladie de Coats se caractérise par l’association d’anomalies vasculaires rétiniennes, à type de télangiectasies et d’anévrismes, à une exsudation intra- et sous-rétinienne [23]. Depuis sa description initiale en 1908 (fondée sur l’examen du fond d’œil et l’anatomopathologie), la description clinique de la maladie de Coats a été affinée. Dans sa forme typique, on pourrait la décrire comme l’association d’anomalies du réseau capillaire rétinien, d’un secteur plus ou moins étendu du fond d’œil, à une exsudation intra- et sous-rétinienne, chez un patient de sexe masculin, jeune et sans antécédents. Le spectre clinique est vaste, allant de la forme pédiatrique qui peut être très sévère, avec décollement de rétine exsudatif total et leucocorie dont le pronostic est sombre, à une forme très modérée, diagnostiquée chez l’adulte, se limitant à la présence de quelques anomalies capillaires maculaires et parfois périphériques, et correspondant aux télangiectasies maculaires de type 1.
Les études de génétique moléculaire suggèrent que la maladie de Coats ferait partie d’un spectre d’anomalies génétiques regroupées sous le terme d’« hypovasculopathies rétiniennes » comprenant notamment la maladie de Norie, la vitréorétinopathie exsudative familiale et la dystrophie facio-scapulo-humérale [24, 25]. Toutes ces pathologies sont associées à des anomalies de développement de la vascularisation rétinienne, des télangiectasies et une exsudation rétinienne, qui seraient en rapport avec des mutations de gènes codant pour des protéines de la voie de signalisation Wnt au cours de l’angiogenèse rétinienne. Néanmoins, aucune mutation germinale n’a actuellement été identifiée dans la maladie de Coats.
La maladie de Coats est le plus souvent unilatérale (80 à 95 % des cas) avec une nette prédominance masculine (trois pour un) [26]. Chez l’adulte, la surface d’anomalies de la vascularisation est habituellement moins étendue que chez l’enfant, ce qui explique probablement le diagnostic plus tardif et l’évolutivité plus lente de la maladie. Le fond d’œil retrouve un placard d’exsudats périphériques adjacents à des anomalies vasculaires telles que des télangiectasies, des dilatations anévrismales et parfois des zones de non-perfusion capillaire. Les formes plus évoluées peuvent être associées à un placard d’exsudats maculaires ou un décollement séreux rétinien plus ou moins étendu. Un OMC est retrouvé dans 1 % des cas [26]. L’angiographie à la fluorescéine permet de mieux visualiser les anomalies vasculaires. En cas d’OMC, outre les anomalies de la périphérie rétinienne, on retrouve également des anomalies maculaires à type de dilatation du réseau capillaire et des télangiectasies. Ces anomalies correspondraient en fait aux télangiectasies maculaires de type 1 de la classification de Gass et Blodi. L’OCT permet d’évaluer l’extension maculaire de l’exsudation telle qu’un OMC, un DSR s’étendant à la macula ou un placard d’exsudats maculaires (fig. 14-13).
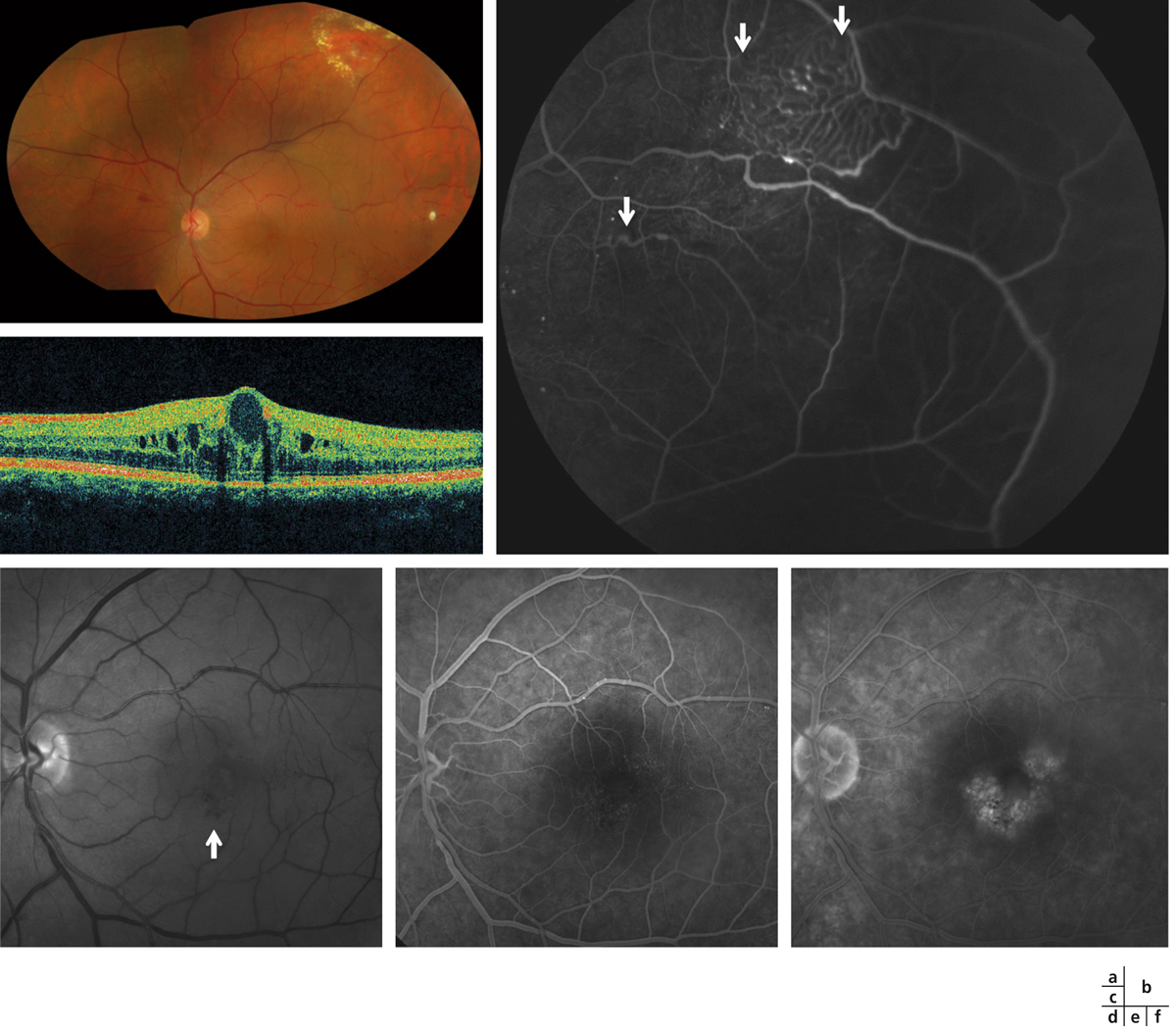
Fig. 14-13 Maladie de Coats chez un patient de 43 ans.
Cliché en couleurs (a) : il existe en périphérie temporale supérieure et temporale des anomalies vasculaires associées à des exsudats. L’angiographie à la fluorescéine de la périphérie (b) permet de bien visualiser l’aspect anormalement dilaté du réseau capillaire et les télangiectasies (flèches). L’OCT (c) permet de mettre en évidence un OMC. Celui-ci est lié à la présence de télangiectasies maculaires, bien visibles sur le cliché anérythre (d : flèche) et sur les temps précoces de l’angiographie à la fluorescéine (e). Les télangiectasies sont diffuses aux temps tardifs et on retrouve l’OMC (f).
• Stade 1 = télangiectasies rétiniennes.
• Stade 2 = télangiectasies et exsudations intrarétiniennes n’éteignant pas la macula (2A) ou atteignant la macula (2B).
• Stade 3A = décollement de rétine exsudatif subtotal n’atteignant pas la macula (3A1) ou atteignant la macula (3B2).
• Stade 3B = décollement de rétine total.
• Stade 4 = décollement de rétine + augmentation de la pression intra-oculaire.
• Stade 5 = phtise.
D’après Shields JA et al. [27].
En l’absence de traitement, l’évolution va se faire vers l’augmentation de l’exsudation intrarétinienne et la survenue d’un décollement de rétine exsudatif. Le traitement permet le plus souvent de faire régresser durablement l’exsudation, bien qu’une surveillance à long terme soit nécessaire car des récidives sont possibles à partir de petites télangiectasies dont la taille a augmenté avec le temps. Les complications hémorragiques sont extrêmement rares dans la maladie de Coats [27].
L’objectif du traitement dans la maladie de Coats est la destruction des anomalies vasculaires afin de stopper l’exsudation. Les formes modérées, sans décollement de rétine doivent être traitées par photocoagulation laser. La longueur d’onde de 532 nm la plus fréquemment utilisée (diode verte) est parfaitement adaptée à son absorption par l’hémoglobine contenue dans les hématies qui circulent assez lentement dans ces capillaires anormaux. L’objectif est de coaguler minutieusement chacune des anomalies vasculaires visibles. Il n’y a pas d’intérêt particulier à traiter les zones de non-perfusion entourant les anomalies vasculaires [27]. La régression complète des exsudats lipidiques est très lente et peut prendre jusqu’à une année. Les formes associées à un décollement de rétine partiel ou total peuvent être également traitées avec succès par laser. Les ectasies elles-mêmes sont suffisamment volumineuses pour absorber l’énergie du laser et entraîner une coagulation même sur une rétine décollée. En cas d’OMC associé, il faut chercher et traiter les télangiectasies maculaires. Quand celles-ci sont trop proches du centre, les IVT d’anti-VEGF peuvent être une alternative thérapeutique. Celles-ci devront être répétées dans le temps, puisque l’OMC persistera tant que les anomalies vasculaires n’auront pas été détruites. Il semble effectivement y avoir une augmentation du taux de VEGF intravitréen chez les patients présentant une maladie de Coats [28]. Les IVT d’anti-VEGF permettraient de diminuer ce taux et une régression de l’exsudation rétinienne, même en cas de DSR étendu.
[1] Singh AD, Nouri M, Shields CL, et al. Retinal capillary hemangioma : a comparison of sporadic cases and cases associated with von Hippel-Lindau disease. Ophthalmology 2001 ; 108 : 1907-11.
[2] Richards FM, Payne SJ, Zbar B, et al. Molecular analysis of de novo germline mutations in the von Hippel-Lindau disease gene. Hum Mol Genet 1995 ; 4 : 2139-43.
[3] Latif F, Tory K, Gnarra J, et al. Identification of the von Hippel-Lindau disease tumor suppressor gene. Science 1993 ; 260 : 1317-20.
[4] Richard S, Graff J, Lindau J, Resche F. Von Hippel-Lindau disease. Lancet 2004 ; 363 : 1231-4.
[5] Stolle C, Glenn G, Zbar B, et al. Improved detection of germline mutations in the von Hippel-Lindau disease tumor suppressor gene. Hum Mutat 1998 ; 12 : 417-23.
[6] Neumann HP, Wiestler OD. Clustering of features and genetics of von Hippel-Lindau syndrome. Lancet 1991 ; 338 : 258.
[7] Dollfus H, Massin P, Taupin P, et al. Retinal hemangioblastoma in von Hippel-Lindau disease : a clinical and molecular study. Invest Ophthalmol Vis Sci 2002 ; 43 : 3067-74.
[8] Webster AR, Maher ER, Moore AT. Clinical characteristics of ocular angiomatosis in von Hippel-Lindau disease and correlation with germline mutation. Arch Ophthalmol 1999 ; 117 : 371-8.
[9] Singh AD, Nouri M, Shields CL, et al. Treatment of retinal capillary hemangioma. Ophthalmology 2002 ; 109 : 1799-806.
[10] Gaudric A, Krivosic V, Duguid G, et al. Vitreoretinal surgery for severe retinal capillary hemangiomas in von hippel-lindau disease. Ophthalmology 2011 ; 118 : 142-9.
[11] Wong WT, Liang KJ, Hammel K, et al. Intravitreal ranibizumab therapy for retinal capillary hemangioblastoma related to von Hippel-Lindau disease. Ophthalmology 2008 ; 115 : 1957-64.
[12] Schmidt-Erfurth UM, Kusserow C, Barbazetto IA, Laqua H. Benefits and complications of photodynamic therapy of papillary capillary hemangiomas. Ophthalmology 2002 ; 109 : 1256-66.
[13] Shields JA, Decker WL, Sanborn GE, et al. Presumed acquired retinal hemangiomas. Ophthalmology 1983 ; 90 : 1292-300.
[14] Shields CL, Shields JA, Barrett J, De Potter P. Vasoproliferative tumors of the ocular fundus. Classification and clinical manifestations in 103 patients. Arch Ophthalmol 1995 ; 113 : 615-23.
[15] Smeets MH, Mooy CM, Baarsma GS, et al. Histopathology of a vasoproliferative tumor of the ocular fundus. Retina 1998 ; 18 : 470-2.
[16] Shields CL, Kaliki S, Al-Dahmash S, et al. Retinal vasoproliferative tumors : comparative clinical features of primary vs secondary tumors in 334 cases. JAMA Ophthalmol 2013 ; 131 : 328-34.
[17] Heimann H, Bornfeld N, Vij O, et al. Vasoproliferative tumours of the retina. Br J Ophthalmol 2000 ; 84 : 1162-9.
[18] Krivosic V, Massin P, Desjardins L, et al. Management of idiopathic retinal vasoproliferative tumors by slit-lamp laser or endolaser photocoagulation. Am J Ophthalmol 2014 ; 158 : 154-61.
[19] Cohen VML, Shields CL, Demirci H, Shields JA. Iodine I 125 plaque radiotherapy for vasoproliferative tumors of the retina in 30 eyes. Arch Ophthalmol 2008 ; 126 : 1245-51.
[20] Irvine F, O’Donnell N, Kemp E, Lee WR. Retinal vasoproliferative tumors : surgical management and histological findings. Arch Ophthalmol 2000 ; 118 : 563-9.
[21] Barbezetto IA, Smith RT. Vasoproliferative tumor of the retima treated with PDT. Retina 2003 ; 23 : 565-7.
[22] Saito W, Kase S, Fujiya A, et al. Expression of vascular endothelial growth factor and intravitreal anti-VEGF therapy with bevacizumab in vasoproliferative retinal tumors. Retina 2013 ; 33 : 1959-67.
[23] Coats G. Forms or retinal disease with massive exsudation. Lond Ophtalm Hosp Rep 1908 : 440-525.
[24] Ye X, Wang Y, Cahill H, et al. Norrin, frizzled-4, and Lrp5 signaling in endothelial cells controls a genetic program for retinal vascularization. Cell 2009 ; 139 : 285-98.
[25] Clevers H. Eyeing up new Wnt pathway players. Cell 2009 ; 139 : 227-9.
[26] Shields JA, Shields CL, Honavar SG, Demirci H. Clinical variations and complications of Coats disease in 150 cases : the 2000 Sanford Gifford Memorial Lecture. Am J Ophthalmol 2001 ; 131 : 561-71.
[27] Shields JA, Shields CL, Honavar SG, et al. Classification and management of Coats disease: the 2000 Proctor Lecture. Am J Ophthalmol 2001 ; 131 : 572-83.
[28] He YG, Wang H, Zhao B, et al. Elevated vascular endothelial growth factor level in Coats’ disease and possible therapeutic role of bevacizumab. Graefes Arch Clin Exp Ophthalmol 2010 ; 248 : 1519-21.
L. Desjardins
➤ Les hémangiomes choroïdiens, tumeurs vasculaires bénignes, qu’ils soient isolés ou syndromiques, peuvent être pris en charge selon différentes modalités thérapeutiques mais ces traitements s’accompagnent souvent de récidive ou d’effets secondaires.
➤ La principale difficulté réside dans le diagnostic ; l’angiographie au vert d’indocyanine est précieuse pour confirmer la présence d’un hémangiome choroïdien.
Les hémangiomes choroïdiens sont des tumeurs vasculaires bénignes. Ils peuvent être isolés, et sont alors localisés, ou associés à une maladie de Sturge-Weber-Krabbe réalisant plus souvent un hémangiome diffus.
La clinique des hémangiomes choroïdiens est bien décrite dans le rapport de la Société française d’ophtalmologie 2002 du Pr Zografos [1] ; c’est pourquoi nous décrirons brièvement les aspects cliniques afin de nous concentrer sur les problèmes thérapeutiques et les controverses actuelles concernant la prise en charge thérapeutique.
Les hémangiomes circonscrits de la choroïde sont des tumeurs rares touchant plus souvent les hommes (avec un ratio d’environ 1 sur 2). Ils surviennent en général entre 40 et 60 ans. Ils peuvent être asymptomatiques, découverts lors d’un examen systématique du fond d’œil. Ils se localisent préférentiellement au niveau du pôle postérieur et souvent dans la région maculaire ou paramaculaire. Leur taille est variable mais en général modérée avec un diamètre de l’ordre de 10 mm et une épaisseur d’environ 2 à 4 mm. Lorsque les hémangiomes augmentent de volume, ils sont souvent responsables d’une exsudation avec décollement séreux rétinien (DSR). C’est alors qu’apparaissent des symptômes tels que baisse d’acuité visuelle, métamorphopsies et scotome central. Un œdème maculaire cystoïde (OMC) peut accompagner certains hémangiomes et sera bien mis en évidence en OCT. L’existence d’un DSR chronique peut être à l’origine d’altérations de l’épithélium pigmentaire en surface de l’hémangiome avec parfois des migrations pigmentaires qui peuvent altérer la vision centrale. On peut aussi observer dans certains cas une fibrose sous-rétinienne qui peut s’étendre à la région maculaire.
Les hémangiomes diffus se rencontrent en général chez des patients présentant un syndrome de Sturge-Weber-Krabbe. Il s’agit d’une phacomatose associant un nævus flammus de l’hémiface avec l’apparition fréquente d’un hémangiome choroïdien diffus et d’un glaucome du côté atteint. Une atteinte méningée homolatérale est possible. L’hémangiome choroïdien diffus peut être responsable d’un décollement de la rétine. Il est parfois au début assez difficile à diagnostiquer à l’examen du fond d’œil et l’échographie ou l’échographie Doppler est une aide précieuse. Une surveillance systématique des enfants présentant un syndrome de Sturge-Weber-Krabbe est indispensable et la prise en charge thérapeutique est souvent complexe.
Le diagnostic repose avant tout sur l’examen du fond d’œil si possible en ophtalmoscopie binoculaire qui va montrer une masse orangée caractéristique. Les examens complémentaires les plus importants pour confirmer le diagnostic d’hémangiome choroïdien sont l’échographie et l’angiographie au vert d’indocyanine (indocyanine green [ICG]). L’OCT est utile pour évaluer le DSR et l’état de la région maculaire. En échographie B, l’hémangiome est hyperéchogène avec une forme régulière en dôme. Ce caractère hyperéchogène peut être difficile à évaluer pour les lésions de moins de 3 mm d’épaisseur mais devient évident pour les lésions plus volumineuses et permet alors de différencier l’hémangiome d’un mélanome achrome. L’échographie en mode Doppler montre bien la riche vascularisation de ces hémangiomes. L’angiographie ICG montre une hyperfluorescence précoce, diffuse et homogène dès le stade veineux et un phénomène de wash-out avec hypofluorescence sur les séquences tardives. Cette hyperfluorescence précoce permet de différencier les hémangiomes des métastases choroïdiennes (fig. 14-14). Il est important de noter que l’IRM ne permet pas de différencier une métastase d’un mélanome achrome ou d’un hémangiome, car toutes ces lésions prennent le contraste après injection de gadolinium (contrairement à l’hématome sous-rétinien).

Fig. 14-14 Hémangiome choroïdien localisé.
a. Cliché en couleurs qui visualise l’hémangiome juxtapapillaire. b. Imprégnation précoce lors de l’ICG. c. Aspect du wash-out lors de l’ICG.
Le traitement n’est nécessaire que pour les hémangiomes actifs qui augmentent de volume, deviennent symptomatiques ou sont responsables d’un DSR.
L’observation n’est indiquée que pour les hémangiomes choroïdiens stables, sans DSR évolutif, n’entraînant pas d’œdème maculaire ou de baisse d’acuité visuelle. Un contrôle annuel du fond d’œil et de l’échographie est souhaitable et les patients doivent être avertis de la nécessité de consulter en cas d’apparition de symptômes visuels. Une prise en charge rapide est effectivement nécessaire en cas de baisse visuelle si on veut espérer préserver la vision.
La photocoagulation de la surface de la tumeur est une méthode ancienne permettant de réduire le DSR. Néanmoins elle n’agit pas sur la tumeur et la récidive du décollement est fréquente. Les récidives du décollement ou les décollements prolongés conduisent à des migrations pigmentaires, un OMC et une fibrose sous-rétinienne avec destruction de la vision centrale [2]. C’est pourquoi la photocoagulation a été remplacée par la photothérapie dynamique qui agit plus en profondeur et donnerait de meilleurs résultats. Néanmoins, la seule façon d’éradiquer complètement la tumeur est d’utiliser un traitement de radiothérapie par protonthérapie ou par brachythérapie.
La photothérapie dynamique (photodynamic therapy [PDT]) qui a d’abord été utilisée dans le traitement des néovaissseaux de la dégénérescence maculaire liée à l’âge (DMLA) est utilisée depuis plusieurs années dans le traitement des hémangiomes choroïdiens. Deux techniques ont été décrites (tableau 14-2) [3].
Les résultats publiés dans la littérature attestent de l’efficacité de la photothérapie dynamique dans le traitement des hémangiomes circonscrits. Toutefois l’efficacité est variable avec un suivi souvent limité et des protocoles très variables, de nombreux patients ayant reçu plusieurs séances (tableau 14-3). Étant donné le petit nombre de patients dans ces études, aucune d’entre elles n’a analysé l’influence de la taille de l’hémangiome sur le résultat de la PDT. Dans notre expérience, il semble cependant que les hémangiomes volumineux d’épaisseur supérieure à 4 mm récidivent fréquemment après PDT (fig. 14-15 à 14-17).
Les récidives du DSR et les traitements itératifs conduisent souvent à une fibrose maculaire avec baisse définitive de l’acuité visuelle. C’est pourquoi les hémangiomes récidivants ou d’emblée volumineux sont plutôt traités par irradiation plutôt que PDT.
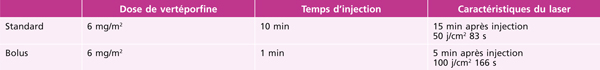
Tableau 14-2 Photothérapie dynamique des hémangiomes choroïdiens circonscrits, d’après Pilotto et al. [3].
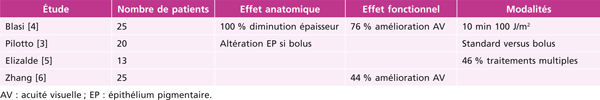
Tableau 14-3 Résultats des principales études évaluant l’effet de la photothérapie dynamique dans les hémangiomes choroïdiens.

Fig. 14-15 Hémangiome choroïdien de l’œil droit.
Aspect du fond d’œil avant (a) et après (b) photothérapie dynamique.
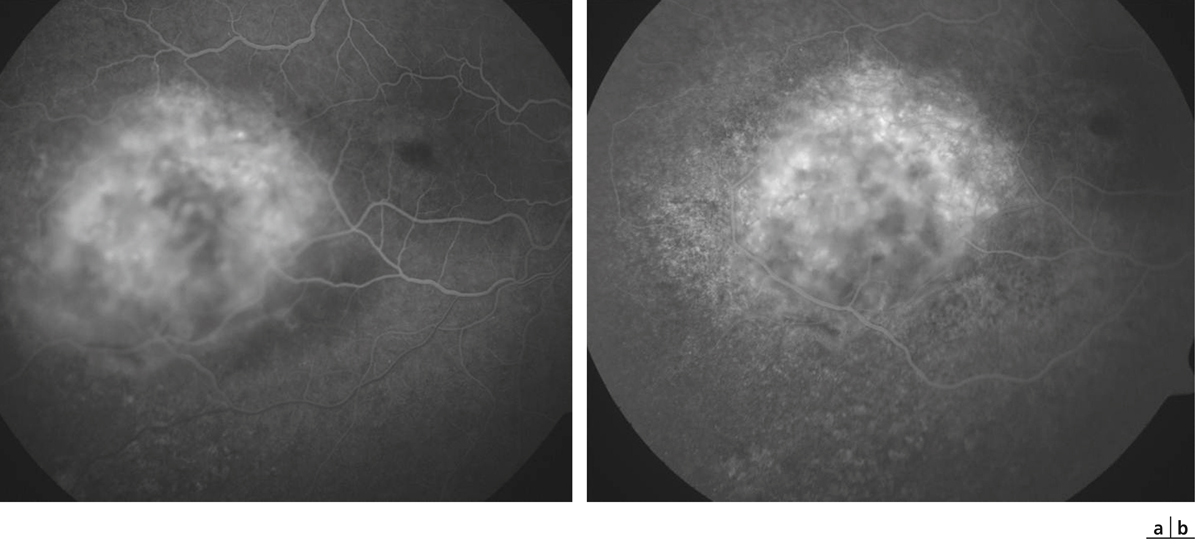
Fig. 14-16 Même patient qu’à la fig. 14-15. Angiographie fluorescéinique avant (a) et après (b) photothérapie dynamique.

Fig. 14-17 Même patient qu’à la fig. 14-15. Œdème maculaire associé à un hémangiome.
OCT avant (a) et après (b, c) photothérapie dynamique. En c, le recul est de 9 mois.
L’efficacité à long terme de différentes techniques d’irradiation a été démontrée en termes de résorption du DSR et de réduction du volume tumoral [7]. Les techniques utilisables incluent l’irradiation externe conventionnelle fractionnée, la curiethérapie et le traitement par faisceau de protons accélérés.
La protonthérapie permet de délivrer une dose homogène à la tumeur tout en respectant les tissus sains avoisinants. Les clips de repérage, s’ils sont utilisés, sont employés comme pour l’irradiation d’un mélanome, ce qui nécessite donc une procédure chirurgicale avant la protonthérapie (fig. 14-18 et 14-19). Les résultats des principales études sont rapportés dans le tableau 14-4. Le facteur statistiquement significatif pour la récupération visuelle semble le délai de prise en charge. Les trois quarts des patients traités dans les 6 mois suivant l’apparition de l’œdème maculaire ont une vision améliorée contre seulement 29 % si le patient est traité après 6 mois. La constatation d’une possible toxicité maculaire avec 20 grays seulement nous fait évaluer un plus grand fractionnement (20 grays en huit fractions, protocole en cours d’étude).

Fig. 14-18 Aspect du fond d’œil avant (a) et après (b) protonthérapie.
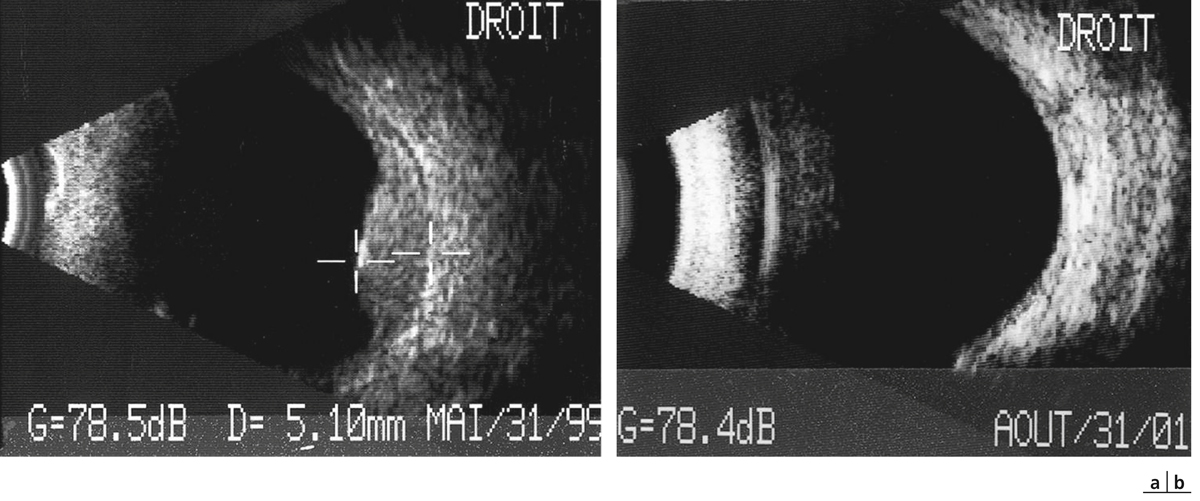
Fig. 14-19 Même patient qu’à la fig. 14-18. Échographie avant (a) et après (b) protonthérapie.
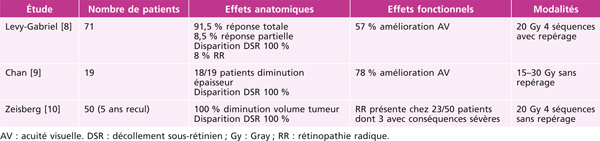
Tableau 14-4 Études évaluant l’effet de l’irradiation par protonthérapie dans les hémangiomes choroïdiens.
Le traitement par curiethérapie est efficace et peut être proposé si on ne dispose pas de la protonthérapie [11].
L’irradiation externe conventionnelle est préférée dans le traitement des hémangiomes diffus, de façon plus fractionnée car le volume à irradier représente l’ensemble de la choroïde. Nous avons récemment revu une série de 26 yeux chez 25 enfants qui avaient des hémangiomes diffus avec décollement parfois total de la rétine. La rétine a été recollée dans 24 yeux avec diminution de l’épaisseur de l’hémangiome dans tous les cas et amélioration du glaucome pour neuf enfants sur douze (fig. 14-20 et 14-21), l’étude est en cours de publication.

Fig. 14-20 Hémangiome diffus avec décollement de rétine avant (a) et après (b) radiothérapie.

Fig. 14-21 Même patient qu’à la fig. 14-20 . Échographies. Hémangiome diffus avant (a) et après (b) radiothérapie.
Les injections d’anti-VEGF ont été proposées et réalisées par certains auteurs, seules ou en association d’une PDT. Pour Mandal et al., l’utilisation d’anti-VEGF a permis sur trois patients d’obtenir une résorption du DSR pendant 1 an [12]. Néanmoins, il est difficile d’établir le rôle exact des anti-VEGF dans le traitement des œdèmes maculaires liés aux hémangiomes, car la plupart des auteurs les ont utilisés en complément d’une PDT. Pour Kwon et al., la moitié des patients présenterait à long terme une récidive de l’exsudation [13].
Un seul article dans la littérature fait état de l’utilisation de bêtabloquants par voie orale pour traiter des hémangiomes choroïdiens chez cinq patients avec des résultats décevants [14].
[1] Zografos G. Tumeurs intraoculaires. Rapport de la Société Française d’Ophtalmologie. Paris : Masson ; 2002.
[2] Furuta M, Sekiryu T, Kasai A, Oguchi Y. Morphologic changes of the fovea and visual acuity associated with retinal detachment secondary to circumscribed choroidal hemangioma. Saudi J Ophthalmol 2013 ; 27 : 209-13.
[3] Pilotto E, Urban F, Parrozzani R, Midena E. Standard versus bolus photodynamic therapy in circumscribed choroidal hemangioma : functional outcomes. Eur J Ophthalmol 2011 ; 21 : 452-8.
[4] Blasi MA, Tiberti AC, Scupola A, et al. Photodynamic therapy with verteporfin for symptomatic circumscribed choroidal hemangioma : five-year outcomes. Ophthalmology 2010 ; 117 : 1630-7.
[5] Elizalde J, Vasquez L, Iyo F, Abengoechea S. Photodynamic therapy in the management of circumscribed choroidal hemangioma. Can J Ophthalmol 2012 ; 47 : 16-20.
[6] Zhang Y, Liu W, Fang Y, et al. Photodynamic therapy for symptomatic circumscribed macular choroidal hemangioma in Chinese patients. Am J Ophthalmol 2010 ; 150 : 710-5 e1.
[7] Zografos L, Gailloud C, Bercher L. Irradiation treatment of choroidal hemangiomas. J Fr Ophtalmol 1989 ; 12 : 797-807.
[8] Levy-Gabriel C, Rouic LL, Plancher C, et al. Long-term results of low-dose proton beam therapy for circumscribed choroidal hemangiomas. Retina 2009 ; 29 : 170-5.
[9] Chan RV, Yonekawa Y, Lane AM, et al. Proton beam irradiation using a light-field technique for the treatment of choroidal hemangiomas. Ophthalmologica 2010 ; 224 : 209-16.
[10] Zeisberg A, Seibel I, Cordini D, et al. Long-term (4 years) results of choroidal hemangioma treated with proton beam irradiation. Graefes Arch Clin Exp Ophthalmol 2014 ; 252 : 1165-70.
[11] Aizman A, Finger PT, Shabto U, et al. Palladium 103 (103Pd) plaque radiation therapy for circumscribed choroidal hemangioma with retinal detachment. Arch Ophthalmol 2004 ; 122 : 1652-6.
[12] Mandal S, Naithani P, Venkatesh P, Garg S. Intravitreal bevacizumab (avastin) for circumscribed choroidal hemangioma. Indian J Ophthalmol 2011 ; 59 : 248-51.
[13] Kwon HJ, Kim M, Lee CS, Lee SC. Treatment of serous macular detachment associated with circumscribed choroidal hemangioma. Am J Ophthalmol 2012 ; 154 : 137-45e1.
[14] Tanabe H, Sahashi K, Kitano T, et al. Effects of oral propranolol on circumscribed choroidal hemangioma : a pilot study. JAMA Ophthalmol 2013 ; 131 : 1617-22.
S. Tick
➤ Le mélanome choroïdien (MC) est asymptomatique dans 20 à 30 % des cas et se manifeste le plus souvent par une lésion pigmentée, en relief, associée à du pigment orange à sa surface et un décollement de rétine périlésionnel.
➤ L’échographie retrouve une lésion classiquement hyperéchogène en son sommet avec atténuation progressive du signal et une excavation choroïdienne.
➤ L’œdème maculaire lors d’un MC peut être lié à la localisation rétrofovéolaire du mélanome, à un décollement de rétine chronique, à une réaction inflammatoire secondaire à la nécrose tumorale ou à une augmentation du VEGF.
➤ L’OM peut également survenir dans le cadre d’une maculopathie radique ou toxique ou du fait de causes intercurrentes (chirurgie de cataracte, traction vitréomaculaire associée).
➤ Les métastases choroïdiennes sont d’aspect classiquement rond et achrome et de localisation rétro-équatoriale.
➤ L’échographie retrouve une lésion ou plusieurs lésions classiquement iso-échogène(s) sans excavation choroïdienne.
➤ L’œdème rétinien est le plus souvent directement lié à la localisation maculaire de la lésion métastatique mais est bien moins fréquent que le décollement séreux très fréquemment retrouvé en OCT.
➤ L’œdème maculaire peut être associé à des complications générales, cérébrales ou aux effets secondaires de la chimiothérapie.
Le mélanome choroïdien est la tumeur intra-oculaire la plus fréquente ; elle représente 90 % des tumeurs oculaires après l’âge de 15 ans en Europe. Son incidence annuelle, stable dans la littérature depuis 50 ans, est de cinq à neuf cas par million de personnes suivant les régions et les populations étudiées. Les principaux facteurs de risque de survenue des mélanomes de l’uvée sont l’âge (pic de fréquence entre 55 et 65 ans), le sexe masculin, l’origine caucasienne et la présence d’une mélanocytose congénitale.
Si les circonstances de découvertes sont variées, il s’avère que 20 à 30 % des cas sont retrouvés lors de la découverte systématique. Il s’ensuit des symptômes variés et peu spécifiques tels que la baisse d’acuité visuelle, l’amputation du champ visuel, les myodésopsies. Parfois la douleur oculaire due à l’atteinte ciliaire directe tumorale ou par atteinte secondaire inflammatoire, peut être un signe d’appel. Le diagnostic des mélanomes choroïdiens est clinique par la visualisation d’une lésion le plus fréquemment pigmentée, en relief, typiquement en bouton de chemise ou nodulaire, accompagnée de pigment orange en surface, de décollement de rétine périlésionnel ou inférieur à distance. L’échographie oculaire, examen complémentaire indispensable, permet de mettre en évidence une lésion classiquement hyperéchogène en son sommet avec une atténuation du signal progressive dans la tumeur : l’excavation choroïdienne. Elle permet surtout de mesurer l’épaisseur tumorale et la longueur axiale indispensables au traitement conservateur par faisceaux de protons. Le reste du bilan local initial comprend une angiographie à la fluorescéine (hyperfluorescence progressive, pin points), une angiographie au vert d’indocyanine (analyse de la vascularisation choroïdienne intratumorale) et un OCT (décollement séreux infraclinique, logettes kystiques ou aspect schisique de la rétine en regard de la tumeur).
L’œdème maculaire, conséquence du mélanome choroïdien, peut être dû à plusieurs mécanismes : la dégénérescence rétinienne en regard d’un mélanome rétrofovéolaire (fig. 14-22), un décollement de rétine chronique responsable d’un œdème maculaire secondaire, une réaction inflammatoire secondaire à un mélanome choroïdien nécrotique d’emblée, ou encore l’augmentation du VEGF intravitréen due à la présence même de la tumeur [1]. En effet, Boyd et al. ont montré que le taux de VEGF était plus élevé dans l’humeur aqueuse des yeux énucléés pour mélanome choroïdien que dans les yeux témoins (cette élévation n’était corrélée ni à la taille tumorale ni à la présence d’un décollement de rétine associé) [2]. L’œdème maculaire cystoïde (OMC) peut donc être présent lors du diagnostic de mélanomes choroïdiens pourtant très à distance de la macula. Cette association justifie donc l’examen du fond d’œil jusqu’en grande périphérie en cas d’OMC [3]. Dans une étude très récente, un œdème maculaire infraclinique était présent dans 54 % des cas (sur une série de 306 yeux) [4] avec une corrélation significative entre l’œdème maculaire infraclinique au diagnostic et la taille tumorale ou la présence de décollement séreux rétinien initial.

Fig. 14-22 Mélanome en partie rétrofovéolaire.
a. Cliché couleur. b. Angiographie fluorescéinique. Pin points en angiographie. c. SD-OCT. Œdème maculaire cystoïde associé à un DSR au diagnostic.
Une grande majorité des mélanomes, dans les pays occidentaux, sont traités de manière conservatrice par radiothérapie (brachythérapie, irradiation par faisceaux de protons). Les vaisseaux rétiniens irradiés au cours du traitement subissent des modifications histologiques semblables aux vaisseaux tumoraux irradiés : dilatations fusiformes des vaisseaux de petite taille, microanévrismes [5]. Un réseau vasculaire collatéral peut se former. L’incompétence vasculaire peut se traduire par un œdème maculaire, des exsudats lipidiques, un décollement séreux rétinien. Il a été montré que l’incidence de l’OMC post-thérapeutique (traitement par brachythérapie à l’iode 125) était significativement plus importante en cas de présence d’œdème infraclinique au moment du diagnostic de mélanome [6]. Les facteurs de risque liés à l’apparition d’OMC au cours du suivi post-thérapeutique sont le sexe féminin, l’épaisseur tumorale, la distance entre la tumeur et la fovéa, la présence d’hémorragies à la surface de la tumeur, et une différence de plus de 10 % de l’épaisseur centromaculaire entre les deux yeux au moment du diagnostic de mélanome (fig. 14-23). Face à une maculopathie radique, plusieurs attitudes thérapeutiques peuvent être envisagées : photocoagulation au laser [7], photothérapie dynamique, injections intravitréennes de corticostéroïdes [8] ou d’anti-VEGF (voir chapitre 14.1).

Fig. 14-23 Œdème maculaire 2 ans après une protonthérapie pour mélanome choroïdien supérieur chez une femme de 55 ans.
À noter les impacts de laser réalisé pour ischémie rétinienne secondaire. Il s’agit d’une maculopathie associée à une rétinopathie radique. a. Cliché couleur. b. Angiographie fluorescéinique. c. SD-OCT.
Au décours de l’irradiation des mélanomes choroïdiens volumineux, des décollements de rétine exsudatifs et des phénomènes ischémiques ont été décrits et regroupés sous le nom de syndrome de la tumeur toxique [9]. Au cours de ce syndrome, sont associés un relargage de cytokines pro-inflammatoires, des phénomènes exsudatifs dus aux vaisseaux irradiés « incompétents » et une augmentation de la concentration intra-oculaire en VEGF. Ces facteurs ischémiques et inflammatoires contribuent à la pérennisation de l’action directe de la radiothérapie sur la macula. Les pistes thérapeutiques évoquées dans la littérature sont les traitements anti-inflammatoires (corticostéroïdes en intravitréen), les anti-VEGF [10, 11], le traitement par photocoagulation des zones d’ischémie. L’hypothèse d’une résection transclérale de la tumeur résiduelle des patients présentant un décollement rétinien exsudatif et un glaucome néovasculaire après irradiation a été par ailleurs émise. En effet, en éliminant la source des médiateurs inflammatoires, une amélioration théorique des conséquences de ce syndrome toxique pourrait être possible [12]. Cependant, il semble que la course de la maculopathie et de la rétinopathie se poursuive malgré la destruction de la lésion une fois que les phénomènes inflammatoires et ischémiques ont débuté. L’endorésection, après radiothérapie et avant l’apparition de ces phénomènes exsudatifs, semble être plus efficace en prévention de ce syndrome de la tumeur toxique.
La cataracte est une complication fréquente du traitement conservateur (brachythérapie ou protonthérapie) des mélanomes choroïdiens. Gragoudas a montré une incidence de 42 % de cataracte sous-capsulaire postérieure post-protonthérapie dans les deux années qui suivent le traitement [13]. La COMS Study Group [14] montre une incidence de 83 % de cataracte à 5 ans post-brachythérapie par iode 125. Plus d’un quart des patients opérés de cataracte a présenté un œdème maculaire postopératoire. L’œdème maculaire apparaît alors comme la cause la plus fréquente de non-récupération visuelle directement liée à la chirurgie. Les pistes thérapeutiques dans ces cas d’œdèmes maculaires postopératoires sont peu étudiées dans la littérature. Le traitement pourrait reposer sur le traitement de la rétinopathie radique concomitante, des injections intravitréennes de corticoïdes ou d’anti-VEGF. Aucune donnée n’est disponible sur l’efficacité du traitement topique anti-inflammatoire et général par acétazolamide dans ces cas.
Au cours des mélanomes choroïdiens métastatiques, une nouvelle classe thérapeutique peut être utilisée, les inhibiteurs de MEK (mitogen-activated protein kinase enzyme). Il existe un risque de toxicité oculaire et notamment d’œdème maculaire toxique d’apparition généralement rapide et réversible à l’arrêt du traitement (fig. 14-24) [15].

Fig. 14-24 Toxicité des inhibiteurs de MEK utilisés notamment dans les cas de mélanomes choroïdiens métastatiques.
a. Avant traitement. b. Après traitement. OM d’apparition rapide, 9 jours après traitement.
Une autre cause, plus rare d’œdème maculaire au cours des mélanomes choroïdiens, est la présence de traction vitréomaculaire post-thérapeutique. La seule étude concernant cette complication particulière concerne les patients traités par thermothérapie transpupillaire. Le délai d’apparition moyen de la traction vitréomaculaire en post-thérapeutique était de 23 mois (± 18 mois) avec une amélioration fonctionnelle chez tous les patients après traitement chirurgical de la traction (six patients) [16]. Des tractions vitréomaculaires associées à des membranes épirétiniennes en post-protonthérapie ont également été observées, plus fréquemment en cas de mélanome postérieur.
La prévalence réelle des métastases intra-oculaires est difficile à évaluer. Dans la plupart des séries cliniques, la prévalence des métastases uvéales chez les patients atteints de carcinome est de 2,3 à 9,2 %. Les patients atteints de métastase uvéale ont un âge médian de 51 à 59 ans avec une prévalence plus importante chez la femme. Les tumeurs primitives à l’origine de métastases uvéales sont principalement des tumeurs carcinomateuses et plus particulièrement les adénocarcinomes (carcinomes mammaires : fig. 14-25 et pulmonaire en tête) et, beaucoup plus rarement les mélanomes, les tumeurs carcinoïdes ou encore les sarcomes. La symptomatologie des métastases choroïdiennes est aspécifique. Les symptômes les plus fréquemment décrits sont une baisse de l’acuité visuelle, un scotome, une amputation du champ visuel, des métamorphopsies ou myodésopsies. Les métastases choroïdiennes des carcinomes sont classiquement rondes ou ovalaires, et achromes. La localisation des métastases choroïdiennes est le plus fréquemment rétro-équatoriale. Elles sont bilatérales dans 10 % et multiples dans 40 % des cas. L’angiographie à la fluorescéine et au vert d’indocyanine peut aider au diagnostic en cas de doute clinique. Les métastases choroïdiennes sont en général hypofluorescentes aux séquences précoces de l’angiographie à la fluorescéine et s’imprègnent progressivement de colorant. En angiographie au vert d’indocyanine, la lésion est spécifiquement hypofluorescente à la phase précoce de la séquence angiographique sans réelle modification de la structure vasculaire choroïdienne avoisinante en cas de lésion récente.
L’échographie B est indispensable au cours du bilan des métastases choroïdiennes montrant dans la plupart des cas une ou plusieurs lésions iso-échogènes, uniformes sans excavation choroïdienne. Lors de l’OCT (au mieux en mode enhanced depth imaging [EDI]), les métastases choroïdiennes apparaissent comme une bande hyporéflective au sein de la choroïde profonde associée à un élargissement de l’espace suprachoroïdien (fig. 14-26). Une série récente a montré la présence de décollement séreux rétinien dans près de 80 % des cas et un œdème maculaire dans 14 % des cas [17]. Une IRM cérébrale est indispensable à la recherche de lésions secondaires métastatiques associées.
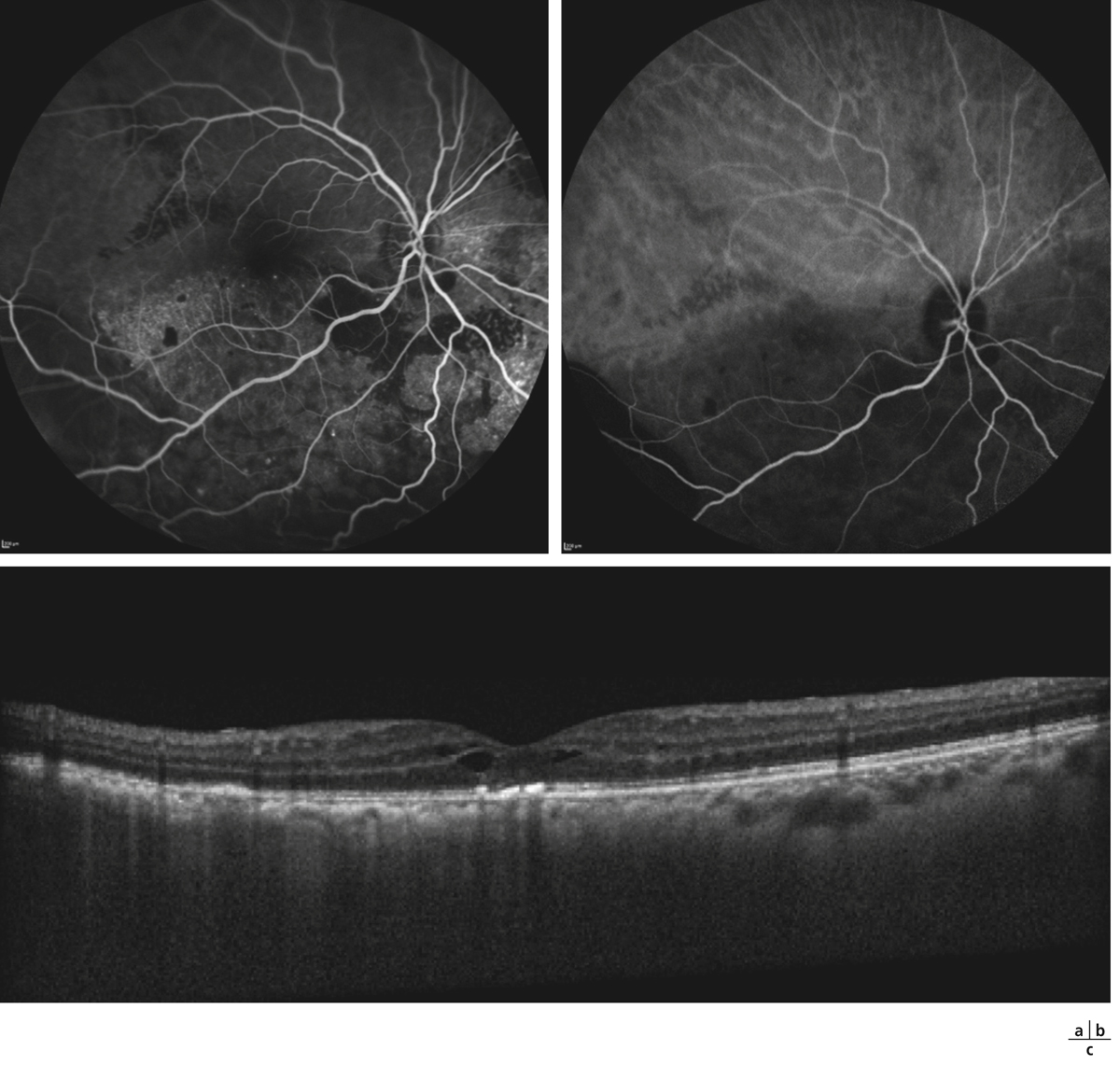
Fig. 14-25 Métastase choroïdienne d’un adénocarcinome mammaire envahissant l’hémichoroïde inférieure.
a. Imprégnation hétérogène en angiographie à la fluorescéine. b. Hypocyanescence de la lésion en ICG. c. OCT. Œdème maculaire dû à la localisation diffuse de la lésion.

Fig. 14-26 Infiltration choroïdienne dans le cadre d’une métastase choroïdienne diffuse.
a. Cliché couleur. b. Cliché bleu. c. Aspect en EDI-OCT typique d’irrégularité de la surface antérieure (lumpy bumpy) de la lésion associée à un DSR et à une bande hyporéflective intrachoroïdienne.
L’œdème est le plus souvent dû à la localisation maculaire de la lésion métastatique. L’œdème maculaire est plus rare que le décollement séreux rétinien (DSR) au cours de la maladie métastatique en raison de la rapidité d’évolution de la lésion. Il est également moins fréquent qu’au cours des mélanomes choroïdiens dont l’évolution est plus lente. Les métastases choroïdiennes peuvent encercler la papille et engendrer un œdème papillaire dû à la fois aux troubles circulatoires péripapillaires induits par la tumeur mais aussi à la compression directe de la tumeur du nerf optique par la masse tumorale. L’œdème maculaire peut beaucoup plus rarement être la conséquence d’un œdème papillaire par infiltration métastatique de la tête du nerf optique [18]. L’œdème maculaire peut donc être la conséquence d’un œdème papillaire en cas d’évolution relativement lente. L’infiltration du nerf optique peut également exceptionnellement provoquer une occlusion de la veine centrale de la rétine et un œdème maculaire secondaire [19]. La stratégie thérapeutique doit prendre en compte le pronostic fonctionnel visuel mais aussi le traitement carcinologique en cours par voie générale, la localisation uni- ou bilatérale et l’état général du patient. Il réside dans la réduction de la masse tumorale par radiothérapie externe ou irradiation par faisceau de protons et la chimiothérapie en cas de tumeur primitive chimiosensible. Des cas de traitement par injections intravitréennes d’anti-VEGF ont été publiés avec des doses et des fréquences d’injection variables [20].
Syndrome de thrombose associée au cancer : c’est une complication fréquente au cours des pathologies néoplasiques avec un risque multiplié par 4 de thrombose par rapport à la population générale. Une des conséquences de cette hypercoagulabilité est le risque d’occlusion veineuse rétinienne et donc d’œdème maculaire secondaire. Le traitement de référence du syndrome de thrombose associé au cancer est l’héparine de bas poids moléculaire.
Lésions secondaires cérébrales concomitantes : environ 20 % des patients atteints de métastases choroïdiennes sont atteints de lésions secondaires cérébrales concomitantes [21]. Ces lésions métastatiques peuvent induire hypertension intracrânienne, œdème papillaire, décollement séreux rétinien et œdème maculaire secondaires [22]. Le traitement réside en la réduction de la tension intracrânienne par les corticoïdes par voie intraveineuse et un traitement de la(des) lésion(s) cérébrale(s) : radiothérapie cérébrale, radiochirurgie, réduction tumorale par chimiothérapie.
Effet secondaire des chimiothérapies : les inhibiteurs des tyrosines kinases, les agents antimicrotubulaires, les chimiothérapies à base de taxanes notamment peuvent provoquer un OMC toxique avec ou sans diffusion angiographique (voir chapitre 14.7).
[1] Garoon R, Shields CL, Kaliki S, Shields J. Cystoid macular edema as the initial manifestation of choroidal melanoma. Oman J Ophthalmol 2012 ; 5 : 187-8.
[2] Boyd SR, Tan D, Bunce C, et al. Vascular endothelial growth factor is elevated in ocular fluids of eyes harbouring uveal melanoma: identification of a potential therapeutic window. Br J Ophthalmol 2002 ; 86 : 448-52.
[3] Brownstein S, Orton R, Jackson B. Cystoid macular edema with equatorial choroidal melanoma. Arch Ophthalmol 1978 ; 96 : 2105-7.
[4] Mashayekhi A, et al. Early Subclinical macular edema in eyes with uveal melanoma: association with future cystoid macular edema. Ophthalmology 2015 ; 122 : 1023-9.
[5] Groenewald C, Konstantinidis L, Damato B. Effects of radiotherapy on uveal melanomas and adjacent tissues. Eye (Lond) 2013 ; 27 : 163-71.
[6] Shields CL, et al. Intravitreal triamcinolone acetonide for radiation maculopathy after plaque radiotherapy for choroidal melanoma. Retina 2005 ; 25 : 868-74.
[7] Hykin PG, et al. The efficacy of focal laser therapy in radiation-induced macular edema. Ophthalmology 1998 ; 105 : 1425-9.
[8] Baillif S, et al. Intravitreal dexamethasone 0.7-mg implant for radiation macular edema after proton beam therapy for choroidal melanoma. Retina 2013 ; 33 : 1784-90.
[9] Damato BE. Management of patients with uveal melanome. In : Singh AD, Damato BE, Pe’er J, et al. Clinical Ophtalmic Oncology. Elsevier ; 2007, p. 92-93.
[10] Gupta, A, Muecke JS. Treatment of radiation maculopathy with intravitreal injection of bevacizumab (Avastin). Retina 2008 ; 28 : 964-8.
[11] Finger PT. Radiation retinopathy is treatable with anti-vascular endothelial growth factor bevacizumab (Avastin). Int J Radiat Oncol Biol Phys 2008 ; 70 : 974-7.
[12] McCannel TA. Post-brachytherapy tumor endoresection for treatment of toxic maculopathy in choroidal melanoma. Eye (Lond) 2013 ; 27 : 984-8.
[13] Gragoudas ES, et al. Lens changes after proton beam irradiation for uveal melanoma. Am J Ophthalmol 1995 ; 119 : 157-64.
[14] Collaborative Ocular Melanoma Study Group. Incidence of cataract and outcomes after cataract surgery in the first 5 years after iodine 125 brachytherapy in the Collaborative Ocular Melanoma Study: COMS Report no 27. Ophthalmology 2007 ; 114 : 1363-71.
[15] Duncan KE, Chang LY, Patronas M. MEK inhibitors : a new class of chemotherapeutic agents with ocular toxicity. Eye (Lond) 2015 ; 29 : 1003-12.
[16] Kashani AH, Aaberg TM Jr, Capone A Jr. Vitreomacular traction as a consequence of posterior hyaloidal contraction after transpupillary thermotherapy. Am J Ophthalmol 2013 ; 155 : 937-45.
[17] Al-Dahmash SA, et al. Enhanced depth imaging optical coherence tomography of choroidal metastasis in 14 eyes. Retina 2014 ; 34 : 1588-93.
[18] Shields JA, Shields CL, Singh AD. Metastatic neoplasms in the optic disc : the 1999 Bjerrum Lecture : part 2. Arch Ophthalmol 2000 ; 118 : 217-24.
[19] Backhouse O, et al. Optic nerve breast metastasis mimicking meningioma. Aust N Z J Ophthalmol 1998 ; 26 : 247-9.
[20] Augustine H, et al. Treatment of ocular metastasis with anti-VEGF : a literature review and case report. Can J Ophthalmol 2014 ; 49 : 458-63.
[21] Bottke D, et al. Is a diagnostic CT of the brain indicated in patients with choroidal metastases before radiotherapy ? Strahlenther Onkol 2005 ; 181 : 251-4.
[22] Hoye VJ 3rd, et al. Optical coherence tomography demonstrates subretinal macular edema from papilledema. Arch Ophthalmol 2001 ; 119 : 1287-90.
I. Meunier, C. Hamel
➤ L’œdème maculaire cystoïde complique certaines dystrophies rétiniennes héréditaires principalement constituées des rétinopathies pigmentaires (RP).
➤ La baisse d’acuité visuelle fluctuante et l’héméralopie sont les principaux signes cliniques qui font évoquer le diagnostic.
➤ L’OMC bilatéral de type cystoïde est confirmé par l’OCT aux stades précoces, avant l’apparition de l’atrophie rétinienne, alors que l’examen du fond d’œil et l’autofluorescence retrouvent des signes de RP.
➤ L’électrorétinogramme (ERG) est l’examen clé pour aboutir au diagnostic causal.
➤ Les inhibiteurs de l’anhydrase carbonique constituent le principal traitement évalué actuellement même si leur effet reste modéré.
Bien que les dystrophies rétiniennes héréditaires soient rares (un cas sur 5000 environ), l’œdème maculaire est fréquent au cours de leur évolution. Les rétinites pigmentaires qui représentent plus de 50 % des dystrophies héréditaires sont les principales dystrophies associées à un œdème maculaire. Celui-ci est fréquent, noté dans 20 à 50 % des rétinites pigmentaires (RP), l’atteinte étant unilatérale dans 50 à 60 % des cas. La fréquence de l’œdème maculaire varie avec le mode de transmission : très faible dans les formes liées à l’X, estimée à 20 à 25 % dans les formes autosomiques récessives et à plus de 50 à 60 % dans les formes dominantes [1–4]. À l’inverse des rétinites pigmentaires, l’œdème maculaire est rarissime dans les dystrophies de type cônes–bâtonnets. Dans un contexte de maculopathie héréditaire, l’œdème maculaire doit faire rechercher une complication néovasculaire, un processus inflammatoire surajouté, un « faux œdème maculaire » du rétinoschisis, un syndrome de Goldmann-Favre et exceptionnellement un œdème maculaire dominant [5].
Une dystrophie rétinienne est à évoquer si et uniquement si l’œdème maculaire est cystoïde (OMC et diffus. Cet OMC, unilatéral ou bilatéral, est fluctuant dans le temps : il peut disparaître ou réapparaître et cela en l’absence de tout traitement.
L’OMC se traduit par une baisse d’acuité visuelle variable et fluctuante, dépendante de l’épaisseur de l’œdème maculaire et du degré de la perte des cônes maculaires. Les patients ne rapportent pas de métamorphopsies ou de micropsies.
L’héméralopie est le signe essentiel à rechercher à l’interrogatoire : Voyez-vous les étoiles, toutes les étoiles ? Pouvez-vous vous placer dans une salle de cinéma si vous arrivez en retard ? Votre enfant change-t-il de comportement dans l’obscurité ? Avez-vous une certaine maladresse ou des difficultés dans les jeux de balle ? Il existe cependant une très grande variabilité quant à la perception de l’héméralopie. Elle peut être peu invalidante dans les rétinites pigmentaires modérées ou dans un environnement citadin. La photophobie et la dyschromatopsie sont des signes tardifs dans les RP.
L’examen du fond d’œil et les clichés en couleurs sont réalisés après dilatation de la pupille. Au-delà de l’œdème maculaire, on recherche une diminution de la coloration de la papille qui peut être très discrète dans les formes débutantes de RP. On évalue le calibre des vaisseaux rétiniens dont la réduction signe une pathologie impliquant aussi la périphérie rétinienne. Puis, on précise la couleur, l’homogénéité de la rétine périphérique. Bien que non spécifiques, les pseudo-ostéoblastes ou les pigmentations rondes grossières en périphérie rétinienne ou en temporal au pôle postérieur sont là encore le signe d’une atteinte diffuse avec une perte de photorécepteurs (fig. 14-27).
Les clichés en autofluorescence démasquent dans la plupart des cas un liseré caractéristique annulaire périfovéolaire et de petites plages hypo-autofluorescentes disséminées sur toute ou partie de la périphérie rétinienne (fig. 14-28).
La tomographie en cohérence optique (OCT) a révolutionné le diagnostic causal des œdèmes maculaires. En effet, l’imagerie OCT des œdèmes maculaires des RP est très caractéristique avec une perte de la ligne ellipsoïde et une réduction de l’épaisseur de la couche nucléaire externe bien au-delà de la zone d’œdème et en temporal (fig. 14-29 et 14-30). Elle permet également de visualiser une membrane épirétinienne qui peut être associée à l’OMC. Elle est l’examen clé pour le suivi et l’évaluation de la réponse au traitement (fig. 14-31).
L’angiographie à la fluorescéine n’est pas indiquée dans ce contexte étiologique. Elle peut orienter à tort vers une uvéite postérieure du fait des phénomènes de diffusion étendus au pôle postérieur au-delà de la zone œdémateuse (fig. 14-32). En revanche, l’hétérogénéité de la périphérie rétinienne est en faveur d’une dégénérescence rétinienne. Rappelons qu’il n’est pas rare que le patient ait été suivi pour une uvéite postérieure, alors qu’il s’agissait d’une rétinite pigmentaire avec un œdème maculaire et des remaniements vitréens.

Tableau 14-5 Points clés de la sémiologie simplifiée de l’œdème maculaire des rétinites pigmentaires.
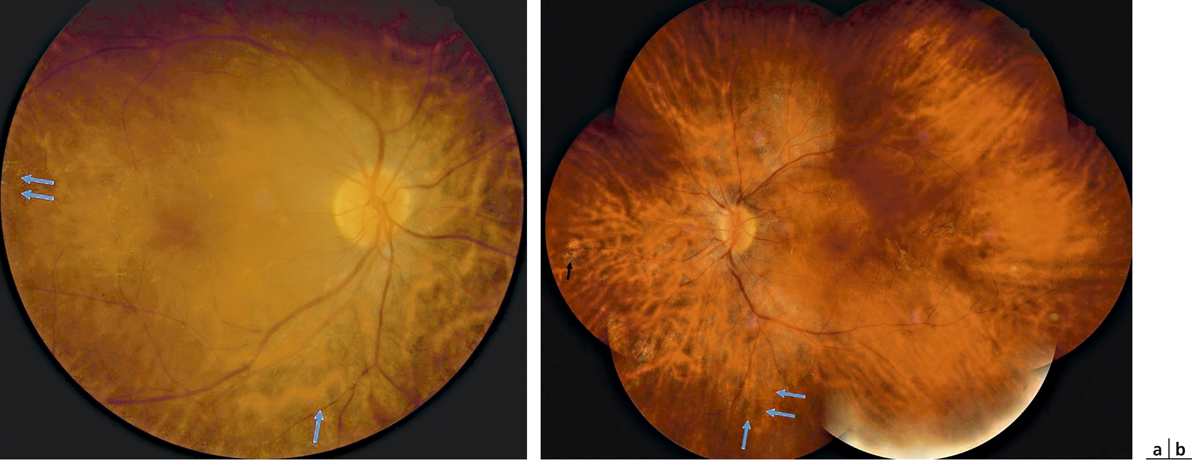
Fig. 14-27 Cliché en couleurs du pôle postérieur de l’œil droit (a) et montage rétinien de l’œil gauche (b) d’une patiente de 27 ans ayant une rétinite pigmentaire modérée et une baisse de l’acuité visuelle centrale par œdème maculaire à l’œil droit (7/10).
Le calibre des vaisseaux rétiniens est diminué, la papille est colorée. En périphérie, la rétine est parsemée de fines lésions blanchâtres (flèches bleues) avec de très rares petites mottes pigmentaires (flèche noire). Cet aspect oriente d’emblée vers une dystrophie rétinienne diffuse. Noter la membrane épirétinienne maculaire aux deux yeux.
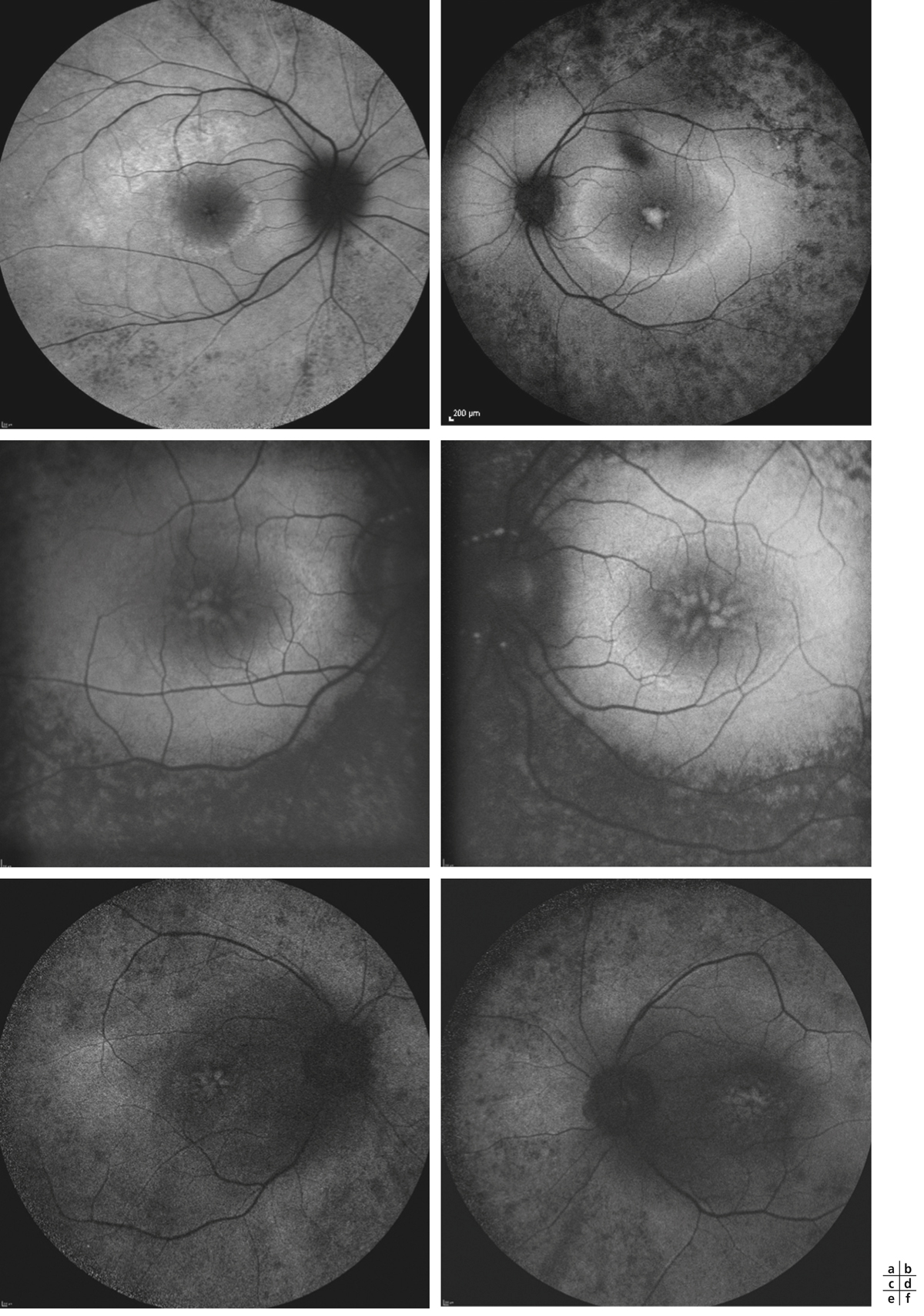
Fig. 14-28 Différents aspects de l’autofluorescence dans des rétinites pigmentaires.
Œdème maculaire unilatéral ou bilatéral (a-d). Le liseré hyper-autofluorescent périfovéolaire est très évocateur d’une rétinite pigmentaire. Il n’est pas constant (e, f). La perte des photorécepteurs se traduit en périphérie par de petites lésions hypo-autofluorescentes de densité variable. Les logettes d’œdème maculaire sont hyper-autofluorescentes.
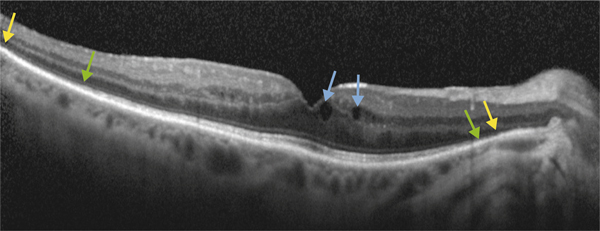
Fig. 14-29 Grille de lecture des coupes OCT en cas d’œdème maculaire compliquant une rétinite pigmentaire.
En périphérie (entre les flèches jaunes et vertes), la ligne ellipsoïde n’est plus discernable, la couche nucléaire externe qui correspond aux noyaux des photorécepteurs a une épaisseur très diminuée (nettement inférieure à celle de la couche nucléaire interne ou couches des noyaux des cellules bipolaires) et seule la membrane limitante externe est visible. À l’inverse, dans la zone centrale (entre les flèches vertes), la membrane limitante externe et la ligne ellipsoïde sont l’une et l’autre préservées. Noter les éléments kystiques (flèches bleues).

Fig. 14-30 Différents aspects OCT d’œdème maculaire compliquant une rétinite pigmentaire.
L’œdème maculaire est unilatéral ou bilatéral et fluctuant. L’œdème est diffus cystoïde sauf dans les rétinites pigmentaires associées à des pseudo-Coats (œdème maculaire avec exsudats). Quels que soient le stade évolutif ou le niveau d’acuité visuelle, trois critères constants signent la rétinite pigmentaire : la diminution de l’épaisseur de la couche nucléaire externe et sa quasi-disparition en périphérie, la perte de la ligne ellipsoïde puis de la membrane limitante externe en dehors de la fovéa.
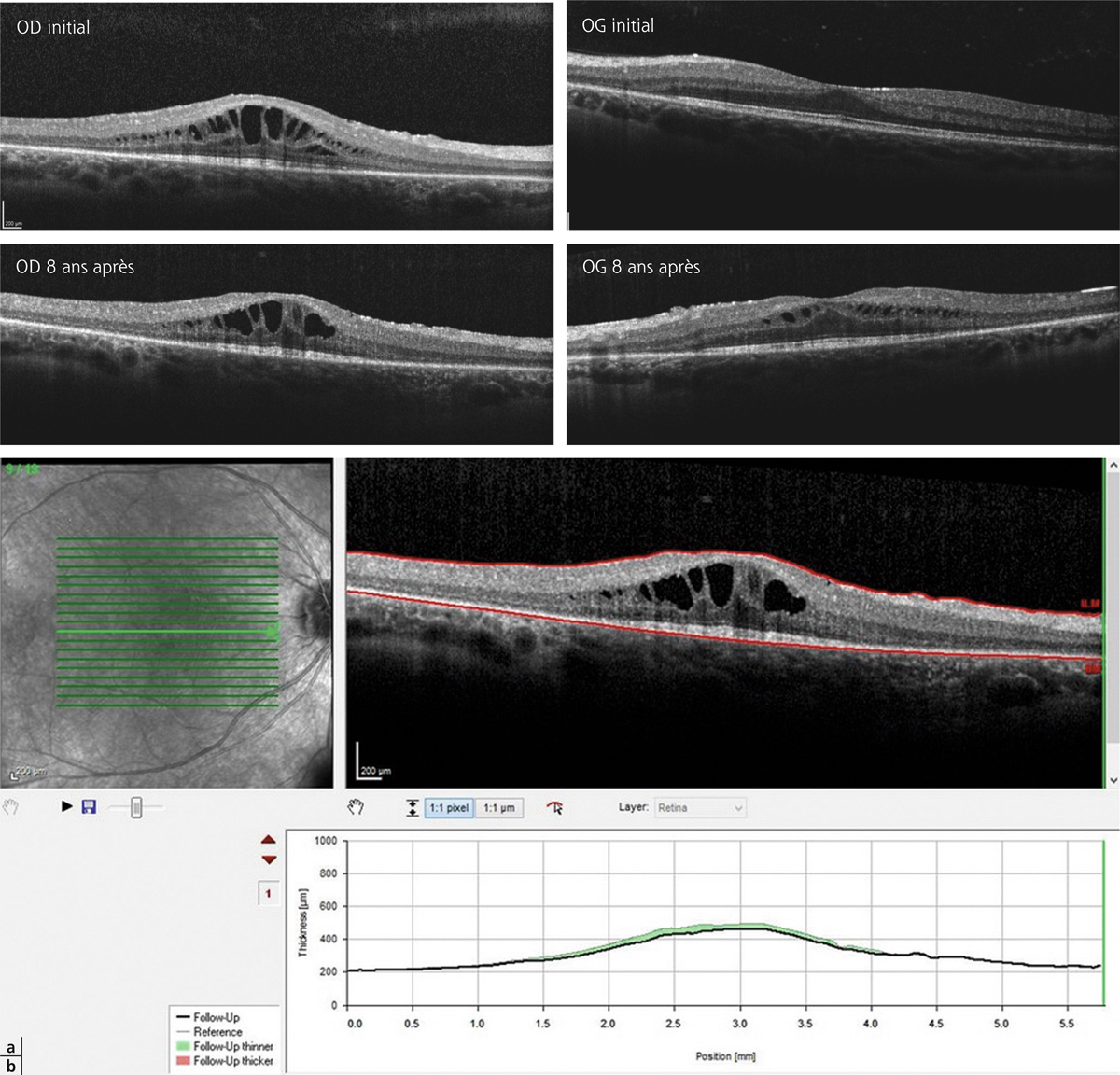
Fig. 14-31 Évolution à 8 ans sous traitement par inhibiteurs de l’anhydrase carbonique.
L’acuité visuelle a été maintenue et a baissé en cas d’arrêt du traitement. a. Les données OCT ont peu évolué à l’œil droit (OD) avec une épaisseur de l’œdème stable et une ligne ellipsoïde préservée même si la zone de préservation de la ligne ellipsoïde est moins étendue à 8 ans. L’acuité visuelle à l’œil droit a varié de 5 à 7/10. À l’œil gauche (OG), un œdème est apparu malgré le traitement, l’acuité était de 10/10 après avoir été à 12/10. b. Profil maculaire comparatif de l’œil droit à 8 ans d’intervalle.
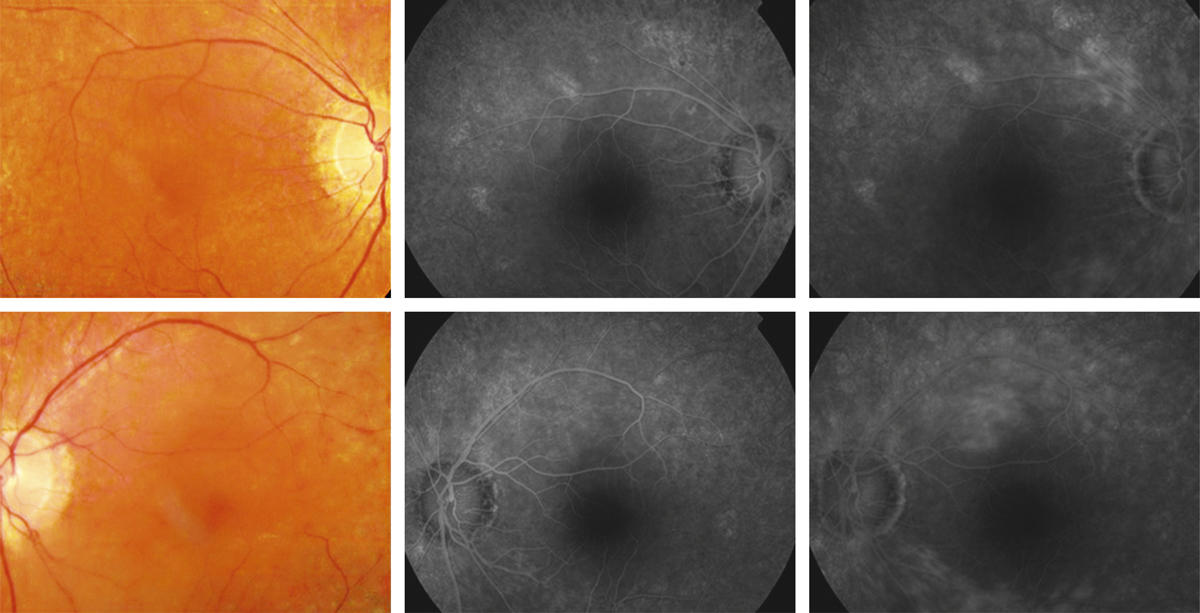
Fig. 14-32 Angiographie à la fluorescéine.
Cet examen est un véritable piège dans les rétinites pigmentaires, car les images de diffusion orientent à tort vers une uvéite postérieure, et ce d’autant que le patient peut, dans les rétinites pigmentaires comme dans les uvéites, avoir un œdème maculaire, un vitré remanié et une membrane épirétinienne. Dans ce contexte, la présence d’une héméralopie et celle d’un liseré sur l’image en autofluorescence sont des éléments clés en faveur d’une rétinite pigmentaire qui sera à confirmer par l’électrorétinogramme grand champ.
L’électrorétinogramme (ERG) est l’examen clé pour confirmer le diagnostic causal de l’œdème maculaire. Tout œdème maculaire cystoïde unilatéral ou bilatéral associé à une héméralopie doit conduire à la réalisation d’un ERG champ total selon les recommandations de l’International Society for Clinical Electrophysiology of Vision (ISCEV) : pupille dilatée, coques cornéennes, adaptation à l’obscurité de 20 minutes puis adaptation à la lumière de 10 minutes. Les réponses des bâtonnets et des cônes sont anormales si elles sont à moins de 50 % des valeurs inférieures de référence (population témoin appariée en âge).
L’œdème maculaire est probablement lié à une rupture de la barrière hémato-rétinienne interne par un mécanisme inflammatoire et également à de possibles tractions vitréorétiniennes avec une fréquence élevée des membranes épirétiniennes dans les rétinites pigmentaires (15,6 %) [3]. Ces anomalies s’intriquent avec la dégénérescence programmée lente et chronique des photorécepteurs. Cet œdème est fluctuant au cours de l’évolution de la dystrophie, mais souvent absent aux stades évolués, surtout marqués par l’amincissement rétinien maculaire ou fovéolaire et la perte des cônes maculaires. L’acuité visuelle peut être relativement conservée malgré l’importance de l’œdème (fig. 14-33) ou effondrée alors que ce dernier est discret à l’OCT. En effet, le pronostic visuel reste principalement fonction du stade de la perte des photorécepteurs centraux et donc de l’intégrité de la ligne ellipsoïde et de l’épaisseur de la couche nucléaire externe regroupant les noyaux des photorécepteurs [6].
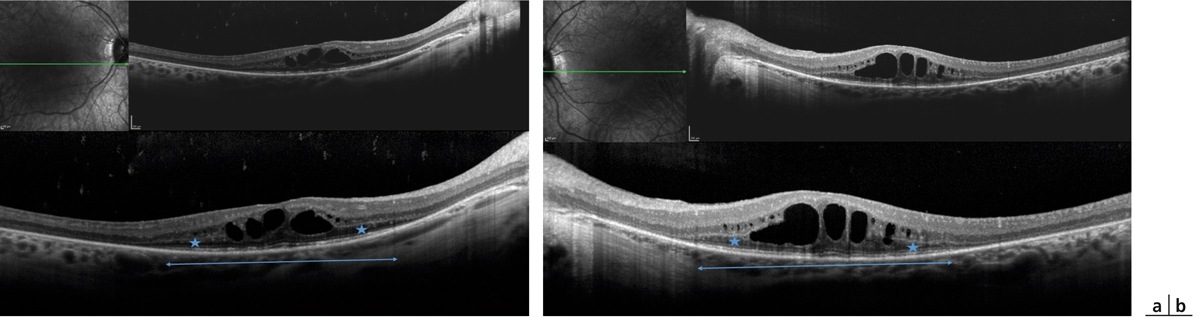
Fig. 14-33 Œdème maculaire bilatéral dans le cadre d’une rétinite pigmentaire liée à l’X.
Une telle atteinte est exceptionnelle pour ce mode de transmission. Le patient âgé de 30 ans avait une acuité visuelle en 2008 diminuée, chiffrée à 7/10 à l’œil droit (a) et à 5/10 à l’œil gauche (b). Il a été mis sous inhibiteurs de l’anhydrase carbonique à raison de 3 comprimés/jour puis 2,5 comprimés. La tolérance est satisfaisante. L’acuité visuelle à 5 ans est de 9/10 à l’œil droit (a) et de 6/10 à l’œil gauche (b). Sur les coupes OCT, la ligne ellipsoïde rétrofovéolaire est préservée aux deux yeux (barre bleue) en regard de l’épaississement fovéolaire et des éléments cystiques : 450 µ œil droit (a) et 600 µ œil gauche (b). La disparition de la ligne ellipsoïde et de la couche nucléaire (étoiles bleues) en dehors de la zone fovéale est caractéristique d’une rétinite pigmentaire.
Elle n’est indiquée que si l’acuité visuelle est diminuée, l’œdème significatif et la ligne des photorécepteurs relativement conservée. Au stade évolué avec des éléments kystiques et une rétine amincie, l’intérêt du traitement est discutable. Il n’y a aucune grande cohorte disponible permettant de codifier le traitement, compte tenu de la rareté des dystrophies rétiniennes.
Les inhibiteurs de l’anhydrase carbonique agiraient en augmentant les transferts d’ions et d’eau de la rétine vers la choroïde et en diminuant l’extravasation à partir des vaisseaux rétiniens par rupture de la barrière hémato-rétinienne interne. Ils sont proposés sur une période de 3 mois, poursuivis ou arrêtés en fonction de la tolérance (fatigue, perte de l’appétit, perte de poids, coliques néphrétiques) et de la réponse thérapeutique (fig. 14-33). L’amélioration de l’acuité visuelle n’est pas le seul critère d’évaluation de la réponse au traitement, car celle-ci dépend également de la perte des cônes maculaires. La diminution de l’œdème dans la zone fovéale et parafovéale est le critère OCT retenu pour la poursuite du traitement. Le traitement par voie topique semblerait aussi efficace que le traitement par voie systémique [7, 8].
Ces thérapies sont difficiles à envisager au long cours chez des patients ayant un œdème et une perte programmée et constante des cônes maculaires. Quelques publications ont montré une efficacité sur l’œdème sans amélioration nette de l’acuité visuelle et des réponses de l’ERG multifocal [8, 9]. Il n’y a pas d’études examinant la place des injections répétées.
Il est souhaitable d’adresser le patient à un centre de référence pour que le mode de transmission et les risques d’atteinte des descendants lui soient expliqués. Le mode de transmission est dans un premier temps hypothétique à partir de l’arbre généalogique. Seule l’identification du gène et de la mutation permet dans la plupart des cas de donner in fine le risque de transmission (mutation de novo, variation de pénétrance).
[1] Adackapara CA, Sunness JS, Dibernardo CW, et al. Prevalence of cystoid macular edema and stability in oct retinal thickness in eyes with retinitis pigmentosa during a 48-week lutein trial. Retina Phila Pa 2008 ; 28 : 103-10.
[2] Hajali M, Fishman GA. The prevalence of cystoid macular oedema on optical coherence tomography in retinitis pigmentosa patients without cystic changes on fundus examination. Eye Lond Engl 2009 ; 23 : 915-9.
[3] Testa F, Rossi S, Colucci R, et al. Macular abnormalities in Italian patients with retinitis pigmentosa. Br J Ophthalmol 2014 ; 98 : 946-50.
[4] Walia S, Fishman GA, Hajali M. Prevalence of cystic macular lesions in patients with Usher II syndrome. Eye Lond Engl 2009 ; 23 : 1206-9.
[5] Fishman GA, Goldberg MF, Trautmann JC. Dominantly inherited cystoid macular edema. Ann Ophthalmol 1979 ; 11 : 21-7.
[6] Sandberg MA, Brockhurst RJ, Gaudio AR, Berson EL. Visual acuity is related to parafoveal retinal thickness in patients with retinitis pigmentosa and macular cysts. Invest Ophthalmol Vis Sci 2008 ; 49 : 4568-72.
[7] Liew G, Moore AT, Webster AR, Michaelides M. Efficacy and prognostic factors of response to carbonic anhydrase inhibitors in management of cystoid macular edema in retinitis pigmentosa. Invest Ophthalmol Vis Sci 2015 ; 56 : 1531-6.
[8] Salvatore S, Fishman GA, Genead MA. Treatment of cystic macular lesions in hereditary retinal dystrophies. Surv Ophthalmol 2013 ; 58 : 560-84.
[9] Moschos MM, Moustafa GA. Intravitreal aflibercept (Eylea) injection for cystoid macular edema secondary to retinitis pigmentosa - a first case report and short review of the literature. BMC Ophthalmol 2015 ; 15 : 44.
V. Krivosic
➤ Les télangiectasies maculaires du type 1 correspondent à une maladie de Coats de l’adulte, avec des anomalies vasculaires prédominant dans la macula. L’examen de la périphérie retrouve souvent des anomalies vasculaires localisées typiques de la maladie de Coats. Elles sont unilatérales et touchent préférentiellement les hommes.
➤ Les télangiectasies maculaires de type 2 correspondent à des anomalies bilatérales de la maille capillaire maculaire dites « occultes », peu visibles au fond d’œil et associées à une atrophie de la rétine neurosensorielle. Leur cause n’est pas connue. Elles pourraient être dues à la dégénérescence des cellules de Müller, conduisant à la mort des photorécepteurs. Aucun traitement n’a fait la preuve de son efficacité.
Les télangiectasies maculaires sont habituellement secondaires. Les causes les plus fréquentes sont le diabète, l’hypertension artérielle (HTA), les occlusions veineuses, les vascularites et l’hyperviscosité sanguine. Dans certains cas, aucune cause n’est retrouvée. Ces formes ont été regroupées et plusieurs classifications ont été proposées (tableau 14-6) [1, 2]. Il existe en fait deux types de télangiectasies maculaires. Le type 1 correspond à des télangiectasies visibles, probablement congénitales, associées à un œdème maculaire cystoïde (OMC), et fait partie du spectre clinique de la maladie de Coats. Le type 2 correspond à des anomalies vasculaires probablement acquises sur un fond de dégénérescence maculaire bilatérale.
Tableau 14-6 Classification des télangiectasies maculaires idiopathiques.
Les télangiectasies maculaires de type 1 correspondent à des anomalies de la maille capillaire maculaire à type de dilatations anévrismales et de télangiectasies, associées à une exsudation intrarétinienne. Elles correspondent en fait à une maladie de Coats diagnostiquée chez l’adulte, avec des anomalies vasculaires qui prédominent dans la macula. L’examen de la périphérie retrouve en effet souvent des anomalies vasculaires localisées typiques de la maladie de Coats.
Les télangiectasies maculaires de type 1 touchent habituellement les hommes. Elles se manifestent sur le plan clinique par une baisse de l’acuité visuelle (AV) unilatérale. Les anomalies vasculaires sont visibles à l’examen du fond d’œil. L’angiographie à la fluorescéine permet de bien visualiser les télangiectasies sur les temps précoces. Puis le colorant diffuse au cours de la séquence à partir des anomalies vasculaires. On peut parfois mettre en évidence un OMC aux temps tardifs. Il est important d’examiner la périphérie rétinienne de ces patients à la recherche d’un secteur plus ou moins étendu d’anomalies vasculaires associées évoquant une maladie de Coats (fig. 14-34). L’OCT permet de bien visualiser et de quantifier les DSR et les OMC.

Fig. 14-34 Télangiectasies maculaires de type 1 chez un patient de 47 ans.
Cliché en couleurs (a) : les anomalies vasculaires maculaires sont visibles (flèches) et on retrouve des exsudats secs. L’OCT montre un épaississement maculaire (insert). L’angiographie à la fluorescéine permet de bien visualiser les télangiectasies sur les temps précoces (b), et des anomalies vasculaires périphériques typiques de la maladies de Coats (c). Il y a une diffusion maculaire au temps tardif et une micrologette d’œdème maculaire (d).
L’évolution des télangiectasies maculaires de type 1 peut être marquée par la survenue d’un OMC et d’une accumulation d’exsudats lipidiques au pôle postérieur. Ce sont ces complications exsudatives qui sont responsables de la baisse d’acuité visuelle. Cette baisse d’acuité est en général de l’ordre de 5/10, mais peut atteindre 1/10.
En cas de baisse de l’AV inférieure à 5/10, un traitement au laser thermique peut être envisagé (argon vert). L’objectif est la destruction des anomalies maculaires vasculaires diffusantes. Plusieurs études non randomisées rapportent une disparition de l’exsudation intrarétinienne et une petite amélioration visuelle après traitement au laser [3]. Évaluées de manière ponctuelle dans des cas rapportés, les IVT d’anti-VEGF semblent également être un traitement qui pourrait permettre de maintenir l’AV en faisant régresser l’œdème maculaire [4].
Les télangiectasies maculaires de type 2 correspondent à des anomalies bilatérales de la maille capillaire maculaire dites « occultes », car peu visibles au fond d’œil et associées à une atrophie de la rétine neurosensorielle. Leur cause n’est pas connue.
Deux études ont examiné la prévalence des télangiectasies maculaires de type 2 : la Beaver Dam Study qui retrouve une prévalence de 0,1 % [5] et la Melbourne Collaborative Cohort Study qui retrouve une prévalence de 0,0045 à 0,022 % [6].
Il existe probablement une susceptibilité génétique aux télangiectasies maculaires de type 2, mais aucun gène n’a pour le moment été identifié. Dans l’étude MacTel, il a été mis en évidence un taux élevé de diabète (28 %) et d’HTA (52 %) [7]. La pathogénie des télangiectasies maculaires de type 2 est mal connue. L’hypothèse communément admise a longtemps été une atteinte des capillaires maculaires. Cependant, celle-ci n’explique pas de manière satisfaisante l’atrophie progressive de la rétine neurosensorielle. Une autre hypothèse est la dégénérescence des cellules de Müller, conduisant à la mort des photorécepteurs. Il y a de nombreux indices anatomopathologiques et fonctionnels en faveur de cette dernière. Il n’est donc pas clairement identifié si ce sont les anomalies vasculaires qui sont la cause de la mort des photorécepteurs ou si les anomalies vasculaires sont la conséquence d’un dysfonctionnement des cellules neurales ou des cellules gliales.
La classification de Gass et Blodi [1], basée sur l’analyse du fond d’œil et l’angiographie à la fluorescéine, est peu utilisée en pratique clinique.
Les télangiectasies maculaires de type 2 se manifestent sur le plan clinique par une baisse de l’AV bilatérale vers 50–60 ans (âge moyen 56 ans). Le signe le plus précoce est la perte de l’hypofluorescence centrale sur les clichés en autofluorescence, liée à la perte en pigment maculaire. L’examen du fond d’œil retrouve un croissant clair (perte de la transparence rétinienne) en temporal de la macula. Cet aspect est particulièrement bien visible sur le cliché en lumière bleue. Parfois on retrouve également des petits points blancs réfringents localisés dans les couches rétiniennes les plus internes. Les télangiectasies sont moins visibles que dans les télangiectasies maculaires de type 1. Habituellement, le diamètre des vaisseaux maculaires a tendance à diminuer au fur et à mesure qu’ils se rapprochent de la fovéa. Dans les télangiectasies maculaires de type 2, on retrouve une veinule maculaire dilatée qui plonge dans le réseau vasculaire profond. L’angiographie à la fluorescéine permet de bien visualiser les anomalies vasculaires, en particulier aux temps précoces. Au cours de la séquence angiographique et aux temps tardifs, on observe une diffusion du colorant à partir de celles-ci. Elles commencent habituellement en temporal de la macula puis vont avoir tendance à s’étendre à l’ensemble de la circonférence maculaire au cours de l’évolution. L’OCT est également utile au diagnostic. Les signes observés en OCT sont maintenant bien identifiés [12, 13] : kystes intrarétiniens, de taille variable et pouvant se localiser dans l’ensemble des couches rétiniennes (fig. 14-35), et interruption de la ligne des photorécepteurs et de la couche nucléaire externe (fig. 14-36). L’épaisseur rétinienne est normale ou diminuée. La diffusion observée en angiographie à la fluorescéine ne correspond pas à un OMC ou à un DSR. Le plus probable est que cette diffusion soit responsable d’un œdème diffus, entraînant un discret épaississement d’une rétine atrophique. La micropérimétrie permet de mieux corréler les anomalies fonctionnelles et les anomalies anatomiques, en particulier celles observées en OCT. On retrouve une hyposensiblité au niveau des zones de rupture de la couche ellipsoïde. En revanche, la sensibilité est préservée en regard des kystes localisés au niveau des couches externes [14].
En angiographie OCT, on retrouve une raréfaction aussi bien du réseau superficiel que du réseau profond maculaire dès les stades précoces. Aux stades plus évolués, on retrouve une prolifération de vaisseaux anormaux au niveau des couches rétiniennes externes habituellement avasculaire [15]. Il semblerait que cette prolifération soit corrélée à la zone de rupture de la couche ellipsoïde, elle-même secondaire à la mort ou au dysfonctionnement des cellules de Müller.

Fig. 14-35 Œil gauche d’une patiente de 67 ans, présentant des télangiectasies maculaires de type 2 de forme peu évoluée.
Cliché en couleurs (a) et cliché en lumière bleue (b) : diminution de la transparence rétinienne en temporal de la fovéa. On visualise une veinule dilatée dans l’aire maculaire qui semble plonger dans la rétine (flèche). Les télangiectasies sont révélées par les temps précoces de l’angiographie à la fluorescéine (c). L’OCT (d) montre des kystes intrarétiniens localisés dans les couches externes et internes. On note également une irrégularité de la couche ellipsoïde et des couches rétiniennes externes en temporal de la fovea.
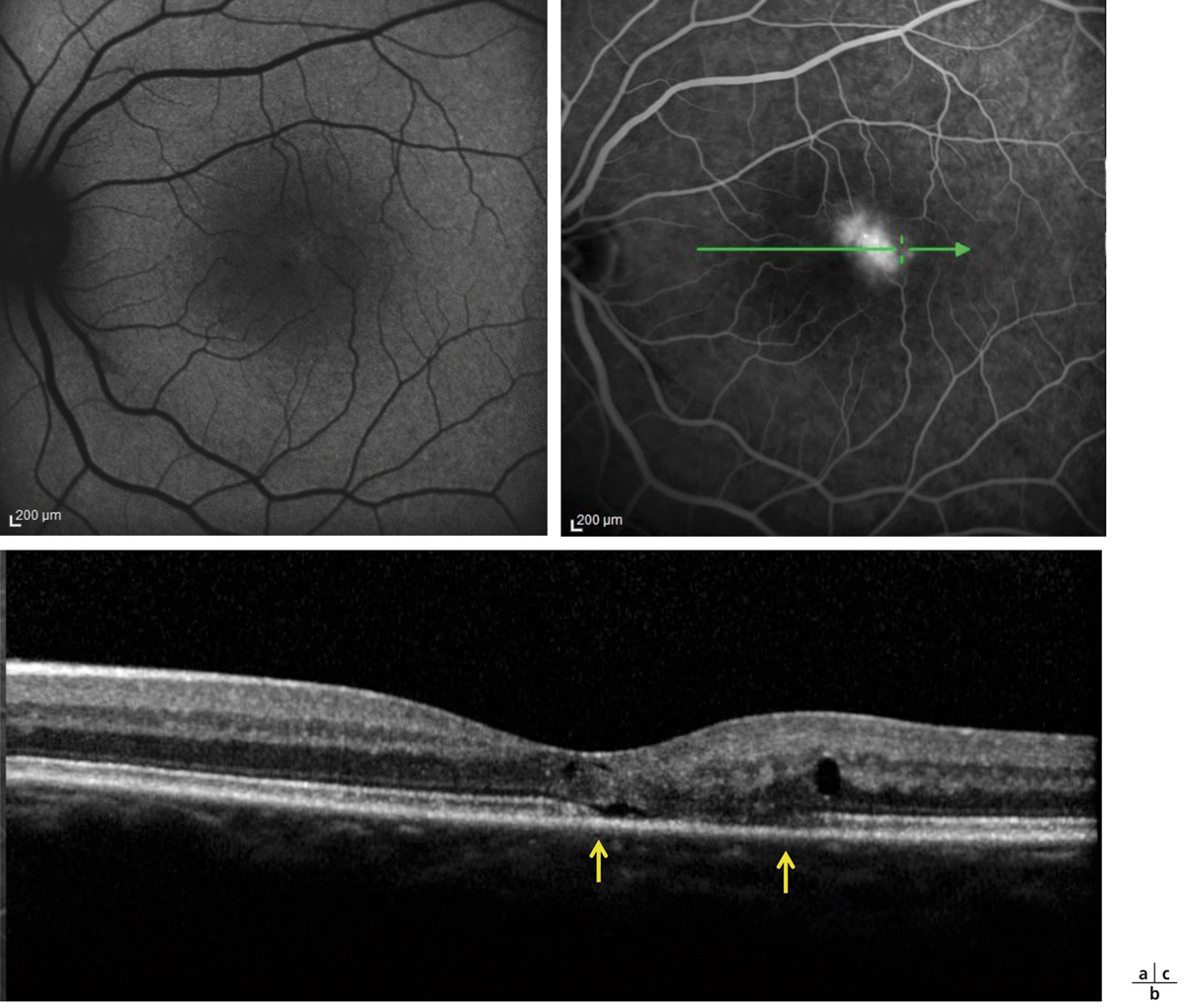
Fig. 14-36 Télangiectasies maculaires de type 2.
Autofluorescence (a) : aspect anormalement clair de la fovéa, correspondant à la perte du pigment xanthophylle. L’OCT révèle une large rupture de la couche ellipsoïde (b : flèches) et une quasi-disparition des couches rétiniennes externes. La diffusion observée en angiographie à la fluorescéine (c) ne correspond pas à une augmentation de l’épaisseur rétinienne.
L’évolution se fait vers une majoration de l’atrophie rétinienne et une prolifération d’un réseau de vaisseaux dilatés dans la macula. On voit parfois apparaître une accumulation de pigment en périfovéolaire (fig. 14-37). Dans les télangiectasies maculaires de type 2, l’acuité visuelle est habituellement longtemps préservée (20/40 en moyenne dans l’étude MacTel à l’inclusion) [7]. La vision centrale peut se dégrader progressivement du fait de l’atrophie maculaire. Dans de rare cas (14 % pour Gass et Blodi et 2 % dans l’étude MacTel) [1, 7], une baisse rapide et marquée de l’acuité peut survenir du fait de l’apparition d’un néovaisseau. Il s’agit de prolifération intrarétinienne, sans composante choroïdienne. Ces néovaisseaux sont le plus souvent localisés en temporal de la macula. Ils sont associés à une exsudation intra- et sous-rétinienne (OMC, DSR et exsudats secs) et des hémorragies rétiniennes (fig. 14-38 et 14-39).

Fig. 14-37 Télangiectasies maculaires de type 2.
Cas d’une forme très atrophique avec migration pigmentaire, bien visible sur le cliché en couleurs (a). Les coupes radiaires de l’OCT permettent de mettre en évidence une large rupture de la couche ellipsoïde (b, flèches). Le pigment est localisé au niveau des couches internes et entraîne un effet masque des structures sous-jacentes (c, flèche).
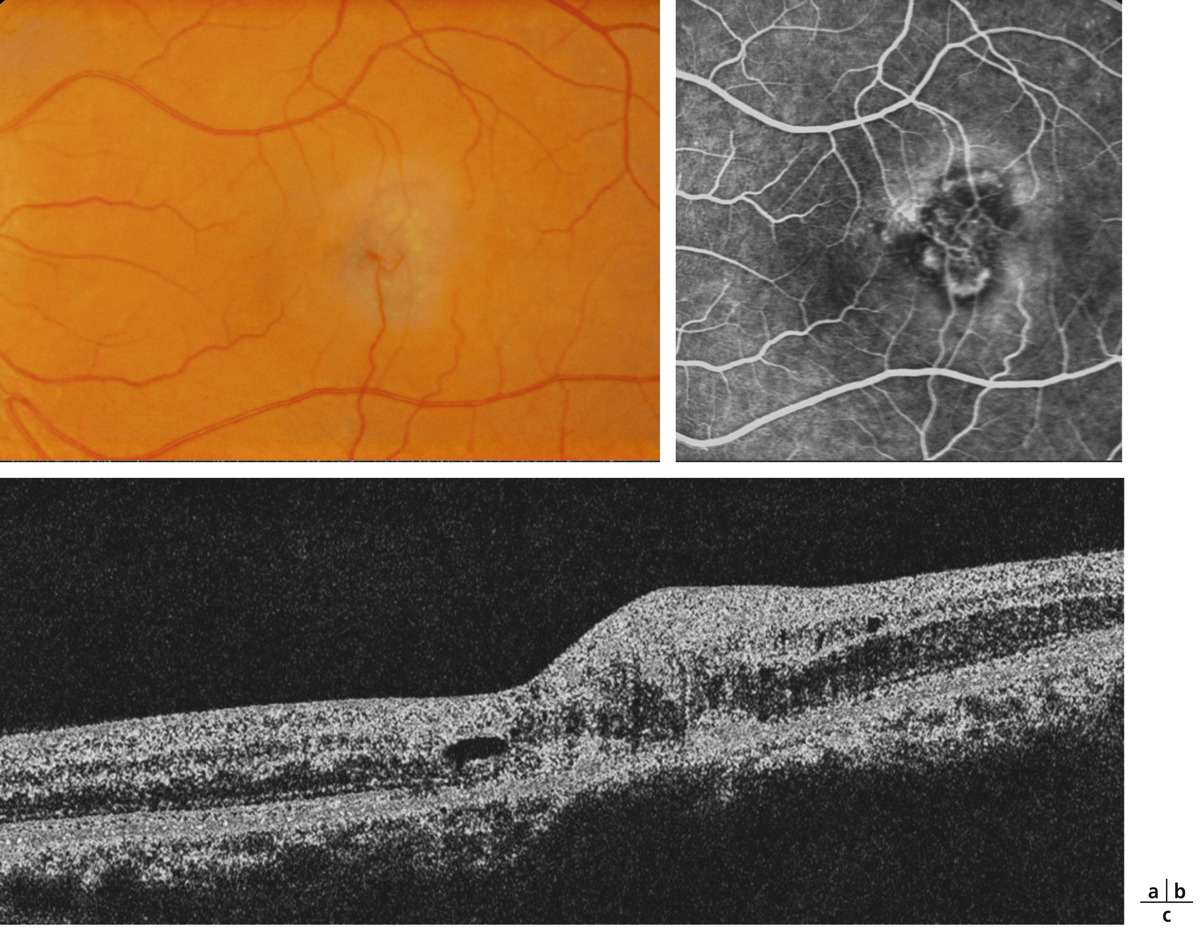
Fig. 14-38 Télangiectasies maculaires de type 2 compliquées de néovaisseau intrarétinien.
Cliché en couleurs (a) : veinule dilatée en temporal de la macula plongeant dans une lésion grisâtre correspondant à la membrane néovasculaire. On note également la présence d’une petite hémorragie. Le lacis néovasculaire est bien visible sur les temps précoces de l’angiographie à la fluorescéine (b). On observe un épaississement rétinien en regard du néovaisseau sur la coupe horizontale de l’OCT (c). Le néovaisseau correspond à une lésion hyperréflective localisée au-dessus de l’épithélium pigmentaire. Il n’y a pas d’effraction de l’épithélium pigmentaire.
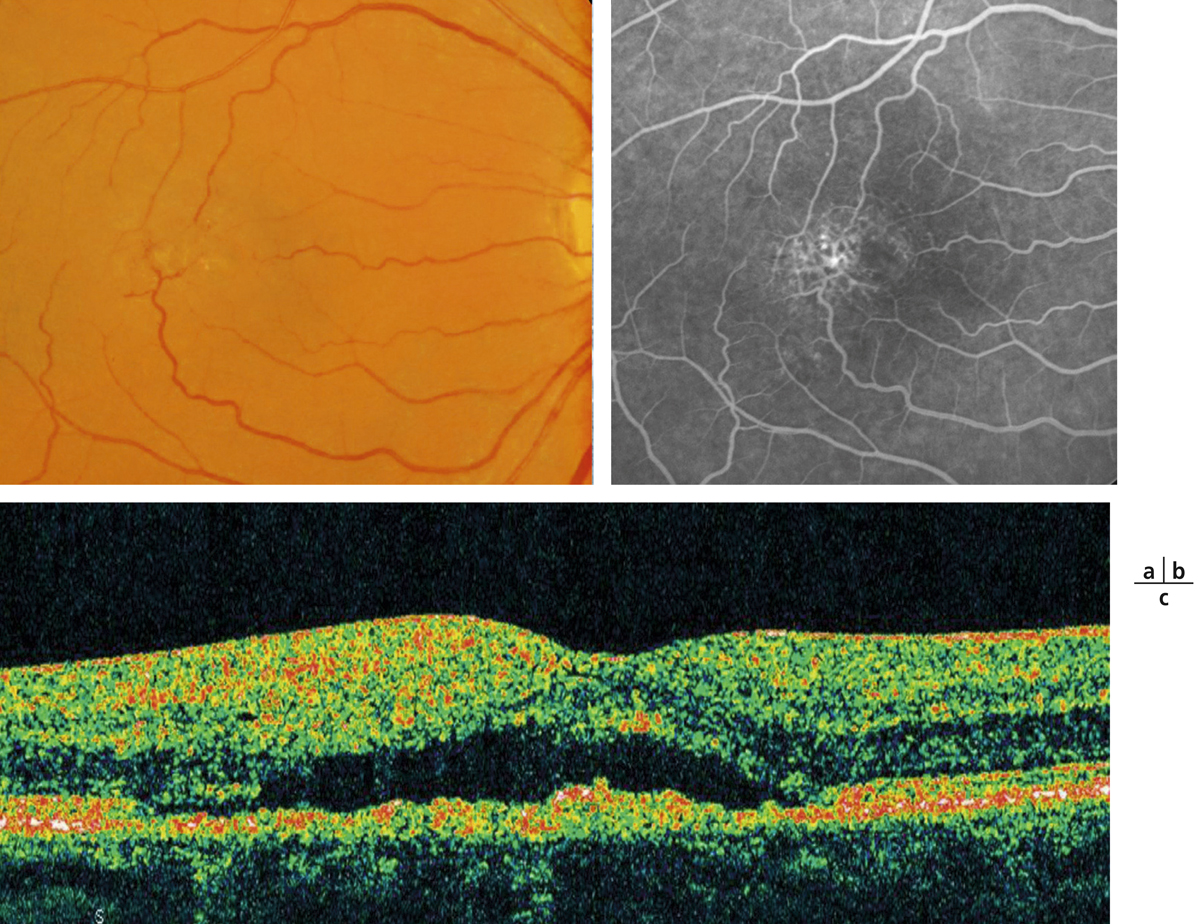
Fig. 14-39 Télangiectasies maculaires de type 2 associées à un décollement séreux rétinien.
Cliché en couleurs (a) : diminution de la transparence rétinienne en temporal de la fovéa et veinule maculaire dilatée plongeant dans la rétine. L’angiographie à la fluorescéine révèle les télangiectasies (b). Sur la coupe horizontale de l’OCT (c), on retrouve un décollement séreux rétinien.
Aucun traitement n’a fait la preuve de son efficacité dans les télangiectasies maculaires de type 2. La photocoagulation au laser thermique est inefficace [7] et risque d’aggraver l’atrophie rétinienne. La PDT à la vertéporfine (Visudyne®) et les IVT d’anti-VEGF n’ont pas non plus donné de bons résultats [16, 17]. Dans la majorité des cas, la meilleure conduite à tenir est donc l’abstention thérapeutique et la surveillance. Un traitement neuroprotecteur est actuellement en cours d’évaluation [18]. En cas de survenue d’un néovaisseau choroïdien, les traitements anti-VEGF (bévacizumab) pourraient permettre une certaine stabilisation de l’évolution [19].
Les télangiectasies maculaires de type 3 s’accompagnent d’une importante baisse de l’acuité visuelle. Cette forme est extrêmement rare. Dans ce groupe, les télangiectasies sont associées à un élargissement de la zone avasculaire centrale du fait de l’oblitération de capillaires maculaires et d’un OMC (fig. 14-40). L’évolution est de très mauvais pronostic. L’acuité visuelle est en général très altérée au moment du diagnostic. Le principal diagnostic différentiel est la rétinopathie d’irradiation (fig. 14-41).

Fig. 14-40 Télangiectasies maculaires de type 3 chez une patiente de 63 ans.
Les anomalies vasculaires sont visibles sur le cliché anérythre. On retrouve également des exsudats (a). L’angiographie à la fluorescéine révèle les télangiectasies et les zones de non-perfusion capillaire sur les temps précoces (b). Sur les temps tardifs, on note le remplissage d’un œdème maculaire cystoïde (c).

Fig. 14-41 Rétinopathie d’irradiation chez un patient de 35 ans ayant été traité par radiothérapie pour une tumeur cérébrale à deux reprises, 5 et 15 ans auparavant.
Cliché en couleurs (a) : hémorragie maculaire et exsudats lipidiques. La coupe radiaire horizontale de l’OCT montre un décollement séreux rétinien et une logette d’OMC centrale (b). Le contenu de cette logette est hyper-réflectif. Les temps précoces de l’angiographie à la fluorescéine révèlent la présence de télangiectasies maculaires qui diffusent aux temps tardifs (c, d).
[1] Gass JD, Blodi BA. Idiopathic juxtafoveolar retinal telangiectasis. Update of classification and follow-up study. Ophthalmology 1993 ; 100 : 1536-46.
[2] Yannuzzi LA, Bardal AM, Freund KB, et al. Idiopathic macular telangiectasia. Arch Ophthalmol 2006 ; 124 : 450-60.
[3] Chopdar A. Retinal telangiectasis in adults : fluorescein angiographic findings and treatment by argon laser. Br J Ophthalmol 1978 ; 62 : 243-50.
[4] Sigler EJ, Randolph JC, Calzada JI, et al. Current management of Coats disease. Surv Ophthalmol 2014 ; 59 : 30-46.
[5] Klein R, Blodi BA, Meuer SM, et al. The prevalence of macular telangiectasia type 2 in the Beaver Dam eye study. Am J Ophthalmol 2010 ; 150 : 55-62.
[6] Aung KZ, Wickremasinghe SS, Makeyeva G, et al. The prevalence estimates of macular telangiectasia type 2 : the Melbourne Collaborative Cohort Study. Retina 2010 ; 30 : 473-8.
[7] Clemons TE, Gillies MC, Chew EY, et al. Baseline characteristics of participants in the natural history study of macular telangiectasia (MacTel) MacTel Project Report No. 2. Ophthalmic Epidemiol 2010 ; 17 : 66-73.
[8] Yannuzzi LA, Bardal A, Freund KB, et al. Idiopathic macular telangiectasia. Arch Ophthalmom 2006 ; 124 : 450-60.
[9] Gass JD, Blodi BA. Idiopathic juxtafoveolar retinal telangiectasis : update of classification and follow-up study. Ophthalmology 1993 ; 100 : 1536-46.
[10] Coats G. Forms or retinal disease with massive exsudation. Lond Ophtalm Hosp Rep 1908 ; 525 : 440-525.
[11] Leber T. Über eine durch Vorkommen multipler Miliaraneurysmen charakterisierte Form von Retinaldegeneration. Graefes Arch Ophthalmol 1912 ; 8.
[12] Gaudric A, Ducos de Lahitte G, Cohen SY, et al. Optical coherence tomography in group 2A idiopathic juxtafoveolar retinal telangiectasis. Arch Ophthalmol 1960 2006 ; 124 : 1410-9.
[13] Paunescu LA, Ko TH, Duker JS, et al. Idiopathic juxtafoveal retinal telangiectasis : new findings by ultrahigh-resolution optical coherence tomography. Ophthalmology 2006 ; 113 : 48-57.
[14] Charbel Issa P, Helb HM, Holz FG, Scholl HPN, MacTel Study Group. Correlation of macular function with retinal thickness in nonproliferative type 2 idiopathic macular telangiectasia. Am J Ophthalmol 2008 ; 145 : 169-75.
[15] Gaudric A, Krivosic V, Tadayoni R. Outer retina capillary invasion and ellipsoid zone loss in macular telangiectasia type 2 imaged by optical coherence tomography angiography. Retina 2015 ; 35 : 2300-6.
[16] De Lahitte GD, Cohen SY, Gaudric A. Lack of apparent short-term benefit of photodynamic therapy in bilateral, acquired, parafoveal telangiectasis without subretinal neovascularization. Am J Ophthalmol 2004 ; 138 : 892-4.
[17] Charbel Issa P, Finger RP, Holz FG, Scholl HPN. Eighteen-month follow-up of intravitreal bevacizumab in type 2 idiopathic macular telangiectasia. Br J Ophthalmol 2008 ; 92 : 941-5.
[18] Chew EY, Clemons TE, Peto T, et al. Ciliary neurotrophic factor for macular telangiectasia type 2 : results from a phase 1 safety trial. Am J Ophthalmol 2015 ; 159 : 659-66.
[19] Kovach JL, Rosenfeld PJ. Bevacizumab (avastin) therapy for idiopathic macular telangiectasia type II. Retina 2009 ; 29 : 27-32.
S. Mrejen
➤ La présence de kystes intrarétiniens est une complication fréquente de la choriorétinopathie séreuse centrale (CRSC) chronique.
➤ L’apparition des kystes n’est pas liée à une rupture de la barrière hémato-rétinienne interne mais semble plutôt liée à la chronicité des signes exsudatifs et à un certain degré d’atrophie de la rétine externe, d’où l’appellation de « dégénérescence maculaire cystoïde » (DMC).
➤ La dégénérescence maculaire cystoïde se localise préférentiellement en inter-papillo-maculaire. Elle semble atteindre la fovéa dans plus de la moitié des cas et est alors associée à un mauvais pronostic visuel.
➤ Les kystes intrarétiniens sont à considérer comme des signes exsudatifs de la CRSC et leur présence ne modifie pas l’attitude thérapeutique dans la CRSC chronique. Cependant la résolution de ces kystes intrarétiniens ne sera pas toujours associée à une récupération visuelle lorsqu’ils sont centraux, car il peut persister une atrophie de la rétine externe.
➤ Le traitement par PDT demi-fluence permet une amélioration anatomique. La récupération fonctionnelle est limitée s’il existe déjà une atrophie de la rétine externe.
La choriorétinopathie séreuse centrale (CRSC) est caractérisée par des décollements séreux de la rétine et de l’épithélium pigmentaire (EP) rétinien liés à une exsudation d’origine choroïdienne à travers des points de fuite au niveau de l’EP. C’est une rétinopathie qui atteint habituellement l’homme jeune mais peut se présenter à tout âge avec une grande variabilité phénotypique. C’est la quatrième rétinopathie non chirurgicale la plus fréquente après la DMLA, la rétinopathie diabétique et les occlusions veineuses rétiniennes [1]. La physiopathologie reste incomplètement élucidée.
Il est classique de distinguer deux phénotypes principaux : les CRSC aiguë et chronique. Le critère de définition de la CRSC chronique, bien que débattu et arbitraire, est une durée de plus de 4 à 6 mois. Au sein des formes chroniques, la forme diffuse de la maladie est appelée « épithéliopathie rétinienne diffuse ». La CRSC chronique a un pronostic visuel plus réservé que la CRSC aiguë, et atteint typiquement des sujets plus âgés avec un sex-ratio homme/femme moins élevé [2].
Bien que les signes exsudatifs soient habituellement sous-rétiniens, des kystes intrarétiniens ont été décrits dans la CRSC chronique [3, 4], habituellement après une longue évolution de la maladie [5]. La présence de cavités kystiques intrarétiniennes dans la CRSC est un signe de chronicité et de mauvais pronostic. Elle doit aussi faire éliminer certains diagnostics différentiels, en particulier des néovaisseaux choroïdiens liés à la DMLA, une vasculopathie polypoïdale choroïdienne ou une maculopathie associée à une fossette colobomateuse.
La prévalence des kystes intrarétiniens dans la CRSC chronique varie beaucoup selon les études et les populations de patients évaluées et a été retrouvée égale à 10,5 % (4/38 yeux) [6], 25 % (9/36 yeux) [7], et jusqu’à 71 % (29/40 yeux) [8]. La prévalence de ces signes exsudatifs intrarétiniens varie avec la durée d’évolution de la maladie et sa sévérité, ce qui pourrait expliquer la grande variabilité de sa survenue selon les populations évaluées. La première description des kystes intrarétiniens dans la CRSC concernait huit yeux de sept patients ayant une acuité visuelle inférieure à 1/10 et ces kystes étaient tous de distribution maculaire [3]. Dans cette étude, la durée des signes exsudatifs sous-rétiniens variait de 3,5 à 34 ans et les auteurs considéraient que c’était un signe de mauvais pronostic [3]. Les auteurs ont choisi le terme de « dégénérescence maculaire cystoïde » et non d’« œdème maculaire cystoïde » car les cavités visualisées en OCT ne s’imprègnent pas de colorant en angiographie à la fluorescéine (fig. 14-42). Plus tard, Piccolino et al. ont proposé de renommer cette entité « dégénérescence cystoïde du pôle postérieur », car ces kystes intrarétiniens présentent une étendue et une localisation variables, avec une distribution souvent extrafovéolaire et compatible avec une bonne acuité visuelle (fig. 14-43) [4]. La localisation la plus fréquente est plutôt la région inter-papillo-maculaire (fig. 14-43), dans environ deux tiers des cas, suivie de la région supéromaculaire puis inférieure et temporale [4]. La fovéa peut être atteinte dans plus de la moitié des cas [4]. Dans tous les yeux évalués avec une dégénérescence cystoïde du pôle postérieur et une acuité visuelle supérieure à 5/10, les kystes intrarétiniens étaient strictement extrafovéolaires [4].
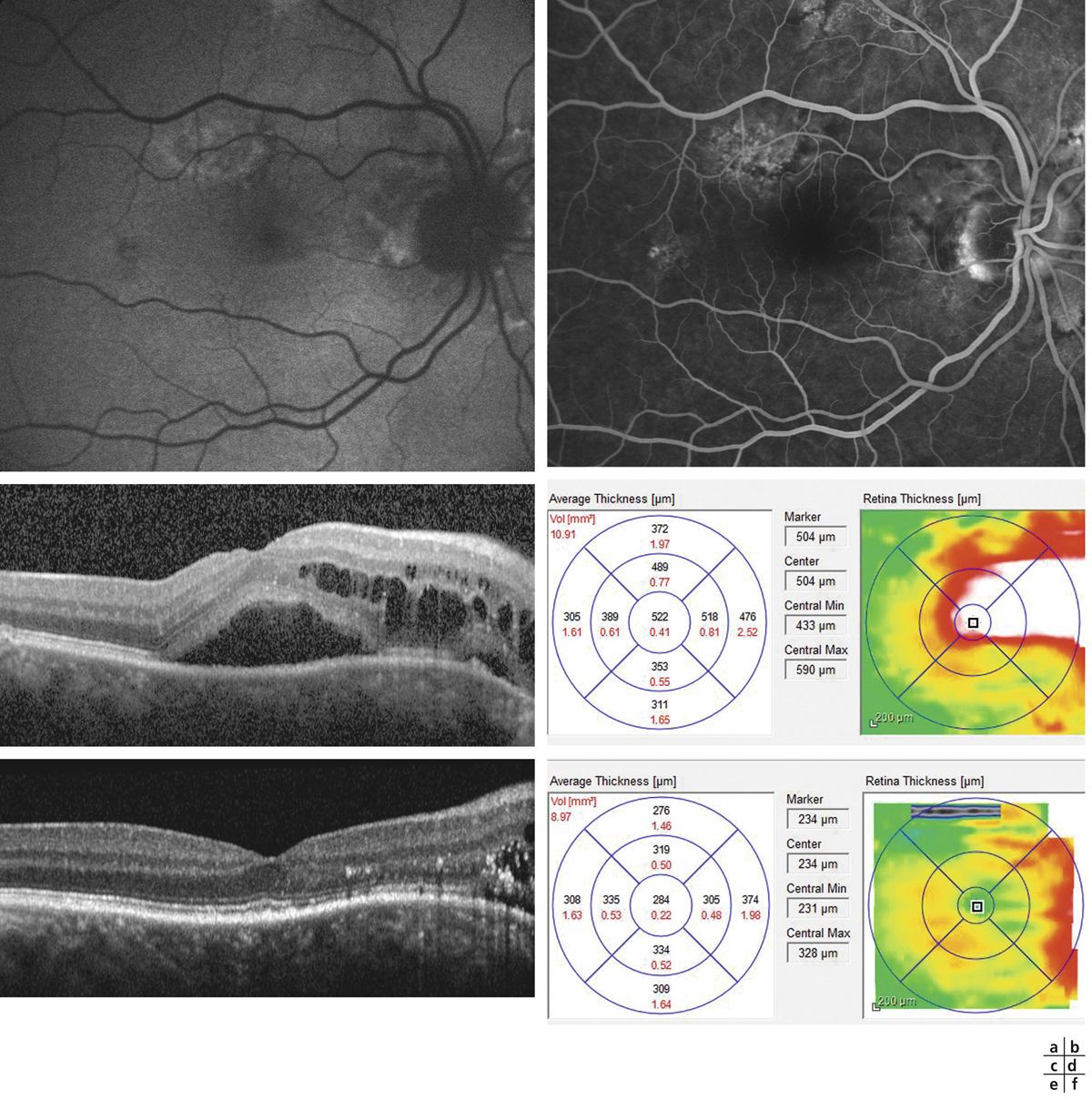
Fig. 14-42 Homme de 54 ans, avec CRSC chronique bilatérale, présentant une baisse de vision à 4/10 à l’œil droit depuis 4 mois.
Le cliché en autofluorescence (a) montre des altérations diffuses de l’EP maculaire. Le cliché à 2 minutes de l’angiographie à la fluorescéine (b) ne montre pas d’OMC central ni de diffusion anormale à partir des vaisseaux rétiniens, mais des plages d’hyperfluorescence diffuses mal limitées, correspondant aux zones de décompensation de l’EP. La coupe horizontale fovéolaire d’OCT (c) montre un décollement séreux rétinien central associé à une dégénérescence maculaire cystoïde, dont les kystes sont principalement localisés au niveau de la rétine externe. La cartographie de l’épaisseur maculaire en OCT (d) montre la distribution des signes exsudatifs prédominant en inter-papillo-maculaire et maculaire. Trois mois après une séance de PDT demi-fluence, la coupe horizontale fovéolaire d’OCT (e) et la cartographie (f) montrent la résolution des signes exsudatifs intra- et sous-rétiniens centraux, même s’il persistent en péripapillaire. Cette amélioration anatomique est corrélée à une amélioration visuelle à 8/10.
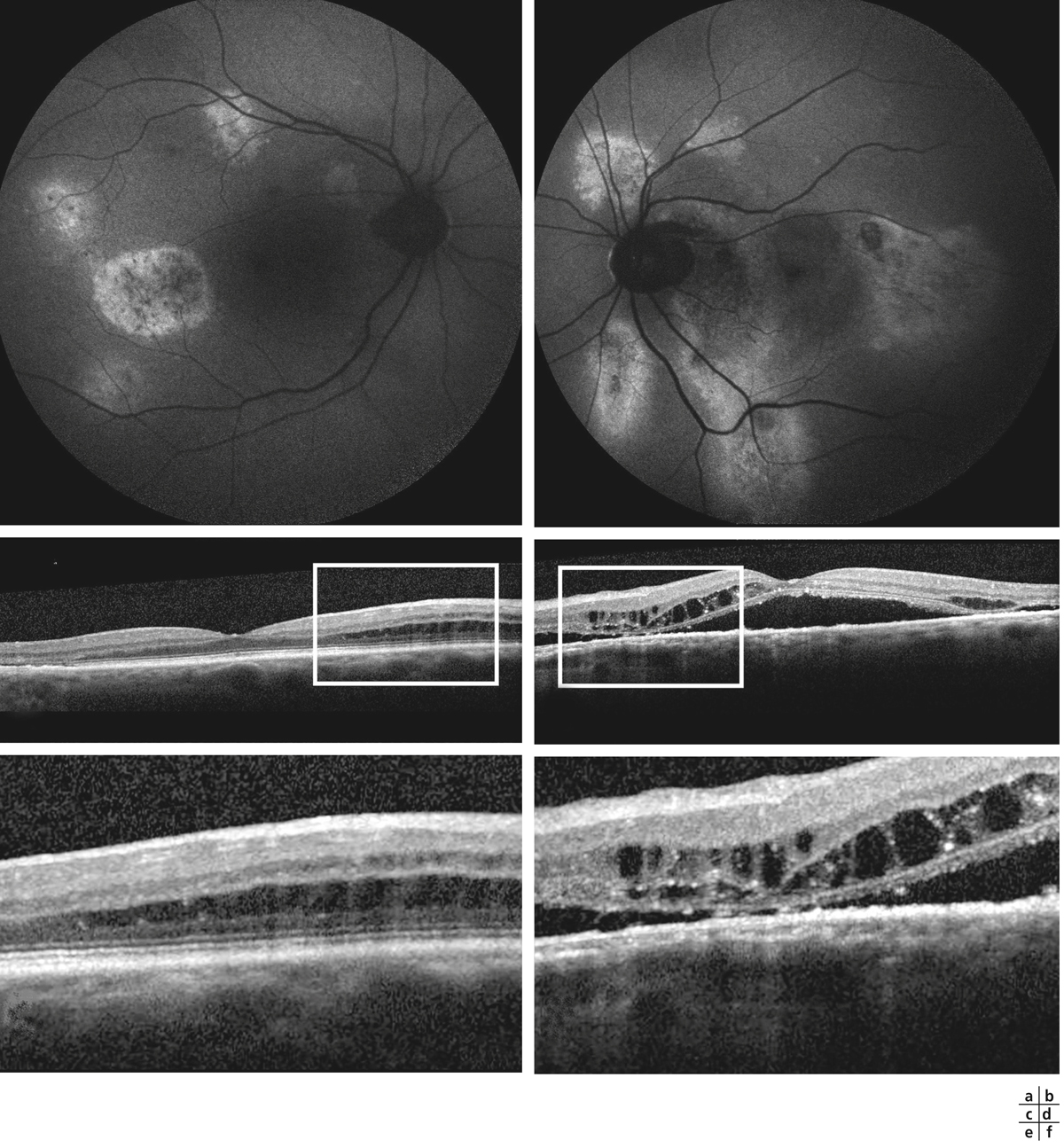
Fig. 14-43 Homme de 60 ans avec une épithéliopathie rétinienne diffuse bilatérale présentant une baisse de vision unilatérale gauche à 3/10.
Le cliché en autofluorescence (a, b) montre des altérations diffuses hyper-autofluorescentes bilatérales et deux coulées gravitationnelles à gauche. On note des altérations de l’EP hypo-autofluorescentes prédominant en interpapillomaculaire à gauche (b). Les coupes horizontales fovéolaires d’OCT (c, d) montrent une dégénérescence maculaire cystoïde (DMC) bilatérale prédominant en interpapillomaculaire. À gauche, la DMC est plus étendue et associée à un décollement séreux rétinien central. Le détail des zones encadrées en blanc (e, f) montre que les kystes prédominent au niveau de la couche nucléaire externe. Ils peuvent aussi impliquer la couche nucléaire interne (e, f) et peuvent être associés à une atrophie de la rétine externe (f) ou pas (e). Seul l’œil gauche présente une baisse d’acuité visuelle car la DMC implique la fovéa.
(Remerciements au Dr Alexandra Pierru.)
La durée de la CRSC est un facteur de risque majeur de développer une dégénérescence maculaire cystoïde (DMC), en particulier en cas de symptômes évoluant depuis plus de 5 ans. Une durée des symptômes liés à la CRSC supérieure à 10 ans, et à 15 ans semble encore plus fortement corrélée au risque de survenue de DMC. Des facteurs de risque systémiques tels que la prise de corticoïdes systémiques et locaux, la présence de fibrose sous-rétinienne ou de larges cicatrices de laser thermique ont été mis en évidence par l’analyse univariée d’une série de 51 patients atteints de CRSC chronique dont 24 ont développé une DMC [5]. Cependant, l’analyse multivariée n’a retrouvé que deux facteurs de risque indépendants de survenue de DMC : une durée des symptômes supérieure à 5 ans et la présence de fibrose sous-rétinienne [5]. L’âge, le sexe et l’hypertension artérielle ne semblaient pas associés à la survenue de DMC [5].
À l’examen du fond d’œil, l’œdème intrarétinien n’est détectable cliniquement que dans environ la moitié des cas [3]. Tous les yeux évalués semblent présenter des altérations diffuses de l’EP (fig. 14-42 et 14-43) [3, 4]. Cependant, la topographie de la dégénérescence maculaire cystoïde ne correspond pas toujours à celle des altérations de l’EP (fig. 14-42 et 14-43) [4]. On peut observer des plages d’hypopigmentation et/ou d’hyperpigmentation correspondant à des plages d’altérations de l’EP, mais aussi des zones blanc jaunâtre de fibrose sous-rétinienne [4]. Selon certains auteurs, la présence de kystes intrarétiniens apparaîtrait au niveau de zones d’adhérences pathologiques entre la rétine, l’EP et la choroïde interne partiellement atrophiques.
La tomographie en cohérence optique (OCT) a facilité la première description de la dégénérescence maculaire cystoïde dans la DMLA [3], ainsi que sa caractérisation topographique [4]. Il est classique de distinguer de larges cavités kystiques centrales avec perte de la dépression fovéolaire. Ces kystes sont principalement localisés au niveau de la rétine externe avec une relative préservation de la rétine interne, mais peuvent aussi occuper toute l’épaisseur rétinienne (fig. 14-42 et 14-43) [3, 4]. L’OCT montre des kystes intrarétiniens associés à une altération des lignes correspondant aux photorécepteurs ou à une atrophie de la rétine externe (fig. 14-43) [3]. Un décollement séreux rétinien peut y être associé au niveau soit des kystes intrarétiniens, soit adjacent (fig. 14-42 et 14-43). Ces DMC se développent volontiers dans des zones de préalables décollements séreux rétiniens chroniques avec développement d’une relative altération structurale de la rétine externe.
Les kystes intrarétiniens visualisés en OCT ne s’imprègnent pas de colorant en angiographie à la fluorescéine. Il n’y a pas d’œdème maculaire cystoïde central ni de diffusion anormale à partir des vaisseaux rétiniens (voir fig. 14-42). Il peut y avoir un ou plusieurs points de fuite focaux actifs mais on retrouvera plutôt les signes angiographiques de la CRSC chronique, c’est-à-dire des plages d’hyperfluorescence diffuse mal limitées, correspondant plutôt à une décompensation plus diffuse de l’EP. Il peut y avoir une hyperfluorescence précoce sans diffusion par effet fenêtre correspondant à des plages d’atrophie de l’EP et de la rétine externe, souvent associées à ces DMC [3].
L’angiographie ICG permet de confirmer le diagnostic de CRSC en mettant en évidence des plages multifocales d’hyperfluorescence correspondant à une hyperperméabilité de la choroïde interne et des veines choroïdiennes dilatées et hyperfluorescentes. L’intensité de ces plages hyperfluorescentes est maximale aux temps intermédiaires et s’atténue quasi complètement aux temps tardifs, permettant d’éliminer une plaque de néovascularisation occulte. Ainsi l’angiographie ICG est-elle également essentielle pour éliminer les principaux diagnostics différentiels en cas d’œdème intrarétinien associé à la CRSC : des néovaisseaux choroïdiens liés à la DMLA ou une vasculopathie polypoïdale choroïdienne. Elle aidera aussi à mettre en évidence dans certains cas des néovaisseaux ou polypes secondaires à la CRSC chronique elle-même.
La DMC dans la CRSC n’est pas liée à une rupture de la barrière hémato-rétinienne interne, car il n’y a pas d’anomalie angiographique des vaisseaux rétiniens et pas d’anomalie associée de la rétine interne en OCT. Par ailleurs, ces kystes semblent se développer dans les formes chroniques de la maladie avec une exsudation sous-rétinienne très prolongée qui peut générer une ischémie et une dégénérescence progressives de la rétine externe. Il semblerait que cet œdème soit plutôt lié à une rupture de la barrière hémato-rétinienne externe et à une infiltration passive de liquide à travers la barrière hémato-rétinienne externe lésée. La dégénérescence maculaire cystoïde semble être liée à des lésions irréversibles de la rétine externe et apparaît donc comme un facteur de mauvais pronostic visuel dès lors que la fovéa est atteinte.
Certains auteurs ont émis l’hypothèse que ces kystes intrarétiniens se développaient au niveau de zones d’adhérence pathologique entre la rétine et l’EP et la choroïde interne atrophiques. Ces adhérences pathologiques peuvent se former au niveau d’une zone préalablement touchée par une exsudation fibrineuse, d’une fibrose sous-rétinienne ou au niveau de larges cicatrices de laser thermique. Ces adhérences pathologiques seraient des zones de rupture irréversible de la barrière hémato-rétinienne externe facilitant le passage de liquide d’origine choroïdienne en intrarétinien [4].
La CRSC chronique et la DMLA néovasculaire partagent un certain nombre de signes cliniques et d’imagerie communs comme la présence de signes exsudatifs intrarétiniens, sous-rétiniens et sous l’EP, mais ont un pronostic et un traitement différents. Le tableau 14-7 précise les critères de l’examen clinique et du bilan d’imagerie qui orienteront plutôt vers un diagnostic de CRSC chronique ou de DMLA néovasculaire. De plus, la CRSC chronique peut se compliquer de vasculopathie polypoïdale ou de néovaisseaux choroïdiens secondaires [9].
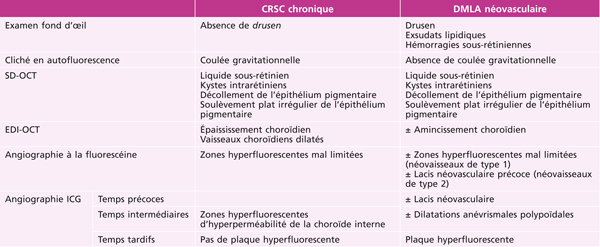
Tableau 14-7 Diagnostic différentiel entre CRSC chronique et DMLA néovasculaire.
La DMC est un facteur de mauvais pronostic visuel qui n’est généralement pas observé chez les patients qui ont pu récupérer un bon niveau d’acuité visuelle après leur première poussée [3]. Les facteurs de mauvais pronostic visuel dans la CRSC chronique incluent une atrophie de la rétine externe, une atrophie de l’EP centrale et une dégénérescence maculaire cystoïde.
La DMC peut présenter des fluctuations, une résolution ou des récurrences spontanées, comme les signes exsudatifs sous-rétiniens de la CRSC (voir fig. 14-42). Les études ont retrouvé des résultats contradictoires concernant l’évolution de la DMC après PDT à la vertéporfine. La présence de DMC a été notée comme un facteur prédictif de non-efficacité de la PDT demi-dose dans un groupe de 38 yeux de 37 patients atteints de CRSC chronique [6]. Dans cette étude, le taux de succès anatomique de la PDT demi-dose était d’environ 90 % après un suivi moyen de 14 mois. Les yeux avec DMC présentaient significativement plus de persistance et de récurrence de signes exsudatifs que ceux qui n’en présentaient pas. Le taux de succès anatomique était de 100 % pour les yeux sans DMC et 25 % pour les yeux avec DMC après un suivi moyen de 14 mois [6]. Dans une autre étude rétrospective sur 46 yeux de 42 patients suivis 4 ans, la PDT standard a permis d’obtenir une résolution complète des signes exsudatifs dans 93,4 % des cas et une résolution complète des signes exsudatifs intrarétiniens dans la totalité des 10 cas avec DMC [10].
[1] Wang M, Munch IC, Hasler PW, et al. Central serous chorioretinopathy. Acta Ophthalmol 2008 ; 86 : 126-45.
[2] Spaide RF, Campeas L, Haas A, et al. Central serous chorioretinopathy in younger and older adults. Ophthalmology 1996 ; 103 : 2070-9 ; discussion 2079-80.
[3] Iida T, Yannuzzi LA, Spaide RF, et al. Cystoid macular degeneration in chronic central serous chorioretinopathy. Retina 2003 ; 23 : 1-7 ; quiz 137-8.
[4] Piccolino FC, De La Longrais RR, Manea M, Cicinelli S. Posterior cystoid retinal degeneration in central serous chorioretinopathy. Retina 2008 ; 28 : 1008-12.
[5] Piccolino FC, De La Longrais RR, Manea M, et al. Risk factors for posterior cystoid retinal degeneration in central serous chorioretinopathy. Retina 2008 ; 28 : 1146-50.
[6] Nicolo M, Zoli D, Musolino M, Traverso CE. Association between the efficacy of half-dose photodynamic therapy with indocyanine green angiography and optical coherence tomography findings in the treatment of central serous chorioretinopathy. Am J Ophthalmol 2012 ; 153 : 474-480 e471.
[7] Kim YY, Flaxel CJ. Factors influencing the visual acuity of chronic central serous chorioretinopathy. Korean J Ophthalmol 2011 ; 25 : 90-7.
[8] Cornut PL, Quaranta-El Maftouhi M, Mauget-Faysse M. Photodynamic therapy for chronic central serous chorioretinopathy and diffuse retinal epitheliopathy. J Fr Ophtalmol 2012 ; 35 : 82-7.
[9] Fung AT, Yannuzzi LA, Freund KB. Type 1 (sub-retinal pigment epithelial) neovascularization in central serous chorioretinopathy masquerading as neovascular age-related macular degeneration. Retina 2012 ; 32 : 1829-37.
[10] Silva RM, Ruiz-Moreno JM, Gomez-Ulla F, et al. Photodynamic therapy for chronic central serous chorioretinopathy : a 4-year follow-up study. Retina 2013 ; 33 : 309-15.
L. Kodjikian, D. Bellocq
➤ L’origine médicamenteuse iatrogénique, systémique ou topique, représente une part non négligeable des causes d’œdème maculaire.
➤ Il est indispensable pour tout ophtalmologiste de savoir identifier ces anomalies et d’en connaître l’origine afin, d’une part, d’éviter une escalade d’examens diagnostiques et, d’autre part, de pouvoir mettre en place une démarche thérapeutique adéquate nécessitant souvent un arrêt précoce des traitements avant l’apparition d’altérations maculaires définitives.
L’origine médicamenteuse par l’administration de traitements systémiques ou locaux peut être incriminée dans la survenue d’un œdème maculaire cystoïde (OMC). L’objectif de ce sous-chapitre est de faire une revue la plus complète possible des différentes thérapeutiques à l’origine d’un œdème maculaire et d’en décrire pour chacune : l’incidence, les hypothèses physiopathologiques, les différentes manifestations et éventuellement les possibilités de prise en charge.
Le tamoxifène est un modulateur sélectif des récepteurs des œstrogènes utilisé sous forme orale dans le cancer du sein. Un traitement pendant 5 ans par le tamoxifène est indiqué dans le cancer mammaire en présence de récepteurs hormonaux, soit comme traitement palliatif du cancer mammaire métastasé, soit comme traitement hormonal adjuvant chez des femmes atteintes d’un carcinome mammaire primitif invasif.
Plusieurs effets secondaires généraux ont été rapportés suite à l’utilisation du tamoxifène : les accidents thrombo-emboliques, l’augmentation du risque de carcinome de l’endomètre ainsi qu’une majoration des effets secondaires néfastes de la ménopause. La toxicité rétinienne après traitement par tamoxifène est rare et apparaît dans environ 1,5 % des cas à la dose recommandée de 10 à 20 mg/jour [1] pendant 5 ans, et augmente probablement avec la majoration des doses.
Cette atteinte maculaire a été décrite pour la première fois par Kaiser-Kupfer et Lippman [2] sur une série de 3 cas présentant une baisse importante de l’acuité visuelle secondaire à un œdème maculaire suite à la prise de tamoxifène. Cette atteinte était associée à des dépôts intrarétiniens réfringents et des modifications de l’épithélium pigmentaire rétinien de siège maculaire et paramaculaire (fig. 14-44).
D’autres séries ont retrouvé une toxicité rétinienne du tamoxifène. Gorin et al. [3] ont retrouvé 7 cas d’œdème maculaire après une dose faible de tamoxifène dans une série de 205 cas. Une série prospective sur 63 yeux a retrouvé 4 cas de maculopathie après dose faible de tamoxifène [4] où les auteurs décrivent les mêmes anomalies, c’est-à-dire la présence d’un œdème maculaire associé à des dépôts intrarétiniens réfringents.
Gualino et al. ont également retrouvé une toxicité après administration de tamoxifène, avec à l’OCT présence de lésions hyporéflectives intrarétiniennes, et interruption de la ligne des photorécepteurs [5], ce qui souligne également le potentiel atrophique d’un traitement par tamoxifène.
Cette donnée a été confirmée par la suite par la série de Park avec l’utilisation de spectral-domain optical coherence tomography (SD-OCT) haute résolution qui retrouvait des altérations kystiques de la couche nucléaire interne jusqu’à la couche ellipsoïde avec perte des photorécepteurs (fig. 14-45).
En cas d’atteinte hyporéflective pseudo-kystique, l’angiographie à la fluorescéine ne retrouve pas de diffusion maculaire.
L’origine physiopathologique est incertaine. Le tamoxifène agirait comme un antagoniste des transporteurs du glutamate des cellules de l’épithélium pigmentaire [6], entraînant alors une surcharge de glutamate au niveau rétinien à l’origine d’un dysfonctionnement des cellules de Müller et d’une dégénérescence axonale responsable de l’atrophie et de la formation de cavités intrarétiniennes. Il s’agirait semble-t-il de cavités cystoïdes fovéolaires vides, sans véritable œdème maculaire (absence de diffusion à l’angiographie).
L’évolution est incertaine, avec persistance [7] ou résolution [8] des altérations maculaires après l’arrêt du traitement. Certaines séries ont également montré le bénéfice d’injection intravitréenne hors autorisation de mise sur le marché (AMM) d’anti-VEGF [9].
En résumé, l’atteinte ophtalmologique ne doit pas être un obstacle à l’utilisation du tamoxifène. Une évaluation ophtalmologique lors de la mise en place du traitement associée à un suivi régulier est suffisante, sachant que l’atteinte fonctionnelle se manifeste tardivement par rapport aux premières altérations visibles à l’OCT.
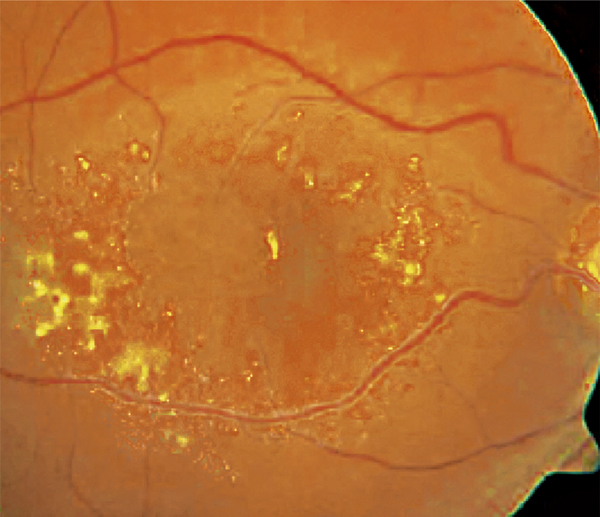
Fig. 14-44 Rétinopathie au tamoxifène : présence de dépôts intrarétiniens réfringents et modifications de l’épithélium pigmentaire rétinien.
(Source : Mittra RA, Mieler F. Drug Toxicity ot the posterior segment. In : Ryan SJ. Dir. Retina. Volume 2. 4th ed. Mosby ; 2006, chap. 108 : p. 1839-56. Reproduction autorisée.)

Fig. 14-45 Rétinopathie au tamoxifène, coupe SD-OCT.
Altérations kystiques de la couche nucléaire interne jusqu’à la couche ellipsoïde avec perte des photorécepteurs.
OCT : optical coherence tomography, SD : spectral domain.
(Source : Mittra RA, Mieler F. Drug Toxicity ot the posterior segment. In : Ryan SJ. Dir. Retina. Volume 2. 4th ed. Mosby ; 2006, chap. 108 : p. 1839-56. Reproduction autorisée.)
Les taxanes sont une classe de diterpènes très utilisés en tant qu’agents chimiothérapeutiques. Cette classe comprend le paclitaxel (taxol) et le docétaxel (taxotère). Ils inhibent la fonction des microtubules qui est essentielle pour la division cellulaire ; les taxanes bloquent donc la division normale des cellules.
Certains cas cliniques ont souligné la présence d’une toxicité rétinienne des taxanes. Ils seraient à l’origine d’un œdème maculaire bilatéral (fig. 14-46) symptomatique, caractérisé à l’OCT par une accumulation de liquide intrarétinien prédominant au niveau de la couche plexiforme externe sans traduction angiographique [10, 11]. Murphy et al. ont décrit deux cas de toxicité maculaire au paclitaxel caractérisés par la présence de liquide intrarétinien d’évolution favorable, 3 semaines à 3 mois après l’arrêt du traitement (fig. 14-46) [11]. L’origine physiopathologique est incertaine : il s’agirait d’une toxicité directe des taxanes sur les cellules de Müller [12] à l’origine d’une accumulation de liquide intrarétinien. Plus récemment, une altération du fonctionnement des microtubules au niveau de l’épithélium pigmentaire rétinien a été décrite [13].
Des séries ont décrit l’efficacité de la prise orale d’acétazolamide associé ou non à un traitement topique par anti-inflammatoire non stéroïdien (AINS) lorsque l’arrêt des taxanes n’était pas possible [14]. Murphy et al. ont montré l’efficacité d’une association de collyre AINS et corticoïde [11] dans la résolution de l’œdème maculaire. L’utilisation de corticoïdes par voie générale (prednisolone) ou intravitréenne (triamcinolone) n’a pas cependant montré d’efficacité dans la disparition de cet œdème maculaire.
En résumé, une évaluation ophtalmologique sera nécessaire en cas de plaintes fonctionnelles suite à la prise de taxanes. La décision thérapeutique doit alors être collégiale.
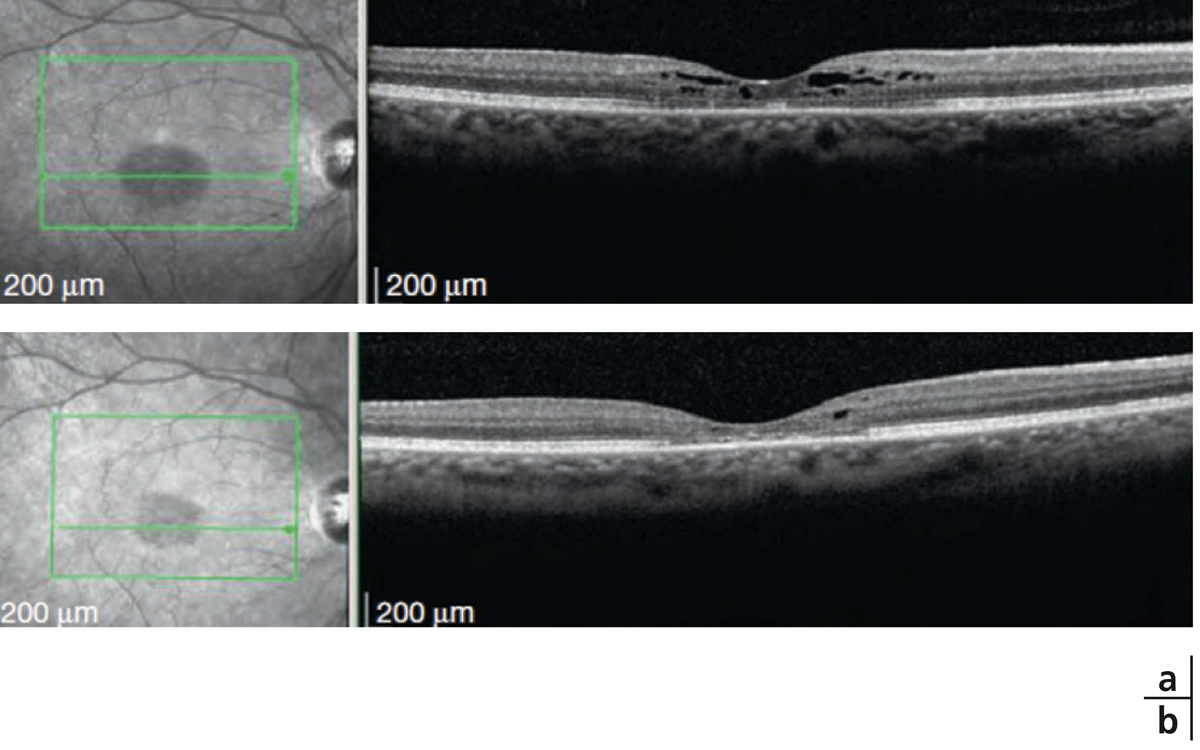
Fig. 14-46 Rétinopathie au taxane, coupe SD-OCT.
Présence de logettes d’OMC sur la coupe OCT (a). Résolution quasi totale de l’œdème à l’arrêt du traitement mais présence d’une atrophie maculaire minime (b).
(Source : Mittra RA, Mieler F. Drug Toxicity ot the posterior segment. In : Ryan SJ. Dir. Retina. Volume 2. 4th ed. Mosby ; 2006, chap. 108 : p. 1839-56. Reproduction autorisée.)
Le fingolimod (FTY720) est un médicament modulateur des récepteurs de la sphingosine-1-phosphate. Initialement, le fingolimod était utilisé comme immunomodulateur après greffe rénale. L’étude pivot retrouvait un œdème maculaire à 1 an dans 1,3 % et 2,2 % pour des doses respectivement de 2,5 mg/j et 5 mg/j [15].
À ce jour, le fingolimod est un traitement recommandé pour le traitement de la sclérose en plaques. Deux essais cliniques de phase 3 ont retrouvé des altérations maculaires après un traitement au long cours oscillant de 0 à 1,6 % selon les doses et les essais [16, 17]. L’association semble être dose dépendante, avec un délai moyen d’apparition au-delà du 3e mois et une résolution spontanée à l’arrêt du traitement. Le risque de toxicité maculaire est également majoré en cas de comorbidités associées telles qu’un terrain diabétique ou uvéitique [15]. L’origine physiopathologique serait une altération au niveau de la perméabilité vasculaire suite à la dégradation du récepteur sphingosine-1-phosphate 1.
Il n’existe pas de consensus sur la prise en charge de cet œdème maculaire. Saab et al. ont décrit une résolution totale de l’œdème 2 mois après l’arrêt du traitement [18]. Liu et al. ont décrit un cas de résolution après 3 mois d’arrêt associé à un traitement par AINS topique et collyre corticoïde (prednisone 1 %) [19].
En pratique, selon les recommandations de la Food Drug Administration (FDA) américaine, il est nécessaire de faire un bilan ophtalmique avant la mise en place d’un traitement par fingolimod puis une évaluation entre le 3e et le 4e mois, ou plus précocement en cas de plaintes fonctionnelles.
Le thiazolidinedione est un antidiabétique oral qui augmente la sensibilité de l’insuline au niveau des muscles, de la graisse et du foie. Il était auparavant un traitement de seconde intention chez les diabétiques de type 2, mais a été retiré du marché français en 2011 suite aux nombreux effets secondaires systémiques.
La série de Ryan, réalisée chez 30 patients, a montré une aggravation de l’œdème maculaire après introduction du thiazolidinedione avec une incidence de 1,5 à 2,6 % [20], ainsi qu’une amélioration de l’œdème après arrêt du traitement sans laser ou injection d’anti-VEGF. La série rétrospective la plus récente sur 103 369 patients a montré une association entre le traitement par thiazolidinedione et la survenue d’un œdème maculaire après ajustement des facteurs de confusion [21]. D’autres séries n’ont cependant pas retrouvé de liens avec la survenue de l’œdème maculaire.
En conclusion, il n’est pas possible à ce jour de conclure sur le rôle du thiazolidinedione dans la survenue de l’œdème maculaire.
L’acide nicotinique, appelé également niacine, inhibe la libération des acides gras libres à partir du tissu adipeux, ce qui pourrait contribuer à la diminution des taux de lipides sériques et de cholestérol ainsi qu’à une augmentation du high density lipoprotein cholesterol (HDL-cholestérol).
Gass a été le premier à décrire l’existence d’une maculopathie secondaire à l’acide nicotinique. Dans une série rétrospective chez les patients traités par hypolipémiants, ceux traités par acide nicotinique ont un taux plus important de maculopathie [22]. L’incidence de maculopathie par acide nicotinique est estimée à 0,67 % [22]. Typiquement, l’œdème maculaire est cystoïde avec de nombreuses cavités cystoïdes intrarétiniennes sans diffusion à l’angiographie. D’un point de vue physiopathologique, Spirn et al. ont supposé une atteinte toxique directe de l’acide nicotinique sur la barrière hémato-rétinienne [23].
L’atteinte semble être bilatérale et se manifeste à partir d’une posologie quotidienne de 1,5 g/jour [22] avec une évolution spontanément favorable à l’arrêt du traitement.
Les interférons (IFN) sont des glycoprotéines de la famille des cytokines. Ils sont, notamment, produits par les cellules du système immunitaire. Ils sont utilisés dans le traitement de maladies virales mais également en cancérologie.
La complication oculaire la plus fréquente est la rétinopathie caractérisée par des hémorragies prérétiniennes et des nodules cotonneux. Plusieurs cas de maculopathies aux interférons ont été décrits après IFN-α [24], IFN-α [24] et IFN-α pégylé [25], dans le cadre d’un traitement pour hépatite C.
Dans cinq cas sur six, l’œdème maculaire était associé à la présence d’une rétinopathie aux IFN. Le délai de survenue de l’œdème maculaire était compris entre 6 à 48 semaines après le début du traitement. Tous les patients présentaient une baisse de l’acuité visuelle. L’arrêt du traitement s’est traduit par la disparition de l’œdème dans 100 % des cas, avec récupération fonctionnelle dans 80 % des cas [25].
L’origine physiopathologique est inconnue. Le rôle de l’hypo-albuminémie et de la thrombocytopénie a été suspecté face à la disparition de l’œdème maculaire après correction de ces marqueurs biologiques dans 50 % des cas.
La zidovudine, médicament antirétroviral, le premier utilisé pour le traitement de l’infection par le virus de l’immunodéficience humaine (VIH), est un inhibiteur nucléosidique de la transcriptase inverse. Elle a été reconnue comme responsable d’un œdème maculaire bilatéral chez un patient VIH, cet œdème maculaire étant réapparu après réintroduction du traitement [26].
La survenue d’un œdème maculaire a également été décrite après traitement par rifabutine [27].
L’acitrétine est un rétinoïde (dérivé de la vitamine A). Il est indiqué dans les pathologies cutanées telles que le psoriasis et peut entraîner un œdème maculaire bilatéral associé à des anomalies de l’épithélium pigmentaire [28].
D’autres thérapeutiques, comme l’imatinib (mésilate d’imatinib ou mésylate d’imatinib, médicament utilisé pour traiter certains types de cancer), le fluconazole (antifongique) ou encore le rituximab (anticorps monoclonal chimérique dirigé contre la molécule de surface CD20) ont été reconnus comme à l’origine d’un œdème maculaire avec disparition de cet œdème à l’arrêt du traitement.
L’anti-MEK est une nouvelle thérapie ciblée utilisée dans le traitement des métastases de mélanomes cutanés. Cette thérapie, qui vient d’obtenir une autorisation temporaire d’utilisation (ATU), présente une toxicité ophtalmologique importante décrite dans plusieurs cas cliniques avec notamment apparition d’occlusion veineuse rétinienne œdémateuse ou encore des cas de DSR [29].
Enfin la corticothérapie systémique peut être à l’origine de choriorétinite séreuse centrale responsable d’anomalies maculaires à type principalement de DSR. Cette pathologie, liée à une hyperperméabilité de la circulation choroïdienne, reste de physiopathologie encore mal connue, mais il semblerait que cette anomalie soit plus fréquente en cas de taux élevé de cortisol. Une corticothérapie systémique peut donc être à l’origine du problème ; habituellement on assiste à une amélioration des symptômes lors de la décroissance de la posologie.
Un suivi ophtalmologique semble donc nécessaire dans ces indications thérapeutiques.
Les analogues des prostaglandines sont utilisés dans le traitement du glaucome. Ils permettent de diminuer la pression intra-oculaire en agissant sur la voie uvéosclérale. Les prostamides agissent également sur la voie trabéculaire. De nombreux effets secondaires sont connus après l’utilisation de ces collyres, comme l’irritation conjonctivale, la modification de la pigmentation irienne et l’hypertrichose. La survenue d’un œdème maculaire après l’utilisation de latanoprost ou bimatoprost a également été décrite dans de nombreuses publications [30, 31]. La série de Schumer, étude de phase III, retrouve une incidence d’OMC de 0,7 % après utilisation de latanoprost [30]. D’autres séries ont décrit une récidive de l’OMC après réintroduction du latanoprost [31], œdème initialement guéri après interruption du traitement local. La série de Warwar réalisée sur 136 yeux a retrouvé une incidence de 1,2 % [32]. Cependant, dans ces séries, d’autres nombreux facteurs pouvant altérer la barrière hémato-rétinienne étaient présents comme une rupture capsulaire et une pathologie inflammatoire, rendant alors difficile d’établir une relation entre la survenue d’un œdème maculaire après utilisation de ce type de collyres. La série de Hoyng a évalué la survenue d’un œdème maculaire chez des patients traités par latanoprost sans atteinte de la barrière hémato-rétinienne, et a retrouvé une incidence minime de 0,006 % [33]. Sur une série prospective réalisée en insu sur 145 yeux traités par latanoprost, seul un cas d’OMC a été décrit chez un patient pseudophaque sans altération de la capsule postérieure.
Ces différentes études montrent donc la très faible incidence de l’œdème maculaire après administration d’analogues des prostaglandines ou de prostamides, même si l’incidence semble légèrement plus importante en cas de rupture préalable de la barrière hémato-rétinienne. Il n’existe pas de consensus sur la démarche à mettre en place en postopératoire chez les patients traités par ces collyres, certains praticiens préférant interrompre ce traitement en cas de facteurs de risque surajoutés d’œdème maculaire.
L’épinéphrine est utilisée comme un agent antiglaucomateux mais également en tant qu’agent mydriatique. La survenue d’un œdème maculaire après administration d’épinéphrine a été décrite dans plusieurs séries chez des patients aphakes. La série de Kolker [34] a rapporté l’apparition de maculopathie à l’épinéphrine caractérisée par une diffusion à l’angiographie à la fluorescéine similaire à celle du syndrome d’Irvine-Gass. Dans sa série, Thomas [35] retrouve une incidence d’œdème maculaire angiographique de 28 % après l’administration d’épinéphrine chez les patients aphakes.
Il semblerait que l’épinéphrine entraîne la sécrétion de prostaglandines endogènes favorisant la formation de l’œdème maculaire en cas de rupture de la barrière hémato-rétinienne. Ainsi, une série plus récente n’a pas retrouvé de lien entre œdème maculaire et collyre épinéphrine qu’en cas de barrière hémato-rétinienne intacte.
Un résumé des différentes atteintes œdémateuses maculaires d’origine médicamenteuse est proposé dans le tableau 14-8.
L’œdème maculaire d’origine médicamenteuse représente une complication probablement sous-diagnostiquée car :
il n’existe pas toujours de suivi ophtalmologique dans le cadre de ces traitements ;
l’atteinte est souvent infraclinique et difficilement identifiable à l’examen du fond d’œil.
L’avènement de l’OCT facilite certainement le diagnostic de ces atteintes infracliniques. L’apparition de plaintes fonctionnelles justifie l’examen ophtalmologique pour éviter une atrophie maculaire décrite dans les suites de certains traitements. Il est également important de réaliser une déclaration de pharmacovigilance afin que ces effets indésirables ne restent pas méconnus des différents praticiens.

Tableau 14-8 Résumé des différentes atteintes œdémateuses maculaires d’origine médicamenteuse.
[1] Heier J, Dragoo R, Enzenaouer R, WaterhousW. Screening for ocular toxicity in asymptomatic patients treated tamoxifen. Am J Ophthamol 1994 ; 117 : 112-3.
[2] Kaiser-Kupfer MI, Lippman ME. Tamoxifen retinopathy. Cancer Treat Rep 1978 ; 62 : 315-20.
[3] Gorin MB, Day R, Costantino JP, et al. Long-term tamoxifen citrate use and potential ocular toxicity. Am J Ophthalmol 1998 ; 125 : 493-501.
[4] Pavlidis NA, Petris C, Briassoulis E, et al. Clear evidence that long-term, lowdose tamoxifen treatment can induce ocular toxicity. A prospective study of 63 patients. Cancer 1992 ; 69 : 2961-4.
[5] Gualino V, Cohen SY, Delyfer MN, et al. Optical coherence tomography findings in tamoxifen retinopathy. Am J Ophthalmol 2005 ; 140 : 757-8.
[6] Mäenpää H, Mannerström M, Toimela T, et al. Glutamate uptake is inhibited by tamoxifen and toremifene in cultured retinal pigment epithelial cells. Pharmacol Toxicol 2002 ; 91 : 116-22.
[7] McKeown CA, Swartz M, Blom J, Maggiano JM. Tamoxifen retinopathy. Br J Ophthalmol 1981 ; 65 : 177-9.
[8] Griffiths MF. Tamoxifen retinopathy at low dosage. Am J Ophthalmol 1987 ; 104 : 185-6.
[9] Bourla DH, Gonzales CR, Mango CW, et al. Intravitreous vascular endothelial growth factor (VEGF) inhibitor therapy for tamoxifen induced macular edema. Semin Ophthalmol 2007 ; 22 : 87-8.
[10] Smith SV, Benz MS, Brown DM. Cystoid macular edema secondary to albumin-bound paclitaxel therapy. Arch Ophthalmol 2008 ; 126 : 1605-6.
[11] Murphy CG, Walsh JB, Hudis CA, et al. Cystoid macular edema secondary to nab-paclitaxel therapy. J Clin Oncol 2010 ; 28 : 684-7.
[12] Joshi MM, Garretson BR. Paclitaxel maculopathy. Arch Ophthalmol 2007 ; 125 : 709-10.
[13] Ham DS, Lee JE, Kim HW, Yun IH. A case of cystoid macular edema associated with paclitaxel chemotherapy. Korean J Ophthalmol 2012 ; 26 : 388-90.
[14] Meyer KM, Klink T, Ugurel S, Bröcker EB. Regression of paclitaxel-induced maculopathy with oral acetazolamide. Graefes Arch Clin Exp Ophthalmol 2012 ; 250 : 463-4.
[15] Salvadori M, Budde K, Charpentier B, et al. ; FTY720 0124 Study Group. FTY720 versus MMF with cyclosporine in de novo renal transplantation : a 1-year, randomized controlled trial in Europe and Australasia. Am J Transpl 2006 ; 6 : 2912-21.
[16] Cohen JA, Barkhof F, Comi G, et al. ; TRANSFORMS Study Group. Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 2010 ; 362 : 402-15.
[17] Kappos L, Radue EW, O’Connor P, et al. ; FREEDOMS Study Group. A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 2010 ; 362 : 387-401.
[18] Saab G, Almony A, Blinder KJ, et al. Reversible cystoid macular edema secondary to fingolimod in a renal transplant recipient. Arch Ophthalmol 2008 ; 126 : 140-1.
[19] Liu L, Cuthbertson F. Early bilateral cystoid macular oedema secondary to fingolimod in multiple sclerosis. Case Rep Med 2012 ; 2012 : 134636.
[20] Ryan EH Jr, Han DP, Ramsay RC, et al. Diabetic macular edema associated with glitazone use. Retina 2006 ; 26 : 562-70.
[21] Idris I, Warren G, Donnelly R. Association between thiazolidinedione treatment and risk of macular edema among patients with type 2 diabetes. Arch Intern Med 2012 ; 172 : 1005-11.
[22] Fraunfelder FW, Fraunfelder FT, Illingworth DR. Adverse ocular effects associated with niacin therapy. Br J Ophthalmol 1995 ; 79 : 54-6.
[23] Spirn MJ, Warren FA, Guyer DR, et al. Optical coherence tomography findings in nicotinic acid maculopathy. Am J Ophthalmol 2003 ; 135 : 913–4.
[24] Shimura M, Saito T, Yasuda K, Tamai M. Clinical course of macular edema in two cases of interferon-associated retinopathy observed by optical coherence tomography. Jpn J Ophthalmol 2005 ; 49 : 231-4.
[25] Sheth HG, Michaelides M, Siriwardena D. Cystoid macular edema and visual loss as sequelae to interferon alpha treatment of systemic hepatitis C. Indian J Ophthalmol 2010 ; 58 : 147-8.
[26] Lalonde RG, Deschênes JG, Seamone C. Zidovudine-induced macular edema. Ann Intern Med 1991 ; 114 : 297-8.
[27] Vaudaux JD, Guex-Crosier Y. Rifabutin-induced cystoid macular oedema. J Antimicrob Chemother 2002 ; 49 : 421-2.
[28] Lois N, White M. Acitretin-associated maculopathy. Arch Ophthalmol 2004 ; 122 : 928-30.
[29] Urner Bloch U, Urner M. Transient MEK inhibitor associated retinopathy in metastatic melanoma. Ann Oncol 2014 ; 25 : 1437-41.
[30] Schumer RA, Camras CB, Mandahl AK. Latanoprost and cystoid macular edema : is there a causal relation ? Curr Opin Ophthalmol 2000 ; 11 : 94-100.
[31] Rowe JA, Hattenhauer MG, Herman DC. Adverse side effects associated with latanoprost. Am J Ophthalmol 1997 ; 124 : 683-5.
[32] Warwar RE, Bullock JD, Ballal D. Cystoid macular edema and anterior uveitis associated with latanoprost use. Experience and incidence in a retrospective review of 94 patients. Ophthalmology 1998 ; 105 : 263-8.
[33] Hoyng PF, Rulo AH, Greve EL, et al. Fluorescein angiographic evaluation of the effect of latanoprost treatment on blood–retinal barrier integrity : a review of studies conducted on pseudophakic glaucoma patients and on phakic and aphakic monkeys. Surv Ophthalmol 1997 ; 41 : S83-8.
[34] Kolker AE, Becker B. Epinephrine maculopathy. Arch Ophthalmol 1968 ; 79 : 552-62.
[35] Thomas JV, Gragoudas ES, Blair NP, Lapus JV. Correlation of epinephrine use and macular edema in aphakic glaucomatous. Arch Ophtalmol 1978 ; 96 : 625-8.
F. Metge-Galatoire, R. Despréaux
➤ La maladie de Coats se caractérise typiquement par la survenue chez un jeune garçon de télangiectasies vasculaires rétiniennes le plus souvent unilatérales avec exsudation rétinienne.
➤ Les télangiectasies rétiniennes restent souvent périphériques et l’œdème maculaire est une complication rare.
➤ Le principal diagnostic différentiel est le rétinoblastome.
➤ Le traitement au laser, parfois associé aux anti-VEGF, donne de bons résultats sur le plan anatomique.
➤ La baisse de vision est liée à l’atteinte maculaire ou à un décollement de rétine de mauvais pronostic.
➤ Le traitement d’un OMC repose souvent sur l’association d’un traitement par photocoagulation au laser et d’anti-VEGF.
➤ Une surveillance prolongée est nécessaire en raison de la possibilité de reprises évolutives tardives.
L’œdème maculaire cystoïde des enfants prématurés est infraclinique, bilatéral et fréquent. Il se résorbe le plus souvent spontanément et n’est pas forcément corrélé au stade de rétinopathie des prématurés (ROP). Sa présence ou non n’empêche pas le dépistage de la ROP et ne modifie pas ses indications thérapeutiques. De plus, des anomalies fovéolaires persistent dans le temps, avec souvent présence d’une épaisseur fovéolaire plus importante, sans corrélation avec l’acuité visuelle.
Décrite au début du xxe siècle par Coats et Leber [1], la maladie de Coats se caractérise par la présence de télangiectasies vasculaires rétiniennes, responsables d’une exsudation intra- et sous-rétinienne, sans signes de traction vitréorétinienne [2]. Cette pathologie concerne plus fréquemment l’enfant que l’adulte. Elle est sporadique, supposée congénitale mais sans caractère familial et affecte typiquement le garçon, de façon unilatérale [2]. Cliniquement, la maladie de Coats se présente de manière très variable en fonction de l’étendue des anomalies vasculaires : de la découverte systématique de télangiectasies asymptomatiques chez l’adulte au décollement de rétine total chez le jeune enfant lorsque l’exsudation est très importante.
La maladie de Coats a pu être décrite dès l’âge de 3 mois et affecte les garçons plus souvent que les filles avec une sex-ratio supérieure à 3/1 ; l’atteinte est unilatérale dans plus de 75 % des cas. L’étiologie de la maladie de Coats reste aujourd’hui inconnue ; son origine génétique n’a pas été établie même si certains auteurs suspectent une mutation dans le gène en cause dans la maladie de Norrie (NDP gene) situé sur le chromosome Xp11.2 [3]. Le caractère unilatéral de la maladie reste inexpliqué ; sa pathogénie met en cause une raréfaction présumée congénitale des péricytes et des cellules endothéliales avec pour conséquence une altération de la barrière hémato-rétinienne à l’origine de l’exsudation [4]. La raréfaction et la dilatation du lit capillaire rétinien, associées à la présence de télangiectasies et parfois de dilatations anévrismales des gros vaisseaux, en particulier artériels, sont caractéristiques de cette maladie [5]. L’accumulation progressive de matériel lipoprotéique en intrarétinien aboutirait à la rupture de la limitante externe et à la diffusion des exsudats et de liquide exsudatif sous la rétine pour aboutir à la constitution, dans les cas extrêmes, d’un décollement de rétine (DR) exsudatif, d’autant plus rapide et important que les anomalies vasculaires rétiniennes sont étendues [2, 6].
L’âge moyen de diagnostic de la maladie se situe vers 10 ans, dans les deux premières décades de la vie le plus souvent. Un diagnostic précoce de la maladie, habituellement fait sur des signes indirects d’amblyopie (strabisme) ou de DR (leucocorie), témoigne d’une forme plus évolutive avec des anomalies vasculaires diffuses. De nombreuses études ont montré que plus le diagnostic était fait tôt, plus le tableau clinique était grave témoignant d’une forme plus évolutive de la maladie avec un risque majoré d’énucléation [2, 7-9]. Ainsi, le DR qui est le stade le plus évolué de la maladie concerne les enfants de moins de 5 ans avec un pic de fréquence avant 3 ans [2, 10, 11]. Chez l’enfant plus grand, le diagnostic pourra se faire devant une baisse d’acuité visuelle, en rapport avec l’accumulation d’exsudats au niveau de la macula, ou plus rarement la présence d’un œdème maculaire cystoïde (OMC). C’est parfois un examen systématique qui permet le diagnostic dans les formes mineures où l’exsudation n’atteint pas le pôle postérieur.
Les télangiectasies rétiniennes (fig. 14-47) sont le plus souvent localisées dans le quadrant inférotemporal mais peuvent s’étendre à tous les quadrants et dans un tiers des cas en arrière de l’équateur. Elles n’affectent que rarement l’aire maculaire (< 5 % des cas) [2]. C’est dans ces formes postérieures qu’un œdème maculaire cystoïde peut être observé. Les exsudats, qui sont visibles tout d’abord autour des télangiectasies, s’accumulent secondairement dans l’aire maculaire et en position rétrofovéolaire (fig. 14-48), même lorsque les télangiectasies sont périphériques, en raison de la position dos à plat maintenue de façon particulièrement prolongée chez les jeunes enfants notamment pendant le sommeil. Aucun signe inflammatoire n’est associé à la maladie (pas de Tyndall vitréen, pas d’œdème papillaire).
En angiographie (fig. 14-49), la raréfaction du lit capillaire rétinien, associée à la présence de télangiectasies plus ou moins diffusantes et à des territoires de non-perfusion périphérique, est caractéristique de la maladie. Cette absence de vascularisation périphérique supposée congénitale dans le territoire jouxtant les télangiectasies, qui donne un aspect noir de la rétine en angiographie, ne paraît pas correspondre à une ischémie rétinienne caractérisée, car il n’est jamais constaté de néovascularisation secondaire spontanée à ce niveau ; les exsudats non visibles directement en angiographie masquent le fond choroïdien. Un œdème maculaire peut être visible en particulier en présence de télangiectasies postérieures ce qui n’est pas le cas le plus fréquent ; l’OMC est donc une complication relativement rare de la maladie de Coats et concerne assez exceptionnellement le jeune enfant.
L’atteinte maculaire est mieux évaluée en OCT qui permet de faire la différence entre une fluorescence fibrovasculaire d’exsudat vieilli, associé à une atrophie maculaire (fig. 14-50) ou un œdème maculaire cystoïde. L’OCT peut également permettre la visualisation d’un DR infraclinique.
La maladie est d’autant plus évolutive que l’atteinte vasculaire est plus importante et peut aboutir à la constitution d’un décollement de rétine exsudatif qui s’étend progressivement, devient total, bulleux puis rétrocristallinien (fig. 14-51). Un glaucome néovasculaire (GNV), secondaire au DR chronique, peut se constituer dans environ 10 % des cas [2]. Le DR peut pousser le cristallin vers l’avant et être responsable d’une hypothalamie puis d’une athalamie avec opacification cornéenne secondaire lorsque le cristallin touche la cornée. À ce stade (GNV, athalamie), l’énucléation ou l’éviscération deviennent nécessaires.
Une classification de la maladie de Coats a été proposée par Shields (encadré 14-2
• Stade 1 = télangiectasies isolées.
• Stade 2 = télangiectasies et exsudation :
■ exsudation extrafovéolaire ;
■ exsudation rétrofovéolaire.
• Stade 3 = décollement de rétine exsudatif :
■ A = décollement de rétine subtotal :
– extramaculaire,
– macula décollée ;
■ B = décollement de rétine total.
• Stade 4 = décollement de rétine total et glaucome.
• Stade 5 = stade terminal de la maladie.
) [9].
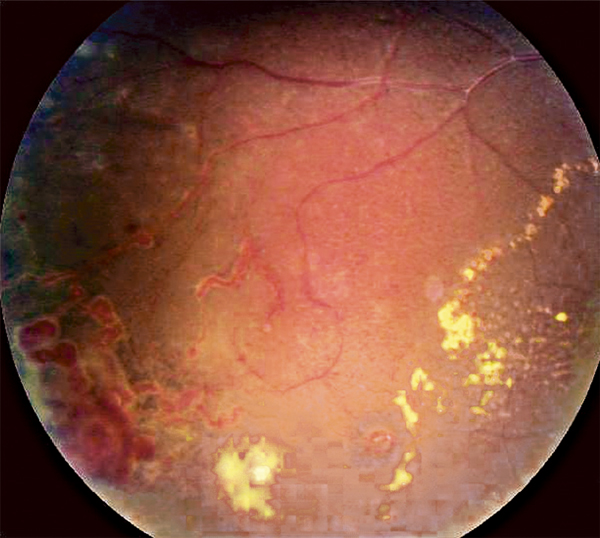
Fig. 14-47 Volumineuses télangiectasies périphériques temporales avec présence d’hémorragies et d’exsudats.

Fig. 14-48 Gros exsudat rétrofovéolaire.
Les télangiectasies responsables de l’exsudation sont périphériques et ne sont pas directement visibles sur ce cliché centré sur le pôle postérieur.
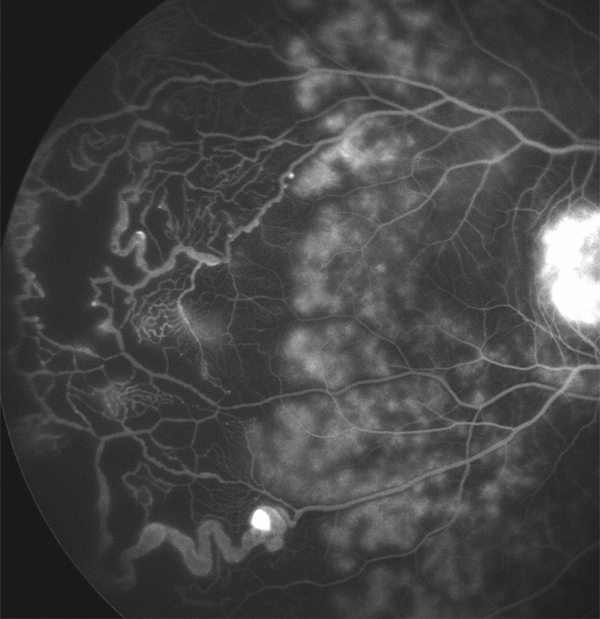
Fig. 14-49 En angiographie à la fluorescéine, on visualise les télangiectasies (dont une très volumineuse) et la raréfaction du lit capillaire rétinien.

Fig. 14-50 En OCT, présence d’une fibrose sous-rétinienne avec atrophie maculaire.
Pas d’OMC, car les télangiectasies sont périphériques.

Fig. 14-51 Décollement de rétine total sur maladie de Coats.
Les anomalies vasculaires sont nettement visibles. Une imagerie sera néanmoins systématique chez cet enfant de 2 ans pour éliminer formellement le diagnostic de rétinoblastome.
La présence d’anomalies vasculaires associées à des exsudats doit amener à la réalisation d’une angiographie fluorescéinique ; son aspect caractéristique permet en général de poser le diagnostic. Il en est autrement lorsqu’un décollement de rétine existe car, dans ces cas, le jeune âge habituel des enfants (< 5 ans) impose d’éliminer le diagnostic de rétinoblastome par des examens d’imagerie (échographie, TDM). Dans la maladie de Coats, on ne note pas de masse tumorale et les calcifications évocatrices de rétinoblastome sont absentes.
En écho-Doppler couleur, la rétine décollée apparaît épaissie avec un débit vasculaire élevé, ce qui est inhabituel dans les décollements de rétine d’autre origine.
Le pronostic visuel de la maladie de Coats est relativement bon tant que la macula est épargnée par les exsudats ; en cas de télangiectasies postérieures compliquées d’OMC, le pronostic est relativement favorable si les télangiectasies sont suffisamment éloignées du centre de la macula pour être accessibles au laser. Le pronostic bascule lorsque les exsudats, secondaires à la diffusion des anomalies vasculaires périphériques, précipitent derrière la macula ; en effet, dans cette localisation, en l’absence de traitement rapide, les exsudats ont tendance à se fibroser laissant des séquelles visuelles irréversibles.
Le pronostic visuel est également très mauvais en cas de DR exsudatif, cependant, la nécessité de traiter ces DR est justifiée par les complications trophiques qu’ils entraînent et qui peuvent nécessiter une éviscération à terme.
Le but du traitement est de réduire ou idéalement de supprimer les phénomènes exsudatifs en agissant sur les anomalies vasculaires.
La cryothérapie a été le traitement le plus utilisé au cours des deux dernières décennies, mais comme en témoigne la grande série rétrospective de Shields [9], le traitement au laser des télangiectasies a pris une importance progressivement croissante et est actuellement le traitement de choix tous stades confondus [12–15]. La cryothérapie est aujourd’hui utilisée en deuxième intention ou comme traitement adjuvant du laser ou de procédures chirurgicales complexes. Elle ne peut être efficace que sur une rétine non décollée.
Le traitement laser consiste à occlure sélectivement les télangiectasies vasculaires; sa cible d’absorption est le pigment rouge de l’hémoglobine du sang circulant dans les dilatations vasculaires et il n’est pas nécessaire que la rétine soit à plat pour que le laser soit efficace sur sa cible vasculaire [13]. La longueur d’onde jaune est théoriquement la plus adaptée car très bien absorbée par le rouge pour de faibles puissances d’émission ; en pratique, la longueur d’onde couramment utilisée est le vert (532 nm) du laser argon ou YAG doublé. Son absorption est très satisfaisante pour des puissances relativement peu élevées. L’utilisation du laser diode (810 nm) est également possible à des puissances légèrement supérieures en raison d’une absorption moindre [15]. L’occlusion des télangiectasies nécessite un temps d’exposition assez long de 0,5 à 2 secondes pour une puissance entraînant un blanchiment franc de la zone à occlure. Il est recommandé d’effectuer si nécessaire plusieurs photocoagulations d’un même vaisseau à quelques minutes d’intervalle pour minimiser le risque de reperméabilisation secondaire.
Il n’est théoriquement pas nécessaire de réaliser de photocoagulation rétinienne autour des télangiectasies pour traiter l’exsudation car, nous l’avons vu, la rétine avasculaire n’est pas ischémique à proprement parler ; cependant, l’occlusion des télangiectasies par le laser, si celles-ci sont étendues, provoque une ischémie rétinienne secondaire qui rend utile la photocoaguation rétinienne en aval des anomalies vasculaires traitées, pour éviter l’apparition d’une néovascularisation secondaire.
La résorption des exsudats et du liquide sous-rétinien en cas de DR est longue. Le résultat anatomique du traitement laser est apprécié au bout de 3 à 5 mois ; un retraitement ne sera envisagé qu’après un minimum de 3 mois (fig. 14-52).
Lorsque les anomalies vasculaires sont étendues sur plus de deux quadrants, il est plus souvent nécessaire de répéter le traitement [16] ; les résultats du traitement sont satisfaisants sur le plan fonctionnel dans les stades précoces de la maladie et sur le plan anatomique lorsqu’il existe un décollement de rétine. La récidive de l’exsudation est cependant possible à long terme : elle serait de 7 % à 10 ans pour Shields [2] ; Shienbaum, sur une série de 13 yeux, retrouve un taux de récurrence de 33 %, celle-ci survenant en moyenne 4,3 ans après le premier traitement pour un suivi global de 12,4 ans [17]. Ce risque de récidive impose un suivi à vie pour traiter précocement les lésions responsables [2].
Peu d’articles dans la littérature traitent des résultats de la prise en charge des DR sur maladie de Coats par traitement laser ; Schefler, dans une série de 14 yeux présentant un DR partiel ou total, rapporte un succès anatomique avec réapplication rétinienne totale dans 11 cas (78 %) après traitement par laser diode avec un nombre moyen de 6,2 séances de traitement par œil [15]. Dans une série rétrospective personnelle de 15 patients, le laser a pu être utilisé seul dans 7 cas (46 %) avec un succès anatomique dans 6 cas (83 %) et un nombre moyen de 3,3 séances de laser par œil [13]. Dans 8 cas, une chirurgie endoculaire a été associée au traitement laser. Une amélioration anatomique a été obtenue dans 12 cas (80 %) et aucune énucléation n’a été à déplorer.
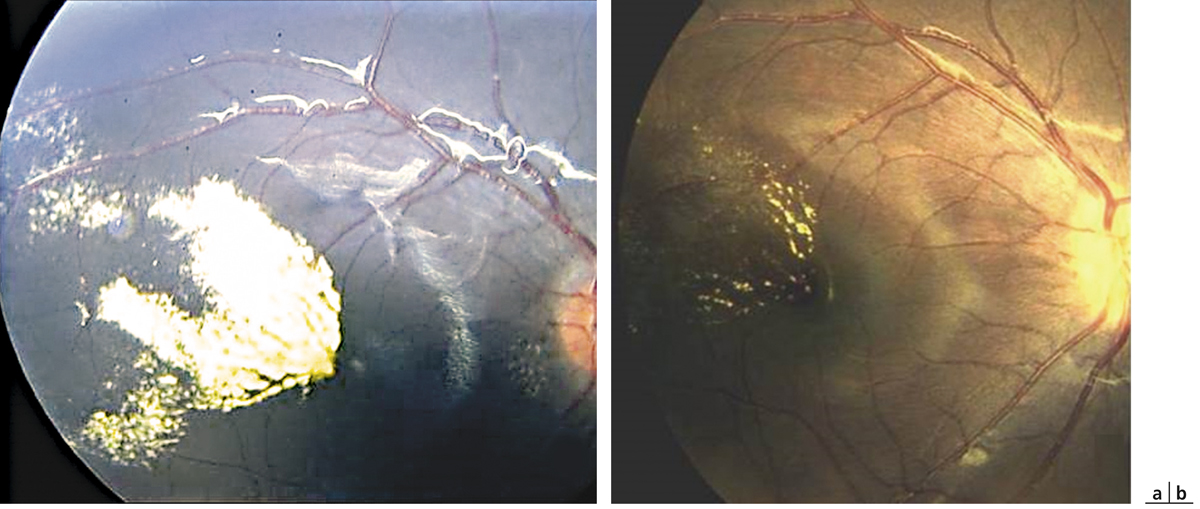
Fig. 14-52 Exsudats sous-rétiniens sous-maculaires peu denses.
a. Avant traitement. b. 4 mois après 2 séances de photocoagulation au laser 532 nm (cicatrices visibles en temporal), on note une nette résorption des exsudats.
La chirurgie est indiquée en cas d’échec du laser ou lorsque celui-ci n’est pas réalisable, comme dans certaines formes très bulleuses de décollement de rétine rétrocristallinien où il n’est pas aisé d’atteindre les télangiectasies. Ces cas de décollements de rétine majeurs se compliquent fréquemment d’hypothalamie puis d’athalamie, exposant au risque de glaucome par fermeture de l’angle et d’opacification cornéenne. La chirurgie s’impose alors pour enlever le cristallin et traiter le décollement de rétine.
La procédure chirurgicale comporte l’ablation du cristallin en cas de chambre antérieure étroite, la mise en place d’une ligne d’infusion (en chambre antérieure ou en pars plicata selon le statut cristallinien), la ponction ab externo du liquide sous-rétinien puis le traitement des télangiectasies par cryoapplication ou laser. Dans certains cas, une vitrectomie associée à la mise en place d’un tamponnement interne par huile de silicone peut être nécessaire.
Le VEGF est impliqué dans de nombreuses pathologies mettant en jeu une rupture de la barrière hémato-rétinienne [18, 19]. Une élévation significative du taux de VEGF a été retrouvée dans la maladie de Coats. Cependant, les publications faisant état de l’utilisation d’un anti-VEGF (bévacizumab, Avastin®) dans le traitement de la maladie de Coats [14, 20–23] portent pour la plupart sur un nombre de cas réduits. De plus, les anti-VEGF ont presque constamment été utilisés en association avec d’autres thérapies, dans des cas de gravité variable et selon des modalités différentes, ce qui rend difficile l’interprétation des résultats rapportés. Seul Sigler indique une amélioration constante de l’œdème maculaire et de l’exsudation en cas d’utilisation de bévacizumab seul, dans une série non publiée [24]. Il recommande cependant d’associer un traitement au laser aux anti-VEGF. Il est difficile, à l’heure actuelle, de tirer des conclusions sur l’efficacité réelle de ces traitements dans la maladie de Coats ; ils semblent avoir un effet synergique du laser et être un bon appoint thérapeutique, en particulier en cas d’œdème maculaire ou de glaucome néovasculaire associé.
L’œdème maculaire cystoïde (OMC) a été décrit chez le grand prématuré pour la première fois à la fin des années 2000 [25] puis a pu être facilement mis en évidence grâce à un OCT de type SD-OCT portable, couplé à l’ophtalmoscopie indirecte durant des examens de dépistage pour ROP [26]. L’OMC est, en effet, le plus souvent infraclinique chez le nourrisson prématuré et un examen ophtalmologique traditionnel ne permet pas son diagnostic en général.
L’OMC se révèle fréquent sur ce terrain puisqu’il est retrouvé chez 40 à 70 % des enfants prématurés de moins de 32 semaines d’aménorrhée [25–29]. Dans ce contexte, les logettes cystoïdes apparaissent plus fréquemment dans la couche nucléaire interne et concernent plus rarement les autres couches rétiniennes [26]. Cependant, tous les aspects cliniques ont été décrits, de la simple lésion cystoïde fovéolaire à l’œdème schisis-like concernant toute la surface maculaire [30]. Quand un OMC est présent, il est en règle bilatéral [28, 29].
La présence d’un OMC n’est pas clairement corrélée à l’âge gestationnel en dessous de 32 semaines d’aménorrhée ; en revanche, il semblerait que l’OMC soit exceptionnel chez l’enfant né à terme sur les rares études publiées dans cette population. En comparant une population d’enfants prématurés et d’enfants nés à terme, Vajzovic et al. [30] a retrouvé un OMC chez 72 % des prématurés (46/64) et 6 % des enfants nés à terme (3/47). De plus, l’OMC des enfants à terme consistait en quelques petites logettes sans modification significative du profil maculaire, alors qu’il était significatif avec effacement de la dépression fovéolaire chez la majorité des enfants prématurés.
La corrélation entre l’OMC et la présence d’une ROP ou son stade n’est pas non plus établie, les études étant souvent contradictoires sur ce point ; il semblerait toutefois que la majorité d’entre elles ne retrouve aucun lien entre les deux pathologies [26, 28, 29]. Certains auteurs rapportent une épaisseur centrale fovéolaire et une épaisseur des couches internes de la rétine significativement plus élevées, sans OMC, chez les enfants ayant des antécédents de ROP traitée ou non [28, 31–34]. Il est à préciser que l’utilisation des anti-VEGF n’est un facteur confondant dans aucune des études, l’analyse morphologique de la macula ayant toujours été faite sur des populations où ils n’avaient pas été utilisés ou avant leur administration éventuelle.
L’évolution de l’OMC du prématuré se fait vers la résolution spontanée en quelques semaines en dehors de tout traitement ; Vinekar et al. ont objectivé une disparition de l’OMC dans tous les cas à 52 semaines d’aménorrhée sur une série de 19 yeux [27], mais d’autres auteurs ont rapporté sa disparition de façon beaucoup plus rapide (1 à 3 semaines après le début du dépistage) [28].
La physiopathologie de l’OMC du prématuré reste obscure et pourrait rentrer dans le contexte de l’immaturité neurologique globale de ces enfants. Rothman [34] suggère d’ailleurs que sa présence pourrait être un indice péjoratif de développement neurologique et sensoriel. En effet, en comparant deux populations d’enfants prématurés porteurs d’OMC (groupe 1 de 33 yeux) ou sans OMC (groupe 2 de 22 yeux), il constate que les tests d’évaluation psychométriques, réalisés entre 18 et 24 mois d’âge corrigé, montrent des performances significativement moins bonnes sur le plan du langage et de la motricité chez les enfants du groupe 1; il n’existe en revanche pas de différence significative sur les performances cognitives. Par ailleurs, il n’existe pas non plus de différence entre les deux groupes concernant l’âge gestationnel, la présence ou le stade de ROP. Toutefois, l’épaisseur rétinienne mesurée en OCT reste significativement plus élevée à 24 mois dans le groupe 1, malgré la résolution de l’OMC.
[1] Shields JA, Shields CL. Review : Coats disease: the 2001 LuEsther T. Mertz lecture. Retina 2002 ; 22 : 80-91.
[2] Shields JA, Shields CL, Honavar SG, Demirci H. Clinical variations and complications of Coats disease in 150 cases : the 2000 Sanford Gifford Memorial Lecture. Am J Ophthalmol 2001 ; 131 : 561-71.
[3] Black GC, Perveen R, Bonshek R, et al. Coats’ disease of the retina (unilateral retinal telangiectasis) caused by somatic mutation in the NDP gene : a role for norrin in retinal angiogenesis. Hum Mol Genet 1999 ; 8 : 2031-5.
[4] Sneed SR, Blodi CF, Pulido JS. Treatment of Coats’ disease with the binocular indirect argon laser photocoagulator. Arch Ophthalmol 1989 ; 107 : 789-90.
[5] Reese AB. Telangiectasis of the retina and Coats’ disease. Am J Ophthalmol 1956 ; 42 : 1-8.
[6] Chang MM, McLean IW, Merritt JC. Coats’ disease : a study of 62 histologically confirmed cases. J Pediatr Ophthalmol Strabismus 1984 ; 21 : 163-8.
[7] Cahill M, O’Keefe M, Acheson R, et al. Classification of the spectrum of Coats’ disease as subtypes of idiopathic retinal telangiectasis with exudation. Acta Ophthalmol Scand 2001 ; 79 : 596-602.
[8] Jones JH, Kroll AJ, Lou PL, Ryan EA. Coats’ disease. Int Ophthalmol Clin 2001 ; 41 : 189-98.
[9] Shields JA, Shields CL, Honavar SG, et al. Classification and management of Coats disease: the 2000 Proctor Lecture. Am J Ophthalmol 2001 ; 131 : 572-83.
[10] Char DH. Coats’ syndrome : long term follow up. Br J Ophthalmol 2000 ; 84 : 37-9.
[11] Haik BG. Advanced Coats’ disease. Trans Am Ophthalmol Soc 1991 ; 89 : 371-6.
[12] Adam RS, Kertes PJ, Lam WC. Observations on the management of Coats’ disease : less is more. Br J Ophthalmol 2007 ; 91 : 303-6.
[13] Mrejen S, Metge F, Denion E, et al. Management of retinal detachment in Coats disease. Study of 15 cases. Retina 2008 ; 28 : S26-32.
[14] Mulvihill A, Morris B. A population-based study of Coats disease in the United Kingdom II : investigation, treatment, and outcomes. Eye 2010 ; 24 : 1802-7.
[15] Schefler AC, Berrocal AM, Murray TG. Advanced Coats’ disease. Management with repetitive aggressive laser ablation therapy. Retina 2008 ; 28 : S38-41.
[16] Nucci P, Bandello F, Serafino M, et al. Selective photocoagulation in Coats’ disease : ten year follow-up. Eur J Ophthalmol 2002 ; 12 : 501-5.
[17] Shienbaum G, Tasman WS. Coats disease : a lifetime disease. Retina 2006 ; 26 : 422-4.
[18] Aiello LP, Bursell SE, Clermont A, et al. Vascular endothelial growth factor-induced retinal permeability is mediated by protein kinase C in vivo and suppressed by an orally effective beta-isoform-selective inhibitor. Diabetes 1997 ; 46 : 1473-80.
[19] Ishida S, Usui T, Yamashiro K, et al. VEGF164-mediated inflammation is required for pathological, but not physiological, ischemia-induced retinal neovascularization. J Exp Med 2003 ; 198 : 483-9.
[20] Jun JH, Kim YC, Kim KS. Resolution of severe macular edema in adult Coats’ disease with intravitreal triamcinolone and bevacizumab injection. Korean J Ophthalmol 2008 ; 22 : 190-3.
[21] Kaul S, Uparkar M, Mody K, et al. Intravitreal anti-vascular endothelial growth factor agents as an adjunct in the management of Coats’ disease in children. Indian J Ophthalmol 2010 ; 58 : 76-8.
[22] Lin CJ, Hwang JF, Chen YT, Chen SN. The effect of intravitreal bevacizumab in the treatment of Coats disease in children. Retina 2010 ; 30 : 617-22.
[23] Sun Y, Jain A, Moshfeghi DM. Elevated vascular endothelial growth factor levels in Coats disease: rapid response to pegaptanib sodium. Graefes Arch Clin Exp Ophthalmol 2007 ; 245 : 1387-8.
[24] Sigler EJ, Randolph JC, Calzada JI, et al. Current management of Coats disease. Surv Ophthalmol 2013 ; 59 : 30-46.
[25] Joshi MM, Trese MT, Capone A Jr. Optical coherence tomography findings in stage 4A retinopathy of prematurity : a theory for visual variability. Ophthalmology 2006 ; 113 : 657-60.
[26] Lee AC, Maldonado RS, Sarin N, et al. Macular features from spectral-domain optical coherence tomography as an adjunct to indirect ophthalmoscopy in retinopathy of prematurity. Retina 2011 ; 31 : 1470-82.
[27] Vinekar A, Avadhani K, Sivakumar M, et al. Understanding clinically undetected macular changes in early retinopathy of prematurity on spectral domain optical coherence tomography. Invest Ophthalmol Visual Sci 2011 ; 52 : 5183-8.
[28] Maldonado RS, O’Connell R, Ascher SB, et al. Spectral-domain optical coherence tomographic assessment of severity of cystoid macular edema in retinopathy of prematurity. Arch Ophthalmol 2012 ; 130 : 569-78.
[29] Dubis AM, Subramaniam CD, Godara P, et al. Subclinical macular findings in infants screened for retinopathy of prematurity with spectral-domain optical coherence tomography. Ophthalmology 2013 ; 120 : 1665-71.
[30] Vajzovic L, Rothman AL, Tran-Viet D, et al. Delay in retinal photoreceptor development in very preterm compared to term infants. Invest Ophthalmol Vis Sci 2015 ; 56 : 908-13.
[31] Akerblom H, Larsson E, Eriksson U, Holmström G. Central macular thickness is correlated with gestational age at birth in prematurely born children. Br J Ophthalmol 2011 ; 95 : 799-803.
[32] Ecsedy M, Szamosi A, Karko C, et al. A comparison of macular structure imaged by optical coherence tomography in preterm and full-term children. Invest Ophthalmol Vis Sci 2007 ; 48 : 5207-11.
[33] Recchia FM, Recchia CC. Foveal dysplasia evident by optical coherence tomography in patients with a history of retinopathy of prematurity. Retina 2007 ; 27 : 1221-6.
[34] Rothman AL, Tran-Viet D, Gustafson KE, et al. Poorer neurodevelopmental outcomes associated with cystoid macular edema identified in preterm infants in the intensive care nursery. Ophthalmology 2015 ; 122 : 610-9.