Œdème maculaire et DMLA
Coordonné par J.-F. Korobelnik
O. Semoun, M. Srour, E.-H. Souied
➤ L’activité néovasculaire dans la dégénérescence maculaire liée à l’âge s’accompagne de phénomènes exsudatifs, à l’origine d’une modification de l’architecture rétinienne et d’une altération de la fonction visuelle.
➤ L’imagerie multimodale joue un rôle crucial dans le diagnostic étiologique, l’indication thérapeutique, le suivi, l’évaluation de l’efficacité des traitements, et l’élimination des diagnostics différentiels.
➤ L’imagerie multimodale permet de différencier les néovaisseaux choroïdiens de type 1 (ou « occultes » ou sous-épithéliaux), de type 2 (ou « visibles » ou pré-épithéliaux), de type 3 (anastomoses choriorétiniennes ou proliférations angiomateuses rétiniennes) et les vasculopathies polypoïdales.
La dégénérescence maculaire liée à l’âge (DMLA) exsudative est caractérisée par le développement d’une structure néovasculaire d’origine choroïdienne. Dans les anastomoses choriorétiniennes (ACR) ou néovaisseaux choroïdiens (NVC) de type 3, l’origine choroïdienne ou rétinienne de cette prolifération vasculaire reste l’objet d’une controverse.
Le NVC croît en moyenne de 10 µm/24 h [1], et est responsable de phénomènes dits « exsudatifs », en libérant du fluide ou du sang sous la rétine neurosensorielle et en son sein. Cette exsudation entraîne des modifications de l’architecture rétinienne ainsi que des altérations rapidement progressives de la fonction visuelle, ce qui en fait une urgence thérapeutique.
L’imagerie maculaire joue un rôle crucial dans le diagnostic, le suivi et le traitement des patients atteints de DMLA. La classification des formes cliniques repose en grande partie sur cette imagerie, en particulier sur l’angiographie à la fluorescéine (AF) et l’examen en tomographie à cohérence optique (spectral-domain optical coherence tomography ou SD-OCT). Les récents progrès technologiques ont permis une meilleure compréhension de la physiopathologie de cette affection, en offrant un large éventail de techniques d’imagerie. Nous décrirons différentes modalités d’imagerie courante et leurs caractéristiques selon les formes cliniques observées, en insistant sur la traduction iconographique de l’exsudation occasionnée. L’imagerie « normale » maculaire est illustrée sur la figure 12-1.
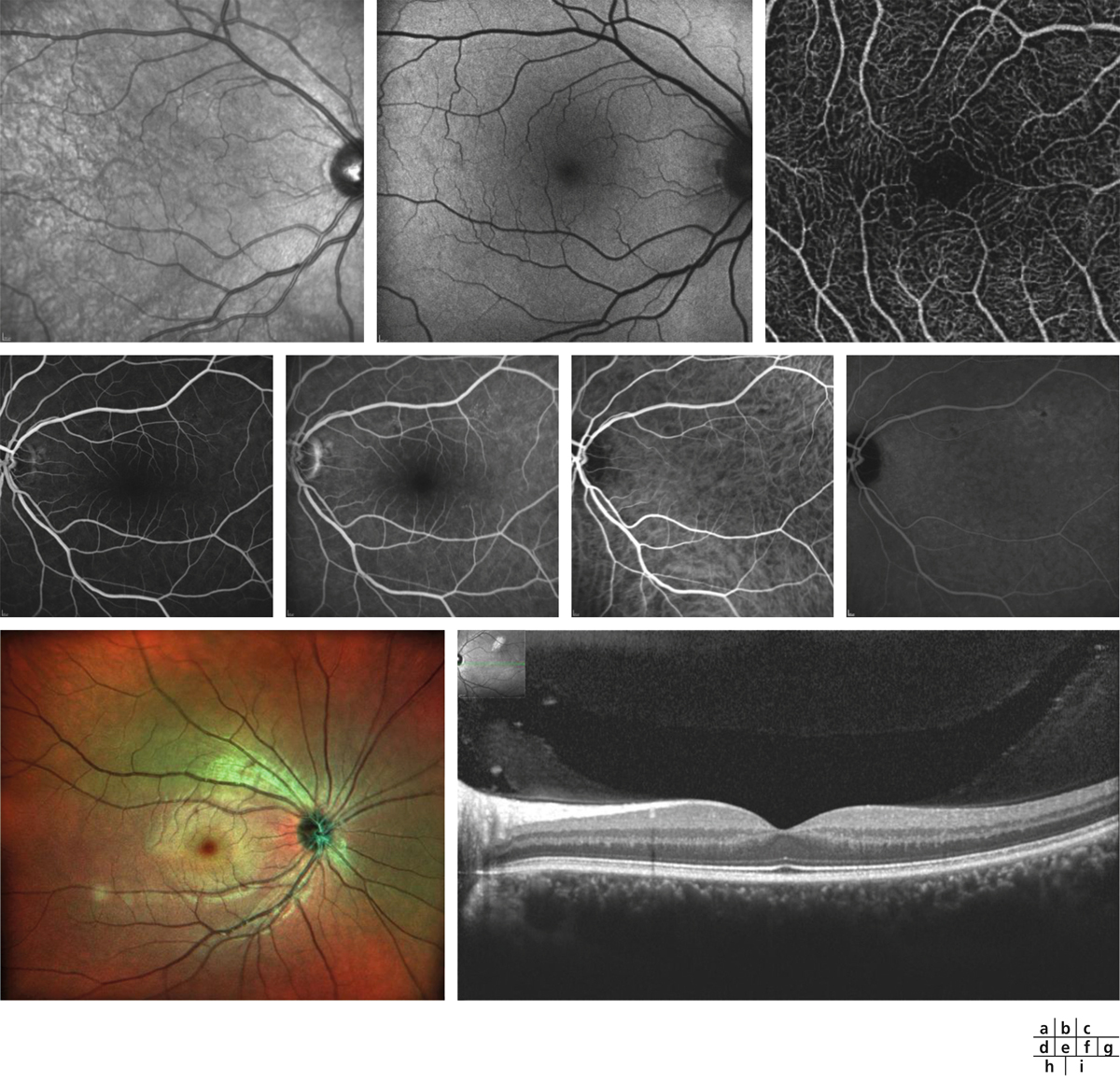
Fig. 12-1 Imagerie normale.
a. Cliché infrarouge. b. Autofluorescence du fond d’œil. c. Cliché angio-OCT au niveau rétinien superficiel. d. Angiographie à la fluorescéine au temps précoce. e. Angiographie à la fluorescéine au temps tardif. f. Angiographie en ICG au temps précoce. g. Angiographie en ICG au temps tardif. h. Cliché MultiColor™. i. SD-OCT.
(Remerciements aux Dr A. Georges, F. Lalloum et A. Miere.)
Les photographies en couleurs du fond d’œil sont des éléments utiles pour le dépistage, l’identification et la surveillance des différentes formes de DMLA ou ses précurseurs comme les drusen, les migrations de pigment ou les altérations de l’épithélium pigmentaire (EP) rétinien. Certaines classifications de la DMLA, ainsi que des échelles de gravité sont basées sur un classement normalisé des photographies du fond d’œil [2]. En outre, l’analyse précise des lésions peut souvent orienter vers un diagnostic étiologique, qui sera ensuite confirmé par d’autres examens. Des clichés monochromatiques peuvent également être effectués pour apprécier la présence d’un soulèvement des vaisseaux rétiniens, témoin d’un décollement séreux rétinien ou d’un œdème maculaire. Ils permettent également de visualiser un saignement, en offrant un contraste accru donnant une bonne visualisation des vaisseaux capillaires de la rétine et donc des très petites hémorragies.
Le mode MultiColor™ a été développé pour le Spectralis™ SD-OCT (Heidelberg Engineering). Les clichés MultiColor™ sont composés de la superposition de trois images monochromatiques acquises simultanément en temps réel à une longueur d’onde spécifique grâce à un ophtalmoscope à balayage laser confocal (confocal scanning laser ophthalmoscopy [cSLO]) de réflectance bleue (486 nm), verte (518 nm) et infrarouge (815 nm). Un moyennage automatique minimise les artefacts. Cependant, cette technique d’imagerie avec des pseudo-couleurs est relativement nouvelle et un recul plus important sera nécessaire pour définir sa place (fig. 12-1).
L’imagerie infrarouge (IR) est une méthode in vivo non invasive (fig. 12-1). Bien que très fréquemment réalisée en pratique, cette imagerie dans la DMLA est mal documentée dans la littérature. L’étude des clichés IR (820 nm) des NVC de type 2 a montré la présence d’un anneau blanchâtre entourant un noyau central sombre [3]. Les bords de cet anneau correspondent à la zone de diffusion au temps tardif de l’AF, et à la zone noire entourant la membrane néovasculaire à la phase précoce (fig. 12-2a).
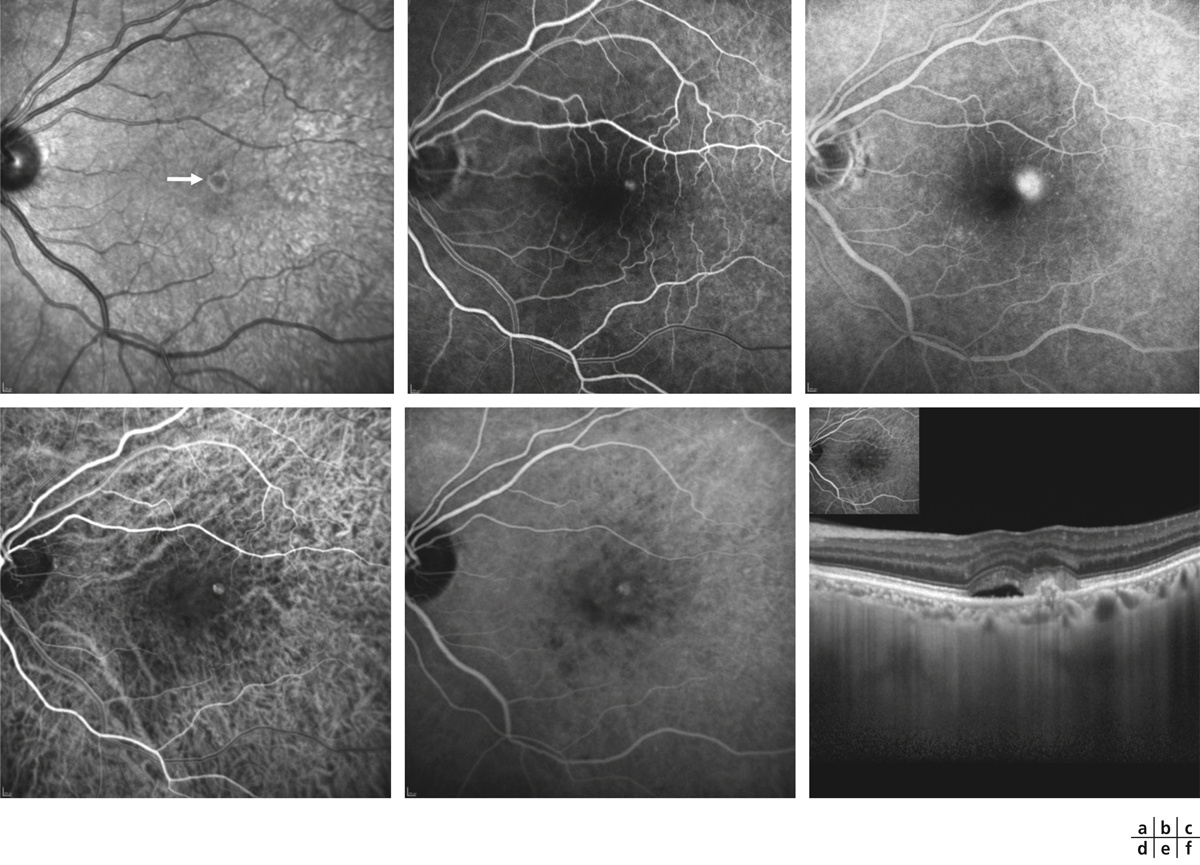
Fig. 12-2 Néovaisseaux visibles ou de type 2.
a. Cliché infrarouge : le néovaisseau apparaît comme un anneau hyper-réflectif blanchâtre avec un noyau central sombre. b. Cliché précoce en angiographie à la fluorescéine : image hyperfluorescente précoce temporofovéolaire. c. Cliché tardif en angiographie à la fluorescéine : diffusion progressive du colorant. d. Cliché précoce en ICGA : image hyperfluorescente bien définie correspondant aux néovaisseaux. e. Cliché tardif en ICGA : la fluorescence tend à diminuer avec le temps, par effet wash-out. f. SD-OCT : lésion sous-rétinienne réflective, au-dessus de l’EP, qui semble correspondre au complexe néovasculaire, associé à fluide sous-rétinien (ou DSR).
L’autofluorescence du fond d’œil (fundus autofluorescence [FAF]) est une méthode basée sur les propriétés et la distribution de la lipofuscine, produit par la dégradation des segments externes des photorécepteurs qui s’accumulent dans l’EP (voir chapitre 5.2). L’excitation de la lipofuscine se produit de 300 à 500 nm de longueur d’onde, avec une émission à 620–630 nm [4]. Le FAF peut être obtenu en utilisant soit le cSLO soit un rétinophotographe classique (fig. 12-1b) [5]. L’intensité de l’autofluorescence est comparée au signal d’arrière-plan homogène et peut être soit augmentée (hyper-autofluorescence) soit diminuée (hypo-autofluorescence). L’hyper-autofluorescence peut résulter d’une augmentation de la lipofuscine dans l’EP ou de dépôt de matériel extracellulaire sous l’EP (drusen, dystrophie vitelliforme). L’hypo-autofluorescence est généralement la conséquence d’une diminution ou d’une absence de cellules de l’EP. L’atrophie de l’EP apparaît comme une zone sombre délimitée [6]. Les saignements récents apparaissent sombres en raison de phénomènes de masquage. Le FAF peut être proposé dans la DMLA exsudative, afin de détecter et suivre une atrophie de l’EP associée ou la présence de matériel. Un œdème chronique ou une exsudation chronique peut résulter en une hyper-autofluorescence d’allure gravitationnelle en FAF.
Depuis plusieurs décennies, l’AF demeure le gold standard pour l’imagerie des DMLA lors du diagnostic initial (voir chapitre 5.2). Le diagnostic d’activité des NVC est basé sur la diffusion du colorant, au cours de la séquence angiographique, définie par l’augmentation de la taille et de l’intensité de la fluorescence dans le temps, avec des limites floues aux temps tardifs. L’AF est un outil essentiel pour l’évaluation initiale des NVC. Elle peut être utile pour apprécier la réponse thérapeutique, car la disparition des diffusions peut indiquer la régression ou l’inactivation des NVC, tandis que de nouvelles diffusions suggèrent une récidive.
La classification des formes de DMLA est historiquement fondée sur les caractéristiques et la topographie de la diffusion en AF (tableau 12-1). Les NVC « visibles » de type 2 ou « pré-épithéliaux » se présentent comme une hyperfluorescence bien délimitée correspondant à la membrane néovasculaire aux temps précoces de l’angiographie. Les phases tardives sont marquées par une diffusion progressive du colorant à partir de cette lésion (fig. 12-2b et c). Les NVC occultes de type 1 ou « sous-épithéliaux » se présentent comme une hyperfluorescence mal définie hétérogène (pin points) au niveau de l’EP dès la phase précoce, avec des diffusions tardives (fig. 12-3). Les NVC anciens peuvent parfois donner un aspect d’œdème maculaire cystoïde. Les NVC sont appelés predominantly classic ou minimally classic, selon que les lésions visibles pré-épithéliales sont majoritaires ou non. Un décollement de l’épithélium pigmentaire (DEP) est souvent associé. Dans le cadre de la DMLA exsudative, l’œdème maculaire peut présenter soit un aspect diffus, soit un aspect cystoïde, souvent associé à des néovaisseaux de type 1.
La classification des décollements de l’épithélium pigmentaire (DEP) est également basée sur l’AF. Les DEP séreux sont définis par un remplissage rapide, progressif et uniforme de la lésion sans diffusion [7]. Les DEP fibrovasculaires sont caractérisés par une élévation irrégulière de l’EP avec une hyperfluorescence dans les 2 minutes suivant l’injection et la persistance de la coloration ou d’une diffusion au temps tardif [8]. Ils sont associés aux NVC occultes. Les DEP drusenoïdes résultent de l’élargissement progressif et de la confluence de drusen séreux. Ils sont caractérisés par une coloration progressive et irrégulière de l’espace sous l’EP, sans diffusion [9]. Dans la vasculopathie polypoïdale choroïdienne (VPC), une hyperfluorescence arrondie unique ou multiple, centrale ou péripapillaire peut être notée, souvent avec diffusion. Un petit réseau choroïdien anormal peut être vu près des lésions au temps précoce. Cependant, des hémorragies peuvent masquer ces images (fig. 12-4). Dans les NVC de type 3, encore nommés anastomose choriorétinienne (ACR) ou prolifération angiomateuse rétinienne (RAP), un hot spot est généralement visible, caractérisé par une petite hyperfluorescence intense au temps moyen à proximité d’un vaisseau rétinien, avec diffusion tardive (fig. 12-5). Parfois, un hot spot peut correspondre à une VPC ou à des NVC occultes focaux [10].
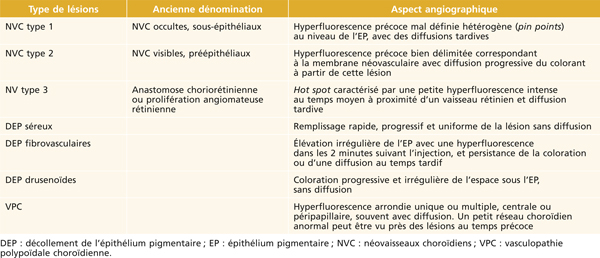
Tableau 12-1 – Caractéristiques en angiographie à la fluorescéine des néovaisseaux choroïdiens de la DMLA.
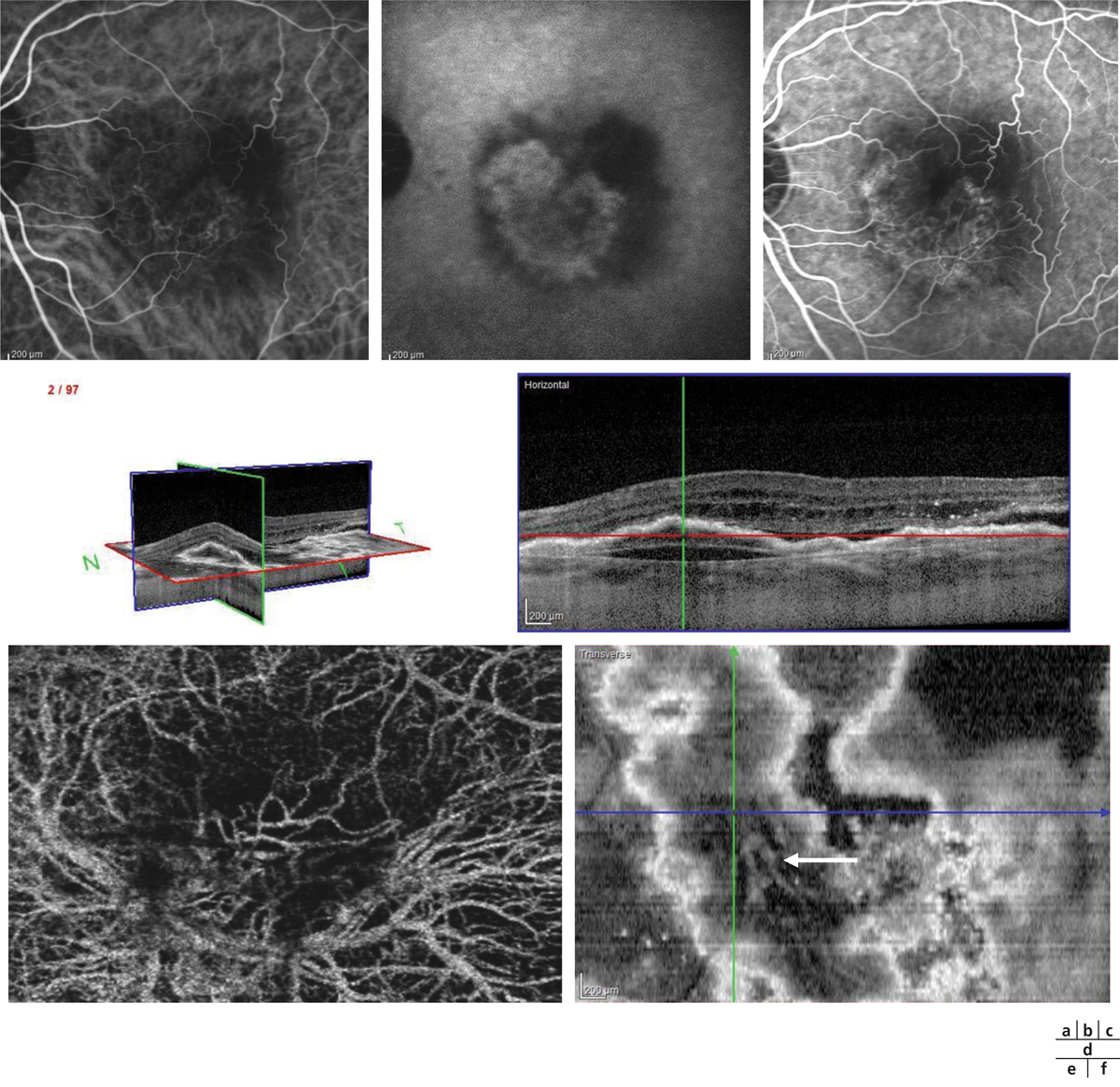
Fig. 12-3 Néovaisseaux occultes ou de type 1.
a. Temps précoce de ICGA : visualisation du réseau néovasculaire choroïdien, sous la forme d’une ramification hyperfluorescente dans la région maculaire. b. Temps tardif de l’ICGA : visualisation de la totalité de la membrane néovasculaire choroïdienne (plaque hyperfluorescente tardive) au sein d’un décollement de l’épithélium pigmentaire de la rétine (DEP) fibrovasculaire (hypofluorescent). c. Temps moyen de l’angiographie à la fluorescéine : hyperfluorescence hétérogène (pin points) avec diffusion. d. EDI-SD-OCT B-scan (N pour nasal et T pour temporal). DEP associée à des kystes intrarétiniens et accumulation de liquide sous-rétinien. e. Exemple de néovaisseaux de type 1 en angio-OCT au niveau choriocapillaire : visualisation du réseau vasculaire occulte sans injection de produit de contraste. f. EDI-OCT « en face » : visualisation de la structure interne hyper-réflective ramifiée au sein du DEP, correspondant aux néovaisseaux de type 1 (flèche). Le réseau est clairement visible, associé à l’accumulation de liquide sous-rétinien sombre, entourant le DEP.
(Remerciement au Dr F. Coscas.)
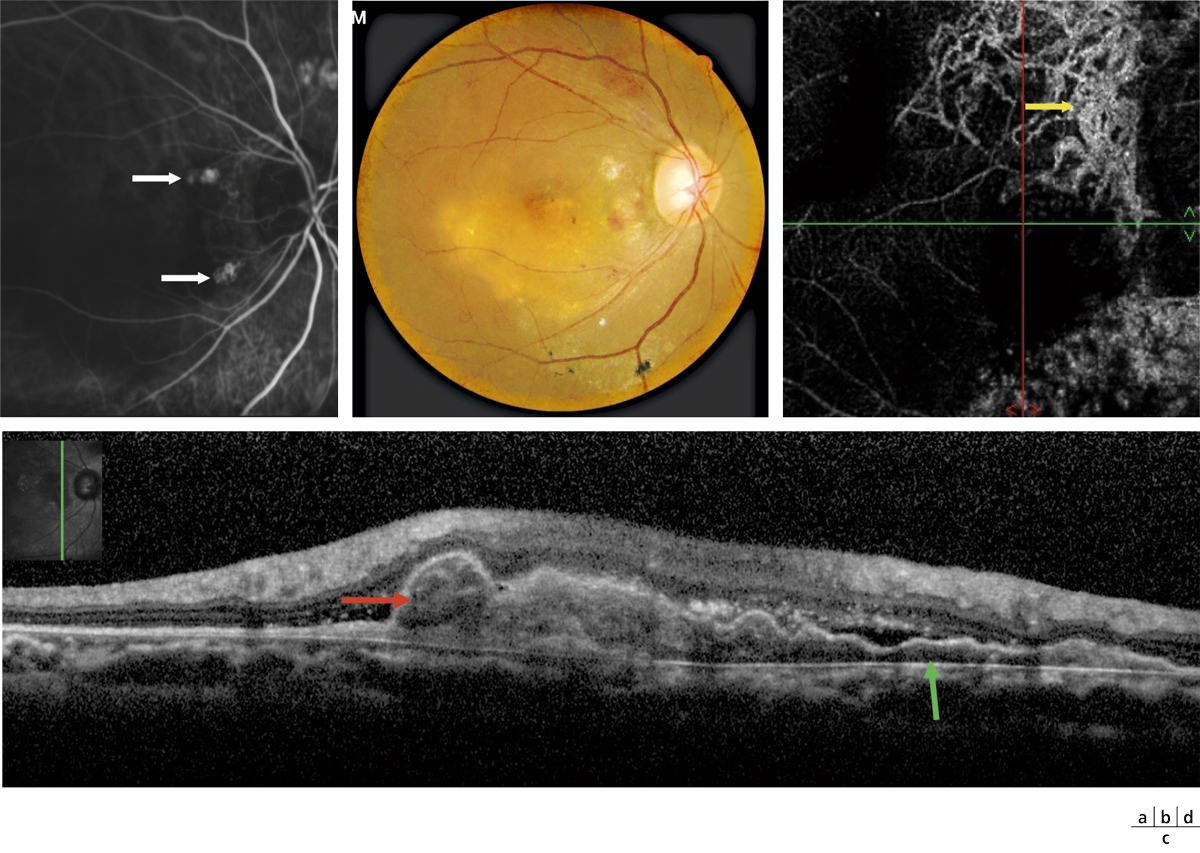
Fig. 12-4 Vasculopathie polypoïdale choroïdienne.
a. Angiographie en ICG au temps moyen mettant en évidence des hyperfluorescences multiples arrondies péripapillaires (flèches blanches). b. Photographie du fond d’œil. c. SD-OCT : image hyper-réflective arrondie en arrière de l’EP, correspondant au polype (flèche rouge), accolée à un DEP irrégulier correspondant au réseau choroïdien anormal (flèche verte). d. Aspect en angio-OCT permettant une visualisation facilitée du réseau choroïdien anormal (flèche jaune) ou branching network.
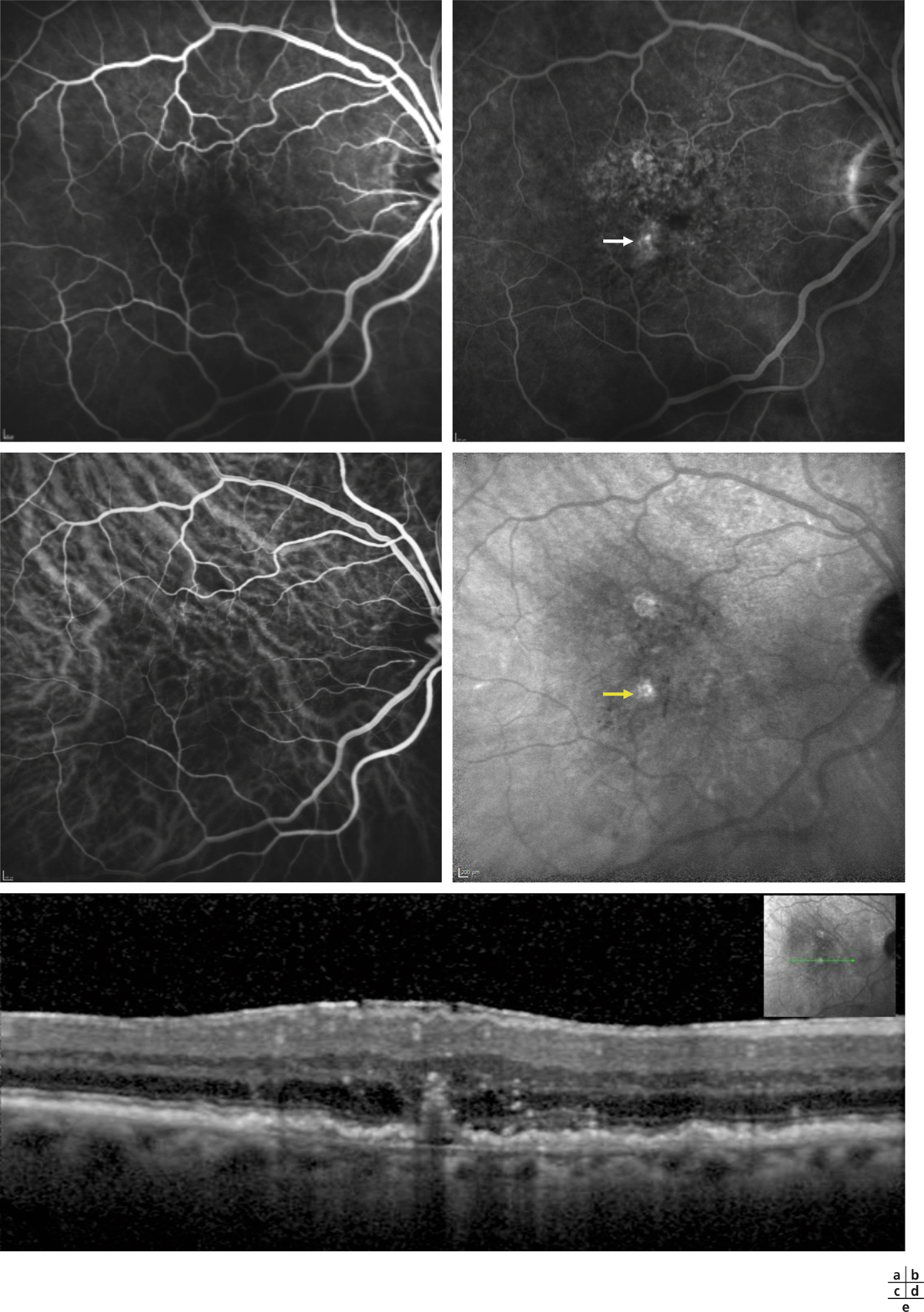
Fig. 12-5 Anastomose choriorétinienne ou néovaisseau de type 3.
a. Temps précoce de l’angiographie à la fluorescéine. b. Temps tardif de l’angiographie à la fluorescéine. Hyperfluorescence ponctiforme ou hot spot (flèche blanche) au sein d’une hyperfluorescence hétérogène par effet fenêtre lié aux altérations de l’épithélium pigmenté. c. Temps précoce de l’ICG. d. Temps tardif de l’ICG. Le hot spot est mieux défini (flèche jaune). e. SD-OCT. Coupe passant par le hot spot visualisant l’anastomose avec kissing sign, ou signe de l’entonnoir, et logettes œdémateuses au sein de la rétine neurosensorielle.
L’angiographie au vert d’indocyanine (indocyanine green angiography [ICGA]) est un outil complémentaire pour le diagnostic et le suivi des DMLA néovasculaires en s’affranchissant de la barrière de l’EP. L’ICGA offre une imagerie de qualité de la choroïde et de la choriocapillaire. Le dispositif d’acquisition peut être couplé à un cSLO, afin d’obtenir simultanément une AF et une ICGA en mode confocal. L’ICGA permet de visualiser l’ensemble de la membrane néovasculaire choroïdienne de type 1, les néovaisseaux de type 3 et la VPC.
Les NVC de type 2 sont souvent visualisés dès les temps précoces sous la forme d’un réseau néovasculaire hyperfluorescent (fig. 12-2d et e). Cette fluorescence a généralement tendance à disparaître par la suite (wash-out), parfois une zone hyperfluorescente reste présente. Sur les clichés tardifs, les vaisseaux rétiniens apparaissent sombres (image inversée).
Les NVC de type 1 peuvent souvent être visualisés dès les premiers clichés de l’ICGA et se présentent comme une image hyperfluorescente aux temps tardifs (plaque tardive, fig. 12-3a et b).
Les néovaisseaux de type 3 sont caractérisés par une hyperfluorescence intense focale ou hot spot (fig. 12-5c et d) [10].
Typiquement, la VPC apparaît comme une hyperfluorescence arrondie, unique ou multiple, à proximité du nerf optique ou de la fovéa [10]. Un réseau de ramification et de dilatation au niveau des extrémités du réseau vasculaire choroïdien est souvent visible, il s’agit du réseau choroïdien anormal nourricier ou branching network (fig. 12-4a).
Réaliser une ICGA chez les patients avec suspicion de DMLA néovasculaire, lors du premier examen et parfois dans le suivi des cas douteux, permet de poser un diagnostic morphologique le plus précis possible dans le cadre d’une imagerie multimodale.
La tomographie par cohérence optique (OCT) est un outil primordial pour le diagnostic et le traitement des patients. Toutefois, l’OCT seule ne suffit pas à faire la distinction entre les différentes formes cliniques lors du diagnostic. Une approche multimodale est plus appropriée. La réponse thérapeutique étant liée en partie à la résorption du liquide intra- ou sous-rétinien, une évaluation minutieuse des coupes OCT est nécessaire au fil du temps. Les comparaisons de l’épaisseur et des modifications de la morphologie maculaire dans le temps permettent d’évaluer cette réponse. Certains appareils ont une fonction follow-up, qui permet de suivre l’épaisseur de la rétine à un endroit précis dans le temps (fig. 12-6).
L’activité néovasculaire peut avoir plusieurs manifestations en OCT [11] :
la manifestation la plus précoce est un épaississement rétinien diffus, sans logettes (fig. 12-6a) ;
le liquide sous-rétinien, ou décollement séreux rétinien (DSR), se présente comme un espace sombre virtuel entre la rétine et l’EP. Récemment, il a été démontré que ce DSR pouvait se manifester précocement sous la forme d’une hyper-réflectivité grise à bords flous, surmontant l’EP (fig. 12-7a) [12]. Ce « gris » doit être considéré comme un signe exsudatif ou d’activité néovasculaire et constitue une indication thérapeutique. Il faut néanmoins le différencier des autres hyper-réflectivités surmontant l’EP comme les accumulations de matériel des lésions vitelliformes ou les hémorragies (fig. 12-6e et 12-7c). Souvent, une altération de la zone ellipsoïde est associée aux phénomènes exsudatifs ;
l’exsudation intrarétinienne peut se traduire par des logettes rondes et sombres dans les couches rétiniennes ;
des points hyper-réflectifs peuvent être visualisés, souvent dans la rétine externe et pourraient correspondre à des processus inflammatoires (fig. 12-7b) ;
le DEP est caractérisé par une élévation de l’EP. Sa présence peut signaler l’existence de NVC occultes quiescents [13] ;
l’OCT montre les drusen comme des élévations de réflectivité et de taille variables de l’EP. Les pseudo-drusen réticulés sont identifiés sous la forme de zones hyper-réflectives granulaires entre l’EP et la jonction segment interne–segment externe [14]. Les drusen séreux peuvent confluer et donner naissance à un DEP drusenoïde, de forme irrégulière. En revanche, les DEP séreux sont une élévation lisse et régulière de l’EP, au contenu hyporéflectif et en forme de dôme. Les DEP fibrovasculaires sont des élévations plus irrégulières, au contenu de réflectivité moyenne, séparées par des bandes hyporéflectives (fig. 12-3d). Les déchirures de l’EP sont caractérisées par une discontinuité au sein d’un large DEP dont le bord libre est souvent enroulé créant un aspect ondulé du DEP (fig. 12-7d) ;
les NVC de type 3 sont décrits comme une érosion ou petite élévation de l’EP, un signe de volet ou, plus tardivement, une image en forme d’entonnoir focal de l’EP (kissing sign), accompagné de liquide sous- et intrarétinien (fig. 12-5e) [15]. Une élévation localisée de l’EP, avec une altération focale de l’EP et des photorécepteurs, associée à un amincissement de la plexiforme externe, pourrait être un précurseur des ACR [16] ;
dans la VPC, le réseau choroïdien anormal donne une faible élévation irrégulière de l’EP, alors que les polypes apparaissent comme des protubérances plus nettes, « en ogives » souvent associées à des phénomènes exsudatifs (fig. 12-4c) ;
les tubulations rétiniennes apparaissent comme des espaces hyporéflectifs ovoïdes en réseau, entourés d’une fine bande hyper-réflective dans la couche nucléaire externe. Ces lésions accompagnent communément une fibrose sous-rétinienne ou une atrophie (fig. 12-8) ;
les kystes dégénératifs, ou logettes dégénératives, apparaissent comme des images hyporéflectives de forme géométrique à limite nette, stable dans le temps, qu’il faut différencier des logettes exsudatives, plus rondes et sensibles aux anti-VEGF [17]. Ces tubulations et kystes ne font pas l’objet d’une indication thérapeutique.
Dernièrement, le développement de l’enhanced depth imaging–optical coherence tomography (EDI-OCT) a permis une meilleure visualisation de la choroïde, avec une définition accrue des couches profondes rétiniennes. Une nouvelle approche de l’OCT, appelée « en face », combine l’EDI-OCT avec une analyse transversale. Ainsi par exemple, l’analyse « en face » des NVC de type 1 révèle le trajet hyper-réflectif du réseau néovasculaire occulte au sein d’un DEP hyporéflectif (voir fig. 12-3) [18]. L’angio-OCT permet une visualisation des vaisseaux et néovaisseaux sans injection, grâce à une technologie analysant les flux vasculaires (voir fig. 12-1c, 12-3e et 12-4d).
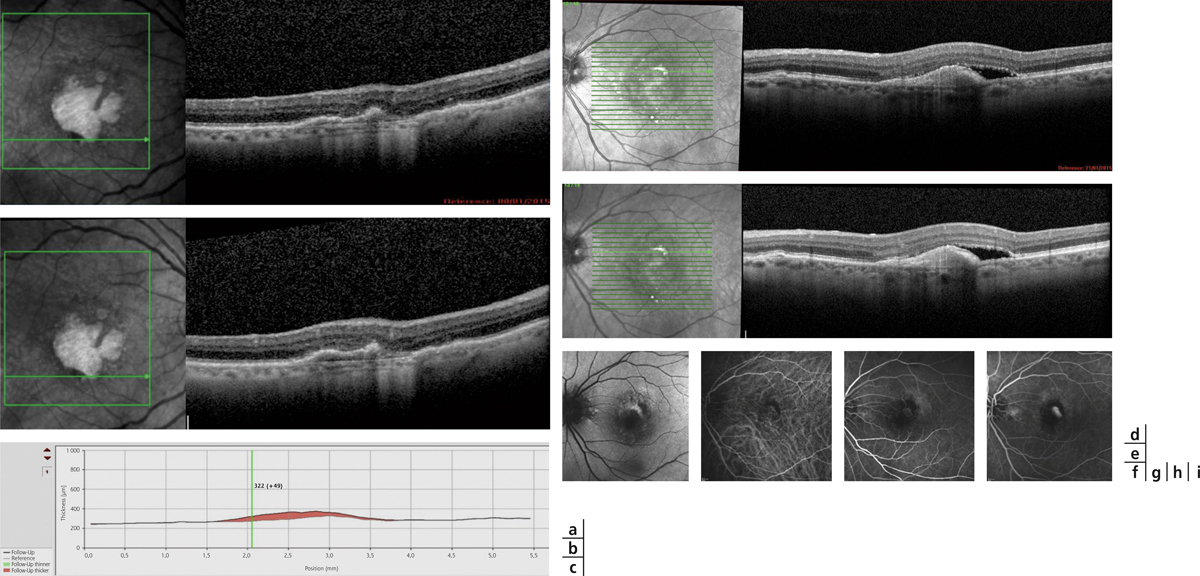
Fig. 12-6 Importance du suivi dans le temps.
a. SD-OCT d’un patient suivi pour des néovaisseaux choroïdiens compliquant une DMLA atrophique, sans signes d’exsudation. b. Même patient, 1 mois plus tard. Une analyse fine permet de mettre en évidence un épaississement neurorétinien au-dessus du DEP, signe précoce de récidive exsudative. c. Cet épaississement est mis en évidence par la fonction follow-up qui permet de chiffrer précisément cet épaississement. d. SD-OCT chez un patient présentant un DEP associé à une lame hyporéflective au-dessus de l’EP que l’on pourrait attribuer à une DSR, et donc à une exsudation. e. Même patient, 1 mois plus tard, sans traitement. L’aspect est identique. Il s’agissait en réalité d’une lésion vitelliforme, la lame hyporéflective correspondant à du matériel fragmenté, sans indication thérapeutique. f. Autofluorescence chez ce patient, retrouvant une hyper-autofluorescence du matériel. g. Angiographie à la fluorescéine au temps précoce. h. Angiographie à la fluorescéine au temps moyen. i. Angiographie à la fluorescéine au temps tardif. Il existe une simple coloration de la lésion sans diffusion.
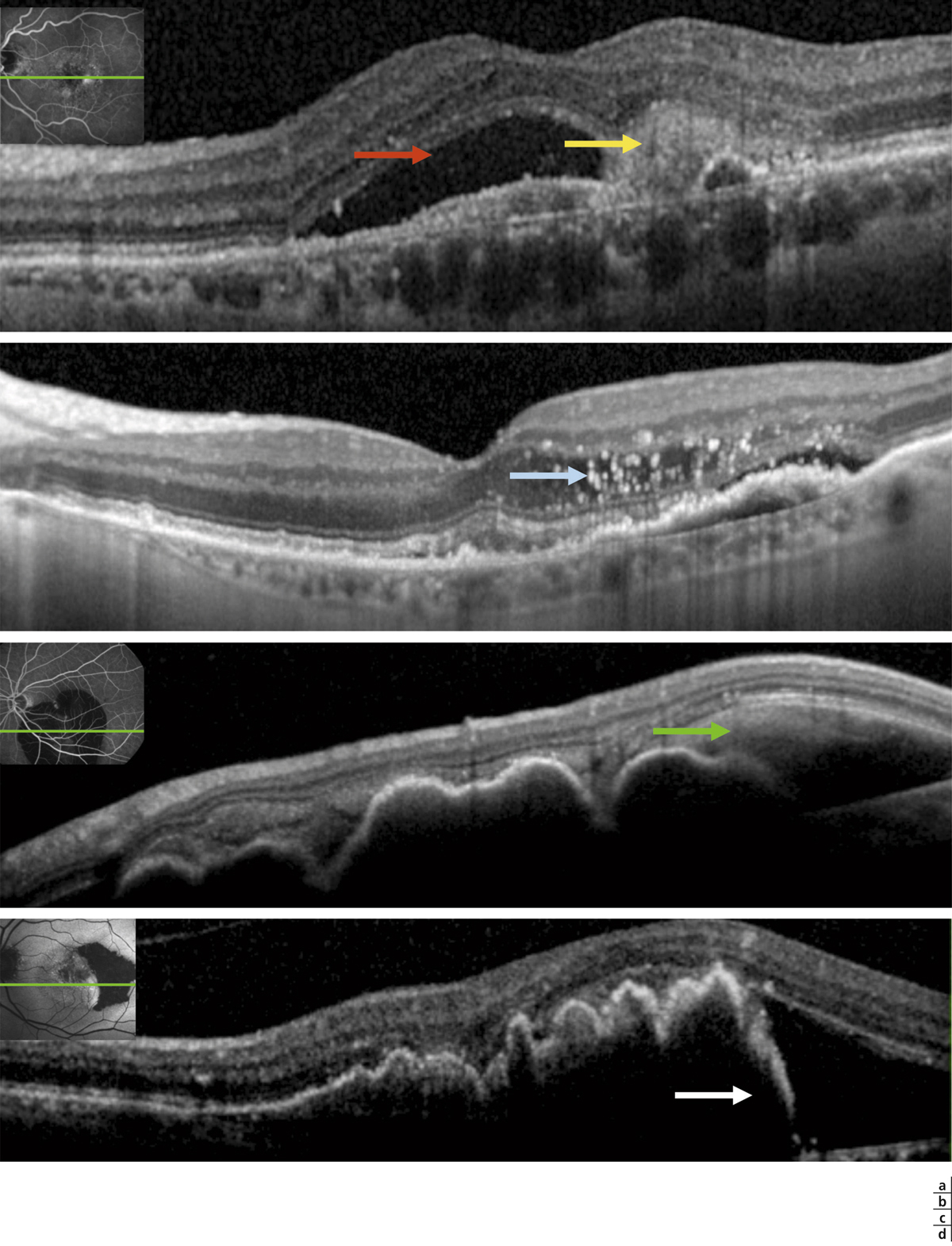
Fig. 12-7 Différentes hyper-réflectivités en OCT.
a. Décollement séreux rétinien « gris » (flèche jaune), surmontant un épaississement rétinien, à différencier du DSR classique noir (flèche rouge). b. Points hyper-réflectifs (flèche bleue). c. Hémorragie sous-rétinienne (flèche verte). d. Déchirure de l’épithélium pigmentaire (flèche blanche), avec DEP enroulé et hyper-réflectivité sous l’EP correspondant aux néovaisseaux sous-épithéliaux.
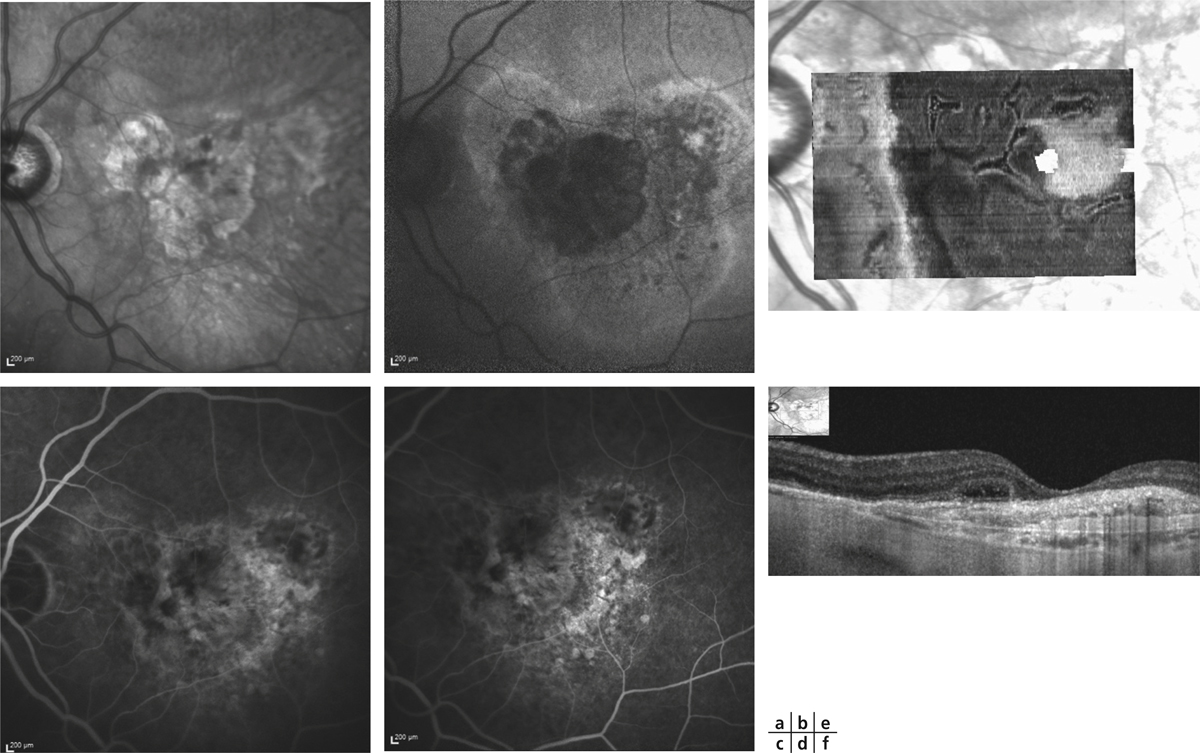
Fig. 12-8 Tubulations rétiniennes associées à une lésion fibro-atrophique chronique.
a. Cliché en infrarouge. b. Cliché en autofluorescence. c. Cliché au temps précoce de l’angiographie fluorescéinique (AF). d. Cliché au temps tardif de l’AF. e. OCT « en face » montrant l’aspect dendritique de ces tubulations. f. SD-OCT : tubulation rétinienne apparaissant comme une lésion ovalaire hyporéflective de la rétine externe, entourée d’une bande hyper-réflective.
L’activité néovasculaire dans la DMLA exsudative est idéalement appréciée par une approche multimodale pour un diagnostic étiologique le plus précis possible et l’élimination des diagnostics différentiels. Cette activité se traduit par la présence de saignement au fond d’œil, d’une diffusion angiographique, d’un épaississement diffus ou localisé neurorétinien, d’un DSR noir ou gris en OCT. Une évaluation comparative dans le temps est souvent nécessaire.
[1] Klein ML, Jorizzo PA, Watzke RC. Growth features of choroidal neovascular membranes in age related macular degeneration. Ophthalmology 1989 ; 96 : 1416-9.
[2] Ferris FL 3rd, Wilkinson CP, Bird A, et al. Beckman Initiative for Macular Research Classification Committee. Clinical classification of age-related macular degeneration. Ophthalmology 2013 ; 120 : 844-51.
[3] Semoun O, Guigui B, Tick S, et al. Infrared features of classic choroidal neovascularisation in exudative age-related macular degeneration. Br J Ophthalmol 2009 ; 93 : 182-5.
[4] Gaillard ER, Atherton SJ, Eldred G, et al. Photophysical studies on human retinal lipofuscin. Photochem Photobiol 1995 ; 61 : 448-53.
[5] Schmitz-Valckenberg S, Holz FG, Bird AC, Spaide RF. Fundus autofluorescence imaging. Retina 2008 ; 28 : 385-409.
[6] Von Ruckmann A, Fitzke FW, Bird AC. Distribution of fundus autofluorescence with a scanning laser ophthalmoscope. Br J Ophthalmol 1995 ; 79 : 407-12.
[7] Gass JDM. Stereoscopic atlas of macular disease : diagnosis and management. 4th ed. St. Louis : Mosby ; 1997, p. 24-6.
[8] Subfoveal neovascular lesions in age-related macular degeneration. Guidelines for evaluation and treatment in the macular photocoagulation study. Macular Photocoagulation Study Group. Arch Ophthalmol 1997 ; 109 : 1242-57.
[9] Roquet W, Roudot-Thoraval F, Coscas G, et al. Clinical features of drusenoid pigment epithelial detachment in age related macular degeneration. Br J Ophthalmol 2004 ; 88 : 638-42.
[10] Fernandes LH, Freund KB, Yannuzzi LA, et al. The nature of focal areas of hyperfluorescence or hot spots imaged with indocyanine green angiography. Retina 2002 ; 22 : 557-68.
[11] Gess AJ, Fung AE, Rodriguez JG. Imaging in neovascular age-related macular degeneration. Semin Ophthalmol 2011 ; 26 : 225-33.
[12] Ores R, Puche N, Querques G, et al. Gray hyper-reflective subretinal exudative lesions in exudative age-related macular degeneration. Am J Ophthalmol 2014 ; 158 : 354-61.
[13] Querques G, Srour M, Massamba N, et al. Functional characterization and multimodal imaging of treatment-naïve « quiescent » choroidal neovascularization. Invest Ophthalmol Vis Sci 2013 ; 54 : 6886-92.
[14] Querques G, Canouï-Poitrine F, Coscas F, et al. Analysis of progression of reticular pseudodrusen by spectral domain-optical coherence tomography. Invest Ophthalmol Vis Sci 2012 ; 53 : 1264-70.
[15] Querques G, Atmani K, Berboucha E, et al. Angiographic analysis of retinal-choroidal anastomosis by confocal scanning laser ophthalmoscopy technology and corresponding (eye-tracked) spectral-domain optical coherence tomography. Retina 2010 ; 30 : 222-34.
[16] Querques G, Souied EH, Freund KB. Multimodal imaging of early stage 1 type 3 neovascularization with simultaneous eye-tracked spectral-domain optical coherence tomography and high speed real time angiography. Retina 2013 ; 33 : 1881-7.
[17] Querques G, Coscas F, Forte R, et al. Cystoid macular degeneration in exudative age-related macular degeneration. Am J Ophthalmol 2011 ; 1 : 100-7.
[18] Coscas F, Coscas G, Querques G, et al. En face enhanced depth imaging optical coherence tomography of fibrovascular pigment epithelium detachment. Invest Ophthalmol Vis Sci 2012 ; 53 : 4147-51.
N. Leveziel
➤ Le laser et la photothérapie dynamique à la Visudyne® conservent certaines indications, isolément ou en traitement combiné.
➤ Les anti-VEGF représentent actuellement la meilleure thérapeutique de l’œdème maculaire compliquant la DMLA exsudative.
➤ La progression ou l’apparition de plages d’atrophie peut être favorisée par les anti-VEGF.
➤ La prise en charge de l’œdème maculaire compliquant la DMLA exsudative se confond avec la prise en charge de la DMLA exsudative, puisqu’il s’agit d’un signe d’activité néovasculaire.
, La DMLA exsudative a été la première pathologie rétinienne à pouvoir être traitée par photothérapie dynamique (photodynamic therapy [PDT]) à la vertéporfine, avant d’être supplantée par les anti-vascular endothelial growth factors (anti-VEGF) – ranibizumab, aflibercept et bévacizumab – qui se sont imposés comme traitement de référence ; il est à noter que le bévacizumab n’a pas reçu d’autorisation de mise sur le marché (AMM) dans cette indication.
La photocoagulation confluente périfovéale, utilisée avant l’ère de la PDT, n’est actuellement que rarement utilisée, éventuellement pour les formes évoluées de la maladie pour lesquelles une amélioration fonctionnelle n’est pas attendue et afin de limiter l’extension des lésions néovasculaires [1, 2]. Une méta-analyse américaine réalisée en 2007, à l’ère naissante des anti-VEGF, ne recommandait plus l’utilisation de cette approche thérapeutique [3].
Cependant, la photocoagulation directe au laser d’une anastomose choriorétinienne (ou néovaisseaux de type 3) localisée à distance de la fovéa demeure un traitement efficace tant sur la lésion néovasculaire que sur les phénomènes exsudatifs, à condition d’avoir réalisé une angiographie au vert d’indocyanine. Celle-ci permet d’une part de visualiser l’anastomose et d’autre part d’éliminer une néovascularisation occulte potentiellement associée à l’anastomose. Dans ce dernier cas de figure, la photocoagulation n’est pas recommandée.
Les principes et la technique de la photothérapie dynamique sont exposés dans le chapitre 6.5.
La photothérapie dynamique à la Visudyne® a obtenu l’AMM dans les néovaisseaux à prédominance visible (AMM européenne le 27/07/2000) ou les néovaisseaux occultes montrant des signes d’évolution récente ou en cours (22/08/2002) dans la DMLA et dans les néovaisseaux compliquant la myopie forte (20/03/2001). Le rapport de la commission de transparence du 17/10/2012 considère que cette thérapeutique constitue actuellement un traitement de seconde intention dans les néovaisseaux choroïdiens à prédominance visible, et n’est plus recommandée dans les néovaisseaux de type occulte puisqu’il existe des alternatives thérapeutiques (anti-VEGF).
Cette approche thérapeutique est encore utile en cas de lésion évoluée, permettant d’obtenir la fibrose des lésions et de réduire les phénomènes exsudatifs, lorsque l’utilisation des anti-VEGF s’avère inefficace [4]. Elle est aussi utilisée en combinaison avec les anti-VEGF dans certaines formes cliniques de la maladie comme la vasculopathie choroïdienne polypoïdale. Dans cette dernière forme clinique, un essai comparatif a montré que le ranibizumab utilisé en monothérapie est supérieur à la PDT seule en termes de résultats fonctionnels [5].
Par ailleurs, le traitement combiné a été recommandé par un panel d’experts, l’initiation du traitement consistant en trois injections intravitréennes d’anti-VEGF avec une PDT initiale. Après cette période d’induction, ils proposent un traitement par anti-VEGF en cas de disparition des polypes et de persistance de phénomènes exsudatifs, et un traitement combiné en cas de disparition incomplète des polypes [6]. Avant de débuter le traitement, et au cours du traitement, l’utilisation de l’angiographie au vert d’indocyanine reste très utile pour mettre précisément en évidence les polypes, ainsi que le réseau vasculaire choroïdien dilaté pouvant être raccordé aux polypes.
Les caractéristiques principales des anti-VEGF et leur pharmacocinétique sont exposées dans le chapitre 6.3.
Dans l’étude MARINA, 716 patients ayant des néovaisseaux occultes ou des formes à prédominance occulte ont été randomisés en trois bras différents (injection simulée, n = 238 ; ranibizumab 0,3 mg en injection mensuelle, n = 238 ; ranibizumab 0,5 mg en injection mensuelle, n = 240) [7].
Le gain moyen d’acuité visuelle à 24 mois était respectivement de 5,4 et 6,6 lettres dans les bras 0,3 et 0,5 mg, alors qu’une perte moyenne de 14,9 lettres était rapportée dans le bras contrôle. À 24 mois, le pourcentage de patients ayant perdu moins de 15 lettres de meilleure acuité visuelle corrigée (MAVC) était significativement plus important avec le ranibizumab (92 % à la dose de 0,3 mg et 90 % à la dose de 0,5 mg) qu’avec les injections simulées (52,9 %).
L’étude ANCHOR a inclus 423 patients avec néovaisseaux visibles prédominants, avec une randomisation en trois bras (PDT tous les 3 mois si nécessaire et injection simulée, n = 143 ; injections mensuelles de ranibizumab 0,3 mg, n = 140 ; injections mensuelles de ranibizumab 0,5 mg, n = 140). À 24 mois, les bras recevant une injection de 0,3 et 0,5 mg avaient des gains moyens d’acuité visuelle (AV) de 8,1 et de 10,7 lettres respectivement, alors que le bras PDT-injection simulée perdait en moyenne 9,8 lettres (p < 0,0001) [4].
Dans l’étude PIER ayant inclus 184 patients, le ranibizumab à la dose de 0,5 (n = 61) ou 0,3 mg (n = 60) a été comparé à des injections simulées chez des patients ayant des néovaisseaux occultes, des néovaisseaux à prédominance visible et des néovaisseaux occultes prédominants [8].
Le schéma de traitement était une injection intravitréenne à trois reprises pendant 3 mois puis trimestrielle, en comparaison à l’injection simulée (n = 63). À 12 mois, le pourcentage de patients ayant perdu moins de 15 lettres était significativement plus important avec le ranibizumab 0,3 mg (83,3 %) et 0,5 mg (90,2 %) qu’avec le bras contrôle (49,2 %). La perte en lettres était significativement plus faible dans les bras ranibizumab 0,3 mg (–1,6 lettre) et 0,5 mg (–0,2 lettre) que dans le bras injections simulées (–16,3 lettres), avec des résultats visuels largement moins bons que dans les deux autres études précédentes, ceci démontrant qu’un régime d’injections intravitréennes tous les 3 mois n’est généralement pas suffisant dans la DMLA exsudative.
Si les études pivotales montrent en général de bons résultats visuels dans les bras anti-VEGF au cours de la phase initiale (fig. 12-9), les études d’extension des grands essais cliniques ont montré une dégradation progressive de l’AV avec le passage à un régime allégé, notamment avec le passage en mode PRN (pro renata). Ainsi l’étude Seven-up constitue une étude d’extension des patients inclus initialement dans les études MARINA et ANCHOR, traités pendant 2 ans par injections mensuelles de ranibizumab puis en mode PRN. Cette étude montre une diminution progressive de l’AV à partir du passage en mode PRN avec des visites de suivi non systématiques (fig. 12-10) [9].
Au contraire, la phase d’extension de l’étude VIEW 1 menée de la deuxième année à la quatrième année constitue plutôt l’exemple inverse, car elle démontre qu’un régime PRN basé sur une surveillance mensuelle et associé à une injection systématique tous les 3 mois se traduit par une relative préservation visuelle, avec une AV à 62 lettres au terme du suivi (gain de + 6,8 lettres par rapport à l’AV initiale). Mais il s’agit là d’un régime plus strict, avec des contrôles réguliers et des injections programmées (fig. 12-11).
Si les résultats des études pivotales ont représenté un tournant majeur dans l’histoire de la DMLA, la prise en charge des patients en pratique quotidienne se solde en général par des résultats fonctionnels et anatomiques moins remarquables, ceci étant principalement expliqué par le protocole de traitement parfois allégé (PRN) ou une difficulté de suivi mensuel des patients (fig. 12-12) [10, 11]. En effet, les symptômes évocateurs de récurrences, baisse de l’AV, aggravation ou apparition de métamorphospies ou d’un scotome, sont en général précédés par des signes de récurrence anatomique (réapparition de logettes, de fluide sous-rétinien, accentuation du DEP, nouvelle hémorragie rétinienne).
En outre, le développement de lésions atrophiques a été rapporté dans différentes études [12]. À ce titre, le régime de traitement mensuel, la présence de lésions atrophiques dans l’œil adelphe ou de logettes intrarétiniennes dans l’œil traité ou la présence d’une anastomose choriorétinienne représentent des facteurs de risque de développement d’une atrophie géographique durant le traitement. Au contraire, la présence d’un décollement de l’épithélium pigmentaire ou d’un décollement séreux rétinien constituerait des facteurs protecteurs (tableau 12-2).
Dans ce contexte, un traitement débutant par trois injections mensuelles puis poursuivi par des injections progressivement espacées (« treat and extent »), adapté au délai avant récidive pour chaque patient, semble présenter un bon compromis entre un nombre d’injections acceptable (au prix d’injections parfois non justifiées au regard des critères cliniques) et un suivi de réalisation plus aisée [13].
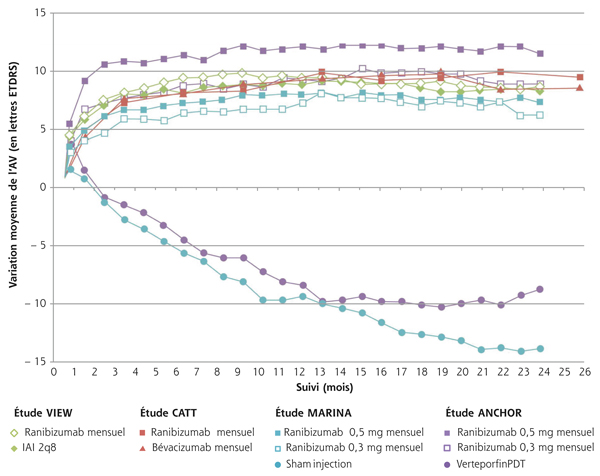
Fig. 12-9 Résultats fonctionnels au cours des principales études pivotales.
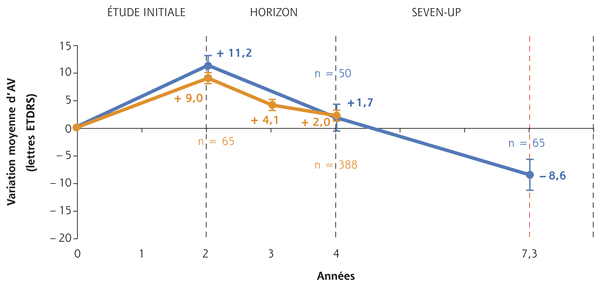
Fig. 12-10 Phase d’extension des études MARINA et ANCHOR : étude Seven-up. Résultats fonctionnels.
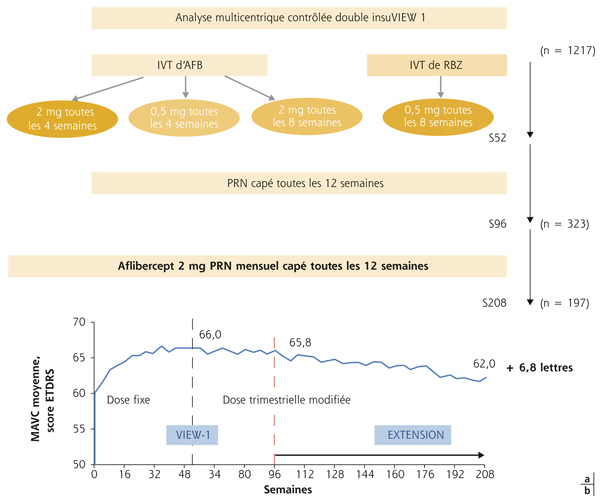
Fig. 12-11 Dégénérescence maculaire liée à l’âge.
Étude d’extension à 208 semaines de l’étude VIEW 1 (a). Phase d’extension de VIEW 1 : résultats fonctionnels (b).
AFB : aflibercept ; IVT : injection intravitréenne ; MAVC : meilleure acuité visuelle corrigée ; RBZ : ranibizumab.
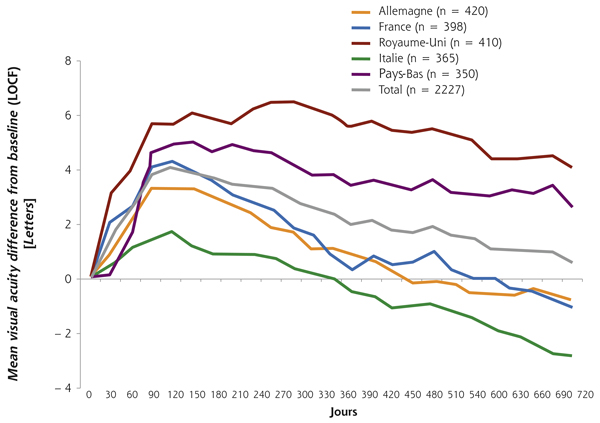
Fig. 12-12 Anti-VEGF et DMLA exsudative en vie réelle : résultats fonctionnels dans une étude multicentrique européenne (étude AURA).
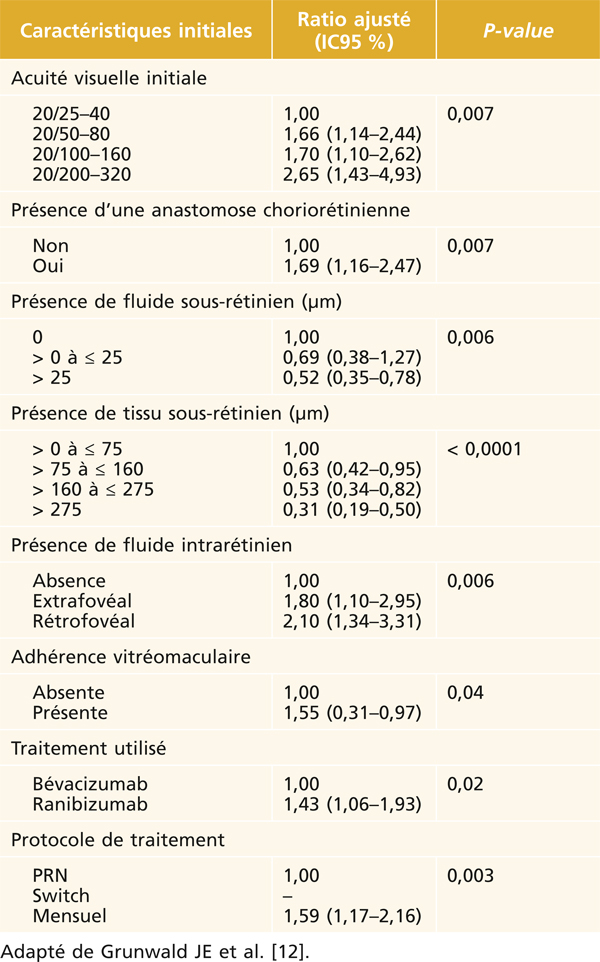
Tableau 12-2 – Étude CATT. Principaux facteurs associés au développement de l’atrophie géographique dans l’œil traité.
Les deux études pivotales VIEW 1 et VIEW 2 se sont déroulées entre août 2008 et septembre 2010 aux États-Unis et au Canada (VIEW 1) et entre avril 2008 et septembre 2010 en Asie, Europe et Amérique du Sud (VIEW 2) [14]. Elles ont comporté quatre bras différents avec un schéma fixe la première année : ranibizumab 0,5 mg mensuel (RQ4), aflibercept 0,5 mg mensuel (0,5Q4), aflibercept 2 mg mensuel (2Q4), aflibercept 2 mg tous les 2 mois (2Q8) après trois injections initiales. Au cours de la seconde année, le schéma de traitement est un protocole PRN, capé à 12 semaines (injections systématiques à 12 semaines, même en absence de signes exsudatifs). Une nouvelle injection était préconisée en cas d’augmentation de l’épaisseur rétinienne centrale de 100 µm ou plus, une baisse visuelle de 5 lettres ETDRS (Early Treatment Diabetic Retinopathy Study) ou plus associée à la présence de fluide en OCT, la récidive ou la persistance des phénomènes exsudatifs, une diffusion angiographique ou une nouvelle hémorragie rétinienne maculaire. En regroupant ces deux études au protocole identique, 2170 patients ont pu être inclus dans l’analyse du critère de jugement principal et 2412 patients pour l’analyse des principaux critères de jugement secondaires au terme de la première année de traitement.
À 1 an, la variation moyenne d’AV était de + 8,7 lettres pour le groupe RQ4, + 9,3 lettres pour le groupe 2Q4 ; + 8,3 lettres pour le groupe 0,5Q4 et + 8,4 lettres dans le groupe 2Q8. La proportion de patients gagnant au moins 15 lettres à 1 an est de 32,4 % dans le groupe RQ4 et de 31 % dans le groupe 2Q8 (pas de différence significative). À 2 ans, la proportion de patients gagnant au moins 15 lettres à 1 an est de 31,6 % dans le groupe RQ4 et de 33,4 % dans le groupe 2Q8 (pas de différence significative). En termes de variation d’épaisseur rétinienne centrale, une réduction plus importante était observée dans le groupe 2Q8 par rapport au groupe RQ4. Ainsi, à 2 ans, la réduction d’épaisseur rétinienne centrale était de –121 µm (± 116) dans le groupe 2Q8, et de 114 ± 110 µm dans le groupe RQ4 dans l’étude VIEW 1. Une tendance similaire était observée dans l’étude VIEW 2. Le pourcentage d’yeux ne présentant pas de phénomènes exsudatifs était de 68 % dans le groupe 2Q8 et de 62 % dans le groupe RQ4 à 1 an et de 50 % et 45 % à 2 ans pour ces deux groupes.
En pratique quotidienne, il semble difficile de distinguer précisément laquelle des deux molécules, ranibizumab ou aflibercept, est la plus efficace, simplement parce que ces deux molécules sont toutes deux remarquablement efficaces quand on garde à l’esprit les thérapeutiques antérieures. Il nous faudra dans l’avenir définir plus précisément les indications de chacun de ces deux traitements.
Le bévacizumab est la thérapeutique la plus fréquemment utilisée dans la DMLA et dans l’œdème maculaire diabétique aux États-Unis et dans le monde, en dehors de l’Europe où une hétérogénéité d’utilisation est fréquente selon les pays. Dans ce contexte, la commission d’évaluation initiale du rapport bénéfice/risque des produits de santé de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) s’est prononcée en faveur de l’utilisation du bévacizumab dans le traitement de la DMLA sous la forme d’une recommandation temporaire d’utilisation (RTU) en ophtalmologie. Des études à grande échelle et au long cours sont nécessaires pour évaluer la bonne tolérance du produit discutée dans certaines études [15, 16].
En pratique, les anti-VEGF actuellement largement utilisés en France, le ranibizumab et l’aflibercept, sont globalement équivalents en termes de résultats fonctionnels pour le traitement de la DMLA. Leur innocuité, tant locale que systémique relativement bonne, doit être mise en balance avec les facteurs de risque cardiovasculaires de chaque patient. Le régime de traitement mensuel est plus souvent associé à un risque cardiovasculaire augmenté (fig. 12-13).
Le régime de traitement semblant être actuellement privilégié est le régime « inject and extend ». Il permet un espacement progressif des visites et des injections, et en fonction du délai observé avant la première récidive, il permet de prévenir, grâce à la réalisation par la suite d’une injection systématique, une nouvelle récidive.
Une mention particulière est l’évolution d’une forme initialement exsudative vers une forme atrophique. Différents facteurs de risque d’évolution vers l’apparition d’une atrophie géographique sous traitement anti-VEGF ont été identifiés et doivent être pris en compte dans notre attitude thérapeutique.
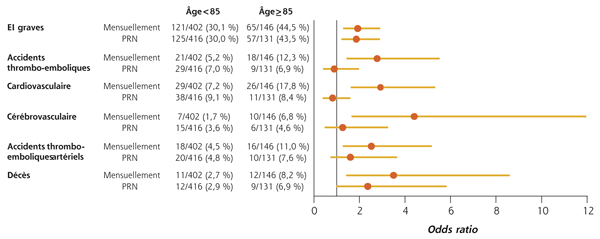
Fig. 12-13 Anti-VEGF et événements cardiovasculaires. Comparaison du schéma PRN au schéma mensuel en fonction de l’âge.
EI : événement indésirable ; PRN : pro renata.
(Source : adapté de Dugel PU et al., AAO 2013.)
[1] Coscas G, Soubrane G, Ramahefasolo C, Fardeau C. Perifoveal laser treatment for subfoveal choroidal new vessels in age-related macular degeneration. Results of a randomized clinical trial. Arch Ophthalmol 1991 ; 109 : 1258-65.
[2] Spraul CW, Lang GE, Lang GK. Results of perifoveal argon laser coagulation of subfoveal choroid neovascularization in age related macular degeneration. Ophthalmologe 1995 ; 92 : 640-6.
[3] Virgili G, Bini A. Laser photocoagulation for neovascular age-related macular degeneration. Cochrane Database Syst Rev 2007 ; 18 : CD004763.
[4] Brown DM, Kaiser PK, Michels M, et al. ; Anchor Study Group. Ranibizumab versus verteporfin for neovascular age-related macular degeneration. N Engl J Med 2006 ; 355 : 1432-44.
[5] Oishi A, Kojima H, Mandai M, et al. Comparison of the effect of ranibizumab and verteporfin for polypoidal choroidal vasculopathy : 12-month LAPTOP study results. Am J Ophthalmol 2013 ; 156 : 644-51.
[6] Koh AH, EXPERT PCV PANEL, Chen LJ, Chen SJ, et al. Polypoidal choroidal vasculopathy: evidence-based guidelines for clinical diagnosis and treatment. Retina 2013 ; 33 : 686-716.
[7] Rosenfeld PJ, Brown DM, Heier JS, et al. ; MARINA STUDY GROUP. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med 2006 ; 355 : 1419-31.
[8] Regillo CD, Brown DM, Abraham P, et al. Randomized, double-masked, sham-controlled trial of ranibizumab for neovascular age-related macular degeneration : PIER Study year 1. Am J Ophthalmol 2008 ; 145 : 239-48.
[9] Rofagha S, Bhisitkul RB, Boyer DS, et al. ; SEVEN-UP STUDY GROUP. Seven-year outcomes in ranibizumab-treated patients in ANCHOR, MARINA, and HORIZON : a multicenter cohort study (SEVEN-UP). Ophthalmology 2013 ; 120 : 2292-9.
[10] Cohen SY, Mimoun G, Oubraham H, et al. ; LUMIERE STUDY GROUP. Changes in visual acuity in patients with wet age-related macular degeneration treated with intravitreal ranibizumab in daily clinical practice : the LUMIERE study. Retina 2013 ; 33 : 474-81.
[11] Holz FG, Tadayoni R, Beatty S, et al. Multi-country real-life experience of anti-vascular endothelial growth factor therapy for wet age-related macular degeneration. Br J Ophthalmol 2015 ; 99 : 220-6.
[12] Grunwald JE, Daniel E, Huang J, et al. ; CATT RESEARCH GROUP. Risk of geographic atrophy in the comparison of age-related macular degeneration treatments trials. Ophthalmology 2014 ; 121 : 150-61.
[13] Oubraham H, Cohen SY, Samimi S, et al. Inject and extend dosing versus dosing as needed: a comparative retrospective study of ranibizumab in exudative age-related macular degeneration. Retina 2011 ; 31 : 26-30.
[14] Heier JS, Brown DM, Chong V, et al. ; VIEW 1 and VIEW 2 Study Groups. Intravitreal aflibercept (VEGF trap-eye) in wet age-related macular degeneration. Ophthalmology 2012 ; 119 : 2537-48.
[15] Kodjikian L, Decullier E, Souied EH, et al. Bevacizumab and ranibizumab for neovascular age-related macular degeneration: an updated meta-analysis of randomised clinical trials. Graefes Arch Clin Exp Ophthalmol 2014 ; 252 : 1529-37.
[16] Moja L, Lucenteforte E, Kwag KH, et al. Systemic safety of bévacizumab versus ranibizumab for neovascular age-related macular degeneration. Cochrane Database Syst Rev 2014 ; 15 : CD011230.
S.-Y. Cohen, B. Wolf
➤ Plusieurs lésions peuvent simuler une DMLA exsudative : les kystes intrarétiniens dégénératifs, les tubulations, le matériel sous-rétinien.
➤ Les kystes intrarétiniens associés à l’atrophie siègent dans la couche nucléaire interne. Ils correspondraient à une dégénérescence des cellules de Müller.
➤ Les tubulations siègent dans la rétine externe : elles apparaissent sous forme de lésions hyporéflectives entourées d’un anneau hyper-réflectif. Il pourrait s’agir de photorécepteurs dégénérés qui se regroupent en une structure circulaire ou ovoïde.
➤ Les dépôts de matériels sous-rétiniens peuvent se rencontrer dans de nombreuses affections : dystrophie pseudo-vitelliforme de l’adulte, dystrophies réticulées, dépôts de matériels sous-rétiniens associés aux drusen cuticulaires. En cas de drusen cuticulaires, ils peuvent être difficiles à différencier des néovaisseaux sous-rétiniens.
La reconnaissance de l’œdème en tant que manifestation exsudative est essentielle dans l’évaluation initiale d’un patient présentant une dégénérescence maculaire liée à l’âge (DMLA) comme au cours du suivi post-thérapeutique. En effet, la présence de manifestations exsudatives, décollement séreux rétinien ou œdème microkystique, permet en routine la classification de la DMLA dans le cadre des formes néovasculaires ou exsudatives, également appelées « humides ». Les conséquences thérapeutiques sont importantes amenant à proposer des traitements actifs, parfois invasifs.
Différentes lésions peuvent simuler les manifestations exsudatives de la DMLA. Trois principaux pièges diagnostiques sont évoqués ici : les kystes dégénératifs compliquant la DMLA atrophique, les tubulations de la rétine externe et les décollements séreux rétiniens liés à la présence d’un matériel sous-rétinien.
Les pseudo-kystes rétiniens associés à l’atrophie géographique ont été décrits en 2010 [1]. Dans une étude portant sur 88 yeux, présentant une atrophie géographique, les auteurs ont rapporté la présence de pseudo-kystes dans 24 yeux (27,2 %). Ces pseudo-kystes correspondaient à des petites cavités cystoïdes situées habituellement au niveau de la couche nucléaire interne de la rétine. Ces kystes, analysés en tomographie à cohérence optique de type spectral-domain (SD-OCT), correspondaient toujours à des zones d’atrophie formelle de l’épithélium pigmentaire. Lorsqu’une angiographie avait été réalisée, elle ne mettait en évidence aucune diffusion anormale de colorant. De plus, la présence de ces kystes ne s’associait pas à un épaississement de la rétine sensorielle, permettant d’éliminer un véritable œdème. L’hypothèse pathogénique proposée était une dégénérescence des cellules de Müller, par analogie à ce qui est suspecté dans d’autres maladies dégénératives telles que l’intoxication au tamoxifène ou la dégénérescence rétinienne associée aux télangiectasies maculaire de type II. Il n’y avait pas de correspondance entre la présence de ces kystes et le type d’atrophie géographique (homogène, homogène avec épargne fovéolaire, en fer à cheval ou diffuse).
Les kystes associés à l’atrophie peuvent être uniques ou multiples. Devant leur présence, il convient de comparer l’image OCT à l’imagerie en autofluorescence pour bien vérifier la coïncidence anatomique des deux éléments (fig. 12-14). En cas de doute sur un épaississement rétinien, il est préférable d’effectuer un examen angiographique pour vérifier l’absence de néovaisseau associé.
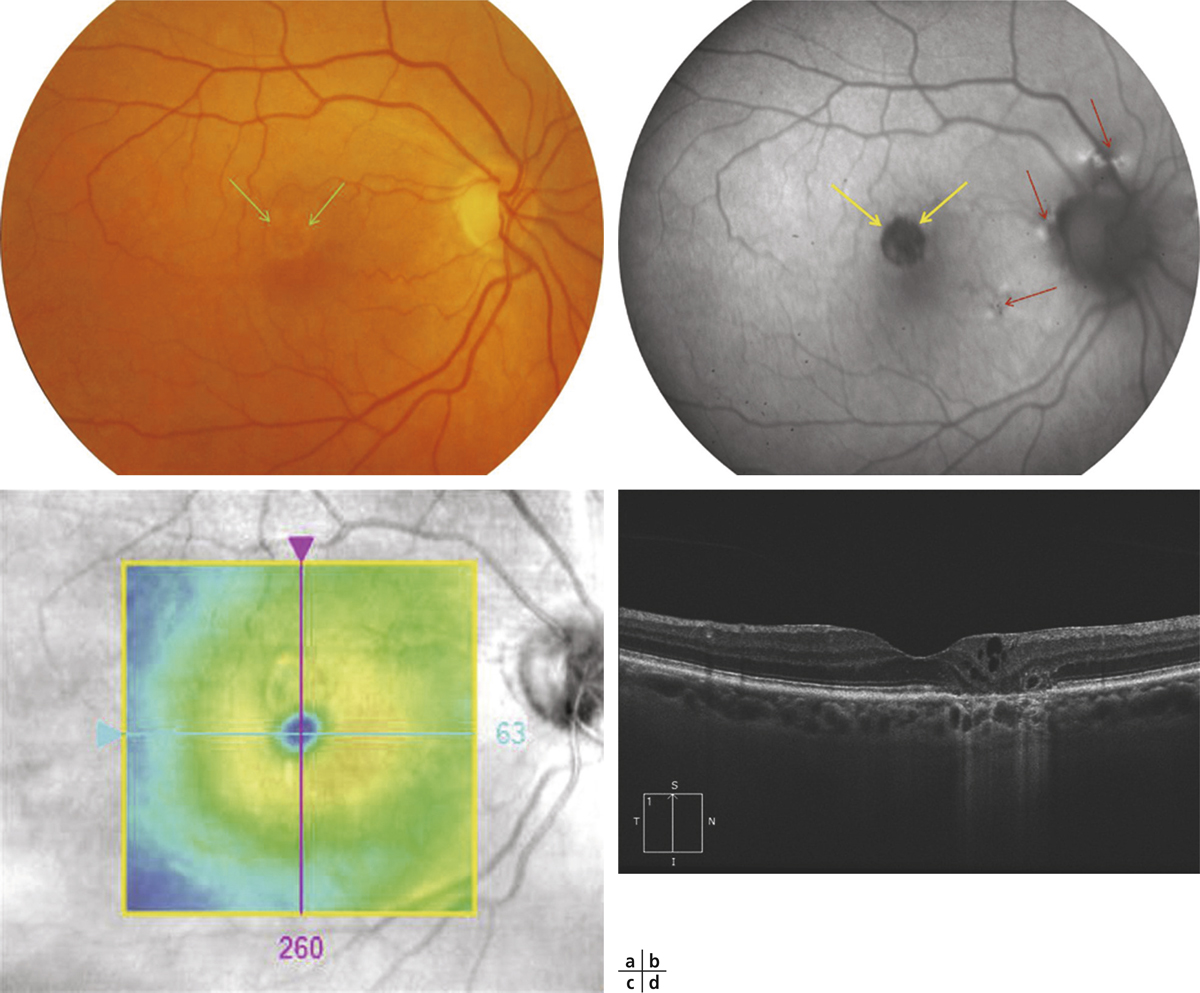
Fig. 12-14 Pseudokystes associés à l’atrophie rétinienne.
Anomalie du reflet supéromaculaire avec image claire, arrondie à bord net (a). En autofluorescence, la lésion atrophique apparaît ronde, à bord très net. On note des altérations pigmentaires de voisinage (b). En OCT, la cartographie est peu perturbée (c), mais la coupe verticale met très bien en évidence des pseudo-kystes intrarétiniens sans épaississement de la rétine sensorielle (d). Noter l’existence d’une zone d’hyper-réflectivité correspondant à l’atrophie géographique localisée. On note également l’interruption de la ligne des photorécepteurs.
Les tubulations de la rétine externe ont été décrites en 2009 [2], grâce à l’apport du SD-OCT. Ces tubulations apparaissent comme des lésions hyporéflectives, rondes, pouvant contenir quelques petits points hyper-réflectifs à l’intérieur. Leur caractéristique principale est d’être entourée d’un anneau hyper-réflectif homogène (fig. 12-15). Ces anomalies se situent toujours au niveau de la couche nucléaire externe de la rétine. Dans l’étude initiale, 69 yeux de 63 patients ont été examinés par OCT. Des ramifications tubulaires ont été identifiées dans la rétine externe de 54 patients atteints de DMLA et de 9 patients présentant d’autres maladies dégénératives. Les tubules mesuraient de 40 à 140 µ de hauteur et de 40 à 2 060 µ de largeur. De véritables réseaux de tubulations ont été identifiés chez certains patients. Ces tubulations étaient habituellement stables au cours du suivi. L’hypothèse des auteurs est qu’il pourrait s’agir de photorécepteurs dégénérés qui se regroupent en une structure circulaire ou ovoïde.
D’autres études sont venues confirmer l’existence de ces lésions. Elles ont permis de confirmer la présence de ces lésions en cas de DMLA néovasculaire à un stade cicatriciel ou devant une DMLA de type atrophique (fig. 12-16 à 12-18) [3, 4]. Les tubulations peuvent former des réseaux qui sont particulièrement bien analysés en OCT « en face » [5]. Les auteurs montrent des réseaux de ramification ressemblant aux cellules dendritiques. Cet aspect est plus souvent rencontré en regard des lésions fibreuses correspondant à l’évolution de néovaisseaux choroïdiens compliquant la DMLA. Dans les formes atrophiques, l’aspect est souvent un peu différent avec une disposition périlésionnelle des tubules autour des limites de la zone atrophique.
La valeur pronostique de ces tubulations est discutée. La présence de tubulations a été associée à une vitesse d’extension un peu plus rapide de l’atrophie géographique [6]. Cependant, une autre étude a mis en évidence l’inverse, avec une vitesse d’extension plus faible dans les yeux présentant des tubulations de la rétine externe par rapport à ceux qui n’en présentaient pas. Il s’agissait d’une analyse en sous-groupes des patients enrôlés dans l’étude Mahalo [7]. Dans l’étude CATT, la présence de tubulations a été observée plus fréquemment dans les yeux qui avaient, à l’inclusion, une mauvaise acuité visuelle, une atrophie géographique déjà présente ou une lésion de plus grande taille. Leur développement n’était pas associé à l’utilisation du ranibizumab ou du bévacizumab. L’acuité visuelle à la fin de l’étude était moins bonne dans les yeux présentant des tubulations que dans les yeux sans tubulations, de façon statistiquement significative [8].
Les tubulations de la rétine externe ne sont pas spécifiques de la DMLA. Elles peuvent être rencontrées dans les dystrophies réticulées, les acute zonal occult outer retinopathy (AZOOR), les rétinites pigmentaires, la maladie de Stargardt, l’atrophie gyrée ou la choroïdérémie ou encore le pseudo-xanthome élastique [9–11].
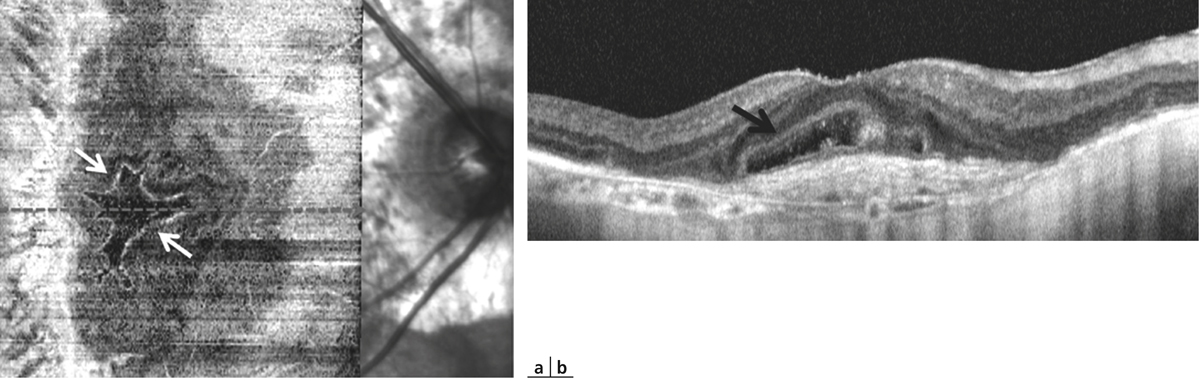
Fig. 12-15 Tubulations rétiniennes en regard d’une lésion néovasculaire fibrosée.
L’OCT en face (a) passant par la lésion retrouve l’aspect en « pseudo-dendrite » des tubulations (flèches). L’OCT B-scan (b) montre une lésion hyporéflective entourée d’une bordure hyper-réflective (flèche) et localisée dans la couche nucléaire externe.
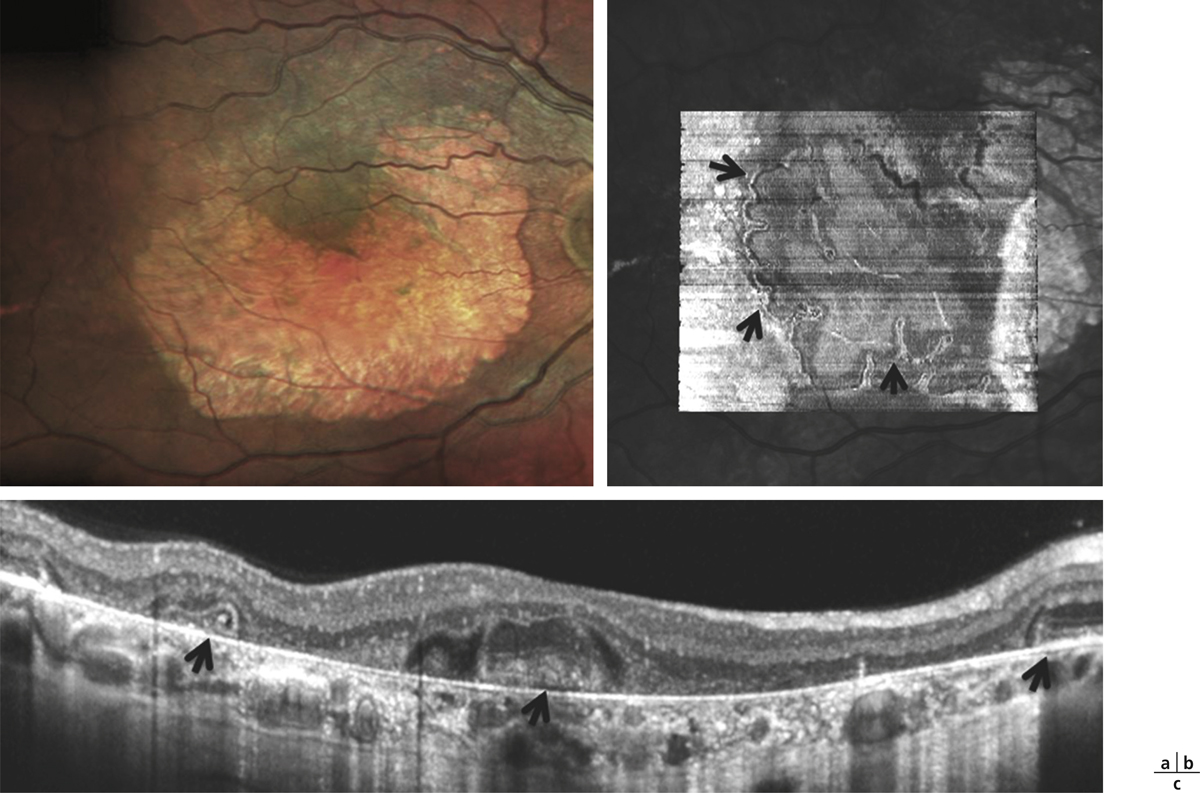
Fig. 12-16 Tubulations rétiniennes observées dans un contexte de DMLA atrophique.
Le cliché en pseudo-couleurs (a) montre une lésion atrophique en fer à cheval. L’OCT B-scan (c) objective la présence de lésions hyporéflectives (flèches) à bordure hyper-réflective, localisées dans la couche nucléaire externe. L’OCT « en face » (b) met en évidence le réseau tubulaire épousant les contours de la lésion atrophique (flèches).
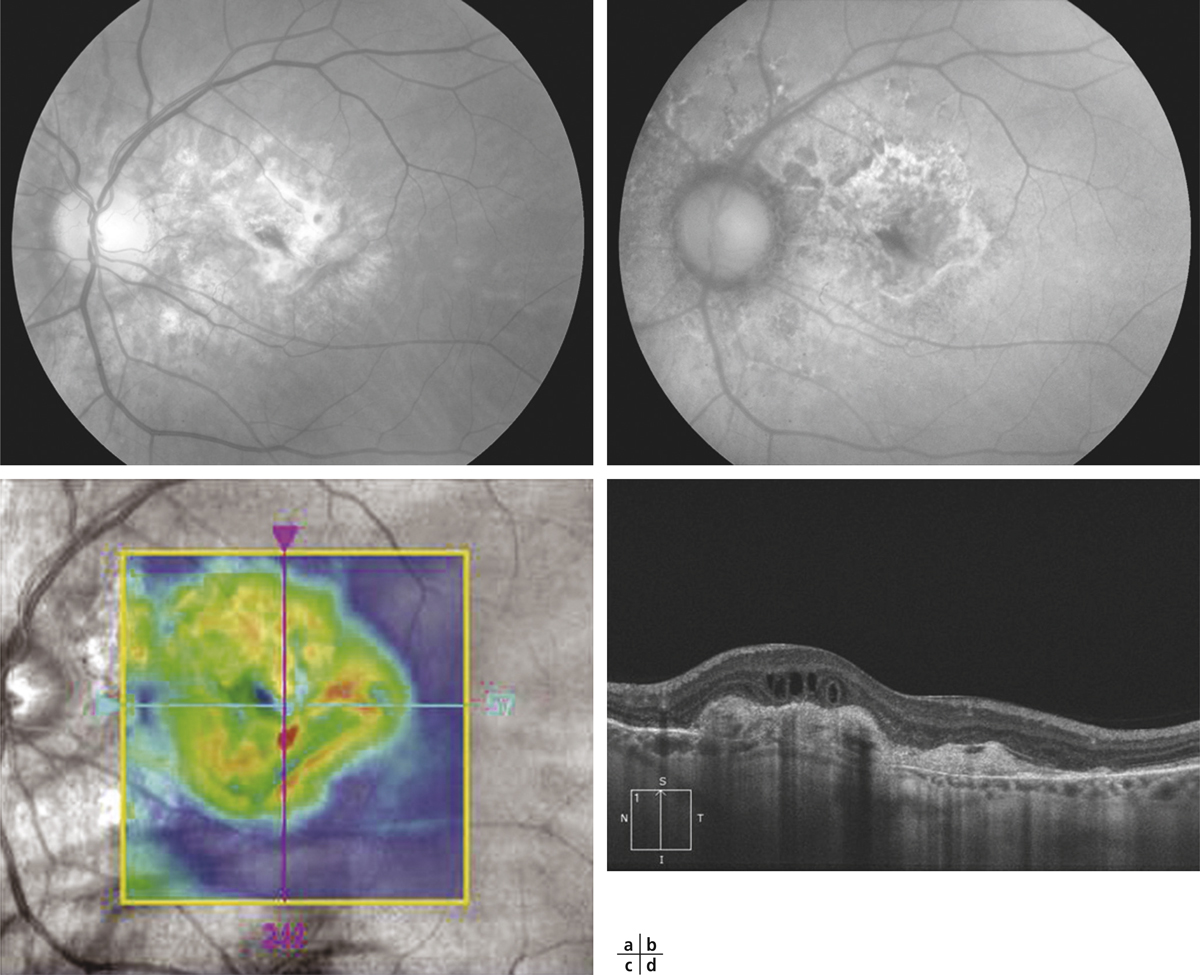
Fig. 12-17 Tubulations associées à une DMLA néovasculaire à un stade fibreux.
Cliché en lumière verte d’une dégénérescence maculaire néovasculaire à un stade fibreux (a). De nombreuses zones d’atrophie se situent en inter-papillo-maculaire en autofluorescence (b). La cartographie de l’OCT (mapping) montre une désorganisation importante de la rétine sensorielle (c). La coupe verticale passant par la fovéola montre un épaississement de la couche profonde correspondant à la cicatrice fibreuse du néovaisseau (d). La coupe met en évidence deux types de lésions : une tubulation typique avec une paroi hyper-réflective, mais également des kystes d’œdème intrarétinien résiduel chez ce patient déjà traité à plusieurs reprises par injections intravitréennes d’anti-VEGF. Cette image permet de bien différencier l’aspect anatomique de l’œdème qui correspond à une exsudation résiduelle par rapport à la tubulation qui correspond à une lésion cicatricielle, non active.
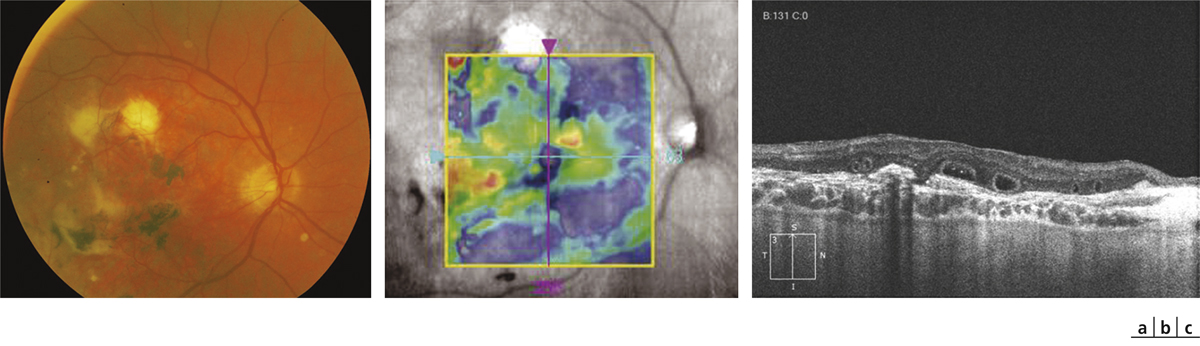
Fig. 12-18 Tubulations associées à une DMLA à un stade cicatriciel.
Cliché en couleurs montrant une lésion cicatricielle disciforme avec des mottes pigmentées et de la fibrose (a). La cartographie (mapping) de l’OCT montre une désorganisation de la rétine avec alternance de zones surélevées et de zones amincies (b). La coupe verticale passant par la macula montre des tubulations typiques surmontant la fibrose (c). Les tubulations sont de taille variable. Elles présentent une paroi caractéristique hyper-réflective.
Les dépôts de matériels sous-rétiniens et les décollements séreux rétiniens chroniques qui peuvent aboutir à ces dépôts sont retrouvés dans de nombreuses affections : dystrophie pseudo-vitelliforme de l’adulte, dystrophies réticulées, dépôts de matériels sous-rétiniens associés aux drusen cuticulaires, pseudo-xanthome élastique, choriorétinopathie séreuse centrale chronique, etc. [12–18].
Les dépôts des dystrophies pseudo-vitelliformes sont habituellement facilement reconnus sur l’existence d’une lésion unique centrale, correspondant à une accumulation de matériel bien individualisée en OCT [12–14]. En cas de doute diagnostique, l’angiographie montre une coloration progressive du matériel par ses berges donnant une image annulaire caractéristique.
L’analyse OCT de ces lésions montre fréquemment un soulèvement de la rétine sensorielle associé à l’existence de lésions hyper-réflectives, correspondant à l’accumulation du matériel. Ce matériel peut prendre un aspect en pseudo-hypopion caractéristique avec une différence importante entre coupes verticales et coupes horizontales traduisant le caractère déclive du dépôt, lié à la gravitation [18–20]. Il est à souligner que, habituellement, les patients ne ressentent pas de baisse d’acuité visuelle majeure. Les symptômes sont en général mineurs, correspondant à une petite perte d’acuité visuelle associée à des métamorphopsies assez stables.
La reconnaissance des drusen cuticulaires peut être facilitée par l’utilisation de clichés en autofluorescence donnant une image granitée du fond d’œil, avec de très nombreuses lésions hypo-autofluorescentes focales [21]. En OCT, l’aspect en dents de scie des drusen cuticulaires est également typique. En revanche, le dépôt de matériel associé aux drusen cuticulaires peut se révéler un piège diagnostique beaucoup plus difficile (fig. 12-19). En effet, l’image angiographique montre la coloration de très nombreux drusen du pôle postérieur donnant une image en ciel étoilé ou en voie lactée caractéristique, mais le dépôt de matériel prend fortement le colorant dès les temps précoces avec un aspect de diffusion à l’intérieur de la macula, simulant une image angiographique de néovaisseaux choroïdiens visibles [17–19]. L’association de drusen à ces diffusions intenses de colorant peut donc aisément simuler une DMLA exsudative avec des décisions thérapeutiques agressives.
Toutes ces lésions peuvent simuler une DMLA exsudative. Leur reconnaissance est donc importante pour éviter des traitements inappropriés, en particulier des injections intravitréennes inutiles.
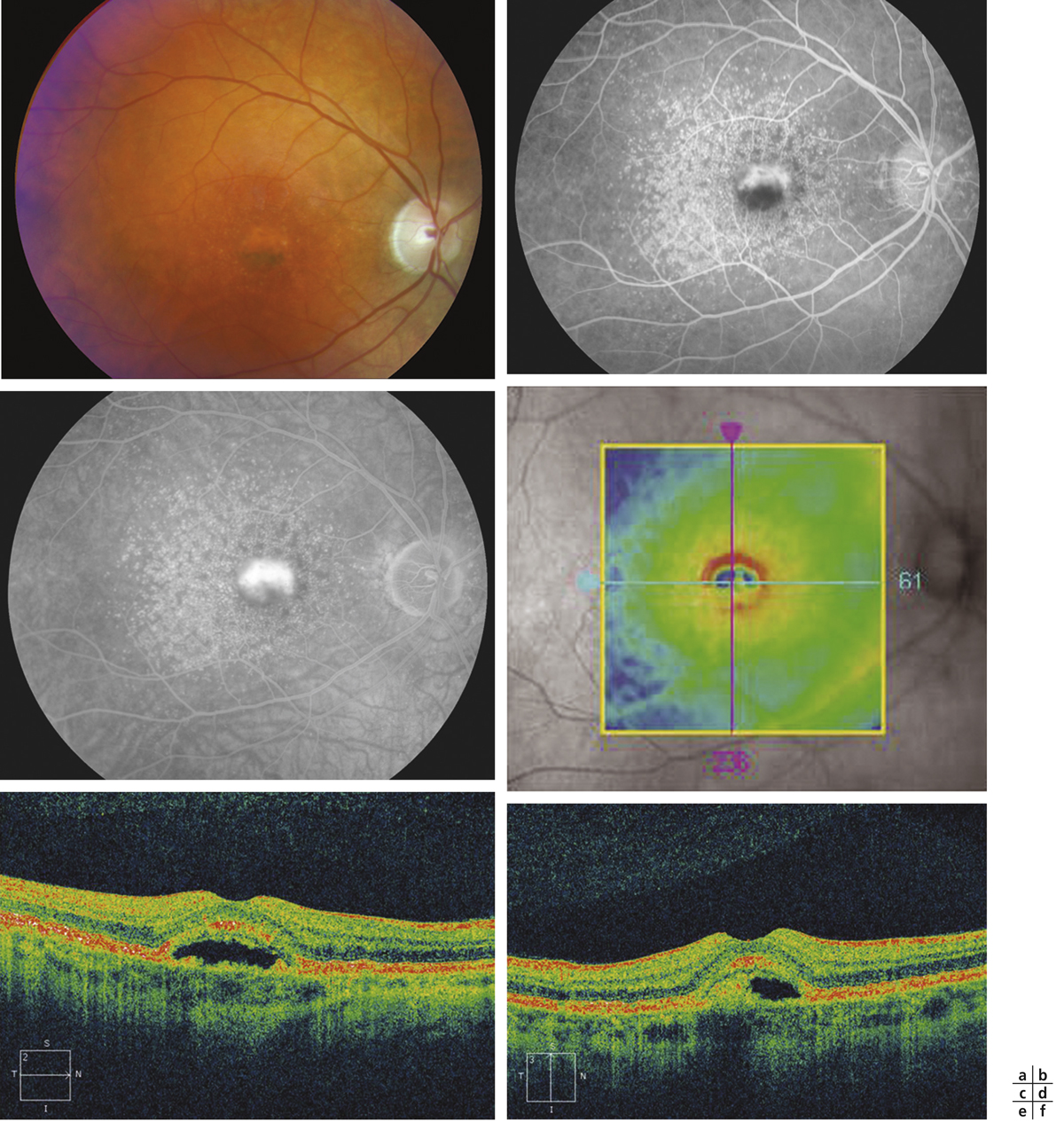
Fig. 12-19 Drusen cuticulaires associés à du matériel pseudo-vitellin.
Dépôt de matériel sous-rétinien central prenant un aspect pigmenté à sa partie inférieure. Les drusen sont peu visibles sur le cliché en couleurs (a). L’angiographie à la fluorescéine montre des points hyperfluorescents innombrables groupés autour de la macula, correspondant à l’image appelée en voie lactée ou en ciel étoilé. Le matériel se colore de façon inhomogène (b, c). La cartographie de l’OCT est perturbée (d). La comparaison des coupes horizontale et verticale permet de bien visualiser que le dépôt se situe à la partie inférieure de la macula suivant les règles de la gravitation (e, f). La comparaison de l’OCT et de l’angiographie doit faire remettre en cause le diagnostic de néovaisseau choroïdien qui avait été porté trop rapidement sur la base de l’angiographie.
[1] Cohen SY, Dubois L, Nghiem-Buffet S, et al. Retinal pseudocysts in age-related geographic atrophy. Am J Ophthalmol 2010 ; 150 : 211-7.
[2] Zweifel SA, Engelbert M, Laud K, et al. Outer retinal tubulation : a novel optical coherence tomography finding. Arch Ophthalmol 2009 ; 127 : 1596-602.
[3] Wolff B, Maftouhi MQ, Mateo-Montoya A, et al. Outer retinal cysts in age-related macular degeneration. Acta Ophthalmol 2011 ; 89 : e496-9.
[4] Quaranta-El Maftouhi M, Wolff B, Mauget-Faÿsse M. Kystes rétiniens externes dans la dégénérescence maculaire liée à l’âge exsudative : un nouvel aspect de l’OCT. J Fr Ophtalmol 2010 ; 33 : 605-9.
[5] Wolff B, Matet A, Vasseur V, et al. En face OCT imaging for the diagnosis of outer retinal tubulations in age-related macular degeneration. J Ophthalmol 2012 ; 2012 : 542417.
[6] Moussa K, Lee JY, Stinnett SS, Jaffe GJ. Spectral domain optical coherence tomography – determined morphologic predictors of age-related macular degeneration – associated geographic atrophy progression. Retina 2013 ; 33 : 1590-9.
[7] Hariri A, Nittala MG, Sadda SR. Outer retinal tubulation as a predictor of the enlargement amount of geographic atrophy in age-related macular degeneration. Ophthalmology 2014 ; 122 : 407-13.
[8] Lee JY, Folgar FA, Maguire MG, et al. Outer retinal tubulation in the comparison of age-related macular degeneration treatments trials (CATT). Ophthalmology 2014 ; 121 : 2423-31.
[9] Iriyama A, Aihara Y, Yanagi Y. Outer retinal tubulation in inherited retinal degenerative disease. Retina 2013 ; 33 : 1462-5.
[10] Goldberg NR, Greenberg JP, Laud K, et al. Outer retinal tubulation in degenerative retinal disorders. Retina 2013 ; 33 : 1871-6.
[11] Ellabban AA, Hangai M, Yamashiro K, et al. Tomographic fundus features in pseudoxanthoma elasticum : comparison with neovascular age-related macular degeneration in Japanese patients. Eye (Lond) 2012 ; 26 : 1086-94.
[12] Benhamou N, Souied EH, Zolf R, et al. Adult-onset foveomacular vitelliform dystrophy : a study by optical coherence tomography. Am J Ophthalmol 2003 ; 135 : 362-7.
[13] Spaide RF, Noble K, Morgan A, Freund KB. Vitelliform macular dystrophy. Ophthalmology 2006 ; 113 : 1392-400.
[14] Finger RP, Charbel Issa P, Kellner U, et al. Spectral domain optical coherence tomography in adult-onset vitelliform macular dystrophy with cuticular drusen. Retina 2010 ; 30 : 1455-64.
[15] Mimoun G, Caillaux V, Querques G, et al. Ranibizumab for choroidal neovascularization associated with adult-onset foveomacular vitelliform dystrophy : one-year results. Retina 2013 ; 33 : 513-21.
[16] Coscas F, Puche N, Coscas G, et al. Comparison of macular choroidal thickness in adult onset foveomacular vitelliform dystrophy and age-related macular degeneration. Invest Ophthalmol Vis Sci 2014 ; 55 : 64-9.
[17] Leng T, Rosenfeld PJ, Gregori G, et al. Spectral domain optical coherence tomography characteristics of cuticular drusen. Retina 2009 ; 29 : 988-93.
[18] Querques G, Guigui B, Leveziel N, et al. Insights into pathology of cuticular drusen from integrated confocal scanning laser ophthalmoscopy imaging and corresponding spectral domain optical coherence tomography. Graefes Arch Clin Exp Ophthalmol 2011 ; 249 : 1617-25.
[19] Pilli S, Zawadzki RJ, Werner JS, Park SS. High-resolution Fourier-domain optical coherence tomography findings in vitelliform detachment associated with basal laminar drusen. Retina 2011 ; 31 : 812-4.
[20] Finger RP, Charbel Issa P, Kellner U, et al. Spectral domain optical coherence tomography in adult-onset vitelliform macular dystrophy with cuticular drusen. Retina 2010 ; 30 : 1455-64.
[21] Meyerle CB, Smith RT, Barbazetto IA, Yannuzzi LA. Autofluorescence of basal laminar drusen. Retina 2007 ; 27 : 1101-6.