J.-P. Renard, E. Sellem
« L’art est long…, l’observation difficile, l’expérience trompeuse. »
Hippocrate
La neuroprotection des cellules ganglionnaires rétiniennes et de leurs axones est le but ultime du traitement du glaucome primitif à angle ouvert (GPAO). Dans tous les cas, elle passe par l’amélioration du gradient de pression déficitaire entre la pression de perfusion oculaire insuffisante et la pression intra-oculaire (PIO) excessive. Cet objectif est essentiellement atteint en abaissant la PIO à un niveau en deçà duquel elle n’exerce plus théoriquement d’effet délétère sur la survie des cellules ganglionnaires rétiniennes. Cet abaissement doit impérativement être complété par l’amélioration d’une éventuelle pression de perfusion oculaire défaillante et par le contrôle de facteurs de risque de la neuropathie optique glaucomateuse, lorsqu’ils sont naturellement identifiés et accessibles à un traitement.
Cette prise en charge globale doit également tenir compte de deux autres facteurs essentiels : ceux liés aux particularités cliniques de l’affection et ceux inhérents à chaque patient.
En ce qui concerne la neuropathie optique, au-delà du problème commun à la prise en charge de toute maladie chronique, la détermination d’une PIO cible individuelle est importante dès le départ, et celle-ci doit être réévaluée à chaque étape du suivi clinique de la maladie. Les notions de « PIO idéale », de « PIO limite » et de « PIO acceptable » autorisent toutefois une certaine amplitude de manœuvre en fonction du rapport bénéfice/risque propre à chaque situation clinique.
La périodicité des contrôles doit être bien déterminée et expliquée au patient. Elle est là encore adaptée individuellement, tenant chaque fois compte de la progression du glaucome et du stade évolutif au moment du diagnostic.
Enfin, comme pour toute pathologie chronique, l’observance thérapeutique doit être connue au plus près. Il faut l’évaluer en fonction de la tolérance au traitement et de son ancienneté, de l’âge du sujet, de ses activités socioprofessionnelles et de la perception qu’a celui-ci de sa maladie, entre autres.
Différents facteurs individuels interviennent éminemment dans la prise en charge du GPAO. Une information éclairée doit tenir compte du profil psychologique propre à chaque patient. C’est toute l’importance de la relation que le médecin développe avec le patient qui prend son entière dimension. Elle permettra d’assurer la meilleure qualité de vie possible dans cette prise en charge pratique, avec une adaptation aux particularités de la vie quotidienne du sujet traité.
Évaluer, réévaluer, identifier, adapter, expliquer… ces considérations thérapeutiques générales doivent garder la notion essentielle de concilier le traitement maximal raisonnable, qui assure un contrôle efficace de la neuropathie glaucomateuse, avec le meilleur confort et la meilleure qualité de vie possible du patient, dans un souci constant de la préservation du capital fonctionnel.
T. Zeyen
L’abaissement de la pression intra-oculaire (PIO) reste toujours la seule option disponible pour traiter les patients glaucomateux,
Le niveau auquel la PIO devrait être abaissée diffère d’un patient à l’autre.
Différents calculs pour établir une pression cible sont proposés.
Malgré les progrès passionnants enregistrés dans le domaine de la neuroprotection, il reste, sauf exceptions, le seul traitement actuellement disponible pour traiter le glaucome. Plusieurs études contrôlées randomisées ont montré que l’abaissement de la PIO est bénéfique en retardant le début du glaucome chez les patients souffrant d’une hypertension oculaire (HTO) et en retardant la progression chez les patients glaucomateux, y compris chez ceux ayant un glaucome à pression normale (GPN) [7, 11, 15, 18, 20, 24]. Certains auteurs ont même suggéré qu’une chirurgie précoce était plus avantageuse que le traitement médicamenteux pour stabiliser l’évolution du glaucome [14, 19]. Le traitement au laser ou la chirurgie précoce présentent l’avantage supplémentaire d’améliorer la qualité de vie du patient qui ne devra plus suivre un schéma posologique strict et qui ne sera plus exposé aux effets secondaires des médicaments.
La vitesse de progression de l’atteinte glaucomateuse diffère d’un patient à l’autre (eFig. 17-1). Généralement, la progression est parabolique avec une vitesse lente au début et beaucoup plus rapide à la fin de la maladie [27]. Souvent, la maladie évolue par paliers avec des périodes de progression et de stabilisation. Parfois, elle est linéaire avec une vitesse de progression corrélée avec le niveau de la PIO, mais sans entraîner nécessairement un handicap visuel final. Parfois, la progression peut s’arrêter sans changement perceptible du niveau de la PIO. Inversement, nous savons aussi que la progression peut se poursuivre, du moins un certain temps, même après avoir abaissé de façon drastique la PIO, par exemple après une chirurgie filtrante. Cela est souvent le cas pour le glaucome avancé.
Il est donc important de documenter la progression le plus tôt possible et déterminer le taux de progression pour chaque patient en particulier [4]. Cette information permettra au clinicien de le traiter à un stade suffisamment précoce, et d’évaluer la PIO en dessous de laquelle la progression du glaucome peut être retardée, voire arrêtée.

eFig. 17-1 Types de progression du glaucome. Généralement, la progression est parabolique avec une vitesse lente au début et une vitesse beaucoup plus rapide à la fin de la maladie (courbe orange). Souvent, l’évolution va par échelons avec des périodes de progression et de stabilisation (courbe rouge). Parfois, elle est linéaire avec une vitesse corrélée avec le niveau de la PIO, mais sans entraîner nécessairement un handicap visuel (ligne noire). Parfois, la vitesse de progression peut s’arrêter sans changement perceptible du niveau de la PIO (ligne bleue).
Le taux de perte des cellules ganglionnaires due au vieillissement comparé au glaucome est illustré figure 17-1. Cette perte physiologique est d’environ 0,4 % par an. La vitesse de perte des cellules ganglionnaires dans le glaucome se situe entre 1 et 4 % par an [1, 27]. Des déficits précoces du champ visuel (CV) sont généralement détectables après une perte de 40 % des cellules ganglionnaires : cela signifie que les déficits du CV ne sont détectables que dix ans après le début du glaucome. En revanche, cela n’implique pas que tout sujet non glaucomateux développera ultérieurement des déficits du CV à la condition de vivre au moins cent ans, car d’autres facteurs de risque jouent un rôle dans le développement de la maladie. En abaissant la PIO, on essaie d’infléchir la courbe de perte glaucomateuse vers la courbe de perte due au vieillissement. Le degré auquel la PIO devrait être abaissée pour atteindre cet objectif est malheureusement inconnu.
Une pression cible peut être définie comme l’estimation de la limite supérieure de la PIO compatible avec une stabilité ou une progression suffisamment lente pour maintenir une qualité de vision raisonnable compte tenu de l’espérance de vie du patient.
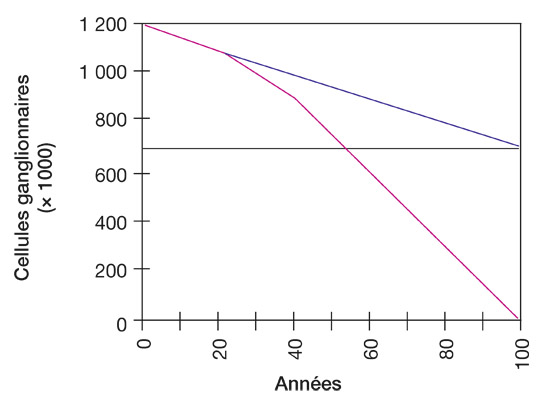
Fig. 17-1 Perte de cellules ganglionnaires dans le glaucome. La perte naturelle des cellules ganglionnaires due au vieillissement est d’environ 0,4 % par an (ligne bleue). La vitesse de perte des cellules ganglionnaires dans le glaucome se situe entre 1 et 4 % par an (ligne rouge) [1, 27]. La ligne horizontale noire montre la limite de la malvoyance.
Il est évidemment difficile d’évaluer précisément, et à l’avance, le niveau de PIO auquel une progression du glaucome peut être retardée, voire arrêtée, chez un patient donné. Plusieurs méthodes ont été utilisées en pratique et dans des études cliniques. Il est logique de penser que la PIO la plus basse possible sera la meilleure pour empêcher une progression des déficits. Cependant, des pressions extrêmement basses peuvent engendrer des complications et les médicaments nécessaires pour les obtenir ont des effets secondaires potentiels.
Il est admis aujourd’hui qu’une valeur fixe pour tous les patients (par exemple une PIO < 21 mmHg) est dépassée étant donné que celle-ci ne tient pas compte de la variabilité individuelle. L’étude AGIS a néanmoins suggéré qu’une PIO inférieure à 18 mmHg à chaque visite peut prévenir la progression d’un glaucome avancé [24]. Il convient toutefois de se rappeler qu’il s’agissait, dans cette étude, d’une analyse a posteriori et que ces patients présentaient une PIO moyenne de 12 mmHg.
De nombreuses études cliniques randomisées ont utilisé un pourcentage (tableau 17-1) [10, 17, 21, 22]. Cette approche est attrayante, mais elle ne tient pas compte des facteurs de risque de progression qui sont différents pour chaque patient. Plus le risque de progression est grand, plus la PIO devrait être basse. Le risque de progression est lié au degré de l’excavation papillaire et des déficits périmétriques présents, et à la PIO qui a probablement produit ces déficits (« PIO maximale », souvent aussi appelée « PIO de présentation »). D’autres facteurs de risque seront abordés ci-dessous.
Nous proposons un algorithme, modifié de la formule de H. Jampel, qui permet de calculer une pression cible individualisée [13, 26] :
PIO cible = PIO max – (PIO max) % – Z
Cette formule tient compte de la PIO maximale qui a probablement produit les déficits et des facteurs de risque de progression. Z représente la gravité de l’atteinte du nerf optique et des déficits du CV :
1 mmHg : papille excavée avec CV normal ;
2 mmHg : déficits du CV débutants (MD < 6 dB) ;
3 mmHg : déficits du CV modérés/avancés (MD > 6 dB) ;
4 mmHg (ou plus) : facteurs de risque additionnels.
Les facteurs de risque additionnels sont les suivants : taux de progression, état de l’œil adelphe, hérédité, âge, épaisseur cornéenne centrale, myopie, race, fluctuations de la PIO, présence de pseudo-exfoliation ou d’hémorragies papillaires (eFig. 17-2).
Par exemple, un patient avec une PIO maximale de 30 mmHg, une excavation papillaire débutante et des déficits du CV modérés (MD entre 6 et 12 dB) pourrait avoir une PIO cible de 18 mmHg (30 mmHg – 30 % – 3 mmHg). Cette pression cible peut donc être affinée en incluant d’autres facteurs de risque mentionnés précédemment [9, 16]. Le taux de progression, qui pourra être évalué après un suivi de deux à trois ans, deviendra le facteur de risque le plus important pour modifier la PIO cible initialement établie.
D’autres formules qui tiennent compte des facteurs de risque de progression du glaucome existent. L’une d’entre elles est proposée par la Société européenne du glaucome (EGS) (fig. 17-2). Les facteurs à considérer en général lorsqu’on établit une PIO cible sont illustrés figure 17-3.
Enfin, la pression cible peut être également estimée selon le stade de l’atteinte du CV (tableau 17-2) [8, 12, 24]. Cela est particulièrement utile lorsqu’on ne connaît pas la pression maximale (ou « de présentation ») chez un patient glaucomateux.
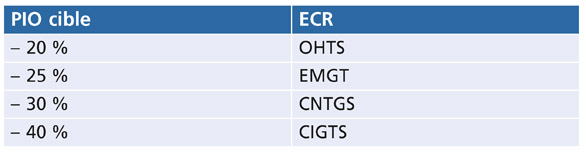
Tableau 17-1 – PIO cibles, exprimées en pourcentage, utilisées dans les études cliniques randomisées (ECR) [10, 17, 21, 22].
OHTS : Ocular Hypertension Study ; EMGT : Early Manifest Glaucoma Trial ; CNTGS : Collaborative Normal-Tension Glaucoma Study ; CIGTS : Collaborative Initial Glaucoma Treatment Study.
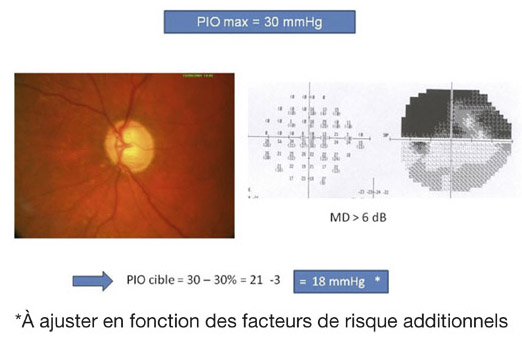
eFig. 17-2 Exemple d’un calcul d’une PIO cible individualisée.
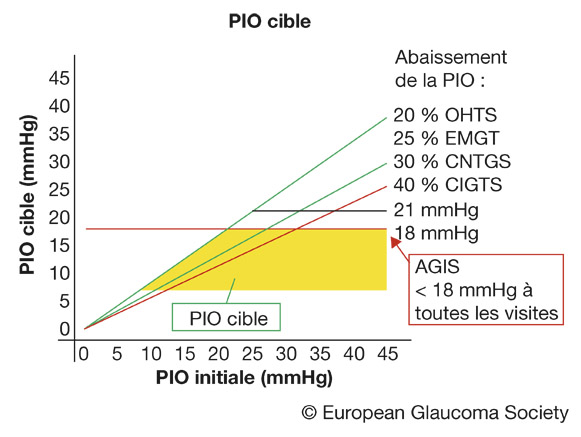
Fig. 17-2 Évaluation graphique du résultat thérapeutique souhaité sous forme d’un abaissement de la PIO dans les grandes études prospectives. La pression cible devrait se situer dans la zone jaune. Plus la PIO initiale est basse, plus la PIO cible le sera et vice versa. Le pourcentage de réduction de la PIO cible (c’est-à-dire 20 %, 25 %, 30 % et 40 %, respectivement) dépend principalement du degré de dommage du CV au diagnostic ainsi que de la vitesse de progression. (Avec l’autorisation de l’EGS.)

Fig. 17-3 Les facteurs à considérer lorsqu’on établit une PIO cible sont : le stade du glaucome (au plus avancé, au plus bas la PIO cible), l’âge et l’espérance de vie (au plus jeune, au plus bas la PIO cible ; par ailleurs, l’âge est un facteur de risque indépendant car le patient âgé a un plus grand risque de progression), la PIO maximale (au plus basse, au plus bas la PIO cible) et le taux de progression (au plus rapide, au plus bas la PIO cible). (Avec l’autorisation de l’EGS.)
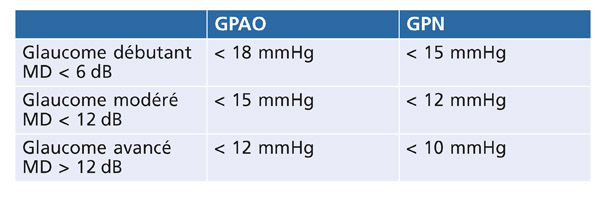
Tableau 17-2 – Estimation de la PIO cible selon le stade de l’atteinte du CV [8, 12, 24].
Cela est particulièrement important lorsque celui-ci est suivi par un groupe d’ophtalmologistes. Si la PIO cible n’est pas clairement notée dans le dossier, il y a une tendance naturelle à l’élever progressivement.
Il est utile de tracer une courbe pressionnelle pour chaque patient glaucomateux et de marquer la pression cible (ou les pressions cibles successives) sur cette courbe.
Il est évident que celle-ci doit être abaissée si une progression du glaucome est confirmée alors que les mesures de la PIO sont systématiquement en dessous de la cible initialement fixée. Cela est particulièrement vrai lorsque la progression risque d’hypothéquer la qualité de vie du patient. Une baisse additionnelle de 20 % doit alors être envisagée [5]. Inversement, il peut être nécessaire d’élever la pression cible si le nerf optique et le CV restent suffisamment stables pour garantir la qualité de vie en tenant compte de l’espérance de vie du patient. Cela permettra alors de réduire le traitement médicamenteux et, par conséquent, de diminuer les effets secondaires de certains produits.
En effet, il est peu probable que la thérapie sera modifiée sur base d’un changement de 1 mmHg. Pour les mêmes raisons, il est bon de confirmer une PIO élevée avant de décider si une modification de la thérapie est nécessaire. Les mesures de la PIO seront idéalement prises à différentes heures de la journée, en particulier si l’on suspecte une progression du glaucome.
À ce sujet, il est bon de rappeler que les fluctuations de la PIO sont considérées comme un facteur de risque additionnel en cas de progression [3, 9]. Les courbes nycthémérales, faites pendant les heures de travail, ont montré que la PIO moyenne est plus élevée entre 8 et 9 heures du matin et entre 16 et 17 heures l’après-midi [6]. Une courbe pressionnelle de 24 heures (avec hospitalisation) ou une courbe pressionnelle mesurée par le patient à domicile (Icare One Self-Tonometer ou, plus controversée cliniquement, la lentille Triggerfish®) peuvent donner des informations supplémentaires utiles [25].
Une cornée mince (souvent associée au GPN) sous-estimera la tonométrie par aplanation tandis qu’une cornée épaisse (souvent associée à l’HTO) la surestimera. En outre, une cornée mince représente probablement un facteur de risque de progression, indépendamment de la sous-estimation de la PIO [2]. Il s’ensuit que la pachymétrie cornéenne est devenue un examen standard pour l’évaluation des patients avec HTO ou glaucome. Il est important de souligner qu’il n’existe pas de formule pour corriger la mesure de la PIO en fonction de l’épaisseur cornéenne.
La compliance est un facteur limitatif dans l’utilisation des pressions cibles étant donné que les mesures de la PIO ne reflètent pas toujours les fluctuations réelles de la PIO chez un patient non compliant. Chez ces patients, il est préférable d’utiliser des médicaments à dosage unique et des combinaisons fixes pour essayer d’atteindre la pression cible. Toutefois, les effets secondaires des médicaments doivent être pris en considération et, si la pression cible ne peut pas être atteinte avec une thérapie médicale tolérable, le traitement au laser ou la chirurgie doivent être envisagés.
Enfin, il est important de rappeler que le but du traitement est de préserver une qualité de vie raisonnable chez le patient glaucomateux. Des pressions cibles très basses ne sont justifiées que si cette qualité de vie est menacée par le taux de progression du glaucome en tenant compte de l’espérance de vie du patient [23].
Il est important de réévaluer périodiquement la PIO cible. Celle-ci doit être abaissée de 20 % si le taux de progression risque d’hypothéquer la qualité de vie du patient. Inversement, il faut envisager d’élever la pression cible si le nerf optique et le CV restent suffisamment stables pour garantir une qualité de vie raisonnable en tenant compte de l’espérance de vie du patient.
Retenir
La « pression cible individualisée » devra tenir compte de la pression à laquelle l’atteinte glaucomateuse s’est probablement produite (pression maximale ou de présentation), du risque de progression future, des facteurs de risque et de l’espérance de vie du patient.
Elle ne doit pas être inutilement basse et influer négativement sur la qualité de vie du patient.
Elle doit tenir compte de la compliance.
Elle doit être clairement notée dans le dossier du patient.
Il est essentiel de la réévaluer périodiquement.
[1] Airaksinen PJ, Tuulonen A, Alanko HI. Rate and pattern of neuroretinal rim area decrease in ocular hypertension and glaucoma. Arch Ophthalmol. 1992 ; 110 : 206-10.
[2] Brandt JD. Central corneal thickness – tonometry artifact, or something more ? Ophthalmology. 2007 ; 114 : 1963-4.
[3] Caprioli J, Coleman A. Pressure fluctuation. Ophthalmology. 2009 ; 116 : 817.
[4] Chauhan BC, Garway-Heath DF, Goni FJ, et al. Practical recommendations for measuring rates of visual field change in glaucoma. Br J Ophthalmol. 2008 ; 92 : 569-73.
[5] Chauhan BC, Mikelberg FS, Artes PH, et al. Canadian Glaucoma Study : 3. Impact of risk factors and intraocular pressure reduction on the rates of visual field change. Arch Ophthalmol. 2010 ; 128 : 1249-55.
[6] Collaer N, Zeyen T, Caprioli J. Sequential office pressure measurements in the management of glaucoma. J Glaucoma. 2005 ; 14 : 196-200.
[7] Comparison of glaucomatous progression between untreated patients with normal-tension glaucoma and patients with therapeutically reduced intraocular pressures. Collaborative Normal-Tension Glaucoma Study Group. Am J Ophthalmol. 1998 ; 126 : 487-97.
[8] Damji KF, Behki R, Wang L. Canadian perspectives in glaucoma management : setting target intraocular pressure range. Can J Ophthalmol. 2003 ; 38 : 189-97.
[9] Gao F, Miller JP, Miglior S, et al. A joint model for prognostic effect of biomarker variability on outcomes : long-term intraocular pressure (IOP) fluctuation on the risk of developing primary open-angle glaucoma (POAG). JP J Biostat. 2011 ; 5 : 73-96.
[10] Gordon MO, Kass MA. The Ocular Hypertension Treatment Study : design and baseline description of the participants. Arch Ophthalmol. 1999 ; 117 : 573-83.
[11] Heijl A, Leske MC, Bengtsson B, et al. Reduction of intraocular pressure and glaucoma progression : results from the Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 ; 120 : 1268-79.
[12] Hodapp E PRI, Anderson DR. Clinical decisions in glaucoma. St. Louis, Mosby, 1993 : 52-61.
[13] Jampel HD. Target pressure in glaucoma therapy. J Glaucoma. 1997 ; 6 : 133-8.
[14] Jay JL, Murray SB. Early trabeculectomy versus conventional management in primary open angle glaucoma. Br J Ophthalmol. 1988 ; 72 : 881-9.
[15] Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study : a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002 ; 120 : 701-13 ; discussion : 829-30.
[16] Leske MC, Heijl A, Hyman L, et al. Predictors of long-term progression in the early manifest glaucoma trial. Ophthalmology. 2007 ; 114 : 1965-72.
[17] Leske MC, Heijl A, Hyman L, Bengtsson B. Early Manifest Glaucoma Trial : design and baseline data. Ophthalmology. 1999 ; 106 : 2144-53.
[18] Lichter PR, Musch DC, Gillespie BW, et al. Interim clinical outcomes in the Collaborative Initial Glaucoma Treatment Study comparing initial treatment randomized to medications or surgery. Ophthalmology. 2001 ; 108 : 1943-53.
[19] Migdal C, Gregory W, Hitchings R. Long-term functional outcome after early surgery compared with laser and medicine in open-angle glaucoma. Ophthalmology. 1994 ; 101 : 1651-6 ; discussion : 7.
[20] Miglior S, Zeyen T, Pfeiffer N, et al. Results of the European Glaucoma Prevention Study. Ophthalmology. 2005 ; 112 : 366-75.
[21] Musch DC, Lichter PR, Guire KE, Standardi CL. The Collaborative Initial Glaucoma Treatment Study : study design, methods, and baseline characteristics of enrolled patients. Ophthalmology. 1999 ; 106 : 653-62.
[22] Schulzer M. Intraocular pressure reduction in normal-tension glaucoma patients. The Normal Tension Glaucoma Study Group. Ophthalmology. 1992 ; 99 : 1468-70.
[23] Singh K, Spaeth G, Zimmerman T, Minckler D. Target pressure-glaucomatologists’ holey grail. Ophthalmology. 2000 ; 107 : 629-30.
[24] The Advanced Glaucoma Intervention Study (AGIS) : 7. The relationship between control of intraocular pressure and visual field deterioration. The AGIS Investigators. Am J Ophthalmol. 2000 ; 130 : 429-40.
[25] Zeyen T. Diurnal curves with the iCare One Home Tonometer in glaucoma patients and normal controls. IOVS. 2012 ; 43 : ARVO E-Abstract 5074.
[26] Zeyen T. Target pressures in glaucoma. Bull Soc Belge Ophtalmol. 1999 ; 274 : 61-5.
[27] Zeyen TG, Caprioli J. Progression of disc and field damage in early glaucoma. Arch Ophthalmol. 1993 ; 111 : 62-5.
H. Bresson-Dumont
La prise en charge du glaucome ne se réduit pas à la seule réduction de la PIO.
La recherche des autres facteurs de risque du glaucome est primordiale en consultation, et le moment clé est l’interrogatoire avec l’analyse de l’ordonnance des traitements généraux du patient.
Ces facteurs seront traités par le médecin référent, mais il est nécessaire pour l’ophtalmologiste de guider cette prise en charge globale, par un dialogue avec les différents professionnels de santé.
De nombreuses mesures hygiénodiététiques doivent aussi être conseillées aux patients atteints de glaucome évolué, afin de préserver au mieux le nerf optique et sa vascularisation.
L’examen ophtalmologique traditionnel renseigne sur la qualité anatomofonctionnelle de l’œil et permet d’orienter le traitement hypotonisant. Toutefois, la prise en charge complète du patient glaucomateux nécessite la recherche des facteurs de risque du glaucome autres qu’oculaires (hypertension intra-oculaire, myopie, syndrome exfoliatif, angle étroit, etc.). Comme cela a été décrit dans les chapitres précédents, les facteurs vasculaire, dégénératif et génétique, entre autres, jouent un rôle primordial dans la pathogénie des glaucomes et demandent parfois une prise en charge spécifique.
L’interrogatoire est le moment fort de la consultation et permet d’orienter, ensuite, la recherche spécifique des autres facteurs de risque afin de mettre en œuvre un traitement adapté, parfois avec l’aide des autres professionnels de santé. Pour optimiser cet interrogatoire, le patient doit comprendre les interactions entre l’œil et le corps, en particulier avec la vascularisation générale. Les patients et les praticiens des autres spécialités médicales sont souvent peu informés de ce lien, si fort, entre œil, glaucome et état général. Un schéma simple explicitant cette interaction peut rendre service dans un but pédagogique (fig. 17-4).
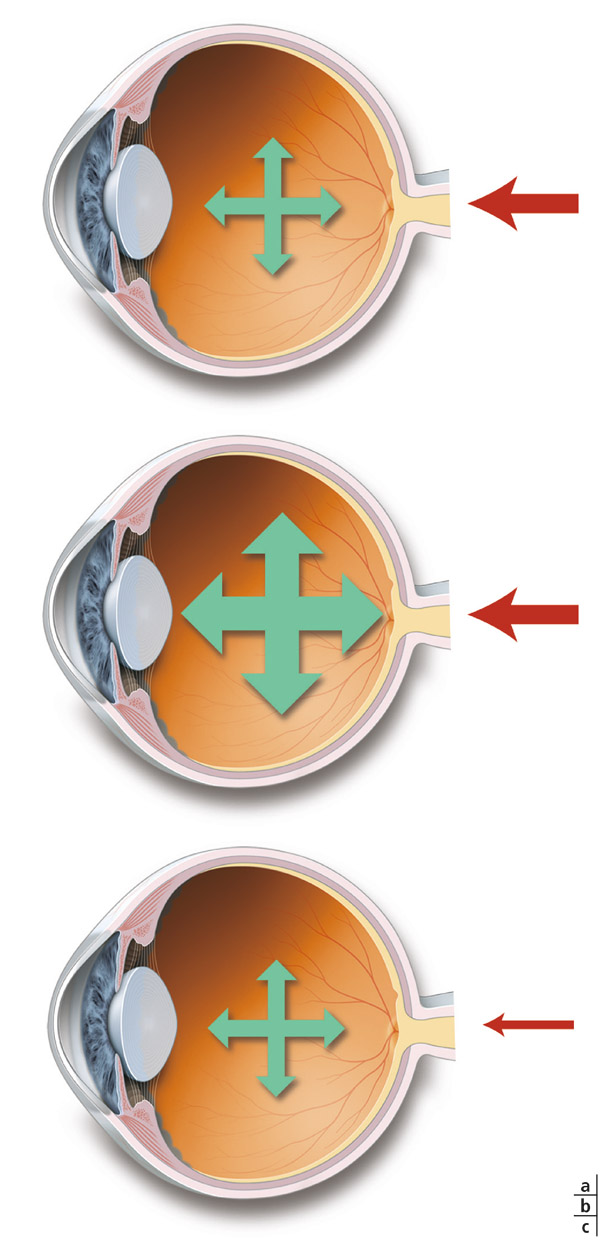
Fig. 17-4 Schéma pouvant aider à expliquer le facteur vasculaire dans le glaucome. a. Patient normal. b. Hypertonie oculaire. c. Hypoperfusion. Chez un patient normal, il existe un équilibre entre pression de perfusion (flèche rouge) et PIO (flèche verte). En cas d’hypertension oculaire ou d’hypovascularisation, l’équilibre est perturbé, induisant un risque de lésions glaucomateuses.
L’interrogatoire est le moment clé pour découvrir les facteurs de risque du glaucome.
Avoir un membre de la fratrie ou un parent du premier degré atteint est un facteur de risque majeur de glaucome. Les glaucomes des sujets jeunes sont souvent héréditaires. Des antécédents de glaucome y sont parfois retrouvés à toutes les générations. Si le glaucome des parents est sévère, parfois jusqu’à la cécité, il est à craindre que la forme clinique du patient soit susceptible d’évoluer rapidement, justifiant une prise en charge énergique avec un abaissement pressionnel important.
Parcourir l’ordonnance de traitements du patient est primordial pour avoir rapidement une idée de l’état vasculaire et général. La recherche des facteurs diminuant la perfusion oculaire s’appuie sur la formule qui relie le flux sanguin oculaire (FSO) aux facteurs de risque vasculaires (fig. 17-5). Ainsi, en dehors de l’augmentation de la pression intra-oculaire (PIO), toute diminution de la pression artérielle moyenne (en particulier la pression diastolique) ou augmentation des résistances vasculaires (diminution du calibre vasculaire, augmentation de la viscosité sanguine) participe à la diminution du FSO dans la tête du nerf optique [3].
L’interrogatoire cherchera donc tout ce qui diminue le calibre vasculaire : artériosclérose, hyperlipidémie, hypertension artérielle, diabète (l’idéal est de voir le résultat des analyses sanguines).
Les troubles du rythme cardiaque diminuent la qualité de la perfusion oculaire. Il en va de même des variations tensionnelles importantes, des hypotensions artérielles orthostatiques ou non, et des dips nocturnes, malheureusement difficiles à mettre en évidence en dehors d’un Holter tensionnel sur 24 heures. Les varices importantes peuvent favoriser les hypotensions artérielles, en particulier orthostatiques.
Les accidents vasculaires aigus sont susceptibles de provoquer une ischémie oculaire temporaire : infarctus du myocarde, accident vasculaire ischémique transitoire ou non, choc hypovolémique aigu, hémorragie massive, phlébite à répétition. Il est possible de constater des déficits périmétriques définitifs avec ischémie localisée du nerf optique après ces épisodes aigus.
Les modifications rhéologiques, par le biais d’une hyperviscosité (anémie chronique, myélome, chimiothérapie, etc.), risquent de diminuer le flux sanguin oculaire.
Le syndrome vasospastique est plus fréquent chez la femme jeune, mais doit être recherché systématiquement devant tout glaucome, car il favoriserait les troubles de la vascularisation oculaire : migraine vraie à différencier des « céphalées de tension » (stress, anxiété, etc.), syndrome ou maladie de Raynaud, dysrégulation vasculaire primitive (extrémités froides, hypotension artérielle, soif chronique, difficulté à l’endormissement). Le syndrome d’apnée du sommeil est évoqué devant un faciès caractéristique (obésité, hyperlaxité palpébrale, assoupissements fréquents dans la journée) et éventuellement confirmé par un bilan pulmonaire [6].
L’écho-Doppler des vaisseaux du cou n’est opportun que pour éliminer un diagnostic différentiel devant une suspicion d’hypoperfusion oculaire au fond d’œil, un glaucome unilatéral ou très asymétrique, ou encore pour surveiller une sténose carotidienne connue.
L’interrogatoire précisera également les conditions socio-économiques, professionnelles et le mode de vie (tabac, utilisation de pesticides, etc.) du patient.
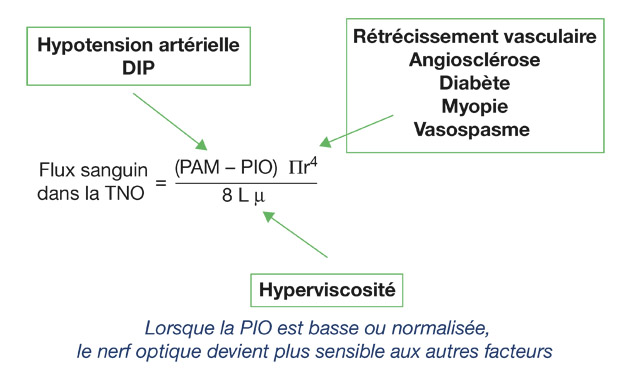
Fig. 17-5 Tableau reliant le flux sanguin oculaire aux facteurs de risque vasculaire. Selon la loi de Poiseuille, le débit sanguin est égal au rapport de la variation de pression (assimilée à la pression de perfusion moyenne, c’est-à-dire pour l’œil la pression artérielle moyenne minorée de la pression oculaire) divisée par les résistances vasculaires.
Les relations entre les pathologies ophtalmologiques et les pathologies vasculaires sont très souvent mal connues par nos confrères généralistes et cardiologues. Toute demande de bilan vasculaire doit être accompagnée d’une explication circonstanciée pour être acceptée et comprise. Au moindre doute, une recherche complémentaire de tous les facteurs vasculaires doit être assurée (examen biologique complet, tension artérielle, examen cardiologique complet avec électrocardiogramme), ainsi qu’un monitoring ambulatoire de la pression artérielle [1, 4] et une recherche de syndrome d’apnée du sommeil au besoin.
La demande d’un Holter de la tension artérielle est un bon exemple d’incompréhension si la demande n’est pas suffisamment explicitée de façon claire et détaillée (encadré 17-1). Il est préférable de demander l’ensemble des résultats (tracés, etc.) pour vérifier soi-même la présence ou non d’une hypotension artérielle, de dips ou de variations tensionnelles importantes. Le dépistage d’une hypotension artérielle est toujours difficile à faire prendre en compte par les cardiologues. Il faut savoir prendre un contact direct avec le confrère spécialiste afin de justifier la demande d’une modification thérapeutique.
Certains médicaments favorisent l’hypotension artérielle, comme les antidépresseurs, les neuroleptiques, les vasodilatateurs et les antiparkinsoniens. L’ensemble des traitements suivis par le patient sera relevé et notifié dans le dossier.
Cher Confrère,
J’ai l’occasion de suivre Mr/Mme X pour un glaucome à pression modérée dont le facteur de risque principal de dégradation du nerf optique n’est pas l’hypertension oculaire. Le facteur vasculaire est prépondérant dans la destruction des fibres visuelles, par le biais d’une hypoperfusion dans les artères ciliaires courtes postérieures. Il a été prouvé par de nombreuses publications scientifiques que certains facteurs vasculaires tels que l’hypertension artérielle, l’hyperlipidémie, l’artériosclérose (par le biais d’une réduction du calibre des artères ciliaires), mais aussi l’hypotension artérielle, les troubles du rythme cardiaque (par hypoperfusion) et les troubles rhéologiques (hyperviscosité sanguine, anémie chronique, pathologies hématologiques) pertubaient de façon importante la vascularisation locale oculaire. Tous ces facteurs doivent être diminués au maximum afin de ralentir la progression de la maladie glaucomateuse.
Je demande donc à Mr/Mme X de vous consulter afin de mettre en œuvre un bilan vasculaire complet et reste à votre disposition pour en rediscuter de vive voix.
Je vous prie de croire, cher Confrère, en l’assurance de mes sentiments les meilleurs.
En cas de demande de relevé de monitoring ambulatoire de la pression artérielle, il faut préciser :
J’aurais souhaité, si cela était possible, avoir accès à l’ensemble du relevé tensionnel sur le nycthémère afin de dépister des variations tensionnelles importantes, des dips nocturnes anormaux et des épisodes d’hypotension artérielle qui seraient délétères pour la pression de perfusion oculaire, risquant d’aggraver de façon irrémédiable la destruction du nerf optique.
Le relevé de monitoring ambulatoire de la pression artérielle comporte un résumé chiffré des valeurs tensionnelles sur 24 heures, pendant la période diurne et la période nocturne. Suivent la liste des valeurs horaires moyennes, la liste brute des valeurs mesurées, puis ces mêmes valeurs sous forme de graphiques, moyennées par heure ou données brutes aux horaires de chaque prise (eFig. 17-3).
Le résumé des valeurs informe sur la variabilité tensionnelle par l’écart type, diurne et nocturne, qui est élevé si supérieur à 12 mmHg. Les valeurs maximales et minimales étant notées, il est facile de savoir s’il y a eu des pics tensionnels ou des hypotensions. Il est possible de calculer les dips systoliques et diastoliques en faisant le rapport entre la différence tensionnelle jour/nuit divisée par la pression diurne (exemple : PAS jour – PAS nuit/PAS jour) : ils sont anormalement élevés s’ils sont supérieurs à 15 %. La pression diastolique de perfusion (PPD) est calculée selon la formule : PAD jour – PIO ; elle doit être supérieure à 50 mmHg. Cependant, il est toujours difficile de calculer cet indice si une courbe nycthémérale de la PIO n’a pas été réalisée en même temps.
Sur le relevé détaillé des mesures tensionnelles à chaque prise, les valeurs basses d’hypotension (inférieure à 101/61 le jour, et 86/48 la nuit) sont relevées et le pourcentage est calculé par rapport au nombre total de mesures (% de valeurs basses/nombre de valeurs). Supérieur à 15 %, ce rapport est pathologique.
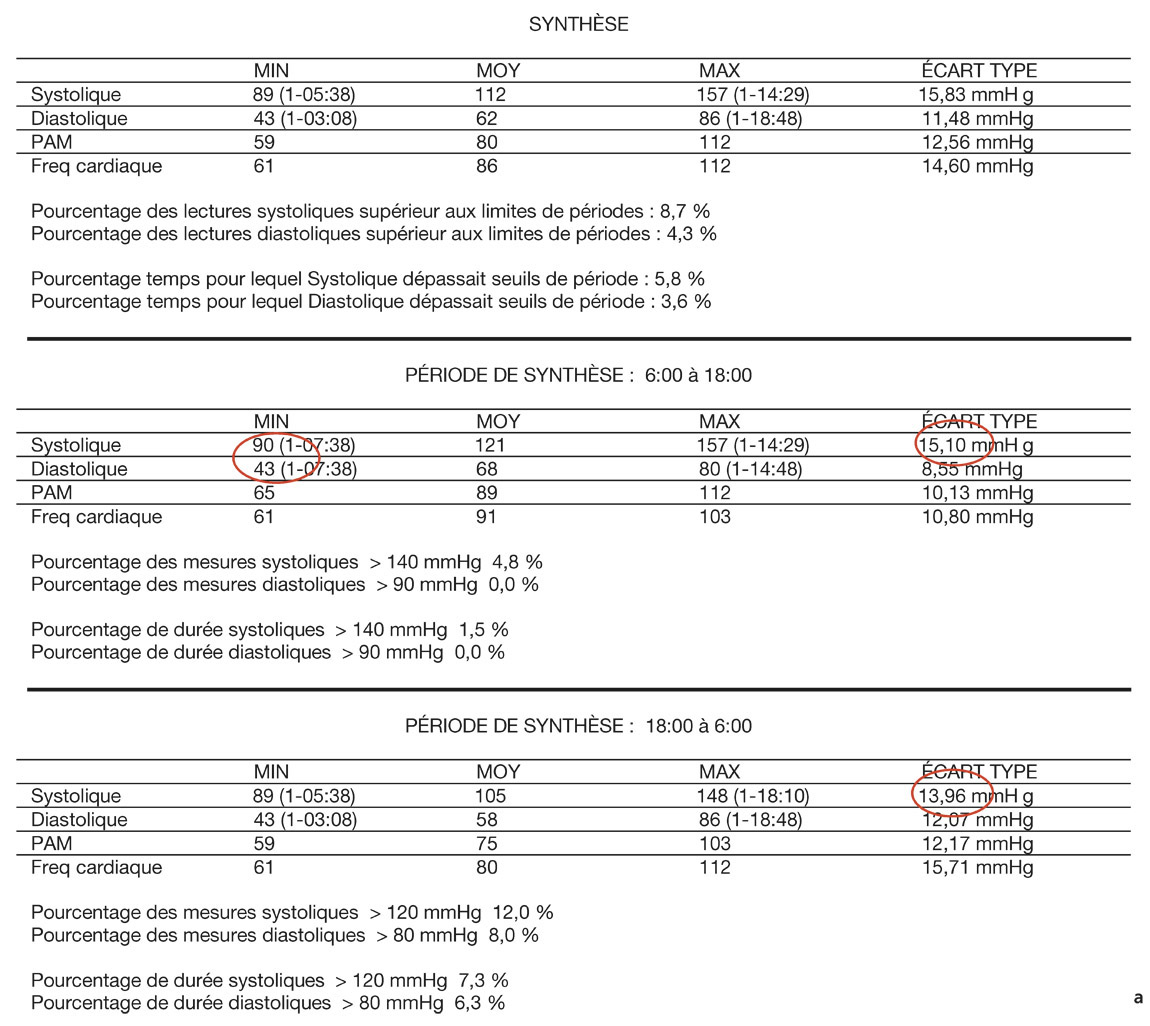
eFig. 17-3 Exemple de monitoring ambulatoire de la tension artérielle. a. Le résumé des valeurs informe sur la variabilité tensionnelle par l’écart type, diurne et nocturne, qui est élevé si supérieur à 12 mmHg. Les valeurs maximales et minimales étant notées, il est facile de savoir s’il y a eu des pics tensionnels ou des hypotensions.
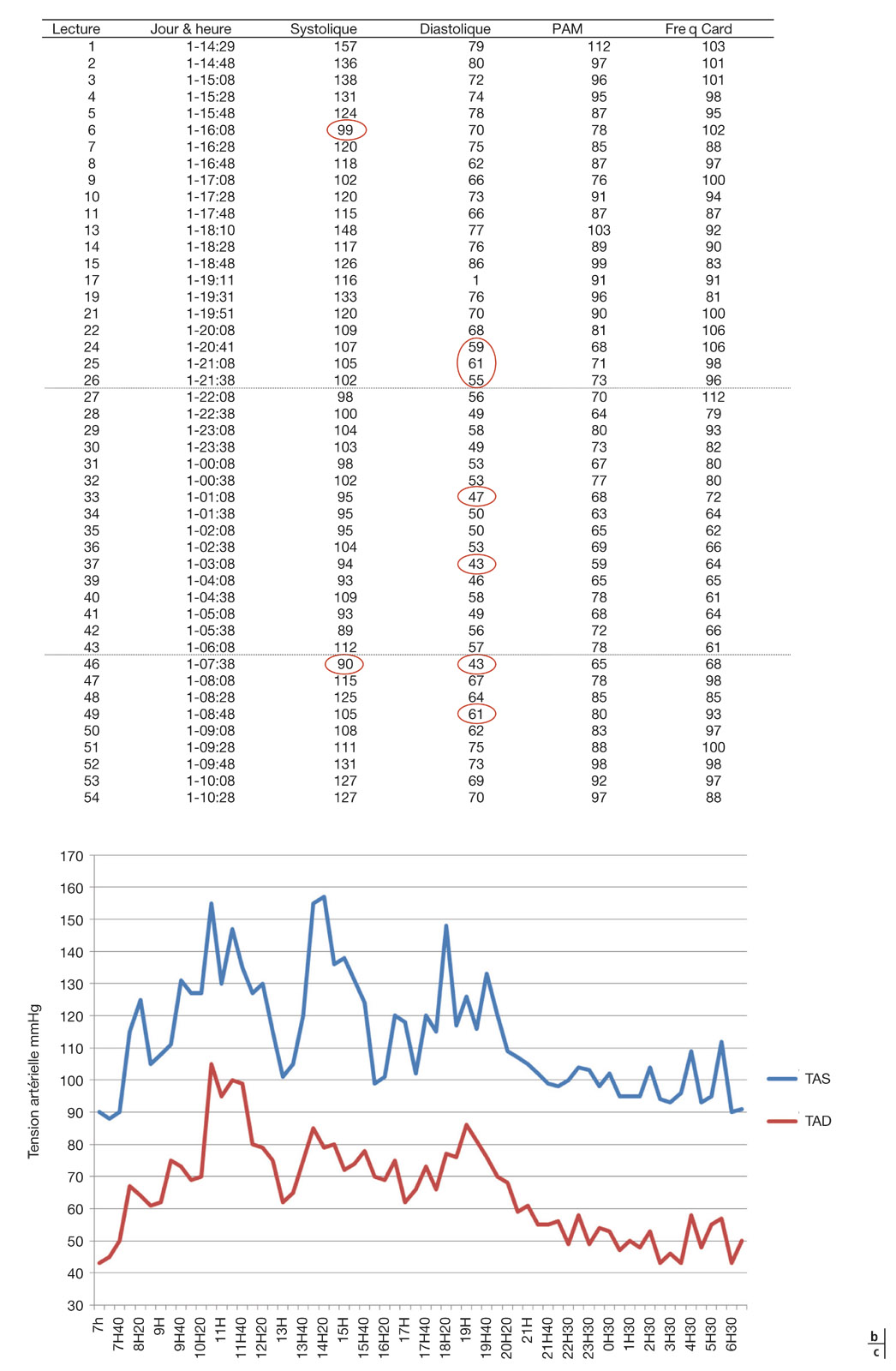
eFig. 17-3 b. Sur le relevé détaillé des mesures tensionnelles à chaque prise, les valeurs basses d’hypotension (inférieure à 101/61 le jour, et 86/48 la nuit) sont relevées et le pourcentage est calculé par rapport au nombre total de mesures (% de valeurs basses/nombre de valeurs). Supérieur à 15 %, ce rapport est pathologique. c. Graphique des valeurs brutes sur 24 heures. On voit ici des tensions artérielles très variables tout au long du nycthémère, et certaines mesures sont très basses.
Limiter le stress, les vêtements serrant le cou (foulard, cravate ou col serrés) qui augmentent la pression veineuse épisclérale.
Pour limiter l’hypotension orthostatique : il est préférable d’éviter les levers brusques, mettre des bas de contention en cas de varices importantes.
Éviter la plongée sous-marine, les modifications barométriques importantes et l’altitude extrême, qui entraînent des modifications rhéologiques et un appauvrissement en oxygène.
Éviter de jouer d’un instrument à vent – trompette, saxophone –, car cela induit une augmentation de la pression veineuse épisclérale, et donc une élévation de la pression intra-oculaire qui peut être de plusieurs heures après l’arrêt de l’exercice musical.
Éviter le yoga, les exercices la tête en bas, qui entraînent une gêne au retour veineux et une hyperpression oculaire.
Boire beaucoup, en particulier augmenter l’apport hydrique le soir. Préférer des plats salés pour réduire les hypotensions artérielles nocturnes [3].
Éviter les vasoconstricteurs dans la migraine tels que les triptans ou la dihydroergotamine ; se protéger du froid.
Privilégier une alimentation équilibrée, riche en magnésium, en anti-oxydants et en acides gras poly-insaturés oméga 3. Pour les acides gras poly-insaturés, il est recommandé de consommer des noix, de l’huile de poisson gras (en particulier l’huile de foie de morue), de l’huile de tournesol, de maïs et de soja. Pour l’apport en anti-oxydants, il faudrait privilégier les caroténoïdes présents dans la plupart des fruits (agrumes, pêches) et légumes jaunes et verts (surtout les légumes crucifères : choux vert, frisé, rouge, chou-fleur, rave, choux de Bruxelles, rutabaga, navet, et même les radis, le cresson, la roquette et le raifort), ainsi que les apports en vitamines A, C, E, B1 et B2. Le thé vert, le vin rouge et le chocolat apportent les polyphénols flavonoïdes et diminuent le stress oxydatif mitochondrial. Certains conseillent le ginkgo biloba [2, 5, 7-9].
Rechercher et limiter les expositions trop importantes à l’utilisation d’agents potentiellement neurotoxiques (pesticides, etc.).
Pratiquer une activité sportive régulière [10], avoir une bonne hygiène de vie, en éviter le surpoids, le tabac et les aliments favorisant l’artériosclérose.
Afin de mieux tolérer les traitements locaux hypotonisants, faire des soins de paupières réguliers et bien se démaquiller le soir, pour les femmes.
La prise en charge du glaucome ne se réduit pas à la réduction de la PIO. Le patient doit être considéré dans sa totalité. La recherche des autres facteurs du glaucome est primordiale et seront traités avec l’aide du médecin référent. Il est nécessaire pour l’ophtalmologiste de guider cette prise en charge globale et de conseiller le patient sur les mesures hygiénodiététiques, alimentaires, comportementales et environnementales, visant à préserver au mieux le nerf optique et sa vascularisation.
Retenir
L’interrogatoire est un moment fort de la consultation ; il permet de guider l’examen et la prise en charge des patients glaucomateux. Il colligera :
les antécédents personnels et familiaux ;
les facteurs de risque vasculaires, en particulier tout ce qui diminue le calibre vasculaire : artériosclérose, hyperlipidémie, hypertension artérielle, diabète. Il est primordial de voir l’ordonnance des traitements prescrits ;
et aussi les conditions socio-économiques, professionnelles et le mode de vie (tabac, utilisation de pesticide, etc.).
Ces éléments aideront à prescrire un traitement adapté au patient, éventuellement avec l’aide des autres professionnels de santé.
[1] Béchetoille A, Bresson-Dumont H. Diurnal and nocturnal blood pressure drops in patients with focal ischemic glaucoma. Graefes Arch Clin Exp Ophthalmol. 1994 ; 232 : 675-9.
[2] Coleman AL, Kodjebacheva G. Risk factors for glaucoma needing more attention open. Ophthalmol J. 2009 ; 3 : 38-42.
[3] Flammer J, Mozaffarieh M. Autoregulation, a balancing act between supply and demand. Can J Ophthalmol. 2008 ; 43 : 317-21.
[4] Graham SL, Drance SM, Wijsman K, et al. Ambulatory blood pressure monitoring in glaucoma. The nocturnal dip. Ophthalmology. 1995 ; 102 : 61-9.
[5] Huang WB, Fan Q, Zhang XL. Cod liver oil : a potential protective supplement for human glaucoma. Int J Ophthalmol. 2011 ; 4 : 648-51.
[6] Mojon DS, Mathis J, Zulauf M, et al. Optic neuropathy associated with sleep apnea syndrome. Ophthalmology. 1998 ; 105 : 874-7.
[7] Mozaffarieh M, Flammer J. New insights in the pathogenesis and treatment of normal tension glaucoma. Curr Opin Pharmacol. 2013 ; 13 : 43-9.
[8] Mozaffarieh M, Grieshaber MC, Orgül S, Flammer J. The potential value of natural antioxidative treatment in glaucoma. Surv Ophthalmol. 2008 ; 53 : 479-505.
[9] Renard JP, Rouland JF, Bron A, et al. Nutritional, lifestyle and environmental factors in ocular hypertension and primary open-angle glaucoma : an exploratory case-control study. Acta Ophthalmol. 2013 ; 91 : 505-13.
[10] Yip JL, Broadway DC, Luben R, et al. Physical activity and ocular perfusion pressure : the EPIC-Norfolk eye study. Invest Ophthalmol Vis Sci. 2011 ; 52 : 8186-92.
J.-P. Renard
La périodicité des contrôles dépend des circonstances de diagnostic et de suivi du GPAO, du stade clinique de la neuropathie et de plusieurs facteurs propres à chaque patient.
Au stade d’hypertension intra-oculaire (HTO), l’observation est essentielle quel que soit le statut du patient, et sa fréquence dépend étroitement des facteurs de risque associés.
La périodicité des contrôles est différente au stade du diagnostic initial et au cours du suivi ; elle doit s’adapter au stade clinique de l’affection et à un certain nombre de facteurs clés liés au patient.
La neuropathie optique glaucomateuse est caractérisée par un certain nombre de particularités cliniques et paracliniques dont l’évolution se fait selon différentes modalités, comme nous avons pu le voir au cours des chapitres précédents. L’évolution des lésions est progressive à des taux variables avec une progression de l’atteinte fonctionnelle et de l’atteinte structurale qui ne sont pas toujours en relation directe. Nous avons vu que l’analyse de ces relations entre atteinte structurale et atteinte fonctionnelle reste un point préoccupant pour le clinicien. Si elles bénéficient de nouvelles techniques d’évaluation, notamment de nouvelles méthodes d’analyses statistiques combinées selon des modèles variés dont le modèle bayésien, leur analyse n’en demeure pas moins un défi permanent dans la prise en charge et le contrôle du GPAO.
La neuropathie optique glaucomateuse est caractérisée par un certain nombre de particularités cliniques et paracliniques dont l’évolution se fait selon différentes modalités, comme nous avons pu le voir au cours des chapitres précédents. L’évolution des lésions est progressive à des taux variables avec une progression de l’atteinte fonctionnelle et de l’atteinte structurale qui ne sont pas toujours en relation directe. Nous avons vu que l’analyse de ces relations entre atteinte structurale et atteinte fonctionnelle reste un point préoccupant pour le clinicien. Si elles bénéficient de nouvelles techniques d’évaluation, notamment de nouvelles méthodes d’analyses statistiques combinées selon des modèles variés dont le modèle bayésien, leur analyse n’en demeure pas moins un défi permanent dans la prise en charge et le contrôle du GPAO.
Ces différents paramètres permettent de comprendre l’absence de consensus bien établi et de protocole strict, clair et défini concernant la périodicité à laquelle doivent être effectués la prise en charge, la surveillance, ainsi que le suivi clinique au long cours de tout patient atteint de GPAO.
La classique définition d’une évolution lentement progressive de la neuropathie peut être un élément faussement rassurant et à l’origine d’une tendance à un espacement important des différentes visites de contrôle.
La multiplicité des examens paracliniques (en imagerie, notamment pour l’analyse de l’atteinte structurale), ainsi que la mise en évidence d’une atteinte fonctionnelle brutalement apparue dans la progression, pouvant être liée à des fluctuations et des variations intra-individuelles de l’enregistrement des tests psychophysiques (champ visuel), peuvent et sont souvent source d’une multiplication des visites de contrôle.
L’établissement d’une règle de conduite concernant la périodicité des contrôles de tout patient glaucomateux sera ainsi lié, orienté et établi en fonction de données majeures, qui se rapprochent des paramètres de la prise en charge adaptée à chaque patient et qui sont respectivement :
les circonstances de diagnostic et de suivi du GPAO. La fréquence des contrôles sera conditionnée selon qu’il s’agira :
d’un premier examen avec diagnostic initial,
d’une demande de second avis,
d’une visite de suivi ;
le stade clinique de la neuropathie optique glaucomateuse. Il conditionne de façon importante la périodicité des contrôles qui s’établira en fonction du stade débutant, modéré, ou déjà avancé, voire très évolué, de la maladie ;
enfin, un certain nombre de facteurs liés au patient, dont l’évaluation ainsi que la maîtrise sont en relation étroite avec la qualité de la relation médecin-malade établie. Ils peuvent être regroupés en trois catégories dont les éléments sont évalués pour établir une fréquence optimale des contrôles. L’âge du patient, les caractéristiques socio-économiques et socioprofessionnelles propres à chaque individu, ainsi que le profil psychologique associé au mode de vie interviennent notamment pour une bonne compréhension des caractéristiques de l’affection et de ses conséquences, et conditionnent la relation de confiance ainsi que l’observance du traitement.
La fréquence des contrôles est donc sous la dépendance de nombreux paramètres cliniques et paracliniques à évaluer et, bien conduite, elle conditionne le bon contrôle de la neuropathie optique glaucomateuse.
Plusieurs critères conditionnent la fréquence des contrôles chez un patient présentant une HTO :
l’évaluation les facteurs de risque de progression de l’HTO vers le GPAO ;
la connaissance des recommandations pour le dépistage du GPAO. Les études OHTS et EGPS, qui incluaient dans leur protocole une analyse du champ visuel (CV) tous les six mois, ont rapporté que les lésions glaucomateuses initiales chez les patients atteints d’HTO pouvaient être détectées initialement sur une modification soit du CV, soit de la tête du nerf optique. Les paramètres structuraux et fonctionnels doivent donc être évalués lors de chaque contrôle.
Toute modification doit être supérieure à l’amplitude des variations ou des fluctuations interexamens qui peuvent être relevées.
La détection d’une altération au niveau du CV doit être confirmée par un nouvel examen. Les résultats de l’étude de l’OHTS rapportent qu’un déficit du CV décelé pour la première fois sur un relevé fiable n’est pas retrouvé au deuxième examen dans 86 % des cas. Après deux CV fiables relevant des déficits anormaux, le relevé suivant est normal dans 40 % des cas, et l’on considère classiquement qu’il est utile de disposer de trois relevés anormaux du CV associés à une corrélation de l’atteinte fonctionnelle avec l’aspect du nerf optique pour confirmer la progression d’une HTO vers le GPAO.
La conversion vers un glaucome peut survenir, que le patient soit traité ou non, et la prescription d’un traitement n’est pas un gage de meilleure fidélisation du patient aux différentes visites. L’observation est donc essentielle quel que soit le statut du patient. Le patient bien informé du risque de progression doit correctement comprendre la nécessité d’un suivi régulier. Ainsi, pour un patient avec peu de facteurs de risque et un faible risque de progression, un champ visuel annuel peut être tout à fait suffisant. En revanche, un patient avec de multiples facteurs de risque et un taux élevé de risque de progression doit être contrôlé plus fréquemment. Un CV tous les six mois est raisonnable chez ces patients à plus haut risque d’évolution vers le glaucome.
Un bilan complet structural et fonctionnel doit être réalisé lors de chaque examen, sans oublier l’appréciation de toute modification éventuelle de facteurs de risques associés.
Dans un premier temps, il est capital de définir rapidement le type progression de la forme clinique présentée par chaque patient, non prédictif pour un patient sur deux en moyenne. Cette progression, variable selon les individus, distingue deux groupes de patients : d’une part, les « progresseurs rapides » caractérisés par une évolution de la neuropathie optique glaucomateuse accélérée et souvent difficile à contrôler, et d’autre part, les « progresseurs lents », plus facilement équilibrés par un traitement médical et rentrant dans le cadre des formes classiques de la neuropathie optique glaucomateuse d’évolution lentement progressive.
Ces éléments conditionnent la fréquence des visites de contrôles et de suivi de tout patient présentant un GPAO examiné pour la première fois quel que soit le stade clinique, a fortiori lorsqu’il s’agit d’un glaucome débutant.
À ce stade de diagnostic initial, il est donc essentiel de définir le type de progression en tenant compte également de l’effet d’apprentissage qui reste fréquent pour l’adaptation aux différents examens.
Il convient ainsi de distinguer la périodicité des contrôles au stade du diagnostic initial de celle du stade de suivi.
L’évaluation de la progression de l’atteinte fonctionnelle nécessite donc de réaliser un minimum d’examens dans un temps relativement court.
Si trois examens du CV dans les six premiers mois sont recommandés par certains, il est bien évident que leur réalisation en pratique clinique courante n’est pas envisageable dans la majorité des cas. Leur réalisation au cours de la 1re année rentre plus dans le domaine du possible. Ils permettent d’établir une bonne base de données, en tenant compte de l’effet d’apprentissage. Les différentes études ont bien démontré l’importance d’un nombre suffisant de CV pour évaluer la vitesse de progression.
Classiquement, trois CV rapprochés sont recommandés pour stabiliser l’effet d’apprentissage et, dans la mesure du possible, un total de six relevés dans les deux premières années afin de détecter les « progresseurs rapides » (de l’ordre de 2 dB/an de baisse du MD) [1].
Devant la constatation d’une aggravation au niveau du champ visuel, une confirmation de cette évolution par un nouveau relevé est nécessaire dans un délai relativement court, de l’ordre de trois à quatre semaines.
On comprend ainsi aisément qu’au moment du diagnostic, la fréquence du suivi doit être très élevée les deux premières années afin de déterminer ce potentiel évolutif possible de progression rapide. Elle va ensuite s’adapter aux résultats des premiers examens réalisés.
Si une atteinte fonctionnelle et structurale importante est mise en évidence, la fréquence du suivi les deux premières années doit être élevée afin de confirmer son caractère évolutif potentiel ou sa stabilité.
En cas de déficit modéré et de premiers examens du CV particulièrement rassurants et fiables, la fréquence des examens peut être diminuée et limitée à deux contrôles les deux premières années.
Au-delà de cette période initiale que l’on peut qualifier de probatoire, la fréquence du suivi dépend du stade clinique de l’affection.
Si la neuropathie est bien contrôlée avec une vitesse de progression lente, voire une complète stabilité, un suivi régulier peut être envisagé avec une fréquence tous les huit à dix mois.
En cas de progression rapide avec l’apparition d’une dégradation au niveau de l’atteinte fonctionnelle ou structurale, celle-ci doit être contrôlée rapidement afin d’être confirmée ou infirmée. Dans ce cas, un suivi plus régulier, tous les six mois, peut être envisagé jusqu’à l’obtention d’une stabilité.
La fréquence des visites de suivi sera globalement identique, adaptée au type de progression de la neuropathie, et la constatation d’une aggravation pourra être rapidement contrôlée. Une fréquence de suivi régulière sera ensuite adaptée après stabilisation.
La périodicité du suivi dans les formes évoluées sera beaucoup plus courte, tous les trois à quatre mois en fonction des circonstances et de l’importance du déficit fonctionnel.
L’ensemble des études épidémiologiques et de dépistage ont rapporté que le stade évolutif de la neuropathie optique glaucomateuse présentait une sévérité similaire dans tous les groupes d’âge, avec cependant une plus grande fréquence de glaucome précoce et débutant chez les sujets plus jeunes [4].
Il faut également tenir compte d’un certain nombre de facteurs associés à l’espérance de vie et au risque de cécité. Une récente revue des facteurs pronostiques de progression à partir des données de 85 études publiées jusqu’à fin 2010 rapporte une augmentation du risque avec la durée de la maladie, une PIO très élevée ainsi qu’un état du CV plus dégradé au moment du diagnostic [2, 3, 5].
Chez le sujet jeune, les difficultés d’acceptation de l’affection asymptomatique et du traitement avec ses contraintes nécessitent souvent des contrôles plus rapprochés. Ils facilitent la bonne compréhension et l’acceptation de la neuropathie avec un meilleur contrôle de l’observance thérapeutique.
Chez le sujet âgé, les affections pathologiques souvent associées avec plusieurs traitements permettent en général une meilleure acceptation des visites de contrôle et de l’observance thérapeutique. La fréquence des visites et du suivi n’est, dans la majorité des cas, pas influencée par l’âge avancé du patient.
Les différentes études réalisées dans les pays industrialisés ont bien rapporté une augmentation de la fréquence d’un diagnostic tardif du glaucome, avec une prédominance des formes évoluées au moment du diagnostic dans les classes socio-économiques peu élevées de population. La découverte de ces formes cliniques justifie et nécessite une fréquence du suivi plus importante et rapprochée lorsque ces facteurs sont associés au tableau clinique.
L’association à d’autres facteurs de risque socioprofessionnels tels que l’exposition à des agents neurotoxiques (pesticides, etc.) peut également justifier une augmentation de la fréquence du suivi après avoir prévenu le patient de ce facteur de risque évolutif (voir chapitre 8-IV).
Enfin, les caractéristiques psychologiques propres à chaque patient doivent être prises en considération dans l’évaluation du tableau de la prise en charge et de la périodicité des contrôles. La personnalité du patient, son acceptation de la neuropathie, son état d’anxiété ainsi que la fiabilité des examens réalisés au cours des différents contrôles sont autant de facteurs qui doivent être pris en compte pour établir et moduler la fréquence du suivi.
Retenir
Si la périodicité des contrôles est variable – tous les huit à douze mois en cas de neuropathie optique stable sans déficit du champ visuel, tous les six mois si les déficits du champ visuel sont modérés et tous les trois à quatre mois en cas de GPAO évolué, instable et avec des déficits sévères du champ visuel –, le protocole de suivi restera rigoureux avec une évaluation structurale et fonctionnelle à chaque contrôle.
À ces considérations du stade clinique de la neuropathie, la vitesse de progression (quel que soit le stade clinique) et plusieurs facteurs de risque propres à chaque patient modulent en permanence cette périodicité que l’on s’attachera à adapter dans le cadre du colloque singulier personnalisé.
[1] Chauhan BC, Garway Heath DF, Goni FJ, et al. Practical recommendations for measuring rates of visual field change in glaucoma. Br J Ophthalmol. 2008 ; 92 : 569-73.
[2] De Moraes CG, Juthani VJ, Liebmann JM, et al. Risk factors for visual field progression in treated glaucoma. Arch Ophthalmol. 2011 ; 129 : 562-8.
[3] Ernest PJ, Schouten JS, Beckers HJ, et al. An evidence-based review of prognostic factors for glaucomatous visual field progression. Ophthalmology. 2013 ; 120 : 512-9.
[4] Heijl A, Bengtsson B, Oskarsdottir SA. Prevalence and severity and undetected manifest glaucoma : results from the Early Manifest Glaucoma Trial screening. Ophthalmology. 2013 ; 120 : 1541-5.
[5] Kooner KS, Albdoor M, Cho BJ, et al. Risk factors for progression to blindness in high tension primary open angle glaucoma : comparison of blind and no blind subjects. Clin Ophthalmol. 2008 ; 2 : 757-62.
M. Detry-Morel
Les problèmes de non-observance sont fréquents, complexes et sous-estimés par le patient et son ophtalmologiste.
Toute aggravation progressive du champ visuel authentifiée en dépit d’un contrôle satisfaisant de la PIO doit conduire à se poser la question de savoir s’il faut davantage réduire la PIO cible ou s’il faut essayer de déceler une inobservance et y remédier.
L’amélioration de l’observance repose sur la qualité de la relation médecin-patient, l’information et l’éducation du patient.
L’efficacité des programmes d’information et d’éducation n’est pas formellement prouvée. Ces programmes devront être régulièrement répétés.
Fondé sur des instillations quotidiennes de collyres et des visites de contrôle périodiques, le traitement médical du glaucome primitif à angle ouvert (GPAO) requiert une coopération très soutenue des patients pour que leur maladie puisse être contrôlée [1]. Sans que le patient n’en perçoive les bénéfices, le coût de ce traitement, ses contraintes et ses effets secondaires viendront se surajouter à son éventuel handicap visuel et amoindrir sa qualité de vie. La non-observance a potentiellement des conséquences importantes. Elle expose le patient aux risques que ses médications soient multipliées, que sa maladie s’aggrave et/ou que d’autres alternatives de traitement (laser ou chirurgie) lui soient proposées. Pour les organismes d’Assurance maladie, elle implique un surcroît de dépenses lié à la prescription de médications inutilisées et/ou inutiles et à des visites plus fréquentes, au recours à d’autres traitements plus coûteux et à la prise en charge du handicap lié à la maladie et à sa progression.
L’observance au régime prescrit a deux composantes :
l’adhérence désigne l’adéquation du comportement du patient aux prescriptions et aux recommandations du médecin. Les défauts d’adhérence englobent les oublis et les abandons de traitement, les horaires ou les espacements incorrects, les instillations non efficaces ou excessives, les automédications et le non-respect des visites de contrôle ;
la persistance correspond au renouvellement des prescriptions par le patient pour le même traitement sur le long terme [1, 23, 28].
Les méthodes d’évaluation de l’observance médicamenteuse sont fondées sur :
l’interrogatoire des patients et l’utilisation de questionnaires ;
le monitorage des gouttes instillées à l’aide du flacon moniteur électronique (FME). En mesurant le décompte des gouttes instillées et en renseignant sur la date des instillations et leur espacement, le FME représente le « gold standard » en matière de mesure d’observance [1, 14-17, 23, 28] ;
la déclaration du nombre de flacons délivrés en pharmacie et/ou l’évaluation des données de dispensation par les compagnies d’Assurance maladie. Le nombre de flacons délivrés permet de mesurer le rapport moyen de possession des médications (RPM) qui correspond au rapport de la quantité de flacons prescrits que le patient a en sa possession et le nombre de flacons qu’il devrait avoir s’il va recharger ses prescriptions à un rythme normal [2, 28] ;
l’observation directe permettant d’attester d’une instillation efficace ;
l’examen clinique par la mesure de la PIO et la détection d’une aggravation des pertes glaucomateuses.
La proportion de non-observance varie de 4,6 à 80 % et plus selon les définitions, les critères employés et les méthodes d’évaluation appliquées [2, 15, 28]. D’une méta-analyse portant sur 34 études originales, Olthoff et al. [19] ont dégagé quatre grands types de constatations listées ci-après.
Une proportion élevée des patients est confrontée à des problèmes d’observance.
a. Adhérence. Un quart des patients oublierait la moitié de leurs instillations. Des erreurs involontaires du schéma de traitement concerneraient de 50 à 90 % des cas de mauvaise observance. La proportion d’instillations mises dans les deux semaines qui précèdent une visite programmée (« effet blouse blanche ») est significativement plus élevée que toutes celles couvrant la période entière d’observation [2, 23, 28]. Lors de traitements associés, un quart des patients ne respecte pas un intervalle minimal de trois minutes entre leurs médications. Entre 13 et 20 % des patients, en majorité plus âgés, dépendent d’une tierce personne pour leurs instillations [4, 19, 20]. Environ un tiers des patients néglige leurs visites de contrôle [1].
b. Persistance. Les taux de persistance se sont révélés être en dessous de 50 % à un an. Dans la Glaucoma Adherence and Persistency Study (GAPS) portant sur les données recueillies à partir des pharmacies auprès de 14 000 sujets, les patients avaient pris en moyenne 64 % de leurs médications et le RPM était de 0,64 à un an. Alors que 59 % des sujets avaient encore un agent hypotenseur à 12 mois, seulement 10 % l’avaient employé de manière continue sur cette période [2]. Dans l’étude d’Okeke et al. [17] fondée sur l’emploi d’un FME, 45 % des patients étaient non persistants au traitement plus de 75 % du temps. Dans une étude rétrospective basée sur les données recueillies auprès des compagnies d’assurance chez plus de 5 000 patients, Nordstrom et al. [16] ont constaté que près de la moitié des sujets qui avait reçu et acheté une première prescription interrompait complètement leurs médications durant les six premiers mois, et que seuls 37 % d’entre eux avaient récemment renouvelé leur prescription initiale trois ans après la première délivrance de médications. La persistance peut fluctuer dans le temps et varie d’une classe pharmacologique à l’autre [2, 3, 19, 28]. Les prostaglandines et la combinaison dorzolamide-timolol jouissent d’une meilleure persistance que les autres classes de médications [1, 22-24].
Les estimations d’observance fondées uniquement sur l’interrogatoire des patients ont montré que des oublis involontaires concernaient entre 23 et 58 % des patients et plus pour des traitements plus complexes, et que 30 à 40 % des patients reconnaissaient qu’ils n’avaient jamais eu l’intention de suivre le traitement [20, 24]. Ces proportions sont plus élevées dans les questionnaires remis aux patients dans lesquels de 70 à 85 % d’oublis sont avoués [20]. À partir d’un questionnaire standardisé complété par 500 patients et dans lequel l’inobservance avait été définie comme étant l’oubli d’une goutte de médication par semaine et/ou l’incapacité à décrire avec exactitude le régime médicamenteux, Kholdebarin et al. [10] ont constaté que plus de 50 % des patients n’observaient pas la thérapie ou utilisaient une technique d’instillation inadéquate. Parallèlement, les dispositifs FME confortent ces chiffres, donnant une proportion encore plus importante d’oublis (66-90 %) [17].
Les patients surestiment leur observance par rapport aux données recueillies par les centrales pharmaceutiques et le FME et, voulant passer naturellement pour de « bons » patients, donnent l’illusion au praticien qu’ils se soignent bien. Dans la GAPS, 89 % des patients déclaraient une adhérence quotidienne exemplaire alors que le RPM moyen correspondant n’était que de 0,67 [2]. Dans l’étude de Gray et al. [7], 6 % seulement des patients avouaient à leur ophtalmologiste qu’ils ne mettaient pas bien leurs collyres alors que 94 % inscrivaient dans leur questionnaire qu’ils les oubliaient.
Les prédictions du clinicien sont faiblement corrélées avec la prise réelle des médications authentifiée par le FME [6, 17]. Jusqu’à un patient sur cinq rencontrerait des problèmes d’observance que le clinicien est incapable de déceler [21].
À l’exception des glaucomes sévères, l’impact réel de l’inobservance sur l’évolution clinique du glaucome n’a pas été formellement démontré. Pour une majorité des auteurs, les patients non observants encourent un plus grand risque d’aggraver leur maladie mais le niveau de pression intra-oculaire (PIO) serait comparable entre les patients dont le champ visuel s’aggrave et ceux dont le champ visuel est stable [25, 26]. Une relation entre l’observance et le niveau de PIO n’a pu être démontrée de manière évidente et unanime ; de même, le niveau d’observance minimal efficace et le degré de non-observance susceptible d’être un facteur de risque de progression du glaucome n’est pas clairement défini [25, 29].
L’adhérence au traitement antiglaucomateux est influencée par de nombreux facteurs (eCas clinique 17-1). Dans la classification bien connue de Tsai, 71 « barrières » ou obstacles à l’observance ont été identifiés et individualisés en : (i) facteurs de situation et liés à l’environnement ; (ii) facteurs liés au traitement ; (iii) facteurs liés au patient ; (iv) facteurs liés au médecin [30]. Une partie des problèmes de non-adhérence reste liée à des facteurs qui échappent en tout ou partie au contrôle du médecin (coût des médications, contrats des polices d’assurance des patients, conditionnement des médications).
Les études conduites au cours de ces dix dernières années ont souligné le rôle essentiel des facteurs individuels d’une part et de ceux liés au traitement d’autre part.
Ce cas clinique concerne un patient né en 1945, astigmate léger, sans autre facteur de risque pour le GPAO et suivi depuis avril 1997 pour une hypertension oculaire modérée associée à des chiffres de PIO à vide oscillant entre 20 et 26 mmHg OD et 21-23 mmHg OG au tonomètre à l’aplanation de Goldmann (moyenne des mesures de pachymétrie cornéenne : 578 μm). Le patient avait accepté de participer à l’essai clinique randomisé qui fut conduit en Europe sur le traitement de l’hypertension oculaire (EGPS ou European Glaucoma Prevention Study) entre 1998 et 2003. Conformément au protocole de l’étude, il avait dû s’astreindre à un traitement local comportant trois instillations quotidiennes de dorzolamide ou d’un placebo dans chaque œil. Ses papilles optiques et son champ visuel étaient restés inchangés pendant toute la durée de l’étude, tandis que ses mesures de PIO s’étaient révélées fluctuantes et plus élevées sur un œil puis sur l’autre œil. Alors que le patient, qui n’avait d’ailleurs pas manqué une seule des visites prévues par le protocole de l’étude, affirmait au départ avoir mis son collyre selon le schéma qui lui avait été recommandé, il avait fini par faire part d’oublis fréquents de traitement et même d’interruptions complètes durant plusieurs semaines suite à un surmenage. Comme il avait alors une chance sur trois de recevoir un placebo, il était impossible de se prononcer formellement sur son niveau d’observance et l’interprétation des fluctuations de sa PIO. Au cours des deux années qui ont suivi, une surveillance simple sans traitement lui fut recommandée car il se déclarait plus convaincu par les médecines « douces ». Toutefois, en janvier 2006, comme sa PIO atteignait 30 mmHg à l’OD et que sa papille droite se détériorait légèrement, il avait accepté de reprendre un traitement local sous forme de latanoprost dans l’OD. La réponse au latanoprost s’était révélée concluante mais, de nouveau, la PIO sous traitement avait été mesurée ponctuellement par la suite à 26 mmHg à cet œil et se retrouvait « normalisée » à 18 mmHg à la visite suivante, aux mêmes heures. Un adénocarcinome prostatique doté d’un haut risque de progression lui fut découvert en avril 2010. Se considérant dès lors « en sursis », il cessa son traitement antiglaucomateux pendant une bonne année au terme de laquelle sa PIO était de 33 mmHg OD et de 25 mmHg OG, tandis qu’un déficit débutant était mis en évidence à l’examen du champ visuel aux deux yeux avec un taux de progression très lent mais significatif depuis 2000 (analyse globale de tendance par le programme GPA2 du périmètre Humphrey). Parallèlement, l’atrophie optique glaucomateuse avait légèrement progressé aux deux yeux. À nouveau sensibilisé à son problème, le patient accepta de reprendre un traitement local qu’il abandonna rapidement suite à la découverte de métastases osseuses, car il ne le jugeait plus d’aucune utilité dans son état.
Discussion
Avec un recul portant sur une quinzaine d’années, cette observation illustre les inévitables fluctuations de l’observance médicamenteuse, ellesmêmes inhérentes aux aléas et aux événements marquants de la vie des patients, à leur personnalité et leur perception du glaucome [3]. Elle montre aussi qu’il est important d’essayer de « cerner » le mieux possible le profil psychologique des patients et leur degré de motivation à suivre le traitement par une discussion « ouverte » au moment du diagnostic, sinon au plus tard durant les premières semaines du suivi pour évaluer plus précisément quel semble être leur niveau d’observance et adapter la stratégie du traitement en conséquence [1, 2, 4].
Un « bon patient » n’est pas forcément celui qui semble répondre à ce que son médecin attend de lui mais qui avoue franchement ses difficultés, son refus ou son impossibilité à suivre le traitement qui lui a été prescrit [2].
Bien que la PIO mesurée ponctuellement aux visites de contrôle ne reflète pas la qualité du contrôle de la PIO sur le long terme, la constatation de fluctuations importantes de la PIO ou d’une incohérence des mesures d’une visite à l’autre doit inciter à mettre en doute le niveau d’observance au traitement.
Références
[1] Hamelin N. La relation médecin-malade dans le glaucome. J Fr Ophtalmol. 2008 ; 31 : 2S39-2S44.
[2] Hahn SR. Patient- centered communication to assess and enhance patient adherence to glaucoma medication. Ophthalmology. 2009 ; 116 : S37- S42.
[3] Schwartz GF, Quigley HA. Adherence and persistency with glaucoma therapy. Surv Ophthalmol. 2008 ; 53 : S57- S68.
[4] Stevenson FA, Barry CA, Britten N, et al. Doctor-patient communication about drugs : the evidence for shared decision making. Social Science and Medicine. 2000 ; 50 : 829-40.
Les oublis de traitement, surtout lorsque le patient n’est pas à son domicile, seraient le facteur le plus important [3, 4, 30]. Jusqu’à la moitié des patients rencontrent des difficultés pratiques pour leurs instillations, suite à une carence d’explication dans plus de 70 % des cas [20]. Bien que pour certains auteurs, les patients âgés de moins de 50 ans et ceux de plus de 80 ans auraient tendance à être moins observants, l’âge ne serait pas un facteur de risque déterminant de non-observance [4, 19, 20, 24]. Il n’existe pas de relation nette entre le statut social, le niveau d’éducation et l’observance [19, 24]. Les hommes auraient, sans évidence formelle, plus de risque d’être non observants que les femmes [1]. Le rôle de l’ethnie n’a pas été uniformément investigué bien qu’il semble exister une relation probable [4, 13, 17, 19, 20]. Les patients jouissant d’une meilleure acuité visuelle encourent un risque plus élevé de non-observance [1]. Ceux qui ont un glaucome diagnostiqué auraient plus de chances d’adhérer au traitement que les suspects de glaucome [16]. Le chiffre de PIO de départ n’aurait pas d’effet sur l’observance [1]. Le coût du traitement, du moins dans les pays à couverture sociale élevée, n’aurait qu’un rôle annexe [19, 20].
En revanche, la qualité de la communication médecin-patient, le degré d’information du patient sur sa maladie et sa motivation contribuent dans une large proportion à la qualité de son observance [5, 9, 13]. Une meilleure connaissance du glaucome a été démontrée comme étant associée à une meilleure observance [2, 3, 19, 21]. Le patient qui n’est pas informé du degré de sévérité de sa maladie et des risques de cécité qu’il encourt a plus de risque d’être non observant, de même que s’il dépend exclusivement de son médecin pour son information sur le glaucome, et/ou s’il ne reçoit pas de rappel téléphonique pour ses rendez-vous. Près d’un tiers des patients qui ne se sentent pas concernés par leur traitement aurait une perte visuelle dans 14 % des cas [6]. Dans une étude conduite chez 200 patients, Mansouri et al. [12] ont trouvé que 91 % des patients croyaient à l’efficacité de leur régime thérapeutique, alors que seulement 28 % étaient capables de définir correctement le glaucome et que les facteurs positivement corrélés au glaucome reposaient sur le niveau de connaissance du glaucome et l’aide d’une tierce personne pour l’administration des gouttes.
Le risque de non-observance serait en général plus élevé pour les régimes comportant plus de deux instillations quotidiennes mais ne semble pas augmenter lors de régimes plus complexes, pour autant qu’ils aient été prescrits peu de temps après le diagnostic initial [12, 17-19, 25]. Les taux d’adhérence seraient relativement indépendants des effets secondaires rapportés [4, 12, 27]. Toute modification de traitement pourrait être à l’origine d’une diminution de son observance [20, 25]. Les raisons qui incitent les patients à ne pas s’astreindre à un suivi régulier sont liées à une mauvaise compréhension de leur maladie, au coût des examens de surveillance, à une attente excessive dans les salles d’attente et à une mauvaise compréhension des instructions relatives à l’espacement des visites [13] (eCas clinique 17-2).
Ce cas clinique, relatif à l’observance au traitement, concerne un patient congolais de 45 ans, emmétrope, qui avait consulté pour la première fois en juillet 2009 pour une baisse d’acuité visuelle à l’OG. Deux membres de sa famille étaient atteints de glaucome. L’examen clinique initial avait révélé une acuité visuelle de 0,8 OD et de 0,4 avec difficulté à l’OG, une sclérose nucléaire débutante des cristallins, des mesures de PIO de 28 mmHg OD et de 35 mmHg OG, des cornées fines (490 μm), un angle iridocornéen ouvert et une atrophie glaucomateuse sévère des deux papilles optiques, surtout de la gauche. Un déficit modéré du champ visuel était mis en évidence à l’OD, tandis que le champ visuel de l’OG était fortement altéré avec un scotome absolu altitudinal inférieur empiétant sur la fixation et un large ressaut nasal supérieur. Face à ce tableau clinique, une intervention filtrante a été proposée au patient qui se trouvait à ce moment dans l’impossibilité de la réaliser pour des raisons financières et des difficultés de prolongation de la validité de son visa. Un traitement médical associant latanoprost et Cosopt® fut instauré. Trois semaines plus tard, la PIO était de 14 et de 12 mmHg OD et OG sous ce traitement qui fut reconduit lorsque le patient est retourné en Afrique. Il n’est revenu en contrôle que deux années plus tard. Ses pertes du champ visuel s’étaient sensiblement majorées aux deux yeux, surtout à l’OG, sa PIO était de 26 et de 30 mmHg OD et OG sans traitement depuis plusieurs mois, faute d’un manque de réapprovisionnement de ses collyres.
Discussion
L’observation de ce patient souligne la gravité du GPAO du sujet africain qui est plus fréquent que chez le Caucasien, mais aussi plus grave, de survenue plus précoce, de diagnostic plus tardif, d’évolution plus agressive et rapide, le risque de cécité étant deux fois plus élevé que chez le Caucasien [1-6]. L’existence d’antécédents familiaux de glaucome est aussi retrouvée avec prédilection dans la population mélanoderme [3]. D’autres paramètres anatomiques pourraient simultanément contribuer à la gravité du glaucome du sujet africain, parmi lesquels des niveaux de PIO plus élevés au moment du diagnostic, des papilles optiques de grande taille, des cornées plus minces qui tendent à sous-estimer la mesure de la PIO et sont potentiellement liées à une susceptibilité plus grande au dommage glaucomateux et, enfin, une conjonctive plus réactive [3]. Sur le plan thérapeutique et à l’exception de la pilocarpine, la réponse aux médications ne semble pas différente de celle du sujet caucasien [3] ; en revanche, la gestion du traitement médical se heurte à des difficultés multiples et de très fréquents problèmes d’observance, comme ce fut le cas de ce patient [3]. Une accessibilité souvent difficile aux soins de santé, une couverture sociale réduite, des moyens financiers limités, un manque d’information appropriée et une carence d’approvisionnement en médications en sont les causes principales.
Références
[1] AGIS Investigators. The Advanced Glaucoma Intervention Study (AGIS) : 9. Comparison of glaucoma outcomes in black and white patients within treatment groups. Am J Ophthalmol. 2001 ; 132 : 311-20.
[2] Cook C. Glaucoma in Africa : size of the problem and possible solutions. J Glaucoma. 2009 ; 18 : 124-8.
[3] Denis P. Le glaucome chez le mélanoderme. J Fr Ophtalmol. 2004 ; 27 : 708-712.
[4] Fansi AA, Papamatheakis DG, Harasymowycz PJ. Racial variability of glaucoma risk factors between African Caribbeans and Caucasians in a Canadian urban screening population. Can J Ophthalmol. 2009 ; 44 : 576-81.
[5] Friedman DS, Jampel HD, Munoz B, West SK. The prevalence of open- angle glaucoma among black and whites 73 years and older : the Salisbury Eye Evaluation Glaucoma Study. Arch Ophthalmol. 2006 ; 124 : 1625-30.
[6] Sample PA, Girkin CA, Zangwill LM, et al. African Descent and Glaucoma Evaluation Study Group. The African Descent and Glaucoma Evaluation Study (ADAGES) : design and baseline data. Arch Ophthalmol. 2009 ; 127 : 1136-45.
Les études interventionnelles entreprises dans le but de réduire la prévalence des doses oubliées ou d’améliorer leur espacement ont conclu qu’elles entraînaient une amélioration modeste, quasi immédiate, mais éphémère de l’observance des patients [4, 18, 19]. Dans une étude ayant analysé l’impact à trois mois d’un programme d’intervention multiciblé appliqué chez 66 patients pour un traitement ne comportant qu’une seule instillation quotidienne (fondé sur des rappels téléphoniques, des vidéos éducatives, un questionnaire sur les obstacles à mettre les collyres, des rappels avec témoins audibles et visibles sur leur dispositif FME), Okeke et al. [18] ont noté que le nombre de doses instillées avait significativement augmenté de 54 à 73 % chez les personnes dont le taux d’adhérence de départ était inférieur à 75 %, et ce par rapport au groupe contrôle demeuré stable [18]. Parallèlement, l’effet positif de l’entraînement des compétences en communication a été confirmé par Hahn et al. [8] : dans une étude conduite chez 33 médecins ayant reçu deux séries d’entretien dans lesquels le principe « demander-dire-demander » leur avait été expliqué, la fréquence des questions ouvertes est passée de 18 à 82 %, l’identification des obstacles à une bonne observance de 6 à 26 %, et 78 % des patients ayant une faible adhérence ont pu être décelés contre 25 % avant ce programme de formation, et ce moyennant un allongement de la durée de la consultation de seulement deux minutes.
Les interventions mises en œuvre sont multidirectionelles et adaptées à chaque cas particulier [1]. Les cliniciens doivent être impérativement conscients que la non-observance est fréquente chez leurs patients, que ceux-ci la sous-estiment et qu’il leur arrive exceptionnellement de leur demander s’ils souhaitent ou se sentent capables d’adhérer au régime prescrit [5]. Le rôle du patient durant la consultation a été longtemps sous-estimé ; des programmes promouvant la participation active du patient sont dès lors indispensables. L’information sera régulièrement renouvelée, car sa compréhension et son acceptation sont progressives et fluctuantes. La pratique de questions ouvertes en utilisant les séquences « demander-dire-demander » et l’évaluation de la capacité ponctuelle du patient à changer son comportement sont une des stratégies proposées pour déceler et solutionner les problèmes d’inobservance. La remise d’un questionnaire ciblé contribuera à identifier les patients qui ont le plus besoin d’une information et/ou d’un enseignement portant sur l’instillation du collyre et à sérier ceux qui ont besoin d’une autre alternative thérapeutique [14]. Un bon support familial ou social, des visites plus fréquentes au début du suivi et la corrélation de la prise des médications avec les activités quotidiennes sont aussi d’une grande importance.
1. Prendre en considération les problèmes d’observance et de persistance au moment du choix du traitement et les normaliser, les universaliser auprès du patient.
2. Simplifier les traitements à une ou deux instillations quotidiennes au maximum et privilégier les combinaisons plutôt que les associations.
3. Dispenser les informations dans un message simple, compréhensible et précis tout en s’assurant que celui-ci aura bien été compris et accepté [24]. Entretenir régulièrement l’information, recourir aux aides audiovisuelles (diffusion d’un film en boucle sur le glaucome dans les salles d’attente, distribution de brochures d’information sur le glaucome, consultations des sites Internet sur le glaucome, etc.). Suggérer au besoin de contacter une association de patients glaucomateux.
4. Apprendre au patient comment instiller ses collyres et procéder efficacement à l’occlusion des points lacrymaux, vérifier sa technique d’instillation, lui fournir le cas échéant un dispositif d’aide aux instillations, planifier avec lui ses instillations en fonction de ses activités quotidiennes, lui recommander de conserver un calendrier de son traitement et d’employer des aide-mémoire simples (programmation de la sonnerie du téléphone portable, association à une activité quotidienne, etc.) (fig. 17-6).
5. Se faire aider dans la mesure du possible par le personnel soignant.
6. Ne pas sous-estimer le coût des collyres pour certains patients.
7. Rechercher et être attentif aux effets secondaires rapportés.
8. Recourir aux rappels téléphoniques, aux courriers et/ou courriels pour rappeler les visites de contrôle.
9. Impliquer au besoin un membre de la famille ou un dispensateur de soins pour assister le patient dans l’instillation de ses gouttes en cas de difficultés ou lui rappeler le moment de les instiller.
10. Communiquer avec le médecin traitant.
L’efficacité des actions entreprises devra être évaluée par la suite à intervalles plus rapprochés ; une autre alternative thérapeutique, moins dépendante du facteur d’observance, chirurgicale entre autres, devra sans tarder être envisagée si les problèmes identifiés ne semblent pas ou ne peuvent être contrôlés efficacement.

Fig. 17-6 a. Dispositif d’aide à l’instillation. b. Utilisation en pratique d’un dispositif d’aide à l’instillation.
Les médications ne sont efficaces que chez les patients qui les prennent. Le profil évolutif du glaucome est différent pour chaque patient et peut être faussé par une prise inappropriée ou irrégulière des collyres hypotenseurs. L’observance thérapeutique des patients glaucomateux reste médiocre, mal estimée par les médecins et trop souvent négligée dans la prise en charge des patients. Une meilleure prise de conscience de la fréquence importante de la non-observance et l’établissement d’une « bonne » relation patient-médecin constituent des clés essentielles du traitement de la maladie. L’entretien avec le patient doit être fondé sur des questions ouvertes destinées à renforcer sa motivation, à lui dispenser des conseils sur l’utilisation optimale des collyres et à tenter de rechercher d’éventuels obstacles à une bonne observance. Conjointement, l’identification et la traçabilité des patients qui ne se présentent pas à leurs visites de contrôle sont cruciales et peuvent être facilitées en première intention par des rappels téléphoniques systématiques de leurs rendez-vous. La non-observance peut être urgente à déceler pour permettre le recours à temps à d’autres alternatives de traitement (laser ou chirurgie) moins ou non dépendantes du facteur d’observance. Une diffusion plus large du FME devrait permettre de déceler plus facilement l’inobservance et d’évaluer plus objectivement l’effet du traitement. L’arrivée future de nouvelles voies d’administration (gels ophtalmiques, inserts, liposomes et nanosphères, lentilles de contact destinées à relarguer les médications antiglaucomateuses, formes injectables sous forme de micro- et nanoparticules biodégradables et implants sous-conjonctivaux mis en place chirurgicalement, toutes voies potentiellement combinées à des médications neuroprotectrices) devrait enfin permettre dans l’avenir de diminuer très significativement le rôle du facteur individuel lié au patient [11].
Retenir
Complémentaire de la dispensation d’une information appropriée sur le glaucome, une éducation ciblée du patient qui tiendra compte de son niveau de connaissance sur la maladie est indispensable.
Cependant, une mauvaise information est potentiellement génératrice d’anxiété.
L’interrogatoire, tel qu’il se déroule habituellement, ne permet pas de déceler de manière fiable les problèmes de non-observance et d’en évaluer l’importance.
La PIO mesurée durant les visites de contrôle ne reflète pas l’observance réelle des patients à leur traitement et ne préjuge pas de la qualité du contrôle à long terme de la PIO.
L’observance a plus de chances d’être meilleure sous une monothérapie ou des traitements associés ne comportant que deux prises quotidiennes.
La persistance globale des patients est faible et influencera le choix du ou des collyres à prescrire ; au sein de ceux-ci, les prostaglandines et les combinaisons ont les meilleurs scores de persistance.
[1] European Glaucoma Society. Terminology and guidelines for glaucoma. Treatments principles and options. 3rd edition. Savona, Dogma, 2008 : 144-5.
[2] Friedman DS, Quigley HA, Gelb L, et al. Using pharmacy claims data to study adherence to glaucoma medications : methodology and findings of the Glaucoma Adherence and Persistency Study (GAPS). Invest Ophthalmol Vis Sci. 2007 ; 48 : 5052-7.
[3] Friedman DS, Hahn SR, Gelb L, et al. Doctor-patient communication, health-related beliefs, and adherence in glaucoma : results from the Glaucoma Adherence and Persistency Study. Ophthalmology. 2008 ; 115 : 1320-7.
[4] Friedman DS, Okeke C, Jampel HD, et al. Risk factors for poor adherence to eyedrops in electronically monitored patients with glaucoma. Ophthalmology. 2009 ; 116 : 1097-105.
[5] Friedman DS, Hahn SR, Quigley HA, et al. Doctor-patient communication in glaucoma care. Analysis of videotaped encounters in community-based office practice. Ophthalmology. 2009 ; 116 : 2277-85.
[6] Gelb L, Friedman DS, Quigley HA, et al. Physician beliefs and behaviors related to glaucoma treatment adherence : the Glaucoma Adherence and Persistency Study. J Glaucoma. 2008 ; 17 : 690-8.
[7] Gray TA, Fenerty C, Harper R, et al. Preliminary survey of educational support for patients prescribed ocular hypotensive therapy. Eye. 2010 ; 24 : 1777-86.
[8] Hahn SR, Friedman D, Quigley HA, et al. Effect of patient-centered communication training on discussion and detection of nonadherence in glaucoma. Ophthalmology. 2010 ; 117 : 1339-47.
[9] Herndon LW, Brunner TM, Rollins JM. The Glaucoma Research Foundation Patient Survey : patient understanding of glaucoma and its treatment. Am J Ophthalmol. 2006 ; 141 : S22-S27.
[10] Kholdebarin R, Campbell RJ, Jin YP, Buys YM, for the Canadian Compliance Study Group. Multicenter study of compliance and drop administration in glaucoma. Can J Ophthalmol. 2008 ; 43 : 454-61.
[11] Lavik E, Kuehn MH, Kwon YH. Novel drug delivery systems for glaucoma. Eye. 2011 ; 25 : 578-86.
[12] Mansouri K, Iliev M E, Rohrer K, Shaarawy T. Compliance and knowledge about glaucoma in patients at tertiary glaucoma units. Int Ophthalmol. 2011 ; 31 : 369-76.
[13] Murakami Y, Lee BW, Duncan M, et al. Racial and ethnic disparities in adherence to glaucoma follow-up visits in a county hospital population. Arch Ophthalmol. 2011 ; 129 : 872-8.
[14] Nordmann JP, Baudouin C, Renard JP, et al. Identification of noncompliant glaucoma patients using Bayesian networks and the Eye-Drop Satisfaction Questionnaire. Clin Ophthalmol. 2010 ; 8 : 1489-96.
[15] Nordmann JP, Baudouin C, Renard JP, et al. Measurement of treatment compliance using a medical device for glaucoma patients associated with intraocular pressure control : a survey. Clin Ophthalmol. 2010 ; 4 : 731-9.
[16] Nordstrom BL, Friedman DS, Mozaffari E, et al. Persistance and adherence with topical glaucoma therapy. Am J Ophthalmol. 2005 ; 140 : 598-606.
[17] Okeke CO, Quigley HA, Jampel HD, et al. Adherence with topical glaucoma medication monitored electronically. The Travatan Dosing Aid Study. Ophthalmology. 2009 ; 116 : 191-9.
[18] Okeke C, Quigley HA, Jampel HD, et al. Interventions improve poor adherence with once daily glaucoma medications in electronically monitored patients. Ophthalmology. 2009 ; 116 : 2286-93.
[19] Olthoff CM, Schouten JS, van de Borne BW, Webers CA. Noncompliance with ocular hypotensive treatment in patients with glaucoma or ocular hypertension. An evidence-based review. Ophthalmology. 2005 ; 112 : 953-61.
[20] Olthoff CM, Hoevenaars JG, van den Borne BW, et al. Prevalence and determinants of non-adherence to topical hypotensive treatment in Dutch glaucoma patients. Graefes Arch Clin Exp Ophthalmol. 2009 ; 247 : 235-43.
[21] Quigley HA, Friedman DS, Hahn SR. Evaluation of practice patterns for the care of open angle glaucoma compared with claims data : the Glaucoma Adherence and Persistency Study. Ophthalmology. 2007 ; 114 : 1599-606.
[22] Rait JL, Adena MA. Persistency rates for prostaglandin and other hypotensive eyedrops : population-based study using pharmacy claim data. Clin Exper Ophthalmol. 2007 ; 35 : 602-11.
[23] Reardon G, Schwartz G, Kotak S. Persistence on prostaglandin ocular hypotensive therapy : an assessment using medication possession and days covered on therapy. BMC Ophthalmology. 2010 ; 10 : 1-9.
[24] Renard JP, Giraud JM, Fenolland JP, May F. L’adhérence au traitement dans le glaucome. J Fr Ophtalmol. 2010 ; 33 : 291-5.
[25] Robin AL, Novack GD, Covert DW, et al. Adherence in glaucoma : objective measurements of once-daily and adjunctive medication use. Am J Ophthalmol. 2007 ; 144 : 533-40.
[26] Rossi GC, Pasineti GM, Scudeller L, et al. Do adherence rates and glaucomatous visual field progression correlate ? Eur J Ophthalmol. 2011 ; 21 : 410-4.
[27] Schwartz GF. Compliance and persistency in glaucoma follow-up treatment. Curr Opin Ophthalmol. 2005 ; 16 : 114-21.
[28] Schwartz GF, Quigley HA. Adherence and persistency with glaucoma therapy. Surv Ophthalmol. 2008 ; 53 : S57-S68.
[29] Sleath B, Blalock SJ, Covert D, et al. The relationship between glaucoma medication adherence, eye drop technique, and visual field defect severity. Ophthalmology. 2011 ; 118 : 2398-402.
[30] Tsai JC. Medication adherence in glaucoma : approaches for optimizing patient compliance. Curr Opin Ophthalmol. 2006 ; 17 : 190-5.
P. Ginies
La qualité de la communication de l’ophtalmologiste avec son patient est essentielle dans la prise en charge du glaucome, non seulement au moment de l’annonce de la maladie, mais aussi tout au long de sa surveillance.
Le médecin doit pouvoir repérer la personnalité de son patient : dépressiante, conversante ou limitante.
En retour, l’ophtalmologiste doit savoir se situer dans l’une de ces trois catégories schématiques : le scientifique froid, le médecin brillant ou le médecin paternaliste.
L’annonce d’un diagnostic à un patient, a fortiori lorsqu’il s’agit d’une maladie chronique, est susceptible d’altérer sa qualité de vie et celle de son entourage. C’est toujours un moment difficile du travail quotidien du médecin dans sa relation thérapeutique aux patients. Dans le cas du glaucome, c’est l’impact, éventuel ou à venir, sur leur vision et leur qualité de vie qui inquiète la grande majorité des patients, beaucoup plus que le niveau de leur pression intra-oculaire (PIO) ou l’état du champ visuel [1, 6].
Il est donc utile et nécessaire pour le médecin de connaître quelques règles de base qui lui permettront de faciliter la mise en place de réflexes et d’approches dans l’échange avec ses patients et de les optimiser. En effet, la qualité de la communication et de la relation médecin-malade représente le meilleur garant de l’observance à long terme des contraintes liées au suivi et au traitement de la maladie chronique. Dans une enquête réalisée chez 4 310 patients glaucomateux (Glaucoma Research Foundation Patient Survey), 28 % d’entre eux indiquaient avoir changé d’ophtalmologiste depuis la découverte du glaucome et, dans 60 % des cas, la raison en était une communication avec le médecin jugée mauvaise par le patient [4].
Le médecin ne doit pas présupposer les effets de l’annonce de la maladie, car elle peut conduire à un échec de la communication. L’annonce du diagnostic doit être neutre, c’est-à-dire à l’écoute de tous les éléments de la scène de communication qui va se jouer, et ce en prenant en compte les trois éléments clés de l’échange : le patient, l’équipe soignante, le message. La résultante en sera : comment le message est-il passé et comment s’exprime-t-il dans l’univers du patient ?
Le patient, c’est celui qui reçoit le message, ou qui ne le reçoit pas… ou qui le reçoit filtré par sa structure de personnalité, c’est-à-dire complètement transformé. On ne peut pas anticiper le temps de l’annonce, il faut juste se dire que les médecins n’ont pas reçu dans leurs études les bases de la science de la communication. Une attitude humble permet de progresser et surtout de repérer ou de comprendre les patients difficiles.
On peut simplifier en trois tableaux dominants la personnalité des patients que l’on rencontre [2] (fig. 17-7). Au début, l’ophtalmologiste ne sait pas les distinguer, mais il peut simplifier la typologie des personnes en tableaux princeps, facilitant l’apprentissage des bons réflexes.

Fig 17-7 De gauche à droite : la personnalité dépressiante, la personnalité conversante, le patient limitant.
(C’est un néologisme issu de dépression, mais qui n’a pas le caractère pathologique de cet état morbide.) Ces patients sont soumis à des comportements d’anticipation précautionneuse. Ils sont discrets, jamais revendicateurs, souffrent en silence, peu loquaces, souvent anxieux, parfois franchement dépressifs. Il faudra ajuster instantanément les gestes, les premières paroles et le ton à cette personnalité plutôt timorée qui craint un discours trop agressif, trop technique ou trop emphatique, et risque de se braquer ou de se refermer définitivement. Ces personnes ne posent pas de question et la consultation paraît facile mais, derrière, l’anxiété n’a pas été gérée, voire la frustration du non-échange fera grandir les forces de ce que les Anglo-Saxons appellent le catastrophisme.
Ces patients sont souvent accompagnés par d’autres personnes qui, à l’évidence, ont pris un ascendant sur eux. Dans le couple, la femme parlera, questionnera et répondra à la place de son mari.
Pour ces personnes, il est certain que l’émotion va interdire une grande partie de la mémorisation de ce qui est expliqué. Si cette incapacité d’assimilation n’est pas perçue à cause de cet état anxieux, ces personnes resteront non seulement mal soignées, mal informées, mais également frustrées et plus encore déprimées après la consultation.
Face à ces patients, il convient de faire preuve d’empathie et de compassion, tout en débutant quelques explications médicales. Mais, rapidement, ces explications seront orientées vers la personne accompagnante, qui a pris depuis longtemps un ascendant dans le quotidien du patient. Elle seule pourra retenir les informations importantes : il faut donc en faire un allié dans l’observance thérapeutique. Cet(te) accompagnant(e), ainsi valorisé(e), aura un véritable rôle de thérapeute, garant du bon suivi des traitements.
Comment fonctionne le message chez ces patients ? La capacité cognitive est altérée par l’émotivité, et les discours médicaux sont des blessures. Des phrases prononcées par le médecin le patient extrait des adjectifs choisis inconsciemment par leur force émotionnelle intrinsèque (par exemple, s’il est dit : « Vous ne risquez pas de perdre la vue », le patient ne retiendra que « perdre la vue »). Cet accrochage fige l’esprit pour le protéger de la vague anxieuse et rend caduque le reste de la consultation. Que faire ? Un geste vaut cent phrases : prendre l’avant-bras du patient en se rapprochant de lui, sans le regarder, pour éviter l’intimidation due au regard, en demandant une attention particulière à la personne accompagnante (qui se sentira valorisée), et serrer affectueusement la main en signe de prise en compte de la situation et du fait qu’il est autorisé à lâcher prise. C’est de la communication non verbale, où le temps de la rencontre est bref mais adapté (ce qui, de surcroît, fait gagner du temps et de l’efficacité pour l’observance).
(C’est un néologisme pour exprimer l’apparente conversivité, ou histrionie.) Ces personnes valorisent l’apparence. Elles valorisent tout ce qui brille dans un discours, dans l’atmosphère ; peut-être leurs habits, leurs manières et leur débit de paroles orienteront vers ce diagnostic communicationnel.
Sans une technique adaptée, le risque est de perdre du temps dans la consultation. Il ne faut pas se déconcentrer, la vigilance du médecin doit être en éveil : un mot plus fort que l’autre, une parole déplacée, et cette personne qui cherche parfois inconsciemment l’affrontement pour échapper à son conflit intrapsychique trop douloureux à évoquer, va agresser et essayer par des questions contradictoires de piéger son interlocuteur. Passé trois quarts d’heure de consultation, il faut craindre que le patient ou la patiente de ce type entre dans le cadre d’une structure histrionique ! À l’inverse, tout peut paraître fluide, agréable, même valorisant, durant les premières consultations. Le médecin est tombé dans un leurre qui se conclura bruyamment par une mise en échec démesurée… et par une mauvaise réputation distillée dans la salle d’attente !
L’essentiel est de réussir à borner, à limiter en temps et en énergie cette consultation. Mais il faut le faire avec tact, sans aucune agressivité, et en valorisant toujours le patient au-delà de la courtoisie. Le sérieux du médecin et sa compétence ne sont pas des valeurs lisibles par ces personnes qui ne seront observantes que parce ce que ce médecin a la confiance de la haute société de la ville.
Ce n’est pas un état limite au sens psychiatrique, mais ce patient est excessif dans ses projets de vie. Sa vie n’est qu’un combat, depuis l’enfance, pour rester solide autour de son noyau, souvent précocement fracturé ; il a dû gérer de graves événements de son enfance. Malgré ces gros traumatismes physiques, psychologiques ou sociaux, le patient présente une force apparente : un colosse, mais parfois fragile. Il a surmonté les trois quarts des épreuves de la vie, mais il n’a pas pu effacer des détails des failles au sein de ses expériences. Ces traces dans les connexions cérébrales sont profondes et durables : l’annonce d’un glaucome peut les réactiver brutalement.
À l’occasion de l’annonce de sa maladie, le patient craint de s’apercevoir qu’il est fragile et sa réaction est disproportionnée, dans la peur, dans la douleur ou, au contraire, rien ne transparaît… mais le volcan gronde ! L’annonce constituera le premier moment de doute sur son choix de vie seulement fondée sur le combat. Lui, qui a surmonté tous les obstacles de la vie, se voit confronté à un mal insidieux et chronique : le glaucome et sa PIO (ces patients peuvent devenir obsessionnels sur un critère médical, comme la PIO précisément, pour ne pas avoir à remettre en question leurs propres valeurs).
Pour retarder la lucidité sur le risque de dépendance, il a recueilli tous les détails de la maladie sur Internet. Il aime la rigueur du professionnel et pas les statistiques floues. Des schémas explicatifs pédagogiques peuvent aider à améliorer sa gestion de la situation. Un schéma, une brochure ou un conseil sur un site Internet sera un gage positif pour le contrat de confiance.
Il faut apprendre à ne pas « asséner » le diagnostic, ne pas dire « J’ai une mauvaise nouvelle… » ou « Il faut que je vous annonce… ». L’ophtalmologiste doit s’effacer au profit du pédagogue. Pour cela, il faut faire un diagnostic pédagogique, et pas seulement ophtalmologique. Le premier conseil est de ne pas projeter sa propre vision du glaucome à la place de celle du patient. Voici quelques exemples observés chez les patients, de ce que l’on pourrait qualifier d’« interprétation écran », anticipant des scénarios individuels de cassure de la qualité de vie :
obligation insupportable de porter des lunettes ;
anticiper avec terreur une opération ;
impossible geste quotidien de mettre des gouttes oculaires ;
prendre un traitement à vie ;
etc.
En quelques secondes se construit un problème qui n’a pas toujours à voir avec la gravité de la maladie glaucomateuse, mais avec la conception de vie particulière de ce patient. Face à cette altération de la qualité de vie majorée, le médecin est désemparé. Se poser la question systématiquement, même si l’on ne connaît pas le passé du patient ou si on ne le comprend pas, c’est laisser ouverte la consultation empathique où le médecin et son patient auront l’opportunité de trouver un terrain de rencontre entre la logique particulière du patient et la nécessité du traitement. Cette posture n’est pas facile à adopter, soit parce que l’on ne cherche pas à relever le détail du discours du patient qui mettrait le médecin en phase avec lui, soit parce que la personnalité du médecin est trop marquée (pourtant, que de temps gagné et d’incompréhensions levées dès le début du suivi de cette maladie chronique si l’on est attentif à ce non-dit !).
Le diagnostic de personnalité du patient étant posé, il faut maintenant proposer une introspection au médecin lui-même, qui doit aussi se situer parmi différents types de personnalités. Schématiquement, trois caractères d’ophtalmologiste sont individualisables (fig. 17-8) :
le scientifique froid, dont la grande compétence est reconnue. Il va dispenser une information technique, scientifique (« Votre PIO est à un niveau anormal »), dont le patient ne comprendra pas grand-chose et ne retiendra rien, ou recevra une bouffée d’angoisse déstructurante, ou ne reviendra plus se faire suivre ni par vous ni par un autre, ce qui est plus grave. Ce médecin devra oser la séduction, et rompre la glace pour laisser place à l’empathie ;
le médecin brillant, qui séduit les trois quarts de sa clientèle. Il sait expliquer la maladie avec des mots très imagés mais, parfois, il est peu patient pour le suivi des malades chroniques. Rassurer, soutenir, faire le geste de toucher le patient au moment où il « craque » n’est pas dans sa nature. Convaincre certains patients qui doutent de sa compétence ophtalmologique ne va pas de soi, car cette situation l’horripile ;
le médecin paternaliste, qui anticipe déjà ce que le patient craint… mais la consultation risque d’être longue, et la relation médecin-malade d’évoluer vers une relation très dépendante. C’est bien pour les patients qui cherchent sans cesse à être rassurés. Toutefois, un tiers des malades souhaite des chiffres, des protocoles, de l’imagerie, des examens complémentaires incessants. Ils ne les ont pas trouvés dans cette consultation, et vont les rechercher dans le nomadisme médical (avec parfois un risque de iatrogénie).
Il est donc important pour l’ophtalmologiste de savoir dans quel rôle, dans quelle personnalité il a été placé par son patient lors de la consultation. Même s’il ne se reconnaît pas dans les trois caractères décrits plus haut, le médecin est investi par son patient d’un profil unique… pour caricaturer, celui de frère, d’amant ou de père. Plus il comprendra l’image qu’il renvoie à son patient, plus il surmontera les blocages dans la communication et les incompréhensions inutiles et fatigantes. Cette attention à la relation médecin-malade enrichira son expérience et augmentera la perception de consultations réussies, de qualité, dès lors plus courtes et moins fatigantes.

Fig 17-8 De gauche à droite : le scientifique froid, le médecin brillant, le médecin paternaliste.
Il faut porter attention à l’accueil du patient au cabinet médical. La salle d’attente et, surtout, la réception au secrétariat doivent déjà être considérées comme partie intégrante de la préparation à une communication réussie. Cela impose de former les secrétaires et toutes les personnes pouvant prendre en charge le patient au cabinet (orthoptistes, infirmières, etc.).
Le regroupement des patients dans la salle d’attente entraîne fréquemment un échange d’informations entre eux, durant l’attente de la consultation. Ces échanges sont autant d’informations, fréquemment erronées, sur les différentes pathologies. Des idées reçues, des schémas préétablis de compréhension de pathologies, des mythes, des pseudo-vérités circulent dans ce contexte. Pour en limiter l’impact, vous pouvez déjà essayer, par des fiches d’information adaptées à la pathologie du patient (donnés par la secrétaire), d’intéresser le patient à son problème. Cela peut être doublé par l’existence d’une documentation spécifique « grand public » disposée dans la salle d’attente, par des affiches pédagogiques informatives sur le mur de la salle d’attente ou des vidéos expliquant la consultation ou les grands problèmes des pathologies ophtalmologiques. L’intérêt est double : diminuer le trop grand nombre d’informations incontrôlées qui sont échangées entre les patients, et leur éviter de s’accrocher aux informations négatives. C’est un véritable état de pré-hypnose positive du consultant qui est recherché, pour éviter le catastrophisme lié à l’anxiété. Ainsi les défenses du patient lors de la consultation seront peut-être moins agressives, et le patient davantage concentré et réceptif à l’exposé de sa maladie, de ses conséquences et de son traitement.
Tous les patients n’ont pas le même temps de maturation : il faut donc oser découper une consultation en deux temps espacés de quelques jours. Les éventuels personnels paramédicaux du cabinet sont parfois de meilleurs médiateurs de l’information, car ils sont souvent considérés comme plus abordables et sans représentation intimidante. Formés, ils seront des alliés dans les maladies chroniques.
Toutes les études montrent que l’angoisse pour les patients de perdre la vue est un stress qui est équivalent, voire supérieur, à l’angoisse de perdre la vie. Et certains mécanismes de défense sont inconsciemment mis en place par le patient afin d’ignorer des faits avec lesquels ils ont du mal à vivre… [3].
Il n’est donc pas inutile pour le médecin ophtalmologiste de connaître les phases de deuil rencontrées chez les patients, décrites en soins palliatifs [5, 7, 8]. Ces phases peuvent être classées en sept comportements qui peuvent se retrouver isolés ou en phases successives, voire intriqués.
La colère est souvent présente lors de l’annonce d’un diagnostic grave ou d’un pronostic sombre. Cette colère est parfois sourde, rentrée, parfois verbalisée dans les mots ou les comportements. Pour le médecin, un conseil : rester maître de son apparence, le patient souffre à vif, il va perdre les codes de l’échange normal, et l’ophtalmologiste – en miroir – devra les conserver. Pour cela, reformuler les informations sur un ton calme en demandant ce que le patient a compris. Cette situation de violence fait partie du travail du médecin, qui ne doit pas la fuir. S’il résiste à l’orage, une consultation apparemment agressive sera souvent suivie d’un renforcement de la confiance.
La réalité (ou la possibilité) de la perte de la vue est tellement insupportable que l’un des moyens de la rendre plus tolérable est de la nier. C’est un véritable déni de la situation, mais il permet de protéger le noyau de la personnalité qui, à cet instant, risquerait d’être totalement déstructuré s’il y avait acceptation de la réalité. Attention : le patient dans le déni peut donner l’apparence de comprendre et d’accepter, mais ce n’est qu’une façade. Le médecin doit demander au patient d’expliciter ce qu’il a effectivement compris, ou changer ses mots et le lieu de l’échange (par exemple, au fauteuil de consultation puis au fauteuil d’examen).
C’est une attitude souvent mal connue et mal individualisée. Le sujet a des comportements de négociation vis-à-vis de la réalité et du diagnostic. Il va, par exemple, marchander sur quelques symptômes désagréables annexes, mettant en porte-à-faux le thérapeute qui essaie de centrer la consultation sur le symptôme principal à gérer, ici la PIO. C’est un troc parfois malsain, en tout cas qui met mal à l’aise. L’entourage du patient est parfois impliqué dans cette perception éloignée de la réalité. Ces patients peuvent faire d’un handicap mineur – les gouttes dans les yeux – un obstacle insupportable. Il faut alors être ferme, borner la relation et s’appuyer sur un tiers familial.
Cette angoisse évolue par poussées et est souvent nocturne ou vespérale. C’est le comble de l’émotivité, qui interdit toute possibilité de compréhension logique du diagnostic, ou du traitement, pour le patient. Elle est souvent communicative aux membres proches de la famille, mais également aux parents éloignés qui n’ont que des informations indirectes, aggravées par cette anxiété pathologique. Tant qu’elle n’est pas réglée pharmacologiquement ou par un soutien psychologique, elle va parasiter la prise en charge médicale et thérapeutique.
C’est l’évolution extrême de la tristesse, de l’anxiété ou de la dépression, face à l’impossibilité d’appréhender le risque d’atteinte fonctionnelle de la vision. Un avis et une prise en charge spécialisée sont alors nécessaires.
La charge émotionnelle est si grande qu’il peut y avoir perte de tout comportement adapté. Cet état peut prendre un aspect de désorientation, de confusion. Il est parfois décalé et réveille une fragilité antérieure ou des blessures profondes anciennes.
Le sujet lâche ses défenses, ses repères et son énergie ; il peut évoluer vers une régression dans ses comportements et devenir aussi dépendant de son entourage qu’un nourrisson. Dans le suivi du glaucome, certains patients vont développer un abandon larvé et, en quelques mois, arrêter le traitement ou ne plus prendre de rendez-vous de suivi. Il faut, par le réseau avec le médecin généraliste ou par une organisation adaptée, leur écrire pour fixer un rendez-vous.
Peut-être a minima y a-t-il, face à l’épreuve, un passage par ces différentes phases. Mais, heureusement, un certain nombre de patients arrive jusqu’à la phase d’acceptation. Lors de l’acceptation, les phases précédentes se transforment alors en comportement plus proche de la « norme ».
L’annonce du glaucome et l’information fournie à cette occasion est d’une importance capitale. L’information donnée doit être simple et se concentrer sur quelques messages importants que le patient doit comprendre, intégrer et ne pas oublier. Par exemple :
l’explication d’une PIO trop élevée dans les yeux ;
le glaucome est une maladie chronique, progressive et silencieuse : il faudra surveiller et se traiter, même si l’on n’a pas mal et/ou pas de symptômes ;
le glaucome se traite tous les jours, voire plusieurs fois par jour, avec des collyres qu’il ne faut pas oublier, et en appliquant les consignes (instiller correctement, respecter les horaires et les périodes de wash-out) ;
éventuellement, le laser et la chirurgie pourront être nécessaires ultérieurement.
Une fiche standard, comme un dépliant, imagée, non exhaustive, avec quatre idées pourrait accompagner le patient avec son ordonnance.
Ces points sont bien entendu à adapter selon le patient et son niveau de demande, mais il ne faut pas oublier l’objectif principal : assurer l’observance au long cours, tant des examens cliniques et paracliniques que des traitements. Face à une plainte juridique, la non-fourniture de la preuve de l’information est coupable. Le dossier du praticien doit donc comporter la preuve de ce temps de communication éducatif (traçabilité).
La réussite de la consultation éducative, c’est que le patient comprenne que son avenir (ou du moins celui de sa vision) est entre ses mains, et qu’il ne doit pas s’installer dans une attitude de déni. Il doit s’impliquer dans sa maladie, sa prise en charge et son traitement, point crucial du pronostic à long terme du glaucome [1]. Cette appropriation de la maladie et du traitement par le patient est le meilleur gage d’une observance thérapeutique au long cours. C’est le témoin d’une annonce de la maladie et d’une relation médecin-malade toujours de grande valeur communicationnelle, permettant aussi un enrichissement de l’ophtalmologiste à chaque situation, même la plus délicate.
Intéressé ou non à la communication et à ses règles, le médecin ophtalmologiste a tout à gagner à s’investir dans ce travail qui ne sera pas une charge supplémentaire mais, bien au contraire, une sorte de formation continue in situ lors de chaque consultation, doublée d’un étonnant gain de temps. La souffrance des patients est ainsi améliorée car ils perçoivent cette sollicitude dans l’échange, surtout parce que cette attitude n’est pas assez globalement répandue.
Retenir
Le colloque singulier participe à la confiance réciproque, indispensable à la compliance thérapeutique et à un suivi durable et efficace de la maladie.
L’évaluation de la personnalité du patient, associée à celle que le médecin doit percevoir de la sienne, permet d’améliorer et d’enrichir ce colloque singulier.
L’attitude du médecin doit s’adapter au patient et à son niveau de demandes, mais celles-ci sont souvent non dites.
L’annonce de la maladie peut faire rentrer le patient dans une véritable phase de deuil, avec ses composantes habituelles que sont, entre autres, la révolte, le déni de la réalité, l’angoisse ou la prostration.
Il faut faire en sorte que le patient s’approprie sereinement in fine sa maladie et sa prise en charge, meilleur gage d’une observance thérapeutique au long cours.
[1] Cochereau I. Dépister, informer, participer, autoriser… ? Nos patients et leur glaucome. J Fr Ophtalmol. 2007 ; 30 : 2S79-2S81.
[2] Ginies P. La relation médecin-malade dans les maladies chroniques. J Fr Ophtalmol. 2008 ; 31 : 2S34-2S38.
[3] Hamelin N. La relation médecin-malade dans le glaucome. J Fr Ophtalmol. 2008 ; 31 : 2S39-2S44.
[4] Herndon LW, Brunner TM, Rollins JN. The Glaucoma Research Foundation Patient Survey : patient understanding of glaucoma and its treatment. Am J Ophthalmol. 2006 ; 141 (Suppl.) : S22-S27.
[5] Kubler-Ross E. La mort, dernière étape de la croissance. Paris, Le Rocher, 1994.
[6] Lee PP. Patient perspectives in glaucoma care : introduction to the American Journal of Ophthalmology Supplement. Am J Ophthalmol. 2006 ; 141 (Suppl.) : S1-S2.
[7] Leriche R. Souvenirs de ma vie morte. Paris, Seuil, 1956.
[8] Mount BM. The problem of caring for the dying in a general hospital ; the palliative care unit as a possible solution. Can Med Assoc J. 1976 ; 115 : 119-21.
J.-P. Nordmann
Le concept d’alliance thérapeutique, interaction entre le médecin et son patient, est applicable au glaucome.
Il peut être évalué par un questionnaire à trois rubriques : les buts, les tâches et le lien.
Il permet d’améliorer la relation médecin-malade, l’observance médicamenteuse, la connaissance de la maladie et de ses risques par le patient.
L’ophtalmologiste doit s’efforcer d’amener son patient à partager cette alliance thérapeutique.
L e glaucome est une affection chronique nécessitant le plus souvent un traitement à vie. Cette affection n’entraîne pas de douleur et les troubles visuels, même s’ils sont faciles à objectiver par un examen de champ visuel, ne sont que très tardivement ressentis par les patients. Pendant longtemps, la seule gêne perçue est celle subie lors de l’instillation de collyres. Cela explique la mauvaise observance thérapeutique dans le glaucome. Environ 40 % des patients arrêtent leur traitement ou le prennent épisodiquement.
La coopération du patient est donc un élément capital pour le succès thérapeutique. Le degré de cette coopération dépend en premier lieu de la qualité des relations entre le médecin et son patient et du partage d’objectifs communs, ce qui n’est en rien évident. Par exemple, le patient peut avant tout souhaiter que le collyre administré ne lui donne pas les yeux rouges et son médecin vouloir en premier lieu que celui-ci fasse baisser de façon importante la pression intra-oculaire. En fait, médecins et patients n’ont pas naturellement des objectifs identiques.
L’alliance thérapeutique est un concept initié par le psychothérapeute Zetzel en 1956 pour décrire l’interaction entre le psychanalyste et son patient [10]. Ce modèle a été repris par Bordin en 1979 en clinique psychiatrique [1]. Il définit cette alliance thérapeutique comme la somme de trois dimensions reliées : l’entente entre le médecin et son patient sur les objectifs du traitement (buts), sur les modalités thérapeutiques (tâches) et sur le lien de confiance entre eux [6, 9]. Dans le glaucome, le « but » est évidemment de ralentir la progression du glaucome, les « tâches » consistent en une prise soigneuse du traitement et des visites régulières chez l’ophtalmologiste et le « lien » est la confiance mutuelle. Une bonne alliance thérapeutique, dans ces trois domaines, est l’élément le plus important pour la qualité de l’observance dans de nombreuses maladies chroniques comme l’hypertension artérielle ou le diabète. Qu’en est-il dans le glaucome ?
L’alliance thérapeutique s’évalue par l’établissement d’un questionnaire précis qui analyse les différentes composantes de celle-ci [2, 5]. Les questions sont posées d’une part au médecin et d’autre part au patient. Une trentaine de questions est nécessaire pour une évaluation de qualité. Pour chaque question (en fait une affirmation), sept réponses sont possibles entre « jamais », « rarement », « occasionnellement », « parfois », « souvent », « très souvent », « toujours », ce qui permet d’établir un score. Les médecins et les patients répondent indépendamment aux questions et les résultats sont comparés ultérieurement. Quelques exemples de questions types sont donnés ci-après.
Question au médecin : « Mon patient et moi avons une perception commune de ses objectifs. »
Question au patient : « Mon médecin a une bonne perception de mes objectifs. »
Dans cette composante se trouvent aussi des questions comme :
Question au médecin : « J’ai l’impression que mon patient a besoin que l’on clarifie l’objectif de son traitement. »
Question au patient : « J’aimerais que mon médecin et moi puissions clarifier l’objectif de mon traitement. »
Question au médecin : « Je sais parfaitement ce que j’attends de mon patient dans le cadre de son traitement. »
Question au patient : « Je sais parfaitement ce que mon médecin attend de moi dans le cadre de mon traitement. »
Question au médecin : « Je crois que je comprends vraiment mon patient. »
Question au patient : « Mon médecin et moi, nous nous comprenons vraiment. »
Dans cette composante se trouvent aussi des questions comme :
Question au médecin : « Je me sens mal à l’aise avec mon patient. »
Question au patient : « Je me sens mal à l’aise avec mon médecin. »
Le niveau d’alliance thérapeutique est très élevé dans le glaucome [3], davantage que dans la plupart des autres maladies chroniques. Il n’y a pas beaucoup de discordances entre la perception de la situation des médecins et des patients.
Dans la plupart des cas, une compréhension mutuelle importante existe entre médecins et patients. Cela est logique dans la mesure où, devant cette affection potentiellement très grave, un patient qui n’aurait pas confiance en son médecin aurait tendance à en changer. Si la relation dure, c’est que cette confiance est présente. Curieusement, 10 % des patients se sentent néanmoins mal à l’aise avec leur médecin et 10 % des médecins (pas forcément les mêmes) se sentent aussi très mal à l’aise avec leur patient.
Médecins et patients s’accordent volontiers sur la stratégie médicale, à savoir l’importance de la prise du traitement.
Les patients reprochent souvent à leur médecin de ne pas leur donner suffisamment d’informations sur leur maladie ou leur traitement. En fait, la situation est plus complexe. Les médecins ne sont pas capables de discerner facilement les patients qui souhaiteraient ces informations des autres. Il s’ensuit une situation où le médecin peut donner des explications à des patients qui ne le désirent pas, ou peuvent s’en inquiéter, et omettre de fournir celles-ci à d’autres personnes, qui elles leur semblent déjà suffisamment au courant de leur maladie. Il est donc souhaitable que le médecin soit pro-actif et n’hésite pas à demander à son patient directement s’il aimerait plus de renseignements sur la stratégie thérapeutique utilisée.
Malgré un très fort degré d’alliance thérapeutique, les médecins se font une idée fausse de l’observance des patients. En effet, à la question « Pensez-vous que votre patient est globalement observant ? », les médecins répondent par l’affirmative dans 95 % des cas, alors que les patients avouent ne l’être réellement que dans 46 % des cas. Ce niveau réel et relativement bas d’observance est retrouvé dans presque toutes les études sur le glaucome.
Il est tentant de penser que le niveau d’alliance thérapeutique dépend d’un lien naturel entre un patient et son médecin. Lorsque ce dernier sait expliquer et convaincre, cette alliance va de soi. En réalité, de nombreuses études ont été réalisées dans d’autres domaines de la médecine comme l’addiction à la drogue ou à l’alcool (comment convaincre quelqu’un d’arrêter ?). Elles montrent que des techniques précises permettent d’améliorer les résultats, en particulier les méthodes d’entretien motivationnel [7]. Le principe de ces techniques d’entretien motivationnel consiste à ne pas essayer de convaincre le patient que les raisons invoquées par les soignants pour lui faire changer d’habitudes sont bonnes (changer voulant dire prendre son traitement régulièrement plutôt que sporadiquement), mais rendre efficientes les raisons de changer, déjà en place chez le patient, mais neutralisées par ses propres raisons de ne pas changer. Cela consiste principalement en :
soutenir l’envie déclarée ou révéler l’envie masquée ;
donner confiance en soi ;
rendre explicites les freins à l’action en reconnaissant que l’ambivalence est naturelle (vais-je me traiter correctement ou pas ?).
Quelques principes généraux peuvent aider à améliorer l’observance :
valoriser l’interlocuteur : en s’appuyant sur des succès antérieurs dans n’importe quel domaine de la vie du patient, complimenter sur les résultats obtenus, même s’ils ne sont que partiels (par exemple : « Puisque vous avez réussi à arrêter de fumer, il doit être possible aussi pour vous de vous astreindre à une prise régulière de votre traitement ») ;
intéresser le patient : en l’informant, l’impliquant et éventuellement en l’inquiétant un peu, mais sans lui faire peur, car il existe alors un risque réel de déni ou de fuite ;
compatir : être empathique, reconnaître le poids de la maladie et/ou des contraintes. Il faut accepter que le patient considère comme une forte contrainte le fait de prendre régulièrement un traitement ;
travailler l’ambivalence (le pour et le contre) : tout acte dans la vie implique une ambivalence, à savoir un choix entre « faire » et « ne pas faire ». Accepter cette ambivalence comme normale aide le patient à aller dans le bon sens ;
ouvrir les possibilités de réponse, en évitant les questions fermées : éviter par exemple de demander « Prenez-vous bien votre traitement ? », ce qui entraînera automatiquement une réponse affirmative, sans possibilité ultérieure d’avouer une mauvaise observance. Demander plutôt « Comment prenez-vous votre traitement ? » ;
intégrer dans la relation les éléments conflictuels… comme la résistance du patient (par exemple sa force de caractère), plutôt qu’essayer de les neutraliser ;
reprendre ce que le patient a dit et qui va dans le sens du changement souhaitable ;
de façon générale, une grande crainte des patients est de ne pas être écoutés. Le fait de reprendre en écho ce que le patient a dit permet de lever cette inquiétude ;
écouter, sans trop interrompre, s’efforcer d’entendre ce que le patient exprime ou sous-entend… Un dicton connu des psychiatres dit : « Un médecin a deux oreilles et une bouche. Deux oreilles pour écouter et une bouche… pour se taire ! »
Ces méthodes paraissent peu évidentes, mais leur application consciencieuse dans chaque consultation permet une réelle amélioration de l’alliance thérapeutique et en conséquence de l’observance [8].
Après avoir été l’apanage de la psychiatrie, la notion d’alliance thérapeutique est apparue très utile en médecine dans le cadre de la gestion de la relation médecin-malade dans les pathologies chroniques [4]. Cette alliance thérapeutique est très élevée dans le glaucome, sans doute supérieure à celle qui pourrait être rencontrée, par exemple, en chirurgie réfractive. Néanmoins, dans le glaucome, un réel problème d’observance existe puisqu’environ seulement la moitié des patients prennent régulièrement leur traitement. Même si les patients et les médecins s’entendent bien dans le cadre de cette affection, il reste très difficile à ces derniers d’évaluer cette observance.
Quelles sont les questions que vous ne devez pas formuler de la façon suivante :
A : Prenez-vous bien votre traitement ?
B : Comment faites-vous si vous oubliez de prendre un soir votre traitement ?
C : Combien de fois par mois estimez-vous oublier de prendre votre traitement ?
D : Respectez-vous le traitement tel que je vous l’ai prescrit ?
E : Savez-vous que vous risquez de perdre la vue si vous ne vous traitez pas ?
Réponse
Les questions A et D sont des questions fermées (dont la réponse ne peut être que oui ou non) et vont amener le patient à répondre comme le souhaite le médecin. Il ne faut donc pas les poser ainsi. La question E est aussi fermée et en outre joue sur la peur, un sentiment risquant d’entraîner un phénomène de déni. Une formulation plus subtile et plus positive serait souhaitable.
Retenir
Dans le glaucome, le but de l’alliance thérapeutique est de ralentir la progression de la maladie, les tâches sont l’observance médicamenteuse et le respect des contrôles, et le lien est la confiance mutuelle entre l’ophtalmologiste et son patient.
Un questionnaire existe ; il est dirigé sur les composantes des chacun de ces objectifs.
L’alliance thérapeutique, très élevée déjà dans le glaucome, peut encore être renforcée.
Elle vise particulièrement à améliorer l’observance, médiocre dans le glaucome.
[1] Bordin ES. The generalizability of the psychoanalytic concept of the working alliance. Psychotherapy : Theory Res Pract. 1979 ; 16 : 252-60.
[2] Corbière M, Bisson J, Lauzon S, Ricard N. Factorial validation of a French short-form of the Working Alliance Inventory. Int J Methods Psychiatr Res. 2006 ; 15 : 36-45.
[3] Friedman DS, Quigley HA, Gelb L, et al. Using pharmacy claims data to study adherence to glaucoma medications : methodology and findings of the Glaucoma Adherence and Persistency Study (GAPS). Invest Ophthalmol Vis Sci. 2007 ; 48 : 5052-7.
[4] Fuertes JN, Mislowack A, Bennett J, et al. The physician-patient working alliance. Patient Educ Couns. 2007 ; 66 : 29-36.
[5] Guédeney N, Fermanian J, Curt F, Bifulco A. Testing the Working Alliance Inventory (WAI) in a French primary care setting : predictive value and factor structure. Soc Psychiatry Psychiatr Epidemiol. 2005 ; 40 : 844-52.
[6] Horvath AO, Greenberg LS. Development and validation of the Working Alliance Inventory. J Counsel Psychol. 1989 ; 36 : 223-33.
[7] Kravitz RL, Hays RD, Sherbourne CD, et al. Recall of recommendations and adherence to advice among patients with chronic medical conditions. Arch Intern Med. 1993 ; 153 : 1869-78.
[8] Nordmann JP, Denis P, Vigneux M, et al. Development of the conceptual framework for the Eye-Drop Satisfaction Questionnaire (EDSQ) in glaucoma using a qualitative study. BMC Health Serv Res. 2007 ; 7 : 124-7.
[9] Tracey TJ, Kokotovic AM. Factor structure of the Working Alliance Inventory. Psychol Assess. 1989 ; 1 : 207-10.
[10] Zetzel E. Current concepts of transference. Intern J Psychoanalysis. 1956 ; 37 : 369-75.
B. Arnould
La qualité de vie est l’objectif central de la prise en charge du patient glaucomateux ou atteint d’hypertension oculaire.
La qualité de vie des patients est déterminée par trois facteurs principaux : le choc psychologique consécutif à l’annonce du diagnostic, les inconvénients et effets secondaires du traitement, et la dégradation de la fonction visuelle.
Tous les domaines de la qualité de vie sont concernés : fonctionnement physique, activités de la vie quotidienne, état psychologique, relations sociales, etc.
À chaque étape de l’évolution de la maladie – depuis l’hypertension oculaire isolée non traitée jusqu’au glaucome avancé – correspond une dégradation spécifique de la qualité de vie des patients.
La relation entre déficit du champ visuel et qualité de vie n’est pas purement linéaire : bilatéralité, localisation des zones déficitaires et rapidité de l’évolution interviennent aussi.
La panoplie d’instruments de mesure s’est étoffée mais reste limitée. Il existe un instrument de mesure de la qualité de vie en français, le Glau-QoL, développé et validé suivant les standards internationaux, dont une version courte est destinée à un usage en pratique médicale courante.
L’écart qui sépare la théorie de la pratique, et les recommandations des actions, est immense.
Comme toutes les pathologies oculaires ayant pour conséquence une dégradation de la fonction visuelle, le glaucome a un effet négatif sur la vie des patients, effet qui va s’amplifier au cours des années avec l’évolution progressive vers la cécité. Plus spécifiques au glaucome sont les effets de la dynamique de la maladie, irréversible et lentement progressive, et le caractère parfois tardif du diagnostic, qui infligent aux patients une souffrance psychique importante. Cet impact psychologique est d’autant moins accessible au clinicien qu’il n’est pas directement lié à la physiopathologie. S’y ajoute le fardeau d’un traitement parfois malaisé, souvent contraignant et pas toujours bien toléré. L’ensemble dresse un tableau [34] qui justifie pleinement que la qualité de vie (QdV) du patient soit centrale dans la prise en charge du patient porteur d’un glaucome comme dans celle du patient atteint d’hypertension intra-oculaire. Toutefois, malgré la prise en considération grandissante de la QdV dans la prise en charge du glaucome et dans la recherche, les études de QdV restent insuffisantes et sont moins avancées que dans des pathologies comparables [12, 18].
Lors de son assemblée constitutive, l’Organisation mondiale de la santé a d’emblée défini la santé comme un état optimal de bien-être physique, mental et social, et cette définition n’a pas été changée depuis son adoption officielle en 1948 [23] : « Health is a state of complete physical, mental and social well-being and not merely the absence of disease or infirmity. » Cliniciens et psychologues de la santé ont tenté, avec le concept de QdV, de se doter d’un outil opérationnel permettant d’aller au-delà des évaluations symptomatiques et des tests de performance fonctionnelle, pour embrasser l’ensemble des conséquences de la maladie sur la vie des sujets. D’après Schipper et al. [28], la QdV liée à la santé « représente, tel que le patient le perçoit, l’effet de la maladie et de son traitement sur la vie quotidienne du patient. Cet effet général s’exprime en grands domaines comme l’activité physique, l’état psychologique, les relations sociales… ».
Quels que soient les auteurs, on retrouve des constantes dans l’étude de la QdV en santé :
légitimité du point de vue du sujet : le patient, mieux que quiconque, peut décrire comment il va ;
ancrage dans la réalité quotidienne : la QdV correspond à l’expérience concrète du sujet, dans la période actuelle de sa vie ;
relation causale avec la maladie et le traitement : l’étude de la QdV liée à la santé s’intéresse aux conséquences directes et indirectes de la maladie (et donc de sa prise en charge), et seulement à ces conséquences. Elle ne couvre pas d’autres aspects de la vie des sujets en relation avec d’autres déterminants (environnement, travail, culture, etc.) ;
complexité : la QdV ne se résume pas par un unique index. Elle est par essence multidimensionnelle. Les différentes composantes de la QdV sont appelées des « domaines ». Dans un questionnaire de QdV, un groupe de questions – ou « items » – se rapportant concrètement au même domaine s’appelle une « dimension », dimension sur laquelle on peut calculer un « score » à partir des réponses aux différents items qui la composent.
Un questionnaire générique s’adresse à de larges catégories de patients – par exemple tous les adultes – quels que soient leur état de santé ou leur maladie. Le SF-36 est l’exemple typique du questionnaire générique. Un questionnaire spécifique est destiné à une population particulière : les questions qu’il contient ont du sens pour cette population, mais n’en ont pas nécessairement pour des patients n’appartenant pas au groupe ciblé. Le Glau-QoL est un exemple typique de questionnaire spécifique : il comporte un ensemble de questions qui couvrent tous les aspects de la QdV des patients porteurs d’un glaucome ou d’une hypertension intra-oculaire, et nombre de ces questions n’auraient pas de sens pour des patients non concernés pas le glaucome. Certains questionnaires ont des statuts intermédiaires, comme le NEI-VFQ, questionnaire de QdV spécifique des pathologies ayant un impact sur la fonction visuelle, mais non spécifique d’une de ces pathologies en particulier.
L’expression patient-reported outcomes (PRO) – littéralement « résultats rapportés par le patient » – est un terme de jargon de la recherche clinique, créé au début des années 2000 pour cadrer l’utilisation de la QdV et désigne plus généralement des auto-questionnaires dans la recherche clinique et dans l’évaluation des produits de santé par les agences réglementaires [1]. Dans ce contexte est un PRO tout questionnaire concernant le patient et complété par lui sans interférence d’un tiers. Les questionnaires de QdV sont donc des PRO, ainsi que toutes les échelles d’évaluation de la symptomatologie complétées par le patient, ainsi que les échelles d’auto-évaluation fonctionnelle.
Les économistes se sont eux aussi intéressés à la qualité de vie. À la différence des cliniciens et des psychologues, ils ont cherché à se doter d’outils universels permettant d’associer à un état de santé donné une quantité de valeur. Le concept de durée de vie ajustée à la qualité de vie – quality-adjusted life years (QALY) – permet de comparer entre eux tous les états de santé et donc d’informer les décisions de santé publique par une rationalité économique intégrant la qualité de vie. Pour établir la valeur d’un état de santé, les économistes font souvent appel à des questionnaires génériques comme le questionnaire EQ-5D.
Les activités de la vie quotidienne sont le domaine de la QdV affecté le plus évidemment par le glaucome, comme une conséquence directe de la dégradation des performances visuelles du patient. Cet impact négatif concerne tous les aspects de la vie quotidienne telles que les activités domestiques, la lecture, la conduite (et plus généralement la mobilité à l’extérieur de chez soi), le travail et les tâches productives, l’interaction sociale. Il intervient relativement tôt et a été démontré chez des patients pour lesquels le diagnostic n’avait pas encore été posé. Les difficultés auxquelles sont exposés les patients glaucomateux dans leur vie quotidienne se multiplient et s’intensifient avec la perte progressive de la fonction visuelle [34].
La souffrance psychologique des patients est la conséquence combinée de plusieurs caractéristiques de la maladie glaucomateuse : la limitation progressive dans les activités de tous les jours, le choc de se savoir porteur d’une maladie potentiellement cécitante, souvent doublé de la détresse liée à sa découverte éventuellement tardive, l’anxiété due à la menace que représente l’évolution possible et irréversible vers la malvoyance et la cécité, et enfin les inconvénients liés au traitement, inconvénients d’autant plus difficiles à accepter que l’efficacité du traitement s’avère limitée ou tout au moins inconstante. Cette souffrance psychologique est multiforme, avec des composantes émotionnelles de frustration, de sentiment d’injustice, de vulnérabilité, la difficulté d’appréhender et de communiquer une affection silencieuse et invisible, l’altération de l’image de soi, et l’anxiété. Elle prend parfois une forme pathologique, le glaucome entraînant un risque accru de dépression [14], risque qui augmente avec son évolution.
La prise en charge du glaucome affecte elle aussi la vie des patients, comme dans toute maladie chronique pour laquelle il n’existe pas de solution curative. Les traitements médicamenteux imposent une discipline quotidienne, l’administration des gouttes est techniquement délicate, particulièrement chez le patient âgé, et les effets secondaires peuvent s’avérer pénibles. En l’absence de symptôme, l’observance au traitement repose sur la confiance qu’a le patient dans le système de soins et sur la qualité de sa relation avec l’ophtalmologiste [20]. Les différentes options de traitement (médicamenteux, laser, chirurgie) présentent toutes des inconvénients et des risques de complication ou d’intolérance. Toutefois il n’est pas établi qu’une option soit supérieure aux autres en termes d’impact sur la QdV [7, 13].
L’évolution des différents domaines de la QdV est déterminée par le franchissement des différentes étapes qui marquent le passage d’un stade de la maladie à un autre [6] : hypertension intra-oculaire isolée non traitée (HTONT), hypertension intra-oculaire isolée traitée (HTOT), glaucome débutant (GD), glaucome modéré (GM), glaucome avancé (GA). L’impact psychologique, et en particulier sa composante d’anxiété, est d’emblée fort, même quand le diagnostic est posé précocement et que seule une surveillance s’impose (stade HTONT). Avec le traitement (stade HTOT) apparaît le fardeau lié, tandis que la confiance dans la prise en charge s’améliore, et sans que les autres domaines évoluent de façon sensible. L’apparition du glaucome (stade GD) affecte avant tout la conduite automobile, sans avoir d’impact sur les autres activités de la vie quotidienne ni sur les autres domaines. Lorsque le glaucome est suffisamment évolué pour entraîner une dégradation sensible de la fonction visuelle (stade GM), l’impact délétère est important et multiple sur les activités de la vie quotidienne, la conduite et l’état psychologique. Puis, avec l’avancement du glaucome (stade GA), cette évolution s’amplifie et se diversifie, avec la poursuite marquée de la dégradation des activités de la vie quotidienne, de la conduite, de l’état psychologique, une anxiété accrue et intense, et une forte atteinte de l’image de soi. Seule la confiance dans les soins et le fardeau du traitement ne sont pas affectés par ces dernières évolutions.
Les principaux facteurs ayant un impact sur la QdV des patients sont directement liés à la maladie, et plus particulièrement aux caractéristiques du champ visuel : bilatéralité, localisation des zones déficitaires, rapidité de l’évolution.
L’état du meilleur œil est déterminant pour la QdV des patients [26, 35] ; lorsque l’atteinte est bilatérale, l’impact sur les activités de la vie quotidienne, ainsi que sur la mobilité, se trouve fortement amplifié [34].
Il existe un lien statistique entre la localisation des déficits du champ visuel et la difficulté à accomplir certaines tâches spécifiques, comme la lecture, la marche ou la conduite [19, 27]. À déficit comparable du champ visuel une dégradation plus rapide accentue l’impact sur la QdV [16]. Toutefois, la dégradation du champ visuel en tant que tel ne détermine jamais directement la QdV des patients : c’est exclusivement à travers l’expérience par le patient de la dégradation de sa fonction visuelle que le champ visuel influe sur sa QdV [14, 15].
Des actions de réhabilitation peuvent avoir, grâce à une amélioration de la fonction visuelle, un impact positif sur la QdV [17].
Les caractéristiques démographiques et individuelles jouent un faible rôle comparé à celui de la maladie elle-même, dans l’évolution de la QdV des patients. Toutefois, l’âge des patients a un effet amplificateur sur la dégradation de certains domaines de QdV. L’impact psychologique est plus fort chez les patients plus jeunes [6], et l’impact sur la conduite est plus important chez les patients plus âgés [32]. La capacité à se prendre en charge soi-même peut influencer favorablement l’évolution de la QdV [38]. Enfin, la personnalité du patient peut influer sur sa QdV [9, 36].
Pour prendre en compte la QdV des patients dans la recherche et les soins, chercheurs et cliniciens ont besoin de réaliser des évaluations objectivées (c’est-à-dire indépendantes de l’observateur, et non pas du sujet étudié), standardisées (pour que les informations soient interprétables par tous) et quantifiées (pour répondre aux exigences de l’approche scientifique). La psychométrie est la discipline qui étudie le développement et la validation d’instruments de mesure permettant de documenter des caractéristiques subjectives chez les patients. Ces instruments de mesure prennent la forme de questionnaires et permettent le calcul de scores (score de détresse psychologique, score de mobilité, score d’autonomie, score de fonction visuelle, etc.). S’il n’existe pas de mesure parfaite, il en existe de plus ou moins bonnes, et toutes ne sont pas interchangeables : le choix de l’instrument de mesure parmi la panoplie de questionnaires existants est avant tout dirigé par son adéquation à la question posée, sous réserve qu’un minimum de critères de qualité soit satisfait.
La première qualité d’un instrument de mesure est la validité de son contenu. Une fois défini ce que l’on cherche à mesurer (par exemple l’impact du glaucome sur la conduite automobile, du point de vue du patient), il est essentiel de s’assurer de l’exhaustivité du questionnaire, de la spécificité de chacune des questions et de la pertinence des échelles de réponse proposées.
Dans le glaucome, la recherche qualitative est une approche puissante et informative lorsqu’il s’agit de connaître la perspective des patients [39]. Elle est trop rarement utilisée pour la construction d’un modèle de mesure [33], première étape dans le développement d’un questionnaire de QdV [24].
Les autres qualités attendues d’un instrument de mesure sont les propriétés métrologiques des scores calculés à partir des réponses aux items : validité, fiabilité, et sensibilité [5].
La validité est la capacité de l’instrument à mesurer ce qu’il est censé mesurer, et seulement cela.
La fiabilité est la capacité de l’instrument à produire des résultats identiques quand le phénomène mesuré ne change pas, indépendamment des variations dans le contexte de la mesure.
La sensibilité est la capacité de l’instrument à détecter des différences dans le phénomène observé, différences entre groupes ou dans le temps.
L’utilisation d’un questionnaire dans des conditions non clarifiées peut ruiner le travail réalisé avec lui. En plus des critères scientifiques, des critères très opérationnels jouent un rôle important dans le choix d’un instrument de mesure de la QdV, que ce soit pour la recherche ou pour un usage en pratique médicale courante : les conditions d’utilisation du questionnaire sont-elles claires (copyright, droits, etc.) ? Les instructions pour son administration, le calcul des scores et leur interprétation sont-elles disponibles ? L’auteur du questionnaire est-il bien identifié et disponible pour répondre aux questions ? La version française a-t-elle été réalisée et validée dans les règles ? La version utilisée est-elle la version officielle ou une version dont le contenu a pu être transformé hors du contrôle des auteurs et de la communauté scientifique ?
Peu de questionnaires utilisés dans la recherche sur la QdV dans le glaucome franchissent le niveau minimal de qualité permettant leur évaluation critique [33], et parmi eux une fraction plus limitée encore mesure effectivement la QdV.
Jusqu’à relativement récemment [5], très peu d’instruments de mesure spécifiques du glaucome avaient été développés, et aucun ne mesurait la QdV. Parmi les onze instruments de mesure de la QdV validés dans le glaucome et décrits dans la revue systématique de Vandenbroeck et al. [33], seuls trois sont spécifiques du glaucome, les huit autres étant plus largement spécifiques de la vision. Les trois questionnaires de QdV spécifiques du glaucome sont le Glaucoma Quality of Life questionnaire (Glau-QoL), le Glaucoma Utility Index (GUI) et le Glaucoma Health Perception Index (GHPI). Ce dernier est invalide car il a été développé sans une contribution formelle de patients. Le GUI est un questionnaire de préférences, développé dans une perspective d’évaluation économique. Le Glau-QoL reste donc le seul questionnaire de QdV spécifique du glaucome développé et validé suivant les règles de l’art psychométrique. Parmi les questionnaires QdV au spectre plus large, validés pour une évaluation de la QdV dans le glaucome, on retiendra le NEI-VFQ (National Eye Institute-Visual Function Questionnaire), dans ses deux formes (51 items dans la longue, 25 items dans la courte), qui présente l’avantage d’une très large utilisation dans une grande variété de pathologies oculaires. Tous les questionnaires présentent une remarquable lacune avec l’absence de données documentées concernant la sensibilité au changement dans le temps, à l’exception notable du Low-Vision Quality of Life questionnaire (LVQL), destiné à évaluer l’effet de la rééducation sur la fonction visuelle et la QdV des patients. Cette lacune doit être interprétée plus comme la conséquence combinée de la relative lenteur d’évolution de la maladie, spécialement lorsqu’elle est prise en charge correctement, et de l’absence de traitement curatif permettant d’observer des évolutions positives de la fonction visuelle et de la QdV, plutôt que comme une faiblesse de construction des instruments.
La fonction visuelle n’est pas la QdV. Toutefois, elle en est le principal déterminant, ce qui explique que de nombreux auteurs se concentrent sur la mesure de la fonction visuelle, plus concrète et plus proche de la clinique que la QdV. La dénomination abusive de certains questionnaires, tel le Glaucoma Quality of Life questionnaire (GQL-15) – qui mesure la fonction visuelle et non pas la QdV – entretient cette confusion. Parmi les sept instruments de mesure de la fonction visuelle spécifiques du glaucome, identifiés par Vandenbroeck, aucun n’avait documenté un développement fondé sur une étape formelle de recherche qualitative auprès de patients. Seulement deux – le Glaucoma Symptom Identifier (GSI) et le Independent Mobility Questionnaire (IMQ) – avaient été validés suivant l’approche recommandée pour ce type d’instrument. Aucun de ces sept instruments n’avait démontré sa sensibilité au changement dans le temps.
Les auteurs s’accordent pour dire que la QdV du patient est centrale dans la prise en charge du glaucome [22]. Ils sont suivis en cela par la Haute Autorité de Santé, qui donne comme objectif final du traitement de « préserver la fonction visuelle et la qualité de vie du patient à un coût raisonnable » [10]. La QdV des patients est déterminée par trois facteurs principaux : le choc psychologique consécutif à l’annonce du diagnostic, les inconvénients et effets secondaires du traitement, et la dégradation de la fonction visuelle. Quels sont les leviers sur lesquels le clinicien peut intervenir pour se conformer à l’objectif de la prise en charge, et quels sont les outils à sa disposition pour évaluer et orienter son action ?
L’annonce du diagnostic d’une maladie chronique, particulièrement lorsqu’elle présente un risque marqué d’évolution vers une invalidité irréversible, est une tâche délicate, technique. La bonne ou la mauvaise exécution de cette tâche de communication peut avoir des conséquences importantes et durables sur la QdV des patients. Elle peut aussi influer sur leur comportement ultérieur vis-à-vis de la maladie et du traitement, ainsi que sur la qualité de la relation avec leur médecin et leur confiance dans le système de soins. Adapter l’annonce à la personnalité du patient nécessite à la fois une bonne connaissance de soi et de son patient. Le message doit être simple, compréhensible, mais précis. Il existe des règles simples [11] qui, appliquées, permettent de limiter le choc de l’annonce et de préserver la qualité de la relation.
Le traitement n’est pas toujours bien toléré. Dans une stratégie essentiellement préventive (la grande majorité des patients présentant une hypertension oculaire ne développeront pas de glaucome, même en l’absence de traitement), le rapport bénéfice/risque doit être évalué pour chaque individu, et réévalué en fonction de l’évolution de la maladie. Lorsqu’il est mal toléré, il doit être adapté. Mais comment évaluer la tolérance, et comment surveiller l’observance ? Des instruments de mesure spécifique du glaucome existent, permettant de documenter la tolérance et la satisfaction par rapport au traitement : Treatment Satisfaction Survey for IntraOcular Pressure (TSS-IOP) [3, 8], Comparison of ophtalmic medication for Tolerability (ComTol) [4], Glaucoma Satisfaction Questionnaire (Glausat) [25]. Les comportements des patients peuvent être étudiés avec des instruments spécifiques focalisés sur l’adhérence : Eye-Drop Satisfaction Questionnaire (EDSQ) [21], Adherence Questionnaire [29], ou certains de ses déterminants : Glaucoma Self-Efficacy scale et Outcomes Expectations scale [30]. Toutefois ces instruments ont généralement été développés d’abord dans un objectif de recherche, et leur validation, et éventuellement leur adaptation pour un usage en pratique clinique, restent à mettre en œuvre.
L’ensemble des questionnaires cités sont résumés au tableau 17-3.
Tableau 17-3 – Questionnaires cités dans le texte (par ordre alphabétique d’acronyme).
La dégradation de la fonction visuelle influe de façon importante sur la dégradation de la plupart des composantes de la QdV. L’accès du clinicien à des informations contextualisées et fiables permettant de connaître, à un moment donné, les limitations auxquelles fait face son patient dans sa vie de tous les jours du fait de son glaucome, lui permettrait d’adapter l’information sur la maladie et son évolution, et éventuellement de réévaluer les différentes options thérapeutiques. Malheureusement, ici encore, les instruments de mesure ont essentiellement été développés et appliqués en recherche et ne sont pas adaptés à l’évaluation individuelle en pratique médicale courante.
Malgré l’intérêt que représente en principe l’évaluation de la QdV du patient glaucomateux en pratique clinique, à la fois pour orienter et évaluer la prise en charge, on a peu de signes d’une adoption par les ophtalmologistes d’outils de mesure leur permettant de mettre ce principe en application. L’écart qui sépare la théorie de la pratique et les recommandations des actions est immense. Il n’est pas spécifique du glaucome, ni de l’ophtalmologie, et tient à une combinaison de plusieurs facteurs : le temps nécessaire au changement ; le manque de familiarité avec les concepts permettant d’appréhender le point de vue subjectif du patient ; le manque de confiance dans les méthodes et les outils pour le mesurer ; la multiplicité et l’imperfection des outils, etc. Un obstacle majeur reste l’inadéquation des instruments de mesure – essentiellement développés et validés dans une optique de recherche – aux contraintes et objectifs de la pratique clinique [2]. Des tentatives existent pour répondre au défi que représente la mise à disposition des cliniciens des instruments fluides, dont le contenu, l’administration et l’interprétation sont adaptés aux enjeux et au contexte de la consultation médicale. La version courte (17 items) du Glau-QoL (voir description de son contenu tableau 17-4) est une tentative dans ce sens [40], ou plus récemment le glaucoma Patient-Reported Outcome Experience Measure (POEM) [31] ou encore l’Assessment of Ability Related to Vision (AARV) [37]. Espérons que la révolution numérique et la généralisation des supports dématérialisés de collecte, de traitement et de circulation de l’information lèveront les principaux obstacles à un changement des pratiques, pour le plus grand bien des patients et la plus grande satisfaction de leurs médecins !
Retenir
Le point de vue du sujet est légitimement obtenu auprès du sujet lui-même, sans intermédiaire ni interprétation. Seul le patient peut évaluer sa qualité de vie de façon fiable et valide.
La mesure de la qualité de vie est ancrée dans la vie de tous les jours des patients atteints de glaucome ou d’hypertension oculaire. Elle est par essence multidimensionnelle.
La qualité de vie se mesure avec des instruments validés.
Un bon questionnaire est un outil irremplaçable de communication et d’échange entre le patient, le clinicien et le chercheur.
Qualité de vie, fonction visuelle, tolérance, satisfaction sont des concepts reliés, mais non interchangeables.
Le choix d’un instrument de mesure dépend avant tout de son contenu, qui doit être en adéquation avec une question clinique (par exemple : « Mon patient est-il anxieux à cause de l’évolution de sa pression intra-oculaire ? ») ou de recherche (par exemple : « Un travail spécifique sur l’annonce permet-il de diminuer l’impact sur les patients ? »).
Tableau 17-4 – Description du contenu du Glau-QoL 17.
Le questionnaire Glau-QoL 17 peut être utilisé gratuitement en recherche académique et en pratique clinique. Pour un usage commercial, des droits d’auteur et de distribution s’appliquent. Dans tous les cas, l’utilisateur doit compléter et signer un accord d’utilisation. Voir http://www.mapi-trust.org/services/questionnairelicensing/catalog-questionnaires/238-glauqol
[1] Acquadro C, Berzon R, Dubois D, et al. Incorporating the patient’s perspective into drug development and communication : an ad hoc task force report of the Patient-Reported Outcomes (PRO) Harmonization Group meeting at the Food and Drug Administration, February 16, 2001. Value Health. 2003 ; 6 : 522-31.
[2] Arnould B. Patient-reported outcomes and clinical practice. From measurement instruments to decision tools : much more than simple change in format. PRO Newsletter. 2006 ; 36 : 21-4.
[3] Atkinson MJ, Stewart WC, Fain JM, et al. A new measure of patient satisfaction with ocular hypotensive medications : the Treatment Satisfaction Survey for Intraocular Pressure (TSS-IOP). Health Qual Life Outcomes. 2003 ; 1 : 67.
[4] Barber BL, Strahlman ER, Laibovitz R, et al. Validation of a questionnaire for comparing the tolerability of ophthalmic medications. Ophthalmology. 1997 ; 104 : 334-42.
[5] Baudouin C, Bechetoille A, Bron A, et al. Intérêt de la mesure de la qualité de vie (QDV) et de l’observance thérapeutique chez les patients atteints de glaucome chronique à angle ouvert. J Fr Ophtalmol. 2000 ; 23 : 1029-50.
[6] Bechetoille A, Arnould B, Bron A, et al. Measurement of health-related quality of life with glaucoma : validation of the Glau-QoL (c) 36-item questionnaire. Acta Ophthalmol Scand. 2007 24 ; 86 : 71-80.
[7] Boland MV, Ervin AM, Friedman DS, et al. Comparative effectiveness of treatments for open-angle glaucoma : a systematic review for the U.S. Preventive Services Task Force. Ann Intern Med. 2013 ; 158 : 271-9.
[8] Day DG, Sharpe ED, Atkinson MJ, et al. The clinical validity of the treatment satisfaction survey for intraocular pressure in ocular hypertensive and glaucoma patients. Eye (Lond.). 2006 ; 20 : 583-90.
[9] Demailly P, Zoute C, Castro D. [Personalities and chronic glaucoma]. J Fr Ophtalmol. 1989 ; 12 : 595-601.
[10] Dépistage et diagnostic précoce du glaucome : problématique et perspective en France. Haute Autorité de Santé, service évaluation médico-économique et santé publique, 2006.
[11] Ginies P. [Relationship with the glaucomatous patient : how to announce glaucoma to the patient]. J Fr Ophtalmol. 2009 ; 32 : 190-3.
[12] Glen FC, Crabb DP, Garway-Heath DF. The direction of research into visual disability and quality of life in glaucoma. BMC Ophthalmol. 2011 ; 11 : 19.
[13] Guedes RA, Guedes VM, Freitas SM, Chaoubah A. Quality of life of medically versus surgically treated glaucoma patients. J Glaucoma. 2013 ; 22 : 369-73.
[14] Jampel HD, Frick KD, Janz NK, et al. Depression and mood indicators in newly diagnosed glaucoma patients. Am J Ophthalmol. 2007 ; 144 : 238-44.
[15] Janz NK, Wren PA, Guire KE, et al. Fear of blindness in the Collaborative Initial Glaucoma Treatment Study : patterns and correlates over time. Ophthalmology. 2007 ; 114 : 2213-20.
[16] Lisboa R, Chun YS, Zangwill LM, et al. Association between rates of binocular visual field loss and vision-related quality of life in patients with glaucoma. JAMA Ophthalmol. 2013 ; 131 : 486-94.
[17] Luo RJ, Liu SR, Tian Z, et al. Rehabilitation of vision disorder and improved quality of life in patients with primary open angle glaucoma. Chin Med J (Engl.). 2011 ; 124 : 2687-91.
[18] Mills T, Law SK, Walt J, et al. Quality of life in glaucoma and three other chronic diseases : a systematic literature review. Drugs Aging. 2009 ; 26 : 933-50.
[19] Murata H, Hirasawa H, Aoyama Y, et al. Identifying areas of the visual field important for quality of life in patients with glaucoma. PLoS One. 2013 ; 8 : e58695.
[20] Nordmann JP, Akesbi J. [Improve adherence in glaucoma patients : a doctor’s duty]. J Fr Ophtalmol. 2011 ; 34 : 403-8.
[21] Nordmann JP, Denis P, Vigneux M, et al. Development of the conceptual framework for the Eye-Drop Satisfaction Questionnaire (EDSQ) in glaucoma using a qualitative study. BMC Health Serv Res. 2007 ; 7 : 124.
[22] Parikh RS, Parikh SR, Navin S, et al. Practical approach to medical management of glaucoma. Indian J Ophthalmol. 2008 ; 56 : 223-30.
[23] Preamble to the Constitution of the World Health Organization as adopted by the International Health Conference. Official Records of the World Health Organization. 1948 ; 2 : 100.
[24] Rouland JF, Denis P, Bechetoille A, et al. [Creating a specific quality-of-life questionnaire in patients with glaucoma : item generation]. J Fr Ophtalmol. 2002 ; 25 : 785-94.
[25] Ruiz MA, Pardo A, Martinez de la Casa JM, et al. Development of a specific questionnaire measuring patient satisfaction with glaucoma treatment : Glausat. Ophthalmic Epidemiol. 2010 ; 17 : 131-43.
[26] Sawada H, Fukuchi T, Abe H. Evaluation of the relationship between quality of vision and the visual function index in Japanese glaucoma patients. Graefes Arch Clin Exp Ophthalmol. 2011 ; 249 : 1721-7.
[27] Sawada H, Yoshino T, Fukuchi T, Abe H. Assessment of the vision-specific quality of life using clustered visual field in glaucoma patients. J Glaucoma. 2012 [Epub ahead of print].
[28] Schipper H, Clinch J, Powell V. Definitions and conceptual issues. In : Spilker B (ed.). Quality of life assessment in clinical trials. New York, Raven Press Ltd, 1990 : 11-24.
[29] Schwartz GF, Plake KS, Mychaskiw MA. An assessment of readiness for behaviour change in patients prescribed ocular hypotensive therapy. Eye (Lond.). 2009 ; 23 : 1668-74.
[30] Sleath B, Blalock SJ, Robin A, et al. Development of an instrument to measure glaucoma medication self-efficacy and outcome expectations. Eye (Lond.). 2010 ; 24 : 624-31.
[31] Somner JE, Sii F, Bourne RR, et al. Moving from PROMs to POEMs for glaucoma care : a qualitative scoping exercise. Invest Ophthalmol Vis Sci. 2012 ; 53 : 5940-7.
[32] van Landingham SW, Hochberg C, Massof RW, et al. Driving patterns in older adults with glaucoma. BMC Ophthalmol. 2013 ; 13 : 4.
[33] Vandenbroeck S, De GS, Zeyen T, et al. Patient-reported outcomes (PRO’s) in glaucoma : a systematic review. Eye (Lond.). 2011 ; 25 : 555-77.
[34] Varma R, Lee PP, Goldberg I, Kotak S. An assessment of the health and economic burdens of glaucoma. Am J Ophthalmol. 2011 ; 152 : 515-22.
[35] Wang B, Aung T, Marella M, et al. Impact of bilateral open and closed-angle glaucoma on glaucoma-specific functioning in Asians. J Glaucoma. 2013 ; 22 : 330-5.
[36] Warrian KJ, Spaeth GL, Lankaranian D, et al. The effect of personality on measures of quality of life related to vision in glaucoma patients. Br J Ophthalmol. 2009 ; 93 : 310-5.
[37] Wei H, Sawchyn AK, Myers JS, et al. A clinical method to assess the effect of visual loss on the ability to perform activities of daily living. Br J Ophthalmol. 2012 ; 96 : 735-41.
[38] Wu P, Xi S, Xia H, et al. Survey on vision-related quality of life and self-management among patients with glaucoma. J Glaucoma. 2012 [Epub ahead of print].
[39] Wu PX, Guo WY, Xia HO, et al. Patients’ experience of living with glaucoma : a phenomenological study. J Adv Nurs. 2011 ; 67 : 800-10.
[40] Zanlonghi X, Arnould B, Bechetoille A, et al. [Glaucoma and quality of life]. J Fr Ophtalmol. 2003 ; 26 (n° spécial 2) : S39-S44.
X. Zanlonghi
La pathologie glaucomateuse est potentiellement cécitante.
Les déficits visuels périphériques sont perçus par le patient très tardivement.
Il n’est pas utile de proposer des aides techniques à fort grossissement ; il faut privilégier les techniques de rééducation de balayage et d’exploration active de l’espace visuel.
Selon l’Organisation mondiale de la santé (OMS), « le handicap visuel est la résultante de la déficience visuelle », consécutive à une pathologie oculaire, héréditaire ou favorisée par des facteurs externes. Constituant la deuxième cause principale de cécité dans le monde (après la cataracte, mais avant la DMLA), le glaucome est également la première cause de la perte irréversible de la vision. La prévalence du glaucome augmente fortement avec l’âge (12,3 % en moyenne dans le monde) et provoque d’importants problèmes de qualité de vie qui s’ajoute aux diminutions des capacités physiques (arthrose, surdité, etc.) et aux possibles détériorations cognitives dues à l’âge [4]. Dans les stades évolués, cette neuropathie optique entraîne une perte d’autonomie et devient un handicap [15].
En France, le nombre de déficients visuels par glaucome est très mal connu, et aucune donnée n’existe sur la perte du champ visuel. Pour la perte de la vision centrale, on estimait en 2004 que le glaucome était responsable en France de 10 à 15 % des cas de cécité et/ou basse vision (catégories III à V selon la classification de l’OMS qui correspond à une acuité visuelle comprise entre 1/10 et cécité absolue), soit environ 15 000 cas [9].
Nous n’évoquerons pas les patients atteints de glaucome débutant car ils ne sont pas déficients visuels, donc sans gêne dans la vie courante. Ce chapitre concerne les déficiences visuelles entraînées par les glaucomes avancés ou graves [6].
L’évolution progressive et insidieuse du glaucome, en l’absence de traitement, s’accompagne de l’installation puis de l’extension de déficits périmétriques, initialement discrets. En s’approfondissant et en s’étendant, ces déficits entraînent des difficultés et des limitations importantes dans l’accomplissement de certaines activités, très variables d’un patient à un autre, certains adaptant d’eux-mêmes leurs activités à leur niveau de déficit [11] (fig. 17-9).
L’évaluation de l’évolution du glaucome se fait entre autres par la réalisation régulière du champ visuel (CV) monoculaire et central, étudiant les 60° centraux. Un CV de Goldmann est très rarement réalisé, examen pourtant intéressant lors d’une atteinte grave car il révèle les déficits périphériques à ce stade. La réalisation d’un CV binoculaire permet d’objectiver les scotomes réellement gênant pour la vie quotidienne et donne une bonne évaluation de la qualité de la vision centrale et périphérique du patient [7, 18], ainsi que des répercussions de ces atteintes dans la vie courante. Le CV binoculaire permet également d’orienter plus directement l’interrogatoire. Si l’acuité visuelle centrale est conservée longtemps dans l’évolution du glaucome, elle peut être atteinte dans les formes très évoluées par l’extension et la confluence de scotomes péricentraux. Le bilan fonctionnel est idéalement mixte, ophtalmologique et orthoptique.
L’interrogatoire est un point essentiel du bilan. Par des questions orientées, on peut aider le patient à prendre conscience de quelques gênes fonctionnelles.

Fig. 17-9 Évolution des principales gênes fonctionnelles en fonction de la gravité de la perte du champ visuel binoculaire.
À ce stade, de larges scotomes profonds sont relevés grâce à l’examen du CV. Ce sont des scotomes absolus (absence de vision) et négatifs (non perçus par le patient [3]) qui n’atteignent pas la périphérie.
Il est très intéressant de comparer deux CV monoculaires avec un CV binoculaire. Nous n’obtenons pas l’équivalent d’une simple superposition des deux CV monoculaires mais que certaines zones scotomateuses disparaissent par le phénomène de complétion binoculaire [14]. L’atteinte binoculaire est nettement moins importante que ne pourrait le laisser penser la superposition des deux champs monoculaires.
Le patient n’a pas ou peu conscience de ses scotomes alors que le CV est déjà bien altéré. Si les bonnes questions ne sont pas posées, le patient peut dire que tout va bien et qu’il n’est pas gêné dans la vie quotidienne [17].
La grande majorité de ces patients conduit encore et décrit souvent une gêne à la conduite nocturne surtout liée à un éblouissement par les phares des voitures. La vision en ambiance mésopique accentue l’étendue des scotomes.
Les conditions de travail doivent être connues : poste fixe, déplacements, etc. Les patients qui sont amenés à être mobiles se cognent relativement souvent dans une chaise déplacée, un carton laissé au milieu du passage pourtant libre à l’aller, etc.
Les patients atteints de glaucome à un stade avancé décrivent aussi une héméralopie (gêne à la vision nocturne avec perte des repères spatiaux). Il faut vérifier comment est éclairé leur poste de travail.
Parfois, ils signalent des difficultés dans le retour à la ligne durant la lecture, leurs vitesses de lecture diminuent légèrement, et il leur faut privilégier la lecture de textes en colonnes [12].
Une évaluation de la déambulation par un instructeur en locomotion de la qualité des déplacements en sécurité est parfois conseillée dès ce stade.
En ce qui concerne la gêne à la lecture peuvent être proposés :
une prise en charge rééducative orthoptique autour de la lecture et principalement axée sur le repérage spatial sur une feuille ou sur un écran d’ordinateur afin d’aider le patient dans les retours à la ligne ;
quelques aides optiques de type loupe à faible grossissement telle une règle loupe avec guide-ligne intégré (eFig. 17-4). Ces patients n’ont pas besoin d’un trop fort grossissement car ils ont une bonne acuité visuelle centrale et peuvent la plupart du temps encore lire Parinaud 2 avec leurs lunettes de près ;
pour des efforts prolongés de lecture, conseiller des verres bifocaux ou, mieux, des demi-lunes de près plutôt que des verres progressifs. Parfois il est préférable de prescrire des verres de près plein champ ;
des aides techniques simples tels un guide-ligne, une règle à baisser au fur et à mesure de la lecture.

eFig. 17-4 Règle loupe avec guide-ligne rouge intégré.
Le CV binoculaire devient tubulaire, les scotomes s’étendent vers la périphérie et donnent une importante atteinte périphérique, laissant un CV central de quelques degrés, voire moins.
À ce stade, un CV à la coupole de Goldmann réalisé au V/4 donne des renseignements importants sur la qualité de la vision périphérique. Il peut rester parfois seulement un îlot de vision périphérique temporal.
Le patient décrit de nombreuses gênes, toutes liées à un déficit périmétrique majeur, se situant à différents niveaux (fig. 17-10) :
en ce qui concerne la déambulation, il voit plus à travers un « canon de fusil ». Très gêné dans tous ses déplacements, il ose de moins en moins sortir seul, au sein d’une foule, se cogne souvent surtout dans des endroits qu’il connaît mal et panique régulièrement [13] ;
dans les actes de la vie quotidienne : à table, il ne trouve plus aussi facilement la salière, son verre transparent et doit balayer un moment l’espace avant de localiser un objet. À ce stade, il voit mal ce qu’il y a dans son assiette et en laisse une partie. Il aime bien que la personne qui a cuisiné lui dise ce qu’il mange ;
la lecture devient très difficile : le patient a du mal à repérer la ligne suivante, il saute des lignes. Ce n’est pas tant la taille des caractères qui le gêne car son acuité visuelle reste correcte, même à ce stade, que la perte des contrastes [2]. À un stade vraiment terminal, le patient décrit une baisse d’acuité visuelle centrale et une vision floue ;
en ce qui concerne la vie sociale, il est gêné de ne pas reconnaître les gens car ils ne voient pas leurs visages en entier, il les reconnaît à la voix ou si les gens se présentent à lui, notamment dans la rue [8] ;
il décrit une photophobie et une héméralopie importantes [1].
Toutes ces gênes conduisent à une perte d’autonomie majeure [5].

Fig. 17-10 Glaucome grave et trois situation de la vie quotidienne : la conduite, les courses sur un étal de marché et la lecture.
À ce stade très avancé, il faut proposer [10] :
une rééducation orthoptique orientée sur le repérage spatial, que ce soit sur feuille ou dans l’espace, qui aidera le patient pour la lecture ou dans la rue ;
les aides optiques seront simples, de type loupe à faible grossissement avec repère de ligne intégré. Parfois une sur-correction légère de type verres plein champ avec une addition de + 5,00 est concluante ;
les aides informatiques s’orienteront vers les systèmes à base de synthèse vocale ;
les aides techniques seront un guide-ligne ou une règle pour avoir une lecture suivie ;
les essais de verres filtrants pour lutter contre la photophobie ne sont pas toujours concluants car, lors d’un passage dans une zone d’ombre, le patient, du fait de son héméralopie, se trouve plongé dans l’obscurité de manière brutale. Le patient est demandeur de verres atténuant sa photophobie, mais pas trop sombres du fait de son héméralopie.
Il est bien évident qu’à ce stade, une prise en charge pluridisciplinaire devra être mise en place dans un centre de rééducation et de réadaptation fonctionnelle. Il est nécessaire qu’au moins un instructeur de locomotion, un AVJiste (rééducateur en actes de la vie journalière), un orthoptiste et un psychologue interviennent.
L’accidentologie augmente avec la gravité du glaucome [16]. Quel que soit le handicap (physique, visuel, auditif ou mental), l’arrêté du 21 décembre 2005 stipule que tout conducteur a la responsabilité de s’assurer de son aptitude à conduire. Pour cela, il doit prendre rendez-vous auprès d’un médecin agréé par la préfecture du département. L’arrêté du 31 août 2010 prévoit des dérogations possibles en cas d’atteinte du CV, pour peu que les autres fonctions visuelles (l’acuité visuelle, la vision crépusculaire, la sensibilité à l’éblouissement et aux contrastes) permettent de compenser cette déficience. Ce même arrêté précise que pour le permis véhicule léger : « Tout candidat à la délivrance ou au renouvellement d’un permis de conduire doit avoir une acuité visuelle binoculaire, avec correction optique s’il y a lieu, d’au moins 0,5 en utilisant les deux yeux ensemble. En outre, le CV horizontal ne doit pas être inférieur à 120° et doit s’étendre d’au moins 50° vers la gauche et la droite et de 20° vers le haut et le bas. Aucun défaut ne doit être présent dans un rayon de 20° par rapport à l’axe central. » Pour le permis poids lourd, il y a « incompatibilité si l’acuité visuelle est inférieure à 8/10 pour l’œil le meilleur et à 1/10 pour l’œil le moins bon ». Le CV binoculaire est également précisé puisqu’il y a : « Incompatibilité si le CV binoculaire horizontal des deux yeux est inférieure à 160°, à 70° vers la gauche et la droite et à 30° vers le haut et le bas. Aucun défaut ne doit être présent dans un rayon de 30° par rapport à l’axe central. »
Lorsqu’un patient est atteint d’un glaucome avancé ou grave avec une perte importante du CV binoculaire, il peut être en situation de handicap, notamment pour exercer son activité professionnelle. Quel que soit le milieu professionnel du patient, ce dernier doit être orienté vers une MDPH (maison départementale des personnes handicapées) qui, via la commission des droits et de l’autonomie des personnes handicapées, lui délivreront une RQTH (reconnaissance de la qualité de travailleur handicapé). Une fois la RQTH délivrée, des aides à l’aménagement du poste de travail pour l’entreprise ou l’administration ou de recherche d’emploi pour l’employé handicapé seront proposées [18]. D’autres prestations de type formation ou équipements individuels peuvent aussi être suggérées. Au sein de l’entreprise, le médecin du travail est un interlocuteur privilégié de la personne handicapée. Il est le seul habilité à apprécier l’aptitude du salarié à son poste de travail.
Le glaucome n’est pas considéré comme une affection de longue durée reconnue par la Sécurité sociale. Néanmoins, le handicap peut être évalué et, en fonction de celui-ci, le malade pourra bénéficier de prestations et/ou d’aides pour les moins de 60 ans au titre de la PCH (prestation de compensation du handicap), de l’AAH (allocation aux adultes handicapés) et, pour les plus de 60 ans, au titre de la PCH ou de l’APA (allocation personnalisée d’autonomie). Pour effectuer ces démarches, le patient doit s’informer auprès de la Caisse nationale de solidarité pour l’autonomie (CNSA) ou auprès de la MDPH dont il dépend.
Plusieurs cartes peuvent être accordées selon la gravité du handicap visuel :
la carte de priorité permet d’obtenir une priorité d’accès aux places assises dans les transports en commun, dans les espaces et salles d’attente, de même que dans les établissements et les manifestations accueillant du public. Elle permet également d’obtenir une priorité dans les files d’attente ;
la carte d’invalidité civile qui a pour but d’attester que son détenteur est handicapé. Elle est accessible sous conditions et permet de bénéficier de certains droits spécifiques, notamment dans les transports. Cette carte d’invalidité est délivrée, sur demande, à toute personne dont le taux d’incapacité permanente est au moins de 80 % ou qui est bénéficiaire d’une pension d’invalidité classée en 3e catégorie par la Sécurité sociale ;
la carte européenne de stationnement permet à son titulaire ou à la personne qui l’accompagne de stationner sur les places réservées aux personnes handicapées. Elle peut être attribuée à toute personne atteinte d’un handicap qui réduit de manière importante et durable sa capacité et son autonomie de déplacement à pied. Elle peut aussi être délivrée à une personne contrainte d’être aidée dans tous ses déplacements.
Liens utiles
Organisation mondiale de la santé : www.who.int/blindness/causes/fr/
Journal Officiel de la République française : www.legifrance.gouv.fr
République française : www.permisdeconduire.gouv.fr
République française : www.sante.gouv.fr
[1] Bresson-Dumont H. Le glaucome grave. In : Zanlonghi X, Quiton-Fantoni S (eds). L’aptitude visuelle : l’œil sain, l’œil opéré, l’œil pathologique. Rapport des sociétés d’ophtalmologie. Marseille, Lamy, 2013 : 368-373
[2] Burton R, Crabb DP, Smith ND, et al. Glaucoma and reading : exploring the effects of contrast lowering of text. Optom Vis Sci. 2012 ; 89 : 1282-7.
[3] Crabb DP, Smith ND, Glen FC, et al. How does glaucoma look ? Patient perception of visual field loss. Ophthalmology. 2013 ; 120 : 1120-6.
[4] Detry-Morel M. Les six points clés du suivi du patient glaucomateux. Bull Soc Belge Ophtalmol. 2010 ; 316 : 63-84.
[5] Ernest PJG, Busch MJWM, Webers CAB, et al. Prevalence of end-of-life visual impairment in patients followed for glaucoma. AActa Ophthalmol Scand. 2013 ; 91 : 738-43.
[6] European Glaucoma Society (EGS). Guide pour les glaucomes. Terminology and Guidelines for Glaucoma. Dogma/European Glaucoma Society, 2008, 186 pages.
[7] Esterman B. Functional scoring of the binocular field. Ophthalmology. 1982 ; 89 : 1226-34.
[8] Glen FC, Crabb DP, Smith ND, et al. Do patients with glaucoma have difficulty recognizing faces ? Invest Ophthalmol Vis Sci. 2012 ; 53 : 3629-37.
[9] HAS. Dépistage et diagnostic précoce du glaucome : problématique-perspective en France. Recommandation en santé publique. Rapport d’orientation. Service évaluation médico-économique et santé publique, novembre 2006, 70 pages.
[10] Nilsson UL. Visual rehabilitation of patients with advanced stages of glaucoma, optic atrophy, myopia or retinitis pigmentosa. Doc Ophthalmol. 1989 ; 70 : 363-83.
[11] Parc C, Tiberghien E, Pierre-Kahn V. Driving habits in glaucoma patients. J Fr Ophtalmol. 2012 ; 35 : 235-41.
[12] Ramulu PY, West SK, Munoz B, et al. Glaucoma and reading speed : the Salisbury Eye Evaluation project. Arch Ophthalmol. 2009 ; 127 : 82-7.
[13] Ramulu PY, van Landingham SW, Massof RW, et al. Fear of falling and visual field loss from glaucoma. Ophthalmology. 2012 ; 119 : 1352-8.
[14] Safran AB, Assimacopoulos A. Le handicap visuel. Déficits ignorés et troubles associés. Paris, Masson, 1997, 262 pages
[15] Sander MS, Bournot MC, Lelièvre F, et al. Les personnes ayant un handicap visuel. Les apports de l’enquête Handicaps-Incapacités-Dépendance. Revue Études et Résultats, DREES, juillet 2005, n° 416.
[16] Tanabe S, Yuki K, Ozeki N, et al. The association between primary open-angle glaucoma and motor vehicle collisions. Invest Ophthalmol Vis Sci. 2011 ; 52 : 4177-81.
[17] Wilson MR. Functional status and well-being in patients with glaucoma as measured by the medical outcomes Study Short Form-36. Ophthalmology. 1998 ; 105 : 2112-6.
[18] Zanlonghi X, Quiton-Fantoni S. L’aptitude visuelle : l’œil sain, l’œil opéré, l’œil pathologique. Rapport des sociétés d’ophtalmologie. Marseille, Lamy, 2013, 496 pages.
- Chapitre 17
Considérations thérapeutiques générales

