P. Hamard
Le glaucome à pression normale (GPN) est un glaucome primitif à angle ouvert (GPAO) sans élévation de la pression intra-oculaire (PIO) où les facteurs non pressionnels prédominent.
Le GPN est un diagnostic d’élimination (maladie de Horton, tumeur +).
Le GPN est évolutif, mais il évolue lentement dans 50 % des cas.
Le traitement est celui de la PIO et du terrain.
Le GPN, décrit par von Graefe en 1847, est une neuropathie optique progressive et bilatérale caractérisée par une excavation papillaire et des déficits périmétriques correspondants, chez un sujet ayant un angle iridocornéen ouvert et des PIO dans des valeurs statistiquement normales (≤ 21 mmHg) en l’absence de toute autre cause pouvant elle-même expliquer ces modifications papillaires et/ou périmétriques.
Le concept de GPN est controversé car sa définition repose sur une « normalité de la PIO », la PIO étant est une variable continue pour laquelle le seuil de normalité est purement arbitraire. La valeur seuil mythique des 21 mmHg, à reconsidérer en fonction de la valeur de la pachymétrie centrale, n’a finalement qu’un intérêt théorique qui permet de comprendre et de classifier les glaucomes.
S’il n’est pas démontré que le GPN soit une entité distincte du GPAO, il présente certaines particularités cliniques et paracliniques et nécessite une prise en charge spécifique. Le GPN doit toujours rester un diagnostic d’élimination une fois récusées d’autres neuropathies, notamment vasculaires ou tumorales.
S’il est rapporté dans la littérature que 40 à 75 % des GPAO ont une PIO inférieure à 21 mmHg lors du premier examen, cette prévalence de GPN serait sans doute moindre si la pachymétrie cornéenne centrale et les résultats d’une courbe tensionnelle oculaire (CTO) nycthémérale avaient été renseignés dans toutes les études. On estime que 30 à 44 % de ces patients étiquetés GPN auraient en fait une PIO sous-estimée du fait d’une épaisseur de la cornée centrale (ECC) fine (< 510 µm) [11, 52] et que 10 à 20 % d’entre eux auraient au moins une mesure de PIO supérieure à 21 mmHg dépistée par une CTO [50].
Le GPN représente 50 à 60 % des GPAO chez les Japonais contre 25 à 30 % chez les occidentaux et il est la plus fréquente forme de glaucome dans les populations hispaniques et mexicaines, mais la pachymétrie n’y est pas renseignée. Le GPN survient généralement plus tardivement que le GPAO (en moyenne 10 ans) et sa prévalence augmente avec l’âge (0,2 % entre 43 et 54 ans, 1,6 % pour les plus de 75 ans, 63,6 % pour les plus de 64 ans [39]). Il survient plus tôt chez les patients myopes, et la prédominance féminine ne fait pas l’unanimité.
La physiopathogénie du GPN est loin d’être élucidée mais d’autres facteurs que l’élévation de la PIO jouent sans doute un rôle important dans la survenue de la neuropathie (voir chapitre 10-V).
Des antécédents familiaux de glaucome sont retrouvés dans 20 à 40 % des cas, avec selon les cas une transmission autosomique dominante ou des mutations sur différents gènes (notamment optineurine et OPA1) (voir chapitre 4).
Plusieurs arguments plaident en faveur du rôle de la PIO, même peu élevée, dans la survenue et l’évolution du GPN, avec une prévalence du GPN qui augmente avec les valeurs de la PIO (1-2 % si 10 < PIO < 14 mmHg, 3 % si PIO voisine de 20 mmHg), une surface d’anneau neurorétinien (ANR) qui diminue à mesure que la PIO augmente [32], tandis que la baisse de 30 % de la PIO réduit le taux de progression du champ visuel de 35 à 12 % [8].
Toutefois, un certain pourcentage de GPN traités continue d’évoluer, et la progression du glaucome chez les GPN non traités n’est pas corrélée à la PIO [10].
La réduction du flux sanguin oculaire (FSO), facteur de risque d’incidence et de progression du GPAO, est retrouvée chez 50 % des GPN [20]. Elle s’explique par une baisse ou par des fluctuations des pressions de perfusion oculaire liées à des variations de la tension artérielle (TA), par une augmentation des résistances vasculaires ou par un déficit de l’autorégulation locale qui est souvent liée à un vasospasme [22, 53], l’hypothèse d’une vasculopathie inflammatoire n’étant pas exclue [42] (voir chapitre 10-V).
En pratique, les GPN présentent une plus grande fréquence d’hypotension artérielle chronique, notamment des chutes de la TA diastolique nocturne [40], facteur de risque de progression du GPN [46]. Les overdippers ont une neuropathie plus sévère, tandis que ceux qui présentent des variations circadiennes de leur pression de perfusion oculaire moyenne liées à des variations de leur TA présentent des risques d’aggravation de leurs déficits périmétriques centraux [55]. Une corrélation significative entre la baisse de la TA et la diminution de la pression du liquide céphalorachidien a été récemment rapportée, suggérant qu’une hypotension artérielle chronique puisse faire varier le gradient de pression translaminaire et induire une souffrance axonale [49].
La prévalence du vasospasme est fréquente dans les GPN : 4,7 à 37 % de migraine, 8,4 % syndrome de Raynaud [40] – Harris et al. [26] ont décrit la réversibilité d’un vasospasme des vaisseaux rétro-oculaire en condition d’hypercapnie chez certains. L’hyperviscosité sanguine locale par hyperagrégabilité érythrocytaire et/ou moindre déformabilité érythrocytaire qui a été rapportée chez les GPN [4, 24] augmente les résistances vasculaires locales.
La fréquence des associations entre le GPN et certaines pathologies vasculaires est troublante : les lésions ischémiques diffuses constatées en IRM cérébrale sont huit fois plus fréquentes chez les GPN que chez les témoins, les déficits périmétriques paracentraux étant plus profonds chez ces patients [56] ; la prévalence du syndrome obstructif d’apnée du sommeil qui génère une microangiopathie, une hypoxie et une dysrégulation est élevée : 47 à 80 % [44, 50], l’épaisseur des fibres rétiniennes en OCT étant inversement corrélée au taux de saturation en oxygène [43] ; l’ischémie myocardique silencieuse est fréquente (45 % chez les GPN, 26 % chez les GPAO et 5 % chez les témoins).
L’hypothèse qu’une immunité aberrante ou qu’une auto-immunité puisse initier ou exacerber une neuropathie glaucomateuse repose sur des études épidémiologiques qui ont retrouvé des associations avec les pathologies auto-immunes chez 30 % des GPN, sur la constatation d’un taux d’anticorps sériques d’origines variées (par exemple, contre les heat shock protein ou les glycosaminoglycanes de la matrice extracellulaire de la tête du nerf optique, anticorps anti-alpha-fodrine retrouvés aussi dans la maladie d’Alzheimer), qui est plus élevé chez les GPN que chez les témoins, ou encore de dépôts d’anticorps au niveau des cellules ganglionnaires rétiniennes. Il n’est toutefois pas possible actuellement de dire si des anticorps retrouvés sont directement impliqués dans la physiopathogénie du glaucome, ou s’ils sont simplement les marqueurs d’épiphénomènes ou encore des marqueurs non spécifiques qui accompagnent la neuropathie.
Plusieurs études ont rapporté chez les GPN une réduction de la pression du liquide céphalorachidien (LCR) [3, 35, 49] attestant d’une augmentation de la différence de pression translaminaire qui pourrait induire une souffrance axonale lors de la traversée de la lame criblée. Cette hypothèse repose sur les corrélations qui ont été retrouvées entre la différence de pression translaminaire et le degré d’excavation papillaire des GPN [3] et les déficits périmétriques [49] (voir chapitre 10-V).
D’autres émettent l’hypothèse d’un dysfonctionnement dans la circulation du LCR avec, comme chez les sujets âgés ou ceux atteints de maladie d’Alzheimer ou d’une hydrocéphalie à pression normale, une réduction du renouvellement du LCR et donc une moindre élimination des substances neurotoxiques [58].
La lame criblée des GPN, évaluée par OCT-spectral domain, serait plus fine et donc plus déformable chez les GPN que chez les témoins ou les GPAO hypertensifs, notamment chez ceux ayant des hémorragies du disque optique [48].
La physiopathogénie du GPN est complexe et mal élucidée. Les hypothèses pour expliquer la dégénérescence des fibres nerveuses rétiniennes (FNR) et des cellules ganglionnaires en l’absence d’HTO sont nombreuses et non exclusives : prédisposition génétique, immunité aberrante, prédisposition anatomique fragilisant de la lame criblée, réduction ou instabilité du flux sanguin oculaire, dysfonctionnement de la dynamique circulatoire du LCR, augmentation du gradient de pression translaminaire. Ces facteurs de risque non pressionnels pourraient accroître la vulnérabilité des FNR et des cellules ganglionnaires à des valeurs peu élevées de la PIO.
Le GPN est le plus souvent découvert fortuitement lors d’un examen clinique retrouvant une excavation papillaire. Les consultations sont plus rarement motivées par une gêne fonctionnelle liée à une atteinte périmétrique paracentrale ou une baisse visuelle de survenue progressive qui signe alors un diagnostic tardif.
Toute baisse visuelle rapidement progressive doit faire rechercher une neuropathie autre que glaucomateuse, notamment une neuropathie vasculaire ou tumorale.
Chez la plupart des GPN, il existe un rythme nycthéméral de la PIO [12, 33], l’acrophase pouvant être diurne (54,5 %) ou nocturne (36,4 %) [50], l’amplitude des variations étant toutefois proche de celle des sujets normaux, de l’ordre de 4,0 à 5,5 mmHg [33], mais plus marquée en cas d’acrophase diurne que nocturne [50].
Une CTO chez tout suspect de GPN s’impose donc, non seulement pour confirmer le diagnostic de GPN, mais également pour optimiser la prise en charge thérapeutique en fonction de l’horaire de l’acrophase.
Plusieurs études rapportent que la cornée des GPN est en moyenne plus fine que celles des témoins ou des GPAO [11, 40, 52]. Une ECC fine pourrait être un marqueur de susceptibilité à la neuropathie du GPN ou un facteur prédictif d’aggravation, Choi et al. [7] retrouvant que la diminution de l’ECC de 75 GPN nouvellement diagnostiqués est corrélée à l’augmentation verticale de l’excavation papillaire et à l’élargissement de perte en fibres, tandis que Kurtz et al. [41] montrent que la sévérité de la neuropathie est inversement corrélée à l’ECC et non pas aux valeurs de la PIO initiale. Les GPN ayant les cornées les plus fines (< 516 µm) auraient plus de facteurs de risque vasculaires associés (69 %) que ceux ayant une ECC supérieure à 531 µm (36 %) [16].
En pratique, s’il est admis qu’une ECC fine sous-estime les valeurs de la PIO, il n’est pas exclu qu’une ECC fine soit un facteur de risque de GPN.
Grise-Dulac et al. [23] ont trouvé que la viscoélasticité cornéenne, mesurée par l’Ocular Response Analyser, était significativement réduite chez les GPN par rapport aux témoins, indépendamment de l’ECC. L’hystérésis cornéenne, évaluée par le CH (corneal hysteresis), pourrait permettre de caractériser les propriétés viscoélastiques du globe oculaire entier et notamment celles de la lame criblée puisque la cornée, la sclère péripapillaire et la lame criblée partagent les mêmes composants de la matrice extracellulaire codés par les mêmes gènes, leurs propriétés biomécaniques étant sans doute similaires. Si cette hypothèse était démontrée, les yeux ayant un CH abaissé pourraient être associés à une plus grande vulnérabilité du nerf optique aux facteurs de risque de glaucome.
La neuropathie optique du GPN entraîne des modifications papillaires et/ou des FNR en tous points équivalentes à celles du GPAO, avec dans certains cas de subtiles différences pouvant conforter l’implication de phénomènes autres que pressionnels, notamment vasculaires, dans la souffrance du nerf optique.
La taille du disque optique est similaire, voire plus grande, que celle des GPAO hypertensifs et serait inversement corrélée à l’ECC [47]. La perte en FNR est plus localisée et plus centrale surtout quand la PIO est basse (< 15 mmHg) [36], avec une plus grande fréquence de fossettes colobomateuses, témoins potentiels d’une vulnérabilité particulière de la lame criblée aux valeurs de la PIO [31]. À déficits périmétriques équivalents [25], l’ANR est plus mince chez les GPN que chez les GPAO, plus particulièrement en inféro-temporal, suggérant chez les GPN une plus grande réduction en tissu glial résiduel.
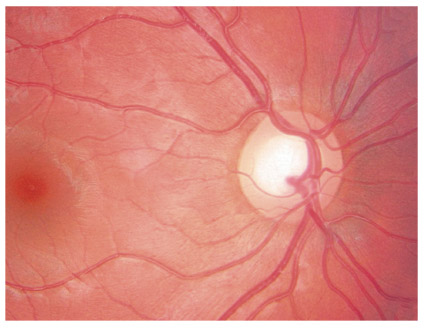
Zone de moindre vascularisation, elle est plus fréquente et plus étendue qu’en cas de GPAO, et progresse davantage chez les GPN qui présentent des hémorragies papillaires (fig. 13-1). Son extension est un facteur de risque de progression du GPN, témoin du rôle que peuvent jouer les facteurs vasculaires locaux dans le développement et l’aggravation du GPN.
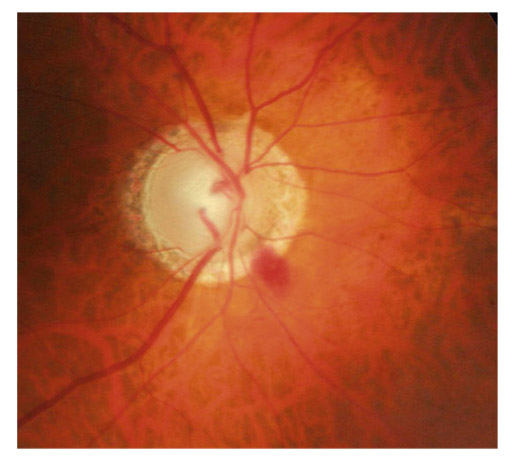
Fig. 13-1 Atrophie péripapillaire et hémorragie.
Certaines caractéristiques papillaires permettent d’identifier des formes cliniques de neuropathie à basse tension, qui diffèrent dans leur évolution, guidant la prise en charge thérapeutique.
Elles sont le plus souvent inféro-temporales, bilatérales et fréquemment asymétriques. Le déficit en FNR correspondant est plus localisé et plus large que celui rencontré dans les GPAO hypertensifs, et se traduit au champ visuel par des scotomes arciformes profonds de l’hémichamp supérieur affleurant le point de fixation. Cette forme se rencontre plus volontiers chez la femme vasospastique et est évolutive dans 48 % des cas [20].
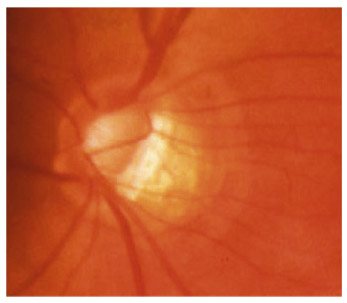
Elles sont en pente douce, dites en « verre de montre », entourées d’une atrophie choriorétinienne. La papille est souvent pâle et les hémorragies fréquentes. Les déficits périmétriques correspondants sont aussi bien localisés que diffus (fig. 13-2). L’angiographie retrouve des anomalies circulatoires au pôle postérieur, la progression du champ visuel étant corrélée au ralentissement circulatoire choroïdien [20]. Le glaucome scléreux sénile est assimilé à une forme de neuropathie chronique ischémique liée à l’artériosclérose, peu évolutive (33 % des cas), mais souvent associée au risque d’occlusion de la veine centrale de la rétine.
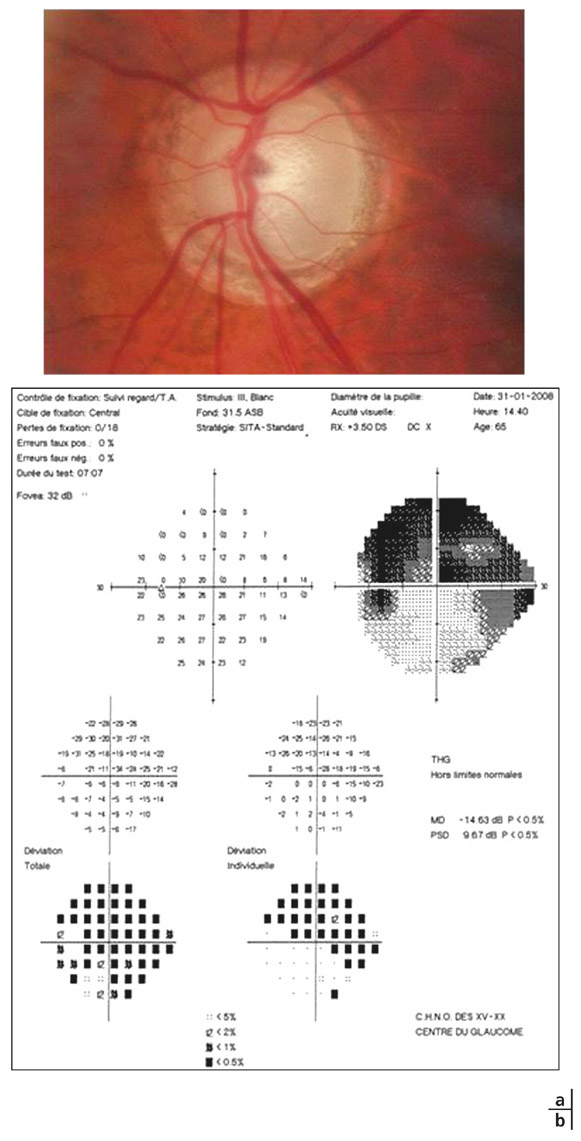
Fig. 13 -2 GPN scléreux sénile.
La papille est souvent de grande taille, pâle, entourée d’une atrophie péripapillaire. L’angiographie met en évidence des anomalies de remplissage du pôle postérieur. Les déficits périmétriques sont diffus et localisés, fréquemment proches du point de fixation et évolutifs dans 68 % des cas, souvent rapidement.
L’incidence ou la prévalence des hémorragies est trois fois plus importante chez les GPN que chez les GPAO (33 et 11 % respectivement) [54]. Les hémorragies sont le plus souvent temporales (60 %) et inférieures (70 %), récurrentes dans 64 % des cas dans les deux premières années et récidivant dans 72 % des cas dans le même quadrant du nerf optique. Elles annoncent une aggravation du champ visuel à cinq ans [30].
En pratique, par rapport au GPAO hypertensif, les GPN présentent souvent une perte en FNR plus localisée et plus centrale, une atrophie péripapillaire plus étendue et extensive, des hémorragies du disque optique ou des FNR plus fréquentes et récidivantes, particularités qui témoignent d’anomalies circulatoires locales.
Les déficits périmétriques sont soit diffus, soit localisés, et dans tous les cas non homonymes, organisés par rapport au méridien horizontal, ne respectant pas le méridien vertical, et corrélés aux déficits en fibres. Par rapport aux GPAO, les déficits périmétriques sont toutefois plus souvent localisés que diffus, plus profonds et plus volontiers paracentraux, d’où la nécessité de réaliser des relevés périmétriques dans les 10° centraux.
Les déficits périmétriques sont évolutifs seulement dans 56 % des cas sans traitement à cinq ans (contre 93 % en cas de glaucome exfoliatif, et 74 % en cas de GPAO hypertensif [29]), et d’évolution plus lente que celles des GPAO (MD : – 0,36 dB/an et – 1,31 dB/an respectivement). La progression serait plus rapide en cas d’atteinte de l’hémichamp visuel supérieur [6].
Au stade précoce du GPN, en cas de déficits dans les 10° centraux, l’analyse du complexe cellulaire ganglionnaire maculaire a une forte capacité discriminante de glaucome, équivalente à celle de l’épaisseur des FNR [51]. L’étude des FNR en OCT est effectivement importante, car elle aide à distinguer les GPN (atteinte supérieure et/ou inférieure) des neuropathies non glaucomateuses (atteinte temporale).
Faut-il réaliser une IRM systématiquement chez tout suspect de GPN ? S’il est vrai que des lésions comprimant la voie optique antérieure peuvent entraîner une excavation papillaire et que ces lésions sont retrouvées chez 6,5 % des GPN en cas d’IRM systématique [1], la prévalence des processus compressifs chez les patients présentant un tableau clinique typique de GPN est très faible et l’IRM cérébrale systématique ne paraît pas justifiée [21], à condition que le diagnostic de GPN soit porté d’après les données d’un examen ophtalmologique complet, comprenant notamment l’examen de la réactivité pupillaire et la recherche de signes neuro-ophtalmologiques [34], et qu’il n’existe aucun signe clinique ou symptôme suspect. L’IRM cérébrale sera réservée à certaines indications [21] (tableau 13-1).
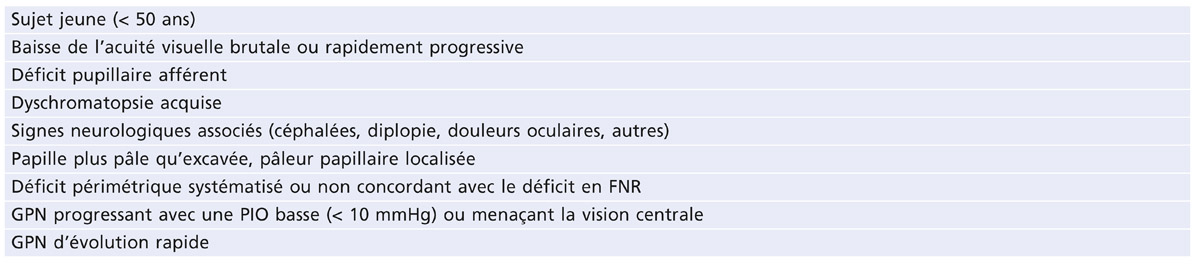
Tableau 13-1 Indications de l’IRM cérébrale chez un patient suspect de GPN.
Kesler et al. [34] ont montré, dans une étude rétrospective portant sur 36 GPN ayant eu un écho-Doppler carotidien systématique, que celui-ci était normal dans 91,7 % des cas, un seul patient (2,8 %) ayant une sténose de plus de 50 %. Cet examen sera réservé aux GPN évoluant avec des PIO abaissées ou aux formes très asymétriques.
Ils doivent être éliminés avant de porter un diagnostic de GPN, car certains engagent le pronostic visuel et nécessitent un traitement spécifique.
Ils sont diagnostiqués sur l’interrogatoire (prise de bêtabloquants, clonidine, digitaliques, digoxine, alphabloquants, inhibiteurs calciques, inhibiteurs de l’angiotensine de conversion ou dopaminergiques), la mesure de la pachymétrie cornéenne centrale (pression faussement basse du fait d’une cornée fine), la gonioscopie (angle fermable) et la réalisation d’une courbe de tension oculaire (révélant des glaucomes à pression intermittente [39]).
Il s’agit des crises glaucomatocycliques du syndrome de Posner-Schlossman dont la PIO entre les crises est normale, du glaucome cortisonique dont la PIO s’est normalisée à l’arrêt de la corticothérapie, du glaucome pigmentaire en phase de régression et du glaucome traumatique dont la PIO s’est normalisée.
En présence d’une excavation papillaire avec PIO normale, certains arguments orientent vers une neuropathie optique non glaucomateuse (tableau 13-2).
Les deux diagnostics différentiels à éliminer en priorité sont les neuropathies optiques artéritiques, compte tenu notamment du risque de bilatéralisation, et les neuropathies tumorales compressives, toutes deux ayant un traitement très spécifique.
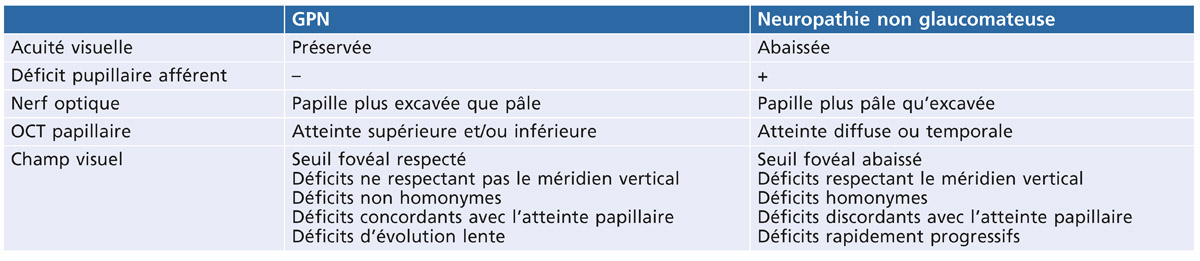
Tableau 13-2 Éléments d’orientation clinique et paraclinique en faveur d’un GPN ou d’une neuropathie non glaucomateuse (en dehors des stades terminaux de glaucome).
Elles sont volontiers unilatérales, caractérisées par une baisse d’acuité visuelle brutale ou très rapidement progressive et massive.
La neuropathie artéritique de Horton entraîne une pâleur papillaire et, dans 80 % des cas à trois mois, une excavation papillaire [14].
Les neuropathies non artéritiques surviennent plus volontiers sur des disques optiques de petite taille. L’excavation est beaucoup moins marquée qu’en cas de glaucome ou de neuropathie optique ischémique antérieure artéritique [14].
La neuropathie optique ischémique des chocs vasculaires, classée par Drance comme une forme particulière de GPN non évolutif, est diagnostiquée sur l’interrogatoire.
Tout processus comprimant les voies optiques peut entraîner une atteinte papillaire semblable à celle du GPN avec un profil évolutif semblable. Toutefois, la papille reste toujours plus pâle qu’excavée.
Compression du nerf optique : la neuropathie est unilatérale, plus ou moins associée à une exophtalmie, des douleurs et une diplopie. Il existe un déficit pupillaire afférent relatif du côté atteint. L’asymétrie d’atteinte papillaire est très évocatrice.
Compression chiasmatique : la neuropathie est bilatérale, plus ou moins associée à des céphalées, des troubles endocriniens et une hémianopsie bitemporale.
Compression rétrochiasmatique : les déficits périmétriques sont bilatéraux homonymes et respectent le méridien vertical.
Les pseudo-excavations glaucomateuses sur des disques optiques de taille normale, ou « glaucoma like-disc », sont des excavations à grand axe horizontal, sans atrophie papillaire bêta, tandis que les vaisseaux péripapillaires, la couche des FNR et le champ visuel sont normaux (fig. 13-3). Certains « glaucoma like-disc » pourraient toutefois être des formes précoces de GPN et doivent donc être surveillés.
Les excavations des disques optiques de grande taille (plus de 2 mm) sont souvent à grand axe vertical ; elles sont symétriques dans 90 % des cas et pourraient être un facteur de risque de glaucome.
Les dysversions papillaires sont bilatérales, contemporaines souvent d’une myopie et/ou d’un astigmatisme et associées à une atrophie péripapillaire dans l’axe de la dysversion (fig. 13-4). Elles entraînent des déficits périmétriques variés d’allure glaucomateuse qui ne sont pas évolutifs.
Les fossettes colobomateuses congénitales, unilatérales dans 85 % des cas, volontiers temporales, peuvent entraîner des déficits périmétriques sectoriels non évolutifs dans 50 % des cas.
L’atrophie optique dominante entraîne une excavation papillaire classiquement triangulaire avec pâleur temporale, un déficit central ou cæco-central au champ visuel avec épargne périphérique, et une dyschromatopsie d’axe bleu-jaune. L’IRM objective une atrophie diffuse de la voie optique allant jusqu’au chiasma.
La neuropathie optique héréditaire de Leber se traduit par une pâleur papillaire temporale et un scotome central au champ visuel.
Les drusen papillaires peuvent comprimer les FNR et entraîner des déficits fasciculaires et des scotomes périmétriques potentiellement évolutifs, voire une neuropathie ischémique. Lorsqu’elles se calcifient, elles peuvent entraîner l’érosion des parois vasculaires et donc une hémorragie papillaire.
Les neuropathies acquises, qu’elles soient inflammatoires (sclérose en plaques, sarcoïdose, syphilis, neuromyélite optique de Devic), radiques, traumatiques ou toxiques (intoxication au méthanol, ethylène-glycol, éthambutol) seront diagnostiquées sur l’interrogatoire, les signes cliniques associés et confirmées selon les cas par des examens paracliniques spécifiques.
Ils peuvent être liés à une cicatrice choriorétinienne sur le trajet des FNR, une occlusion vasculaire rétinienne, une neuropathie rétrobulbaire ou une maculopathie. Le diagnostic est clinique et souligne l’importance de l’examen du fond d’œil dilaté chez tout patient suspect de GPN.
Le taux et la rapidité de progression du GPN sont variables. La progression concerne 56 % des GPN dans un délai moyen de cinq ans, et survient plus lentement que celle des GPAO hypertensifs (– 0,36 dB/an versus – 1,31 dB/an) [29].
Les facteurs de risque de progression sont :
la PIO dont le rôle dans la progression du GPN est indéniable, puisque son abaissement de 30 % diminue les risques de progression de 35 à 12 % selon la Collaborative Normal-Tension Glaucoma Study (CNTGS) [10]. Le risque de progression est corrélé à la valeur de la PIO initiale et à l’amplitude des variations de la PIO quelle que soit la sévérité de l’atteinte au moment du diagnostic [45]. La réduction de la PIO réduit les taux de progression du champ visuel (MD : – 0,05 dB/an chez les GPN asiatiques traités par timolol, et MD : – 0,25 dB/an chez les GPN non traités [2]). Cette évolution est confirmée à 12 ans par l’étude récente de Kim et al. [37] ;
la sévérité des déficits périmétriques [45] ;
les facteurs de risque « pression-indépendants ». Il s’agit du sexe féminin (RR : 1,85 ; p = 0,062) [17], de la migraine (RR : 2,58 (p = 0,0058) [17], des hémorragie du disque optique (RR : 2,72 ; p = 0,0036) [17], de l’absence de prise d’inhibiteurs calciques [15], de l’atrophie péripapillaire [15], de l’hypotension artérielle nocturne chronique, notamment diastolique [28], et des fluctuations nycthémérales des pressions de perfusion oculaires moyennes [55]. La myopie est un facteur de risque de progression discuté.
Le but du traitement du GPN est le même que celui du GPAO : limiter la progression du glaucome tout en maintenant une qualité de vie. Le traitement du GPN représente un défi, car il s’agit de faire baisser une PIO considérée normale et de traiter des facteurs de risque, notamment vasculaires, dont la responsabilité directe dans le déterminisme ou l’évolution de la neuropathie n’est pas toujours démontrée.
L’étude CNTGS [9] qui a suivi des GPN dont un seul œil était traité nous a appris que 60 % seulement des GPN progressaient en cinq ans et qu’un abaissement de 30 % de la PIO initiale permettait de ralentir la progression des déficits périmétriques dans 80 % des cas.
En théorie ne devront être traités que les GPN dont la progression est documentée, avec pour objectif un abaissement pressionnel de 30 % (soit une PIO entre 8 et 12 mmHg), sachant que la progression est lente, mais qu’elle peut menacer la vision centrale.
Si, parmi les traitements hypotonisants oculaires locaux, certains ont en théorie des propriétés neuroprotectrices ou vasculoprotectrices, la logique est de privilégier ceux qui ont le plus d’efficacité sur l’abaissement tensionnel et le moins d’effets secondaires. Toutefois l’efficacité des agents hypotenseurs utilisés dans le GPAO est moindre en cas de GPN selon la méta-analyse de Cheng et al. [5] à partir de 15 essais cliniques randomisés (tableau 13-3). D’après cette analyse, les prostaglandines et le timolol 0,5 sont les plus efficaces. Toutefois, les bêtabloquants exposent au risque de baisse de la tension artérielle diastolique nocturne, et donc à la progression de la neuropathie selon l’étude de Hayreh et al. [27]. Chez les GPN qui progressent, l’administration d’un bêtabloquant le soir devra donc être évitée surtout si le patient est hypertendu artériel traité. Les bêtabloquants seront également à éviter en cas de vasospasme ou d’hypotension artérielle qu’ils pourraient aggraver.
On retiendra par ailleurs que la brimonidine a un potentiel neuroprotecteur théorique et que les inhibiteurs de l’anhydrase carbonique ont un potentiel vasculoprotecteur.
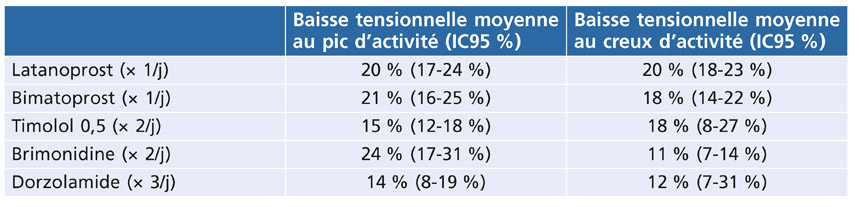
Tableau 13-3 Efficacité au pic d’action et au creux d’activité des différentes classes thérapeutiques en cas de GPN [5].
Une étude récente, toutefois rétrospective, rapporte pour la première fois que la trabéculoplastie sélective a permis de réduire significativement la PIO moyenne de 18 GPN (de 14,3 ± 2,6 mmHg à 12,2 ± 1,7 mmHg, p < 0,001) et les variations de PIO (1,9 ± 0,9 mmHg avant traitement et 1,0 ± 0,6 mmHg après traitement, p = 0,002) [18].
Si ces résultats sont confirmés sur de plus larges séries prospectives, la trabéculoplastie pourrait être une solution efficace pour abaisser la PIO des GPN qui ont des PIO moyennes de plus de 15 mmHg ou qui présentent des fluctuations de la PIO.
Elle est indiquée lorsque le glaucome s’aggrave ou menace le point de fixation, lorsque le traitement médical ou par laser n’est pas suffisant à l’obtention d’une PIO cible. Il faut recourir aux antimétabolites (mitomycine C ou 5-fluorouracile) pour obtenir un abaissement tensionnel suffisant. Si la trabéculectomie abaisse davantage la PIO, elle expose également à davantage de complications que la sclérectomie non perforante, notamment au risque type d’hypotonie qui peut se compliquer de baisse visuelle.
Aucune thérapeutique n’a prouvé son efficacité à améliorer le flux sanguin oculaire de façon spécifique. Il faut se contenter de contrôler les paramètres potentiellement impliqués dans un déséquilibre du flux sanguin oculaire, en collaboration avec un interniste (voir chapitre 10-V).
En cas d’hypertension artérielle, le traitement antihypertenseur devra éviter les substances hypotensives vasoconstrictrices (par exemple bêtabloquants) et le Holter tensionnel artériel s’assurera que le traitement ne majore pas de dips nocturnes.
Il faut rechercher les facteurs qui déclenchent ou majorent une hypotension artérielle, notamment orthostatique : traitement antidépresseur, antiparkinsonien, varices importantes. En cas d’hypotension artérielle primitive, on conseillera les boissons salées au coucher, la prise de magnésium, l’heptaminol, exceptionnellement une corticothérapie par voie générale.
Les facteurs de risque liés à l’artériosclérose seront contrôlés en collaboration avec l’interniste.
Son traitement repose sur des règles hygiénodiététiques : arrêt du tabac et exercice physique en priorité. Les inhibiteurs calciques seront à considérer chez les patients progressant malgré des PIO de moins de 15 mmHg [38] ou chez les plus jeunes patients ayant une composante vasospastique, sous strict contrôle cardiologique compte tenu des effets secondaires potentiels. L’administration orale d’un inhibiteur calcique, la nilvadipine, utilisée à la dose de 4 mg/j dans un essai clinique prospectif masqué, a permis de retarder la progression de la dégradation du champ visuel des GPN traités sur trois ans, avec une amélioration concomitante du flux sanguin choroïdien et du nerf optique d’environ 35 % [2].
Le magnésium, qui réduit le vasospasme induit par l’ET1 in vitro, pourrait améliorer la circulation périphérique de certains GPN vasospastiques : une amélioration des performances périmétriques a été constatée après un mois de traitement à la dose de 240 mg/j [19]. En ce qui concerne le traitement de la migraine, on déconseillera les antimigraineux vasoconstricteurs.
Les déficiences du système microcirculatoire ayant un rôle probablement plus important chez les GPN que chez les GPAO, le recours à des molécules visant à améliorer la microcirculation peut se justifier en théorie, même si pour beaucoup d’entre elles le bénéfice clinique n’a pas été mis en évidence (extraits de gingko biloba [13], antagonistes des récepteurs sérotoninergiques, donépézil hydrochloride – Aricept® –, inhibiteur de la cholinestérase qui améliorerait le flux sanguin au niveau du nerf optique et des globes occipitaux chez certains GPN [59]).
Concernant le contrôle des facteurs associés, on peut citer le syndrome d’apnée du sommeil (voir chapitre 10-V) sans qu’aucune étude à l’heure actuelle n’ait prouvé le bénéfice de son traitement dans l’évolution du GPN.
Retenir
Le GPN est un GPAO avec une PIO inférieure à 21 mmHg où prédominent les facteurs de risque non pressionnels (génétiques, morphologiques, vasculaires ou auto-immuns), les facteurs de risque vasculaires étant les seuls accessibles à un traitement potentiel (hypotension artérielle notamment nocturne, vasospasme, syndrome d’apnée du sommeil).
Le GPN reste un diagnostic d’élimination des glaucomes hypertensifs méconnus (cornée fine, élévation intermittente de la PIO), cicatriciel (exfoliatif, pigmentaire, cortisonique), du glaucome par fermeture intermittente de l’angle, des neuropathies vasculaires (Horton ++) et tumorales (++), et de toute neuropathie (héréditaire, inflammatoire, infectieuse ou toxique) qui peut finir par s’excaver, la papille restant toujours plus pâle qu’excavée, sans oublier les causes neurorétiniennes responsables de déficits périmétriques.
Le bilan de tout patient suspect de GPN devrait associer systématiquement un interrogatoire, une gonioscopie, une courbe tensionnelle oculaire, une pachymétrie cornéenne centrale, un fond d’œil dilaté, une périmétrie automatisée avec étude des 10° centraux, un OCT des FNR et maculaire.
L’IRM orbitaire et encéphalique, pour éliminer un processus compressif, est indiquée en cas de baisse de l’acuité visuelle brutale ou rapidement progressive, de sujet jeune, de signes neurologiques associés, de déficit pupillaire afférent, si la papille est plus pâle qu’excavée, si les déficits périmétriques respectent le méridien vertical ou sont discordants avec l’atteinte papillaire ou des FNR, si l’évolution est rapide ou menace la vision centrale.
Les présentations cliniques et paracliniques du GPN sont similaires à celles des GPAO avec toutefois une plus grande fréquence des hémorragies papillaires ou des FNR, une perte souvent plus localisée et plus centrale des FNR, une plus grande fréquence d’atrophie péripapillaire progressive et de déficits périmétriques profonds volontiers paracentraux. La papille est dans tous les cas plus excavée que pâle, les déficits périmétriques organisés par rapport au méridien horizontal, toujours corrélés aux déficits en FNR et, dans la majorité des cas, bilatéraux.
Le GPN progresse souvent lentement, dans 50 % des cas. Les facteurs de progression actuellement reconnus sont la PIO, les hémorragies péripapillaires, l’atrophie péripapillaire, le sexe féminin, la migraine et l’hypotension artérielle nocturne.
L’abaissement de la PIO par traitement médical, trabéculoplastie ou chirurgie s’impose en cas de déficit évolutif et/ou menaçant la fonction visuelle, une baisse de 30 % de la PIO diminuant les risques de progression sans toutefois les éliminer.
La prise en charge des facteurs de risque non pressionnels est fondamentale et se fait en collaboration avec l’interniste (facteurs vasculaires, apnée du sommeil en particulier).
[1] Ahmed IKA, Feldman F, Kucharczyk W, Trope GE. Neuroradiologic screening in normal-pressure glaucoma : study results and literature review. J Glaucoma. 2002 ; 11 : 279-86.
[2] Araie M. Basic and clinical studies of pressure-independent damaging factors of open angle glaucoma. Nihon Ganka Gakkai Zasshi. 2011 ; 115 : 213-36.
[3] Berdahl JP, Fautsch MP, Stinnett SS, et al. Intracranial pressure in primary open angle glaucoma, normal tension glaucoma, and ocular hypertension. Invest Ophthalmol Vis Sci. 2008 ; 49 : 5412-8.
[4] Cheng HC, Chan CM, Yeh SI, et al. The hemorheological mechanisms in normal tension glaucoma. Curr Eye Res. 2011 ; 36 : 647-53.
[5] Cheng JW, Cai JP, Wei RL. Meta-analysis of medical intervention for normal tension glaucoma. Ophthalmology. 2009 ; 116 : 1243-9.
[6] Cho HK, Kee C. Comparison of the progression rates of the superior, inferior, and both hemifield defects in normal-tension glaucoma patients. Am J Ophthalmol. 2012 ; 154 : 958-68.
[7] Choi HJ, Kim DM, Hwang SS. Relationship between central corneal thickness and localized retinal nerve fiber layer defect in normal-tension glaucoma. J Glaucoma. 2006 ; 15 : 120-3.
[8] Collaborative Normal-Tension Glaucoma Study Group. Comparison of glaucomatous progression between untreated patients with normal-tension glaucoma and patients with therapeutically reduced intraocular pressures. Ophthalmol. 1998 ; 126 : 487-97.
[9] Collaborative Normal-Tension Glaucoma Study Group. The effectiveness of intraocular pressure reduction in the treatment of normal-tension glaucoma. Am J Ophthalmol. 1998 ; 126 : 498-505.
[10] Collaborative Normal-Tension Glaucoma Study Group. Natural history of normal-tension glaucoma. Ophthalmology. 2001 ; 108 : 247-53.
[11] Copt RP, Thomas R, Mermoud A. Corneal thickness in ocular hypertension, primary open angle glaucoma and normal tension glaucoma. Arch Ophthalmol. 1999 ; 117 : 14-6.
[12] Costagliola C Parmeggiani F, Virgili G, et al. Circadien changes of intra-ocular pressure and ocular perfusion pressure after timolol or latanoprost in Caucasians with normal-tension glaucoma. Graefes Arch Clin Exp Ophthalmol. 2008 ; 246 : 389-96.
[13] Cybulska-Heinrich AK, Mozaffarieh M, Flammer. Ginkgo biloba : an adjuvant therapy for progressive normal and high tension glaucoma. J Mol Vis. 2012 ; 18 : 390-402.
[14] Danesh-Meyer HV, Boland MV, Savino PJ, et al. Optic disc morphology in open-angle glaucoma compared with anterior ischemic optic neuropathies. Invest Ophthalmol Vis Sci. 2010 ; 51 : 2003-10.
[15] Daugeliene L, Yamaoto T, Kitazaa Y. Risk factors for visual field damage progression in normal-tension glaucoma. Graefes Arch Clin Exp Ophtalmol. 1999 ; 237 : 106-8.
[16] Doyle A, Bensaid A, Lachkar Y. Central corneal thickness and vascular risk factors in normal tension glaucoma. Acta Ophthalmol Scand. 2005 ; 83 : 191-5.
[17] Drance S, Anderson DR, Schulzer M. Collaborative Normal-Tension Glaucoma Study Group. Risk factors for progression of visual field abnormalities in normal-tension glaucoma. Am J Ophthalmol. 2001 ; 131 : 699-708.
[18] El Mallah MK, Walsh MM, Stinnett SS, Asrani SG. Selective laser trabeculoplasty reduces mean IOP and IOP variation in normal tension glaucoma patients. Clin Ophthalmol. 2010 ; 4 : 889-93.
[19] Gaspar AZ, Gasser P, Flammer J. The influence of magnesium on visual field and peripheral vasospasm in glaucoma. Ophthalmologica. 1995 ; 209 : 11-3.
[20] Geijssen HC, Greve EL. Vascular concepts in glaucoma. GPN Curr Opin Ophthalmol. 1995 ; 6 : 71-7.
[21] Greenfield DS, Siatkowski RM, Glaser JS, et al. The cupped disc. Who needs neuroimaging ? Ophthalmology. 1998 ; 105 : 1866-74.
[22] Grieshaber MC, Mozaffarieh M, Flammer J. What is the link between vascular dysregulation and glaucoma ? Surv Ophthalmol. 2007 ; 52 (Suppl. 2) : S144-54.
[23] Grise-Dulac A, Saad A, Abitbol O, et al. Assessment of corneal biomechanical properties in normal tension glaucoma and comparison with open-angle glaucoma, ocular hypertension, and normal eyes. J Glaucoma. 2012 ; 21 : 486-9.
[24] Hamard P, Hamard H, Dufaux J, Quesnot S. Optic nerve head blood flow using a laser Doppler velocimeter and haemorheology in primary open angle glaucoma and normal pressure glaucoma. Br J Ophthalmol. 1994 ; 78 : 449-53.
[25] Häntzschel J, Terai N, Sorgenfrei F, et al. Morphological and functional differences between normal-tension and high-tension glaucoma. Acta Ophthalmol. 2013 ; 91 : e386-91.
[26] Harris A, Sergott RC, Spaeth GL, et al. Color Doppler analysis of ocular vessel blood velocity in normal-tension glaucoma. Am J Ophthalmol. 1994 ; 118 : 642-9.
[27] Hayreh SS, Podhajsky P, Zimmerman MB. Beta-blocker eyedrops and nocturnal arterial hypotension. Am J Ophthalmol. 1999 ; 128 : 301-9.
[28] Hayreh SS, Zimmerman MB, Podhajsky P, Alward WL. Nocturnal arterial hypotension and its role in optic nerve head and ocular ischemic disorders. Am J Ophthalmol. 1994 ; 117 : 603-24.
[29] Heijl A, Bengtsson B, Hyman L, Leske MC. Early Manifest Glaucoma Trial Group. Natural history of open-angle glaucoma. Ophthalmology. 2009 ; 116 : 2271-6.
[30] Ishida K, Yamamoto T, Sugiyama K, Kitazawa Y. Disk hemorrhage is a significantly negative prognostic factor in normal tension glaucoma. Am J Ophthalmol. 2000 ; 129 : 707-14.
[31] Javitt JC, Spaeth GL, Katz LJ, et al. Acquired pits of the optic nerve. Increased prevalence in patients with low-tension glaucoma. Ophthalmology. 1990 ; 97 : 1038-43.
[32] Jonas JB, Grundler AE, Gonzales-Cortés J. Pressure-dependent neuroretinal rim loss in normal-pressure glaucoma. Am J Ophthalmol. 1998 ; 125 : 137-44.
[33] Kano K, Kuwayama Y. Diurnal variation of intraocular pressure in normal-tension glaucoma. Nippon Ganka Gakkai Zasshi. 2003 ; 107 : 375-9.
[34] Kesler A, Haber I, Kurtz S. Neurologic evaluations in normal-tension glaucoma workups : are they worth the effort ? IMAJ. 2010 ; 12 : 287-9.
[35] Killer HE, Miller NR, Flammer J, et al. Cerebrospinal fluid exchange in the optic nerve in normal-tension glaucoma. Br J Ophthalmol. 2012 ; 96 : 544-8.
[36] Kim DM, Seo JH, Kim SH, Hwang SS. Comparison of localized retinal nerve fiber layers defects between a low-teen intraocular pressure group and a high teen intraocular pressure group in normal tension glaucoma patients. J Glaucoma. 2007 ; 16 : 293-6.
[37] Kim M, Kim DM, Park KH, et al. Intraocular pressure reduction with topical medications and progression of normal-tension glaucoma : a 12-year mean follow-up study. Acta Ophthalmol. 2013 ; 92 : e270-5.
[38] Kitazawa J, Shirai H, Go FJ. The effect of calcium antagonistes on visual field in low-tension glaucoma. Graefes Arch Clin Exp Ophthalmol. 1989 ; 277 : 408-12.
[39] Klein BE, Klein R, Sponsel WE, et al. Prevalence of glaucoma. The Beaver Dam Eye Study. Ophthalmology. 1992 ; 99 : 1499-504.
[40] Krupin T, Liebmann JM, Greenfield DS, et al. The Low-pressure Glaucoma Treatment Study (LoGTS) study design and baseline characteristics of enrolled patients. Ophthalmology. 2005 ; 112 : 376-85.
[41] Kurtz S, Haber I, Kesler A. Corneal thickness measurements in normal-tension glaucoma workups : is it worth the effort ? J Glaucoma. 2010 ; 19 : 58-60.
[42] Leibovitch I, Kurtz S, Kesler A, et al. C-reactive protein levels in normal tension glaucoma. J Glaucoma. 2005 ; 14 : 384-6.
[43] Lin PW, Friedman M, Lin HC, et al. Normal tension glaucoma in patients with obstructive sleep apnea/hypopnea syndrome. J Glaucoma. 2011 ; 20 : 553-8.
[44] Mojon DS, Hess CW, Goldblum D, et al. Normal-tension glaucoma is associated with sleep apnea syndrome. Ophtalmologica. 2002 ; 216 : 180-4.
[45] Nakagami T, Yamazaki Y, Hayamizu F. Prognostic factors for progression of visual field damage in patients with normal-tension glaucoma. Jpn J Ophthalmol. 2006 ; 50 : 38-43.
[46] Okumura Y, Yuki K, Tsubota K. Low diastolic blood pressure is associated with the progression of normal tension glaucoma. Ophthalmologica. 2012 ; 228 : 36-41.
[47] Pakravan M, Parsa A, Sanagou M, Parsa CF. Central corneal thickness and correlation to optic disc size : a potential link for susceptibility to glaucoma. Br J Ophthalmol. 2007 ; 91 : 26-8.
[48] Park HYL, Jeon SH, Park CK. Enhanced depth imaging detects lamina cribrosa thickness differences in normal tension glaucoma and primary open-angle glaucoma. Ophthalmology. 2012 ; 119 : 10-20.
[49] Ren R, Jonas JB, Wang NL, et al. Cerebrospinal fluid pressure in glaucoma : a prospective study. Ophthalmology. 2010 ; 117 : 259-66.
[50] Renard E, Palombi K, Gronfier C, et al. Twenty-four hour (Nyctohemeral) rhythm of intra ocular pressure in normal-tension glaucoma. Invest Ophthalmol Vis Sci. 2010 ; 51 : 882-9.
[51] Renard JP, Fenolland JR, El Chehab H, et al. Analyse du complexe cellulaire ganglionnaire maculaire (GCC) en tomographie par cohérence optique (SD-OCT) dans le glaucome. J Fr Ophtalmol. 2013, 36 : 299-309.
[52] Shah S, Chatterjee A, Mathai M, et al. Relationship between corneal thickness and measured intraocular pressure in a general ophthalmology clinic. Ophthalmology. 1999 ; 106 : 2154-60.
[53] Shoshani YZ, Harris A, Shoja M, et al. Endothelin and its suspected role in the pathogenesis and possible treatment of glaucoma. Curr Eye Res. 2012 ; 37 : 1-11.
[54] Suh MH, Park KH. Period prevalence and incidence of optic disc hemorrhage in normal tension glaucoma and primary open angle glaucoma. Experiment Ophthalmol. 2011 ; 39 : 513-9.
[55] Sung KR, Cho JW, Lee S, et al. Characteristics of visuel field progression in medically treated normal-tension glaucoma patients with unstable ocular perfusion pressure. Invest Ophthalmol Vis Sci. 2011 : 52 : 737-43.
[56] Suzuki J, Tomidokoro A, Araie M, et al. Visual field damage in normal-tension glaucoma patients with or without ischemic changes in cerebral magnetic resonance imaging. Jpn J Ophthalmol. 2004 ; 48 : 340-4.
[57] Wax M. The case for autoimmuity in glaucoma. Exp Eye Res. 2011 ; 93 : 187-90.
[58] Wostyn P, De Groot V, Van Dam D, et al. Senescent changes in cerebrospinal fluid circulatory physiology and their role in the pathogenesis of normal-tension glaucoma. Am J Ophthalmol. 2013 ; 156 : 5-13.
[59] Yoshida Y, Sugiyama T, Utsunomiya K, et al. A pilot study for the effects of donepezil therapy on cerebral and optic nerve head blood flow, visual field defect in normal-tension glaucoma. J Ocul Pharmacol Ther. 2010 ; 26 : 187-92.
J. Laloum
Un glaucome est à angle fermé ou est mixte, jusqu’à preuve gonioscopique du contraire.
Le cristallin joue un rôle pivot dans les fermetures.
Le risque de fermeture est évolutif et doit donc être régulièrement réévalué.
L’iridotomie périphérique (IP) doit être pratiquée au moindre doute.
Après IP, la gonioscopie systématique vérifie l’ouverture de l’angle.
Les glaucomes mixtes (GM) se définissent par le mécanisme de l’hypertonie lié à la juxtaposition de deux obstacles :
un obstacle prétrabéculaire irien primitif ;
un obstacle trabéculaire, primitif lui aussi, persistant donc malgré la levée du premier obstacle.
La fréquence des glaucomes primitifs par fermeture de l’angle (GPFA), majoritaires en Asie de l’Est, est largement sous-estimée dans les pays occidentaux. Les critères épidémiologiques de séparation d’avec les GPAO sont remis en cause car trop restrictifs, et l’existence de formes frontières est probable. En pratique, qu’il s’agisse de réels GM ou de glaucomes de classification incertaine ne change pas la conduite à tenir.
La persistance d’une hypertension intra-oculaire (HTO) après levée de l’obstacle prétrabéculaire pose des problèmes, surtout nosologiques. La sous-estimation, voire la méconnaissance d’un obstacle prétrabéculaire lors du diagnostic ou de la surveillance d’un GPAO, est en revanche lourde de conséquences. C’est dire que le diagnostic de GPAO doit devenir un diagnostic d’élimination : un obstacle irien prétrabéculaire existe jusqu’à preuve du contraire [22]. Ce risque est évolutif : la gonioscopie doit être pratiquée régulièrement tout au long du suivi des GPAO.
L’écoulement de l’humeur aqueuse de la chambre postérieure au canal de Schlemm rencontre dans le glaucome mixte trois résistances successives, disposées « en série » [16].
Lié à l’étroitesse du chenal situé entre le bord pupillaire et la cristalloïde antérieure, le bloc pupillaire (BP) est toujours présent, sauf chez les pseudo-phakes et certains myopes forts. Il est augmenté par le myosis et l’épaisseur de l’iris. Ce bloc crée un gradient de pression entre les chambres antérieure et postérieure, avec deux conséquences :
l’iris bombe en avant. Cette convexité antérieure dépend du gradient, mais aussi de la taille et de l’antéro-position de la pupille par rapport à la racine de l’iris [28] ;
la PIO mesurée par tonométrie sous-estime la pression à laquelle est soumise la tête du nerf optique.
Cette deuxième résistance répond à deux mécanismes :
une partie de la circonférence trabéculaire fonctionnelle est totalement obstruée par l’iris, en raison de contacts iridotrabéculaires (CIT) complets réversibles et/ou de synéchies antérieures périphériques (SAP) ;
une apposition incomplète de l’iris sur le trabéculum fonctionnel restant pourrait constituer par endroits des chenaux étroits résistifs rendant compte de la corrélation entre l’angle de drainage et la PIO, même en l’absence de fermeture.
Le trabéculum lui-même est le siège d’une résistance pathologique, primitive, identique à celle rencontrée dans les GPAO.
Il s’y ajoute une résistance trabéculaire secondaire à l’obstruction irienne et persistant malgré sa levée ; elle est liée à des modifications histologiques retrouvées à distance des SAP dans les GPFA : fusion des lames trabéculaires [11] et occlusion du canal de Schlemm par atteinte endothéliale [25].
La difficulté de distinguer entre altération primitive et secondaire de la perméabilité trabéculaire explique le statut nosologique particulier de cette affection.
La quasi-totalité des publications sur les fermetures de l’angle concerne les populations d’Asie et d’Inde. La transposition aux populations d’Occident doit être faite avec prudence. Néanmoins, certaines différences sont moins importantes qu’on le pensait il y a peu : la prévalence des GPFA, bien que moindre qu’en Asie, atteint en Europe 0,4 % après 40 ans, et la prédominance des formes chroniques semble une réalité [9].
La classification de l’ISGEO distingue trois stades :
stade 1 : risque de fermeture ;
stade 2 : fermeture de l’angle. Il existe de plus au moins un signe de dysfonctionnement trabéculaire, et l’HTO en fait partie ;
stade 3 : il associe au stade précédent une atteinte glaucomateuse.
Devant un GPAO, un simple risque de fermeture suffit donc pour évoquer l’erreur diagnostique (GPFA) ou le GM.
La notion de « risque de fermeture » joue un rôle pivot dans la distinction entre GPAO et GM/GPFA. Sa définition par l’ISGEO repose sur la gonioscopie statique pratiquée avec une fente lumineuse fine, en position neutre : il y a « risque de fermeture » si le trabéculum fonctionnel est vu sur moins de 90°. L’absence de visibilité peut être seulement liée à la convexité irienne et non à une apposition [14]. Cette définition (trabéculum fonctionnel vu sur moins de 90°) manque une fermeture pathologique (caractérisée par la présence de SAP) sur deux, dans une population de l’Est de l’Asie [8]. Elle est remplacée dans les études récentes par l’absence de visibilité sur moins de 180° [3]. Le critère de Schaffer des 20° (voir encadré) est plus sensible et reste assez spécifique : la prévalence de SAP est alors dix fois supérieure à celle rencontrée dans les angles larges (> 30°) [8].
Ces difficultés épidémiologiques sont essentiellement dues au caractère dynamique des CIT (voir plus loin le diagnostic). Elles recoupent une réalité clinique majeure : un grand nombre de GPAO sont en fait des GPFA, ou bien des glaucomes mixtes.
Dans le cadre des risques isolés de fermeture, l’évolution vers la fermeture est relativement rare. La discussion sur le choix plus ou moins strict des critères de risque de fermeture est donc légitime. En revanche, devant un glaucome, la moindre suspicion de fermeture impose l’IP.
Le glaucome mixte est évoqué dans trois situations différentes :
dans le suivi d’un GPAO, avec l’apparition secondaire d’un risque de fermeture ou d’une fermeture. Cette situation, liée au caractère évolutif avec l’âge des facteurs biométriques de fermeture, passe facilement inaperçue si la gonioscopie n’est pas régulièrement répétée ;
devant une fermeture de l’angle (stade 2), quand il persiste une HTO nécessitant un traitement, malgré une suppression satisfaisante du BP et de l’obstruction prétrabéculaire ;
devant un GPFA (stade 3), l’IP seule ne permet de contrôler la PIO que dans moins d’un cas sur deux [21]. Le diagnostic de glaucome mixte est dans ce cadre beaucoup plus rarement évoqué.
Peu de données sont disponibles. Abrams [1] ne retrouvait que cinq cas sur une série de 1 861 glaucomes. Hyams et al. [13], reprenant une série de patients hypertones pour lesquels une IP avait été pratiquée pour suspicion de GPFA, retrouvaient 2,2 % de glaucomes mixtes diagnostiqués sur une épreuve de provocation, et 1,1 % de GPAO à angle très étroit (grade 1 dans la classification de Schaffer). Une étude sur une population de patients d’origine japonaise retrouve 3 % de GM parmi les glaucomes primitifs [19]. Une étude comparable dans une population d’origine vietnamienne retrouve, au contraire des précédentes, une proportion élevée (13,4 %) de GM [20].
Classification de Schaffer (fig. 13-5)

Note : la classification originelle comportait aussi les structures visibles. Seule la largeur de l’angle en degré reste utilisée en pratique clinique courante(a).
Classification de Spaeth
Elle comporte quatre éléments.
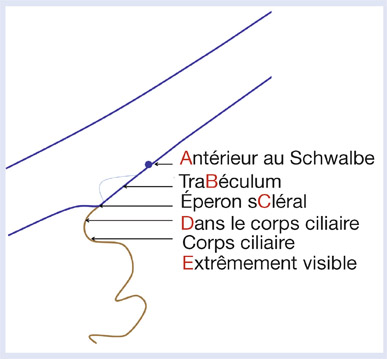
Insertion de l’iris (fig. 13-6)
apparente avant indentation : majuscule entre parenthèses (ABCD), indiquée seulement si elle est différente de l’insertion réelle ;
réelle en majuscule : ABCD, après indentation.
Angle de la classification de Schaffer (voir fig. 13-5)
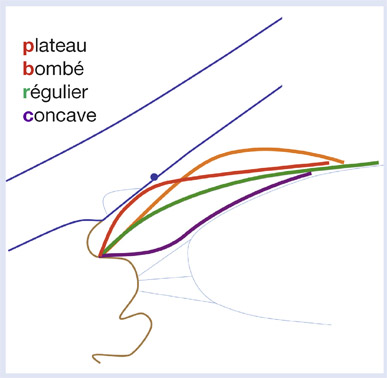
Forme de l’iris : régulière, bombée, plateau, concave (fig. 13-7)
Pigmentation à 12 heures (de 0 à 4+).
Exemple (A)C10b2+ : insertion de l’iris apparente : antérieure au Schwalbe, réelle après indentation : en arrière de l’éperon. Angle de 10° (très étroit). Convexité antérieure de l’iris(b).
L’association GPAO-GPFA caractérisant le GM est généralement supposée fortuite, et sa prévalence est donc estimée par le produit des prévalences de chacun des glaucomes [8]. Une interaction entre les deux affections ne peut cependant être exclue dans certains cas, indiquant une prévalence probablement plus élevée : une fonction trabéculaire à la limite de la normale peut entraîner une hypertonie et un GM quand elle se conjugue à un BP et à une résistance prétrabéculaire eux aussi limites. Une corrélation nette a été démontrée sur des GPAO phakes entre la profondeur de la chambre antérieure en périphérie et la progression du GPAO [18], et une étude sur des glaucomes primitifs a montré une corrélation directe entre l’étroitesse de l’angle et la valeur de la PIO, indépendamment de l’existence d’une fermeture.
Après levée du BP et des obstacles prétrabéculaires iriens complets réversibles, le bilan des résistances résiduelles précise facilement le degré de trabéculum non obstrué par les SAP, mais il est confronté à deux difficultés :
nosologique, car il est impossible de distinguer les défauts de perméabilité trabéculaire primitif et secondaire ;
diagnostique, car la constitution de chenaux résistifs est un phénomène dynamique difficile à évaluer.
C’est dire l’importance devant tout glaucome primitif de vérifier la suppression évaluée dynamiquement de toute obstruction prétrabéculaire réversible, au mieux par une gonioscopie réalisée dans l’obscurité et par un OCT-SD de segment antérieur (Visante™ ± 3D).
L’épaississement du cristallin avec l’âge provoque une antériorisation pupillaire et augmente le BP [9, 28], d’où une accentuation de la convexité irienne qui, chez les sujets prédisposés, ferme l’angle. Une éventuelle laxité zonulaire augmente ce risque. Une surveillance gonioscopique régulière s’impose en cas de GPAO du sujet phake (voir plus loin les éléments du diagnostic de fermeture).
Il existe parfois des éléments de suspicion : femme hypermétrope de plus de 35 ans, notion d’antécédent familial et origine ethnique (Asie de l’Est). En revanche, la symptomatologie de fermeture, plus fréquente en Occident qu’en Asie de l’Est, reste rare et peu spécifique : céphalées péri-orbitaires unilatérales, non pulsatiles, favorisées par l’obscurité ; halos visuels [24].
L’examen de la chambre antérieure recherche des signes d’orientation qui peuvent manquer. La profondeur de la chambre au limbe est appréciée par la méthode de Van Herick : un risque de fermeture existe pour une profondeur inférieure au quart de l’épaisseur cornéenne [6]. Cet examen rapide et sans contact doit être systématique, y compris chez les patients myopes.
On retrouve très rarement des séquelles d’ischémie du segment antérieur liées à une fermeture aiguë spontanément résolutive (correctopie avec atrophie irienne et fibres radiaires spiralées, glaukomflecken).
C’est en fait la gonioscopie, élément systématique du bilan de tout glaucome, qui affirme le diagnostic. Elle recherche :
un risque de fermeture :
CIT ≥ 180°. Le CIT est dynamique et difficile à repérer. Un appui trop fort sur le verre chasse l’humeur aqueuse ou modifie mécaniquement les structures proches du limbe, ouvrant l’angle. Un myosis peut avoir le même effet [10]. Les règles de cette recherche sont donc strictes : elle est pratiquée dans une quasi-obscurité, en utilisant une fente fine qui évite le diaphragme pupillaire. Le patient regarde droit devant, et un léger déplacement du verre permet de passer au-dessus de la « colline irienne ». On précise la hauteur du contact et son étendue en degrés,
une fermeture :
SAP : seule la gonioscopie dynamique permet d’en faire le bilan en les distinguant des CIT, réversibles à l’indentation. On en précise la hauteur et l’étendue, ainsi que le type : S plus fréquent (la synéchie débute près du Schwalbe et peut donner l’impression d’un passage en pont), ou B (l’accolement débute au fond de l’angle : l’iris paraît s’insérer directement sur le dernier élément visible de l’angle), favorisé par les insertions basales de l’iris et impliqué dans les creeping glaucomas (forme insidieuse de glaucome chronique par fermeture progressive et asymptomatique de l’angle). La topographie préférentielle des SAP est, par ordre décroissant, les quadrants supérieur, inférieur, nasal, temporal [14],
amas de pigment stromal irien sur le trabéculum, séquelles d’une fermeture [7, 26].
des éléments d’orientation étiologique, mieux précisés après levée du BP.
Les classifications de l’angle (voir encadré) sont utiles, mais peuvent être remplacées par une simple description de l’angle : structure où s’insère réellement l’iris, forme de l’iris, proximité avec le trabéculum fonctionnel.
Pratiquée au moindre doute, elle visualise les CIT dans chaque quadrant. L’examen est rapide, confortable et possible dans une quasi-obscurité. Il présente toutefois quelques limites :
la visualisation de l’angle est limitée à quelques méridiens. La recherche des CIT et des SAP est donc difficile et leur bilan impossible ;
le corps ciliaire, situé derrière l’épithélium pigmenté de l’iris, n’est pas visualisable.
En revanche, cet examen permet la mesure de paramètres prédictifs, diagnostiques et étiologiques : ouverture de l’angle à 500 µ de l’éperon scléral (AOD 500), lieu théorique du trabéculum fonctionnel, épaisseur de l’iris, flèche irienne, flèche cristallinienne, profondeur et largeur de la chambre antérieure (fig. 13-8 et 13-9) [17].
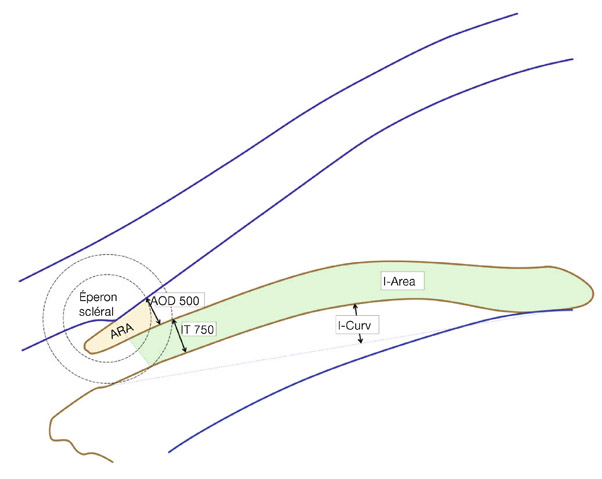
Fig. 13-8 Schéma des principaux paramètres OCT-UBM. ARA : surface du récessus de l’angle ; AOD 500 : ouverture de l’angle à 500 µ de l’éperon ; IT 750 : épaisseur de l’iris à 750 µm de l’éperon ; I-Curv : flèche irienne ; I-Area : surface de la coupe méridienne de l’iris.
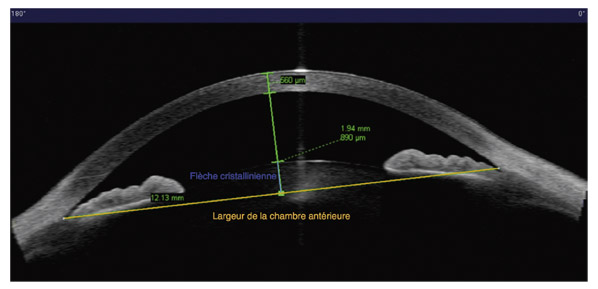
Fig. 13-9 Largeur de la chambre antérieure et flèche cristallinienne (OCT-SA). La largeur de la chambre antérieure est calculée d’éperon à éperon. La distance du sommet du cristallin à la ligne des éperons définit la flèche cristallinienne.
Elle visualise l’angle avec une meilleure résolution et en trois dimensions sur l’ensemble de la circonférence dans les cas favorables (l’examen de l’angle est parfois difficile dans le quadrant supérieur). La visualisation du trabéculum et de l’anneau de Schwalbe est possible [15], mais la distinction CIT et SAP est seulement indirecte (fig. 13-10).
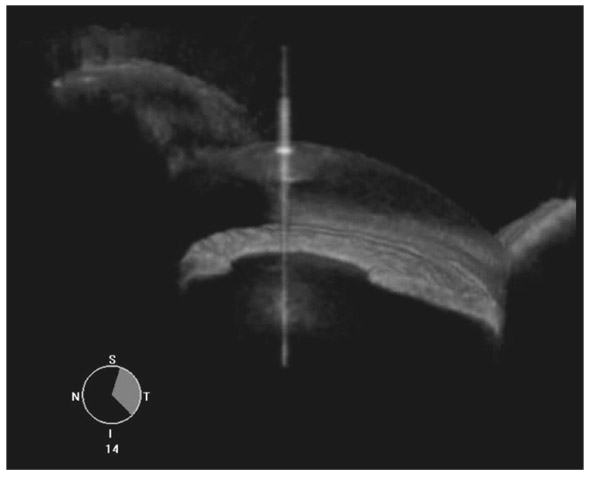
Fig. 13-10 OCT swept-source 3D d’un angle sur une portion de circonférence. La vue de l’angle en 3D peut améliorer l’évaluation des résistances prétrabéculaires dynamiques.
Elle visualise les CIT de façon comparable à la gonioscopie, à condition de la pratiquer dans une quasi-obscurité comparable. Son intérêt par rapport à la gonioscopie et à l’OCT est la visualisation des structures rétro-iriennes. Cet examen n’est pas indispensable pour cette étape diagnostique (fig. 13-11).
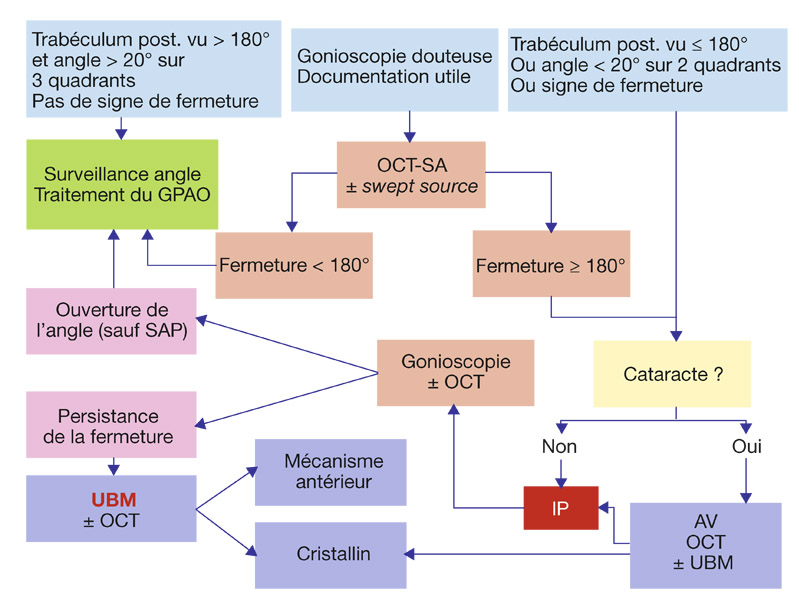
Fig. 13-11 Algorithme diagnostique.
À l’issue de ce bilan où la gonioscopie garde une place centrale, le diagnostic de suspicion de fermeture de l’angle suffit dans ce cadre particulier de glaucome ou de suspicion de glaucome pour imposer la levée du BP. Même si d’autres mécanismes interviennent, le BP est généralement prépondérant, et l’IP le traitement le plus simple en l’absence de cataracte. C’est donc seulement si la fermeture persiste après l’IP que la recherche des autres mécanismes, et leur traitement, sont nécessaires. En présence d’une cataracte, suivant l’acuité visuelle et l’importance du facteur cristallinien (voir plus loin), la levée du BP par phako-exérèse (PKE) précoce d’emblée est une option en cours d’évaluation.
Une nouvelle évaluation de l’angle est indispensable. La gonioscopie, éventuellement aidée de l’OCT-SA, vérifie l’efficacité fonctionnelle de l’IP (aplanissement de l’iris) et précise la réouverture de l’angle.
Ces différents mécanismes sont fréquents en Asie du Sud-Est, et souvent associés. Leur diagnostic précis, orienté par la gonioscopie et l’OCT-SA, repose sur la biomicroscopie par ultrasons (UBM).
Les procès ciliaires sont basculés en avant et poussent l’iris contre le trabéculum. La gonioscopie avec indentation dessine un profil irien en double bosse caractéristique (fig. 13-12).
La bosse périphérique correspond aux procès iriens basculés en avant, l’autre bosse au rebord cristallinien. Les CIT sont parfois difficiles à apprécier en raison du caractère abrupt de la gouttière iridotrabéculaire : l’OCT-SA peut être utile pour vérifier le degré d’apposition [12], mais elle ne peut affirmer le mécanisme.
C’est l’UBM qui fait le diagnostic en montrant, sur au moins deux quadrants, quatre signes :
le CIT ;
la bascule antérieure des procès ciliaires ;
l’absence du sulcus ciliaire ;
l’angulation de la racine de l’iris.
Les mêmes signes gonioscopiques et à l’UBM, auxquels s’ajoute la faible convexité irienne, font porter avant IP le diagnostic, assez fréquent, de configuration iris plateau (fig. 13-13). Le syndrome d’iris plateau, beaucoup plus rare, se définit par la persistance après IP des CIT.
La classification de Ritch précise la hauteur d’apposition de l’iris. Quand persiste un doute, l’épreuve de provocation à la phényléphrine (mesure de l’élévation pressionnelle 30 minutes et une heure après instillation de phényléphrine 5 %) peut être utile en évaluant le retentissement pressionnel de l’obstruction. Ce retentissement dépend du caractère plus ou moins complet de l’obstruction, mais aussi de son étendue.

Fig. 13-12 Iris plateau à la gonioscopie. L’indentation montre un profil irien en double bosse.
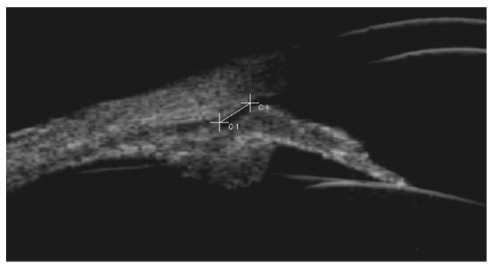
Fig. 13-13 Iris plateau à l’UBM. Les principaux critères sont l’antéro-position des procès ciliaires et l’absence de sulcus. (Cliché : Olivier Bergès.).
Ce mécanisme est distinct de l’iris plateau : l’iris, inséré à la base du corps ciliaire, s’accole d’abord au fond de l’angle. Les SAP éventuelles sont généralement de type B (eFig. 13-1).
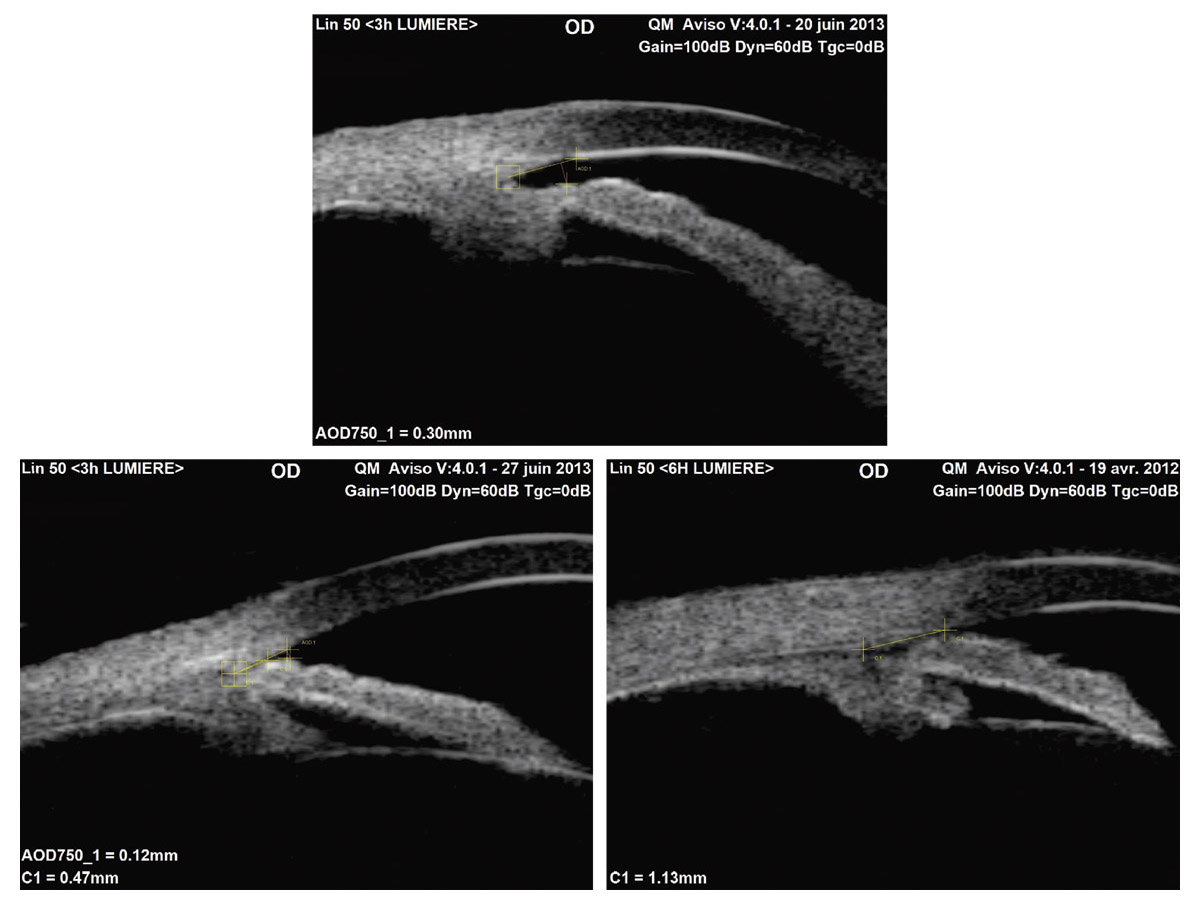
eFig. 13-1 Trois images UBM illustrant une insertion ciliaire basale (a), médiane (b) et distale (c) de l’iris. (Cliché : docteur Olivier Bergès.)
Le pli irien périphérique peut, par son seul volume, obstruer l’angle [12]. L’épaisseur de l’iris, plus importante dans la population chinoise, est corrélée au risque de fermeture. L’OCT-SA permet la mesure des paramètres iriens utiles [29] (voir plus haut). Il a, par ailleurs, montré le rôle des variations du volume irien dans certaines fermetures [2].
Le cristallin joue un rôle pivot dans la fermeture de l’angle. L’antéro-position, progressive avec l’âge, de la cristalloïde antérieure accentue la fermeture par BP (voir plus haut). Elle peut, malgré la levée du BP par IP, plaquer directement la périphérie de l’iris contre le trabéculum. La gonioscopie montre une déformation évocatrice de l’iris en volcan. L’UBM apprécie la participation éventuelle de mécanismes antérieurs (iris plateau, insertion basale de l’iris, iris épais). L’OCT-SA mesure la flèche cristallinienne (voir plus haut), qui semble le meilleur facteur prédictif de l’efficacité de la phako-exérèse sur la réouverture de l’angle. Pratiquée après IP, elle ouvre l’angle de 12,4° en moyenne et entraîne une baisse pressionnelle d’autant plus importante que l’angle était étroit [23].
Beaucoup plus rarement, un cristallin intumescent provoque une fermeture complète de l’angle (glaucome phakomorphique).
En l’absence de CIT après levée du BP (il s’agit alors d’un BP pur, cas le plus fréquent en Europe), ou sinon après traitement des mécanismes associés, le diagnostic de GM est évoqué s’il persiste une HTO que n’explique pas l’étendue de la fermeture séquellaire (moins de 180°), ni une fermeture relative, dont la recherche doit être poursuivie régulièrement chez les sujets phakes. Que l’obstacle trabéculaire soit primitif ou secondaire à l’obstruction prétrabéculaire pose un problème nosologique, mais ne modifie pas la conduite à tenir. En revanche, la persistance ou l’apparition d’une résistance prétrabéculaire résiduelle relative, doit faire envisager l’indication d’une PKE.
Le glaucome mixte est une entité nosologique difficile à individualiser, mais c’est une raison supplémentaire pour renverser la charge de la preuve lors du diagnostic, puis de la surveillance d’un GPAO : il existe un élément de fermeture jusqu’à preuve du contraire [22]. Les progrès des examens complémentaires permettent de mettre en évidence les facteurs biométriques prédictifs de fermeture les plus pertinents, de visualiser dynamiquement les fermetures et d’en préciser l’étiologie. Toutefois, la recherche d’un obstacle en amont d’un trabéculum primitivement pathologique repose d’abord sur la clinique, et la gonioscopie reste irremplaçable [27].
Retenir
Un GPAO peut évoluer secondairement vers la fermeture.
La recherche gonioscopique d’une fermeture se fait sur un œil en mydriase scotopique.
La gonioscopie avec indentation permet de distinguer CIT et SAP.
Une réouverture insuffisante de l’angle après IP nécessite un bilan étiologique.
L’appréciation du facteur cristallinien est une des étapes clés du bilan de la fermeture.
[1] Abrams JD. Mixed glaucoma. Br J Ophthalmol. 1961 ; 45 : 503-10.
[2] Aptel F, Denis P. Optical coherence tomography quantitative analysis of iris volume changes after pharmacologic mydriasis. Ophthalmology. 2010 ; 117 : 3-10.
[3] Barkana Y, Dekel I, Goldich Y, et al. Angle closure in Caucasians – a pilot, general ophthalmology clinic-based study. J Glaucoma. 2011 ; 21 : 337-41.
[4] Foster PJ, Aung T, Nolan WP, et al. Defining “occludable” angles in population surveys : drainage angle width, peripheral anterior synechiae, and glaucomatous optic neuropathy in east Asian people. Br J Ophthalmol. 2004 ; 88 : 486-90.
[5] Foster PJ, Buhrmann R, Quigley HA, Johnson GJ. The definition and classification of glaucoma in prevalence surveys. Br J Ophthalmol. 2002 ; 86 : 238-42.
[6] Foster PJ, Devereux JG, Alsbirk PH, et al. Detection of gonioscopically occludable angles and primary angle closure glaucoma by estimation of limbal chamber depth in Asians : modified grading scheme. Br J Ophthalmol. 2000 ; 84 : 186-92.
[7] Foster PJ, Gazzard G, Garway-Heath T, Ritch R. Pattern of trabecular surface pigment deposition in primary angle closure. Arch Ophthalmol. 2006 ; 124 : 1062.
[8] Foster PJ. Defining “occludable” angles in population surveys : drainage angle width, peripheral anterior synechiae, and glaucomatous optic neuropathy in east Asian people. Br J Ophthalmol. 2004 ; 88 : 486-90.
[9] Friedman DS, Foster PJ, Aung T, He M. Angle closure and angle-closure glaucoma : what we are doing now and what we will be doing in the future. Clin Exp Ophthalmol. 2012 ; 40 : 381-7.
[10] Gazzard G, Foster P, Friedman D, et al. Light to dark physiological variation in irido-trabecular angle width. Br J Ophthalmol. 2004.
[11] Hamanaka T, Kasahara K, Takemura T. Histopathology of the trabecular meshwork and Schlemm’s canal in primary angle-closure glaucoma. Invest Ophthalmol Vis Sci. 2011 ; 52 : 8849-61.
[12] He M, Foster PJ, Johnson GJ, Khaw PT. Angle-closure glaucoma in East Asian and European people. Different diseases ? Eye (London). 2006 ; 20 : 3-12.
[13] Hyams SW, Keroub C, Pokotilo E. Mixed glaucoma. Br J Ophthalmol. 1977 ; 61 : 105-6.
[14] Kong X, Foster PJ, Huang Q, et al. Appositional closure identified by ultrasound biomicroscopy in population-based primary angle-closure glaucoma suspects : the Liwan eye study. Invest Ophthalmol Vis Sci. 2011 ; 52 : 3970-5.
[15] Leung CKS, Weinreb RN. Anterior chamber angle imaging with optical coherence tomography. Eye (London). 2011 ; 25 : 261-7.
[16] Ng WT, Morgan W. Mechanisms and treatment of primary angle closure : a review. Clin Exp Ophthalmol. 2011 ; 40 : e218-28.
[17] Nongpiur ME, Haaland B, Friedman DS, et al. Classification algorithms based on anterior segment optical coherence tomography measurements for detection of angle closure. Ophthalmology. 2013 ; 120 : 48-54.
[18] Pan Z, Furuya T, Kashiwagi K. Longitudinal changes in anterior chamber configuration in eyes with open-angle glaucoma and associated factors. J Glaucoma. 2011 ; 21 : 296-301.
[19] Pekmezci M, Vo B, Lim AK, et al. The characteristics of glaucoma in Japanese Americans. Arch Ophthalmol. 2009 ; 127 : 167-71.
[20] Peng PH, Manivanh R, Nguyen N, et al. Glaucoma and clinical characteristics in Vietnamese Americans. Curr Eye Res. 2011 ; 36 : 733-8.
[21] Peng PH, Nguyen H, Lin HS, et al. Long-term outcomes of laser iridotomy in Vietnamese patients with primary angle closure. Br J Ophthalmol. 2011 ; 95 : 1207-11.
[22] Ritch R, Nolan W, Lam D. Laser and medical treatment of primary angle closure glaucoma. In : Weinreb RN, Friedman D (eds). Angle closure and angle closure glaucoma : reports and consensus statements of the 3rd Global AIGS Consensus Meeting on Angle Closure Glaucoma. The Hague, The Netherlands, Kugler Publications, 2006.
[23] Shams PN, Foster PJ. Clinical outcomes after lens extraction for visually significant cataract in eyes with primary angle closure. J Glaucoma. 2011 ; 21 : 545-50.
[24] Shindler KS, Sankar PS, Volpe NJ, Piltz-Seymour JR. Intermittent headaches as the presenting sign of subacute angle-closure glaucoma. Neurology. 2005 ; 65 : 757-8.
[25] Sihota R, Lakshmaiah NC, Walia KB, et al. The trabecular meshwork in acute and chronic angle closure glaucoma. Indian J Ophthalmol. 2001 ; 49 : 255-9.
[26] Sihota R. Classification of primary angle closure disease. Curr Opin Ophthalmol. 2011 ; 22 : 87-95.
[27] Smith SD, Singh K, Lin SC, et al. Evaluation of the anterior chamber angle in glaucoma : a report by the American Academy of Ophthalmology. Ophthalmology. 2013 ; 120 : 1985-97.
[28] Tiedeman JS. A physical analysis of the factors that determine the contour of the iris. Am J Ophthalmol. 1991 ; 111 : 338-43.
[29] Wang B, Sakata LM, Friedman DS, et al. Quantitative iris parameters and association with narrow angles. Ophthalmology. 2010 ; 117 : 11-7.
F. Valtot
La possibilité qu’un glaucome primitif à angle ouvert (GPAO) soit strictement unilatéral reste controversée.
Cette situation est le plus souvent transitoire, mais elle peut durer.
Les autres causes de glaucome unilatéral doivent donc être systématiquement recherchées.
Duke Elder disait que « l’œil glaucomateux est un œil malade dans un corps malade ». Drance écrivait en 2005 que « le glaucome est une maladie multifactorielle dans laquelle l’hypertension intra-oculaire est un facteur causal important, dose-dépendant, mais ce n’est pas le seul » [7]. Nul ne sait si l’hypertension intra-oculaire (HTO) isolément (jusqu’à un certain niveau évidemment, estimé à 40 mmHg par Spaeth) peut suffire, car on connaît l’existence de nombreux autres facteurs de risque. Si certains sont locaux la plupart sont généraux et interfèrent sur l’évolution de la neuropathie. On imagine difficilement qu’ils aient un effet limité sur un seul des deux yeux.
Le GPAO est défini comme une neuropathie optique progressive associée :
à des modifications caractéristiques, évolutives, de la tête du nerf optique, des fibres nerveuses rétiniennes (FNR) et des cellules ganglionnaires ;
à des altérations spécifiques du champ visuel également progressives.
Le diagnostic n’est certain qu’avec la preuve de l’évolution de la pathologie dans le temps.
En 1972, Étienne [10] a publié les résultats d’une étude portant sur 1 373 patients glaucomateux examinés l’année précédente à Lyon : 289 yeux, soit 21 %, avaient un glaucome unilatéral d’origine variée. Seuls 33 patients semblaient avoir un GPAO unilatéral, soit 2,40 %. Drance en 1968 [9] était arrivé aux mêmes chiffres. Comme Drance, Étienne trouvait dans le groupe des yeux adelphes de GPAO apparemment unilatéral un certain nombre d’HTO : seuls 21 % de ces yeux avaient une PIO inférieure à 22 mmHg dans l’étude de Drance. Cependant, Étienne avait 19 yeux sur 33, soit 57 %, qui avaient une courbe nycthémérale ne dépassant pas 23 mmHg, des papilles jugées normales et des champs visuels (Goldmann) normaux. Toutefois, une tonographie pratiquée systématiquement avait montré une valeur anormale de la facilité d’écoulement, et le test à la dexaméthasone – quand il pouvait être fait – était toujours positif sur ces yeux normotones. Étienne considérait que ces yeux étaient donc des glaucomes en devenir et concluait que le GPAO unilatéral est une situation transitoire. Pour lui, ces cas « unilatéraux » n’étaient en fait dus qu’à un décalage dans le temps de l’évolution des deux yeux. À cette époque, la périmétrie automatisée n’était pas encore pratiquée et il n’y avait pas d’OCT. On peut logiquement penser que ces tests auraient, aujourd’hui, dépisté des anomalies. De même, des examens modernes de la papille, des FNR et des cellules ganglionnaires ne seraient pas restés muets et auraient sans doute permis de dépister des signes très précoces de glaucome sur ces yeux.
De nombreux cliniciens, dont Béchetoille [1], pensent aussi que cette affection est bilatérale, mais asymétrique. Cette asymétrie est souvent providentielle pour le patient, puisqu’elle permet de découvrir un glaucome déjà évolué d’un côté, alors que l’autre œil est à un stade bien moins avancé que l’autre œil. La cause de cette asymétrie est totalement inconnue et ne semble pas avoir provoqué l’intérêt ou la curiosité des glaucomatologues modernes. Elle est pourtant difficilement explicable lorsque la réfraction, l’épaisseur de la cornée ou l’absence d’anomalie circulatoire unilatérale ne peuvent pas justifier le sort différent des deux yeux. Quelquefois, la responsabilité d’une HTO unilatérale plus forte peut être incriminée. Cependant, l’absence d’argument devant cette asymétrie d’évolution entre les deux yeux est fréquente.
Quoi qu’il en soit, Étienne retenait de son étude que 95 % environ des glaucomes unilatéraux étaient des glaucomes secondaires ou des glaucomes par fermeture de l’angle. Il avait conclu que, jusqu’à preuve du contraire, le GPAO unilatéral n’existait pas. L’atteinte de l’autre œil était programmée et surviendrait tôt ou tard. Pour des raisons inconnues (peut-être immunitaires), elle n’était que retardée dans le temps d’un côté. Il fallait en prévenir le patient (surtout s’il avait été opéré du premier œil avec succès, et se croyait guéri), et le surveiller à vie [11].
Le glaucome à pression normale (GPN) n’est pas différent du GPAO, sinon qu’il est souvent associé à une cornée fine [5] et à une pression intra-oculaire (PIO) dans les limites statistiquement normales [15]. La PIO doit avoir été contrôlée à un niveau constamment inférieur à 22 mmHg sans traitement, si possible sur plusieurs courbes nycthémérales [6] pour entrer dans la définition classique. La Collaborative Normal-Tension Glaucoma Study (CNTGS) publiée en 1998, sous la direction de Drance et Anderson, acceptait des PIO allant jusqu’à 24 mmHg. Cependant, il n’est pas rare de remettre en cause ce diagnostic, parfois après plusieurs années, par la découverte inopinée d’une HTO [12, 29], si bien que Nicolela [23] considère que le GPN ne diffère du GPAO que par le fait que la PIO y est éminemment variable. Le patient peut être vu de nombreuses fois sans que l’on détecte une HTO fugace. Il faut aussi souligner que la PIO nocturne est rarement mesurée et, quand elle l’est, sauf dans de rares cas, elle n’est pas mesurée en position couchée, alors qu’elle est plus forte que sur un sujet assis [19]. Levene en 1980 relevait parmi les particularités du GPN – par rapport au GPAO – une plus grande fréquence de cas unilatéraux [17]. Cela peut s’expliquer d’abord par le fait que cette pathologie évolue plus lentement que le GPAO : sur des sujets non traités, seuls 10 % des yeux évoluent en un an et 30 à 50 % des yeux n’évoluent pas pendant cinq ans [22], si bien que la conversion du second œil mettra plus de temps à s’installer. Comme dans le GPAO, la majorité des cas est bilatérale et asymétrique. D’ailleurs, il a été démontré dans ces cas que l’œil le plus atteint est celui qui a la PIO la plus élevée [4].
Il existe une seconde raison à cette fréquence atypique de GPN unilatéraux trouvés par Levene : c’est sans doute chez les patients étiquetés GPN que l’on trouve le plus d’erreurs de diagnostic. Privé de la notion d’HTO en présence d’une papille asymétrique, pâle et/ou excavée, associée à un champ visuel perturbé, l’ophtalmologiste aura tendance à poser le diagnostic de glaucome sans tension sans toujours aller plus loin. Hitchings [15] notait avec pertinence qu’on devrait, avant de poser le diagnostic de GPN (particulièrement s’il est unilatéral), toujours vérifier qu’il n’y a pas d’autre cause possible de l’atteinte du champ visuel et de la papille. Si la plupart des cas douteux ne résistent pas à un bon examen clinique, la difficulté majeure réside dans les associations.
Drance lui-même rapportait le cas [8] d’une femme de 55 ans présentant une grande excavation bilatérale, avec une papille gauche plus excavée, surtout en bas, avec une encoche de la margelle. Il y avait au champ visuel une encoche nasale supérieure et un scotome arciforme paracentral supérieur correspondant parfaitement à l’atteinte anatomique. L’autre œil était normal. La PIO des deux côtés était à 16 mmHg et le diagnostic de glaucome sans tension aurait pu être porté si d’autres investigations n’avaient découvert une sténose carotidienne gauche qui fut opérée. La patiente suivie 20 ans par Drance ne montra aucune progression. Toutefois, il s’interrogeait sur l’avenir de cette patiente si elle n’avait pas été explorée correctement, ou si elle avait eu le malheur que sa PIO ait été à 30 mmHg.
Cette pathologie dite « non artéritique » provoque en général une pâleur du disque sans excavation, associée à une atteinte rétinotopique du champ visuel non évolutive. Y sont associés une baisse de l’acuité visuelle et un trouble de la vision des couleurs.
Ils sont accompagnés de grandes excavations. Ils sont en général bilatéraux, mais peuvent être unilatéraux, surtout s’ils sont associés à une myopie. Ils représentent alors une source d’erreur de diagnostic fréquente.
Elle est quelquefois unilatérale, et les anomalies de la papille associées à des altérations du champ visuel sont très difficiles à distinguer de celles d’un GPN.
Là encore, une dysversion très marquée, dite en gueule de four, représente une difficulté majeure, surtout si elle est unilatérale : le bord neurorétinien disparaît sur la moitié de la circonférence, et elle s’associe à des anomalies du champ visuel. La dysversion est souvent associée à un astigmatisme et les anomalies du champ visuel ne sont pas évolutives.
Les drusen posent le même type de problème, d’autant qu’elles empêchent la constitution d’une excavation ou la remplissent [30].
L’absence de soudure fœtale in utero entraîne la formation d’une grande papille malformée. L’association à un colobome irien ou choroïdien, ou à la présence vaisseaux ciliaires nombreux, rend le diagnostic facile lorsqu’elle existe.
La présence de zones de faiblesse de la lame criblée en temporal est en général congénitale. Elle est souvent accompagnée d’une baisse d’acuité due à une atteinte associée de la rétine.
Il s’agit d’un disque beaucoup plus large que la normale et excavé. Un tissu « glial » blanc ou gris, entouré d’un anneau de tissu irrégulièrement pigmenté occupe le centre du disque. Les vaisseaux semblent sortir de la périphérie de la papille [2].
Dans certaines neuropathies, une excavation (associée à une pâleur) peut exister, ce qui risque bien sûr d’en imposer pour un glaucome. Les principales causes d’excavation non glaucomateuse [18] sont :
l’artérite temporale (neuropathie optique antérieure ischémique artéritique), dite artérite à cellules géantes ou maladie de Horton ; la compression (tumeur, anévrisme, hématome) ou la section du nerf optique ;
certaines intoxications ;
un choc hémorragique ;
l’atrophie optique de Kjer (neuropathie héréditaire autosomique dominante).
Dans ces trois derniers cas, l’atteinte est bilatérale, mais peut être asymétrique. Il existe des signes qui aident à faire la différence entre une excavation glaucomateuse et celle qui serait due à une autre neuropathie :
une atteinte de la vision des couleurs d’axe rouge-vert précoce est fréquente dans les neuropathies non glaucomateuses. En cas de glaucome, elle est d’axe bleu-jaune ;
la baisse d’acuité est précoce et quasi constante dans les neuropathies, alors qu’elle n’existe dans le glaucome qu’au stade agonique.
Son expression clinique est typiquement bilatérale, quelquefois unilatérale au début, rarement accompagnée d’excavation. Cependant, une atrophie survenant sur une grande papille ayant une grande excavation peut ressembler à un glaucome. Dans ce cas, l’atteinte du champ visuel ne respecte pas le méridien horizontal et l’atrophie (pâleur) « déborde » sur le bord neurorétinien. Il n’est pas rare que l’IRM découvre un méningiome chez des patients relativement âgés, qui sont aussi ceux qui ont des glaucomes sans tension.
Une neuro-imagerie est demandée pour les patients soupçonnés de glaucome unilatéral :
ayant une pâleur du bord neurorétinien ;
et/ou ayant un champ visuel respectant la limite verticale et non la limite horizontale ;
ou ayant un scotome central ;
ou ayant une anomalie de la vision des couleurs d’axe rouge-vert et une baisse d’acuité visuelle.
Certaines affections rétiniennes entraînent une atteinte du champ visuel unilatérale qui ressemble à celle du glaucome. Elle peut être évolutive (rétinoschisis, occlusion vasculaire) ou faussement évolutive (cicatrices de toxoplasmose) à cause des fluctuations des réponses des patients. Les nerfs optiques sont normaux (eCas clinique 13-1). Toutefois les patients peuvent avoir une hypertonie associée qui jette le trouble.
Madame C., 58 ans, est inquiète car sa soeur vient d’être opérée d’un glaucome. Sa grand-mère est morte aveugle sans que l’on sache pourquoi. Elle consulte son ophtalmologiste qui trouve un tonus à 16 mmHg et une pachymétrie à 510 microns des deux côtés. Il demande un champ visuel qui est normal à droite et présente une encoche nasale typique à gauche. Il diagnostique un glaucome à pression normale unilatéral et la met sous traitement. Elle consulte pour confirmation.
L’examen du fond d’œil montre des papilles normales et symétriques. L’examen du fond d’œil au rétinographe non mydriatique montre un volumineux foyer de choroïdite ancien du côté gauche expliquant l’atteinte du champ visuel (elle n’en avait pas connaissance). Tous les examens ont confirmé l’absence de glaucome des deux côtés et le traitement a été arrêté.
Certains yeux ont une authentique excavation glaucomateuse unilatérale, avec une atteinte du champ visuel parfaitement concordante. Aucune HTO n’est retrouvée. Le suivi montre que ni l’excavation, ni le champ visuel n’évoluent. Il s’agit de véritables glaucomes, dits éteints (voir chapitre 14-III). Les sujets ont souffert d’HTO pendant un certain temps, puis cette dernière a disparu, mais a laissé des séquelles : une papille excavée et un champ visuel altéré mais stable. C’est l’interrogatoire qui va faire le diagnostic de la cause :
un traumatisme ancien. Quelquefois oublié par un patient négligent, il a pu entraîner une forte HTO qui a disparu en laissant une excavation, une atteinte campimétrique et parfois de modestes séquelles anatomiques, comme une rupture du sphincter de l’iris ou une récession angulaire localisée ;
un glaucome cortisonique. Le patient reconnaît avoir utilisé pendant des années une pommade à la dexaméthasone prescrite par un généraliste et renouvelée par le pharmacien, par exemple pour supporter une lentille unilatérale ou blanchir un œil rouge inesthétique. Puis le patient a cessé cette pratique et a quelquefois la chance que la PIO revienne à la normale. Une application prolongée sur un seul œil, particulièrement chez les enfants [16], peut provoquer un vrai glaucome ;
des crises glaucomato-cyclitiques. Ces crises se répètent pendant quelques années, l’œil étant parfaitement normotone entre les crises. Elles ont tendance à s’espacer, puis disparaître avec l’âge. L’atteinte est le plus souvent unilatérale. L’évolution peut cesser en laissant sur la papille et le champ visuel des séquelles qui n’évoluent plus. Quelquefois, cependant, il y a conversion en GPAO.
des épisodes fugaces d’uvéite hypertensive. Celles-ci ont duré quelques années et ont cessé ;
un glaucome pigmentaire « refroidi ». La dispersion pigmentaire est en général bilatérale, mais souvent asymétrique. La conversion en glaucome peut n’être qu’unilatérale à cause de prédispositions anatomiques particulières dont la principale est la myopie, plus importante d’un côté. La dispersion pigmentaire a tendance à s’atténuer, voire à disparaître à partir de la 5e décennie de la vie. Si les capacités de phagocytose du trabéculum ne sont pas épuisées, les cellules trabéculaires « nettoient » l’angle et la PIO peut se normaliser. Cependant, 30 ans de forte HTO ont laissé des traces indélébiles sur la papille et le champ visuel. Pour Tello et al. [32], le signe pathognomonique de la dispersion pigmentaire causale est la présence résiduelle de pigment dans l’angle supérieur, alors que l’angle inférieur est moins ou pas pigmenté. Ce seul signe, pour lui, permet de faire la différence entre un glaucome pigmentaire refroidi et un glaucome à pression normale.
Que ces glaucomes soient liés uniquement à un blocage pupillaire ou qu’il y ait la participation d’un iris plateau, ils sont bilatéraux à terme, sauf s’il y a une différence de réfraction entre les deux yeux. La crise de glaucome par fermeture de l’angle est le plus souvent unilatérale, mais une enquête [3] évoque une bilatéralisation d’emblée dans 17 % des cas, et le risque de bilatéralisation est estimé à 75 % en l’absence de mesures préventives [20]. Les glaucomes chroniques par fermeture de l’angle, souvent asymptomatiques, sont quelquefois unilatéraux au début de la maladie, mais ils se bilatéralisent, à tel point qu’ils ont été responsables de la cécité complète de plus d’un million de chinois en 2001 [13].
L’affection est bilatérale dans 65 à 80 % des cas, mais elle est rarement symétrique [2]. Il a été décrit des cas unilatéraux mais l’apparition plus tard d’un glaucome juvénile, voire d’un GPAO à l’âge adulte sur l’œil non atteint, n’est pas exceptionnelle.
C’est dans ce groupe que se rencontrent la plupart des glaucomes unilatéraux.
C’est le glaucome secondaire le plus répandu (25 % des glaucomes à angle ouvert dans le monde) [26].
Le syndrome exfoliatif et le glaucome exfoliatif sont souvent cliniquement unilatéraux pendant quelques années. Cependant, l’œil adelphe d’un glaucome exfoliatif unilatéral apparemment sain est déjà histologiquement encombré de matériel exfoliatif. Cela peut être facilement vérifié sur des biopsies conjonctivales. De fait, si deux tiers des glaucomes exfoliatifs sont unilatéraux pour une raison inconnue lors de leur découverte [28], en dix ans, un tiers de ceux-ci deviennent bilatéraux [25].
Le glaucome pigmentaire est dû à l’HTO secondaire à l’envahissement des structures trabéculaires par le pigment libéré dans l’humeur aqueuse à partir de l’épithélium postérieur de l’iris agressé par les frottements. On a vu que cette dispersion pigmentaire peut être asymétrique, surtout si la myopie est asymétrique (l’œil le plus myope étant le plus atteint). Il s’ensuit une HTO variable et la possibilité d’une conversion vers le glaucome qui est parfois unilatéral et le reste. Car, à la différence du matériel exfoliatif qui est fabriqué tout au long de la vie, la libération du pigment diminue et disparaît souvent à la soixantaine, si bien que le second œil ne se convertit pas toujours. Cela dit, la dispersion et le glaucome pigmentaires étant dans la majorité des cas bilatéraux, toute atteinte unilatérale doit entraîner un examen particulièrement minutieux à la recherche d’une autre cause de dispersion pigmentaire secondaire, comme les mélanomes de l’uvée (à noter que, dans ces circonstances, on ne trouve ni fuseau de Krükenberg, ni zones de transillumination de l’iris). Une autre cause de glaucome pigmentaire secondaire unilatéral est le frottement d’un implant de chambre postérieure mal positionné, d’un implant réfractif sur un œil phake ou d’une implantation piggyback sur un œil aphake.
La contusion oculaire est une cause fréquente de consultation aux urgences hospitalières. La majorité des consultants est constituée de jeunes hommes de moins de 30 ans. Les enfants représentent 27 à 48 % des cas au Royaume-Uni [21]. Cela explique que, passée la phase aiguë qui est traitée, les patients oublient l’épisode. Apparemment, tout est rentré dans l’ordre et ils peuvent rester des dizaines d’années sans consulter. Or 4 à 9 % des sujets porteurs d’une récession traumatique de l’angle supérieure à 180° développent un glaucome qui évolue silencieusement. Il faut demander au patient et à sa famille de retrouver le souvenir de l’incident causal. L’examen soigneux de la pupille (rupture du sphincter, mydriase aréflectique), de l’iris (iridodialyse), de l’angle (récession ou cyclodialyse), de la zonule qui peut être partiellement rompue et du cristallin sub-luxé ou taché, permet de confirmer qu’il y a eu traumatisme. Il ne faut pas oublier d’examiner l’autre œil où il n’est pas rare de découvrir une HTO ou un glaucome. L’explication avancée est que si le glaucome survient sur certains yeux contus et pas sur tous, c’est parce qu’ils étaient déjà prédisposés et que le traumatisme n’a fait qu’avancer le déclenchement de la pathologie. Les plaies pénétrantes sont en général mieux suivies, encore qu’il faille toujours penser à vérifier l’absence de corps étranger méconnu en cas d’HTO.
Ils sont dus selon Ritch et al. [27] à des causes très diverses, qui sont le plus souvent responsables de fermeture de l’angle unilatérale (voir chapitre 14-VI). Ils ne peuvent qu’exceptionnellement poser des problèmes diagnostiques avec le GPAO (kystes ciliaires, cerclage chirurgical, tumeurs du segment postérieur, etc.).
L’iris plateau est bilatéral et responsable de glaucomes bilatéraux, souvent asymétriques.
Ils sont unilatéraux, plus fréquents chez les femmes, et se développent typiquement entre 40 et 50 ans. Ils sont dus à une anomalie de l’endothélium cornéen conduisant à une atrophie de l’iris, un œdème cornéen et une fermeture de l’angle par des synéchies. Cette entité recouvre trois maladies : l’atrophie essentielle de l’iris, le syndrome de Chandler et le syndrome de Cogan-Reese. Ils ne doivent pas être confondus avec l’invasion épithéliale post-traumatique ou chirurgicale, qui peut aussi entraîner un glaucome unilatéral. Un examen de l’endothélium en microscopie spéculaire montre en cas de syndrome irido-cornéo-endothéliaux (ICE) un aspect typique pathologique, pauci-cellulaire, avec des cellules pléomorphiques.
Dix à vingt pour cent des uvéites s’accompagnent de glaucome [14]. Ces glaucomes frappant souvent des sujets jeunes sont graves, car liés à des épisodes de très forte HTO dus à l’atteinte trabéculaire, puis à une HTO permanente après l’apparition de goniosynéchies. Ils peuvent aussi être aggravés par l’utilisation des corticoïdes nécessaires au traitement de l’inflammation.
Il provoque des crises brutales d’HTO très forte, sur un œil calme, chez un sujet jeune. L’apparition de précipités descemétiques est décalée de 24 à 48 heures. L’angle est ouvert et il n’y a jamais de goniosynéchies. Les crises sont récidivantes et guérissent sans séquelles, diminuant en fréquence avec l’âge, puis disparaissant. Si elles sont très fréquentes, elles peuvent aboutir à un vrai glaucome.
Environ 25 % des cyclites de Fuchs s’accompagnent de glaucome. Il s’agit là encore de sujets jeunes dont l’œil est calme, mais dont l’endothélium est couvert de précipités blancs. L’angle est ouvert sans goniosynéchies. L’hétérochromie et l’atrophie iriennes, discrètes au début, doivent être recherchées, ainsi que des nodules iriens, une hyalite et des cicatrices choroïdiennes. L’existence d’hyphémas, fréquents au cours de cette affection, peut provoquer des HTO aiguës sur un fond chronique. L’évolution se fait d’un seul tenant et le glaucome s’accompagne d’une cataracte.
La constatation inconstante d’un ulcère herpétique à un moment de l’évolution de l’uvéite hypertensive signe son origine et permet un traitement ciblé qui évite le plus souvent l’évolution de l’HTO vers un vrai glaucome. Elle laisse souvent une atrophie en plaque localisée de l’épithélium irien postérieur, repérable par transillumination.
Typiquement, il s’agit d’un œil hypertone dont les veines épisclérales sont dilatées et tortueuses, avec quelquefois un chémosis et la présence de sang dans le canal de Schlemm. L’amplitude du pouls est majorée lors de la mesure de la tension à l’aplanation. Les causes sont triples [24] :
veineuses : les obstructions veineuses au cours des pathologies thyroïdiennes avec ou sans exophtalmie, le syndrome de la veine cave supérieure, les tumeurs orbitaires, la thrombose du sinus caverneux ;
anomalies artérioveineuses : les fistules carotidocaverneuses traumatiques ou spontanées, les varices de l’orbite ou le syndrome de Sturge-Weber ;
idiopathiques.
Il s’agit d’un glaucome secondaire lié à l’hypoxie rétinienne qui fait suite à une occlusion veineuse rétinienne dans sa forme ischémique (cause la plus fréquente), à une rétinopathie diabétique proliférante, à une sténose carotidienne serrée, à une occlusion artérielle rétinienne, à une tumeur oculaire ou à un décollement de rétine. Des néovaisseaux apparaissent sur l’iris et dans l’angle où ils gênent l’écoulement et provoquent une HTO. Secondairement, une membrane fibrovasculaire ferme complètement l’angle et l’HTO devient majeure et souvent douloureuse. Le diagnostic est évident.
Origine cristallinienne : glaucome phakolytique, glaucome phako-anaphylactique, glaucome dû aux débris cristalliniens intra-oculaires à la suite de chirurgie de la cataracte, de plaie perforante, voire de capsulotomie au laser YAG.
Pathologie rétinovitréenne : le glaucome des cellules fantômes secondaire à une hémorragie du vitré et le syndrome de Schwartz-Matsuo (faisant suite à un décollement de rétine non opéré qui peut aboutir à un glaucome à angle ouvert) sont des causes beaucoup plus rares que les glaucomes induits par les complications de la chirurgie rétinovitréenne.
Tumeurs oculaires : une étude portant sur 2 597 yeux porteurs d’une tumeur oculaire, montre que 5 % de ces yeux ont une HTO lors du diagnostic. Sur le nombre total, 2 111 yeux ont un mélanome de l’uvée et le traitement augmente encore de 3 % le taux d’HTO [31] ; 227 yeux sont porteurs de métastases oculaires. Il faut aussi penser au rétinoblastome qui s’accompagne de 25 à 50 % de glaucome. Tous les processus tumoraux malins (lymphome, leucémie) ou bénins peuvent entraîner un glaucome. Une bonne règle est de toujours penser qu’un glaucome unilatéral peut être dû à une tumeur oculaire et la rechercher (surtout s’il prend le masque d’un glaucome pigmentaire ou d’une uvéite) en faisant pratiquer une échographie.
Glaucomes après chirurgie oculaire : une HTO transitoire est banale après n’importe quel type de chirurgie oculaire. D’autres se prolongent suffisamment pour entraîner un glaucome. La pire éventualité est la survenue sournoise d’une HTO parfois des années après la chirurgie (par exemple après une cataracte congénitale) chez des patients peu ou mal surveillés. Un œil opéré doit faire l’objet d’une surveillance attentive de la PIO et du nerf optique durant toute la vie du patient.
Retenir
Il semble que le GPAO unilatéral n’existe pas.
L’affection est probablement toujours bilatérale, mais peut être très décalée dans le temps d’un œil à l’autre.
Il faut donc surveiller soigneusement le patient jusqu’à l’apparition des symptômes les plus précoces d’entrée dans la maladie du deuxième œil.
Le diagnostic de GPAO est en effet souvent erroné, soit qu’il ne s’agisse pas d’un glaucome mais d’une anomalie anatomique ou d’une atteinte du nerf optique, soit qu’il s’agisse d’un glaucome secondaire à angle ouvert ou d’un glaucome par fermeture primitive ou secondaire de l’angle.
[1] Béchetoille A. Les glaucomes. Angers, éditions Japperenard, 1997, vol. 1 : 221-34.
[2] Béchetoille A. Les glaucomes. Angers, éditions Japperenard, 1997, vol. 1 : 80-81.
[3] Béchetoille A, Carré H. Le déclenchement de la fermeture de l’angle. Bull Mém Soc Fr Ophthalmol. 1977 ; 90 : 91-5.
[4] Cartwrigt MJ, Anderson DR. Correlation of asymmetric damage and asymmetric intraocular pressure in normal-tension glaucoma (low-tension glaucoma). Arch Ophthalmol. 1988 ; 106 : 898-900.
[5] Copt RP, Thomas R, Mermoud A. Corneal thickness in ocular hypertension. Primary open angle glaucoma and normal-tension glaucoma. Arch Ophthalmol. 1999 ; 117 : 14-6.
[6] Demailly P, Lehrer M. Traitement actuel du glaucome primitif à angle ouvert. Paris, Masson, 1989 : 399-413.
[7] Drance SM. Is glaucoma only an eye disease ? In : Answers in glaucoma. Amsterdam, Cultura Médica, 2005 ; 6 : 27-9.
[8] Drance SM. Non glaucomatous cupping of the disc. Glaucomes à pression normale. Angers, éditions Japperenard, 1990 : 105-12.
[9] Drance SM, Wheeler C, Pattullo M. Uniocular open-angle glaucoma. Am J Ophthalmol. 1968 ; 65 : 891-902.
[10] Étienne R. Unilateral glaucoma. Br J Ophthalmol. 1972 ; 56 : 254-8.
[11] Fénolland JR, Giraud JM, Maÿ F, et al. Neuropathie optique glaucomateuse unilatérale atypique chez un sujet jeune. J Fr Ophtalmol. 2010 ; 33 : 206-07.
[12] Fontana L, Poinoosawmy D, Wu J, Hitchings RA. The natural history of intraocular pressure in untreated normal tension glaucoma : a long-term follow-up study. Invest Ophthalmol Vis Sci. 1996 ; 37 : S927.
[13] Foster PJ, Johnson GJ. Glaucoma in China : how big is the problem ? Br J Ophthalmol. 2001 ; 85 : 1277-82.
[14] Herbert HM, Viswanathan A, Jackson H, et al. Risk factors for elevated intraocular pressure in uveitis. J Glaucoma. 2004 ; 46 : 556-62.
[15] Hitchings RA. A practical approach to the management of normal tension glaucoma. Essentials in ophthalmology. Glaucoma. 2004 ; 10 : 147-56.
[16] Lam DSC, Fan DSP, Ng JSK, et al. Ocular hypertensive and anti-inflammatory responses to different dosages of topical dexamethasone in children : a randomized trial. Clin Exp Ophthalmol. 2005 ; 33 : 252-8.
[17] Levene RZ. Low tension glaucoma : a critical review and new material. Surv Ophthalmol. 1980 ; 24 : 621-63.
[18] Levin LA. Glaucoma masquereders. In : Answers in glaucoma. Amsterdam, Cultura Médica, 2005 : 89-90.
[19] Liu JH, Kripke DF, Twa MD, et al. Twenty-four-hour pattern of intraocular pressure in the aging population. Invest Ophthalmol Vis Sci. 1999 ; 40 : 2912-17.
[20] Lowe RF. Acute angle-closure glaucoma. The second eye. An analysis of 200 cas. Br J Ophthalmol. 1962 ; 46 : 641-4.
[21] Mac Ewen CJ. Eye injuries : a prospective survey of 5671 cas. Br J Ophthalmol. 1989 ; 73 : 888-94.
[22] Membrey WL, Poinoosawmy DP, Bunce C, et al. Comparison of visual field progression in patients with normal pressure glaucoma between eyes with and without visual field loss that threatens fixation. Br J Ophthalmol. 2000 ; 84 : 1154-8.
[23] Nicolela MT. How should normal tension glaucoma be managed ? In : Answers in glaucoma. Amsterdam, Cultura Médica, 2005 : 149-52.
[24] Piltz-Seymour J, Uhler TA. Other secondary glaucomas. Glaucoma. 2009 ; 35 : 419-30.
[25] Puska P. Unilateral exfoliation syndrome : conversion to bilateral exfoliation and to glaucoma. A prospective 10-year follow-up study. J Glaucoma. 2002 ; 11 : 517-24.
[26] Ritch R. Exfoliation syndrome-the most common identifiable cause of open-angle glaucoma. J Glaucoma. 1996 ; 3 : 176-8.
[27] Ritch R, Liebmann JM, Tello C. A construct for understanding angle-closure glaucoma : the role of ultrasound biomicroscopy. Ophthalmol Clin North Am. 1995 ; 8 : 281-13.
[28] Schlötzer-Schrehardt U, Naumann GOH. Pseudoexfoliation glaucoma. Essentials in Ophthalmology Glaucoma. 2004 ; 11 : 157-76.
[29] Sellem E. Glaucome primitif à angle ouvert. In : Schnyder C, Mermoud A (eds). Atlas en ophtalmologie. Glaucome. Issy-les-Moulineaux, Elsevier, 2005 : 198-207.
[30] Sellem E. Les vrais et les faux glaucomes unilatéraux de l’adulte. J Fr Ophtalmol. 2010 ; 33 : 268-72.
[31] Shields CL, Shields JA, Shields MB. Prevalence and mechanisms of secondary intraocular pressure elevation in eyes with intraocular tumors. Ophthalmology. 1987 ; 94 : 839-46.
[32] Tello C, Radcliffe N, Ritch R. Pigmentary dispersion syndrome and glaucoma. In : Schacknow PN, Samples JR (eds). The Glaucoma Book. Springer. 2010 ; 38 : 499-505.
A. Lefrancois
La myopie forte est une maladie à potentiel évolutif probablement à support génétique (gène 15q14 ? [13]), avec atteinte spécifique du collagène oculaire.
L’amincissement scléral et choroïdorétinien ainsi que les probables modifications hémodynamiques qui en résultent en font une maladie de la « rigidité oculaire ».
L’évaluation de la pression intra-oculaire (PIO) est ainsi faussée, avec un taux élevé de glaucomes à pression normale (GPN) et une susceptibilité plus forte pour l’atteinte glaucomateuse.
L’âge de survenue du glaucome se situe en règle avant 40 ans en cas de myopie évolutive.
Le diagnostic et le pronostic visuels dépendent surtout de deux facteurs :
le glaucome (difficile à évaluer en raison de la modification des repères anatomiques et des données physiologiques habituels) ;
la rétine périphérique (risque de décollement rétinien) comme postérieure (essentielle à étudier dans la démarche diagnostique et thérapeutique pour la prise en charge du glaucome).
L’association possible des deux pathologies et la durée d’évolution constituent à terme un fort risque de cécité.
La myopie forte correspond à une myopie réfractive inférieure à – 6,00 dioptries ou une longueur axiale oculaire supérieure à 26 mm.
Bien qu’un biais de sélection ait pu être invoqué avec un dépistage meilleur chez des patients venus consulter plus fréquemment pour leur problème réfractif, et malgré quelques rares études contradictoires – en particulier l’OHTS et l’EGPS fondées sur le dépistage à partir de l’hypertension intra-oculaire (HTO) révélatrice –, il est admis que la myopie forte constitue un facteur de risque pour la survenue et l’aggravation d’un glaucome primitif à angle ouvert (GPAO). Ce risque augmente avec le degré de myopie [4, 23].
La prévalence de l’HTO chez les myopes est diversement appréciée, de 2,8 à 28,5 %. Plusieurs études relèvent un risque accru d’HTO dans cette population [4, 24]. Metge et Mondon ont noté une plus forte proportion de PIO supérieure à 19 mmHg chez les myopes les plus forts (28 % au delà de 29 mm de longueur axiale) [24]. Dans la Blue Mountain Study [17], Mitchell et son équipe signalent un risque accru d’HTO seulement en cas de myopie faible ou moyenne (≤ – 3,00 dioptries1 [23]. La relation myopie-HTO est insignifiante dans d’autres études [9]. Becker et Podos [29] ont signalé une forte prédisposition à l’HTO des yeux myopes au test à la dexaméthasone. Il convient de s’en souvenir en cas de traitement cortisonique anti-inflammatoire topique prolongé [24].
Le glaucome est toutefois plus fréquent chez le myope que chez l’emmétrope. Curtin [5] relève une prévalence de glaucome de 3 % pour des longueurs axiales inférieures à 26,4 mm, de 11,2 % pour des longueurs axiales égales ou supérieures à 26,5 mm, et de 23,1 % pour les plus grandes longueurs axiales supérieures à 29 mm. Perkins et Phelps [28] évaluent le risque de GPAO à 1/35 chez le myope contre 1/70 chez l’emmétrope et 1/183 chez l’hypermétrope [23, 24]. De tous les facteurs de risque évalués en méta-analyse [15], la myopie forte (> – 6,00 D) a une prévalence de 11 % (IC95 % : 8,3-18) avec odds-ratio (OR) de 5,7 (IC95 % : 3,1-11). Celle-ci est la plus forte de tous les facteurs de risque pour le glaucome. Pour une myopie ≤ – 3,00 D, la prévalence est de 6 % (IC95 % : 4,5-7,8) avec OR 2,1 (IC95 % : 1,3-3,4). Pour Mitchell, après ajustement avec l’âge, le sexe et les autres facteurs de risque, l’OR entre GPAO et myopie est de 2,3 pour des yeux avec myopie faible (≤ – 3,00 D) contre 3,3 pour des yeux avec myopie modérée et forte (> – 3,00 D), confirmant l’augmentation du risque avec le degré de myopie. Dans la Beijing Eye Study [37], une myopie inférieure à – 6,00 D multiplie par cinq le risque d’avoir un glaucome par rapport aux emmétropes. Les niveaux modérés de PIO, similaires entre les deux groupes, confirment les travaux de l’EMGT [4] : le glaucome est souvent constaté pour une pression plus faible chez le myope fort, avec un âge de survenue plus précoce que dans le GPN du non myope.
Dans toutes les études, la prévalence féminine est nette : 57 % pour Lefrançois et 63 % pour Metge et Mondon [24].
En fait, le risque de glaucome, apparaît encore plus marqué pour les myopies fortes avec PIO souvent statistiquement normale en raison de particularités anatomophysiologiques.
L’atteinte du collagène oculaire observée chez les myopes forts entraîne un amincissement et un étirement de la coque oculaire : si aucune corrélation n’existe entre longueur axiale oculaire et épaisseur cornéenne, il n’en est pas de même au niveau scléral, avec pour principales conséquences une modification de la rigidité oculaire et une augmentation des contraintes mécaniques. Sur un globe oculaire qui perd sa sphéricité, les lois de la physique rendent ces contraintes majeures au pôle postérieur, ainsi que sur la lame criblée et les fibres nerveuses rétiniennes (FNR) qui la traversent [1]. Les conformations du canal scléral (souvent élargi, de forme anormale, d’orientation oblique), de la lame criblée et de la sclère péripapillaire anormalement fines, ainsi que la faiblesse de la matrice fibrogliale des FNR contribuent à favoriser le rôle du stress mécanique et l’évolution péjorative des anomalies pour une PIO donnée.
Les études anatomiques d’yeux myopes forts, récemment confirmées en OCT-EDI (OCT-enhanced depht imaging), OCT-SS (OCT-swept source) et OCT en optique adaptative confirment l’existence de défauts localisés de la lame criblée [35] et la disparition fréquente de la choriocapillaire péripapillaire associée à l’amincissement choroïdien postérieur [25, 26, 31]. Il en résulte une susceptibilité vasculaire plus forte avec des conséquences hémodynamiques participant aux anomalies maculaires, mais aussi péripapillaires et papillaires associées au glaucome [9, 31]. Les implications de l’absence de la membrane de Bruch et de la choroïde dans la région parapapillaire, celles de l’extension parapapillaire de l’espace liquidien cérébrospinal [16], ainsi que l’identification histologique d’une nouvelle zone d’atrophie γ/δ non associée au glaucome sur les yeux myopes forts, font l’objet d’études actuelles [6, 18]. Ces études devraient déboucher sur une meilleure identification clinique et en OCT des sujets myopes forts à haut risque de glaucome (zone β) ou à moindre risque de glaucome (zone γ/δ).
L’anatomie de la zone intermédiaire (allongement de la zone rétrolimbique et pré-équatoriale avec modifications des repères chirurgicaux, étirement du muscle ciliaire, risque accru de décollement rétinien, etc.) et la physiologie de l’angle iridocornéen et de la zone ciliaire (expliquant la particulière susceptibilité au décollement ciliochoroïdien après chirurgie filtrante) doivent être considérées.
L’imagerie dynamique orbitaire montre que la forme oblongue de l’œil myope pourrait enfin expliquer que, dans certaines positions du regard ou pendant le sommeil, une élévation plus ou moins prolongée de la PIO par compression externe contre les parois orbitaires lors de la rotation de l’œil puisse être méconnue.
L’évaluation de la PIO doit tenir compte de l’épaisseur cornéenne centrale comme toujours, en sachant l’absence de corrélation entre cette épaisseur et la longueur axiale oculaire. Étant donné le rôle essentiel de la rigidité oculaire, l’évaluation de la PIO avec les procédés conventionnels de mesure de la PIO (tonomètre de Goldmann et tonomètre à air) conduit à une sous-évaluation du risque de glaucome chez le myope fort.
L’utilisation de tonomètres type DCT Pascal™ (tonomètre à contour dynamique) ou ORA (Ocular Response Analyser®, Corvis) serait plus adaptée en cas de myopie. Les chiffres obtenus sont plus élevés et plus proches du risque réel de glaucome. Nombre de glaucomes considérés comme GPN sont ainsi reclassés en GPAO à PIO élevée.
Le tonomètre DCT a pour avantage de ne pas être dépendant de l’épaisseur cornéenne (donc plus très fiable et reproductible après chirurgie réfractive cornéenne) et de fournir l’OPA (ocular pulse analysis) qui pourrait être un indicateur des phénomènes hémodynamiques postérieurs.
L’hystérésis cornéenne et le facteur de résistance cornéenne obtenus par l’ORA, abaissés aussi par la myopie forte, ne permettent pas de conclure entre myopie et glaucome. La mesure de la PIOcc (pression corrigée selon les propriétés biomécaniques de la cornée) est une meilleure évaluation que le paramètre PIO Goldmann évalué simultanément par l’ORA.
Devant la sous-évaluation fréquente de la PIO, la pratique d’une courbe tonométrique nycthémérale diurne et nocturne revêt une importance particulière à la suite de la découverte d’une anomalie suspecte du champ visuel chez un myope fort ou devant un syndrome pigmentaire, et plus exceptionnellement devant un syndrome exfoliatif [18], ainsi que pour dépister des fluctuations pressionnelles aux effets nocifs.
L’étude de l’angle iridocornéen du myope fort, considéré en règle comme un angle large et ouvert, est souvent négligée. Pourtant, une étude ancienne de Huet trouvait 25 % d’angles pathologiques. La classification de Spaeth note soigneusement chaque élément : l’insertion irienne sur le trabéculum antérieur ou postérieur non exceptionnelle ; la courbure de l’iris périphérique (concavité postérieure de l’iris fréquente) ; le degré d’ouverture presque toujours large ; la fréquence particulière d’angles feutrés où l’éperon scléral n’est pas visible, d’angles pigmentés, ou avec des procès et des trabécules iriens. Toutes ces circonstances doivent, chez un myope fort, même en absence d’HTO avérée, faire craindre l’existence ou la survenue ultérieure d’un glaucome [24].
Son examen peut être gêné par des troubles liés à l’amétropie (astigmatisme, modifications de la taille des images) et des troubles fréquents de transparence des milieux (cataracte plus précoce, remaniement du vitré) dont la prise en compte intervient aussi dans l’interprétation des examens paracliniques.
Il n’existe pas de parallélisme absolu entre le degré d’amétropie et l’aspect du fond d’œil. Même en cas de myopie forte, toutes les situations sont rencontrées, depuis un fond d’œil de morphologie proche de la normale avec une papille ronde, jusqu’aux situations tant redoutées avec staphylome myopique associant des modifications majeures de la papille et de la choriorétine péripapillaire, centrale et périphérique, répertoriées par Curtin [5] (voir chapitre 10-VI, paragraphe « Biomicroscopie et rétinophotographies »).
Les FNR sont peu visibles au biomicroscope avec filtre vert ou bleu, en cas de myopie forte [37].
L’aspect morphologique de la papille du myope fort est très variable :
sur une papille ronde mais de grande taille, le glaucome entraîne les mêmes modifications que chez un individu emmétrope : encoche de l’anneau neurorétinien et ovalisation verticale progressive de l’excavation papillaire, associées à une pâleur progressive. En fait, cette papille est souvent au fond d’un puits résultant de l’allongement et de l’amincissement postérieur du globe oculaire, et la diminution de la profondeur du canal scléral propulse la lame criblée en avant avec amincissement du tissu prélaminaire, ainsi peu propice à s’excaver (fig. 13-14 et 13-15). Une excavation globale matérialisée par un léger décrochage au niveau de l’anneau scléral doit être recherchée ;
un aspect en entonnoir avec insertion oblique du nerf optique, consécutif à une super-traction ou torsion exercée par un allongement localisé au pôle postérieur, rend encore plus difficile l’identification d’une excavation ;
la dysversion papillaire ou tilted disc syndrome associe une papille ovalisée de petite taille à orientation oblique ou horizontale et un croissant scléral avec une atrophie choriorétinienne en secteur (inféro-nasal ou inféro-temporal). La dysversion, bilatérale dans 80 % des cas, serait plus fréquente chez les sujets de race jaune. Elle est notée pour des myopies moyennes, mais aussi dans la myopie forte. La stabilité de l’anomalie morphologique pour éliminer un glaucome est en fait très théorique [2, 14, 15].
L’excavation papillaire glaucomateuse est donc absente dans une très forte proportion de myopie forte, et cette absence est de règle au-delà de – 15 D [24].
La pâleur papillaire ne peut pas, la plupart du temps, être prise en compte chez le myope fort. En effet, la papille est globalement pâle du fait de l’amincissement du tissu laminaire précribriforme.
Les hémorragies papillaires glaucomateuses du myope fort sont à différencier des hémorragies consécutives à la progression de la myopie et aux tractions exercées par le vitré sur la papille.
L’atrophie péripapillaire est très fréquente dans la myopie forte (80,2 % pour Chang et al. [3]). Sa présence et sa complexité sont souvent corrélées au degré de myopie et à la taille de la papille. Sur un œil non myope, cette atrophie décrite par Jonas est plus fréquente dans le GPAO et plus particulièrement dans le GPN [34]. L’existence d’une atrophie péripapillaire perd ainsi toute sa valeur en cas de myopie forte.
L’état du pôle postérieur est très important à considérer [3, 8, 10, 14] :
pour évaluer l’existence et la conformation d’un staphylome ou de zones d’atrophie choriorétinienne, à prendre en compte pour la réalisation et l’interprétation des examens complémentaires ;
pour évaluer la macula dont l’état conditionne une grande part du pronostic visuel ultime. Au-delà de – 20 D, l’atteinte maculaire est quasi constante. Les complications néovasculaires précoces cèdent progressivement le pas, avec l’âge, à des anomalies encore plus cécitantes [8, 12].
Même si l’examen papillaire du myope fort reste souvent décevant pour affirmer et suivre un glaucome, l’examen du fond d’œil constitue un élément fondamental pour évaluer la validité et interpréter les examens complémentaires.
Fig. 13-14 Myopie forte (– 18 D, pseudo-phake), sans suspicion de glaucome. a. Papille non excavée, vaste zone d’atrophie choriorétinienne myopique. b. Champ visuel avec de larges scotomes disséminés, sans limitation nette avec le méridien horizontal. (Doc. : E. Sellem.)

Fig. 13-15 a, b. Œil droit : glaucome avéré, myopie forte (– 24 D pseudo-phake) : absence d’excavation papillaire, large tache aveugle, déficit arciforme supérieur, strictement limité par le méridien horizontal, typiquement glaucomateux. c. OCT difficilement interprétable sur ce rapport combiné champ visuel et OCT (programme Glaucoma Workplace, Zeiss). Œil gauche : glaucome avéré, myopie forte (– 23 D, pseudo-phake) : déficit arciforme inférieur dans l’aire de Bjerrum. (Doc. : J.-P. Renard.)
Les rétinophotographies couleur, anérythre et en lumière bleue de la papille et du pôle postérieur constituent un élément de surveillance essentiel en cas de myopie forte et sont à confronter aux relevés du champ visuel [32].
Lorsqu’il est réalisable, l’HRT peut avoir un intérêt pour l’analyse topographique comparative de la papille lors des examens successifs.
Les apports prometteurs des OCT-SD, OCT-EDI, OCT-SS et OCT en optique adaptative restent à définir en cas de myopie forte, en raison des difficultés d’évaluations fiables des données chiffrées en fonction de la longueur axiale (facteur de Littmann), des incidences obliques et des modifications de réflectivité (papilles dysversées et atrophies) qui faussent les mesures et compliquent l’interprétation pour l’étude des FNR [14, 21, 25, 26, 31-34]. Jonas retrouve en imagerie les zones β et γ. La zone β non pathognomonique de la myopie forte est plus fréquente en cas de glaucome. L’existence d’une zone γ quasi exclusive à la myopie forte ne serait pas associée au glaucome [7, 19].
En cas de dysversion papillaire, l’épaisseur des fibres est généralement plus élevée en temporal et diminuée dans les autres secteurs alors qu’il existe une rotation des pics corrélée à la topographie de la dysversion. Seule la diminution des valeurs dans le temps doit être considérée, car l’anomalie est peu ou pas évolutive [16].
Les difficultés d’interprétation sont moins importantes au pôle postérieur, d’où l’intérêt de l’étude systématique du complexe cellulaire ganglionnaire (GCC) associée à celle des photorécepteurs et de la choroïde de la région maculaire dans les pathologies associées à la myopie forte [20, 30].
L’interprétation des résultats doit être prudente étant donné la fréquence relative de résultats anormaux constatée chez des myopes non glaucomateux (environ 20 % pour des myopies de – 2,00 à – 10,00 D, mais combien pour les myopies plus fortes ?). Bien que les premières estimations montrent l’absence de différence statistiquement significative pour le dépistage et la capacité de détection d’un changement glaucomateux entre la mesure d’épaisseur des FNR et l’analyse du complexe GCC en cas de myopie forte, il semble conseillé (lorsque les mesures sont fiables), d’effectuer les deux mesures. Toute modification doit être ensuite rattachée à un glaucome : les mesures par hémi-champ supérieur et inférieur correspondant aux déficits glaucomateux sont plus interprétables pour le suivi.
Chez le myope fort suspect de glaucome, c’est l’examen clé pour le diagnostic et le suivi, malgré les importantes difficultés d’interprétation [7, 27, 33].
Les stratégies actuelles autorisent l’utilisation de la périmétrie automatisée standard 30-2, 24-2 et 10-2, notamment en cas d’atteinte maculaire myopique associée. La périmétrie cinétique de Goldmann peut être encore précieuse en cas de persistance d’un îlot périphérique ou en cas de difficulté d’interprétation devant un fond d’œil avec des plages irrégulières d’atrophie choriorétinienne. Les périmétries bleu-jaune, FDT (frequency-doubling technology) et flicker n’ont aucun intérêt.
L’interprétation du champ visuel est indissociable de l’examen du fond d’œil en essayant de corréler les résultats à l’aspect du nerf optique, à la profondeur et à l’étendue du staphylome postérieur, ainsi qu’à l’état de la choriorétine [5].
La distinction entre les déficits liés à la myopie forte et ceux liés au glaucome est rendue difficile par la superposition possible des localisations (voir fig. 13-14 et 13-15) :
un déficit diffus se rapporte plus à la myopie et à une cataracte ; il sera tardif dans l’évolution du glaucome ;
l’élargissement de la tache aveugle (souvent plus marquée en périmétrie cinétique) n’est jamais un signe de glaucome ;
les déficits centro-caecaux sont plutôt d’origine myopique. Lorsque, dans ces zones de dépression globale de sensibilité rétinienne apparaissent des scotomes plus profonds péricentraux, il faut craindre néanmoins une origine glaucomateuse ;
les scotomes dans l’aire de Bjerrum se rapprochent volontiers dangereusement du point de fixation sans qu’il soit toujours possible de faire la distinction de ce qui revient à un glaucome ou à la myopie (bord du staphylome) ;
les déficits quadranopsiques bitemporaux simulent une atteinte chiasmatique débutante. Une dysversion papillaire, associée en général à une atrophie péripapillaire nasale ou temporale inférieure et à un staphylome postérieur localisé, en est la cause. Ces déficits, fréquents dans la myopie forte, affectent les isoptères centraux sans atteindre les isoptères périphériques (intérêt de la périmétrie cinétique en complément du 24-2 en cas de doute). Ils empiètent souvent sur la ligne médiane. Ces patients doivent néanmoins être surveillés en raison du risque accru de glaucome, à suspecter devant une évolution du déficit ;
l’encoche nasale située d’un côté ou de l’autre du méridien horizontal, à rechercher systématiquement en périmétrie périphérique, est spécifique du glaucome et n’est jamais myopique ;
les déficits relatifs aux séquelles d’un décollement de rétine opéré sont aisés à identifier ;
les déficits asymétriques du champ visuel semblent plus fréquents chez les myopes forts. La limitation typique par le méridien horizontal des déficits glaucomateux distingue ceux-ci des déficits périmétriques myopiques non systématisables (voir fig. 13-14 et 13-15).
En cas de myopie forte, nous venons de voir qu’en dehors de circonstances particulières (forte HTO, facteurs de risque associés, anomalie typique du champ visuel avec encoche périphérique en doigt de gant), le diagnostic précoce de la maladie glaucomateuse est souvent difficile en raison d’une similitude des anomalies.
La recherche, essentielle, d’une progression glaucomateuse se complique par le fait que la myopie forte elle-même évolue. Les anomalies anatomiques et fonctionnelles des deux pathologies s’associent, et c’est finalement la topographie des zones évolutives qui doit aider à faire la part de chacune des pathologies.
La progression des zones d’atrophies choriorétiniennes péripapillaires ou extrapapillaires avec aggravation d’un staphylome myopique, ophtalmoscopiquement visibles, se traduit par des modifications de toutes les mesures, et il est probable que les nouvelles imageries seront prises en défaut pour évaluer les responsabilités respectives, sauf en ce qui concerne la survenue inopinée d’une maculopathie non glaucomateuse pouvant conduire à la cécité [3, 15, 25, 31].
L’évolution péjorative des mesures anatomiques et fonctionnelles en cas de dysversion papillaire isolée a toutes chances d’être d’origine glaucomateuse.
Dans tous les autres cas, l’étude anatomique et fonctionnelle par hémi-champ supérieur et inférieur est importante pour différencier les conséquences non systématisées d’un staphylome myopique évolutif d’une progression glaucomateuse.
En 2014, dans les situations extrêmes rencontrées au cours de la myopie forte, le suivi du champ visuel reste donc plus fiable et plus productif pour évaluer la progression d’un glaucome que les nouvelles imageries encore en expertise.
Plus qu’ailleurs, la frontière entre GPAO et GPN est difficile à tracer chez le myope fort en raison de l’inconstance des modifications pressionnelles induites par les anomalies de rigidité sclérale [34, 36].
Il est sans doute plus fréquent qu’on ne le dit. Tout jeune myope fort doit bénéficier d’un examen ophtalmologique régulier avec gonioscopie.
Développé dans le chapitre 14-I, il est associé dans 80 à 85 % des cas à une myopie. Dans l’étude de Lichter et Shaffer [22], la réfraction moyenne est de – 2,4 D, avec un éventail de + 3,00 à – 13,5 D. D’après nos constatations personnelles, il semble s’agir plus volontiers d’une myopie moyenne autour de – 4,00 D que d’une myopie forte [24].
Son association à la myopie forte est exceptionnelle. Le pronostic est aggravé en en raison des fortes instabilités pressionnelles, même après chirurgie filtrante précoce.
Au cours de l’acte chirurgical, la sensibilité particulière du nerf optique impose la plus grande prudence lors de la reformation du volume vitréen par gaz ou silicone. Le glaucome cortisonique, secondaire au traitement local postopératoire, doit être prévenu. Le glaucome secondaire après décollement rétinien sur myopie forte doit être évité : c’est la deuxième cause d’énucléation chez le myope fort. Après plusieurs interventions, le risque de glaucome réfractaire est de mécanisme multiple : de type obstructif, post-inflammatoire ou par silicone ou néovasculaire.
Étant donné la gravité particulière du glaucome associé à la myopie forte, et même en l’absence d’autre élément clinique, une longue pratique personnelle fait proposer un traitement à partir de 16 mmHg au tonomètre de Goldmann.
Bien qu’aucun argument ne permette d’affirmer l’effet bénéfique de l’abaissement de la PIO sur l’évolution d’un staphylome myopique, mieux vaut traiter une progression avérée d’origine incertaine que prendre le risque de voir flamber la fonction visuelle.
C’est le traitement de première intention.
L’apport des prostaglandines a amélioré l’arsenal thérapeutique. Leur usage doit être prudent en cas de modification maculaire non glaucomateuse ou après pseudo-phakie.
Le recours aux associations, avec risque accru d’intolérance, est fréquent devant la nécessité d’obtenir une pression cible basse.
En raison du risque de décollement de rétine, les myotiques sont à proscrire, même après examen soigneux de la périphérie rétinienne.
Le traitement du facteur vasculaire par les inhibiteurs calciques est actuellement abandonné.
Le traitement laser par trabéculorétraction peut être tenté dans un deuxième temps dans quelques situations, lorsque l’angle est accessible sans goniodysgénésie. L’utilisation d’un laser sélectif est préférée au laser à l’argon malgré une efficacité identique, qui reste toutefois faible chez le myope fort en dehors des quelques glaucomes pigmentaires et des rares glaucomes avec syndrome exfoliatif.
Le cyclo-affaiblissement par laser diode (ou par ultrasons) est réservé aux formes réfractaires souvent multi-opérés.
La chirurgie filtrante est la procédure de choix en cas d’intolérance ou d’évolution péjorative sous traitement médical, ou d’emblée devant une menace sur la vision centrale liée au glaucome ou une très forte hypertonie initiale. C’est une chirurgie difficile en raison de la modification des repères anatomiques avec l’allongement limbique. La chirurgie non perforante est préférée à la chirurgie perforante en raison du moindre risque de complications hypotoniques par décollement ciliochoroïdien à craindre particulièrement en cas de myopie forte [10, 11]. L’utilisation d’antimitotiques type mitomycine doit être faite avec circonspection (doses ou durées d’application plus faibles), en se souvenant de la faible épaisseur des tissus et du risque accru de complications. L’utilisation de valves ou shunts est exceptionnelle.
Devant l’association glaucome et cataracte, une chirurgie en deux temps, sur le glaucome puis sur la cataracte, est sans doute préférable à une chirurgie combinée. En l’absence d’évaluation statistique, il n’y a pas de règle précise concernant les indications et les protocoles à suivre pour ces diverses procédures en cas de myopie forte. L’escalade thérapeutique est sans doute plus rapide en raison de l’âge plus précoce de découverte et de l’espérance de vie ainsi que de la gravité particulière de l’atteinte fonctionnelle souvent mixte (glaucomateuse et rétinienne) avec risque de cécité.
Retenir
Prévalence du glaucome au moins multipliée par trois en cas de myopie forte.
Risque augmentant avec le degré de myopie.
Prévalence accrue du GPN chez le myope fort en raison des défauts d’évaluation pressionnelle oculaire liés à la maladie et risque de retard diagnostique.
Évaluation anatomique difficile, mais essentielle, recoupant les effets staphylome/glaucome (rétinophotographies, OCT-SD avec mesure du complexe ganglionnaire).
Crainte d’une maculopathie associée menaçant la vision centrale.
Le champ visuel reste l’élément clé du suivi du glaucome en permettant une corrélation topographique de ses résultats avec l’aspect anatomique.
Intérêt des mesures anatomiques et fonctionnelles par hémi-champ supérieur et inférieur pour différencier glaucome et myopie évolutifs.
Abaisser la pression cible à 17 mmHg afin de diminuer les contraintes mécaniques semble raisonnable en cas de myopie forte, même en l’absence d’anomalie évolutive.
La gravité de l’évolution précipite souvent l’escalade thérapeutique.
[1] Belleza AJ, Hart RT, Burgoyne CF. The optic nerve head as a biomechanical structure : initial finite element modeling. Invest Ophthalmol Vis Sci. 2000 ; 41 : 2991-3000.
[2] Brito PN, Vieira MP, Falcão, et al. Optical coherence tomography study of peripapillary retinal nerve fiber layer and choroidal thickness in eyes with tilted optic disc. J Glaucoma. 2013 ; [Epub ahead of print].
[3] Chang L, Pan CW, Ohno-Matsui K, et al. Myopia-related fundus changes in Singapore adults with high myopia. Am J Ophthalmol. 2013 ; 155 : 991-9.
[4] Chihara E, Liu X, Dong J, et al. Severe myopia as a risk factor for progressive visual field loss in primary open-angle glaucoma. Ophthalmologica. 1997 ; 211 : 66-71.
[5] Curtin BJ. The myopias. Basic science and clinical management. Philadelphia, Harper and Row, 1985 : 239-245.
[6] Dai Y, Jonas JB, Huang H, et al. Microstructure of parapapillary atrophy : beta zone and gamma zone. Invest Ophthalmol Vis Sci. 2013 ; 54 : 2013-8.
[7] Dai Y, Jonas JB, Huang H, et al. In-vivo microstructural anatomy of parapapillary atrophy : beta-zone and gamma. ARVO, 2013, Poster Number 4804.
[8] Flores-Moreno I, Ruiz-Medrano J, Duker JS, Ruiz-Moreno JM. The relationship between retinal and choroidal thickness and visual acuity in highly myopic eyes. Br J Ophthalmol. 2013 ; 97 : 1010-3.
[9] Gordon MO, Beiser JA, Brandt JD, et al. The Ocular Hypertension Treatment Study : baseline factors that predict the onset of primary open angle glaucoma. Arch Ophthalmol. 2002 ; 120 : 714-20 ; discussion : 829-30.
[10] Gavrilova B, Roters S, Engels BF, et al. Late hypotony as a complication of viscocanalostomy : a case report. J Glaucoma. 2004 ; 13 : 263-7.
[11] Hamel M, Shaarawy T, Mermoud A. Deep sclerectomy with collagen implant in patients with glaucoma and high myopia. J Cataract Refract Surg. 2001 ; 27 : 1410-7.
[12] Hayashi K, Ohno-Matsui, K, Shimada N, et al. Long term pattern of progression of myopic maculopathy. A natural history study. Ophthalmology. 2010 ; 117 : 1595-611.
[13] Hayashi H, Yamashiro K, Nakanishi H, et al. Association of 15q14 and 15q25 with high myopia in Japanese. Invest Ophthalmol Vis Sci. 2011 ; 52 : 4853-8.
[14] Hayashi, I, Takahashi A, Kawano, et al. Scleral thickness in highly myopic eyes measured by enhanced depth imaging optical coherence tomography. Eye. 2013 ; 27 : 410-7.
[15] Hollands H, Johnson D, Hollands S, et al. Do findings on routine examination identify patients at risk for primary open-angle glaucoma ? The rational clinical examination systematic review. JAMA. 2013 ; 309 : 2035-42.
[16] Hwang HY, Yoo C, Kim YY. Myopic optic disc tilt and the characteristics of peripapillary retinal nerve fiber layer thickness measured by spectral-domain optical coherence tomography. J Glaucoma. 2012 ; 4 : 260-5.
[17] Jonas JB, Martus P, Budde WM. Anisometroia and degree of optic nerve damage in chronic open-angle glaucoma. Am J Ophthalmol. 2002 ; 134 : 547-51.
[18] Jonas JB, Berenshtein E, Holbach L. Lamina cribrosa thickness and saptial relations-hips between intraocular space and cerebrospinal fluid space in highly myopic eyes. Invest Ophthalmol Vis Sci. 2004 ; 45 : 2660-5.
[19] Jonas JB, Ohno-Matsui K, Spaide RF, et al. Macular bruch’s membrane defects and axial length association with gamma zone and delta zone in peripapillary région. Invest Ophthalmol Vis Sci. 2013 ; 54 : 1295-302.
[20] Kim NR, Lee ES, Seong GJ, et al. Comparing the ganglion cell complex and retinal nerve fibre layer measurements by Fourier domain OCT to detect glaucoma in high myopia. Br J Ophthalmol. 2011 ; 95 : 1115-21.
[21] Kiumehr S, Park SC, Syril D, et al. In vivo evaluation of focal lamina cribrosa defects in glaucoma. Arch Ophthalmol. 2012 ; 130 : 552-9.
[22] Lichter PR, Shaffer RN. Diagonostics and pronostics signs in pigmentary glaucoma. Trans Am Acad Ophthalmol Otolaryngol. 1970 ; 74 : 984-98.
[23] Mitchell P, Hourihan F, Sandbach J, Wang JJ. The relationship between glaucoma and myopia : the Blue Mountains Eye Study. Ophthalmology. 1999 ; 106 : 2010-5.
[24] Mondon H, Metge P. Les complications de la myopie forte et leur traitement (A. Lefrançois). Rapport de la Société française d’ophtalmologie. Paris, éditions Masson, 1994 : 413-440.
[25] Ohno-Matsui K, Akiba M, Ishibashi T, et al. Observations of vascular structures within and posterior to sclera in eyes with pathologic myopia by swept-source optical coherence tomography. Invest Ophthalmol Vis Sci. 2012 ; 53 : 7290-8.
[26] Park SC, De Moraes CG, Teng CC, et al. Enhanced depth imaging optical coherence tomography of deep optic nerve complex structures in glaucoma. Ophthalmology. 2012 ; 119 : 3-9.
[27] Perdichi A, Iester M, Scuderi G, et al. Visual field damage and progression in glaucomatous myopic eyes. Eur J Ophthalmol. 2007 ; 17 : 534-7.
[28] Perkins ES, Phelps CD. Open angle glaucoma, ocular hypertension low tension glaucoma and refraction. Arch Ophthalmol. 1982 ; 100 : 1464-7.
[29] Podos SM, Becker B, Morton WR. High myopia and primary open angle glaucoma. Am J Ophthalmol. 1966 ; 62 : 1 038-43.
[30] Renard JP, Fenolland JR, El Chehab H, et al. Analyse du complexe cellulaire ganglionnaire maculaire (GCC) en tomographie par cohérence optique (SD-OCT) dans le glaucome. J Fr Ophtalmol. 2013 ; 36 : 299-309.
[31] Shimada N, Ohno-Matsui K, Nishimuta A, et al. Peripapillary changes detected by optical coherence tomography in eyes with high myopia. Ophthalmology. 2007 ; 114 : 2070-6.
[32] Shoji T, Nagaoka Y, Sato H, et al. Impact of high myopia on the performance of SD-OCT parameters to detect glaucoma. Graefes Arch Clin Exp Ophthalmol. 2012 ; 250 : 1843-9.
[33] Soghi T, Sato H, Ishida M. Assesment of glaucomatous changes in subjects with high myopia using spectral domain coherence tomography. Invest Ophthalmol Vis Sci. 2011 ; 52 : 1098-102.
[34] Sohn SW, Song JS, Kee C. Influence of the extent of myopia on the progression of normal tension glaucoma. Am J Ophthalmol. 2010 ; 149 : 831-8.
[35] You JY, Park SC, Su D, et al. Focal lamina cribrosa defects associated with glaucomatous rim thinning and acquired pits. JAMA Ophthalmol. 2013 ; 131 : 314-20.
[36] Zangwill DR, Tessler Z, Yassur Y. The correlation between intraocular pressure and refractive status. Arch Ophthalmol. 1985 ; 103 : 1812-5.
[37] Zhang Y, Xu L, Zhang L, et al. Ophthalmoscopic assesment of retinal fiber layer. The Beijing Eye Study. Plos One. 2013 ; 8 : e62022.
J.-F. Rouland
Le glaucome juvénile est un glaucome primitif à angle ouvert apparaissant dans l’enfance.
Rare, il est le plus souvent héréditaire avec une transmission autosomique dominante.
Une anomalie du développement du trabéculum est à l’origine d’une hypertension intra-oculaire rapidement très élevée, en général révélatrice de la pathologie.
Le diagnostic repose sur la mesure de la pression intra-oculaire, l’examen du champ visuel et l’analyse de la papille optique, en tenant compte de l’âge du patient.
Le traitement est essentiellement chirurgical pour lever l’obstacle trabéculaire.
Le glaucome juvénile (glaucome juvénile) est une des formes cliniques du glaucome de l’enfant. Il est classique de séparer ces formes cliniques de glaucome de l’enfance en fonction de l’âge d’apparition, de leur hérédité, de l’association à d’autres malformations et enfin du siège de l’anomalie oculaire à l’origine du glaucome.
Le glaucome juvénile est un glaucome primitif à angle ouvert dont la caractéristique est de se développer durant l’enfance, sans atteinte systémique associée [18].
Le glaucome est une affection rare chez l’enfant. Les glaucomes primitifs représentent environ 50 % des cas diagnostiqués et 50 % sont des glaucomes secondaires.
Les glaucomes juvéniles, au sein des glaucomes primitifs, sont une minorité estimée à 6 %, ou avec une incidence de 0,32/100 000 sujets de moins de 20 ans [1, 12].
L’âge de survenue se situe entre 5 et 18 ans pour la majorité des cas. La littérature retrouve cependant des cas de glaucomes dit juvéniles jusqu’à 50 ans ! Il était classique autrefois de donner le terme de juvénile à tout glaucome découvert chez un grand enfant, voire un adulte jeune [14, 19].
La majorité des cas sont familiaux selon une transmission autosomique dominante avec une forte pénétrance. Cependant, quelques cas de transmission récessive ont été rapportés, notamment en cas de consanguinité. Il semble exister une prédominance masculine (2 : 1). Aux États-Unis, le glaucome juvénile est plus fréquent chez les sujets noirs [9, 11].
Plusieurs gènes ont été identifiés. Cinq loci GLC1 sont associés au glaucome juvénile : GLC1A, GLC1J, GLC1K, GLC1M et GLC1N. Parmi eux, GLC1A (1q24.3-q25) est associé au gène codant la myociline, glycoprotéine exprimée dans de nombreux tissus de l’organisme dont le corps ciliaire et le trabéculum. Cette mutation est retrouvée dans 10 % des glaucomes juvéniles.
Une anomalie du développement du trabéculum est rapportée, mais à un degré moindre que celle observée dans le glaucome congénital. Un épaississement du tissu trabéculaire avec des dépôts intratissulaire pouvant s’associer à une insertion antérieure de l’iris est retrouvé [2]. Il semblerait exister une corrélation entre l’âge d’apparition du glaucome juvénile et le degré d’immaturité de l’angle [16].
Très souvent asymptomatique, le glaucome juvénile va être découvert au décours d’un examen systématique ou d’un bilan ophtalmologique dans une famille de glaucome juvénile, ou à l’occasion de manifestations fonctionnelles telles que des céphalées ou des douleurs rétro- ou péri-oculaires, voire une baisse de l’acuité visuelle. Après l‘âge de 3 ans la photophobie, la buphtalmie et le larmoiement ne sont pas présents. Le diagnostic repose alors, comme chez l’adulte, sur la mesure de la pression intra-oculaire (PIO) qui est souvent très élevée et sur son retentissement péjoratif sur le nerf optique s’altérant très rapidement. Il est toujours bilatéral mais peut être asymétrique [1, 2, 12].
Les glaucomes juvéniles ne présentent pas de buphtalmie et/ou de vergetures descemétiques : l’âge d’apparition de l’HTO étant plus tardive, l’œil n’a plus ces capacités d’extensibilité.
Une myopie de plus de – 3 dioptries est retrouvée dans 73 % des cas de glaucome juvénile et supérieure à – 6 dioptries dans 40 % des cas. L’association ethnie noire et myopie semble un facteur aggravant.
La PIO est élevée et, surtout, très rapidement mal tolérée par le nerf optique. Des chiffres supérieurs à 40 mmHg sont fréquemment retrouvés chez ces enfants. La mesure de la PIO associée à la pachymétrie, chez un enfant appartenant à une famille de glaucome juvénile ou présentant une myopie forte, doit être réalisée régulièrement (deux fois par an) car son élévation peut apparaître rapidement [6, 11].
La gonioscopie est normale dans un tiers des cas [7]. Dans les deux autres tiers, on retrouve des goniodysgénésies telles que des procès ou trabécules iriens très épais, associés ou non à une insertion haute (ou antérieure) de la racine de l’iris. Un trabéculum immature peut parfois donner un aspect en verre dépoli de l’angle [16] (fig. 13-16).

Fig. 13-16 Gonioscopie dans un cas de glaucome juvénile ( eCas clinique 13-2). Bombements localisés en regard de la racine de l’iris, visualisation des vaisseaux intra-iriens, trabéculum hyper-transparent.
eCas clinique 13-2 Le jeune D., âgé de 11 ans, nous est adressé pour une baisse d’acuité visuelle de l’œil droit dans un contexte d’hypertonie oculaire très importante. Il n’existe aucune plainte fonctionnelle en dehors de la baisse de vision. Il ne présente pas d’antécédent personnel ou familial particulier. L’acuité visuelle est de 7/10 à l’œil droit, non améliorable avec une myopie de – 0,75 D. À gauche, l’acuité visuelle est de 10/10 avec – 0,50 D. La PIO est à 45 mmHg aux deux yeux (pachymétrie : 510 μm) sous traitement hypotonisant par analogue de prostaglandines depuis 8 jours.

Fig. A Le diamètre cornéen est normal, sans œdème ni anomalie cornéenne.

Fig. B La chambre antérieure est profonde.

Fig. C La gonioscopie retrouve des bombements localisés en regard de la racine de l’iris.

Fig. D L’angle est largement ouvert, peu pigmenté avec une visualisation des vaisseaux intra- iriens.

Fig. E Il semble exister, en regard des bombements de l’iris, des goniodysgénésies entre l’iris et le trabéculum.

Fig. F La papille optique droite est très excavée avec une quasidisparition de la bordure neurorétinienne.

Fig. G Aspect comparable de la papille optique sur l’œil gauche.

Fig. H OCT Visante de l’angle de l’œil droit : angle très étiré, avec une racine de l’iris semblant très reculée avec un iris concave.

Fig. I OCT Visante de l’angle de l’œil gauche identique à l’examen de l’œil droit.

Fig. J Champ visuel Humphrey de l’œil droit en stratégie SITA standard. VFI : 40 %, MD : – 20,78 dB. Scotome inférieur absolu, relatif en supérieur : stade avancé de glaucome.

Fig. K Champ visuel Humphrey de l’œil droit en stratégie SITA standard. VFI : 49 %, MD : – 24,12 dB. Scotome supérieur absolu affleurant le point de fixation relatif en inférieur : stade avancé de glaucome.

Fig. L OCT de la papille optique : altération majeure de la structure à la fois de la papille optique et des FNR.

Fig. M OCT du complexe ganglionnaire : atteinte bilatérale avancée.

Fig. N Le jeune D. est opéré en urgence de son œil droit par trabéculo-trabéculectomie. La PIO est mesurée à 6 mmHg le lendemain de l’intervention avec une régression importante de l’excavation papillaire associée à quelques hémorragies de décompression.
Conclusion
Les glaucomes juvéniles se présentent avec des PIO très élevées rapidement péjoratives. La papille optique est souvent très excavée et le champ visuel se dégrade rapidement. La recherche des antécédents familiaux est systématique mais ne retrouve pas toujours une hérédité évidente.
La gonioscopie est indispensable et confirme par ses anomalies le diagnostic de glaucome juvénile primitif.
L’examen de la papille est clinique et doit être archivé sous forme de rétinophotographies ou d’une imagerie par analyseur de la tête du nerf optique. Bien que les bases de données de comparaison soient obtenues sur des patients normaux de plus de 18 ans, il est tout à fait recommandé de réaliser ces mesures qui permettent de faire un diagnostic plus précoce [8].
L’excavation glaucomateuse est rapide et non spécifique. En revanche, une réversibilité partielle de l’atteinte s’observe parfois après la chirurgie lors de la régularisation de la PIO (fig. 13-17).
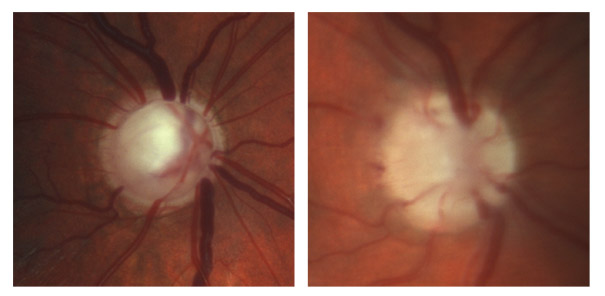
Fig. 13-17 Papille droite d’un cas de glaucome juvénile, avant et après intervention antiglaucomateuse, montrant une régression importante de l’excavation avec quelques hémorragies de décompression.
Un relevé du champ visuel est indispensable dès que l’âge de l’enfant le permet [13]. Il confirmera le diagnostic et servira d’examen de référence dans la surveillance à vie de cet enfant. Les déficits sont identiques à ceux retrouvés chez l’adulte, mais ils sont d’évolution rapide si l’élévation de la PIO n’est pas prise en charge.
Le traitement est avant tout chirurgical. Le traitement médical peut être débuté dans l’attente du geste chirurgical ou en postopératoire devant une PIO cible non atteinte. Toutefois, il ne permet pas de stabiliser durablement la PIO. La littérature confirme l’efficacité la chirurgie dans plus de 80 % des cas (avec ou sans traitement médical adjuvant) quelle que soit la technique utilisée : trabéculotomie, trabéculectomie, goniotomie, voire viscocanalostomie.
Les excellents résultats pressionnels obtenus par la chirurgie filtrante sont une caractéristique particulière de cette forme juvénile des GPAO [3-5, 10, 15, 17, 19] (eCas cliniques 13-2 et 13-3).
Le jeune E., âgé de 11 ans, est suivi par son ophtalmologiste traitant pour une myopie bilatérale de – 6 dioptries aux deux yeux. Il n’a pas d’antécédents particuliers connus, ni personnel ni familiaux.
Au décours d’une visite systématique, son ophtalmologiste en réalisant un examen de la rétine découvre une importante excavation papillaire bilatérale. La mesure de la PIO est mesurée à 35 mmHg (pour une pachyémtrie de 740 μm). L’acuité visuelle est de 10/10 pour les deux yeux. L’examen de l’angle apparaît normal et largement ouvert sans goniodysgénésie.

Fig. A Excavation papillaire de l’œil droit.

Fig. B Excavation papillaire de l’œil gauche très importante.

Fig. C Champ visuel Humphrey de l’œil droit en stratégie FASTPAC le 25/09/00. Les critères de fiabilité sont médiocres (7/18 pertes de fixation) mais il s’agit du premier champ visuel chez un enfant de 11 ans : MD – 19,17 dB. Encoche nasale profonde et étendue, scotome relatif en supérieur.

Fig. D Champ visuel Humphrey de l’œil gauche en stratégie FASTPAC le 25/09/00. Les critères de fiabilité sont médiocres (pertes de fixation) : MD – 17,32 dB. Encoche nasale profonde et étendue, scotome relatif en supérieur.
Le traitement chirurgical est refusé par la famille. Un traitement médical par bêtabloquants et analogues de prostaglandine est débuté, réduisant la PIO à 25 mmHg (pachymétrie de 740 μm).

Fig. E Un nouvel examen du champ visuel Humphrey de l’œil droit en stratégie FASTPAC est réalisé le 10/04/01. Les critères de fiabilité sont corrects. L’aggravation du déficit est manifeste malgré une mesure stable de la PIO à 25 mmHg. MD : – 20,43 dB.

Fig. F L’examen du champ visuel Humphrey de l’œil gauche en stratégie FASTPAC réalisé le 10/04/01 : les déficits constatés 7 mois plus tôt ont diminué sur cet œil gauche.
Malgré nos recommandations la famille refuse l’intervention pour l’œil droit.

Fig. G L’examen du champ visuel Humphrey de l’œil droit en stratégie SITA standard est réalisé le 07/11/01. Les critères de fiabilité sont corrects. L’aggravation du déficit se poursuit malgré une mesure stable de la PIO. MD : – 26,07 dB.
La famille, constatant la nette aggravation du déficit, accepte le principe de l’intervention chirurgicale de l’œil droit. Une trabéculotrabéculectomie (sans antimétabolites) est réalisée en novembre 2001 à droite puis en février 2002 à l’œil gauche avec une PIO postopératoire à 18 mmHg sans traitement.

Fig. H L’examen du champ visuel Humphrey de l’œil gauche en stratégie SITA standard est réalisé le 07/11/01. Les critères de fiabilité sont corrects. Le déficit est stable sans aggravation manifeste.

Fig. I Résultats du dernier bilan campimétrique du 25/07/12. La PIO reste, pour les deux yeux entre 17 et 20 mmHg sans traitement médical. Les résultats des champs visuels durant ces onze années confirment la stabilisation, voire une amélioration des déficits.

Fig. J Les examens successifs confirment la stabilisation et l’absence de progression pour l’œil gauche.
Conclusion
Ce jeune patient est aujourd’hui étudiant en droit.
Le traitement médical seul ne suffit pas à stabiliser ces PIO très élevées. La chirurgie filtrante est efficace et durable dans cette forme particulière de glaucome primitif de l’enfant. La myopie se confirme comme étant souvent associée au glaucome juvénile, en particulier pour des réfractions supérieure à – 6 dioptries.
Le glaucome juvénile est une forme rare de glaucome primitif de l’enfant. Il se caractérise par une absence d’anomalie oculaire (en dehors de l’angle) ou systémique. La liste des glaucomes de l’enfant primitifs congénitaux ou secondaires est longue, et ils sont beaucoup plus fréquents que le glaucome juvénile [1, 18].
Retenir
Le glaucome juvénile est une forme rare du glaucome de l’enfant.
Il est asymptomatique initialement et doit être recherché en particulier dans les familles de glaucome juvénile (hérédité autosomique dominante).
Son diagnostic repose essentiellement sur la mesure de la PIO qui est élevée et rapidement délétère pour le nerf optique.
Le traitement est avant tout chirurgical avec un relativement bon pronostic.
[1] Aponte EP, Diehl N, Mohney BG. Incidence and clinical characteristics of childhood glaucoma : a population-based study. Arch Ophthalmol. 2010 ; 128 : 478-82.
[2] Beck AD. Diagnosis and management of pediatric glaucoma. Ophthalmol Clin North Am. 2001 ; 14 : 501-12.
[3] Beck AD, Freedman SF. Trabeculectomy with mitomycin-C in pediatric glaucomas. Ophthalmology. 2001 ; 108 : 835-7.
[4] Costa VP, KatzLJ, Spaeth GL. Primary trabeculectomy in young adults. Ophthalmology. 1993 ; 100 : 1071-76.
[5] Denis P, Rouland JF, Ousmane L. La chirurgie du glaucome de l’enfant. In : Chirurgies des glaucomes. Paris, Éditions Lamy, 2005 : 385-406.
[6] Goldwyn R, Waltman SR, Becker B. Primary open-angle glaucoma in adolescents and young adults. Arch Ophthalmol. 1970 ; 84 : 579-82.
[7] Gupta V, Srivastava RM, Rao A, et al. Clinical correlates to the goniodysgensis among juvenile-onset primary open-angle glaucoma patients. Graefes Arch Clin Exp Ophthalmol. 2013 ; 251 : 1571-6.
[8] Hutcheson KA. Application of new ophthalmic technology in the pediatric patient. Curr Opin Ophthalmol. 2007 ; 18 : 384-91.
[9] Khan AO. Conditions that can be mistaken as early childhood glaucoma. Ophthalmic Genet. 2011 ; 32 : 129-37.
[10] Kjer B, Kessing S. Trabeculotomy in juvenile primary open-angle glaucoma. Ophthalmic Surg. 1993 ; 24 : 663-8.
[11] Lotufo D, Ritch R, Szmyd L, Burris JE. Juvenile glaucoma, race, and refraction. JAMA. 1989 ; 261 : 249-52.
[12] Papadopoulos M, Cable N, Rahi J, Khaw PT. BIGES Investigators. The British Infantile and Childhood Glaucoma (BIG) Eye Study. Invest Ophthalmol Vis Sci. 2007 ; 48 : 4100-6.
[13] Rouland JF. Glaucoma in children and adolescents : visual field and optic nerve in children. J Fr Ophtalmol. 2009 ; 32 : 182-4.
[14] Scheie HG. Goniopuncture : an evaluation after 11 years. Arch Ophthalmol. 1961 ; 65 : 31-8.
[15] Stangos AN, Whatham AR, Sunaric-Megevand G. Primary viscocanalostomyfor juvenile open-angle glaucoma. Am J Ophthalmol. 2005 ; 140 : 490-6.
[16] Tawara A, Inomata H. Developmental immaturity of the trabecular meshwork in juvenile glaucoma. Am J Ophthalmol. 1984 ; 98 : 82-97.
[17] Tsai JC, Chang HW, Kao CN. Trabeculectomy with mitomycin C versus trabeculectomy alone for juvenile primary open-angle glaucoma. Ophthalmologica. 2003 ; 217 : 24-40.
[18] Yeung HH, Walton DS. Clinical classification of childhood glaucomas. Arch Ophthalmol. 2010 ; 128 : 680-4.
[19] Yeung HH, Walton DS. Goniotomy for juvenile open-angle glaucoma. J Glaucoma. 2010 ; 19 : 1-4.
F. Aptel
La prévalence et la sévérité du GPAO sont plus élevées chez les sujets mélanodermes que chez les sujets européens ou d’origine européenne.
Les sujets mélanodermes présentent des papilles de grande taille avec de grandes excavations, sans que le lien avec la prévalence accrue du glaucome ne soit démontré.
Il n’existe pas de preuves formelles d’une pression intra-oculaire plus élevée chez les sujets mélanodermes.
L’épaisseur cornéenne des patients mélanodermes est retrouvée plus fine que celle des sujets européens ou d’origine européenne dans toutes les études réalisées.
Une plus faible réponse au traitement médical hypotonisant chez les sujets mélanodermes reste discutée.
Le taux d’échec des chirurgies filtrantes réalisées avec ou sans antimétabolites est plus élevé.
D’assez nombreuses études épidémiologiques se sont intéressées à la prévalence du glaucome primitif à angle ouvert (GPAO) chez les sujets mélanodermes. Certaines de ces études ont évalué la prévalence de cette forme de glaucome dans des populations exclusivement ou très essentiellement constituées de sujets mélanodermes, et ont retrouvé des taux nettement supérieurs à ceux rapportés dans d’autres études conduites dans des lieux géographiques différents et sur des populations de peaux blanches ou claires. D’autres études ont évalué la prévalence du glaucome dans des populations mixtes et ont également retrouvé une prévalence plus élevée du GPAO chez les sujets mélanodermes. Ces études, s’accordent également pour montrer que le GPAO apparaît plus précocement, évolue plus rapidement et aboutit plus fréquemment à la cécité chez les sujets mélanodermes.
Les causes ou mécanismes de la fréquence et de la sévérité des GPAO chez les sujets mélanodermes ne sont pas parfaitement connus. Certaines caractéristiques anatomiques des yeux des sujets mélanodermes semblent différer significativement de celles des populations de peaux claires, notamment la morphologie de la tête du nerf optique (TNO) et de la couche des fibres nerveuses rétiniennes (FNR), et également l’épaisseur de la cornée, sans que l’on sache avec certitude si ces différences jouent un rôle dans la fréquence et la sévérité des glaucomes du mélanoderme. Certains facteurs de risque avérés de glaucome pourraient être plus fréquents chez les sujets mélanodermes, tels que l’hypertonie oculaire (HTO) et la myopie. Enfin, des facteurs de risque discutés, tels que le diabète et l’hypertension artérielle, sont de façon certaine plus fréquents chez les sujets mélanodermes.
Du fait de l’importance du processus de cicatrisation, les taux de survie dans le temps des chirurgies filtrantes sont significativement plus faibles chez les sujets mélanodermes. La différence de réponse aux classes thérapeutiques et aux trabéculoplasties, sélectives ou non, reste en revanche controversée.
Le terme mélanoderme désigne stricto sensu une personne de peau foncée. Il a pour inconvénient d’être mal défini – la limite entre peaux claires et foncées n’étant pas définie, et la pigmentation de la peau variant en fonction de l’exposition au soleil – et donc relativement subjectif. Il a en revanche pour avantage de désigner des personnes ayant en commun une plus forte quantité de mélanine dans certains tissus, quelle que soit leur origine géographique. Le terme mélanoderme est souvent utilisé pour désigner des personnes originaires du continent africain (Africains, Afro-Américains, habitants des Caraïbes, etc.), alors que des populations africaines ont la peau claire et des populations européennes ont la peau foncée. Dans les études anglo-saxonnes, le terme de « black » est souvent utilisé, ainsi que le terme d’Afro-Américain aux États-Unis.
L’expression « origine ethnique » est parfois utilisée dans certaines études, notamment francophones. Ce terme est également subjectif et mal défini. Selon certains, une ethnie désigne un groupe humain possédant un ou plusieurs traits socioculturels communs, comme une langue, une religion ou des traditions communes, sans que tous aient forcément une origine géographique commune (CNIL). De ce fait, il est plus juste de parler de groupe ethnique que d’origine ethnique, et ce terme est sans doute plus adapté au domaine des sciences sociales.
Le terme de race est également parfois utilisé, mais plutôt dans des études anglo-saxonnes. Ce terme est probablement impropre lui aussi. En biologie, la race est dans la taxonomie (classification des espèces) un rang de classification inférieur à l’espèce. De nombreux biologistes et généticiens s’accordent pour dire que les différentes populations de l’espèce humaine ne présentent probablement pas assez de différences de répartition des gènes pour que l’on puisse parler de race.
La fréquence du GPAO chez les sujets mélanodermes a été évoquée par plusieurs auteurs dès les années 1950 [25, 35]. Ces deux dernières décennies, plusieurs larges études épidémiologiques descriptives et analytiques ayant réalisé un dépistage du GPAO dans des populations entières, de sujets mélanodermes ou composées de populations mixtes, ont unanimement confirmé la prévalence élevée de cette forme de glaucome chez les mélanodermes. Un résumé de ces principales études est mentionné dans l’eTableau 13-1 [4, 21, 28, 29, 33, 41].
Ces mêmes études épidémiologiques montrent également que le GPAO apparaît plus précocement chez les sujets mélanodermes. Les prévalences retrouvées dans les différentes classes d’âge de ces études sont mentionnées dans l’eTableau 13-2 [4, 21, 28, 33, 41].
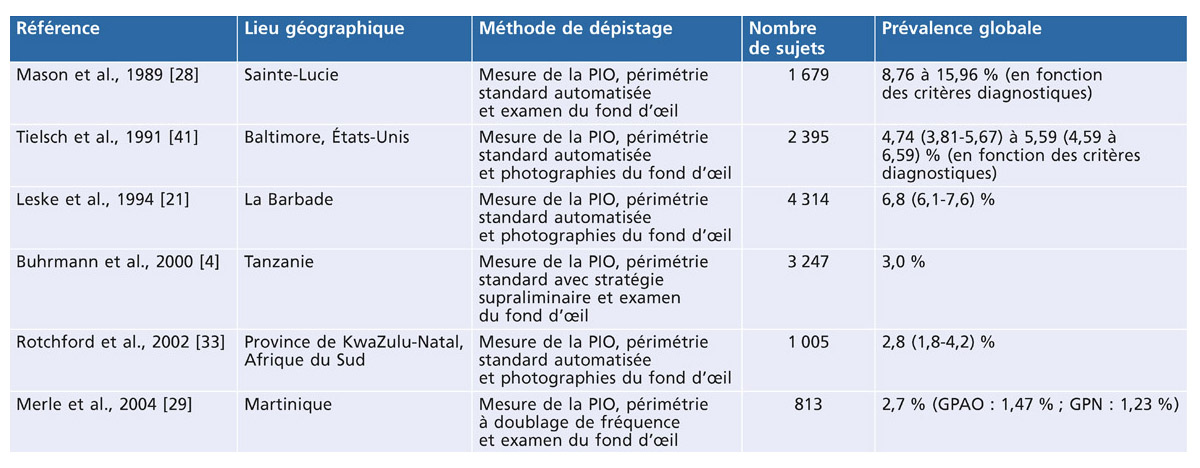
eTableau 13-1 Prévalence du GPAO dans les études épidémiologiques réalisant un dépistage du glaucome dans une population composée partiellement ou complètement de sujets mélanodermes. Prévalence et intervalle de confiance à 95 %.
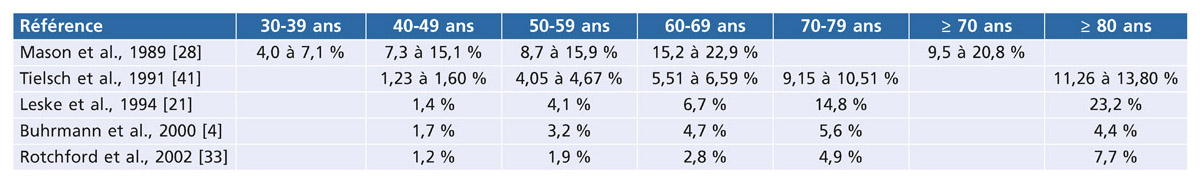
eTableau 13-2 Prévalence du GPAO en fonction de la classe d’âge dans des populations composées partiellement ou complètement de sujets mélanodermes. Prévalence et intervalle de confiance à 95 %.
Les glaucomes pigmentaires et pseudo-exfoliatifs sont considérés comme rares chez les sujets mélanodermes ; cependant, aucune large étude épidémiologique ne confirme cela formellement.
Les glaucomes par fermeture de l’angle sont également considérés comme peu fréquents chez les sujets mélanodermes. Luntz a retrouvé dans une région d’Afrique du Sud que les glaucomes par fermeture de l’angle représentaient 20 % du total des cas de glaucomes chez des sujets mélanodermes et 17 % chez des sujets blancs consultant dans un hôpital universitaire [25]. Les formes chroniques et peu symptomatiques étaient en revanche significativement plus fréquentes que les formes aiguës et symptomatiques chez les sujets mélanodermes (26,8 % de formes aiguës et 73,2 % de formes chroniques chez les sujets mélanodermes versus 53,6 % de formes aiguës et 46,4 % de formes chroniques chez les sujets blancs).
De nombreuses études ont retrouvé des différences significatives de la TNO et des FNR chez les sujets mélanodermes. Chez des sujets sains ont été mis en évidence une plus grande surface du disque optique, des plus grands diamètres horizontaux et verticaux du disque optique, un plus grand rapport cup/disc moyen, horizontal et vertical, une plus grande surface et un plus grand volume de l’excavation, de même qu’une plus grande profondeur maximale de l’excavation [5, 11, 26, 27, 42, 43]. Quatre études n’ont en revanche pas retrouvé de différences significatives de surface de l’anneau neurorétinien (ANR) entre des sujets mélanodermes et blancs [5, 27, 42, 43]. Chez des sujets hypertones et glaucomateux a été souligné un plus grand rapport cup/disc moyen et vertical [39, 46].
Une étude prospective est actuellement conduite aux États-Unis – l’étude ADAGES (African Descent and Glaucoma Evaluation Study) – afin d’évaluer entre autres les différences d’anatomie de la TNO et des FNR entre des sujets mélanodermes et blancs, l’évolution dans le temps de ces paramètres, et la recherche parmi ces paramètres d’éventuels facteurs prédictifs du risque de développement ultérieur d’un glaucome. Une description de ces différents paramètres anatomiques mesurés lors de l’inclusion des participants a été publiée récemment [12]. Les sujets mélanodermes avaient un disque optique de plus grande taille (OCT : 2,47 ± 0,45 versus 2,26 ± 0,43 mm² ; HRT : 2,06 ± 0,47 versus 1,77 ± 0,39 mm²) et une excavation plus profonde (HRT : 0,63 ± 0,19 versus 0,55 ± 0,21 mm) que les sujets blancs. La couche des fibres était plus épaisse chez les sujets mélanodermes et l’épaisseur maculaire ne différait pas significativement. On peut également noter que le volume et l’aire de l’ANR ne différaient pas significativement.
Les différentes études semblent donc montrer que les sujets mélanodermes sains ont des papilles de plus grande taille, avec des excavations plus grandes et plus profondes, mais une même quantité de tissu neurorétinien. Il n’existe pas de preuves formelles d’un lien – positif ou négatif – entre la taille de la papille et la susceptibilité de développer un glaucome. Certains suggèrent que les papilles de grande taille présentent une lame criblée plus sujette à un déplacement postérieur – induisant une contrainte mécanique sur les cellules ganglionnaires rétiniennes – en cas d’élévation pressionnelle. D’autres suggèrent au contraire que les papilles de grande taille sont associées à une quantité plus importante de tissu neurorétinien. Cette assertion est bien supportée par les résultats de l’étude récente ADAGES, qui retrouve une épaisseur plus importante de la couche des fibres nerveuses rétiniennes chez les sujets mélanodermes [12]. Plusieurs études réalisées sur des effectifs moins importants avaient néanmoins retrouvé des résultats opposés.
De nombreuses études ont montré que, parmi des populations de patients glaucomateux, les sujets mélanodermes présentaient des déficits périmétriques plus précoces (à atteinte structurelle identique), plus sévères et plus évolutifs (voir plus loin). De façon intéressante, plusieurs études ont également souligné que, chez des sujets sains, les mélanodermes présentaient souvent des résultats plus médiocres : indices globaux (MD, PSD, etc.) plus faibles, présence de points déficitaires plus nombreux, etc. [31, 34]. L’étude récente ADAGES semble le confirmer [31]. Après ajustement pour de nombreuses variables (âge, taille de la papille, épaisseur cornéenne, etc.), les sujets afro-américains présentaient des résultats plus médiocres : MD et PSD légèrement mais significativement plus faibles, présence de points déficitaires plus nombreux.
De nombreuses explications ont été avancées pour expliquer ces différences [32]. Certains ont suggéré une différence constitutionnelle des structures impliquées dans la fonction visuelle entre les sujets mélanodermes et les sujets blancs (notamment les cellules ganglionnaires rétiniennes), qui pourrait expliquer la facilité à développer un glaucome en cas de facteurs de risque de glaucome associés (hypertonie oculaire, etc.). D’autres explications, sans doute plus rationnelles, sont proposées : présence dans une population dite saine de sujets présentant des déficits glaucomateux débutants en plus grand nombre dans la population mélanoderme, caractère inadapté des bases de données normatives qui ont été établies essentiellement chez des sujets européens ou de descendance européenne, effet d’apprentissage plus important chez les sujets mélanodermes qui ont souvent un accès moins aisé à des consultations et examens ophtalmologiques, et enfin facteurs socioculturels, notamment de langage, les consignes pour la réalisation d’un champ visuel étant souvent données en anglais dans ces études.
L’examen des rares études évaluant la distribution des PIO chez des sujets mélanodermes – et la comparant à celle de sujets blancs – donne des résultats contradictoires. Un certain nombre d’études réalisées chez des sujets sains, hypertones ou glaucomateux retrouve des niveaux pressionnels plus élevés chez les sujets mélanodermes. Ainsi, la Barbados Eye Study, chez 4 601 sujets, retrouvait une PIO moyenne de 18,7 ± 5,2, 18,2 ± 3,8, et 16,5 ± 3,0 mmHg chez des sujets mélanodermes, métis et blancs, respectivement [22]. Une PIO de plus de 21 mmHg était retrouvée chez 18,4 %, 13,6 % et 4,6 % des sujets mélanodermes, métis et blancs respectivement. A contrario, un plus petit nombre d’études ne retrouvait pas de valeurs pressionnelles plus élevées chez les sujets mélanodermes. L’étude ADAGES, chez 1 221 sujets, ne soulignait pas non plus de différence significative de PIO (16,26 ± 3,90 mmHg chez les sujets mélanodermes versus 16,45 ± 4,48 mmHg chez les sujets de descendance européenne) [12, 31]. Il faut néanmoins noter que l’épaisseur cornéenne était significativement plus faible dans cette dernière étude chez les sujets mélanodermes (voir ci-après).
Plusieurs études semblent montrer que les sujets mélanodermes ont une épaisseur cornéenne plus fine. Un résumé des principales études est proposé dans le tableau 13-4 [1, 3, 20, 37]. Cette différence semble se vérifier à la fois dans chez les sujets sains, hypertones et glaucomateux.
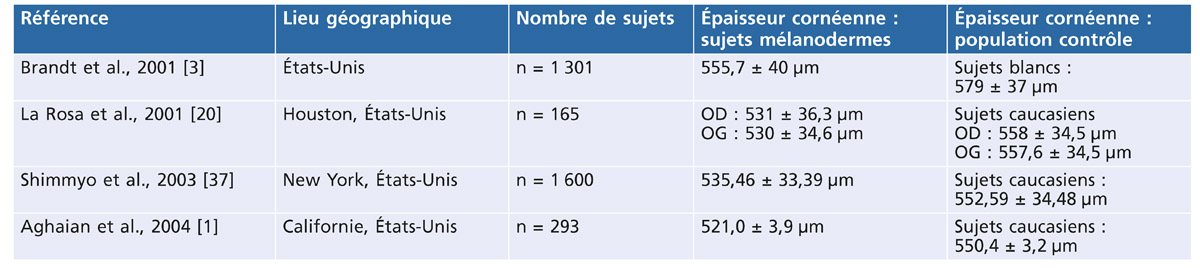
Tableau 13-4 Épaisseur cornéenne centrale de populations mélanodermes et d’origine européenne.
Les quelques études réalisées ne semblent pas retrouver une incidence et une prévalence de la myopie et d’autres troubles réfractifs plus élevées chez les sujets mélanodermes que chez les sujets d’origine européenne. L’étude Baltimore Eye Study retrouvait ainsi une prévalence plus faible de l’hypermétropie et de la myopie chez les sujets mélanodermes [16].
Des antécédents familiaux de GPAO sont fréquemment retrouvés chez les sujets mélanodermes. Ainsi, dans l’étude Barbados Family Study of Open-Angle Glaucoma, 39 % des sujets rapportaient avoir un ou plusieurs membres de leur famille atteints de glaucome [23]. Peu d’études ont comparé la distribution de mutations ou anomalies génétiques connues pour augmenter le risque de glaucome primitif à angle ouvert (MYOC, OPTN, GLC1A, etc.) dans des populations mélanodermes et d’origine européenne. La prévalence des mutations ne semblait pas différer significativement [8].
La prévalence du diabète et de ses complications, notamment oculaires, est sensiblement plus élevée chez les sujets mélanodermes que les sujets d’origine européenne [18]. L’existence d’une relation causale entre diabète et risque de développer une hypertonie oculaire et/ou un glaucome reste cependant controversée, et pas formellement établie.
De nombreuses études semblent indiquer une prévalence élevée de l’hypertension artérielle chez les sujets mélanodermes [19]. Néanmoins, et de façon similaire à d’autres facteurs de risques cardiovasculaires tels que le diabète, l’existence d’un lien entre hypertension artérielle et risque de survenue d’un glaucome, et la nature de ce lien, restent discutés.
Les études épidémiologiques montrent que le GPAO apparaît plus précocement chez les sujets mélanodermes (voir plus haut « Prévalence du GPAO » et eTableau 13-2) [4, 21, 28, 29, 33, 41]. D’autres études montrent également qu’à âge identique ou à stade de la maladie identique, les sujets mélanodermes présentent des déficits périmétriques ou des altérations de la TNO et des FNR plus importants, témoignant d’une plus grande sévérité du GPAO chez les sujets mélanodermes [2, 39].
Un petit nombre d’études semble également montrer que le taux de progression des déficits glaucomateux est plus élevé chez les sujets mélanodermes, traités ou non, que chez les sujets d’origine européenne [24, 45]. De nombreuses raisons peuvent être avancées pour expliquer ce caractère particulièrement évolutif du glaucome chez les sujets mélanodermes : une plus grande sensibilité aux différents facteurs de risque des différentes structures impliquées dans le développement d’un glaucome (cellules ganglionnaires rétiniennes, etc.), une plus faible réponse aux traitements médicaux et chirurgicaux, un médiocre accès aux soins et de fréquents retards diagnostiques, de même qu’une plus faible observance des traitements et du suivi.
Les sujets mélanodermes possèdent une quantité plus importante de mélanine dans le corps ciliaire, la choroïde, l’épithélium pigmenté rétinien et éventuellement l’iris. De nombreuses molécules hypotonisantes se lient à la mélanine, réduisant ainsi la fraction libre et donc active de ces molécules. De ce fait, l’efficacité de certains traitements hypotonisants peut être réduite chez les sujets mélanodermes [14].
En 1991, Sommer et al. [38] montraient dans un des rapports de la Baltimore Eye Survey que la PIO de sujets mélanodermes recevant un traitement médical ne différait pas significativement de la PIO de ceux ne recevant pas un traitement médical, alors que dans cette même étude la PIO des sujets blancs recevant un traitement médical était inférieure de plus de 5 mmHg à celle des sujets non traités (18,69 ± 3,23 mmHg versus 24,15 ± 5,23 mmHg). D’autres études ont retrouvé une baisse pressionnelle faible et peu durable chez des sujets mélanodermes traités par bêtabloquants (lévobunolol, timolol, bétaxolol), agonistes adrénergiques (dipivefrin) et pilocarpine.
Les études plus récentes, réalisées avec des classes thérapeutiques différentes (analogues de prostaglandines, α2-agonistes, inhibiteurs de l’anhydrase carbonique topiques) ne semblent plus montrer de différences significatives de réponse au traitement chez les sujets mélanodermes [15, 30]. Ainsi, dans l’OHTS, le traitement médical permettait une baisse pressionnelle de 22,6 ± 9,9 % chez les sujets afro-américains et de 22,4 ± 9,9 % chez les autres (différences non significatives) [15].
Peu d’études comparent l’efficacité du traitement par trabéculoplastie laser chez des sujets caucasiens et mélanodermes. Dans l’étude prospective multicentrique randomisée Advanced Glaucoma Intervention Study, le taux d’échec à dix ans de la trabéculoplastie au laser argon était de 49,2 % chez les sujets mélanodermes et de 52,5 % chez les sujets d’origine européenne (pas de différence significative) [7]. Aucune étude similaire n’a comparé l’effet de la trabéculoplastie sélective.
D’assez nombreuses études non comparatives évaluant le pronostic à moyen et long termes des chirurgies filtrantes (trabéculectomie, sclérectomie profonde non perforante, viscocanalostomie) chez des sujets mélanodermes montrent des taux de succès limités, et plus faibles que ceux retrouvés chez des sujets blancs [7, 10, 17, 36]. Ainsi, dans l’étude Advanced Glaucoma Intervention Study, la probabilité cumulée d’échec de la première trabéculectomie réalisée était de 31,9 % chez les sujets mélanodermes et de 17,7 % chez les sujets d’origine européenne [7]. En cas de réalisation d’une trabéculectomie chez des sujets ayant déjà bénéficié d’une trabéculoplastie au laser argon, la probabilité cumulée d’échec de la trabéculectomie réalisée était de 41,4 % chez les sujets mélanodermes et de 26,4 % chez les sujets d’origine européenne. Il faut cependant noter que peu de chirurgies avaient été réalisées en utilisant des agents antimitotiques, tels le 5-fluoro-uracile ou la mitomycine C, qui peuvent réduire le risque de fibrose conjonctivale chez ces sujets. Dans l’étude Tube versus Trabeculectomy, dans laquelle une éponge imprégnée de mitomycine C était appliquée sur la sclère pendant 4 minutes, l’origine ethnique du patient ne modifiait pas significativement le pronostic des traitements chirurgicaux réalisés [10].
Des études américaines ont montré que les Afro-Américains bénéficiaient moins souvent que les personnes d’origine européenne d’un examen ophtalmologique et d’un dépistage du glaucome [13, 44]. En cas de glaucome avéré, un traitement médical est moins fréquemment initié et poursuivi, et une chirurgie filtrante moins fréquemment réalisée [6, 13, 44]. Enfin, des études montrent que la connaissance de la pathologie et l’observance thérapeutique peuvent être plus faibles chez les sujets mélanodermes [9, 40].
Retenir
Le glaucome primitif à angle ouvert est plus fréquent, plus précoce, plus sévère et plus évolutif chez les sujets mélanodermes.
Une mesure de la PIO et un examen rigoureux de la TNO doivent être systématiques lors de l’examen ophtalmologique d’un patient mélanoderme.
La tête du nerf optique des sujets mélanodermes présente des particularités anatomiques (papilles de grande taille avec de grandes excavations) qui doivent être connues lors de son analyse clinique, photographique ou à l’aide des différentes technologies d’imagerie disponibles.
Les sujets mélanodermes présentent des cornées plus fines, aboutissant à une sous-estimation de la PIO mesurée.
Le risque de cicatrisation conjonctivale après chirurgie filtrante est plus élevé chez les sujets mélanodermes, et les agents antimétabolites doivent donc être utilisés fréquemment et en prolongeant leur application peropératoire.
[1] Aghaian E, Choe JE, Lin S, Stamper RL. Central corneal thickness of Caucasians, Chinese, Hispanics, Filipinos, African Americans, and Japanese in a glaucoma clinic. Ophthalmology. 2004 ; 111 : 2211-9.
[2] AGIS Investigators. The Advanced Glaucoma Intervention Study (AGIS) : 9. Comparison of glaucoma outcomes in black and white patients within treatment groups. Am J Ophthalmol. 2001 ; 132 : 311-20.
[3] Brandt JD, Beiser JA, Kass MA, Gordon MO. Central corneal thickness in the Ocular Hypertension Treatment Study (OHTS). Ophthalmology. 2001 ; 108 : 1779-88.
[4] Buhrmann RR, Quigley HA, Barron Y, et al. Prevalence of glaucoma in a rural East African population. Invest Ophthalmol Vis Sci. 2000 ; 41 : 40-8.
[5] Chi T, Ritch R, Stickler D, et al. Racial differences in optic nerve head parameters. Arch Ophthalmol. 1989 ; 107 : 836-9.
[6] Devgan U, Yu F, Kim E, Coleman AL. Surgical undertreatment of glaucoma in black beneficiaries of medicare. Arch Ophthalmol. 2000b ; 118 : 253-6.
[7] Ederer F, Gaasterland DA, Dally LG, et al. AGIS Investigators. The Advanced Glaucoma Intervention Study (AGIS) : 13. Comparison of treatment outcomes within race : 10-year results. Ophthalmology. 2004 ; 111 : 651-64.
[8] Fingert JH, Héon E, Liebmann JM, et al. Analysis of myocilin mutations in 1703 glaucoma patients from five different populations. Hum Mol Genet. 1999 ; 8 : 899-905.
[9] Gasch AT, Wang P, Pasquale LR. Determinants of glaucoma awareness in a general eye clinic. Ophthalmology. 2000 ; 107 : 303-8.
[10] Gedde SJ, Schiffman JC, Feuer WJ, et al. Tube versus Trabeculectomy Study Group. Treatment outcomes in the Tube Versus Trabeculectomy (TVT) study after five years of follow-up. Am J Ophthalmol. 2012 ; 153 : 789-803.
[11] Girkin CA, McGwin G, Xie A, Deleon-Ortega J. Differences in optic disc topography between black and white normal subjects. Ophthalmology. 2005 ; 112 : 33-9.
[12] Girkin CA, Sample PA, Liebmann JM, et al. ADAGES Group. African Descent and Glaucoma Evaluation Study (ADAGES) : II. Ancestry differences in optic disc, retinal nerve fiber layer, and macular structure in healthy subjects. Arch Ophthalmol. 2010 ; 128 : 541-50.
[13] Glynn RJ, Gurwitz JH, Bohn RL, et al. Old age and race as determinants of initiation of glaucoma therapy. Am J Epidemiol. 1993 ; 138 : 395-406.
[14] Harris LS, Galin MA. Effect of ocular pigmentation on hypotensive response to pilocarpine. Am J Ophthalmol. 1971 ; 72 : 923-5.
[15] Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study : a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002 ; 120 : 701-13 ; discussion : 829-30.
[16] Katz J, Tielsch JM, Sommer A. Prevalence and risk factors for refractive errors in an adult inner city population. Invest Ophthalmol Vis Sci. 1997 ; 38 : 334-40.
[17] Kim HY, Egbert PR, Singh K. Long-term comparison of primary trabeculectomy with 5-fluorouracil versus mitomycin C in West Africa. J Glaucoma. 2008 ; 17 : 578-83.
[18] Kountz D. Special considerations of care and risk management for african american patients with type 2 diabetes mellitus. J Natl Med Assoc. 2012 ; 104 : 265-73.
[19] Kramer H, Han C, Post W, et al. Racial/ethnic differences in hypertension and hypertension treatment and control in the multi-ethnic study of atherosclerosis (MESA). Am J Hypertens. 2004 ; 17 : 963-70.
[20] La Rosa FA, Gross RL, Orengo-Nania S. Central corneal thickness of Caucasians and African Americans in glaucomatous and nonglaucomatous populations. Arch Ophthalmol. 2001 ; 119 : 23-7.
[21] Leske MC, Connell AM, Schachat AP, Hyman L. The Barbados Eye Study. Prevalence of open angle glaucoma. Arch Ophthalmol. 1994 ; 112 : 821-9.
[22] Leske MC, Connell AM, Wu SY, et al. Risk factors for open-angle glaucoma. The Barbados Eye Study. Arch Ophthalmol. 1995 ; 113 : 918-24.
[23] Leske MC, Nemesure B, He Q, et al. Patterns of open-angle glaucoma in the Barbados Family Study. Ophthalmology. 2001 ; 108 : 1015-22.
[24] Lichter PR, Musch DC, Gillespie BW, et al. CIGTS Study Group. Interim clinical outcomes in the Collaborative Initial Glaucoma Treatment Study comparing initial treatment randomized to medications or surgery. Ophthalmology. 2001 ; 108 : 1943-53.
[25] Luntz MH. Primary angle-closure glaucoma in urbanized South African caucasoid and negroid communities. Br J Ophthalmol. 1973 ; 57 : 445-56.
[26] Mansour AM. Racial variation of optic disc parameters in children. Ophthalmic Surg. 1992 ; 23 : 469-71.
[27] Mansour AM. Racial variation of optic disc size. Ophthalmic Res. 1991 ; 23 : 67-72.
[28] Mason RP, Kosoko O, Wilson MR, et al. National survey of the prevalence and risk factors of glaucoma in St. Lucia, West Indies. Part I. Prevalence findings. Ophthalmology. 1989 ; 96 : 1363-8.
[29] Merle H, Renard A, Donnio A, et al. Glaucoma screening in Martinique. Results in 813 hospital employees. J Fr Ophtalmol. 2004 ; 27 : 136-42.
[30] Netland PA, Landry T, Sullivan EK, et al. Travoprost Study Group. Travoprost compared with latanoprost and timolol in patients with open-angle glaucoma or ocular hypertension. Am J Ophthalmol. 2001 ; 132 : 472-84.
[31] Racette L, Liebmann JM, Girkin CA, et al. ADAGES Group. African Descent and Glaucoma Evaluation Study (ADAGES) : III. Ancestry differences in visual function in healthy eyes. Arch Ophthalmol. 2010 ; 128 : 551-9.
[32] Racette L, Wilson MR, Zangwill LM, et al. Primary open-angle glaucoma in blacks : a review. Surv Ophthalmol. 2003 ; 48 : 295-313.
[33] Rotchford AP, Johnson GJ. Glaucoma in Zulus : a population-based cross-sectional survey in a rural district in South Africa. Arch Ophthalmol. 2002 ; 120 : 471-8.
[34] Rubin GS, West SK, Muñoz B, et al. A comprehensive assessment of visual impairment in a population of older Americans. The SEE Study. Salisbury Eye Evaluation Project. Invest Ophthalmol Vis Sci. 1997 ; 38 : 557-68.
[35] Sarkies JW. Primary glaucoma amongst Gold Coast Africans. Br J Ophthalmol. 1953 ; 37 : 615-20.
[36] Shah P, Agrawal P, Khaw PT, et al. ReGAE 7 : long-term outcomes of augmented trabeculectomy with mitomycin C in African Caribbean patients. Clin Experiment Ophthalmol. 2012 ; 40 : e176-82.
[37] Shimmyo M, Ross AJ, Moy A, Mostafavi R. Intraocular pressure, Goldmann applanation tension, corneal thickness, and corneal curvature in Caucasians, Asians, Hispanics, and African Americans. Am J Ophthalmol. 2003 ; 136 : 603-13.
[38] Sommer A, Tielsch JM, Katz J, et al. Relationship between intraocular pressure and primary open angle glaucoma among white and black Americans. The Baltimore Eye Survey. Arch Ophthalmol. 1991 ; 109 : 1090-5.
[39] The Glaucoma Laser Trial (GLT) : 5. Subgroup differences at enrollment. Glaucoma Laser Trial Research Group. Ophthalmic Surg. 1993 ; 24 : 232-40.
[40] Tielsch JM, Sommer A, Katz J, et al. Socioeconomic status and visual impairment among urban Americans. Baltimore Eye Survey Research Group. Arch Ophthalmol. 1991 ; 109 : 637-41.
[41] Tielsch JM, Sommer A, Katz J, et al. Racial variations in the prevalence of primary open-angle glaucoma. The Baltimore Eye Survey. JAMA. 1991 ; 266 : 369-74.
[42] Tsai CS, Zangwill L, Gonzalez C, et al. Ethnic differences in optic nerve head topography. J Glaucoma. 1995 ; 4 : 248-57.
[43] Varma R, Tielsch JM, Quigley HA, et al. Race-, age-, gender-, and refractive error-related differences in the normal optic disc. Arch Ophthalmol. 1994 ; 112 : 1068-76.
[44] Wang F, Javitt JC, Tielsch JM. Racial variations in treatment for glaucoma and cataract among Medicare recipients. Ophthalmic Epidemiol. 1997 ; 4 : 89-100.
[45] Wilson MR, Kosoko O, Cowan CL, et al. Progression of visual field loss in untreated glaucoma patients and glaucoma suspects in St. Lucia, West Indies. Am J Ophthalmol. 2002 ; 134 : 399-405.
[46] Zangwill LM, Weinreb RN, Berry CC, et al. Confocal Scanning Laser Ophthalmoscopy Ancillary Study to the Ocular Hypertension Treatment Study. Racial differences in optic disc topography : baseline results from the confocal scanning laser ophthalmoscopy ancillary study to the ocular hypertension treatment study. Arch Ophthalmol. 2004 ; 122 : 22-8.
P. Germain
Le traitement antiglaucomateux peut favoriser la survenue d’une cataracte.
La survenue d’une cataracte a un impact sur le suivi et l’évolution de la pathologie glaucomateuse.
La chirurgie de la cataracte a des répercussions sur la pathologie glaucomateuse.
Cataracte et glaucome sont deux pathologies dont la prévalence augmente avec l’âge. Des modifications cristalliniennes sont retrouvées chez 60 % des patients âgés de 65 à 74 ans et chez plus de 90 % des patients de plus de 75 ans [31]. Aussi, avec le vieillissement global de la population, la prise en charge de patients présentant ces deux entités est de plus en plus fréquente.
La survenue d’une cataracte va modifier le cours de la vie d’un patient présentant un GPAO. En effet, le handicap fonctionnel sera majoré, le contrôle de la maladie glaucomateuse pourra devenir plus difficile à obtenir et les moyens de surveillance habituels du glaucome, qu’ils soient fonctionnels ou structuraux, seront parfois pris en défaut. De nouvelles décisions thérapeutiques peuvent s’avérer nécessaires. Pour faire le bon choix, le clinicien devra connaître l’impact d’une chirurgie de la cataracte sur l’évolution du glaucome.
Ces deux pathologies présentent des interactions :
d’une part, l’incidence de la survenue et de la progression de la cataracte dans une population glaucomateuse est en effet plus élevée que dans une population normale. Les facteurs étiologiques sont mal connus. La maladie glaucomateuse, mais surtout ses traitements, semblent impliqués ;
d’autre part, le développement d’une cataracte chez un patient glaucomateux va entraîner des altérations fonctionnelles qui vont interférer dans la vision d’un patient déjà porteur d’un handicap et donc modifier sa qualité de vie. Les modifications anatomiques du cristallin avec le temps sont bien connues. Grâce aux nouvelles technologies, les relations étroites entre le cristallin et les structures d’évacuation trabéculaires sont mieux comprises.
Bien qu’aucune des grandes études cliniques à notre disposition n’ait été formatée pour analyser les facteurs cataractogènes dans une population glaucomateuse, il a été suggéré que la cataracte pourrait résulter de la maladie glaucomateuse, de son traitement ou des deux. Les principales études longitudinales à notre disposition ont été analysées par une équipe du Moorfields Eye Hospital pour confirmer ces soupçons [20].
Une étude de cohorte australienne rapporte qu’une hypertension oculaire (HTO) non traitée pourrait multiplier par deux le risque de développer une cataracte de type nucléaire (et non pas corticale ou sous-capsulaire postérieure) sur un suivi de cinq ans [3]. Dans une autre étude sur une population mélanoderme, ce risque apparaît plus faible (risk ratio à 1,4) [17]. L’élévation pressionnelle pourrait être le facteur étiopathogénique de l’altération cristallinienne.
Les collyres hypotonisants sont incriminés dans la survenue d’une cataracte depuis des années. Le rôle iatrogène de la pilocarpine et des anticholinestérases est bien connu. L’impact des collyres de première intention est également suspecté. Parmi les études de cohorte, l’étude de la population des Barbades rapporte que l’utilisation de bêtabloquants en combinaison avec d’autres molécules multiplie par trois le risque de survenue d’opacités nucléaires quatre ans plus tard, en comparaison avec une population non traitée [17]. L’étude EMGT (Early Manifest Glaucoma Treatment Study) retrouve également une augmentation de l’incidence de survenue d’opacités nucléaires dans le groupe traité par bétaxolol et trabéculoplastie en comparaison avec le groupe non traité [9]. L’OHTS (Ocular Hypertension Treatment Study) retrouve un taux plus élevé de chirurgie de cataracte dans le groupe traité (7,6 %) en comparaison avec le groupe non traité (5,6 %) sur un suivi de 6,3 ans [11].
Le traitement médical semble donc augmenter le risque de survenue d’une cataracte, en particulier de type nucléaire. Le mécanisme par lequel le traitement médical augmenterait la formation de la cataracte n’est pas clairement établi : altération du métabolisme du cristallin lié à la diminution du flux d’humeur aqueuse, rôle néfaste du chlorure de benzalkonium ?
Le rôle cataractogène de la trabéculectomie est beaucoup mieux documenté. Là encore, l’analyse des principales études longitudinales rapporte qu’une phaco-exérèse est réalisée chez 20 à 52 % des patients ayant bénéficiés d’une trabéculectomie sur un suivi allant jusqu’à sept ans [20]. La CIGTS (Collaborative Initial Glaucoma Treatment Study) propose comme traitement initial soit la chirurgie, soit le traitement médical. Elle retrouve dans le groupe trabéculectomie un risque de phaco-exérèse multiplié par huit, risque qui diminue avec le temps. En effet, après cinq ans, ce risque n’est plus que trois fois plus important, l’âge jouant alors un rôle dans la survenue de la cataracte dans les deux groupes [21]. En ce qui concerne les yeux affectés d’un glaucome avancé de l’étude AGIS (Advanced Glaucoma Intervention Study), la trabéculectomie augmente le risque de développer une cataracte de 78 % [33].
Les techniques non perforantes semblent moins cataractogènes. Cela se conçoit si l’on considère les facteurs étiologiques qui pourraient être impliqués dans la survenue de la cataracte. L’iridectomie classiquement proposée lors de la réalisation d’une trabéculectomie pourrait contribuer, par l’inflammation induite, au développement de la cataracte. Certains auteurs recommandent même de réaliser cette iridectomie seulement dans les yeux prédisposés à avoir une chambre antérieure étroite [6]. Une hypotonie précoce avec chambre antérieure étroite semble également être un facteur de risque : dans ce cas, le patient aura un risque sur deux de développer une cataracte à cinq ans [34] (fig. 13-18).
Le rôle des antimétabolites est également souligné. Une toxicité directe par la mitomycine C est probable, dose-dépendante [28]. Le 5-fluoro-uracile ne semble pas avoir cet inconvénient [36].
En pratique, il est important de signaler ce risque de cataracte à tout patient devant bénéficier d’une chirurgie filtrante.
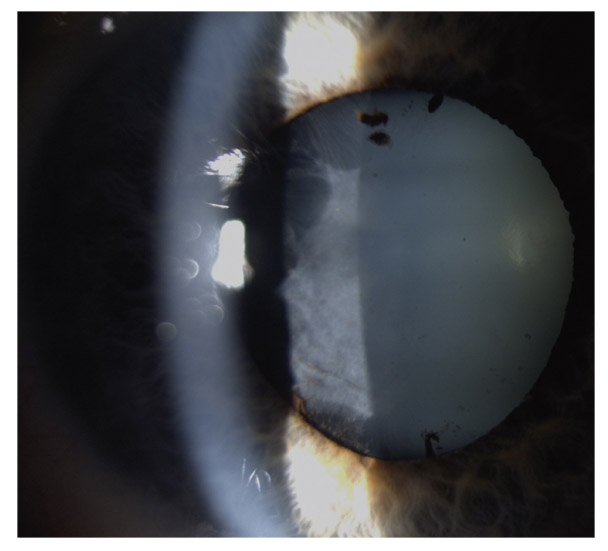
Fig. 13-18 Cataracte rapidement évolutive après trabéculectomie réalisée deux mois auparavant. Hypotonie et hypothalamie postopératoires précoces.
Le cristallin est un organe cinétique qui se modifie avec le temps. Son poids et son volume triplent de la naissance jusqu’à la sénescence. Après l’enfance, son épaisseur poursuit une augmentation linéaire. Parmi les techniques nouvelles d’imagerie, la tomographie à cohérence optique (OCT) semble être un outil parfaitement adapté pour mesurer l’épaisseur cristallinienne. Il s’agit d’une méthode non contact reproductible [37]. Cette épaisseur augmente de 21 µm par an [27]. L’évolution du cristallin dans le temps va entraîner des modifications de nombreux paramètres biométriques de tout le segment antérieur. Avec l’OCT, il est possible, après localisation de l’éperon scléral, d’étudier de façon précise et reproductible un certain nombre de paramètres biométriques : profondeur de la chambre antérieure, courbure irienne, épaisseur irienne en différents points, flèche cristallinienne, etc. L’étude d’une population coréenne de 388 personnes âgées de 30 à 89 ans montre qu’avec l’âge, la profondeur de la chambre antérieure diminue et l’angle irido-cornéen devient plus étroit [32].
En pratique clinique, cela signifie qu’il faut répéter l’examen gonioscopique tout au long du suivi, car un GPAO peut se transformer avec le temps en un glaucome à angle étroit.
Une apposition irienne trabéculaire intermittente, en particulier nocturne, peut se produire. Si une iridotomie n’est pas réalisée, une apposition définitive plus ou moins étendue survient, avec constitution de synéchies antérieures périphériques. Par ailleurs, l’angle devenu étroit d’un GPAO peut s’élargir après la réalisation d’une iridotomie, mais la pression intra-oculaire (PIO) peut rester élevée : on parle alors de glaucome de mécanisme combiné (combined mechanism glaucoma des Anglo-Saxons). À noter que le terme différent de glaucome de mécanisme mixte (mixed mechanism glaucoma) correspond à un glaucome qui combine plusieurs mécanismes (par exemple GPAO et glaucome cortisonique, GPAO et inflammation, etc.).
Il est classique de dire qu’un patient glaucomateux garde une acuité visuelle centrale satisfaisante jusqu’à un stade très évolué de sa maladie. La cataracte induit une perte de contraste par diffusion de la lumière, alors que le glaucome entraîne des scotomes parfois rapidement ressentis par le patient lorsqu’ils sont paracentraux. L’examen du champ visuel en périmétrie automatisée standard (blanc-blanc) permet en règle générale d’évaluer la pathologie glaucomateuse même en cas de cataracte assez avancée. En revanche, la périmétrie bleu-jaune n’est pas fiable lorsqu’une cataracte est présente. En périmétrie Humphrey, l’effet de la cataracte sur les indices classiques (MD et PSD) et sur le VFI a été étudié [26]. Les auteurs de cette étude ont comparé ces paramètres avant et après une phaco-exérèse réalisée chez des patients glaucomateux. Le MD s’améliore après la chirurgie, et le PSD s’aggrave (le déficit glaucomateux est en quelque sorte mieux souligné). De façon intéressante, le VFI est inchangé, n’étant pas affecté par la cataracte. Une autre étude montre que l’indice de progression du glaucome est influencé par la présence d’une cataracte, ce qui peut rendre la détection d’une progression du glaucome plus difficile chez les patients glaucomateux porteurs d’une cataracte [1].
L’impact de la cataracte dans la vie d’un patient glaucomateux a pu être évalué par des tests visuels spécifiques de qualité de vie sur un suivi de presque huit ans chez plus de 600 patients [21]. Ces tests permettent de retrouver un certain nombre de facteurs de risque de survenue d’une cataracte (chirurgie du glaucome, âge, myopie, glaucome pseudo-exfoliatif). Ils sont capables de détecter l’aggravation de la cataracte et l’amélioration de la vision en postopératoire.
La survenue d’une cataracte chez un patient glaucomateux modifie également les mesures obtenues avec les analyseurs de fibres nerveuses rétiniennes (FNR). Le GDx™ utilise le principe de biréfringence de la couche des FNR. Cependant, cette biréfringence est également une propriété de la cornée et à un moindre degré du cristallin. La dernière génération de GDx™, dont la commercialisation a été suspendue en 2013, permet de s’affranchir de la biréfringence cornéenne. Le rôle de la cataracte est actuellement précisé. Les principaux indices du GDx™ sont influencés par la cataracte avec une sous-estimation des paramètres d’épaisseur. Celle-ci ne doit pas conduire à des modifications thérapeutiques inappropriées. Le NFI (nerve fiber indicator) est reconnu comme étant un paramètre très sensible à la dégradation du glaucome. Une amélioration apparente de ce paramètre après chirurgie de la cataracte ne doit pas fausser l’appréciation de la maladie glaucomateuse, et il est recommandé de s’appuyer sur une nouvelle référence d’examen pour le suivi ultérieur [5]. Ces recommandations s’appliquent également à l’OCT où la présence d’une cataracte entraîne des erreurs de segmentation, parfois dans la mesure des FNR péripapillaires mais surtout dans l’analyse du complexe cellulaire ganglionnaire [22] (fig. 13-19). Cependant, l’indice de puissance du signal est volontiers affecté par la cataracte et évite alors fréquemment les sources d’erreur d’interprétation, voire la réalisation, de cet examen [15].
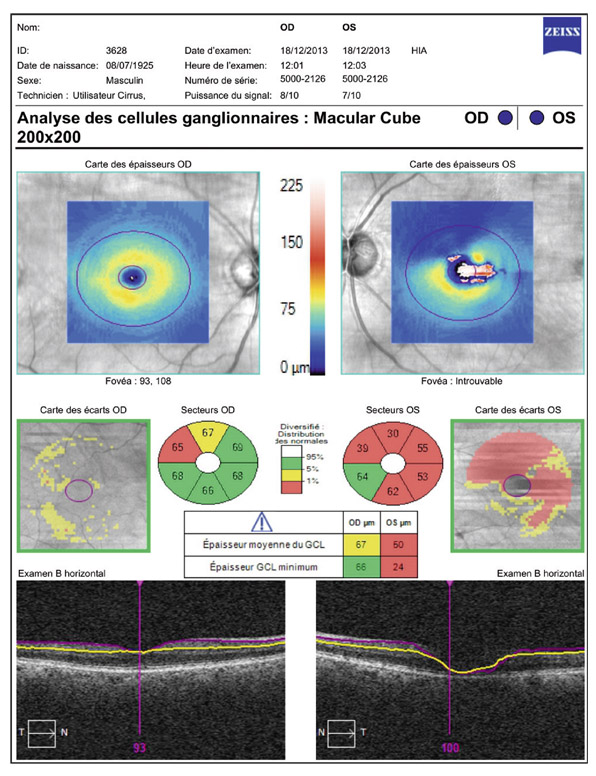
Fig. 13-19 Examen OCT montrant l’erreur de segmentation avec le complexe cellulaire ganglionnaire. (Doc. : J.-P. Renard.)
Un patient glaucomateux risque au cours de sa vie d’être confronté à une chirurgie de la cataracte. L’extraction de cette cataracte pourrait dans certains cas exercer un effet favorable sur PIO, mais parfois poser problème si le patient a déjà bénéficié d’une chirurgie filtrante.
De nombreuses études ont montré que la PIO avait tendance à être plus basse après une chirurgie de cataracte non compliquée. Cette baisse pressionnelle est de 2 à 4 mmHg un an après la chirurgie et est plus marquée si le patient n’a pas de dégâts glaucomateux [33].
Cet effet pressionnel pourrait se maintenir dans le temps, mais en s’amenuisant. Ainsi cette baisse est encore de 1,4 à 1,7 mmHg trois à cinq ans après la chirurgie chez des patients glaucomateux ou non [30].
Une grande étude avec un suivi de dix ans a montré que la baisse pressionnelle obtenue après chirurgie de cataracte pourrait être dépendante des valeurs pressionnelles de départ. Ainsi la réduction pressionnelle postopératoire est d’autant plus importante que les valeurs de PIO de départ sont élevées. Les valeurs de PIO demeurent inchangées sur les yeux ayant les valeurs pressionnelles préopératoires les plus basses. Ainsi un patient glaucomateux bien équilibré sur le plan pressionnel n’obtiendrait pas de baisse pressionnelle importante après une chirurgie de cataracte [25].
Les patients glaucomateux sont plus sujets aux pics pressionnels postopératoires. Ces pics pressionnels sont en général précoces, survenant quatre heures après la chirurgie, et passent le plus souvent inaperçus. Ils sont d’autant plus importants que la pathologie glaucomateuse est avancée [10]. Des patients avec une pathologie glaucomateuse sévère pourraient ainsi aggraver brutalement leur maladie glaucomateuse. Ces pics pressionnels, plus fréquents et plus importants en cas de syndrome pseudo-exfoliatif, peuvent être liés à des résidus de produit viscoélastique intracamérulaires, à des phénomènes inflammatoires induits par la chirurgie de la cataracte, ou encore à une réponse à la corticothérapie locale [18].
L’OHTS s’est récemment focalisée sur ce point précis : quelle baisse pressionnelle est obtenue par une chirurgie de la cataracte en cas d’HTO isolée [19] ? En étudiant le groupe non traité, indemne de réalisation d’iridotomie ou de trabéculectomie et ayant bénéficié d’une chirurgie de la cataracte, les auteurs rapportent une baisse pressionnelle de 16 % à 36 mois. L’importance de cette baisse pressionnelle est, là encore, retrouvée dépendante des valeurs pressionnelles initiales. Cependant, la moitié de la baisse pressionnelle initiale est perdue à trois ans. Ces données intéressantes ne peuvent toutefois pas être extrapolées à des patients glaucomateux ou à des patients traités médicalement.
Le mécanisme de la réduction pressionnelle après chirurgie de la cataracte est inconnu. Des facteurs étiologiques mécaniques sont soupçonnés : il est souvent avancé que l’extraction du cristallin favorise un élargissement de l’angle et donc une amélioration du flux d’excrétion trabéculaire. D’autres auteurs pensent que la chirurgie de la cataracte permet à la zonule d’exercer une traction sur le corps ciliaire, ce qui libérerait la compression du trabéculum et du canal de Schlemm [25]. La traction exercée par la zonule sur le corps ciliaire pourrait diminuer la production d’humeur aqueuse [30]. L’irrigation mécanique pendant la phaco-émulsification pourrait laver le trabéculum. Le rôle de facteurs biochimiques est également avancé : hyposécrétion d’humeur aqueuse secondaire à l’inflammation des corps ciliaires, sécrétion endogène de prostaglandines, production d’interleukines-1α par le trabéculum. La réduction pressionnelle inférieure notée chez le patient glaucomateux pourrait être liée au fait que le trabéculum pathologique serait moins sensible à ces différents mécanismes.
Une meilleure compréhension de la baisse pressionnelle liée à l’extraction cristallinienne pourrait être obtenue par les études reproductibles en OCT de certains facteurs biométriques. Certains paramètres ont été étudiés avant la chirurgie de la cataracte et trois mois après [13] : ouverture de l’angle à 500 µm de l’éperon scléral ; angle, volume, profondeur et largeur de la chambre antérieure ; flèche cristallinienne ; courbure irienne. L’étude confirme l’ouverture de l’angle de la chambre antérieure et son approfondissement après phaco-émulsification avec mise en place d’un implant de chambre postérieure pliable. La réduction pressionnelle postopératoire notée est proportionnelle à cette réouverture angulaire. Plus intéressante encore, la mesure de la flèche cristallinienne en préopératoire est un facteur corrélé à la baisse pressionnelle obtenue à trois mois. Ce paramètre pourrait être un facteur prédictif d’ouverture angulaire et de réduction pressionnelle après chirurgie de la cataracte. Ces paramètres morphométriques ont également été analysés en cas de glaucome chronique par fermeture de l’angle et de GPAO [15]. Dans ces deux types de glaucomes, l’angle s’ouvre et la chambre antérieure s’approfondit, mais l’effet sur la PIO est différent : une baisse pressionnelle est notée en postopératoire immédiat dans le groupe glaucome par fermeture de l’angle, alors qu’une montée pressionnelle est constatée dans le groupe à angle ouvert. Au terme de l’étude, l’abaissement pressionnel est conséquent dans le groupe à angle fermé (27 %) alors qu’il est insignifiant dans le groupe à angle ouvert.
La chirurgie de la cataracte réalisée sur des yeux présentant une bulle de filtration fonctionnelle augmente le risque d’échec de la chirurgie filtrante en postopératoire. Certains facteurs de risque d’échec ont été identifiés [4]. L’extraction extracapsulaire manuelle triple ce risque en comparaison avec la phaco-émulsification. La manipulation de l’iris en cours de chirurgie joue un rôle défavorable. Un âge jeune au moment de l’intervention de la cataracte (< 51 ans), une pression oculaire supérieure à 10 mmHg avant l’intervention et un pic pressionnel postopératoire précoce (> 25 mmHg) sont associés à un moins bon contrôle pressionnel postopératoire. En revanche, le fait de réaliser la chirurgie de cataracte au moins six mois après la chirurgie filtrante limiterait le risque d’échec. Certains critères ultrasoniques de la bulle de filtration pourraient représenter un risque d’échec (bulle sans trajet visible dans l’espace sous-scléral, hyper-réflectivité à l’intérieur de la bulle) [35]. Cependant, en reprenant toutes les études s’intéressant à ce sujet, de nombreux biais sont identifiés (méthodologie de l’étude, biais statistiques, utilisation ou non d’antimétabolites lors de l’intervention filtrante, etc.). À l’issue de cette analyse, les auteurs ne peuvent apporter de preuves solides pour conseiller qu’une phaco-exérèse soit réalisée dans le même temps ou après la trabéculectomie [24].
L’examen attentif du cristallin d’un patient porteur d’un glaucome chronique à angle ouvert conduit parfois, en mettant en évidence des anomalies parfois discrètes, à une révision du diagnostic.
Cette entité clinique n’est pas toujours de diagnostic aisé. Une unilatéralité de la maladie glaucomateuse peut éveiller des soupçons. Son diagnostic est bien sûr aidé par la présence des dépôts classiques sur la margelle pupillaire, réalisant un liseré de dépôts duveteux blanchâtres. La présence de ces dépôts est plus rarement retrouvée au niveau angulaire. Les dépôts retrouvés sur la cristalloïde antérieure représentent dans leur forme typique un aspect en cocarde bien caractéristique. Cependant, au stade de début de la maladie, ils sont difficiles à voir et il faut savoir les rechercher attentivement sur une pupille dilatée. Une cataracte est associée dans environ 50 % des cas, avec les particularités bien connues de fragilité zonulaire. Ces dépôts peuvent être retrouvés sur la face antérieure d’un implant de chambre postérieure (fig. 13-20).

Fig. 13-20 Dépôts de matériel exfoliatif sur la face antérieure de l’implant de chambre postérieure.
Cette forme clinique n’est, là encore, pas toujours facile à mettre en évidence. Elle survient volontiers dans une population d’adultes jeunes, de sexe masculin et myopes. Le syndrome de dispersion pigmentaire est classiquement retrouvé avec ses dépôts pigmentés sur la face postérieure de la cornée et au niveau trabéculaire. Le pigment peut également être observé sur la surface antérieure du cristallin, sur son équateur ou même à la jonction de la zonule et de la capsule postérieure (ligne de Scheie).
Le cristallin intervient dans la physiopathogénie de cette affection. Une relation étroite entre le nombre et la localisation des zones transilluminables et les paquets de fibres zonulaires s’insérant sur la capsule antérieure a été mise en évidence. En moyenne, 65 à 80 paquets de fibres sont responsables d’autant de zones transilluminables, adoptant une disposition radiaire. L’existence fréquente d’une concavité antérieure de l’iris est notée, comme si l’iris était trop grand pour l’œil. Il est alors proposé que la friction de l’iris sur les fibres zonulaires soit la cause du syndrome de dispersion pigmentaire [2].
Le concept de bloc pupillaire inverse est ensuite introduit : un gradient pressionnel entre les chambres antérieure et postérieure serait responsable d’un bombé irien postérieur entraînant un contact irido-zonulaire étroit [14]. La séquence d’événements conduisant à ce bloc pupillaire inverse, confirmée par des études en UBM, pourrait être initiée par des phénomènes physiologiques tels que l’accommodation, le clignement des paupières ou l’exercice physique. En effet, l’iris se comporte comme une valve laissant passer l’humeur aqueuse de la chambre postérieure vers la chambre antérieure. Le contact irido-zonulaire est majoré dans ces yeux prédisposés, ce qui empêche un équilibre pressionnel entre les chambres et conduit au bloc pupillaire inverse.
L’accommodation peut entraîner une majoration de la concavité antérieure de l’iris, augmentant elle-même la dispersion pigmentaire. Les travaux en UBM ont montré que l’accommodation produit un déplacement antérieur du cristallin, diminuant la profondeur de la chambre antérieure. Il en résulte une augmentation de la pression dans la chambre antérieure et l’iris est alors davantage plaqué en arrière sur le cristallin avec une augmentation du contact irido-zonulaire. Cette théorie pourrait expliquer le jeune âge de survenue du glaucome pigmentaire, l’accommodation étant active chez le jeune [23].
Il est ainsi important de savoir repérer les signes d’examen conduisant au diagnostic de ces deux affections. En effet, leur pronostic est volontiers plus sombre. La stratégie thérapeutique mise en œuvre pour les prendre en charge sera parfois différente de celle utilisée pour un GPAO en raison de leurs spécificités anatomique et physiopathogénique.
Tout un pan de la chirurgie réfractive est représenté par la chirurgie endoculaire. Elle consiste soit à placer un implant dans la chambre antérieure ou postérieure de l’œil en laissant le cristallin en place, soit à réaliser une phaco-exérèse chez un patient ne présentant pas de cataracte. Toutes ces techniques peuvent avoir des répercussions pressionnelles.
Réalisée pour corriger une myopie forte (> – 8 à – 10 D) [12], elle permet d’éviter le risque d’ectasie cornéenne possible après une chirurgie LASIK en cas de présence d’un lit stromal résiduel trop fin.
Différentes techniques offrent l’avantage, en laissant le cristallin en place, de préserver l’accommodation naturelle. Par ailleurs, le risque de décollement de rétine est moins élevé qu’avec la chirurgie du cristallin clair car la déstabilisation vitréenne est moindre.
Trois solutions sont proposées. La première consiste à placer dans la chambre antérieure un implant à fixation irienne : sont disponibles un implant de PMMA (Artisan) introduit par une incision cornéenne assez grande (5 à 6 mm) ou un implant en acrylique (Artiflex) autorisant une incision de 3 mm. La pose dans la chambre postérieure, entre l’iris et la face antérieure du cristallin, d’un implant souple est beaucoup moins répandue actuellement. Enfin, la mise en place d’implant de chambre antérieure à support angulaire est actuellement délaissée en raison des complications plus importantes observées (halos nocturnes, ovalisation pupillaire, perte cellulaire endothéliale) [16]. La réalisation d’une iridotomie est nécessaire pour éviter un blocage pupillaire. Elle est pratiquée au laser en préopératoire ou chirurgicalement lors de l’intervention.
Le capital endothélial cellulaire doit être suffisant, en particulier si une implantation en chambre antérieure est réalisée. Un autre problème est représenté par la diminution de la profondeur de la chambre antérieure avec le temps. Peu gênant chez le myope dont la chambre antérieure est généralement profonde, l’utilisation de ces implants pour corriger l’hypermétropie est plus limitée. La survenue d’une cataracte est une éventualité propre à l’implantation précristallinienne. Des opacités sous-capsulaires antérieures se développent dans 6 à 7 % des cas sur un suivi de sept ans [29].
Ces techniques manipulant l’iris peuvent entraîner une dispersion pigmentaire secondaire, responsable d’un encombrement trabéculaire et d’une augmentation précoce de la PIO. L’iridotomie peut se boucher par du pigment et conduire à un glaucome par blocage pupillaire nécessitant une chirurgie filtrante précoce. L’élévation pressionnelle peut être plus tardive : une élévation supérieure à 2 mmHg est rapportée dans un groupe de 27 yeux de 15 patients ayant bénéficié d’une implantation précristallinienne à l’issue d’un suivi de 17 mois en moyenne [7].
Pour toutes ces raisons, l’existence d’une cataracte, d’un glaucome, d’une uvéite ou de toute pathologie cornéenne ou rétinienne évolutive constitue une contre-indication à l’emploi de cette chirurgie réfractive endoculaire.
Cette technique efficace reste très controversée chez un patient myope fort, car le risque de décollement rétinien du pseudo-phake est augmenté et majoré après capsulotomie au laser YAG. Par ailleurs, le pouvoir d’accommodation disparaît, et la prédictibilité du calcul d’implant est moindre.
En revanche, une baisse pressionnelle de 2 mmHg en moyenne a pu être observée [7]. Cependant, cet effet est sans doute modeste sur ces yeux présentant en règle générale un angle largement ouvert.
Là encore, cette chirurgie n’a pas sa place chez le patient myope fort glaucomateux chez qui d’autres priorités thérapeutiques doivent être respectées.
Retenir
Le traitement du GPAO, en particulier chirurgical, favorise la survenue d’une cataracte : le patient doit être prévenu de cette éventualité.
L’angle iridocornéen d’un patient porteur d’un GPAO peut devenir étroit dans le temps du fait d’une augmentation de volume du cristallin : il faut savoir répéter l’examen gonioscopique régulièrement.
La survenue d’une cataracte affecte le suivi d’un patient glaucomateux : certains paramètres de la périmétrie et des examens structuraux peuvent être modifiés.
La chirurgie de la cataracte entraîne une baisse pressionnelle d’importance variable, moindre en présence de glaucome évolué. Elle est dépendante des valeurs pressionnelles de départ et diminue avec le temps. Certains paramètres morphométriques du segment antérieur obtenus par l’OCT pourraient être prédictifs de la réduction pressionnelle obtenue après chirurgie de cataracte.
Un patient glaucomateux opéré de cataracte seule a un risque plus important de présenter un pic pressionnel postopératoire précoce.
Le classique risque de mise en échec d’une chirurgie filtrante après une chirurgie de la cataracte semble moins probant avec l’amélioration des techniques de phaco-exérèse. Un délai raisonnable doit être respecté entre ces deux interventions.
[1] Ang GS, Shunmugam M, Azuara-Blanco A. Effect of cataract extraction on the glaucoma progression index (GPI) in glaucoma patients. J Glaucoma. 2010 ; 19 : 275-8.
[2] Campbell DG. Pigmentary dispersion and glaucoma. A new theory. Arch Ophthalmol. 1979 ; 97 : 1667-72.
[3] Chandrasekaran S, Cumming RG, Rochtchina E, Mitchell P. Associations between elevated intraocular pressure and glaucoma, use of glaucoma medications, and 5-year incident cataract : the Blue Mountains Eye Study. Ophthalmology. 2006 ; 113 : 417-24.
[4] Chen PP, Weaver YK, Budenz DL, et al. Trabeculectomy function after cataract extraction. Ophthalmology. 1998 ; 105 : 1928-35.
[5] Dada T, Behera G, Agarwal A, et al. Effect of cataract surgery on retinal nerve fiber layer thickness parameters using scanning laser polarimetry (GdxVCC). Indian J Ophthalmol. 2010 ; 58 : 389-94.
[6] de Barros DS, Da Silva RS, Siam GA, et al. Should an iridectomy be routinely performed as a part of trabeculectomy ? Two surgeons’ clinical experience. Eye (Lond). 2009 ; 23 : 362-7.
[7] Emarah AM, El-Helw MA, Yassin HM. Comparison of clear lens extraction and collamer lens implantation in high myopia. Clin Ophthalmol. 2010 ; 4 : 447-54.
[8] Friedman DS, Jampel HD, Lubomski LH, et al. Surgical strategies for coexisting glaucoma and cataract : an evidence-based update. Ophthalmology. 2002 ; 109 : 1902-13.
[9] Heijl A, Leske MC, Bengtsson B, et al. Early Manifest Glaucoma Trial Group. Reduction of intraocular pressure and glaucoma progression : results from the Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 ; 120 : 1268-79.
[10] Heltzer JM. Coexisting glaucoma and cataract. Ophthalmology. 2004 ; 111 : 408-9.
[11] Herman DC, Gordon MO, Beiser JA, et al. Ocular Hypertension Treatment Study (OHTS) Group. Topical ocular hypotensive medication and lens opacification : evidence from the ocular hypertension treatment study. Am J Ophthalmol. 2006 ; 142 : 800-10.
[12] Huang D, Schallhorn SC, Sugar A, et al. Phakic intraocular lens implantation for the correction of myopia : a report by the Aerican Academy of Ophthalmology. Ophthalmology. 2009 ; 116 : 2244-58.
[13] Huang G, Gonzalez E, Lee R, et al. Association of biometric factors with anterior chamber angle widening and intraocular pressure reduction after uneventful phacoemulsification for cataract. J Cataract Refract Surg. 2012 ; 38 : 108-16.
[14] Karickhoff JR. Pigmentary dispersion syndrome and pigmentary glaucoma : a new mechanism concept, a new treatment, and a new technique. Ophthalmic Surg. 1992 ; 23 : 269-77.
[15] Kim NR, Lee H, Lee ES, et al. Influence of cataract on time domain and spectral domain optical coherence tomography retinal nerve fiber layer measurements. J Glaucoma. 2012 ; 21 : 116-22.
[16] Kohnen T, Kook D, Morral M, Güell JL. Phakic intraocular lenses. Part 2 : results and complications. J Cataract Refract Surg. 2010 ; 36 : 2168-94.
[17] Leske MC, Wu SY, Nemesure B, Hennis A. Barbados Eye Studies Group. Risk factors for incident nuclear opacities. Ophthalmology. 2002 ; 109 : 1303-8.
[18] Levkovitch-Verbin H, Habot-Wilner Z, Burla N, et al. Intraocular pressure elevation within the first 24 hours after cataract surgery in patients with glaucoma or exfoliation syndrome. Ophthalmology. 2008 ; 115 : 104-8.
[19] Mansberger SL, Gordon MO, Jampel H, et al. Ocular Hypertension Treatment Study Group. Reduction in intraocular pressure after cataract extraction : the Ocular Hypertension Treatment Study. Ophthalmology. 2012 ; 119 : 1826-31.
[20] Mathew RG, Murdoch IE. The silent enemy : a review of cataract in relation to glaucoma and trabeculectomy surgery. Br J Ophthalmol. 2011 ; 95 : 1350-4.
[21] Musch DC, Gillespie BW, Niziol LM, et al. Collaborative Initial Glaucoma Treatment Study Group. Cataract extraction in the collaborative initial glaucoma treatment study : incidence, risk factors, and the effect of cataract progression and extraction on clinical and quality-of-life outcomes. Arch Ophthalmol. 2006 ; 124 : 1694-700.
[22] Nakatani Y, Higashide T, Ohkubo S, et al. Effect of cataract and its removal on ganglion cell complex thickness and peripapillary retinal nerve fiber layer thickness measurements by fourier-domain optical coherence tomography. J Glaucoma. 2013 ; 22 : 447-55.
[23] Pavlin CJ, Harasiewicz K, Foster FS. Posterior iris bowing in pigmentary dispersion syndrome caused by accommodation. Am J Ophthalmol. 1994 ; 118 : 114-6.
[24] Peponis VG, Chalkiadakis SE, Katzakis MC, Parikakis EA. The effect of phacoemulsification on late bleb failure or intraocular pressure in patients with glaucoma : a systematic review. Clin Ophthalmol. 2012 ; 6 : 1045-9.
[25] Poley BJ, Lindstrom RL, Samuelson TW. Long-term effects of phacoemulsification with intraocular lens implantation in normotensive and ocular hypertensive eyes. J Cataract Refract Surg. 2008 ; 34 : 735-42.
[26] Rao HL, Jonnadula GB, Addepalli UK, et al. Effect of cataract extraction on Visual Field Index in glaucoma. J Glaucoma. 2013 ; 22 : 164-8.
[27] Richdale K, Bullimore MA, Zadnik K. Lens thickness with age and accommodation by optical coherence tomography. Ophthalmic Physiol Opt. 2008 ; 28 : 441-7.
[28] Robin AL, Ramakrishnan R, Krishnadas R, et al. A long-term dose-response study of mitomycin in glaucoma filtration surgery. Arch Ophthalmol. 1997 ; 115 : 969-74.
[29] Sanders DR. Anterior subcapsular opacities and cataracts 5 years after surgery in the visian implantable collamer lens FDA trial. J Refract Surg. 2008 ; 24 : 566-70.
[30] Shingleton BJ, Pasternack JJ, Hung JW, O’Donoghue MW. Three and five year changes in intraocular pressures after clear corneal phacoemulsification in open angle glaucoma patients, glaucoma suspects, and normal patients. J Glaucoma. 2006 ; 15 : 494-8.
[31] Sperduto RD, Seigel D. Senile lens and senile macular changes in a population-based sample. Am J Ophthalmol. 1980 ; 90 : 86-91.
[32] Sun JH, Sung KR, Yun SC, et al. Factors associated with anterior chamber narrowing with age : an optical coherence tomography study. Invest Ophthalmol Vis Sci. 2012 ; 53 : 2607-10.
[33] The Advanced Glaucoma Intervention Study (AGIS) : 4. Comparison of treatment outcomes within race. Seven-year results. Ophthalmology. 1998 ; 105 : 1146-64.
[34] Törnqvist G, Drolsum LK. Trabeculectomies. A long-term study. Acta Ophthalmol (Copenh). 1991 ; 69 : 450-4.
[35] Wang X, Zhang H, Li S, Wang N. The effects of phacoemulsification on intraocular pressure and ultrasound biomicroscopic image of filtering bleb in eyes with cataract and functioning filtering blebs. Eye (Lond). 2009 ; 23 : 112-6.
[36] Wong TT, Khaw PT, Aung T, et al. The Singapore 5-Fluorouracil Trabeculectomy Study : effects on intraocular pressure control and disease progression at 3 years. Ophthalmology. 2009 ; 116 : 175-84.
[37] Zeng Y, Liu Y, Liu X, et al. Comparison of lens thickness measurements using the anterior segment optical coherence tomography and A-scan ultrasonography. Invest Ophthalmol Vis Sci. 2009 ; 50 : 290-4.
Y. Lachkar
Les patients présentant un glaucome ont un risque trois fois plus important de présenter ou de développer une occlusion veineuse (et inversement).
Si l’occlusion veineuse est en cours de traitement ou diagnostiquée plus tardivement, il faut garder à l’esprit :
la possibilité d’un glaucome primitif à angle étroit qui peut simuler un GPAO (œil blanc indolore, pupille réactive), imposant donc la réalisation systématique d’une gonioscopie ;
la survenue possible d’un glaucome néovasculaire ;
les hypertonies oculaires induites par la corticothérapie.
Le traitement médical du glaucome impose une bonne connaissance des interactions pharmacologiques liées à l’occlusion veineuse.
Le glaucome est une neuropathie optique où la pression intra-oculaire (PIO) reste le facteur de risque le plus important, mais où les facteurs vasculaires prennent une part importante dans la physiopathologie ou comme facteurs d’aggravation. De nombreux éléments figurent également parmi les facteurs prédisposant à la survenue d’une occlusion veineuse, soulignant ainsi l’intrication entre ces deux pathologies. De plus, l’occlusion veineuse rétinienne peut révéler la présence d’un glaucome ou d’une hypertension intra-oculaire (HTO) jusque-là méconnue. Nous aborderons dans ce chapitre les relations entre glaucome, hypertonie oculaire et occlusions veineuses rétiniennes (OVR), à l’exclusion du glaucome néovasculaire, entité particulière et complication redoutable de la néovascularisation.
L’association entre le glaucome et les OVR a été observée dès le début du xxe siècle par Verhoeff [30]. Depuis, de nombreux investigateurs ont rapporté l’association des occlusions de la veine centrale de la rétine (OVCR) avec le glaucome primitif à angle ouvert (GPAO) ou l’hypertension oculaire (HTO) [4, 7], et avec le syndrome de pseudo-exfoliation capsulaire [8, 9] (tableau 13-5).
Ces études suggèrent qu’un glaucome ou une HTO préexistants prédisposent à l’apparition d’une OVCR (voir tableau 13-5). La prévalence du GPAO dans les OVCR varie de 6 à 69 % dans la littérature. Cependant, la plupart des études qui ont analysé cette association étaient rétrospectives [4, 15, 29]. Les études comparant les OVCR à un groupe contrôle ont démontré qu’un antécédent de GPAO ou d’HTO était plus fréquent dans les OVCR [2, 9, 19, 23, 25, 27].

Tableau 13-5 Prévalence du glaucome dans les OVR.
Hayreh et al. [15] séparent dans leur analyse le glaucome et l’HTO. Dans une étude portant sur 674 OVCR ou occlusions veineuses hémi-centrales (OVHC), la prévalence du glaucome était de 10 % et celle de l’HTO était de 16 %, avec une répartition identique dans les formes centrales et hémi-centrales, prévalence beaucoup plus élevée que dans la population générale [15].
Dans cette même étude, Hayreh souligne que les yeux atteints d’OVCR ou d’OVHC avaient une diminution de la PIO par rapport à l’œil adelphe dans 48 % des cas, et que cette diminution était plus fréquente dans les yeux glaucomateux non traités par collyres hypotonisants qu’en l’absence de glaucome.
Le groupe de l’Eye Disease Case-Control Study a démontré que la présence d’un GPAO était associée aux trois types d’OVR : centrale, hémi-centrale et branche [5, 20], ce qui était confirmé par l’étude de Sperduto et al. [27]. Cependant, si l’association entre OVCR et glaucome est confirmée unanimement par toutes les études, celle entre glaucome et OBV est moins nette et controversée [9, 26].
La Beaver Dam Eye Study a rapporté une incidence de l’occlusion veineuse de 0,2 % en cinq ans pour les OVCR et de 0,6 % pour les OBV. L’analyse détaillée des facteurs de risque, qui n’a été rapportée que pour les OBV, n’a pas retrouvé d’association significative entre la survenue d’une OBV et la présence d’une HTO ou d’un glaucome [16, 17]. Cependant, avec un suivi de dix ans, cette même étude conclut que les participants chez qui une OVR est survenue avaient plus souvent initialement un glaucome connu ou probable [16].
Ainsi, le rôle de l’HTO comme facteur de risque des OVR semble dépendre du type de l’occlusion, ce qui suggère qu’il est important de séparer ces types d’occlusion dans les analyses cliniques et épidémiologiques [2, 31].
Dans les OVCR, le GPAO est un facteur prédisposant qui précède l’occlusion veineuse, retrouvé avec une prévalence de 7 à 65 %. La plupart des études retrouvent une prévalence entre 10 et 40 % (voir tableau 13-5), avec un odds ratio en moyenne de 3, ce qui signifie que l’on retrouve trois fois plus de glaucome chez les patients ayant une OVCR que dans la population générale, et aussi, par le caractère inversible des odds ratios, qu’un patient ayant un GPAO a trois fois plus de risque de faire une OVCR qu’un patient non glaucomateux.
Moore a montré que l’excavation profonde de la papille était une association commune avec les OVCR, retrouvée dans 67 % des 18 yeux étudiés [21]. Hayreh et al. [15] ont démontré qu’une excavation glaucomateuse de la papille était présente lors de la visite initiale chez 65,5 % des patients glaucomateux ayant une OVR. Aucune différence dans l’excavation papillaire n’était retrouvée entre les différents types d’OVR (OVCR versus OVHC, forme ischémique versus forme non ischémique).
Le groupe d’étude sur le traitement de l’HTO a suivi 1 636 patients hypertendus oculaires pendant en moyenne neuf ans, divisés en patients traités et non traités [3]. Vingt-six OVR sont survenues pendant cette période de suivi chez 23 patients : 14 OVCR, 7 OVHC et 5 OBV, ce qui soulignait au passage le lien plus fort entre HTO et OVCR ou OVHC qu’entre HTO et OBV. L’étude statistique montrait que le risque d’avoir une OVR à dix ans chez les patients ayant une HTO était de 2,1 % dans le groupe observé et de 1,4 % dans le groupe traité ; cette différence entre patients traités et non traités n’était pas significative. Dans cette étude, la survenue d’une OVR était liée de manière statistiquement significative à l’âge des patients et au degré d’excavation papillaire, notamment le rapport cup/disc horizontal (p = 0,0004).
D’autres études prospectives ont retrouvé ce lien. Dobree a ainsi trouvé que 4 à 5 % des patients ayant un glaucome à angle ouvert ou fermé développaient une OVR après un suivi d’un à huit ans [10]. Il rapportait que la survenue d’une OVCR était deux fois plus fréquente dans les yeux ayant une excavation papillaire que dans les yeux sans excavation. Il suggérait que l’excavation pouvait provoquer une occlusion veineuse par deux mécanismes : d’une part du fait du déplacement mécanique des gros troncs vasculaires devant la papille, d’autre part du fait de l’augmentation de la pression veineuse résultant de l’augmentation de l’excavation.
De nombreuses études ont retrouvé une diminution du flux sanguin oculaire chez les patients atteints de glaucome [5, 11, 32]. Cette réduction du flux sanguin oculaire implique la tête du nerf optique, la choroïde, la circulation rétinienne ainsi que la circulation rétrobulbaire. Ces altérations vasculaires sont plus fréquentes chez les patients atteints de glaucome à pression normale.
Les relations entre le GPAO et les facteurs vasculaires sont bien connues et ont été développées dans un autre chapitre (voir chapitre 10-V).
Depuis la première description de Verhoeff, beaucoup d’études ont rapporté l’association entre OVR et glaucome chronique ou HTO, et ont recherché quelle relation de cause à effet pouvait exister entre ces deux entités. Malheureusement, cette question reste sans réponse précise.
Verhoeff avait suggéré que l’élévation de la PIO comprimait et collabait la paroi de la veine centrale de la rétine. Dans une étude histopathologique, il a montré que cela entraînait une prolifération de l’intima qu’il tenait pour être la cause des OVCR [30]. Comme Duke-Elder, Dobree considérait que l’incidence de la thrombose était modérément liée à la valeur de la PIO, qu’il était probable que l’association soit due à une stase veineuse secondaire à l’élévation de la PIO, et que la présence d’anomalies artérielles puisse aussi être un facteur étiologique [10]. Cole et al. [5] soulignaient le rôle des affections médicales associées au glaucome et à l’HTO dans la constitution des OVR. D’autres auteurs considéraient qu’OVR et glaucome, sans lien étiologique, étaient plutôt deux manifestations différentes d’anomalies vasculaires sous-jacentes [22].
Le diagnostic de glaucome en cas d’occlusion veineuse est plus difficile, car certains paramètres peuvent avoir leur interprétation faussée par l’occlusion veineuse. De plus, le contexte peut conduire l’ophtalmologiste à ne se focaliser que sur le diagnostic principal : l’occlusion veineuse.
Le principal piège est de ne traiter que le symptôme « PIO élevée » par un agent hypotonisant, sans rechercher l’étiologie qui peut être multiple : angle étroit, GPAO, glaucome secondaire.
Ainsi, si l’occlusion veineuse est en cours de traitement ou diagnostiquée tardivement, il faudra également garder à l’esprit :
la survenue possible d’un glaucome néovasculaire ;
les HTO induites par la corticothérapie.
La mesure de la PIO est systématique et soumise aux mêmes règles qu’en cas d’absence d’occlusion veineuse, notamment l’interprétation des chiffres en fonction de l’épaisseur cornéenne centrale. La pachymétrie est donc systématique.
Il est capital de mesurer la PIO dans les deux yeux car, en phase aiguë, il est fréquent d’observer une PIO plus basse dans l’œil ayant l’occlusion veineuse [15, 31].
Les déficits du champ visuel surviennent en cas d’occlusion veineuse et peuvent simuler un glaucome en cas d’occlusion de branche veineuse. Ainsi, en phase aiguë, le relevé du champ visuel sera faussé et ne pourra pas servir de référence pour le suivi de la neuropathie optique glaucomateuse.
Si un glaucome est diagnostiqué, il sera conseillé de réaliser le bilan périmétrique à distance de la phase aiguë, d’autant plus que des phénomènes de fatigue peuvent aussi fausser le résultat, notamment pour l’œil adelphe.
Elle est systématique et devra, si l’angle paraît étroit, être réalisée avec indentation afin de rechercher des synéchies antérieures périphériques et de décider de la conduite à tenir du point de vue thérapeutique. Elle permettra également de rechercher des signes de pseudo-exfoliation capsulaire qui peut être un facteur de risque de poussée de tension et de survenue d’une occlusion veineuse [12]. La présence d’une exfoliation a été retrouvée dans 50 à 60 % des occlusions veineuses par certaines équipes, en combinant la recherche clinique et histologique.
La gonioscopie permettra également de rechercher des signes débutants de néovascularisation, complication redoutable de l’ischémie pouvant conduire au glaucome néovasculaire.
L’analyse biomicroscopique de la tête du nerf optique permettra de retrouver les signes classiques de neuropathie optique glaucomateuse, parfois difficiles à identifier sur l’œil atteint (fig. 13-21). C’est dire l’importance de l’examen de l’œil controlatéral. On recherchera :
l’augmentation du rapport cup/disc en corrélant la taille de l’excavation avec la taille du disque ;
une encoche de l’anneau neurorétinien ;
une hémorragie du disque optique sur l’œil adelphe.
L’analyse de la papille dans l’œil atteint d’occlusion veineuse est difficile en raison de l’œdème qui fausse l’interprétation de l’excavation. L’analyse des fibres nerveuses rétiniennes par tomographie à cohérence optique est également faussée et ne peut donc servir de référence, aussi bien du point de vue diagnostique que pour le suivi du glaucome. Le GPAO étant le plus souvent bilatéral, l’examen de l’œil adelphe est donc fondamental.
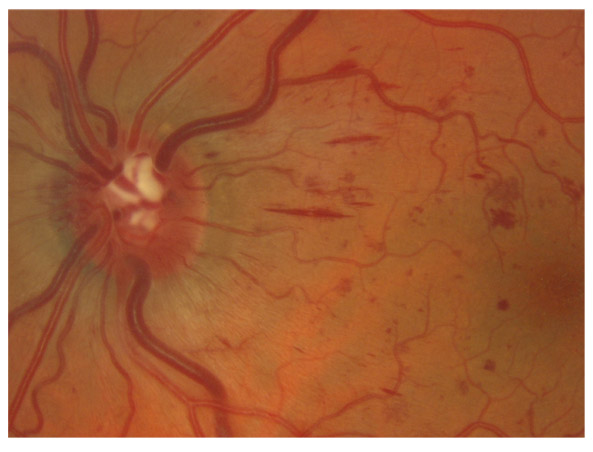
Fig. 13-21 Tableau d’OVCR chez un patient atteint de GPAO modéré. (Cliché : E. Sellem.)
Le traitement du glaucome ou d’une HTO chez les patients présentant une occlusion veineuse doit se faire après un bilan diagnostique et préthérapeutique afin d’éliminer notamment certaines contre-indications médicamenteuses.
Une des particularités thérapeutiques dans la prise en charge de la PIO chez les patients présentant une occlusion veineuse est le problème lié à l’œdème maculaire. Plusieurs cas cliniques d’œdème maculaire cystoïde apparus sous traitement par latanoprost ont été décrits dans la littérature. Dans ces cas, la très grande majorité des patients étaient aphakes ou pseudo-phakes avec une rupture capsulaire postérieure et, dans de nombreux cas, ils présentaient d’autres facteurs de risque d’œdème maculaire cystoïde (antécédent d’œdème maculaire cystoïde avant l’initiation du traitement par latanoprost, antécédent d’uvéite postérieure, traction maculaire, membrane épirétinienne, occlusion de branche veineuse, chirurgie de la cataracte compliquée, implant de chambre antérieure) [5]. Étant donné la faible fréquence de l’œdème maculaire cystoïde dans les yeux à risque, l’utilisation des analogues des prostaglandines n’est pas formellement contre-indiquée. Cependant, à la phase aiguë d’une OVR, il semble préférable d’éviter d’utiliser un analogue des prostaglandines, notamment si le sujet est aphake ou pseudo-phake.
En dehors de cette réserve, tous les produits antiglaucomateux restent autorisés pour instaurer ou poursuivre un traitement hypotonisant oculaire.
Bien qu’il soit en théorie plus logique d’éviter les collyres potentiellement vasoconstricteurs (certains bêtabloquants et α1-agonistes), il n’a pas été démontré que certains collyres étaient plus bénéfiques que d’autres pour traiter les patients glaucomateux ayant présenté une occlusion veineuse [32].
L’indication des traitements physiques et chirurgicaux chez les patients glaucomateux ayant des antécédents d’occlusion veineuse est similaire aux patients glaucomateux sans occlusion veineuse. Il faudra cependant prendre en compte les traitements éventuellement associés, notamment la prise d’anticoagulants ou d’antiagrégants plaquettaires et leur risque hémorragique, ainsi que le risque d’œdème maculaire en cas de chirurgie combinée de la cataracte et du glaucome.
Les patients atteints de GPAO et présentant une occlusion veineuse peuvent poser certains problèmes, particulièrement à cause des injections intravitréennes qui peuvent être proposées, notamment de corticoïdes. L’intérêt et l’utilisation de corticoïdes par voie intravitréenne communément utilisée pour le traitement des occlusions veineuses doivent être bien évalués en cas de glaucome. En effet, même chez le sujet non glaucomateux, les injections de corticoïdes peuvent induire fréquemment une HTO [6, 13] : dans plus de 70 % des cas avec l’acétonide de fluocinolone, 41 % avec l’acétonide de triamcinolone et 16 % avec la dexaméthasone. Le glaucome était ainsi un critère d’exclusion des études analysant l’efficacité des injections de corticoïdes dans les occlusions veineuses. Il faudra ainsi préférer l’utilisation d’injections intravitréennes d’anti-VEGF. Celles-ci peuvent cependant induire des HTO en cas d’injections répétées [1], mais beaucoup moins souvent, dans 6 % des cas seulement, et elles sembleraient plus fréquentes avec le bévacizumab (9,9 %) qu’avec le ranibizumab (3,1 %) [14]. Cependant, ces résultats concernent les injections répétées en cas de DMLA, et il n’existe pas de données actuelles concernant le risque d’élévation de la PIO après injections intravitréennes répétées d’anti-VEGF au décours d’une OVR.
Retenir
En cas d’association de glaucome et d’occlusion veineuse, un bilan cardiovasculaire est nécessaire afin de rechercher et traiter certains facteurs de risque dont l’HTA, le syndrome d’apnée du sommeil ou une sténose carotidienne associée.
Du point de vue thérapeutique, il n’a pas été démontré qu’une classe thérapeutique médicamenteuse était meilleure qu’une autre pour limiter l’apparition d’une occlusion veineuse chez les patients glaucomateux.
En cas de glaucome avec présence de facteurs vasculaires et/ou d’occlusion veineuse, il est en principe plus logique d’éviter les collyres potentiellement vasoconstricteurs (certains bêtabloquants et α1-agonistes) et d’éviter les collyres à risque d’œdème maculaire (analogues des prostaglandines) si le sujet est aphake ou pseudo-phake avec capsule ouverte.
En cas d’occlusion veineuse survenant chez un patient glaucomateux, les injections d’anti-VEGF doivent être préférées à celles de corticoïdes intravitréens.
[1] Angulo Bocco MC, Glacet Bernard A, Zourdani A, et al. Intravitreous injections retrospective study of 2028 injections and their side effects. J Fr Ophtalmol. 2008 ; 31 : 693-8.
[2] Appiah AP, Trempe CL. Risk factors associated with branch vs. central retinal vein occlusion. Ann Ophthalmol. 1989 ; 21 : 153-5.
[3]Barnett EM, Fantin A, Wilson BS, et al. The incidence of retinal vein occlusion in the ocular hypertension treatment study. Ophthalmology. 2010 ; 117 : 484-8.
[4] Chew EY, Trope GE, Mitchell BJ. Diurnal intraocular pressure in young adults with central retinal vein occlusion. Ophthalmology. 1987 ; 94 : 1545-9.
[5] Cole MD, Dodson PM, Hendeles S. Medical conditions underlying retinal vein occlusion in patients with glaucoma or ocular hypertension. Br J Ophthalmol. 1989 ; 73 : 693-8.
[6] Coscas G, Loewenstein A, Augustin A, et al. Management of retinal vein occlusion consensus document. Ophtalmologica. 2011 ; 226 : 4-28.
[7] Cugati S, Wang JJ, Rochtchina E, Mitchell P. Ten-year incidence of retinal vein occlusion in an older population : the Blue Mountains Eye Study. Arch Ophthalmol. 2006 ; 124 : 726-32.
[8] Cursiefen C, Hammer T, Kuchle M, et al. Pseudoexfoliation syndrome in eyes with ischemic central retinal vein occlusion. A histopathologic and electron microscopic study. Acta Ophthalmol Scand. 2001 ; 79 : 476-8.
[9] Cursiefen C, Handel A, Schonherr U, Naumann GO. Pseudoexfoliation syndrome in patients with retinal vein branch and central vein thrombosis. Klin Monbl Augenheilkd. 1997 ; 211 : 17-21.
[10] Dobree JH. Venous obstruction and neovascularization at the disc in chronic glaucoma. Trans Ophthal Soc UK. 1957 ; 77 : 229-37 ; discussion : 37-8.
[11] Doyle A, Bensaid A, Lachkar Y. Central corneal thickness and vascular risk factors in normal tension glaucoma. Acta Ophthalmol Scand. 2005 ; 83 : 191-5.
[12] Gillies WE, Brooks AM. Central retinal vein occlusion in pseudoexfoliation of the lens capsule. Clin Experiment Ophthalmol. 2002 ; 30 : 176-87.
[13] Glacet Bernard A, Coscas G, Zourdani A, et al. Steroids ans macular oedema from retinal vein occlusion. Eur J Ophthalmol. 2010 ; 21 : 37-44
[14] Good T, Kimura A, Mandava N, et al. Sustained elevation of intraocular pressure after intravireal injections of anti VEGF agents. Br J Ophthalmol. 2011 ; 95 : 1111-4.
[15] Hayreh SS, Zimmerman MB, Beri M, Podhajsky P. Intraocular pressure abnormalities associated with central and hemicentral retinal vein occlusion. Ophthalmology. 2004 ; 111 : 133-41.
[16] Klein B, Meuer SM, Knudtson MD, Klein R. The relationship of optic disk cupping to retinal vein occlusion : the Beaver Dam Eye Study. Am J Ophthalmol. 2006 ; 141 : 859-62.
[17] Klein R, Klein BE, Moss SE, Meuer SM. The epidemiology of retinal vein occlusion : the Beaver Dam Eye Study. Trans Am Ophthalmol Soc. 2000 ; 98 : 133-41 ; discussion : 41-3.
[18] Klein R, Moss SE, Meuer SM, Klein BE. The 15-year cumulative incidence of retinal vein occlusion : the Beaver Dam Eye Study. Arch Ophthalmol. 2008 ; 126 : 513-8.
[19] Koizumi H, Ferrara DC, Brue C, Spaide RF. Central retinal vein occlusion case-control study. Am J Ophthalmol. 2007 ; 144 : 858-63.
[20] Mitchell P, Smith W, Chang A. Prevalence and associations of retinal vein occlusion in Australia. The Blue Mountains Eye Study. Arch Ophthalmol. 1996 ; 114 : 1243-7.
[21] Moore R. Retinal venous thrombosis : a clinical study of sixty-two cases followed over many years. Br J Ophthalmol. 1924 ; 8 (Suppl. 2] : 1-90.
[22] Pasco M, Singer L, Romem M. Chronic simple glaucoma and thrombosis of the retinal vein. Eye Ear Nose Throat Mon. 1973 ; 52 : 294-7.
[23] Rath EZ, Frank RN, Shin DH, Kim C. Risk factors for retinal vein occlusions. A case-control study. Ophthalmology. 1992 ; 99 : 509-14.
[24] Risk factors for central retinal vein occlusion. The Eye Disease Case-Control Study Group. Arch Ophthalmol. 1996 ; 114 : 545-54.
[25] Risk factors for branch retinal vein occlusion. The Eye Disease Case-Control Study Group. Am J Ophthalmol. 1993 ; 116 : 286-96.
[26] Saatci OA, Ferliel ST, Ferliel M, et al. Pseudoexfoliation and glaucoma in eyes with retinal vein occlusion. Int Ophthalmol. 1999 ; 23 : 75-8.
[27] Sperduto RD, Hiller R, Chew E, et al. Risk factors for hemiretinal vein occlusion : comparison with risk factors for central and branch retinal vein occlusion : the eye disease case-control study. Ophthalmology. 1998 ; 105 : 765-71.
[28] Tilleul J, Glacet-Bernard A, Coscas G, et al. Circonstances de survenue des occlusions veineuses rétiniennes. J Fr Ophtalmol. 2011 ; 34 : 318-24.
[29] Vannas S, Tarkkanen A. Retinal vein occlusion and glaucoma. Tonographic study of the incidence of glaucoma and of its prognostic significance. Br J Ophthalmol. 1960 ; 44 : 583-9.
[30] Verhoeff F. The effect of chronic glaucoma on the central retinal vessels. Arch Ophthalmol. 1913 ; 42 : 145-52.
[31] Williamson TH. Central retinal vein occlusion : what’s the story ? Br J Ophthalmol. 1997 ; 81 : 698-704.
[32] Weinreb RN, Harris A. Ocular blood flow in glaucoma. Consensus series 6 of the World Glaucoma Association. Kugler Publication 2009.
E. Blumen-Ohana
Glaucome primitif à angle ouvert (GPAO) et dégénérescence maculaire liée à l’âge (DMLA) sont des pathologies potentiellement graves sur le plan fonctionnel.
L’association des deux pathologies chez un même patient est possible, rendue même plus fréquente étant donné l’allongement de la durée de vie.
Le spectre pronostique de l’association « glaucome-DMLA » est plus inquiétant encore qu’une pathologie isolée.
Même si les possibilités thérapeutiques disponibles actuellement sont nettement meilleures, il n’en demeure pas moins que la prise en charge concomitante des deux pathologies pose parfois des difficultés.
Avec l’âge, la fréquence de certaines pathologies augmente. Elles s’expriment cliniquement de façon isolée ou, plus rarement, de façon concomitante. Le GPAO est une neuropathie optique progressive dont la prévalence augmente avec l’âge [10, 13]. La DMLA touche typiquement les sujets âgés de plus de 60 ans [2, 4]. Ces deux pathologies n’ont pas de facteur de risque commun, hormis l’âge, et représentent toutes les deux des causes majeures de cécité légale dans le monde (2e et 3e causes de cécité [19]). Elles ont de ce fait un impact sur la qualité de vie des patients concernés (activités quotidiennes, nécessité d’une assistance, etc.) [7].
La DMLA et le glaucome ont une prévalence qui augmente avec l’âge [13, 15] ; les personnes concernées sont de plus en plus nombreuses étant donné le vieillissement de la population.
Ces deux pathologies sont donc susceptibles de coexister chez un même patient. Elles posent le problème du vieillissement en général, avec le risque d’associations à d’autres pathologies liées à l’âge, ophtalmologiques comme la cataracte ou générales comme l’hypertension artérielle, le diabète, etc. La prise en charge impose de prendre en considération ces associations cliniques, qui peuvent concerner des patients actifs et demandeurs de solutions, afin de maintenir leurs activités et leur qualité de vie.
Une première question peut être posée concernant une éventuelle prédisposition génétique commune aux deux pathologies ; certains auteurs se sont intéressés à cette question, mais n’ont pas pu démontrer une éventuelle association [20].
En ce qui concerne les autres facteurs de risque, il a été démontré une implication de facteurs nutritionnels et environnementaux dans la DMLA : le tabagisme, l’exposition solaire, les carences vitaminiques ont clairement été mis en cause [2, 5, 6]. En revanche, la situation est moins univoque pour le glaucome où certains facteurs de risque ont été identifiés, mais où l’implication de facteurs nutritionnels ou environnementaux doit encore être précisée. Les facteurs de risque de survenue d’un glaucome font intervenir l’hypertension intra-oculaire (HTO), les antécédents familiaux, l’origine ethnique, le syndrome pseudo-exfoliatif, la myopie, etc.
En pratique, tout oppose le GPAO et la DMLA. En effet, le GPAO entraîne des modifications progressives de la tête du nerf optique (TNO) et des fibres nerveuses rétiniennes (FNR), associées à des déficits du champ visuel, en l’absence de toute autre pathologie susceptible d’induire de telles modifications [9]. L’acuité visuelle est classiquement préservée jusqu’à un stade avancé du glaucome. Le GPAO entraîne une atteinte structurale et fonctionnelle. L’atteinte structurale s’exprime à l’examen biomicroscopique du fond d’œil, sur les photographies de la TNO et sur les résultats des analyseurs de la papille et de la couche des FNR (de plus en plus l’OCT, mais encore le GDx™ et le HRT). L’atteinte fonctionnelle est, en pratique quotidienne, démasquée et évaluée dans le temps par l’analyse du champ visuel essentiellement.
La DMLA est caractérisée par une atteinte de la rétine centrale, avec des signes fonctionnels qui peuvent apparaître rapidement : métamorphopsies, micropsies, baisse d’acuité visuelle, etc. On observe au stade précoce une maculopathie avec présence de drusen et d’altérations de l’épithélium pigmentaire maculaire. Deux formes cliniques de DMLA s’opposent classiquement, la forme atrophique et la forme exsudative, mais les variations évolutives sont en fait multiples avec des caractéristiques différentes [16, 23]. La forme atrophique est généralement d’évolution lente avec une baisse d’acuité visuelle progressive inexorable, associée à des zones géographiques d’atrophie maculaire. La forme exsudative est plus bruyante avec des signes fonctionnels inquiétants d’installation brutale et, à l’examen, des modifications exsudatives de la macula avec des hémorragies, un décollement séreux rétinien, un décollement de l’épithélium pigmentaire, etc. Les examens complémentaires vont permettre de caractériser les néovaisseaux choroïdiens responsables, visibles ou occultes, avec souvent des intrications sémiologiques. Les examens complémentaires indiqués en cas de suspicion de complication néovasculaire d’une DMLA sont les rétinophotographies du fond d’œil, l’angiographie en fluorescéine et/ou en vert d’indocyanine, et la tomographie en cohérence optique (OCT).
Une des premières difficultés, en face de cette association nosologique potentielle, est de savoir l’évoquer. En effet, avec les avancées technologiques, les activités cliniques sont de plus en plus spécialisées, et le risque pour le praticien est donc de n’envisager que son domaine de prédilection pour la prise en charge d’un patient et d’ignorer la globalité du tableau clinique. Il est fondamental de savoir reconnaître les signes évocateurs d’une telle association clinique dans deux circonstances :
patient suivi pour son GPAO qui un jour se plaint d’une baisse d’acuité visuelle : l’erreur serait d’attribuer cette baisse d’acuité visuelle, authentifiée sur une échelle de lecture et sur le seuil fovéal au champ visuel, à une évolution de sa neuropathie optique glaucomateuse, sans s’intéresser à la macula ;
patient présentant une DMLA, atrophique ou humide, sans HTO mesurée, et chez qui on pourra constater a posteriori l’atteinte glaucomateuse sur les clichés successifs d’angiographie, l’atteinte étant le plus souvent bilatérale…
Le diagnostic différentiel et le diagnostic d’atteinte conjointe imposent d’examiner la totalité du fond d’œil dilaté et d’interpréter les examens complémentaires disponibles, en prenant garde aux sources d’erreurs induites par l’association GPAO-DMLA (fig. 13-22).
La démarche diagnostique suivante peut être proposée :
relever systématiquement, à chaque contrôle, l’acuité visuelle en vision de loin et en vision de près. Elle sera notifiée dans le dossier, et on s’attachera devant une baisse d’acuité visuelle à en rechercher l’étiologie et à vérifier systématiquement si elle s’accompagne d’une symptomatologie fonctionnelle maculaire ;
examiner les régions maculaire et papillaire lors du fond d’œil en biomicroscopie, avant de noter d’éventuelles modifications inhérentes à la pathologie suivie ou requérant l’expérience spécifique de l’observateur ;
rapprocher les éléments du fond d’œil des rétinophotographies, en analysant les aspects douteux : une hémorragie parapapillaire évocatrice, un déficit fasciculaire en faveur d’une atteinte glaucomateuse ; des altérations de l’épithélium pigmentaire, un soulèvement neurorétinien dans l’aire maculaire ou des dépôts de matériel maculaire en cas de DMLA ;
lors de l’analyse des tracés en OCT, vérifier l’intégrité maculaire avant d’interpréter toute anomalie au niveau du complexe cellulaire ganglionnaire maculaire (GCC) ou dans la couche des fibres nerveuses rétiniennes (fig. 13-23) ;
se méfier d’une baisse du seuil fovéal en périmétrie automatisée, en règle conservé jusqu’aux stades tardifs du GPAO.
Enfin, cette démarche diagnostique doit être complétée par la mesure de la PIO rapportée à la pachymétrie centrale cornéenne et par la gonioscopie en cas de doute, même si le motif de consultation est sans en rapport avec un GPAO.
Le tableau 13-6 résume les éléments diagnostiques en faveur de l’une ou l’autre des pathologies, en étant conscient que la dichotomie imposée est conventionnelle et non toujours cliniquement évidente.
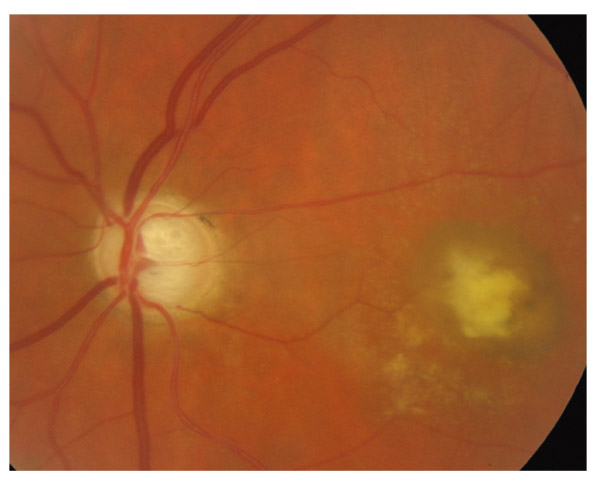
Fig. 13-22 Fond d’œil d’un patient atteint de DMLA sévère associée à un GPAO évolué. (Cliché : E. Sellem.)
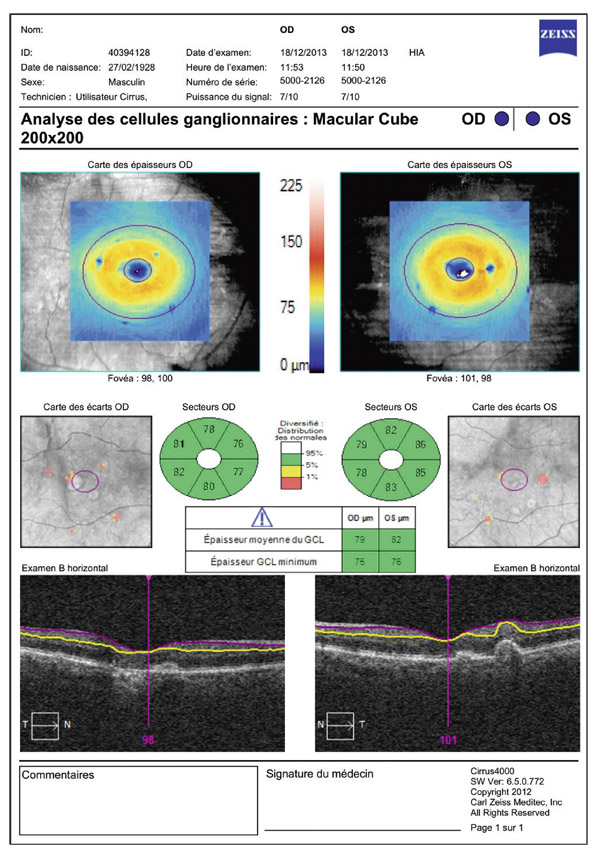
Fig. 13-23 Relevé OCT perturbé par des drusen maculaires. (Doc. : J.-P. Renard.)
Tableau 13-6 Comparaison GPAO/DMLA.
Le suivi évolutif va poser différentes problématiques. La première est d’ordre fonctionnel : le glaucome isolé entraîne généralement une atteinte initiale périphérique avec, progressivement, en cas d’évolution, un encerclement du point de fixation central, un déficit périmétrique étendu, mais une préservation de la vision centrale et parfois une acuité visuelle à 10/10, alors que ne persistent que quelques degrés fonctionnels au niveau du champ visuel. La DMLA, quant à elle, entraîne une altération précoce de la vision centrale [24]. L’association des deux pathologies a donc des conséquences fonctionnelles majorées et parfois dramatiques, avec une atteinte concomitante de la vision centrale et du champ visuel périphérique.
La deuxième problématique souligne la difficulté de suivi conjoint des deux pathologies chroniques avec des atteintes pouvant relever de l’une ou l’autre. À quoi faut-il attribuer une aggravation du champ visuel paracentrale ? Le GPAO en est-il responsable, ou la pathologie maculaire évolue-t-elle ? Autant de situations cliniques où il est parfois difficile de trancher de façon univoque. Il faut par ailleurs rappeler que les analyseurs des FNR, et notamment l’OCT, sont susceptibles d’être faussés dans leur analyse « glaucome » par la présence de modifications maculaires [12, 14]. Les rétinophotographies du fond d’œil gardent ici tout leur intérêt pour ce qui concerne la surveillance du nerf optique, mais également de la macula.
La troisième problématique concerne les interactions thérapeutiques quant à l’innocuité des injections intravitréennes d’agents anti-VEGF (vascular endothelial growth factor) vis-à-vis de la PIO, mais également des cellules ganglionnaires [1, 3, 8, 17, 21, 22]. Par ailleurs, certaines thérapeutiques hypotonisantes oculaires, comme les analogues des prostaglandines, pourraient théoriquement entretenir l’inflammation sous-rétinienne maculaire et perturber par exemple l’assèchement d’un décollement séreux rétinien induit par une néovascularisation choroïdienne [11, 18, 25].
La quatrième problématique relève d’aspects psychologiques et d’accompagnement des patients touchés par ces deux pathologies. Les conséquences émotionnelles déclenchées par une atteinte ophtalmologique n’ont nul besoin d’être démontrées. Le spectre pronostique du GPAO et de la DMLA est plutôt sombre dans l’esprit du public, sensibilisé par les campagnes d’information et de dépistage des deux pathologies. Le discours « optimiste » que l’on peut tenir pour rassurer les patients atteints d’une seule pathologie n’est plus de mise. « Vous ne serez jamais aveugle, le champ visuel périphérique sera toujours fonctionnel » : cette phrase prononcée pour redonner du courage aux patients atteints de DMLA devient caduque si le glaucome s’ajoute au tableau clinique. Inversement, il devient difficile de rassurer un patient glaucomateux quant à sa vision centrale si une DMLA survient.
L’association GPAO-DMLA peut revêtir des aspects cliniques très différents. Sans pouvoir parfaitement systématiser les situations rencontrées cliniquement, on peut néanmoins distinguer quatre situations cliniques.
Poursuivre classiquement le suivi de la progression glaucomateuse.
Informer le patient de l’atteinte maculaire constatée, des signes fonctionnels maculaires devant l’alerter et l’amener à consulter rapidement car pouvant correspondre à une complication exsudative de sa DMLA.
Expliquer au patient les règles hygiénodiététiques de mise pour la prévention de la DMLA, discuter la supplémentation en vitamines anti-oxydantes et en acides gras insaturés oméga-3.
Surveiller la DMLA débutante par le biais de la mesure de l’acuité visuelle, la recherche de métamorphopsies par la grille d’Amsler, l’examen du fond d’œil ainsi que les rétinophotographies et OCT ; l’angiographie en fluorescéine ne sera proposée que si nécessaire. Une aide peut consister à proposer un champ visuel s’intéressant plus spécifiquement à la région centrale pour évaluer l’atteinte induite par la DMLA, en plus de la stratégie habituellement utilisée pour le suivi du glaucome, soit un test de seuil 10-2 ou maculaire pour Humphrey ou C08 pour Octopus.
Il peut s’agir d’une DMLA atrophique entraînant une baisse d’acuité visuelle ou d’une DMLA (drusen, modifications de l’éphithélium pigmentaire, etc.) retentissant sur la vision centrale sans complication néovasculaire sous-rétinienne mise en évidence.
Le diagnostic de GPAO passe par l’examen clinique de la TNO, recherchant des arguments en faveur d’une neuropathie optique glaucomateuse : HTO rapportée à l’épaisseur cornéenne centrale, examens paracliniques (rétinophotographies, analyse de FNR, champ visuel).
Faire la part des choses entre ce qui est induit par le glaucome et ce qui est induit par la DMLA impose une confrontation des résultats. Certaines situations nécessitent un recul apporté par le suivi évolutif des deux pathologies associées.
Cette situation clinique est particulièrement stressante pour le patient et le praticien impliqué dans la prise en charge. Le suivi évolutif peut être un vrai défi du fait des sources d’erreurs induites par les deux pathologies avec, par exemple, des scotomes centraux ou paracentraux du champ visuel, sans savoir avec certitude s’ils sont induits par la DMLA ou le GPAO. L’interprétation des examens devra en effet être prudente, du fait de la mauvaise fixation secondaire à la DMLA et des modifications induites sur l’analyse des FNR par les deux pathologies intriquées. Il n’est pas rare de devoir revenir aux basiques que sont l’acuité visuelle, la PIO et la périmétrie cinétique de Goldmann. En ce qui concerne la prise en charge, les pics d’HTO induits par les injections intravitréennes d’anti-VEGF – qu’il faudra encadrer par une majoration du traitement hypotonisant oculaire – sont à prendre en considération. Les analogues des prostaglandines seront discutés, par mesure de précaution, pour éviter l’entretien éventuel de phénomènes exsudatifs.
Cette situation est la plus grave, pouvant survenir éventuellement sur un œil fonctionnel unique… La situation est souvent stationnaire au niveau de la DMLA, avec des séquelles irréversibles, comme une cicatrice fibreuse au niveau du pôle postérieur. La surveillance se fait sur le plan clinique et éventuellement paraclinique, mais les enjeux sur le plan de la vision centrale sont dépassés (eCas clinique 13-4). Une attention particulière sera portée donc sur l’évolution du champ visuel périphérique, réalisé à la coupole de Goldmann, le plus souvent du fait de l’absence de fixation centrale. La prise en charge du GPAO se fera en tenant compte du statut de l’œil adelphe, avec une marge de manœuvre limitée, tout en sachant qu’aucun type de traitement médical ou chirurgical n’est contre-indiqué ; toutefois, le rapport bénéfice/risque sera évalué attentivement. La multiplicité et l’hétérogénéité des présentations cliniques rendent difficile une attitude univoque de prise en charge : celle-ci sera décidée au cas par cas.
Les figures A à C illustrent le cas d’une patiente monophtalme, âgée de 75 ans et très active, présentant un glaucome très avancé sur son œil fonctionnel, associé à une DMLA avec néovaisseaux occultes mais une acuité visuelle à 8/10 P2. La prise en charge chirurgicale du glaucome a été imposée par une PIO à 40 mmHg malgré un traitement médical maximal et a permis de temporiser la situation pendant quatre ans. Ce cas clinique illustre l’importance de prendre en considération la totalité des éléments cliniques, pour pouvoir optimiser la surveillance et la prise en charge difficiles de cette association GPAO-DMLA.

Fig. A Œil droit présentant un GPAO au stade terminal et une DMLA avec drusen séreuses confluentes.

Fig. B Œil gauche fonctionnel unique présentant un GPAO avancé associé à une DMLA compliquée de néovaisseaux occultes et une acuité visuelle à 8/10 P2.

Fig. C Relevé du champ visuel œil gauche correspondant.
Les injections intravitréennes d’anti-VEGF sont-elles pourvoyeuses d’hypertonie oculaire et de glaucome ?
Les injections intravitréennes ont révolutionné la prise en charge de la DMLA exsudative et leur essor est reflété par le nombre d’injections réalisées en pratique quotidienne. Elles sont néanmoins non dénuées de risque et susceptibles d’entraîner des pics d’HTO précoces [3], voire l’installation d’une HTO pérenne [1, 3, 8, 21] nécessitant une thérapeutique hypotonisante oculaire [17], chirurgicale dans les cas extrêmes [22]. L’HTO survenant au décours des injections intravitréennes d’anti-VEGF a été rapportée dans différentes séries, qui ont identifié certains facteurs de risque parmi lesquels on retrouve un nombre d’injections croissant [1], un court intervalle de temps entre les injections [17] et un antécédent de GPAO [8].
Les thérapeutiques hypotonisantes sont-elles anodines pour la maculopathie liée à l’âge ?
Des publications ont incriminé certaines thérapeutiques hypotonisantes oculaires dans la survenue de complications maculaires [11, 18, 25], essentiellement à type d’œdème maculaire cystoïde, rare, avec les analogues de prostaglandines ; en revanche, aucune publication n’a à ce jour démontré une quelconque influence d’un traitement antiglaucomateux sur une DMLA préexistante.
Retenir
GPAO et DMLA ont l’âge comme facteur de risque commun, et l’association GPAO-DMLA est plus fréquente du fait de l’allongement de la durée de vie.
Le pronostic de cette association pathologique est redoutable et susceptible d’influencer la qualité de vie des patients concernés.
Les caractéristiques cliniques et paracliniques de l’une et l’autre de ces pathologies méritent d’être soulignées, ainsi que les interactions thérapeutiques, afin d’en optimiser la prise en charge conjointe.
Les progrès thérapeutiques en matière de DMLA et de glaucome permettront sans doute à terme de préserver les activités quotidiennes de nos patients seniors touchés par les formes cliniques les plus graves.
[1] Adelman RA, Zheng Q, Mayer HR. Persistent ocular hypertension following intravitreal bevacizumab and ranibizumab injections. J Ocul Pharmacol Ther. 2010 ; 26 : 105-10.
[2] Age-Related Eye Disease Study Research G. Risk factors associated with age-related macular degeneration. A case-control study in the age-related eye disease study : Age-Related Eye Disease Study Report Number 3. Ophthalmology. 2000 ; 107 : 2224-32.
[3] Aref AA. Management of immediate and sustained intraocular pressure rise associated with intravitreal antivascular endothelial growth factor injection therapy. Curr Opin Ophthalmol. 2012 ; 23 : 105-10.
[4] Chaine G, Hullo A, Sahel J, et al. Case-control study of the risk factors for age related macular degeneration. France-DMLA Study Group. Br J Ophthalmol. 1998 ; 82 : 996-1002.
[5] Chakravarthy U, Wong TY, Fletcher A, et al. Clinical risk factors for age-related macular degeneration : a systematic review and meta-analysis. BMC Ophthalmology. 2010 ; 10 : 31.
[6] Clemons TE, Milton RC, Klein R, et al. Age-Related Eye Disease Study Research G. Risk factors for the incidence of Advanced Age-Related Macular Degeneration in the Age-Related Eye Disease Study (AREDS) AREDS report no. 19. Ophthalmology. 2005 ; 112 : 533-9.
[7] Eichenbaum JW. Geriatric vision loss due to cataracts, macular degeneration, and glaucoma. Mount Sinai J Med. 2012 ; 79 : 276-94.
[8] El Chehab H, Le Corre A, Giraud JM, et al. [Efficacy of prophylactic treatment of intraocular pressure spikes due to intravitreal injections]. J Fr Ophtalmol. 2012 ; 35 : 614-21.
[9] European Glaucoma Society. Terminology and guidelines for glaucoma. Third edition. 2008.
[10] Friedman DS, Jampel HD, Munoz B, West SK. The prevalence of open-angle glaucoma among blacks and whites 73 years and older : the Salisbury Eye Evaluation Glaucoma Study. Arch Ophthalmol. 2006 ; 124 : 1625-30.
[11] Furuichi M, Chiba T, Abe K, et al. Cystoid macular edema associated with topical latanoprost in glaucomatous eyes with a normally functioning blood-ocular barrier. J Glaucoma. 2001 ; 10 : 233-6.
[12] Garas A, Papp A, Hollo G. Influence of age-related macular degeneration on macular thickness measurement made with fourier-domain optical coherence tomography. J Glaucoma. 2013 ; 22 : 195-200.
[13] Gordon MO, Beiser JA, Brandt JD, et al. The Ocular Hypertension Treatment Study : baseline factors that predict the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002 ; 120 : 714-20 ; discussion : 829-30.
[14] Jaffe GJ, Caprioli J. Optical coherence tomography to detect and manage retinal disease and glaucoma. Am J Ophthalmol. 2004 ; 137 : 156-69.
[15] Klein R, Cruickshanks KJ, Nash SD, et al. The prevalence of age-related macular degeneration and associated risk factors. Arch Ophthalmol. 2010 ; 128 : 750-8.
[16] Koenig F, Soubrane G, Coscas G. [Angiographic aspects of senile macular degeneration : spontaneous course]. J Fr Ophtalmol. 1984 ; 7 : 93-8.
[17] Mathalone N, Arodi-Golan A, Sar S, et al. Sustained elevation of intraocular pressure after intravitreal injections of bevacizumab in eyes with neovascular age-related macular degeneration. Graefe’s Arch Clin Exper Ophthalmol. 2012 ; 250 : 1435-40.
[18] Ozturk F, Yavas GF, Kusbeci T. The effect of ocular hypotensive agents on macula. Ann Ophthalmol. 2007 ; 39 : 302-6.
[19] Resnikoff S, Pascolini D, Etya’ale D, et al. Global data on visual impairment in the year 2002. Bulletin of the World Health Organization. 2004 ; 82 : 844-51.
[20] Scheetz TE, Fingert JH, Wang K, et al. A genome-wide association study for primary open angle glaucoma and macular degeneration reveals novel Loci. PloS One. 2013 ; 8 : e58657.
[21] Singh RS, Kim JE. Ocular hypertension following intravitreal anti-vascular endothelial growth factor agents. Drugs & Aging. 2012 ; 29 : 949-56.
[22] Skalicky SE, Ho I, Agar A, Bank A. Glaucoma filtration surgery following sustained elevation of intraocular pressure secondary to intravitreal anti-VEGF injections. Ophthalmic Surgery, Lasers & Imaging. 2012 ; 43 : 328-34.
[23] Soubrane G, Haddad WM, Coscas G. [Age-related macular degeneration]. Presse Med. 2002 ; 31 : 1282-7.
[24] Valtot F. [Glaucoma and age-related macular degeneration intricacy]. J Fr Ophtalmol. 2008 ; 31 : 2S55-60.
[25] Yeom HY, Hong S, Kim SS, et al. Influence of topical bimatoprost on macular thickness and volume in glaucoma patients with phakic eyes. Can J Ophthalmol. 2008 ; 43 : 563-6.
L. Ballonzoli, T. Bourcier
L’association glaucome primitif à angle ouvert (GPAO)-décollement de rétine est le plus souvent fortuite.
La chronologie des événements dans l’analyse clinique est importante.
La détermination du mécanisme de l’HTO est l’étape capitale. Elle dépend d’une analyse sémiologique fine du segment antérieur incluant une gonioscopie.
Hypertension intra-oculaire (HTO) liée aux corticoïdes et GPAO préexistant méconnus restent des diagnostics d’élimination.
La thérapeutique est guidée par le mécanisme de l’HTO.
Les recours chirurgicaux sont peu fréquents mais souvent de mauvais pronostic.
Le contrôle de la PIO est important dans le suivi postopératoire du décollement de rétine (DR).
La combinaison du GPAO et d’un décollement de rétine est le plus souvent fortuite, même si les deux pathologies, l’une chronique, l’autre aiguë, ont des facteurs de risque commun : myopie forte, syndrome de Stickler ou syndrome de Marfan, contexte de traumatisme oculaire pénétrant ou non. Cette association pathologique peut s’envisager sous différents angles selon la chronologie de découverte des symptômes. Ici encore, c’est l’examen clinique qui guide la démarche diagnostique, détermine la physiopathologie et permet le choix des options thérapeutiques. En effet, la gonioscopie, l’examen de la chambre antérieure et de l’iris occupent une place primordiale.
Cette situation peut se rencontrer de façon non exceptionnelle chez le patient avançant dans l’âge, puisque l’incidence de ces pathologies augmente avec le vieillissement de la population. Si fréquemment le diagnostic de GPAO est déjà connu, il arrive dans près de 10 % des cas qu’il soit posé de façon surprenante en pré- ou peropératoire devant l’aspect excavé et pathologique de la papille. Cependant, l’hypotonie oculaire provoquée par la survenue d’un décollement de rétine peut masquer un GPAO préexistant méconnu [10]. Dans ce cas, l’examen de l’œil adelphe (mesure de la pression intra-oculaire, aspect de la chambre antérieure, de l’angle et de la papille) apportera de précieux renseignements diagnostiques. Dans le cas d’un patient glaucomateux connu et équilibré sous traitement médical, il faudra veiller à ce que la chirurgie du décollement de rétine déséquilibre le moins possible la pression intra-oculaire (PIO) du patient. Dans le cas d’un patient sous collyre myotique, la question de l’imputabilité du décollement de rétine se posera, d’autant qu’il existe d’autres facteurs de risque : myopie forte ou syndrome de dispersion pigmentaire [46]. Dans le cas de patients opérés de glaucome, que ce soit par chirurgie filtrante (perforante ou non) ou par pose de valve, la problématique de l’impact de la chirurgie du décollement de rétine sur le pronostic du glaucome se pose directement. En effet, les déchirures rétiniennes surviennent statistiquement le plus souvent dans le quadrant temporal supérieur, qui est également le site de choix pour positionner une chirurgie filtrante ou une valve [52, 54]. Dès lors, la chirurgie du décollement de rétine se doit, le plus possible, de respecter le site de filtration pour ne pas compromettre l’évolution postopératoire du glaucome. Cela commence dès l’abord conjonctivoténonien. Dans certains cas, la pose d’une indentation n’est pas possible, contraignant le chirurgien à une vitrectomie [7, 21, 36, 44]. Le développement récent des techniques de vitrectomie transconjonctivale micro-invasive 25 G et 27 G constitue un avantage indéniable pour privilégier cette option chirurgicale, en précisant toutefois qu’une suture de l’orifice conjonctival est indispensable dans ce contexte. Enfin, le risque d’augmentation postopératoire de la PIO (quel qu’en soit le mécanisme) devra faire l’objet d’une prophylaxie systématique par collyre hypotonisant.
Il définit classiquement une hypertonie oculaire compliquant une hémorragie du vitré, le plus souvent traumatique avec ouverture de la hyaloïde antérieure [15, 40]. L’hypertonie apparaît entre une et trois semaines après l’hémorragie vitréenne. Elle est due à l’obstruction du trabéculum par des hématies dégradées ayant perdu leur déformabilité. L’aspect gonioscopique en « sucre candi » ou « tartiné de beurre » est pathognomonique, montrant un niveau blanc-jaunâtre surmontant un composé brun-rouge hématique. L’évolution est rarement spontanément favorable et, après une phase initiale de quelques jours de traitement médical, si la situation persiste, l’indication de lavage de la chambre antérieure est posée, associé ou non à une vitrectomie en fonction du volume de l’hémorragie intravitréenne [1].
Il s’agit d’une pathologie rare, décrite par Schwartz en 1973 : glaucome à angle ouvert secondaire à un décollement de rétine rhegmatogène par déchirure de l’épithélium non pigmenté ou par dialyse à l’ora [26, 51]. L’HTO peut être au premier plan et permettre la découverte du décollement de rétine [12]. Elle se caractérise par des fluctuations très importantes et concerne le plus souvent des hommes jeunes aux antécédents de traumatisme oculaire. Dans cette entité, ce sont les articles externes des photorécepteurs en suspension dans l’humeur aqueuse (Tyndall visible en lampe à fente) qui viennent obstruer le trabéculum [37-39]. La réapplication de la rétine permet la résolution de l’hypertonie après une majoration postopératoire immédiate qu’il convient de prévenir.
De nombreuses pathologies rétiniennes peuvent être responsables d’un glaucome secondaire par fermeture de l’angle. On distingue essentiellement trois mécanismes : le glaucome néovasculaire, la formation de synéchies antérieures périphériques et la bascule antérieure du complexe iridocristallinien. Le tableau 13-7 fait la synthèse de ces pathologies.

Tableau 13-7 Étiologies des glaucomes secondaires aux pathologies vitréorétiniennes se manifestant par un décollement de rétine, tous mécanismes confondus.
La mise en place d’une indentation peut se compliquer d’HTO dans 1,4 à 4,4 % des cas [13, 15, 32, 49]. La modification de la circulation choroïdienne avec altération du drainage des veines vortiqueuses peut provoquer une congestion de la choroïde et du corps ciliaire [50]. Cette congestion ciliaire est alors responsable d’une bascule antérieure du bloc ciliocristallinien qui favorise la fermeture aiguë de l’angle iridocornéen [47]. Goezinne et al. [22] rapportent ainsi une diminution de profondeur de la chambre antérieure mesurée en OCT, persistant pendant près d’un an après la chirurgie. Les facteurs favorisant sont l’étroitesse de l’angle iridocornéen avant la chirurgie, une myopie forte, un cerclage sur 360°, une compression des veines vortiqueuses, une cryopexie excessive et un âge élevé. La conduite thérapeutique associe collyres cycloplégiques, anti-inflammatoires et hypotonisants. La pilocarpine est contre-indiquée. L’iridotomie laser est inefficace. Classiquement, l’évolution est favorable sous traitement médical en quelques jours. La persistance du tableau peut alors justifier une iridoplastie à l’argon visant à réouvrir l’angle, voire un repositionnement de l’indentation avec drainage choroïdien [11]. Dans les cas extrêmes, une chirurgie filtrante (de réalisation difficile) peut être nécessaire, et certaines équipes proposent la mise en place de valve [35, 52]. En revanche, la cyclodestruction n’est pas recommandée.
La vitrectomie simple sans tamponnement est responsable d’une HTO précoce survenant dans les trois premières heures postopératoires [18, 31]. Elle est supérieure à 30 mmHg chez près de 37 % des patients [3, 16]. L’inflammation oculaire semble jouer un rôle majeur dans la survenue de cette HTO [25] dont l’incidence augmente en cas de photocoagulation étendue, d’indentation préexistante ou concomitante, de chirurgie du cristallin combinée et d’apparition d’un voile de fibrine dans l’aire pupillaire en postopératoire. L’incidence de cette HTO augmente également si la vitrectomie est associée à un tamponnement par gaz (40 %) ou par silicone (50 %) [43, 44].
Les facteurs de risque dans le cas d’un décollement de rétine semblent liés à l’ancienneté de ce dernier et à l’étendue des déchirures [24]. Ces données acquises avec les techniques de vitrectomie 20 G sont actuellement remises en question avec les micro-incisions 23 G et 25 G [6, 28] qui semblent plutôt exposer à une hypotonie oculaire précoce. Dans l’attente de résultats sur des études à plus grande échelle, la prudence est de mise et l’on ne peut qu’encourager la prévention de cette HTO précoce par l’instillation de collyres hypotonisants en fin d’intervention. La vitrectomie est également impliquée dans la survenue de glaucome secondaire apparaissant plusieurs mois ou années après le geste chirurgical. La physiopathologie est complexe, le stress oxydatif des cellules trabéculaires semblant jouer un rôle majeur alors que le cristallin aurait un effet protecteur [36, 44]. Ces données ont été remises en cause récemment par les résultats d’études cliniques [34, 58]. En l’état actuel des connaissances, il est important de surveiller la PIO postopératoire immédiate et à long terme après une vitrectomie, et d’établir une base de référence structurelle et fonctionnelle pour proposer un suivi au moins annuel au patient, notamment s’il présente d’autres facteurs de risque.
Les gaz expansifs – hexafluorure de soufre (SF6), perfluoroéthane (C2F6) et perfluoropropane (C3F8) – sont fréquemment utilisés en chirurgie du décollement de rétine rhegmatogène depuis l’avènement de la vitrectomie [55]. Ils sont employés en mélange combiné à l’air afin d’obtenir une concentration isovolumique (20 % pour le SF6, 17 % pour le C2F6, et 12 à 14 % pour le C3F8), limitant ainsi leur expansion et par conséquent leur effet hypertonisant. Ils offrent l’avantage d’une grande force de réapplication et d’une évacuation sans réintervention allant de quinze jours à trois semaines pour le SF6, et à deux mois pour le C3F8. En contrepartie, ils contre-indiquent les changements importants de pression atmosphérique (séjour en altitude, voyage en avion, caisson hyperbare) et l’utilisation de protoxyde d’azote lors d’une anesthésie générale, au risque d’une expansion brutale de la bulle de gaz provoquant une HTO majeure avec mise en péril de la vascularisation papillaire. Le patient doit être informé de ces risques et prendre les précautions qui s’imposent. Malgré le respect de ces règles, on observe très souvent en pratique clinique une HTO précoce, peu importante et bien jugulée par le traitement médical. Exceptionnellement, une erreur de mélange ou un mauvais positionnement du patient en postopératoire peuvent être responsables d’une poussée vers l’avant du bloc ciliocristallinien ou du passage de gaz en chambre antérieure. En cas de bloc pupillaire (iris convexe), une iridotomie au laser sera indiquée. La persistance de l’apposition iridotrabéculaire dans ce contexte inflammatoire devra faire redouter la formation de synéchies antérieures périphériques qui, une fois confirmées, pourront imposer une chirurgie filtrante.
L’huile de silicone est utilisée dans la chirurgie des décollements de rétine complexes associés à une prolifération vitréorétinienne et/ou néovasculaire [8, 19, 48]. L’HTO peut survenir à tout moment après injection d’huile de silicone et se présenter de façon modérée et transitoire à sévère et prolongée, responsable d’authentiques glaucomes secondaires réfractaires. L’incidence est donc difficile à préciser : elle varie de 4,8 à 48 % selon les études [2, 15, 17, 23, 27, 29, 30, 36, 45]. Cette incidence semble diminuer autour de 10 % avec l’amélioration des techniques chirurgicales et la purification des huiles. En cas d’HTO postopératoire précoce, a fortiori lorsque l’injection de silicone est combinée à une vitrectomie et une indentation sclérale, l’inflammation oculaire est le principal mécanisme, et un traitement médical (associant collyres hypotonisant et anti-inflammatoire) suffit à contrôler la PIO. Chez l’aphake, l’huile de silicone, flottant sur l’humeur aqueuse, fait hernie dans la pupille et provoque un blocage pupillaire qu’il convient de prévenir par la réalisation systématique d’une iridectomie inférieure (supérieure en cas de silicone lourd). Celle-ci peut se boucher secondairement (par du sang ou de la fibrine) et provoquer un glaucome par fermeture de l’angle. La survenue d’une hypertonie à chambre antérieure profonde avec reflet luisant de l’iris et ménisque de silicone dans l’angle iridocornéen doit faire suspecter un remplissage complet de la chambre antérieure par le silicone et imposer une ablation devant le risque de décompensation cornéenne. Parmi les autres mécanismes (rubéose, synéchies antérieures périphériques) impliqués dans le développement de ce glaucome secondaire, le passage de particules émulsifiées en chambre antérieure semble jouer un rôle majeur [14, 20, 30, 56]. Ces particules de silicone émulsifié persistent malgré l’ablation de l’huile et pourraient induire des remaniements inflammatoires et fibrotiques du trabéculum responsables de l’augmentation secondaire de la PIO. L’effet de l’ablation de l’huile de silicone sur la normalisation de la PIO reste modeste, voire inexistant pour certains [41]. Le recours à une chirurgie filtrante semble souvent nécessaire, ne permettant pas toujours le contrôle tensionnel. Valves et tubes semblent plus efficaces que la trabéculectomie [9, 23, 33, 45, 53]. Enfin, le cyclo-affaiblissement au laser peut apporter une solution satisfaisante [19, 33] mais est à réserver en dernier recours aux cas ayant un mauvais pronostic visuel en raison des réactions inflammatoires sévères qu’il provoque [42].
L’HTO cortico-induite reste un diagnostic d’élimination dans ce contexte de survenue post-décollement de rétine. Néanmoins, on sait que l’instillation de collyres cortisonés est responsable d’HTO chez 5 à 30 % des sujets d’une population non glaucomateuse. Ce chiffre est proche de 90 % en cas de GPAO préexistant, les autres facteurs de risque étant le diabète et la myopie forte [4, 5]. Il s’agit donc d’une hypothèse à considérer en cas d’HTO importante survenant 10 à 20 jours après l’intervention, sur un œil calme, à chambre antérieure profonde et angle ouvert. Sur le plan thérapeutique, la prescription de corticoïdes étant indispensable en postopératoire, on tentera de limiter la survenue de cette HTO cortico-induite en remplaçant la dexaméthasone par de la rimexolone ou de la fluorométholone dès que le tableau clinique le permettra. Par ailleurs, l’adjonction de collyres anti-inflammatoires non stéroïdiens apportera une prévention efficace de l’œdème maculaire.
Tous les collyres visant à réduire la PIO peuvent être utilisés en cas de glaucome associé à un décollement de rétine. Seules la pilocarpine et, de façon controversée, les prostaglandines nécessitent quelques précautions d’emploi au regard de leur effet pro-inflammatoire et du risque de déchirure rétinienne imputable à la pilocarpine. L’acétazolamide per os est également un moyen classique et efficace de contrôler la PIO dans les premiers jours suivant une intervention de décollement de rétine.
L’iridotomie au laser YAG est utile en cas de blocage pupillaire ou pour réouvrir une iridectomie bouchée. Elle n’est d’aucune aide en cas de bascule antérieure irido-cristallinienne, où le seul traitement laser envisageable peut être une iridoplastie qui est souvent ici de réalisation difficile. La trabéculoplastie sélective ou à l’argon n’a pas d’indication dans ce contexte.
La plupart des études rapportent l’intérêt de la trabéculectomie ou des dispositifs de drainage (valves et tubes). Ces derniers ont la faveur des auteurs anglo-saxons par rapport à la trabéculectomie classique pour atteindre un contrôle pressionnel satisfaisant. Le pourcentage d’échec de la trabéculectomie est élevé dans ce contexte particulier. Dans tous les cas, le pronostic visuel est mauvais.
Le cyclo-affaiblissement est un traitement efficace pour diminuer la PIO en cas de glaucome secondaire à un décollement de rétine. Néanmoins, la nécessité de répéter le traitement, l’importante réaction inflammatoire qu’il génère et le risque de baisse de vision secondaire en font un traitement de dernière ligne, à réserver aux patients dont le pronostic visuel est déjà compromis.
Retenir
La combinaison du GPAO et d’un décollement de rétine est le plus souvent fortuite, même si les deux pathologies ont des facteurs de risque communs.
Cette association pathologique peut s’envisager sous différents angles selon la chronologie de découverte des symptômes.
C’est l’examen clinique qui guide la démarche diagnostique, détermine la physiopathologie et permet le choix des options thérapeutiques.
Ces tableaux cliniques complexes sont souvent difficiles à maîtriser sur le plan thérapeutique.
Le suivi postopératoire du décollement de rétine avec surveillance attentive de la PIO est important.
[1] Abu el-Asrar AM, al-Obeidan SA. Pars plana vitrectomy in the management of ghost cell glaucoma. Int Ophthalmol. 1995 ; 19 : 121-4.
[2] Al-Jazzaf AM, Netland PA, Charles S. Incidence and management of elevated intraocular pressure after silicone oil injection. J Glaucoma. 2005 ; 14 : 40-6.
[3] Anderson NG, Fineman MS, Brown GC. Incidence of intraocular pressure spike and other adverse events after vitreoretinal surgery. Ophthalmology. 2006 ; 113 : 42-7.
[4] Armaly MF. Effect of corticosteroids on intraocular pressure and fluid dynamics. I. The effect of dexamethasone in the normal eye. Arch Ophthalmol. 1963 ; 70 : 482-91.
[5] Armaly MF. Effect of corticosteroids on intraocular pressure and fluid dynamics. II. The effect of dexamethasone in the glaucomatous eye. Arch Ophthalmol. 1963 ; 70 : 492-9.
[6] Bamonte G, Mura M, Stevie Tan H. Hypotony after 25-gauge vitrectomy. Am J Ophthalmol. 2011 ; 151 : 156-60.
[7] Benz MS, Scott IU, Flynn HW, et al. Retinal detachment in patients with a preexisting glaucoma drainage device : anatomic, visual acuity, and intraocular pressure outcomes. Retina. 2002 ; 22 : 283-7.
[8] Budde M, Cursiefen C, Holbach LM, et al. Silicone oil-associated optic nerve degeneration. Am J Ophthalmol. 2001 ; 131 : 392-4.
[9] Budenz DL, Taba KE, Feuer WJ, et al. Surgical management of secondary glaucoma after pars plana vitrectomy and silicone oil injection for complex retinal detachment. Ophthalmology. 2001 ; 108 : 1628-32.
[10] Burton TC, Arafat NI, Phelps CD. Intraocular pressure in retinal detachment. Int Ophthalmol. 1979 ; 1 : 147-52.
[11] Burton TC, Folk JC. Laser iris retraction for angle-closure glaucoma after retinal detachment surgery. Ophthalmology. 1988 ; 95 : 742-8.
[12] Callender D, Jay JL, Barrie T. Schwartz-Matsuo syndrome : atypical presentation as acute open angle glaucoma. Br J Ophthalmol. 1997 ; 81 : 609-10.
[13] Codenotti M, Iuliano L, Fogliato G, et al. Scleral buckling dislocation mimicking glaucoma progression. Eur J Ophthalmol. 2013 ; 23 : 271-4.
[14] Cvenkel B, Zupan M, Hvala A. Transmission electron microscopic analysis of trabecular meshwork in secondary glaucoma after intravitreal silicone oil injection. Int Ophthalmol. 1996-1997 ; 20 : 43-7.
[15] Creuzot-Garcher C. [Glaucoma surgery and retinal pathology]. J Fr Ophtalmol. 2007 ; 30 : 200-8.
[16] Desai UR, Alhalel AA, Schiffman RM, et al. Intraocular pressure elevation after simple pars plana vitrectomy. Ophthalmology. 1997 ; 104 : 781-6.
[17] Federman JL, Schubert HD. Complications associated with the use of silicone oil in 150 eyes after retina-vitreous surgery. Ophthalmology. 1988 ; 95 : 870-6.
[18] Framme C, Klotz S, Wolf-Schnurrbusch UE, et al. Intraocular pressure changes following 20G pars-plana vitrectomy. Acta Ophthalmol. 2012 ; 90 : 744-9.
[19] Gangwani R, Liu DT, Congdon N, et al. Effectiveness of diode laser trans-scleral cyclophotocoagulation in patients following silicone oil-induced ocular hypertension in Chinese eyes. Indian J Ophthalmol. 2011 ; 59 : 64-6.
[20] Gao RL, Neubauer L, Tang S, et al. Silicone oil in the anterior chamber. Graefes Arch Clin Exp Ophthalmol. 1989 ; 227 : 106-9.
[21] Gedde SJ. Management of glaucoma after retinal detachment surgery. Curr Opin Ophthalmol. 2002 ; 13 : 103-9.
[22] Goezinne F, La Heij EC, Berendschot TT, et al. Anterior chamber depth is significantly decreased after scleral buckling surgery. Ophthalmology. 2010 ; 117 : 79-85.
[23] Gonvers M, Andenmatten R. Temporary silicone oil tamponade and intraocular pressure : an 11-year retrospective study. Eur J Ophthalmol. 1996 ; 6 : 74-80.
[24] Hasegawa Y, Okamoto F, Sugiura Y, et al. Intraocular pressure elevation in the early postoperative period after vitrectomy for rhegmatogenous retinal detachment. Jpn J Ophthalmol. 2012 ; 56 : 46-51.
[25] Han DP, Lewis H, Lambrou FH, et al. Mechanisms of intraocular pressure elevation after pars plana vitrectomy. Ophthalmology. 1989 ; 96 : 1357-62.
[26] Heatley G, Pro M, Harasymowycz P. Schwartz-Matsuo syndrome. J Glaucoma. 2006 ; 15 : 562-4.
[27] Henderer JD, Budenz DL, Flynn HW, et al. Elevated intraocular pressure and hypotony following silicone oil retinal tamponade for complex retinal detachment : incidence and risk factors. Arch Ophthalmol. 1999 ; 117 : 189-95.
[28] Ho LY, Garretson BR, Ranchod TM, et al. Study of intraocular pressure after 23-gauge and 25-gauge pars plana vitrectomy randomized to fluid versus air fill. Retina. 2011 ; 31 : 1109-17.
[29] Honavar SG, Goyal M, Majji AB, et al. Glaucoma after pars plana vitrectomy and silicone oil injection for complicated retinal detachments. Ophthalmology. 1999 ; 106 : 169-76 ; discussion : 177.
[30] Ichhpujani P, Jindal A, Jay Katz L. Silicone oil induced glaucoma : a review. Graefes Arch Clin Exp Ophthalmol. 2009 ; 247 : 1585-93.
[31] Ki-I Y, Yamashita T, Uemura A, et al. Long-term intraocular pressure changes after combined phacoemulsification, intraocular lens implantation, and vitrectomy. Jpn J Ophthalmol. 2012 ; 57 : 57-62.
[32] Kreiger AE, Hodgkinson BJ, Frederick AR, et al. The results of retinal detachment surgery. Analysis of 268 operations with a broad scleral buckle. Arch Ophthalmol. 1971 ; 86 : 385-94.
[33] Kumar A, Dada T, Singh RP, et al. Diode laser trans-scleral cyclophotocoagulation for glaucoma following silicone oil removal. Clin Experiment Ophthalmol. 2001 ; 29 : 220-4.
[34] Lalezary M, Kim SJ, Jiramongkolchai K, et al. Long-term trends in intraocular pressure after pars plana vitrectomy. Retina. 2011 ; 31 : 679-85.
[35] Lima VC, de Moraes CG, Gentile RC, et al. Combined baerveldt glaucoma implant and scleral buckling surgery for patients with retinal detachment and coexisting glaucoma. J Glaucoma. 2013 ; 22 : 294-300.
[36] Mangouritsas G, Mourtzoukos S, Portaliou DM, et al. Glaucoma associated with the management of rhegmatogenous retinal detachment. Clin Ophthalmol. 2013 ; 7 : 727-34.
[37] Matsuo T. Photoreceptor outer segments in aqueous humor : key to understanding a new syndrome. Surv Ophthalmol. 1994 ; 39 : 211-33.
[38] Matsuo T, Muraoka N, Shiraga F, et al. Schwartz-Matsuo syndrome in retinal detachment with tears of the nonpigmented epithelium of the ciliary body. Acta Ophthalmol Scand. 1998 ; 76 : 481-5.
[39] Mitry D, Constable I, Singh J. Photoreceptor outer segment glaucoma in rhegmatogenous retinal detachment. Arch Ophthalmol. 2009 ; 127 : 1053-4.
[40] Montenegro MH, Simmons RJ. Ghost cell glaucoma. Int Ophthalmol Clin. 1995 ; 35 : 111-5.
[41] Moisseiev J, Barak A, Manaim T, et al. Removal of silicone oil in the management of glaucoma in eyes with emulsified silicone. Retina. 1993 ; 13 : 290-5.
[42] Moisseiev E, Ohana O, Gershovitch L, et al. Visual prognosis and complications following silicone oil removal. Eur J Ophthalmol. 2013 ; 23 : 236-41.
[43] Muether PS, Hoerster R, Kirchhof B, et al. Course of intraocular pressure after vitreoretinal surgery : is early postoperative intraocular pressure elevation predictable ? Retina. 2011 ; 31 : 1545-52.
[44] Müller M, Geerling G, Zierhut M, et al. [Glaucoma and retinal surgery]. Ophthalmologe. 2010 ; 107 : 419-26.
[45] Nguyen QH, Lloyd MA, Heuer DK, et al. Incidence and management of glaucoma after intravitreal silicone oil injection for complicated retinal detachments. Ophthalmology. 1992 ; 99 : 1520-6.
[46] Pape LG, Forbes M. Retinal detachment and miotic therapy. Am J Ophthalmol. 1978 ; 85 : 558-66.
[47] Perez RN, Phelps CD, Burton TC. Angel-closure glaucoma following scleral buckling operations. Trans Sect Ophthalmol Am Acad Ophthalmol Otolaryngol. 1976 ; 81 : 247-52.
[48] Romano MR, Angi M, Romano V, et al. Intraocular pressure changes following the use of silicone oil or Densiron 68 as endotamponade in pars plana vitrectomy. Clin Ophthalmol. 2010 ; 4 : 1391-6.
[49] Ruiz-De-Gopegui E, Ascaso FJ, Del Buey MA, et al. [Effects of encircling scleral buckling on the morphology and biomechanical properties of the cornea]. Arch Soc Esp Oftalmol. 2011 ; 86 : 363-7.
[50] Sato EA, Shinoda K, Inoue M, et al. Reduced choroidal blood flow can induce visual field defect in open angle glaucoma patients without intraocular pressure elevation following encircling scleral buckling. Retina. 2008 ; 28 : 493-7.
[51] Schwartz A. Chronic open-angle glaucoma secondary to rhegmatogenous retinal detachment. Am J Ophthalmol. 1973 ; 75 : 205-11.
[52] Scott IU, Gedde SJ, Budenz DL, et al. Baerveldt drainage implants in eyes with a preexisting scleral buckle. Arch Ophthalmol. 2000 ; 118 : 1509-13.
[53] Singh D, Chandra A, Sihota R, et al. Long-term success of mitomycin-augmented trabeculectomy for glaucoma after vitreoretinal surgery with Silicone oil insertion : A Prospective Case Series. Retina. 2014 ; 34 : 123-8.
[54] Thompson WS, Smiddy WE, Flynn HW, et al. Outcome of functioning filtering blebs after pars plana vitrectomy. Ophthalmic Surg Lasers. 1996 ; 27 : 367-73.
[55] Toffoli D, Arbour JD, Harasymowycz P. Retained perfluoron postvitreoretinal surgery causing secondary open-angle glaucoma. Can J Ophthalmol. 2008 ; 43 : 372.
[56] Valone J, McCarthy M. Emulsified anterior chamber silicone oil and glaucoma. Ophthalmology. 1994 ; 101 : 1908-12.
[57] Yang HK, Woo SJ, Park K, et al. Intraocular pressure changes after vitrectomy with and without combined phacoemulsification and intraocular lens implantation. Korean J Ophthalmol. 2010 ; 24 : 341-6.
[58] Yu AL, Brummeisl W, Schaumberger M, et al. Vitrectomy does not increase the risk of open-angle glaucoma or ocular hypertension – a 5-year follow-up. Graefes Arch Clin Exp Ophthalmol. 2010 ; 248 : 1407-14.
C. Burillon
Après chirurgie réfractive cornéenne (CRC), 100 µm d’ablation entraînent une baisse de la pression intra-oculaire (PIO) mesurée estimée entre 5 et 7 mmHg.
Garder en mémoire la PIO préopératoire et calculer l’abaissement pressionnel induit par la CRC en mesurant la PIO postopératoire. Inscrire le différentiel sur le dossier et le donner au patient.
Archiver tous les documents de référence (épaisseur de la cornée centrale, réfraction initiale, protocole opératoire, PIO pré- et postopératoire, photographie des papilles, OCT, etc.) et les communiquer au patient.
Informer le patient qu’il doit toujours conserver son dossier préopératoire et faire part à son ophtalmologiste de ses antécédents de CRC lors de chaque contrôle.
La chirurgie réfractive cornéenne est devenue très populaire depuis quelques années et de nombreux patients sont opérés pour tous les défauts réfractifs. Environ 150 000 procédures de CRC sont réalisées chaque année, et ce nombre ne cesse d’augmenter [12]. Étant donné que la plupart des patients candidats à cette chirurgie sont des sujets myopes et que le glaucome a une nette prévalence chez ces sujets, la sécurité de la chirurgie réfractive cornéenne en termes de développement du glaucome, puis de sa progression, est fréquemment soulevée. Par ailleurs, le candidat à une CRC est généralement jeune avec un risque potentiel de développer un glaucome primitif à angle ouvert (GPAO) quel que soit son défaut réfractif initial, surtout s’il présente des antécédents familiaux de glaucome, ou d’autres facteurs de risque de glaucome (patient mélanoderme, pathologies vasculaires, corticothérapie au long cours, etc.).
Pour toutes ces raisons, le dépistage du GPAO affectant près d’un million de personnes en France – nombre en progression constante – et son suivi doivent pouvoir se faire sans difficulté et de façon systématique chez les patients ayant subi une CRC.
Nous n’aborderons pas ici la chirurgie réfractive cristallinienne (voir chapitre 13-VII).
Toute CRC modifie la forme de la cornée dans le but de corriger le défaut réfractif. Or toute anomalie réfractive peut s’associer à un glaucome, tout particulièrement la myopie forte, mais également – sans fermeture angulaire – un hypermétrope, un astigmate, ou encore un sujet presbyte. Pour mémoire, le risque relatif pour un myope de développer un glaucome est de 1,88 par rapport à un sujet non myope [21]. La relation glaucome-myopie est variable selon les études : si elle est relativement faible pour les myopies de moins de 3 dioptries, elle est beaucoup plus élevée chez les myopes de plus de 3 dioptries [26]. Les sujets myopes moyens à forts, sains au moment de la chirurgie réfractive, doivent donc être considérés comme des sujets plus à risque de développer ultérieurement un glaucome que ceux présentant un autre type d’amétropie.
La surveillance classique de ces patients opérés passe par le suivi de l’évolution réfractive et par l’examen des structures oculaires cherchant à dépister d’autres pathologies :
l’état cornéen : l’aspect de la surface est évalué afin de dépister tout syndrome sec, facteur de mauvaise acuité visuelle mais également de troubles aberrométriques, de risque infectieux, voire d’insuffisance progressive en cellules souches limbiques, ce qui aboutirait à une modification de l’épaisseur cornéenne. L’état de l’interface est analysé si la chirurgie était lamellaire, avec la recherche de syndrome inflammatoire, de plis ou d’invasion épithéliale. L’endothélium sera également examiné avec attention. La forme de la cornée, face antérieure et face postérieure, sera évaluée à chaque examen grâce à la réalisation d’une topographie cornéenne à balayage optique, qui permet l’évaluation de l’épaisseur cornéenne sur toute sa surface en plus de la kératométrie (cependant, en fonction des topographes, les mesures de l’élévation postérieure et de la pachymétrie optique sont moins fiables sur les cornées opérées) ;
la mesure de la PIO sera nécessairement fonction des particularités cornéennes décrites ;
l’examen du cristallin permet d’éliminer ou non une cataracte ;
l’examen du segment postérieur est très important pour définir l’état vitréen, décollé ou non, pour dépister les lésions dégénératives de la rétine et pour analyser la papille optique et les fibres nerveuses rétiniennes qui l’entourent.
La méthode de mesure de la PIO la plus communément utilisée est celle du tonomètre à aplanation de Goldmann, basée sur la loi d’Imbert-Fick qui tient compte de la rigidité cornéenne, elle-même influencée par l’épaisseur cornéenne. Les mesures fournies sont fondées sur une épaisseur cornéenne de 520 µm [10].
Ainsi, comme cela a déjà été détaillé au chapitre 9-II paragraphe « Techniques de mesure de la pression intra-oculaire », la fiabilité de la mesure avec ce type de tonométrie oculaire est sujette à une certaine imprécision, d’autant plus grande que la cornée du sujet se départit du modèle simplifié proposé par Goldmann [9, 33]. La mesure de la PIO par tonomètre à air est également fondée sur un principe d’aplanation même s’il est non contact. Après Lasik (laser in situ keratomileusis), plusieurs études ont démontré que la baisse mesurée de la PIO était significativement plus importante avec le tonomètre à air qu’avec le tonomètre de Goldmann [7]. Toutefois, de même qu’avec le Goldmann, cette baisse est corrélée au degré de myopie préopératoire. Ainsi la PIO mesurée après CRC ne correspond plus à la PIO réelle avec ces deux moyens de mesure.
À la différence des autres tonométries, la tonométrie dynamique de Pascal™ (Ziemer Ophthalmic Systems) s’affranchirait du facteur cornéen (tonométrie de contour), épaisseur comme courbure et biomécanique.
Plusieurs études ont démontré que le tonomètre de Pascal™ fournissait des mesures de la PIO non modifiées par l’amincissement de la cornée induit par la chirurgie réfractive [31]. En démontrant que les mesures données par le tonomètre de Pascal™ n’étaient pas significativement différentes des mesures réalisées directement en intracamérulaire, Boehm et al. [3] ont mis en évidence que ce tonomètre était plus approprié pour mesurer la PIO sur des cornées opérées de chirurgie réfractive que le tonomètre de Goldmann.
Ainsi, la mesure de la PIO devra amener le médecin à réfléchir sur sa validité, en fonction de l’amétropie initiale et de son traitement. Encore faudra-t-il que le patient connaisse son amétropie et le type de sa chirurgie, ce qui n’est pas toujours le cas.
La mesure d’une cornée fine doit toujours inciter l’examinateur à rechercher un glaucome, de même que le diagnostic de PIO normale ne peut s’affirmer qu’après la réalisation d’une pachymétrie. Enfin, devant une pachymétrie basse, il ne faut pas oublier de demander au patient s’il a été opéré de chirurgie réfractive cornéenne, certains omettant totalement d’évoquer cette chirurgie ancienne et, volontairement ou pas, effacée de leur mémoire !
Le raisonnement change lorsque le patient présente une cornée amincie à la suite d’une chirurgie réfractive. Il s’agit de patients myopes qui ont subi une photokératectomie réfractive ou un Lasik, diminuant l’épaisseur cornéenne centrale (ECC). La résistance cornéenne diminue en même temps que son épaisseur et la PIO réelle est plus élevée que celle mesurée. De nombreuses études ont essayé de prédire la chute pressionnelle par rapport à la diminution de l’épaisseur de la cornée, et la tendance moyenne serait de relier une baisse de 0,5 mmHg à la correction d’une dioptrie de myopie [27]. Pour autant, tous les lasers Excimer n’enlèvent pas la même épaisseur stromale cornéenne par dioptrie corrigée en raison des particularités du traitement : asphérique ou personnalisé, par exemple. Il serait donc plus logique de ramener l’ablation réalisée à la diminution pressionnelle : 1 mmHg de réduction pour chaque 37,8 µm enlevé [8] ou encore, plus facilement mémorisable, 100 µm de cornée photo-ablatée correspondraient à une diminution pressionnelle moyenne de 5 mmHg [13].
Par ailleurs, l’épaisseur et le diamètre du volet découpé par microkératome ou laser femtoseconde sont des facteurs intervenant dans la rigidité de la nouvelle cornée, et il est difficile d’établir une formule fiable et reproductible permettant l’évaluation d’un facteur correctif de la PIO après CRC.
Au mieux, la PIO préopératoire est connue, et le préambule peut être fixé qu’un glaucome n’a aucune raison de survenir rapidement après la chirurgie. Ainsi la valeur de PIO trouvée après le traitement réfractif, lorsque la cornée sera stabilisée (au moins six mois après), sera augmentée du différentiel existant avec la valeur préopératoire. La différence entre cette PIO postopératoire et la PIO préopératoire correspondra au retentissement induit par l’amincissement cornéen sur la valeur mesurée de la PIO. Par exemple, chez un patient de 25 ans qui avait une PIO à 14 mmHg avant Lasik réalisé pour une myopie de – 7 D, et qui n’a plus que 9 mmHg après, il faudra apporter toute sa vie un facteur correctif de 5 mmHg ajouté à la PIO mesurée par tonomètre à aplanation ou à air.
L’augmentation de l’ECC est peu étudiée lors de la chirurgie de l’hypermétropie ou de la presbytie. En fait, dans les traitements photo-ablatifs de ces défauts réfractifs, le centre cornéen n’est pas épaissi : c’est la moyenne périphérie de la cornée qui est amincie afin de modifier la courbure centrale cornéenne, permettant d’augmenter le pouvoir convergent de la cornée. Ainsi la PIO n’est pas augmentée par ces traitements, comme on aurait pu s’y attendre. La cornéenne étant modifiée par l’ablation d’une partie de la membrane de Bowman dans la photokératectomie réfractive ou par la découpe intrastromale du Lasik, certains auteurs ont même retrouvé un abaissement pressionnel après traitement de l’hypermétropie [1, 34].
Lors de la mise en place d’inlays sous un volet cornéen, dans le traitement de la presbytie, l’ECC est alors augmentée de quelques microns, correspondant à l’épaisseur de l’inlay. Le Kamra™ d’Acufocus, ayant une épaisseur de 5 µm, n’induit aucune modification pressionnelle.
Le traitement de l’astigmatisme par incisions arciformes, la kératotomie radiaire, la mise en place d’anneaux cornéens dans la myopie et la chirurgie centrale de la presbytie par Intracor™ (anneaux circulaires centraux de découpe par femtolaser) modifient la forme centrale de la cornée sans modifier l’ECC en théorie. La PIO mesurée est inchangée avec la tonométrie de contact, par rapport à la valeur préopératoire. Quelques auteurs ont démontré que la modification de la forme antérieure de la cornée pouvait également, mais faiblement, modifier la mesure de la PIO par tonographie par aplanation [4, 16, 20]. Cette affirmation n’est pas retrouvée par d’autres auteurs, le facteur isolé de courbure cornéenne antérieure étant difficilement retrouvé, car souvent associé à une modification de l’ECC [23].
En fait, c’est la rigidité cornéenne qui se transforme dans ces cas, et seule la mesure de cette rigidité pourrait confirmer ou non la validité de la mesure de la PIO : l’Ocular Response Analyser® (ORA) serait l’examen permettant d’apporter le plus de réponses en évaluant la viscosité et l’élasticité de la cornée [19].
De nouveaux appareils tels que l’Ocular Response Analyzer® (ORA, Reichert) et plus récemment le Corvis ST (Oculus) [2, 24] évaluent un nouveau paramètre, l’hystérèse, qui est la propriété de certains systèmes physiques à différer dans le temps la réponse à une force qui leur est appliquée. La cornée, par exemple, ne revient pas instantanément à sa forme d’origine car elle absorbe une partie de l’énergie mécanique incidente.
L’ORA émet un jet d’air continu dirigé vers le sommet cornéen et permet de mesurer deux pressions d’aplanation consécutives : P1 lors de la déformation cornéenne initiale consécutive à l’augmentation de pression et P2 au moment où la cornée retourne vers son état initial. À partir de ces valeurs, le logiciel de l’ORA définit l’hystérèse cornéenne comme la différence entre P1 et P2, proportionnelle au degré de viscosité de la cornée et inversement proportionnelle à son degré d’élasticité (voir chapitre-9-II paragraphe « Techniques de mesure de la pression intra-oculaire »).
Après chirurgie réfractive cornéenne, le coefficient d’hystérèse est abaissé [2]. Sans traitement photo-ablatif, la simple découpe du volet stromal au Lasik réduit également la valeur de l’hystérèse cornéenne [9]. En réduisant cette dernière, la chirurgie réfractive modifie la viscoélasticité de la cornée et ainsi les mesures de la PIO de Goldmann.
Disponible depuis peu, le Corvis™ ST (Corneal Visualisation, Scheimpflug Technology) est un tonomètre non contact couplé à une caméra Scheimpflug, qui permet d’observer et d’enregistrer les mouvements réactionnels de la cornée à un jet d’air continu [19]. Il rend possible l’analyse de la rigidité cornéenne et fournit une mesure de la PIO compensée par les paramètres cornéens. À ce jour, d’autres études sont encore nécessaires avec ces deux techniques afin de définir un facteur de correction de la PIO mesurée après CRC.
L’examen biomicroscopique binoculaire de la papille peut évoquer à lui seul une suspicion de GPAO. Il faudra savoir reconnaître les anomalies papillaires constitutionnelles comme les dysversions classiques et les plages d’atrophie parapapillaire du myope, qui devront être notées dans le dossier dès leur mise en évidence. Les petites papilles de l’hypermétrope doivent également être notées et surveillées, car l’excavation ne deviendra évidente qu’à un stade évolué de la maladie. L’hémorragie papillaire est quasi pathognomonique du GPAO, mais peut se confondre avec l’émergence d’un vaisseau [2].
Une rétinophotographie peut permettre un meilleur examen rétrospectif des papilles avec, par ailleurs, un éventuel repérage des déficits optiques fasciculaires. Elle doit être systématique en préopératoire en cas de myopie forte, de papille d’aspect douteux, d’antécédents familiaux de GPAO ou dès lors que l’on suspecte un GPAO, afin de servir de référence lors des consultations ultérieures.
Chez ces patients, les capacités diagnostiques restent limitées en cas de forte amétropie et s’il existe une anomalie papillaire constitutionnelle, souvent liée à la réfraction.
Toutefois, si les papilles se modifient un peu, avec un doute sur l’aspect de l’excavation, un examen du champ visuel doit être réalisé (périmétrie standardisée automatique, périmétrie bleu-jaune) et ne présentera aucune anomalie spécifique en relation avec la CRC. S’il existe une dégradation légère de quelques points d’une région du champ visuel, les examens de la structure pourront ou non conforter le diagnostic de début de GPAO. L’analyse des fibres nerveuses rétiniennes (FNR) complétée par l’étude du complexe maculaire cellulaire ganglionnaire en OCT représente l’examen initial de choix afin de dépister l’éventuelle progression d’une atteinte de ces éléments. Leur analyse reste difficile avec de nombreux artéfacts en cas de forte amétropie préexistante, mais les données ainsi recueillies serviront de base de référence pour le suivi de l’évolution. Lorsqu’elle est possible, l’OCT permet une meilleure évaluation que la polarimétrie par balayage laser pour l’analyse des FNR. Enfin, l’HRT (tomographie confocale) présente peu d’intérêt pour l’évaluation de ces papilles souvent dysmorphiques.
L’ensemble du bilan réalisé, éventuellement renouvelé, permettra de conclure à l’apparition d’un glaucome, alors même que la PIO sera toujours inférieure à 20 mmHg.
Dans tous les cas, les patients opérés doivent être informés qu’un suivi ophtalmologique régulier est nécessaire afin de dépister au plus tôt l’apparition ou l’aggravation d’une éventuelle neuropathie optique glaucomateuse. Les analyses structurelles et fonctionnelles du nerf optique font partie intégrante de l’arsenal du suivi clinique des hypertensions intra-oculaires (HTO) et des GPAO, et ne sont en rien modifiées par la chirurgie réfractive.
La PIO est le premier facteur de risque de glaucome, et quasiment le seul paramètre dont le traitement diminue l’incidence et la progression du glaucome. Même s’il a été démontré que l’épaisseur cornéenne a une influence sur la mesure de la PIO et que la prise en compte de la pachymétrie cornéenne ne suffisait plus à prédire les caractéristiques mécaniques du mur cornéen, une augmentation de la valeur de la PIO survenant après la chirurgie réfractive devra alerter le médecin. Que cette PIO soit mesurée avec un tonomètre de Goldmann ou à air, ou encore avec un tonomètre Pascal™, c’est son évolution qui permettra d’affirmer le bon contrôle du traitement ou bien l’aggravation de la maladie glaucomateuse avec un éventuel phénomène d’échappement au traitement instauré. Le diagnostic d’HTO ou de GPAO sera probable, même si les valeurs des PIO mesurées sont inférieures à 20 mmHg, puisque la conversion aura été faite entre la PIO mesurée et la PIO réelle, dans la mesure où seront connus la réfraction initiale et le niveau de l’ablation réalisée. Si cette conversion n’a pas été possible par manque d’informations sur la chirurgie réfractive, il faudra néanmoins s’inquiéter de la modification de la valeur de la PIO et analyser alors simultanément la progression éventuelle de la fonction et de la structure.
La progression des déficits structuraux sera mise en évidence par la comparaison des examens papillaires, réalisés soit par l’intermédiaire d’une lentille, soit en comparant des rétinophotographies successives. Il sera utile de confier ces clichés aux patients afin de les responsabiliser et d’évaluer l’évolution à chaque consultation. Ces clichés ne permettent pas une analyse quantitative, mais l’exclusion d’un vaisseau circum-linéaire ou la survenue d’une hémorragie papillaire seront de bons éléments d’évolution glaucomateuse. L’OCT, le GDx™ et l’HRT sont proposés avec des logiciels d’analyse d’événement et de tendance qui confirmeront ou non la perte des FNR. Ainsi la comparaison entre les résultats de deux ou plusieurs examens identifiera l’évolution dépassant significativement la variabilité inter-examen habituelle.
La comparaison entre les tracés à deux dates différentes permet d’évoquer la progression de l’atteinte fonctionnelle, qui n’est pas forcément parallèle à celle de la structure. Différents logiciels existent, facilitant ces comparaisons, comme le GPA (glaucoma progression analysis) du périmètre Humphrey, l’étude du VFI (visual field index) ou encore le progamme EyeSuite du périmètre Octopus.
Un mois après les premières modifications de la structure et de la fonction, une consultation est nécessaire pour apprécier l’effet du traitement instauré. La PIO doit avoir diminué et les autres examens doivent être stables, voire parfois un peu améliorés. Un contrôle à trois mois est programmé avant de réaliser un suivi biannuel.
Le traitement d’une élévation pressionnelle après CRC ne présente pas de différence avec celui des patients glaucomateux n’ayant pas été opérés.
Par ailleurs, la CRC n’entraîne pas de risque supplémentaire dans l’évolution du GPAO, la prévalence de la progression n’étant pas différente entre un groupe opéré et un autre non opéré [15].
Les patients glaucomateux peuvent-ils être des candidats à la CRC ? C’est la question que doit se poser tout chirurgien face au patient toujours demandeur de suppression de son défaut réfractif. Le glaucome est par définition une maladie évolutive, et il faut savoir se projeter dans l’avenir avant de proposer une telle chirurgie [18, 29].
La CRC entraîne toujours une perte de la sensibilité au contraste, marquée au cours des premiers mois postopératoires puis diminuant avec le temps [22]. Certaines découpes irrégulières de la lenticule ou des photo-ablations mal centrées vont aggraver cette perte de sensibilité. Or la sensibilité au contraste est également diminuée chez un glaucomateux [28]. L’association de la CRC et du glaucome pourrait ainsi entraîner un handicap plus important du patient.
C’est ainsi que tout glaucome avéré avec atteinte périmétrique ne doit pas être opéré.
La simple HTO, même traitée médicalement, sans atteinte fonctionnelle ni structurale, peut autoriser la réalisation d’une CRC, sauf en cas de forte myopie et à la condition impérative d’une traçabilité préopératoire de toutes les mesures oculaires. Ces informations doivent être stockées dans notre dossier et données également au patient en insistant sur leur importance. Une CRC de surface de type photokératectomie réfractive, si elle est réalisable et efficace, sera pratiquée de préférence.
Il sera rigoureux afin de dépister un syndrome sec et/ou une inflammation chronique, volontiers induits par les collyres antiglaucomateux… ou par le port de lentilles de contact.
Il faudra absolument traiter ces symptômes avant la chirurgie réfractive sous peine d’aggravation majeure qui compliquerait la poursuite de la prise en charge du glaucome. L’utilisation de collyres sans conservateurs, l’hydratation journalière de la surface oculaire et la suppression des lentilles de contact seront nécessaires, mais pas toujours suffisantes. S’il n’y a pas d’amélioration, la CRC est formellement contre-indiquée.
La photokératectomie réfractive est la chirurgie qui déstabilisera le moins la rigidité cornéenne, mais elle entraîne très souvent une sécheresse oculaire sur le long terme.
Le Lasik modifiera certainement la valeur de la PIO réelle. Il entraîne toujours une augmentation de la PIO au cours de l’utilisation de l’anneau de succion en peropératoire [6], mais cette augmentation est moins importante avec le laser femtoseconde qu’avec un microkératome (de moins en moins utilisé) [32] et reste brève, normalement sans retentissement sur les FNR [5, 14]. Un risque beaucoup plus important est celui induit par la corticothérapie locale prescrite en postopératoire [11, 17]. Sa courte durée permet généralement une normalisation tensionnelle à son arrêt mais, à l’occasion de complications comme la kératite lamellaire diffuse (SOS syndrome), le traitement prolongé peut déclencher un glaucome ou aggraver rapidement un GPAO préexistant [17].
Le Lasek (laser subepithelial keratectomy) est peu réalisé et entraîne les mêmes effets qu’une photokératectomie réfractive [25].
Les inlays intracornéens aggravent toujours un syndrome sec initial. Ils ont l’avantage de pouvoir être retirés si problème.
La chirurgie intra-oculaire (implant du phake et implant multifocal) doit rester formellement contre-indiquée sur un œil présentant un angle pathologique et une sensibilité au contraste altérée.
Ainsi, le GPAO diagnostiqué et traité reste une contre-indication à la CRC. Une éventuelle photokératectomie réfractive peut être envisagée en cas d’HTO ou de glaucome débutant bien contrôlé à condition de respecter les règles bien établies du bilan pré- et postopératoire, sans oublier l’importance d’une information claire et la plus complète possible en insistant sur l’importance du suivi clinique et les difficultés diagnostiques secondaires engendrées par cette chirurgie [29, 30].
Retenir
Toujours réaliser un examen oculaire complet avant de faire une CRC, a fortiori chez un patient susceptible de devenir glaucomateux.
Savoir refuser la CRC lors de GPAO diagnostiqué et traité : un mauvais résultat éventuel sera reproché.
La PIO mesurée à l’aplanation après CRC ne correspond pas à la vraie valeur de la PIO.
L’hystérèse cornéenne est un paramètre à étudier par le spécialiste en chirurgie réfractive comme par le spécialiste qui assure la prise en charge du glaucome.
L’étude couplée de la structure et de la fonction des FNR reste le meilleur moyen de diagnostic d’un glaucome et de l’évaluation de son évolution après CRC.
[1] Alonso-Munoz L, Lleo-Perez A, Rahhal MS, et al. Assessment of aplanation tonometry after hyperopic laser in situ keratomileusis. Cornea. 2002 ; 21 : 156-60.
[2] Bengtsson B, Leske MC, Yang Z, Heijl A. Disc hemorrhages and treatment in the early manifest glaucoma trial. Ophthalmology. 2008 ; 115 : 2044-8.
[3] Boehm AG, Weber A, Pillunat LE, et al. Dynamic contour tonometry in comparison to intracameral IOP measurements. Invest Ophthalmol Vis Sci. 2008 ; 49 : 2472-7.
[4] Burvenic H, Sallet G, De Clercq J. The correlation between IOP measurement, central corneal thickness and corneal curvature. Bull Soc Belge Ophtalmol. 2000 ; 276 : 23-6.
[5] Chan KC, Poostchi A, Wong T, et al. Visual field changes after transient elevation of intraocular pressure in eyes with and without glaucoma. Ophthalmology. 2008 ; 115 : 667-72.
[6] Chaurasia SS, Luengo Gimeno F, Tan K, et al. In vivo real-time intraocular pressure variations during LASIK flap creation. Invest Ophthalmol Vis Sci. 2010 ; 51 : 4641-5.
[7] El Danasoury MA, El Maghraby A, Coorpender SJ. Cange in intraocular pressure in myopic eyes measured with contact and non-contact tonometers after laser in situ keratomileusis. J Refract Surg. 2001 ; 17 : 97-104.
[8] Emara B, Probst LE, Tingey DP, et al. Correlation of intraocular pressure and central corneal thickness in normal myopic eyes and after laser in situ keratomileusis. J Cataract Refract Surg. 1998 ; 24 : 1320-5.
[9] Gatinel D, Chaabouni S, Adam PA, et al. Corneal hysteresis, resistance factor, topography, and pachymetry after corneal lamellar flap. J Refract Surg. 2007 ; 23 : 76-84.
[10] Goldmann H. Applanation tonometry. In : Newell FW (ed.). Glaucoma transactions of the second conference. New York : Josiah Macy Jr Foundation, 1957 : 167-220.
[11] Hamilton DR, Manche EE, Rich LF, Maloney RK. Steroid-induced glaucoma after laser in situ keratomileusis associated with interface fluid. Ophthalmology. 2002 ; 109 : 659-65.
[12] Harmon D. Market Scope’s 2010 Comprehensive report on the global refractive surgery. Market Scope, 2010.
[13] Hornova J, Sedlak P, Hlouskova B. Refractive procedures-lasik- and intraocular pressure in myopic eyes. Cesk Slov Oftalmol. 2000 ; 56 : 98.
[14] Hosny M, Zaki RM, Ahmed RA, et al. Changes in retinal nerve fiber layer thickness following mechanical microkeratome-assisted versus femtosecond laser-assisted LASIK. Clin Ophthalmol. 2013 ; 7 : 1919-22.
[15] Kim YJ, Yun SC, Na JH, et al. Glaucoma progression in eyes with a history of refractive corneal surgery. Invest Ophthalmol Vis Sci. 2012 ; 53 : 4485-9.
[16] Kohlhaas M, Lerche RC, Draeger J, et al. The influence of corneal thickness and corneal curvature on tonometry reading after corneal refractive surgery. Eur J Implant Refract Surg. 1995 ; 7 : 84-8.
[17] Lautebach S, Funk J, Reinhard T, Pache M. Steroid glaucoma after laser in situ keratomileusis. Klin Monbl Augenheilkd. 2007 ; 224 : 438-40.
[18] Lin X, Yu M. Application of laser-assisted in situ keratomileusis in glaucoma patients. Yan Ke Xue Bao. 2006 ; 22 : 80-4.
[19] Luce DA. Determining in vivo biomechanical properties of the cornea with an ocular response analyzer. J Cataract Refract Surg. 2005 ; 31 : 156-62.
[20] Mark HH. Corneal curvature in applanation tonometry. Am J Ophthalmol. 1973 ; 76 : 223-4.
[21] Mitchell P, Hourihan F, Sandbach J, et al. The relationship between glaucoma and myopia : the Blue Montains Eye Study. Ophthalmology. 1999 ; 18 : 14-22.
[22] Nassiri N, Safi S, Aghazade Amiri M, et al. Visual outcome and contrast sensitivity after photorefractive keratectomy in low to moderate myopia : wavefront-optimized versus conventional methods. J Cataract Refract Surg. 2011 ; 37 : 1858-64.
[23] Paranhos A, Paranhos FR, Prata JA, et al. Influence of keratometric readings on comparative intraocular pressure measurements with Goldmann, Tono-Pen, and non-contact tonometers. J Glaucoma. 2000 ; 9 : 219-23.
[24] Pepose JS, Feigenbaum SK, Qazi MA, et al. Changes in corneal biomechanics and intraocular pressure following Lasik using static, dynamic, and noncontact tonometry. Am J Ophthalmol. 2007 ; 143 : 39-47.
[25] Qazi MA, Sanderson JP, Mahmoud AM, et al. Postoperative changes in intraocular pressure and corneal biomechanical metrics Laser in situ keratomileusis versus laser-assisted subepithelial keratectomy. J Cataract Surg. 2009 ; 35 : 1774-88.
[26] Qiu M, Wang SY, Singh K, Lin SC. Association between myopia and glaucoma in the United States population. Invest Ophthalmol Vis Sci. 2013 ; 54 : 830-5.
[27] Rashad KM, Bahnassy AA. Changes in intraocular pressure after laser in situ keratomileusis. J Refract Surg. 2001 ; 17 : 420-7.
[28] Richman J, Lorenzana LL, Lankaranian D, et al. Importance of visual acuity and contrast sensitivity in patients with glaucoma. Arch Ophthalmol. 2010 ; 128 : 1576-82.
[29] Samuelson TW. Refractive surgery in glaucoma. Curr Opin Ophthalmol. 2004 ; 15 : 112-8.
[30] Shrivastava A, Madu A, Schultz J. Refractive surgery and the glaucoma patient. Curr Opin Ophthalmol. 2011 ; 22 : 215-21.
[31] Siganos DS, Papastergiou GI, Moedas C. Assessment of the Pascal dynamic contour tonometer in monitoring intraocular pressure in unoperated eyes and eyes after Lasik. J Cataract Refract Surg. 2004 ; 30 : 746-51.
[32] Vetter JM, Faust M, Gericke A, et al. Intraocular pressure measurements during flap preparation using 2 femtosecond lasers and 1 microkeratome in human donor eyes. J Cataract Refract Surg. 2012 ; 38 : 2011-8.
[33] Wolfs RC, Klaver CC, Vingerling JR, et al. Distribution of central corneal thickness and its association with intraocular pressure : The Rotterdam Study. Am J Ophthalmol. 1997 ; 123 : 767-72.
[34] Zadok D, Raifkup F, Landao D, et al. Intraocular pressure after lasik for hyperopia. Ophthalmology. 2002 ; 109 : 1659-61.
T. Bourcier, L. Ballonzoli
Les glaucomes post-kératoplastie (GPK) représentent la 2e cause d’échec d’une greffe de cornée et de mauvaise récupération visuelle après la survenue d’un rejet du greffon.
L’incidence du GPK s’échelonne selon les séries de 9 à 31 % en postopératoire précoce et de 18 à 35 % en postopératoire tardif.
Un antécédent de glaucome représente le principal facteur de risque de GPK.
Le GPK peut également se déclarer de novo.
La plupart des GPK se développent dans l’année qui suit la greffe.
Le niveau moyen de la PIO est de 30 mmHg.
Dans tous les cas, l’augmentation de la PIO postopératoire constitue un facteur de progression bien connu de la neuropathie optique mais accélère (d’un facteur 3) également la perte cellulaire endothéliale et diminue la durée de vie des greffons cornéens.
Le diagnostic et le suivi des glaucomes pré- et post-kératoplastie sont difficiles chez des patients ayant des cornées irrégulières et/ou opaques.
Un glaucome primitif présent préalablement à la réalisation de la greffe de cornée aura presque toujours tendance à s’aggraver et/ou devenir secondaire du fait de la formation progressive de synéchies antérieures périphériques.
Le pronostic anatomique et fonctionnel des GPK est souvent péjoratif.
La prévalence et la sévérité du GPK semblent moindres en cas de greffe lamellaire antérieure ou de greffe endothéliale par rapport aux greffes transfixiantes.
L’objectif des greffes de cornée est de rétablir la vision de patients atteints de cécité ou de malvoyance majoritairement ou exclusivement d’origine cornéenne, en remplaçant une cornée opaque et/ou déformée par une cornée transparente et régulière. Il s’agit d’allogreffes. Plusieurs techniques chirurgicales de greffes de cornée sont actuellement utilisées : kératoplastie transfixiante de pleine épaisseur (épithélium, stroma, endothélium) mais aussi greffes lamellaires : kératoplasties lamellaires antérieures (ALK, DALK), greffes endothéliales (DSAEK, DMEK). Ces dernières ont de nombreux avantages par rapport à la kératoplastie transfixiante qui reste encore en 2014 la plus pratiquée de par le monde. Les principales indications des greffes de cornée sont le kératocône, les dystrophies bulleuses du pseudo-phake ou de l’aphake, la dystrophie endothéliale de Fuchs, les séquelles de traumatismes cornéens, les séquelles de kératites infectieuses incluant notamment l’herpès, et les échecs de greffes de cornée antérieures.
Le succès anatomique et fonctionnel d’une greffe de cornée dépend de nombreux facteurs pré-, per- et postopératoires et notamment de la persistance d’un greffon clair (sans rejet immunologique ni décompensation endothéliale), le plus sphérique possible (peu d’astigmatisme), mais aussi de l’absence de maculopathie ou de glaucome associé. Irvine et Kaufman [16] ont été les premiers à décrire cette association entre greffe de cornée et glaucome en 1969. Que le patient soit déjà atteint d’un glaucome primitif à angle ouvert (GPAO) ou non préalablement à la kératoplastie, les GPK sont fréquents et leur prévalence est probablement sous-estimée en raison de difficultés diagnostiques. L’issue des GPK, volontiers secondaires et réfractaires, peut être fatale soit pour le nerf optique (aggravation et/ou apparition d’une neuropathie optique sévère), soit pour l’endothélium cornéen (décompensation ou rejet), et parfois les deux. Quel(s) que soi(en)t le(s) mécanisme(s) impliqué(s), les GPK représentent la 2e cause d’échec d’une greffe de cornée et de mauvaise récupération visuelle après la survenue d’un rejet du greffon [5].
Il n’existe pas de définition officielle du GPK, qui est généralement défini dans la littérature par une pression intra-oculaire (PIO) supérieure à 21 mmHg avec (véritable GPK) ou sans altérations de la papille et du champ visuel (simple hypertonie post-kératoplastie), ou par la nécessité de renforcer un traitement hypotonisant préexistant avant la greffe, ou encore par une augmentation de la PIO de 10 mmHg par rapport à la valeur préopératoire [7, 20]. Un délai postopératoire d’un à trois mois est généralement retenu pour différencier GPK précoce et GPK tardif.
Ce chapitre se propose de détailler l’incidence, les facteurs de risque, la physiopathologie et les moyens diagnostiques des glaucomes présents avant ou survenant après les différents types de kératoplastie. La prise en charge thérapeutique des GPK sera détaillée dans le chapitre 20-III.
L’incidence du GPK, lorsque l’on considère l’ensemble des kératocônes, toutes indications confondues, s’échelonne selon les séries de 9 à 31 % en postopératoire précoce et de 18 à 35 % en postopératoire tardif [2, 3, 5-7, 9, 12, 25]. Cette incidence est hautement variable en fonction de l’étiologie de la greffe et de certaines pathologies associées à risque :
30 % de GPK précoces en cas de greffe pour dystrophie bulleuse de l’aphake ou du pseudo-phake ;
45 % de GPK précoces et 52 % de GPK tardifs en cas de greffes répétées [antécédent(s) de greffe(s)] ;
71 % de GPK précoces et 76 % de GPK tardifs en cas glaucome préexistant, qu’il s’agisse d’un GPAO ou de glaucomes secondaires (glaucomes inflammatoires, glaucomes avec synéchies antérieures périphériques, glaucome de l’aphake, syndrome irido-cornéo-endothélial, syndrome de Peters, etc.) ;
75 % de GPK pour les greffes sur kératites infectieuses (herpétiques ou autres) ou en situation de perforation cornéenne traumatique, immunologique ou infectieuse.
En revanche, l’incidence du GPK se situe entre 0 et 12 % dans le groupe des greffes pour kératocône et est également faible en cas de kératoplastie transfixiante pour dystrophie de Fuchs (tableau 13-8).
Un antécédent de glaucome (38,7 %), d’uvéite et l’âge représente les principaux facteurs de risque de GPK [9, 14].
La plupart des cas (89,4 %) des GPK sont diagnostiqués dans la première année postopératoire [14]. L’intervalle moyen entre la kératoplastie transfixiante et le diagnostic de GPK varie selon les séries de trois mois [17] à douze mois environ [2, 3, 14, 25].
Le niveau moyen de la PIO dans les GPK est de 30 ± 8 mmHg [9, 17] mais des pressions allant jusqu’à 50 à 60 mmHg peuvent être atteintes chez les patients aphakes ou en cas de blocage pupillaire, de glaucome malin ou d’hémorragie expulsive.
Tableau 13-8 Risque relatif de GPK en fonction de la pathologie cornéenne greffée (d’après [18])
Les mécanismes impliqués dans l’apparition d’un GPK ou l’aggravation d’un glaucome préexistant sont multiples.
L’incision circonférentielle de la membrane de Descemet de la cornée greffée entraîne une distorsion de l’angle iridocornéen et un collapsus du trabéculum. Cette compression des structures de l’angle est favorisée par :
des sutures cornéennes serrées, longues et superficielles sur des cornées réceptrices volontiers épaisses ;
l’absence de surdimensionnement du greffon par rapport à la cornée réceptrice ;
les grands diamètres de trépanation.
La réalisation de gestes chirurgicaux associés (cataracte, vitrectomie, iridoplastie, changement d’implant, trabéculectomie), la présence en postopératoire d’un hyphéma, de vitré ou de substance viscoélastique en chambre antérieure, la survenue d’un blocage pupillaire, d’une hémorragie expulsive, d’un glaucome malin ou d’un syndrome d’Urrets-Zavalia peuvent être en cause dans la survenue d’un GPK précoce (fig. 13-24).
Les GPK tardifs sont majoritairement liés à la formation progressive de synéchies antérieures périphériques (SAP) qui entraînent une fermeture secondaire de l’angle. Ces SAP sont favorisées par les infections ou inflammations de l’angle, les prolapsus vitréens, les antécédents de greffe, les traumatismes ou dysgénésies de l’angle, les iris flasques atrophiques ou la survenue d’une période d’hypotonie prolongée pendant la chirurgie [12, 17]. La progression des SAP conduit à l’aggravation du GPK à moyen ou long terme. Des études ont montré qu’elles étaient présentes dans 24 % des yeux en préopératoire et 56 % en postopératoire [14, 17, 18, 23]. Il s’agit d’un élément de mauvais pronostic : un traitement chirurgical du GPK est nécessaire dans 60 % des GPK avec SAP versus 35,7 % en cas de GPK sans SAP. En outre, les acuités visuelles des patients à 6 et 24 mois sont significativement moins bonnes en cas de SAP, et le taux d’échec des greffes augmente.
Les glaucomes cortico-induits (voir chapitre 14-IV) constituent une autre cause importante de GPK tardifs. L’instillation de collyres anti-inflammatoires stéroïdiens destinés à prévenir le risque de rejet de greffe est en effet nécessaire pendant une durée prolongée en cas de kératoplastie transfixiante. Ainsi des hypertonies « simples » cortico-induites avec PIO supérieure à 22 mmHg ont été rapportées dans 22 à 29 % des cas, de véritables GPK dans 5 % des cas, et ce trois à six mois en moyenne après la chirurgie [8].
Les autres causes de GPK sont indiquées dans le tableau 13-9.
Dans tous les cas, l’augmentation de la PIO constitue un facteur de progression bien connu de la neuropathie optique glaucomateuse mais accélère également la perte cellulaire endothéliale des greffons cornéens. Il existe une corrélation entre le niveau et la durée de l’élévation de la PIO, et la diminution de la densité endothéliale du greffon [10, 22]. Sur cornées non greffées, une diminution de 10 à 33 % de la densité cellulaire endothéliale a été rapportée après crise de glaucome aigu par fermeture de l’angle et dans le cadre de glaucomes à angles ouverts [10]. Dans une série récente de kératoplastie transfixiante, la perte cellulaire endothéliale était de 45 % à un an, 60 % à deux ans en cas de GPK associé [14]. Reinhard et al. [22] ont montré que la perte cellulaire endothéliale est multipliée par trois au cours des trois premières années chez les patients ayant un GPK et des antécédents de glaucome en comparaison à des patients sans GPK ni antécédent de glaucome. Le taux de survie à trois ans d’un greffon cornéen est de 71 % en cas d’antécédents de glaucome contre 89 % en l’absence d’antécédent [22]. Pour Allouch et al. [2], le taux de survie du greffon à deux ans était de 82,1 % sans GPK contre 71,5 % en cas de GPK. Dans l’étude d’Ing et al. [15], le taux de survie du greffon à trois ans était de 75,8 % dans le groupe glaucome contre 88,1 % dans le groupe normal. Curieusement, il n’y avait pas dans cette étude de différence entre les deux groupes de kératoplastie transfixiante en termes de rejet immunitaire, mais la moitié des échecs dans le groupe kératoplastie transfixiante + glaucome était attribuable au glaucome. Il semblerait néanmoins pour Aldave et al. [1] que le GPK constitue bel et bien un facteur de risque de rejet immunologique de greffe de cornée. En outre, les rejets étaient plus précoces dans le groupe GPK que dans le groupe indemne de GPK.
Fig. 13-24 Kératoplastie transfixiante à J7.
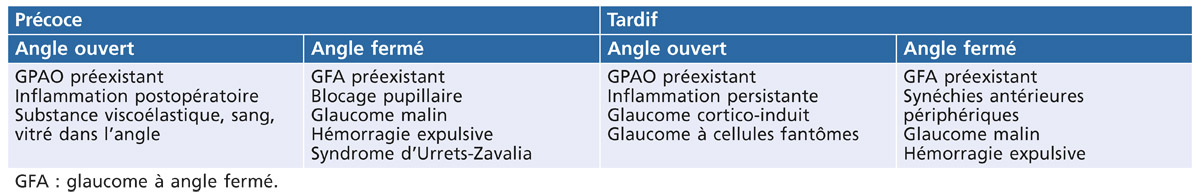
Tableau 13-9 Causes de GPK selon la chronologie et le mécanisme.
La mesure de la PIO, la réalisation d’une gonioscopie et l’analyse de la papille sont difficiles en raison des perturbations de la biomécanique et de la transparence cornéenne (œdème, cicatrice, irrégularité). Ainsi, la présence d’un œdème stromal sous-estime la valeur de la PIO mesurée tandis qu’une cicatrice cornéenne est un facteur de surestimation.
Dans ce contexte de pathologies cornéennes, la mesure de l’épaisseur cornéenne centrale par pachymétrie à ultrasons se révèle indispensable.
Des photographies des papilles seront réalisées chaque fois que possible.
À défaut de gonioscopie, une échographie UBM du segment antérieur peut orienter le chirurgien en précisant la position de l’iris, en recherchant des SAP et la présence d’un éventuel implant intra-oculaire, et en mesurant la profondeur de la chambre antérieure et la largeur de l’angle iridocornéen [7].
La réalisation d’un champ visuel en périmétrie automatisée standard est souvent impossible compte tenu de la mauvaise acuité visuelle des patients. Une périmétrie cinétique de Goldmann sera cependant utile afin de détecter des altérations du champ visuel qui, si elles se révèlent trop importantes (champ visuel tubulaire, perte du point de fixation), peuvent contre-indiquer la kératoplastie transfixiante.
En postopératoire très précoce (moins de sept jours), le diagnostic de GPK repose sur la mesure de la PIO. Cependant, l’absence d’épithélium cornéen ou la présence d’un épithélium irrégulier, œdémateux, rendent difficile la mesure de la PIO par aplanation. Aussi le palper bidigital prudent de l’œil opéré est-il souvent le seul moyen d’estimer la PIO dans les tout premiers jours postopératoires. Pendant cette période, la présence d’un greffon anormalement fin et clair constitue un signe indirect d’HTO (l’œdème stromal postopératoire du greffon est réduit par l’effet compressif de l’hypertonie oculaire) (fig. 13-25 et 13-26).
En postopératoire précoce (de sept jours à un mois environ), le fond d’œil étant inaccessible ou très difficilement analysable et la réalisation d’un champ impossible, le diagnostic de GPK repose là encore sur la mesure de la PIO. Toutefois, la présence d’un astigmatisme parfois marqué, responsable de mires de fluorescéine elliptiques, et l’épaisseur cornéenne importante due à l’œdème stromal engendrent des mesures erronées lorsque l’opérateur utilise le tonomètre à aplanation de Goldmann. C’est la raison pour laquelle le tonomètre DCT de Pascal™ ou l’ORA (Ocular Response Analyzer®) qui mesure la PIO indépendamment de la pachymétrie cornéenne, le Tonopen® et les tonomètres pneumatiques doivent préférentiellement être utilisés.
Au-delà du premier mois, le tonomètre à aplanation de Goldmann peut de nouveau être utilisé. En cas de fort astigmatisme cornéen, deux mesures seront prises et moyennées en effectuant une rotation de 90° du cône d’aplanation. Une autre méthode consiste à placer l’axe du biprisme le long de l’axe négatif de l’astigmatisme. La PIO sera mesurée et corrigée par des nomogrammes en fonction de l’épaisseur cornéenne centrale selon la correspondance habituelle (cornées fines = sous-estimation, cornées épaisses = surestimation).
Dès que le greffon devient clair, des photographies répétées des papilles seront préférées aux champs visuels et aux systèmes d’analyse des fibres nerveuses rétiniennes, de moindre fiabilité.
Une gonioscopie prudente (sans indentation marquée) à la recherche de SAP pourra être effectuée dès que la transparence du greffon et la solidité de l’anneau limitant le permettent.
La microscopie spéculaire avec analyse morphologique endothéliale, le calcul des indices analytiques ainsi que la mesure de la pachymétrie cornéenne centrale par ultrasons en permettant une surveillance de l’endothélium cornéen, constituent des indicateurs indirects de l’éventuelle progression du GPK.
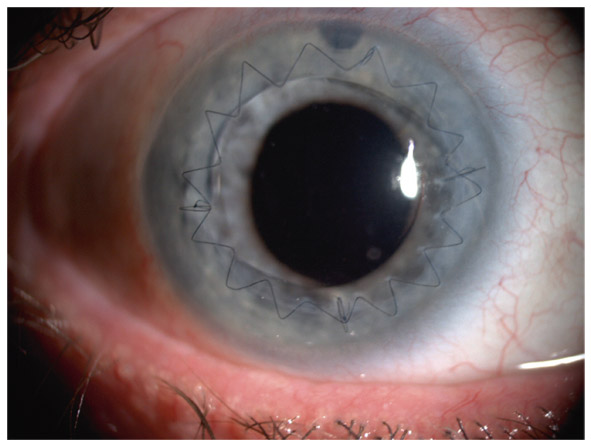
Fig. 13-25 Kératoplastie transfixiante du pseudo-phake (chambre antérieure). (Cliché : R. Résal.)
Fig. 13-26 Trabéculectomie post-kératoplastie transfixiante sur le même œil. (Cliché : R. Résal.)
Il s’agit majoritairement de greffes réalisées dans le cadre du traitement de patients atteints de kératocône. L’incidence du GPK varie de 0 à 9 % après un suivi moyen de 16 mois [13]. Musa et al. [19] rapportent 17 % d’hypertonies simples cortico-induites et 4,3 % de GPK définitifs nécessitant un traitement hypotonisant prolongé. Aucune des séries publiées ne mentionne de recours à une chirurgie hypotonisante. La prise en charge médicale du GPK après ALK ou DALK est la même que pour les GPK survenant après kératoplastie transfixiante.
La DSAEK (Descemet stripping automated endothelial keratoplasty) est devenue, en quelques années, la thérapeutique de choix des dysfonctions endothéliales (dystrophie bulleuse de l’aphake ou du pseudo-phake, dystrophie de Fuchs). En postopératoire, il existe une augmentation importante et persistante de l’épaisseur de la cornée greffée, y compris lorsque l’œdème du greffon disparaît. L’épaisseur cornéenne centrale observée après DSAEK est en moyenne de 650 à 700 µm, de sorte que la mesure de la PIO doit être corrigée.
L’incidence globale (toutes pathologies endothéliales confondues) du glaucome post-DSAEK est de 0 à 8 % dans la plupart des séries publiées [3, 21]. Un antécédent de chirurgie du glaucome a été démontré comme étant un facteur d’échec de la DSAEK : 9 % contre 2 % de dislocations du greffon [4, 11].
En revanche, dans une population de patients greffés pour dystrophie bulleuse du pseudo-phake, le taux de GPK est identique quelle que soit la technique : DSAEK ou kératoplastie transfixiante [24]. Un blocage pupillaire aigu et précoce peut être observé lorsque la bulle d’air laissée en chambre antérieure en fin d’intervention est trop volumineuse et qu’aucune iridectomie ou iridotomie prophylactique n’a été effectuée. La plupart des glaucomes chroniques post-DSAEK sont dus à une distorsion de l’angle et/ou la présence de SAP et/ou sont cortico-induits. Le traitement médical et chirurgical est le même que pour les glaucomes post-kératoplastie transfixiante. Cependant, peu de séries de suivis de glaucome post-DSAEK sont actuellement disponibles.
Concernant les DMEK (greffe endothéliale exclusive, sans support stromal postérieur), Naveiras et al. [20] rapportent un taux de GPK de 6,5 % (2 % d’aggravations, 4,5 % de GPK de novo) sur une série de 275 patients (260 dystrophies de Fuchs, 15 dystrophies bulleuses du pseudo-phake). Sont en cause le blocage de l’angle par la bulle d’air (2 %), la réponse aux corticoïdes (0,7 %), les SAP (0,7 %) et le décentrement du greffon. Deux yeux sur 275 ont dû bénéficier d’une chirurgie du glaucome.
Retenir
Un antécédent de glaucome chronique mérite d’être considéré avec la plus haute importance avant la validation de l’indication chirurgicale d’une greffe de cornée.
La possibilité d’une aggravation du glaucome avec nécessité d’escalade thérapeutique, le rôle délétère du GPK sur le taux de survie du greffon et les chances de succès fonctionnel de la greffe sont à bien expliquer au patient.
L’apparition de novo d’une hypertension ou d’un glaucome post-kératoplastie doit être redoutée.
L’issue des GPK, volontiers secondaires et réfractaires, peut s’avérer fatale pour le nerf optique ou pour l’endothélium cornéen (décompensation ou rejet), parfois pour les deux.
[1] Aldave AJ, Rudd JC, Cohen EJ, et al. The role of glaucoma therapy in the need for repeat penetrating keratoplasty. Cornea. 2000 ; 19 : 772-6.
[2] Allouch C, Borderie V, Touzeau O, et al. [Incidence and factors influencing glaucoma after penetrating keratoplasty]. J Fr Ophtalmol. 2003 ; 26 : 553-61.
[3] Al-Mahmood AM, Al-Swailem SA, Edward DP. Glaucoma and corneal transplant procedures. J Ophthalmol. 2012 ; 2012 : 576394.
[4] Anshu A, Price MO, Price FW. Descemet’s stripping endothelial keratoplasty : long-term graft survival and risk factors for failure in eyes with preexisting glaucoma. Ophthalmology. 2012 ; 119 : 1982-7.
[5] Ayyala RS. Penetrating keratoplasty and glaucoma. Surv Ophthalmol. 2000 ; 45 : 91-105.
[6] Banitt M, Lee RK. Management of patients with combined glaucoma and corneal transplant surgery. Eye (Lond). 2009 ; 23 : 1972-9.
[7] Dada T, Aggarwal A, Minudath KB, et al. Post-penetrating keratoplasty glaucoma. Indian J Ophthalmol. 2008 ; 56 : 269-77.
[8] Erdurmus M, Cohen EJ, Yildiz EH, et al. Steroid-induced intraocular pressure elevation or glaucoma after penetrating keratoplasty in patients with keratoconus or Fuchs dystrophy. Cornea. 2009 ; 28 : 759-64.
[9] Franca ET, Arcieri ES, Arcieri RS, Rocha FJ. A study of glaucoma after penetrating keratoplasty. Cornea. 2002 ; 21 : 284-8.
[10] Gagnon MM, Boisjoly HM, Brunette I, et al. Corneal endothelial cell density in glaucoma. Cornea. 1997 ; 16 : 314-8.
[11] Goshe JM, Terry MA, Li JY, et al. Graft dislocation and hypotony after Descemet’s stripping automated endothelial keratoplasty in patients with previous glaucoma surgery. Ophthalmology. 2012 ; 119 : 1130-3.
[12] Greenlee EC, Kwon YH. Graft failure : III. Glaucoma escalation after penetrating keratoplasty. Int Ophthalmol. 2008 ; 28 : 191-207.
[13] Han DC, Mehta JS, Por YM, et al. Comparison of outcomes of lamellar keratoplasty and penetrating keratoplasty in keratoconus. Am J Ophthalmol. 2009 ; 148 : 744-51.
[14] Huber KK, Maier AK, Klamann MK, et al. Glaucoma in penetrating keratoplasty : risk factors, management and outcome. Graefes Arch Clin Exp Ophthalmol. 2013 ; 251 : 105-116.
[15] Ing JJ, Ing HH, Nelson LR, et al. Ten-year postoperative results of penetrating keratoplasty. Ophthalmology. 1998 ; 105 : 1855-65.
[16] Irvine AR, Kaufman HE. Intraolar pressure following penetrating keratoplasty. Am J Ophthalmol. 1969 ; 68 : 835-44.
[17] Karadag O, Kugu S, Erdogan G, et al. Incidence of and risk factors for increased intraocular pressure after penetrating keratoplasty. Cornea. 2010 ; 29 : 278-82.
[18] Kirkness CM, Moshegov C. Post-keratoplasty glaucoma. Eye (Lond). 1988 ; 2 (Suppl.) : S19-26.
[19] Musa FU, Patil S, Rafiq O, et al. Long term risk of intraocular pressure elevation and glaucoma escalation after deep anterior lamellar keratoplasty. Clin Experiment Ophthalmol. 2012 ; 40 : 780-5.
[20] Naveiras M, Dirisamer M, Parker J, et al. Causes of glaucoma after Descemet membrane endothelial keratoplasty. Am J Ophthalmol. 2012 ; 153 : 958-66.
[21] Ozeki N, Yuki K, Shiba D, et al. Intraocular pressure elevation after Descemet’s stripping endothelial keratoplasty. Jpn J Ophthalmol. 2012 ; 56 : 307-11.
[22] Reinhard T, Bohringer D, Sundmacher R. Accelerated chronic endothelial cell loss after penetrating keratoplasty in glaucoma eyes. J Glaucoma. 2001 ; 10 : 446-51.
[23] Sihota R, Sharma N, Panda A, et al. Post-penetrating keratoplasty glaucoma : risk factors, management and visual outcome. Aust NZ J Ophthalmol. 1998 ; 26 : 305-9.
[24] Wandling GR, Rauen MP, Goins KM, et al. Glaucoma therapy escalation in eyes with pseudophakic corneal edema after penetrating keratoplasty and Descemet’s stripping automated endothelial keratoplasty. Int Ophthalmol. 2012 ; 32 : 9-14.
[25] Yildirim N, Gursoy H, Sahin A, et al. Glaucoma after penetrating keratoplasty : incidence, risk factors, and management. J Ophthalmol. 2011 ; 2011 : 951294.
1. Dans ce chapitre, considérer les dioptries en valeur absolue (par exemple une myopie de – 5 dioptries est supérieure à une myopie de – 3 dioptries).
- Chapitre 13
Formes cliniques et associées- I - Glaucome à pression normale
- II - Glaucomes mixtes
- III - Glaucome unilatéral
- IV - Glaucome et myopie forte
- V - Glaucome juvénile
- VI - Glaucome du mélanoderme
- VII - Glaucome et cristallin
- VIII - Glaucome et occlusions veineuses rétiniennes
- IX - Glaucome et dégénérescence maculaire liée à l’âge
- X - Glaucome et décollement de rétine
- XI - Glaucome et chirurgie réfractive cornéenne
- XII - Glaucome et kératoplasties