C. Lamirel
-
L’image qui se forme sur la rétine est enregistrée par les photorécepteurs puis lue par les cellules bipolaires et codée sous forme de potentiels d’action par les cellules ganglionnaires rétiniennes (CGR).
-
L’image est décomposée puis transmise sur une douzaine de canaux parallèles qui codent chacun une gamme particulière du contraste, du spectre colorée et des fréquences spatiales et temporelles.
-
La voie visuelle principale est la voie rétinogéniculée responsable de la vision consciente. Elle est la mieux connue avec trois canaux principaux : magnocellulaire, parvocellulaire et koniocellulaire.
-
La voie rétinocolliculaire et le système optique accessoire sont impliqués dans le contrôle des mouvements des yeux et de la tête.
-
Les voies rétino-hypothalamique et rétino-prétectale sont responsable de l’analyse de la luminance moyenne de l’image pour le recalage des rythmes biologiques sur le cycle nycthéméral et le réflexe photomoteur. Elles impliquent des CGR à mélanopsine qui sont intrinsèquement sensibles à la lumière.
La voie visuelle principale, responsable de la vision consciente, est constituée d’une chaîne de quatre éléments principaux : les photorécepteurs (cônes et bâtonnets), la cellule bipolaire rétinienne (CBR) entièrement contenue dans l’épaisseur de la rétine interne, la cellule ganglionnaire rétinienne (CGR) dont l’axone se termine dans le noyau géniculé latéral (NGL), et un neurone relais (géniculocortical) qui va transmettre l’information jusqu’au cortex visuel primaire situé dans le lobe occipital (fig. 5-1 et 5-2 ; eFig. 5-1). Les axones des CGR sont aussi appelés fibres nerveuses rétiniennes et se rassemblent tous au niveau de la papille optique pour constituer le nerf optique.
La CGR est un élément essentiel de cette chaîne du traitement du système visuel : l’information de 100 millions de photorécepteurs converge vers seulement 1,5 millions de CGR, avant de diverger vers 120 millions de neurones dans le cortex visuel primaire [9, 42]. Ce sont les 80 types de neurones de la rétine qui assurent ensemble le premier traitement de l’information visuelle en transformant le signal analogique des photorécepteurs en potentiels d’action qui sont transmis au système nerveux central sur 12 canaux parallèles d’information (eFig. 5-2 ; fig. 5-3) [23, 32].
La mosaïque des photorécepteurs code l’information visuelle à la manière d’une caméra CCD (charge-coupled device) : l’intensité lumineuse est codée en fonction de la position sur la rétine, de la longueur d’onde et du temps [23]. Dans une première étape, la mosaïque des photorécepteurs est lue par 12 types de CBR qui sont à la base de ces 12 canaux parallèles [10, 21]. Ces 12 types de CBR propagent l’information et la combinent vers une vingtaine de types de CGR qui transforment l’information analogique des photorécepteurs et des CBR en potentiels d’action pour une transmission rapide et efficiente du point de vue énergétique jusqu’au cerveau.

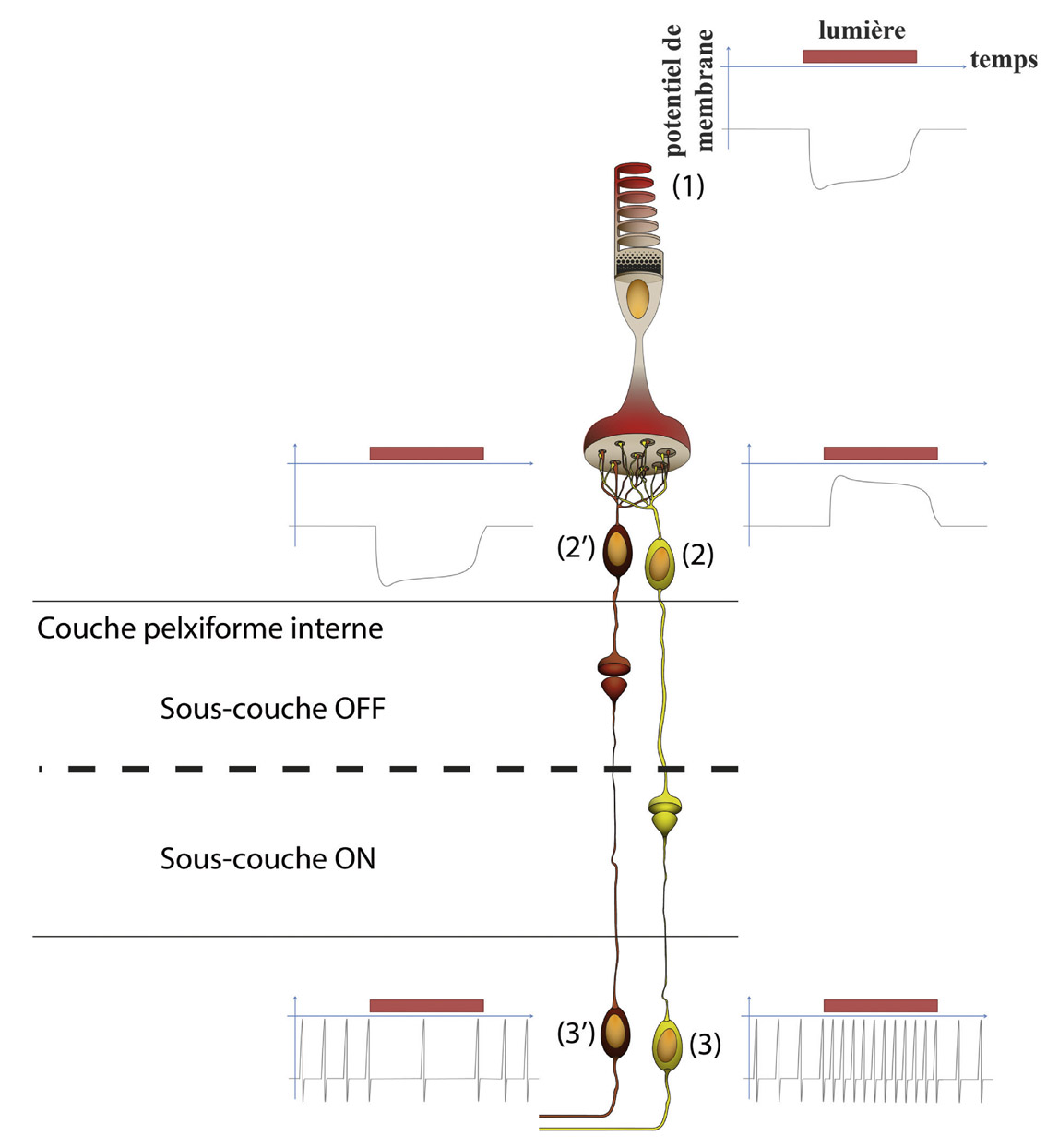
Fig. 5-1 Les trois premiers éléments de la chaîne visuelle sont les photorécepteurs, les CBR et les CGR (les noms à gauche correspondent aux différentes couches de rétine ; la taille relative des différents éléments n’est pas respectée pour les besoins de l’illustration). La connexion entre les photorécepteurs, ici un cône rouge (1), et les CBR (2 et 2′) correspond à la couche plexiforme externe de la rétine. La connexion entre les CBR et les CGR (3 et 3′) correspond à la couche plexiforme interne de la rétine. Cette couche est fonctionnellement divisée en deux sous-couches : la sous-couche OFF, la plus externe, où se font les connexions entre les CBR OFF (2′) et les CGR à centre OFF (3′) et la sous-couche ON, la plus interne, où se font les connexions entre les CBR ON (2) et les CGR à centre ON (3). Les axones des CGR cheminent à la surface de la rétine dans la couche des fibres nerveuses rétiniennes. (© 2013, Service d’ophtalmologie du Pr. Cochereau.)
Chaque type de CGR recouvre toute la rétine et analyse donc l’ensemble du champ visuel pour former un canal d’information. Chaque canal d’information ne code qu’une gamme particulière du contraste, des fréquences spatiales, temporelles ou spectrales de la scène visuelle (voir eFig. 5-2 et fig. 5-3). Par exemple, le canal magnocellulaire code les variations de luminance dans le temps sans tenir compte de la couleur, tandis que le canal parvocellulaire code les détails fins et l’opposition colorée rouge/vert. Ce n’est qu’au niveau cortical que ces différents canaux sont intégrés pour nous donner une vision globale et cohérente du monde qui nous entoure.
Il est encore difficile d’avoir une vision globale et cohérente de tous les types de CGR et de leurs propriétés de codage de l’information visuelle : la moitié des processus de codage de l’image est encore à découvrir [21]. Les 20 types de CGR connus se distinguent par leurs caractéristiques anatomiques et fonctionnelles qui sont mieux décrites dans les modèles animaux. De plus, certains types de CGR sont décrits sur des modèles murins et d’autres sur des singes plus au moins proches de l’homme sans que les correspondances entre les différentes espèces soient toutes élucidées. Nous évoquerons dans cette première partie le modèle général de ces CGR.
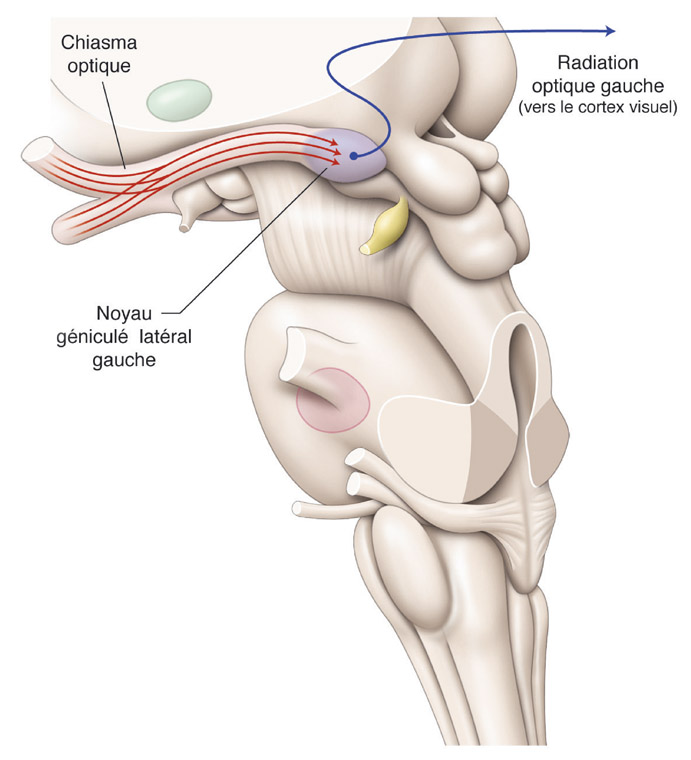
eFig. 5-1 Anatomie macroscopique de la voie visuelle principale en coupe axiale passant par les noyaux géniculés latéraux en vue de profil gauche. Les axones des CGR de la voie principale forment la couche des fibres nerveuses rétiniennes, les nerfs optiques, le chiasma optique et les tractus optiques et se terminent dans les noyaux géniculés latéraux. Le 4e élément de la voie visuelle principale correspond aux neurones relais géniculocorticaux qui forment les radiations optiques jusqu’aux lobes occipitaux. La rétinotopie des noyaux géniculés latéraux et des lobes occipitaux est représentée en fig. 5-2 par le code couleur. (D’après D.L. Felten, R.F. Jozefowicz. Atlas de neurosciences humaines de Netter. Masson, 2006, p. 237.)
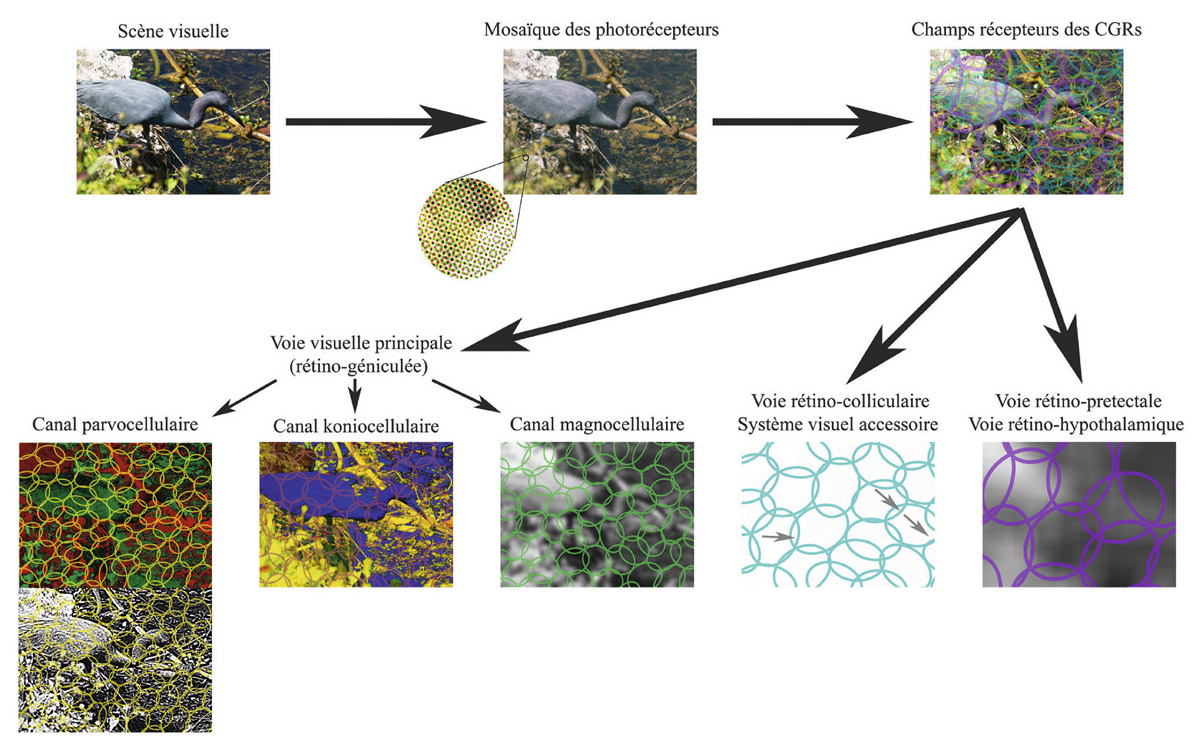
eFig. 5-2 Le traitement de l’information visuelle par les CGR aboutit à des canaux parallèles. L’image qui se forme sur la rétine est d’abord analysée par la mosaïque des photorécepteurs qui codent la scène visuelle en fonction de l’intensité lumineuse, du temps et de la position sur la rétine. Cette mosaïque des photorécepteurs est lue par les CBR puis par les CGR dont les champs récepteurs sont représentés par des éclipses de couleurs différentes. Chaque type de CGR couvre l’ensemble de la rétine mais ne va analyser l’information que d’une bande particulière de fréquence spatiale, temporelle et spectrale formant un canal parallèle d’analyse de l’information visuelle. Par exemple, les CGR naines (figurées par les ellipses jaunes) n’analysent que les détails fins de la scène visuelle et l’opposition colorée rouge/vert et vont former le canal parvocellulaire de la voie visuelle principale. Le canal koniocellulaire est composé de CGR petites bistratifiées (figurées par les ellipses mauves) qui traitent l’opposition colorée bleu/jaune, tandis que le canal magnocellulaire est formé par les CGR parasols (ellipses vertes) qui analysent les basses fréquences spatiales. La voie rétinocolliculaire et le système visuel accessoire sont composés de CGR sensibles aux mouvements (ellipses bleues) qui analysent ici le mouvement de la tête, du bec et de la patte de l’oiseau. La voie rétino-prétectale et la voie rétino-hypothalamique sont composées de CGR à mélanopsine (ellipses violettes) qui analysent la luminance globale de la scène visuelle. La réciproque de ce système d’organisation est que chaque point de la rétine et du champ visuel est analysé par plusieurs CGR. (© 2013, Service d’ophtalmologie du Pr. Cochereau.)
La CGR est un neurone du système nerveux central (SNC) constitué d’un corps cellulaire, d’un arbre dendritique, d’un axone et de ses terminaisons synaptiques [38].
Le corps cellulaire de la CGR est contenu dans la couche de cellules ganglionnaires de la rétine et ne représente qu’un dixième du volume de la CGR. Il contient le noyau de la CGR et donc l’information génétique nécessaire à la production des différents constituants du neurone ainsi que les organites qui participent à cette synthèse : réticulum endoplasmique, ribosomes, appareil de Golgi, etc. Les constituants de la CGR sont synthétisés principalement dans le corps cellulaire et, à un moindre degré, dans les dendrites. Il n’y a pas de séparation franche entre le corps cellulaire et les dendrites, et les organites cellulaires circulent librement entre les deux. L’axone de la CGR est lui fonctionnellement distinct du corps cellulaire. Il est polarisé avec le cône proximal à sa jonction avec le corps cellulaire et son extrémité distale où sont situées les synapses [37]. C’est l’organisation du cytosquelette qui donne au neurone sa forme, et en particulier les neurofilaments qui en sont le constituant principal. C’est aussi le long du cytosquelette que se font les transports des organites et des constituants cellulaires. Les microtubules sont responsables de la polarisation de l’axone et sont essentiels aux flux axoplasmiques rapides antérogrades ou rétrogrades. Le transport axonal rapide antérograde permet d’amener à la terminaison de l’axone les organites membranaires et en particulier les vésicules synaptiques nécessaires à la transmission synaptique à la vitesse de 400 mm par jour [13]. Le transport axonal rapide rétrograde (200 à 266 mm par jour) rend possible le renvoi des constituants de la terminaison synaptique vers le corps cellulaire où ils seront réutilisés ou détruits. Ce flux axoplasmique rétrograde rapide permet aussi d’amener au corps cellulaire des facteurs de croissance et autres signaux nécessaires à l’homéostasie du neurone [7]. Il existe un troisième type de flux axoplasmique : le transport axonal lent (0,2 à 2,5 mm par jour) qui amène les protéines et les briques élémentaires du cytosquelette nécessaires au maintien ou à la croissance de l’axone [22]. Il serait également impliqué dans la génération des dendrites et de la forme du neurone [1]. Tous ces transports nécessitent de l’énergie fournie par le réseau mitochondrial qui est distribué dans toutes les parties du neurone en fonction des besoins [35].
L’arbre dendritique correspond à l’ensemble des prolongements du corps cellulaire qui reçoivent l’information d’autres neurones : dans le cas des CGR, l’information provient des CBR et des cellules amacrines qui sont des interneurones de la rétine. L’arbre dendritique des CGR s’étend dans la couche plexiforme interne de la rétine. Cette couche plexiforme interne peut se diviser fonctionnellement en deux zones, ON et OFF (voir fig. 5-1) [10, 36]. La terminaison de l’arbre dendritique d’une CGR dans la sous-couche ON ou OFF détermine sa réponse à un stimulus lumineux. La partie la plus interne de la couche plexiforme interne de la rétine correspond à la sous-couche ON : les CGR y reçoivent l’information de CBR qui sont excitées par la lumière. À l’inverse, la partie la plus externe est une sous-couche OFF où les CGR y reçoivent l’information de CBR qui sont inhibées par la lumière.
La taille de l’arbre dendritique détermine la taille du champ récepteur de la CGR : plus l’arbre dendritique est grand, plus le nombre de CBR (et donc de photorécepteurs) connectées par une CGR sera grand [21]. Ce champ récepteur est défini comme la partie de la rétine dont la stimulation appropriée déclenche une réponse de la CGR. À ce champ récepteur sur la rétine correspond également une partie du champ visuel à l’intérieur duquel une stimulation adéquate va pouvoir activer la CGR. D’une manière générale et quel que soit le type de CGR, la taille de l’arbre dendritique et de son champ récepteur augmente avec l’excentricité de la CGR sur la rétine par rapport à la fovéa (voir fig. 5-4) [10].
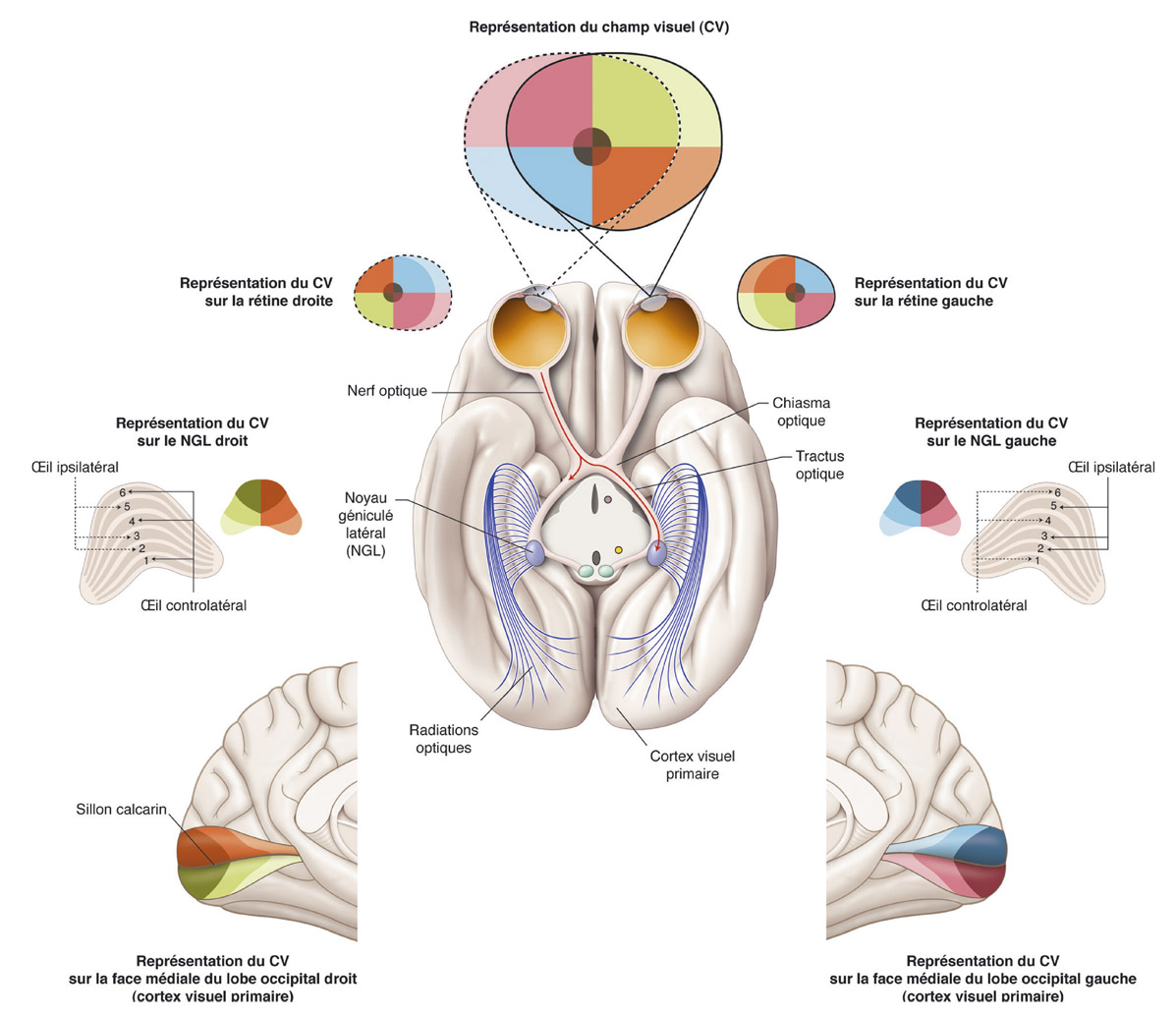
Fig. 5-2 Anatomie macroscopique de la voie visuelle principale en coupe axiale passant par les noyaux géniculés latéraux. Les axones des CGR de la voie principale forment la couche des fibres nerveuses rétiniennes, les nerfs optiques, le chiasma optique, les tractus optiques et se terminent dans les noyaux géniculés latéraux. Le 4e élément de la voie visuelle principale correspond aux neurones relais géniculocorticaux qui forment les radiations optiques jusqu’aux lobes occipitaux. La rétinotopie des noyaux géniculés latéraux et des lobes occipitaux est représentée par le code couleur. (D’après D.L. Felten, R.F. Jozefowicz. Atlas de neurosciences humaines de Netter. Masson, 2006, p. 238.)
L’axone est un prolongement du neurone qui transporte l’information traitée par le neurone vers sa cible post-synaptique. L’extrémité proximale de l’axone à la jonction avec le corps cellulaire est le lieu où s’effectue la synthèse de toutes les influences excitatrices et inhibitrices que reçoit la GCR [24]. C’est là que va se former ou non un potentiel d’action (PA) qui sera propagé le long de l’axone jusqu’aux terminaisons synaptiques [3]. La vitesse de propagation du potentiel d’action est dépendante du diamètre de l’axone et de la présence de myéline [14]. Les axones les plus gros conduisent les PA plus rapidement que les axones de plus petit diamètre. La partie intra-oculaire de l’axone des CGR chemine à la surface de la rétine, formant la couche des fibres nerveuses rétiniennes, et n’est pas myélinisée [31]. L’organisation et le trajet des axones dans la couche des fibres nerveuses rétiniennes et dans la tête du nerf optique sont systématisés [30]. En arrière de la lame criblée, les axones sont myélinisés avec une conduction saltatoire des PA plus rapide et moins consommatrice d’énergie que dans leur partie non myélinisée [6]. La myéline du nerf optique dépend des oligodendrocytes car le nerf optique n’est physiologiquement pas un nerf périphérique (myélinisé par des cellules de Schwann), mais un faisceau de substance blanche du SNC. Après le nerf optique, les axones cheminent dans le chiasma puis dans les tractus optiques et se terminent dans les noyaux géniculés latéraux pour la voie visuelle principale consciente et dans des noyaux du tronc cérébral pour les voies visuelles secondaires.
Il existe au sein de l’axone de la CGR un gradient énergétique important entre la partie non myélinisée, soumise à un milieu intra-oculaire et fortement consommatrice d’énergie, et la partie rétrobulbaire myélinisée, entourée de liquide cérébrospinal, où la dépense d’énergie est réduite et localisée aux nœuds de Ranvier [6]. Cette particularité expliquerait la vulnérabilité des CGR aux pathologies mitochondriales.
L’axone des CGR se termine dans le noyau géniculé latéral pour la voie visuelle principale ou dans des noyaux du tronc cérébral pour les voies visuelles secondaires [28]. Certains axones ont des collatérales qui permettent à la CGR de transmettre l’information visuelle à deux ou plusieurs noyaux du SNC impliqués dans la vision. La synapse est le point le plus éloigné du corps cellulaire de la CGR, donc la partie de la cellule la plus vulnérable aux perturbations des flux axoplasmiques [8]. Le neurone post-synaptique peut influencer la CGR par la production de facteurs neurotrophiques qui sont nécessaires au maintien de la connexion synaptique, au fonctionnement de l’axone et à la survie de la CGR [17, 26].
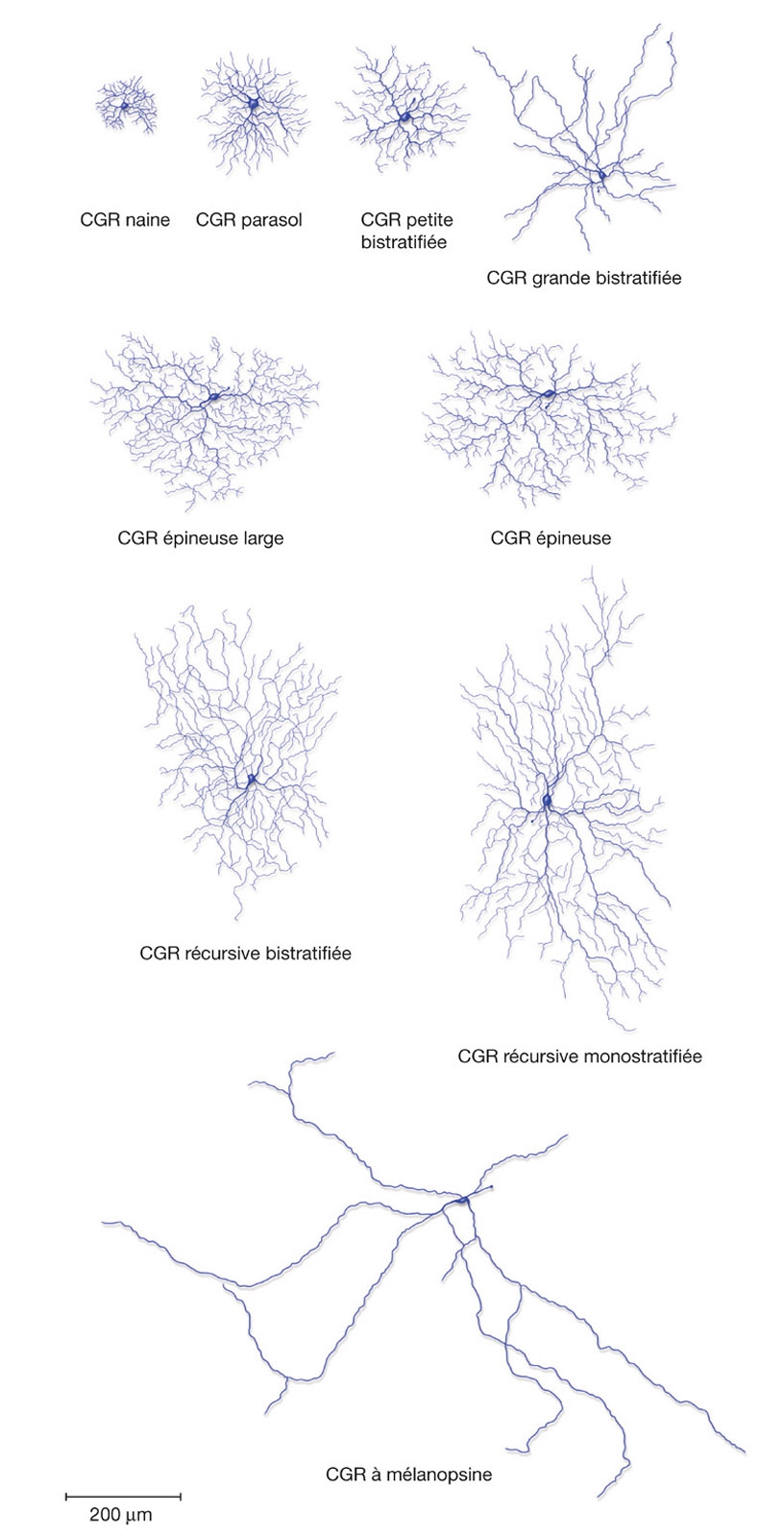
Fig. 5-3 Exemple de neuf CGR. Les quatre CGR de la ligne du haut participent à la voie visuelle primaire. Les quatre CGR au centre sont impliquées dans la voie rétinocolliculaire et le système optique accessoire. La CGR du bas participe à la voie rétino-hypothalamique et rétino-prétectale. (D’après M.S. Gazzaniga. The Cognitive Neurosciences III, third edition, p. 292. © 2004 Massachusetts Institute of Technology, reproduction autorisée par The MIT Press.)
La principale propriété fonctionnelle des CGR est de répondre à un stimulus lumineux projeté sur une zone adéquate de la rétine appelée champ récepteur de la CGR. Le champ récepteur d’une CGR est globalement rond et sa taille dépend du nombre de photorécepteurs dont elle reçoit l’information via les CBR, et donc de la taille de son arbre dendritique. Ce champ récepteur est constitué d’un centre et d’un pourtour qui ont des réponses opposées à un stimulus lumineux. La réponse de la CGR lorsqu’un faisceau lumineux est projetée au centre d’un champ récepteur permet de les classer en deux catégories fonctionnelles : les CGR à centre ON et les CGR à centre OFF [21].
Les propriétés du centre du champ récepteur d’une CGR sont expliquées par les connexions qu’elle a avec les CBR. Ces connexions permettent de distinguer fonctionnellement les deux grands circuits, ON et OFF, qui apparaissent au niveau des CBR (eFig. 5-3).
Les photorécepteurs sont inhibés par la présence d’un stimulus lumineux, ce qui diminue la quantité de glutamate libérée par leurs synapses dans la couche plexiforme externe de la rétine. C’est le type de récepteur au glutamate de la CBR qui va déterminer sa réponse ON ou OFF [36]. Les CBR de type ON possèdent un récepteur métabotropique au glutamate (mGluR6) qui inverse le signal : l’inhibition des photorécepteurs par la lumière aboutit à une activation des CBR de type ON. Toutes les CBR de type ON font synapses avec les CGR dans la moitié interne de la couche plexiforme interne de la rétine (sous-couche ON).
Les CBR de type OFF possèdent un récepteur ionotropique (iGluR) au glutamate qui conserve le signal : l’inhibition des photorécepteurs par la lumière aboutit à une inhibition des CBR de type OFF. Toutes les CBR de type OFF font synapses avec les CGR dans la moitié externe de la couche plexiforme interne de la rétine (sous-couche OFF). Cette transmission verticale de l’information depuis les photorécepteurs, aux CBR puis aux CGR explique les propriétés du centre du champ récepteur des CGR.
Les propriétés du pourtour du champ récepteur des CGR sont liées aux cellules horizontales et aux cellules amacrines [21]. Les cellules horizontales forment un réseau au sein de la couche plexiforme externe et inhibent les photorécepteurs et les CBR adjacents par des synapses électriques (gap junctions) afin d’augmenter localement le gain de la rétine. Elles participent ainsi à l’antagonisme centre-pourtour du champ récepteur des CGR. Les cellules amacrines réalisent également des connexions horizontales mais au niveau de la couche plexiforme interne pour moduler la réponse des CBR et des CGR en créant un effet contextuel plus complexe et subtil que celui des cellules horizontales. Ce sont ces cellules qui vont injecter le signal des bâtonnets dans les circuits des CGR.
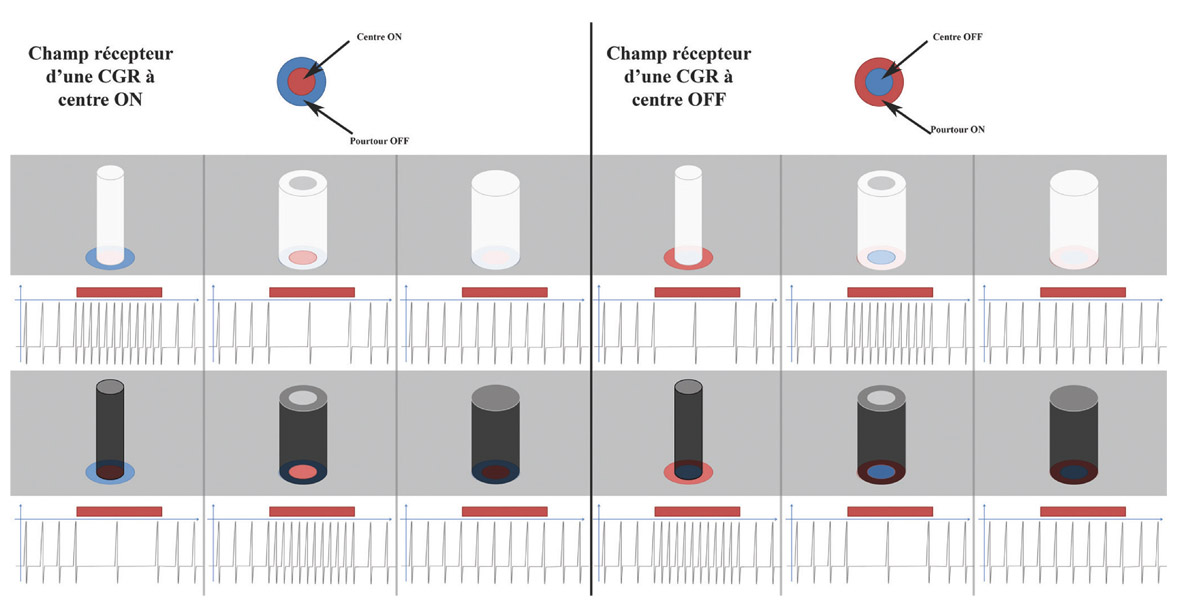
Une CGR à centre ON va augmenter sa réponse (augmentation de la fréquence des potentiels d’action) lorsqu’un faisceau lumineux est projeté au centre de son champ récepteur. Si le même faisceau lumineux est projeté sur le pourtour de son champ récepteur, la CGR va être inhibée (eFig. 5-4). À l’inverse, si une ombre est projetée sur le pourtour de la CGR à centre ON, elle va augmenter sa réponse, et si l’ombre est projetée sur le centre de son champ récepteur, la CGR va être inhibée. Un faisceau lumineux ou une ombre projetée uniformément sur le centre et le pourtour de la CGR ne vont pratiquement pas modifier sa réponse.
Une CGR à centre OFF va répondre de manière opposée (voir eFig. 5-4). Elle sera activée par un faisceau lumineux projeté sur le pourtour du champ récepteur ou une ombre projetée en son centre. Elle sera inhibée par une ombre projetée sur le pourtour ou une lumière projetée au centre de son champ récepteur. Sa réponse ne sera pas modifiée si une lumière ou une ombre sont projetées uniformément sur le centre et le pourtour de son champ récepteur.
Il est également possible de différencier les CBR selon leur profil de réponse temporelle à un stimulus en fonction de la rapidité de l’inactivation de leurs récepteurs au glutamate [34]. Certaines CBR ont des réponses soutenues et vont répondre tant que le stimulus est présenté du fait d’une inactivation lente de leurs récepteurs au glutamate. D’autres auront des réponses transitoires et ne vont répondre qu’à l’apparition ou à la disparition du stimulus du fait d’une inactivation rapide de leurs récepteurs au glutamate. Le profil de réponse temporelle à la lumière d’une CBR sera transmis aux CGR qu’elles connectent (eFig. 5-5).
Ce schéma d’organisation est général et simplifié, puisque chacun des 12 types de CBR présente des propriétés spécifiques qui le différencient des 11 autres et va aboutir à un canal de codage de l’information visuel [4]. Ce codage de l’image sur 12 canaux répond à un problème d’économie d’énergie. Le codage de l’information sous forme analogique est difficile à transmettre sur de longues distances, expliquant que pour la vision il se limite aux photorécepteurs et aux CBR [34]. Le codage de l’information sous forme de trains de potentiels d’action est plus facile à transmettre sur de longues distances et plus économique du point de vue énergétique. Toutefois, cette forme de codage limite la quantité d’information que peut transmettre un seul neurone. Il est probable que cette décomposition de l’image en 12 canaux sur 20 types de CGR codant chacune pour une propriété de l’image permette de répondre à ce problème [25, 42].
eFig. 5-3 Les circuits ON et OFF de la rétine. La lumière hyperpolarise les cônes (1) et les bâtonnets, ce qui aboutit à une diminution de la quantité de glutamate dans la fente synaptique. Comme le glutamate est inhibiteur pour les CBR de type ON (2), la lumière va aboutir à une dépolarisation de la CBR de type ON qui va activer la CGR à centre ON (3). À l’inverse, le glutamate est excitateur pour les CBR de type OFF (2′), et la lumière va déclencher une hyperpolarisation de la CBR de type OFF qui inhibe la CGR à centre OFF (3′). Les photorécepteurs (1) et les CBR (2 et 2′) ont une réponse graduelle et analogique à la lumière tandis que les CGR (3 et 3′) codent la lumière sous la forme de potentiels d’action. (© 2013, Service d’ophtalmologie du Pr. Cochereau.)
eFig. 5-4 Champ récepteur d’une CGR à centre ON à gauche et à centre OFF à droite. La réponse de la CGR est représentée selon qu’un faisceau lumineux (ligne du milieu) ou une ombre (ligne du bas) est dirigé sur le centre (colonne de gauche), sur le pourtour (colonne du milieu) ou sur l’ensemble du champ récepteur (colonne de droite). Ce type de champ récepteur correspond à celui des CGR parasols du canal magnocellulaire. (© 2013, Service d’ophtalmologie du Pr. Cochereau.)

eFig. 5-5 Exemple de réponse tonique (ligne du milieu) ou phasique (ligne du bas) d’une CGR à centre ON qui est excité (à gauche) ou inhibé (à droite). (© 2013, Service d’ophtalmologie du Pr. Cochereau.)
Cette voie correspond à la voie rétino-géniculo-corticale qui est la voie de la vision consciente (voir fig. 5-1). Elle est divisée en trois canaux visuels : le canal magnocellulaire, le canal parvocellulaire et le canal koniocellulaire selon la cyto-architecture en couches du NGL (fig. 5-4) [23, 32]. Cette organisation est aussi valide en aval du NGL puisque les neurones relais issus de ces couches ont des projections corticales différentes. Cette voie visuelle principale correspond à 90 % des CGR chez les primates [10].
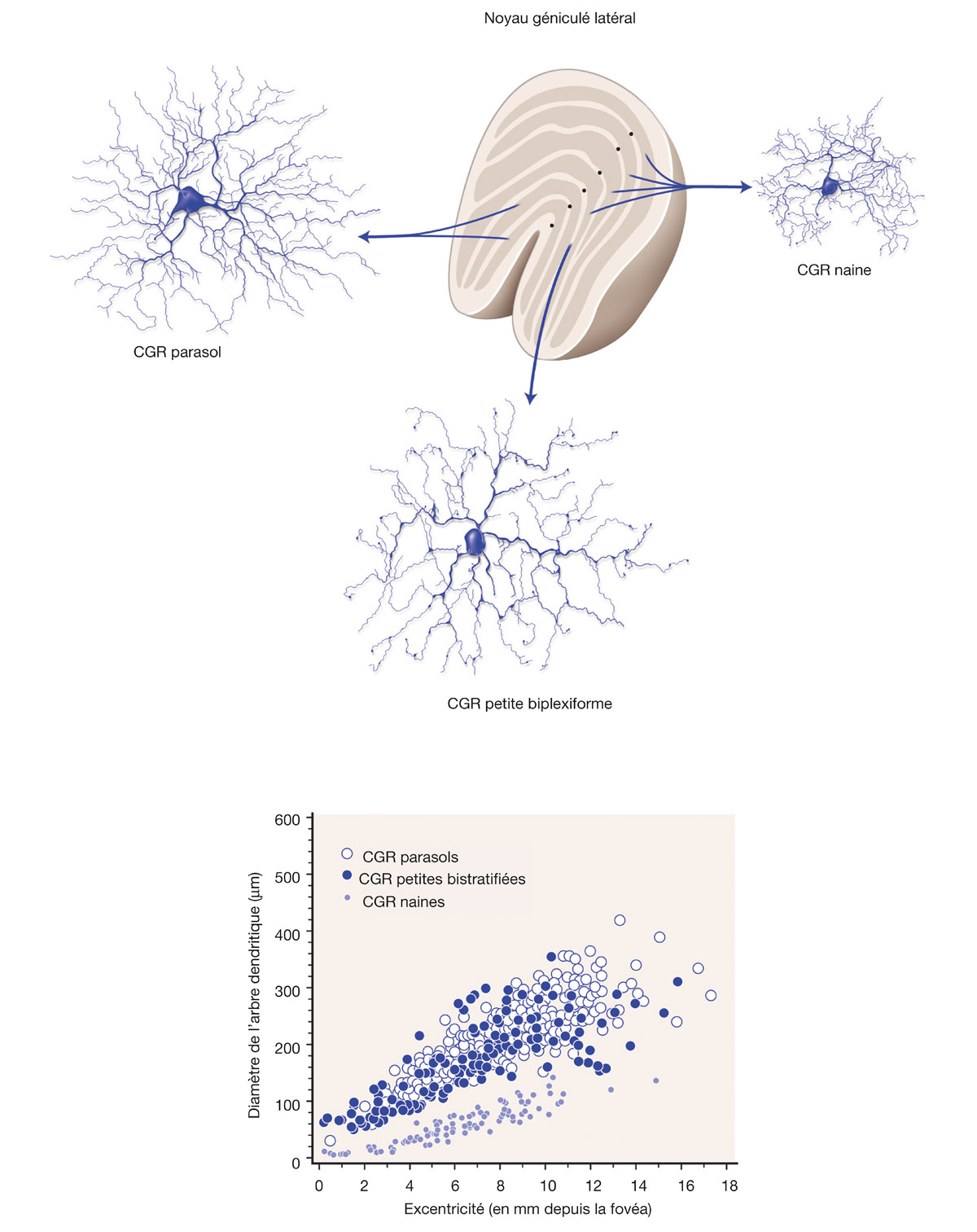
Fig. 5-4 Cyto-architecture du noyau géniculé latéral avec les trois types de CGR les plus nombreux : les CGR naines pour le canal parvocellulaire, les CGR parasols pour le canal magnocellulaire et les CGR petites bistratifiées pour le canal koniocellulaire. Pour chacun des types de CGR, la petite cellule correspond à une localisation périfovéolaire tandis que la plus grande correspond à une localisation périphérique. Le graphique montre la taille du champ récepteur en fonction de l’excentricité rétinienne. Quel que soit le type de cellule, la taille du champ récepteur augmente avec l’excentricité rétinienne. À même excentricité, le champ récepteur d’une CGR naine est plus petit que celui d’une CGR parasol ou petite bistratifiée. (D’après M.S. Gazzaniga. The Cognitive Neurosciences III, third edition, p. 284. © 2004 Massachusetts Institute of Technology, reproduction autorisée par The MIT Press.)
Après le nerf optique, les CGR issues de l’hémirétine nasale de chaque œil (correspondant à l’hémichamp visuel temporal) décussent au niveau de la partie centrale du chiasma tandis que les CGR issues de l’hémirétine temporale (correspondant à l’hémichamp visuel nasal) cheminent à la partie latérale du chiasma sans décusser. Les fibres nerveuses rétiniennes issues de la fovéa et des 2 à 3° centraux du champ visuel décussent à 50 % au niveau du chiasma indépendamment de leur localisation temporale ou nasale, expliquant l’épargne maculaire du champ visuel dans les hémianopsies latérales homonymes [5].
Les tractus optiques font suite au chiasma et comprennent l’ensemble de la représentation de l’hémichamp visuel controlatéral issu des deux yeux. Ainsi le tractus optique droit comprend les axones des CGR de la partie nasale de l’œil gauche (hémichamp visuel temporal qui est l’hémichamp gauche de cet œil) et ceux des CGR issues de la partie temporale de l’œil droit (hémichamp visuel nasal qui est l’hémichamp visuel gauche de cet œil).
Les tractus optiques se terminent dans les noyaux géniculés latéraux qui sont la cible principale des axones des CGR. Les noyaux géniculés latéraux sont organisés de manière rétinotopique : sur une coupe coronale passant par le NGL, la partie maculaire de l’hémichamp visuel est située au centre du NGL, sa partie supérieure projette sur la partie latérale du NGL, et sa partie inférieure projette sur la partie médiale du NGL [28].
Des neurones relais issus des NGL projettent vers le cortex visuel situé dans le lobe occipital et forment les radiations optiques. Le cortex visuel primaire (V1) est situé de part et d’autre du sillon calcarin. Cette aire V1 est organisée de manière rétinotopique selon deux directions. Dans la direction verticale, la partie supérieure du sillon calcarin correspond au champ visuel inférieur, et sa partie inférieure correspond au champ visuel supérieur et le méridien horizontal du champ visuel se projette au fond du sillon calcarin. Dans la direction postéro-antérieure, la partie la plus postérieure du sillon calcarin (pôle occipital) correspond à la partie la plus centrale du champ visuel, tandis que la partie la plus antérieure (près du sillon occipito-pariétal) correspond à la partie la plus périphérique du champ visuel qui est alors monoculaire.
Au-delà de l’aire visuelle primaire, plus de 30 aires corticales sont impliquées dans la vision [19]. Elles sont organisées en deux grandes voies visuelles corticales : la voie ventrale vers le lobe temporal analyse les formes, les textures, les couleurs et les visages, tandis que la voie dorsale vers le lobe pariétal analyse le mouvement, le relief et la disposition dans l’espace.
Les trois canaux de cette voie principale sont décrits à partir de l’architecture du NGL. Ce noyau est structuré en six couches principales superposées (numérotées de 1 à 6 depuis la couche inférieure jusqu’à la couche supérieure, voir fig. 5-4) [23]. Chacune de ces couches ne reçoit l’information que d’un seul œil. En fonction de la taille des cellules qu’elles contiennent, ces six couches se répartissent en deux zones : magnocellulaire qui contient des neurones de grande taille (deux couches identifiées par la lettre M) et parvocellulaire qui contient des neurones de petite taille (quatre couches identifiées par la lettre P).
La zone magnocellulaire correspond aux deux couches les plus inférieures : la couche la plus inférieure M1 correspond à l’œil controlatéral et la couche immédiatement au-dessus M2 à l’œil ipsilatéral.
La zone parvocellulaire correspond aux quatre couches les plus supérieures : les couches P4 et P6 reçoivent les informations de l’œil controlatéral et les couches P3 et P5 celles de l’œil ispilatéral.
Ce n’est que plus tardivement que les couches du canal koniocellulaire (identifié par la lettre K) ont été reconnues. Elles correspondent à la partie inférieure des six couches principales précédemment décrites et sont dénommée K1 à K6 (voir fig. 5-4) [23]. Ces sous-couches reçoivent les informations du même œil que la couche principale mais les neurones qu’elles contiennent sont plus grands et leurs propriétés fonctionnelles différentes.
Les CGR qui composent ce canal visuel sont les cellules naines (« midget » en anglais, voir fig. 5-3 et 5-4) [10]. Elles représentent 50 % des CGR de la rétine et leur distribution est superposable à celle des cônes avec un pic de densité au niveau de la rétine centrale où elles pourraient représenter jusqu’à 95 % des CGR, alors qu’elles ne représentent que 45 % des CGR de la rétine périphérique. Dans les 10° centraux du champ visuel, le circuit du canal parvocellulaire est très simple : une cellule naine reçoit l’information d’une seule CBR naine qui est elle aussi connectée à un seul cône rouge ou vert (fig. 5-5). Les CGR naines ne reçoivent pas d’information des cônes bleus. Pour chaque cône rouge ou vert de la rétine centrale, deux circuits existent : l’un à centre ON, l’autre à centre OFF.
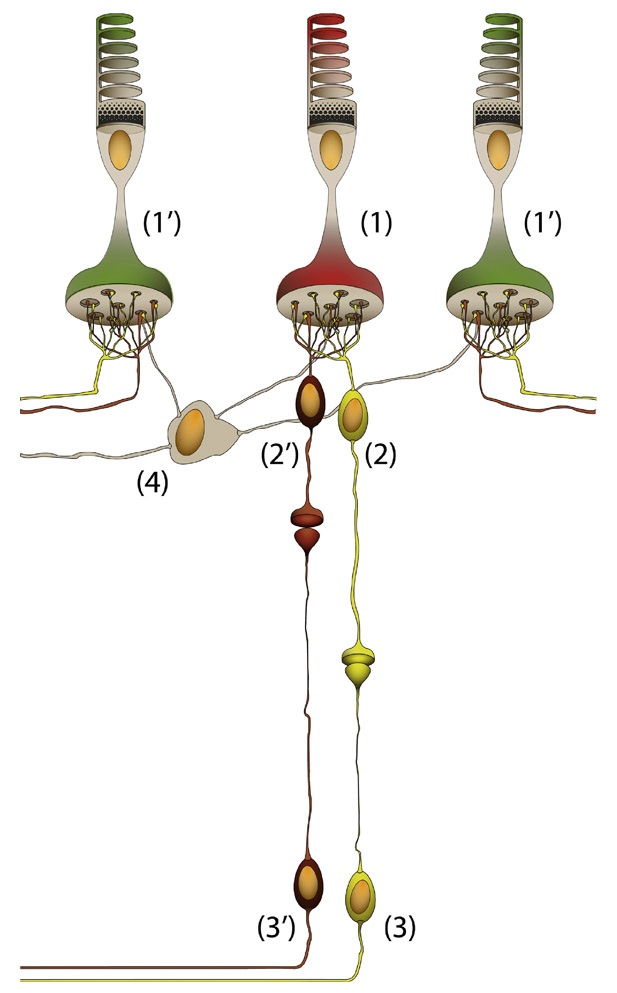
Fig. 5-5 Circuit des CGR naines du canal parvocellulaire. Au niveau fovéolaire, une CGR naine à centre ON (3) ne connecte qu’une CBR naine de type ON (2) qui n’est connectée qu’à un cône (1), rouge ici. Une CGR naine à centre OFF (3′) ne connecte qu’une CBR naine de type OFF (2′) qui n’est connectée qu’à un cône (1), rouge ici. Un cône ne connecte que deux CBR et deux CGR : un pour le circuit ON et un pour le circuit OFF. L’effet du pourtour du champ récepteur des CGR est lié à l’effet des cellules horizontales (4) qui vont connecter les cônes verts adjacents (1′). (© 2013, Service d’ophtalmologie du Pr. Cochereau.)
Il existe quatre types de champ récepteur des CGR naines : centre rouge ON/pourtour vert OFF, centre rouge OFF/pourtour vert ON, centre vert ON/pourtour rouge OFF et centre vert OFF/pourtour rouge ON (eFig. 5-6).
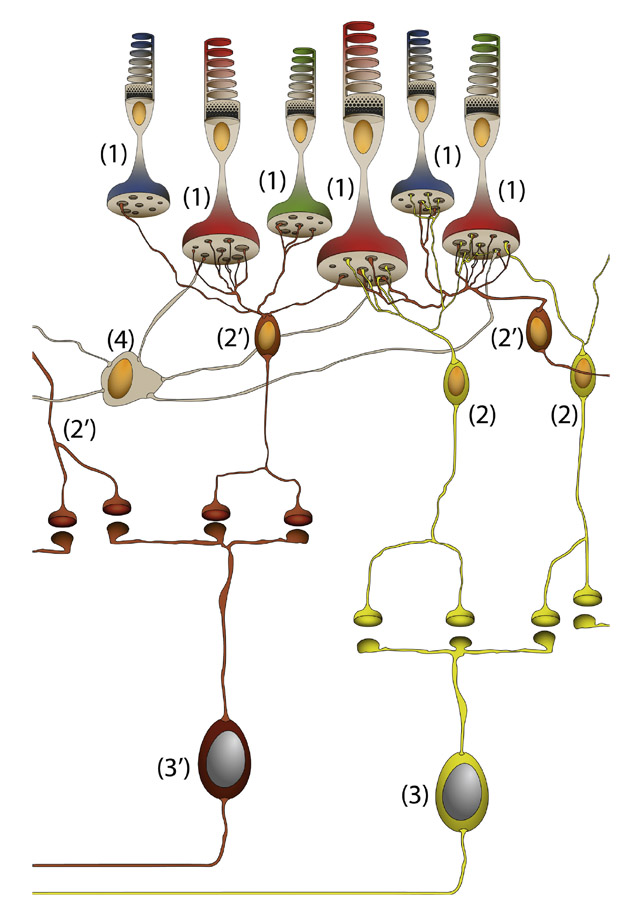
Fig. 5-6 Circuit des CGR parasols du canal magnocellulaire. Une CGR parasol à centre ON (3) connecte plusieurs CBR diffuses de type ON (2) qui sont connectées à plusieurs cônes (1) de types différents. Une CGR parasol à centre OFF (3′) connecte plusieurs CBR diffuses de type OFF (2′) qui sont connectées à plusieurs cônes (1) de types différents. Un cône va connecter plusieurs CBR diffuses et plusieurs CGR parasols du circuit ON et OFF. L’effet du pourtour du champ récepteur des CGR est lié à l’effet des cellules horizontales (4) qui vont connecter les cônes verts adjacents non représentés ici.
(© 2013, Service d’ophtalmologie du Pr. Cochereau.)
Plus en périphérie de la rétine, le champ récepteur des CGR naines augmente de taille et une CGR naine va connecter plusieurs cônes, mais tous du même type vert ou rouge. Quelle que soit l’excentricité, le champ récepteur d’une CGR naine du canal parvocellulaire sera toujours plus petit que celui d’une CGR du canal magnocellulaire ou koniocellulaire.
La réponse des CGR naines du canal parvocellulaire est tonique : elles émettent des potentiels d’action de manière continue tant qu’un stimulus est présenté [36]. Les axones du canal parvocellulaire sont les plus fins et donc les plus lents à transmettre l’information jusqu’au cortex. Les neurones relais des couches parvocellulaires du NGL empruntent les radiations optiques pour se connecter spécifiquement dans la couche 4Cβ du cortex visuel primaire. Le canal parvocellulaire participe principalement à la voie visuelle corticale ventrale impliquée dans la reconnaissance des formes et des couleurs [19]. Le canal parvocellulaire est impliqué dans la vision des hautes fréquences spatiales et des basses fréquences temporales, c’est-à-dire l’acuité visuelle fine et la perception des textures d’objets. Le circuit des CGR naines dans la rétine centrale explique ces propriétés puisque l’information ne provient que d’un seul cône, ce qui permet une grande résolution spatiale. Le canal parvocellulaire participe aussi à la vision colorée du fait de l’opposition rouge/vert du champ récepteur des CGR naines.

eFig. 5-6 Champ récepteur du canal parvocellulaire avec de gauche à droite : une CGR naine à centre rouge ON, à centre rouge OFF, à centre vert ON et à centre vert OFF. La réponse de la CGR est représentée selon qu’un faisceau lumineux rouge (ligne du milieu) ou vert (ligne du bas) est dirigé sur le centre du champ récepteur. La réponse à un faisceau lumineux rouge ou vert sur le pourtour n’est pas représentée mais aboutit à une réponse opposée de la CGR. (© 2013, Service d’ophtalmologie du Pr. Cochereau.)
Les CGR qui composent ce canal visuel sont les cellules parasols (voir fig. 5-3 et 5-4). Elles représentent 10 à 16 % des CGR de la rétine [10]. Leur distribution dans la rétine est parallèle à celle des cônes avec un pic de densité au niveau de la rétine centrale. La répartition des cellules parasols n’est pas homogène parmi les quatre quadrants de la rétine puisqu’elles sont plus nombreuses dans la partie nasale de la rétine correspondant au champ visuel temporal [39]. Quelle que soit l’excentricité, une cellule parasol connecte plusieurs CBR, dites diffuses, qui connectent elles-mêmes plusieurs cônes rouges ou verts. Deux circuits existent : l’un à centre ON, l’autre à centre OFF (voir eFig. 5-4 ; fig. 5-6).
Les CGR parasols à centre ON reçoivent des connexions de plusieurs CBR diffuses ON au niveau de la partie interne de la sous-couche ON de la couche plexiforme interne. Les CGR parasols à centre OFF reçoivent des connexions de plusieurs CBR diffuses OFF au niveau de la partie externe de la sous-couche OFF de la couche plexiforme interne. La partie périphérique du champ récepteur des CGR parasols, le pourtour, est liée aux cellules horizontales connectées aux photorécepteurs situés dans cette zone et aux cellules amacrines.
Plus une cellule parasol est située en périphérie de la rétine, plus son champ récepteur augmente de taille et plus le nombre de CBR diffuses et de cônes qu’elle connecte augmente. Quelle que soit l’excentricité, le champ récepteur d’une CGR parasol du canal magnocellulaire sera toujours plus grand que celui d’une CGR naine du canal parvocellulaire.
La réponse des CGR parasols du canal magnocellulaire est phasique : elles émettent des potentiels d’action de manière courte lors de changement d’un stimulus (voir eFig. 5-5) [36]. Les axones du canal magnocellulaire sont les plus gros et donc les plus rapides à transmettre l’information jusqu’au cortex. Les neurones relais des couches magnocellulaires du NGL empruntent les radiations optiques pour se connecter spécifiquement dans la couche 4Cα du cortex visuel primaire et vont participer à la voie visuelle corticale dorsale pour l’analyse du mouvement et des rapports dans l’espace [19].
Le canal magnocellulaire participe à la vision des basses fréquences spatiales et des hautes fréquences temporales, c’est-à-dire à la perception du mouvement ou des changements rapides d’intensité lumineuse comme le flicker. Le circuit des CGR parasols dans la rétine explique ces propriétés puisque l’information de nombreux cônes converge vers une cellule parasol, lui donnant un champ récepteur large, propre à l’analyse du mouvement d’un stimulus. La réponse phasique et la conduction rapide des CGR parasols expliquent également leur sensibilité aux changements rapides de luminance et aux mouvements. Comme, à excentricité égale, une cellule parasol reçoit l’information de plus de cônes que la cellule naine, elle est plus sensible aux faibles contrastes que la cellule naine mais au prix d’une perte de la discrimination des détails fins. Les cellules parasols sont insensibles à la chromaticité d’un stimulus car elles connectent de manière non spécifique les cônes rouges et verts (et peut-être bleus).
Ce canal participe à la vision colorée et code pour l’opposition bleu/jaune. Les petites cellules bistratifiées participent à ce canal et en sont les mieux connues (voir fig. 5-3 et 5-4) [10]. Elles représentent 6 % environ du nombre total de CGR. Quelle que soit l’excentricité, le champ récepteur d’une petite cellule bistratifiée du canal koniocellulaire est équivalent à celui d’une cellule parasol du canal magnocellulaire, et sera toujours plus grand que celui d’une CGR naine du canal parvocellulaire.
Les dendrites des petites cellules bistratifiées se retrouvent dans les sous-couches ON et OFF de la couche plexiforme interne (eFig. 5-7). Dans la sous-couche ON, elles connectent plusieurs CBR ON qui ne connectent sélectivement que des cônes bleus [16]. À l’inverse, dans la sous-couche OFF, elles connectent plusieurs cellules bipolaires OFF qui ne connectent que des cônes rouges et verts. Le mélange de l’information colorée des cônes rouges et verts correspond physiologiquement à la couleur jaune. Les petites cellules bistratifiées véhiculent donc l’opposition colorée centre bleu ON/pourtour jaune OFF (fig. 5-7).
D’autres types de CGR interviennent dans le canal koniocellulaire, par exemple pour coder l’opposition colorée jaune ON/bleu OFF et pourraient impliquer les CGR dites cellules monostratifiées éparses (« sparse monostratified » en anglais) [10]. Une deuxième voie de l’opposition colorée bleu ON/jaune OFF a été identifiée, impliquant les grandes cellules bistratifiées (voir fig. 5-3), mais il est possible que d’autres types de CGR participent à ce canal koniocellulaire. Ces CGR sont peu nombreuses et il est donc plus difficile de les identifier.
Les propriétés fonctionnelles des CGR du canal koniocellulaire sont probablement variées et moins bien connues que celles des canaux parvo- et magnocellulaire [10, 23]. Le diamètre des axones du canal koniocellulaire est intermédiaire entre celui des canaux parvo- et magnocellulaire, avec des vitesses de conduction également intermédiaires. Les neurones relais des couches koniocellulaires du NGL empruntent les radiations optiques pour se connecter spécifiquement dans les couches 2 et 3 et dans les blobs du cortex visuel primaire où ils participent à la vision colorée dans la voie corticale ventrale [19].
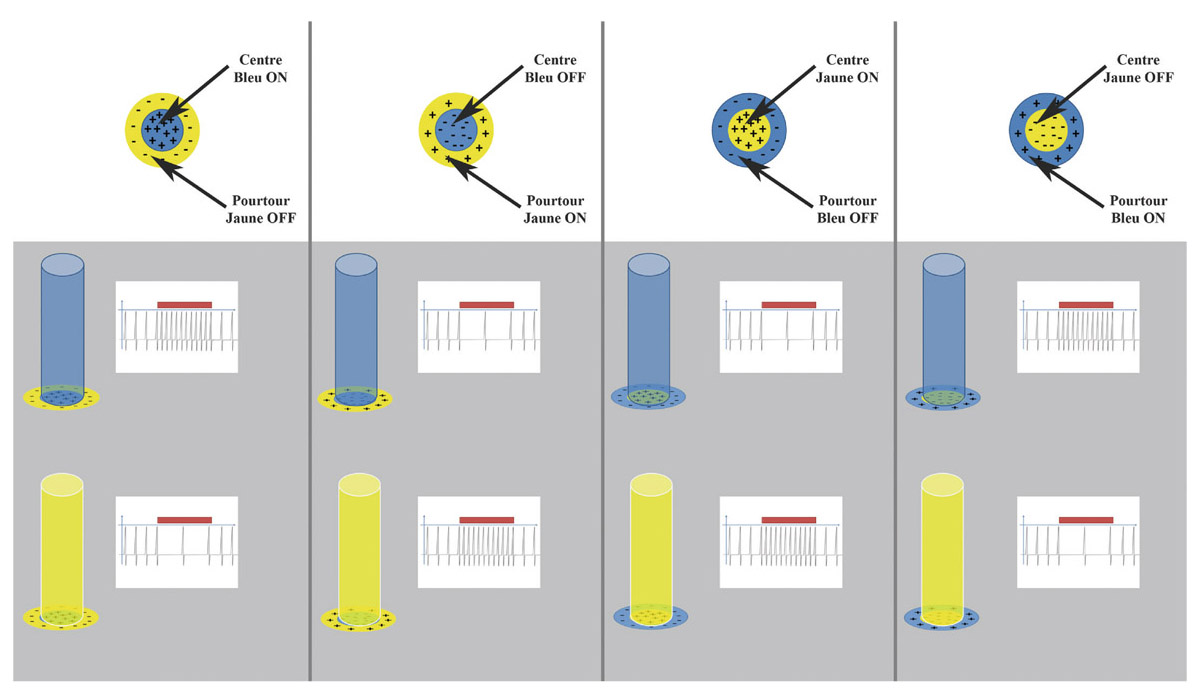
eFig. 5-7 Champs récepteurs du canal koniocellulaire avec de gauche à droite : une CGR à centre bleu ON (correspondant à une CGR petite bistratifiée), à centre bleu OFF, à centre jaune ON et à centre jaune OFF. La réponse de la CGR est représentée selon qu’un faisceau lumineux bleu (ligne du milieu) ou jaune (ligne du bas) est dirigé sur le centre du champ récepteur. La réponse à un faisceau lumineux bleu ou jaune sur le pourtour n’est pas représentée mais aboutit à une réponse opposée de la CGR. (© 2013, Service d’ophtalmologie du Pr. Cochereau.)
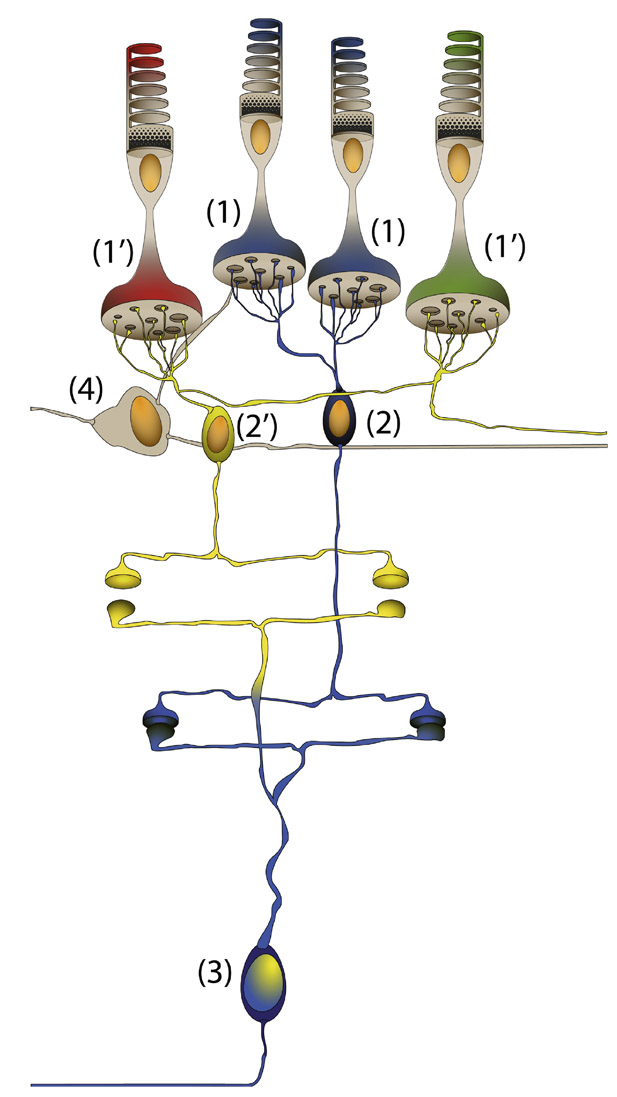
Fig. 5-7 Circuit d’une CGR petite bistratifiée (3) du canal koniocellulaire. Elle va connecter une ou plusieurs CBR (2) qui sont spécifiques des cônes bleus (1) dans la sous-couche ON de la plexiforme interne qui correspond au centre bleu ON du champ récepteur. Dans la sous-couche OFF, la CGR petite bistratifiée va connecter des CBR (2′) qui connectent à la fois des cônes rouges et verts (1). La réponse conjuguée des cônes rouges et verts correspond physiologiquement à la couleur jaune du pourtour OFF du champ récepteur de la CGR petite bistratifiée. (© 2013, Service d’ophtalmologie du Pr. Cochereau.)
Le signal des bâtonnets n’est pas véhiculé par un type particulier de CGR mais injecté dans le circuit des CGR par l’intermédiaire de cellules amacrines type AII (fig. 5-8) [11]. Les bâtonnets se connectent à un type de CBR ON qui leur est spécifique. Le circuit OFF n’existe pas pour les CBR des bâtonnets. Ces dernières connectent dans la sous-couche ON de la couche plexiforme interne un interneurone de la rétine : les cellules amacrines de type AII. Ces cellules amacrines AII vont ensuite connecter des CBR ON des canaux parvo-, magno- et koniocellulaires, et probablement d’autres circuits, pour y injecter l’information en provenance des bâtonnets par des synapses électriques (gap junctions) qui sont de type excitateur. Ces cellules amacrines AII connectent également les CBR OFF et les CGR OFF par des synapses inhibitrices. En condition mésopique, le signal des bâtonnets va moduler de manière locale l’activité des autres circuits de traitement de l’information visuelle. En condition scotopique, le signal des bâtonnets sera le seul injecté dans les différents canaux de la voie visuelle.
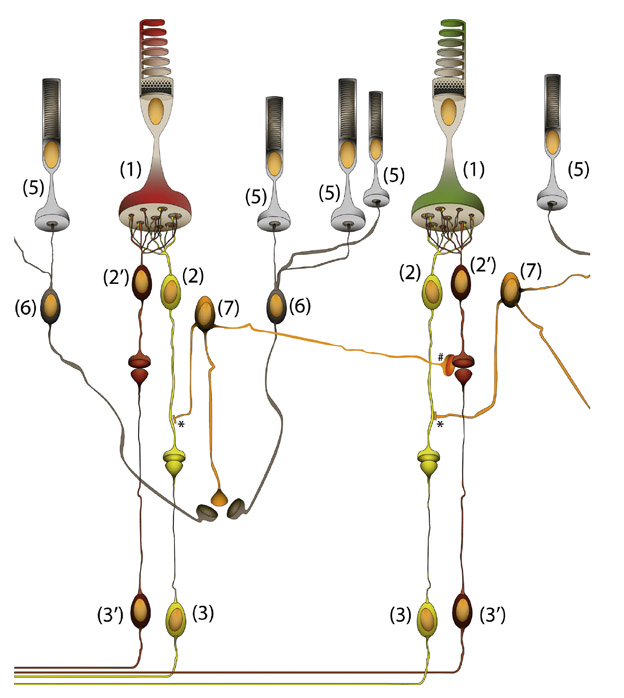
Fig. 5-8 Circuit du signal des bâtonnets. Ici est représenté le circuit des deux CGR naines du canal parvocellulaire ON (3) et OFF (3′). L’information des bâtonnets (5) est lue par des CBR spécifique des bâtonnets (6) qui se dépolarisent à la lumière et activent les cellules amacrines de type AII (7). Ces cellules amacrines AII se connectent par des synapses électriques excitatrices (gap junctions, *) aux CBR de type ON (2) et aux autres cellules amacrines AII environnantes. Elles connectent également des CBR OFF (2′) et des CGR OFF (3′) par des synapses inhibitrices (#). Il n’y a donc pas de canal spécifique aux bâtonnets, mais leur signal est injecté dans celui des autres circuits rétiniens. En condition scotopique, le signal des bâtonnets, via les CBR à bâtonnets et les amacrines AII, active les CBR de type ON et inhibe les CBR et les CGR OFF. (© 2013, Service d’ophtalmologie du Pr. Cochereau.)
Ces deux voies visuelles impliquent des structures sous-corticales qui participent au contrôle des mouvements des yeux et de la tête (fig. 5-9 et eFig. 5-8). La voie rétinocolliculaire participe aux mouvements rapides des yeux (saccades) et de la tête dans le but de changer la direction du regard vers une nouvelle cible visuelle [12]. Le système visuel accessoire semble plutôt impliqué dans les mouvements lents de la tête et des yeux comme le nystagmus optocinétique et les réflexes oculo-céphaliques [40].
Dix pour cent des CGR projettent dans le colliculus supérieur, ce qui en fait la deuxième cible principale des CGR chez les primates [27]. Les deux colliculi supérieurs sont situés à la face postérieure du mésencéphale où ils forment la région du tectum avec les deux colliculi inférieurs qui reçoivent des afférences auditives. Ils sont reliés aux deux NGL par les bras conjonctivaux supérieurs. Les axones des CGR quittent les tractus optiques avant les NGL et empruntent les bras conjonctivaux supérieurs pour atteindre les colliculi supérieurs. Tout comme le NGL ipsilatéral, le colliculus supérieur reçoit des informations visuelles des deux yeux qui correspondent à l’hémichamp visuel controlatéral.
La structure microscopique des colliculi supérieurs est composée de six couches qui peuvent être regroupées en trois groupes : couches superficielles, intermédiaires et profondes [12]. Les couches superficielles ne reçoivent que des informations visuelles, et ce sont celles où font synapses les CGR selon une organisation rétinotopique : la partie rostrale correspond à la partie centrale de l’hémichamp visuel controlatéral, tandis que la partie périphérique de l’hémichamp visuel est située à la partie caudale du colliculus supérieur. Le quadrant supérieur de l’hémichamp visuel se projette sur la partie médiale du colliculus et le quadrant inférieur sur sa partie latérale. La partie centrale de l’hémichamp visuel occupe une plus grande surface que la partie périphérique. Ces couches reçoivent également des informations visuelles en provenance d’aires visuelles du cortex. Les neurones de ces couches projettent sur les couches intermédiaires.
Les couches intermédiaires et profondes reçoivent des informations de différentes modalités sensorielles : visuelles via les couches superficielles du colliculus, mais aussi auditives et somatotopiques. Elles contiennent également des neurones impliqués dans la génération de saccades oculaires qui projettent dans les noyaux du tronc cérébral impliqué dans le contrôle des mouvements oculaires. Ces neurones sont disposés de manière organisée : à la partie rostrale, ils codent pour des saccades de petite amplitude, tandis qu’à la partie caudale ils codent pour des saccades de plus grande amplitude. La partie médiale du colliculus code pour des saccades vers le quadrant supérieur et sa partie latérale pour des saccades vers le quadrant inférieur. Cette organisation est concordante avec la représentation rétinotopique des afférences visuelles dans les couches superficielles. Le colliculus supérieur serait impliqué dans la transformation de données sensorielles, en particulier visuelles, en données motrices pour guider le regard mais aussi la tête, le corps et les gestes de préhension vers un stimulus important. Cependant, le colliculus supérieur n’est qu’une des structures d’un large réseau cortico-sous-cortical impliquant les aires visuelles corticales, les aires corticales prémotrices et le tronc cérébral [18].
Le système optique accessoire est principalement décrit chez l’animal et reste moins bien connu chez les singes et chez l’homme [40]. Ce système contient des noyaux de petite taille dans le diencéphale qui reçoivent directement des projections des CGR. Ce système analyse les mouvements globaux de l’image sur la rétine induits par le nystagmus optocinétique ou les mouvements de la tête et des yeux, et projette vers le noyau réticulaire tegmental pontique et l’olive bulbaire inférieure.
Les CGR qui projettent dans les colliculi supérieurs et le système optique accessoire sont moins bien connues que les CGR de la voie visuelle principale, mais certains types ont été identifiés.
Un premier, type appelé CGR épineuses (« thorny », voir fig. 5-3), est composé des trois sous-types représentant chacun 1 % de la population des CGR [10]. Leur champ dendritique est deux fois plus grand que celui des cellules parasols du canal magnocellulaire. Ces cellules projettent probablement à la fois dans les NGL et dans les colliculi supérieurs.
Les cellules épineuses larges (« broad thorny cells », voir fig. 5-3) sont dotées d’un arbre dendritique épais situé au centre de la couche plexiforme interne débordant dans les sous-couches ON et OFF. Ces cellules répondent de manière transitoire à l’apparition d’un stimulus lumineux ou à la disparition d’un stimulus lumineux (réponse transitoire ON/OFF).
Les cellules épineuses étroites (« narrow thorny cells », voir fig. 5-3) sont dotées d’un arbre dendritique plus fin situé en bordure de la couche plexiforme interne, soit dans la sous-couche ON, soit dans la sous-couche OFF. Leurs caractéristiques fonctionnelles ne sont pas connues, mais elles répondent probablement de manière transitoire ON ou OFF à un stimulus lumineux.
Les CGR récursives sont un autre type de neurones de la voie rétinocolliculaire (voir fig. 5-3) [10, 36]. L’arbre dendritique de ces neurones est encore plus large que celui des cellules épineuses. À la différence des autres CGR, le chevauchement de l’arbre dendritique entre deux cellules récursives adjacentes est plus important. De plus, de nombreuses branches de deuxième ordre de l’arbre dendritique ont un trajet en demi-tour vers le corps cellulaire, ce qui leur a donné ce nom de cellules récursives. Ces particularités font supposer que ces CGR correspondent à des cellules particulièrement bien étudiées chez le lapin, qui ne répondent qu’à un stimulus en mouvement dans une direction et un sens particulier : ces cellules sont qualifiées de direction-sélective [29, 43]. Le déplacement d’un stimulus visuel dans la bonne direction et dans le bon sens déclenche une réponse forte et soutenue du neurone, même pour déplacement faible du stimulus de moins de 0,25° d’angle visuel. Si un stimulus se déplace dans le sens opposé ou dans la mauvaise direction, ces neurones sont fortement inhibés.
Deux sous-types de CGR récursives sont décrits [10]. Les cellules récursives bistratifiées dont l’arbre dendritique est situé dans les sous-couches ON et OFF de la plexiforme interne et qui auraient une réponse de type ON-OFF en plus de leur réponse direction-sélective (voir fig. 5-3). Le champ récepteur de ces cellules représente jusqu’à 3° d’angle visuel, et elles répondent pour une large plage de vitesses de mouvement. Le pourtour de ces cellules est fortement inhibiteur. Elles ne répondraient que pour des mouvements locaux, par exemple le mouvement d’un stimulus dans le champ visuel. Leur réponse est très faible pour le mouvement global de l’image sur la rétine entraînée par les déplacements des yeux ou de la tête. Chez les rongeurs, les cellules récursives bistratifiées de type ON-OFF coderaient les mouvements dans les quatre directions principales de leurs yeux : haut, bas, avant, arrière [43]. Ces cellules récursives bistratifiées projetteraient dans le colliculus supérieur, le noyau géniculé et le système optique accessoire.
Le second type de cellules récursives est monostratifié dans la sous-couche ON de la plexiforme interne (voir fig. 5-3). Elles auraient une réponse de type ON en plus de leur réponse direction-sélective. Leur champ récepteur est encore plus grand que celui des cellules de type ON-OFF. Elles ne répondent que pour des faibles vitesses de mouvement et l’influence du pourtour inhibiteur est très faible sur la réponse de ces neurones. De ce fait, ils répondent préférentiellement au déplacement global de la scène visuelle sur la rétine induit par les mouvements de la tête ou des yeux. Chez les rongeurs, les trois directions du mouvement auxquelles sont sensibles les cellules récursives monostratifiées ON correspondent aux directions des canaux semi-circulaires : antérieure, supéro-postérieure et inféro-postérieure [43]. C’est un argument supplémentaire de leur rôle dans l’analyse des mouvements de l’image induits par les mouvements de la tête et des yeux. Ces neurones ne projetteraient que dans le système optique accessoire qui participe au contrôle des mouvements des yeux et de la tête.
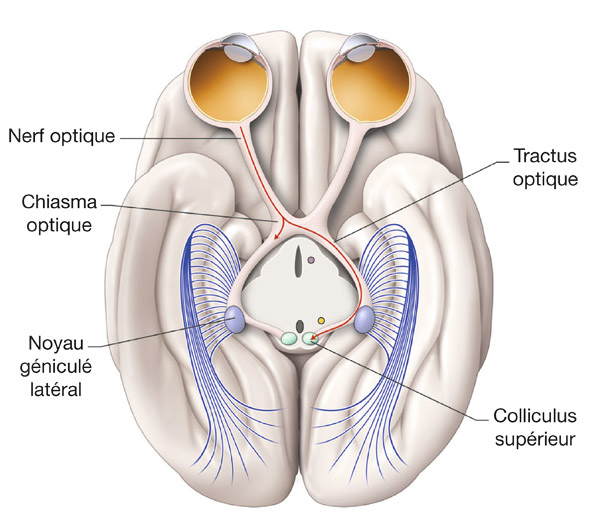
Fig. 5-9 Anatomie macroscopique de la voie rétinocolliculaire et du système optique accessoire en coupe axiale passant par les noyaux géniculés latéraux.
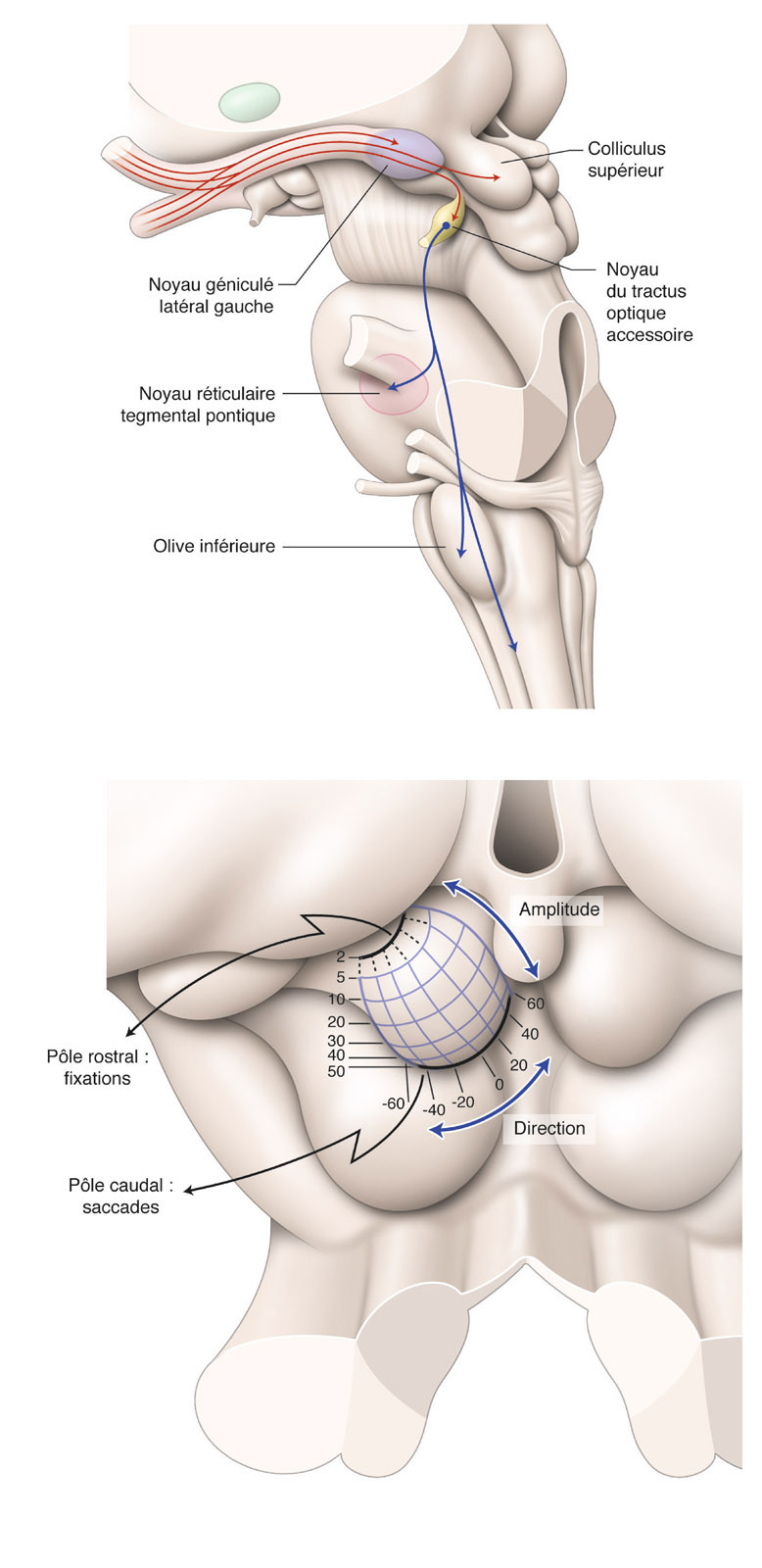
eFig. 5-8 Anatomie macroscopique de la voie rétinocolliculaire et du système optique accessoire en coupe axiale passant par les noyaux géniculés latéraux en vue de profil gauche (a). Les axones des CGR de ces deux voies empruntent la couche des fibres nerveuses rétiniennes, les nerfs optiques, le chiasma optique et les tractus optiques qu’ils quittent avant les noyaux géniculés latéraux. Ils se dirigent alors vers les colliculi supérieurs (voie rétinocolliculaire) en empruntant les bras des colliculi supérieurs ou vers les noyaux du tractus optique (système optique accessoire). Le colliculus supérieur gauche est impliqué dans la réalisation des saccades oculaires vers l’hémichamp visuel droit. Ces saccades sont codées en fonction de la direction et de l’amplitude (b). Le rostre du colliculus est donc impliqué dans la fixation oculaire, tandis que la partie caudale est impliquée dans les saccades les plus périphériques. Le noyau du tractus optique participe aux mouvements conjugués de la tête et des yeux et projette sur des structures du pont (noyau réticulaire tegmental pontique) et du bulbe (olive inférieure). (D’après D.L. Felten, R.F. Jozefowicz. Atlas de neurosciences humaines de Netter. Masson, 2006, p. 238 et 237.)
La voie rétino-prétectale est la voie du réflexe photomoteur (fig. 5-10 et eFig. 5-9) [2, 28]. Le prétectum est une structure médiane du mésencéphale située entre en avant et latéralement le thalamus et les NGL, et les colliculi supérieurs en arrière. Les axones des CGR quittent la bandelette optique avant le NGL pour atteindre le noyau olivaire ipsilatéral du prétectum. Ces CGR constituent la voie afférente du réflexe photomoteur. Ces fibres véhiculent une information de luminance globale de la scène visuelle. Le noyau olivaire ipsilatéral projette à son tour sur les noyaux d’Edinger-Westphal ispilatéral et controlatéral. Ces noyaux sont responsables de l’innervation du sphincter irien après un relais dans le ganglion ciliaire de l’œil. Ces fibres cheminent dans la 3e paire crânienne et forment la voie efférente parasympathique du réflexe photomoteur.
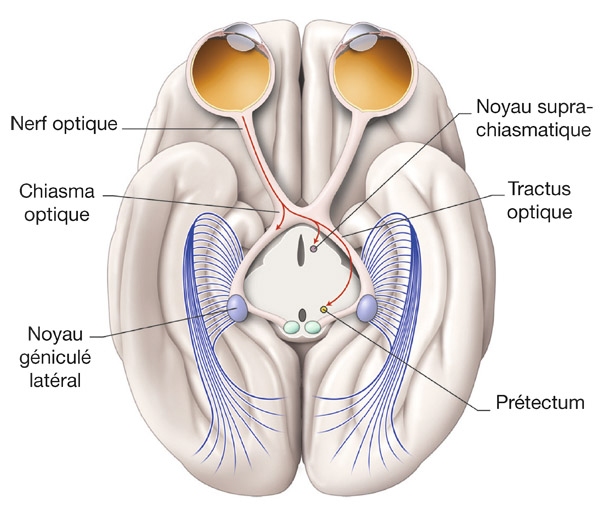
Fig. 5-10 Anatomie macroscopique de la voie rétino-prétectale et rétino-hypothalamique en coupe axiale passant par les noyaux géniculés latéraux. (D’après D.L. Felten, R.F. Jozefowicz. Atlas de neurosciences humaines de Netter. Masson, 2006, p. 238.)
La voie rétino-hypothalamique correspond aux projections des CGR dans le noyau suprachiasmatique [2]. Ce noyau est une structure médiane de l’hypothalamus située immédiatement au-dessus du chiasma optique. Ce noyau joue un rôle majeur de pacemaker dans les rythmes biologiques et dans leur synchronisation avec l’alternance jour-nuit [20]. L’afférence visuelle de ce noyau proviendrait de terminaisons collatérales de CGR de la voie rétino-prétectale. Comme pour le réflexe photomoteur, l’information visuelle transmise au noyau suprachiasmatique est une information de luminance globale de la scène visuelle.
Les CGR des voies rétino-prétectale et rétino-hypothalamique répondent de manière linaire, régulière et continue avec l’augmentation de la luminance de la scène visuelle [10]. Elles appartiennent à une classe très particulière et récemment identifiée : les cellules ganglionnaires à mélanopsine (voir fig. 5-3 ; fig. 5-11) [15, 33]. Ces cellules correspondraient aux cellules jusqu’alors identifiées morphologiquement comme les cellules géantes monostratifiées qui projettent dans le prétectum et l’hypothalamus, ainsi que dans le NGL. Ces cellules sont peu nombreuses, ne représentant qu’entre 1 et 4 % des CGR chez le rongeur et moins de 0,2 % chez l’homme et le singe [10]. Leur densité est maximale en périfovéolaire et décroît avec l’excentricité rétinienne. L’arbre dendritique de ces cellules est extrêmement large et permet de différencier différents types [33]. Les plus nombreuses, appelées M1, ont leur arbre dendritique dans la sous-couche OFF de la couche plexiforme interne, à sa frontière avec la couche nucléaire interne. L’arbre dendritique des cellules M2 est situé dans la sous-couche ON de la couche plexiforme interne, à sa frontière avec la couche des cellules ganglionnaires. Le corps cellulaire de certaines cellules à mélanopsine, environ 5 % d’entre elles, a été identifié dans la couche nucléaire interne, sans qu’on en connaisse la signification. Le noyau suprachiasmatique reçoit plus de connexions de cellules M1 (80 %) que de cellules M2, tandis que 55 % de connexions du noyau olivaire prétectal proviennent de cellules M2 et 45 % des connexions des cellules M1.
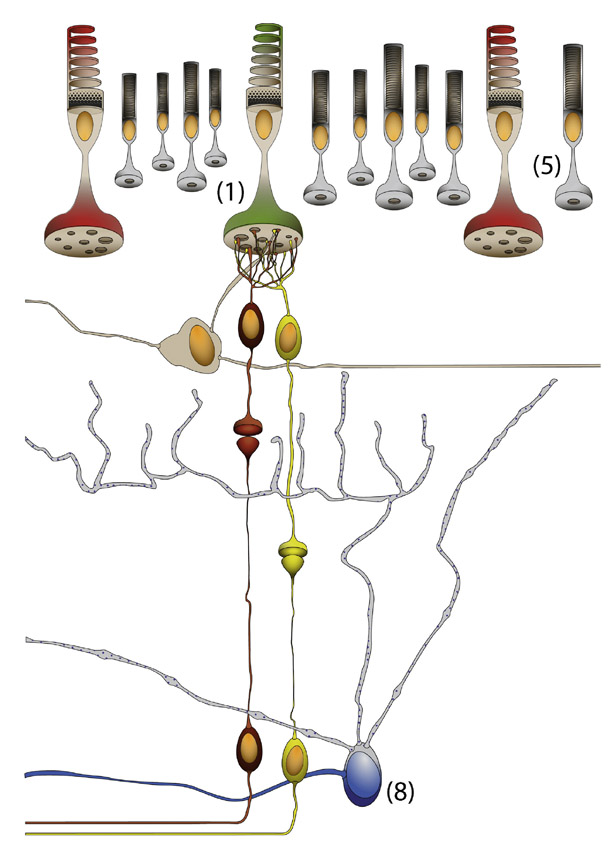
Fig. 5-11 Circuit d’une CGR à mélanopsine (8) de la voie rétino-prétectale et rétino-hypothalamique. Celle-ci peut être activée par la lumière par une voie extrinsèque passant par les cônes (1) et les bâtonnets (5) sans qu’on en connaisse le circuit exact. Toutefois, elle peut répondre à la lumière par une voie intrinsèque : la mélanopsine (représentée par les granulations), contenue dans ses dendrites, son corps cellulaire et le cône proximal de l’axone, réagit directement à la lumière et provoque la dépolarisation tonique de la CGR même en l’absence de cônes et de bâtonnets.
(© 2013, Service d’ophtalmologie du Pr. Cochereau.)
La réponse des cellules à mélanopsine à la lumière est double : extrinsèque ou intrinsèque [2, 15, 33]. La réponse extrinsèque est dépendante des cônes et des bâtonnets via des cellules bipolaires et des cellules amacrines, sans que le circuit soit parfaitement connu. La réponse intrinsèque n’est pas dépendante des photorécepteurs et peut se voir même lorsqu’une pathologie comme une rétinite pigmentaire a détruit tous les photorécepteurs ou in vitro lorsque les photorécepteurs sont pharmacologiquement inactivés. Cette réponse est liée à la phototransduction de la mélanopsine contenue dans les dendrites, le corps cellulaire et la partie proximale de l’axone de ces CGR. La mélanopsine est un photopigment au même titre que ceux contenus dans les cônes et les bâtonnets, mais ontologiquement sa structure et sa fonction sont plus proches de l’opsine retrouvée chez les invertébrés. Sa sensibilité spectrale s’étend de 420 à 625 nm, avec un pic à 480 nm, ce qui correspond à de la lumière bleue. La cascade moléculaire de la réponse intrinsèque des cellules à mélanopsine n’est pas encore complètement élucidée, tout comme le cycle de régénération de la mélanopsine. Par analogie à la transduction présente chez les invertébrés, il est probable que l’isomérisation de la mélanopsine par la lumière active des protéines G, différentes de celles utilisées dans les cônes et les bâtonnets, qui activent la phospholipase C et conduisent à la dépolarisation de la CGR. La régénération de la mélanopsine ne ferait pas appel au cycle enzymatique du rétinol des photorécepteurs et de l’épithélium pigmentaire de la rétine. La mélanopsine se renouvellerait de manière spontanée par ses propriétés de bistabilité comme l’opsine des invertébrés. La réponse intrinsèque à la lumière est plus faible et plus lente que la réponse extrinsèque. La latence de la réponse intrinsèque varie de quelques centaines de millisecondes pour les stimuli intenses, à presque une minute pour les stimuli les plus faibles. Par comparaison, la réponse des bâtonnets à la lumière est vingt fois plus rapide, et celle des cônes cent fois plus rapide. Une fois la réponse intrinsèque déclenchée, elle est aussi plus tonique que la réponse extrinsèque : la réponse maximale est obtenue après 10 à 20 secondes d’illumination constante, et la réponse se poursuit entre 5 et 60 secondes après l’arrêt de la stimulation lumineuse.
Les cellules à mélanopsine peuvent donc répondre de manière rapide aux changements brusques de luminance via la réponse extrinsèque, ce qui est nécessaire pour ajuster de manière fine le diamètre pupillaire. Elles sont aussi capables de répondre de manière continue à des variations plus lentes de luminance, comme les variations diurnes de l’ensoleillement, via la réponse intrinsèque pour ajuster le diamètre de base de la pupille et informer notre horloge interne de l’« heure solaire ». Cette réponse intrinsèque permet de comprendre pourquoi les patients atteints de rétinite pigmentaire restent calés sur le cycle nycthéméral malgré la destruction complète de tous les cônes et bâtonnets et malgré leur absence de perception lumineuse consciente.
Il est par ailleurs possible que des cellules à mélanopsine participent à la voie visuelle principale pour indiquer le niveau global de luminance de la scène visuelle.
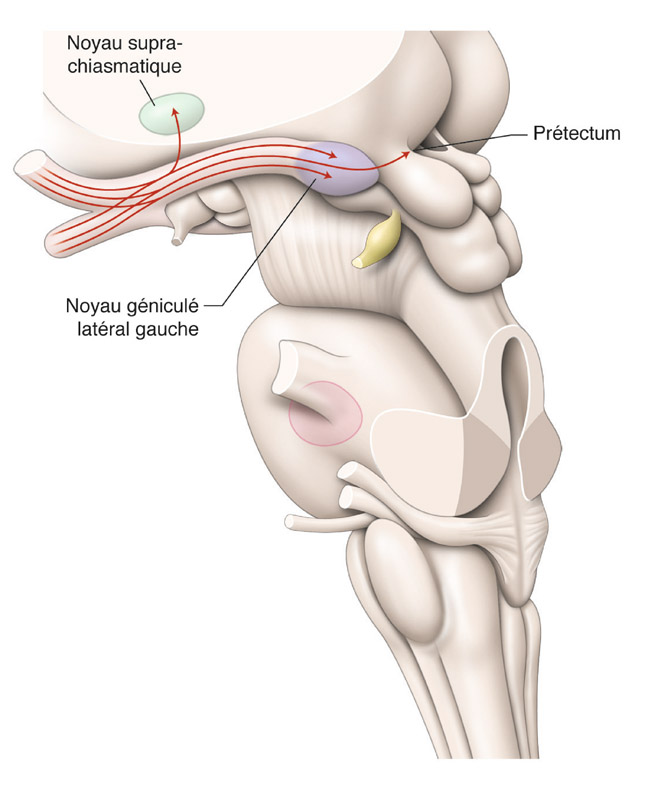
eFig. 5-9 Anatomie macroscopique de la voie rétino-prétectale et rétino-hypothalamique en coupe axiale passant par les noyaux géniculés latéraux en vue de profil gauche. Les axones des CGR de la voie rétino-prétectale empruntent la couche des fibres nerveuses rétiniennes, les nerfs optiques, le chiasma optique et les tractus optiques qu’ils quittent avant les noyaux géniculés latéraux. Ils se dirigent alors vers le prétectum dans le mésencéphale impliqué dans le réflexe photomoteur. Les axones des CGR de la voie rétino-hypothalamique quittent le chiasma optique pour se diriger vers le noyau suprachiasmatique de l’hypothalamus qui est impliqué dans la synchronisation des rythmes biologiques avec le cycle nycthéméral. (D’après D.L. Felten, R.F. Jozefowicz. Atlas de neurosciences humaines de Netter. Masson, 2006, p. 237.)
La CGR n’est pas un simple relais de l’information et le nerf optique n’est pas un simple câble qui relie l’œil au cerveau. La CGR est le lieu où l’image qui se projette sur la rétine est analysée et codée sur une douzaine de canaux (tableau 5-1), traitant chacun un type d’information comme les détails fins, la luminance globale, le contraste, le mouvement, l’opposition colorée bleu/jaune ou rouge/vert. Cette organisation répond à un besoin de transmission efficace et à moindre coût énergétique de l’information visuelle depuis l’œil jusqu’au cerveau. Cette redondance de l’information explique qu’un scotome glaucomateux ne soit découvert qu’après une perte importante des fibres nerveuses rétiniennes, de 30 à 50 % respectivement pour la périmétrie automatisé blanc-blanc et pour la périmétrie manuelle de Goldmann. Cette organisation explique aussi pourquoi une méthode de mesure du champ visuel qui cible spécifiquement un seul canal de transmission puisse découvrir des scotomes plus précocement que la périmétrie blanc-blanc. Ainsi le champ visuel bleu/jaune teste le canal koniocellulaire et le champ visuel FDT-Matrix teste le canal magnocellulaire.
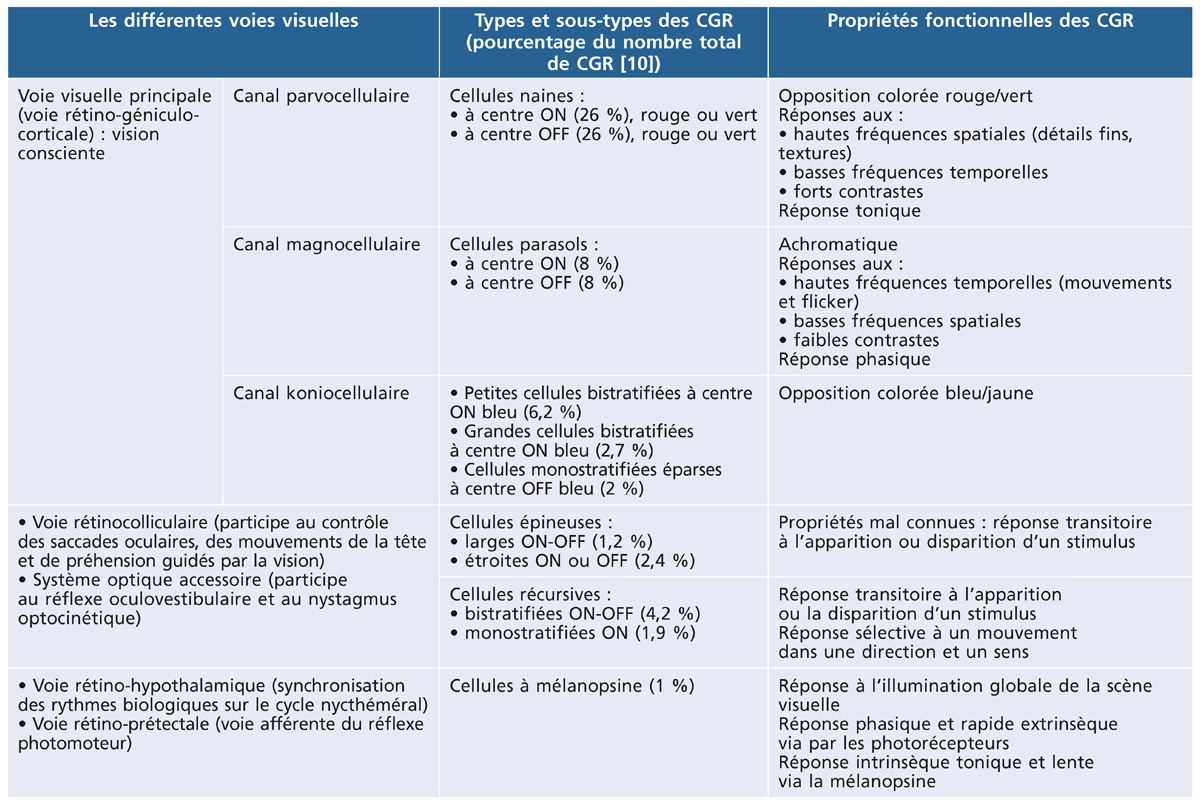
Tableau 5.1 – Tableau synthétique des différentes voies visuelles, des CGR qui y contribuent et de leurs propriétés.
Le nombre de chaque type de CGR est exprimé en pourcentage du nombre total de CGR calculé à 8 mm de la fovéa en temporal d’après [10]. Le total ne fait pas 100 % car certains types de CGR restent à identifier tandis que d’autres sont morphologiquement identifiés mais leurs propriétés fonctionnelles sont encore inconnues.
Chaque point du champ visuel est analysé par plusieurs types de CGR. Cette redondance de l’information explique le retard de détection d’un scotome glaucomateux en périmétrie standard. Une périmétrie qui cible spécifiquement un canal du traitement de l’information visuelle sera plus sensible.
[1] Baas PW, Buster DW. Slow axonal transport and the genesis of neuronal morphology. J Neurobiol. 2004 ; 58 : 3-17.
[2] Benarroch EE. The melanopsin system : phototransduction, projections, functions, and clinical implications. Neurology. 2011 ; 76 : 1422-7.
[3] Bender KJ, Trussell LO. The physiology of the axon initial segment. Annu Rev Neurosci. 2012 ; 35 : 249-65.
[4] Breuninger T, Puller C, Haverkamp S, Euler T. Chromatic bipolar cell pathways in the mouse retina. J Neurosci. 2011 ; 31 : 6504-17.
[5] Bunt AH, Minckler DS. Foveal sparing. New anatomical evidence for bilateral representation of the central retina. Arch Ophthalmol. 1977 ; 95 : 1445-7.
[6] Carelli V, Ross-Cisneros FN, Sadun AA. Mitochondrial dysfunction as a cause of optic neuropathies. Prog Retin Eye Res. 2004 ; 23 : 53-89.
[7] Cosker KE, Courchesne SL, Segal RA. Action in the axon : generation and transport of signaling endosomes. Curr Opin Neurobiol. 2008 ; 18 : 270-5.
[8] Crish SD, Calkins DJ. Neurodegeneration in glaucoma : progression and calcium-dependent intracellular mechanisms. Neuroscience. 2011 ; 176 : 1-11.
[9] Curcio CA, Sloan KR, Kalina RE, Hendrickson AE. Human photoreceptor topography. J Comp Neurol. 1990 ; 292 : 497-523.
[10] Dacey D. Origins of perception : retinal ganglion cell diversity and the creation of parallel visual pathways. In : Gazzaniga (ed.). The conitive neurosciences. 3rd ed. Cambridge, A Bradford Book, 2004 : 281-301.
[11] Demb JB, Singer JH. Intrinsic properties and functional circuitry of the AII amacrine cell. Vis Neurosci. 2012 ; 29 : 51-60.
[12] Gandhi NJ, Katnani HA. Motor functions of the superior colliculus. Annu Rev Neurosci. 2011 ; 34 : 205-31.
[13] Goldstein AY, Wang X, Schwarz TL. Axonal transport and the delivery of pre-synaptic components. Curr Opin Neurobiol. 2008 ; 18 : 495-503.
[14] Hartline DK, Colman DR. Rapid conduction and the evolution of giant axons and myelinated fibers. Curr Biol. 2007 ; 17 : R29-35.
[15] Hattar S, Liao HW, Takao M, et al. Melanopsin-containing retinal ganglion cells : architecture, projections, and intrinsic photosensitivity. Science. 2002 ; 295 : 1065-70.
[16] Haverkamp S, Wassle H, Duebel J, et al. The primordial, blue-cone color system of the mouse retina. J Neurosci. 2005 ; 25 : 5438-45.
[17] Hruska M, Dalva MB. Ephrin regulation of synapse formation, function and plasticity. Mol Cell Neurosci. 2012 ; 50 : 35-44.
[18] Krauzlis RJ. The control of voluntary eye movements : new perspectives. Neuroscientist. 2005 ; 11 : 124-37.
[19] Livingstone M, Hubel D. Segregation of form, color, movement, and depth : anatomy, physiology, and perception. Science. 1988 ; 240 : 740-9.
[20] Lucas RJ, Lall GS, Allen AE, Brown TM. How rod, cone, and melanopsin photoreceptors come together to enlighten the mammalian circadian clock. Prog Brain Res. 2012 ; 199 : 1-18.
[21] Masland RH. The neuronal organization of the retina. Neuron. 2012 ; 76 : 266-80.
[22] Miller KE, Heidemann SR. What is slow axonal transport ? Exp Cell Res. 2008 ; 314 : 1981-90.
[23] Nassi JJ, Callaway EM. Parallel processing strategies of the primate visual system. Nat Rev Neurosci. 2009 ; 10 : 360-72.
[24] Ogawa Y, Rasband MN. The functional organization and assembly of the axon initial segment. Curr Opin Neurobiol. 2008 ; 18 : 307-13.
[25] Perge JA, Koch K, Miller R, et al. How the optic nerve allocates space, energy capacity, and information. J Neurosci. 2009 ; 29 : 7917-28.
[26] Perlson E, Maday S, Fu MM, et al. Retrograde axonal transport : pathways to cell death ? Trends Neurosci. 2010 ; 33 : 335-44.
[27] Perry VH, Cowey A. Retinal ganglion cells that project to the superior colliculus and pretectum in the macaque monkey. Neuroscience. 1984 ; 12 : 1125-37.
[28] Prasad S, Galetta SL. Anatomy and physiology of the afferent visual system. Handb Clin Neurol. 2011 ; 102 : 3-19.
[29] Pushchin II. Retinal ganglion cells of the accessory optic system : a review. J Integr Neurosci. 2012 ; 12 : 145-62.
[30] Radius RL, Anderson DR. The course of axons through the retina and optic nerve head. Arch Ophthalmol. 1979 ; 97 : 1154-8.
[31] Radius RL, Anderson DR. The histology of retinal nerve fiber layer bundles and bundle defects. Arch Ophthalmol. 1979 ; 97 : 948-50.
[32] Rodieck RW. La vision. 1re éd. Paris, De Boeck Université, 2003.
[33] Sand A, Schmidt TM, Kofuji P. Diverse types of ganglion cell photoreceptors in the mammalian retina. Prog Retin Eye Res. 2012 ; 31 : 287-302.
[34] Saszik S, DeVries SH. A mammalian retinal bipolar cell uses both graded changes in membrane voltage and all-or-nothing Na+ spikes to encode light. J Neurosci. 2012 ; 32 : 297-307.
[35] Saxton WM, Hollenbeck PJ. The axonal transport of mitochondria. J Cell Sci. 2012 ; 125 : 2095-104.
[36] Schiller PH. Parallel information processing channels created in the retina. Proc Natl Acad Sci USA. 2010 ; 107 : 17087-94.
[37] Schwartz JH, De Camilli P. Synthesis and trafficking of neuronal protein. In : Kandel ER, Schwartz JH, Jessell TM (eds). Principles of neural science. 4th ed. New York, McGraw-Hill, 2000 : 88-104.
[38] Schwartz JH, Westbrook GL. The cytology of neurons. In : Kandel ER, Schwartz JH, Jessell TM (eds). Principles of neural science. 4th ed. New York, McGraw-Hill, 2000 : 67-87.
[39] Silveira LC, Perry VH. The topography of magnocellular projecting ganglion cells (M-ganglion cells) in the primate retina. Neuroscience. 1991 ; 40 : 217-37.
[40] Simpson JI. The accessory optic system. Annu Rev Neurosci. 1984 ; 7 : 13-41.
[41] Sterling P. Some principles of retinal design : the Proctor lecture. Invest Ophthalmol Vis Sci. 2013 ; 54 : 2267-75.
[42] Van Essen DC, Newsome WT, Maunsell JH. The visual field representation in striate cortex of the macaque monkey : asymmetries, anisotropies, and individual variability. Vision Res. 1984 ; 24 : 429-48.
[43] Vaney DI, Sivyer B, Taylor WR. Direction selectivity in the retina : symmetry and asymmetry in structure and function. Nat Rev Neurosci. 2012 ; 13 : 194-208.

