A. Labbé
La papille optique ou tête du nerf optique constitue un support structurel mais aussi fonctionnel pour l’ensemble des axones des cellules ganglionnaires rétiniennes qui la traverse.
La tête du nerf optique peut être divisée au niveau histologique en quatre régions : la couche des fibres nerveuses rétiniennes, la portion prélaminaire, la portion laminaire ou lame criblée, et la portion rétrolaminaire.
La région laminaire correspond à la lame criblée ou lamina cribrosa. La fonction principale de la lame criblée est de permettre le passage des fibres nerveuses rétiniennes et des vaisseaux centraux de la rétine au travers du canal scléral tout en préservant ces structures du gradient de pression entre les espaces intra- et extra-oculaires.
Le réseau artériel de la partie antérieure du nerf optique provient entièrement des branches de l’artère ophtalmique, une branche de la carotide interne.
Le nerf optique peut être divisé en une partie intra-oculaire, qui comprend la couche des cellules ganglionnaires rétiniennes, la couche des fibres nerveuses rétiniennes et la papille (ou tête du nerf optique), et une partie rétrobulbaire qui comprend la portion intra-orbitaire, la partie intracanaliculaire dans le canal optique et la portion intracrânienne qui aboutit au chiasma puis au tractus optique jusqu’au corps géniculé latéral [30]. La papille optique ou tête du nerf optique constitue une zone anatomique cruciale pour le nerf optique, en particulier dans la physiopathologie des glaucomes. En termes biomécaniques, la tête du nerf optique est une structure fragile remplissant le canal scléral qui constitue une interruption dans l’enveloppe cornéosclérale solide du globe oculaire. Cette zone offre par ailleurs un support structurel mais aussi fonctionnel pour l’ensemble des axones des cellules ganglionnaires rétiniennes (CGR) qui la traverse. L’atteinte des axones des CGR au niveau de la tête du nerf optique serait ainsi le principal mécanisme physiopathologique à l’origine de la neuropathie optique glaucomateuse. La portion intra-oculaire du nerf optique étant visible lors de l’examen clinique, elle est également une structure centrale dans l’examen du patient glaucomateux ou suspect de glaucome, à la fois pour le diagnostic mais aussi pour l’évaluation de la progression de la neuropathie optique glaucomateuse.
La mise en place et le développement de l’appareil visuel se déroulent durant la vie intra-utérine et se poursuivent après la naissance, et ce développement est indissociable de celui du système nerveux. À l’image d’autres organes, l’embryologie du système visuel se divise en plusieurs phases : embryogenèse, organogenèse et différenciation. L’embryogenèse, qui débute dès la fécondation, aboutit à la mise en place des trois tissus fondamentaux de l’embryon : l’ectoblaste, le mésoblaste et l’entoblaste. Le développement de l’appareil visuel fait ainsi appel à deux de ces trois feuillets, l’ectoblaste pour la rétine, le nerf optique et le cristallin, et le mésoblaste pour les parois du globe oculaire et une grande partie des annexes [10, 14, 30].
La vésicule optique primitive est la première structure oculaire qui apparaît à partir de la 3e semaine de gestation. Il s’agit d’une évagination du tube neural, issue du prosencéphale (fig. 6-1). L’extension progressive de ces cellules neuro-ectodermiques forme une dépression centrale puis s’invagine sur elle-même pour former la vésicule optique secondaire ou cupule optique (voir fig. 6-1) [10, 14, 30, 56]. Cette dernière reste reliée au diencéphale par le pédoncule optique, futur nerf optique. La papille optique, encore virtuelle, se situe à la jonction entre le pédoncule et la vésicule optique [10, 14, 30, 56]. Simultanément, le pédoncule optique s’allonge et s’invagine, créant ainsi une rainure centrale inférieure sur toute sa longueur jusqu’à la partie inférieure de la cupule optique antérieure. Vers la 4e semaine, par cette fente ou fissure embryonnaire, pénètre l’artère hyaloïdienne, future artère centrale de la rétine. La fente embryonnaire commence à se fermer à partir de la 5e semaine de gestation par la fusion de la partie centrale de la cupule optique. Puis la fermeture se poursuit et s’achève à la 7e semaine par l’extension et l’accolement des deux feuillets cellulaires constituant la vésicule et le pédicule optique ; l’artère hyaloïdienne est alors incluse dans le futur nerf optique [10, 14, 30, 56]. Le feuillet cellulaire externe qui reste unistratifié correspond à l’ébauche de l’épithélium pigmentaire ; le feuillet interne qui formera une couche multistratifiée correspond à l’ébauche de la rétine neurosensorielle (voir fig. 6-1) [10, 14, 30, 56]. Compte tenu de la position de cette fente embryonnaire, l’absence de fermeture de celle-ci est ainsi responsable d’un colobome choriorétinien toujours situé dans la partie inférieure du globe oculaire [10].

Fig. 6-1 a, b. Coupes schématiques de la vésicule optique et de la cupule optique.
Parallèlement au développement du pédoncule optique, les cellules se divisent et migrent dans la couche interne de la cupule optique pour donner la future rétine. Les premières cellules à se différencier sont les futures cellules ganglionnaires de la rétine et les cellules de Müller [30]. Entre la 5e et 6e semaine, les cellules ganglionnaires rétiniennes développent des axones qui convergent vers la papille primitive et formeront la couche des fibres nerveuses rétiniennes [14, 30]. Ces axones atteignent la papille primitive vers la 7e semaine et le cerveau primitif, en formant le futur chiasma optique, entre les 7e et 8e semaines. À ce stade, la partie distale du pédoncule optique est ainsi constituée, du centre vers la périphérie, de l’artère hyaloïdienne, des axones des cellules ganglionnaires et d’un double feuillet cellulaire reliés aux feuillets interne (future rétine) et externe (futur épithélium pigmentaire) de la cupule optique [10, 14, 30, 56].
À partir de la 7e semaine se forme également le futur système glial du nerf optique lorsque les cellules du feuillet interne du pédoncule optique se différencient en glioblastes et se multiplient en rangées longitudinales parallèles aux axones du nerf optique [30], et les cellules du feuillet externe viennent former un manchon glial périphérique. La gaine du nerf optique apparaît à la fin de la 7e semaine et se différencie en dure-mère, pie-mère et arachnoïde vers les 13e-14e semaines [30].
Au niveau de la tête du nerf optique primitif, la lame criblée se développe après l’apparition des axones des cellules ganglionnaires et de l’artère hyaloïdienne qui constitueront son futur contenu [14, 30]. Ainsi, vers la 8e semaine, les cellules gliales provenant du feuillet externe du pédoncule optique viennent former un réseau provisoire autour des axones des cellules ganglionnaires puis une vascularisation apparaît vers la 13e-14e semaine. Ce réseau sera ensuite renforcé par des cellules mésenchymateuses vers le 4e mois. La lame criblée est considérée comme une structure mature vers le 7e mois. Elle est séparée des cellules sclérales qui l’entourent par un feuillet continu de cellules gliales qui apparaît vers la 9e semaine. De même, à partir de la 8e semaine, l’artère hyaloïdienne est recouverte de cellules gliales qui prolifèrent et forment une structure conique autour de l’artère appelée papille de Bergmeister. L’importance de l’atrophie de ces cellules et du système hyaloïdien avant la naissance pourrait ainsi influencer la surface et le volume de la future excavation papillaire [14, 30].
La myélinisation se fait de la partie proximale jusqu’à la partie distale du nerf optique. Elle se développe ainsi près du chiasma vers le 7e mois et s’achève à la lame criblée approximativement un mois après la naissance [30].
On distingue plusieurs éléments lors de l’analyse de la papille : de dedans en dehors, l’excavation au centre, puis l’anneau neurorétinien, l’anneau scléral péripapillaire et enfin la zone parapapillaire (fig. 6-2) [30, 56].
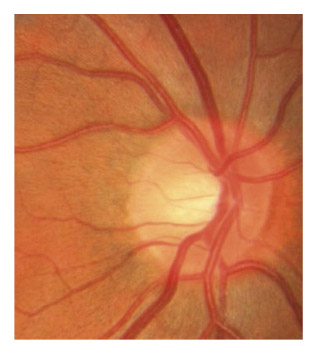
Fig. 6-2 Photographie d’une papille normale.
Les axones des cellules ganglionnaires rétiniennes sortent de l’œil par le canal scléral qui forme un entonnoir à pointe postérieure [14, 30]. Lors de l’examen clinique, la tête du nerf optique ou papille correspond à la surface interne de cette ouverture sclérale postérieure.
La taille de la papille est très variable d’un individu à l’autre, mais également entre les deux yeux d’un même individu. Une asymétrie de taille de la papille est ainsi observée dans approximativement 10 % de la population normale [26, 60]. En fonction de la méthode de mesure utilisée mais aussi de la population étudiée, le diamètre moyen de la papille est compris entre 1,47 mm et 1,89 mm [60]. En mesurant directement la taille de la tête du nerf optique sur plus de 100 yeux énucléés, le diamètre minimal moyen était de 1,67 ± 0,72 mm, le diamètre maximal moyen de 1,92 ± 0,32 mm et la surface moyenne de 2,59 ± 0,72 mm2 (de 0,68 à 4,42 mm2) [25]. Dans une vaste étude clinique fondée sur l’analyse photographique de la taille de la papille, Jonas et al. [24, 26] ont retrouvé un diamètre vertical moyen de 1,92 ± 0,29 mm (0,96 à 2,91 mm) et un diamètre horizontal moyen de 1,76 ± 0,31 mm (0,91 à 2,61 mm). Ces mêmes auteurs ont montré que la surface moyenne de la papille était de 2,69 ± 0,70 mm2 (0,80 mm2 à 5,54 mm2) avec une variabilité interindividuelle de 1 à 6,8 et une distribution gaussienne [26, 33]. L’asymétrie de la surface des papilles des deux yeux d’un même individu est inférieure à 1 mm2 chez près de 99 % des individus normaux [62]. Les mesures de taille de la papille et de l’excavation sont différentes en fonction des appareils utilisés (photographies, HRT – Heidelberg retinal tomography –, OCT – optical coherence tomography), et ne sont donc pas comparables entre elles, la référence demeurant la mesure sur des stéréophotographies du nerf optique [58]. Dans une population adulte de sujets normaux, la surface de la papille est ainsi mesurée entre 1,79 et 2,67 mm2 en HRT, entre 2,29 et 3,09 mm2 sur des stéréophotographies, et entre 1,60 et 2,63 mm2 en OCT [58].
La plupart des papilles ont une forme plus ou moins ovalisée à grand axe vertical, le diamètre vertical étant plus grand que le diamètre horizontal d’approximativement 7 à 10 % [24, 26]. Les très grands nerfs optiques sont appelés macrodisques et les très petits microdisques. En considérant la surface de la papille, les macrodisques sont des papilles dont l’aire est supérieure à 4,09 mm2 et les microdisques sont les papilles dont la surface est inférieure à 1,29 mm2. Ces deux extrêmes correspondent à environ 2,3 % de la population générale [24, 26]. Les macrodisques primitifs peuvent être asymptomatiques (grande papille physiologique) ou symptomatiques avec des anomalies morphologiques ou fonctionnelles comme un colobome papillaire, une fossette ou encore un syndrome morning glory [26].
Les yeux avec de grandes papilles ont une surface d’anneau neurorétinien plus grande, plus de fibres nerveuses rétiniennes, plus de photorécepteurs, une surface rétinienne plus importante et un diamètre horizontal et vertical du globe oculaire plus important [23, 24, 60]. Les petites papilles ont été associées à l’amblyopie, aux drusen du nerf optique, au pseudo-œdème papillaire, ainsi qu’à la névrite optique ischémique antérieure non artéritique [24, 60].
L’excavation papillaire correspond à la portion centrale de la tête du nerf optique dépourvue de fibres nerveuses rétiniennes. Comme pour la taille de la papille, la taille de l’excavation est aussi une donnée variable dans la population [58]. La surface de l’excavation est le paramètre le plus souvent mesuré, avec une surface moyenne comprise entre 0,53 et 1,40 mm2 (de 0,00 mm2 à 3,07 mm2) [26]. Dans une population de sujets normaux, le diamètre horizontal moyen de l’excavation a été mesuré à 0,83 ± 0,58 mm (0,00-2,08 mm), alors que le diamètre vertical moyen mesurait 0,77 ± 0,55 mm (0,00-2,13 mm) [26]. L’excavation normale est donc ovale horizontalement avec un diamètre horizontal 7,7 % plus grand que le diamètre vertical, soit l’inverse de ce qui est observé au niveau du disque optique dont le diamètre vertical est le plus grand [33]. Par ailleurs, il existe une corrélation entre la taille de la papille et celle de l’excavation, les grandes papilles ayant également de grandes excavations [26, 11]. Cela est un élément important de l’analyse clinique du nerf optique puisqu’il n’y a normalement pas d’excavation dans les petites papilles (1,6 à 1,8 mm2) [26].
Le rapport C/D, décrit pour la première fois par Armaly [3], correspond au rapport entre le diamètre de l’excavation (C pour cup) et le diamètre de la papille (D pour disc). Compte tenu de la forme de la papille et de son excavation, le rapport C/D est donc habituellement plus grand dans son diamètre horizontal que vertical. Jonas et al. [26] ont ainsi observé que le rapport C/D horizontal était plus petit que le rapport vertical chez moins de 7 % des sujets normaux. Ainsi, chez les patients glaucomateux, le C/D vertical s’élargit typiquement plus vite que le C/D horizontal [24]. Le rapport C/D vertical moyen varie ainsi entre 0,3 et 0,56 et le rapport moyen des surfaces du C/D varie entre 0,14 et 0,37 [58]. À l’image de la papille et de l’excavation, le rapport C/D montre également de très grandes variations interindividuelles allant chez les sujets normaux de 0,0 jusqu’à 0,84 [26]. Le rapport C/D vertical est corrélé à la taille de la papille chez les sujets normaux mais aussi chez les sujets glaucomateux [23, 26]. Dans la Blue Montains Eye Study (6 678 yeux), il a été observé une corrélation positive entre le rapport C/D et la taille de la papille avec une augmentation moyenne du rapport C/D de 0,35 à 0,55 entre les petits (1,1-1,3 mm) et les grands nerfs optiques (1,8-2,0 mm) [9]. Un rapport C/D élevé est donc considéré comme physiologique dans les grandes papilles, alors qu’une excavation moyenne doit être considérée comme pathologique dans une petite papille [24].
Dans une étude portant sur 139 sujets normaux, il a été observé une différence de C/D supérieure à 0,3 entre les deux yeux chez 1 % des sujets, à 0,2 chez 4 % et à 0,1 chez 16 % des patients [26]. Une asymétrie de rapport C/D supérieure à 0,2 entre les deux papilles d’un même individu est ainsi souvent considérée comme un élément pathologique. Néanmoins, cet élément ne peut être interprété qu’en comparant en parallèle la taille des papilles. Certaines asymétries de rapport C/D sont en réalité simplement liées à une asymétrie physiologique de la taille des papilles (approximativement 10 % de la population) [24]. Par ailleurs, le rapport C/D seul n’est en rien représentatif du nombre de fibres nerveuses rétiniennes passant par la tête du nerf optique.
Il est la partie essentielle de la papille car il correspond aux axones des cellules ganglionnaires rétiniennes. Comme pour la taille de la papille, la surface de l’anneau neurorétinien est très variable entre les individus et selon les méthodes de mesure utilisées. Dans une étude sur photographies du nerf optique d’une population normale, Jonas et al. [26] avaient retrouvé des mesures normales allant de 0,80 à 4,66 mm2, avec une mesure moyenne de 1,97 ± 0,50 mm2. La surface de l’anneau neurorétinien est néanmoins corrélée à la taille de la papille, une grande papille ayant un grand anneau neurorétinien et inversement [60].
L’anneau neurorétinien est en général plus large dans sa partie inférieure, suivi par sa partie supérieure, puis nasale et temporale [26], mais il existe de nombreuses variations physiologiques notamment pour les papilles de grande et petite tailles. Cette forme de l’anneau neurorétinien peut s’expliquer par plusieurs facteurs : (i) la distribution des fibres nerveuses rétiniennes dans le nerf optique ; (ii) la localisation de la fovéa légèrement inférieure par rapport au nerf optique (0,53 ± 0,34 mm) ; (iii) la morphologie de la lame criblée, avec les pores les plus larges dans les régions inférieures et supérieures comparées aux régions nasales et temporales ; et (iv) le diamètre des artérioles rétiniennes qui est plus grand au niveau de l’arcade inféro-temporale que supéro-temporale [24, 60].
Également appelé anneau scléral d’Elschnig, il apparaît comme une ligne blanche circulaire. Il délimite la papille avec l’anneau neurorétinien en dedans et la zone péripapillaire en dehors. Il est plus visible chez les sujets porteurs d’une atrophie optique.
La zone péripapillaire peut être le siège d’une atrophie choriorétinienne qui est habituellement séparée en deux zones : la zone périphérique ou zone alpha (α) et la zone bêta (β) qui est située entre la zone α et l’anneau scléral péripapillaire (fig. 6-3) [32]. La zone α correspond à un amincissement de la couche choriorétinienne péripapillaire et apparaît cliniquement comme une zone de pigmentation irrégulière [30, 54]. Elle est retrouvée avec une taille variable pour 83,9 % des yeux de sujets normaux [30]. La zone β correspond à une atrophie importante de l’épithélium pigmenté et de la choriocapillaire avec une visualisation accrue des vaisseaux choroïdiens et de la sclère adjacente à l’anneau scléral péripapillaire (voir fig. 6-3) [30, 54]. Elle est plus rare que la zone α car elle est retrouvée dans approximativement 17 % des yeux [30, 58]. La surface de ces deux zones augmente avec l’âge à une vitesse d’approximativement 0,21 mm2/10 ans et est corrélée à la taille de la papille [63].
Les deux zones α et β sont décrites chez les sujets normaux comme chez les sujets glaucomateux. Chez les sujets normaux, ces zones sont plus fréquemment observées et plus larges dans le secteur temporal horizontal puis dans le secteur temporal inférieur et temporal supérieur. Elles sont beaucoup plus rares en nasal. Chez les yeux glaucomateux, la zone β est observée plus fréquemment [58, 64], et les deux zones α et β sont significativement plus larges que chez les sujets normaux [32]. Dans l’étude Beijing Eye Study, la surface de la zone β étaient significativement plus grande chez les sujets glaucomateux par rapport aux sujets normaux : 1,21 ± 1,92 mm2 et 0,32 ± 0,99 mm2, respectivement [64].
Grâce aux techniques d’imagerie les plus récentes comme la tomographie en cohérence optique mais aussi en histologie, cette séparation de l’atrophie péripapillaire en deux zones α et β est maintenant discutée [28]. Il a ainsi été observé chez des yeux myopes, entre la zone β (caractérisée par la présence de la membrane de Bruch) et le bord du nerf optique, une zone appelée γ (gamma) composée simplement de la sclère et de la couche des fibres nerveuses rétiniennes. Une zone appelée δ (delta), présente uniquement dans les yeux très fortement myopes, correspondrait quant à elle à la partie centrale de la zone γ au sein de laquelle aucun vaisseau de plus de 50 μm ne serait présent et qui aurait une taille minimale de 300 μm [28].

Fig. 6-3 Photographie d’une papille avec une atrophie péripapillaire.
La zone péripapillaire est habituellement séparée en deux zones : la zone périphérique ou zone α (A) et la zone β (B) qui est située entre la zone α et l’anneau scléral péripapillaire. La zone α correspond à un amincissement de la couche choriorétinienne péripapillaire. La zone β correspond à une atrophie importante de l’épithélium pigmenté et de la choriocapillaire avec une visualisation accrue des vaisseaux choroïdiens et de la sclère adjacente à l’anneau scléral péripapillaire. (Collection Y. Wang, Beijing Institute of Ophthalmology, Pékin, Chine.)
Des différences dans la morphologie des papilles ont été observées en fonction de l’origine ethnique. Plusieurs études ont ainsi observé des papilles de plus grande surface avec de plus grandes excavations et un rapport C/D plus élevé chez les sujets d’origine africaine par rapport aux autres origines ethniques [23, 58]. La surface moyenne de la papille serait ainsi mesurée entre 1,84 et 2,50 mm2 avec une excavation de 0,57-0,95 mm2 chez les sujets d’origine africaine, entre 1,97 et 2,67 mm2 avec une excavation de 0,47-0,93 mm2 chez les sujets d’origine asiatique, et entre 1,65 et 2,34 mm2 avec une excavation de 0,12-0,70 mm2 chez les sujets d’origine caucasienne [58]. Mansour et al. [39] ont aussi mesuré la taille de la papille dans différents groupes ethniques et ont observé que les sujets blancs et hispaniques avaient des nerfs optiques plus petits que les sujets d’origine asiatique ou indienne, les sujets d’origine africaine ayant les plus grandes papilles. La surface de la papille serait ainsi 12 % plus large chez les sujets d’origine africaine par rapport aux sujets caucasiens [62]. Ces résultats sont également retrouvés pour le diamètre de la papille.
Les résultats concernant l’existence de différences morphologiques entre les papilles des hommes et des femmes sont discordants [60]. Par ailleurs, dans les études retrouvant une différence, celle-ci était faible [23]. Dans la vaste étude épidémiologique Framingham Study qui portait sur plus de 10 000 sujets, il a néanmoins été retrouvé que les femmes avaient un rapport C/D horizontal et vertical plus petit que les hommes [36].
Des études ont montré qu’une myopie ou une hypermétropie faible (– 5 à + 5 dioptries) ne semblait pas influencer la taille du disque optique [26]. Néanmoins, en dehors de ces limites, la myopie forte serait significativement associée à des papilles de plus grande taille et les hypermétropies fortes à des papilles de plus petite taille [27, 58, 60, 62].
Avec l’âge, une diminution progressive du nombre de fibres nerveuses rétiniennes a été démontrée [29, 55, 60]. Ces résultats pourraient être corrélés à l’observation clinique de l’élargissement progressif du rapport C/D et de la diminution de la surface de l’anneau neurorétinien liés à l’âge, en dehors de l’existence d’un glaucome [60]. Néanmoins, ils ne sont pas retrouvés de manière constante [43]. L’âge ne semble pas être un facteur influençant la taille de la papille.
La papille ou tête du nerf optique est une zone de transition à travers laquelle les axones des cellules ganglionnaires rétiniennes quittent le globe oculaire pour former le nerf optique. La tête du nerf optique peut être divisée au niveau histologique en quatre régions : la couche des fibres nerveuses rétiniennes, la portion prélaminaire, la portion laminaire ou lame criblée, et la portion rétrolaminaire (fig. 6-4).

Fig. 6-4 Schéma d’une coupe de la papille et du canal scléral.
La partie la plus antérieure de la tête du nerf optique correspond à la couche des fibres nerveuses rétiniennes. Elle est constituée par les axones des cellules ganglionnaires dans leur transition de la rétine superficielle à la composition neuronale du nerf optique. Le nombre moyen de fibres nerveuses rétiniennes est estimé à 1 200 000 avec des variations chez les sujets normaux allant de 750 000 à 1 500 000 axones [23, 29]. Le diamètre moyen des fibres nerveuses rétiniennes est approximativement de 1 μm (de 0,1 à 8,3 μm), avec des variations en fonction de leur localisation [30, 61]. Le diamètre des axones est ainsi significativement plus petit dans les régions temporales et internes du nerf optique par rapport aux régions nasales et externes [31, 41]. Certaines études ont retrouvé une corrélation entre le nombre de fibres nerveuses rétiniennes et la taille de la papille, mais ces résultats sont inconstants [30]. La variabilité du nombre de fibres nerveuses rétiniennes mais aussi la taille de la papille pourraient ainsi résulter du nombre de cellules ganglionnaires rétiniennes créées pendant l’embryogenèse et de leur régression jusqu’à la naissance.
L’organisation des axones des cellules ganglionnaires rétiniennes est bien systématisée lors de leur passage au niveau de la papille. Les fibres provenant des cellules ganglionnaires les plus périphériques cheminent à proximité de la choroïde et pénètrent en périphérie de l’anneau neurorétinien, alors que les fibres provenant des cellules ganglionnaires proches de la papille cheminent à proximité du vitré et occupent une portion plus centrale dans la papille [53] (fig. 6-5).
Le nombre de fibres nerveuses rétiniennes est corrélé à l’âge avec une perte physiologique de fibres nerveuses rétiniennes d’environ 5 500 par an (de 5 426 [49] à 5 637 [45]) [30], soit approximativement 0,3 % par an [29]. Il n’a pas été retrouvé de différence véritablement significative entre les genres concernant le nombre d’axones des cellules ganglionnaires [30].
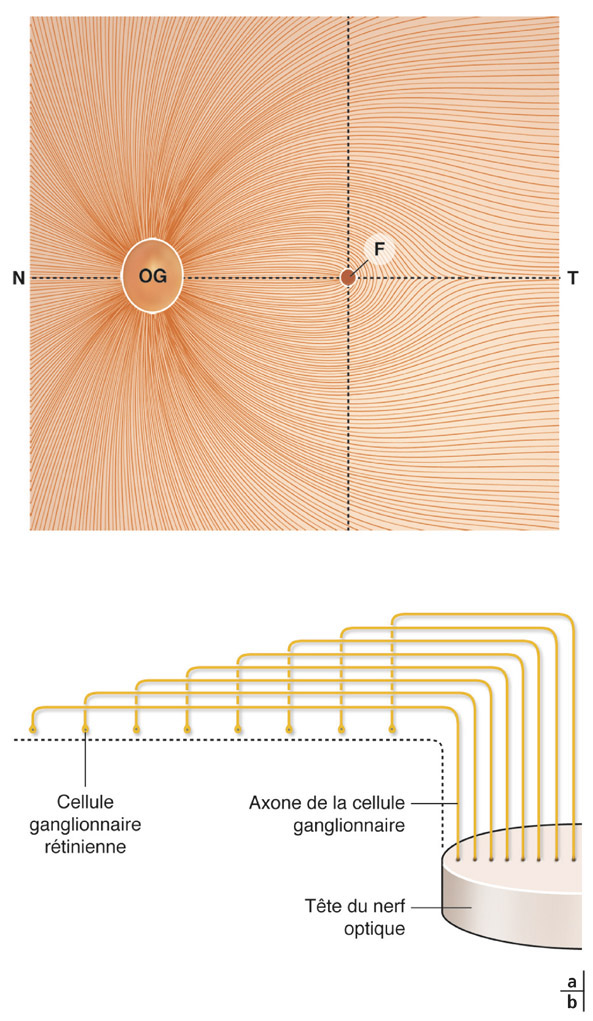
Fig. 6-5 a, b. Schéma de la disposition des axones des cellules ganglionnaires rétiniennes lors de leur passage au niveau de la tête du nerf optique. Les fibres provenant des cellules ganglionnaires les plus périphériques cheminent à proximité de la choroïde et pénètrent en périphérie de l’anneau neurorétinien alors que les fibres provenant des cellules ganglionnaires proches de la papille cheminent à proximité du vitré et occupent une portion plus centrale dans la papille. N : nasal ; OG : œil gauche ; F : fovéa ; T : temporal.
Elle est située juste en arrière de la couche des fibres nerveuses rétiniennes. Histologiquement, la portion prélaminaire de la papille est constituée des fibres nerveuses rétiniennes, des vaisseaux rétiniens et de cellules gliales. Les axones représentent 90 % du tissu constituant la papille à sa partie superficielle [14]. Les astrocytes sont les cellules gliales principales de la portion prélaminaire et sont organisées de manière plane perpendiculaire aux axones des cellules ganglionnaires rétiniennes. Ces cellules ont un rôle de support essentiel pour les axones des cellules ganglionnaires rétiniennes, à l’image des cellules de Müller de la rétine [30]. Les astrocytes forment également une interface séparant les axones des tissus conjonctifs avoisinants [30]. La proportion de tissu glial augmente d’approximativement 5 % au niveau de la couche superficielle des fibres nerveuses rétiniennes jusqu’à 12 à 17 % dans la région prélaminaire et jusqu’à 23 % au niveau de la lame criblée [40]. La matrice extracellulaire de la région prélaminaire est différente de celle de la lame criblée ; elle contient du collagène de type IV, de la laminine, de la fibronectine et du collagène de type III associés à la matrice extracellulaire de la paroi des vaisseaux sanguins [18].
La région laminaire correspond à la lame criblée et est en continuité avec les parois du canal scléral [14]. La fonction principale de la lame criblée est de permettre le passage des fibres nerveuses rétiniennes et des vaisseaux centraux de la rétine au travers du canal scléral tout en préservant ces structures du gradient de pression entre les espaces intra- et extra-oculaires [30].
Morphologiquement, la lame criblée est légèrement incurvée avec une concavité antérieure, ses couches internes communiquant avec le réseau glial prélaminaire et ses couches externes fusionnant avec les septums rétrobulbaires du nerf optique (fig. 6-6) [30]. La lame criblée correspond à un tamis à plusieurs étages constitué par le tiers antérieur de la sclère postérieure [14] (fig. 6-7). Dans les yeux normaux, la lame criblée mesure approximativement 237 μm de hauteur [51]. Elle est composée de fibres de collagène et élastiques qui s’entrecroisent en feuillets de tissus conjonctifs fenêtrés. Ces feuillets contiennent également des capillaires entourés par une membrane basale et quelques cellules d’aspect fibroblastiques appelées cellules de la lame criblée [20, 50, 51]. Ces lames de tissu conjonctif sont perforées par 200 à 400 orifices irréguliers de tailles variables (de 22,5 à 500 μm) [1], formant des canaux à travers lesquels les axones des cellules ganglionnaires passent [14, 30]. La taille de ces pores varie ainsi au niveau de la lame criblée : ils sont plus larges dans les parties inférieures et supérieures du nerf optique par rapport aux régions nasales et temporales [50]. Le nombre des pores de la lame criblée augmente en fonction de la profondeur au sein de la lame criblée : ils sont ainsi plus nombreux au niveau de la partie profonde de la lame criblée [44]. Des orifices centraux plus larges permettent le passage de l’artère et de la veine centrale de la rétine. Les orifices de la lame criblée sont parfois observés au fond de l’excavation de la tête du nerf optique. Les nouvelles techniques d’imagerie, comme l’optique adaptative [2] (fig. 6-8) ou encore l’imagerie en tomographie par cohérence optique [47] (fig. 6-9), permettent aussi de visualiser directement la lame criblée.
De composition différente de la matrice extracellulaire de la sclère, la matrice extracellulaire de la lame criblée est constituée de nombreuses fibres d’élastine, de collagène de types I, III et IV, de laminine et de protéoglycanes [5, 18]. L’organisation des fibres d’élastine de la lame criblée serait essentielle au rôle mécanique de protection des fibres nerveuses rétiniennes qui la traversent, notamment vis-à-vis des modifications du gradient de pression translaminaire. Chez le sujet jeune, la matrice extracellulaire de la lame criblée correspond à celle d’un tissu compliant qui serait résilient aux changements mécaniques aigus dus aux fluctuations de la PIO. Le corps des feuillets de la lame criblée contient de nombreuses fibres d’élastine, un réseau de membrane basale filamenteuse et du collagène fibrillaire de types I et III [18]. Séparant le corps de ces feuillets cribriformes des astrocytes qui les entourent, on retrouve une couche bien définie et continue composée de collagène IV, de laminine et de protéoglycanes [5] (fig. 6-10). Ces structures lamellaires, qui correspondent à la membrane basale des astrocytes, s’étendent de manière linéaire au sein du corps des feuillets cribriformes, formant ainsi un réseau de matériel filamenteux [13, 20]. La zone d’insertion de la lame criblée au niveau de la sclère contient des fibres élastiques disposées de manière concentrique circonférentielle et arrangées de manière serrée autour des régions laminaires et prélaminaires de la tête du nerf optique. Dans sa partie externe, la portion intralaminaire du nerf optique est recouverte par le tissu de Jacoby qui correspond à des couches verticales de tissu conjonctif et d’astrocytes entourant et séparant le nerf optique du tissu péripapillaire adjacent [30]. Les fibres élastiques de la lame criblée sont en continuité ou proviennent de ces fibres élastiques périphériques [13, 18, 20]. Les astrocytes de la lame criblée ont également des prolongements qui viennent s’insérer dans les fibres élastiques de la zone d’insertion et forment ainsi un véritable ancrage [18]. Ce réseau élastique de la lame criblée pourrait expliquer la réversibilité de l’excavation parfois observée lors d’une diminution importante de la pression intra-oculaire chez les sujets jeunes [18, 52]. Avec le vieillissement, la densité de la matrice extracellulaire augmente au niveau de la lame criblée. On note une augmentation de la quantité de collagène I, III et IV [18, 19]. Il a également été montré que, chez les sujets jeunes, les fibres élastiques sont longues et fines et orientées longitudinalement dans les feuillets de la lame criblée. Avec l’âge, la densité d’élastine semble augmenter [19] et les fibres élastiques deviennent plus épaisses, prenant un aspect tubulaire [22]. Un autre composant important de la matrice extracellulaire de la lame criblée est représenté par les protéoglycanes [5, 18]. Ces molécules seraient particulièrement importantes pour la fonction mécanique de soutien de la lame criblée. Avec l’âge, la composition de ces protéoglycanes dans la lame criblée se modifierait, diminuant la capacité de résilience de la lame criblée [5, 18].
Les astrocytes sont les cellules gliales prédominantes au niveau de la tête du nerf optique [21]. Ils forment une couche continue qui entoure les orifices de la lame criblée et communiquent par l’intermédiaire de jonctions cellulaires pour former un réseau protecteur pour les axones des CGR [21]. À l’image de la région prélaminaire, les astrocytes isolent au sein des septums de la lame criblée les axones les uns des autres et du tissu conjonctif adjacent, y compris des vaisseaux sanguins [30]. Les astrocytes peuvent être distingués en fonction de leur expression de molécules d’adhésion en deux populations : ceux qui recouvrent les tubes gliaux qui guident les axones au sein de la lame criblée, et ceux qui recouvrent les feuillets de la lame criblée [21]. Leur position entre la lame criblée et les axones leur confère un rôle essentiel pour transférer à ces derniers les modifications de la lame criblée (voir fig. 6-10) (voir chapitre 8-II). Les astrocytes ont un rôle fonctionnel important en maintenant l’environnement extracellulaire constant afin de permettre les échanges ioniques impliqués dans la conduction du potentiel d’action par les axones des CGR. Ils sont aussi essentiels pour le maintien des feuillets de la lame criblée, où ils sont impliqués dans la production de collagène et d’élastine qui contribuent à l’intégrité structurelle de la lame criblée [21]. Enfin, les astrocytes fabriquent la membrane basale qui recouvre le corps des feuillets de la lame criblée.
En plus des astrocytes, une autre population de cellules a été identifiée au sein de la lame criblée [42]. Elles ont été classées en cellules gliales mais n’expriment pas le GFAP (glial fibrillary acid protein) [35]. Ces cellules ont une forme étoilée et sont situées au sein des feuillets de la lame criblée, mais leur relation exacte avec les CGR demeure non précisée ; elles pourraient toutefois intervenir dans le remodelage de la lame criblée dans le glaucome [42].
L’artère et la veine centrale de la rétine sont entourées d’une gaine conjonctive périvasculaire et fixées l’une à l’autre et au tissu conjonctif qui forme les bords de la lame criblée. L’endothélium capillaire est à ce niveau continu et non fenêtré [14, 30].
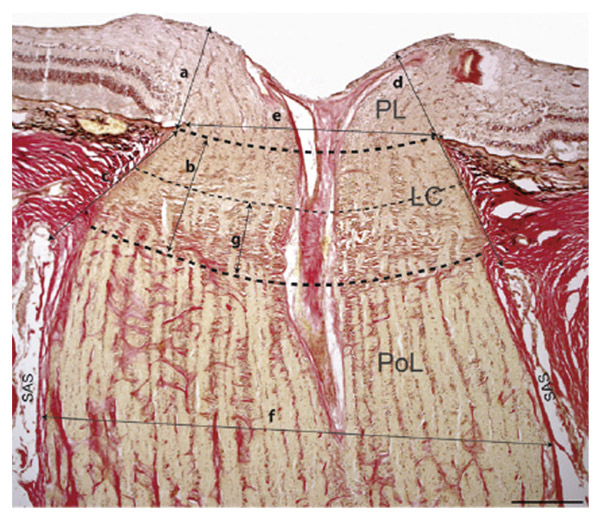
Fig. 6-6 Coupe histologique d’une papille normale montrant les paramètres d’analyse histomorphométrique. Épaisseur prélaminaire (a), épaisseur totale de la lame criblée (b), distance entre la surface antérieure de la lame criblée et l’espace sous-arachnoïdien (c), distance entre la membrane limitante interne et l’espace sous-arachnoïdien (d), diamètre du nerf optique au niveau du canal scléral (e) et 1 mm en arrière de la lame criblée, épaisseur de la partie postérieure de la lame criblée (g). SAS : espace sous-arachnoïdien ; LC : lamina cribrosa ; PL : région prélaminaire ; PoL : région post-laminaire. (D’après Balaratnasingam C, Morgan WH, Johnstone V, Pandav SS, Cringle SJ, Yu DY. Histomorphometric measurements in human and dog optic nerve and an estimation of optic nerve pressure gradients in human. Exp Eye Res. 2009 ; 89 : 618-28. Reproduction autorisée.)
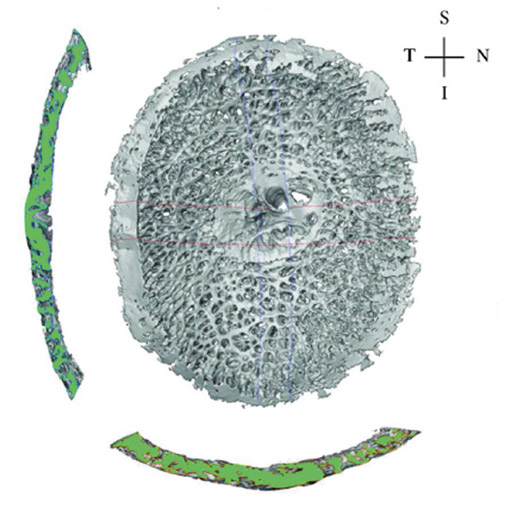
Fig. 6-7 Reconstruction en trois dimensions du tissu conjonctif de la lame criblée chez le singe. S : supérieur ; I : inférieur ; N : nasal ; T : temporal.
(D’après Grytza R, Girkin CA, Libertiaux V, Crawford Downs J. Perspectives on biomechanical growth and remodeling mechanisms in glaucoma. Mechanics Research Communications. 2012 ; 42 : 92-106. Reproduction autorisée.)
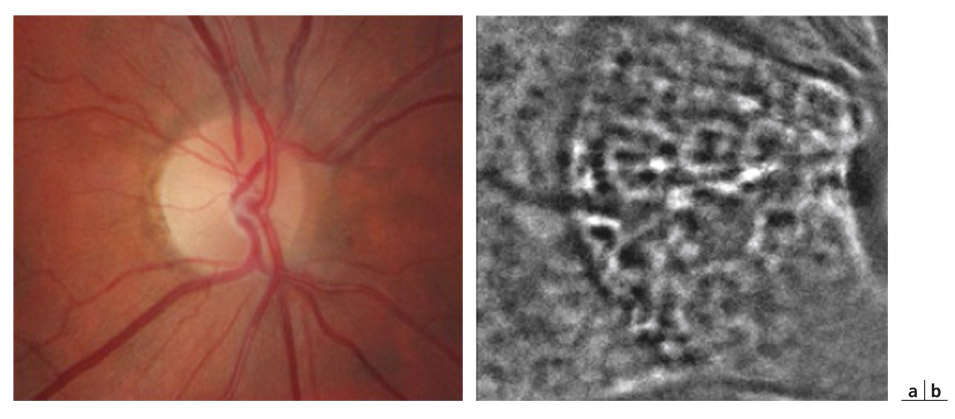
Fig. 6-8 Photographie d’une papille normale (a). Image en optique adaptative de la même papille montrant la lame criblée (b) (RTX1, Imagine Eyes, Orsay, France). (Collection S. Carette Zwillinger.)
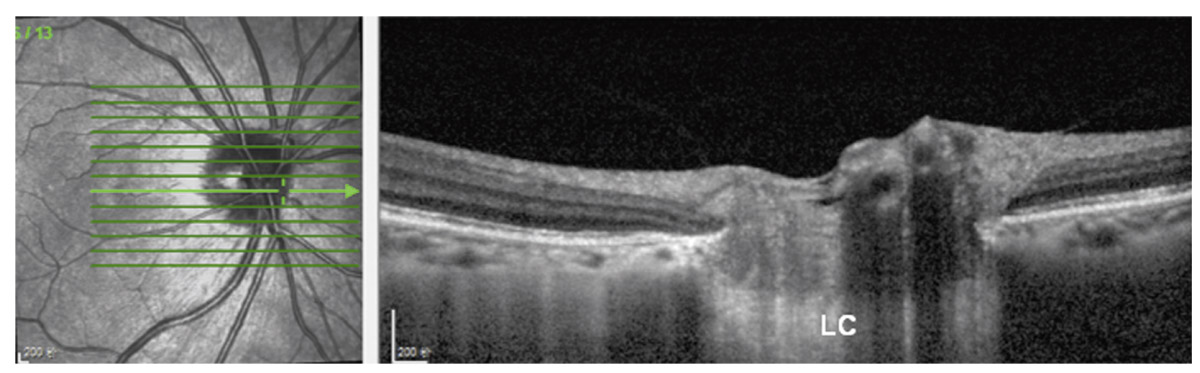
Fig. 6-9 Image en tomographie par cohérence optique de la papille et de la lame criblée (LC) chez un sujet normal. (Collection Y. Wang, Beijing Institute of Ophthalmology, Pékin, Chine.)

Fig. 6-10 Représentation schématique d’une section de la lame criblée montrant les relations entre les astrocytes, le collagène, l’élastine, les cellules endothéliales, les membranes basales et les fibres nerveuses adjacentes. (D’après Morrison JC, L’Hernaut NL, Jerdan JA, Quigley HA. Ultrastructural location of extracellular matrix components in the optic nerve head. Arch Ophthalmol. 1989 ; 107 : 123-29.)
La portion rétrolaminaire du nerf optique commence à la partie postérieure de la lame criblée ; elle est marquée par le début de la myélinisation axonale et est entourée par les gaines méningées du système nerveux central [14, 30]. La myélinisation des axones postérieure à la lame criblée augmente la taille du nerf optique jusqu’à 3 à 4 mm, soit deux à trois fois la taille de la papille [61]. La portion rétrolaminaire est composée par les axones des cellules ganglionnaires rétiniennes, par les oligodendrocytes qui forment la couche de myéline autour de ces axones, par les astrocytes qui recouvrent les fibres myélinisées et les séparent du tissu conjonctif voisin, y compris les vaisseaux sanguins, et enfin par les septums du nerf optique qui divisent incomplètement les fibres nerveuses rétiniennes en faisceaux et ont une fonction nutritionnelle et de support [14, 30]. Au centre de la portion distale du nerf optique se trouvent également les vaisseaux rétiniens centraux. Enfin, en périphérie, les gaines du nerf optique séparent le nerf optique de la sclère avec, de l’intérieur vers l’extérieur, la pie-mère, l’arachnoïde et la dure-mère. Les gaines méningées qui entourent le nerf optique réalisent un espace qui communique avec le système ventriculaire cérébral [14, 30]. Le gradient de pression translaminaire (entre la pression intra-oculaire et la pression du liquide céphalorachidien rétrobulbaire) jouerait certainement un rôle crucial dans la neuropathie optique glaucomateuse, en particulier dans les glaucomes à pression dite normale (voir chapitre 8-II) [24].
Dans la région rétrolaminaire, la matrice extracellulaire des septums est continue et a des caractéristiques similaires à celles de la pie-mère [18]. La membrane basale de ces septums est par ailleurs en continuité avec la membrane basale des feuillets de la lame criblée. Il y a donc une transition entre l’organisation transversale de la matrice extracellulaire de la lame criblée et les colonnes longitudinales des septums rétrolaminaires [20].
Le réseau artériel de la partie antérieure du nerf optique provient entièrement des branches de l’artère ophtalmique, une branche de la carotide interne [14]. La portion orbitaire de l’artère ophtalmique vascularise ainsi la majeure partie du globe oculaire par les branches de l’artère centrale de la rétine et les artères ciliorétiniennes (fig. 6-11). Il existe de très nombreuses variations individuelles dans la vascularisation de la portion antérieure du nerf optique et de la région péripapillaire, la description exacte de celle-ci demeurant toujours un sujet de controverse [8, 17]. Parallèlement, le drainage veineux de la portion antérieure du nerf optique ne s’effectue que par une seule veine : la veine centrale de la rétine.
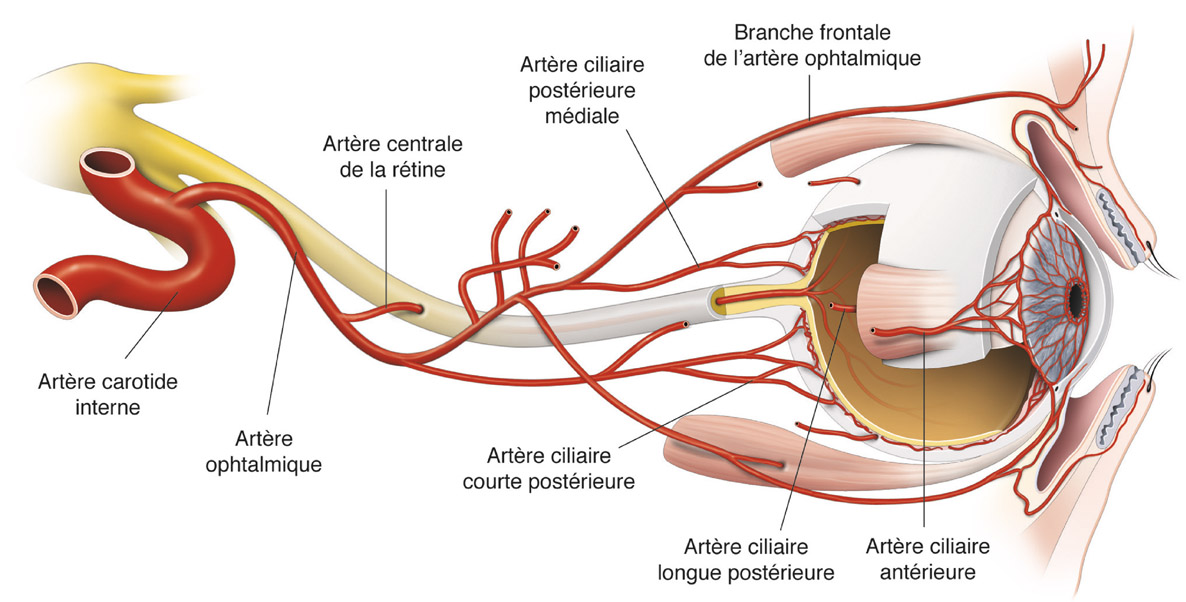
Fig. 6-11 Schéma de la vascularisation de l’orbite et de l’œil. La carotide interne vascularise l’orbite et le globe oculaire par l’intermédiaire de branches de l’artère ophtalmique.
La plupart des individus ont entre deux et trois (de une à cinq) artères ciliaires postérieures qui proviennent de l’artère ophtalmique au niveau de la partie postérieure de l’orbite [14, 17, 38, 46]. Ces artères ciliaires postérieures sont organisées le plus souvent en deux contingents latéral et médial qui donnent ensuite les artères ciliaires longues postérieures et les artères ciliaires courtes postérieures. Les artères ciliaires longues postérieures avancent antérieurement en dehors du globe oculaire avant de pénétrer la sclère pour vasculariser l’iris, le corps ciliaire et la région antérieure de la choroïde. Les artères ciliaires postérieures se dirigent antérieurement avant de se diviser en dix à vingt artères ciliaires courtes postérieures juste avant de pénétrer dans la sclère entourant le nerf optique [14, 17, 38, 46]. Quelques artères ciliaires courtes postérieures se projettent sans se diviser directement au travers de la sclère dans la choroïde, et d’autres se divisent dans la sclère pour donner des branches qui vascularisent la choroïde et la tête du nerf optique. Les artères ciliaires courtes postérieures vascularisent ainsi la choroïde péripapillaire et la plus grande partie de la portion antérieure du nerf optique (voir fig. 6-11 et fig. 6-12). Certaines branches des artères ciliaires courtes postérieures peuvent confluer pour former un cercle artériel microscopique au sein des espaces scléraux péripapillaires, le cercle artériel de Zinn-Haller. Ce cercle artériel, qui peut entourer complètement le nerf optique, serait le plus souvent incomplet [8, 17]. Excepté pour la couche superficielle des fibres nerveuses de la tête du nerf optique dont la vascularisation provient de l’artère centrale de la rétine, pour quelques branches rétrolaminaires de l’artère centrale de la rétine et quelques branches provenant de la vascularisation choroïdienne, le système artériel principal de la partie antérieure du nerf optique provient des artères ciliaires courtes postérieures [17, 46].
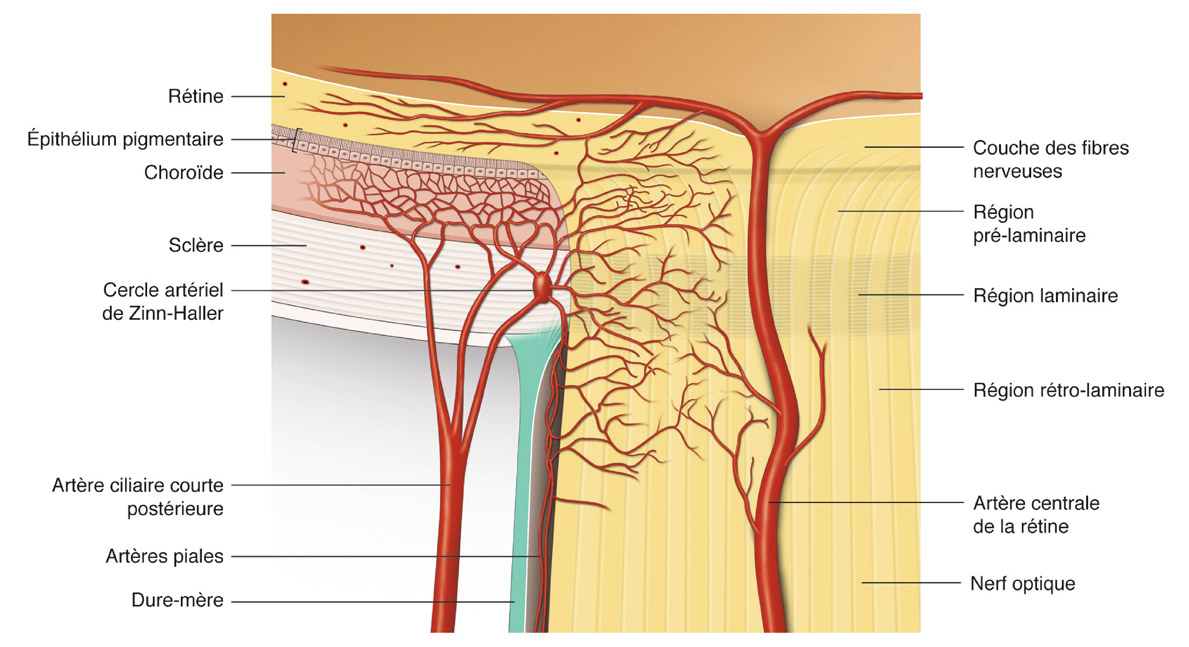
Fig. 6-12 Schéma de la vascularisation artérielle de la tête du nerf optique. (D’après Cioffi GA, Van Buskirk EM. Vasculature of the anterior optic nerve and peripapillary choroid. Vasculature of the anterior optic nerve and peripapillary choroid. In : Ritch R, Shields BM, Krupin T (eds). The glaucomas, basic sciences. St Louis, Mosby, 1996 : 177-88.)
C’est aussi une branche orbitaire postérieure de l’artère ophtalmique. Elle pénètre le nerf optique approximativement 10 à 15 mm en arrière du globe oculaire et toujours à sa face inférieure [14]. L’artère centrale de la rétine progresse antérieurement, adjacente à la veine centrale de la rétine dans la portion centrale du nerf optique. L’artère centrale de la rétine vascularise en premier lieu la rétine et la portion la plus superficielle de la papille. Elle n’a pratiquement aucune branche intranerveuse, excepté occasionnellement dans sa partie rétrolaminaire [8, 46] (voir fig. 6-12). Certains auteurs ont ainsi décrit des collatérales intraneurales qui partent perpendiculairement du tronc de l’artère centrale de la rétine vers la périphérie, mais leur nombre serait très variable et leur présence limitée à la région rétrolaminaire du nerf optique [16, 17]. Des branches piales provenant de la face antérieure de l’artère centrale de la rétine peuvent parfois également contribuer à la vascularisation de la tête du nerf optique. Elles progressent à la surface du nerf optique et se divisent en de très nombreuses branches collatérales terminales qui naissent perpendiculairement et pénètrent dans le nerf optique [14]. Enfin, l’artère ophtalmique et les artères ciliaires postérieures pourraient aussi dans certains cas contribuer à la vascularisation de la tête du nerf optique [46].
La couche superficielle des fibres nerveuses rétiniennes est principalement vascularisée par des artérioles récurrentes provenant des branches péripapillaires des artères rétiniennes [38] (voir fig. 6-12). Ces petites artères qui se dirigent vers le centre de la tête du nerf optique sont appelées vaisseaux épipapillaires [8]. Les capillaires provenant de ces vaisseaux sont continus avec les capillaires rétiniens de la périphérie de la papille et ont aussi des anastomoses postérieures avec les capillaires de la portion prélaminaire de la tête du nerf optique [17]. La zone temporale de la couche des fibres nerveuses rétiniennes peut aussi avoir une contribution artérielle d’une artère ciliorétinienne lorsqu’elle celle-ci est présente [8, 17]. Il n’y a pas de contribution directe choroïdienne au niveau de la couche superficielle des fibres nerveuses [38]. Les vaisseaux de la couche des fibres nerveuses rétiniennes sont, comme ceux de la rétine et du nerf optique, non fenêtrés, et les jonctions serrées entre les cellules endothéliales font partie de la barrière hématorétinienne [14].
Pour certains auteurs, la région prélaminaire recevrait sa vascularisation par des branches directes des artères ciliaires courtes postérieures et par des branches provenant du cercle artériel de Zinn-Haller lorsque celui-ci est présent (voir fig. 6-12) [7, 8, 38]. Pour d’autres, comme Hayreh et al. [16, 17], celle-ci proviendrait de fines branches centripètes issues de la choroïde péripapillaire. Des branches provenant des artères ciliaires courtes postérieures peuvent également traverser la choroïde pour vasculariser la région prélaminaire [38]. L’artère centrale de la rétine ne semble pas participer à la vascularisation de la région prélaminaire [7, 17].
La région laminaire est ainsi vascularisée par les artères ciliaires courtes postérieures soit directement, soit par l’intermédiaire du cercle artériel de Zinn-Haller [7, 8, 16, 17, 37]. La région laminaire est la région la plus richement vascularisée de la tête du nerf optique. Les artérioles précapillaires perforent les bords externes de la lame criblée avant de se diviser en un réseau capillaire intraseptal [16, 17, 38] (voir fig. 6-12). Des artères se divisent également en provenance du système ciliaire court postérieur pour s’anastomoser aux artères piales, qui contribuent aussi à la vascularisation de la région laminaire [17]. La choroïde péripapillaire ne contribuerait qu’occasionnellement à la vascularisation de la région laminaire sans connexion véritable [8, 46]. L’artère centrale de la rétine ne donnerait aucune branche venant vasculariser la région de la lame criblée [8, 17].
La région rétrolaminaire est essentiellement vascularisée par des branches des artères piales et du système artériel ciliaire court postérieur (voir fig. 6-12) [7, 8, 16, 17, 37, 38]. Il existe ainsi une vascularisation centripète à partir du système vasculaire pial, ce dernier recevant des branches piales récurrentes provenant du cercle de Zinn-Haller et des artères ciliaires courtes postérieures, et parfois de la choroïde péripapillaire [17]. Des branches piales de l’artère centrale de la rétine ou d’autres artères orbitaires peuvent aussi contribuer à la vascularisation de la région rétrolaminaire dans certains cas [16, 17]. Alors que l’artère centrale de la rétine ne contribue pas aux régions prélaminaires et laminaires, elle contribue parfois avec de petites branches centrifuges à la région rétrolaminaire [38]. Ces artères s’anastomosent avec le réseau capillaire formé par les artères piales et les artères ciliaires courtes postérieures.
La couche la plus interne de la choroïde, la choriocapillaire, est composée d’un riche réseau anastomotique de capillaires fenêtrés qui débutent à la limite de la papille. Les capillaires de la choriocapillaire sont séparés et distincts de ceux de la tête du nerf optique. La plupart des études montrent que la choroïde péripapillaire est vascularisée principalement par des branches des artères ciliaires courtes postérieures directement ou via le cercle de Zinn-Haller [7, 8, 37]. La choroïde péripapillaire peut également donner de petites branches au niveau des régions prélaminaires et laminaires de la tête du nerf optique [17].
Alors qu’il existe un réseau vasculaire artériel très développé provenant de nombreux vaisseaux, le drainage veineux de la portion antérieure du nerf optique ne s’effectue principalement que par une seule veine : la veine centrale de la rétine [8, 14]. Dans la couche des fibres nerveuses rétiniennes, le sang est drainé directement dans les veines rétiniennes qui se rejoignent pour former la veine centrale de la rétine (fig. 6-13). Dans la portion prélaminaire, laminaire et rétrolaminaire, le drainage veineux se fait également par la veine centrale de la rétine ou des efférentes axiales de la veine centrale de la rétine [7, 8]. Dans la région prélaminaire, de petites veinules connectant le nerf optique aux veines de la choroïde péripapillaire ont été également identifiées [17]. En périphérie de la région laminaire et rétrolaminaire, le drainage veineux peut aussi se faire via les veines piales. Celles-ci se jettent finalement dans la veine centrale de la rétine lorsqu’elle sort du nerf optique. Parce que la veine centrale de la rétine est le principal système de drainage de la tête du nerf optique, un flux sanguin centripète est créé au sein du nerf optique. Ce flux n’est retrouvé que chez l’homme et les primates [7].
Pour le drainage de la choroïde péripapillaire, des veines choroïdiennes émergent approximativement 200 à 300 microns en périphérie du nerf optique. Elles se drainent dans le système vortiqueux [8]. À l’inverse du nerf optique, il existe donc un flux centrifuge de sang dans la région choroïdienne péripapillaire.

Fig. 6-13 Schéma du drainage veineux de la tête du nerf optique. (D’après Cioffi GA, Van Buskirk EM. Vasculature of the anterior optic nerve and peripapillary choroid. Vasculature of the anterior optic nerve and peripapillary choroid. In : Ritch R, Shields BM, Krupin T (eds). The glaucomas, basic sciences. St Louis, Mosby, 1996 : 177-88.)
Les capillaires de la rétine péripapillaire, de la partie superficielle du nerf optique, de la tête du nerf optique et de la région rétrolaminaire sont anatomiquement confluents et forment un réseau vasculaire non fenêtré continu tout le long de la portion antérieure du nerf optique [38]. La choriocapillaire péripapillaire ne s’anastomose cependant pas avec les plexus capillaires dans la région prélaminaire [17]. Par ailleurs, il existe des différences dans l’organisation de ces capillaires dans la portion antérieure de la tête du nerf optique et au niveau de la lame criblée. Alors que les capillaires de la région prélaminaire et rétrolaminaire ont une organisation irrégulière et complexe (capillaires longitudinaux et transverses), ceux de la région laminaire sont à l’image de l’organisation des septums du tissu conjonctif de la lame criblée, organisés principalement de manière transverse [17, 37, 50]. Les précapillaires périphériques à la lame criblée se branchent ainsi aux capillaires intralaminaires au sein de ces septums pour former un réseau polygonal (fig. 6-14). Les capillaires de la région rétrolaminaire sont moins organisés mais possèdent un riche réseau d’anastomoses avec les capillaires de la région laminaire.
La plupart des vaisseaux au niveau de la tête du nerf optique sont des capillaires avec quelques artérioles précapillaires, en particulier en périphérie du nerf [8, 16, 37]. Lorsque les artérioles pénètrent le nerf optique, une transition rapide se fait ainsi en artérioles précapillaires, puis en capillaires. Les artérioles ont une couche de muscle lisse limitée entourant les cellules endothéliales [8]. Les capillaires sont composés d’une couche unique de cellules endothéliales reliées entre elles par des jonctions serrées entourées d’un tissu glial de soutien et de péricytes intermittents [8]. La couche de muscle lisse et les péricytes des précapillaires et capillaires ont des capacités contractiles et pourraient avoir ainsi une activité vasomotrice locale [7, 8].
Les cellules gliales et les astrocytes en particulier pourraient jouer un rôle dans la régulation du message nerveux et dans la vascularisation [21]. Dans la région laminaire, les astrocytes recouvrent les espaces entre les lamelles de collagène et envoient des prolongements entre les fibres nerveuses rétiniennes. Ils recouvrent également les vaisseaux et sont concentrés sur les bords des tissus entourant le nerf optique. Cette proximité entre les astrocytes et les vaisseaux sanguins pourrait suggérer un rôle de régulation vasculaire pour les astrocytes au niveau de la tête du nerf optique [4, 38].
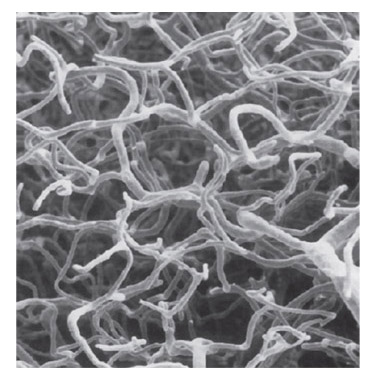
Fig. 6-14 Image du réseau microvasculaire de la région laminaire du primate sans la lame criblée. Les précapillaires périphériques à la lame criblée se branchent ainsi aux capillaires intralaminaires au sein de ces septums pour former un réseau polygonal. (D’après Mackenzie PJ, Cioffi GA. Vascular anatomy of the optic nerve head. Can J Ophthalmol. 2008 ; 43 : 308-12. Reproduction autorisée.)
De nombreuses études ont tenté d’évaluer le flux sanguin au niveau de la tête du nerf optique, mais il n’existe pas à ce jour une méthode réellement fiable pour le mesurer directement chez l’homme, en particulier au niveau des couches profondes de la tête du nerf optique [6, 15]. Les mécanismes qui sous-tendent les modifications du flux sanguin au niveau de la tête du nerf optique sont complexes et demeurent donc imparfaitement compris.
Dans un tissu vascularisé, le flux sanguin est directement proportionnel à la pression de perfusion. Le flux sanguin est ainsi égal au rapport pression de perfusion/résistance au flux. La pression de perfusion correspond à la différence de pression entre la pression artérielle moyenne et la pression veineuse. Au niveau de la tête du nerf optique et dans des conditions physiologiques, la pression intra-oculaire (PIO) peut remplacer la pression veineuse, généralement inférieure, pour l’évaluation de la pression de perfusion de la tête du nerf optique [15]. À l’état normal, le flux vasculaire dans la tête du nerf optique est donc dépendant des résistances au flux sanguin, à la pression artérielle et à la PIO [15].
Plusieurs études ont montré que la vascularisation de la tête du nerf optique était capable d’autorégulation, c’est-à-dire de maintenir le flux sanguin lorsque celle-ci est soumise à une modification modérée de sa pression de perfusion liée soit à une élévation de la PIO, soit à une variation de la pression artérielle [6, 59]. Une autorégulation du flux sanguin a ainsi été suggérée au niveau de la tête du nerf optique après l’observation chez les primates d’une redistribution de celui-ci au sein de la lame criblée en réponse à une élévation de la PIO [12]. Néanmoins, l’extrapolation de ces modèles vasculaires aux processus physiologiques chez l’homme demeure difficile. Quelques études se sont intéressées à cette autorégulation chez l’homme normal en utilisant le laser Doppler sur la surface de la tête du nerf optique. Riva et al. [56] ont ainsi rapporté une autorégulation du flux sanguin jusqu’à 40 mmHg, voire jusqu’à 45 mmHg pour Pillunat et al. [48]. Cependant, ces études mesurent surtout le flux sanguin dans la partie superficielle du nerf optique qui provient essentiellement de l’artère centrale de la rétine, et leur extrapolation à des mécanismes qui seraient mis en place plus profondément dans le nerf optique demeure incertaine. La pression artérielle n’étant pas modifiée par la PIO, un flux sanguin constant au niveau de la tête du nerf optique ne peut donc être obtenu que par une modification de la résistance vasculaire. Ces capacités d’autorégulation pourraient être liées, à l’image de sa régulation au niveau du système nerveux, à plusieurs mécanismes : métabolique, myogénique ou encore neurogène [6, 59]. Compte tenu de l’absence d’innervation autonome au niveau de la tête du nerf optique, les mécanismes métaboliques et myogéniques seraient prépondérants ; néanmoins, leur fonctionnement et leur rôle respectif ne sont pas encore clairement établis [15, 59].
Au-delà de cette autorégulation, il pourrait également exister, à l’image du flux sanguin au niveau de la rétine ou du cerveau, un couplage neurovasculaire du flux sanguin au niveau de la tête du nerf optique [4, 6]. Il correspond à la régulation du flux sanguin en réponse à la stimulation nerveuse. Chez l’animal mais aussi des sujets normaux, il a ainsi été observé une augmentation du flux sanguin au niveau de la rétine et de la tête du nerf optique lors de stimulations lumineuses de type flicker [11]. Les cellules gliales et en particulier les astrocytes qui sont en contact étroit avec les neurones, mais aussi avec la paroi des vaisseaux sanguins, pourraient jouer un rôle central dans ce mécanisme de régulation du flux sanguin au niveau de la tête du nerf optique [4]. De nouvelles techniques permettant de mesurer le flux sanguin dans des structures plus profondes de la tête du nerf optique sont néanmoins nécessaires pour préciser ces différents mécanismes de régulation et leur éventuelle relation avec la neuropathie optique glaucomateuse.
L’analyse de la papille est un élément central de l’examen d’un patient glaucomateux ou suspect de glaucome. Cependant, la papille observée en pratique clinique ne correspond qu’à la surface visible des tissus qui composent la tête du nerf optique. Les nouvelles techniques d’imagerie en tomographie par cohérence optique à domaine spectral (OCT-SD) semblent montrer aujourd’hui que cette analyse clinique ne correspondrait pas fidèlement à la réalité anatomique. Ces observations pourraient modifier non seulement notre examen clinique du nerf optique mais aussi les méthodes d’évaluation morphologique de la papille.
L’analyse de la papille dans le glaucome nécessite une identification précise de la limite externe et interne de l’anneau neurorétinien, c’est-à-dire le bord papillaire et l’excavation. Quelle que soit la technique d’imagerie utilisée – ophtalmoscopie directe, lampe à fente, photographie de la papille ou encore les techniques d’imagerie structurales –, elles sont toutes fondées sur l’analyse de l’anneau neurorétinien et dépendent donc de ses limites interne et externe. La papille est délimitée à sa partie externe par ce qui est traditionnellement décrit comme la limite interne de l’anneau scléral. Anatomiquement, c’est la disparition de la membrane de Bruch au niveau de la papille qui délimite le bord externe de l’anneau neurorétinien car les axones ne peuvent pas traverser une membrane de Bruch intacte. Cette ouverture de la membrane de Bruch, non visible lors de l’examen clinique, représente la limite externe réelle de la papille.
Les avancées récentes dans le domaine de l’imagerie par OCT-SD permettent maintenant de visualiser les structures anatomiques de la tête du nerf optique comme les surfaces antérieures et postérieures de la lame criblée, le complexe membrane de Bruch-épithélium pigmentaire rétinien ou encore l’ouverture du canal scléral. En superposant ces images aux structures observées cliniquement, il est maintenant possible de les identifier anatomiquement (fig. 6-15). Ces observations remettent en cause la validité de notre analyse clinique mais aussi des techniques d’imagerie de l’anneau neurorétinien. Ainsi, la limite externe visible cliniquement de l’anneau neurorétinien (ou de la papille) ne correspond pas obligatoirement à la limite externe de la membrane de Bruch qui détermine le véritable anneau neurorétinien. Des études récentes en OCT-SD chez l’homme ont ainsi montré que la limite papillaire externe du bord papillaire observée cliniquement ne correspond pas toujours à la limite anatomique réelle de la papille. Ces erreurs d’évaluation de la papille seraient également à l’origine d’erreurs de mesure quantitative par les analyseurs de la tête du nerf optique.
Ces résultats ouvrent de nouvelles perspectives pour l’analyse structurale de la tête du nerf optique dans le glaucome.
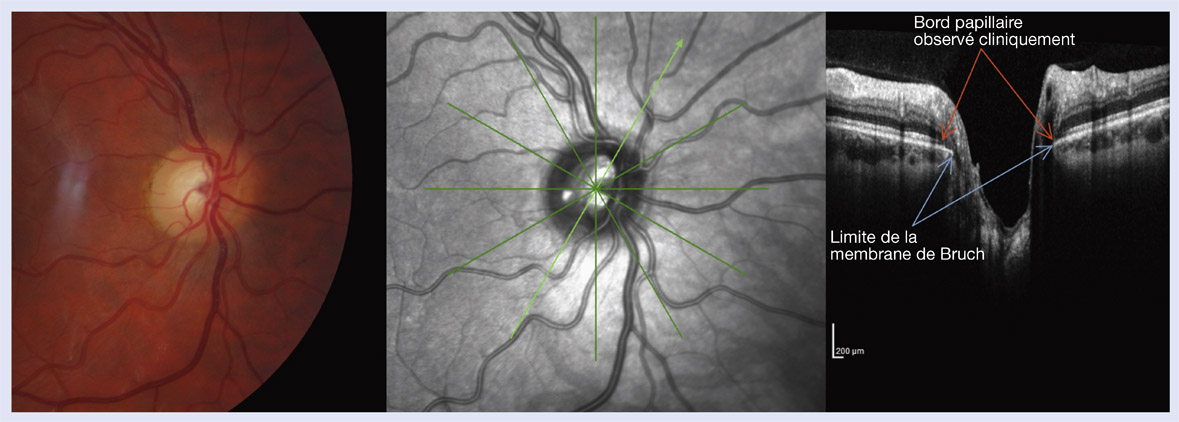
Fig. 6-15 Photographie d’une papille (à gauche). Image en infrarouge de la même papille (au centre). Coupe en OCT-SD de la papille montrant la limite observée cliniquement du bord papillaire et la limite de la membrane de Bruch (à droite).
Pour en savoir plus
[1] Chauhan BC, Burgoyne CF. From clinical examination of the optic disc to clinical assessment of the optic nerve head : a paradigm change. Am J Ophthalmol. 2013 ; 156 : 218-27.
[2] Chauhan BC, O’Leary N, Almobarak FA, et al. Enhanced detection of open angle glaucoma with an anatomically accurate optical coherence tomography-derived neuroretinal rim parameter. Ophthalmology. 2013 ; 120 : 535-43.
Retenir
La tête du nerf optique constitue une zone anatomique cruciale pour le nerf optique, notamment dans la physiopathologie des glaucomes.
L’atteinte des axones des cellules ganglionnaires rétiniennes au niveau de la lame criblée serait ainsi le principal mécanisme physiopathologique à l’origine de la neuropathie optique glaucomateuse.
[1] Airaksinen PJ, Drance SM. Neuroretinal rim area and retinal nerve fiber layer in glaucoma. Arch Ophthalmol. 1985 ; 103 : 203-4.
[2] Akagi T, Hangai M, Takayama K, et al. In vivo imaging of lamina cribrosa pores by adaptive optics scanning laser ophthalmoscopy. Invest Ophthalmol Vis Sci. 2012 ; 53 : 4111-9.
[3] Armaly MF. Genetic determination of cup/disc ratio of the optic nerve. Arch Ophthalmol. 1967 ; 78 : 35-43.
[4] Attwell D, Buchan AM, Charpak S, et al. Glial and neuronal control of brain blood flow. Nature. 2010 ; 468 : 232-43.
[5] Caparas VL, Cintron C, Hernandez-Neufeld MR. Immunohistochemistry of proteoglycans in human lamina cribrosa. Am J Ophthalmol. 1991 ; 112 : 489-95.
[6] Cherecheanu AP, Garhofer G, Schmidl D, et al. Ocular perfusion pressure and ocular blood flow in glaucoma. Curr Opin Pharmacol. 2013 ; 13 : 36-42.
[7] Cioffi GA, Van Buskirk EM. Microvasculature of the anterior optic nerve. Surv Ophthalmol. 1994 ; 38 (Suppl.) : S107-16 ; discussion : S16-7.
[8] Cioffi GA, Van Buskirk EM. Vasculature of the anterior optic nerve and peripapillary choroid. In : Ritch R, Shields BM, Krupin T (eds). The glaucomas, basic sciences. St Louis, Mosby, 1996 : 177-88.
[9] Crowston JG, Hopley CR, Healey PR, et al. Blue Mountains Eye S. The effect of optic disc diameter on vertical cup to disc ratio percentiles in a population based cohort : the Blue Mountains Eye Study. Br J Ophthalmol. 2004 ; 88 : 766-70.
[10] De Laage de Meux P. Ophtalmologie pédiatrique. Paris, Masson, 2003, 441 pages.
[11] Garhofer G, Zawinka C, Resch H, et al. Diffuse luminance flicker increases blood flow in major retinal arteries and veins. Vision Res. 2004 ; 44 : 833-8.
[12] Geijer C, Bill A. Effects of raised intraocular pressure on retinal, prelaminar, laminar, and retrolaminar optic nerve blood flow in monkeys. Invest Ophthalmol Vis Sci. 1979 ; 18 : 1030-42.
[13] Goldbaum MH, Jeng SY, Logemann R, Weinreb RN. The extracellular matrix of the human optic nerve. Arch Ophthalmol. 1989 ; 107 : 1225-31.
[14] Hamard H, Chevaleraud J, Rondot P. Neuropathies optiques. Paris, Masson, 1986.
[15] Hayreh SS. Blood flow in the optic nerve head and factors that may influence it. Prog Retin Eye Res. 2001 ; 20 : 595-624.
[16] Hayreh SS. Blood supply of the optic nerve head in health and disease. In : Lambrou GN, Greve EL (eds). Ocular blood flow in glaucoma. Amsterdam, Kugler and Ghedini, 1989 : 3-48.
[17] Hayreh SS. The blood supply of the optic nerve head and the evaluation of it – myth and reality. Prog Retin Eye Res. 2001 ; 20 : 563-93.
[18] Hernandez MR, Gong H. Extracellular matrix of the trabecular meschwork and optic nerve head. In : Ritch R, Shields BM, Krupin T (eds). The glaucomas : basic sciences. St Louis, Mosby, 1996 : 213-49.
[19] Hernandez MR, Luo XX, Andrzejewska W, Neufeld AH. Age-related changes in the extracellular matrix of the human optic nerve head. Am J Ophthalmol. 1989 ; 107 : 476-84.
[20] Hernandez MR, Luo XX, Igoe F, Neufeld AH. Extracellular matrix of the human lamina cribrosa. Am J Ophthalmol. 1987 ; 104 : 567-76.
[21] Hernandez MR. The optic nerve head in glaucoma : role of astrocytes in tissue remodeling. Prog Retin Eye Res. 2000 ; 19 : 297-321.
[22] Hernandez MR. Ultrastructural immunocytochemical analysis of elastin in the human lamina cribrosa. Changes in elastic fibers in primary open-angle glaucoma. Invest Ophthalmol Vis Sci. 1992 ; 33 : 2891-903.
[23] Hoffmann EM, Zangwill LM, Crowston JG, Weinreb RN. Optic disk size and glaucoma. Surv Ophthalmol. 2007 ; 52 : 32-49.
[24] Jonas JB, Budde WM, Panda-Jonas S. Ophthalmoscopic evaluation of the optic nerve head. Surv Ophthalmol. 1999 ; 43 : 293-320.
[25] Jonas JB, Gusek GC, Guggenmoos-Holzmann I, Naumann GO. Size of the optic nerve scleral canal and comparison with intravital determination of optic disc dimensions. Graefes Arch Clin Exp Ophthalmol. 1988 ; 226 : 213-5.
[26] Jonas JB, Gusek GC, Naumann GO. Optic disc, cup and neuroretinal rim size, configuration and correlations in normal eyes. Invest Ophthalmol Vis Sci. 1988 ; 29 : 1151-8.
[27] Jonas JB, Gusek GC, Naumann GO. Optic disk morphometry in high myopia. Graefes Arch Clin Exp Ophthalmol. 1988 ; 226 : 587-90.
[28] Jonas JB, Jonas SB, Jonas RA, et al. Parapapillary atrophy : histological gamma zone and delta zone. PloS One. 2012 ; 7 : e47237.
[29] Jonas JB, Muller-Bergh JA, Schlotzer-Schrehardt UM, Naumann GO. Histomorphometry of the human optic nerve. Invest Ophthalmol Vis Sci. 1990 ; 31 : 736-44.
[30] Jonas JB, Naumann GOH. The optic nerve : its embryology, histology, and morphology. In : Varma R, Spaeth GL, Parker KW (eds). The optic nerve in glaucoma. Philadelphia, J.B. Lippincott, 1993 : 3-26.
[31] Jonas JB, Nguyen NX, Naumann GO. The retinal nerve fiber layer in normal eyes. Ophthalmology. 1989 ; 96 : 627-32.
[32] Jonas JB, Nguyen XN, Gusek GC, Naumann GO. Parapapillary chorioretinal atrophy in normal and glaucoma eyes. I. Morphometric data. Invest Ophthalmol Vis Sci. 1989 ; 30 : 908-18.
[33] Jonas JB, Zach FM, Gusek GC, Naumann GO. Pseudoglaucomatous physiologic large cups. Am J Ophthalmol. 1989 ; 107 : 137-44.
[34] Jonas JB. Role of cerebrospinal fluid pressure in the pathogenesis of glaucoma. Acta Ophthalmol. 2011 ; 89 : 505-14.
[35] Kirwan RP, Leonard MO, Murphy M, et al. Transforming growth factor-beta-regulated gene transcription and protein expression in human GFAP-negative lamina cribrosa cells. Glia. 2005 ; 52 : 309-24.
[36] Leibowitz HM, Krueger DE, Maunder LR, et al. The Framingham Eye Study monograph : an ophthalmological and epidemiological study of cataract, glaucoma, diabetic retinopathy, macular degeneration, and visual acuity in a general population of 2631 adults, 1973-1975. Surv Ophthalmol. 1980 ; 24 (Suppl.) : 335-610.
[37] Lieberman MF, Maumenee AE, Green WR. Histologic studies of the vasculature of the anterior optic nerve. Am J Ophthalmol. 1976 ; 82 : 405-23.
[38] Mackenzie PJ, Cioffi GA. Vascular anatomy of the optic nerve head. Can J Ophthalmol. 2008 ; 43 : 308-12.
[39] Mansour AM. Racial variation of optic disc size. Ophthalmic Res. 1991 ; 23 : 67-72.
[40] Minckler DS, Tso MO. A light microscopic, autoradiographic study of axoplasmic transport in the normal rhesus optic nerve head. Am J Ophthalmol. 1976 ; 82 : 1-15.
[41] Minckler DS. Correlations between anatomic features and axonal transport in primate optic nerve head. Trans Am Ophthalmol Soc. 1986 ; 84 : 429-52.
[42] Morgan J. Pathogenesis of glaucomatous optic neuropathy. In : Shaarawy TM, Sherwood MB, Hitchings RA, Crowston JG (eds). Glaucoma. Londres, Saunders-Elsevier, 2009 : 45-54.
[43] Moya FJ, Brigatti L, Caprioli J. Effect of aging on optic nerve appearance : a longitudinal study. Br J Ophthalmol. 1999 ; 83 : 567-72.
[44] Ogden TE, Duggan J, Danley K, et al. Morphometry of nerve fiber bundle pores in the optic nerve head of the human. Exp Eye Res. 1988 ; 46 : 559-68.
[45] Ogden TE. Nerve fiber layer of the primate retina : morphometric analysis. Invest Ophthalmol Vis Sci. 1984 ; 25 : 19-29.
[46] Onda E, Cioffi GA, Bacon DR, Van Buskirk EM. Microvasculature of the human optic nerve. Am J Ophthalmol. 1995 ; 120 : 92-102.
[47] Park HY, Jeon SH, Park CK. Enhanced depth imaging detects lamina cribrosa thickness differences in normal tension glaucoma and primary open-angle glaucoma. Ophthalmology. 2012 ; 119 : 10-20.
[48] Pillunat LE, Anderson DR, Knighton RW, et al. Autoregulation of human optic nerve head circulation in response to increased intraocular pressure. Exp Eye Res. 1997 ; 64 : 737-44.
[49] Potts AM, Hodges D, Shelman CB, et al. Morphology of the primate optic nerve. I. Method and total fiber count. Invest Ophthalmol. 1972 ; 11 : 980-8.
[50] Quigley HA, Addicks EM. Regional differences in the structure of the lamina cribrosa and their relation to glaucomatous optic nerve damage. Arch Ophthalmol. 1981 ; 99 : 137-43.
[51] Quigley HA, Hohman RM, Addicks EM, et al. Morphologic changes in the lamina cribrosa correlated with neural loss in open-angle glaucoma. Am J Ophthalmol. 1983 ; 95 : 673-91.
[52] Quigley HA. The pathogenesis of reversible cupping in congenital glaucoma. Am J Ophthalmol. 1977 ; 84 : 358-70.
[53] Radius RL, Anderson DR. The histology of retinal nerve fiber layer bundles and bundle defects. Arch Ophthalmol. 1979 ; 97 : 948-50.
[54] Rensch F, Jonas JB. Direct microperimetry of alpha zone and beta zone parapapillary atrophy. Br J Ophthalmol. 2008 ; 92 : 1617-9.
[55] Repka MX, Quigley HA. The effect of age on normal human optic nerve fiber number and diameter. Ophthalmology. 1989 ; 96 : 26-32.
[56] Riva CE, Hero M, Titze P, Petrig B. Autoregulation of human optic nerve head blood flow in response to acute changes in ocular perfusion pressure. Graefes Arch Clin Exp Ophthalmol. 1997 ; 235 : 618-26.
[57] Rouland JF. Anatomie de la papille optique. Encycl Méd Chir (Paris, Elsevier), Ophtalmologie, 21-008-A-05, 1997.
[58] Samarawickrama C, Hong T, Jonas JB, Mitchell P. Measurement of normal optic nerve head parameters. Surv Ophthalmol. 2012 ; 57 : 317-36.
[59] Schmidl D, Garhofer G, Schmetterer L. The complex interaction between ocular perfusion pressure and ocular blood flow – relevance for glaucoma. Exp Eye Res. 2011 ; 93 : 141-55.
[60] Sing NM, Anderson SF, Townsend JC. The normal optic nerve head. Optom Vis Sci. 2000 ; 77 : 293-301.
[61] Varma R, Minckler DS. Anatomy and pathophysiology of the retina and optic nerve. In : Ritch R, Shields BM, Krupin T (eds). The glaucomas, basic sciences. St Louis, Mosby, 1996 : 139-75.
[62] Varma R, Tielsch JM, Quigley HA, et al. Race-, age-, gender-, and refractive error-related differences in the normal optic disc. Arch Ophthalmol. 1994 ; 112 : 1068-76.
[63] Wang Y, Xu L, Zhang L, et al. Peripapillary atrophy in elderly Chinese in rural and urban Beijing. Eye (Lond). 2008 ; 22 : 261-6.
[64] Xu L, Wang Y, Yang H, Jonas JB. Differences in parapapillary atrophy between glaucomatous and normal eyes : the Beijing Eye Study. Am J Ophthalmol. 2007 ; 144 : 541-6.
- Chapitre 6
Anatomie de la tête et de la portion antérieure du nerf optique

