J.-P. Renard, J.-P. Nordmann
Le système de classification des différents stades évolutifs du glaucome décrit en 2006 par R.P. Mills et al. est classiquement utilisé en pratique courante. Ils distinguent cinq stades cliniques en fonction du degré de l’atteinte fonctionnelle au niveau du relevé du champ visuel (tableau 12-1).
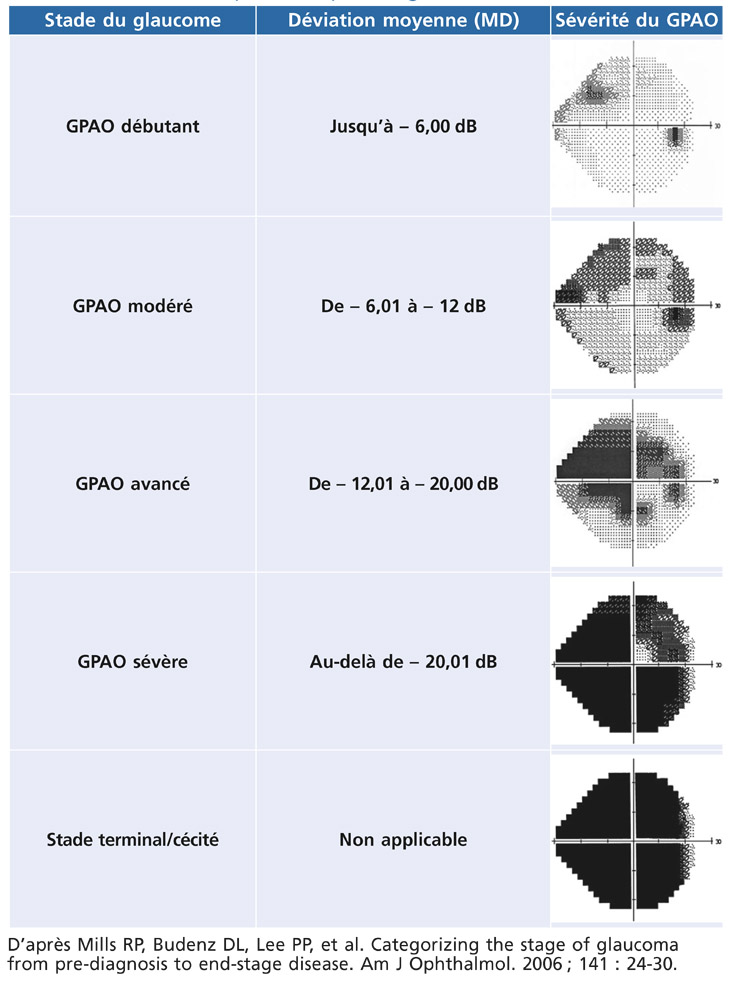
Tableau 12-1 – Stades périmétriques du glaucome.
D’après Mills RP, Budenz DL, Lee PP, et al. Categorizing the stage of glaucoma from pre-diagnosis to end-stage disease. Am J Ophthalmol. 2006 ; 141 : 24-30.
Connaître l’importance des pics et des fluctuations de la PIO.
Savoir éliminer une atteinte glaucomateuse débutante.
Dépister les facteurs de risque de progression et les signes d’alerte.
Délivrer une information précise et bien comprise au patient.
Maîtriser les facteurs d’indication thérapeutique.
La détection de l’hypertension intra-oculaire (HTO) et sa prise en charge représentent un élément essentiel dans la prévention ou le ralentissement de l’apparition d’un GPAO, pour lequel elle constitue le principal facteur de risque de développement qui peut être contrôlé.
L’ HTO est définie par une élévation isolée de la pression intra-oculaire (PIO) classiquement supérieure à 21 mmHg, associée à un angle iridocornéen (AIC) ouvert, mais sans altération glaucomateuse structurale de la tête du nerf optique (TNO) et des fibres nerveuses rétiniennes (FNR), et sans atteinte fonctionnelle du champ visuel (CV) aux tests cliniques standard.
La répartition de la PIO au sein de la population normale est continue, sans coupure franche entre les sujets normaux et « anormaux ». Ses valeurs s’étendent de 10 à 21 mmHg avec une PIO moyenne de 15,5 ± 2,5 mmHg. Les PIO supérieures à 21 mmHg (PIO moyenne + 2 écarts types) ont été classées de façon conventionnelle comme élevées. Si les limites supérieures de la PIO au sein de la population normale augmentent avec l’âge, passant de 20 mmHg avant 40 ans à 28 mmHg au-delà de 75 ans, il est classique de garder de façon conventionnelle pour définition d’une HTO toute PIO supérieure à 21 mmHg [13].
La prévalence de l’HTO fluctue selon les études entre 3,5 et 12,6 %. Ces fluctuations sont liées au fait que ces études portent sur des populations dont les effectifs sont variables avec des sujets de groupes ethniques et d’âges différents [17, 28].
Globalement, l’HTO concerne 3 à 8 % des sujets âgés de plus de 40 ans, soit en France entre 1 et 2,6 millions de personnes (pour 33 232 000 de moins 40 ans sur une population totale de 65 800 000 – données INSEE 2013).
L’étude observationnelle EFGH1J (Étude France Glaucome Hypertonie un Jour), réalisée par 1 173 ophtalmologistes sur 3 896 patients, rapporte, au sein des patients atteints d’HTO ou de GPAO, une prévalence de 29 % d’HTO isolée dont 54 % sont de sexe féminin. Ces HTO, dont l’âge moyen des patients est de 58 ans, peuvent s’observer à tout âge, avec une répartition pour 95 % d’entre elles entre 18 et 96 ans [29].
La majorité des HTO (90 %) se situe entre 21 et 25 mmHg. La conséquence pratique d’une PIO élevée est un risque plus important de GPAO, dont elle constitue le premier facteur de risque et non pas une affection pathologique à elle seule. Si les données de la littérature rapportent un risque d’évolution vers un glaucome généralement estimé autour de 1 % par an, en fait nous savons que ce risque augmente de façon non linéaire avec le niveau de la PIO. L’étude OHTS (Ocular Hypertension Study) rapporte un taux de progression vers un GPAO plus important que ce que nous pensions, avec deux fois moins de glaucome chez les patients traités que dans le groupe de sujets non traités (respectivement 4,4 % et 10,9 %). La probabilité de développer une neuropathie glaucomateuse à 5 ans était de 4,4 % pour les patients traités et de 9,5 % – soit près de 2 % par an – en l’absence de traitement. Un plus grand nombre d’HTO confirmées nécessiteraient par conséquent d’être traitées, le risque de développer un glaucome dépendant du niveau de la PIO car chaque millimètre de mercure additionnel augmente ce risque [10].
La découverte d’une PIO élevée doit répondre à plusieurs questions.
Pour décider de la conduite à tenir et avant d’initier un traitement ou une surveillance attentive, il faut :
confirmer l’HTO et en préciser ses caractéristiques ;
s’assurer qu’il s’agit d’une HTO isolée ;
rechercher les facteurs de risque d’évolution vers un glaucome associé.
Le niveau de l’HTO et ses variations, qui sont propres à chaque patient, doivent être évalués. La PIO est un paramètre physiologique dynamique avec des fluctuations variables dont l’importance intervient aussi bien dans le diagnostic que dans la décision thérapeutique (voir chapitre 9-II, paragraphe « Techniques de mesure de la pression intra-oculaire »).
La constatation d’une élévation de la PIO au cours d’une mesure réalisée au tonomètre à air, sans contact, doit faire l’objet d’une confirmation par une mesure de la PIO au tonomètre par aplanation de Goldmann qui, à ce jour, reste la technique de référence la plus précise pour l’évaluation de la PIO chez tout patient présentant une HTO ou un GPAO.
Une série de trois mesures doit être effectuée pour chaque œil afin de retenir une valeur moyenne fiable de la PIO au moment de son évaluation.
Les fluctuations à court terme de la PIO ou variations nycthémérales sur 24 heures peuvent être subdivisées en variations diurnes, nocturnes et circadiennes Les fluctuations diurnes et circadiennes (24 heures) varient largement entre les individus glaucomateux et sains.
De nombreuses études, en particulier celle de l’équipe grenobloise de Jean-Paul Romanet, ont permis de préciser les courbes nycthémérales des sujets sains et glaucomateux (voir chapitre 9-II, paragraphe « Techniques de mesure de la pression intra-oculaire ») [5, 14, 23].
Toute mesure de la PIO représente une donnée instantanée de la valeur de la PIO et ne donne pas de renseignement sur son comportement dans le temps ni sur ses fluctuations.
Il existe peu d’études d’analyse des fluctuations de la PIO chez les patients présentant une HTO. Celles-ci semblent plus proches de celles du patient glaucomateux, avec une amplitude moyenne de l’ordre de 8 mmHg et une amplitude maximale pouvant atteindre 16 mmHg [11].
Le rôle des fluctuations de la PIO en tant que facteur de risque de conversion de l’HTO vers le GPAO reste encore débattu avec des résultats contradictoires pour un certain nombre d’études.
Il est clairement établi que la PIO moyenne élevée constitue un facteur de risque de progression chez tout patient atteint d’HTO et/ou de GPAO. Il est nécessaire en pratique d’évaluer cette PIO moyenne et ses fluctuations initiales.
Les trois paramètres importants des fluctuations de la PIO corrélés avec la progression doivent être bien connus : le pic de la PIO, son amplitude de variation (PIO maximale – PIO minimale [PIOm]) et sa variation dans le temps (déviation standard au cours des différentes mesures à long terme) [22].
Les fluctuations à long terme de la PIO ne semblent pas être associées de façon significative à un risque d’apparition de GPAO chez des sujets présentant une HTO non traitée. Une étude réalisée sur 252 yeux atteints d’HTO avec un suivi moyen de 7 ans met en exergue, parmi les patients ayant présenté un GPAO, le rôle du niveau de la PIOm en tant que facteur de risque significatif d’apparition d’un glaucome (avec un risque d’environ 10 % par mmHg supplémentaire) [16].
Il est important :
d’évaluer de façon précise le niveau de la PIO moyenne chez tout patient présentant une HTO ;
d’apprécier ses fluctuations initiales, dans la mesure du possible, par plusieurs mesures à différents horaires lors des premières consultations successives, ou par la réalisation d’une courbe diurne de la PIO. Même si la reproductibilité à court terme de ces courbes de mesures de la PIO chez les sujets sains et les patients présentant un GPAO a pu être remise en cause sur de faibles effectifs, la réalisation d’une courbe diurne de la PIO permet de préciser les variations de la PIO, et de détecter un éventuel pic de celle-ci au cours de la journée avec en particulier une mesure en fin de matinée [20,21].
On retiendra qu’en l’état actuel de nos connaissances, les fluctuations à long terme ne semblent pas représenter un facteur de risque de progression vers le GPAO, mais que le niveau de la PIO moyenne initiale doit être retenu comme facteur de risque avec une bonne connaissance de l’amplitude des fluctuations de la PIO à court terme au cours du nycthémère.
Il est donc indispensable de préciser, devant une HTO, les pics pressionnels et l’amplitude des variations de la PIO par plusieurs mesures, et dans la mesure du possible par une courbe diurne.
La qualité de la mesure de la PIO peut être influencée par différents facteurs liés à la technique ou aux patients, et qu’il faut bien connaitre (voir chapitre 9-II) (eTableaux 12-1 et 12-2).
Lors du bilan de tout patient présentant une HTO, la mesure de la PIO sera réalisée par aplanation au tonomètre de Goldmann, qui reste donc la technique de référence. En effet, les tonomètres à air ont tendance à surestimer les fortes PIO et à sous-estimer les faibles PIO.

eTableau 12-1 Causes de surestimation de mesure de la PIO.

eTableau 12-2 Causes de sous-estimation de mesure de la PIO.
L’épaisseur cornéenne centrale (ECC) a également une influence sur la mesure de la PIO. La mesure de la PIO au tonomètre par aplanation de Goldmann (mise au point pour une cornée d’épaisseur centrale moyenne normale et une surface d’aplanation de 3,06 mm) peut être faussement élevée en cas de cornée épaisse et faussement réduite en cas de cornée fine. Cette surestimation concerne la tonométrie par aplanation. Il n’existe actuellement aucune abaque de correction fiable qui puisse être utilisée en pratique clinique pour une correction éventuelle du chiffre mesuré de PIO (estimation d’environ 0,2 à 0,7 mmHg tous les 10 μm). Seule une mesure de la PIO au tonomètre de Pascal et à l’Ocular Response Analyser (ORA) permet de s’affranchir de l’influence de l’ECC dans la mesure de la PIO.
De nombreuses études épidémiologiques ont mesuré l’ECC moyenne au sein de populations glaucomateuses et non glaucomateuses. Aucune ne trouve de différence statistiquement significative entre chaque groupe alors que l’on aurait pu s’attendre à une épaisseur cornéenne moyenne plus basse de façon significative chez les patients glaucomateux. Les différentes études n’ont pas retrouvé, à ce jour, de relation directe entre l’ECC et les autres structures tissulaires oculaires, en particulier au niveau de la TNO et notamment avec l’épaisseur de la lame criblée.
Les seules données récentes rapportent qu’une mutation de certains gènes impliqués dans le métabolisme du collagène du stroma cornéen et de la membrane de Descemet pourrait intervenir dans le déterminisme d’une faible épaisseur cornéenne. Leur mutation, en particulier celle du gène COL8A2, a été observée chez un groupe de patients présentant une cornée fine et un GPAO évolué [7, 30, 31].
La mesure d’une ECC fine doit alerter car elle indique une PIO réelle plus élevée que celle mesurée au tonomètre par aplanation. Elle doit inciter à rechercher une atteinte glaucomateuse avec une vigilance particulière.
Lorsque le GPAO est connu, l’existence d’une cornée d’épaisseur centrale fine doit faire craindre une progression plus rapide en raison de cette sous-évaluation de la réelle PIO [24].
La mesure de l’épaisseur cornéenne est donc indispensable devant toute HTO et elle doit être :
pratiquée sur une cornée considérée stable, quelques heures après le réveil ;
connue avant tout équipement (notamment par lentilles précornéennes) et avant toute chirurgie réfractive ;
contrôlée 3 mois après une chirurgie de la cataracte ou 6 mois après une chirurgie réfractive.
Enfin, son évaluation doit être pratiquée avant l’examen gonioscopique et avant la dilatation pupillaire, car ces deux derniers peuvent induire une lésion potentielle de la surface cornéenne, influençant la mesure.
Le bilan peut être complété par une analyse des propriétés biomécaniques de la cornée à l’aide de l’ORA. Les résultats rapportent une valeur de la PIO corrigée et compensée (PIOcc) pour les propriétés viscoélastiques de la cornée indépendante de l’ECC. Chez les patients atteints d’HTO ou de GPAO, l’hystérésis de la cornée est diminuée, avec des valeurs proches de celles observées chez les patients atteints de GPAO par rapport aux sujets normaux. Cet indice représente ainsi un indicateur complémentaire potentiel chez les patients atteints d’HTO et de glaucome prépérimétrique [1, 25].
Lorsque le diagnostic d’une HTO est posé, l’étape suivante consiste à évaluer de la façon la plus précise possible le risque individuel qu’elle représente. Affirmer le caractère isolé de l’HTO passe par une documentation clinique initiale complète, la recherche d’un éventuel retentissement structural et fonctionnel ainsi que par la détection de facteurs de risque d’évolution associés.
Devant tout patient présentant une HTO, la recherche des antécédents oculaires et généraux doit être systématique. L’interrogatoire précisera la présence d’éventuels antécédents familiaux, d’HTO ou de GPAO, toute cause secondaire d’élévation de la PIO, comme un traumatisme ou un antécédent d’uvéite oculaire, l’utilisation de médicament pouvant avoir un effet sur la PIO (corticoïdes au long cours, bêtabloquant par voie générale, etc.). Enfin, une pathologie associée de type cardiovasculaire, hypertension artérielle, hypotension artérielle, pouvant influer sur la vascularisation de la tête du nerf optique (TNO), doit être précisée et connue en raison de ses conséquences potentielles dans le choix d’une thérapeutique éventuellement initiée au terme du bilan.
Un examen ophtalmologique complet doit être réalisé afin de confirmer l’absence d’une neuropathie optique glaucomateuse débutante.
Une réfraction précise avec une mesure de la meilleure acuité visuelle corrigée est essentielle. Elle permet de rechercher une éventuelle pathologie associée (cataracte, maculopathie quelle qu’en soit la cause, DMLA, etc.), d’assurer les meilleures conditions pour la réalisation de l’examen du CV, et elle servira de référence pour le suivi des examens successifs.
L’examen biomicroscopique du segment antérieur éliminera les stigmates d’une dispersion pigmentaire, d’une pseudo-exfoliation capsulaire, ou encore d’une uvéite à l’origine d’une éventuelle HTO secondaire, et précisera la présence possible d’une phakosclérose ou d’un autre trouble des milieux pouvant perturber le relevé du CV.
L’examen gonioscopique confirmera la présence d’un angle iridocornéen (AIC) ouvert exempt de toute anomalie à type de pigmentation excessive du trabéculum, de dysgénésies angulaires, de synéchie antérieure périphérique, de récession ou de toute autre séquelle de traumatisme angulaire.
Le renouvellement régulier de cet examen gonioscopique est essentiel. Il doit être réalisé en moyenne tous les 2 ans chez un patient présentant une HTO isolée, en raison des modifications potentielles de la profondeur de la chambre antérieure liées à l’augmentation de volume du cristallin et à la fermeture progressive de l’AIC.
À l’examen du fond d’œil, l’analyse soigneuse des fibres nerveuses rétiniennes (FNR) recherchera une atteinte souvent précoce, précédant celle du disque optique, ainsi que l’atteinte fonctionnelle du CV.
Cette analyse peut être difficile en cas de grande papille avec excavation importante, s’il existe une dysversion papillaire ou une atrophie péripapillaire associée importante (voir chapitre 10-VI, paragraphe « Biomicroscopie et rétinophotographies »).
L’existence de facteur de risque particulier relevé à l’examen clinique (rapport C/D vertical élevé > 0,7, grande papille avec grande excavation, présence d’une atrophie péripapillaire bêta, etc.) doit être notée dans le dossier clinique du patient pour une plus grande vigilance dans le suivi de l’HTO dans le temps.
Une photographie permet l’analyse qualitative de la TNO et, avec les programmes actuels des rétinographes non mydriatiques, offre la possibilité d’interposer un filtre bleu pour compléter le cliché par une photographie des FNR à la recherche d’un déficit précoce débutant.
Elle constitue un document de référence pour l’évaluation et le suivi de la progression lors des prochains contrôles. Si l’interprétation des rétinographies reste subjective avec des variations dépendantes de l’examinateur, ces clichés fournissent des images de référence importantes pour le suivi de l’HTO et le dépistage précoce d’un GPAO débutant (voir fig. 12-1).
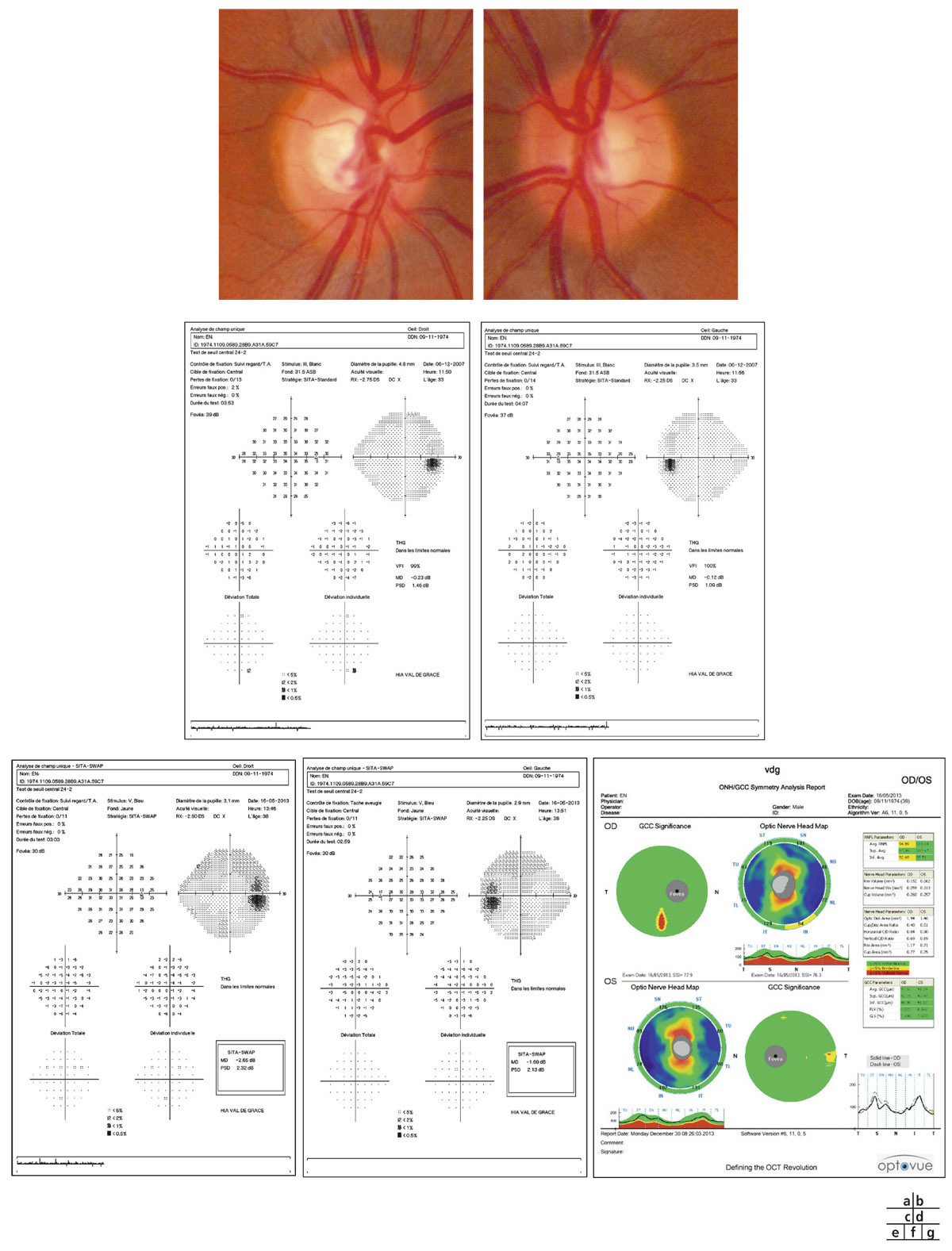
Fig. 12-1 Patient suivi pour hypertension intra-oculaire. a, b. Rétinophotographies œil droit (OD) et œil gauche (OG). c, d. Relevés initiaux en PAS blanc-blanc OD et OG. e, f. Relevés en périmétrie bleu-jaune et relevés d’analyse des FNR, de la TNO et du complexe maculaire ganglionnaire en OCT-SD (g). (Clichés J.-P. Renard.)
Les techniques d’analyse automatisée de la TNO et des FNR sont d’un intérêt essentiel pour le dépistage des GPAO débutants et doivent faire partie du bilan initial de tout patient présentant une HTO.
Si un certain nombre de données dépendent du plan de référence lié à la délimitation par l’opérateur des bords de la TNO (analyse de régression de Moordfields – Moorfields regression analysis [MRA]), certains indices comme le GPS (Glaucoma probabibility score ou score de probabilité du glaucome), indépendants de ce plan de référence, ont montré leur sensibilité dans le dépistage précoce d’un glaucome débutant ainsi que leur intérêt pour la détection d’une progression au cours du suivi de l’HTO [26]. Une étude complémentaire de l’OHTS analyse, avec l’HRT, le taux de changement structural chez les patients ayant développé un GPAO : les résultats rapportent un taux de perte de la surface de l’anneau neurorétinien (rim area [RA]) 5 fois plus rapide, surtout pour les yeux avec les PIO les plus fortes. La mesure du taux de modification de cet indice peut ainsi donner une information importante pour la prise en charge des patients atteints d’HTO [32].
Le suivi de ces indices vient compléter les données du logiciel d’analyse de modification topographique, indépendant du plan de référence, avec les mesures quantitatives ponctuelles de surface et de volume au niveau de la TNO et de la rétine péripapillaire, capables de différencier un vrai changement topographique d’une variabilité de mesures.
Cette analyse fait partie intégrante du bilan de tout patient présentant une HTO. Elle doit se faire au niveau des trois sites d’analyse possible en OCT-spectral domain :
la couche des FNR avec l’acquisition péripapillaire ;
les paramètres de la TNO ;
ainsi que l’analyse du complexe maculaire cellulaire ganglionnaire (GCC) plus récente (voir fig. 12-1).
Elle permet une évaluation initiale quantitative de ces différents paramètres, avec la possibilité d’un suivi de qualité sous condition d’une interprétation rigoureuse des résultats par l’examinateur (voir chapitre 9-IV, paragraphe « Tomographie par cohérence optique » et chapitre 11-II, paragraphe « Tomographie par cohérence optique-spectral domain »). L’intérêt intra-individuel de ces nouvelles possibilités d’analyse a largement été démontré pour la détection d’une progression.
La recherche d’un éventuel retentissement fonctionnel par la réalisation d’un champ visuel (CV) initial dit « de base » doit être pratiquée chez tout patient présentant une HTO.
La périmétrie automatisée standard (PAS) blanc-blanc (Sita-Standard 24°-2 ou DG2) reste la technique de référence. Néanmoins, la perte en fibres axonales est déjà importante (30 à 40 % des fibres détruites) quand les premiers déficits apparaissent. Aussi, un relevé du CV normal ne doit pas faire exclure une neuropathie optique glaucomateuse débutante. Il faut également se méfier des résultats faussement positifs lors du premier examen pouvant être liés à un effet d’apprentissage du patient, et il faut souvent réaliser deux ou trois CV avant de retenir un résultat suffisamment fiable que l’on puisse considérer comme relevé d’évaluation initiale de l’HTO (voir fig. 12-1).
Enfin, il faut aussi prendre garde à certains petits déficits très évocateurs situés dans la zone paracentrale sur un relevé du CV 24°-2 ou 30°-2. Ils doivent au moindre doute inciter à la réalisation d’un relevé du CV dans les 10° centraux pour dépister un déficit débutant dans cette zone, dont la fréquence a été rapportée par de nombreuses études au stade précoce du GPAO.
Un glaucome prépérimétrique doit être recherché par un examen en périmétrie automatisée bleu jaune ou par le FDT MatrixTM (Frequency doubling technology).
Un déficit en périmétrie bleu jaune est retrouvé chez 12 à 39 % des HTO. Et 50 % des patients présentant une HTO avec un déficit en PAS bleu-jaune développent dans les 5 ans un déficit en PAS blanc-blanc. Cependant, son utilisation systématique est limitée en raison de la possibilité de nombreux résultats faussement positifs, et ses meilleures indications sont représentées par les HTO chez les sujets jeunes avec des milieux oculaires clairs (voir fig. 12-1). Elle présente l’avantage de permettre un suivi avec une analyse de la progression dans le temps.
La périmétrie automatisée au FDT MatrixTM détecte des déficits chez près de 30 % des HTO et dans un délai pouvant aller jusqu’à 4 ans avant l’apparition d’un GPAO en PAS blanc-blanc. Cependant, elle ne dispose pas de programme d’analyse de la progression, à la différence de la PAS classique [2, 4, 6, 12].
Ces différentes techniques d’exploration du CV, en analysant des fonctions visuelles spécialisées et différentes, permettent de dépister une atteinte fonctionnelle précoce dans l’HTO et le glaucome débutant prépérimétrique.
Le bilan de toute HTO passe par la recherche de facteurs de risque de progression vers l’installation d’un GPAO débutant. Les études cliniques prospectives randomisées OHTS et EGPS (European Glaucoma Prevention Study) ont précisé un certain nombre de ces facteurs de risque de conversion.
Le risque de GPAO augmente avec la valeur de la PIO. On retient classiquement une prévalence du GPAO à 5 ans de l’ordre de 3 % pour les PIO inférieures à 25 mmHg, de 25 % entre 25 et 30 mmHg et de 30 % a priori au-delà de 30 mmHg. L’étude OHTS rapporte à 5 ans, pour des PIO comprises entre 24 et 32 mmHg, une prévalence du GPAO de l’ordre de 9,5 %, soit près de 2 % par an. Si le risque de GPAO augmente avec le niveau de la PIO, les fluctuations pressionnelles à long terme n’ont pas démontré qu’elles représentaient un facteur de risque de conversion de l’HTO vers le glaucome [16].
Ces autres facteurs sont les suivants :
l’ECC. Elle est rapportée en tant que facteur de risque de progression vers le glaucome avec un risque de conversion de 30 % (dans l’EGPS) à 71 % (dans l’OHTS) pour toute diminution de l’ECC de 40 μm. L’importance de considérer l’ECC dans l’évaluation du risque de développement d’un GPAO est donc largement démontrée. Nous avons vu qu’elle doit être considérée comme un facteur de risque et intervenir dans l’interprétation dans la mesure de la PIO. Le fait qu’elle représenterait un marqueur caractéristique tissulaire biomécanique et structural oculaire qui pourrait influencer le risque de développement de GPAO reste encore une hypothèse à évaluer ;
la myopie forte, avec un risque de GPAO multiplié jusqu’à trois dans certaines études ;
la présence d’un syndrome de dispersion pigmentaire ;
un syndrome pseudo-exfoliatif.
Ces facteurs sont :
l’âge, avec une augmentation de la prévalence au-delà de 65 ans de l’ordre 7,2 % ;
l’ethnie, avec un risque multiplié globalement par quatre chez les sujets noirs qui présentent souvent une cornée d’épaisseur fine [8, 18] ;
les antécédents familiaux, avec un risque multiplié par deux en cas de présence d’un GPAO chez un parent du premier degré ;
les facteurs vasculaires : hypotension artérielle, maladie cardiovasculaire et hypertension artérielle mal équilibrée, migraine, vasospasme, etc.
L’analyse des données regroupées de l’OHTS et de l’EGPS (1 319 patients sans traitement) a permis d’identifier cinq facteurs de risque associés de façon significative à un risque de conversion de l’HTO vers le GPAO :
l’âge, qui représente un facteur de risque indépendant dans les deux études ;
le niveau de la PIO, avec 10 % de risque supplémentaire de GPAO par mmHg ajouté à la PIO initiale ;
l’ECC, avec un risque de conversion augmenté de 71 % dans l’OHTS et de 32 % dans l’EGPS pour toute diminution de l’ECC de 40 μm ;
le rapport C/D vertical, avec un risque augmenté de 19 % pour toute augmentation du rapport de 0,1 ;
l’indice PSD (dB), avec un risque augmenté de 13 % pour toute élévation de 0,2 dB.
Il faut cependant souligner que la puissance de l’étude est probablement insuffisante pour détecter une valeur prédictive significative pour beaucoup de ces facteurs de risque évalués. Ainsi, les antécédents familiaux restent peu précis dans ces deux études.
Une évaluation du risque de développer un glaucome chez des patients présentant une HTO sans traitement à 5 ans a été précisée de façon simplifiée par un système de points et une version électronique. Ce calculateur de risque a été développé et validé en 2007 à partir des données de l’EGPS et de l’OHTS avec les cinq variables significativement associées à une conversion de l’HTO vers le GPAO. Démontrant une puissance statistique d’environ 74 % des cas, une version plus récente du calculateur STAR (Scoring tool for assessing risk [STAR2]) ajoute à l’évaluation la présence d’un diabète sans ou avec rétinopathie en tant que sixième facteur. De façon simplifiée, un système de points est attribué à chaque facteur en fonction de ses résultats. La somme des points permet d’évaluer l’estimation d’un risque de progression vers le GPAO à 5 ans (tableau 12-2).
Ce calculateur a été mis au point pour estimer un risque de développement des signes les plus précoces du GPAO. Établi sur des populations restreintes et sélectionnées avec des critères d’inclusion et d’exclusion stricts pouvant ne pas être représentatifs de toute la population, il faut retenir qu’il s’agit d’une évaluation plus objective du risque qui ne remplace pas le jugement clinique pour toute décision de prise en charge d’un patient atteint d’HTO. Sa consultation peut présenter un intérêt informatif complémentaire sans cependant être décisionnelle à elle seule pour initier un traitement. Il est bien précisé que la prédiction obtenue avec l’utilisation de ce calculateur de risque doit être considérée comme une aide, mais en aucun cas ne doit remplacer le jugement clinique. Ce calculateur est consultable sur internet : ohts.wustl.edu/risk/calculator.html [15, 19].
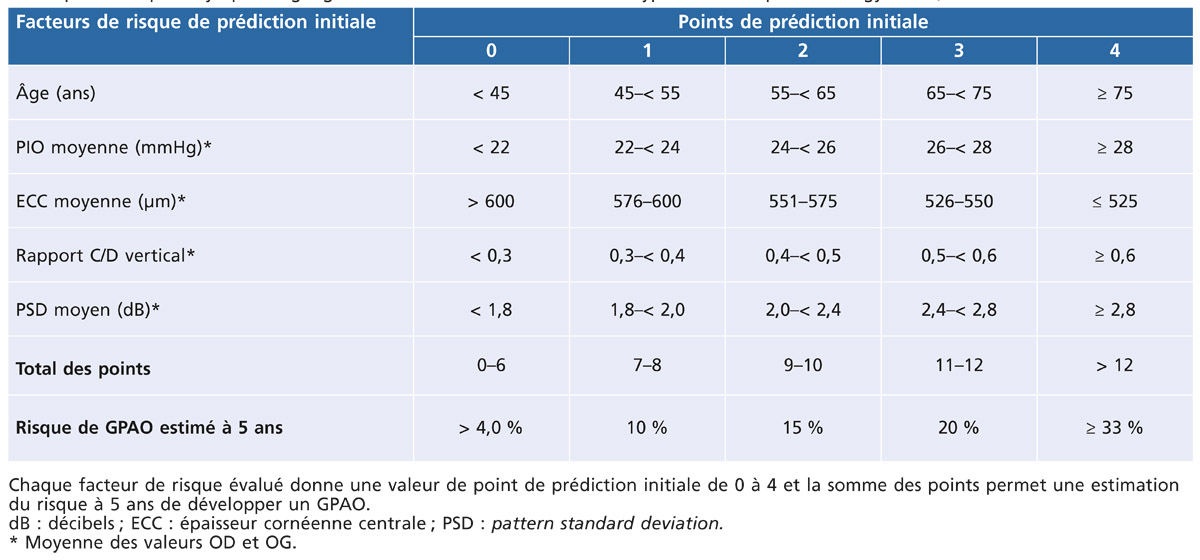
Tableau 12-2 – Estimation du risque de progression de l’HTO vers le GPAO à 5 ans.
D’après Ocular Hypertension Treatment Study Group, European Glaucoma Prevention Study Group. Validated prediction model for the development of primary open angle glaucoma in individuals with ocular hypertension. Ophthalmology. 2007 ; 114 : 10-19.
Le diagnostic précoce d’HTO ne justifie pas systématiquement un traitement, loin s’en faut, mais il implique obligatoirement une surveillance.
Seulement 8 à 15 % des HTO évoluent en 10 ans vers la neuropathie optique glaucomateuse. Dans 85 % des cas, le traitement est inutile ou débuté trop précocement. Par ailleurs, le traitement médical est source de contraintes, d’effets indésirables, et il altère inévitablement la qualité de vie.
L’étude OHTS a montré que le risque à 5 ans pour une HTO d’évoluer vers un GPAO était réduit de 50 % en cas de traitement (4,4 % versus 10,9 % chez les patients non traités) et les premières altérations – que l’HTO soit traitée ou non – concernent d’abord la TNO avant les modifications du CV dans la majorité des cas. Les dernières données de cette étude rapportent un suivi à 13 ans des patients, avec une évaluation de la progression en fonction de l’importance des facteurs de risque de développement d’un GPAO évaluée par le calculateur de risque de l’OHTS-EGPS. Les patients ont été répartis en trois groupes équivalents pour lesquels le risque estimé à 5 ans de développement d’un GPAO était respectivement, pour le premier, inférieur à 6 %, pour le deuxième, de 6 à 13 % et, pour le dernier groupe, supérieur à 13 %.
Les résultats rapportent chez les patients de ce dernier groupe, au début de l’étude, une proportion plus importante de patients ayant développé un GPAO (28 % des patients traités dès le début et 40 % de ceux traités à partir de la septième année). Les auteurs ont estimé qu’un cas de glaucome était prévenu pour 7 patients traités. À noter que la haute conversion en GPAO de ce groupe était surtout évidente les premiers mois du suivi, suggérant que plusieurs facteurs de risque étaient en fait présents, avec des pertes axonales existantes, et que la conversion reflétait simplement une perte progressive additionnelle. La détection ainsi plus précoce et plus précise de ce type de patients, grâce à nos moyens d’évaluation de l’atteinte structurale et fonctionnelle, leur permettrait de bénéficier d’un traitement plus adapté.
Le tiers de patients à faible risque de cette étude présentait très peu de conversion en GPAO (7 à 8 %) avec ou sans traitement prophylactique. Pour ce groupe, environ 98 patients auraient les inconvénients et subiraient le coût d’un traitement chronique pour prévenir un seul cas de glaucome, ce qui ne représente pas de toute évidence un rapport optimal !
Enfin, pour le tiers du sujet à moyen risque (6 à 13 %), les auteurs estiment qu’il faut traiter 16 patients pour prévenir un seul cas de glaucome, avec des différences respectives de 19 et 24 % entre les patients traités dès le début de l’étude et ceux traités seulement les cinq dernières années [9].
Ces données nous apportent ainsi un certain nombre d’informations pour une décision thérapeutique qui doit être évaluée dans chaque cas en fonction de différentes variables.
Une surveillance régulière avec les nouveaux moyens de dépistage d’une atteinte structurale ou fonctionnelle est indiquée dans la majorité des cas.
Un examen clinique biomicroscopique complété autant que possible par des rétinophotographies (TNO-FNR), un examen OCT-spectral domain, voire un examen par HRT, répétés tous les 6 mois, puis tous les ans, constituent un bon moyen de dépistage de l’atteinte structurale et d’évaluation de son suivi.
L’examen du fond d’œil s’attachera à rechercher la présence d’une hémorragie du disque optique et les photographies de la TNO permettront d’affiner cette recherche. L’OHTS a confirmé que la présence d’une hémorragie du disque optique représentait un facteur de risque indépendant du développement de GPAO. Le risque de développement est 6 fois plus grand chez les patients présentant une HTO avec une hémorragie du disque optique par rapport à ceux exempts d’hémorragie. Il est donc important de retenir leur rôle en tant que stigmate pronostique négatif chez tout patient présentant une HTO [3, 27].
Les altérations les plus précoces au niveau du CV sont le plus souvent localisées au niveau de l’hémi-CV supérieur, avec une prédominance des atteintes au niveau de la marche nasale, mais également au niveau des faisceaux arciformes dans les 15° ainsi que dans les 5° centraux du CV.
Il est donc important de suivre ces patients, à l’aide des tests en périmétrie automatisée, à la recherche d’un déficit précoce dans ces secteurs, au FDT MatrixTM, en PAS bleu-jaune et, selon les cas, on n’hésitera pas à compléter le relevé par une analyse du CV des 10° centraux. L’analyse des résultats doit tenir compte de la variabilité intertest. La détection d’un déficit doit toujours être confirmée par un second relevé au niveau du CV. Dans l’étude OHTS, la détection d’un déficit n’était pas retrouvée au cours du deuxième examen dans 86 % des cas.
Le suivi régulier de ces patients atteints d’HTO permettra de les classer en HTO à risque modéré ou élevé.
Il est important :
de documenter le dossier du patient avec les relevés successifs des différents examens ;
d’évaluer à chaque contrôle la présence d’éventuels nouveaux facteurs de risque associés ;
de compléter avec une information suffisamment détaillée et bien comprise par le patient sur les caractéristiques de l’HTO ainsi que sur ses risques évolutifs.
Enfin, une nouvelle estimation de risque à 5 ans à l’aide du calculateur de risque peut être envisagée selon les cas.
Au total, les facteurs d’indications thérapeutiques de l’HTO sont fonction des résultats de plusieurs paramètres :
niveau de la PIO et importance de ses variations nycthémérales ;
ECC mince ≤ 510 μm ;
résultats de l’analyse des FNR et de la TNO en OCT-SD et/ou HRT, ainsi que du CV en FDT MatrixTM et PAS bleu-jaune ;
sujet jeune ;
facteurs de risque associés (sujet mélanoderme, antécédents familiaux, myopie, dispersion pigmentaire, pseudo-exfoliation capsulaire, terrain vasculaire, etc.).
Toutes les HTO ne doivent pas être traitées. Une simple surveillance régulière et rigoureuse est suffisante dans la majorité des cas. Il est donc important de définir les HTO à risque élevé ou modéré avec leurs facteurs de risque d’évolution qui justifient un traitement précoce, et de dépister une atteinte structurale et fonctionnelle débutante dans tous les cas.
Retenir
Évaluer de façon précise le niveau de la PIO moyenne chez tout patient présentant une HTO.
Apprécier les fluctuations initiales de la PIO lors des premières consultations.
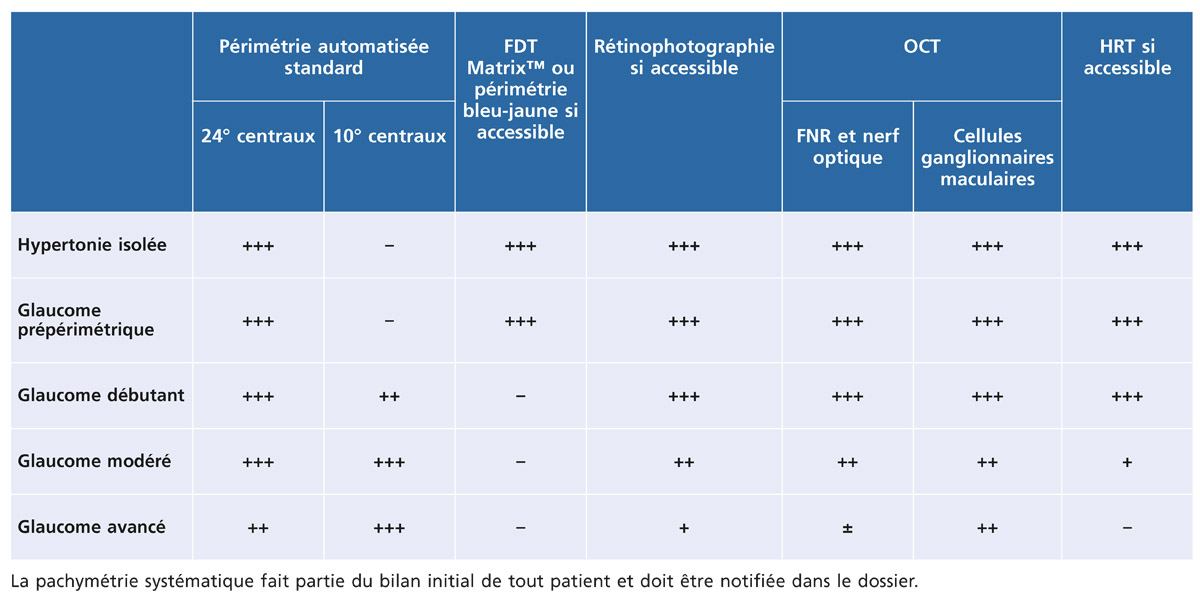
Examen clinique, rétinophotographies et imagerie automatisée sont complémentaires (tableau 12-3).
Rechercher les facteurs de risque.
Surveillance rigoureuse systématique.
Traiter seulement les HTO à risque élevé.

Tableau 12-3 – Examens complémentaires recommandés pour l’hypertension intra-oculaire isolée.
[1] Abitbol O, Bouden J, Doan S, et al. Corneal hysteresis measured with the ORA in normal and glaucomatous eyes. Acta Ophthalmol. 2010 ; 88 : 116-19.
[2] Brusini P, Salvetat ML, Zeppieri M, et al. Frequency doubling technology perimetry with the Humphrey Matrix 32 test. J Glaucoma. 2006 ; 15 : 77-83.
[3] Budenz DL, Anderson DR, Feuer WJ, et al. Detection and prognostic significance of optic disc hemorrhages during the Ocular Hypertension Treatment Study Ophtalmology. 2006 ; 113 : 2137-43.
[4] Centofanti M, Fogagnolo P, Oddone F, et al. Learning effect of Humphrey Matrix FDT perimetry in patients with ocular hypertension. J Glaucoma. 2008 ; 17 : 436-41.
[5] Chiquet C, Denis P. Bases neuro-anatomiques et physiologiques des variations de la PIO. J Fr Ophtalmol. 2004 ; HS2 : 2S11-2S18.
[6] Choi JA, Lee NY, Park CK. Interpretation of the Humphrey Matrix 24°-2 test in the diagnosis of preperimetric glaucoma. Jpn J Ophthalmol. 2009 ; 53 : 24-30.
[7] Desronvil T, Logan-Wyatt D, Abdrabou W, et al. Distribution of COL8A2 and COL8A1 genes variants in Caucasian primary open angle glaucoma patients with thin central corneal thickness. Mol Vis. 2010 ; 16 : 2185-91.
[8] Herndon LW, Weizer JS, Stinnett SS. Central Corneal Thickness as a risk factor for advanced glaucoma damage. Arch Ophthalmol. 2004 ; 122 : 17-21.
[9] Kass MA, Gordon MO, Gao F. Delaying treatement of ocular hypertension. The ocular hypertension treatment study. Arch Ophthalmol. 2010 ; 128 : 276-87.
[10] Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Study : randomized trial determines that topical ocular hypertensive medication delays or prevents the onset of primary open angle glaucoma. Arch Ophthalmol. 2002 ; 120 : 701-13.
[11] Kotecha A, Lim S, Garway-Heath D. Tonometry and intraocular pressure fluctuations. In : Shaarawy T, Sherwood MB, Hitchings RA, Crowston JC (Eds). Glaucoma. New York : Saunders-Elsevier ; 2009. p. 103-13.
[12] Leeprenchanon N, Giaconi JA, Manassakom A, et al. Frequency doubling périmetry and SWAP to detect early glaucoma. Ophthalmology 2007 ; 114 : 931-7.
[13] Leibowitz HM, Kreuger DE, Maunder LR, et al. The Framingham eye study monograph : an ophtalmological an epidomiological study of cataract, glaucoma, diabetic retinopathy, macular degeneration and visual acuity in a general population of 2631 adults, 1973-1975. Surv Ophtalmol. 1980 ; 24 (Suppl) : 335-610.
[14] Liu JHK, Sit AJ, Weinreb RN, et al. Variations of 24-hours IOP an healthy individuals righ eye versus left eye. Ophthalmology. 2005 ; 112 : 1672-75.
[15] Medeiros FA, Weinreb RN. Risk assessment in glaucoma and ocular hypertension. Int Ophthalmol Clin. 2008 ; 48 : 1-12.
[16] Medeiros FA, Weinreb RN, Zangwil LM, et al. Long term IOP fluctuations and risk of conversion from OHT to glaucoma. Ophthalmology. 2008 ; 115 : 934-40.
[17] Nemesure B, Vu SY, Hennis A, et al. Factors related to the 4 years risks of High IOP : The Barbados eye studies. Arch Ophtalmol. 2003 ; 121 : 856-62.
[18] Nemesure B, Wu SY, Hennis A, et al. Corneal thickness and IOP in the Barbados eyes studies. Arch Ophthalmol. 2003 ; 121 : 240-4.
[19] Ocular Hypertension Treatment Study Group, European Glaucoma Prevention Study Group. Validated prediction model for the development of primary open-angle glaucoma in individuals with ocular hypertension. Ophthalmology. 2007 ; 114 : 10-19.
[20] Realini T, Weinreb RN, Wisniewski S. Diurnal IOP pattern as not repeatable and the short term and healthy individuals. Ophthalmology. 2010 ; 117 : 1700-4.
[21] Realini T, Weinreb RN, Wisniewski S. Short term repeatability of diurnal IOP patterns and glaucomatous individuals. Ophthalmology. 2011 ; 118 : 47-51.
[22] Renard JP, Giraud JM, Fénolland JR, et al. Les fluctuations de la PIO en pratique clinique. 18e Symposium Recherche et Glaucome. EDK ; 2011. p. 47-57.
[23] Romanet JP, Maurent-Palombi K, Noël C, et al. Variations nycthémérales de la PIO. J Fr Ophtalmol. 2004 ; HS2 : 2S19-2S26.
[24] Sellem E. Épaisseur cornéenne centrale et glaucome : quelles relations ? 20e Symposium Recherche et Glaucome. EDK ; 2013 : 39-45.
[25] Streho M, Dariel R, Giraud JM, et al. Evaluation of the Ocular Response Analyser in ocular hypertension, glaucoma and normal population : prospective study on 329 eyes. J Fr Ophtalmol. 2008 ; 31 : 953-60.
[26] Strouthidis NG, Scott A, Peter NM, et al. Optic disc and visual field progression in OHT subjects detection rates specificity and agreement. Invest Ophthalmol Visc Sci. 2006 ; 47 : 2904-10.
[27] Uhler TA, Piltz-Seymour J. Optic disc hemorrages in glaucoma and ocular hypertension : implications and recomandations. Curr Opin ophthalmol. 2008 ; 19 : 89-94.
[28] Varma R, Ying-Lai M, Francis BA, et al. Prevalence of open angle glaucoma and ocular hypertension in Latinos : the Los Angeles Latino Eye Study. Ophthalmology. 2004 ; 111 : 1439-48.
[29] Villain M, Nordmann JP, Renard JP, et al The French Glaucoma and Ocular Hypertension one day study. J Fr Ophtalmol 2006 ; 29 : 520-5.
[30] Vitart V, Bencié G, Hayward C, et al. New loci associated with corneal central thickness include COL5A1, AKAP13 and AVGR8 Hum. Mol Genet. 2010 ; 19 : 4304-11.
[31] Vithana EN, Aung T, Khor CC, et al. Collagen-related genes influence the glaucoma risk factor central corneal thickness. Hum Mol Genet. 2011 ; 20 : 649-58.
[32] Zangwill LM, Jain S Dirkes K, et al The rate of structural change : the confocal scanning laser ophthalmoscopy ancillary study to the Ocular Hypertension Treatment Study. Am J Ophthalmol. 2013 ; 155 : 971-82.
Les moyens cliniques et paracliniques actuels ont nettement amélioré les possibilités diagnostiques des glaucomes prépérimétriques.
L’évaluation du glaucome prépérimétrique passe par une démarche méthodique en six grandes étapes.
Une bonne connaissance des différents moyens de suivi, associée à une attitude vigilante et adaptée de l’ophtalmologiste, évitera toute perte de chance au patient atteint de glaucome prépérimétrique, en particulier si des contrôles réguliers sont possibles.
Le glaucome prépérimétrique (GPP) stade initial de la neuropathie optique glaucomateuse, se caractérise par l’existence d’une dégénérescence des fibres nerveuses rétiniennes (FNR), sans les déficits caractéristiques du champ visuel en périmétrie automatisée standard (PAS), associée à un angle iridocornéen ouvert, et à un certain nombre de facteurs de risque, avec tout d’abord une élévation de la pression intra-oculaire (PIO) et, à un degré plus au moins important, d’autres facteurs de risque de neuropathie optique glaucomateuse : oculaires, familiaux, génétiques, vasculaires, etc.
Stade initial de la conversion d’une hypertension intra-oculaire (HTO) isolée vers le GPAO, le GPP représente le premier passage dans le cadre du continuum de l’ensemble de l’évolution de la neuropathie optique glaucomateuse, le plus souvent chronique et lente.
On parle également de stade de conversion d’un patient avec une PIO supérieure à la normale, ayant un effet délétère et pathologique pour l’œil concerné, avec une exploration de la fonction visuelle en PAS blanc-blanc normale et qui peut présenter soit une atteinte de la structure, soit une atteinte fonctionnelle uniquement décelée par d’autres stratégies d’analyse du champ visuel, comme la PAS bleu-jaune ou l’analyse du champ visuel en périmétrie MatrixTM, qui explorent d’autres voies de transmission de l’information visuelle, et seraient plus sensibles à la détection d’un déficit fonctionnel que la PAS blanc-blanc.
Si le diagnostic du GPP reste difficile, il a bénéficié d’une part de meilleures possibilités d’évaluation grâce à l’acquisition de nouveaux moyens diagnostiques, et d’autre part d’une nette amélioration des moyens de suivi.
Enfin, il faut être bien conscient que le diagnostic de GPP marque l’annonce du début de la prise en charge nécessaire d’une affection chronique au long cours, avec déjà un impact non négligeable sur la qualité de vie du patient.
La détection précoce de la neuropathie optique glaucomateuse à ce stade est essentielle pour préserver la fonction visuelle chez ces patients souvent asymptomatiques. Une approche minutieuse est donc nécessaire et nous pouvons définir une démarche méthodique en six étapes que nous rappellerons brièvement : l’analyse des facteurs de risque, l’évaluation précise de la PIO et de l’implication des facteurs cornéens, l’étude de l’angle iridocornéen et du segment antérieur du globe oculaire, l’examen stéréoscopique de la TNO et des FNR, l’évaluation du relevé de l’analyse du champ visuel et, enfin, l’analyse des résultats des nouvelles techniques d’imagerie.
Le but est d’obtenir une approche la plus précise possible de l’histoire du patient et d’évaluer les facteurs de risque. Il est important de revoir l’ensemble de ces facteurs bien connus dans le GPAO, développés par ailleurs, et incluant les antécédents familiaux, surtout chez les parents du premier degré, les antécédents généraux (vasculaires, utilisation antérieure de stéroïdes au long cours, etc.), l’âge (supérieur ou égal à 40 ans), l’ethnie, les facteurs de risques oculaires (ancienneté de l’HTO, antécédent de traumatisme oculaire, myopie, etc.) (voir chapitre 10-V).
L’évaluation précise de la PIO est un temps important de l’évaluation du GPP, aussi bien celle de la PIO maximale non traitée que celle des fluctuations de PIO corrélées avec la progression de la neuropathie optique glaucomateuse. La tonométrie par aplanation reste la technique de référence et doit être utilisée pour une évaluation de qualité. L’interprétation des mesures doit se faire en fonction de l’épaisseur cornéenne centrale (ECC) mesurée en pachymétrie, en ayant toujours à l’esprit la notion d’une sous-estimation de l’effet délétère d’un chiffre pressionnel en cas de cornée fine et d’une surestimation en cas d’épaisseur cornéenne élevée (ECC normale = 540 ± 30 μm).
L’examen biomicroscopique du segment antérieur est important afin d’identifier un certain nombre de facteurs oculaires (dispersion pigmentaire, syndrome exfoliatif, etc.) qui peuvent être à l’origine d’un glaucome secondaire à venir. On recherchera en particulier toute anomalie du bord pupillaire, l’existence de défects iriens transilluminables, de matériel exfoliatif, d’un aspect poivre et sel atrophique irien, la présence de dépôt pigmentaire au niveau de l’endothélium cornéen et/ou au niveau de l’angle iridocornéen associée à des dépôts également au niveau de la zonule et/ou de l’équateur du cristallin ; tous évocateurs d’un glaucome secondaire existant ou à venir.
L’examen de l’angle iridocornéen est un temps essentiel, avec une gonioscopie dynamique en cas de doute sur l’ouverture de l’angle iridocornéen.
Les autres examens type OCT du segment antérieur et échographie UBM peuvent exceptionnellement, en fonction du contexte clinique (doute diagnostique, angle très étroit, etc.), présenter un intérêt, mais ils n’ont pas leur place dans l’évaluation courante du GPP.
L’examen méthodique, détaillé et sous dilatation de la TNO reste un élément clé de l’évaluation du GPP et de l’enregistrement de sa progression. L’analyse biomicroscopique du couple indissociable représenté par l’anneau neurorétinien (ANR) et l’excavation doit être minutieuse, avec une documentation précise de leurs caractéristiques, ainsi que celle du rapport C/D, en particulier vertical, qui doit être évalué en fonction de la taille du disque optique (DO) (voir chapitre 10-VI, paragraphe « Biomicroscopie et rétinophotographies »). Il faut savoir éliminer les faux positifs, en particulier en cas de présence d’un DO de grande taille. Enfin, le bilan est complété par la réalisation d’une photographie couleur de la TNO au rétinographe non mydriatique et sa répétition annuelle est fortement recommandée (voir fig.12-2).

Fig. 12-2 Glaucome prépérimétrique. a, b. Rétinophotographies œil droit (OD) et œil gauche (OG). c, d. Relevés FDT MatrixTM OD et OG. e, f. Relevés PAS blanc blanc OD et OG avec suivi d’évolution.
Cette évaluation constitue le temps essentiel de l’évaluation du GPP. Elle passe par la confirmation dans un premier temps de l’absence de déficit fonctionnel détectable par la technique de référence standard, en PAS blanc-blanc au programme SITA Standard de l’Humphrey ou DG2 de l’Octopus (voir fig. 12-2).
De nombreux travaux ont démontré l’intérêt des techniques d’analyse complémentaire de la fonction visuelle par la périmétrie à doublage de fréquence (FDT MatrixTM) et par la PAS bleu-jaune (PBJ – SWAP). Celles-ci permettent une détection bien plus précoce d’un déficit fonctionnel du champ visuel que la PAS blanc-blanc. La réalisation d’une PAS BJ (programme DG2 Swap [Octopus] ou SITA Swap [Humphrey]) est conditionnée par l’existence de milieux intra-oculaires clairs. Les critères optimaux pour retenir un déficit en PAS BJ comprennent un groupe d’au moins 4 points contigus à p<5 % ou d’au moins 3 points contigus à p<1 % [10].
Un certain nombre de données récentes rapportent une plus haute sensibilité du FDT MatrixTM dans la détection d’un déficit fonctionnel précoce, avec un intérêt particulier en tant que technique diagnostique complémentaire de l’analyse en tomographie par cohérence optique pour la détection du GPP [4, 5] (voir fig. 12-2). Les critères minimaux d’une atteinte fonctionnelle à retenir sont identiques à ceux de la stratégie SITA Standard, avec au moins 3 points contigus déficitaires à p<5 % dont au moins 1 point à p<1 % et/ou le Glaucoma hemifield test (GHT) en dehors de la normale.
Il est impératif par ailleurs d’obtenir un certain nombre de relevés du champ visuel afin d’évaluer la reproductibilité des résultats avant d’affirmer le diagnostic, compte tenu de la courbe d’apprentissage fréquente associée à la réalisation des tests.
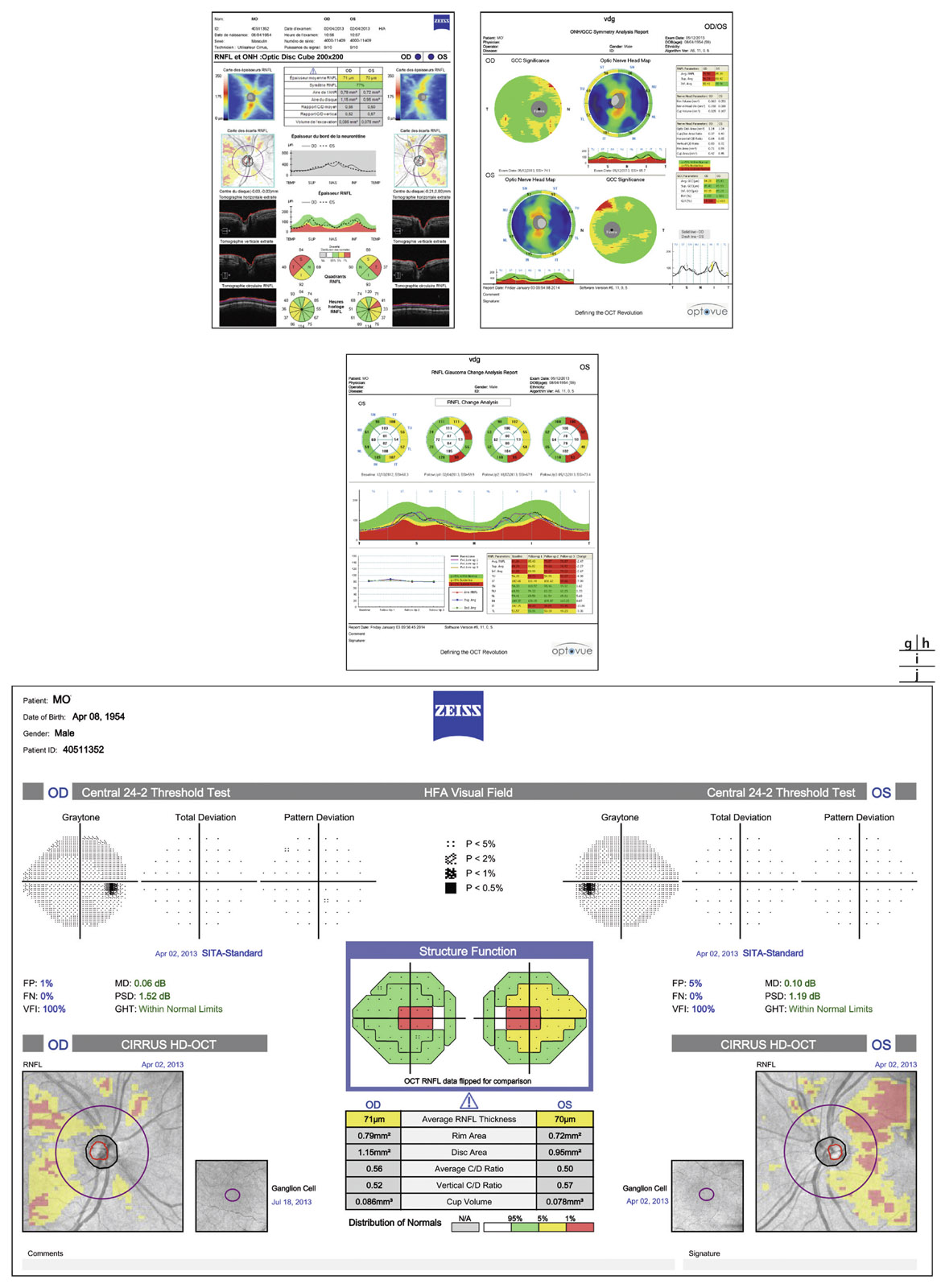
Fig. 12-2 g, h. Relevés OCT-SD Cirrus et RTVue : FNR, TNO et maculaire OD et OG avec suivi d’évolution des FNR OG (i). j. Relevé d’analyse combinée structure fonction (OCT – CV 24-2). (Clichés J.-P. Renard.)
Plusieurs systèmes d’imagerie sont facilement disponibles pour venir en aide dans le diagnostic et la prise en charge du GPP ainsi que pour le suivi de la progression.
L’ophtalmoscopie confocale à balayage laser (CSLO – HRT3), la polarimétrie à balayage laser (GDx) et surtout la tomographie par cohérence optique (OCT-SD) permettent la mise en évidence d’un certain nombre de modifications structurales quantifiables comme les pertes en FNR et les encoches de l’ANR qui précèdent souvent les pertes fonctionnelles au niveau du champ visuel, et qui peuvent ainsi être mesurées afin de déterminer un risque initial et un suivi approprié.
L’étude de la couche des FNR en OCT-SD rapporte un pouvoir discriminant du GPP supérieur à l’analyse en ophtalmoscopie confocale à balayage laser (HRT3), avec notamment une plus grande sensibilité de l’analyse de la couche des FNR dans les secteurs temporaux supérieur et inférieur [7].
L’évaluation du complexe maculaire cellulaire ganglionnaire, grâce aux nouveaux OCT-SD, rapporte l’intérêt de certains paramètres, en particulier des indices GLV (Global loss volume) et GCIPL dans la détection des GPP et des glaucomes précoces [2, 3, 9]. D’autres études rapportent une meilleure performance diagnostique des lésions glaucomateuses prépérimétriques par l’analyse des FNR en OCT-SD [8] (voir fig. 12-2).
Enfin, de récentes données en angiographie OCT quantitative du flux sanguin du nerf optique rapportent des réductions significatives de la perfusion de la TNO par rapport aux sujets normaux chez les patients atteints de GPP. Ces constatations sur une étude pilote indiquent que l’angiographie OCT peut détecter les anomalies de perfusion de la TNO, et a le potentiel de révéler les mécanismes du flux sanguin de la TNO en relation avec le glaucome [6].
L’interprétation de ces analyses automatisées nécessite une technique rigoureuse, avec une élimination des résultats faux positifs, en particulier chez les patients myopes chez qui l’on peut observer jusqu’à 17 % de faux positifs, et une confrontation soigneuse avec l’ensemble des données de l’examen clinique. L’évaluation longitudinale et la reproductibilité des résultats sont essentielles.
Ces six étapes de l’évaluation du GPP sont importantes, afin de déterminer la nécessité de la mise en place ou non d’un traitement, ainsi que la fréquence des visites de suivi, en passant par une synthèse méthodique des antécédents, de l’examen clinique et de l’interprétation des différents tests. Bien que le calculateur de risque de l’étude OHTS puisse être un complément utile, cette décision reste fondée sur un jugement clinique qui doit être rigoureux et bien synthétisé.
Tous les résultats cités doivent être confrontés avec prudence. La valeur prédictive positive d’une atteinte isolée en imagerie automatisée des FNR reste controversée et doit encore faire l’objet de doute. Le risque serait de considérer ces patients « glaucomateux » et d’initier un traitement. Il est important de ne pas recommander de traiter un GPP diagnostiqué initialement uniquement sur les résultats des imageries. Enfin, la nécessité d’une évaluation longitudinale suffisamment étoffée, en particulier pour l’évaluation du taux du changement de l’atteinte structurale du nerf optique, constitue une aide critique importante pour préciser le statut clinique du patient, et différencier le GPP d’une neuropathie optique glaucomateuse à progression rapide.
Les techniques d’évaluation de la progression ont considérablement évolué ces dernières années avec l’acquisition de nouveaux programmes d’analyse aussi bien pour le suivi d’évaluation de l’atteinte fonctionnelle et que pour celui de l’atteinte structurale.
Les différents programmes permettent d’obtenir des informations précises et précoces afin de signaler une progression récente, mais également d’anticiper sur le moyen terme l’évolution de la progression à venir.
Si son analyse reste subjective et soumise à l’expérience de l’observateur, la photographie de la TNO est d’un intérêt capital, en particulier dans le GPP pour lequel la réalisation d’une photographie annuelle de la TNO est fortement recommandée.
Le suivi de la progression de l’atteinte de la couche des FNR en OCT-SD a considérablement évolué. Il bénéficie de programmes d’analyses du même principe que ceux de l’analyse de la progression du champ visuel (voir fig. 12-2).
Le suivi du complexe maculaire cellulaire ganglionnaire en OCT-SD a démontré sa sensibilité dans la détection du GPP en s’intéressant en particulier aux indices complémentaires rapportés par certains OCT-SD, notamment à l’indice Global loss volume (GLV) de l’OCT-SD RTVue [2].
Enfin, les possibilités encore plus récentes d’obtenir des rapports combinés avec analyse de la structure et analyse de la fonction sur le même graphe, et une superposition des différentes données des paramètres relevés, apportent là encore des espoirs supplémentaires d’un suivi longitudinal de la progression plus précis et de meilleure qualité (voir fig. 12-2).
Le but de la prise en charge de la neuropathie optique glaucomateuse est de préserver la fonction visuelle et de maintenir la qualité de vie du patient.
Y a-t-il un inconvénient à retarder la mise en place d’un traitement d’un patient atteint de GPP ?
Nous ne disposons pas à l’heure actuelle d’étude randomisée concernant uniquement les patients atteints de GPP.
Étant donné la qualité et la performance des techniques d’évaluations longitudinales actuelles pour dépister une progression éventuelle de l’atteinte structurale et détecter une atteinte fonctionnelle débutante, nous pouvons éviter le traitement de tous les patients atteints de GPP. La détection ainsi plus précoce et plus précise de « progresseurs rapides », mieux sélectionnés, leur permettrait de bénéficier d’un traitement plus adapté, et d’éviter un traitement prophylactique systématique trop précoce.
Une analyse de synthèse de différentes études concernant les patients suspects de glaucome a fait l’objet d’une recherche de consensus par 11 experts, avec l’élaboration d’un système de points que l’on puisse attribuer au patient atteint de GPP en fonction de différents facteurs associés, afin d’établir si l’intérêt d’un traitement est approprié, incertain ou inapproprié en fonction des résultats. D’un intérêt certain, cette recherche de consensus présente cependant l’inconvénient de ne pas prendre en compte le rôle potentiel de certains facteurs comme l’ethnie. Elle manque de précision pour d’autres facteurs, et reste encore à valider pour son utilité en pratique clinique courante [1].
La neuropathie optique glaucomateuse est une affection lentement progressive dans la majorité des cas. Il existe des exceptions où la progression de l’atteinte structurale est nette, même sans changement fonctionnel objectif en PAS, mais qui justifie alors un traitement hypotonisant. Cependant, à côté de ces cas, il en existe de nombreux où la confirmation structurale de la neuropathie est moins certaine, avec une absence de perte fonctionnelle visuelle même minime. C’est tout l’avantage des nouvelles techniques d’analyse de progression de suivi, dont nous disposons notamment avec les programmes GPA, qui permettent à la fois de mieux dépister l’atteinte et d’évaluer sa progression.
Il a bien été établi qu’il existait une variabilité importante du taux de progression de la neuropathie optique glaucomateuse entre les sujets. Cela souligne toute l’importance du suivi étroit de ce type de patients atteints de GPP avec un minimum d’examens initiaux.
Six examens du champ visuel et six examens en OCT sont conseillés, si possible les deux premières années, comme bilan de départ.
Il est important de définir le cours individuel de progression de la maladie qui révélera souvent, pour de nombreux GPP, l’absence de traitement hypotonisant nécessaire. On sait en effet et on a bien démontré le manque d’observance d’un traitement prescrit trop précocement source d’une diminution chronique de l’observance du traitement et devenant ainsi un facteur de risque de progression à lui seul pour la neuropathie.
Le patient atteint de GPP suffisamment informé du risque évolutif et ayant bien compris cette information préfère souvent éviter tout traitement. Ces patients sont beaucoup plus volontaires à un compromis de visites plus fréquentes avec la réalisation, en fonction des circonstances, de tests de dépistages éventuellement plus nombreux. Ces contrôles réguliers sont le gage d’une relation médecin–malade de qualité, à l’origine d’une information renouvelée qui garantit une prise en charge mieux comprise et acceptée par le patient atteint d’un GPP. Ils sont également le gage de l’acceptation de cette évaluation longitudinale avec un meilleur suivi au long cours. Tous ces éléments vont permettre d’augmenter les chances d’une meilleure observance d’un éventuel traitement ultérieur.
L’absence de preuve d’effet bénéfique de l’initiation d’un traitement chez un patient atteint de GPP, sans atteinte fonctionnelle, associé uniquement à l’existence d’une atteinte structurale au niveau de la TNO ou des FNR, combinée avec le progrès technologique des différents moyens diagnostiques et de suivi de la neuropathie optique glaucomateuse justifie une surveillance des patients, qui permet ainsi d’éviter le coût d’un traitement supplémentaire et de réduire la prise en charge de ces patients d’environ 50 %, comme le rapportent plusieurs études [11].
Les moyens diagnostiques et d’évaluation prédictive ont considérablement évolué avec l’acquisition de précision aussi bien dans l’analyse qualitative que dans l’analyse quantitative du retentissement au niveau structural et fonctionnel. L’amélioration de la résolution des différents moyens technologiques permet d’obtenir une information longitudinale individuelle capitale et nécessaire pour la prise en charge de ces patients. Lorsqu’elle est possible, elle permet ainsi d’éviter d’initier un traitement chez les patients atteints de GPP, en dehors des formes cliniques de patients détectés « progresseurs rapides ».
Pour les autres cas, nous savons que la neuropathie optique glaucomateuse progresse en général lentement. Ainsi, la plupart des patients considérés atteints de GPP, soumis à des examens répétés à intervalles réguliers, conduits par un spécialiste averti connaissant bien les avantages ainsi que les limites des moyens diagnostiques et d’analyse de la progression dans une démarche attentive et flexible en fonction des circonstances, seront rarement mis en danger.
Une bonne connaissance des différents moyens diagnostiques cliniques associée à une attitude vigilante et adaptée de l’ophtalmologiste évitera toute perte de chance du patient atteint de GPP, en particulier si des contrôles réguliers sont possibles.
Retenir
La variabilité importante du taux de progression de la neuropathie optique glaucomateuse entre les sujets souligne toute l’importance du suivi étroit de ce type de patients atteints de GPP avec un minimum d’examens initiaux (tableau 12-4).
Les nouvelles techniques d’analyses permettent à la fois de mieux dépister l’atteinte et d’évaluer sa progression.
Le cours individuel de progression de la neuropathie passe par la réalisation d’un nombre suffisant d’examens d’évaluation de l’atteinte structurale et fonctionnelle, qui souvent confirmera l’inutilité d’un traitement hypotonisant pour de nombreux GPP.
La surveillance des patients dans une démarche attentive et flexible en fonction des circonstances permet souvent d’éviter la charge et le coût d’un traitement supplémentaire.
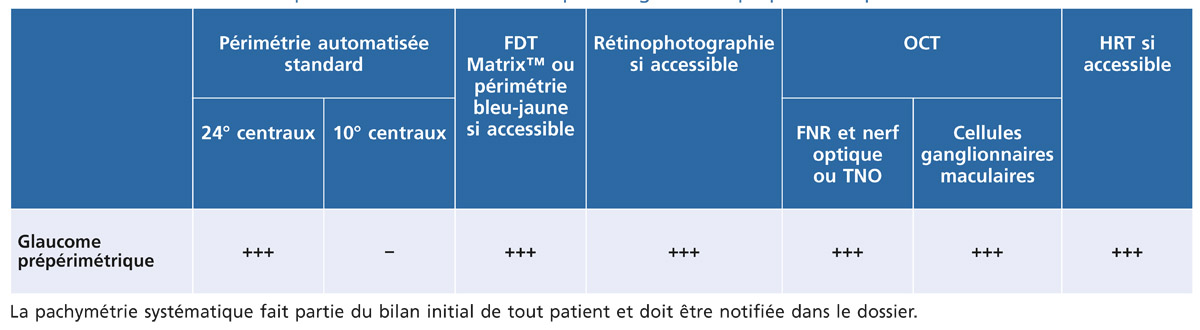
Tableau 12-4 – Examens complémentaires recommandés pour le glaucome prépérimétrique.
[1] Appropriateness of treating glaucoma suspects RAND study group. For which glaucoma suspects is it appropriated to initiate treatment. Ophthalmology. 2009 ; 116 : 710-16.
[2] Arintawati P, Sone T, Akita T, et al. The applicability of ganglion cell complex parameters determined from SD-OCT images to detect glaucomatous eyes. J Glaucoma. 2012. Epub ahead of print.
[3] Delbarre M, El Chehab H, Francoz M, Renard JP. Diagnostic use of macular layer analysis by SD-OCT in primary open-angle glaucoma. J Fr Ophtalmol. 2013 ; 36 : 723-31.
[4] Hirashima T, Hangai M, Nukada M, et al. Frequency-doubling technology and retinal measurments with spectral domain optical coherence tomography in preperimétric glaucoma. Graefes Arch Clin Exp Ophthalmol. 2013 ; 251 : 129-37.
[5] Horn FK, Mardin CY, Bendschneider D, et al. Frequency doubling technique perimetry and spectral domain optical coherence tomography in patients with early glaucoma. Eye. 2011 ; 25 : 17-29.
[6] Jia Y, Morrison JC, Tokayer J, et al. Quantitative OCT angiography of optic nerve head blood flow. Biomed Opt Expres. 2012 ; 3 : 3127-37.
[7] Lisboa R, Leite MT, Zangwill LM, et al. Diagnosing preperimetric glaucoma with spectral domain optical coherence tomography. Ophtalmology. 2012 ; 119 : 2261-9.
[8] Lisboa R, Paranhos A, Weinreb RN, et al. Comparison of different Spectral Domain OCT scanning protocols for diagnosing preperimetric glaucoma. Invest Ophthalmol Visc Sci. 2013 ; 54 : 3417-25.
[9] Nakano N, Hangai H, Mori S, et al. Macular ganglion cell layer imaging in preperimetric glaucoma with speckle noise-reduced spectral domain optical coherence tomography. Ophthalmology. 2011 ; 118 : 2414-26.
[10] Polo V, Larrosa JM, Isilla I, et al. Optimum criteria for Short wavelength-automated perimetry. Ophthalmology. 2001 ; 108 : 285-9.
[11] Traverso CJ, Walt JG, Kelly SP, et al. Direct costs of glaucoma and severity of the disease a multinational long term study of resource utilisation in Europe. Br J Ophthalmol. 2005 ; 89 : 245-52.
Le bilan clinique et paraclinique d’un patient atteint d’un glaucome primitif à angle ouvert débutant passe par différentes étapes dont le respect rigoureux permettra de garantir le maximum de chances au patient.
Cette conduite est renforcée par une bonne connaissance de la possibilité d’une évolution dans 30 % des cas malgré un bon contrôle de la pression intra-oculaire.
Les tests appropriés lors des contrôles réguliers, adaptés en fonction des formes cliniques, permettent d’assurer une bonne évaluation de l’évolution.
Le glaucome primitif à angle ouvert (GPAO) d’évolution chronique et insidieuse affecte, aux stades précoces débutants, préférentiellement la vision périphérique. Habituellement asymptomatique, il se caractérise par une épargne relative de la vision centrale dans la majorité des cas jusqu’aux stades tardifs de la maladie.
Nous disposons de peu de données concernant les circonstances de découverte du glaucome débutant au stade précoce. Nous pouvons retenir trois grandes situations diagnostiques : lors d’un examen systématique, que la pression intra-oculaire (PIO) soit ou non élevée, à l’occasion d’un contrôle réalisé chez un patient avec des antécédents familiaux de GPAO, ou encore dans les circonstances de demande d’un second avis pour confirmation d’un diagnostic posé de glaucome débutant.
Les différentes études épidémiologiques rapportent que le diagnostic de glaucome débutant peut se poser à tout âge.
Les données plus récentes, en particulier concernant le dépistage de glaucomes non diagnostiqués lors de la mise en place de l’étude EMGT (Early Manifest Glaucoma Trial) chez un grand nombre de sujets (n = 32918) âgés de 55 à 79 ans, retrouvent un plus grand nombre de stades précoces du glaucome chez les sujets plus jeunes, où il représente 50 % des cas de glaucomes dépistés. À partir de l’âge de 60 ans et au-delà, une répartition similaire des différents stades évolutifs du glaucome est retrouvée, avec une prédominance des stades précoces (35 %) ou modérés (31 %) au moment du diagnostic initial [8].
Ces résultats concernent à ce jour le plus important effectif de sujets ayant bénéficié d’un dépistage du GPAO. Ils permettent de conclure que, dans nos pays occidentaux, le GPAO débutant est plus fréquemment observé parmi les sujets situés dans les tranches d’âge les plus jeunes (< 60 ans), où il représente la moitié des glaucomes détectés.
Une fois le glaucome débutant déclaré et traité, le bilan doit préciser le degré d’atteinte structurale et fonctionnelle de la neuropathie. L’enjeu majeur consiste à s’assurer de la stabilité ou non de l’évolution par le traitement ; on vérifiera également la tolérance et l’observance de celui-ci.
Le bilan passe donc par des étapes cliniques et paracliniques similaires à celui réalisé en cas de glaucome prépérimétrique, auxquelles viennent s’ajouter celles de l’évaluation de l’efficacité du traitement, de sa tolérance ainsi que de son observance.
L’interrogatoire s’intéresse avant tout au dépistage de toute modification symptomatique ou fonctionnelle survenue depuis la dernière consultation, avec une recherche systématique :
de signes fonctionnels visuels qui peuvent être ressentis par le patient : variation de l’acuité visuelle, photophobie, etc. ;
de symptômes d’altération de la surface oculaire à type d’irritation à l’instillation ou chronique (démangeaisons, brûlures, larmoiement, sensation de corps étranger, sensation de sécheresse).
L’ensemble des facteurs de risque de progression du GPAO doit être à nouveau évalué. La recherche d’une possible nouvelle pathologie associée (syndrome d’apnée du sommeil, maladie cardiovasculaire, hypercholestérolémie, etc.) ainsi que l’initiation de tout nouveau traitement sur le plan systémique peuvent traduire un facteur de risque non évoqué spontanément par le patient, ou encore avoir une influence indirecte sur la mesure de la PIO (traitement systémique par bêtabloquants).
Un examen ophtalmologique complet doit être réalisé lors de toute visite de contrôle au cours du suivi régulier d’un glaucome, quel que soit le stade de son évolution.
Si elle ne constitue pas un paramètre de surveillance spécifique du glaucome, la mesure de la meilleure acuité visuelle corrigée permet de rechercher le retentissement d’une éventuelle nouvelle pathologie associée. Son résultat sera comparé à la mesure de référence réalisée lors des examens précédents et il permettra d’assurer les meilleures conditions pour la réalisation de l’examen du champ visuel (CV) de contrôle.
Systématique, cet examen débute, quel que soit le stade du GPAO, par un examen de la surface oculaire. Bien que plus fréquente chez les patients plus âgés, dans les formes cliniques plus évoluées du GPAO et en cas de traitements multiples, toute altération de la surface oculaire doit être dépistée en raison de ses conséquences sur l’adhérence au traitement et la qualité de vie du patient [1] (voir chapitre 10-VI, paragraphe « Biomicroscopie et rétinophotographies »).
L’examen s’assure de l’absence de tout élément susceptible d’influer sur la mesure de la PIO, et de tout trouble des milieux (phakosclérose) pouvant altérer la fiabilité et la qualité de la réalisation du relevé du CV.
Tous ces éléments seront notés dans le dossier de suivi du patient, et confrontés aux données des examens précédents pour en tenir compte lors de l’interprétation des résultats paracliniques.
Le renouvellement régulier tout les 2 à 3 ans de l’examen gonioscopique est essentiel en raison des modifications anatomiques liées à l’augmentation de volume du cristallin avec l’âge, à l’origine d’un rétrécissement progressif de l’angle iridocornéen.
Réalisée si possible toujours avec la même technique, cette mesure permet de vérifier l’effet pressionnel du traitement prescrit. Elle sera effectuée en fonction des circonstances, soit à des horaires identiques dans la journée, soit à des horaires variables, avec trois mesures de la PIO pour une évaluation de qualité.
On vérifiera que l’épaisseur cornéenne centrale (ECC), indispensable pour l’interprétation de la PIO, ait été mesurée et notée dans le dossier.
On profitera de ce temps essentiel du contrôle de la PIO par aplanation pour s’assurer que le patient ne présente pas de difficulté particulière à la tolérance du traitement lors de l’instillation. On recherchera la notion d’oubli de prise thérapeutique en évoquant la difficulté du suivi régulier de la prescription.
Il est clairement établi qu’une PIO moyenne élevée constitue un facteur de risque de progression chez tout patient glaucomateux. En cas de PIO moyenne basse, certaines études rapportent que les variations de la PIO constituent un facteur de risque de progression chez ces patients. Ces données sont à l’origine du principe de modulation de la PIO introduit par Caprioli [2].
Il est nécessaire d’évaluer la PIO moyenne et ses fluctuations initiales, si cela n’a pas été pratiqué lors des précédentes consultations, en réalisant si possible soit une courbe diurne de la PIO, soit plusieurs mesures à différents horaires lors des premières consultations successives, même si la reproductibilité à court terme des courbes de mesures de la PIO chez les sujets sains et les patients présentant un GPAO a été remise en cause [12, 13].
La calibration du tonomètre à aplanation doit être régulièrement contrôlée, idéalement tous les 2 à 3 mois, afin d’obtenir une réduction maximale du risque d’erreurs de mesures [4] (voir chapitre 9-II, paragraphe « Techniques de mesure de la pression intra-oculaire »).
Une fois la mesure de PIO réalisée, on vérifiera dans le dossier du patient si son résultat correspond à la PIO cible qui avait été fixée lors des examens précédents, et qu’il faudra réévaluer tout au long de l’évolution de la maladie à chaque consultation.
L’analyse biomicroscopique soigneuse de la tête du nerf optique (TNO) est un temps essentiel. Elle doit être réalisée lors de chaque contrôle chez tout patient présentant un GPAO, quel que soit le stade de la neuropathie.
L’examen s’attache à relever tout élément évocateur du diagnostic ou de la progression d’une atteinte structurale avant de consulter ces éléments sur le dossier du patient. Cette attitude rigoureuse évite d’être influencé lors de l’examen clinique. Elle permet ensuite de confirmer ou d’infirmer leur réalité lors des examens précédents, permettant ainsi de mettre en évidence une progression ou de confirmer la stabilité de l’examen clinique (voir chapitre 10-VI, paragraphe « Biomicroscopie et rétinophotographies »).
La présence d’une atrophie péripapillaire bêta sera relevée. On vérifiera sa notification dans le dossier du patient. Sa présence doit rendre l’examen de l’anneau neurorétinien correspondant au même secteur plus vigilant, en raison de la plus grande fréquence d’atteinte des fibres nerveuses rétiniennes (FNR) dans le même secteur correspondant.
L’examen recherche également avec attention la présence d’une hémorragie du disque optique qui doit alerter et être considérée comme un signe de progression chez tout patient présentant un GPAO [5].
L’analyse de la TNO dans le cadre du bilan du GPAO ne peut se limiter à un examen à l’aide d’une lentille (90 D ou autre) qui nécessite, pour être exempt d’erreur, une bonne expérience de l’examinateur. Une rétinophotographie au minimum annuelle complétera l’examen clinique.
La réalisation régulière de rétinophotographie de la tête du nerf optique, en moyenne une fois par an, permet d’enrichir par un document iconographique supplémentaire le suivi de tout patient atteint de glaucome. Son analyse soigneuse à l’issue de l’examen et sa comparaison avec le document de référence de l’examen initial permettent souvent de mettre en évidence certains signes évolutifs passés inaperçus à l’examen clinique (fig. 12-3).
La recherche systématique d’une modification progressive au niveau de la TNO sur les rétinophotographies a été rapportée comme étant un facteur hautement prédictif pour un développement futur de perte fonctionnelle du CV chez les patients glaucomateux. Dans une série de 639 yeux de 407 patients atteints de glaucome prépérimétrique et de glaucome débutant suivis en moyenne pendant 8 ans, la recherche de facteurs de risque prédictifs d’une perte fonctionnelle a été évaluée et a souligné l’importance des modifications structurales au niveau des rétinophotographies en tant que facteurs prédictifs. La présence d’une progression du disque optique était le facteur prédictif de conversion le plus important des facteurs de risque de développement du glaucome, comme la PIO et l’épaisseur cornéenne [10]. Ces résultats suggèrent l’importance du suivi soigneux de l’aspect du disque optique chez les patients présentant un glaucome débutant, un glaucome prépérimétrique ou encore suspects de glaucome.
L’examen clinique rigoureux, par étapes, ainsi réalisé, associé à la rétinophotographie, permet une évaluation initiale de l’ensemble des paramètres du glaucome débutant et assure un suivi de qualité, sous condition d’un enregistrement précis et détaillé des résultats dans le dossier du patient, par l’examinateur vigilant.
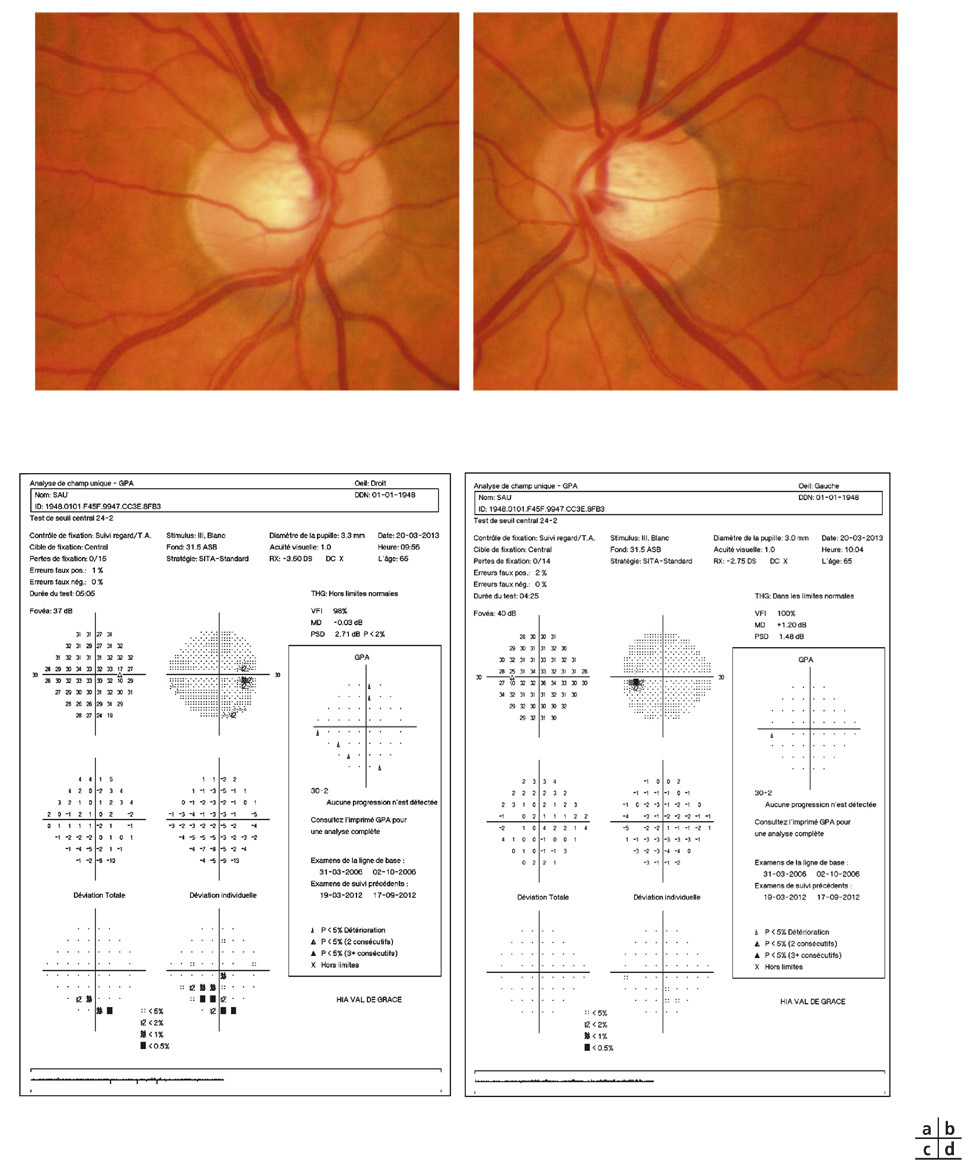
Fig. 12-3 GPAO débutant. a, b. Rétinophotographies œil droit (OD) et œil gauche (OG). c, d. Relevés du CV en PAS blanc-blanc OD et OG.
La détection de l’atteinte du CV ainsi que son suivi font partie intégrante de la prise en charge du patient atteint de GPAO dès le stade de glaucome débutant.
Le bilan de l’atteinte fonctionnelle impose un certain nombre de recommandations :
utiliser des tests de seuils ;
réaliser toujours le même programme et la même stratégie ; classiquement, test de seuil 24°-2 SITA-Standard (Humphrey) ou DG2 (Octopus) avec le même appareil et le même programme afin d’obtenir des résultats comparables en utilisant à ce stade une stratégie blanc-blanc puisque le glaucome est diagnostiqué (voir fig. 12-3) ;
rechercher une atteinte précoce de l’hémi-CV supérieur, plus fréquente aux stades débutants de l’atteinte fonctionnelle de la neuropathie optique glaucomateuse.
Les déficits les plus précoces du CV surviennent au niveau des régions arciformes supérieure et inférieure du CV (dans les 15°), mais également souvent dans la région maculaire supérieure du CV (5°) et peu dans la région maculaire inférieure.
Les déficits à l’intérieur des 10° centraux sont fréquents dans le glaucome débutant. Certains travaux rapportent une prépondérance des déficits dans les 5° centraux, spécialement au niveau du CV supérieur, chez des patients normaux ayant développé les premiers déficits au niveau du CV, ainsi qu’une atteinte des 3° centraux dans plus de 50 % des yeux atteints de glaucome débutant ou modéré [14, 15].
Ces études confirment l’association de lésions maculaires précoces du CV avec l’atteinte des classiques faisceaux arciformes.
Ces lésions paracentrales peuvent être sous-estimées voire ignorées par l’analyse du CV classique aux tests 24°-2 et 30°-2 utilisant une grille de points séparés de 6°.
C’est tout l’intérêt de l’analyse complémentaire, dans le glaucome débutant, du CV central 10°, en particulier du 10°-2 qui analyse 32 points dans les 8° centraux à partir d’un degré du centre fovéolaire. Les déficits de la macula sont souvent, si ce n’est typiquement, de forme arciforme.
On retiendra les critères diagnostiques minimaux d’un déficit : sur les cartes de déviation individuelle, groupe d’au moins 3 points contigus à un indice de probabilité p<5 % dont 1 point à un indice p<1 %, ou encore index GHT (Glaucoma hemifield test) en dehors des limites de la normale.
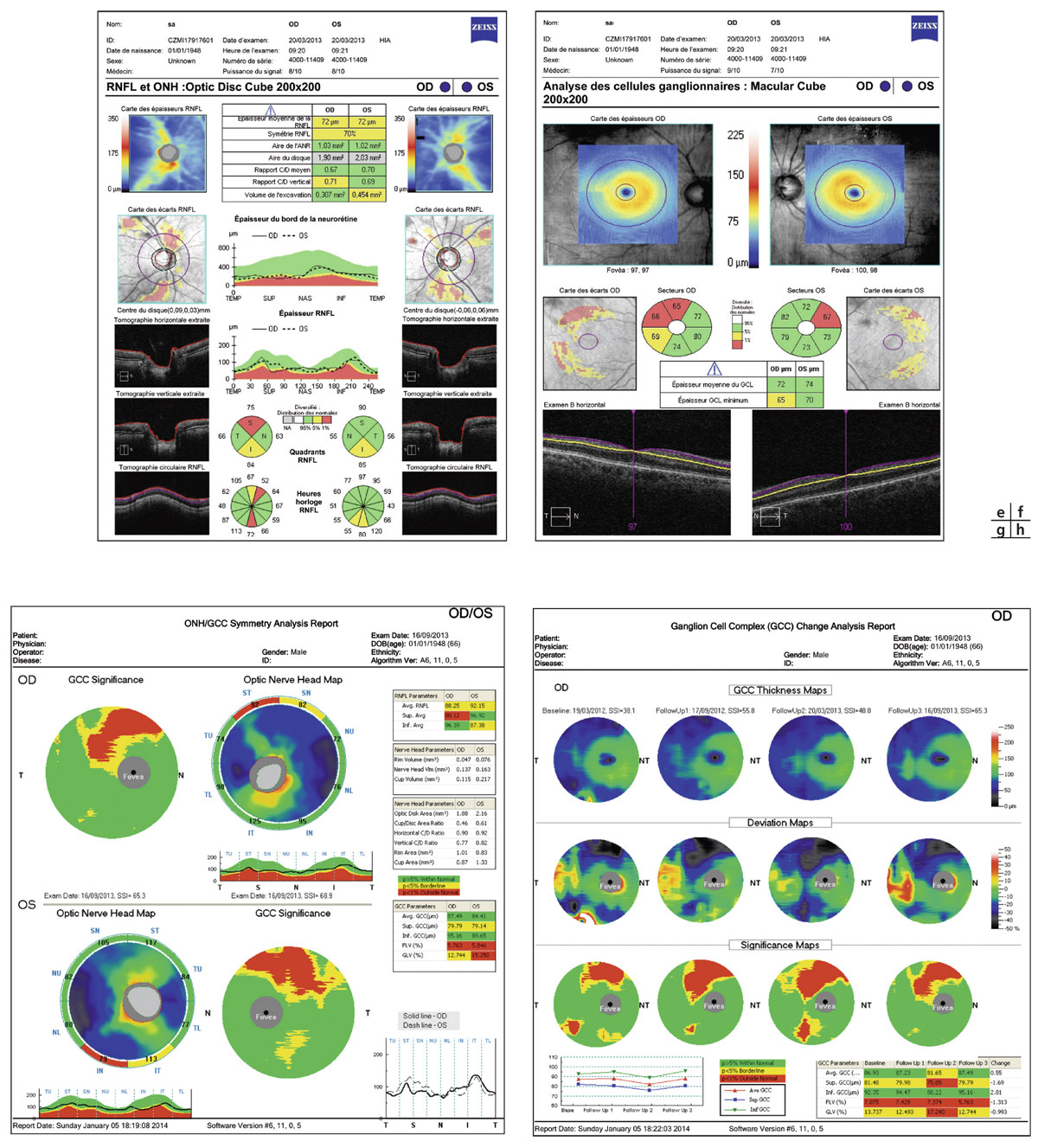
Fig. 12-3 e. Relevés OCT-SD FNR et TNO. f. Relevé OCT-SD complexe cellulaire ganglionnaire plexiforme interne (Crrus HD-OCT). g, h. Relevés complexe maculaire et suivi d’évolution (OCT-SD RTVue).
Connaître le taux de progression de l’atteinte fonctionnelle est fondamental dans la prise en charge de tout patient atteint de GPAO.
Les études rétrospectives et prospectives longitudinales ont montré que les taux de progression varient largement parmi les patients glaucomateux. Par ailleurs, les études sur les facteurs de risque de progression ont rapporté qu’une progression plus rapide de l’atteinte fonctionnelle est un facteur prédictif de progression. Le taux de progression est le facteur prédictif de progression le plus fort pour une progression future [11].
L’analyse de la progression de l’atteinte fonctionnelle permet de différencier les « progresseurs rapides » des « progresseurs lents ». Elle constitue ainsi une des pierres angulaires de la prise en charge du glaucome, avec une influence importante sur la décision thérapeutique.
Lors de l’examen du CV, il faut se souvenir que la variabilité de la sensibilité des différents points testés, au cours du test et d’un test à l’autre, explique qu’une vraie progression est difficile à déterminer. Dans les zones de pertes du CV glaucomateux, cette variabilité de sensibilité peut être quatre fois plus grande que dans les zones de sensibilité normale du CV (voir chapitre 11-II, paragraphe « Évaluation de la progression de l’atteinte fonctionnelle ».
Un certain nombre de recommandations peuvent être retenues :
réaliser un nombre suffisant d’examens du CV pour détecter un niveau de perte moyenne de l’indice MD. En fonction de la sévérité du glaucome, et du traitement, les études rapportent pour les GPAO à PIO élevée une perte moyenne de – 1,31 ± 1,93 dB ; chez les patients atteints de GPN, des taux de progression plus bas, – 0,36 ± 0,94 dB ; enfin, les patients plus jeunes avaient des taux de progression bien plus faibles que les patients plus âgés – 0,6 ± 1,69 dB et, au-delà de 68 ans, – 1,48 ± 2,28 db [7] ;
réaliser un nombre maximal d’examens les deux premières années (recommandation classique). Dans l’idéal, pour dépister les sujets à progression rapide (≥ 2 dB par an), il faudrait réaliser 6 CV les deux premières années et établir une bonne base de données initiales [3] ;
utiliser les logiciels de suivi ;
confirmer l’aggravation par un autre examen du CV ;
corréler avec les résultats de l’examen clinique de la TNO des FNR.
Ces recommandations constituent un guide pratique pour détecter les différents taux de changements et pour leur interprétation dans l’analyse de la progression (fréquence des examens, etc.) [6] (tableau 12-5).
La détection de la progression nécessite :
d’utiliser tous les types d’analyse ;
de bien expliquer au patient l’importance et la fréquence des CV ainsi que la nécessité de les compléter par l’évaluation de la progression en imagerie.
La combinaison de l’ensemble des résultats est à la base de nombreuses décisions cliniques en fonction du contexte.

Tableau 12-5 – Examens complémentaires recommandés pour le glaucome débutant.
Une fois le GPAO diagnostiqué, suivi et traité, lors de chaque visite de contrôle, une analyse quantitative de l’atteinte structurale doit être réalisée. Complément de l’examen clinique, elle permet d’obtenir des mesures objectives et reproductibles des paramètres topographiques de la TNO et des FNR ainsi que du complexe maculaire cellulaire ganglionnaire.
Ces éléments sont évalués par les trois systèmes d’imageries automatisées représentés essentiellement par la tomographie par cohérence optique (OCT), plus rarement l’ophtalmoscopie confocale à balayage laser (HRT3) et, en voie d’extinction pour des raisons de moindre intérêt, la polarimétrie à balayage laser (GDx PROTM).
Cette technique a largement démontré sa sensibilité dans le diagnostic précoce du GPAO par l’analyse de la TNO qu’elle permet. On retiendra l’intérêt diagnostique particulier des analyses de l’indice MRA (Moorfields regression analysis) et de l’analyse de tendance de l’indice GPS (score de probabilité du glaucome).
Une étude complémentaire de l’OHTS (Ocular Hypertension Study) a démontré, chez les patients ayant développé un GPAO et suivis par HRT, un taux de perte de la surface de l’anneau neurorétinien (rim area [RA]) 5 fois plus important, surtout pour les yeux présentant les PIO les plus élevées. La mesure du taux de modification de cet indice peut ainsi donner une information importante pour la prise en charge des patients atteints d’HTO ou de glaucome débutant [17].
Le suivi de la progression dans le temps grâce au programme d’analyse de modification topographique (AMT), indépendant du plan de référence, est particulièrement performant pour différencier une vraie progression d’une variabilité des mesures qui est évaluée lors de chaque examen (voir chapitre 10-VI, paragraphe « Heidelberg Retina Tomograph (HRT) » [16]).
L’examen de tout patient présentant un glaucome débutant doit s’accompagner d’une évaluation de l’atteinte de la structure au niveau des trois sites d’analyse possible en OCT-spectral domain [OCT-SD] :
la couche des FNR avec l’acquisition péripapillaire ;
les paramètres de la TNO ;
et l’analyse du complexe maculaire cellulaire ganglionnaire, plus récente.
L’interprétation des relevés passe par une analyse attentive de tous les paramètres, une bonne connaissance des pièges à éviter ainsi que des critères à retenir pour le suivi de l’évolution de l’atteinte structurale (voir fig. 12-3) (voir chapitre 9-IV, paragraphe « Tomographie par cohérence optique » et chapitre 10-VI, paragraphe « OCT dans le GPAO »).
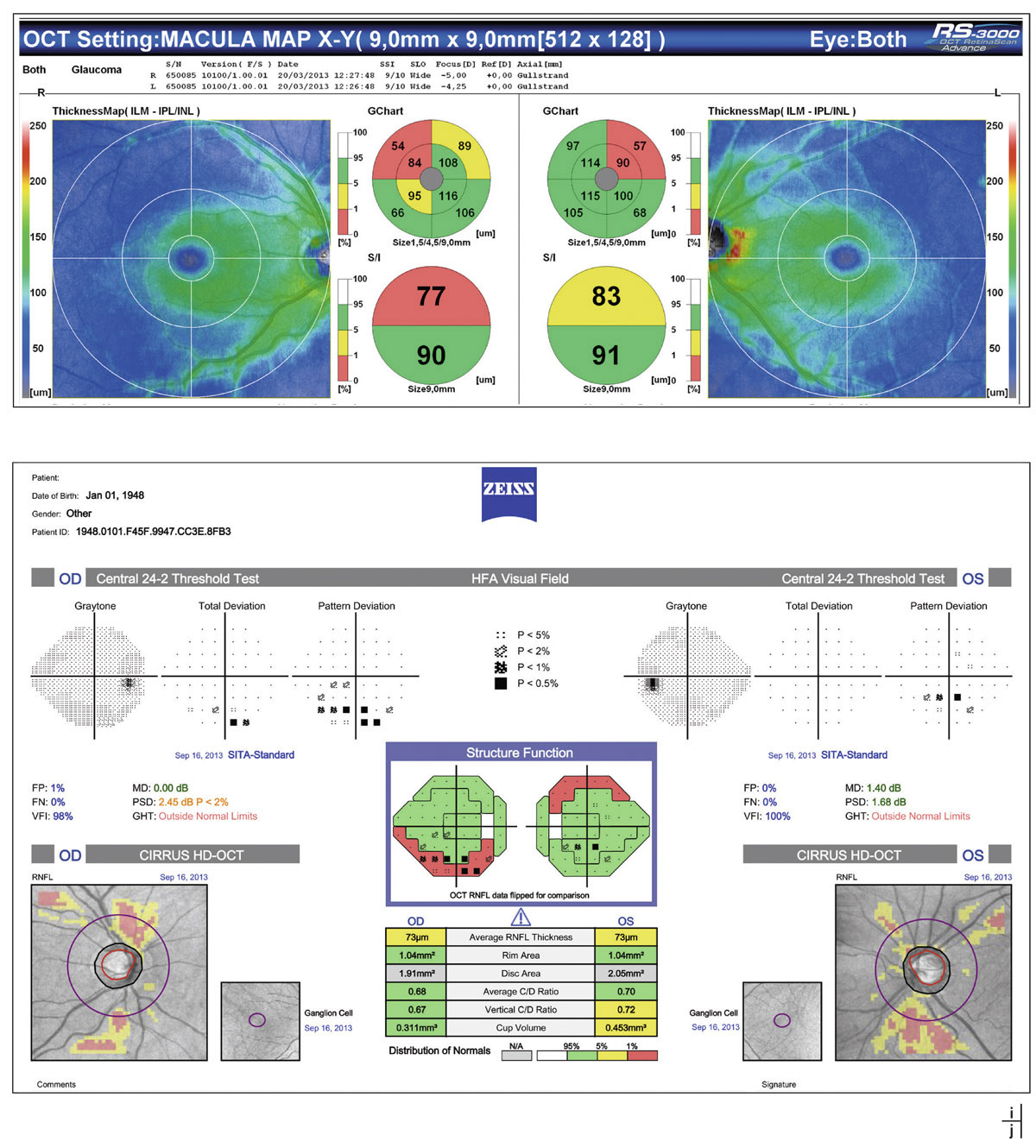
Fig. 12-3 i. OCT-SD RS 3000 Nidek. j. Rapport combiné CV 24-4 et relevés OCT-SD (Zeiss). (Clichés J. P. Renard).
Une fois le diagnostic de glaucome débutant confirmé, il faut dans un premier temps, comme nous l’avons vu, détecter le type évolutif de la forme clinique présentée par chaque patient. Dans la mesure du possible, il faut réaliser, au cours des deux premières années du suivi, un maximum d’examens du CV et d’OCT pour l’analyse structurale des FNR et de la TNO, afin d’identifier et d’établir le type de progression plus ou moins rapide pour une prise en charge adaptée.
En cas de glaucome stable bien contrôlé par le traitement médical, un examen clinique de contrôle tous les 6 mois et un bilan complet, clinique et paraclinique, annuel sont le plus souvent pratiqués.
En cas de glaucome apparemment évolutif, le suivi doit être plus étroit, tous les 3 ou 4 mois, ou plus souvent encore si la PIO est mal contrôlée.
Lors de chaque visite de contrôle, la synthèse des examens cliniques et paracliniques doit comprendre un entretien singulier adapté à chaque patient et au stade évolutif du GPAO, avec la reprise systématique d’une information claire et concise sur l’évolution de la neuropathie.
Des analyses sur des grands échantillons de population ont suggéré que, même en cas de perte du CV modérée chez les patients ayant un glaucome débutant, il existait déjà un impact négatif significatif dans les mesures de qualité de vie en relation avec la vision [9].
Ce facteur doit être évalué et son impact pris en compte. Il souligne la nécessité d’une détection et d’un traitement précoces du glaucome avant qu’une perte significative du CV se soit développée.
L’information s’attachera à souligner l’importance du suivi clinique régulier, avec la fréquence des examens du CV pour le contrôle de l’atteinte fonctionnelle.
La nécessité de la prise en charge des facteurs de risque sera à chaque fois reprécisée.
Enfin, l’observance thérapeutique sera évaluée par une série de questions indirectes afin de rechercher avec le patient les moyens de l’améliorer en fonction de ses activités et de son mode de vie (voir chapitre 17-II, paragraphe « Observance, adhérence et persistance au traitement »).
Cette conduite pratique, associée aux progrès sans cesse croissants des techniques d’analyse de l’atteinte fonctionnelle et structurale, permettra une prise en charge et un suivi du patient atteint de GPAO dès le stade débutant dans les meilleures conditions.
Retenir
Le bilan du GPAO débutant doit rester vigilant afin de dépister suffisamment précocement les formes cliniques à progression rapide pour une prise en charge adaptée.
L’examen clinique rigoureux, par étapes, ainsi réalisé, associé à la rétinophotographie, permet une évaluation initiale de l’ensemble des paramètres du glaucome débutant et assure un suivi de qualité, sous condition d’un enregistrement précis et détaillé des résultats dans le dossier du patient, par l’examinateur vigilant.
En aucun cas une modification de la prise en charge ne sera décidée sur les résultats d’un seul examen.
Toute modification de l’évolution mise en évidence par un des examens cliniques ou paracliniques doit non seulement être confirmée par un second examen en raison des variabilités intra- et interindividuelles des résultats aux tests cliniques et paracliniques, mais également être l’objet d’une synthèse avec l’ensemble des données des autres examens.
Une information claire, la plus complète possible, adaptée à chaque patient, en s’assurant qu’elle soit bien comprise, doit être un souci constant pour assurer la prise en charge dans les meilleures conditions.
[1] Baudouin C, Renard JP, Nordmann JP, et al. Prevalence and risks factors for ocular surface disease among patients treated over the long term for glaucoma or ocular hypertension. Eur J Ophthalmol. 2012 ; Epub ahead of print.
[2] Caprioli J, Varma R. Intraocular pressure : modulation as treatment for glaucoma. Am J Ophthalmol. 2011 ; 152 : 340-44.
[3] Chauhan BC, Garway-Heath BF, Goni FJ, et al. Practical recommandation for measuring rates of visual field change and glaucoma. Br J Ophthalmol. 2008 ; 92 : 569-73.
[4] Choudhari NS, George R, Baskaran M, et al. Measurement of Goldmann applanation tonometer calibration error. Ophthalmology. 2009 ; 116 : 3-8.
[5] de Moraes CG, Prata TS, Liebmann CA, et al. Spatialy consistant localized visual field lost before and after disc hemorrhage. Invest Ophthalmol Visc Sci. 2009 ; 50 : 4727-33.
[6] Giraud JM, Fénolland JR, Renard JP, et al. Analysis of a new visual field index : the VFI in ocular hypertension and glaucoma. J Fr Ophtalmol. 2010 ; 33 : 2-9.
[7] Heijl A, Bengtsson B, Hyman L, et al. Natural history of open angle glaucoma. Ophthalmology. 2009 ; 116 : 2271-6.
[8] Heijl A, Bengtsson B, Oskarsdottir SE. Prevalence and severity of undetected manifest glaucoma. Results from the Early Manifest Glaucoma Trial Screening. Ophthalmology. 2013 ; 120 : 1541-5.
[9] McKean-Cowdin R, Varma R, Wu J, et al. Los Angeles Latino Eye Study Group Severity of visual field lost and health-related quality of life. Am J Ophthalmol. 2007 ; 143 : 1013-23.
[10] Meideros FA, Alencar LM, Zangwil LM, et al. Prediction of fonctionnal lost and glaucoma from progressive optique disc damage. Arch Ophthalmol. 2009 ; 127 : 1250-56.
[11] Nouri-Mahdavi K, Hoffman D, Caprioli J. Prediction of visual field progression and glaucoma. Invest Ophthalmol Visc Sci. 2004 ; 45 : 4346-51.
[12] Realini T, Weinreb RN, Wisniewski S. Diurnal intraocular pressure patterns are not repeatable and the short term in healthy individuals. Ophthalmology. 2010 ; 117 : 1700-4.
[13] Realini T, Weinreb RN, Wisniewski S. Short term repeatability of diurnal intraocular patterns in glaucomatous individuals. Ophthalmology. 2011 ; 118 : 47-51.
[14] Schiefer U, Papageorgiou E, Sample PA, et al. Spatial pattern and glaucomatous visual field loss obtained with regionally condensed stimulus arrangements. Invest Ophthalmol Visc Sci. 2010 ; 51 : 5685-9.
[15] Su D, Parc SC, Simonson JL, et al. Progression pattern of initial parafoveal scotoma in glaucoma. Ophthalmology. 2012. Epub ahead of print.
[16] Vizzeri G, Weinreb RN, Martinez de la Casa JM, et al. Clinicians agreement in establishing glaucomatous progression using the HRT. Ophthalmology ; 2009 ; 116 : 14 24.
[17] Zangwil LM, Jan S, Dirkes K, et al. The rate of structural change : the Confocal Scanning Laser Ophtalmoscopy Ancillary study to the ocular hypertension treatment. Study Am J Ophthalmol. 2013 ; 155 : 971-82.
Le bilan d’un glaucome modéré est similaire à celui d’un glaucome débutant.
Une attention particulière doit être prise à certaines étapes de l’interrogatoire et de l’examen clinique.
Les particularités cliniques et paracliniques pour un dépistage optimal d’une progression doivent être bien connues.
De nouveaux paramètres de surveillance spécifiques au patient et à la relation établie à ce stade clinique du glaucome sont essentiels pour adapter la prise en charge et la fréquence des contrôles.
Le glaucome modéré correspond à une atteinte notable de la structure oculaire et de la fonction visuelle et chacune de façon à peu près similaire. Le diagnostic est en général facile à ce stade, et le traitement doit être énergique.
Le bilan pratique du glaucome primitif à angle ouvert (GPAO) à ce stade clinique est réalisé dans deux grandes situations cliniques :
lors d’un diagnostic initial de glaucome au cours d’un examen systématique de dépistage ;
ou plus souvent, à l’occasion d’une visite de contrôle d’un patient glaucomateux connu, suivi et traité.
Le diagnostic initial de GPAO au stade clinique modéré peut se poser à tout âge avec, comme nous l’avons vu, une fréquence identique à celle du glaucome débutant à partir de l’âge de 60 ans ; il représente un tiers des glaucomes détectés dans nos pays occidentaux parmi les sujets situés dans ces tranches d’âge plus élevées, avec un caractère unilatéral rapporté dans 66 % des cas (voir chapitre 12-IV) [7].
Dans le cadre d’un diagnostic initial, le bilan, comme au stade de glaucome débutant, consiste à préciser le degré d’atteinte structurale et fonctionnelle de la neuropathie. La conduite pratique de ce bilan sera donc similaire (voir chapitre 12-IV). Elle s’attachera à préciser avec attention le niveau lésionnel initial du glaucome, qui servira de référence pour le suivi et la surveillance clinique du patient.
Lorsque le GPAO est connu, la conduite à tenir devant cette forme clinique de glaucome au stade modéré est différente.
Le bilan s’attachera avant tout à s’assurer de la stabilité de la neuropathie.
Cet enjeu majeur passe par une attention particulière à différentes étapes de l’examen, en particulier à celle liée à la vérification soigneuse de la tolérance et de l’observance du traitement, qui vont conditionner l’attitude clinique et thérapeutique pour la préservation du capital structural et fonctionnel de tout patient atteint de GPAO.
Nous rappellerons ici les grandes étapes du bilan détaillé dans le sous-chapitre précédent en soulignant les points auxquels on sera particulièrement vigilants.
L’évaluation de la gêne visuelle doit être plus approfondie car de nombreux patients présentant un trouble du champ visuel (CV) n’en sont pas encore conscients.
Le dépistage de toute manifestation symptomatique évocatrice d’une altération de la surface oculaire, retrouvée chez un tiers des patients présentant un GPAO modéré et chez près de la moitié des glaucomes sévères traités, est important. La recherche de symptômes d’irritation oculaire à l’instillation ou d’irritation chronique permanente doit être systématique (prurit palpébral, larmoiement, brûlures entre les instillations).
L’attention est plus grande chez les patients âgés de plus de 69 ans traités pour un GPAO. Ils présentent en effet deux fois plus de pathologie de surface oculaire que les sujets plus jeunes. Les anomalies sont également plus fréquentes avec l’ancienneté du traitement. En effet, 10 ans de traitement semblent marquer un seuil qui doit attirer l’attention. Enfin, le nombre de traitements est également en cause ; en particulier, à partir d’une trithérapie, le risque paraît nettement augmenté [1, 5].
Les facteurs de risque de progression doivent être à nouveau évalués ainsi que l’institution de tout nouveau traitement systémique pouvant traduire un facteur de risque non déclaré inconsciemment par le patient.
L’examen ophtalmologique passe par les mêmes étapes que celles du bilan du glaucome débutant, sans oublier la recherche d’une étiologie spécifique de l’affection (glaucome pigmentaire, syndrome exfoliatif, etc.).
L’acuité visuelle n’est pas modifiée, sauf s’il existe un important scotome paracentral.
À cette étape de l’examen, le patient peut signaler des symptômes trop souvent négligés, à type de gêne visuelle mal définie (photophobie spontanée ou au travail sur écran, etc.), de troubles d’adaptation à l’obscurité et aux changements de luminosité, traduisant un trouble de la sensibilité aux contrastes, manifestation clinique précoce trop souvent oubliée du GPAO.
Chez le patient traité, l’examen des paupières et de la surface oculaire est l’étape initiale importante de l’examen clinique. Il débute avant tout par une inspection du visage à la recherche de signes d’hyperhémie cutanée, de rosacée, de rougeur péri-oculaire éventuelle. Une blépharite localisée ou diffuse sera notée. L’examen se poursuit par la recherche au niveau du bord libre des paupières d’anomalies à type de télangiectasies, de signes de meibomite. L’examen de la conjonctive du cul-de-sac conjonctival inférieur précède la recherche d’altération du film lacrymal, qui passe par l’évaluation des rivières lacrymales, du temps de rupture du film lacrymal et, selon les circonstances et en fonction des symptômes, celle-ci peut être complétée par un test de Schirmer (voir chapitre 10-I).
L’examen de la conjonctive bulbaire recherchera des zones d’hyperémie périlimbique, la présence d’une kératite ponctuée superficielle inférieure ou dans l’air de la fente palpébrale, ou encore plus diffuse dans le cadre d’une sécheresse oculaire plus évoluée.
L’examen du segment antérieur se poursuit selon les mêmes modalités que dans le cadre du bilan initial.
Nous ne reviendrons pas sur les points essentiels de ce temps clinique capital développés dans le chapitre 12-IV. Nous rappellerons ici les grands principes :
utiliser toujours la même technique de mesure ;
interpréter le résultat en fonction de la pachymétrie notée dans le dossier ;
vérifier si la pression intra-oculaire (PIO) mesurée correspond à la PIO cible ;
en cas de progression déjà notée ou de découverte lors de cette visite de contrôle, évaluer la PIO moyenne et ses fluctuations en programmant soit une courbe diurne de la PIO, soit plusieurs mesures à différents horaires ;
tous les 3 mois, contrôler la calibration du tonomètre à aplanation afin d’obtenir une réduction maximale du risque d’erreur de mesure et de suivi. Une des principales causes d’erreur de la tonométrie en pratique clinique est, en effet, liée à un mauvais étalonnage du tonomètre. La vérification du calibrage des tonomètres de Goldmann, trop peu pratiquée, doit être connue et régulière [9]. Le protocole simple peut être consulté dans le manuel d’instruction de la société Haag-Streit International ou encore sur certains sites internet (www.youtube.com/watch?v=j7c3GhQw7Yw).
En cas de glaucome stable, une évaluation tous les 6 mois est acceptable.
Plus encore que dans les formes débutantes, les fluctuations de PIO sont responsables de l’aggravation du déficit visuel en cas de glaucome modéré.
Une détermination précise de la valeur de PIO est nécessaire pour évaluer une pression cible qui doit être de 20 à 30 % inférieure à la pression initiale pour espérer stabiliser l’affection.
L’examen gonioscopique reste essentiel. L’augmentation du volume du cristallin avec l’âge, source d’un rétrécissement secondaire de l’angle iridocornéen, impose le contrôle régulier, tous les 2 à 3 ans, de son ouverture, quel que soit l’âge du patient.
L’analyse biomicroscopique de la TNO doit être aussi rigoureuse à chaque visite de contrôle (voir chapitre 12-IV. L’examen doit être pratiqué comme suit :
après dilatation pupillaire de préférence, idéalement par un examen stéréoscopique, au travers d’un verre de Goldmann ou avec une lentille non contact (90 D ou autre) qui nécessite une bonne expérience de l’observateur ;
avant de consulter les résultats de l’examen précédent dans le dossier du patient, pour relever tout élément évocateur de diagnostic ou de progression et éviter d’être influencé lors de l’examen clinique ;
sans oublier de noter la présence et l’étendue d’une atrophie péripapillaire ainsi qu’une éventuelle hémorragie du disque optique qui – on le sait marque une progression en cours de la neuropathie optique (fig. 12-4).
Même si ces hémorragies du disque optique ont principalement été décrites dans les stades précoces, les glaucomes modérés et les formes évoluées ne sont pas exempts. Elles représentent une haute spécificité lors de l’évolution de la neuropathie glaucomateuse, comme l’ont confirmé les études, dont celle de l’EMGT (Early Manifest Glaucoma Trial).
Certaines situations restent cependant difficiles à analyser, en particulier en cas de forte myopie, de petite papille ou de dysversion papillaire. Dans ces cas, la profondeur de l’excavation, qui d’ailleurs peut être absente, n’est pas toujours proportionnelle à l’importance du glaucome.
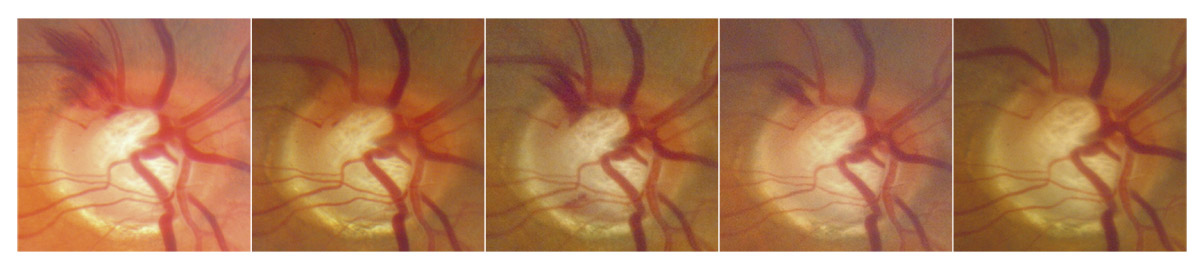
Fig. 12-4 Glaucome modéré avec hémorragies récidivantes du disque optique droit en 5 ans de suivi (2008–2013). (Clichés J.-P. Renard.)
Pratiquée une fois par an avec une analyse soigneuse à l’issue de l’examen, la rétinophotographie de la tête du nerf optique (TNO) permet souvent de mettre en évidence certains signes évolutifs passés inaperçus à l’examen clinique. Elle vient enrichir la base de données individuelle de chaque patient pour le suivi de l’évolution, même si la détection d’une progression est plus difficile en cas d’atrophie diffuse ou en cas d’épithélium pigmentaire peu pigmenté.
Sa réalisation reste trop souvent sous-exploitée en pratique clinique courante. S’il est difficile de relever une modification structurale sur les clichés photographiques du disque optique (DO), une fois que le disque est devenu anormal d’une année sur l’autre, ils présentent en revanche un intérêt majeur pour comparer et analyser l’évolution sur des examens réalisés à plus grande distance (fig. 12-5).
Les rétinographes non mydriatiques aujourd’hui disponibles permettent d’associer différents types de clichés et de réaliser son propre programme de suivi en associant un cliché global du fond d’œil, un grossissement au niveau de la papille, l’adjonction d’un filtre bleu pour l’analyse des fibres nerveuses rétiniennes (FNR), ou encore de dessiner, avec certains logiciels, les limites de l’excavation et du DO.
Quand les images sont de bonne qualité, elles permettent de détecter des déficits peu importants, peu évolués et d’affirmer plus facilement la stabilité ou la progression, même si leur interprétation subjective reste très dépendante de l’expérience de l’observateur [8].
La multiplication des rétinographes a nettement augmenté la fréquence de découverte des hémorragies du DO. Dans l’étude EMGT, après 9 ans de suivi, l’hémorragie du DO était observée au moins une fois chez 55 % des patients glaucomateux. Chez les sujets normaux, la prévalence serait de 0,2 %, ce qui est rare, et dans l’OHTS (Ocular Hypertension Study), le risque d’hémorragie du DO était estimé à 0,5 % par an [2].
Le taux de progression vers une perte fonctionnelle à l’issue de l’apparition d’une hémorragie du DO a été rapporté supérieur à 50 % et il est bien établi maintenant que la progression du glaucome évolue avant et après sa survenue. La notion actuellement retenue est donc celle d’une manifestation vasculaire, mécanique probable, secondaire à des modifications anatomiques locales. L’hémorragie du DO suggère ainsi une progression de la neuropathie passée, en cours et à venir [4, 12].
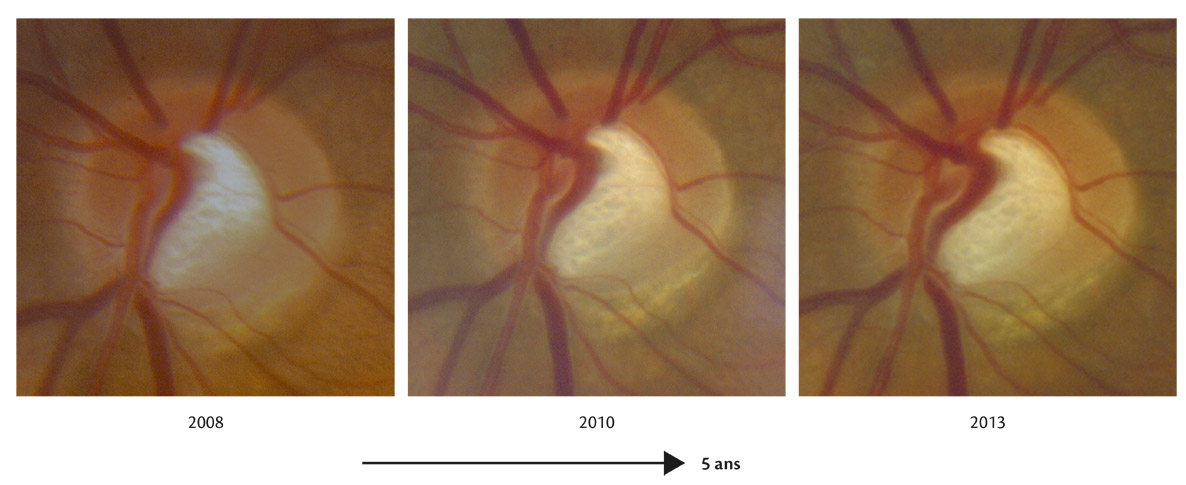
Fig. 12-5 Glaucome modéré. Évolution en 5 ans avec rejet nasal des vaisseaux, amincissement de l’anneau neurorétinien prédominant dans le secteur inférieur et temporal inférieur, augmentation de l’excavation et du rapport C/D vertical. (Clichés J.-P. Renard.)
Le bilan impose les mêmes recommandations que celles suivies pour le glaucome débutant, avec une vigilance particulière sur certains points.
L’utilisation des tests de seuils des 24° centraux, avec des programmes type SITA Standard (Humphrey) et stratégie dynamique (Octopus) reste impérative (voir fig. 12-6).
Une atteinte des 3° centraux du champ visuel (CV), parfois très localisée, chez plus de 50 % des yeux atteints de glaucome modéré souligne l’importance de compléter le bilan par une analyse des 10° centraux du CV avec, en fonction de l’étendue des déficits, la réalisation d’un CV 10°-2 qui analyse 32 points dans les 8° centraux à partir d’un degré du centre fovéolaire [13, 14] (voir fig. 12-6).
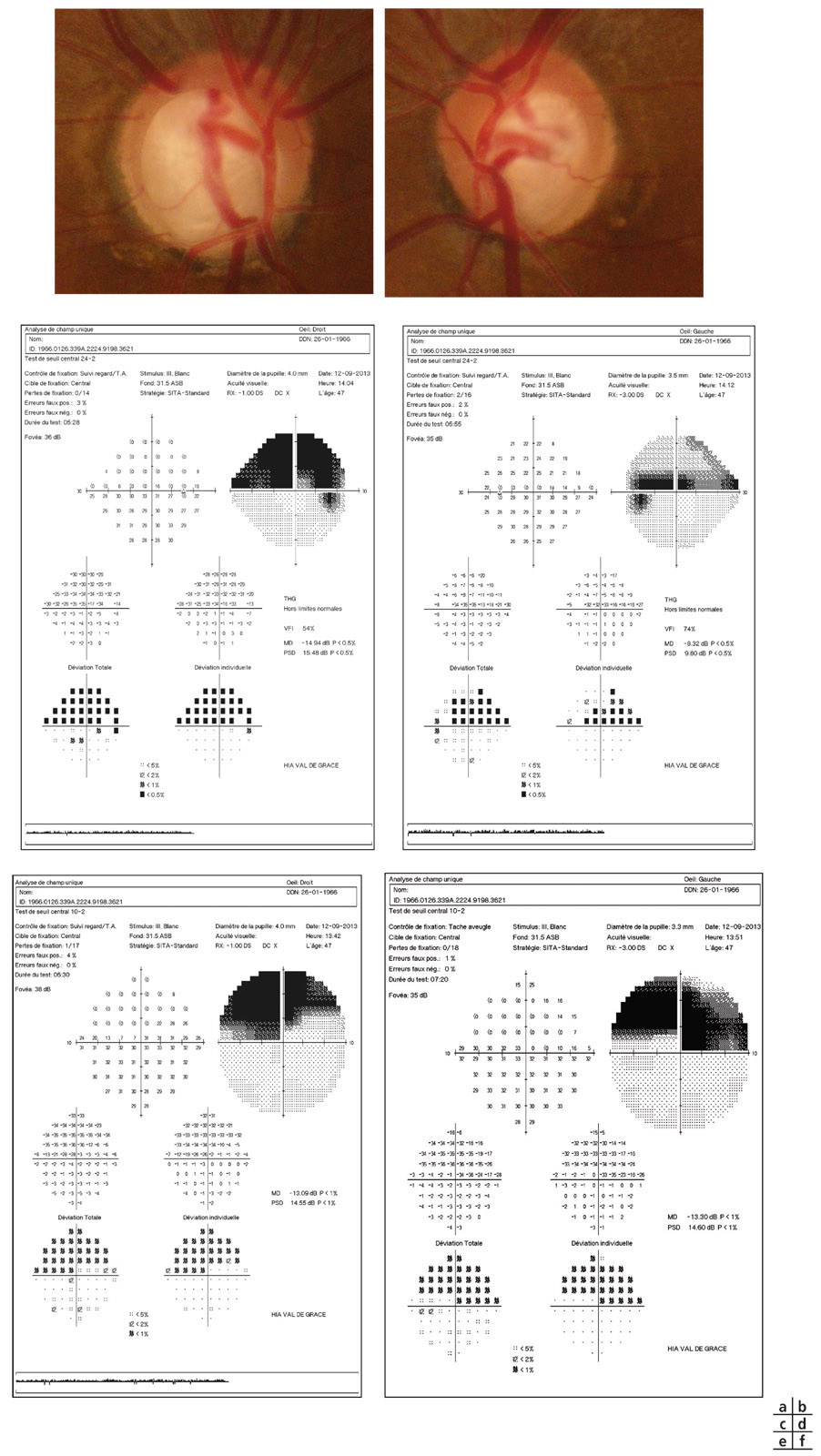
Fig. 12-6 Glaucome modéré de l’œil gauche (OG) et glaucome avancé de l’œil droit (OD). a, b. Rétinophotographies. Relevés CV 24-2 OD et OG (c, d), 10° centraux (e, f).
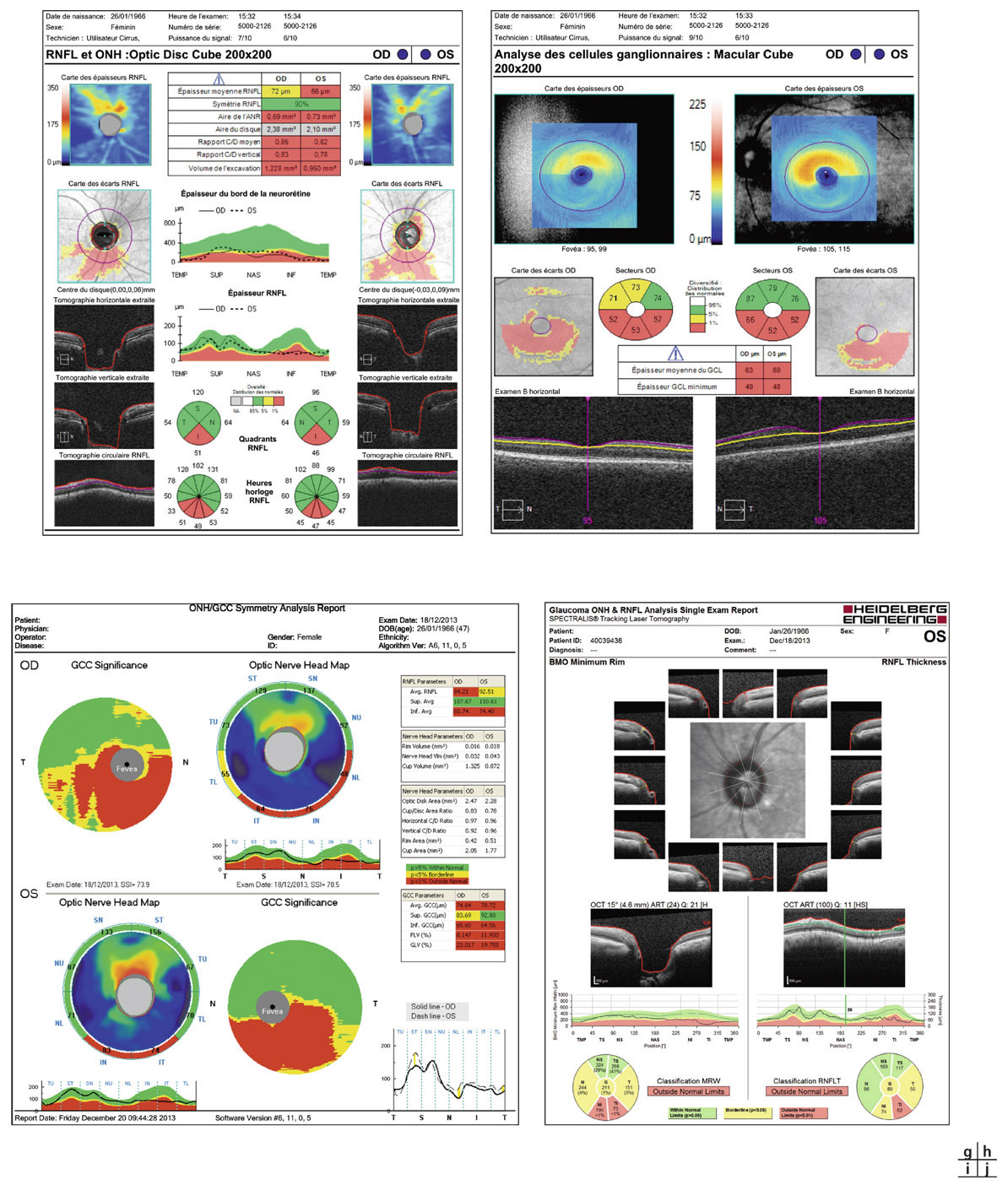
Fig. 12-6 g, h. Relevés OCT-SD Cirrus HD-OCT : FNR, TNO et GCA (ganglion cell analysis). i. RTVue OCT-SD : TNO FNR et complexe cellulaire ganglionnaire (GCC). j. OCT-SD Spectralis : TNO et FNR.
Le suivi de la progression de l’atteinte fonctionnelle suit des règles identiques à celles développées dans le chapitre 12-IV consacré au glaucome débutant.
Trois points majeurs doivent être soulignés :
définir le type de progression rapide ou lent du retentissement fonctionnel du glaucome ;
réaliser un nombre suffisant d’examens les deux premières années du suivi ;
connaître :
les taux de progression de l’indice MD d’environ – 0,05 dB/an rapportés pour les GPAO stables par certaines études [3, 6] (voir chapitre 11-II, paragraphe « Analyse de la progression des déficits périmétriques dans le GPAO – Étude Prog-F ») ;
le taux de progression moyen des glaucomes modérés de – 0,5 dB/an, avec pour les formes évolutives une progression de l’indice MD > – 0,8 dB/an et de l’indice VFI (Visual Field Index) à partir de – 2 %/an [6] (voir chapitre 11-II, paragraphe « Analyse de la progression des déficits périmétriques dans le GPAO – Étude Prog-F »).
Les programmes de suivi de progression sont très utiles dans le glaucome modéré, avec un intérêt particulier du suivi de l’indice VFI du périmètre Humphrey, car pondéré en fonction de la densité des cellules ganglionnaires. Il est ainsi fortement perturbé lorsque les déficits sont proches du point de fixation.
Pour différencier une vraie progression du CV d’une fluctuation aléatoire, un nouveau test de confirmation est toujours nécessaire quand la progression du CV est détectée sur un seul test. Cependant, à d’autres stades d’évolution de la maladie, les observations en série du CV peuvent dans certains cas être plus sensibles pour le diagnostic de lésions progressives du GPAO.
Enfin, les facteurs de risque de progression du CV chez les patients atteints de GPAO modéré ayant présenté une hémorragie du disque optique ont été mieux précisés chez 76 patients suivis en moyenne environ 4 ans. Les facteurs de risque relevés pour un taux de progression rapide observé chez 26 % d’entre eux, soit un taux de progression supérieur à – 1,5 dB/an, étaient d’une part l’âge avancé supérieur à 68 ans – où le risque est multiplié par 200 – et un MD initial altéré plus profond que – 4 dB, où le risque est multiplié par 270 %, avec la prédiction d’un déficit d’au moins 5 dB dans les 4 ans [12].
Dans le glaucome modéré, un bilan du CV tous les 6 mois est nécessaire. Si la PIO n’est pas stabilisée, il peut être utile de réaliser une surveillance plus rapprochée.
Complément de l’examen clinique et de l’analyse du CV, l’analyse et le suivi de l’atteinte structurale sont maintenant le plus souvent réalisés en tomographie par cohérence optique (OCT).
Peu utilisée en France, l’HRT permet cependant une analyse précise de la TNO et de l’importance de l’excavation avec un suivi de celle-ci. Plusieurs scores permettent de déterminer une éventuelle aggravation.
Pour la détection d’une progression, la qualité de l’analyse est étroitement liée au respect des règles d’acquisition et d’interprétation des relevés ainsi qu’à la bonne connaissance des pièges à éviter (voir chapitre 9-IV, paragraphe « Tomographie par cohérence optique » et chapitre 11-II, paragraphe « Tomographie par cohérence optique-spectral domain »).
Cette analyse rentre dans le cadre du bilan complet du GPAO quel que soit le stade clinique de la neuropathie (fig. 12-6).
Dans le cas du suivi d’un patient glaucomateux, elle ne peut pas donner suite à une décision thérapeutique uniquement en fonction de son résultat isolé, qui doit être interprété avec les données des autres examens de contrôle.
Les notions suivantes sont importantes :
l’analyse de la couche des FNR péripapillaires qui évalue l’ensemble des axones des cellules ganglionnaires en OCT est souvent plus performante que l’analyse de l’imagerie maculaire qui concerne seulement 50 % environ de ceux-ci pour le diagnostic du glaucome modéré ;
pour la détection de la progression, la sensibilité de l’analyse du complexe maculaire cellulaire ganglionnaire – en particulier avec le Cirrus HD-OCT – a été démontrée avec une sensibilité similaire à celle de l’évaluation de la couche des FNR péripapillaires chez des patients atteints de glaucome débutant ou modéré [10] ;
les analyses des différents secteurs de la TNO des FNR et du complexe maculaire cellulaire ganglionnaire (GCC), relevées chez 279 yeux atteint de GPAO et suivis plus de 2 ans, soulignent également que l’existence d’une progression est retrouvée chez des patients présentant un GPAO plus évolué (MD = – 4,3 dB) par rapport aux patients sans progression (MD = – 0,84 dB). Cette étude rapporte les paramètres intéressants à surveiller, qui sont :
au niveau des FNR : l’épaisseur moyenne de la couche des FNR ainsi que celle du quadrant inférieur et du secteur 6–7 heures ;
pour la TNO : la surface de l’anneau neurorétinien ainsi que le rapport C/D moyen et vertical ;
enfin pour l’analyse du GCC : le secteur temporal inférieur et externe (voir fig. 12-6).
Cette étude montre la possibilité diagnostique d’une évolution ainsi que les paramètres qui signent la progression à surveiller, et ce quel que soit le niveau de base de l’épaisseur de la couche des FNR [11]. Les valeurs seuils à retenir restent encore à préciser et un plus long recul doit vérifier s’il n’existe pas de variation en fonction du stade évolutif du GPAO en raison des différences de progression possible avec l’évolution de la neuropathie.
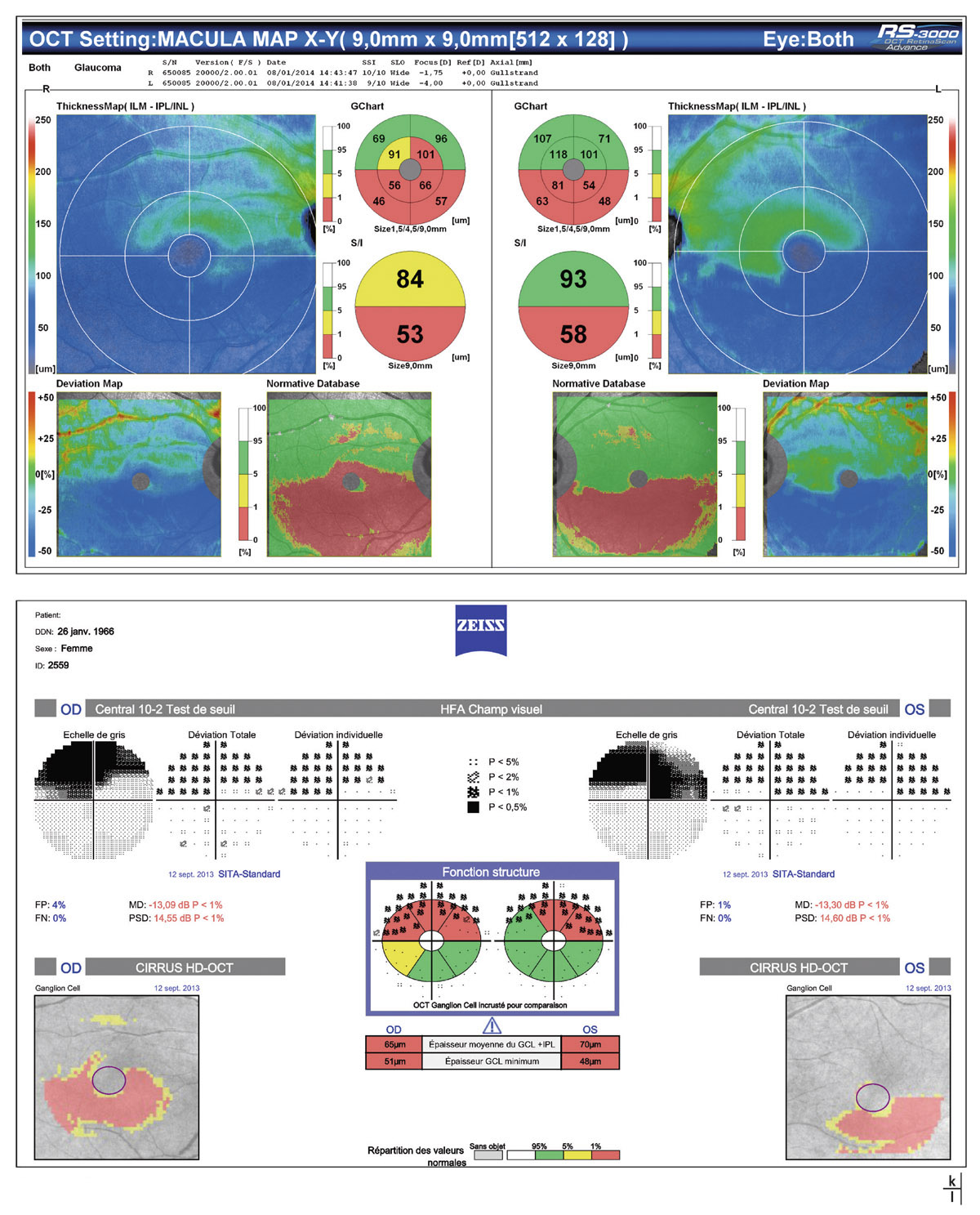
Fig. 12-6 k. OCT-SD RS3000 Nidek. l. Rapport combiné CV 10-2 et HD-OCT complexe GCPIL (Zeiss). (Clichés J.-P. Renard.)
L’ensemble des données du bilan clinique et paraclinique font l’objet d’une synthèse qui doit s’intégrer à l’évaluation de l’adhérence et de la tolérance du traitement par le patient.
Cette synthèse est essentielle pour une information complète, claire et concise du patient sur le stade clinique actuel de la neuropathie, les particularités cliniques évaluées et leurs potentiels évolutifs. L’importance de la prise en charge des facteurs de risque éventuels sera précisée à chaque contrôle.
Enfin, l’observance thérapeutique sera à nouveau évaluée afin d’assurer une prise en charge optimale adaptée au stade clinique du GPAO et aux facteurs individuels liés à chaque patient. La qualité de la relation que le médecin a pu établir dans le cadre du colloque singulier individuel prend ici toute sa dimension (voir chapitre 19).
Le bilan clinique et paraclinique d’un patient atteint de GPAO au stade modéré est donc peu différent de celui du glaucome débutant (tableau 12-6). Il présente des particularités liées d’une part à l’accentuation du déficit fonctionnel, dont il faudra essayer de percevoir le retentissement le plus souvent inaperçu, d’autre part à la tolérance et à l’observance du traitement, avec en particulier la recherche d’éventuels effets secondaires ou d’une pathologie de la surface oculaire dont la fréquence augmente avec l’âge.
Toute modification de l’évolution mise en évidence par un examen clinique ou paraclinique doit être rapidement confirmée par un second examen en raison des variabilités intra- et interindividuelles des résultats aux tests paracliniques, mais également faire l’objet d’une synthèse plus attentive avec l’ensemble des donnés des autres examens.
Une surveillance semestrielle est raisonnable dans le glaucome modéré à la fois pour la mesure de la PIO et l’analyse du CV et de l’OCT.
La conduite pratique du bilan initial renouvelée lors de chaque contrôle doit permettre ainsi d’assurer une prise en charge dans les meilleures conditions des patients atteints de GPAO quel que soit le stade clinique de l’affection.
Retenir
L’évaluation de la gêne visuelle, souvent inconsciente, doit être approfondie.
La recherche d’une altération de la surface oculaire, fréquente chez les patients traités, est un des premiers temps importants de l’examen.
Une détermination précise de la valeur de la PIO et de ses fluctuations est nécessaire, car ces dernières sont responsables de l’aggravation des déficits en cas de glaucome modéré.
Les rétinophotographies permettent souvent de mettre en évidence certains signes évolutifs.
Une analyse des 10° centraux du CV doit souvent compléter le bilan de l’atteinte fonctionnelle.
L’évaluation de l’atteinte structurale des FNR, de la TNO et du complexe cellulaire ganglionnaire maculaire en OCT, avec une bonne connaissance des paramètres à considérer, fait partie intégrante du bilan.
L’épaisseur de la couche des FNR évolue de façon relativement proportionnelle au déficit du CV.
Toute modification de l’évolution mise en évidence par un examen clinique ou paraclinique doit faire l’objet d’une synthèse plus attentive avec l’ensemble des données des autres examens.
Une surveillance semestrielle est raisonnable pour la mesure de la PIO et l’analyse du CV et de l’OCT dans la majorité des cas.
Une réduction de la PIO de 25 % doit être obtenue pour espérer arrêter l’évolution du glaucome.

Tableau 12-6 – Examens complémentaires recommandés pour le glaucome modéré.
[1] Baudouin C, Renard JP, Nordmann JP, et al. Prevalence and risk factors for ocular surface desease among patients treated over the long term for glaucoma or ocular hypertension. Eur J Ophthalmol. 2012. Epub ahead of print.
[2] Budenz DL, Anderson DR, Feuer WJ, et al. Detection and prognostic significance of optic disc hemorrhages during the Ocular Hypertension Treatment Study. Ophtalmology. 2006 ; 113 : 2137-43.
[3] Chauhan BC, Mikelberg FS, Artes PH, et al. Canadian glaucoma study – 3. Impact of risk factors and IOP reduction on the rates of visual field change. Arch Ophthalmol. 2010 ; 128 : 49-55.
[4] de Moraes CG, Prata TS, Liebmann CA, et al. Spatially consistent localized visual field loss before and after disc hemorrhage. Invest Ophthalmol Visc Sci. 2009 ; 50 : 4727-33.
[5] Gibson IK. The ocular surface : the challenge to enable and protect vision. The Fridenwald lecture. Invest Ophthamol Visc Sci. 2007 ; 48 : 4391-8.
[6] Giraud JM, El Chehab H, Aptel F, Renard JP. Progression of visual field in patients with POAG (2) : Level of progression. Acta Ophtalmologica 2013, 91 : 0. doi : 10.1111/j 1755-3768-TO64.
[7] Heijl A, Bengtsson B, Oskarsdottir SE. Prevalence and severity of undetected manifest glaucoma result from the Early Manifest Glaucoma Trial Screening. Ophthalmology 2013 : 120 : 1541-5.
[8] Jampel HD, Friedman D, Quigley H, et al. Agreement among glaucoma specialists in assessing progressive discs changes from photographs in open angle glaucoma patients. Am J Ophthalmol 2009 ; 147 : 39-44.
[9] Kumar N, Hillier RJ. Goldmann tonometer calibration : a national survey. Eye (Lond) 2009 ; 23 : 413-5.
[10] Na JH, Sung KR, Baek S. Detection of glaucoma progression by assessment of segmented macular thickness data obtained using SD-OCT. Invest Ophthalmol Visc Sci. 2012 ; 53 : 3817-26.
[11] Na JH, Sung KR, Lee JR, et al. Detection of glaucomatous progression by spectral-domain optical coherence tomography. Ophtalmology. 2013 ; 120 : 1388-95.
[12] Prata TS, de Moraes CG, Teng CC, et al. Factors affecting rates of visual field progression and glaucoma patient with optic disc hemorrhage. Ophthalmology. 2010 ; 117 : 24-9.
[13] Schiefer U, Papageorgiou E, Sample PA, et al. Spatial pattern and glaucomatous visual field loss obtained with regionally condensed stimulus arrangements. Invest Ophthalmol Visc Sci. 2012 ; 51 : 5685-9.
[14] Su D, Parc SC, Simonson JL, et al. Progression pattern of initial parafoveal scotomas in glaucoma. Ophtalmology 2013 ; 120 : 520-7.
Le bilan clinique et paraclinique d’un patient atteint d’un glaucome primitif à angle ouvert avancé passe par des étapes spécifiques dont le respect rigoureux permettra de garantir le maximum de chances au patient.
Cette conduite est renforcée par une bonne connaissance des possibilités d’évaluation du retentissement fonctionnel et structural.
Les tests appropriés lors des contrôles réguliers, adaptés en fonction des formes cliniques, permettent une bonne évaluation de l’évolution prévisible et d’assurer l’information au patient.
Le glaucome avancé correspond à une atteinte importante de la structure oculaire et de la fonction visuelle. Il peut être défini, en dehors de l’indice de déficit moyen du champ visuel (MD) au-delà de – 12 dB, comme le stade où le patient perçoit en permanence un handicap dans sa vie quotidienne. Si le diagnostic est en général facile à ce stade, le traitement est en revanche plus complexe.
La prévalence du glaucome avancé lors de la découverte de l’affection est très variable d’un pays à l’autre. Si, classiquement, elle correspondait selon certaines études à moins de 10 % des glaucomes primitifs à angle ouvert (GPAO) dans les pays développés, et à plus de 50 % des formes cliniques dans les régions avec un accès difficile aux soins, ces notions ont évolué [2]. En effet, les données plus récentes, en particulier celles concernant le dépistage de glaucomes non diagnostiqués lors de la mise en place de l’étude EMGT (Early Manifest Glaucoma Trial) chez un grand nombre de sujets (n = 32 918) âgés de 55 à 79 ans, retrouvent un plus grand nombre de stades avancés, avec une fréquence de 33 %, dans les tranches d’âge plus élevées. À partir de l’âge de 60 ans et au-delà, nous retrouvons une répartition similaire des différents stades évolutifs du glaucome au moment du diagnostic initial [4].
Ces résultats concernent à ce jour le plus important effectif de sujets ayant bénéficié d’un dépistage du GPAO. Ils permettent de conclure que, dans nos pays occidentaux, un tiers des nouveaux cas de GPAO diagnostiqués le sont au stade de glaucome avancé ou agonique pour au moins un œil dans les tranches d’âge supérieures à 60 ans !
Dans cette même étude, 3,4 % des nouveaux cas de glaucome diagnostiqués (14/406) présentaient une cécité unilatérale liée au GPAO.
Le caractère indolore et la longue absence de trouble visuel expliquent le retard diagnostique de ces formes cliniques de glaucome avancé qui ne sont pas donc pas si rares, et avec un pronostic sévère étant donné l’espérance de vie actuelle. En fin de vie, on estime en effet qu’environ 18 % des patients présentent une cécité bilatérale liée au glaucome et 42 % une cécité unilatérale [11].
Ces données récentes soulignent une fois de plus l’importance d’une approche énergique de tout glaucome, même s’il peut sembler relativement stable pendant longtemps.
Au-delà des points abordés dans le bilan du glaucome modéré et qui ne sont pas repris ici, la conduite de l’interrogatoire va s’attacher à préciser deux informations essentielles.
L’évaluation de la gêne visuelle doit être plus approfondie, car de nombreux patients présentant un trouble majeur du champ visuel (CV) ne semblent pas en être conscients. Cette prise de conscience est nécessaire, en particulier en ce qui concerne les risques de la conduite automobile. Une atteinte bilatérale du CV dans les 10° centraux du champ multiplie par trois le risque d’accident de circulation automobile [7].
Si le glaucome est déjà connu et le patient traité, l’adhérence au traitement doit être particulièrement étudiée (voir chapitre 17-II, paragraphe « Observance, adhérence et persistance au traitement »). En effet, une mauvaise compliance apparaît comme le premier facteur de risque d’évolution vers la cécité [1].
Bien que se rapprochant de l’examen clinique usuel dans le glaucome modéré, certains points doivent être soulignés.
Dans le glaucome avancé, la mesure de l’acuité visuelle présente un intérêt clinique majeur. Elle n’est pas modifiée s’il n’existe pas de déficit au sein des 5° centraux. Cependant, tout scotome proche du point de fixation peut modifier l’acuité visuelle. Dans les formes agoniques, la périmétrie automatisée est parfois impossible à réaliser et l’acuité visuelle devient alors, avec la périmétrie cinétique de Goldmann, une méthode certes plus approximative, mais importante d’évaluation du CV résiduel.
L’examen biomicroscopique se poursuit selon les mêmes modalités que dans le cadre du bilan du GPAO au stade modéré.
Il est important de rechercher l’existence d’un syndrome exfoliatif fréquemment associé à une atteinte grave, en raison de l’importance des poussées hypertoniques, uni- ou bilatérales. Si le syndrome exfoliatif n’est pas un facteur indépendant d’évolution vers la cécité, il le devient à travers les pics hypertoniques associés [10].
L’examen gonioscopique est essentiel dans le glaucome avancé. Même si le diagnostic de glaucome à angle ouvert avait été retenu initialement, l’angle peut avoir tendance à se fermer avec les années, en particulier en raison de l’intumescence du cristallin. Des épisodes de pics hypertoniques par fermetures intermittentes ou partielles de l’angle, passées inaperçues, entraînent une aggravation particulièrement marquée du déficit visuel dans le glaucome avancé.
La mesure rigoureuse de la PIO est bien sûr l’examen clé dans le glaucome avancé. Toutes les études rapportent l’importance de l’HTO en tant que principal facteur de risque d’apparition du glaucome évolué et d’évolution de celui-ci vers la cécité [14]. Plus encore que dans les formes modérées, les fluctuations de pression sont responsables de l’aggravation du déficit visuel en cas de glaucome grave [9].
Plusieurs mesures sont nécessaires pour évaluer la valeur exacte de la PIO et un suivi plus fréquent de celle-ci est souhaitable. En cas de glaucome stable, une évaluation tous les 6 mois est acceptable ; cependant, dans le glaucome avancé, une mesure trimestrielle est parfois nécessaire.
Une détermination précise de la valeur de pression est nécessaire pour évaluer une pression cible qui doit être particulièrement basse dans les formes évoluées.
L’analyse biomicroscopique soigneuse de la tête du nerf optique (TNO) reste nécessaire, à la recherche de signes associés à l’importante excavation papillaire, en particulier l’existence d’hémorragies (facteur de risque d’aggravation indépendant) et de zones d’atrophie péripapillaire.
En cas de CV atteint et détérioré chez un patient âgé, une hémorragie du disque optique (DO) semble prédire une diminution de la perte fonctionnelle, en particulier de l’indice MD d’au moins 5 dB dans les 4 ans. Une étude rapporte chez les patients âgés, au-delà de 68 ans, après une hémorragie du DO, un plus haut risque de perte de CV, de plus de 200 %, dans un délai moyen de 3,2 ans et une progression plus rapide [12] (fig. 12-7).
Certaines situations restent cependant difficiles à analyser, en particulier en cas de forte myopie ou de dysversion papillaire. Dans ces cas, la profondeur de l’excavation n’est pas toujours proportionnelle à l’importance du glaucome.
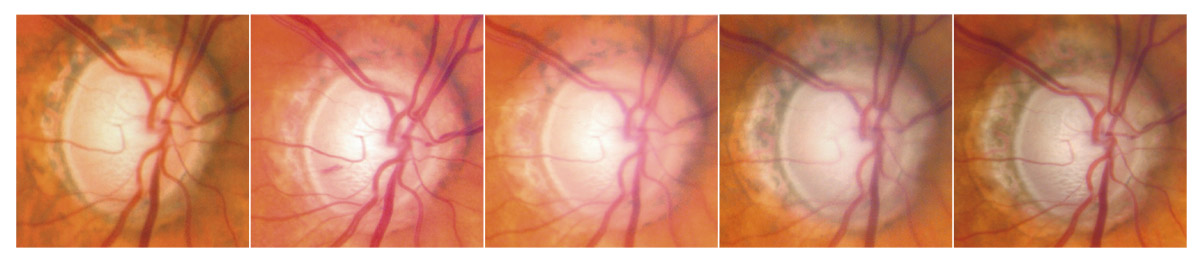
Fig. 12-7 Glaucome avancé. Suivi rétinophographique sur 8 ans avec dépistage d’une hémorragie du disque optique non décelée à l’examen biomicroscopique. À noter progression de la zone β. (Clichés J.-P. Renard.)
La réalisation d’une rétinophotographie de la TNO peut être faite dans le glaucome avancé, mais il faut reconnaître qu’à l’heure de l’OCT, elle perd de son importance pour le suivi de cette forme clinique de glaucome avancé (fig. 12-8). Son principal intérêt consiste à pouvoir détecter plus facilement certains facteurs de risque évolutif passés inaperçus à l’examen direct, comme une hémorragie du bord du disque optique et/ou l’extension d’une atrophie péripapillaire bêta (voir fig. 12-7).
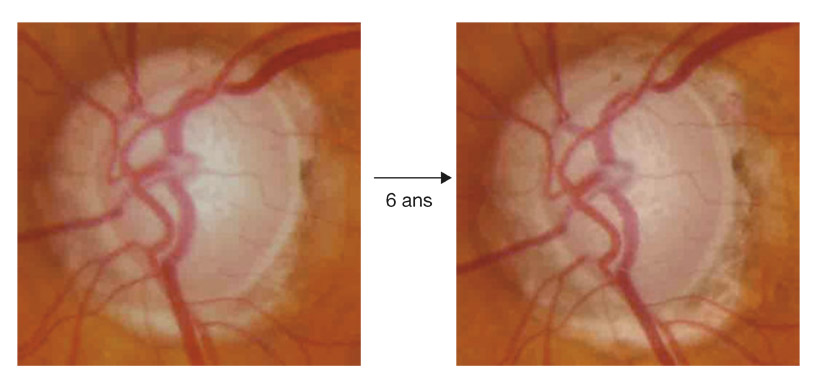
Fig. 12-8 Glaucome avancé. Rétinographies. Suivi à 6 ans, avec peu de modifications décelables en rétinophotographies à ce stade avancé, sinon la progression de la zone β. (Clichés J.-P. Renard.)
L’évaluation du CV en périmétrie automatisée est indispensable dans le glaucome avancé pour une bonne évaluation du retentissement fonctionnel du glaucome.
En effet, à l’heure actuelle, les méthodes d’évaluation de la structure, en particulier de la couche des fibres nerveuses rétiniennes (FNR) péripapillaires, présentent des limites pour suivre la progression de leur atteinte à un stade où la plupart des cellules ganglionnaires sont détruites.
Les tests de seuils des 24° centraux et des 10° centraux, avec des programmes type SITA Standard (Humphrey) et stratégie dynamique (Octopus), doivent être utilisés dans le glaucome avancé. Lors d’un examen usuel des 24 ou 30° centraux, la constatation d’une atteinte au sein des 10° centraux ou jouxtant cette zone doit impérativement entraîner en complément une mesure des 10° centraux. En effet, la zone centrale est relativement mal définie par les tests usuels car les points mesurés sont trop distants les uns des autres. Par exemple, avec le Humphrey, le programme 24-2 mesure des points distant de 6° (environ une largeur de main, bras tendu devant soi), alors que le programme 10-2 évalue 32 points distants de 2° dans les 10° centraux (fig. 12-9 et voir fig. 12-13).
En cas d’îlot central de vision résiduel, l’analyse des 24° n’a plus d’intérêt et celle des 10° suffit. Les tests plus détaillés du centre de la vision (maculaire, 5°) n’ont pas d’intérêt réel dans le glaucome, en raison des variabilités des résultats liés aux pertes de fixation.
Lorsque l’acuité visuelle est réduite, voir inférieure à 1/10, une périmétrie cinétique de Goldmann apporte plus d’informations que la périmétrie automatisée, en particulier lorsque seul un îlot temporal de vision persiste (fig. 12-10). Elle apporte également, au stade de glaucome agonique, l’avantage de permettre un suivi continu de ce champ visuel résiduel, dont on connaît l’importance psychologique chez ces patients.
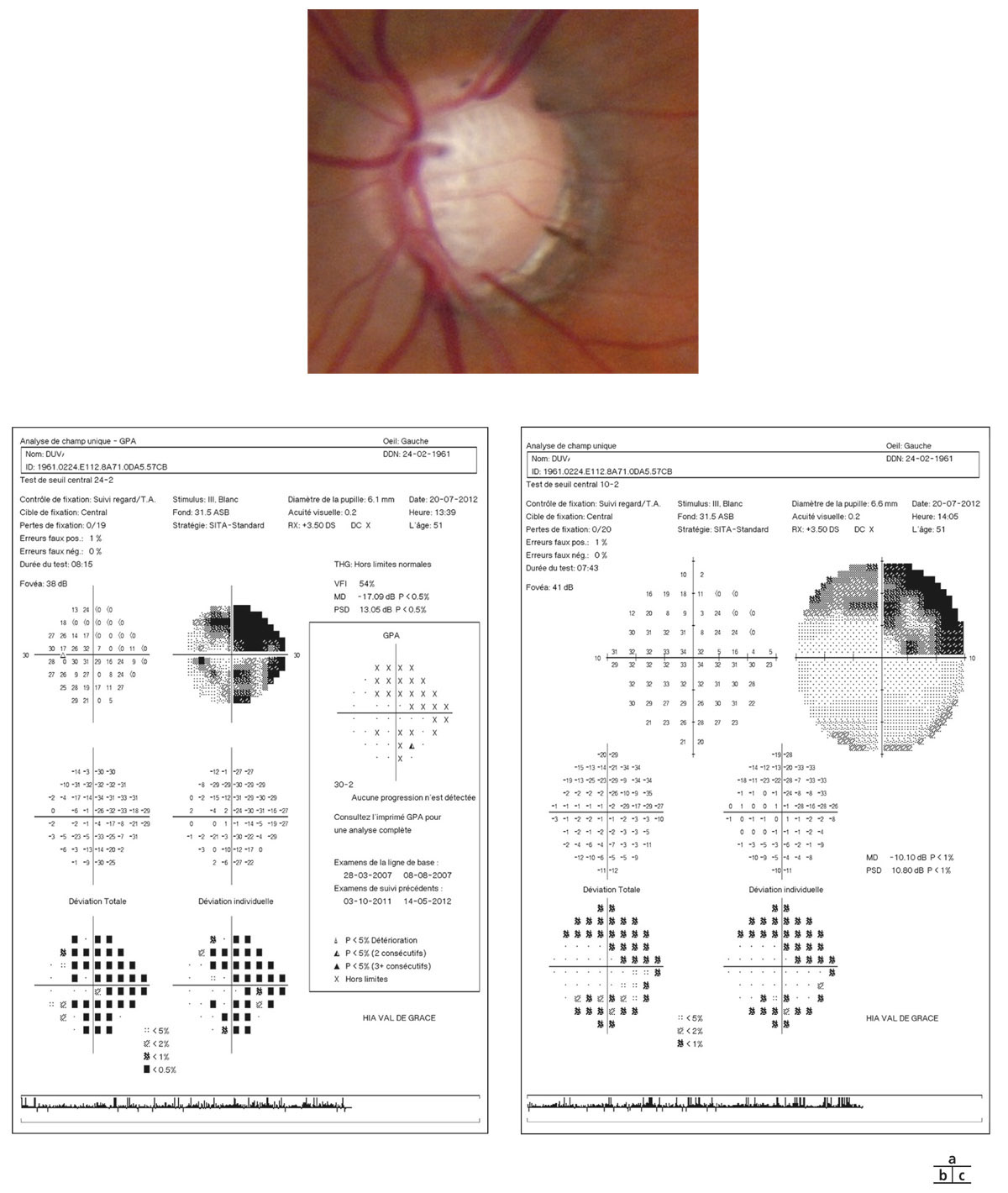
Fig. 12-9 Glaucome avancé. a. Rétinophotographie de l’œil gauche. b. Relevé PAS 24-2 avec atteinte proche du point de fixation. c. Relevé PAS 10-2 d’analyse des 10° centraux. (Clichés J.-P. Renard.)
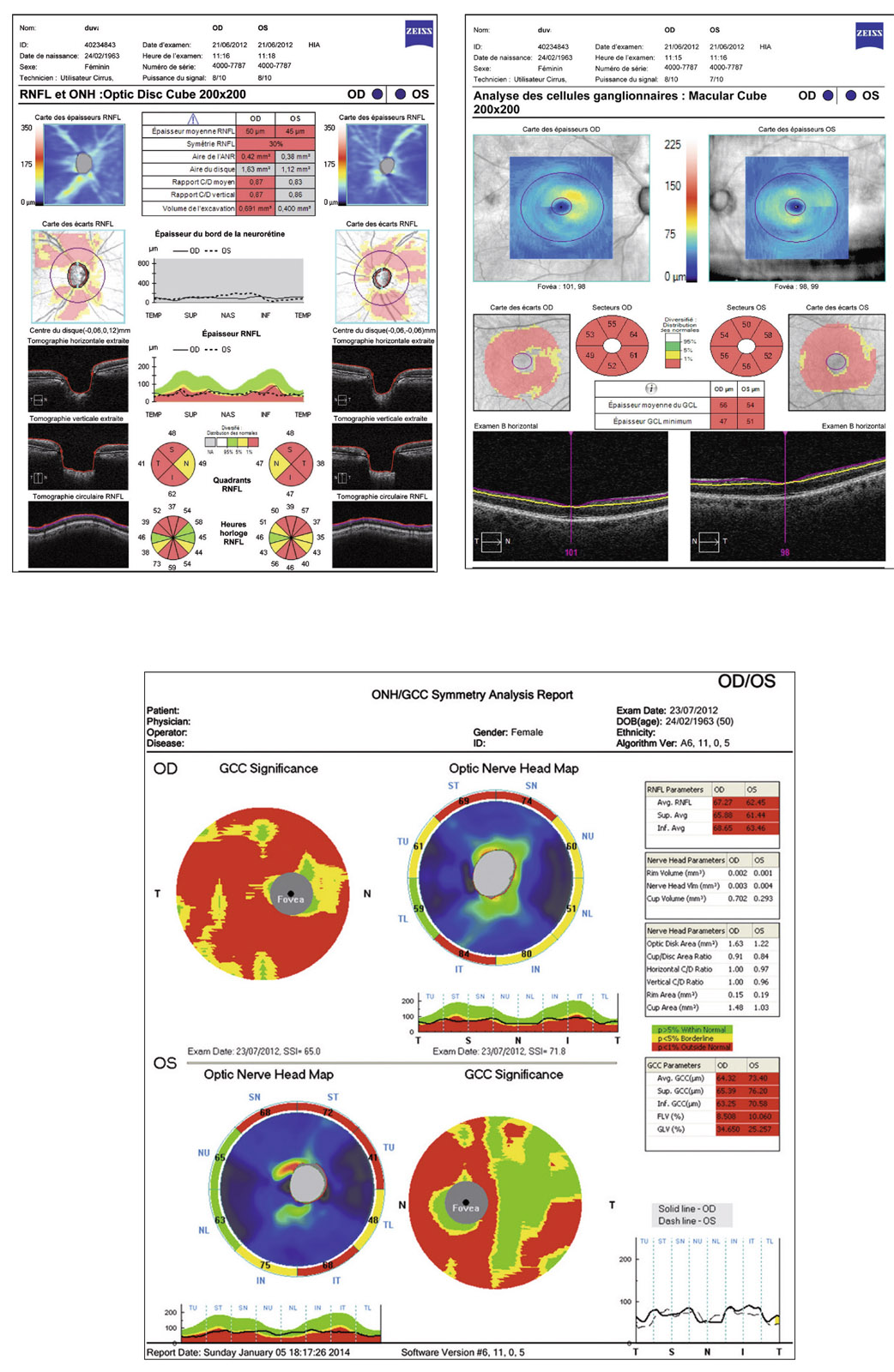
Fig. 12-13 Glaucome avancé de l’œil gauche (OG) et modéré de l’œil droit (OD). a, b. Rétinophotographies OD et OG. c, d. Relevés PAS blanc-blanc 24-2 OD et OG. e, f. PAS 10-2 OD et OG.

Fig. 12-10 Glaucome évolué sévère de l’œil droit sur une papille en forte dysversion. Relevés PAS 24-2 (a), 10-2 (b), périmétrie cinétique (c) et rétinophotographie (d). (Clichés J.-P. Renard.)
Les programmes d’analyse de progression gardent tout leur intérêt dans le glaucome avancé, en particulier l’analyse du Visual field index (VFI) de Humphrey, dont l’évaluation est pondérée en fonction de la densité des cellules ganglionnaires et indépendante des troubles des milieux oculaires. Lorsque le déficit est proche du point de fixation, le VFI s’aggrave fortement. Si des tests des 10° centraux sont réalisés, le VFI n’est pas disponible et il est alors nécessaire d’utiliser les indices globaux (indice MD et, dans une moindre mesure, l’indice PSD).
Dans le glaucome avancé, un bilan du CV tous les 6 mois est nécessaire. Si la PIO n’est pas stabilisée, il peut être utile de réaliser une surveillance plus rapprochée.
Cependant, une évaluation mensuelle n’est pas justifiée, car elle détecte plus les fluctuations que les réelles aggravations éventuelles. Même dans le glaucome grave, des décisions thérapeutiques annexes, comme une chirurgie de la cataracte, sont susceptibles de modifier les indices du CV et gardent tout leur intérêt dans ces glaucomes avancés sévères [6].
L’analyse de la structure est importante dans le glaucome avancé. Elle est plus limitée que dans le glaucome modéré. En effet, lorsque le glaucome s’aggrave au-delà d’un certain stade, la réduction de la couche des FNR péripapillaires analysée avec les OCT-SD actuels atteint un effet dit « plancher » au-delà duquel il n’existe plus de diminution enregistrée de cette couche. Il persiste en effet toujours une couche résiduelle d’environ 40 μm de tissu glial de soutien qui ne peut pas être différenciée de la couche terminale des FNR. Dans les formes avancées de glaucome, l’analyse structurale doit donc être prudente.
Peu utilisée en France, l’HRT présente un intérêt dans le glaucome avancé, surtout avec l’analyse des modifications topographiques de l’anneau neurorétinien et de l’excavation. Plusieurs scores permettent de déterminer une éventuelle aggravation.
L’analyse des structures altérées dans le glaucome est actuellement faite essentiellement par l’OCT, à la fois au niveau de la TNO, de la région péripapillaire et de la région maculaire. Comme nous l’avons précisé, il faut se souvenir que la couches des FNR ne s’amenuise pas au point de disparaître lorsque le glaucome évolue jusqu’au stade dépassé. Il persiste toujours une couche résiduelle de l’ordre de 40 μm dans l’évaluation des FNR péripapillaires. Ainsi, il est difficile, à partir d’un certain stade d’évolution, d’assurer un suivi avec l’analyse par OCT-SD de la TNO et de la couche des FNR péripapillaires.
Dans les glaucomes avancés, l’analyse de l’évolution de la progression de l’épaisseur du complexe cellulaire ganglionnaire a montré sa plus grande sensibilité que le suivi de l’épaisseur de la couche des FNR péripapillaires chez ces patients atteints de GPAO évolué, avec un déficit moyen de – 14 dB (plus profond que – 10 dB), sur un suivi moyen supérieur à 2 ans. La détection d’une progression par l’examen du disque optique ou par l’analyse des FNR péripapillaires n’était pas possible chez plus de 50 % des patients de cette étude. Les résultats rapportent une meilleure détection de la progression du mGCC (épaisseur moyenne du complexe cellulaire ganglionnaire) par rapport au mRNFL (épaisseur moyenne de la couche des FNR péripapillaires) dans les glaucomes avancés [13] (fig. 12-11 et voir fig. 12-13).
Une autre étude comparative de l’épaisseur de la couche des cellules ganglionnaires et de la couche plexiforme interne mesurées en OCT-SD avec les donnés histologiques, chez des patients atteints de glaucome sévères (pertes supérieures à – 15 dB) et chez 30 sujets témoins, rapporte une diminution de l’épaisseur des deux couches laissant une couche résiduelle constituée à la fois par une couche résiduelle de cellules ganglionnaires et une couche plexiforme interne. Il persiste ainsi dans ces glaucomes très évolués une couche résiduelle concernant aussi bien les deux parties, avec un certain nombre de cellules ganglionnaires et la couche plexiforme interne, même si cette dernière contribue légèrement plus à cette couche résiduelle [8].
En conclusion, seule l’analyse du complexe maculaire cellulaire ganglionnaire par OCT-SD présente actuellement un intérêt dans l’évaluation de l’atteinte structurale des glaucomes avancés, mais elle ne permet pas encore à elle seule un suivi adapté des patients présentant un glaucome grave, pour lesquels l’intérêt du CV domine et le permet (voir fig. 12-13).
L’arrivée des nouveaux programmes plus précis d’évaluation de la couche des cellules ganglionnaires séparée de la couche plexiforme interne en OCT-SD (fig. 12-12), ainsi que les études couplant l’OCT-SD, notamment avec la polarimétrie, ouvrent des perspectives enthousiasmantes pour une analyse plus performante de l’atteinte de la structure dans ces formes cliniques évoluées de glaucomes sévères.
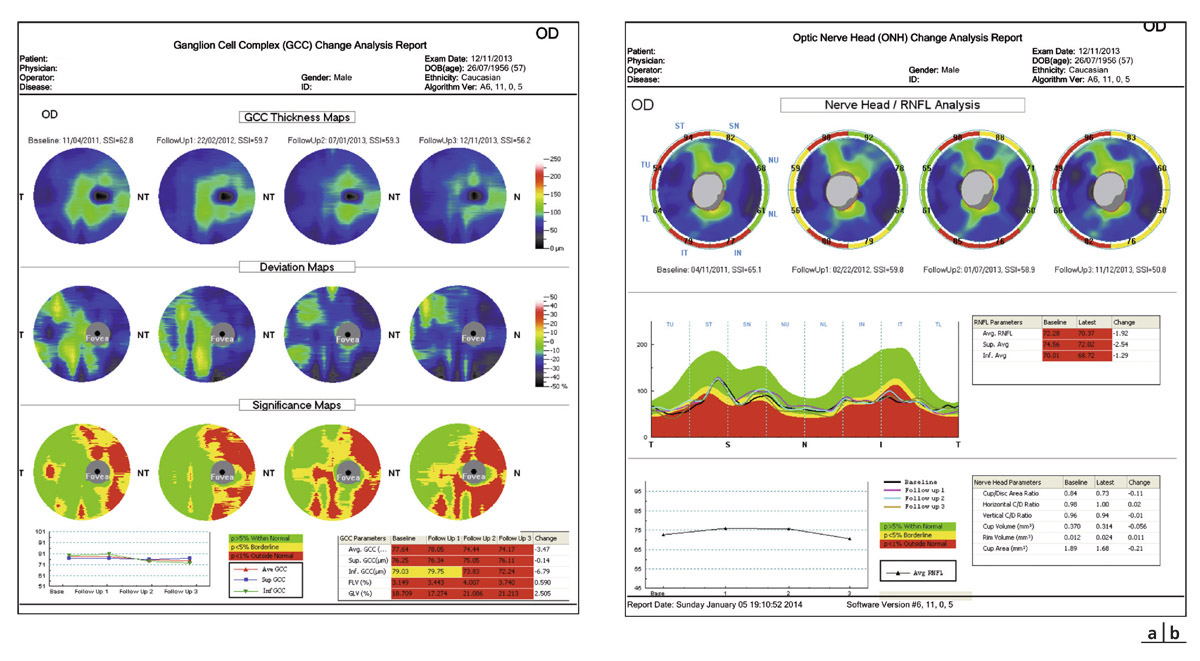
Fig. 12-11 Glaucome avancé. Suivi en OCT-SD de la progression de l’atteinte du complexe ganglionnaire (a) encore possible, alors que l’évaluation de l’épaisseur de la couche des FNR (b) atteint un niveau plancher à partir duquel l’analyse d’une évolution n’est plus possible. (Clichés J.-P. Renard.)
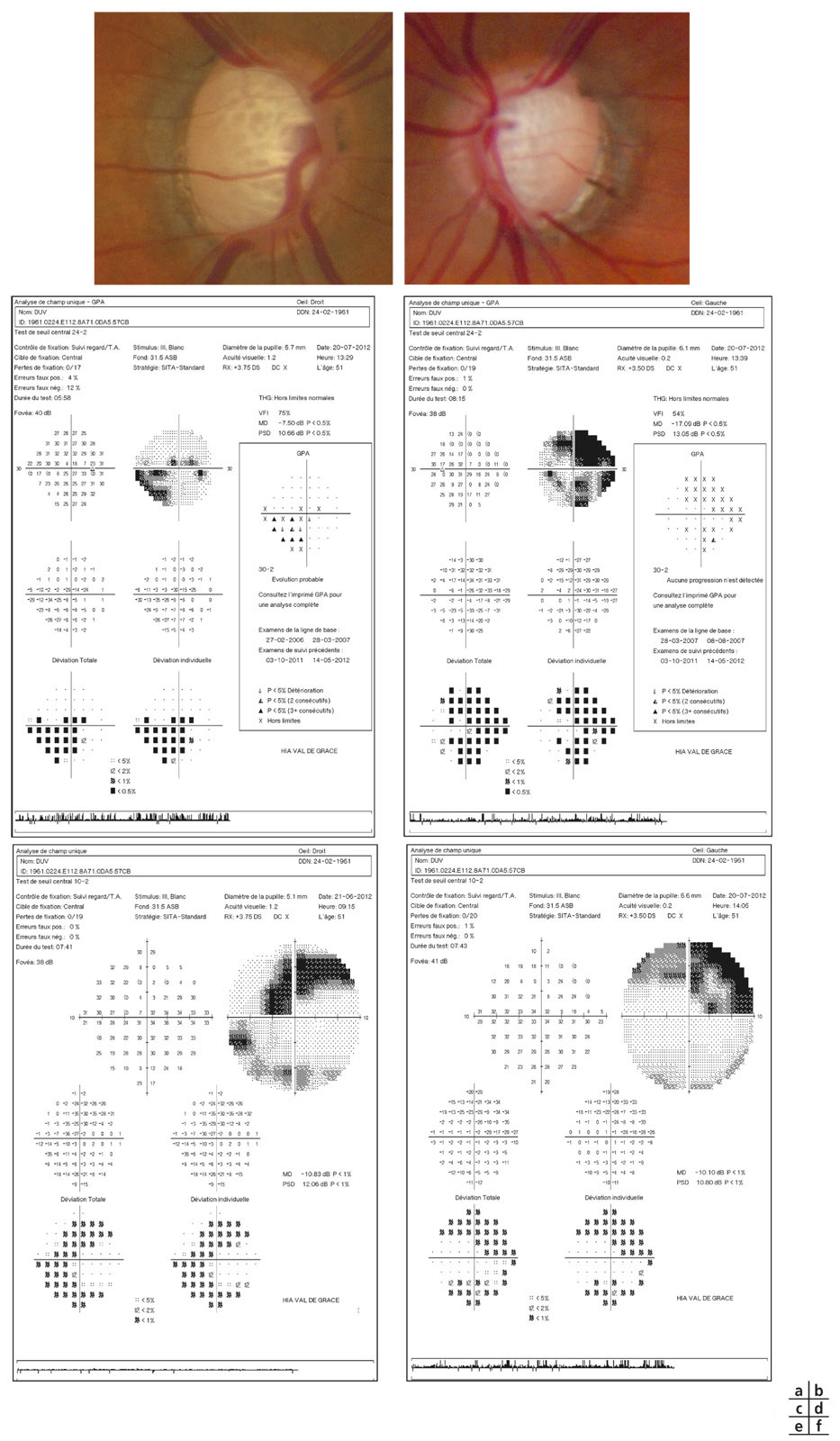
Fig. 12-13 Glaucome avancé de l’œil gauche (OG) et modéré de l’œil droit (OD). a, b. Rétinophotographies OD et OG. c, d. Relevés PAS blanc-blanc 24-2 OD et OG. e, f. PAS 10-2 OD et OG.
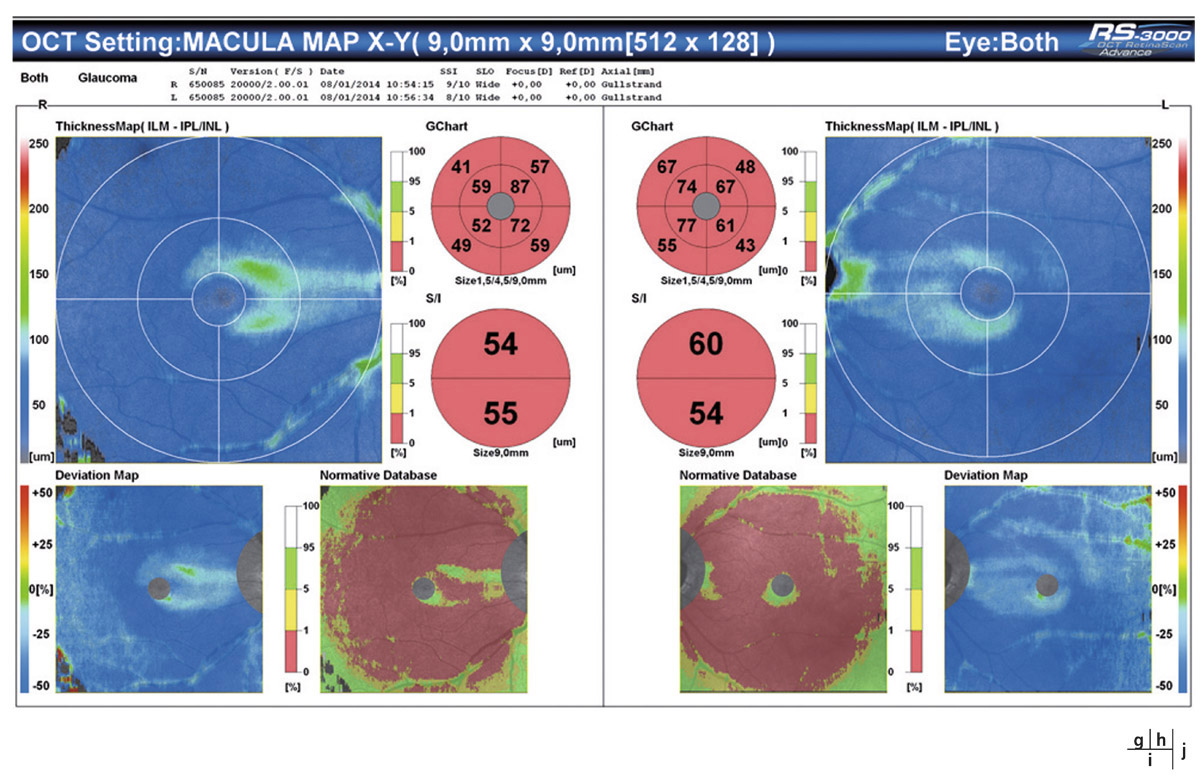
Fig. 12-13 g, h. Relevé OCT-SD OD et OG FNR, TNO et complexe maculaire cellulaire ganglionnaire : Cirrus HD-OCT. i. OCT-SD RTVue. j. OCT-SD RS 3000 Nidek. (Clichés J.-P. Renard.)
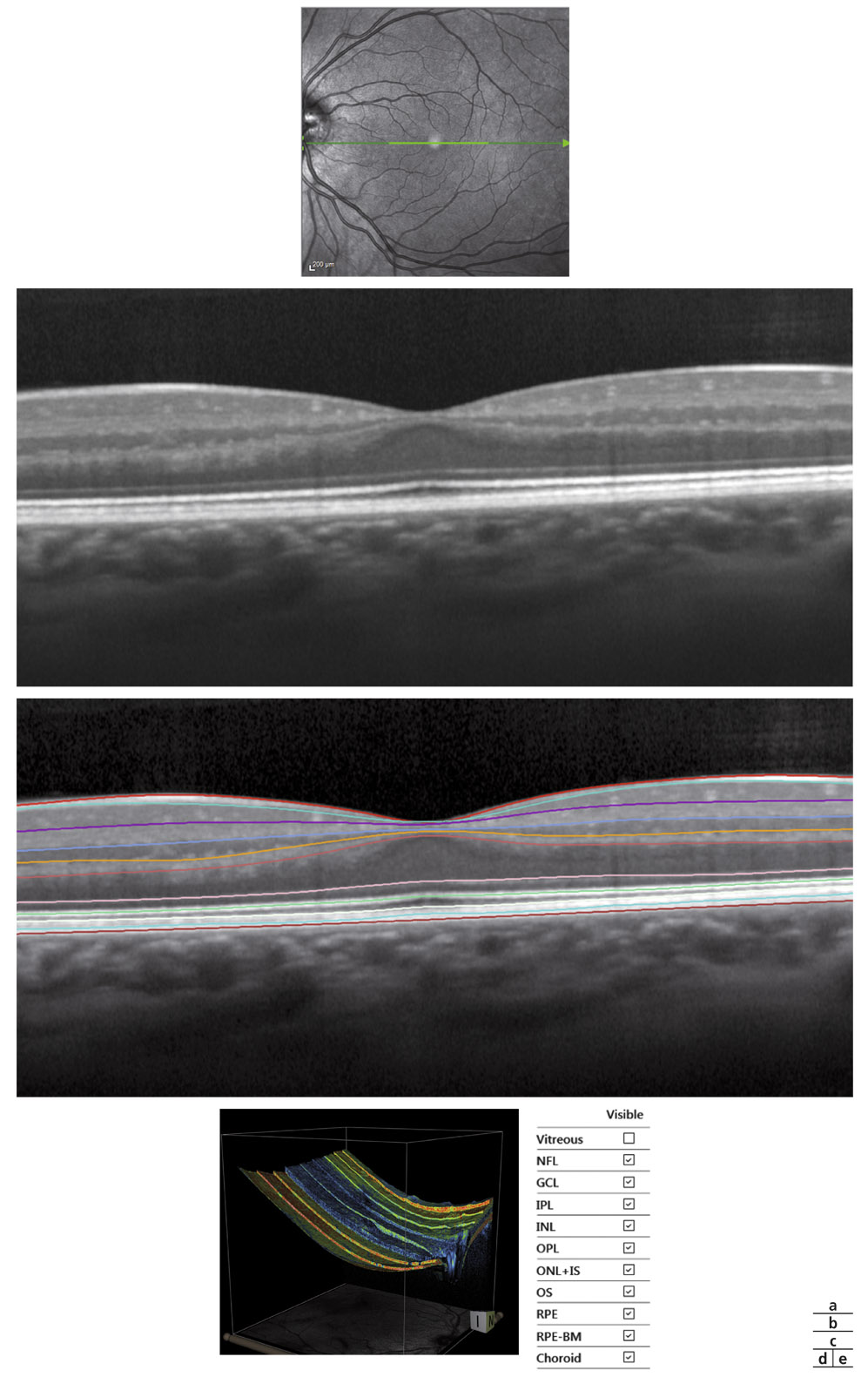
Fig. 12-12 Nouveau logiciel de segmentation des couches rétiniennes en OCT-SD. a, b, c. OCT-SD Spectralis (Heidelberg). d, e. OCT-SD Canon OCT HS-100. (Clichés J.-P. Renard.)
Une surveillance semestrielle est raisonnable dans le glaucome évolué à la fois pour la mesure de la PIO et l’analyse du CV et de l’OCT. Cependant, en cas de déséquilibre pressionnel, un contrôle trimestriel de la PIO peut être souhaitable.
L’information du patient est capitale à ce stade du GPAO. Bien qu’atteints de manière significative, beaucoup de patients ne réalisent pas l’importance de leur déficit. Ils sont surpris, en fin d’évolution, par la rapidité de l’aggravation. Une adhérence étroite au traitement s’impose donc. La prise de conscience du déficit et la sensibilisation de l’entourage sont essentielles pour aider les patients à se préparer à une évolution difficilement contrôlable et éviter les risques d’accidents dans la vie quotidienne, en particulier dans la conduite automobile.
Le glaucome avancé présente des spécificités, en particulier quant à la nécessité d’une surveillance étroite, essentiellement par l’examen clinique et le CV.
Se pose souvent la question des risques chirurgicaux dans une telle situation, avec en particulier celui de la perte du point de fixation dans les suites immédiates de la chirurgie filtrante. Si le risque existe, il est probable qu’il soit surestimé, car la plupart des travaux sur ce point n’ont pas rapporté une baisse significative et définitive de l’acuité visuelle après trabéculectomie ou sclérectomie profonde [3, 15].
En revanche, sur un plus long terme, les phénomènes d’apoptose dans le glaucome [5] expliquent que cette « destruction programmée » des cellules peut survenir alors même que les causes responsables de l’aggravation du déficit ont disparu, par exemple après une chirurgie filtrante réussie.
Retenir
Le bilan d’un patient au stade de GPAO avancé est le même que celui du glaucome modéré.
Une attention particulière doit être portée aux fluctuations de la PIO qui, à ce stade, représentent un facteur de risque évolutif important.
La PIO cible doit être plus basse que dans le glaucome modéré.
Le suivi de l’atteinte fonctionnelle en périmétrie automatisée est capital à ce stade, plus fiable et reproductible que l’analyse de l’atteinte structurale en OCT-SD (tableau 12-7).
Une surveillance semestrielle, voire trimestrielle est nécessaire.
L’importance de l’information et la qualité de la relation avec le patient prennent toute leur dimension à ce stade évolutif du GPAO.
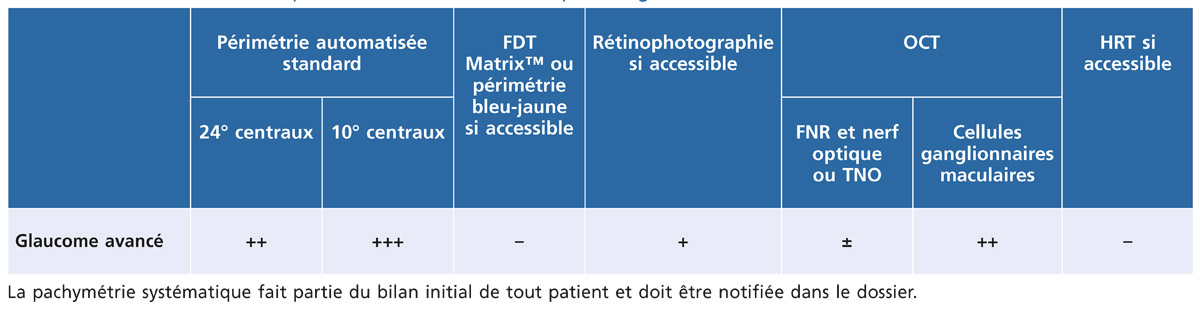
Tableau 12-7 – Examens complémentaires recommandés pour le glaucome avancé.
[1] Chen PP. Blindness in patients with treated open-angle glaucoma. Ophthalmology. 2003 ; 110 : 726-33.
[2] Chen PP. Risk and risk factors for blindness from glaucoma. Curr Opin Ophthalmol. 2004 ; 15 : 107-11.
[3] Grunewald F, Bresson-Dumont H, Bechetoille A. La trabéculectomie est-elle sans danger pour le point de fixation ? J Fr Ophtalmol. 1996 ; 19 : 253-8.
[4] Heijl A, Bengtsson B, Oskarsdottir SE. Prevalence and severity of undetected manifest glaucoma. Results from the Early Manifest Glaucoma Trial Screening. Ophthalmology. 2013 ; 120 : 1541-5.
[5] Kerrigan LA, Zack DJ, Quigley HA, et al. TUNEL-positive ganglion cells in human primary open-angle glaucoma. Arch Ophthalmol. 1997 ; 115 : 1031-5.
[6] Koucheki B, Nouri-Mahdavi K, Patel G, et al. Visual field changes after cataract extraction : the AGIS experience. Am J Ophthalmol. 2004 ; 138 : 1022-8.
[7] McGwin G Jr, Xie A, Mays A, et al. Visual field defects and the risk of motor vehicle collisions among patients with glaucoma. Invest Ophthalmol Vis Sci. 2005 ; 46 : 4437-41.
[8] Moura AL, Raza AS, Lazow MA, et al. Retinal ganglion cell and inner plexiform layer thickness measurements in region of sever visual field sensitivity lost and patient with glaucoma. Eye. 2012 ; 26 : 1188-93.
[9] Nouri-Mahdavi K, Hoffman D, Coleman AL, et al. Advanced Glaucoma Intervention Study. Predictive factors for glaucomatous visual field progression in the Advanced Glaucoma Intervention Study. Ophthalmology. 2004 ; 111 : 1627-35.
[10] Peters D, Bengtsson B, Heijl A. Factors associated with lifetime risk of open-angle glaucoma blindness. Acta Ophthalmol. 2013 ; 110 : 54-7.
[11] Peters D, Bengtsson B, Heijl A. Lifetime risk of blindness in open-angle glaucoma. Am J Ophthalmol. 2013 ; 147 : 207-12.
[12] Prata TS, de Moraes CG, Teng CC, et al. Factors affecting rates of visual field progression and glaucoma patient with optic disc hemorrhage. Ophthalmology. 2010 ; 117 : 24-9.
[13] Sung JH, Sun JH, Na JH. Progression detection capability of macular sickness in advents glaucomatus eyes. Ophthalmology. 2012 ; 119 : 308-13.
[14] The Advanced Glaucoma Intervention Study (AGIS) : 7. The relationship between control of intraocular pressure and visual field deterioration. The AGIS Investigators. Am J Ophthalmol. 2000 ; 130 : 429-40.
[15] Topouzis F, Tranos P, Koskosas A, Pappas T, Anastasopoulos E, Dimitrakos S, Wilson MR. Risk of sudden visual loss following filtration surgery in end-stage glaucoma. Am J Ophthalmol. 2005 ; 140 : 661-6.