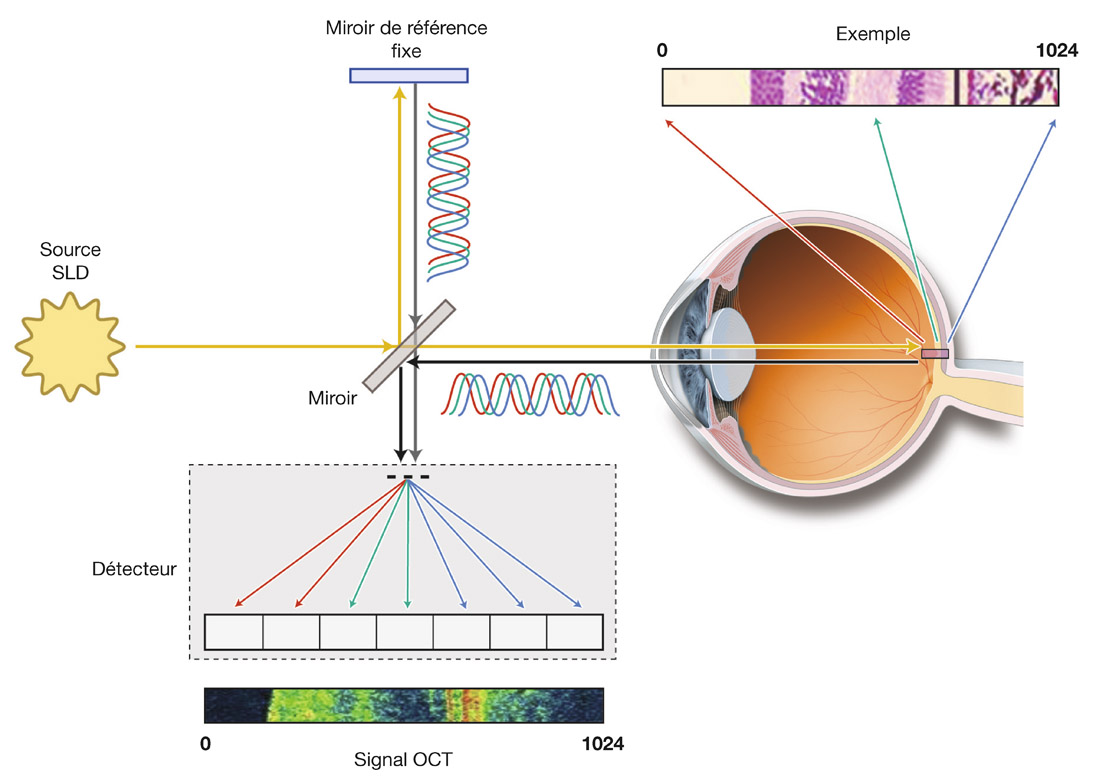
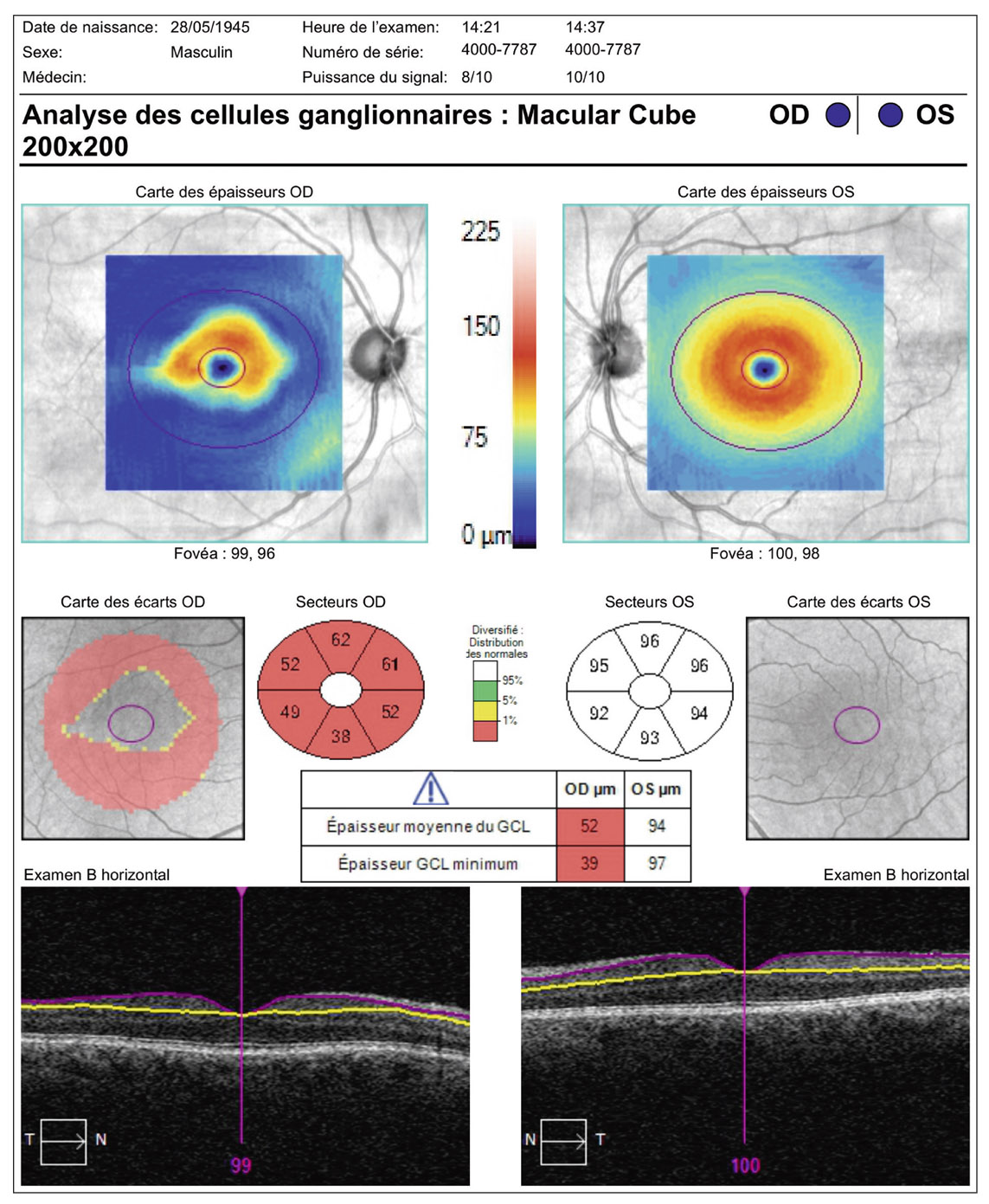
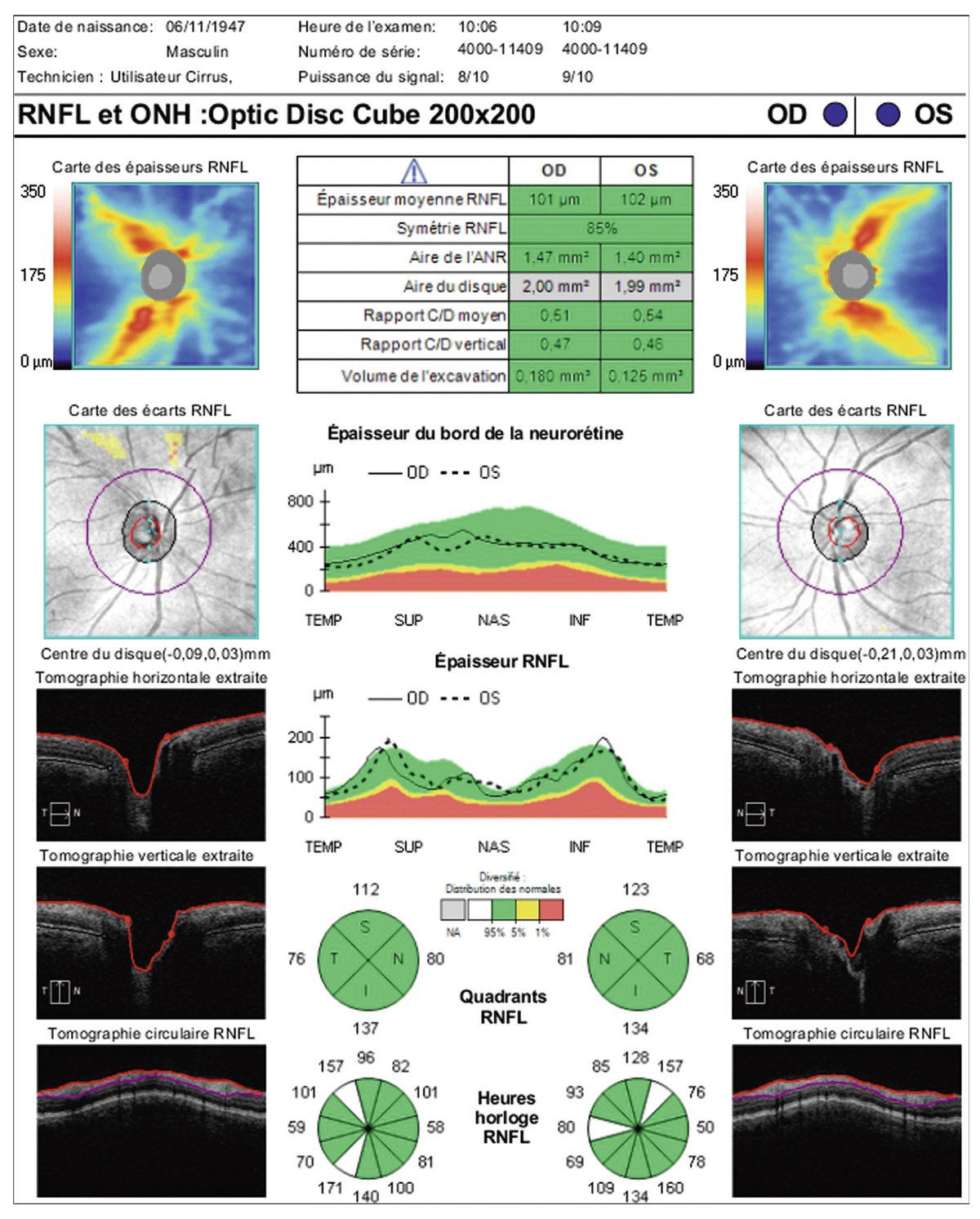
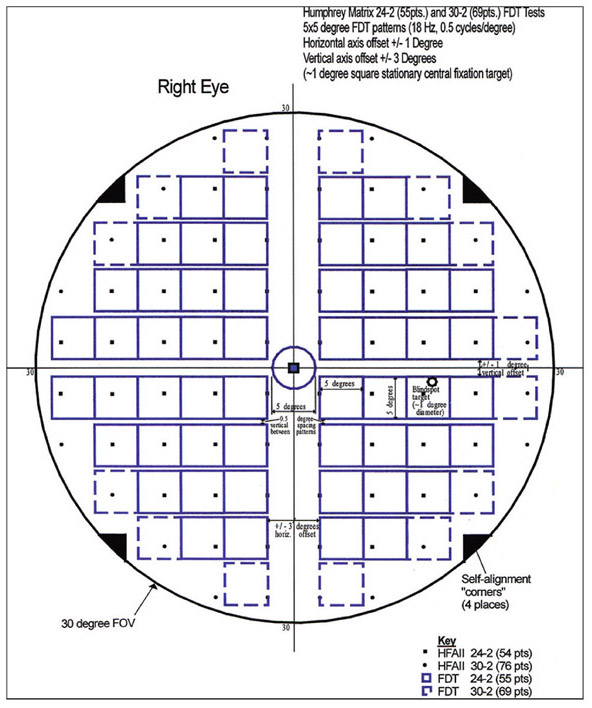
E. Sellem
-
Même si elle n’est affectée que tardivement, l’acuité visuelle (AV) doit être régulièrement mesurée chez le sujet glaucomateux.
-
Cette évaluation systématique lors des visites de contrôle a une valeur médicolégale et permet de dépister une affection associée débutante qui doit être prise en compte (DMLA, etc.).
-
En matière de glaucome, la notation décimale est suffisante pour évaluer l’AV.
-
En dehors de son atteinte dans les glaucomes agoniques, l’AV varie avec l’âge, l’accommodation, la taille de la pupille et certains facteurs psychophysiques.
-
La qualité de vie peut être considérablement perturbée par le GPAO même lorsque l’AV est excellente.
La diminution de l’AV est habituellement un événement tardif et redouté dans l’évolution du glaucome, bien que le champ visuel central et donc les cellules maculaires – comme on le suspectait déjà il y a plusieurs décennies [1] – puissent être affectés à un stade très précoce de la maladie. Seule l’acuité visuelle « subjective » sera envisagée ici (la mesure de l’AV dite « objective », utilisant des méthodes essentiellement électrophysiologiques, est réservée à des indications particulières quand la coopération du sujet interdit tout procédé psychophysique, voir chapitre 9-VI).
Quoi qu’il en soit, la mesure de l’AV couplée à celle de la réfraction est le passage obligé, le premier, de l’examen ophtalmologique. Même si elle présente peu d’intérêt diagnostique chez le patient glaucomateux, elle doit être connue à tous les stades de la maladie, car elle renseigne sur l’éventuelle coexistence d’une pathologie associée, fonctionnelle ou organique, fixée ou évolutive, accessible ou non à un traitement : amblyopie, pathologie cornéenne, cataracte, dégénérescence maculaire, affection neuro-ophtalmologique, etc., pathologie pouvant elle-même perturber l’interprétation des tests de la fonction et de la structure réalisés tout au long du suivi ultérieur. Par ailleurs, la connaissance de l’AV est indispensable pour évaluer les capacités fonctionnelles résiduelles (vie quotidienne, professionnelle, lecture, sport, conduite automobile, etc.) d’un patient qui peut présenter déjà, par ailleurs, de lourdes amputations périmétriques provoquées par l’atteinte de la tête du nerf optique.
La mesure de l’AV de chaque œil, de loin et de près, parfaitement corrigée pour un éventuel défaut réfractif, doit être régulièrement faite chez le sujet glaucomateux ou susceptible de l’être [5, 6].
La lecture de l’échelle de Snellen ou de ses dérivés (chiffres, dessins, optotypes) pour la vision de loin est encore la méthode de mesure subjective la plus connue et la plus utilisée.
Avec elle, la notation dite « de Monoyer » est décimale, avec un dénominateur de 10 pour les acuités comprises entre 1/10 et 10/10 (dans les pays anglo-saxons, l’AV est également exprimée par une fraction, mais dont le numérateur est fixe et égal à 20 : par exemple, 20/40 correspond à 5/10 en échelle décimale). Pour les acuités inférieures à 1/10, le numérateur ne change plus et est fixé à 1 (1/20 = 0,05/10). Si aucune lettre n’est vue à une distance d’un mètre, l’AV du patient est inférieure à 1/40, et l’observateur notera l’aptitude du patient à compter les doigts à 60 cm – éventuellement avec une fixation excentrique –, à apercevoir les mouvements de la main ou à avoir (ou non) une perception lumineuse, notamment dans le champ visuel temporal aux stades agoniques du GPAO.
L’échelle décimale, très simple et d’une grande facilité d’emploi, est controversée car la différence d’angle apparent est beaucoup plus grande entre 1/10 et 2/10 qu’entre 9/10 et 10/10. C’est la raison pour laquelle ont été élaborées des échelles logarithmiques (logarithme de l’angle de résolution minimum) comme l’échelle ETDRS (Early Treatment Diabetic Retinopathy Study), dans laquelle les paliers sont plus nombreux pour les basses AV, et moins nombreux pour les hautes AV (passant, par exemple, directement de 10/10 à 8/10). Elle teste donc de manière plus précise les faibles acuités visuelles. Son principe général est de donner un point par lettre vue, et donc d’attribuer des scores d’AV à la lettre près. Sa réalisation est donc plus longue qu’avec les tests décimaux. Ce score ETDRS, standardisé au niveau international, varie dans le même sens que l’AV en notation décimale. Ces échelles nécessitent un changement d’habitudes avec un matériel spécifique (boîte lumineuse ou écran plat, plusieurs planches), un protocole de présentation des lettres et de lecture rigoureux, et un calcul manuel du score bien que des versions informatisées soient maintenant disponibles (moniteur Metrovision™, L40™ de Luneau, etc.). En matière de glaucome, cette notation logarithmique présente peu d’intérêt pratique : au stade dit agonique, dès lors que le méridien vertical est dépassé, l’AV va s’effondrer rapidement. Toutefois, en cas de pathologie associée (telle une occlusion veineuse rétinienne ou une pathologie maculaire propre), elle est utile pour évaluer avec une grande finesse son retentissement et son évolution fonctionnelle.
Cependant, ces tests à fort contraste n’interrogent qu’une partie très limitée des possibilités de résolution spatiale du système visuel (voir chapitre 9-V). Pour cette raison ont été développées des échelles d’acuité visuelle qui peuvent être utiles pour l’évaluation de la fonction visuelle [2, 4], tels les tableaux d’acuité de Pelli-Robson (où le contraste entre chaque groupe de lettre va en diminuant) et de Regan (le contraste est le même pour un groupe de lettres dont la taille diminue progressivement). Elles sont parfois réalisées dans les centres d’exploration fonctionnelle sophistiqués, et fournissent des informations utiles sur le retentissement de la pathologie dans certains actes de la vie courante (conduite nocturne, activités professionnelles spécifiques, etc.).
Le test de Parinaud est le plus couramment utilisé en France, avec une notation allant de P1,5 à P14 ou P28 selon les planches. Il peut être utile de noter la distance spontanée de lecture, mais il faut aussi imposer une distance de 40 cm (obligatoire pour certains certificats médicaux et pour comparer l’évolution de l’AV de près tout au long du suivi). D’autres planches de lecture sont utilisées à l’étranger : par exemple, notation Jaeger aux États-Unis et notation Wecker en Allemagne.
Des planches spécifiques mesurent d’autres paramètres pour la lecture mais sont malheureusement peu répandues, tel le test d’efficacité visuelle pour la lecture (TEVL) de Cohen, Sander et Zanlonghi (laboratoires Théa®) qui permet avec l’aide d’un chronomètre de calculer le nombre de mots lus par minute [3]. Elles fournissent de précieux renseignements sur cet élément fondamental de la qualité de vie qu’est la capacité à lire, éminemment perturbée dès lors qu’un scotome absolu affleure le point de fixation… même si le patient est encore capable de lire un niveau Parinaud 2 au cabinet de l’ophtalmologiste, avec un contraste excellent et sur quelques mots seulement !
Les conditions de réalisation étant considérées comme optimales (explications, vitesse de présentation et temps passé, réfraction corrigée au mieux, luminance du fond, contraste, etc.), les paramètres affectant l’acuité visuelle sont nombreux et interagissent souvent [6].
L’AV varie de façon importante avec l’âge. Elle serait seulement de 1/10 chez le nouveau-né, pour n’atteindre 10/10 que vers l’âge de 5 ou 6 ans. Quelques adolescents peuvent avoir une AV de 15/10, voire 20/10. À cause de facteurs neuronaux vieillissants, l’acuité visuelle diminue à partir de 60 ans (toute pathologie exclue, dont la cataracte) pour se situer vers 8/10 autour de 70 ans et 6/10 après 80 ans.
Elle n’est pas sollicitée chez les sujets de moins de 45 ans si, en pratique, l’AV en vision de loin est mesurée sur une échelle située à 5 mètres. En vision de près, elle n’intervient que pour des distances très courtes, inférieures à 25 cm, mais pas pour des distances de 40 cm.
Un diamètre pupillaire de 2,5 mm est le plus adapté pour éliminer les perturbations provoquées par un myosis (diminution de l’aberration de sphéricité et de l’éclairement de la rétine, augmentation de la profondeur de champ) ou une mydriase (effets inverses).
L’inexpérience, l’incompréhension du patient et/ou des optotypes mal choisis peuvent participer au recueil d’une AV erronée. Par ailleurs, la confusion est possible pour les couples de lettres F/P, U/V ou D/O/Q… ainsi que pour les lettres à contours arrondis, plus difficiles à reconnaître que celles formées de segments droits.
-
Le glaucome n’affecte l’AV subjective qu’à un stade tardif de son évolution. Le phénomène dit « d’épargne maculaire » permet au patient ayant perdu la totalité d’un hémichamp altitudinal ou présentant un scotome absolu paracentral limité par le méridien horizontal de garder une AV corrigée de 10/10, en dehors naturellement d’autres pathologies associées. Toutefois, une dissociation entre la vision de loin et celle de près (par exemple 5/10 et P14) peut être constatée lorsqu’un scotome absolu jouxte le point de fixation.
-
La cataracte, dans sa forme le plus commune, c’est-à-dire nucléaire, préserve longtemps l’AV de près, mais affecte la vision de loin. Les formes sous-capsulaires postérieures comme les opacifications capsulaires postérieures du pseudo-phake, en revanche, entraînent à la fois une chute de l’AV de loin et de près.
-
Les pathologies maculaires affectent l’AV à toutes les distances. L’acuité photopique est maximale dans la macula, et elle diminue rapidement pour n’être plus que de 4/10 au bord de la macula. L’utilisation d’un trou sténopéique de 2 mm permet de tester plus précisément la fonction maculaire.
-
Les autres pathologies oculaires (cornéennes, uvéales, vitréennes, rétiniennes, extramaculaires) entraînent une atteinte très variable de l’AV en fonction de leur intensité et de leur localisation par rapport à l’axe visuel.
Retenir
-
La mesure de l’AV, même si cette dernière n’est affectée qu’aux stades évolués du glaucome, renseigne sur l’éventuelle coexistence d’une pathologie associée, qui elle-même risque de perturber les tests ultérieurs de la fonction et de la structure.
-
L’échelle de Snellen en vision de loin et le test de Parinaud en vision de près sont les plus utilisés pour mesurer l’acuité visuelle du sujet glaucomateux.
-
Toutefois, ils sont faussement optimistes sur les capacités fonctionnelles du patient dans la vie quotidienne lorsque les scotomes affleurent le point de fixation.
-
Lorsqu’elle s’effondre à cause de la progression du glaucome, l’AV le fait généralement rapidement et sans subtilité, si bien que l’utilisation de l’échelle ETDRS est sans intérêt dans le glaucome, à moins que coexiste une atteinte maculaire spécifique.
-
Lorsque les scotomes absolus jouxtent le point de fixation, cet effondrement fonctionnel est souvent précédé d’une dissociation entre une vision de loin encore correcte et une vision de près beaucoup plus perturbée.
-
L’évaluation de l’AV doit tenir compte de sa diminution physiologique avec l’âge.
[1] Anctil J, Anderson D. Early foveal involvement and generalized depression of the visual field in glaucoma. Arch Ophthalmol. 1984 ; 102 : 363-70.
[2] Bailey IL, Lovie-Kitchin JE. Visual acuity testing. From the laboratory to the clinic. Vision Res. 2013 ; 90 : 2-9.
[3] Gomez A, Zanlonghi X. Réfraction du malvoyant. In : Roth A, Gomez A, Pechereau A (eds). La réfraction de l’œil : du diagnostic à l’équipement optique. Issy-les-Moulineaux, Elsevier-Masson, 2007 : 235-68.
[4] Regan D, Neima D. Low-contrast letter charts in early diabetic retinopathy, ocular hypertension, glaucoma, and Parkinson’s disease. Br J Ophthalmol. 1984 ; 68 : 885-9.
[5] Zanlonghi X. Acuité visuelle, sensibilité aux contrastes dans le cadre des pathologies rétiniennes. In : Cohen SY, Gaudric A (eds). Techniques d’exploration de la rétine. Volume 1 : Rétine. Cachan, Médecine Sciences Publications, 2012 : 115-29.
[6] Zanlonghi X, Speeg-Schatz C. Acuité visuelle. In : Risse JF (Ed.). Exploration de la fonction visuelle. Rapport de la SFO. Paris : Masson ; 1999. p. 99-128.
P. Denis, J.-P. Romanet
P. Denis
-
La mesure de la pression intra-oculaire (PIO) est une étape essentielle du dépistage de l’hypertension intra-oculaire et du suivi des glaucomes, quels qu’en soient le stade et la forme clinique.
-
La tonométrie à aplanation selon Goldmann demeure la technique de référence pour la mesure de la PIO, bien que la fiabilité des résultats soit fonction de paramètres cornéens ou d’autres facteurs extrinsèques (qualité du film lacrymal). En particulier, elle doit être couplée à la mesure de l’épaisseur cornéenne centrale (ECC).
-
Dans tous les cas, il est essentiel que la mesure au tonomètre de Goldmann soit réalisée dans de bonnes conditions techniques, et le soin apporté à la qualité de la mesure est primordial.
-
Afin de s’affranchir du facteur cornéen et d’analyser les propriétés viscoélastiques de la cornée, plusieurs nouveaux tonomètres sont actuellement disponibles, tels que l’Ocular Response Analyzer. Ils permettent une évaluation plus globale de la PIO, intégrée à d’autres paramètres biomécaniques (hystérèse cornéenne).
-
En clinique, la mesure de la PIO n’est qu’un des éléments du diagnostic de la neuropathie. Elle ne fait pas partie stricto sensu de sa définition et doit aussi s’interpréter en fonction des autres stigmates du glaucome.
Si la PIO n’est qu’un facteur de risque du glaucome, elle en est le principal et celui dont le contrôle est essentiel pour ralentir la conversion vers un glaucome ou la progression d’un glaucome avéré. L’obtention d’une mesure fiable de la PIO est donc une étape essentielle du dépistage et du suivi du glaucome.
En pratique, la technique idéale devrait mesurer la pression autour de la tête du nerf optique, dans le compartiment postérieur de l’œil. Idéalement aussi, afin de limiter le traumatisme – bénin – et une possible transmission d’un agent infectieux, la mesure devrait être non invasive, rapide, si possible sans contact cornéen direct. Elle devrait aussi s’affranchir totalement des particularités anatomiques et biomécaniques du globe (courbure, rigidité de la coque oculaire, épaisseur des tuniques de l’œil, hystérèse cornéenne et viscoélasticité tissulaire).
Il est donc indispensable, avant d’interpréter une valeur ponctuelle de la PIO, de s’assurer que la mesure a été réalisée dans de bonnes conditions, avec un matériel adéquat et bien entretenu. Pour la plupart des tonomètres à aplanation, l’interprétation de la mesure doit être faite après avoir mesuré l’ECC centrale. En clinique, la mesure de la PIO n’est qu’un des éléments du diagnostic de la neuropathie et doit aussi s’interpréter en fonction des autres stigmates du glaucome.
Comment mesurait-on la PIO il y deux cents ans ? Sir William Bowman préconisait en 1820 la palpation digitale, en expliquant qu’un peu de pratique suffisait à bien apprécier la pression qui régnait à l’intérieur du globe oculaire. La palpation transpalpébrale des globes oculaires, à l’aide des index, était à l’époque la technique de référence et les tonomètres mécaniques de von Graefe ou de Shiøtz, fondés sur le principe d’indentation, ont mis du temps à s’imposer. Le palper digital demeure le moyen le plus simple, le plus économique, mais aussi le moins précis pour estimer la réelle pression qui règne à l’intérieur du globe oculaire.
Les tonomètres à indentation reposent sur le principe simple que l’on peut soumettre l’œil à l’action d’une force extérieure en déprimant la cornée. Le tonomètre de Shiøtz est composé d’un piston qui déforme et indente la cornée, grâce à son poids et à des poids additionnels et variables. On mesure alors la profondeur de la dépression cornéenne produite par un poids donné, et on en déduit la valeur de la PIO en se basant sur des poids calibrés. L’appareil se présente sous la forme d’une tige métallique coulissant le long d’un axe. La tige pèse 5,5 g et on peut y ajouter des poids supplémentaires pour obtenir une indentation plus forte. Plus la PIO est basse, plus le piston s’enfonce dans la cornée, et la mesure se fait en estimant le déplacement de son pied et en utilisant des étalonnages tonométriques. Le piston transmet son déplacement dans la cornée à un système de levier, dont une branche porte des intervalles gradués. La principale critique de la technique est que l’indentation de la cornée ne produit pas les mêmes effets en fonction des capacités de distension de l’œil, plus faible chez les myopes que chez les hypermétropes ; ainsi, les variations de rigidité sclérale d’un patient à l’autre sont une cause importante d’erreur d’étalonnage et expliquent l’abandon progressif des tonomètres de Shiøtz dans la pratique courante.
Dès son avènement en 1950, la tonométrie à aplanation de Goldmann a régné en maître pour la mesure de la PIO. Aucune nouvelle technique ne l’a véritablement supplantée pour surveiller les patients, même si la tonométrie classique comporte des limites. Les tonomètres non-contact concurrencent actuellement le tonomètre de Goldmann dans les consultations, le premier appareil ayant été disponible dès 1972. Leur fiabilité s’est incontestablement améliorée, même si les critiques adressées au principe du tonomètre de Goldmann sont également valables pour les tonomètres non-contact. La tonométrie à air pulsé sans contact peut être considérée comme une variante du tonomètre à aplanation, et elle utilise un bref jet d’air pour déformer la cornée jusqu’à la rendre concave, mais en passant par une phase où la surface aplanie présente le meilleur angle de réflexion entre la source lumineuse et un capteur opto-électronique ; c’est ce maximum qui est détecté et considéré comme le moment de la mesure. Le temps écoulé entre le début du jet d’air et la réflexion maximale sur la cornée peut être converti en une valeur de PIO.
La tonométrie à aplanation selon Goldmann répond aux lois strictes d’Imbert-Fick stipulant que « la mesure d’une pression régnant dans une sphère remplie de fluide, limitée par une membrane infiniment mince, peut être mesurée par une contre-pression externe, suffisante pour transformer une portion de sclère en un plan ». La pression à l’intérieur d’une sphère élastique (P) est donc estimée par la force nécessaire (W) pour aplanir une portion de sa surface (A), selon l’équation : P = W/A. Il est donc à la fois possible de mesurer la pression en exerçant une force variable pour aplanir une surface prédéterminée (tonomètre à surface fixe) ou en exerçant une force fixe pour aplanir une surface variable (tonomètre à surface variable). Le tonomètre à aplanation de Goldmann est un appareil du premier type, car seule la pression exercée sur la cornée peut varier (fig. 9-1). La mesure est purement statique ; elle calcule la pression à partir d’une force qui aplanit une sphère aux parois élastiques, pour déplacer un volume constant à l’intérieur de la sphère. La force est exprimée en gramme et doit être multipliée par dix pour obtenir la PIO en mmHg ; la surface d’aplanissement du cône (3,06 mm de diamètre) du tonomètre de Goldmann a été spécialement déterminée pour respecter cette équation, et ne déplace qu’un minimum de fluide à l’intérieur de l’œil, environ 0,4 mm3. Dans ces conditions, le rôle perturbateur de la rigidité sclérale est négligeable et les forces élastiques de déformation de la cornée, ainsi que celles liées à la tension superficielle des larmes, sont mieux prises en compte.
Le cylindre de plastique est monté sur un support aboutissant à un boîtier portant un balancier et un tambour sur lequel est gravée une échelle tonométrique, le tout étant monté latéralement sur le biomicroscope. La force destinée à aplanir la cornée est directement convertie en mmHg. L’appareil de Goldmann est étalonné de telle façon que la force nécessaire pour aplanir la cornée répond à l’équation : 1 g = 1 mmHg.
Quand la surface de la cornée est aplanie par le cône, le ménisque de larmes est vu au travers du cylindre de plastique comme un cercle de fluorescence. L’originalité du tonomètre de Goldmann réside dans le cône qui est en fait un biprisme : l’anneau de fluorescence est ainsi transformé en deux hémi-mires (demi-cercles) dont les extrémités se font face. Lorsque la force exercée sur la cornée est identique à la pression qui règne dans l’œil, les extrémités internes des deux hémi-mires se font face et coïncident. L’observateur voit les demi-cercles bleus (correspondant à la surface aplanie), bordés par une lumière verte (correspondant à la fluorescéine à la surface de la cornée) et peut, grâce à la molette tonométrique, ajuster la distance entre les deux hémi-mires. La pression qui règne dans l’œil est celle qui est lue sur la molette latérale du tonomètre lorsqu’il y a une parfaite coïncidence des bords internes du demi-cercle supérieur et du demi-cercle inférieur (fig. 9-2).
La position des deux mires varie continuellement en fonction des oscillations cardiaques et respiratoires. La pression augmente un peu à chaque systole et diminue d’autant durant la diastole. Du fait de ces oscillations pulsatiles, la position des hémi-mires peut varier pendant la mesure, en particulier lorsque les oscillations physiologiques sont exagérées (par exemple en cas d’insuffisance aortique ou de nanophtalmie) (fig. 9-3).
La comparaison à des valeurs manométriques, estimées par canulation de la chambre antérieure, indique que la pression mesurée est dépendante de l’épaisseur de cornée, pouvant donner des écarts de près de 10 mmHg en fonction des variations de celle-ci, surtout aux valeurs extrêmes des pressions.
Le modèle théorique d’Imbert-Fick suppose que la membrane élastique sur lequel se pose le cône du tonomètre soit infiniment mince et totalement sèche, et que le volume de l’œil soit composé d’un seul compartiment liquidien et homogène. Or ces conditions ne sont pas toutes remplies pour le globe oculaire, et le film lacrymal exerce lui-même un effet de succion sur les bords du cône, créant ainsi une tension superficielle autour du cône. Il est également probable que la valeur mesurée soit faussée par la répartition non uniforme de la force exercée du fait de l’existence de plusieurs compartiments ayant un comportement biomécanique différent (chambre antérieure, chambre postérieure, cavité vitréenne). Lors de l’aplanation, l’effet de la rigidité cornéenne est de repousser le cône, ce qui conduit à surestimer la PIO finalement mesurée. A contrario, la tension superficielle des larmes autour du cône « attire » le tonomètre vers la cornée par effet de succion, conduisant à une sous-estimation de la PIO. Dans les conditions normales, ces deux forces s’antagonisent totalement et ne modifient pas la mesure par aplanation. Enfin, les mouvements de convection thermique de l’humeur aqueuse peuvent aussi modifier la répartition des pressions à l’intérieur du globe oculaire ainsi que la rigidité cornéosclérale.
Le tonomètre portable de Perkins fonctionne sur le même principe d’aplanation mais permet des mesures fiables en position de décubitus.

Fig. 9-1 Tonomètre à aplanation de Goldmann.

Fig. 9-2 a. Au début de la mesure, les demi-cercles doivent être éloignés l’un de l’autre. La molette doit être ensuite tournée afin de faire coïncider le bord interne des demi-cercles. b. Les demi-cercles coïncident par leur bord interne : bonne position de la molette. La pression peut être lue sur le vernier du tonomètre. c. Les demi-cercles coïncident par leur bord externe : erreur par défaut. d. Les demi-cercles coïncident complètement : erreur par défaut.

Fig. 9-3 Lecture de la mesure de pression intra-oculaire au tonomètre de Goldmann. Dans cet exemple, les demi-cercles ne coïncident pas par leur bord interne et la pression intra-oculaire est sensiblement inférieure à la valeur lue de 30 mmHg.
Il est nécessaire de vérifier l’étalonnage du tonomètre de Goldmann, au moins trois fois par an, afin de s’assurer que les mesures prises correspondent bien à la graduation du tambour (fig. 9-4). Pour ce faire, on vérifie en utilisant une barre métallique montée sur le corps du tonomètre l’alignement de la graduation zéro de celle-ci et de l’indicateur blanc de la molette du tambour, puis à différents niveaux de pression (20 et 60 mmHg). La bascule de la balance de torsion du tonomètre doit se faire de part et d’autre de l’indice du tambour sans dépasser une graduation. En cas d’anomalie, l’étalonnage du tonomètre est lui-même très délicat et doit être confié au fabricant.

Fig. 9-4 Vérification de l’étalonnage du tonomètre de Goldmann.
Une bonne installation du patient influence directement la qualité de la mesure. Le patient doit être bien installé derrière la lampe à fente, à la bonne hauteur, sans bloquer sa respiration, pour éviter un équivalent de manœuvre de Valsalva. Il doit appuyer son front contre la barre blanche et poser son menton sur la mentonnière. On s’assure qu’il se tient droit et ne se penche pas en avant. Avec le tonomètre de Perkins, le patient est installé dans une chaise avec appui-tête. La cravate ou un col de chemise trop serré sont déconseillés, pour éviter la compression des veines jugulaires et donc augmenter la pression veineuse épisclérale. Le patient doit être mis en confiance pour ne pas serrer les paupières, ne pas cligner les paupières de façon excessive, le contact avec les cils surestimant la valeur de la pression. Il doit regarder au loin, car une accommodation prolongée (vision de près) fait baisser la pression de 2 à 3 mmHg par simple contraction des muscles oculaires. L’œil doit être préalablement anesthésié par de l’oxybuprocaïne ; une goutte de fluorescéine est ensuite instillée (les bandelettes imprégnées de fluorescéine sont aussi utilisées), et le patient doit cligner plusieurs fois afin de diffuser harmonieusement la fluorescéine à la surface de la cornée. Le cône du tonomètre est installé dans l’axe des oculaires du biomicroscope. Afin de ne pas exercer de pression intempestive sur le globe oculaire, il est recommandé de positionner la molette du tambour sur la graduation « 10 mmHg », d’éclairer latéralement et fortement l’extrémité du cône en lumière bleue, puis d’ajuster la molette pour faire coïncider les mires. Deux mesures sont généralement faites (voire une troisième si les deux premières diffèrent de plus de 2 mmHg), moyennées et consignées dans le dossier médical, avec l’heure de la tonométrie. Il n’est pas recommandé d’effectuer plus de prises de PIO, car la pression répétée sur la cornée peut induire une diminution factice de la PIO. Le cône doit être bien centré sur la cornée pour limiter le risque d’aplanation asymétrique.
Le cône du tonomètre ne doit pas être utilisé pour plusieurs patients afin d’éviter la transmission d’agents infectieux et une stérilisation adaptée est obligatoire. Différents systèmes sont proposés pour s’affranchir de la nécessité de la stérilisation entre deux mesures : préservatifs souples, cônes à usage unique.
Hans Goldmann reconnaissait les limites techniques du tonomètre qu’il venait de mettre au point. Il aurait fallu que tous les yeux soient d’une taille, d’une courbure et d’une rigidité idéales. Pour résoudre ce paradoxe, il a dû arbitrairement décréter que l’épaisseur d’une cornée devait être de 520 μm pour que la mesure de pression soit bonne. Or il s’avère que les cornées varient plus en épaisseur que ne le pensait initialement Hans Goldmann.
Le développement de la chirurgie cornéenne ablative a fait surgir un problème technique déjà évoqué par Hans Goldmann lors de la mise au point de son tonomètre, mais popularisé par les chirurgiens de la cornée. La mesure de la PIO au tonomètre de Goldmann est fortement dépendante de la topographie et surtout de l’épaisseur de la cornée [2]. Les écarts de mesure ne sont pas négligeables. Les patients présentant une hypertonie ont une cornée volontiers plus épaisse [6] et ceux présentant un glaucome à pression normale une cornée plus mince. Si la cornée est modifiée en épaisseur, en courbure ou en rigidité, comme après une photokératectomie ou un LASIK, il se crée un biais dans la mesure de la PIO.
D’une façon générale, les cornées minces donnent lieu à une sous-estimation de mesure alors que les cornées épaisses, de plus de 600 μm, surestiment la PIO. Inversement, les patients présentant une hypertension intra-oculaire (HTO) isolée ont fréquemment une cornée plus épaisse. Dans l’Ocular Hypertension Treatment Study (OHTS), une cornée mince apparaît comme un facteur de risque du GPAO, en ce sens que la diminution de l’ECC sous-estime la PIO réelle. Une méta-analyse des publications permet d’estimer qu’un épaississement de 100 μm (par rapport à l’épaisseur d’une cornée normale, de 540 ± 30 μm en pachymétrie ultrasonique) aboutit à une surestimation de la PIO d’environ 5 mmHg [10]. Par canulation de la chambre antérieure, il est possible de corréler plus précisément les modifications de mesure : un changement de 70 μm correspondrait à une variation de 5 mmHg [12]. Quels que soient les facteurs de correction proposés, il n’existe pas d’abaques précis permettant de s’affranchir totalement du facteur cornéen. Il est ainsi possible que les erreurs de mesure de la PIO ne soient significatives que si l’ECC est franchement augmentée, au-delà de 600 μm. Lorsque la cornée est épaisse par œdème cornéen, la tonométrie sous-estime la valeur réelle, probablement parce que l’épithélium cornéen est plus facilement indentable et que ses propriétés biomécaniques sont affectées. Dans cette circonstance, il devient impossible d’évaluer la PIO par tonométrie à aplanation.
Une chirurgie par LASIK affecte à la fois l’épaisseur et la courbure de la cornée. Après chirurgie par laser Excimer, la PIO est modifiée de façon variable et se stabilise au bout d’environ 18 mois après la chirurgie. Il est aussi possible que l’amincissement cornéen induit par la chirurgie modifie la rigidité du globe oculaire, en particulier lorsque la correction dioptrique est élevée, ce qui peut fausser la théorie de Goldmann. Les autres procédures de chirurgie réfractive (inlays intracornéens en particulier) augmentent la rigidité cornéenne et induisent ainsi une surestimation de la mesure, qu’il est difficile de quantifier.
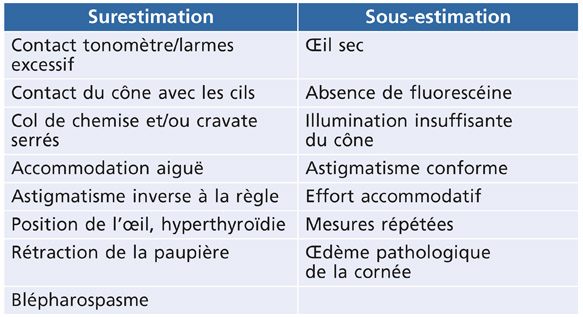
Tableau 9-1 Sources d’erreur de mesure de la PIO au tonomètre de Goldmann.
Les modifications de rayons de courbure modifient la surface de contact avec le cône et transforment les mires en deux semi-ellipses. Si l’orientation usuelle horizontale du cône est maintenue, une erreur de mesure se produit, avec sous-estimation en cas d’astigmatisme direct (conforme à la règle) et de surestimation en cas d’astigmatisme inverse (contraire à la règle). Une erreur de 1 mmHg est souvent enregistrée pour un astigmatisme de 4 dioptries. Pour corriger ce défaut, il est conseillé de faire pivoter le cône dans l’axe vertical, de telle façon à placer la ligne de division des hémi-mires dans l’axe d’astigmatisme. Alternativement, il est aussi possible de mesurer la PIO dans deux axes perpendiculaires à l’astigmatisme et de moyenner les valeurs lues dans les deux axes. En cas d’astigmatisme irrégulier (cicatrices cornéennes, suites de kératoplasties, œdème cornéen), la surface de contact est très déformée et la tonométrie n’est plus fiable.
En théorie, il est plus difficile d’aplanir une cornée de forte courbure qu’une cornée plate. De plus, la surface de la cornée aplanie est plus faible lorsque le rayon de courbure est augmenté. En pratique, la PIO est surestimée pour les cornées très puissantes, et des variations de 3 mmHg sont enregistrées lorsque la puissance cornéenne varie entre 40 et 49 dioptries.
En l’absence de fluorescéine, le diamètre du ménisque de larmes est plus petit et la mesure nécessite d’exercer une indentation plus prononcée pour que le bord interne des mires coïncide. En l’absence de fluorescéine, ou si la concentration de fluorescéine est trop faible, la PIO est sous-évaluée : des écarts de 3 à 5 mmHg sont observés, la tonométrie étant alors réalisée avec une illumination blanche. Cet artéfact est pénalisant si on souhaite comparer les mesures avec celles réalisées avec la fluorescéine, mais les mesures restent pertinentes si la même technique de tonométrie est toujours appliquée (absence de fluorescéine, éclairage par lumière blanche).
Il est conseillé de ne pas instiller de façon concomitante la fluorescéine et l’anesthésique de contact car le larmoiement réflexe déclenché par ce dernier peut diluer le colorant et fausser la mesure. En outre, la fluorescéine peut perdre sa fluorescence en milieu acide et certains anesthésiques de contact (proparacaïne, bénoxinate) sont conditionnés avec un pH voisin de 4. Les bandelettes en papier sont aussi utilisées pour normaliser la concentration de colorant à la surface de la cornée, mais sont moins courantes actuellement. Lorsque la fluorescéine est trop concentrée (au-delà de 0,5 %) ou le larmoiement trop abondant, la mesure de la PIO est surestimée car les demi-cercles sont trop épais et ne se chevauchent plus normalement par leur bord interne (fig. 9-5). L’inverse est vrai lorsque la concentration de la fluorescéine est faible (sous-estimation de la PIO).

Fig. 9-5 Les demi-cercles sont trop larges par excès de fluorescéine ou larmoiement abondant : erreur par excès.
Les lentilles de contact perturbent la mesure en s’interposant entre le cône et la cornée, et il est conseillé d’enlever les lentilles de contact avant de procéder la mesure de la PIO. La mesure semble cependant suffisamment fiable pour les lentilles de faibles puissances négatives, car le centre de la lentille est plus mince [25]. Les mesures par tonométrie à air seraient moins sensibles au port de lentilles que par tonométrie de Goldmann.
Toute variation de pression artérielle systémique modifie directement la PIO. Une augmentation de la pression artérielle systolique de 10 mmHg s’accompagne physiologiquement d’une élévation simultanée de la PIO d’environ 1 mmHg, expliquant probablement la relation entre les deux conditions [23]. Le lien statistique avec la valeur diastolique de la pression artérielle est plus discuté. Il est conseillé de moyenner la valeur obtenue au moment de la systole et celle obtenue au moment de la diastole cardiaque.
La respiration imprime aussi des oscillations rythmiques des demi-cercles de fluorescéine, la pression s’élevant un peu lors de l’inspiration et diminuant d’autant durant l’expiration. Un grand nombre de sujets retiennent leur respiration durant la tonométrie, ce qui peut aboutir à augmenter la pression pulmonaire, puis la pression veineuse épisclérale par la manœuvre de Valsalva. L’augmentation de la pression intrathoracique conduit à une distension des veines choroïdiennes et orbitaires, ce qui augmente instantanément la PIO. Une expiration forcée et maintenue pendant plusieurs secondes aboutit au même résultat d’augmentation de la PIO avec un retour à la normale lors de la reprise de la respiration.
La tonométrie à aplanation est normalement effectuée en quelques secondes et l’accommodation n’est guère sollicitée, en particulier parce qu’il est demandé au patient de regarder au loin. Si la mesure prend du temps et/ou si le patient regarde de trop près l’extrémité du cône, la contraction des muscles extra-oculaires aboutit à une châsse factice de l’humeur aqueuse par la voie trabéculaire. L’accommodation prolongée induit une diminution prolongée de la PIO, estimée à 2-3 mmHg pour une accommodation de 4 dioptries [3]. Cet effet ne s’observe que pour les efforts accommodatifs prolongés, excédant 2-3 minutes, ce qui survient rarement. La diminution de la PIO après accommodation est plus marquée chez les sujets jeunes.
Le tonomètre Tono-Pen® (Oculab Reichert) est un tonomètre électronique fonctionnant sur le même principe d’aplanation que le tonomètre de Mackay-Marg. Il est constitué d’une jauge de pression recouvert d’une ventouse de 1,02 mm qui transmet un signal électrique transmis à un microprocesseur. La surface d’aplanation (2,36 mm2) est plus faible de celle du tonomètre de Goldmann (7,35 mm2). La mesure électronique de la PIO peut être réalisée dans n’importe quelle position et le Tono-Pen® peut donc être utilisé chez les patients alités ou pour les examens sous anesthésie générale. L’instrument enregistre la moyenne de dix lectures consécutives et indépendantes avec un indicateur de statistiques pour ne sélectionner que les résultats tonométriques fiables. La corrélation des mesures avec celles obtenues avec les tonomètres à air pulsé [8] ou avec le tonomètre de Goldmann [4] est acceptable, avec cependant une surestimation dans les valeurs extrêmes de la PIO [16]. Des différences de 2 mmHg sont cependant observées dans près de 20 % des cas. Pour certains, la variabilité interobservateur est insuffisante, ce qui peut être handicapant et souligne l’importance d’une acquisition soigneuse des valeurs de mesure. La mesure de la PIO par le Tono-Pen® ne peut pas être substituée à la tonométrie de Goldmann, mais son utilisation est judicieuse lorsque le patient ne peut s’astreindre à subir un examen à la lampe à fente ou est en décubitus dorsal.
C’est un tonomètre portable dérivé du tonomètre de Goldmann et sa fiabilité est donc comparable [5, 19]. Son avantage réside dans sa maniabilité qui permet de l’utiliser dans n’importe quelle position (patient en décubitus, anesthésie générale). D’autres tonomètres fonctionnent sur le même principe, tels que le tonomètre de Draeger qui préserve la cornée d’une pression excessive.
Depuis plus de vingt ans, les ophtalmologistes se sont progressivement équipés de tonomètres à air pulsé sans contact qui permettent d’obtenir des mesures fiables, rapidement acquises et pouvant faire l’objet d’une délégation paramédicale (fig. 9-6). Ces tonomètres utilisent un bref jet d’air pour aplanir la cornée jusqu’à la rendre concave, mais en passant par une phase où la surface aplanie présente le meilleur angle de réflexion entre la source lumineuse et un capteur électronique à infrarouge relié à une cellule photo-électrique ; c’est ce maximum qui est détecté et enregistré comme moment de la mesure. Le temps écoulé entre la délivrance du jet d’air et la réflexion maximale sur la cornée peut être converti linéairement en une valeur de PIO. Dans les appareils les plus récents, la puissance du jet d’air délivrée par le tonomètre est progressive, sans à-coup, ce qui limite la gêne perçue par le patient. Les tonomètres non-contact obéissent à la loi d’Imbert-Fick et sont donc sujets aux mêmes types d’erreur de mesure que le tonomètre de Goldmann : influence de l’épaisseur et de la courbure cornéennes, de la mouillabilité du cône, etc. Étant donné que le temps d’acquisition du signal est très rapide (1-2 ms), la mesure est plus sensible aux variations de la pression artérielle du cycle cardiaque. Certains rapports suggèrent que la tonométrie non-contact serait encore moins fiable pour des valeurs extrêmes de la pachymétrie cornéenne [33] et pour des PIO très élevées, car la surface d’aplanation est plus étroite et que la déformation de la cornée sous l’effet de la pression du jet d’air est plus progressive. La tonométrie à jet d’air est peu fiable en cas de kératocône, en raison de l’irrégularité de la surface cornéenne [30]. Bien que la mesure soit automatique, il est nécessaire que le jet d’air soit projeté bien perpendiculairement à la surface de la cornée, que le patient soit bien installé, mis en confiance et les paupières relâchées. La calibration du tonomètre doit être réalisée régulièrement (étalonnage interne automatique ou manuel) et les valeurs tonométriques comparées au préalable avec celles obtenues avec le tonomètre de Goldmann.
Ces paramètres étant respectés, la tonométrie à jet d’air peut être considérée comme un bon appareil de dépistage de la PIO, acceptable pour le suivi pressionnel uniquement si la corrélation avec le Goldmann est excellente. Si elles sont pathologiques, les valeurs mesurées doivent être systématiquement contrôlées en tonométrie de Goldmann.
La tonométrie à jet d’air est particulièrement indiquée pour le dépistage de grande envergure du glaucome, pour les patients pusillanimes ou présentant une allergie aux anesthésiques de contact [36]. Exception notable, il n’est pas recommandé de l’utiliser après une kératoplastie du fait du risque d’intrusion intracamérulaire d’une bulle d’air par l’incision.
Fig. 9-6 Tonomètre non-contact.
La tonométrie à rebond repose sur le principe de la mesure de la vitesse de retour d’une fine tige métallique dans son logement après un impact sur la cornée. Une toute petite sonde très légère est utilisée pour rebondir brièvement sur la cornée. La tige suspendue par un champ magnétique possède une extrémité arrondie en forme de petite bille. Plus la PIO est élevée, plus la vitesse de rebond sera rapide. L’examen est indolore et peut être réalisé sans anesthésique de contact. Il est nécessaire de positionner la tige à environ 1 cm de l’œil ; cette dernière doit rester strictement horizontale. Les billes montées sur la tige sont à usage unique, ce qui limite le risque de contamination irienne. Il existe une version utilisable par le médecin (Icare PRO®) et une version plus simple à manier pour les patients (Icare ONE®). Les patients doivent cependant être formés à la mesure de leur pression avec le tonomètre à rebond. Le témoin lumineux affiche 11 zones de pression différentes entre 5 et 50 mmHg, avec une marge de sécurité de 3 mmHg par zone de mesure. Les mesures sont enregistrées dans la mémoire du tonomètre et peuvent être analysées par le professionnel. Cet appareil peut donc être une solution intéressante pour évaluer globalement le profil nycthéméral de la PIO des patients glaucomateux à leur domicile, sans perturber leur mode de vie. Par auto-tonométrie, les mesures surestiment de peu celles du tonomètre de Goldmann, et semblent corrélées à la pachymétrie cornéenne [26]. Chez les sujets sains, le tonomètre Icare® donne des résultats comparables à ceux du tonomètre de Goldmann [9, 35], avec des différences de moins de 3 mmHg dans 80 % des cas [13]. Chez les patients glaucomateux, la spécificité des mesures semble également bonne, mais elles sont moins concordantes en cas de cornée épaisse (0,7 mmHg de différence pour une variation de 10 μm) [7]. La qualité des mesures serait meilleure lorsque le rebond se produit en plein centre de la cornée que tangentiellement [39].
Les propriétés biomécaniques cornéennes influencent les résultats des mesures et des procédures oculaires, et peuvent détenir des indices pour le diagnostic et la prise en charge de certaines maladies oculaires. Jusqu’à maintenant, l’évaluation des propriétés des tissus cornéens était impossible, restreignant ainsi les praticiens et les chercheurs à se contenter de mesures purement géométriques de la cornée, telles que son épaisseur et sa topographie. L’analyseur de la réponse oculaire de Reichert (ORA®) permet une nouvelle mesure des propriétés des tissus cornéens appelée hystérèse cornéenne qui résulte de la résistance visqueuse du tissu cornéen. D’autres firmes commercialisent également des appareils fonctionnant sur le même principe, dont le Corvis® ST (Oculus), tonomètre couplé à une caméra Schleimpfug qui détecte les mouvements de la cornée après aplanation.
L’hystérèse est une propriété présente dans certains systèmes physiques, définie par le caractère différé dans le temps de la réponse à une force qui leur est appliquée. Ces systèmes réagissent « lentement » et ne reviennent pas instantanément à leur forme d’origine car ils absorbent une partie de l’énergie mécanique incidente qu’ils dissipent sous une autre forme (chaleur). Les systèmes purement visqueux possèdent une hystérèse élevée. Le comportement mécanique du tissu cornéen répond aux lois de la physique et peut être modélisé comme un système au comportement viscoélastique. L’élasticité et la viscosité confèrent au tissu cornéen deux caractéristiques comportementales différentes sur le plan des propriétés :
-
comportement élastique. Un système totalement élastique peut stocker de l’énergie avant de la restituer quasi intégralement ;
-
comportement visqueux. Un système visqueux oppose une résistance qui s’accroît de façon non proportionnelle à l’intensité de la force de déformation exercée. Une éponge est un exemple de système visqueux où l’énergie mécanique incidente est dissipée sous forme thermique, ce qui explique un retour différé à l’état d’équilibre d’origine.
L’ORA® est un tonomètre à air non-contact, fixe, connecté à un ordinateur qui permet d’évaluer l’hystérèse de la cornée. À partir de deux forces d’aplanation cornéennes successives, l’appareil donne notamment une mesure de la PIO assimilée à la PIO mesurée en tonométrie de Goldmann ainsi qu’une PIO corrigée (PIOcc) qui est moins dépendante des facteurs biomécaniques cornéens et de l’ECC centrale que la PIO Goldmann [31]. L’ORA® délivre à l’apex de la cornée un jet d’air dont la pression augmente progressivement jusqu’à obtention de l’aplanissement de la cornée puis diminue à nouveau. Une fois aligné sur le sommet de la cornée, l’appareil délivre un jet d’air de 25 ms qui aplanit la cornée, la faisant passer très rapidement d’un état convexe à un état concave, avec un court rebond.
L’originalité de L’ORA® réside dans sa capacité à effectuer, lors du même examen, deux mesures consécutives d’aplanation : la première (P1) lors de l’aplanation cornéenne initiale consécutive à l’augmentation de pression, la seconde (P2) au moment où la cornée, après « indentation » par le jet d’air, reprend sa forme initiale (fig. 9-7 et 9-8).
L’appareil donne notamment une mesure de la PIO brute, non compensée, qui est la moyenne arithmétique des valeurs de pression P1 et P2. Cette pression non compensée est assimilée à la PIO mesurée par le tonomètre de Goldmann. Durant la procédure, la cornée absorbe partiellement l’énergie délivrée par le jet d’air et la pression P2 est logiquement moins élevée que la pression P1. L’hystérèse cornéenne est égale à la différence entre P1 et P2 (P1 – P2). La valeur de l’hystérèse est proportionnelle au degré de viscosité de la cornée, et inversement proportionnelle à son degré d’élasticité. L’ORA® donne aussi une estimation du facteur de résistance cornéenne, qui correspond à l’équation : P1 – k·P2. La valeur de k est déterminée par le logiciel de l’ORA® selon des modèles statistiques de corrélation pour évaluer empiriquement le facteur de rigidité de la cornée. Enfin, l’appareil calcule une pression oculaire compensée pour les propriétés viscoélastiques de la cornée (PIOcc) en proposant une combinaison linéaire entre les valeurs de P1 et P2. La PIOcc ne serait pas dépendante de l’ECC.
L’hystérèse cornéenne est diminuée dans le GPAO, en particulier dans le glaucome à pression normale [18]. Fait intéressant, le coefficient de résistance cornéenne est mieux corrélé avec la PIO que la seule pachymétrie cornéenne, indiquant que la viscoélasticité de l’œil influence plus directement la valeur de la pression. Une diminution de l’hystérèse cornéenne a également été objectivée dans la maladie de Marfan, dans la dystrophie myotonique de Steinert ou durant la grossesse. Plusieurs travaux ont aussi établi un lien entre une hystérèse cornéenne diminuée et les propriétés de déformabilité de la lame criblée (recul de la lame criblée plus important en réponse à une augmentation graduée de la PIO [38]), suggérant un processus plus global de défaillance des propriétés viscoélastiques de l’œil en cas de glaucome [11]. La normalisation chirurgicale de la PIO est susceptible de rétablir l’hystérèse cornéenne et donc la résistance de la cornée [32]. La prise en compte de la biomécanique cornéenne dans la mesure de la PIO et dans l’évaluation du risque glaucomateux devient incontestablement une donnée intéressante et très utile au diagnostic d’HTO et de glaucome.
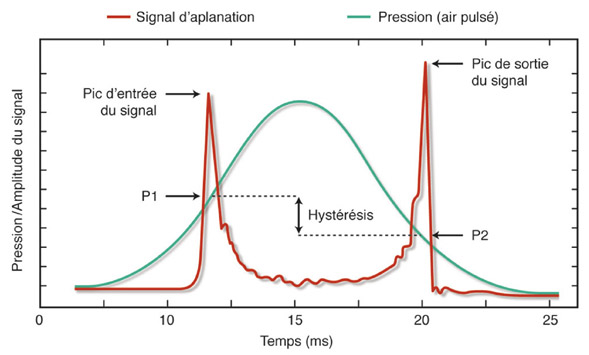
Fig. 9-7 Schéma du tracé de l’ORA®.
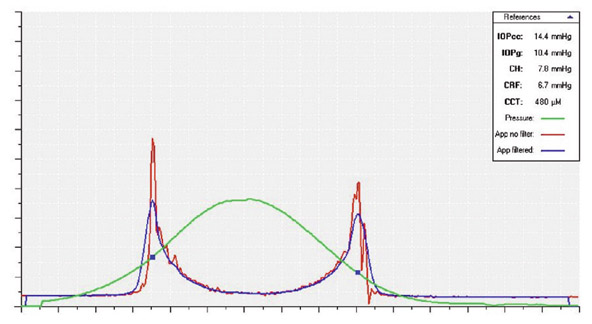
Fig. 9-8 Tracé obtenu avec l’ORA®. Le résultat donne un signal normal. La courbe rouge correspond à l’intensité du signal réfléchi par la cornée. La courbe verte correspond à la pression de l’air au contact de la cornée. Le premier pic, P1, d’intensité infrarouge (signal rouge) est rapide et d’intensité plus forte que le second pic, P2, atténué par la viscoélasticité cornéenne. La fenêtre en haut à droite récapitule les indices quantitatifs [pression brute, PIO compensée, hystérèse cornéenne (CH), facteur de résistance cornéenne (CRF), pachymétrie].
La tonométrie dynamique de contour de Pascal™ pourrait également donner des mesures de PIO plus proches de la réalité, en prenant en compte les paramètres biomécaniques de la cornée (fig. 9-9 et 9-10). Ce tonomètre ne fonctionne pas selon le principe d’aplanation puisqu’il se moule à la surface de la cornée sans la déformer, ce qui fait que cela minimise les éventuelles distorsions biomécaniques liées à la cornée. La surface de contact est suffisamment large (7 mm de diamètre) pour déformer au minimum la cornée. Un capteur piézoélectrique central, placé dans un cône identique à celui du Goldmann, mesure la PIO cent fois par seconde. Le cycle complet de mesures dure huit secondes. L’appareil mesure également l’amplitude du pouls oculaire pendant le temps de contact du tonomètre avec la cornée. L’acquisition des mesures est assez longue [1] et nécessite une bonne coopération du patient. Les mesures sont difficilement obtenues en cas de cornée pathologique (kératocône, cicatrices cornéennes, etc.) [27]. Malgré ces difficultés techniques, la reproductibilité des mesures avec le temps est satisfaisante [15].
Les valeurs de pression seraient moins dépendantes de l’ECC qu’avec le tonomètre de Goldmann, avec une surestimation des PIO par rapport au Goldmann de l’ordre de 1,7 mmHg [17]. Les écarts ne sont pas constants, avec une surestimation plus marquée quand les PIO sont basses, et inversement. La PIO peut être même sous-estimée en cas de valeurs extrêmes [40]. L’écart entre les deux tonomètres ne dépendrait pas de l’ECC [29] ou de sa courbure, sauf lorsque les valeurs sont extrêmes [24]. La mesure de la PIO au Pascal minimise mais ne s’affranchit pas complètement du facteur cornéen [20], comme on aurait initialement pu le penser [28]. La corrélation du tonomètre de Pascal avec l’ORA® semble insuffisante [14], même si les études comparatives sont peu nombreuses.
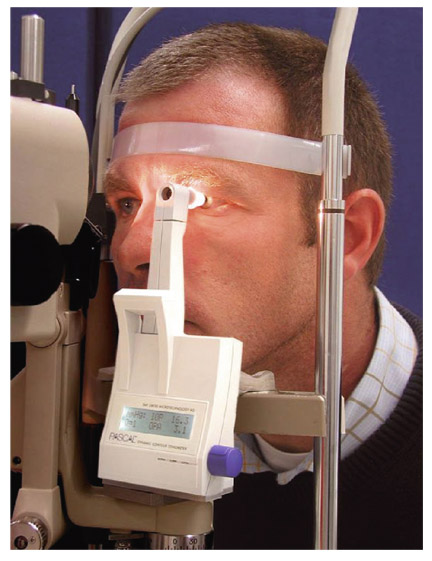
Fig. 9-9 Tonomètre dynamique de contour de Pascal™.

Fig. 9-10 Écran du tonomètre dynamique de contour de Pascal™ donnant la valeur de la PIO ainsi que l’amplitude du pouls oculaire.
Les méthodes actuelles de mesure de la PIO, qu’elles reposent sur les principes d’aplanation, d’indentation ou sans contact, ne permettent que des mesures ponctuelles et statiques. À l’échelle de la vie, une mesure isolée de la PIO est probablement très insuffisante pour caractériser ce paramètre physiologique éminemment variable. À ce jour, des études des fluctuations de la PIO sont parfois réalisées lors de courbes pressionnelles diurnes – mesures à intervalles réguliers de la PIO pendant une journée – ou nycthémérales, dans des laboratoires spécialisés, en respectant les différents temps d’orthostatisme et de décubitus grâce à l’utilisation de tonomètres fixes ou portables. Ces méthodes restent cependant imparfaites pour de nombreuses raisons. Les mesures, mêmes répétées, sont très ponctuelles, ne permettant pas d’évaluer les fluctuations à très court terme de la PIO. Ces conditions justifient le développement de plusieurs systèmes extra- ou intra-oculaires capables de mesurer la PIO. Ces systèmes télémétriques, actuellement en développement, expérimentation ou déjà en utilisation clinique, offrent des perspectives intéressantes pour l’évaluation des fluctuations pressionnelles et l’ajustement chronobiologique des thérapeutiques médicales (choix, horaires d’instillation).
Plusieurs laboratoires et industriels travaillent à l’élaboration de dispositifs placés à la surface de l’œil et permettant par télémétrie l’enregistrement des fluctuations de la PIO sur des durées pouvant dépasser 24 heures.
Ces méthodes de mesure sont fondées sur l’hypothèse qu’il existe une corrélation entre la PIO et la courbure de la cornée. Une variation de la PIO de 1 mmHg produit un changement du rayon de courbure de la cornée centrale d’environ 3 μm. La lentille Sensimed Triggerfish®, intégrant une jauge de contrainte dans une lentille de silicone, développée par des chercheurs de l’école polytechnique de Lausanne et distribuée maintenant par la société Sensimed (Lausanne, Suisse ; distribution par Horus Pharma, Saint-Laurent-du-Var, France), est le premier de ces dispositifs à avoir obtenu un marquage CE et à faire l’objet d’essais cliniques multiples [21, 22]. Le principe des jauges de contrainte ou de déformation (« strain gauge ») est de traduire la déformation d’une pièce métallique en variation de résistance électrique (plus les jauges s’étirent, plus leurs résistances augmentent). Elles consistent en des spires rapprochées et sont généralement fabriquées à partir d’une mince feuille métallique entourée d’un isolant électrique. La jauge de contrainte de la lentille Sensimed Triggerfish® est constituée par une couche de platine et de titane de 7 μm d’épaisseur et de 11,5 μm de diamètre, incluse dans une lentille en silicone d’une épaisseur de 600 μm au centre et de 200 μm en périphérie. Trois géométries de lentilles sont disponibles et adaptées à la courbure cornéenne (rayon de courbure de 8,4, 8,7 ou 9 mm). Le signal est envoyé par télémétrie vers une antenne qui est collée sur la peau, autour de l’œil, puis recueilli et traité par un boîtier porté par le patient pendant la session de mesure (voir fig. 9-19).
Le signal est enregistré toutes les 5 minutes pendant une durée de 30 secondes, avec un rythme de dix mesures par seconde. Les données collectées à la fin d’une session de mesure sont donc constituées de 10 mesures/s × 30 secondes × 12/h × 24 heures = 86 400 mesures. Il est à noter que le signal recueilli est un signal électrique, exprimé en millivolts, mais pas une pression exprimée en mmHg. Cela indique que la lentille ne permet qu’une estimation relative et indirecte d’un signal électrique, mais pas une mesure réelle et exacte de la PIO, exprimée en mmHg. À la fin de la session, le boîtier est connecté à un ordinateur, permettant d’exporter l’ensemble des données qui sont ensuite traitées par un logiciel développé par le fabricant. Une présentation synthétique des fluctuations nycthémérales du signal est fournie, avec la possibilité de visualiser les résultats en détail.
L’intérêt et les résultats de la méthode sont décrits dans le chapitre suivant.
Des équipes ont travaillé au développement de capteurs de pression destinés à être implantés temporairement ou définitivement. Différents dispositifs de géométries et de principes variés ont été imaginés et conçus, tels que des capteurs implantés entièrement, dans la paroi de l’œil, dans l’espace suprachoroïdien et même à l’intérieur de l’œil (matériau piézoélectrique associé à une lentille destinée à être placée dans le sac capsulaire), des drains ou tubes destinés à mettre en communication les espaces intra-oculaires et sous-conjonctivaux tout en permettant une mesure de la PIO, ou encore des capteurs destinés à être suturés au contact de la sclère, indentant celle-ci et permettant ainsi une mesure de principe très similaire à la tonométrie par indentation, mais continue et permanente. Tous ces dispositifs ont été validés ex vivo sur des yeux canulés ou in vivo dans des études animales [34, 37], mais pas chez l’homme, et ne sont donc pas à ce jour utilisés en pratique clinique courante.
Retenir
-
Les mesures faites par tonométrie à aplanation sont directement influencées par les paramètres anatomiques et biomécaniques de la cornée, en premier lieu l’ECC.
-
Les tonomètres non-contact à air pulsé fonctionnent selon le même principe d’aplanation mais ne nécessitent pas d’anesthésie cornéenne préalable. En cas de discordance, les mesures de PIO doivent être vérifiées par le tonomètre de Goldmann.
-
L’ORA® est enfin proposé pour la mesure de la PIO car il permet une estimation non invasive de l’hystérèse cornéenne, ce qui augmente la précision de la mesure de la PIO, en la rendant plus indépendante de l’ECC. Les mesures télémétriques de la PIO pourraient permettre l’enregistrement des fluctuations de la PIO sur des périodes longues, supérieures à 24 heures.
[1] Anderson MF, Agius-Fernandez A, Kaye SB. Comparison of the utility of Pascal dynamic contour tonometry with Goldmann applanation tonometry in routine clinical practice. J Glaucoma. 2013 ; 22 : 422-6.
[2] Argus WA. Ocular hypertension and central corneal thickness. Ophthalmology. 1995 ; 102 : 1810-2.
[3] Armaly MF, Rubin ML. Accommodation and applanation tonometry. Arch Ophthalmol. 1961 ; 65 : 415-23.
[4] Bafa M, Lambrinakis I, Dayan M, Birch M. Clinical comparison of the measurement of the IOP with the ocular blood flow tonometer, the Tonopen XL and the Goldmann applanation tonometer. Acta Ophthalmol Scand. 2001 ; 79 : 15-8.
[5] Baskett JS, Goen TM, Terry JE. A comparison of Perkins and Goldmann applanation tonometry. J Am Optom Assoc. 1986 ; 57 : 832-4.
[6] Brandt JD, Beiser JA, Kass MA, Gordon MO. Central corneal thickness in the ocular hypertension treatment study (OHTS). Ophthalmology. 2001 ; 108 : 1779-88.
[7] Brusini P, Salvetat ML, Zeppieri M, et al. Comparison of Icare tonometer with Goldmann applanation tonometer in glaucoma patients. J Glaucoma. 2006 ; 15 : 213-7.
[8] Denis P, Nordmann JP, Bertin V, et al. Evaluation of the Tono-Pen 2 and the X-Pert noncontact tonometers in cataract surgery. Ophthalmologica. 1993 ; 207 : 155-61.
[9] Detry-Morel M, Jamart J, Detry MB, et al. Evaluation clinique du tonomètre dynamique Icare. J Fr Ophtalmol. 2006 ; 29 : 1119-27.
[10] Doughty MZ, Zaman ML. Human corneal thickness and its impact on intraocular pressure measures : a review and meta-analysis approach. Surv Ophthalmol. 2000 ; 44 : 367-408.
[11] Downs JC, Suh JK, Thomas KA, et al. Viscoelastic material properties of the peripapillary sclera in normal and early-glaucoma monkey eyes. Invest Ophthalmol Vis Sci. 2005 ; 46 : 540-6.
[12] Ehlers N, Bramsen T, Sperling S. Applanation tonometry and central corneal thickness. Acta Ophthalmol (Copenh). 1975 ; 53 : 34-43.
[13] Fernandes P, Díaz-Rey JA, Queirós A, et al. Comparison of the ICare rebound tonometer with the Goldmann tonometer in a normal population. Ophthalmic Physiol Opt. 2005 ; 25 : 436-40.
[14] Hager A, Loge K, Schroeder B, et al. Effect of central corneal thickness and corneal hysteresis on tonometry as measured by dynamic contour tonometry, ocular response analyzer, and Goldmann tonometry in glaucomatous eyes. J Glaucoma. 2008 ; 17 : 361-5.
[15] Herdener S, Pache M, Lautebach S, Funk J. Dynamic contour tonometry (DCT) versus Goldmann applanation tonometry (GAT) – a comparison of agreement and reproducibility. Graefes Arch Clin Exp Ophthalmol. 2007 ; 245 : 1027-30.
[16] Iester M, Mermoud A, Achache F, Roy S. New Tonopen XL : comparison with the Goldmann tonometer. Eye (Lond). 2001 ; 15 : 52-8.
[17] Kaufmann C, Bachmann LM, Thiel MA. Comparison of dynamic contour tonometry with Goldmann applanation tonometry. Invest Ophthalmol Vis Sci. 2004 ; 45 : 3118-21.
[18] Kaushik S, Pandav SS, Banger A, et al. Relationship between corneal biomechanical properties, central corneal thickness, and intraocular pressure across the spectrum of glaucoma. Am J Ophthalmol. 2012 ; 153 : 840-9.
[19] Krieglstein GK, Waller WK. Goldmann applanation versus hand-applanation and schiötz indentation tonometry. Graefes Arch Klin Exp Ophthalmol. 1975 ; 194 : 11-6.
[20] Lachkar Y. J’ai testé pour vous. Le tonomètre à contours. Analyse de la PIO par ‘Dynamic Contour Tonometry’. J Fr Ophtalmol. 2006 ; 29 : S32-5.
[21] Leonardi M, Leuenberger P, Bertrand D, et al. First steps toward noninvasive intraocular pressure monitoring with a sensing contact lens. Invest Ophthalmol Vis Sci. 2004 ; 45 : 3113-7.
[22] Mansouri K, Shaarawy T. Continuous intraocular pressure monitoring with a wireless ocular telemetry sensor : initial clinical experience in patients with open angle glaucoma. Br J Ophthalmol. 2011 ; 95 : 627-9.
[23] McLeod SD, West SK, Quigley HA, Fozard JL. A longitudinal study of the relationship between intraocular and blood pressures. Invest Ophthalmol Vis Sci. 1990 ; 31 : 2361-6.
[24] Milla E, Duch S, Buchacra O, Masuet C. Poor agreement between Goldmann and Pascal tonometry in eyes with extreme pachymetry. Eye (Lond). 2009 ; 23 : 536-42.
[25] Patel S, Illahi W. Non-contact tonometry over soft contact lenses : effect of contact lens power on the measurement of intra-ocular pressure. Cont Lens Anterior Eye. 2004 ; 27 : 33-7.
[26] Rosentreter A, Jablonski KS, Mellein AC, et al. A new rebound tonometer for home monitoring of intraocular pressure. Graefes Arch Clin Exp Ophthalmol. 2011 ; 249 : 1713-9.
[27] Rosentreter A, Athanasopoulos A, Schild AM, et al. Rebound, applanation, and dynamic contour tonometry in pathologic corneas. Cornea. 2013 ; 32 : 313-8.
[28] Salvetat ML, Zeppieri M, Tosoni C, Brusini P. Comparisons between Pascal dynamic contour tonometry, the TonoPen, and Goldmann applanation tonometry in patients with glaucoma. Acta Ophthalmol Scand. 2007 ; 85 : 272-9.
[29] Schneider E, Grehn F. Intraocular pressure measurement-comparison of dynamic contour tonometry and goldmann applanation tonometry. J Glaucoma. 2006 ; 15 : 2-6.
[30] Stabuc Silih M, Hawlina M. Influence of corneal thickness on comparative intraocular pressure measurements with Goldmann and non-contact tonometers in keratoconus. Klin Monbl Augenheilkd. 2003 ; 220 : 843-7.
[31] Streho M, Dariel R, Giraud JM, et al. Évaluation des facteurs biomécaniques cornéens mesurés à l’Ocular Response Analyzer dans l’hypertension intraoculaire, le GPAO et chez le sujet normal. Étude prospective sur 329 yeux. J Fr Ophtalmol. 2008 ; 31 : 953-60.
[32] Sun L, Shen M, Wang J, et al. Recovery of corneal hysteresis after reduction of intraocular pressure in chronic primary angle-closure glaucoma. Am J Ophthalmol. 2009 ; 147 : 1061-6.
[33] Tonnu PA, Ho T, Newson T, et al. The influence of central corneal thickness and age on intraocular pressure measured by pneumotonometry, non-contact tonometry, the Tono-Pen XL, and Goldmann applanation tonometry. Br J Ophthalmol. 2005 ; 89 : 851-4.
[34] Todani A, Behlau I, Fava MA, et al. Intraocular pressure measurement by radio wave telemetry. Invest Ophthalmol Vis Sci. 2011 ; 52 : 9573-80.
[35] Vandewalle E, Vandenbroeck S, Stalmans I, Zeyen T. Comparison of ICare, dynamic contour tonometer, and ocular response analyzer with Goldmann applanation tonometer in patients with glaucoma. Eur J Ophthalmol. 2009 ; 19 : 783-9.
[36] Vernon SA. Non-contact tonometry in the postoperative eye. Br J Ophthalmol. 1989 ; 73 : 247-9.
[37] Walter P, Schnakenberg U, vom Bögel G, et al. Development of a completely encapsulated intraocular pressure sensor. Ophthalmic Res. 2000 ; 32 : 278-84.
[38] Wells AP, Garway-Heath DF, Poostchi A, et al. Corneal hysteresis but not corneal thickness correlates with optic nerve surface compliance in glaucoma patients. Invest Ophthalmol Vis Sci. 2008 ; 49 : 3262-8.
[39] Yamashita T, Miki A, Ieki Y, et al. Central and peripheral intraocular pressure measured by a rebound tonometer. Clin Ophthalmol. 2011 ; 5 : 1113-8.
[40] Yoo C, Eom YS, Kim YY. Goldmann applanation tonometry and dynamic contour tonometry in eyes with elevated intraocular pressure (IOP) : comparison in the same eyes after subsequent medical normalization of IOP. Graefes Arch Clin Exp Ophthalmol. 2010 ; 248 : 1611-6.
J.-P. Romanet, C. Noël, F. Aptel
-
La genèse de la pression intra-oculaire (PIO) ainsi que ses valeurs normales et pathologiques doivent être bien connues.
-
Ses fluctuations et les nombreux facteurs de variation à court et plus long termes doivent être présents à l’esprit du clinicien.
-
Le rythme nycthéméral de la PIO est mieux précisé dans le GPAO.
-
Si les techniques de mesure de la PIO ont beaucoup progressé avec l’avènement proche d’un enregistrement continu, la réalisation d’une courbe diurne de PIO présente encore de nombreuses indications en pratique clinique courante.
Une pression est une force qui se répartit uniformément sur une surface. L’œil est un espace clos par une paroi, équivalente à une surface. Une pression à l’intérieur de l’œil, la PIO, s’exerce sur cette paroi et, étant supérieure à la pression atmosphérique, garantit l’absence de collapsus du globe oculaire. La PIO résulte de l’équilibre entre le contenu du globe (humeur aqueuse, cristallin, vitré, uvée) et son contenant, la coque cornéosclérale, dont la distension est très limitée. La genèse de la PIO dépend en grande partie de la sécrétion et de l’élimination de l’humeur aqueuse, mais d’autres facteurs interviennent également.
Les modifications de volume ou de texture du cristallin peuvent avoir une influence sur la PIO. L’augmentation du volume cristallinien avec l’âge (particulièrement sur une chambre antérieure étroite), son intumescence ou la libération de matériel protéique d’origine cristallinienne sont autant de circonstances physiologiques ou physiopathologiques susceptibles d’induire une élévation parfois très sévère de la PIO.
Le vitré qui représente les deux tiers du volume du globe, du fait de sa forte teneur en eau, peut être soumis à des variations volumétriques en fonction de son niveau d’hydratation. Ces variations volumétriques, contraintes par la rigidité de la paroi oculaire, ont ainsi une répercussion sur la PIO.
L’uvée est l’élément de transmission directe des modifications vasculaires intra-oculaires sur la PIO. Une augmentation brutale du volume sanguin uvéal entraîne une élévation importante et immédiate de la PIO.
La coque cornéosclérale est composée de fibres de collagène et de fibres élastiques dont la capacité de distension est très faible chez l’adulte contrairement à l’enfant. Une augmentation éventuelle de volume du contenu intra-oculaire se trouve immédiatement limitée par la résistance pariétale ou rigidité sclérale, et se traduit par une élévation pressionnelle intra-oculaire. Cette rigidité sclérale varie avec l’âge et avec le statut réfractif du sujet.
Parmi les différents éléments du contenu oculaire, l’humeur aqueuse est le facteur déterminant essentiel de la PIO. Cette dernière est, en effet, tributaire des variations de l’équilibre entre sa production et son élimination, ce qui peut être résumé par l’équation révisée de Goldmann :
Po = (F – U) / C + Pv
où Po est la PIO en millimètres de mercure (mmHg), F la production d’humeur aqueuse en microlitres par minute (mL/min), U la résorption de l’humeur aqueuse par la voie uvéosclérale (en mL/min), C l’écoulement de l’humeur aqueuse par voie trabéculaire en microlitres par minute par millimètres de mercure (mL/min/mmHg) et Pv la pression veineuse épisclérale en millimètres de mercure (mmHg).
Trois éléments sont donc à l’origine de la PIO : la production d’humeur aqueuse par le corps ciliaire, son élimination, notamment par la voie trabéculaire, et la pression veineuse épisclérale. C’est généralement du fait d’une résistance à l’écoulement de l’humeur aqueuse par voie trabéculaire que se produit une élévation de la PIO.
Pour ce qui concerne la sécrétion de l’humeur aqueuse, son débit diurne, mesuré par fluorophotométrie est de l’ordre de 2,75 ± 0,63 µL/min [5]. Son renouvellement complet s’effectue en un peu moins de deux heures. La sécrétion de l’humeur aqueuse est soumise à une variation nycthémérale avec un flux maximal le matin, une baisse dans l’après-midi, sa production n’étant plus que de 50 % pendant le sommeil. Il faut noter que cette baisse de production n’est pas observée chez le sujet privé de sommeil pendant la nuit [38]. Elle est en revanche conservée chez le sujet exposé à une lumière vive à condition qu’il reste en état de sommeil [5]. Cette constatation permet d’éliminer un éventuel rôle de la mélatonine dans cette variation nycthémérale qui serait plutôt à mettre sur le compte des catécholamines, dont la courbe de sécrétion sur 24 heures est superposable à celle de l’humeur aqueuse.
L’élimination de l’humeur aqueuse s’effectue pour 80 à 90 % par la voie trabéculo-canaliculaire constituée par le trabéculum, le canal de Schlemm et ses vaisseaux efférents. Cette voie d’élimination est dépendante du niveau de PIO et on estime le flux d’humeur aqueuse par cette voie de 0,22 à 0,30 μL/min/mmHg. D’autres facteurs peuvent influencer ce type d’élimination, dont la pression veineuse épisclérale. C’est par l’effet « pression veineuse épisclérale » que la position déclive ou orthostatique a une répercussion sur la résistance à l’écoulement de l’humeur aqueuse. La voie uvéosclérale représente 10 à 15 % de l’élimination de l’humeur aqueuse. Elle est un peu plus importante chez les sujets jeunes aux yeux sains. Le flux uvéoscléral est indépendant de la pression, augmente lors de la relaxation du muscle ciliaire et diminue lors de sa contraction. D’une façon générale, les variations d’élimination par cette voie sont faibles.
Les différents facteurs, neuromédiateurs ou système nerveux autonome par exemple, qui interviennent sur les voies d’élimination de l’humeur aqueuse et qui répondent à des variations nycthémérales, influencent dans ce sens l’élimination de celle-ci, sans que l’on puisse néanmoins parler de véritable rythme (voir chapitre 7).
Dès 1958, une étude de Leydhecker et al. [27] auprès de 10 000 sujets sains avait déjà permis de mettre en évidence une courbe de distribution d’allure grossièrement gaussienne de la PIO au sein de la population. Les données des grandes études épidémiologiques ont précisé cette répartition en montrant notamment la sur-représentation des pressions élevées, principalement chez les individus de plus de 40 ans [12] (fig. 9-11). Elles ont situé la PIO moyenne entre 15 et 16 mmHg avec une déviation standard (ou écart type) de 2,5 mmHg. Une PIO statistiquement normale est égale à la PIO moyenne ± 2 déviations standard et est donc comprise entre 9 et 21 mmHg.
Pendant longtemps, la valeur de 21 mmHg a séparé les valeurs normales de PIO des valeurs pathologiques, et ainsi permettait de sélectionner les patients qui relevaient d’un traitement hypotenseur oculaire. Actuellement, un consensus général admet qu’il n’y a pas de valeur seuil en dessous de laquelle la PIO est normale ou sans danger, et au-dessus de laquelle la PIO est pathologique ou dangereuse. Une PIO élevée est cependant toujours considérée comme un facteur de risque majeur de développement d’une neuropathie optique glaucomateuse et comme le seul facteur sur lequel la thérapeutique a vraiment prise.
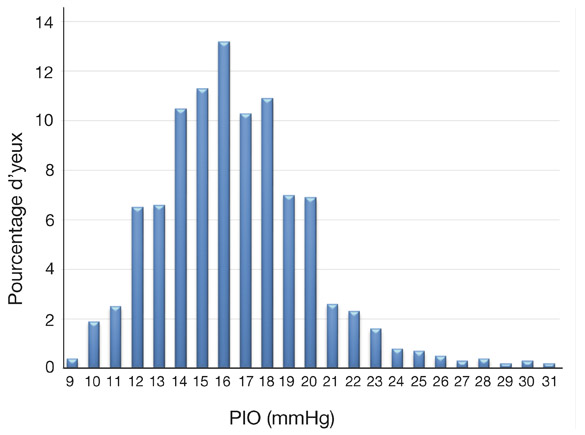
Fig. 9-11 Distribution de la PIO dans une population de 5 220 yeux de sujets sains (Framingham Eye Study).
À côté de la définition statistique de la PIO normale, on doit donc proposer une définition plus clinique qui, pour un individu donné, est la valeur en deçà de laquelle l’individu ne développe pas de pathologie glaucomateuse.
On sait en effet qu’une majorité d’hypertonies oculaires n’évolueront jamais vers un glaucome [24]. À l’inverse, certains individus développeront un glaucome malgré des valeurs de PIO statistiquement normales.
C’est donc surtout l’apparition des premières altérations structurelles de type glaucomateux qui fera considérer le niveau de PIO comme pathologique, niveau qui, en quelque sorte, est propre à chaque individu, même si les valeurs de PIO supérieures à 21 mmHg, corrigées en fonction de la pachymétrie cornéenne, doivent rester un élément d’alerte.
Seules des techniques invasives comme la mise en place de capteurs pressionnels à l’intérieur de l’œil, lors d’études expérimentales chez l’animal, permettent de mesurer précisément et avec fiabilité la PIO.
En pratique clinique, les mesures de la PIO ont fait et font appel à différentes techniques. Les techniques d’indentation (tonomètre de Schiøtz) ont été les premières, mais ce sont surtout les techniques d’aplanation, découvertes par Goldmann et fondées sur la loi d’Imbert-Fick, qui ont été une avancée très notable. Le tonomètre à aplanation de Goldmann reste encore actuellement le tonomètre de référence, même si la tonométrie à air, non contact, a vu un développement considérable au cours de ces dernières années. L’utilisation simple et l’absence de contact cornéen ont contribué à son essor rapide. Certaines causes d’erreur restent néanmoins les mêmes qu’avec la tonométrie à aplanation avec, en outre, une surestimation des valeurs élevées.
Plus récemment, de nouvelles techniques ont été mises au point, permettant d’éliminer un certain nombre de biais liés aux techniques traditionnelles. L’Ocular Response Analyser (ORA®), le tonomètre à contour dynamique (DCT) de Pascal, la tonométrie par impact ou tonométrie par rebond (tonomètre Icare®) en font partie (voir le début de ce chapitre).
La mesure de l’épaisseur cornéenne centrale (ECC) est essentielle dans l’interprétation des valeurs de PIO. La valeur moyenne de l’ECC est comprise entre 530 et 560 µm. Elle est peu variable dans le temps. Une ECC supérieure à 560 µm est un facteur de surestimation de la PIO. Une valeur anormalement élevée de l’ECC peut parfois permettre de reclasser une hypertonie oculaire en PIO statistiquement normale [15].
Hormis le blépharospasme, grand pourvoyeur d’erreur par excès de la PIO, une abondance de larmes ou de fluorescéine, un fort astigmatisme inverse ou un décentrement vertical du cône sont des facteurs de surestimation de la PIO.
Une hyperpression veineuse épisclérale (mauvais positionnement, cravate ou col de chemise trop serrés, glotte fermée du sujet pendant la mesure, etc.) donne également des erreurs par excès.
De la même manière qu’une cornée anormalement épaisse donne des valeurs surestimées de la PIO, les cornées minces, qu’on peut rencontrer plus fréquemment chez les mélanodermes, donnent des valeurs de PIO faussement basses. Des glaucomes étiquetés à pression normale sont parfois reclassés en authentiques glaucomes chroniques pressionnels.
L’œil sec, le manque de fluorescéine, l’illumination insuffisante du cône, le fort astigmatisme conforme, l’accommodation prolongée, les mesures répétées ou l’œdème du stroma cornéen sont des facteurs de sous-estimation de la PIO.
La plupart des études ont montré que la PIO moyenne était plus élevée chez les mélanodermes que chez les Caucasiens et que la prévalence du glaucome y était trois à quatre fois plus importante. Par ailleurs, la survenue du glaucome chez les mélanodermes serait plus précoce, la maladie étant diagnostiquée à un stade déjà souvent évolué. Enfin, une évolution cécitante serait rencontrée quatre fois plus fréquemment chez les patients noirs que chez les patients caucasiens [44].
À l’opposé, la population asiatique aurait une PIO moyenne inférieure à celle des sujets caucasiens [47].
Le rôle de l’hérédité dans les variations innées de la PIO s’appuie essentiellement sur des études épidémiologiques et des travaux de génétique clinique et moléculaire concernant le glaucome primitif à angle ouvert (GPAO). À côté de la forte corrélation entre les antécédents familiaux et le GPAO décrit par de nombreux auteurs, l’identification de plusieurs gènes liés à la maladie glaucomateuse a montré que certains de ces gènes étaient associés au GPAO à pression élevée (GLC1C et GLC1D) et pouvaient être considérés comme des marqueurs de risque de développement d’un glaucome en cas de PIO élevée. D’autres, en revanche, ont été identifiés lors de GPN (GLC1B et GLC1E), montrant ainsi qu’ils étaient associés à des facteurs de risque de développement de la maladie glaucomateuse indépendants de la PIO [23, 45, 51] (voir chapitres 4 et 8).
Grâce aux nouvelles techniques de génétique moléculaire comme le séquençage haut débit, d’autres marqueurs de la maladie glaucomateuse seront probablement découverts et pourraient être une aide pour différencier les hypertonies oculaires isolées de celles évoluant vers un GPAO. Le rôle de l’hérédité, s’il est indéniable, ne doit pas faire ignorer les facteurs environnementaux. Ils ont été argumentés notamment lors d’études sur les jumeaux monozygotes dont un des deux au moins était porteur de glaucome à angle ouvert. Le taux de constatation de la maladie chez les deux jumeaux d’une même paire a été trouvé beaucoup moins important que celui attendu si les facteurs génétiques dans la genèse de la maladie étaient seuls en cause [46].
Il ne semble pas exister de différence significative de la PIO moyenne en fonction du sexe. Les variations notées seraient à mettre sur le compte des variations hormonales lors des épisodes de la vie génitale de la femme – cycle menstruel, grossesse, ménopause.
La PIO moyenne est classiquement plus élevée chez le myope que chez l’emmétrope ou l’hypermétrope. L’écart de la PIO moyenne entre un hypermétrope et un myope de – 5 dioptries a pu être évalué à 1,8 mmHg [14].
Il n’existe pas de consensus sur la relation entre PIO et âge. Un certain nombre d’études sont en faveur d’une élévation de la PIO avec l’âge qui serait liée à une augmentation de la résistance trabéculaire avec le temps [1, 12]. D’autres auteurs n’ont pas retrouvé pas de différence de PIO en fonction de l’âge dans les populations occidentales [2]. Shiose [42], dans une étude sur 200 000 sujets non glaucomateux au Japon, a constaté une diminution de la PIO avec l’âge. Il a estimé que l’augmentation de la PIO avec l’âge dans les populations occidentales serait liée à l’influence de certains facteurs comme l’obésité et l’hypertension artérielle.
Cette même étude japonaise a retrouvé une corrélation positive entre PIO et indice de masse corporelle [42].
Il existe un rythme circannuel de la PIO dans les pays tempérés. L’acrophase, période où la PIO est la plus haute, se situe en hiver, et la bathyphase, période où la PIO est la plus basse, en été, l’amplitude du rythme variant de 1 à 5 mmHg [3].
L’exposition à une température ambiante élevée chez un sujet non acclimaté entraîne une élévation de la PIO, l’effet disparaissant après acclimatation. Cet effet a été rapporté à une augmentation de la température corporelle. Shapiro et al. [41] ont montré qu’une augmentation de 0,6 °C de la température corporelle provoquait une élévation de la PIO de 2,5 mmHg.
L’effet immédiat d’un clignement palpébral spontané ou réflexe se traduit par une élévation immédiate de la PIO de 1 à 2 mmHg de courte durée avec retour à la PIO de départ à la fin du clignement. Une série de clignements (série de 15 clignements de 2 secondes chacun) induirait une baisse de PIO pouvant atteindre 2 mmHg par effet de massage [19].
Gloster et Poinoosawmy [17] ont montré qu’une mydriase obtenue par confinement en chambre noire pendant une heure induisait une élévation de la PIO de 4 mmHg, le retour à la PIO de départ s’effectuant en 10 minutes.
Elle a une action hypotonisante. Une accommodation de quatre dioptries soutenue pendant 3,5 minutes entraînerait une diminution de la PIO de 2 mmHg [31].
Les regards latéraux forcés provoquent une élévation brutale et fugace de la PIO avec retour immédiat à la PIO de base [13]. Ce phénomène peut être exacerbé dans certaines conditions pathologiques comme l’orbitopathie basedowienne.
La PIO varie de façon synchrone avec le pouls et augmente de 1 à 2 mmHg lors de la systole responsable d’un afflux sanguin intra-oculaire. Ces variations ont pu être étudiées expérimentalement chez l’animal [40] (fig. 9-12). Le même type de variation peut être mis en évidence en pratique clinique avec le tonomètre de PascalTM à contour dynamique.
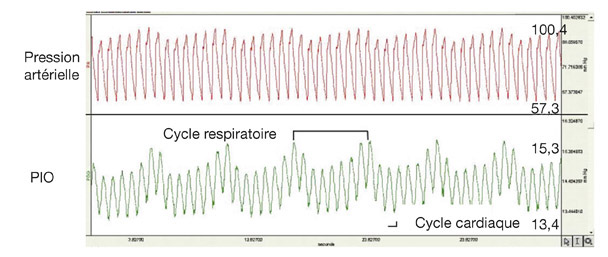
Fig. 9-12 Enregistrement simultané de la pression artérielle systémique et de la PIO par capteurs in situ chez le porc : variations rapides de la PIO en rapport avec le cycle cardiaque, variations plus lentes générées par le cycle respiratoire.
Une augmentation de la pression veineuse centrale (PVC) a une répercussion sur l’élimination de l’humeur aqueuse et sur le drainage du sang veineux hors de l’œil. Lorsque la PVC augmente de 1 mmHg, la PIO s’élève de 0,8 mmHg. La manœuvre de Valsalva, qui a une action directe sur la PVC, provoque ainsi une élévation de la PIO, tout comme les efforts de toux ou de défécation. La respiration, ayant aussi un effet sur la PVC, entraîne de ce fait des variations de la PIO répétitives et synchrones [13, 40] (voir fig. 9-12).
Nous n’aborderons que les variations instantanées de pression artérielle systémique, afin de rester dans le domaine physiologique. Chez l’homme, une étude, déjà ancienne, avait constaté qu’une élévation de 100 mmHg de la pression artérielle entraînait une élévation de 2 mmHg de la PIO, la corrélation étant trouvée plus spécifique avec la systole [8]. Cette corrélation a été confirmée lors de travaux expérimentaux ultérieurs, montrant une répercussion encore plus importante des variations rapides de la pression artérielle systémique sur la PIO [10, 25, 39, 40]. Une étude réalisée chez le porc en 2004 a montré qu’une augmentation de la pression artérielle moyenne de 20 mmHg entraînait une augmentation de 4 mmHg de la PIO, ce qui est très supérieur à l’augmentation communément admise chez l’homme [10, 40] (fig. 9-13). Ces résultats se sont avérés tout à fait compatibles avec les travaux de Kiel chez le lapin [25, 39].
Chez l’homme, l’effet sur la PIO de l’augmentation rapide de la pression artérielle systémique a été étudié récemment lors d’exercices isométriques, squatting ou handgripping [10]. Après deux minutes d’exercice, la PIO a augmenté en moyenne de 46,4 % (4,6 mmHg) lors d’exercices de squatting et 35,3 % (3,6 mmHg) lors d’exercices de handgripping, pour des augmentations de la pression artérielle moyenne de 53,2 % (44,5 mmHg) et 46,1 % (37,2 mmHg) respectivement. Ces travaux ont contribué à confirmer qu’il existait une très forte relation entre les variations à très court terme de la PA et de la PIO.
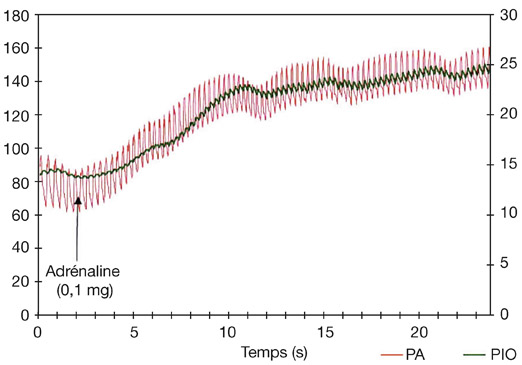
Fig. 9-13 Enregistrement simultané de la pression artérielle systémique et de la PIO par capteurs in situ chez le porc : répercussion instantanée sur la PIO de l’augmentation de la pression artérielle systémique déclenchée par injection intraveineuse d’adrénaline.
L’activité physique intense sur une durée très courte est responsable d’une augmentation de PIO immédiate par l’intermédiaire de l’élévation de la pression artérielle systémique.
Lors d’un effort physique suffisamment prolongé, l’effet sur la PIO s’avère bien différent puisqu’il entraîne une diminution de la PIO proportionnelle à l’intensité de l’effort physique [20, 36]. Des modifications métaboliques impliquant la production d’acide lactique, une augmentation de l’osmolarité sanguine et une diminution du pH pourraient expliquer ce phénomène.
Quant à l’entraînement physique, il a été montré qu’il diminuait la PIO moyenne de repos et minorait, de ce fait, la réponse hypotensive induite par l’effort soutenu [35].
Le passage de l’orthostatisme au décubitus provoque, de manière constante et immédiate, une élévation de la PIO variant de 1,50 à 5 mmHg selon les sujets [9, 11, 30]. Le maintien prolongé en position couchée atténue cette augmentation de PIO [11].
Le positionnement de la tête peut avoir également une influence modérée sur la PIO. En position assise, les valeurs ont été trouvées plus élevées lorsque la tête est en extension et encore plus en flexion, que lorsqu’elle est en position neutre habituelle [30].
L’étude des variations de la PIO selon la position de décubitus montre que, par rapport à des valeurs de PIO enregistrées au cours du décubitus dorsal, le passage en décubitus latéral gauche entraîne une élévation de PIO sur l’œil gauche et une diminution de PIO sur l’œil droit [30] (fig. 9-14).
Des expériences d’inversion corporelle ont mis en évidence une forte augmentation de PIO de 15 mmHg, rapidement réversible dès le retour à la position orthostatique [48].
Toutes ces constatations ont fait évoquer l’hypothèse d’une augmentation de la PIO secondaire à une augmentation du volume sanguin intra-oculaire [43].
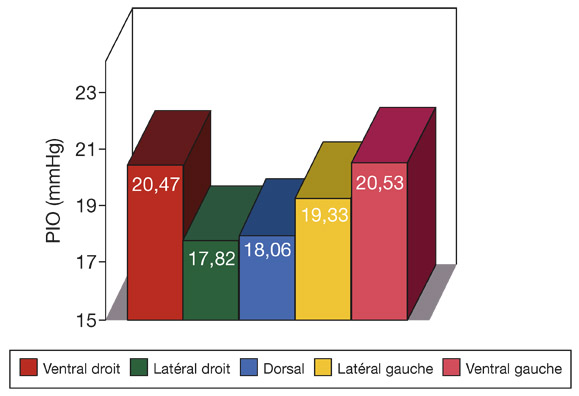
Fig. 9-14 Variations de la PIO en fonction de la position du corps lors du décubitus. La PIO est plus basse lors du décubitus dorsal que lors du décubitus ventral. La PIO de l’œil gauche est plus basse lors du décubitus latéral droit que lors du décubitus homolatéral gauche.
L’ingestion rapide, en moins de 5 minutes, d’une quantité d’eau proportionnelle au poids du sujet (10 mL/kg) est responsable d’une augmentation de la PIO constatée dans l’heure qui suit l’ingestion. L’augmentation moyenne maximale de la PIO est variable selon les auteurs, pouvant aller jusqu’à 4,4 mmHg [6, 18]. Le mécanisme en cause n’est pas totalement élucidé. Cette constatation physiologique est considérée par plusieurs auteurs comme un test utile dans l’évaluation du profil pressionnel d’un GPAO, mais aussi pour évaluer l’efficacité des traitements médicaux, physiques et chirurgicaux [18].
À l’inverse, les états de déshydratation vont induire une baisse de la PIO.
Pendant la grossesse, on constate un effet hypotenseur oculaire avec retour aux valeurs initiales de PIO au cours du post-partum après un délai de trois mois. La progestérone en serait responsable, agissant par diminution de la résistance à l’écoulement de l’humeur aqueuse [52]. La ménopause induirait, au contraire, une élévation pressionnelle.
L’administration de corticostéroïdes peut être responsable à long terme d’une élévation de la PIO par augmentation de la résistance à l’écoulement de l’humeur aqueuse, conséquence de leur action sur le niveau de polymérisation des glucosaminoglycanes du trabéculum. À court terme, l’augmentation de la PIO qu’ils entraînent serait probablement liée à des variations de la sécrétion aqueuse corticodépendante [49]. Il existe, par ailleurs, une relation entre sécrétion du cortisol et PIO. La cinétique des deux courbes nycthémérales, courbe de sécrétion de cortisol et courbe de PIO, est similaire, avec un décalage de phase d’environ trois heures [50]. Une importance particulière est donc à accorder aux glucocorticoïdes dans la régulation de la PIO.
L’alcool éthylique, le cannabis et ses dérivés, l’héroïne, certains agents anesthésiques (kétamine, gaz halogénés, relaxants musculaires dépolarisants) ont un effet hypotenseur au niveau de l’œil et seront à prendre en compte lors de l’examen de la PIO. À l’opposé, le café, consommé à doses importantes, entraînerait une élévation de la PIO qui pourrait atteindre jusqu’à 4 mmHg, avec un effet se prolongeant jusqu’à une heure et demie [6].
Un rythme biologique est dit circadien lorsque sa période est égale ou voisine de celle de la rotation de la terre, donc voisine de 24 heures. Les rythmes circadiens existent chez toutes les espèces. Ils assurent une régulation de nombreuses fonctions internes, permettant une adaptation aux cycles environnementaux. On parlera de rythme circadien pur en présence d’un rythme voisin de 24 heures, en l’absence de toute influence environnementale, influence de la lumière notamment, et de rythme nycthéméral lorsque le rythme s’exprime sur un cycle de 24 heures avec l’influence de l’alternance jour/nuit.
La notion d’horloge biologique interne, localisée dans l’hypothalamus des mammifères, génératrice des rythmes circadiens, date des années 1970. C’est à cette époque que l’œil a été identifié comme la principale entrée neurosensorielle permettant de synchroniser le système circadien. En effet, la rétine contient deux contingents neuronaux distincts : l’un permettant la perception visuelle, l’autre, appelé voie photique, assurant la synchronisation de l’horloge biologique et ainsi l’obtention de rythmes nycthéméraux.
Comme de nombreuses fonctions physiologiques (température, poids, fréquence cardiaque, pression artérielle), la PIO évolue selon un rythme nycthéméral. La chronobiologie est l’étude des rythmes de ces fonctions physiologiques. La chronobiologie de la PIO permet de mieux comprendre sa physiologie et, plus particulièrement, ses variations et la physiopathologie de certains états oculaires pathologiques. Elle apporte, en outre, les données nécessaires pour adapter ou modifier une prise en charge thérapeutique insuffisamment efficace, attitude thérapeutique correspondant à ce qui est appelé la chronothérapeutique.
Un rythme est caractérisé par plusieurs éléments (fig. 9-15). Sa période est l’espace de temps entre deux événements identiques. Son mésor est la moyenne arithmétique de toutes les valeurs instantanées obtenues au cours d’une période. L’amplitude est l’écart entre la valeur maximale de la donnée et sa valeur moyenne ou mésor. L’acrophase est le moment où la donnée est la plus haute (pic). La bathyphase est le moment où la donnée est la plus basse (creux). Une fonction physiologique présentant des variations répétitives ne pourra cependant être qualifiée de rythme biologique qu’après confirmation par des méthodes mathématiques d’analyse des rythmes biologiques (Cosinor, NOSA).

Fig. 9-15 Courbe nycthémérale de PIO chez un sujet sain : caractéristiques du rythme.
La notion de rythme concernant la PIO date du début du siècle dernier. Maslenikow a été le premier en 1904 à constater qu’il existait des variations de la PIO au cours de la journée. Duke-Elder a confirmé l’existence de ces variations diurnes et a décrit la présence d’un pic pressionnel matinal suivi d’une décroissance au cours de la journée. Drance a précisé que ces pics pouvaient survenir à tout moment de la journée. Toutefois, c’est Henkind et al. [21] qui ont présenté les premiers résultats de variations de la PIO sur la totalité du nycthémère, évoquant la notion de rythme. Kitazawa et Horie [26], aboutissant aux mêmes conclusions à partir d’études de la PIO par mesures horaires, a proposé l’hypothèse d’un rythme biologique propre à la PIO (fig. 9-16).
Au milieu des années 1990, une étude française a confirmé que les variations de la PIO suivaient un rythme nycthéméral chez le sujet sain, avec des valeurs élevées la nuit, acrophase vers 3 heures du matin pour les sujets jeunes et un peu plus tardive, vers 5 heures, pour les sujets plus âgés. Les valeurs de PIO étaient plus basses dans la journée, notamment en fin de journée [7]. Ces données ont été retrouvées, un peu plus tard, par l’équipe de Liu. Celle-ci a, par ailleurs, précisé que l’écart entre la valeur la plus haute et la valeur la plus basse était de 8,2 ± 1,4 mmHg si les sujets adoptaient une position corporelle différente la nuit, où ils étaient allongés, et le jour, où ils étaient debout ou assis. L’écart diminuait notablement si les sujets restaient continuellement allongés, n’étant plus que de 3,8 ± 0,9 mmHg, montrant ainsi que la position couchée intervenait dans l’élévation pressionnelle nocturne sans cependant faire disparaître l’effet nuit [28, 29]. Quant aux patients myopes, cette même équipe a montré que la PIO augmentait aussi pendant la nuit, mais de façon plus modérée que chez les sujets sains.
L’ensemble de ces études permet donc de retenir que la PIO chez les sujets sains varie selon un rythme nycthéméral avec une élévation nocturne de la PIO, l’acrophase étant située en seconde partie de nuit. L’amplitude moyenne des fluctuations sur 24 heures est variable selon les individus et comprise entre 3 et 8 mmHg en moyenne.
Peut-on aller jusqu’à dire que chaque individu possède une courbe de PIO totalement reproductible ? Une étude a évalué la reproductibilité de deux courbes de PIO réalisées à une semaine d’intervalle, mais uniquement sur la période diurne chez un même sujet sain. Des concordances ont été trouvées pour certaines valeurs obtenues sur les deux courbes à la même heure, sans néanmoins qu’on puisse parler de reproductibilité véritable des courbes [37]. Parmi les très rares travaux qui ont comparé des courbes réalisées pendant 24 heures plusieurs fois chez un même sujet sain, un travail récent a montré une assez bonne concordance des valeurs diurnes de la PIO et une bonne reproductibilité des pressions moyennes sur 24 heures pour un même individu [33]. Compte tenu des très nombreux facteurs qui peuvent influencer la PIO, une étude de la reproductibilité de ses variations nycthémérales ne peut se concevoir qu’en réalisant des courbes dans des conditions standardisées extrêmement strictes, ce qui ne peut se faire que dans des laboratoires spécialisés et nous éloigne de notre pratique clinique habituelle.
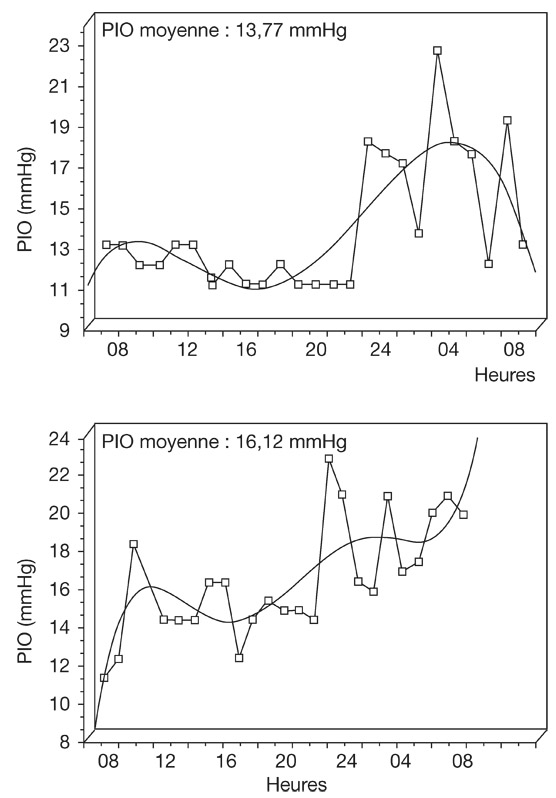
Fig. 9-16 Exemples de courbes nycthémérales établies à partir de mesures horaires de PIO chez deux sujets sains : bathyphase dans la journée, acrophase la nuit.
Frampton et al. [16] et Brown [4] ont été les premiers à étudier les relations entre sommeil et PIO. Ils ont mis en évidence une élévation de la PIO dès l’endormissement et ont constaté que l’augmentation se poursuivait durant la nuit. En revanche, chez les sujets maintenus en état d’éveil durant la nuit, Frampton a pu noter une diminution de la PIO avec bathyphase dans la seconde partie de nuit. Ces études ont toutes été menées en mesurant la PIO après lever du patient et sans enregistrement polysomnographique.
Des études ultérieures, faisant appel à des protocoles de mesures horaires de PIO sur 24 heures en respectant le décubitus des patients lors du sommeil, ont confirmé que la PIO variait en fonction des stades de sommeil chez les sujets sains jeunes et âgés, mais également chez les sujets glaucomateux (fig. 9-17). Les valeurs de PIO lors du sommeil lent profond ont été trouvées plus hautes que celles observées lors du sommeil lent léger, elles-mêmes plus hautes que celles du sommeil paradoxal (phase de mouvements oculaires rapides) et de l’éveil [7, 34] (fig. 9-18).
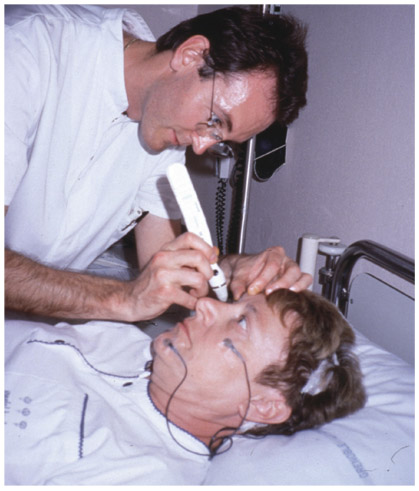
Fig. 9-17 Mesures discontinues (horaires) de PIO pendant 24 heures en utilisant le Tonopen® associées à un enregistrement polyhypnographique.
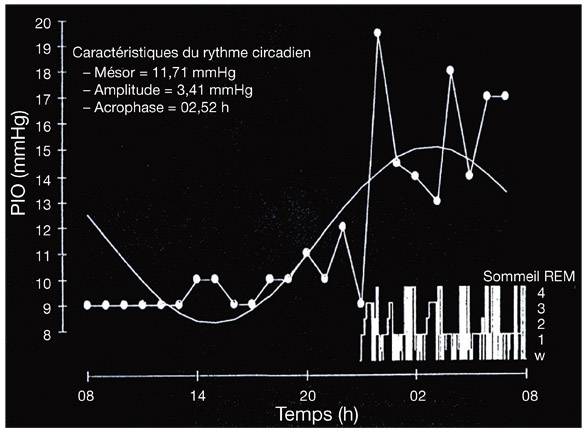
Fig. 9-18 Courbe nycthémérale établie à partir de mesures horaires de PIO chez un sujet sain avec enregistrement du sommeil (hypnogramme). Noter le pic pressionnel d’endormissement et les mesures élevées lors des phases de sommeil paradoxal (REM : rapid eye movements).
Les études qui se sont intéressées aux variations nycthémérales de la PIO ont toutes été réalisées à partir de mesures discontinues, au mieux mesures horaires, mais souvent mesures toutes les deux voire trois heures. Par ailleurs, dans un grand nombre d’entre elles, la PIO était mesurée la nuit après lever du patient.
Dans quelques études, des mesures horaires diurnes et nocturnes ont été enregistrées tout en permettant de maintenir le décubitus nocturne, grâce à différents tonomètres portables. L’enregistrement des mesures de PIO était généralement couplé à une polysomnographie qui évaluait la qualité du sommeil. Dans ces études où les mesures nocturnes étaient effectuées en respectant au mieux les conditions physiologiques, il a été constaté des réveils qui, même brefs, pouvaient avoir une influence sur les résultats pressionnels.
Seules des méthodes d’enregistrement continu de la PIO, dans un cadre ambulatoire, respectant strictement les états de sommeil, pourraient permettre d’explorer avec une plus grande fiabilité ces variations nycthémérales.
Jusqu’à ce jour, de nombreuses recherches ont tenté de présenter des procédés permettant l’enregistrement continu de la PIO. Aucun, cependant, n’a été capable d’explorer la PIO en continu en termes de mesures véritablement pressionnelles comme peuvent le donner les tonomètres de façon instantanée.
Récemment, des dispositifs, faisant appel à des jauges de contrainte placées sur une lentille cornéenne, laissés en place sur l’œil plusieurs heures, ont étudié les variations morphométriques de la cornée engendrées par les variations de la PIO. Le dispositif Sensimed Triggerfish® a été le premier dispositif commercialisé (fig. 9-19). Grâce à un système de transmission, il a pu donner des signaux (et non des valeurs pressionnelles) variant avec le temps et montrant une certaine cohérence avec les variations des mesures de PIO obtenues avec la tonométrie classique [22, 32] (fig. 9-20).
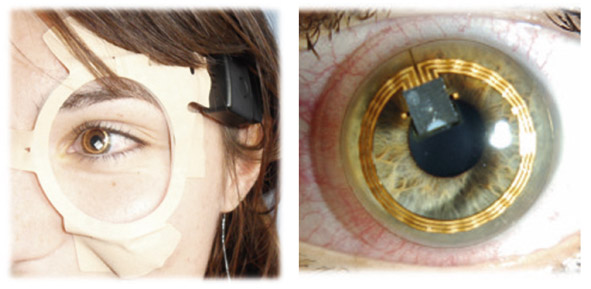
Fig. 9-19 Dispositif Sensimed Triggerfish® : lentille supportant les jauges de contrainte sensibles aux variations morphométriques de la cornée et système de transmission en place sur un sujet sain.
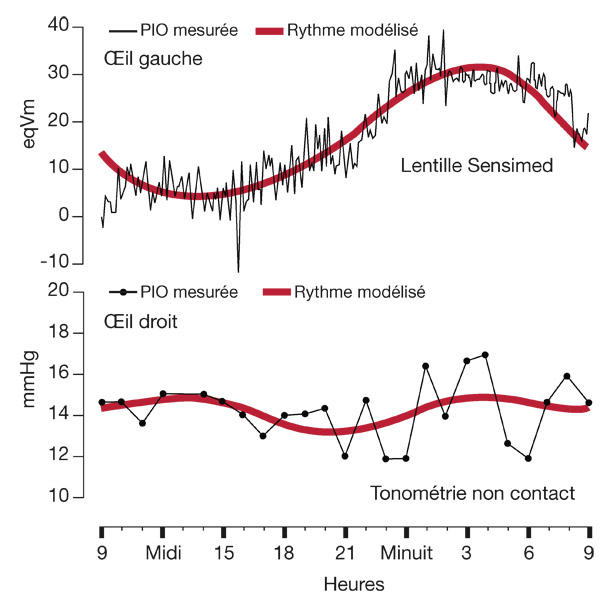
Fig. 9-20 Courbes nycthémérales simultanées du signal donné par le système Sensimed® obtenu au niveau de l’œil gauche et de la PIO mesurée au niveau de l’œil droit chez le même sujet sain.
Mesure unique de la PIO
Hormis le fait qu’elle doit toujours être associée à une pachymétrie cornéenne centrale, une mesure unique et isolée de la PIO constatant une pression inférieure à 21 mmHg est très souvent faussement rassurante. Quant à une PIO élevée découverte de façon fortuite sur une mesure unique et isolée, elle ne peut en aucun cas constituer un argument diagnostique de GPAO.
Courbe diurne
Ainsi, chez tout sujet présentant des facteurs de risque glaucomateux, une courbe diurne de PIO doit être pratiquée. Elle permettra de déterminer la PIO moyenne diurne, d’évaluer l’importance de ses variations au cours de la journée, de repérer les pics pressionnels et leurs moments de survenue. En présence d’une neuropathie glaucomateuse, elle précisera sa forme clinique, pressionnelle ou non, et la sévérité de l’hypertonie quand elle existe.
L’idéal serait de mesurer la PIO toutes les heures pendant la période diurne, de 8 heures à 20 heures. Dans la pratique clinique quotidienne, les courbes diurnes sont généralement obtenues à partir de mesures effectuées toutes les deux heures pendant les périodes classiquement ouvrables, soit de 9 heures à 18 voire 19 heures, fournissant ainsi six à sept valeurs (fig. 9-21). Ces courbes sont contributives car, en dehors du pic pressionnel qui survient juste après le réveil, c’est souvent dans la seconde partie de la période diurne que les valeurs pressionnelles sont les plus hautes chez le patient glaucomateux.
Quand les mesures ne peuvent être réalisées le même jour, chez des patients très contraints par leur activité professionnelle par exemple, on peut reconstruire une courbe diurne à partir de mesures isolées prises lors de consultations à des jours différents. Ces mesures devront alors avoir été effectuées à des heures différentes, permettant de couvrir toute la période diurne.
Qu’elle soit effectuée sur une journée ou reconstruite à partir de mesures étalées dans le temps à des heures différentes, cette courbe diurne de PIO sera le plus souvent suffisante dans le cadre du bilan initial et servira de courbe de référence.
Les rares indications des courbes de PIO sur 24 heures
La grande majorité des courbes réalisées chez les sujets glaucomateux montrent une acrophase diurne avec des PIO moyennes diurnes plus élevées que les pressions moyennes nocturnes. Le recours à une courbe de PIO sur 24 heures n’est donc habituellement pas utile et ne relève que d’indications très particulières.
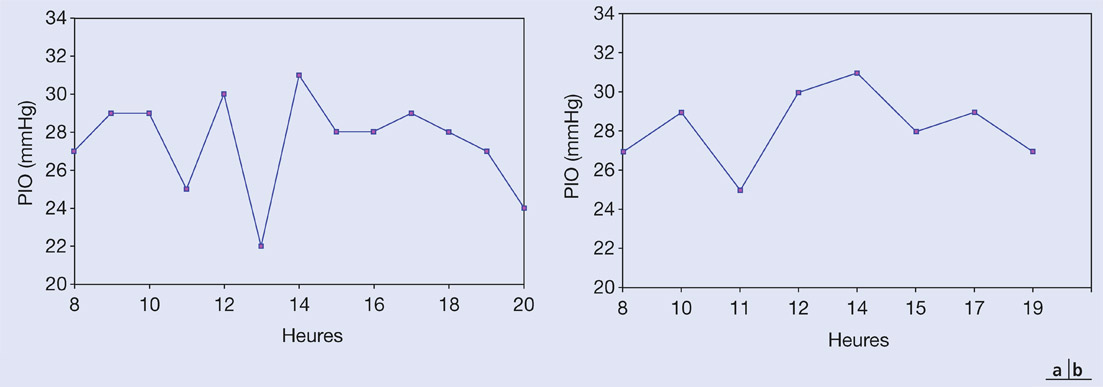
Fig. 9-21 a. Courbe diurne chez un patient glaucomateux établie à partir de mesures horaires de 8 heures à 20 heures, difficilement réalisable en clinique courante. b. Courbe diurne chez un patient glaucomateux établie à partir de huit mesures horaires de 8 heures à 19 heures, souvent suffisante et très recommandée dans le bilan initial.
Retenir
-
La pression intra-oculaire est une grandeur variable.
-
Comme beaucoup d’autres rythmes biologiques, elle présente des variations selon un rythme nycthéméral, sur une période de 24 heures, généré par notre horloge interne et influencé par de nombreux effets périphériques ou environnementaux, comme la lumière par exemple.
-
Son exploration selon un mode statique (prise unique) est très peu informative, voire trompeuse, et il faut savoir recourir à une courbe diurne de PIO en pratique clinique courante.
-
La PIO ne reste néanmoins qu’un des principaux facteurs de risque de la maladie glaucomateuse et, dans une démarche diagnostique, son exploration ne peut se concevoir sans examen des fonctions visuelles, des fibres nerveuses rétiniennes et de la papille optique.
[1] Armaly RF. Age and sex correction of applanation pressure. Arch Ophthalmol. 1967 ; 78 : 480-4.
[2] Bengtsson B. Some factors affecting the distribution of intraocular pressures in a population. Acta Ophthalmol. 1972 ; 50 : 33-46.
[3] Blumenthal M, Blumenthal R, Peritz E, et al. Seasonal variation in intraocular pressure. Am J Ophthalmol. 1970 ; 69 : 608-9.
[4] Brown B. Diurnal variation of IOP. Ophthalmology. 1991 ; 98 : 1485-6.
[5] Brubaker RF. Flow of aqueous humor in humans. Invest Ophthalmol Vis Sci. 1991 ; 32 : 3145-66.
[6] Buckingham T, Young R. The rise and fall of intraocular pressure : the influence of physiological factors. Ophthalmol Physiol Opt. 1986 ; 6 : 95-9.
[7] Buguet A, Py P, Romanet JP. 24-hour (nyctohemeral) and sleep-related variations of intraocular pressure in healthy white individuals. Am J Ophthalmol. 1994 ; 117 : 342-7.
[8] Bulpitt CJ, Hodes C, Everitt MG. Intraocular pressure and systemic blood pressure in the elderly. Br J Ophthalmol. 1975 ; 59 : 717-20.
[9] Carlson KH, McLaren JW, Topper JE, Brubaker RF. Effect of body position on intraocular pressure and aqueous flow. Invest Ophthalmol Vis Sci. 1987 ; 28 : 1346-52.
[10] Castejon H, Chiquet C, Savy O, et al. Effect of acute increase in blood pressure on intraocular pressure in pigs and humans. Invest Ophthalmol Vis Sci. 2010 ; 51 : 1599-605.
[11] Chiquet C, Custaud MA, Le Traon AP, et al. Changes in intraocular pressure during prolonged (7-day) head-down tilt bedrest. J Glaucoma. 2003 ; 12 : 204-8.
[12] Colton T, Ederer F. The distribution of intraocular pressures in the general population. Surv Ophthalmol. 1980 ; 25 : 123-9.
[13] Cooper RL, Beale DG, Constable IJ, Grose GC. Continual monitoring of intraocular pressure : effect of central venous pressure, respiration and eye movements on continual recordings of intraocular pressure in the rabbit, dog and man. Br J Ophthalmol. 1979 ; 63 : 799-804.
[14] David R, Zangwill L, Tessler Z, Yassur Y. The correlation between intraocular pressure and refractive status. Arch Ophthalmol. 1985 ; 103 : 1812-5.
[15] Doughty MJ, Zaman ML. Human corneal thickness and its impact on intraocular pressure measures : a review and meta-analysis approach. Surv Ophthalmol. 2000 ; 44 : 367-408.
[16] Frampton P, Da Rin D, Brown B. Diurnal variation of intraocular pressure and the overriding effects of sleep. Am J Optom Physiol Opt. 1987 ; 64 : 54-61.
[17] Gloster J, Poinoosawmy D. Changes in intraocular pressure during and after the dark-room test. Br J Ophthalmol. 1973 ; 57 : 170-8.
[18] Goldberg I, Clement CI. The water drinking test. Am J Ophthalmol. 2010 ; 150 : 447-9.
[19] Green K, Luxenberg MN. Consequences of eyelid squeezing on intraocular pressure. Am J Ophthalmol. 1979 ; 88 : 1072-7.
[20] Hamilton-Maxwell KE, Feeney L. Walking for a short distance at a brisk pace reduces intraocular pressure by a clinically significant amount. J Glaucoma. 2012 ; 21 : 421-5.
[21] Henkind P, Leitman M, Weitzman E. The diurnal curve in man : new observations. Invest Ophthalmol. 1973 ; 12 : 705-7.
[22] Hubanova R, Aptel F, Chiquet C, Romanet JP. Effect of overnight wear of the Triggerfish® sensor on corneal thickness measured by Visante anterior segment optical coherence tomography. Acta Ophthalmol. 2013 (sous presse).
[23] Kass MA, Becker B. Genetics of primary open-angle glaucoma. Sight Sav Rev. 1978 ; 48 : 21-8.
[24] Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study : a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002 ; 120 : 701-13.
[25] Kiel JW. The effect of arterial pressure on the ocular pressure-volume relationship in the rabbit. Exp Eye Res. 1995 ; 60 : 267-78.
[26] Kitazawa Y, Horie T. Diurnal variation of intraocular pressure in primary open-angle glaucoma. Am J Ophthalmol. 1975 ; 79 : 557-66.
[27] Leydhecker W, Akiyama K, Neumann AG. Der intraocular druck gesunder menschlicher. Klin Monatsbl Regenheilkd. 1958 ; 133 : 632.
[28] Liu JH, Kripke DF, Hoffman RE, et al. Nocturnal elevation of intraocular pressure in young adults. Invest Ophthalmol Vis Sci. 1998 ; 39 : 2707-12.
[29] Liu JH, Kripke DF, Twa MD, et al. Twenty-four-hour pattern of intraocular pressure in the aging population. Invest Ophthalmol Vis Sci. 1999 ; 40 : 2912-17.
[30] Malihi M, Sit AJ. Effect of head and body position on intraocular pressure. Ophthalmology. 2012 ; 119 : 987-91.
[31] Mauger RR, Likens CP, Applebaum M. Effect of accommodation and repeated applanation tonometry on intraocular pressure. Am J Optom Physiol Opt. 1984 ; 61 : 28-30.
[32] Mottet B, Aptel F, Romanet JP, et al. 24-hour intraocular pressure rhythm in young healthy subjects evaluated with continuous monitoring using contact lens sensor. JAMA Ophthalmol. 2013 (sous presse).
[33] Mottet B, Chiquet C, Aptel F, et al. 24-hour intraocular pressure of young healthy humans in supine position ; rhythm and reproductibility. Invest Ophthalmol Vis Sci. 2012 ; 53 : 8186-91.
[34] Noel C, Kabo AM, Romanet JP, et al. Twenty-four-hour time course of intraocular pressure in healthy and glaucomatous Africans : relation to sleep patterns. Ophthalmology. 2001 ; 108 : 139-44.
[35] Passo MS, Goldberg L, Elliot DL, Van Buskirk EM. Exercise conditioning and intraocular pressure. Am J Ophthalmol. 1987 ; 103 : 754-7.
[36] Passo MS, Goldberg L, Elliot DL, Van Buskirk EM. Exercise training reduces intraocular pressure among subjects suspected of having glaucoma. Arch Ophthalmol. 1991 ; 109 : 1096-8.
[37] Realini T, Weinreb RN, Wisniewski SR. Diurnal intraocular pressure patterns are not repeatable in the short term in healthy individuals. Ophthalmology. 2010 ; 117 : 1700-4.
[38] Reiss G, Leed D, Topper J, et al. Aqueous humor flow during sleep. Invest Ophthalmol Vis Sci. 1984 ; 25 : 776-8.
[39] Reitsamer H, Kiel JW. A rabbit model to study orbital venous pressure, intraocular pressure and ocular hemodynamics simultaneously. Invest Ophthalmol Vis Sci. 2002 ; 43 : 3728-34.
[40] Savy O. Étude des relations entre la pression artérielle systémique et la pression intra-oculaire. Étude expérimentale chez le modèle porcin. Thèse de médecine, Grenoble, 2004.
[41] Shapiro A, Shoenfeld Y, Konikoff F, et al. The relationship between body temperature and intraocular pressure. Ann Ophthalmol. 1981 ; 13 : 159-61.
[42] Shiose Y. Intraocular pressure : new perspectives. Surv Ophthalmol. 1990 ; 34 : 413-35.
[43] Smith TJ, Lewis J. Effect of inverted body position on intraocular pressure. Am J Ophthalmol. 1985 ; 99 : 617-8.
[44] Sommer A, Tielsch JM, Katz J, et al. Relationship between intraocular pressure and primary open angle glaucoma among white and black Americans. The Baltimore eye survey. Arch Ophthalmol. 1991 ; 109 : 1090-5.
[45] Stone EM, Fingert JH, Alward WL, et al. Identification of a gene that causes primary open angle glaucoma. Science. 1997 ; 275 : 668-70.
[46] Teikari JM. Genetic factors in open-angle (simple and capsular) glaucoma. A population-based twin study. Acta Ophthalmol. 1987 ; 65 : 715-20.
[47] Wang D, Huang W, Li Y, et al. Intraocular pressure, central corneal thickness, and glaucoma in chinese adults : the liwan eye study. Am J Ophthalmol. 2011 ; 152 : 454-62.
[48] Weinreb R, Cook J, Friberg TR. Effect of inverted body position on intraocular pressure. Am J Ophthalmol. 1984 ; 98 : 784-7.
[49] Weinreb R, Polansky JR, Kramer SG, Baxter JD. Acute effects of dexamethasone on intraocular pressure in glaucoma. Invest Ophthalmol Vis Sci. 1985 ; 26 : 170-5.
[50] Weitzman ED, Henkind P, Leitman M, Hellman L. Correlative 24-hour relationships between intraocular pressure and plasma cortisol in normal subjects and patients with glaucoma. Br J Ophthalmol. 1975 ; 59 : 566-72.
[51] Wiggs JL. Genetic etiologies of glaucoma. Arch Ophthalmol. 2007 ; 125 : 30-7.
[52] Ziai N, Ory SJ, Khan AR, Brubaker RF. Beta-human chorionic gonadotropin, progesterone and aqueous dynamics during pregnancy. Arch Ophthalmol. 1994 ; 112 : 801-6.
C. Baudouin, E. Brasnu, Y. Lachkar, E. Sellem
E. Brasnu, C. Baudouin
-
L’examen clinique du segment antérieur de tout patient glaucomateux – ou suspect de l’être – doit être systématique et méthodique.
-
Il concerne la peau et les annexes péri-oculaires, la conjonctive, la cornée, la chambre antérieure (avec le test de Van Herick), l’iris et le cristallin.
-
Il apprécie la qualité de la sécrétion lacrymale et de la surface oculaire, en particulier pour évaluer la tolérance des traitements antiglaucomateux et rechercher d’éventuels effets indésirables.
L’examen clinique du segment antérieur du patient glaucomateux est essentiel pour rechercher la présence de certaines affections associées à des formes secondaires de glaucome, éliminant ainsi le diagnostic de glaucome primitif à angle ouvert (GPAO), mais également pour évaluer la surface oculaire et la tolérance des traitements antiglaucomateux avec la recherche d’éventuels effets indésirables.
Toutefois, avant d’examiner le patient à la lampe à fente, il est indispensable d’observer le patient dans son ensemble (visage, mains), à la recherche par exemple de signes d’allergie (eczéma péri-oculaire), de taches hypopigmentées ou d’angiofibromes cutanés évocateurs d’une sclérose tubéreuse de Bourneville, de neurinomes plexiformes (maladie de von Recklinghausen), d’anomalies des dents (syndrome d’Axenfeld-Rieger), d’une angiomatose (syndrome de Sturge-Weber), d’une exophtalmie (fistule artérioveineuse), etc.
L’examen biomicroscopique réalisé ensuite doit être complet : examen de la surface oculaire, de la cornée, de la chambre antérieure avec recherche du signe de Van Herick, de l’iris et du cristallin [1].
L’examen clinique de la surface oculaire repose principalement sur la mesure du temps de rupture du film lacrymal, le test à la fluorescéine (intensité de fixation cornéoconjonctivale), le test de Schirmer, l’étude de la morphologie des paupières et des glandes de Meibomius, et l’étude des sécrétions meibomiennes [10].
L’examen des paupières est essentiel au diagnostic des pathologies de la surface oculaire, en particulier chez le patient glaucomateux, à la recherche de signes de iatrogénicité [2, 4, 6]. L’examen cutané peut mettre en évidence des signes en faveur d’une allergie de contact, comme un eczéma palpébral par exemple. Ensuite, l’examen du bord libre des paupières est indispensable pour identifier des signes de dysfonction meibomienne pouvant entrer dans le cadre d’une rosacée ou dermite séborrhéique, mais aussi être liée à une cause secondaire, notamment iatrogène (allergie, inflammation conjonctivale chronique d’origine toxique, etc.). On retrouvera alors un aspect typique avec télangiectasies palpébrales, inflammation du bord libre, obstruction des orifices des glandes de Meibomius et modification de l’aspect du meibum pouvant prendre un aspect visqueux. L’examen de la conjonctive palpébrale recherchera la présence d’une hyperhémie conjonctivale, de follicules, de papilles ou d’une fibrose conjonctivale associée ou non à la présence de symblépharons.
L’étude des sécrétions meibomiennes repose surtout sur l’examen biomicroscopique, l’examen des sécrétions étant réalisé après avoir pressé le bord libre palpébral. Le meibum normal est fluide et s’exprime facilement. Au contraire, le meibum pathologique s’exprime difficilement, voire pas du tout, et prend un aspect trouble, visqueux ou pâteux.
Deux techniques plus complexes peuvent également être intéressantes pour l’exploration de syndromes secs sévères associés à des dysfonctionnements meibomiens, mais sont peu utilisées en pratique clinique courante : la meibométrie et la meibographie. Les techniques de meibographie permettent l’analyse du nombre, de la morphologie des glandes de Meibomius et de leur contenu par transillumination [7, 11]. La meibométrie, quant à elle, permet d’évaluer le taux de sécrétion des glandes de Meibomius et d’analyser le volume et la concentration de la couche lipidique [3, 11]. Pour cela, le prélèvement des sécrétions meibomiennes lipidiques est pratiqué à l’aide d’une lamelle de plastique appliquée dans le tiers central de la marge palpébrale inférieure, l’œil regardant vers le haut. La lamelle est ensuite séchée à l’air libre, puis la densité optique est mesurée avec un meibomètre.
L’examen de la conjonctive avant utilisation de colorants est utile à la recherche d’une hyperhémie conjonctivale ou d’autres signes d’inflammation, comme une fibrose ou la présence de phlyctènes conjonctivales ou conjonctivocornéennes. L’hyperhémie peut également être secondaire à l’instillation de collyres prostanoïdes de synthèse ou d’agents sympathomimétiques au long cours. Des dépôts adrénochromes noirs secondaires à l’instillation des dérivés de l’adrénaline (épinéphrine) peuvent également être observés au niveau de la conjonctive. La présence d’une bulle de filtration doit bien évidemment être recherchée et son aspect précisé (fonctionnalité, intégrité, aspect kystique, cystoïde, etc.).
L’examen de l’épisclère et de la sclère recherche principalement une dilatation des vaisseaux épiscléraux évocatrice d’une élévation de la pression veineuse épisclérale d’un glaucome secondaire (orbitopathie dysthyroïdienne, syndrome de Sturge-Weber, fistule artérioveineuse ou pathologie tumorale) [1].
Le test de Schirmer de type 1, sans stimulation, est le plus utilisé pour la mesure de la sécrétion lacrymale [4, 10]. Il s’effectue sans anesthésie locale, à l’aide d’une bandelette papier de Schirmer placée sur le bord inférieur de la paupière, au niveau du tiers externe. La lecture s’effectue après cinq minutes. On considère qu’une longueur d’imprégnation inférieure 5 mm correspond à un test positif (sécheresse oculaire quantitative).
Le test de Schirmer de type 2, qui s’effectue après stimulation nasale, est pratiquement abandonné.
Le test à la fluorescéine permet d’examiner la cornée et la conjonctive (fig. 9-22) Trois systèmes de quantification de la coloration de la surface oculaire sont actuellement utilisés : Van Bijsterveld, Oxford et une version standardisée du système NEI/Industry Workshop. La fluorescéine imprègne les structures avec rupture des jonctions intercellulaires et colore également le mucus et les sécrétions. La lecture de l’intensité de sa fixation repose sur une stimulation en lumière bleue, jaune ou orange.
Le vert de lissamine, acide organique synthétique, colore le mucus, les cellules en desquamation et les cellules mortes (eFig. 9-1). Sa visibilité peut être améliorée par l’utilisation d’un filtre jaune ou rouge. Le vert de lissamine et la fluorescéine sont disponibles en bandelettes imprégnées ou sous forme d’une solution prêtre à l’emploi. Le produit étant bien toléré, le recours à un anesthésiant n’est pas nécessaire [4].
Fig. 9-22 Examen biomicroscopique de la surface oculaire après coloration à la fluorescéine. a. Examen de la cornée retrouvant une kératite toxique mixte par dessiccation et toxicité des collyres chez un patient glaucomateux multitraité. b. Examen de la conjonctive retrouvant une imprégnation conjonctivale et cornéenne de fluorescéine (filtre écran jaune) chez un patient glaucomateux multitraité. c. Examen à la fluorescéine (filtre écran jaune) d’une bulle de filtration avec gêne fonctionnelle occasionnée par un frottement au niveau de la bulle (imprégnation de fluorescéine).
eFig. 9-1 Photographie de l’œil d’un patient après coloration au vert de lissamine.
Ce test consiste à mesurer le temps de rupture du film lacrymal (tear film break-up time ou TF-BUT) à l’aide d’un volume standard de fluorescéine (fig. 9-23). En pratique, le seuil du TF-BUT pour le diagnostic de l’œil sec est inférieur à 10 secondes, mais des valeurs comprises entre 5 et 10 secondes ont été acceptées par plusieurs auteurs, surtout lors de l’utilisation de faibles volumes de fluorescéine (vidéo 9-1).
Fig. 9-23 Photographie à la lampe à fente de l’œil d’un patient montrant la rupture du film lacrymal coloré à la fluorescéine.
Décrit en 1969 par William Van Herick lui-même, le test de Van Herick est une méthode biomicroscopique simple, rapide et non-contact, d’évaluation de la profondeur de la chambre antérieure en périphérie qui permet une estimation du risque de fermeture de l’angle iridocornéen [9].
La technique biomicroscopique est la suivante : la fente lumineuse est projetée perpendiculairement à la cornée périphérique, ce qui nécessite une rotation de 60° environ du bras de la projection lumineuse de la lampe à fente par rapport à l’axe d’observation binoculaire (fig. 9-24). L’épaisseur de la cornée à ce niveau est utilisée comme unité de mesure permettant d’évaluer la profondeur limbique de la chambre antérieure (PLCA). Le test consiste ainsi à comparer la distance entre l’endothélium cornéen et la face antérieure de l’iris (c’est-à-dire la PCLA) à l’épaisseur cornéenne, afin d’estimer l’ouverture de l’angle iridocornéen [9].

Fig. 9-24 Technique biomicroscopique de réalisation du test de Van Herick chez un patient présentant un angle iridocornéen étroit. La fente lumineuse verticale fine est projetée au niveau de la cornée périphérique, le plus proche possible du limbe, de telle sorte qu’elle l’atteigne perpendiculairement.
D’après Van Herick, si, en périphérie, la distance entre la face postérieure de la cornée (endothélium) et la surface de l’iris (PLCA) est supérieure ou égale à l’épaisseur de la cornée (> 100 %), on peut considérer que l’angle sera toujours ouvert en gonioscopie, cela correspondant au grade 4 de la classification initiale. Si la PLCA est supérieure ou égale à la moitié de l’épaisseur cornéenne (≥ 50 à 100 %), la fermeture est impossible (grade 3). Si la PLCA est comprise entre le quart et la moitié de l’épaisseur cornéenne (> 25 % et < 50 %), cela correspond au grade 2 et impose la réalisation d’une gonioscopie. Si la PLCA est inférieure ou égale à 25 % de l’épaisseur cornéenne (≤ 25 %), il existe une probabilité élevée de retrouver un angle étroit en gonioscopie, et cela correspond au grade 1 de la classification de Van Herick (tableau 9-2) [9].
Foster et al. [5], en 2000, ont comparé ce test à l’examen gonioscopique, définissant un angle fermé comme un angle au sein duquel le trabéculum pigmenté n’était visible que sur moins de 270° en position primaire, c’est-à-dire sans indentation. Cette étude réalisée sur 1 800 patients a ainsi retrouvé une sensibilité de 61,9 % et une spécificité de 89,3 % du test de Van Herick. Les auteurs ont également proposé une modification de cette classification visant à améliorer la précision de la mesure de la PLCA, le grade 1 original étant subdivisé en trois autres grades correspondant à une épaisseur cornéenne de 0 %, 5 % et 15 %, un autre grade de 75 % d’épaisseur cornéenne ayant été également ajouté. Le « grade 15 % » correspondant au grade 1 de la classification initiale permit dans cette étude d’améliorer surtout la spécificité du test (84 %), le grade 5 % à la fois la sensibilité (91 %) et la spécificité du test (93 %) pour la détection du glaucome primitif par fermeture de l’angle, ce test ayant par ailleurs montré une reproductibilité interexaminateur satisfaisante [8].
Le signe de Van Herick est donc une méthode simple, rapide et reproductible d’évaluation du risque potentiel de fermeture de l’angle iridocornéen, mais ne peut en aucun cas dispenser de la réalisation d’une gonioscopie ou d’un examen d’imagerie de l’angle iridocornéen. Rapide et non invasif, il est très utile au dépistage des angles suspects ou à risque de fermeture, et ne doit pas être réservé seulement aux patients hypertones ou glaucomateux (vidéos 9-2 et 9-3 ; eCas cliniques 9-1 et 9-2).

Tableau 9-2 Classification de Van Herick [9].
AIC : angle iridocornéen ; EC : épaisseur cornéenne ;
PLCA : profondeur limbique de la chambre antérieure.
Forme typique
Madame X, 47 ans, hypermétrope de + 4,00 dioptries aux deux yeux, a consulté pour un renouvellement de verres correcteurs. L’examen ophtalmologique réalisé retrouvait : une acuité visuelle corrigée à 10/10 P2 aux deux yeux et une PIO à 15 mmHg à droite et 14 mmHg à gauche. La recherche du signe de Van Herick mettait en évidence une étroitesse de la chambre antérieure en périphérie, avec une PCLA inférieure à 25 % sur l’œil droit et égale à 50 % sur l’œil gauche. La gonioscopie retrouvait un angle étroit aux deux yeux, avec un trabéculum non visible sur plus de la moitié des méridiens. Le reste de l’examen ophtalmologique était normal. Une OCT de segment antérieur a donc été réalisée par la suite, et a confirmé l’étroitesse de l’angle iridocornéen avec présence d’une apposition iridotrabéculaire. Une iridotomie périphérique a ainsi été réalisée à droite et à gauche, permettant d’obtenir une réouverture de l’angle iridocornéen et d’éviter la survenue d’une crise aiguë de fermeture de l’angle, voire d’un glaucome chronique par fermeture de l’angle.
Situation piège
Monsieur Y, patient de 65 ans, myope, est adressé en consultation ophtalmologique pour un avis chirurgical sur un glaucome à pression normale (GPN) diagnostiqué cinq ans plus tôt, traité dans les deux yeux par une bithérapie hypotonisante, avec une dégradation progressive de ses champs visuels, en particulier de l’œil gauche (OG) qui présente un déficit très avancé. Aucun facteur de risque de GPN n’avait été retrouvé après réalisation d’un bilan complet incluant une imagerie cérébrale par résonance magnétique. La PIO maximale retrouvée à l’interrogatoire était de 17 mmHg aux deux yeux. L’examen ophtalmologique réalisé chez ce patient retrouvait : une acuité visuelle corrigée à 8/10 P2 sur l’œil droit (OD) et 7/10 P3 sur l’OG, une PIO à 13 mmHg à droite et 12 mmHg à gauche pour des pachymétries respectives de 545 μm et 552 μm, une phakosclérose bilatérale et une excavation papillaire prédominant du côté gauche (rapport cup/disk = 0,8 OD, 0,95 OG). La recherche du signe de Van Herick mit en évidence une PCLA inférieure à 25 % de l’épaisseur cornéenne à droite et un contact irido- endothélial à gauche. La gonioscopie a retrouvé une fermeture bilatérale de l’angle iridocornéen sans synéchies antérieures périphériques. L’imagerie de l’angle en UBM a confirmé ensuite la fermeture de l’angle iridocornéen et mis en évidence une configuration d’iris plateau aux deux yeux. Le patient a donc bénéficié par la suite d’une iridotomie périphérique au laser aux deux yeux, permettant d’obtenir une réouverture partielle de l’angle et une stabilisation des champs visuels sans remontée pressionnelle (le traitement local fut poursuivi). Ce cas illustre l’intérêt du test de Van Herick dans la prise en charge du patient glaucomateux, permettant ici de redresser le diagnostic de GPN par la réalisation d’une gonioscopie et la mise en évidence d’un authentique glaucome chronique par fermeture de l’angle.
L’examen de la cornée, qui peut mettre en évidence des déficits épithéliaux retrouvés surtout dans les atteintes toxiques médicamenteuses (voir plus haut), est aussi très utile au diagnostic étiologique des glaucomes secondaires. Ainsi une mégalocornée, souvent associée à la présence de ruptures de la membrane de Descemet (stries de Haab), orientera vers un glaucome congénital ou précoce. L’examen de la face postérieure de la cornée et de l’endothélium est également primordial, à la recherche de signes évocateurs d’une cause secondaire d’hypertension intra-oculaire ou de glaucome (présence d’un faisceau de Krükenberg dans la dispersion pigmentaire, de dépôts de matériel exfoliatif dans le glaucome pseudo-exfoliatif, de précipités rétrodescemétiques dans le glaucome uvéitique, aspect en argent martelé de l’endothélium dans les syndromes irido-cornéo-endothéliaux).
L’examen de l’iris, réalisé avant toute dilatation pupillaire, est également systématique, avec surtout l’analyse de l’aspect du plan irien, de la forme et la taille de la pupille. Il faut également rechercher des signes évocateurs d’une atteinte pouvant entraîner un glaucome secondaire : nodules iriens, synéchies iridocristalliniennes, ectropion uvéal, néovaisseaux, zones d’atrophie, corectopie, etc.
L’examen de la taille, de la forme et de la transparence du cristallin fait partie de l’examen clinique de tout patient glaucomateux, réalisé le plus souvent après dilatation pupillaire.
On recherchera la présence d’une cataracte dont le type précis doit être noté (cataracte sous-capsulaire postérieure associée à la prise de stéroïdes locaux ou généraux par exemple), de dépôts pseudo-exfoliatifs ou d’un phakodonésis.
Retenir
-
Un examen complet du segment antérieur doit être réalisé chez tout patient glaucomateux.
-
L’examen du segment antérieur est capital pour le diagnostic de glaucome primitif ou secondaire, pour le dépistage d’un risque de glaucome par fermeture de l’angle (test de Van Herick), pour l’évaluation de la surface oculaire et la recherche de signes d’intolérance au traitement.
[1] AAO. Cours de sciences fondamentales et cliniques. Issy-les-Moulineaux, Elsevier-Masson, 2010.
[2] Asbell PA, Stapleton FJ, Wickstrom K, et al. The international workshop on meibomian gland dysfunction : report of the clinical trials subcommittee. Invest Ophthalmol Vis Sci. 2011 ; 52 : 2065-85.
[3] Chew CK, Jansweijer C, Tiffany JM, et al. An instrument for quantifying meibomian lipid on the lid margin : the Meibometer. Curr Eye Res. 1993 ; 12 : 247-54.
[4] Doan S. La sécheresse oculaire de la clinique au traitement. Paris, MED COM, 2008.
[5] Foster PJ, Devereux JG, Alsbirk PH, et al. Detection of gonioscopically occludable angles and primary angle closure glaucoma by estimation of limbal chamber depth in Asians : modified grading scheme. Br J Ophthalmol. 2000 ; 84 : 186-92.
[6] Hoang-Xuan T, Baudouin C, Creuzot-Garcher C. Inflammation chronique de la conjonctive. Stuttgart, Thieme, 2001.
[7] Nichols JJ, Berntsen DA, Mitchell GL, Nichols KK. An assessment of grading scales for meibography images. Cornea. 2005 ; 24 : 382-8.
[8] Thomas R, George T, Braganza A, Muliyil J. The flashlight test and van Herick’s test are poor predictors for occludable angles. Aust NZ J Ophthalmol. 1996 ; 24 : 251-6.
[9] Van Herick W, Shaffer RN, Schwartz A. Estimation of width of angle of anterior chamber. Incidence and significance of the narrow angle. Am J Ophthalmol. 1969 ; 68 : 626-9.
[10] Dry Eye WorkShop. Methodologies to diagnose and monitor dry eye disease : report of the Diagnostic Methodology Subcommittee of the International Dry Eye WorkShop. Ocul Surf. 2007 ; 5 : 108-52.
[11] Yokoi N, Komuro A. Non-invasive methods of assessing the tear film. Exp Eye Res. 2004 ; 78 : 399-407.
Y. Lachkar, H. Cohn
-
La gonioscopie doit être réalisée chez tout patient atteint ou suspect de glaucome même si la chambre antérieure n’est pas étroite.
-
Elle est essentielle non seulement pour le diagnostic de glaucome primitif à angle ouvert (GPAO) mais également au cours du suivi pour dépister une éventuelle fermeture progressive associée de l’angle iridocornéen.
-
Seule la gonioscopie avec indentation permet de différencier apposition irido-trabéculaire et synéchies antérieures périphériques.
La gonioscopie est l’étude de l’angle iridocornéen. Elle fait partie intégrante de l’examen clinique ophtalmologique et doit être réalisée de façon systématique au même titre que la prise de la pression intra-oculaire (PIO). Elle s’impose a fortiori devant tout glaucome, suspicion de glaucome ou chez les sujets à risque (hypertension intra-oculaire ou patient présentant une suspicion d’angle étroit). Elle permet essentiellement de différencier les angles ouverts des angles susceptibles de se fermer ou fermés.
L’angle iridocornéen est examiné le plus souvent à la lampe à fente, en position assise, avec un verre de contact (gonioscopie indirecte) [1]. Bien que le verre de Goldmann soit le plus souvent utilisé, il convient de connaître la technique de gonioscopie dynamique (avec, par exemple, le verre à quatre miroirs de Zeiss), car une des parois de l’angle, l’iris, est mobile et doit donc être examinée de façon la plus anatomique qui soit (fig. 9-25).
Le but de la gonioscopie est de déterminer la topographie de l’angle iridocornéen de la chambre antérieure de l’œil [2, 7, 9]. Elle est fondée sur la reconnaissance des structures de l’angle et doit être toujours considérée suivant :
-
le niveau d’insertion de l’iris (réel et apparent) ;
-
la forme de la périphérie de l’iris ;
-
l’estimation de l’ouverture de l’angle ;
-
l’intensité de la pigmentation trabéculaire ;
-
l’existence de zones d’apposition iridotrabéculaire ou de synéchies.

Fig. 9-25 Verre à trois miroirs pour la gonioscopie statique uniquement (à gauche) et verre de Posner pour la gonioscopie dynamique et statique (à droite).
Deux techniques gonioscopiques essentielles permettent d’évaluer l’angle iridocornéen : la gonioscopie directe et la gonioscopie indirecte.
L’utilisation d’un gonioscope de contact permet un examen direct et panoramique de l’angle, le rayon lumineux passant directement à travers la cornée afin de visualiser l’angle. Dans cette technique, le patient doit être allongé. Elle est donc le plus souvent utilisée lors d’un examen sous anesthésie générale (enfant). L’agrandissement de l’image est bon, l’orientation est facile pour l’examinateur et la comparaison des deux yeux est possible simultanément. Il faudra cependant utiliser une lampe à fente (portable si besoin).
Les principales lentilles de gonioscopie directe sont : le verre de Koeppe (un produit visqueux de contact est nécessaire), le verre de Layden adapté pour l’enfant (un produit visqueux de contact est également nécessaire) et le verre de Worst.
La visualisation de l’angle se fait à travers un miroir s’intégrant dans un verre de contact. Le patient doit être installé à la lampe à fente et l’observation de l’angle iridocornéen est indirecte. La réalisation de la gonioscopie est rapide lors d’un examen ophtalmologique classique, et le verre central permet par ailleurs d’observer le fond d’œil. Cependant, les deux yeux ne peuvent être examinés simultanément.
Les principales lentilles de gonioscopie indirecte sont le verre de Goldmann de un à quatre miroirs (un produit visqueux de contact est nécessaire), les verres à quatre miroirs de Posner, Zeiss ou Sussman (l’utilisation d’un produit visqueux n’est pas nécessaire), et le verre CGA™ 1.4 de Lasag (un produit visqueux de contact est nécessaire). En pratique, les deux principales lentilles utilisées sont les verres de Goldmann et de Posner.
Les verres de Goldmann sont en verre ou le plus souvent en plastique, dans lequel le miroir à gonioscopie est incliné de 62° sur la face antérieure plane. Il existe des verres de Goldmann à un miroir (verre de gonioscopie) ou à trois miroirs, dont le plus petit est le miroir de gonioscopie incliné à 59°. La zone de contact avec la cornée a un diamètre de 12 mm et recouvre donc entièrement la cornée. Sa courbure postérieure est de 7,4 mm : elle crée donc un vide (le rayon de courbure cornéen est de 7,8 mm) que l’on doit remplir avec une solution visqueuse. Bien que le verre de Goldmann n’exerce aucune pression sur la cornée, le vide créé peut entraîner un effet de succion, notamment au niveau du limbe iridocornéen, et modifier l’aspect de l’angle iridocornéen.
Ce verre à quatre miroirs, avec un rayon de courbure de 7,7 mm, permet une application sur la cornée sans interposition de liquide. La taille du segment du verre rentrant en contact avec la cornée (9 mm) fait qu’il ne recouvre pas complètement celle-ci, expliquant également l’absence d’effet de succion. Les avantages sont la visibilité de l’angle iridocornéen avec un minimum de rotation du verre et, surtout, la possibilité de réaliser une gonioscopie avec indentation ou gonioscopie dynamique [3, 8].
Le verre est posé après instillation d’une goutte d’anesthésique (oxybuprocaïne le plus souvent). La paupière inférieure est légèrement abaissée, puis la partie supérieure du verre est mise en contact avec l’œil et, avec une légère rotation du poignet, la partie inférieure du verre est alors appliquée sur la cornée en prenant soin de ne pas appuyer sur l’œil pour éviter de fausser le repérage anatomique.
Il ne faut pas utiliser une lumière trop forte afin de ne pas induire un myosis qui peut modifier également les structures angulaires Pour les mêmes raisons, on réduira la hauteur de fente lumineuse pour éviter qu’elle se projette dans l’orifice pupillaire. Il est préférable de commencer par l’angle supérieur qui est plus étroit, puis de poursuivre l’examen de façon systématique, quadrant par quadrant.
Dans tous les cas, il faut garder la face antérieure du verre verticale, c’est-à-dire perpendiculaire à l’axe d’observation afin de ne pas modifier artificiellement les rapports anatomiques, car les différentes positions du regard peuvent modifier l’angle de visualisation et fausser le repérage anatomique.
Avec un verre de Goldmann, de façon systématique à chaque examen, il est préférable d’observer d’abord l’angle supérieur qui peut apparaître plus étroit, puis d’examiner les autres portions de l’angle. Il faudra garder la face antérieure verticale, perpendiculaire à l’axe d’observation, afin de ne pas modifier artificiellement les rapports anatomiques. Les quatre quadrants doivent être examinés en combinant les mouvements de la lampe à fente et les rotations du verre.
Si l’angle est étroit, on pourra s’aider des mouvements du globe oculaire vers le miroir qui visualise la portion de l’angle.
Pour cette technique, le miroir à utiliser est un miroir à quatre faces dont la face postérieure a un rayon de courbure de 7,7 mm. Une pression délicate, appliquée sur ce verre au centre de la cornée, permet à l’humeur aqueuse d’être refoulée. Lorsque l’iris est en contact avec le trabéculum, l’angle peut être « réouvert » (fermeture de l’angle par apposition iridotrabéculaire). S’il existe une adhérence entre l’iris et le trabéculum (synéchies antérieures périphériques), cette portion de l’angle reste fermée (fig. 9-26).
Cette indentation peut également être réalisée dans un des quadrants pour dégager et examiner les structures angulaires situées à 180°. Elle est surtout utile :
-
en cas de convexité de l’iris, en permettant de visualiser les structures angulaires non visibles en position anatomique ;
-
lorsque les variations anatomiques rendent l’identification des différentes structures angulaires difficile, ce qui est en fait très fréquent : largeur de la bande ciliaire, visibilité de l’anneau de Schwalbe, degré de pigmentation du trabéculum, existence d’une ligne de Sampaolesi.
La gonioscopie avec indentation doit être systématiquement réalisée au moindre doute sur l’ouverture de l’angle iridocornéen (fig. 9-27 et 9-28).
Le principal piège de cette technique est lié à la mobilisation éventuelle du globe par rapport au miroir [4, 5]. En effet, si le patient regarde en direction du miroir, l’angle aigu ainsi créé entre le trabéculum et le rayon incident rend l’angle artificiellement plus étroit. Il faut donc essayer, tout au long de l’examen, de maintenir la position du verre la plus perpendiculaire possible.
Le second piège est lié à la pression que l’on peut exercer sur le verre : elle va indenter le globe oculaire, chasser l’humeur aqueuse du centre vers la périphérie, vers l’angle iridocornéen et donc l’ouvrir. Ce phénomène s’observe lorsque l’on utilise un verre dont le diamètre est inférieur à celui de la cornée (petit verre de Goldmann, verre de Zeiss ou de Posner). Cet effet mécanique est parfois recherché volontairement au cours de l’examen : c’est la gonioscopie avec indentation ou gonioscopie dynamique. Lorsque l’on utilise un verre de diamètre plus large (verre de Goldmann classique), l’indentation peut également être transmise mais en périphérie, au limbe, et rendre alors au contraire l’angle plus étroit.
Dans certains cas de GPAO à angle étroit, notamment en cas de configuration d’iris plateau, la concavité irienne ne peut être obtenue lors de l’indentation, témoignant ainsi d’un déplacement antérieur du corps ciliaire (aspect en double bosse de l’iris). Lorsque le cristallin entre dans le mécanisme de fermeture, l’indentation entraîne simplement des petits mouvements postérieurs de l’iris qui garde son profil convexe.
La gonioscopie avec indentation est la seule technique qui permette de faire le diagnostic différentiel entre une fermeture par synéchies et une fermeture par apposition iridotrabéculaire, avec une incidence thérapeutique [1]. En effet, les examens de l’angle à l’aide d’appareils tels que l’OCT de segment antérieur ou la biomicroscopie ultrasonique (UBM) autorisent l’analyse de la dynamique de l’angle suivant l’illumination, mais pas suivant la technique d’indentation.
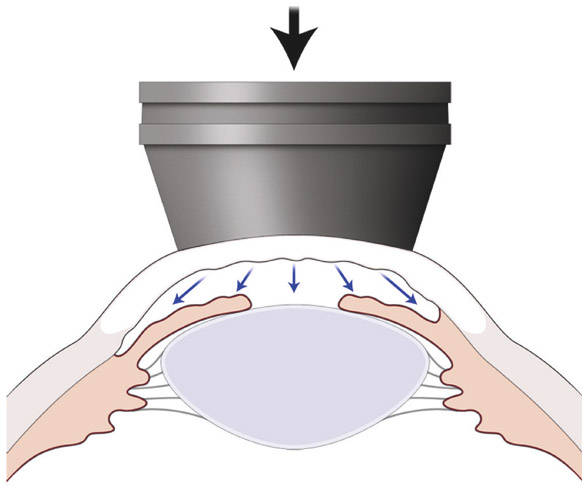
Fig. 9-26 Effets de la gonioscopie dynamique : l’angle s’ouvre à gauche (simple apposition) ; l’angle est synéchié à droite.

Fig. 9-27 Angle ouvert sans pigment (avant fente fine pour rechercher l’anneau de Schwalbe ; voir fig. 9-28).
Fig. 9-28 Fente fine angulée à 20° pour identifier l’insertion de la cornée dans la sclère qui indique le niveau de l’anneau de Schwalbe. Ceci est donc un angle grand ouvert. Technique très utile pour éviter le faux diagnostic d’angle fermé.
-
0 : angle fermé. Aucune structure n’est visible, y compris l’anneau de Schwalbe caché par l’iris qui est en contact avec la cornée.
-
1 : angle fermé, anneau de Schwalbe visible. On devine la partie antérieure non fonctionnelle du trabéculum (degré d’ouverture de l’angle iridocornéen d’environ 10°).
-
2 : angle ouvert, tiers postérieur fonctionnel du trabéculum visible, éperon scléral non visible. Fermeture possible (degré d’ouverture de l’angle iridocornéen d’environ 20°).
-
3 : éperon scléral visible. Fermeture de l’angle iridocornéen impossible (degré d’ouverture de l’angle iridocornéen de 20 à 30°).
-
4 : toutes les structures sont visibles jusqu’à la bande ciliaire. Fermeture impossible (degré d’ouverture de l’angle iridocornéen de 30 à 45°).

Fig. 9-29 La classification du degré d’ouverture de l’angle iridocornéen de Schaffer. a. Anneau de Schwalbe. b. Trabéculums pigmenté et non pigmenté. c. Éperon scléral. d. Bande ciliaire. e. Base de l’iris. (D’après Alward, 1994 [1].)
Elle est fondée sur trois critères [8] : l’appréciation du degré d’ouverture de l’angle en degrés (entre la cornée et l’iris), la courbure de l’iris en périphérie et le site d’insertion de l’iris.
La fermeture de l’angle iridocornéen est impossible entre 20 et 45°, possible entre 10 et 20°, et probable en dessous de 10°.
Cette classification est le plus souvent utilisée en gonioscopie dynamique (verre de Posner ou de Zeiss). Elle a été légèrement modifiée afin de mieux définir la courbure de l’iris. Celle-ci était en effet décrite suivant trois possibilités, comme l’indique la figure 9-30 :
-
plane ou régulière (« r » pour regular) ;
-
convexe (« s » pour steep) ou iris bombé ;
-
concave (« q » pour queer).
Cette classification ne prenant pas en compte la configuration d’iris plateau, elle a été modifiée en :
-
plane ou « f » ou flat ;
-
concave ou « c » ;
-
convexe, courbe ou « b » (pour bowed) ;
-
configuration d’iris plateau ou « p » pour plateau.
Ainsi, la cotation de l’angle peut être notée avec un chiffre pour le degré d’ouverture, une lettre minuscule pour la configuration de l’iris (f, c, b ou p) et une lettre majuscule (de A à E) pour le niveau d’insertion de l’iris.
Spaeth a également introduit une graduation de la pigmentation de la partie postérieure du trabéculum à 12 heures suivant une échelle de 0 à 4+. Enfin, il est également possible de noter, suivant l’indentation, l’insertion de l’iris visible en indiquant entre parenthèses l’insertion avant indentation. Ainsi, si l’indentation fait passer la visualisation de l’insertion de l’iris de C à D, il sera noté : (C)D
L’examen de l’angle iridocornéen est essentiel pour appréhender les différents types de sujets à risque. Il nécessite une technique rigoureuse et une connaissance parfaite de l’anatomie pour éviter de tomber dans de nombreux pièges.
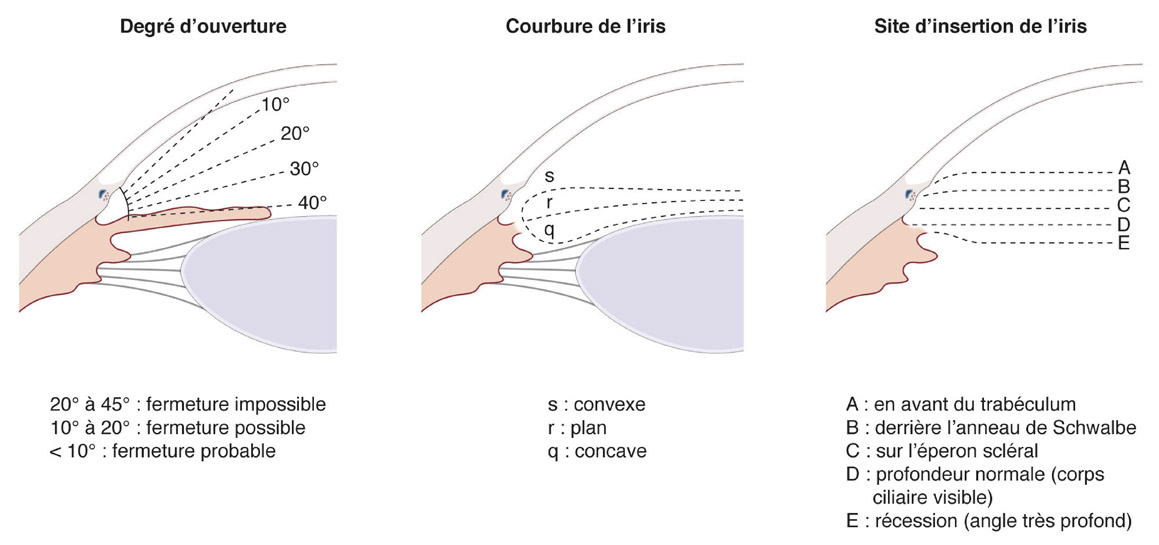
Fig. 9-30 Classification du degré d’ouverture de l’angle iridocornéen selon Spaeth. (D’après Alward, 1994 [1].)
Retenir
-
La méthode de Van Herick pour estimer l’ouverture de l’angle iridocornéen ne peut remplacer la réalisation d’une gonioscopie.
-
Les techniques d’imagerie de l’angle telles que l’OCT du segment antérieur ou l’UBM ne peuvent pas et ne doivent pas remplacer la réalisation d’une gonioscopie.
-
Il ne faut pas confondre examen dynamique de l’angle en gonioscopie dynamique et examen dynamique suivant l’éclairage en imagerie UBM ou OCT.
[1] Alward W. Color atlas of gonioscopy. Londres, Mosby, 1994. www.gonioscopy.org.
[2] Béchetoille A. Les glaucomes. Éditions Japperrenard, 1997.
[3] Cohn H. Gonioscopy why do indentation. In : Giaconi JA (ed.). Pearls of glaucoma management. Berlin, Heidelberd, Springer-Verlag, 2010
[4] Epstein D. The angle of the anterior chamber. In : Chandler and Grant’s Glaucoma, 4th ed. Lea and Feibiger, 1997.
[5] Palmberg P. Gonioscopy. In : Ritch R, Shields MB, Kupin T (eds). The glaucomas. Mosby, 1996.
[6] Shaffer RN. Stereoscopic manual of gonioscopy. St. Louis, Mosby, 1992.
[7] Shields MB. Textbook of glaucoma. Baltimore, Williams and Wilkins, 1992.
[8] Spaeth GL. Distinguishing between the normally narrow, the suspiciously shallow and the particularly pathological anterior chamber angle. Perspect Ophthalmol. 1977 ; 1 : 205-14.
[9] Zalta A. Gonioscopy. In : Kaufman P, Mittag P (eds). Glaucoma. Mosby Year Book, 1994.
E. Sellem
-
Description des méthodes d’observation au biomicroscope de la tête du nerf optique et des fibres nerveuses rétiniennes.
-
La mesure approximative du diamètre papillaire à la lampe à fente permet une première évaluation immédiate du caractère physiologique ou pathologique d’une excavation.
-
Les fibres nerveuses rétiniennes, et leurs éventuels déficits, sont mal identifiables à l’observation biomicroscopique directe.
-
De nombreuses papilles restent difficilement analysables ou ininterprétables : dysversion, myopie forte, drusen papillaires.
En 1851, Helmotz inventa l’ophtalmoscope. Peu de temps après, en 1854, il permit ainsi à l’ophtalmologiste viennois Eduard Jaeger [13] de réaliser et de publier les premiers dessins de papille glaucomateuse [20]. Si l’atrophie optique était évidente ainsi que le rejet nasal des vaisseaux, et même l’atrophie péripapillaire, cet observateur avait alors représenté l’excavation comme un gonflement saillant, une convexité, envahissant la tête du nerf optique (fig. 9-31) ! Jaeger défendait la théorie d’une étiologie inflammatoire, manifestation de la goutte. Von Graefe [24], qui adhérait à cette interprétation anatomopathologique et inflammatoire, incriminait plutôt une choroïdite. Cette erreur d’interprétation perdura plusieurs années, jusqu’à ce que les examens histopathologiques révèlent que ce gonflement apparent en observation monoculaire était en réalité un creusement, une excavation très exactement.
Ces errements inauguraux ont confirmé à eux seuls la nécessité d’examiner le fond d’œil, et singulièrement la papille, en stéréoscopie. L’observation monoculaire ne permet aucunement d’apprécier les pentes d’une excavation papillaire lorsqu’elles sont douces, ou l’importance de la courbure des vaisseaux. Elle peut faire prendre à tort la coloration d’une pente raide d’une excavation totale pour du tissu neurorétinien. Elle n’autorise pas non plus (ou très grossièrement) la mesure de la taille de la papille.
Fig. 9-31 Représentation d’une atrophie glaucomateuse totale de la papille par E. Jaeger en 1854 [13].
Il est préférable de dilater la pupille (après vérification de l’ouverture de l’angle iridocornéen) pour avoir une bonne vision binoculaire, bien que cela ne soit pas indispensable à un observateur exercé. Trois méthodes permettent d’examiner le pôle postérieur dans ces conditions optimales :
-
l’examen du fond d’œil direct à la lampe à fente. La technique la plus utilisée est celle de la pose d’un verre de contact sur le globe oculaire, soit le verre à trois miroirs de Goldmann (+ 64,5 dioptries), soit un autre verre de contact (+ 78, + 90 dioptries, etc.), après avoir anesthésié la cornée et rempli la convexité du verre d’un gel. Ce type d’examen présente l’avantage de donner un fort grossissement, au détriment d’un champ d’observation plus restreint. En matière de glaucome, il permet dans le même temps de faire une gonioscopie si le verre est équipé d’un miroir ad hoc. Une autre technique d’observation directe utilise la lentille biconcave de Hruby (– 55 dioptries) placée près de la surface cornéenne, mais sans contact avec elle. Elle donne également une image directe du fond d’œil. Plus cette lentille est proche de la cornée, plus le champ d’observation est large, mais l’image renvoyée est souvent de trop petite taille pour analyser avec précision les structures papillaires ;
-
l’examen du fond d’œil indirect à la lampe à fente (l’image du fond d’œil est inversée), à l’aide d’un verre non-contact, type lentille de Volk. Le verre est tenu à environ 8 mm de la cornée. Il en est de très nombreux et de différentes puissances : celui de 78 dioptries donne une image plus grande de la papille qu’un verre de 90 dioptries, avec une magnification assez proche de celui du verre de Goldmann à trois miroirs ;
-
l’examen du fond d’œil indirect avec le système de lunette binoculaire et d’éclairement frontal de Scheppens, très diffusé dans les pays anglo-saxons. Cette méthode d’observation nécessite une solide expérience pour être aisément pratiquée. La source lumineuse est dirigée sur l’œil du patient à l’aide d’un miroir mobile, et la lumière réfléchie est recueillie par une lentille convergente (de + 20 ou + 28 dioptries généralement), donnant donc une image inversée du fond d’œil.
Avant toute analyse directe de la tête du nerf optique, il est essentiel de connaître même approximativement son diamètre : en particulier, en l’absence de ce paramètre, la valeur du rapport excavation/tête du nerf optique (rapport cup/disc des Anglo-Saxons ou C/D) n’a aucune valeur diagnostique. Les variations interindividuelles de la surface de l’anneau neurorétinien (ANR) sont moins importantes que celles de la surface papillaire [4, 8], ce que Drance exprime par l’aphorisme : « The larger the disc, the larger the cup. » Un petit nerf optique glaucomateux ne développera une excavation observable qu’à un stade tardif de la maladie et, à l’inverse, une grande papille peut parfaitement être le siège d’une excavation de 7, voire 8/10, strictement physiologique. Certes, les analyseurs (HRT et OCT) fournissent une dimension précise du diamètre papillaire, mais l’observateur peut ne pas en être équipé (ou ne pas systématiquement les utiliser), alors qu’il obtiendra d’emblée par sa mesure au biomicroscope un paramètre essentiel pour apprécier l’état papillaire.
Dès les années 1980, mais avant les analyseurs modernes, toutes les mesures de la taille du disque optique, de l’excavation et de l’anneau neurorétinien étaient faites par planimétrie à partir de clichés sur papier ou de diapositives projetées, soit manuellement [14, 23], soit avec l’aide naissante des ordinateurs [3, 7, 19] (voir chapitre 9-IV, paragraphe « Polarimétrie à balayage laser »), voire sur des globes prélevés…
Franceschetti et Bock en 1950 [10] avaient réalisée cette mesure grâce à un réticule millimétré situé dans l’oculaire du biomicroscope, projeté au fond d’œil au travers d’un verre de Goldmann, mais il était nécessaire d’appliquer un coefficient de grandissement dépendant directement de la réfraction du globe.
Dans le rapport de la SFO de 1957 [11], Goldmann expliquait que s’il avait retenu une puissance de + 64,5 dioptries pour son verre, c’est précisément parce qu’elle assure un agrandissement linéaire constant quelle que soit la réfraction du globe examiné, agrandissement qu’il avait évalué à 1,099 (1/0,91). Nous verrons plus loin que, depuis, ce coefficient a été légèrement réévalué. En France, et pour le glaucome, ces considérations d’optique géométrique nous ont conduits dès 1989 à être les initiateurs et les diffuseurs d’une méthode simple permettant une mesure directe biomicroscopique de la taille de la papille [17, 22]. Cette évaluation avait déjà été décrite en 1985 dans un article de Beuchat concernant l’hypoplasie du nerf optique, mais dans une revue à la diffusion relativement confidentielle auprès de la communauté ophtalmologique [5]. La paternité a pu en être attribuée ultérieurement à d’autres [16, 18, 21].
Le diamètre du disque optique peut être mesuré avec une relative précision à l’aide de la plupart des lampes à fente, que ce soit par la technique d’observation indirecte avec un verre de type Volk ou par l’observation directe avec un verre de contact. La fente lumineuse est projetée verticalement à côté de la papille (les limites de la fente sont plus difficiles à observer si cette projection est faite sur la papille elle-même) et ajustée à la hauteur papillaire grâce à la molette du vernier permettant d’allonger ou de raccourcir cette fente. La hauteur en millimètres et dixièmes de millimètre se lit sur le vernier habituellement situé au-dessus de la molette (fig. 9-32 et 9-33).
Seul le canal scléral doit être considéré comme limite de la papille, en excluant les zones d’atrophie péripapillaire qui fausseraient la mesure.

Fig. 9-32 La mollette permet de régler la hauteur de la fente lumineuse (a), et le vernier indique cette hauteur en millimètres et dixièmes de millimètre (ici 1,75 mm) (b).
Fig. 9-33 La hauteur de la fente lumineuse, placée latéralement, est ajustée à la hauteur de la papille : le vernier indique une hauteur de 2,0 mm.
Il faut corriger cette valeur lue sur le vernier d’un coefficient de magnification (inverse du facteur de multiplication) dépendant à la fois de la puissance et du matériau du verre utilisé et, plus théoriquement, de la distance verre-cornée. Attention : les fortes amétropies peuvent induire des erreurs dans ces mesures, qui ne sont applicables avec fiabilité qu’entre – 8 et + 8 dioptries [16]. Ces coefficients sont présentés dans le tableau suivant (tableau 9-3). Ils varient parfois pour un verre donné suivant le matériau, le fabricant et les auteurs.
Ainsi, lorsque le vernier indique une hauteur de 1,6 mm en utilisant un verre de Volk de 78 D (facteur de multiplication de 1,11), cela signifie que la hauteur réelle de la papille est de 1,78 mm. Elle sera de 2,40 mm avec le verre Superfield de Volk (facteur de 1,5), mais seulement de 1,58 mm avec le V4M de Zeiss (facteur de 0,98).
Plus les verres sont puissants, et plus la taille réelle de la papille est donc sous-estimée. Ce calcul peut paraître fastidieux, mais les ophtalmologistes ont l’habitude d’utiliser les mêmes verres d’examen et peuvent, avec un peu d’expérience, évaluer immédiatement la taille approximative de la papille sans faire chaque fois ce calcul fastidieux. L’eTableau 9-1 fournit précisément le diamètre réel de la papille en fonction de la valeur lue à la lampe à fente et du verre utilisé.
Tableau 9-3 Facteurs de multiplication à appliquer selon la lentille d’examen.

eTableau 9-1 Conversion de la taille de la papille mesurée à la lampe à fente en fonction du verre utilisé.
Elle n’est pas si loin l’époque où le diamètre de la papille était considéré comme une unité de mesure du fond d’œil : quelle erreur ! En réalité, la taille de la papille est très variable d’un individu à l’autre, comme cela a été longuement présenté dans le chapitre 6. Les résultats des différentes publications ont évolué avec l’augmentation de la précision des outils de mesure, et les diamètres « de 1 à 1,5 mm » [6] qui furent longtemps admis paraissent aujourd’hui très sous-estimés.
Parmi de très nombreuses études, redonnons les résultats des travaux de Jonas et Gusek [14], dont il faut saluer l’apport considérable dans la connaissance de ces dimensions papillaires : diamètre vertical moyen de 1,92 ± 0,29 mm et diamètre horizontal moyen de 1,76 ± 0,31 mm pour 457 yeux étudiés chez 361 sujets normaux. Le diamètre de la papille y varie dans un rapport de 1 à près de 3 !
En somme peuvent être considérées comme petite une papille dont le diamètre vertical est égal ou inférieur à 1,5 mm, et grande une papille dont le diamètre vertical est égal ou supérieur à 2,2 mm (fig. 9-34).

Fig. 9-34 Deux papilles non glaucomateuses, avec un même agrandissement photographique. a. Excavation de 7/10 dans une grande papille de diamètre vertical de 2,6 mm. b. Aucune excavation dans une micropapille de diamètre vertical de 0,9 mm.
Ce rapport que l’on doit à Armaly [2] a été décrit dans le chapitre 6. Un C/D horizontal et un C/D vertical peuvent être évalués, mais puisque l’excavation glaucomateuse progresse plus verticalement qu’horizontalement (voir chapitre 10-VI, paragraphe « Biomicroscopie et rétinophotographies »), seul le C/D vertical doit être retenu en pratique. Les excavations en pente douce rendent plus approximative cette évaluation. De la même façon que le diamètre de la papille, le diamètre de l’excavation peut être mesuré à la lampe à fente si l’on souhaite connaître avec précision la valeur de ce rapport, et il est évidemment inutile alors de faire intervenir le facteur de multiplication, commun au disque et à l’excavation.
Un moyen simple d’évaluation biomicroscopique du C/D consiste à partager mentalement la papille en deux moitiés verticales, soit deux fois 5/10, et de compter sur la moitié supérieure puis la moitié inférieure le nombre de cinquièmes d’excavation avant de les additionner (fig. 9-35).
Cela dit, la valeur du C/D n’a en soi aucune valeur diagnostique, et un rapport de 8/10 peut parfaitement ne pas être physiologique si la papille est de grande taille. Elle peut être aussi très approximative dans les excavations en pente douce et/ou peu profonde.
Fig. 9-35 Règle des cinquièmes appliquée à la même papille : 2,5 cinquièmes en haut et 2 cinquièmes en bas d’excavation font 4,5/10 (0,45) de rapport C/D.
Connaissant la hauteur de la papille et le rapport C/D, pour peu que l’excavation et la papille soient assez rondes (ou en faisant la moyenne du diamètre horizontal et du diamètre vertical), la surface de l’anneau neurorétinien pourrait être calculée [1]. Ce calcul risque toutefois d’être peu précis puisque les deux variables de la formule sont d’une part une mesure approximative en dixièmes de millimètre (celui du diamètre vertical papillaire, alors que la papille est rarement ronde), d’autre part une évaluation finalement assez subjective (celle du rapport C/D).
La forme de l’excavation, dont on verra plus loin qu’elle est généralement plutôt ovale et à grand axe vertical dans le GPAO, doit en réalité être comparée à la forme de la papille elle-même… et il est habituel qu’une papille très allongée verticalement soit le siège d’une excavation elle-même à grand axe constitutionnellement vertical (fig. 9-36).
Cette excavation peut physiologiquement être plus ou moins profonde, sans que son importance ait une valeur diagnostique. La lame criblée est d’autant plus visible que cette profondeur est marquée et que l’excavation est grande. Lorsqu’elle est ainsi bien exposée, ses perforations sont habituellement un peu plus larges et visibles en haut et en bas qu’en temporal, mais elles restent relativement petites et rondes chez le sujet normal comparativement au sujet glaucomateux. La récente technologie de l’optique adaptative (voir plus loin paragraphe « Imagerie par optique adaptative ») permet une visualisation extrêmement précise et magnifiée de la lame criblée. Le paquet vasculaire émergeant est lui-même d’autant plus rejeté en nasal que l’excavation, qu’elle soit innée ou pathologique, est large.
Fig. 9-36 Grande papille, de 2,7 mm de diamètre vertical, très allongée verticalement, avec une excavation constitutionnelle à grand axe vertical de 7/10.
L’observation de la largeur de l’anneau neurorétinien et de la régularité de son versant interne est essentielle et doit se faire sur 360°. Lorsque la papille n’est pas dysmorphique (micropapille, dysversion, myopie forte, drusen), la règle mnémotechnique ISNT (inférieur, supérieur, nasal, temporal) s’applique habituellement aux papilles qui présentent une excavation physiologique : l’anneau neurorétinien est plus large en inférieur qu’en supérieur qu’en nasal qu’enfin en temporal (fig. 9-37 et 9-38). La visibilité des capillaires qui le recouvrent est également évaluée.
Fig. 9-37 La règle ISNT est respectée dans ces deux cas de papilles excavées physiologiquement : (a) à 0,45 (papille de la fig. 9-33) et (b) à 0,7.
Fig. 9-38 Règle ISNT non respectée. Si l’ANR est plus mince en supérieur qu’en inférieur, il l’est aussi plus qu’en nasal et qu’en temporal.
L’anneau scléral marque la limite de la papille et est recouvert par les fibres nerveuses rétiniennes (FNR) à leur entrée dans le nerf optique. Il est donc habituel, lorsque ce contingent n’est pas diminué par le glaucome, qu’il soit mal visible à l’examen biomicroscopique. Il suffit pour s’en convaincre de revoir la figure 9-37 de papilles non glaucomateuses, et la figure 9-38 d’une papille glaucomateuse : dans ce dernier cliché, l’anneau scléral est clairement identifiable, plus d’ailleurs en temporal qu’en nasal, là où les FNR disparaissent d’abord chronologiquement. Dans les petites papilles, les FNR sont particulièrement ramassées à l’entrée dans le nerf optique, et le canal scléral est alors impossible à repérer.
Il s’agit d’un vaisseau inconstant, presque toujours une artère, longeant très précisément le rebord interne de l’ANR, en haut ou en bas (parfois au nombre de deux, l’un en haut et l’autre en bas). Il s’observe dans les larges excavations physiologiques (fig. 9-39). C’est un élément précieux de repérage et de surveillance biomicroscopique de l’évolution de l’épaisseur de l’ANR, dont il abandonne le bord interne pour se retrouver dans l’excavation lorsque celle-ci progresse dans le glaucome (« exclusion du vaisseau circum-linéaire ») [12].
Fig. 9-39 Vaisseau circum-linéaire longeant le bord interne et inférieur de l’ANR, dans une papille avec une large excavation physiologique.
Dans 90 % des cas [14], le diamètre de la papille est identique pour les deux yeux d’un même individu (fig. 9-40). Une asymétrie de cette taille entraîne habituellement une asymétrie de l’excavation, plus grande dans la plus grande papille (fig. 9-41). Là encore, la connaissance du diamètre papillaire mesuré pour chaque œil est un élément précieux pour évaluer, dans une première approche, le caractère de l’excavation papillaire.
Fig. 9-40 Symétrie du diamètre papillaire (2,1 mm OD/OG) et symétrie des excavations.
Fig. 9-41 Asymétrie du diamètre papillaire (2,3 mm OD ; 1,9 mm OG) avec asymétrie innée des excavations physiologiques (5/10 OD ; 2/10 OG).
Depuis Armaly [2], il est reconnu que la taille de la papille est un trait héréditaire. Si l’examinateur a la possibilité d’observer et de mesurer les papilles d’un parent, celles-ci peuvent ainsi présenter grossièrement les mêmes caractéristiques de taille que celles du patient. Un faux diagnostic de glaucome pourrait être porté, par exemple, sur la conjonction d’une large excavation chez le patient et de la déclaration d’un glaucome chez sa mère… alors que cette dernière n’avait en réalité qu’une large excavation physiologique considérée comme glaucomateuse !
Les zones α et β de l’atrophie choriorétinienne péripapillaire [15] (Jonas, 1989), qui peuvent exister aussi bien chez les sujets sains que chez les sujets glaucomateux, ont été largement décrites dans le chapitre 6. La zone α très fréquente (80 % de la population normale) est une zone de pigmentation-dépigmentation irrégulière ; interne à elle, contre le canal scléral, la zone β, plus rare (15 à 20 % de la population normale), correspond à une atrophie de l’épithélium pigmenté et de la choriocapillaire, avec une visualisation accrue des vaisseaux choroïdiens et de la sclère péripapillaire (fig. 9-42). Elles s’observent surtout dans le secteur temporal, mais parfois sur la totalité de la circonférence péripapillaire. La surface augmente avec l’âge et en cas de glaucome. Leur fréquence et leur variabilité rendent toutefois leur analyse peu utile pour distinguer une papille normale d’une papille glaucomateuse, a fortiori dans un œil myope où elles sont quasi constantes.
L’OCT a permis d’individualiser encore deux autres zones dans l’atrophie péripapillaire, non repérables biomicroscopiquement, essentiellement dans des globes très myopes, une zone γ située entre le bord temporal de la papille et le début de la membrane de Bruch et, au centre de celle-ci, une zone δ (delta) [9].
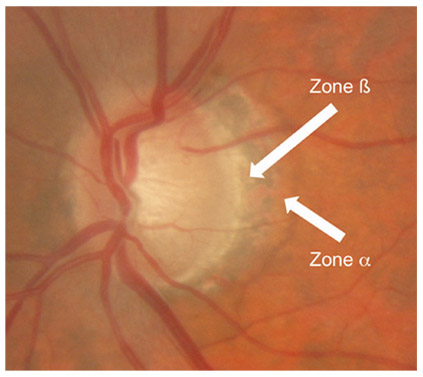
Fig. 9-42 Atrophie péripapillaire, avec l’indication des zones α et β.
Si la papille est clairement examinable à l’examen biomicroscopique, les FNR et, en conséquence, leurs déficits sont très difficilement identifiables avec l’utilisation d’une lumière blanche. En revanche, FNR et déficits sont parfois repérables en utilisant un filtre anérythre (en d’autres termes, éliminant le rouge) ou un filtre vert, car les faibles longueurs d’onde sont réfléchies par les couches superficielles de la rétine et ne pénètrent pas plus profondément (fig. 9-43). Cette visualisation nécessite toutefois une excellente transparence des milieux oculaires afin de bénéficier d’un fort contraste ; elle est impossible lorsque le fond d’œil est peu pigmenté et difficile chez le sujet jeune en raison de la forte réflectivité de la limitante interne.
Fig. 9-43 Observation d’un fond d’œil normal en lumière anérythre. Les FNR sont discrètement visibles en supérieur et en inférieur.
Ils seront largement précisés dans les chapitres 10-VI et 11-I, mais de l’observation biomicroscopique découle souvent une première estimation de l’atteinte ou non de la tête du nerf optique.
Il faut considérer comme suspects :
-
une excavation dans une petite papille ;
-
une petite papille même non excavée, dès lors que d’autres éléments cliniques sont évocateurs de glaucome ;
-
une asymétrie des excavations alors que le diamètre papillaire est le même d’un œil à l’autre ;
-
le non-respect de la zone ISNT sur une papille non dysmorphique ;
-
une encoche localisée de l’anneau neurorétinien, au pire sa rupture ;
-
une exclusion d’un apparent vaisseau circum-linéaire ;
-
une hémorragie papillaire ou péripapillaire ;
-
un déficit localisé visible des FNR en lumière anérythre.
En l’absence de techniques photographiques, a fortiori d’analyseurs du disque optique, la réalisation d’un dessin précis de la papille est toujours utile pour suivre un patient glaucomateux… ou susceptible de l’être.
Cela peut se faire à main levée sur une fiche d’observation (fig. 9-44), ou grâce à une tablette graphique reliée à un ordinateur.
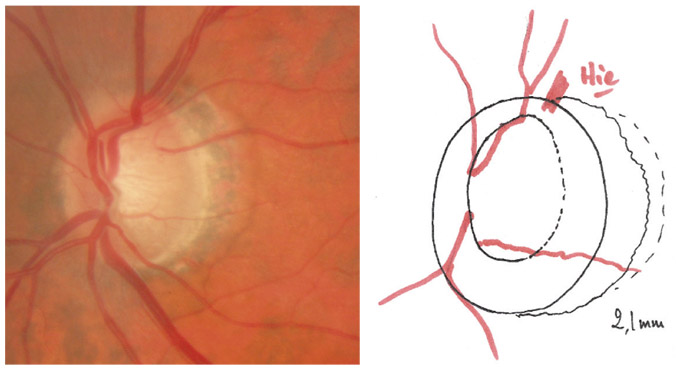
Fig. 9-44 Dessin à main levée de la papille, indiquant en particulier l’hémorragie (Hie) papillaire en temporal supérieur, les vaisseaux pouvant servir de repérage ultérieur pour évaluer une éventuelle augmentation de l’excavation, et l’atrophie péripapillaire.
Le diamètre de la papille en est une première, lorsque l’observateur n’a pas pris soin de s’assurer que cette dimension n’est pas « hors normes » : les grandes papilles ont souvent de larges excavations qui peuvent être considérées comme glaucomateuses, et les petites papilles ne s’excavent que tardivement dans l’évolution du glaucome. Par ailleurs, certaines papilles ont tendance à peu se creuser, constitutionnellement ou pathologiquement, avec une excavation en pente très douce dont les limites sont difficilement identifiables.
Les plus grandes difficultés d’interprétation concernent les papilles en dysversion, les papilles avec des drusen et les papilles des globes fortement myopes, car tous les autres tests actuellement disponibles peuvent aussi y être pris en défaut pour évaluer la présence concomitante d’une atteinte glaucomateuse. Ces problèmes seront évoqués dans le chapitre 10-VI, paragraphe « Biomicroscopie et rétinophotographies ».
La confrontation avec l’ensemble des éléments cliniques ou paracliniques pouvant être recueillis est, plus que jamais, primordiale à l’heure de poser – ou non – un diagnostic de glaucome.
Retenir
-
L’examen de la tête du nerf optique doit impérativement se faire en vision binoculaire. Il comporte systématiquement la mesure biomicroscopique de son diamètre, l’évaluation de l’excavation et du C/D, l’analyse précise circonférentielle de l’anneau neurorétinien et la recherche de signes d’atteinte glaucomateuse.
-
Les grandes papilles sont habituellement le siège d’une grande excavation physiologique, et les petites papilles ne se creusent que tardivement dans l’évolution du glaucome.
-
Les dysversions papillaires, la myopie forte et la présence de drusen papillaires peuvent compliquer singulièrement cette interprétation.
-
La visibilité des FNR est médiocre à l’observation biomicroscopique, même si l’utilisation d’un filtre anérythre l’améliore.
[1] Airaksinen JP, Drance ST, Schultzer M. Neuroretinal rim area in early glaucoma. Am J Ophthalmol. 1985 ; 99 : 1-4.
[2] Armaly MF. Genetic determination of cup/disc ratio of the optic nerve. Arch Ophthalmol. 1967 ; 78 : 35-43.
[3] Bechetoille A. Glaucomes. Angers, Japperenard, 1987, 488 pages.
[4] Bengtsson B. The variation and covariation of cup and disc diameters. Acta Ophthalmol (Copenh). 1976 ; 54 : 804-18.
[5] Beuchat L, Safran AB. Optic nerve hypoplasia : papillary diameter and clinical correlation. J Clin Neuroophthalmol. 1985 ; 5 : 249-53.
[6] Bonamour G, Bregeat P, Bonnet M, Juge P. La papille optique. Paris, Masson, 1968, 531 pages.
[7] Caprioli J, Klingbeil U, Sears M, Pope B. Reproducibility of optic disc measurements with computerized analysis of stereoscopic video images. Arch Ophthalmol. 1986 ; 104 : 1035-9.
[8] Caprioli J, Miller JM. Optic disc rim area is related to disc size in normal subjects. Arch Ophthalmol. 1987 ; 105 : 1683-5.
[9] Dai Y, Jonas JB, Huang H, et al. Microstructure of parapapillary atrophy : beta zone and gamma zone. Invest Ophthalmol Vis Sci. 2013 ; 54 : 2013-8.
[10] Franceschetti A, Bock RH. Megalopapilla ; a new congenital anomaly. Am J Ophthalmol. 1950 ; 33 : 227-35.
[11] Goldmann H. Optique géométrique. In : Bussaca A, Goldmann H, Schiff-Wertheimer S (eds). Biomicrocopie du corps vitré et du fond de l’œil. Rapport SFO 1957. Paris, Masson, 1957 : 29-72 et 344.
[12] Herschler J, Osher RH. Baring of the circumlinear vessel. An early sign of optic nerve damage. Arch Ophthalmol. 1980 ; 98 : 865-9.
[13] Jaeger E. Ueber Staar und Staaroperationen. Vienne, LW Seidel, 1854.
[14] Jonas JB, Gusek GC, Guggenmoos-Holzmann I, Naumann GO. Variability of the real dimensions of normal human optic discs. Graefes Arch Clin Exp Ophthalmol. 1988 ; 226 : 332-6.
[15] Jonas JB, Nguyen XN, Gusek GC, Naumann GO. Parapapillary chorioretinal atrophy in normal and glaucoma eyes. I. Morphometric data. Invest Ophthalmol Vis Sci. 1989 ; 30 : 908-18.
[16] Jonas JB, Papastathopoulos K. Ophthalmoscopic measurement of the optic disc. Ophthalmology. 1995 ; 102 : 1102-6.
[17] Lejeune-Sellem S. Contribution à la reconnaissance des excavations physiologiques de la papille. Thèse de médecine, université Claude-Bernard (Lyon), 1989, 67 pages.
[18] Lim CS, O’Brien C, Bolton NM. A simple clinical method to measure the optic disc size in glaucoma. J Glaucoma. 1996 ; 5 : 241-5.
[19] Pey C. Calcul assisté par ordinateur de la surface de l’anneau neurorétinien. Diagnostic précoce et surveillance du glaucome primitif à angle ouvert. Bull Soc Ophtalmol Fr. 1990 ; 90 : 795-800
[20] Reeves C, Taylor D. A history of the optic nerve and its diseases. Eye. 2004 ; 18 : 1096-09.
[21] Ruben S. Estimation of optic disc size using indirect biomicroscopy. Br J Ophthalmol. 1994 ; 78 : 363-4.
[22] Sellem E, Sellem S. L’indice papillaire, apport à la reconnaissance des excavations physiologiques. Bull Soc Ophtalmol Fr. 1990 ; 90 : 801-4.
[23] Tuulonen A, Airaksinen J, Schwartz B, et al. Neuroretinal rim area measurements by configuration and by pallor in ocular hypertension and glaucoma. Ophthalmology. 1992 ; 99 : 1111-6.
[24] Von Graefe A. Vorläufige Notize über das Wesen des Glaucoms. Arch Ophthalmol 1854 ; 1.
S. Carette, H. Lemij, M. Puech, J.-P. Renard, J.-F. Rouland, E. Sellem
M. Puech, M. Streho
-
L’imagerie de l’angle iridocornéen dans le cadre du glaucome primitif à angle ouvert (GPAO) permet de compléter l’exploration gonioscopique par des images en coupe de l’angle qui donnent une vision complémentaire des différentes structures anatomiques.
-
L’angle iridocornéen est accessible par UBM et OCT.
-
La visualisation en coupe de toutes les composantes anatomiques de l’angle iridocornéen permet à l’imagerie de l’angle des analyses fines sur l’aspect et la position des différentes structures de l’angle ainsi qu’une analyse dynamique.
L’imagerie de l’angle iridocornéen (AIC) présente l’avantage d’une imagerie en coupe qui vient compléter l’analyse de l’angle par gonioscopie. Cette dernière donne une visualisation en secteurs d’arc de l’angle iridocornéen avec un abord direct de la coloration de l’angle permettant d’identifier les différents critères d’ouverture de l’angle.
L’imagerie en coupe par UBM (échographie), OCT (infrarouge) ou Scheimpflug camera (principe photographique) donne un abord différent de l’angle par rapport à la gonioscopie en améliorant l’analyse des rapports anatomiques entre les différentes composantes de l’angle.
L’imagerie par Scheimpflug camera est un système très performant pour l’analyse de coupes de tout le segment antérieur mais la réflectivité importante de la lumière sur la sclère sature souvent les images au niveau de l’AIC, rendant souvent difficile la reconnaissance de l’éperon scléral.
L’analyse de l’angle par UBM et OCT bénéficie d’avantages techniques et de limites qui les rendent souvent complémentaires [2].
Cette technique décrite par Charles Pavlin dans les années 1990 utilise les ultrasons de très haute fréquence (35 à 50 MHz) de façon à obtenir des images en coupe de l’angle iridocornéen ou de tout le segment antérieur sans limitation de pénétration [6]. Les contours et la position des procès ciliaires sont ainsi toujours identifiables.
L’examen par UBM est réalisé en position allongée avec positionnement de la sonde ultrasonore en suspension sur un gel de contact soit en regard des différents méridiens, soit en regard de l’apex cornéen pour obtenir des images en coupe de tout le segment antérieur.
Pour l’analyse de l’angle, la perpendicularité à la cornée et au cristallin permet d’attester de coupes méridiennes strictes avec reconnaissance de l’éperon scléral et visualisation des procès ciliaires (fig. 9-45).
Plusieurs techniques de mesure de l’ouverture de l’AIC ont été décrites, comme l’ouverture angulaire, la profondeur de la chambre antérieure à 500 ou 750 microns de l’éperon scléral, la surface comprise entre la cornée et l’iris au niveau de l’angle. Tous ces éléments numériques peuvent être utiles dans l’appréciation du risque de glaucome par fermeture de l’angle mais sont moins pertinents en matière de GPAO [1].
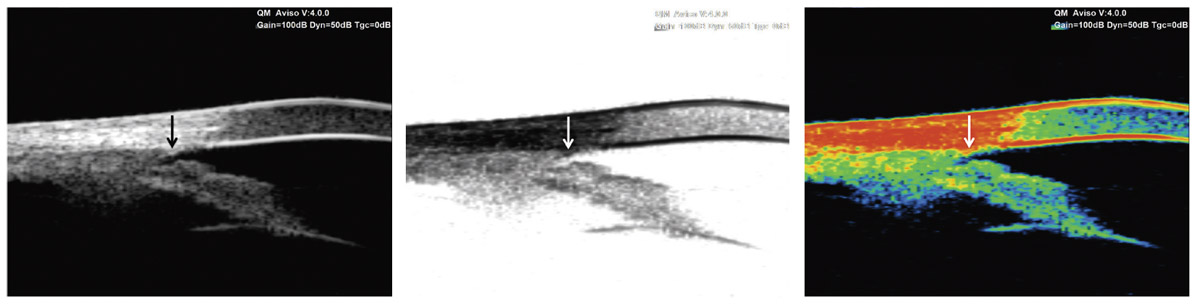
Fig. 9-45 Coupe d’un angle iridocornéen ouvert avec visualisation de l’éperon scléral comme repère anatomique (flèche). L’espace entre la cornée et l’iris (profondeur de chambre antérieure en périphérie) est nettement visible. Notez les différents filtres permettant une meilleure visualisation de l’éperon scléral.
Les coupes d’angle iridocornéen permettent l’appréciation de l’ouverture de l’angle et de ses variations anatomiques. L’aspect le plus couramment observé est caractérisé par une légère convexité de l’iris vers l’avant, une insertion de la racine de l’iris en arrière de l’éperon scléral, celui-ci étant reconnu sous la forme d’un léger promontoire hyperéchogène situé à l’intersection de la courbure de la sclère et de la face postérieure de la cornée [5]. Cet éperon scléral représente le seul repère anatomique stable de l’AIC en fonction des différents stimuli lumineux ou d’accommodation.
L’AIC peut être plus ou moins largement ouvert avec une évolution progressive vers un rétrécissement de l’angle par épaississement du cristallin avec l’âge [3, 9]. Cette évolution peut être corrélée à la flèche cristallinienne et à la profondeur de la chambre antérieure (fig. 9-46).
Un mauvais repérage de l’éperon scléral peut entraîner une appréciation erronée de l’ouverture de l’angle, par exemple en cas de synéchie iridocornéenne qui peut faire mesurer une ouverture angulaire normale alors qu’une apposition de l’iris sur la cornée réalise une fermeture localisée de l’angle masquant le repère de l’éperon scléral (fig. 9-47).
L’ouverture de l’angle peut être plus ou moins importante en fonction des secteurs observés avec la possibilité de voussures de l’iris, le plus souvent sous-tendues par la présence de kystes iridociliaires liquidiens très bien analysés par UBM et plus fréquents dans les secteurs temporal et inférieur (fig. 9-48).
Fig. 9-46 Imagerie en coupe de tout le segment antérieur par OCT-Visante (Zeiss) permettant la mesure de la distance d’angle à angle et de la flèche cristallinienne.
Fig. 9-47 Piège de mesure de l’AIC par mauvaise identification de l’éperon scléral entraînant une mesure d’angle ouvert alors qu’il existe des synéchies iridocornéennes périphériques qui ferment le fond de l’angle (UBM).
Fig. 9-48 Kystes iridociliaires en UBM entraînant un aspect d’angle fermé de façon localisée par appui du kyste liquidien sur la racine de l’iris.
L’imagerie par OCT utilise un faisceau infrarouge de longueur d’onde déterminée de façon à reconstruire des images en coupe des tissus oculaires. Les premières applications ont été décrites par David Huang pour une visualisation de la rétine maculaire à haute résolution [4]. Le principe de reconstruction des images est comparable à celui de l’échographie avec acquisition de lignes d’images basées sur la réflexion du faisceau infrarouge par les différents tissus traversés. Le principe des OCT, fondé sur un faisceau lumineux, présente l’avantage d’une résolution supérieure à l’échographie. Elles sont cependant limitées en pénétration dès que le faisceau infrarouge est arrêté par des tissus opaques (hémorragie, tissus pigmentés, etc.). La visualisation de l’AIC bénéficie ainsi d’une très haute résolution mais avec une absence d’information sur les éléments en arrière de l’iris comme le corps ciliaire.
Les premières images du segment antérieur par OCT ont été réalisées en pratique courante au début des années 2000 [7]. Dans un second temps sont apparus des OCT spécifiquement développées pour le segment antérieur.
Les images de segment antérieur obtenues par ces appareils, focalisés sur le segment antérieur, ont donné des images de très haute résolution très utiles pour l’analyse de la cornée et de l’angle iridocornéen. L’arrivée des appareils en domaine spectral avec une très haute résolution accroît leur intérêt avec une visualisation performante des éléments de l’angle en avant de l’iris (fig. 9-49). La limite de pénétration du faisceau infrarouge est d’autant plus importante que les tissus sont pigmentés (iris bruns) et que la longueur d’onde est plus spécifique de l’exploration de la rétine maculaire. Le développement de ces OCT donne des fenêtres d’exploration en rectangle d’environ 2 mm de profondeur et de largeur variable de 2 à 16 mm pour les plus performants.
La faible profondeur de champ de ces appareils ne leur permet pas d’obtenir une image en coupe de tout le segment antérieur en incluant la cornée et le cristallin.
Fig. 9-49 Imagerie de l’angle par OCT-spectral domain DRI avec une très haute résolution permettant une analyse de réflectivité du trabéculum et une meilleure visualisation des procès ciliaires.
Pour dépasser les limites des OCT de segment postérieur, ces appareils utilisent une longueur d’onde plus élevée (autour de 1 300 nm) améliorant la pénétration au travers du tissu irien et avec une fenêtre d’acquisition de profondeur suffisante pour obtenir des images en coupe de tout le segment antérieur de la cornée au cristallin antérieur avec des coupes d’angle à angle (voir fig. 9-46). Les coupes en large champ permettent une acquisition de tout le segment antérieur avec possibilité de mesures de la profondeur de chambre antérieur et de la distance d’angle à angle ainsi que de la flèche cristallinienne qui peut avoir une importance dans l’appréciation du rôle du cristallin en cas de glaucome.
L’arrivée récente d’OCT en technologie sweep source (balayage de plusieurs longueurs d’onde autour d’une longueur d’onde pivot) permet de nouveaux développements, avec par exemple un abord facilité à la représentation 3D des images du segment antérieur et une meilleure pénétration des tissus (fig. 9-49).
La technique d’examen sans contact des différents OCT représente un avantage avec possibilité de délégation de l’acquisition.
De nombreuses applications se font jour avec la très haute résolution : la visualisation du canal de Schlemm et l’analyse de la réflectivité du trabéculum en cas de glaucome ouvrent la voie à une nouvelle sémiologie de l’angle inaccessible avec les images de résolution inférieure (fig. 9-50).
Un GPAO peut être qualifié par des coupes en OCT ou UBM.
La réflectivité du trabéculum peut être observée en cas de glaucome et nous ouvre un champ d’investigation nouveau (voir fig. 9-49).
L’observation de l’AIC par imagerie en coupe devient complémentaire de l’examen par goniosocopie avec une approche par OCT et UBM, permettant ainsi de compléter le bilan dans certaines situations cliniques en particulier en cas d’AIC étroit avec suspicion de glaucome mixte [8].
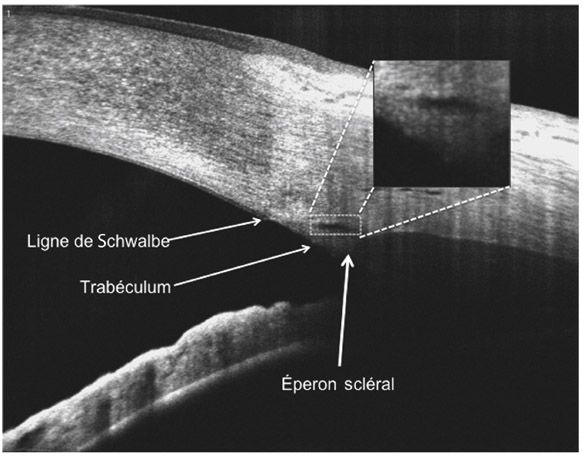
Fig. 9-50 Aspect en très haute résolution d’un angle observé en OCT spectrale avec visualisation du canal de Schlemm.
Retenir
-
L’imagerie de l’angle iridocornéen en cas de GPAO passe par l’exploration avec les UBM et les OCT récents, ces derniers offrant la meilleure résolution d’analyse en technique sans contact.
-
L’imagerie par UBM bénéficie de la meilleure pénétration des ultrasons en arrière de l’iris.
-
L’imagerie par OCT peut être réalisée soit par des OCT dédiées au segment antérieur avec des coupes entières du segment antérieur, soit par des OCT de segment postérieur focalisées sur l’angle avec une très haute résolution d’analyse en OCT spectrale, mais avec une fenêtre limitée à la visualisation d’un seul angle et une limitation de la visibilité du corps ciliaire.
[1] Dada T, Sihota R, Gadia R, et al. Comparison of anterior segment optical coherence tomography and ultrasound biomicroscopy for assessment of the anterior segment. J Cataract Refract Surg. 2007 ; 33 : 837-40.
[2] Fénolland JR, Puech M, Baudouin C, Labbé A. [Imaging of the iridocorneal angle in glaucoma]. J Fr Ophtalmol. 2013 ; 36 : 378-83.
[3] Ku JY, Nongpiur ME, Park J, et al. Qualitative evaluation of the iris and ciliary body by ultrasound biomicroscopy in subjects with angle closure. J Glaucoma. 2013.
[4] Memarzadeh F, Li Y, Francis BA, et al. Optical coherence tomography of the anterior segment in secondary glaucoma with corneal opacity after penetrating keratoplasty. Br J Ophthalmol. 2007 ; 91 : 189-92.
[5] Nonaka A, Iwawaki T, Kikuchi M, et al. Quantitative evaluation of iris convexity in primary angle closure. Am J Ophthalmol. 2007 ; 143 : 695-7.
[6] Pavlin CJ, Harasiewicz K, Sherar MD, Foster FS. Clinical use of ultrasound biomicroscopy. Ophthalmology. 1991 ; 98 : 287-95.
[7] Puech M, El Maftouhi A. [OCT3 exploration of anterior segment]. J Fr Ophtalmol. 2004 ; 27 : 459-66.
[8] Radhakrishnan S, Goldsmith J, Huang D, et al. Comparison of optical coherence tomography and ultrasound biomicroscopy for detection of narrow anterior chamber angles. Arch Ophthalmol. 2005 ; 123 : 1053-9.
[9] Salcan I, Aykan U, Yildirim O, Kanik A. Quantitative ultrasound biomicroscopy study of biometry of the lens and anterior chamber. Eur J Ophthalmol. 2012 ; 22 : 349-55.
E. Sellem
-
Intérêt des clichés de papilles et des fibres nerveuses rétiniennes avec un rétinographe non mydriatique.
-
Pour la papille, avantage de la stéréoscopie.
-
Repérage des signes d’altérations glaucomateuses inaperçues à l’examen biomicroscopique direct, et parfois par les analyseurs.
-
Les techniques anciennes de planimétrie, mesurant les surfaces papillaires, ont perdu leur intérêt avec le développement des analyseurs.
-
Les photographies noir et blanc conventionnelles, de réalisation difficile, sont caduques depuis que les rétinographes non mydriatiques fournissent immédiatement des photographies en couleurs dans lesquelles les éventuels déficits de fibres nerveuses rétiniennes sont aussi facilement identifiables.
Quelle que soit la qualité des dessins de la papille que l’ophtalmologiste peut faire sur papier ou tablette graphique, ils ne représenteront jamais un document d’une précision parfaite. En particulier, lorsque les pentes de l’excavation sont douces, ses limites réelles ne peuvent être évaluées et donc tracées exactement. Par exemple, un observateur dessine une excavation à 4/10 et, deux ans après, à 5/10 : il considère donc que le glaucome progresse… alors que cela peut ne pas être le cas ! A fortiori, cette remarque concerne l’évolution des appréciations chiffrées du rapport C/D (cup/disc), et de lui seul, sans aucun dessin.
Les rétinophotographies sont donc extrêmement utiles, pour ne pas dire essentielles, dans une consultation de glaucome, car elles peuvent repérer des signes objectifs ignorés jusqu’à présent par l’observation biomicroscopique (comme un déficit fasciculaire de fibres nerveuses rétiniennes)… et même par les analyseurs les plus sophistiqués (les hémorragies de la papille en sont une démonstration parfaite). Elles peuvent aussi redresser des erreurs de diagnostic lorsque l’observation directe de la papille a été rapide ou difficile. Ainsi, exemple parmi d’autres, une dysversion papillaire marquée peut s’accompagner de déficits périmétriques pseudo-glaucomateux tout en perturbant considérablement les résultats des analyseurs.
De nombreux cabinets d’ophtalmologie se sont équipés ces dernières années d’un rétinographe non mydriatique (RNM), essentiellement monoscopique, en raison de son coût relativement modeste et des améliorations techniques qui fournissent des clichés d’excellente qualité. Cet appareil devient pratiquement indispensable, à portée de la lampe à fente, non seulement pour les problèmes de glaucome, mais aussi pour de nombreuses autres pathologies affectant le fond d’œil (maculopathies, rétinopathie diabétique et son dépistage, surveillance d’une lésion pigmentée, etc.). Le temps de l’argentique est définitivement révolu ; il obligeait souvent à multiplier les clichés et, surtout, à attendre les délais de développement ne permettant pas, immédiatement, d’aider à conforter ou d’infirmer un diagnostic.
Ces photographies numériques peuvent être très agrandies et éventuellement découpées (« rognées ») pour n’en conserver que la partie essentielle (la plupart des clichés présentés dans cet ouvrage ont été traités ainsi).
Elles sont transférables dans les dossiers informatisés des patients, et leur comparaison – de consultation en consultation – en est ainsi facilitée. Elles peuvent être remises sur papier, sur une clé USB ou un CD-rom, ou même envoyées au patient comme au correspondant éventuel par Internet.
Dans une grande majorité de cas, la dilatation irienne n’est pas nécessaire pour faire ces clichés, mais l’ouverture de la pupille doit être de 3 mm au moins. Ils doivent être pris dans l’obscurité, et il faut attendre 10 à 20 secondes – parfois plus – pour photographier le second œil, afin que le myosis bilatéral déclenché par le réflexe photomoteur disparaisse. Il peut d’ailleurs être conseillé, en cas de glaucome très évolué d’un seul côté, de photographier cet œil en premier, car l’intensité du réflexe photomoteur sera atténuée.
En pratique, une photographie couleur avec un champ de 15° (et une fixation inter-maculo-papillaire) donne un grossissement excellent pour évaluer finement les structures de la tête du nerf optique. Un champ de 30° peut y être associé, permettant l’observation de l’environnement péripapillaire élargi à un large champ rétinien, où les possibles déficits de fibres nerveuses rétiniennes (FNR) sont repérables sur tout leur trajet (fig. 9-51).
Même en l’absence de troisième dimension, la position des vaisseaux et leurs coudures par rapport à l’anneau neurorétinien, ainsi que la modification éventuelle de leur cheminement dans le temps, sont des éléments précieux pour le diagnostic positif et évolutif (fig. 9-52). L’excellente résolution habituelle permet de repérer de petites hémorragies papillaires ou parapapillaires qui seraient passées inaperçues à l’examen biomicroscopique, et qui ne pourront jamais être révélées par les analyseurs actuellement disponibles. La confrontation avec les clichés antérieurs ou ultérieurs permet souvent ce repérage a posteriori lorsqu’une hémorragie très petite avait été ignorée lors de l’observation d’un cliché isolé (fig. 9-53).
Fig. 9-51 Fond d’œil gauche avec une petite papille glaucomateuse. a. Champ de 30°. b. Champ de 45° permettant de mieux analyser le déficit temporal inférieur des FNR et sa topographie.
Fig. 9-52 Papille droite. Quatre ans se sont écoulés entre les deux. La constitution d’une excavation glaucomateuse (b) est facilement identifiable grâce au déplacement des vaisseaux dans la portion inférieure de la papille.
Fig. 9-53 Photographies d’une papille gauche glaucomateuse. a. Il existe une petite hémorragie sur l’anneau scléral à 7 heures, qui n’avait pas été repérée lors de l’observation de ce premier cliché. C’est la confrontation avec le cliché (b) – où elle a disparu –, pris six mois plus tard, qui permet de la découvrir finalement a posteriori.
Selon l’appareillage, deux techniques permettent de réaliser des clichés stéréoscopiques de la papille, une dilatation pupillaire étant le plus souvent nécessaire :
-
soit séquentiellement, avec un RNM monoscopique, obtenu par un petit décalage spatial latéral de l’objectif pour la seconde prise de vue immédiatement faite après la première [12], ou en utilisant un séparateur stéréoscopique d’Allen ;
-
soit une prise simultanée d’une paire d’images, avec des appareils spéciaux équipés de prismes pour répartir les rayons, comme le Topcon Imagenet System™ [4]. Les appareils sont en perpétuel renouvellement, et d’autres constructeurs proposent ce type d’appareillage (Canon, Nidek, Kowa, etc.) ;
Les appareils à prise simultanée donnent des clichés de meilleure qualité stéréoscopique pour évaluer les reliefs et les éventuelles modifications de la papille. En fonction de la méthode utilisée, les clichés sont observés :
-
sur une feuille de développement photographique, avec les deux images placées dans un seul cadre, et la 3e dimension est obtenue par l’observateur en chaussant des lunettes fortement prismées ;
-
dans une jumelle (stereo viewer), un cliché par oculaire (fig. 9-54) ;
-
dans les modèles les plus récents, sur l’écran de l’ordinateur avec le port de lunettes polarisées (fig. 9-55).
Le procédé des anaglyphes a pu être également proposé. Il fonctionne avec un rétinographe ad hoc et une lunette équipée de deux filtres de couleurs différentes mais complémentaires (rouge, et vert ou cyan) disposés devant chacun des yeux. Si le relief est rendu correctement, les couleurs perdent en qualité, puisque les clichés décalés ont été pris au travers d’un filtre coloré différent d’un œil à l’autre (fig. 9-56).
Tous ces appareils de prise stéréoscopique sont peu répandus en France compte tenu de leur coût, de la concurrence des analyseurs et des procédés d’observation qui peuvent ne pas être immédiatement utilisables lorsque les clichés doivent être développés. Toutefois, de nombreuses publications étrangères en font mention et, par exemple, la large étude prospective américaine Ocular Hypertension Treatment Study (OHTS) et l’European Glaucoma Prevention Study (EGPS) avaient évalué l’état papillaire par l’examen de clichés stéréoscopiques. Il est évident que l’analyse des pentes et de la profondeur de l’excavation est plus précise avec les clichés stéréoscopiques que monoscopiques. Les directives de sociétés savantes comme l’European Glaucoma Society ou l’American Academy of Ophthalmology recommandent vivement l’utilisation de la stéréophotographie pour le diagnostic et la surveillance du glaucome, particulièrement lorsque celui-ci est à un stade précoce ou modéré. Toutefois, l’interprétation en reste éminemment subjective aussi bien pour l’évaluation papillaire – comme cela a été démontré dans l’EGPS (la reproductibilité intra-observateur y variait de 0,79 à 1,00 et interobservateur de 0,45 à 0,75, avec trois examinateurs de la papille pourtant très expérimentés !) [13] – que pour repérer une progression de l’excavation [7].
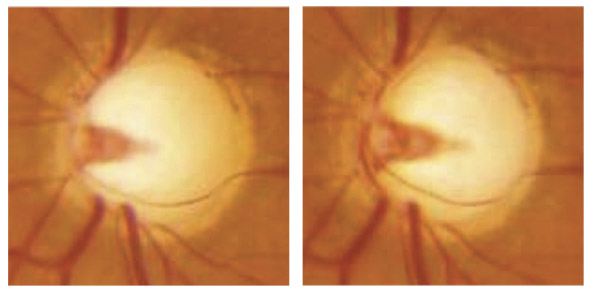
Fig. 9-54 Clichés stéréoscopiques pris simultanément. La diapositive est insérée dans un stereo viewer pour observer la papille en trois dimensions (rétinographe 3DX® Nidek). (Avec l’aimable autorisation d’Y. Lachkar.)
Fig. 9-55 Clichés stéréoscopiques sur écran, à partir de deux prises décalées, et examinés avec une lunette polarisée (Rétinographe Visucam®). (Avec l’aimable autorisation de Zeiss.)
Fig. 9-56 Anaglyphe d’une papille normale. (Avec l’aimable autorisation de R. Susanna.)
Les techniques de planimétrie ont permis, dans les années 1980, de connaître avec précision les valeurs des surfaces du disque optique et de l’anneau neurorétinien, et leurs variations interindividuelles [3, 8]. Elles demeurent, dans de nombreuses études, un élément standard de référence pour l’étalonnage des analyseurs papillaires.
La mesure de ces surfaces a longtemps été faite sur des clichés papier grâce à l’utilisation d’un planimètre d’architecte [2], sur des diapositives projetées [8] ou sur l’écran d’un ordinateur avec une palette graphique comme la méthode proposée par Béchetoille (« Disc-Data ») ou d’autres [5, 6, 11]. Ces techniques étaient relativement fastidieuses et finalement approximatives, ne serait-ce qu’à cause des problèmes fréquemment posés par le repérage du bord interne de l’anneau neurorétinien. Il fallait de surcroît corriger la surface mesurée de plusieurs facteurs dépendant à la fois du rétinographe utilisé, du format de développement et de paramètres géométriques propres à l’œil photographié (courbure de la cornée, réfraction, éventuellement longueur axiale) [9].
Les analyseurs modernes du fond d’œil rendront probablement caduques toutes ces techniques de mesure des paramètres papillaires à partir des clichés rétinographiques. Cela dit, de nombreux appareillages numériques actuels ont incorporé des logiciels permettant la mesure des surfaces papillaires, mais le tracé de leurs limites doit toujours être fait manuellement par l’observateur. Des tentatives d’amélioration de la définition du bord interne de l’anneau neurorétinien, afin de supprimer les erreurs de parallaxe, font appel à des curseurs qui se déplacent dans la profondeur de l’image stéréoscopique [10].
Pendant longtemps, les photographies conventionnelles de la couche des FNR étaient faites selon une procédure stricte concernant le film et le filtre à utiliser, ainsi que le développement des clichés. Les RNM numériques fournissent aujourd’hui, immédiatement, des images d’une qualité équivalente, voire meilleure.
Avant l’ère des analyseurs, ces clichés eurent leur heure de gloire : ils étaient le seul moyen d’affirmer une perte localisée de FNR que l’observation biomicroscopique n’arrivait pas à repérer, et alors que le relevé du champ visuel pouvait être encore normal [1]. La prise de clichés rétiniens nécessitait alors une dilatation pupillaire et les exigences techniques étaient les suivantes [3] : film noir et blanc à basse sensibilité (100 ASA), filtre bleu-vert avec une longueur d’onde comprise entre 450 et 510 nm (car les faibles longueurs d’onde sont réfléchies par les couches superficielles de la rétine et ne pénètrent pas plus profondément), angle large et contraste poussé au maximum au moment du développement. Avec cette technique rigoureuse, la papille n’était cependant pas nettement observable (fig. 9-57).
Fig. 9-57 Photographie argentique en noir et blanc, avec un filtre de 490 nm. Déficits « peignés » en temporal supérieur, et plus large déficit en temporal inférieur. Les structures papillaires ne sont pas analysables.
Les RNM, avec des clichés en couleurs, un système d’autofocalisation et l’obtention immédiate de la photographie sur l’écran de l’ordinateur, où la papille est par ailleurs finement analysable, ont complètement détrôné cette technique ancienne.
Dans un œil normal, les faisceaux de FNR supérieurs et inférieurs sont plus ramassés et épais. Ils sont clairement identifiables sur les clichés : plus clairs et brillants que dans les autres secteurs rétiniens. Ils correspondent aux deux « bosses » que l’on observe sur le déroulé des analyseurs indiquant l’épaisseur de la couche des FNR parapapillaires. Il ne faut donc pas considérer que, de part et d’autre de ceux-ci, en nasal particulièrement et dans la zone inter-papillo-maculaires, les zones plus sombres correspondent obligatoirement à des déficits (fig. 9-58). Les déficits des FNR seront décrits dans le chapitre 10-VI, paragraphe « Biomicroscopie et rétinophotographies ».
La présence d’un épithélium pigmenté rétinien présent et suffisamment dense est nécessaire pour mettre en évidence les FNR sur les photographies. Ainsi, les fonds d’œil des forts myopes ou des sujets albinos ne permettent pas leur observation (fig. 9-59). Les milieux traversés doivent être suffisamment transparents : la présence d’une cataracte peut faire croire à tort à une perte diffuse. Par ailleurs, chez les sujets jeunes de moins de 20 ans, la brillance de la limitante interne peut considérablement perturber cette analyse (fig. 9-60).
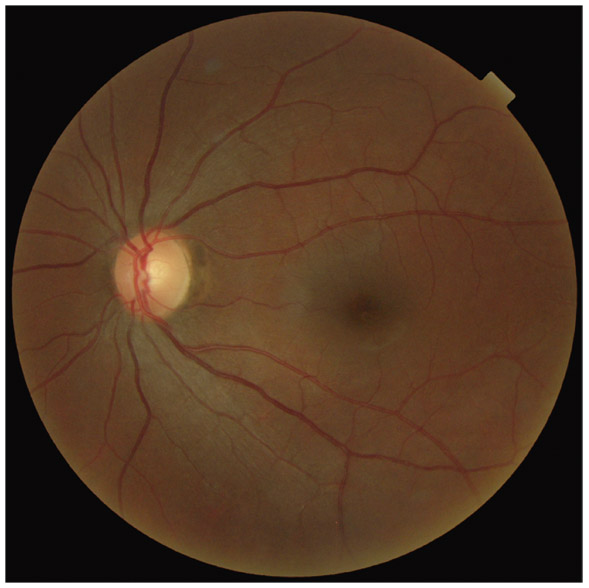
Fig. 9-58 Fond d’œil normal, sans déficit des FNR. Elles sont plus ramassées dans le champ rétinien parapapillaire supérieur et inférieur, et moins repérables en nasal et dans la région intra-papillo-maculaire.
Fig. 9-59 Myopie forte, avec une atrophie de l’épithélium pigmenté rétinien, empêchant l’observation des FNR.
Fig. 9-60 Fond d’œil droit d’une jeune fille de 15 ans. La brillance de la limitante interne masque la visibilité correcte des FNR.
Retenir
-
Les rétinographes non mydriatiques numériques sont des instruments très précieux pour le diagnostic et le suivi du GPAO, entre autres pathologies oculaires.
-
Ils ont détrôné les appareils avec un film argentique.
-
Ils fournissent des images en couleur d’excellente qualité, immédiatement exploitables.
-
Pour la papille, ils peuvent révéler des signes passés inaperçus à l’examen biomicroscopique, en particulier des petites hémorragies que ne peuvent retrouver les analyseurs actuels.
-
Idéalement, des clichés stéréoscopiques de la papille devraient être pris, mais ils nécessitent des rétinographes spécifiques et un protocole d’observation qui limitent leur utilisation en pratique clinique.
-
Les clichés permettant l’observation des FNR ne nécessitent plus de protocole rigoureux, obligatoire autrefois avec les appareils à film argentique et non mydriatiques.
[1] Airaksinen PJ, Drance SM, Douglas GR, et al. Diffuse and localized nerve fiber loss in glaucoma. Am J Ophthalmol. 1984 ; 98 : 566-71.
[2] Airaksinen PJ, Drance SM, Schulzer M. Neuroretinal rim area in early glaucoma. Am J Ophthalmol. 1985 ; 99 : 1-4.
[3] Airaksinen PJ, Nieminen H. Retinal nerve fiber layer photography in glaucoma. Ophthalmology. 1985 ; 92 : 877-9.
[4] Azuara-Blanco A, Katz LJ, Spaeth GL, et al. Detection of changes of the optic disc in glaucomatous eyes : clinical examination and image analysis with the Topcon Imagenet system. Acta Ophthalmol Scand. 2000 ; 78 : 647-50.
[5] Bechetoille A. Glaucomes. Angers, Japperenard, 1987, 488 pages.
[6] Caprioli J, Klingbeil U, Sears M, Pope B. Reproducibility of optic disc measurements with computerized analysis of stereoscopic video images. Arch Ophthalmol. 1986 ; 104 : 1035-9.
[7] Jampel HD, Friedman D, Quigley H, et al. Agreement among glaucoma specialists in assessing progressive discs changes from photographs in open angle glaucoma patients. Am J Ophthalmol. 2009 ; 147 : 39-44.
[8] Jonas JB, Gusek GC, Guggenmoos-Holzmann I, Naumann GO. Variability of the real dimensions of normal human optic discs. Graefes Arch Clin Exp Ophthalmol. 1988 ; 226 : 332-6.
[9] Littmann H. Determination of the true size of an object on the fundus of the living eye. D’après H. Littmann dans son article original : “Zur Bestimmung der wahren Grosse eines Objektes auf dem Hintergrund des lebenden Auges”, publié dans Klinisches Monatsblätter für Augenheilkunde 1982 ; 180 : 286-9. Traduction de T.D. Williams. Optom Vis Sci. 1992 ; 69 : 717-20.
[10] Morgan J, North R, Sheen N. La planimétrie. In : Lester M, Garway-Heath D, Lemij H (eds). Analyse de la tête du nerf optique et des fibres nerveuses rétiniennes (version française). European Galucoma Society. Savona (Italie), Dogma Ed., 2006, 35-9.
[11] Pey C. Calcul assisté par ordinateur de la surface de l’anneau neurorétinien. Diagnostic précoce et surveillance du glaucome primitif à angle ouvert. Bull Soc Ophtalmol Fr. 1990, 90 : 795-800.
[12] Teikari JM, Airaksinen JP. Twin study on cup/disc ratio of the optic nerve head. Br J Ophthalmol. 1992 ; 76 : 218-20.
[13] Zeyen T, Miglior S, Pfeiffer N, et al. European Glaucoma Prevention Study Group. Reproducibility of evaluation of optic disc change for glaucoma with stereo optic disc photographs. Ophthalmology. 2003 ; 110 : 340-4.
H. Lemij, J.-P. Renard, E. Sellem
-
La polarimétrie à balayage laser ou GDx a subi de nombreuses améliorations techniques, permettant de s’affranchir en particulier des problèmes de biréfringence du segment antérieur.
-
Seule l’épaisseur de la couche des fibres nerveuses rétiniennes en parapapillaire est mesurée.
-
Le tracé fournit une grande quantité d’informations et évalue pour chacune d’elles le caractère normal, limite ou pathologique.
-
La commercialisation de la version la plus récente, le GDx PRO™, a été suspendue en 2013.
La polarimétrie à balayage laser confocal a été développée pour permettre d’examiner la couche de fibres nerveuses rétiniennes (FNR) [1]. Le premier appareillage utilisant ce principe a été commercialisé en 1993 (Nerve Fiber Analyzer ou NFA I). L’amélioration des logiciels et l’inclusion d’un compensateur cornéen variable a conduit à la mise au point de générations successives d’analyseurs de plus en plus sophistiqués : le NFA II, le GDx™ (glaucoma diagnostic), le GDx Access™, le GDx VCC™ (variable corneal compensation) et enfin le GDx PRO™. Ce dernier, produit et distribué par Carl Zeiss Meditec (Dublin, Californie, États-Unis), n’est plus commercialisé depuis 2013… De nombreux cabinets en sont toutefois encore équipés : aussi, à ce jour, il est encore important de connaître cette technique d’évaluation de la couche des FNR ainsi que l’interprétation des relevés qui peuvent être présentés par un patient.
La structure radiaire de la couche des FNR et la présence des microtubules intracellulaires des axones en font un tissu biréfringent, c’est-à-dire que la lumière qui le traverse subit un décalage de phase de ses composants orthogonaux. Le total du décalage de phase ou « retard » se rapporte au nombre de microtubules et à leur épaisseur (fig. 9-61). Mesurer ce retard permet d’estimer de façon indirecte l’épaisseur de la couche des FNR dont l’amincissement est l’une des premières manifestations du glaucome [9, 10].
Dans l’œil, la cornée et le cristallin sont également des tissus biréfringents risquant de provoquer de nombreux artéfacts [2, 5]. Afin de corriger le retard individuel du passage par le segment antérieur [6], plusieurs compensateurs ont été mis au point : d’abord fixe, puis variable (VCC). Le plus fiable (ECC) a été intégré à la dernière version du GDx, le GDx PRO™ [8].
Enfin, l’analyseur garde en mémoire les résultats des enregistrements successifs pour un sujet donné et peut fournir une étude de progression dans le temps de la couche des FNR (voir chapitre 11-I).
Fig. 9-61 Principe de la polarimétrie à balayage laser appliqué à la mesure de l’épaisseur de la couche des FNR.
L’examen ne nécessite pas de dilatation pupillaire et se pratique en lumière ambiante. Il doit être fait à distance de la prise de la pression intra-oculaire, qui peut induire un trouble cornéen. Lors de chaque mesure, un total de 256 × 256 pixels est testé en moins d’une seconde pour obtenir une carte de retardement. Les images sont acquises de façon automatique dans les dernières versions, sans que l’opérateur doive centrer la papille dans un champ de 20° × 20°.
Un algorithme permet le calcul de l’épaisseur de la couche des FNR mesurée au sein d’une bande, le cercle de calcul, d’une largeur de 10 pixels, placée de façon concentrique à 1,75 diamètre papillaire du bord externe de la tête du nerf optique (fig. 9-62).
La biréfringence cornéenne individuelle, seulement mesurée lors du premier examen, est automatiquement ajustée. Une lésion maculaire peut perturber cette compensation (car elle est établie à partir de la biréfringence des fibres de Henlé de la macula).
Fig. 9-62 Le cercle de calcul.
Le relevé regroupe les résultats des deux yeux avec à la partie supérieure les données du patient nécessaires à l’analyse par rapport au sujet de même âge (date de naissance, sexe, ethnie). La qualité de l’acquisition est indiquée par les indices Q (≥ 7) et TSS (> 40) qui reflètent notamment les anomalies de réflectance et la quantité d’artéfacts de l’image du fond d’œil, ainsi que l’indice d’erreur résiduelle dans la compensation de la cornée (≤ 4 nm).
Le relevé (fig. 9-63) regroupe [3, 4] :
-
une image du fond d’œil, avec la représentation du cercle d’acquisition, qui doit être parfaitement centré sur la papille ;
-
une carte colorée de la couche des FNR, d’autant plus épaisse que les couleurs sont chaudes (rouge, orange, puis jaune sur le fond bleu) ;
-
une carte de déviation, ou carte des écarts, qui indique l’importance statistique des déficits de la couche des FNR par rapport à un sujet de même âge de la base normative du GDx PRO™ ;
-
la courbe TSNIT (temporal supérieur, nasal inférieur, temporal) de chaque œil, qui représente en déroulé l’épaisseur de la couche des FNR le long du cercle de mesure avec l’intervalle de confiance à 95 % des résultats d’un échantillon de sujets normaux. Les courbes de l’œil droit et de l’œil gauche sont superposées au centre afin de faciliter la détection d’un déficit et surtout de dépister une asymétrie entre les deux yeux ;
-
un tableau des paramètres regroupe pour chaque œil, selon un code coloré en fonction de l’importance statistique de la déviation des résultats par rapport au sujet de même âge, l’épaisseur moyenne de la couche des FNR (TSNIT), celle des hémi-secteurs supérieur et inférieur ainsi que l’écart type, complétés par une évaluation de la symétrie intra-oculaire qui doit être dans la plus proche de l’unité chez le sujet considéré « normal ». Enfin l’indice NFI (nerve fiber indicator), calculé par un autre algorithme, est supposé refléter la probabilité de glaucome sur une échelle de 0 à 100 : une significativité d’atteinte glaucomateuse est retenue pour un indice NFI supérieur à 50. Si cette classification automatique par le NFI s’est avérée meilleure que le jugement des stéréophotographies des papilles par des ophtalmologistes généralistes [7], elle ne peut en aucun cas servir de base au diagnostic comme l’indique bien le relevé.
Les relevés doivent toujours être analysés avec les données de l’examen clinique et une bonne connaissance des limites de l’appareil. La couche des FNR au voisinage de la papille peut varier d’un individu à l’autre, avec parfois des faisceaux dissociés (« split bundles ») qui peuvent être pris pour un déficit. Les gros vaisseaux émergents peuvent également créer une dépression localisée de la couche des FNR.
Une importante atrophie parapapillaire, en particulier dans la myopie forte, et une dysversion papillaire marquée peuvent perturber considérablement les résultats ; une absence de réponse est classique lors de la présence de fibres à myéline.
La chirurgie cornéenne et cristallinienne, ainsi que les lentilles de contact, perturbent habituellement peu la fiabilité des résultats, tout au moins avec la dernière version du GDx. Il est cependant prudent, après chirurgie éventuelle, de pratiquer une nouvelle analyse de base.
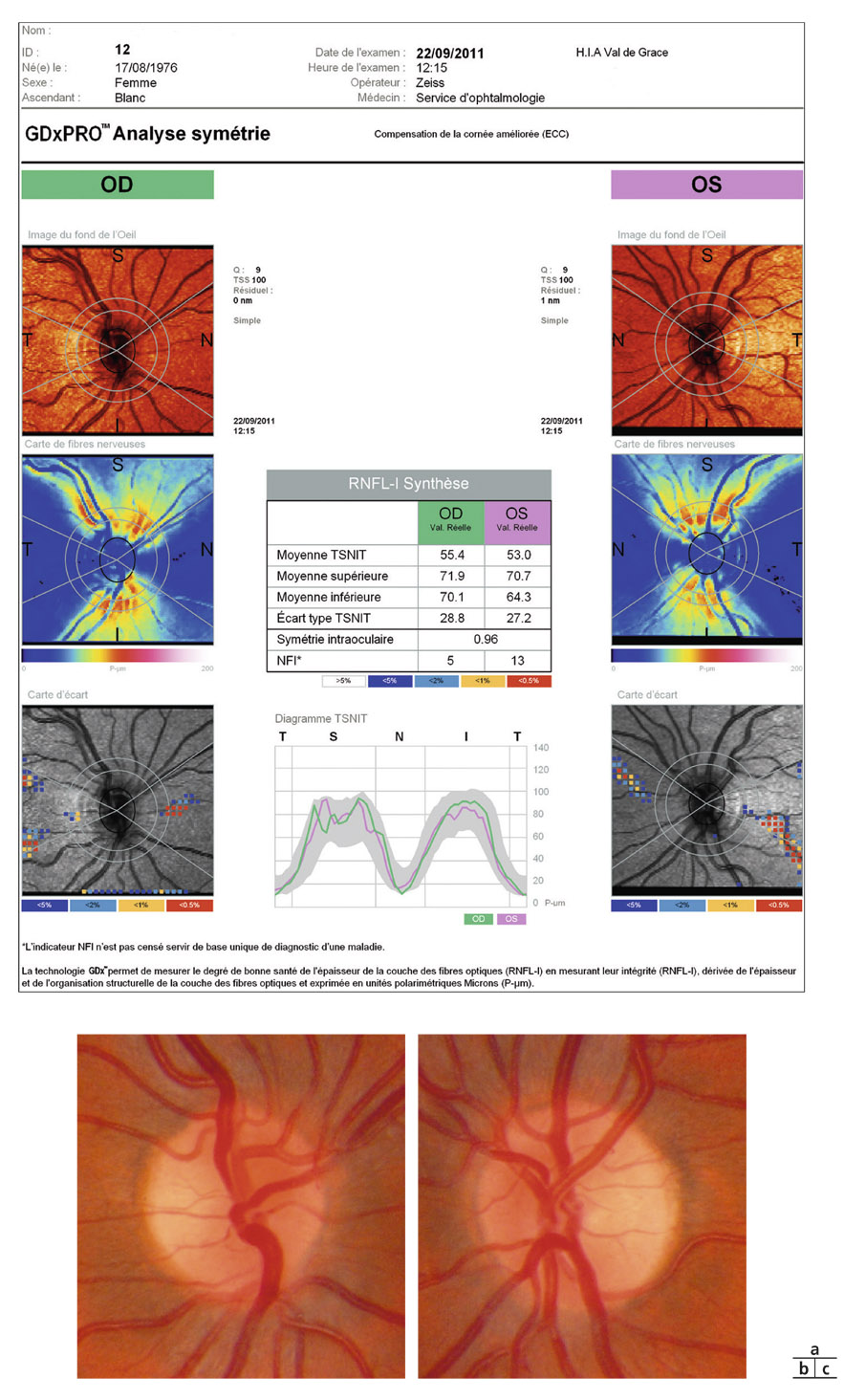
Fig. 9-63 a. Relevé GDx PRO™. Analyse des FNR, œil droit et œil gauche normaux. b, c. Têtes des nerfs optiques de l’œil droit et gauche. (Clichés : J.-P. Renard.)
Retenir
-
Si la commercialisation du GDx a été suspendue, les cabinets qui en sont équipés ne doivent pas renoncer à son utilisation en l’absence d’autres analyseurs.
-
Elle permet une mesure reproductible de l’épaisseur de la couche des FNR, et l’analyse de son évolution dans le temps.
-
Parmi les paramètres recueillis, le NFI est probablement le plus important, donnant un score de probabilité qui, en dessous de 50, indique l’absence probable de glaucome.
-
Toutefois, certaines situations anatomiques rendent ininterprétables ses résultats : forte dysversion papillaire, large atrophie parapapillaire, fibres à myéline.
[1] Dreher AW, Reiter K. Retinal laser ellipsometry : a new method for measuring the retinal nerve fiber layer thickness distribution ? Clin Vision Sci. 1992 ; 7 : 481-8.
[2] Knighton RW, Huang XR. Linear birefringence of the central human cornea. Invest Ophthalmol Vis Sci. 2002 ; 43 : 82-6.
[3] Knighton R, Zhou Q. New techniques. In : Iester M, Garway-Heath DF, Lemij HG (eds). Optic nerve head and retinal nerve fiber analysis. Savona (Italie), Dogma, 2005 : 117-9.
[4] Renard JP, Giraud JM. Glaucomes. Imagerie de la structure : HRT, GDx et OCT. J Fr Ophtalmol. 2006 ; 29 : 64-73.
[5] Reus NJ, Colen TP, Lemij HG. Visualization of localized retinal nerve fiber layer defects with the GDx with individualized and with fixed compensation of anterior segment birefringence. Ophthalmology. 2003 ; 110 : 1512-6.
[6] Reus NJ, Lemij HG. Diagnostic accuracy of the GDx VCC for glaucoma. Ophthalmology. 2004 ; 111 : 1860-65.
[7] Reus NJ, Lemij HG, Garway-Heath DF, et al. Clinical assessment of stereoscopic optic disc photographs for glaucoma : the European Optic Disc Assessment Trial. Ophthalmology. 2010 ; 117 : 717-23.
[8] Reus NJ, Zhou Q, Lemij HG. Enhanced imaging algorithm for scanning laser polarimetry with variable corneal compensation. Invest Ophthalmol Vis Sci. 2006 ; 47 : 3870-7.
[9] Sommer A, Katz J, Quigley HA, et al. Clinically detectable nerve fiber atrophy precedes the onset of glaucomatous field loss. Arch Ophthalmol. 1991 ; 109 : 77-83.
[10] Weinreb RN, Dreher AW, Coleman A, et al. Histopathologic validation of Fourier-ellipsometry measurements of retinal nerve fiber layer thickness. Arch Ophthalmol. 1990 ; 108 : 557-60.
J.-F. Rouland
-
La connaissance des principes de la microscopie confocale est utile à la compréhension des mesures obtenues par l’HRT.
-
L’acquisition, le déroulement de l’examen et ses différentes étapes de recueil des images d’une papille optique sont des procédures simples.
-
Le calcul des paramètres stéréométriques de la papille optique implique la détermination de la ligne de contour et le plan de référence est l’élément clé du principe de l’HRT.
-
Les deux stratégies d’analyse : MRA (Moorfields regression analysis) et GPS (glaucoma probability score) complètent l’ensemble des données stéréométriques de la tête du nerf optique.
Fondé sur le principe de la microscopie confocale, l’Heidelberg Retina Tomograph (HRT) est destiné préférentiellement à l’examen de la tête du nerf optique (TNO).
Cette imagerie, in vivo, rapide, non invasive, avec une faible illumination a été une des explorations pionnières de la TNO dans le glaucome, aussi bien à la phase diagnostique que lors de la surveillance de l’évolution.
Apparu dans les années 1980, l’HRT a évolué technologiquement depuis sa première version HRT (1992) puis HRT 2 (1999) et enfin HRT 3. Cependant, les examens enregistrés sur l’HRT 2 restent compatibles avec la dernière version, rendant possible un suivi prolongé, rarement observé pour les examens d’imagerie obtenus par d’autres procédures.
Une source laser ponctuelle de 670 nm est projetée, à travers un diaphragme, sur la tête du nerf optique (eFig. 9-2). Le faisceau réfléchi est renvoyé par un miroir, à travers un second diaphragme, vers le photodétecteur. Ce chemin optique permet d’obtenir un seul point réfléchi. Les points réfléchis en avant et en arrière du plan focal butent sur le second diaphragme.
Pour obtenir une image en deux dimensions (section optique de la papille optique), le faisceau laser balaye périodiquement la surface examinée, à l’aide de miroirs oscillants. Chaque section optique enregistrée comporte 384 × 384 pixels, soit une surface de 15° × 15°.
En avançant ce plan focal à différentes profondeurs, l’instrument va générer une succession de plans optiques équidistants (de 16 à 64) qui vont permettre de construire une image en trois dimensions. Le nombre de plans est automatiquement proposé en fonction de la profondeur de la papille optique, soit de 384 × 384 × 16 à 384 × 384 × 64 voxels en 1 à 4 secondes [7].
Une telle procédure permet d’obtenir plus de 147 000 mesures par enregistrement. La résolution transverse est de 10 μm pour 300 μm en résolution longitudinale.
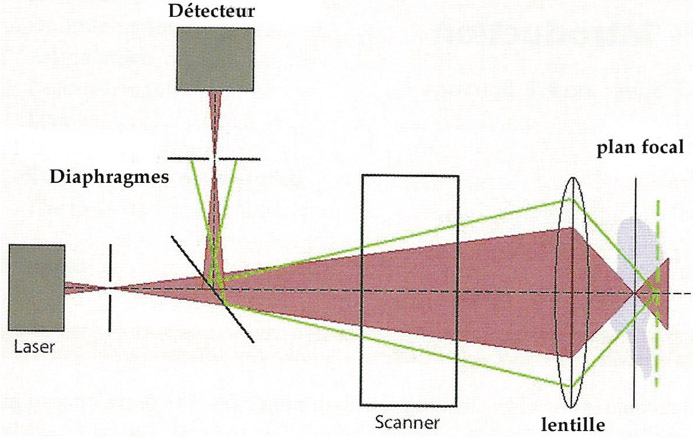
eFig. 9-2 Principe de la microscopie confocale (faisceau réfléchi en vert).
L’examinateur rentre les données administratives et la réfraction du patient (valeurs nécessaires pour la détermination des données morphométriques et la comparaison à la base normative) [5].
L’examen peut être réalisé sans dilatation pupillaire. Le patient, une fois installé, doit rester centré et immobile durant l’examen en évitant de cligner durant les quelques secondes nécessaires à l’acquisition. L’examinateur repère la tête du nerf optique, réalise la mise au point et lance l’acquisition lorsqu’il estime que le centrage de l’image est correct sur l’écran de contrôle (fig. 9-64).
La procédure d’acquisition des plans est automatique. Une fois que le patient est positionné et que la mise au point sur la papille optique est effectuée, l’instrument réalise un « pré-scan » pour déterminer la profondeur de la TNO lors du démarrage de la procédure. Le nombre de plans focaux nécessaires est alors connu pour étudier la totalité de l’épaisseur de la papille optique entre 1 et 4 mm.
La distance séparant chaque plan focal est de 0,0625 mm. Ainsi, pour une papille de 1 mm d’épaisseur, 16 plans focaux (16 × 0.0625 = 1 mm) suffisent, alors qu’il en faut 64 pour une papille de 4 mm.
Lors de chaque acquisition, trois scans sont réalisés. L’instrument contrôle automatiquement les mesures en détectant les erreurs liées aux mouvements oculaires et clignements palpébraux, et il répète la mesure rejetée pour obtenir trois scans successifs fiables et analysables.
L’étape suivante consiste à aligner et moyenner l’ensemble des valeurs pour obtenir une image topographique moyenne et une image en réflectance qui vont servir de base à la présentation des résultats (eFig. 9-3).
Les paramètres stéréométriques sont calculés à partir de cette image moyenne après application de deux procédures. L’une manuelle, par l’examinateur, qui va déterminer le rebord papillaire : la ligne de contour papillaire ; l’autre, automatique, situant le plan de référence qui considère au-dessus de ce plan la bordure neurorétinienne et en dessous l’excavation.
Il s’agit de l’étape clé de l’examen. Elle peut être réalisée sur l’image de réflectance ou sur l’image topographique. L’examinateur va placer, à l’aide de la souris, un repère (croix verte) sur le rebord interne de l’anneau scléral papillaire. À partir de trois points positionnés un cercle apparaît. Quatre à six points sont nécessaires pour obtenir un tracé acceptable de la marge papillaire (fig. 9-65 ; eFig. 9-4).
Ce plan de référence est situé 50 μm en dessous de la surface rétinienne mesurée en inter-papillo-maculaire (6° entre 350 et 356°), zone considérée comme peu influencée par les déficits glaucomateux (la valeur moyenne de l’épaisseur de la couche des fibres nerveuses rétiniennes (FNR) en inter-papillo-maculaire pour les yeux non glaucomateux est de : 16,0 ± 10,8 μm versus 23,4 ± 18,0 μm pour les yeux glaucomateux. Le chiffre de 50 μm correspond à deux déviations standard permettant d’être certainement en dessous de l’anneau scléral papillaire.
Connaissant les limites de l’anneau scléral papillaire et le plan de référence situé 50 μm en dessous du plan rétinien, l’HRT affiche alors les paramètres stéréométriques quantifiant les surfaces et les volumes de la papille optique examinée : 14 paramètres sont proposés.
La littérature confirme la très bonne reproductibilité des mesures aussi bien chez les sujets contrôles sains que chez les patients glaucomateux [4, 8, 9, 11-13].
La ligne de contour étant validée par l’examinateur, l’instrument affiche les différents résultats :
Comme tous résultats d’imagerie, la lecture systématique des tracés se fait de gauche à droite et du haut vers le bas. Les résultats obtenus avec les deux versions de l’HRT sont présentés : HRT 2 (fig. 9-66) et HRT 3 (fig. 9-67) [3].
Apparaissent le nom/prénom, le sexe et la date de naissance puis la date de l’examen et la date du dernier enregistrement, ainsi que la durée séparant ces deux mesures ; enfin, les données techniques de l’acquisition des paramètres : focus (en dioptrie), profondeur et nom de l’opérateur.
Ces critères sont essentiels, comme pour tout examen d’imagerie, afin de comparer les paramètres à la base normative de sujets sains et pour assurer un suivi ultérieur.
La déviation standard topographique est le premier paramètre présenté : une déviation standard inférieure à 20 μm indique une excellente image, très bonne entre 20 et 30 μm et acceptable jusqu’à 40 μm. Au-delà, de cette valeur l’examen doit être rejeté.
La papille optique est divisée en six secteurs où sont affichés deux paramètres stéréométriques [6] : disk area et rim area (surface en mm2 du disque optique et de la l’anneau neurorétinien).
L’excavation est représentée en rouge et l’anneau neurorétinien en vert. Les paramètres du patient sont comparés aux résultats obtenus chez des sujets sains du même âge et d’ethnie identique. Dans la version HRT 2, la base normative collectait les paramètres de 112 yeux normaux. Dans la version HRT 3, plus de 1 000 yeux de sujets normaux caucasiens (> 700 yeux), afro-américains (> 200 yeux) et indiens (> 100 yeux) servent pour l’analyse de référence.
Les quatre lignes noires superposées aux sept histogrammes (50 %, 95 %, 99 % et 99,9 %) indiquent que les résultats obtenus ont une probabilité de 50 à 99,9 % de chance d’être dans le groupe des sujets normaux de même classe d’âge.
Les valeurs « normales » (entre 95 % et 99,9 %) sont identifiées par une icône « check » verte, les valeurs « limites » (entre 50 et 95 %) par un point d’exclamation jaune et les valeurs « anormales » par une croix rouge. Ces icônes sont affichées sur l’image en réflectance.
Pour limiter l’influence de la détermination de la ligne de contour, Heidelberg a développé une procédure « automatique ». Le GPS utilise l’intelligence artificielle pour reconnaître la forme de la papille optique (analyse en trois dimensions de la papille et de la couche des FNR péripapillaires) grâce à une procédure automatisée dite « intelligente », et détermine la probabilité que la forme soit normale ou pathologique.
Cette nouvelle stratégie utilise les mêmes paramètres stéréométriques que le MRA et ne nécessite pas de traçage manuel du contour papillaire, éliminant ainsi le facteur humain. Elle se fonde sur l’analyse de trois paramètres papillaires (taille de l’excavation, sa profondeur et sa pente) et deux paramètres de la couche des FNR (déviations péripapillaires horizontale et verticale).
La base de données intègre les spécificités ethniques et donne une classification par secteur puis globale, avec des résultats sous formes de symboles colorés (check vert : normal ; point d’exclamation jaune : limite ; croix rouge : anormal) (fig. 9-68).
La comparaison de ces deux méthodes d’analyse dans la littérature retrouve dans 50 % des travaux une meilleure sensibilité du GPS, dans 30 % des articles une meilleure sensibilité du MRA versus GPS, et enfin pour les 20 % restants une équivalence [1, 2, 10].
Il semble que le MRA soit plus performant dans les stades avancés de glaucome.
Quoi qu’il en soit, il est préférable de coupler les deux procédures qui, de façon différente, abordent la quantification de la papille optique seule pour le MRA, et de façon associée à l’examen des FNR péripapillaires pour le GPS.
L’absence de détermination de la ligne de contour, dans le cas de la procédure GPS, est un facteur important pour des analyses réalisées par des non-spécialistes.
Les deux analyses sont toujours comparées aux bases normatives de patients sains de mêmes groupes d’âge et d’ethnie [1, 2, 10].
L’HRT est le seul instrument d’analyse de la TNO dont toutes les versions successives sont compatibles (depuis 1999 !). Il permet de façon rapide et reproductible d’obtenir de nombreuses données stéréométriques utiles au diagnostic de l’atteinte glaucomateuse de la papille optique. Fondé sur le principe d’une microscopie confocale par balayage laser, il s’adapte automatiquement aux paramètres de la papille optique.
Il demeure, malgré tout, examinateur-dépendant, par la nécessité de définir les contours de la papille lors de l’examen initial et demeure imparfait dans les malformations papillaires congénitales (macrodisques ou dysversion) ou acquises (myopie forte).
Fig. 9-65 Tracé de la ligne de contour (HRT).
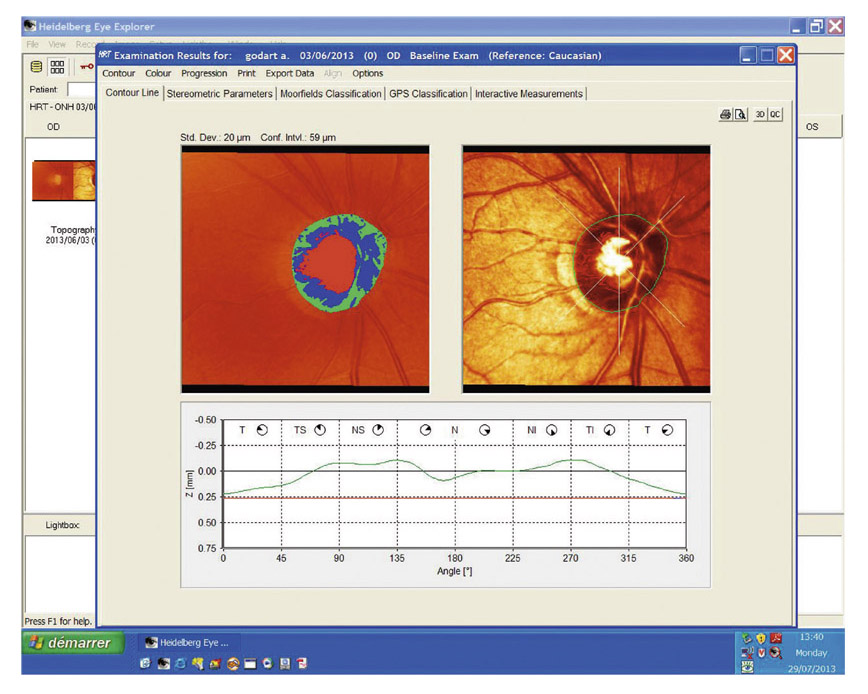
eFig. 9-4 Ligne de contour et plan de référence HRT.
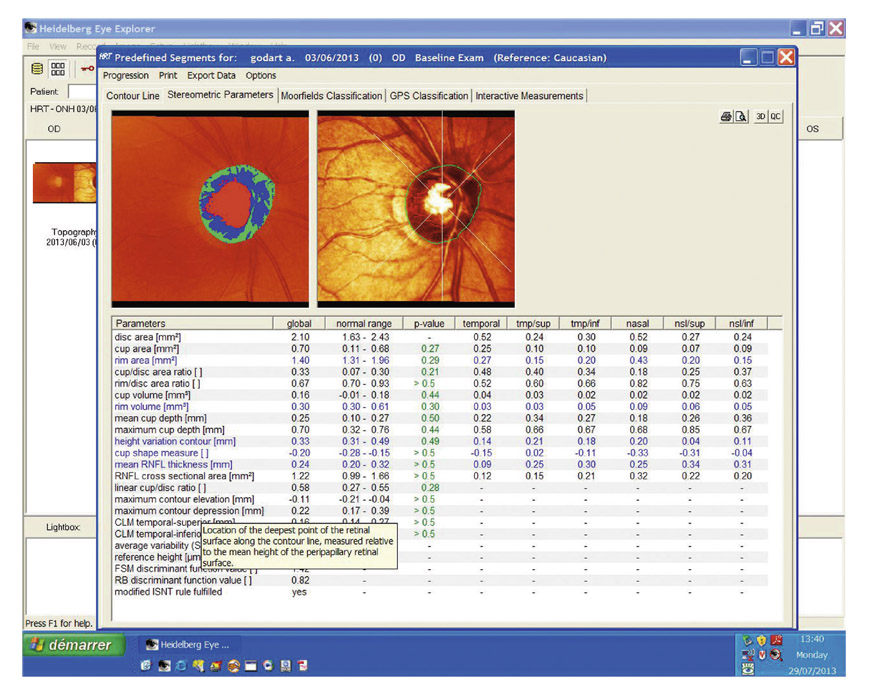
eFig. 9-5 Données stéréométriques.
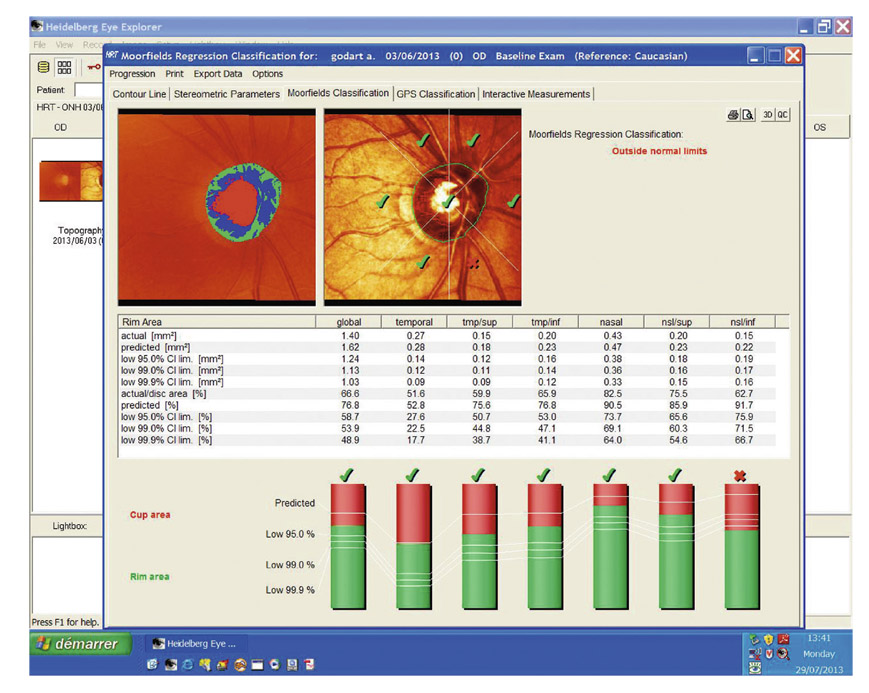
eFig. 9-6 Analyse de régression de Moorfields.
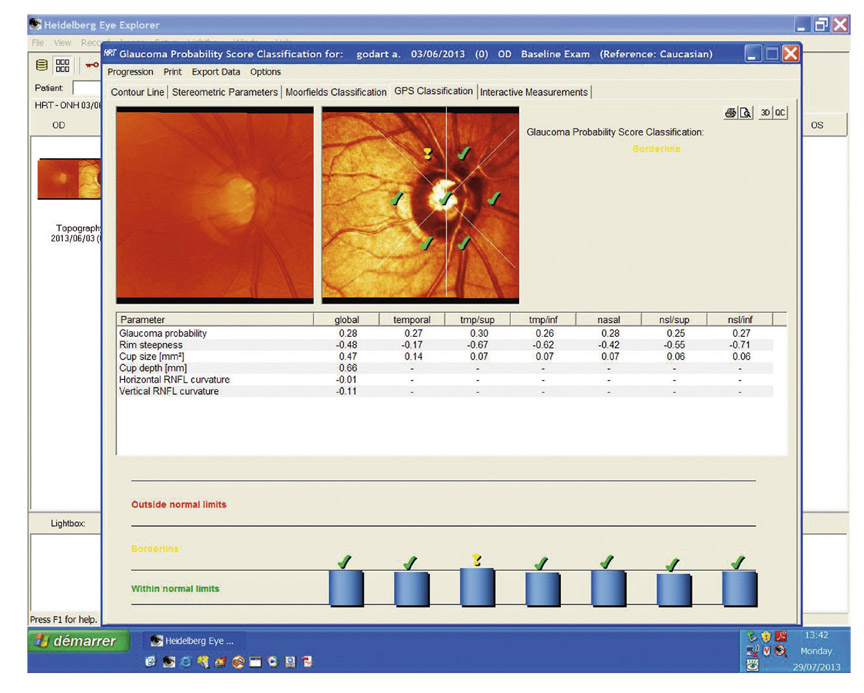
eFig. 9-7 Score de probabilité de glaucome.
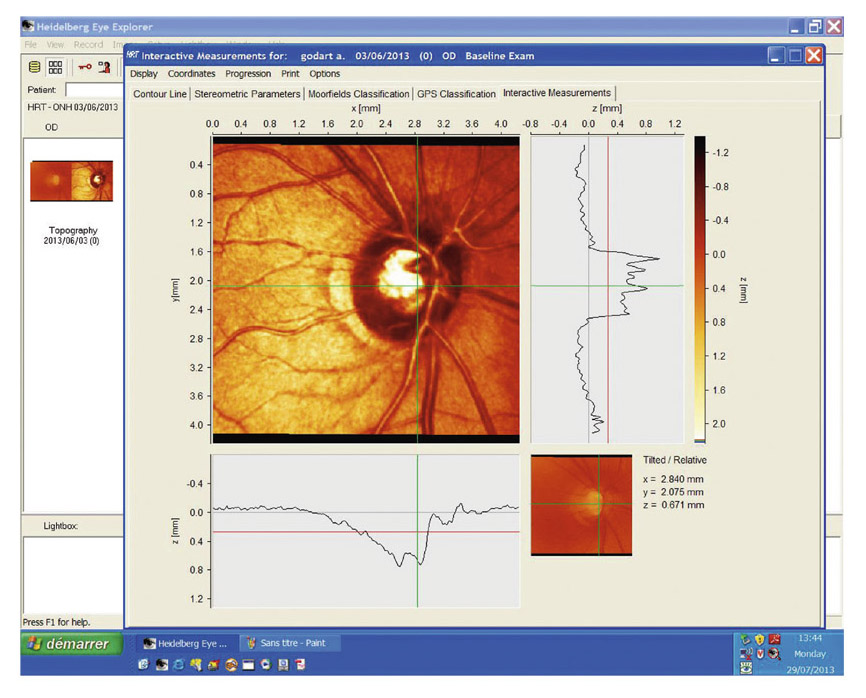
eFig. 9-8 Tracé interactif HRT.

Fig. 9-66 Relevé HRT 2. Interprétation des résultats.
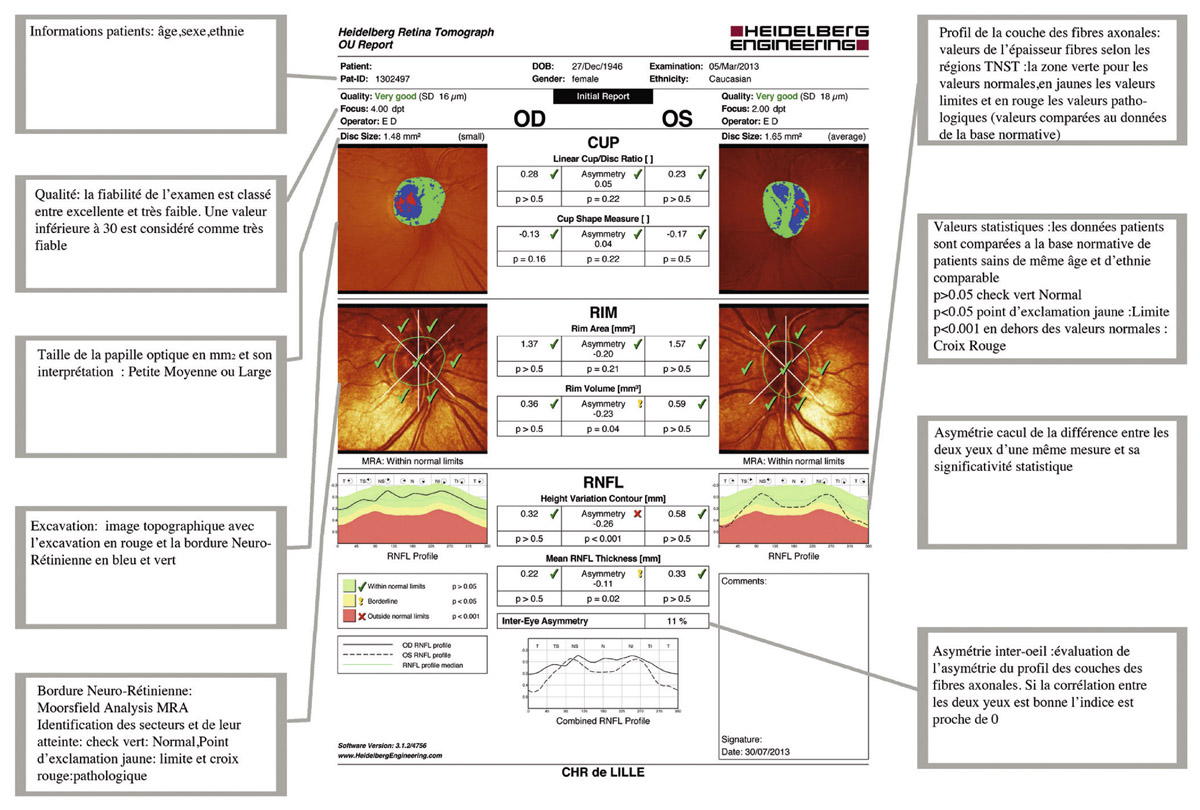
Fig. 9-67 Relevé HRT 3. Interprétation des résultats.
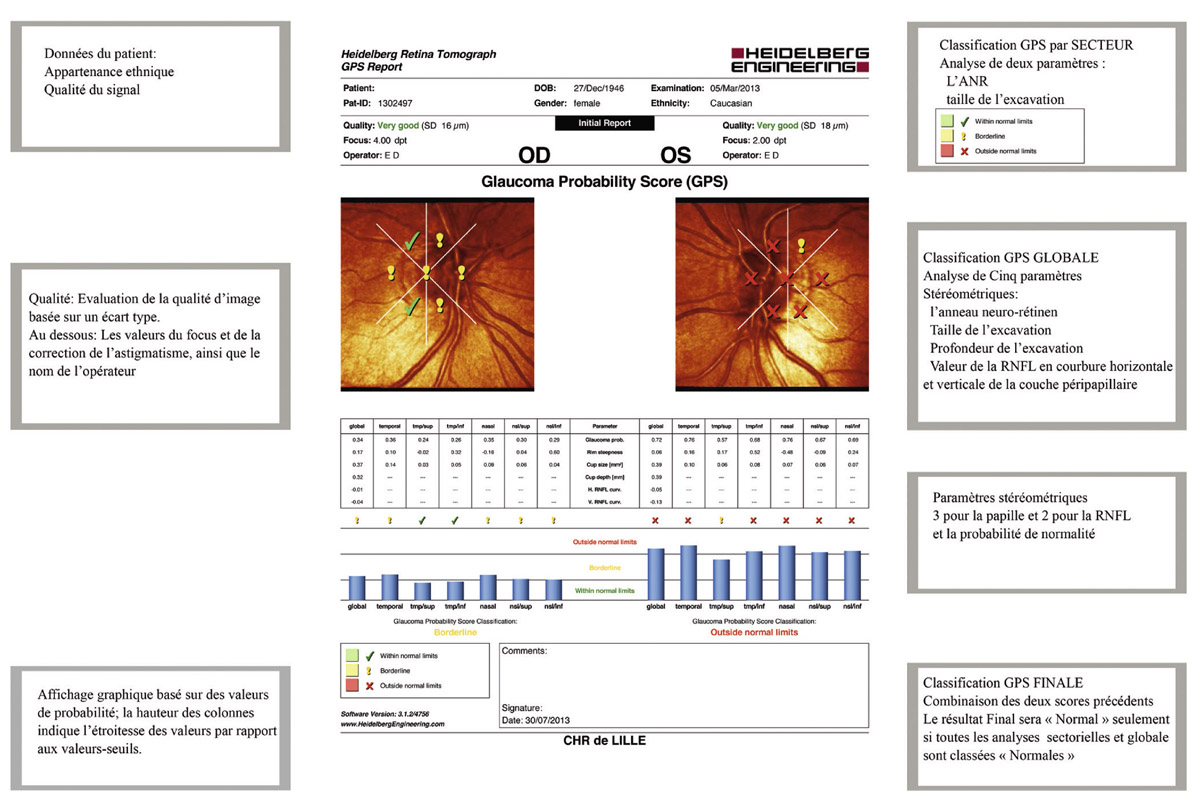
Fig. 9-68 Relevé du score de probabilité de glaucome (GPS).
Retenir
-
L’HRT est un instrument de quantification semi-automatique de la papille optique et des FNR par microscopie confocale in vivo.
-
Principalement destiné à l’examen de la papille optique plus qu’aux fibres nerveuses rétiniennes, il permet une évaluation initiale paramétrique et un suivi prolongé de la progression grâce à la compatibilité des versions successives de l’appareil.
[1] Alencar LM, Bowd C, Weinreb RN, et al. Comparison of HRT-3 glaucoma probability score and subjective stereophotograph assessment for prediction of progression in glaucoma. Invest Ophthalmol Vis Sci. 2008 ; 49 : 1898-906.
[2] Andersson S, Heijl A, Bengtsson B. Optic disc classification by the Heidelberg Retina Tomograph and by physicians with varying experience of glaucoma. Eye (Lond). 2011 ; 25 : 1401-7.
[3] Anton A. Clinical interpretation of the Heidelberg Retina Tomograph 2 (HRT 2). In : Fingeret JM, Liebmann JG (eds). The essential HRT Primer. San Ramon CA, Hedelberg Engineering, 2005 : 41-53.
[4] Burgansky-Eliash Z, Wollstein G, Bilonick RA, et al. Glaucoma detection with the Heidelberg retina tomograph 3. Ophthalmology. 2007 ; 114 : 466-71.
[5] Fingeret M. Using the Heidelberg Retina Tomograph II (HRT 2) : image acquisition and accessing the Data. In : Fingeret JM, Liebmann JG (eds). The essential HRT Primer. San Ramon CA, Hedelberg Engineering, 2005 : 11-31.
[6] Garway-Heath DF. Moorfields regression analysis. In : Fingeret JM, Liebmann JG (eds). The essential HRT Primer. San Ramon CA, Hedelberg Engineering, 2005 : 31-41.
[7] Girkin CA. Principles of confocal scanning laser ophthalmoscopy for the clinician. In : Fingeret JM, Liebmann JG (eds). The essential HRT Primer. San Ramon CA, Heidelberg Engineering, 2005 : 1-11.
[8] Healey PR, Lee AJ, Aung T, et al. Diagnostic accuracy of the Heidelberg Retina Tomograph for glaucoma a population-based assessment. Ophthalmology. 2010 ; 117 : 1667-73.
[9] Rao HL, Babu GJ, Sekhar GC. Comparison of the diagnostic capability of the Heidelberg Retina Tomographs 2 and 3 for glaucoma in the Indian population. Ophthalmology. 2010 ; 117 : 275-81.
[10] Reddy S, Xing D, Arthur SN, et al. HRT III glaucoma probability score and Moorfields regression across the glaucoma spectrum. J Glaucoma. 2009 ; 18 : 368-72.
[11] Yip LW, Mikelberg FS. A comparison of the glaucoma probability score to earlier Heidelberg Retina Tomograph data analysis tools in classifying normal and glaucoma patients. J Glaucoma. 2008 ; 17 : 513-6.
[12] Zheng Y, Cheung CY, Wong TY, et al. Determinants of image quality of Heidelberg Retina Tomography II and its association with optic disc parameters in a population-based setting. Am J Ophthalmol. 2011 ; 151 : 663-70.
[13] Zheng Y, Wong TY, Lamoureux E, et al. Diagnostic ability of Heidelberg Retina Tomography in detecting glaucoma in a population setting : the Singapore Malay Eye Study. Ophthalmology. 2010 ; 117 : 290-7.
J.-P. Renard, S. Magazzeni, J.-R. Fénolland, M. Delbarre
-
La technologie sans cesse perfectionnée des OCT, avec une vitesse d’acquisition et une reproductibilité nettement améliorées, a considérablement élargi leurs applications cliniques.
-
Une connaissance minimale des différents OCT-SD et de leurs divers programmes spécifiques d’acquisition est nécessaire.
-
Les modalités pratiques de l’acquisition du relevé OCT passent par plusieurs étapes codifiées à bien comprendre et, en fin d’acquisition, par la vérification vigilante de plusieurs paramètres avant de retenir la qualité du relevé.
-
L’interprétation des résultats impose une analyse rigoureuse de tous les éléments du relevé de la couche des fibres nerveuses rétiniennes (FNR) et de la tête du nerf optique (TNO) avec une bonne connaissance des limites et des pièges de l’examen.
-
L’analyse du complexe maculaire cellulaire ganglionnaire (ganglion cell complex ou GCC) a beaucoup progressé avec de nouveaux paramètres dont l’intérêt, avec le recul dont nous disposons actuellement, ne cesse d’augmenter et se précise en pratique clinique courante.
-
Les différentes acquisitions des FNR, de la TNO et du complexe GCC permettent une évaluation plus complète de l’atteinte structurale dans le cadre de nombreuses affections neurorétiniennes.
L’évaluation des structures oculaires du segment postérieur représente, comme nous le savons, une étape cruciale dans le diagnostic du glaucome et la détection de la progression de la neuropathie optique glaucomateuse [22].
La tomographie par cohérence optique ou OCT (ou optical coherence tomography) est une technique d’imagerie in vivo utilisée en ophtalmologie depuis près de vingt ans qui permet d’examiner la rétine dans toute son épaisseur.
Mise au point par une équipe du Massachusetts Institute of Technology conduite par James Fujimoto, le prototype a dans un premier temps permis la réalisation d’images en coupe in vitro de la rétine en 1991, puis les premières images in vivo furent publiées en 1995 par Huang, Swanson et Puliafito.
Le premier appareil, l’OCT1, fonctionnant dans le domaine temporel (time domain), a été commercialisé en 1995 par Humphrey Instruments (Californie), devenu par la suite Carl Zeiss Meditec, avec une résolution axiale intratissulaire de l’ordre de 20 μm. En 1999, l’OCT2 améliorait le procédé d’acquisition d’images mais conservait la même source et donc la même résolution.
L’OCT3 ou Stratus OCT (Carl Zeiss Meditec, Californie) arrive sur le marché en 2002 et va connaître un grand succès avec des perspectives d’exploration de la rétine au quotidien et imposant l’OCT comme examen incontournable dans de nombreuses affections neurorétiniennes avec une résolution axiale de 10 μm.
Il faut attendre 2007 pour que les technologies évoluent vers l’OCT en domaine fréquentiel (spectral domain) et permettent d’accéder à une imagerie beaucoup plus rapide et résolutive de l’ordre de 5 μm.
J.-P. Renard, S. Magazzeni
L’OCT est considéré comme une échographie optique. En échographie ultrasonore, la sonde en contact avec l’œil du patient émet des ultrasons qui sont ensuite plus ou moins absorbés ou réfléchis selon la densité des tissus biologiques rencontrés. Un capteur mesure les signaux ultrasonores réfléchis. Les temps de retour et les variations d’intensité des échos permettent ensuite de reconstituer une image du tissu biologique parfois jusqu’à plusieurs centimètres de profondeur et avec une résolution de l’ordre du millimètre. En tomographie par cohérence optique, les ultrasons sont remplacés par la lumière, et l’image reconstituée dépend de l’absorption et de la réflexion de cette lumière par les tissus biologiques. Ce principe prometteur de l’« échographie optique » ne peut pas être mis en pratique directement, car aucun détecteur de lumière n’est assez rapide pour mesurer des temps de propagation (aller et retour) qui se mesurent en femtosecondes. Toutefois, par le biais d’interférences, il est possible de mesurer les temps de propagation de la lumière sur les distances micrométriques qui séparent les structures de l’œil.
La tomographie par cohérence optique fait donc appel au principe expérimental de l’interférométrie en lumière faiblement cohérente, décrit dès le xviie siècle par Newton. Pour obtenir des images en coupe, on balaie avec un faisceau lumineux suivant un plan qui traverse le tissu examiné (en ophtalmologie la rétine ou la cornée). Pour mesurer le temps d’aller et retour et l’intensité des ondes lumineuses réfléchies par les diverses structures de l’œil, on fait interférer la lumière réfléchie de l’objet avec celle d’un autre faisceau ayant parcouru un chemin optique de référence.
Le chemin optique entre deux points est le chemin qu’aurait parcouru la lumière dans le vide pendant le temps qu’elle met à se propager entre ces deux points. Une différence de chemin optique entre deux faisceaux issus de la même source mesure donc une forme de retard optique entre deux ondes qui génèrent des interférences constructives ou destructives de ces dernières.
Les interférences sont créées dans un interféromètre de Michelson (eFig. 9-9) : il s’agit d’un dispositif composé de deux miroirs et d’une lame séparatrice faisant interférer deux faisceaux lumineux issus de la même source et ayant suivi des chemins différents.
Dans le cas qui nous intéresse, l’OCT, l’un des miroirs est dit de référence tandis que le rôle du second miroir est tenu par le tissu de l’œil étudié et la source émet une lumière à spectre large. Cela signifie que la source comporte de multiples longueurs d’onde et que les interférences ne se produisent que sur une certaine distance : la longueur de cohérence, qui est à l’origine de la dénomination de « tomographie par cohérence optique ».
Le signal d’interférence se compose d’une série de franges dont les intensités dépendent des microstructures rencontrées par le faisceau.
La première technologie OCT disponible dans un instrument industriellement commercialisé fut l’OCT-time domain (en domaine temporel). L’OCT-time domain, ou OCT-TD, dont le schéma du principe optique est décrit à la figure 9-69 projette sur la rétine un faisceau de lumière à large bande (820 nm, largeur 40 nm) proche des infrarouges, à l’aide d’une diode super-luminescente.
Lorsque l’interféromètre de l’instrument OCT combine les impulsions lumineuses réfléchies par la rétine et le miroir de référence, il se produit alors des interférences. Un photodétecteur détecte et mesure chaque interférence.
Bien que la lumière réfléchie par la rétine comprenne de multiples échos, la distance parcourue par les divers échos est déterminée en faisant varier la distance jusqu’au miroir de référence. Cela produit une plage de délais dans le temps de la lumière de référence, à des fins de comparaison.
Cet examen axial, appelé scan-A, est ainsi acquis en un lieu ponctuel de la rétine. Chaque examen axial (scan-A) compte 1 024 points de données sur une profondeur de 2 mm. L’utilisation combinée à un scanner composé de miroirs galvanométriques permet d’imager différents lieux de la rétine selon un axe longitudinal. À chaque balayage du scanner, l’instrument capture jusqu’à 768 scans-A le long de l’axe longitudinal pour créer une image en coupe transversale (tomographie) de l’anatomie rétinienne, appelée scan-B.
Il affiche les tomographies en temps réel à l’aide d’une échelle de fausses couleurs qui représente le degré de rétrodiffusion de la lumière par les tissus à différentes profondeurs de la rétine. La résolution axiale dans ce type de technologie était de 20 μm avec l’OCT1 pour s’améliorer à 10 μm avec les derniers appareils d’OCT-time domain.
Du fait de la mobilité du miroir de référence, la vitesse de balayage dans cette technologie a atteint un maximum de 500 scans-A/s avec le Stratus OCT (Carl Zeiss Meditec, Californie) dont le fonctionnement optique est détaillé à la figure 9-70.
Une évolution notable de la technologie est à noter en 2007 avec l’arrivée des OCT-spectral domain (en domaine spectral).
L’OCT-spectral domain, OCT-SD, dont le schéma de principe est illustré à la figure 9-71, est également une forme d’interférométrie à basse cohérence, où des rayons lumineux sont transmis le long de deux chemins optiques : le chemin échantillon (vers l’œil) et le chemin de référence de l’interféromètre. La source de lumière est une diode super-luminescente à 840 nm.
Le détecteur est un spectromètre en OCT-SD qui résout immédiatement les signaux d’interférence dans toute la profondeur de chaque examen axial au moyen d’une transformation de Fourier.
Les amplitudes et les phases relatives des composants spectraux diffusés depuis toutes les profondeurs d’examen axial du tissu échantillon sont résolues sans avoir à faire varier la longueur du chemin de référence.
La représentation spatiale des valeurs de réflectivité obtenues permet la construction d’images bi- ou tridimensionnelles présentant une corrélation étroite avec les images histologiques de la rétine.
Le déplacement d’un bras de référence mécanique étant éliminé, il devient possible d’acquérir les données d’images OCT environ soixante-dix fois plus vite qu’avec l’OCT-TD. Les OCT-SD balayent aujourd’hui les tissus avec une vitesse comprise entre 25 000 et 70 000 scans-A/s.
Cette énorme augmentation de la rapidité permet aux OCT-SD d’acquérir des ensembles de données tridimensionnelles ou des cubes entiers de données dans des temps similaires à ceux de l’OCT-TD.
En dépit de cette vitesse d’examen accrue, la détection spectrale du signal d’interférence fournit une résolution supérieure de l’ordre de 3-5 μm.
L’OCT-swept source, OCT-SS, dans le domaine fréquentiel combine les avantages des technologies time domain et spectral domain. Une source à longueur d’onde variable est utilisée et l’enregistrement se fait sur un photodétecteur comme en time domain.
Cette technologie présente l’avantage de disposer d’une vitesse d’acquisition supplantant l’OCT-SD (> 100 000 scans-A/s), mais la résolution axiale en est cependant moins bonne.
Avec l’emploi d’une source infrarouge à 1 060 nm, le signal pénètre plus profondément dans les tissus qu’avec l’OCT-SD et permet ainsi une meilleure visualisation de la choroïde et de ses limites ainsi que de la lame criblée (voir fig. 9-87).
Si la résolution axiale a été une voie constante d’amélioration pour atteindre une valeur de 3 μm dans la profondeur des tissus, la résolution transversale (capacité à discerner deux éléments connexes dans une même profondeur) est indépendante de la technique d’échantillonnage du signal puisqu’elle est déterminée par les propriétés de focalisation du faisceau optique.
Actuellement limitée à 15-20 μm avec les machines disponibles sur le marché, cette valeur empêche de visualiser la composition d’une même couche et d’en distinguer les éléments unitaires comme les photorécepteurs, par exemple.
L’amélioration de cette résolution fait appel à l’optique adaptative qui rend possibles des résolutions transversales inférieures à 5 μm, permettant déjà le comptage des photorécepteurs. Cette technologie comporte pour l’instant un certain nombre de limitations, mais elle est pleine de promesses et ouvre de nombreuses voies de recherche en imagerie de la rétine.
Les futurs développements dans le domaine de l’OCT seront sans doute majeurs dans l’évaluation de l’atteinte structurale aussi bien au niveau des cellules ganglionnaires, des FNR que de la TNO (voir chapitre 10-VI, paragraphe « OCT : futurs développements »).
J.-P. Renard, J.-R. Fénolland, M. Delbarre
Grâce à l’analyse quantitative, objective et reproductible de la couche des FNR et de la TNO qu’elle permet, l’OCT représente une des techniques, aujourd’hui largement répandue, d’imagerie automatisée pour l’analyse in vivo de ces structures. Les nouveaux algorithmes de segmentation viennent maintenant compléter l’analyse au niveau d’un troisième site, celui du complexe maculaire cellulaire ganglionnaire.
Les différents appareils OCT-SD, actuellement disponibles sur le marché, possèdent tous un programme d’analyse du pôle postérieur ou de la région maculaire rétinienne et sont l’objet de nombreuses applications cliniques.
Il est important de connaître les différentes techniques utilisées par ces logiciels ainsi que leur fiabilité et leur reproductibilité, de comprendre ce que l’on mesure, de savoir interpréter les résultats et de préciser les capacités diagnostiques actuelles que l’on peut en attendre sur le plan pratique, en sachant évaluer leurs limites et repérer les pièges éventuels.
Cet appareil utilise comme source lumineuse une diode super-luminescente (SLD) dont la longueur d’onde est centrée à 840 nm. Une vitesse de balayage à 68 000 scans-A/s, de 1 024 points chacun sur une profondeur de 2 mm, permet d’atteindre une résolution optique axiale et transversale respectivement d’environ 5 et 15 μm.
L’analyse de la couche des FNR péripapillaires est pratiquée après acquisition d’un cube volumétrique de données de 6 × 6 × 2 mm3 (programme Optic Disc Cube 200 × 200, soit 200 scans-B constitués chacun de 200 scans-A correspondant à environ 41 millions de points) en 1,54 seconde. Le logiciel isole au sein du cube, autour de la TNO, un cercle de 3,46 mm de diamètre constitué de 256 scans-A au niveau desquels l’épaisseur de la couche des FNR est mesurée. Le logiciel d’analyse établit également une cartographie d’épaisseur de la couche des FNR sur l’ensemble de la surface du cube qui, comme nous le verrons, est particulièrement intéressante.
Du même cube papillaire, de nouveaux algorithmes permettent d’évaluer plus précisément plusieurs paramètres de la TNO dont la surface de l’anneau neurorétinien (ANR), le volume de l’excavation et les rapports C/D (cup/disc) moyen et vertical [22]. L’analyse du complexe cellulaire ganglionnaire est possible à partir d’un « cube maculaire » d’acquisition de 6 × 6 × 2 mm3 (cube de 6 × 6 mm sur 2 mm de profondeur) selon deux protocoles possibles : cube de 200 scans-B horizontaux composés chacun de 200 scans-A (mode Macular Cube 200 × 200) ou bien, cube de 128 scans-B constitués de 512 scans-A (mode Macular Cube 128 × 512). L’algorithme identifie automatiquement la limite externe de la couche des FNR pour isoler le complexe GCIPL constitué de la couche des cellules ganglionnaires (Ganglion Cell Layer) et de la couche plexiforme interne (Inner Plexiform Layer). Ces deux derniers éléments constituent le complexe GCL (encore appelé GCA ou gangion cell analysis) ainsi analysé, éliminant de l’évaluation la couche des FNR, en raison de la variation chez les sujets normaux de la distribution topographique de ces dernières dans la région maculaire étudiée. Par ailleurs, l’analyse s’effectue au niveau d’une zone elliptique de 14,13 mm2 autour de la fovéa, de 5 mm de diamètre horizontal sur 4 mm de diamètre vertical estimée plus proche de la disposition anatomique observée des différentes couches des cellules ganglionnaires, associée à une épargne fovéolaire d’un cercle central de 1 mm sans mesure.
La taille la plus interne de l’anneau a été choisie afin d’exclure la zone où la couche des cellules ganglionnaires est fine et difficile à détecter alors que les dimensions les plus externes sont choisies pour répondre au plus près à la véritable anatomie de la région maculaire où la couche des cellules ganglionnaires rétiniennes est la plus épaisse chez les sujets normaux [47].
Enfin un nouveau logiciel en cours de développement permet une acquisition élargie de 12 × 9 mm pour une analyse combinée FNR, TNO et GCA sur le même relevé.
L’OCT-SD RTVue 100 utilise une illumination par SLD dont la longueur d’onde est centrée à 840 nm. La vitesse d’acquisition est de 26 000 scans-A/s, la résolution axiale de 5 μm et la résolution latérale de 15 μm. Les scans-A ont une profondeur de 2 à 2,3 mm au niveau du pôle postérieur.
L’analyse de la couche des FNR péripapillaires peut se faire selon différents modes : un mode « RNFL 3.45 » qui utilise une acquisition de type scan-B circulaire de 3,45 mm de diamètre centré sur la TNO et moyenné quatre fois. Le mode le plus utilisé est cependant le mode « ONH map » qui permet de créer une cartographie d’épaisseur ainsi qu’une analyse sur un cercle de 3,40 mm de diamètre. Cette acquisition centrée par l’opérateur sur la TNO consiste en une série de six scans-B circulaires concentriques de 2,5 mm à 4 mm de diamètre (587 à 775 scans-A chacun) et de douze scans-B radiaires de 3,4 mm de long (452 scans-A chacun) en moins de 0,4 seconde. De ces séries de scans-B, l’appareil calcule une cartographie d’épaisseur de la couche des FNR et extrait également des valeurs au niveau d’un cercle de mesure de 3,40 mm de diamètre (série de 920 scans-A).
Les paramètres de la TNO sont également étudiés à l’aide de l’acquisition « ONH map » ou « 3D map » qui permet de définir les limites de la TNO et de l’ANR et d’obtenir différentes mesures (rapport C/D vertical, surface de l’ANR, etc.).
OptoVue est la première firme à avoir développé spécifiquement un algorithme de segmentation du complexe maculaire cellulaire ganglionnaire (ganglion cell complex ou GCC, constitué de la couche des FNR, la couche des cellules ganglionnaires et la couche plexiforme interne). L’acquisition des données se fait selon le protocole MM7 (7 × 6 mm), avec une série de 15 scans-B verticaux (de 800 scans-A) distants de 0,5 mm et un scan-B horizontal (de 934 scans-A). L’ensemble de la grille d’acquisition est légèrement décalé de 1 mm en temporal de la fovéa afin de couvrir la zone rétinienne correspondante à la zone de détection de déficit du champ visuel la plus fréquente. Un nouveau logiciel d’acquisition élargie pour l’analyse des FNR, de la TNO et du GCC sur le même relevé est également en cours d’évaluation.
Cet appareil utilise un double faisceau lumineux : d’une part, un système de tomographie confocale à balayage laser qui assure un balayage du fond de l’œil (résolution de 5 à 11 μm dans une fenêtre de 30° × 30°) et donne une image en face ; d’autre part, un OCT-spectral domain dont la source lumineuse est une SLD dont la longueur d’onde émise est centrée à 870 nm. La vitesse d’acquisition est de 40 000 scans-A/s. (scans-A de 1,9 mm de profondeur avec une résolution de 1 024 pixels). Les résolutions optiques axiale et transversale atteignent respectivement 7 et 14 μm.
La mesure de l’épaisseur de la couche des FNR est assurée par un scan-B circulaire de 3,40 mm de diamètre dont la résolution est de 1 536 scans-A ou de 768 scans-A selon la qualité choisie. Ce scan-B circulaire est centré manuellement par l’opérateur sur la TNO et, grâce au système complémentaire de contrôle de la fixation « eye-tracking », la qualité des scans-B est améliorée numériquement par un moyennage des signaux obtenus. La technologie « fovea-to-disc » permet d’orienter le déroulé du scan-B en tenant compte de l’axe TNO/fovéa pour une meilleure analyse de la perte en FNR péripapillaires et pour une reproductibilité augmentée dans le suivi en éliminant les phénomènes de cyclotorsion [20].
L’analyse des paramètres de la TNO est maintenant possible avec le nouveau logiciel d’acquisition plus précis des extrémités de la lame de Bruch par 24 scans-B radiaires et l’évaluation d’un nouveau paramètre : BMO-MRW (BMO-minimum rim witdth) qui correspond à l’épaisseur de l’ANR la plus faible entre l’extrémité de la membrane de Bruch et la projection au niveau de la limitante interne pour chaque secteur de la TNO (voir plus loin « Analyse de la TNO »).
Le récent module d’analyse du pôle postérieur de l’appareil étudie non seulement l’épaisseur rétinienne totale et le complexe cellulaire ganglionnaire proprement dit, mais aussi permet une mesure séparée de l’épaisseur de toutes les couches rétiniennes (couche des FNR, des cellules ganglionnaires, de la plexiforme interne, etc.). Une acquisition de 30° × 25° (horizontal/vertical) est réalisée à l’aide de 61 lignes scans-B (de 768 scans-A) couvrant une surface rétinienne qui correspondrait au champ visuel 24°-2. Une grille d’épaisseur sur 64 secteurs de 3° (7 × 7 mm) est obtenue. La grille de mesure est orientée selon un axe dirigé de la fovéa au centre du disque optique (correspondant à la distribution topographique du raphé médian). Les analyses d’asymétrie inférieure/supérieure ou gauche/droite possibles ont montré leur intérêt en cas de glaucome débutant ou modéré mais plutôt dans les formes asymétriques [1]. Ce système permet a priori une détection encore plus fine des déficits localisés [49].
Avec une source SLD dont la longueur d’onde émise est centrée à 880 nm, la vitesse d’acquisition est de 53 000 scans-A/s. Les scans-A ont une profondeur de 2 mm pour une résolution de 1 024 points et les résolutions optiques axiale et transversale atteignent respectivement 7 et 20 μm.
Pour l’analyse de la couche des FNR péripapillaires, l’OCT-SD RS 3000 effectue une acquisition de type « cube papillaire » de 6 × 6 mm2 composée de 128 scans-B horizontaux (constitués chacun de 512 scans-A). De ces séries de scans-B, l’appareil donne une cartographie d’épaisseur de la couche des FNR avec une extraction des valeurs au niveau d’un cercle de mesure de 3,40 mm de diamètre autour de la TNO (série de 920 scans-A).
Les paramètres papillaires sont évalués à partir du même cube d’acquisition.
Au niveau maculaire, l’acquisition est de type cube maculaire large de 9 × 9 × 2 mm3 en 1,6 seconde (protocole 128 × 512 scans). La segmentation est de type GCC regroupant l’ensemble des trois couches (FNR + cellules ganglionnaires + couche plexiforme interne) et les résultats se présentent sous la forme de valeurs incluses dans une grille appelée G chart de huit secteurs (ETDRS).
Cet OCT utilise une SLD dont la longueur d’onde émise est centrée à 840 nm. Sa vitesse d’acquisition est de 27 000 scans-A/s, avec des résolutions optiques axiale de 5 à 6 μm et latérale de 20 μm.
Les acquisitions des FNR se font par l’intermédiaire d’une acquisition de type cube papillaire de 6 × 6 mm2 (128 scans-B × 512 scans-A). Un scan-B péripapillaire constitué de 1 024 scans-A est extrait et automatiquement centré sur la TNO.
Les données du complexe cellulaire ganglionnaire sont obtenues à partir de l’acquisition d’un « cube maculaire » de 7 × 7 mm, balayage de trame composé de 512 scans-B verticaux (de 128 scans-A) couvrant une région maculaire de 6 × 6 mm. Une grille d’analyse de 10 × 10 secteurs de 600 μm exprime les résultats et les compare à la base de donnés normatives de l’appareil. À noter que l’appareil dispose également d’un programme d’acquisition 3D élargi du pôle postérieur de 12 × 9 mm qui englobe ainsi la TNO et les FNR péripapillaires. Cet OCT donne les résultats de l’ensemble du GCC mais également les épaisseurs séparées de la couche des FNR, de la couche des cellules ganglionnaires et de la couche plexiforme interne.
Cet OCT-SD récemment disponible utilise une source SLD dont la longueur d’onde émise est centrée à 855 μm. La vitesse d’acquisition de 70 000 scans-A/s améliore les résolutions optiques axiale et transversale respectivement à 3 et 20 μm. Il est associé à un SLO à champ large 44° × 33° (13 × 10 mm) avec optimisation automatique de l’image.
Les acquisitions de la couche des FNR se font par un cube papillaire dénommé « Disc 3D » (cube dont l’analyse porte sur une aire de 6 × 6 mm2 grâce à 256 scans-B × 512 scans-A).
Les paramètres papillaires les plus courants sont également évalués à partir du même cube d’acquisition.
Le programme maculaire permet une segmentation du GCC de très haute définition, sur un cube d’acquisition de 10 × 10 mm avec 1 024 scans-B × 128 scans-A (mode « Glaucoma 3D »), à grande vitesse. Un double système de contrôle « tracking » (pupillaire et sur les vaisseaux du fond d’œil) assure une correction de l’impact des micromouvements oculaires. Une nouvelle fonction (ultra-fast-tracking) permet, si le patient bouge pendant l’acquisition, de renouveler jusqu’à cinq fois le passage des coupes qui lui manquent. Cette redondance réduit le risque d’artéfacts sur les cartes d’évolution. Une évolution logicielle permet également d’effectuer des scans de 13 mm de large. Il permet d’obtenir les mesures de l’ensemble du GCC (NFL + RGC + IPL) à l’aide d’une grille de type ETDRS en plus des valeurs moyennes totales et par hémi-champ. Enfin, il vient récemment de s’enrichir d’une base de données normative de référence (> 492 patients âgés de 18 à 85 ans) dans quatre principales ethnies.
Fig. 9-72 Examen OCT acquisition.
L’acquisition d’un examen OCT de bonne qualité, fiable et reproductible, passe par le respect d’un certain nombre de règles de bonnes pratiques à bien connaître.
Une information la plus complète possible du patient concernant le but, le principe et les modalités de l’examen doit être donnée. Des explications claires, précises et concises sur le déroulement de l’acquisition des données sont nécessaires avant de débuter la procédure. On n’omettra pas de préciser qu’il s’agit d’un examen non-contact, indolore, non éblouissant et rapide.
Le patient sera informé que l’appareil au cours de l’examen émet quelques bruits.
On insistera sur l’importance du maintien de la fixation, à l’intérieur de l’objectif, de la mire lumineuse dont la perception va se préciser au fur et à mesure de la mise au point automatique, ainsi que sur la nécessité d’éviter de suivre du regard le balayage des différents scans.
La dilatation pupillaire n’est pas nécessaire pour la réalisation de l’examen. Cependant, dans certains cas (pupille étroite, trouble des milieux, etc.), l’instillation d’une goutte de tropicamide en l’absence de contre-indication, peut être utile pour une acquisition plus aisée et de meilleure qualité. Il est également plus facile à travers une pupille dilatée de se décentrer de l’axe optique pour éviter une opacité localisée du cristallin ou un anneau de Weiss prépapillaire trop visible et gênant la qualité d’une acquisition des FNR.
La position du patient est essentielle. Il doit être installé le plus confortablement possible, les pieds au sol à plat. Les réglages de la hauteur de la mentonnière de l’OCT ainsi que du siège du patient doivent être adéquats. Il est indispensable que le patient maintienne strictement la tête appuyée contre le support frontal afin de ne pas entraîner de variation dans un axe antéro-postérieur lors de l’acquisition (axe z). En effet, la plage de focalisation des OCT est en général très courte, de l’ordre de quelques millimètres.
Par ailleurs, une déviation latérale de la tête de quelques degrés peut être à l’origine d’artéfacts. Il est donc primordial que l’examinateur contrôle le bon positionnement du patient tout au long de l’examen. Cette tâche est facilitée par les appareils qui permettent à l’examinateur d’être placé perpendiculairement au patient au cours de l’acquisition (fig. 9-72).
Le maintien de la fixation et des yeux ouverts peut être source de gêne chez certains patients glaucomateux multi-traités qui présentent un problème de surface, voire de sécheresse oculaire parfois sévère pendant l’acquisition. L’instillation d’un agent mouillant avant l’examen peut être utile.
La majorité des OCT-SD possède un programme permettant une acquisition automatique et rapide des données. Une bonne maîtrise de l’ensemble des programmes disponibles par l’opérateur est nécessaire. Chaque appareil dispose de ses propres programmes qu’il faut bien connaître et dont il faut dominer l’utilisation afin de permettre une acquisition optimale et reproductible des données.
L’opérateur doit avant tout enregistrer les informations relatives à l’identité du patient, sa date de naissance ainsi que son ethnie. Ces paramètres sont fondamentaux pour l’analyse des données et la comparaison des résultats obtenus avec les valeurs « normales » chez les sujets de même âge, en sachant que ces bases de données normatives sont spécifiques pour chaque appareil (vidéo 9-4).
Dans le cadre du suivi d’un patient, il faut être vigilant à l’enregistrement de l’identité du patient afin d’éviter toute erreur provoquant la création d’un nouveau dossier.
Les particularités de chaque OCT permettent de retenir deux grands types de procédures d’acquisition : l’une où la focalisation est assurée à l’aide d’un palonnier similaire à celui du biomicroscope et qui déplace l’optique de l’OCT vers l’œil du patient ; l’autre utilisant une optique fixe avec un déplacement de la mentonnière et de l’appui frontal dans les trois axes pour la recherche dans un premier temps d’une bonne focalisation sur l’iris, puis une fonction « Z align » souvent automatique qui permet la mise au point sur la rétine (voir fig. 9-72).
Afin d’acquérir un maximum de signal, il est souhaitable que le plan de la lumière incidente de l’OCT soit le plus perpendiculaire possible au plan rétinien. Un « bon alignement » orthogonal sur les plans horizontaux et verticaux est nécessaire. Dans ce but, les appareils donnent souvent des scans-B dynamiques de faible résolution pour se repérer au cours du centrage : lorsqu’un scan-B horizontal apparaît dévié (« tilté »), il convient de corriger le centrage en latéral ; si le scan-B vertical est mal aligné, il faut faire varier la hauteur.
Une fois le plan focal bien déterminé, certains appareils disposent d’une « fonction optimisation » qui améliore le gain de l’acquisition en fonction des conditions de réflectance de la lumière de l’OCT. Il est également souvent possible d’intervenir sur le contraste de l’image, mais sans toutefois en améliorer beaucoup la qualité.
Une autre possibilité d’améliorer cette qualité des images est de réaliser un « moyennage d’images ». Ainsi certains appareils utilisent cette fonction logicielle qui consiste à renforcer le rapport signal/bruit des scans-A en moyennant le signal de plusieurs scans (le moyennage diminue le bruit par la racine carrée du nombre d’images moyennées) (fig. 9-73). Ce moyennage n’augmente pas la résolution des images : il s’agit d’un lissage qui permet notamment de mieux discriminer les interfaces. Il est encore plus performant lorsqu’il est couplé à un système complémentaire de suivi du regard « eye-tracker ». L’eye-tracking assure que le faisceau de l’OCT passe exactement au même endroit, limitant encore le flou induit par le moyennage en cas de micromouvements. Il est également intéressant dans le suivi des patients car il optimise la reproductibilité des scans, minimisant ainsi les variations inter-sessions qui deviennent extrêmement faibles.
Fig. 9-73 Acquisition OCT avec moyennage d’image et eye-tracking.
Puissance du signal
Tous les OCT-SD donnent un critère qualitatif de l’examen représenté par le rapport signal/bruit ou plus simplement la puissance du signal et que l’on peut vérifier dès la fin de l’acquisition. Le nom et l’échelle de cet indicateur sont différents pour chaque OCT. On parle en général de signal strength (SS) ou signal strength index (SSI) exprimé de différentes façons selon l’OCT. Pour le Cirrus HD-OCT, sa valeur doit être supérieure à 6/10 et à 50 avec le RTVue pour considérer le relevé fiable. Si le signal est trop faible, les algorithmes de segmentation seront mis en défaut avec un risque d’erreur de segmentation ou de mesure des épaisseurs moins fiables qu’avec une puissance de signal conforme. La faible puissance du signal peut être liée à une mauvaise acquisition ou à une pathologie associée (trouble des milieux, etc.). Il faut donc toujours confronter les données de l’OCT à l’examen clinique et ne pas retenir un relevé de faible signal (voir vidéo 9-4).
Artéfacts de mouvement
Les acquisitions volumétriques en cubes maculaires ou papillaires peuvent souffrir de micromouvements oculaires au cours des acquisitions (en général < 2 secondes). Ces artéfacts se reconnaissent sur les images « en face » du fond d’œil en cas de mauvais alignement des vaisseaux rétiniens. Tous les OCT-SD ont amélioré leur programme d’acquisition grâce aux systèmes complémentaires de suivi du regard (« eye-tracker ») qui permettent de réduire les erreurs d’acquisition liées à ce type de micromouvements oculaires.
Erreur de segmentation
La segmentation des scans-B doit toujours être vérifiée. Le logiciel de segmentation peut avoir des difficultés pour délimiter les interfaces entre les différentes couches rétiniennes (alors que la force du signal est bonne) (fig. 9-74) Une segmentation manuelle est alors nécessaire pour corriger ce type d’erreur, mais il est souvent plus simple et plus rapide dans ce cas de pratiquer une nouvelle acquisition (voir vidéo 9-4).
L’analyse des FNR en OCT s’est donc développée grâce aux scans-B circulaires péripapillaires dont le but est d’évaluer l’épaisseur de la couche des FNR sur 360° autour de la TNO. Le diamètre de 3,46 mm du scan-B a été sélectionné en OCT-TD pour sa meilleure reproductibilité des mesures et de nombreuses études ont démontré sa bonne capacité diagnostique [5, 6, 24, 27, 29, 30, 33, 36, 43, 44, 46, 50].
Les différents types d’acquisitions spécifiques pour chaque OCT-SD ont été décrits précédemment.
La lecture du relevé s’effectue de haut en bas et de gauche à droite.
À la partie supérieure se trouvent l’identité du patient, ainsi que sa date de naissance qui permet les analyses statistiques et la comparaison des résultats à ceux de sujets de même âge enregistrés dans la base normative de l’appareil. En dehors de ces limites, les valeurs seront exprimées en grisé sur le relevé car elles ne peuvent pas faire l’objet d’une analyse comparative à la base normative (fig. 9-75).
La puissance du signal comme nous l’avons vu est un paramètre important à vérifier à nouveau.
Le cube papillaire apporte l’avantage de construire de plus larges cartographies de la couche des FNR, permettant ainsi de repérer d’autres déficits au-delà du cercle habituel de mesure, et de suivre leur progression qui peut prendre comme nous le verrons des aspects caractéristiques (voir chapitre 11-II, paragraphe « Évaluation de la progression de l’atteinte fonctionnelle ») [31].
Chaque appareil dispose d’une base de données normatives spécifique. Ces bases de données correspondent à des valeurs normales d’épaisseur de la couche des FNR chez des sujets indemnes de toute pathologie et qui sont de sexe, d’âge et de race différents [4]. Certaines bases de données normatives tiennent compte d’autres paramètres, comme celle de l’OCT RTVue (Optovue) qui considère également la surface du disque optique. Une série de patients plus ou moins importante est utilisée afin de déterminer un intervalle de confiance de valeurs normales. Les résultats comparés aux données de la base normatives sont exprimés avec un code coloré :
-
la couleur blanche signifie que les valeurs sont plus épaisses que les limites de l’intervalle de confiance (5 % des sujets présentent les valeurs les plus épaisses). Il s’agit en général de sujets normaux ou atteints d’autres affections (œdème papillaire, attache et traction vitréo-papillaire, etc.), sources d’épaississement de la couche des FNR ;
-
la couleur verte signifie une probabilité de valeur normale de 95 %, dans l’intervalle de confiance de la base de données normatives et à considérer comme normales ;
-
la couleur jaune est un message d’alerte qui indique une probabilité de résultat normal inférieur à 5 % (valeur en dehors de l’intervalle de confiance à p < 0,05 mais supérieur à 0,01 – valeur suspecte ou limite « borderline ») ;
-
la couleur rouge p < 0,01 correspond à une probabilité de mesure normale inférieure à 1 % et à considérer comme statistiquement anormale.
Si les divers OCT actuellement disponibles ont tous une sensibilité et une spécificité bonnes et globalement comparables, celles-ci n’atteignent cependant jamais 100 %.
Il faut donc rester prudent dans l’interprétation des résultats selon le code coloré. Leur expression se fait par rapport à une base de données « normatives » propre à chaque appareil avec souvent un nombre limité de sujets par décennie qui ne couvre pas toutes les variations possibles observables au sein de l’ensemble de la population. La confrontation des résultats avec les données cliniques doit donc être systématique et reste primordiale.
– Cirrus HD-OCT 5000 (fig. 9-75)
Le rapport du Cirrus est établi après une acquisition de type « optic disc cube » (voir plus haut).
Analyse du relevé :
-
Au centre, un tableau résume les paramètres les plus importants avec l’épaisseur moyenne de la couche des FNR de chaque œil et le pourcentage de symétrie de cette couche entre les deux yeux.
-
Latéralement, à la partie supérieure, l’algorithme de mesures donne une carte des épaisseurs de la couche des FNR sur l’ensemble de la surface du cube d’acquisition (6 × 6 mm2). Cette représentation colorimétrique utilise les couleurs chaudes (jaune et rouge) pour les zones les plus épaisses (correspondant aux faisceaux arciformes) et les couleurs froides (bleu et vert) pour les zones les plus minces avec une échelle de correspondance des épaisseurs (de 0 à 350 μm). Un relevé normal donne un aspect en sablier ou aile de papillon (jaune et rouge) où il est important de rechercher une asymétrie entre les secteurs supérieur et inférieur ainsi qu’une zone déficitaire débutante périphérique (encoche bleue dans les secteurs jaune-rouge) qui peut être décelée.
-
Une carte de déviation de l’épaisseur de la couche des FNR par rapport aux valeurs normales du sujet de même âge, située juste en dessous, met en évidence (superpixels constitués de 4 × 4 pixels) les points en dehors de l’intervalle de confiance défini à partir de la base de données normatives (en jaune et en rouge). L’intérêt majeur de cette carte est de pouvoir détecter des anomalies en dehors du classique scan-B RNFL péripapillaire de 3,46 mm de diamètre utilisé en tant que zone de référence pour l’évaluation de l’épaisseur de la couche des FNR.
-
La représentation graphique de l’épaisseur de la couche des FNR mesurée au niveau de chaque scan-A du cercle de mesure péripapillaire, au centre, est une image en déroulé ou « graphe TSNIT » qui fait apparaître les valeurs des deux yeux ainsi que la distribution colorée des valeurs normales en fonction de l’âge du sujet, pour chacun des 256 points composant ce graphe.
-
Les valeurs numériques de l’épaisseur de la couche des FNR dans les quadrants supérieur, inférieur, nasal et temporal, avec une représentation colorimétrique par rapport aux données de la base normative de l’OCT.
-
L’épaisseur des FNR pour chaque méridien horaire ainsi que leur code coloré comparatif par rapport aux sujets de même âge.
-
À la partie latérale inférieure s’observe le déroulé du scan-B circulaire extrait du cube papillaire, ainsi que les limites internes et externes de la couche des FNR pour lequel il est important de vérifier le bon centrage dans la fenêtre d’acquisition et la qualité de la segmentation en cas d’anomalie sur le relevé.
– RTVue (fig. 9-76)
Le rapport du RTVue est classiquement établi après une acquisition de type « ONH map » (voir plus haut).
Analyse du relevé :
-
Une carte circulaire des épaisseurs de la couche des FNR à l’intérieur de laquelle les couleurs chaudes (rouge et orange) représentent les épaisseurs les plus importantes et les couleurs froides (bleu et vert) les épaisseurs les plus faibles.
-
Une analyse de l’épaisseur de la couche des FNR sur un diamètre de 3,40 mm avec 16 secteurs. La valeur de chaque secteur est comparée à celle de la base de données normatives. En cas d’amincissement significatif, les valeurs sont surlignées de couleur jaune (p < 0,05) ou rouge (p < 0,01).
-
Un tableau récapitule les valeurs des épaisseurs moyennes et celles des hémi-champs supérieur et inférieur (avec les résultats pour chaque quadrant nasal et temporal), de la couche des FNR. Ces valeurs sont comparées à la base de données normatives.
-
Un graphe qui rapporte la distribution de l’épaisseur de la couche des FNR selon un déroulé TSNIT. Les valeurs du patient (trait noir) sont représentées avec les valeurs limites de l’intervalle de confiance de la base de données normatives.
-
Un graphe analyse la symétrie des deux courbes TSNIT et les différences sont affichées en jaune ou en rouge si elles sont anormales de façon statistiquement significative.
– Autres OCT-SD
Classiquement le relevé de l’analyse des FNR rapporte des cartes et graphes similaires aux OCT-SD précédents avec pour chaque œil, le plus souvent, une valeur d’épaisseur moyenne, une valeur d’épaisseur par hémi-champ (supérieur, inférieur) par quadrant (inférieur, supérieur, temporal et nasal) et, de façon moins constante, des valeurs méridiennes horaires. Ces valeurs sont abaissées en cas de perte diffuse (fig. 9-77).
Toute asymétrie dans les épaisseurs globales entre les deux yeux est très fortement suspecte.
Enfin il convient de toujours bien analyser la courbe TSNIT qui permet de déceler les pertes focales dans la zone de 3,4-3,46 mm.
Les cartes des épaisseurs de la couche des FNR sur les acquisitions en « cube papillaire » sont toujours importantes et doivent faire l’objet d’une analyse attentive car certains déficits apparaissent au-delà de la classique zone d’analyse de 3,40 mm.
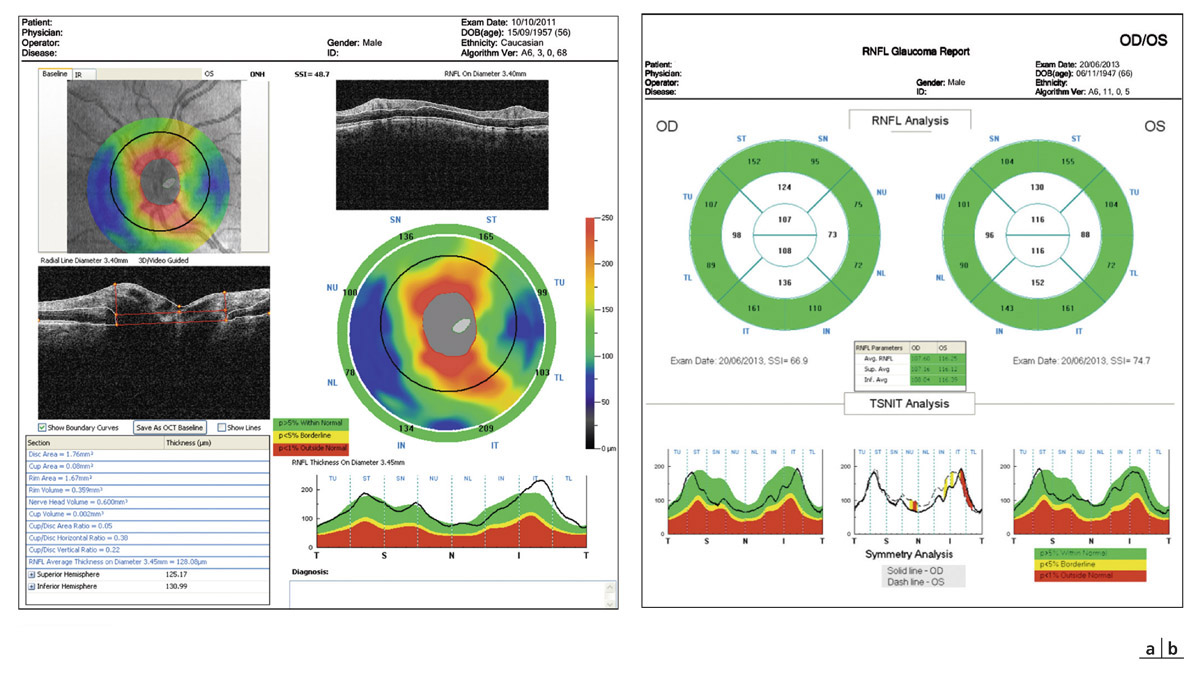
Fig. 9-76 a. Relevé normal des FNR et du disque optique RTVue mode « ONH map ». b. Mode « RNFL 3.45 ».
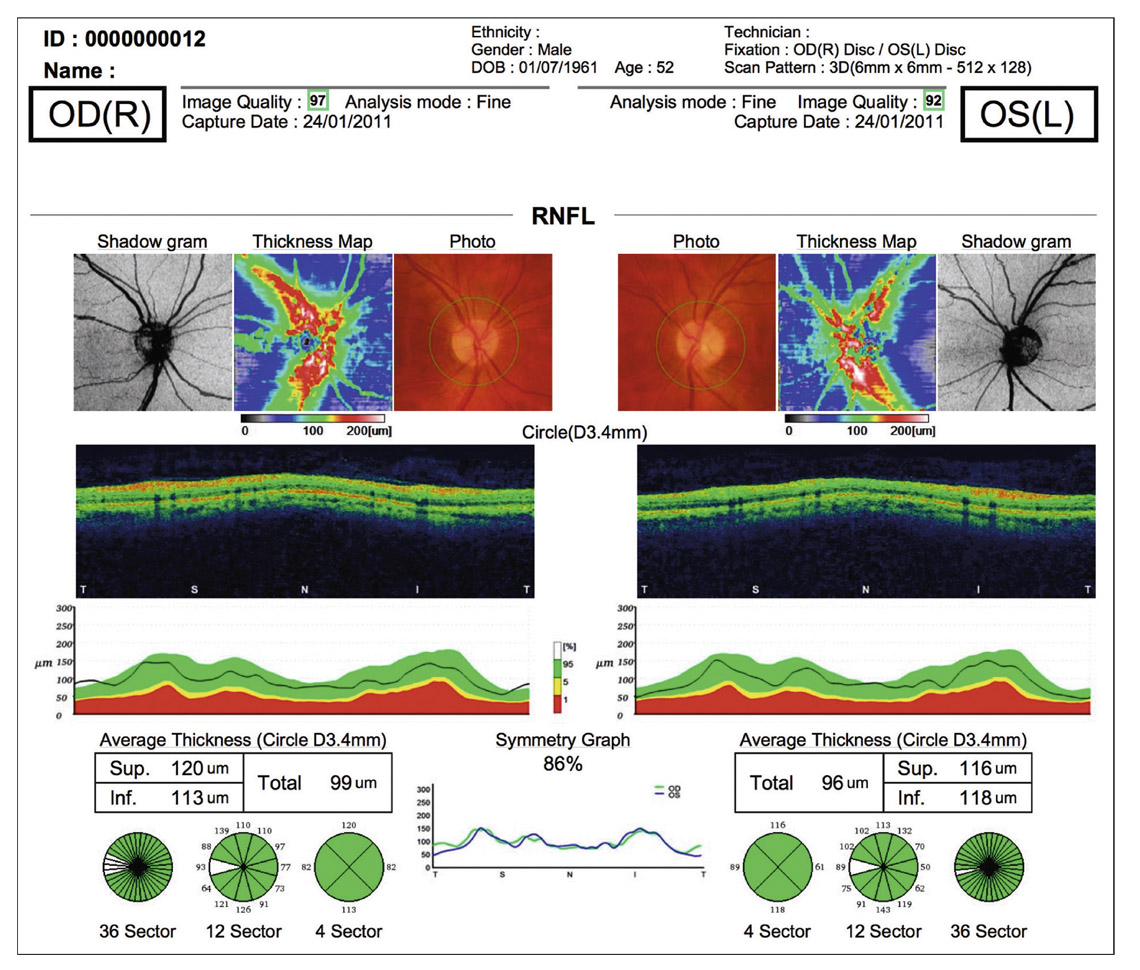
Fig. 9-77 a. Relevé normal 3D OCT 2000 Topcon des FNR.
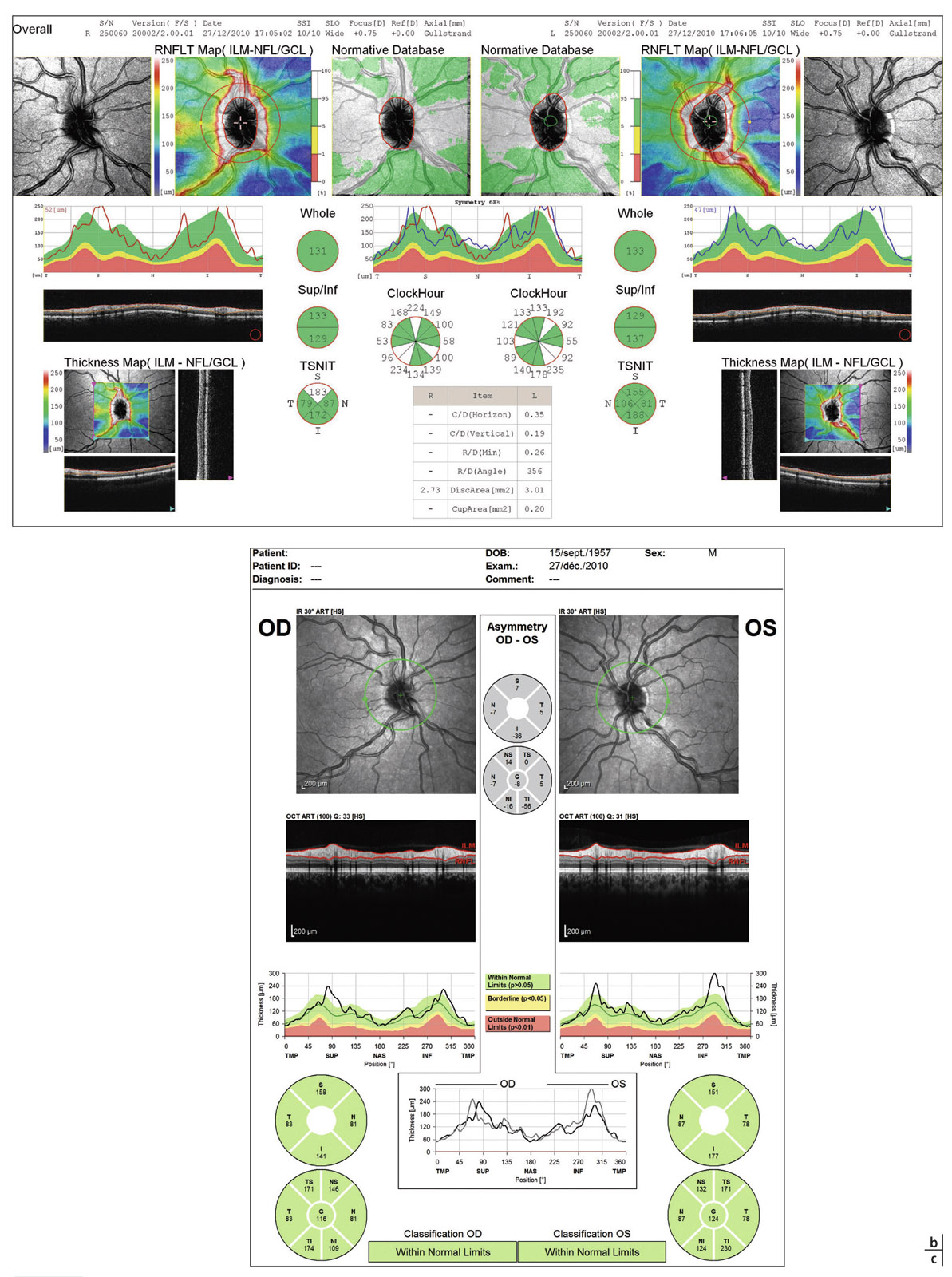
Fig. 9-77 b. Relevé normal NIDEK RS 3000 des FNR et du disque optique. c. Relevé normal OCT Spectralis Heidelberg des FNR.
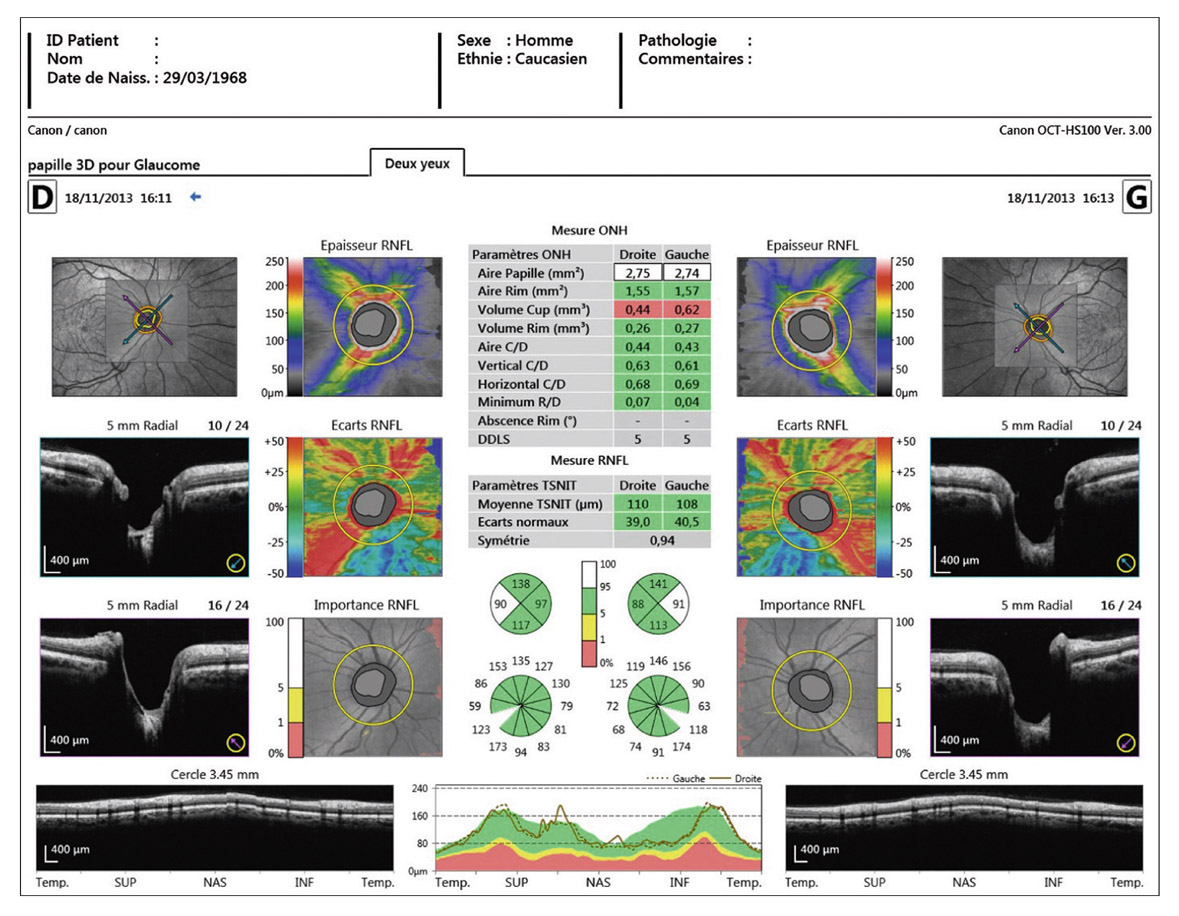
Fig. 9-77 d. Relevé normal OCT Canon HS 100 des FNR et du disque optique.
L’OCT-TD n’était pas jugé performant pour l’analyse des paramètres de la TNO en raison de la réalisation de seulement six scans radiaires et d’une extrapolation des données intermédiaires avec une faible résolution des acquisitions qui rendaient les analyses peu fiables et peu reproductibles.
Les OCT-SD ont nettement amélioré les acquisitions au niveau de la TNO grâce au nombre de scans-B (200 à 512) constitués de nombreux scans-A réalisés sur la zone papillaire et péripapillaire. Ils permettent ainsi d’obtenir une quantité importante d’informations à partir d’un volume tissulaire limité. La détermination, quasi automatique, des limites de l’épithélium pigmentaire et de la membrane de Bruch, repères importants, est bien plus aisée [12]. Cette tendance se confirme avec la nouvelle génération d’OCT-SS. Malgré les grandes variabilités anatomiques de la TNO qui rendent parfois difficiles la détection d’une neuropathie optique glaucomateuse débutante, son analyse devient de plus en plus performante [26].
Les acquisitions, désormais toutes équipées du contrôle « eye-tracking » de suivi du regard, se font, comme nous l’avons vu, soit sous la forme d’un cube volumétrique (Cirrus HD-OCT, Carl Zeiss Meditec, États-Unis ; RS-3000, Nidek, Japon ; 3D-OCT 2000, Topcon, Japon), soit par une association de scans-B circulaires et radiaires (RTVue 100, OptoVue, États-Unis).
La limite de la TNO est déterminée sur chaque coupe OCT par le point au niveau duquel se termine la membrane de Bruch. Ce point est localisé automatiquement par le programme de l’OCT. Le diamètre de la papille est calculé en mesurant la distance séparant deux points diamétralement opposés de la membrane de Bruch. Les difficultés d’analyse de la TNO en OCT résident dans la délimitation de la bordure du canal optique. En effet, ces limites ne sont pas toujours précises sur les différents axes. Les programmes d’analyse de la TNO sont d’ailleurs assez constamment pris en défaut en cas de dysversion papillaire.
À ce jour, les performances diagnostiques des paramètres de la TNO par rapport à celles des FNR restent l’objet de controverses [42, 52].
Si le consensus concernant les paramètres de la TNO en OCT-SD dans le GPAO n’est pas encore obtenu, de nombreux travaux ont permis de préciser les paramètres les plus pertinents à retenir et à suivre dans le cadre de l’évolution. Enfin l’excellente reproductibilité des mesures des paramètres de la TNO réalisées par les OCT de nouvelle génération a été rapportée dans plusieurs études [32, 39].
En général, les acquisitions de la TNO se font avec le « cube papillaire » et sont présentées sur le même relevé que celui de l’analyse des FNR.
– Cirrus HD-OCT 5000
Sur le relevé RNFL et ONH apparaissent de nombreuses données papillaires (voir fig. 9-75) :
-
Un tableau à la partie centrale supérieure du relevé regroupe les paramètres clés : l’aire de l’anneau neurorétinien (ANR) et du disque optique, le rapport C/D moyen, le rapport C/D vertical et le volume de l’excavation. Chaque paramètre est comparé avec la base de données normatives et une expression colorée des alertes est fournie en cas de valeur significativement anormale.
-
Un graphe de l’épaisseur de l’ANR est présenté, au centre, en déroulé « TSNIT » identique à celui de la couche des FNR. La symétrie des deux yeux peut être comparée sur ce graphe qui fait également apparaître la distribution des valeurs normales. Ce graphique est très intéressant pour localiser les encoches de l’ANR : Mwanza et al. [42] ont rapporté une très bonne sensibilité de son analyse (supérieure à celle des FNR).
-
Les limites du disque (en noir) et de l’excavation (en rouge) sont représentées sur la « carte de déviation » ou « carte des écarts » à la normale des épaisseurs RNFL.
-
Deux coupes OCT verticale et horizontale de la TNO sont également présentées à la partie latérale inférieure du relevé. Ces images permettent de vérifier le bon positionnement de la délimitation de la membrane de Bruch sur les deux axes principaux (vertical et horizontal). À noter que ces coupes OCT de la TNO sont souvent affichées avec un agrandissement de l’image dans la direction axiale afin de mieux observer et vérifier la segmentation des différentes couches rétiniennes mais pouvant donner un faux aspect d’excavation. Elles visualisent l’épithélium pigmentaire (noir), la membrane limitante interne surlignée en rouge et l’extrémité de la membrane de Bruch marquée par un point noir qui délimite l’excavation. L’espace entre les points rouges et noirs (limites de la membrane de Bruch) représente l’épaisseur de l’ANR. L’appareil considère que l’espace situé sous une ligne horizontale non représentée sur le relevé et située à 200 μm en avant du plan de la membrane de Bruch constitue le volume de l’excavation.
Les paramètres rapportés les plus discriminants à ce jour en OCT-SD au niveau de la TNO sont l’aire de l’ANR et le rapport C/D vertical.
– RTVue 100 (OptoVue, États-Unis)
Le rapport « ONH map » comporte les paramètres papillaires suivants (voir fig. 9-76) :
-
Les limites du disque optique et de l’excavation sont représentées sur la cartographie d’épaisseur de la couche des FNR.
L’excavation apparaît en gris clair et l’ANR en gris foncé.
-
Un tableau donne les paramètres volumétriques en mm3 : volumes de l’ANR, du disque optique et de l’excavation.
Un second tableau donne les autres paramètres de la TNO : aire du disque optique, de l’ANR de l’excavation, du rapport C/D, et rapport C/D vertical et horizontal.
– Autres OCT
La plupart des OCT-SD donnent certains paramètres papillaires, mais souvent moins que les deux OCT précédemment décrits. On retrouve en général le rapport C/D vertical et horizontal, la surface de l’ANR et de l’excavation, ainsi qu’une représentation visuelle des limites du disque et de l’excavation.
L’OCT-SD Spectralis avec son nouveau logiciel permet l’évaluation de l’indice BMO-MRW qui correspond à la distance minimale entre la terminaison de la membrane de Bruch et la membrane limitante interne avec, semble-t-il, un intérêt particulier pour déterminer la surface de l’ANR, mais qui doit encore être confirmé pour le diagnostic et le suivi de la progression du GPAO (fig. 9-78) (voir chapitre 10).
L’atteinte de la couche des cellules ganglionnaires rétiniennes, bien plus épaisse au niveau de la région maculaire, a été mise en évidence dans le glaucome par différentes études depuis de nombreuses années [11, 17, 21, 54, 55].
La meilleure résolution axiale des OCT-SD, de l’ordre de 3 à 7 microns, permet une segmentation intrarétinienne plus fine et reproductible, et une évaluation séparée des différentes couches de la rétine. C’est ainsi que s’est développée la mesure de l’épaisseur du complexe maculaire cellulaire ganglionnaire, défini par l’ensemble représenté au niveau de la région maculaire par les couches des FNR (RNF), des cellules ganglionnaires (CG-GCL) et de la plexiforme interne (CPI-IPL).
La possibilité d’analyse de ces couches internes de la rétine présente un intérêt potentiel d’une meilleure capacité de détection lésionnelle du site structural de la neuropathie optique glaucomateuse par rapport à l’étude de l’épaisseur totale de la rétine [2, 3, 7, 9-10, 13-15, 16, 18, 19, 23, 25, 28, 34, 35, 37, 38, 40, 41, 45, 48, 51, 53].
L’analyse du complexe maculaire cellulaire ganglionnaire se justifie par plusieurs avantages anatomiques, physiologiques et techniques :
-
plus de 50 % de l’ensemble des cellules ganglionnaires rétiniennes sont localisées dans la zone maculaire ainsi étudiée ;
-
limitation relative de variabilité de cette population cellulaire ganglionnaire dans la région paramaculaire chez les sujets normaux, comme cela a été démontré en histologie [8] ;
-
structure maculaire relativement constante et simple avec moins de variabilité anatomique (pente maculaire) que les autres structures analysées en OCT (couche des FNR et TNO), absence de gros vaisseaux source possible d’artéfacts d’évaluation de l’épaisseur des couches rétiniennes en OCT ;
-
la couche des cellules ganglionnaires représente environ 30 % de l’épaisseur rétinienne maculaire de telle sorte que l’exploration des modifications de la région maculaire peut présenter un plus grand intérêt pour un diagnostic plus précoce du glaucome ;
-
qualité d’acquisition en OCT plus facile car obtenue par une fixation centrale du patient ;
-
acquisition d’un plus grand nombre de scans maculaires avec un balayage plus dense et plus précis en OCT-SD à l’origine d’un plus grand nombre d’informations.
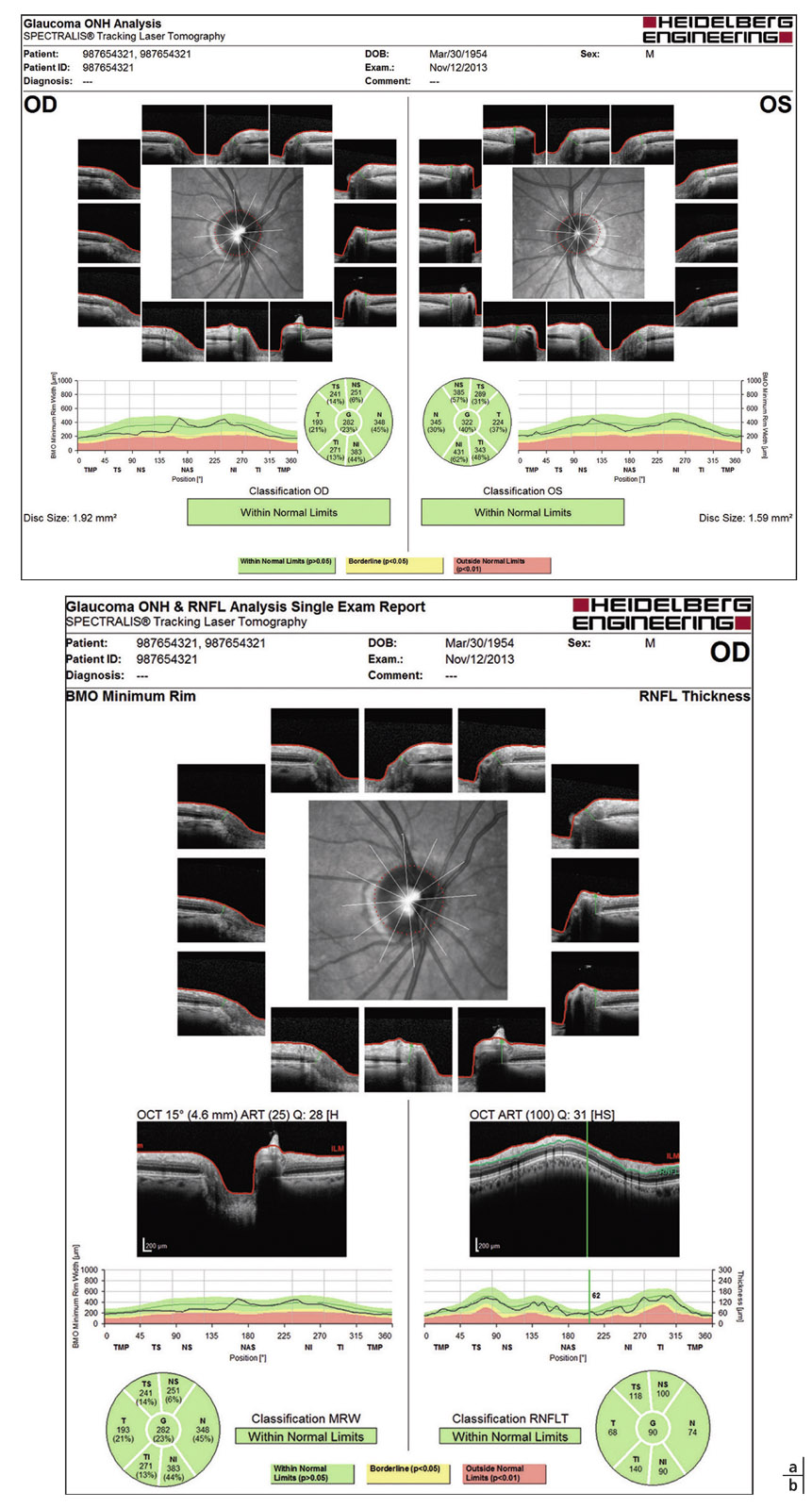
Fig. 9-78 a. Relevé normal d’analyse de l’indice BMO (Bruch membrane opening) de la TNO OCT Spectralis. b. Relevé normal d’analyse de l’indice BMO de la TNO et des FNR OCT Spectralis.
Plusieurs études sont venues confirmer la concordance qualitative des relevés actuels obtenus en OCT-SD par rapport aux résultats des analyses histologiques. Récemment, des travaux de l’analyse histologique de l’épaisseur de la couche des cellules ganglionnaires et des couches choroïdorétiniennes au niveau maculaire, réalisées par deux observateurs en plusieurs localisations (25) sur 18 yeux donneurs, a été comparée aux données obtenues en OCT. Après l’utilisation d’un facteur de correction pour tenir compte du rétrécissement des mesures réalisées sur les coupes histologiques et lié à la préparation, les résultats rapportent une concordance frappante entre les données relevées en OCT-SD et les mesures histologiques corrigées. Ces travaux suggèrent un très haut degré de correspondance entre les données OCT réalisées in vivo et l’ensemble des donnés histologiques post mortem [9] (fig. 9-79).
Une autre étude comparative de l’épaisseur de la couche des cellules ganglionnaires et de la couche plexiforme interne mesurées en OCT-SD avec les données histologiques chez des patients atteints de glaucome sévère (pertes supérieures à – 15 dB) et chez 30 sujets témoins rapporte une diminution de l’épaisseur des deux couches laissant une couche constituée à la fois par une couche de cellules ganglionnaires résiduelles et une couche plexiforme interne. Il persiste ainsi dans ces glaucomes très évolués une couche résiduelle concernant aussi bien les deux parties avec un certain nombre de cellules ganglionnaires et la couche plexiforme interne, même si cette dernière contribue légèrement plus à cette couche résiduelle [38].
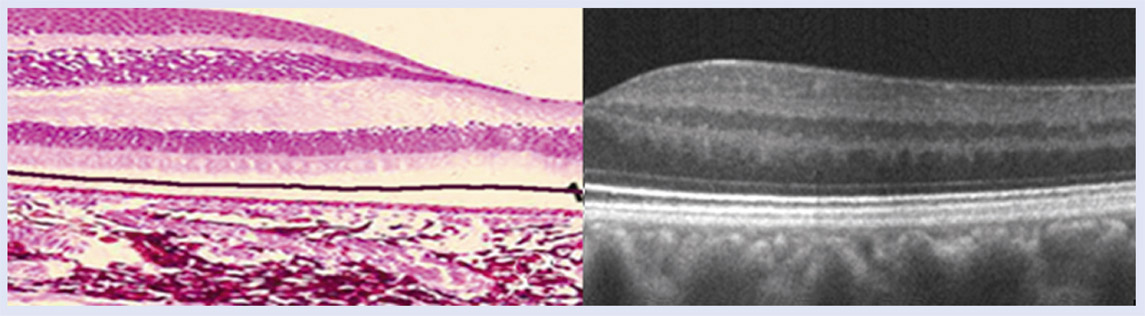
Fig. 9-79 Correspondance histologie rétinienne et relevé OCT.
Comme pour l’analyse des FNR, les relevés doivent être de bonne qualité. Le score ou puissance du signal doit être vérifié pour chacun des relevés avec un respect des valeurs minimales de qualité du signal propre à chaque appareil.
L’interprétation du relevé se fait sur les cartes colorimétriques, les cartes d’épaisseurs et les cartes de déviations par rapport à une base de données normatives selon l’âge et l’ethnie, propre à chaque appareil.
La carte des épaisseurs du complexe correspond à une représentation colorimétrique, globalement circulaire, de la disposition topographique du GCC ou des couches des cellules ganglionnaires et de la couche plexiforme interne, au niveau de l’aire maculaire étudiée avec des couleurs chaudes pour les couches les plus épaisses et froides pour les zones les plus minces du complexe. Il est important d’apprécier et d’analyser la répartition régulière ou non dans les différents secteurs. Elle permet d’attirer l’attention au niveau d’une zone déficitaire débutante ou évoluée. Un aspect totalement asymétrique, en coin, ou une déformation anormale (sablier, expansion latérale, etc.) doit éveiller l’attention à la recherche d’un artéfact (erreur de segmentation de l’algorithme de l’OCT, pathologie maculaire sous-jacente, trouble des milieux oculaires, etc.). La carte des déviations ou carte des « écarts » est une représentation de l’analyse statistique comparative des résultats avec les valeurs de référence des sujets de la même classe d’âge. Une représentation colorée souligne l’importance statistique de l’écart des valeurs (couleur jaune pour une anomalie à p < 5 % ou rouge si p < 1 %). La présentation sectorielle de la région maculaire avec les valeurs numériques de l’épaisseur dans chacun des secteurs est complétée par un tableau des mesures des différents paramètres : épaisseur moyenne ; épaisseurs des hémi-zones maculaires supérieure et inférieure selon les appareils ; valeurs d’indices supplémentaires pour certains OCT-SD (GCIPL minimum du Cirrus HD-OCT, GLV et FLV du RTVue).
Pour les atteintes précoces, l’analyse de la sensibilité des différents paramètres du relevé rapporte une plus grande sensibilité diagnostique du secteur temporal inférieur quand il peut être évalué (Cirrus HD-OCT) et du secteur maculaire inférieur, ainsi que des indices supplémentaires.
L’analyse des résultats en fonction du code coloré doit respecter les mêmes règles que l’analyse de la couche des FNR péripapillaires. L’observation d’une couleur rouge ne doit pas être interprétée de façon isolée sans comparaison avec les résultats des autres données des relevés. En effet, les codes colorés utilisés par rapport aux bases normatives ne recouvrent pas l’ensemble des variations qui peuvent être observées au sein de la population normale. Ces bases dites de référence correspondent à un échantillon limité de sujets normaux de la même classe d’âge et ne peuvent pas couvrir l’ensemble des variations éventuelles observables au sein de la population normale. L’observation d’un résultat avec un code coloré rouge (théoriquement observé chez moins de 1 % de la population normale) doit attirer l’attention, mais ne doit pas classer systématiquement le résultat en tant que valeur anormale [2].
Un certain nombre de résultats est exprimé en code coloré rouge, alors que l’analyse des résultats fonctionnels chez le même patient montre la persistance d’une fonction dans le même secteur analysé. Il semblerait qu’il existe, comme pour l’analyse des FNR péripapillaires, un effet dit « plancher » correspondant à un seuil à partir duquel l’expression des résultats se fait selon un code maximal d’anomalie au-delà duquel l’évaluation de la progression ne puisse pas être exprimée par l’intermédiaire de ce type de résultat. Cependant, des études récentes réalisées chez des patients atteints de glaucome avancé (MD ≤ – 15 dB) rapportent la persistance d’une certaine couche de cellules ganglionnaires résiduelles en OCT-SD [38]. Des études sont encore nécessaires pour préciser ces données.
Un certain nombre de facteurs doivent être considérés lors de l’interprétation des relevés :
-
des facteurs liés au patient : épaisseurs souvent plus faibles chez le sujet myope et plus importantes en cas d’hypermétropie [45] ; une plus grande longueur axiale du globe oculaire peut expliquer une relative diminution d’épaisseur ; enfin un intérêt particulier de l’analyse du GCC en cas de dysversion ou autre anomalie papillaire d’examen difficile ;
-
des facteurs liés à l’OCT-SD et à la technique d’acquisition : toujours vérifier l’indice de qualité du relevé, indice « SS », variable et spécifique pour chaque OCT-SD ; considérer avec prudence l’expression des résultats en fonction de la base normative selon un code coloré.
– Cirrus HD-OCT 5000 (fig. 9-80)
L’analyse du complexe cellulaire ganglionnaire (ou GCA pour ganglion cell analysis) est possible après l’acquisition d’un cube maculaire en protocole 200 × 200 ou bien en protocole 128 × 512 (voir plus haut). Le GCA tient compte des épaisseurs de la couche des cellules ganglionnaires (GCL) et de la couche plexiforme interne (IPL), constituant l’indice GCIPL. Sa très haute reproductibilité a été rapportée par de nombreuses études [15].
Le relevé du rapport GCA comporte plusieurs éléments importants à analyser :
-
Une carte d’épaisseur du complexe GCIPL qui apparaît en transparence sur le fond d’œil du patient. Les épaisseurs sont représentées en couleurs chaudes (rouge et jaune) pour les épaisseurs élevées et en couleur froides (bleu à noir) pour les épaisseurs plus faibles. Cette carte d’épaisseur permet de visualiser directement les atteintes importantes qui souvent ne concernent qu’un hémi-champ et respectent le raphé médian. Les atteintes débutantes sont en général plus marquées dans le secteur temporal, notamment en temporal inférieur.
-
Une carte des déviations à la normale dans la zone ellipsoïdale d’analyse est affichée en dessous. Les pixels jaunes et rouges correspondent à des amincissements anormaux pour l’âge à p < 5 % ou à p < 1 %.
Une atteinte débutante dans le secteur temporal inférieur, fréquemment le premier concerné par un amincissement dans les glaucomes débutants, doit être systématiquement recherchée.
-
Le relevé permet d’obtenir l’épaisseur moyenne (GCL moyen) de l’ensemble du complexe GCL (couche des cellules ganglionnaires et de la couche plexiforme interne) ainsi que l’épaisseur moyenne au niveau des trois secteurs supérieurs et des trois secteurs inférieurs de la zone elliptique analysée. Ces résultats sont complétés par un indice : l’épaisseur moyenne minimum du complexe GCL (GCL minimum) qui correspond en fait au rayon de mesure radiaire du complexe, à partir de la fovéa, avec la plus petite valeur moyenne sur l’ensemble des 360 rayons de mesure de la zone elliptique relevée. Des études récentes soulignent l’intérêt particulier de cet indice dans la détection des glaucomes précoces, en particulier dans les glaucomes à pression normale [10, 40].
-
À la partie inférieure du relevé, un scan-B horizontal permet de vérifier la bonne qualité de la segmentation des couches cellulaires ganglionnaires et de la plexiforme interne par l’algorithme GCA et de s’assurer que le profil maculaire est normal.
– RTVue 100 (fig. 9-81)
L’OCT analyse le complexe cellulaire ganglionnaire en entier (NFL + GCL + IPL). Il est légèrement décalé en temporal de la macula où les atteintes précoces prédominent en raison de la distribution des FNR. Le relevé GCC comporte trois cartes différentes ainsi qu’un tableau récapitulatif des paramètres les plus importants :
-
Carte colorée des épaisseurs du GCC dans l’ensemble de la région étudiée (zone de 6 mm de diamètre) avec des couleurs chaudes (rouge-jaune) pour les valeurs élevées et froides (bleu-noir) pour les valeurs faibles avec une correspondance à une échelle en microns.
-
Carte de déviation aux valeurs normales, carte colorée de déviation par rapport à la population normale : couleur bleue correspondant à une baisse de 20 à 30 % de l’épaisseur du complexe GCC, couleur noire correspondant à une baisse supérieure à 50 % par rapport à la base normative de référence de sujets de même âge.
-
Carte de significativité similaire à celle obtenue dans l’analyse de la couche des FNR péripapillaires (couleur rouge correspondant à une déviation statistiquement significative à p < 1 %, jaune p < 5 %, et vert correspondant aux valeurs observées chez 5 à 95 % de la population normale de référence).
-
Les résultats chiffrés des épaisseurs moyennes globales ainsi que des hémi-zones maculaires supérieure et inférieure sont complétés par deux indices. L’indice FLV (focal loss volume) correspond au pourcentage de volume de perte significative focale sur l’ensemble de la carte du complexe GCC analysé en se rapportant au volume normal pour l’âge. L’indice GLV (global loss volume) en pourcentage correspond à la quantité moyenne de cellules ganglionnaires perdues en volume, sur l’ensemble de la carte GCC analysée. Ces deux indices possèdent une excellente sensibilité diagnostique.
– Autres OCT
Les autres OCT-SD ont également des programmes d’analyse du complexe cellulaire ganglionnaire. Les relevés de la majorité des appareils rapportent les cartes des épaisseurs de déviations et de significativité du complexe GCC ainsi que ses valeurs moyennes et celle des hémi-champs maculaires supérieur et inférieur. L’OCT RS-3000 de Nidek permet une analyse du GCC dans une zone de 9 × 9 mm2 selon une grille EDTRS (fig. 9-82), et l’OCT Canon HS-100 dans une zone de 13 × 9 μmm2 (fig. 9-83).
L’OCT 3D-OCT 2000 de Topcon dispose d’un programme qui donne à la fois les valeurs du GCC et celles du complexe GCIPL ainsi qu’une analyse d’asymétrie selon un code coloré qui complète le relevé des données (fig. 9-84). Enfin l’OCT-Spectralis de Heidelberg apporte une analyse d’asymétrie complémentaire entre les hémi-champs maculaires du même œil (fig. 9-85).
Lors de l’interprétation des résultats, il est important de rechercher une atteinte débutante dans le secteur temporal inférieur, ainsi que dans le secteur maculaire inférieur au niveau des cartes de déviations statistiques afin de dépister un déficit précoce.
Le fait que l’épaisseur moyenne du complexe soit moins sensible et moins spécifique pour la détection précoce d’une atteinte (GCIPL moyen) peut être lié aux particularités des stades précoces affectant le plus souvent les pôles maculaires supérieur et inférieur en premier alors que la moyenne reste dans les limites normales.
De l’ensemble des protocoles d’acquisition utilisés par les différents appareils OCT présentés ici, nous pouvons retenir que chacun utilise un protocole différent avec des algorithmes non comparables d’un appareil à l’autre, avec dans certains cas une analyse globale des différentes couches du complexe cellulaire ganglionnaire maculaire, et dans d’autres une analyse plus sélective de la couche des cellules ganglionnaires. Enfin certains OCT-SD donnent, avec l’analyse du complexe maculaire cellulaire ganglionnaire, des indices supplémentaires de quantification des pertes cellulaires ganglionnaires (indices GCIPL minimum pour le Cirrus HD-OCT, indices FLV et GLV pour le RTVue) qui viennent compléter les informations et semblent présenter un intérêt clinique particulier. En effet, avec une sensibilité diagnostique équivalente voire supérieure à celle de l’analyse de la couche des FNR péripapillaires, ces indices représentent une source d’informations complémentaires importantes en fonction du contexte clinique [10, 16].
Il faut donc retenir que les résultats obtenus par ces différents appareils ne doivent pas être comparés et ne sont pas interchangeables d’un appareil à l’autre comme c’est le cas pour l’analyse des FNR péripapillaires avec les différents OCT-SD.
La physiopathogénie de la neuropathie optique glaucomateuse n’est pas encore totalement élucidée, comme nous l’avons vu. Il persiste toutefois deux hypothèses dominantes : la théorie mécanique et la théorie vasculaire qui attribue le développement de la neuropathie optique glaucomateuse à une ischémie secondaire à une mauvaise perfusion de la TNO au passage à travers la lame criblée [7, 13, 18]. Les études histologiques sont controversées et la description de l’EDI-OCT (EDI pour enhenced depth imaging) par l’équipe de Spaide en 2008 a permis une approche plus précise de la choroïde [51]. À ce jour les résultats des études ne permettent pas de mettre en évidence une relation directe entre épaisseur choroïdienne et GPAO ou GPN [14, 34, 35, 41, 48], et il semblerait que l’épaisseur choroïdienne, désormais mesurable en EDI-OCT, ne soit pas pertinente dans l’évaluation du flux sanguin choroïdien [3].
Les nouveaux OCT-SD permettent une acquisition plus précise de l’imagerie de la lame criblée avec des analyses de plus en plus performantes de leurs caractéristiques en HD-OCT, en particulier avec le mode EDI (fig. 9-86). Elles augmentent ainsi la possibilité d’évaluation de cette structure anatomique importante dans la physiopathogénie de la neuropathie glaucomateuse. Les OCT-SS nous laissent également entrevoir une approche et une analyse encore plus fine de cette zone anatomique essentielle ainsi que de ses modifications au cours de l’évolution (fig. 9-87). Ils ouvrent des perspectives particulièrement enthousiasmantes pour l’analyse de l’atteinte structurale dans le glaucome.
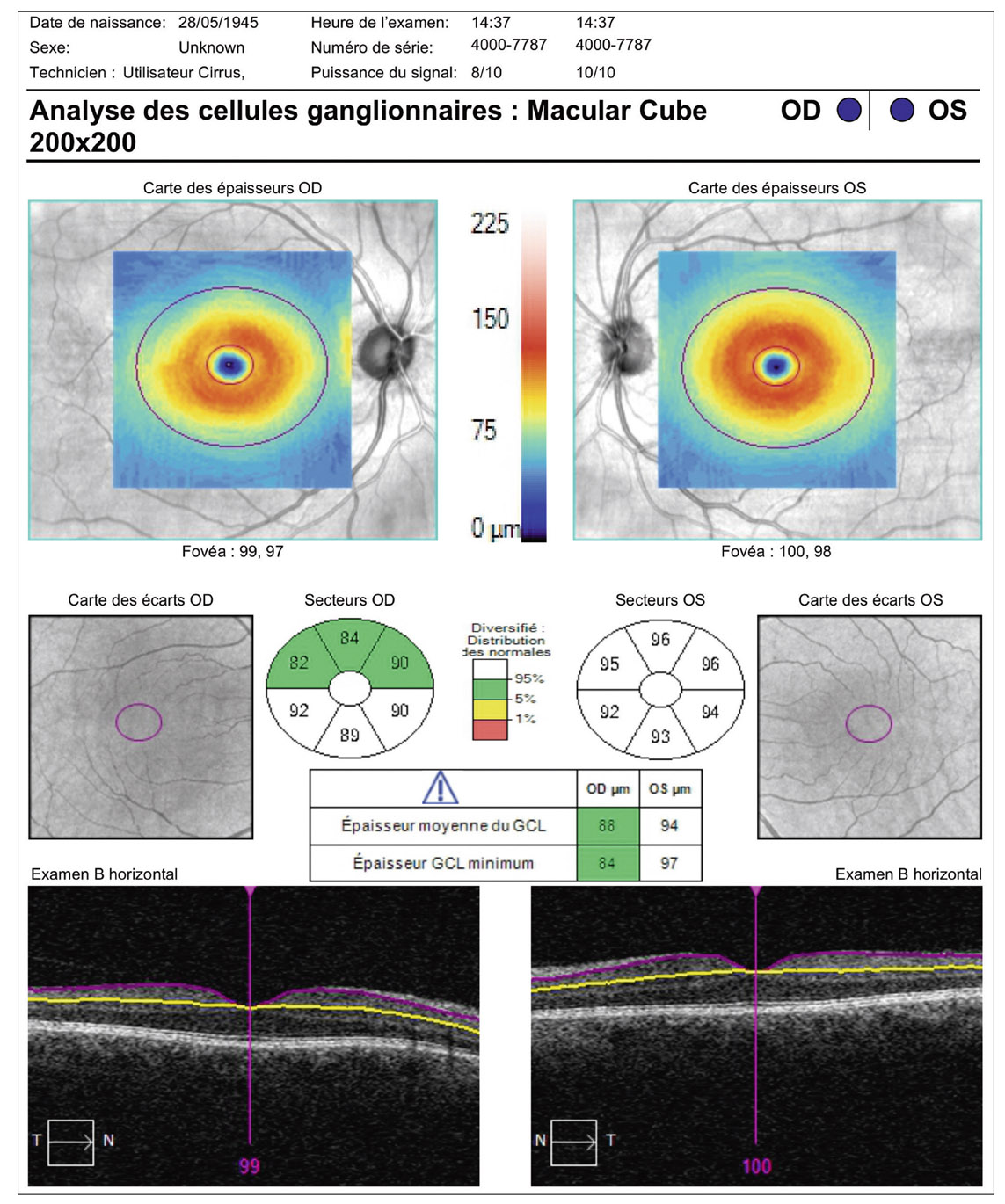
Fig. 9-80 Relevé normal Cirrus HD-OCT du complexe cellulaire ganglionnaire GCL et plexiforme interne.
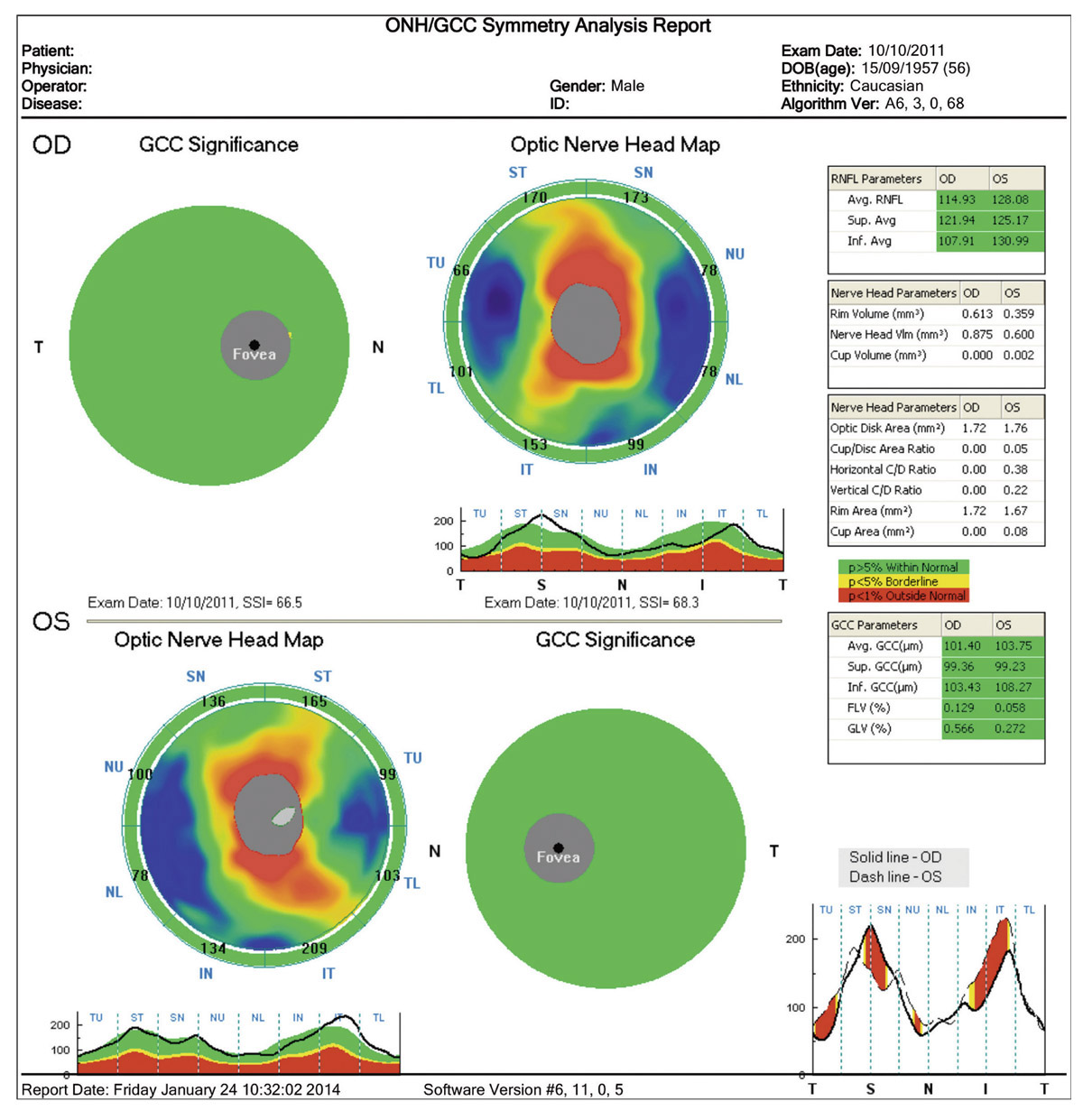
Fig. 9-81 Relevé normal RTVue du GCC avec analyse de symétrie OD-OG.
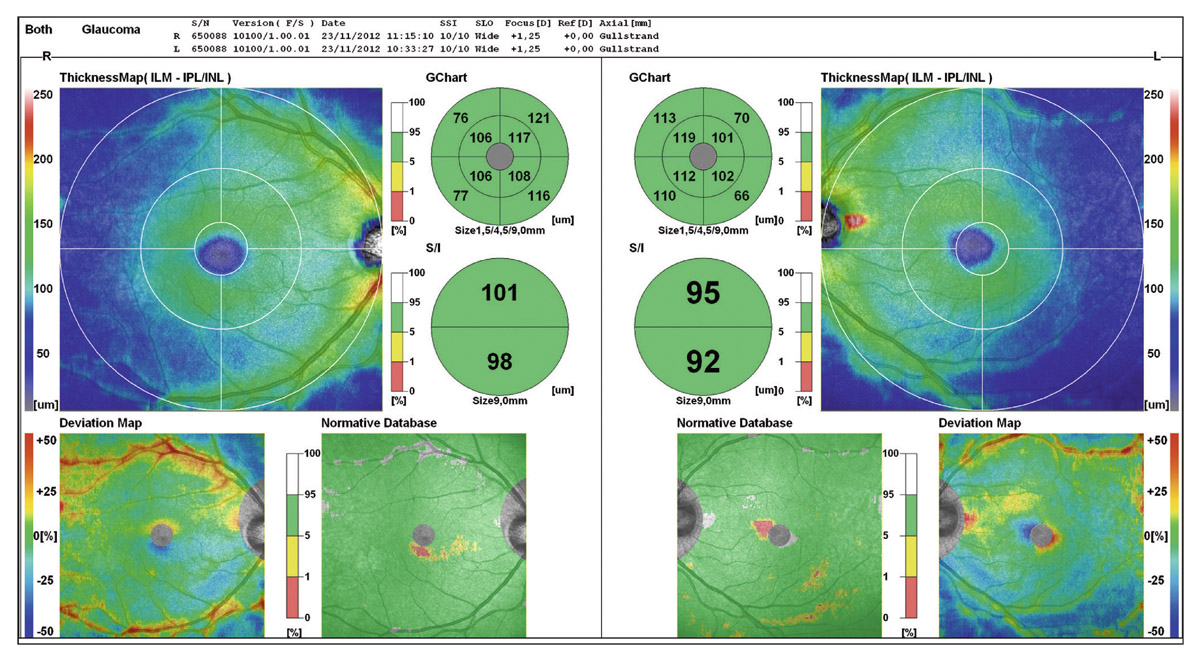
Fig. 9-82 Relevé normal du GCC maculaire OCT-SD RS 3000 Nidek.
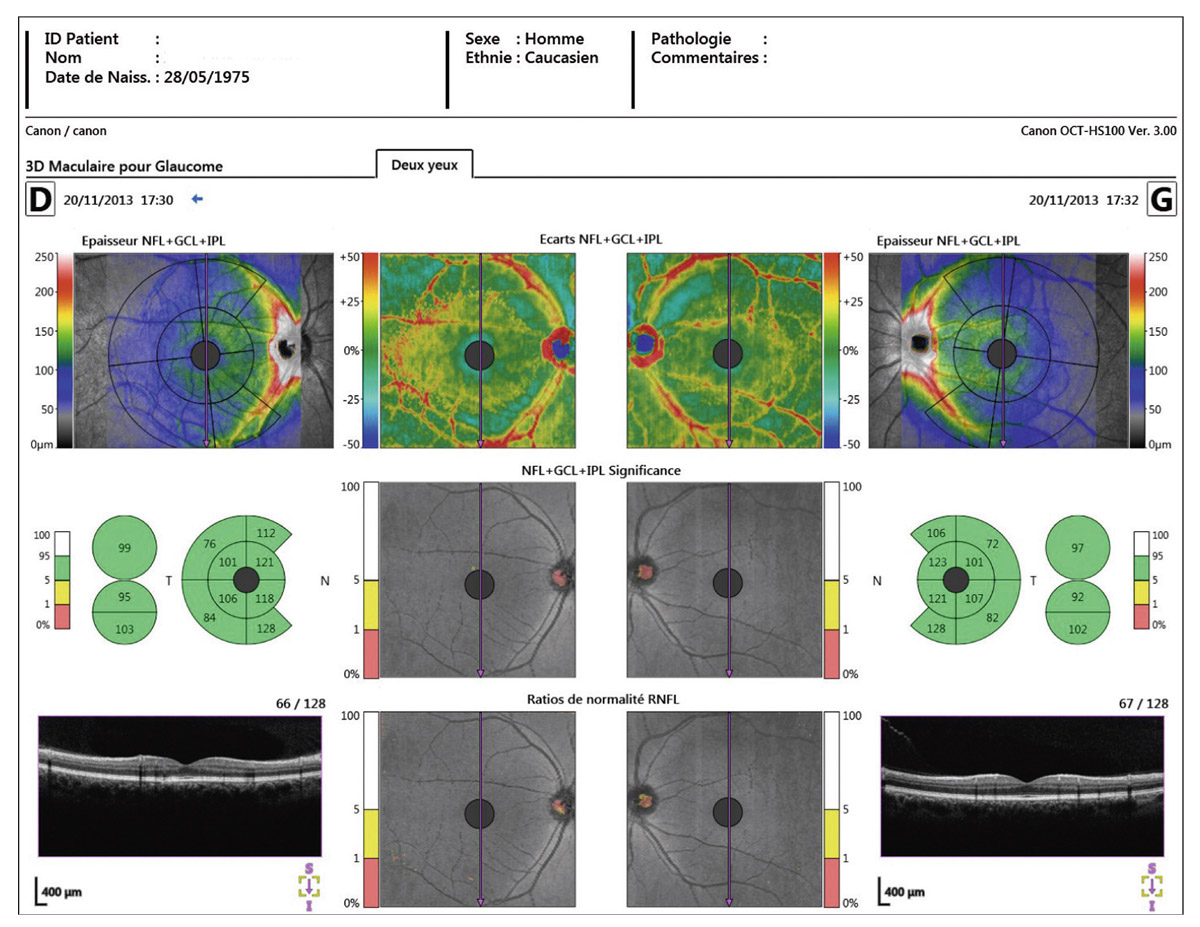
Fig. 9-83 Relevé normal du complexe maculaire OCT Canon HS 100.
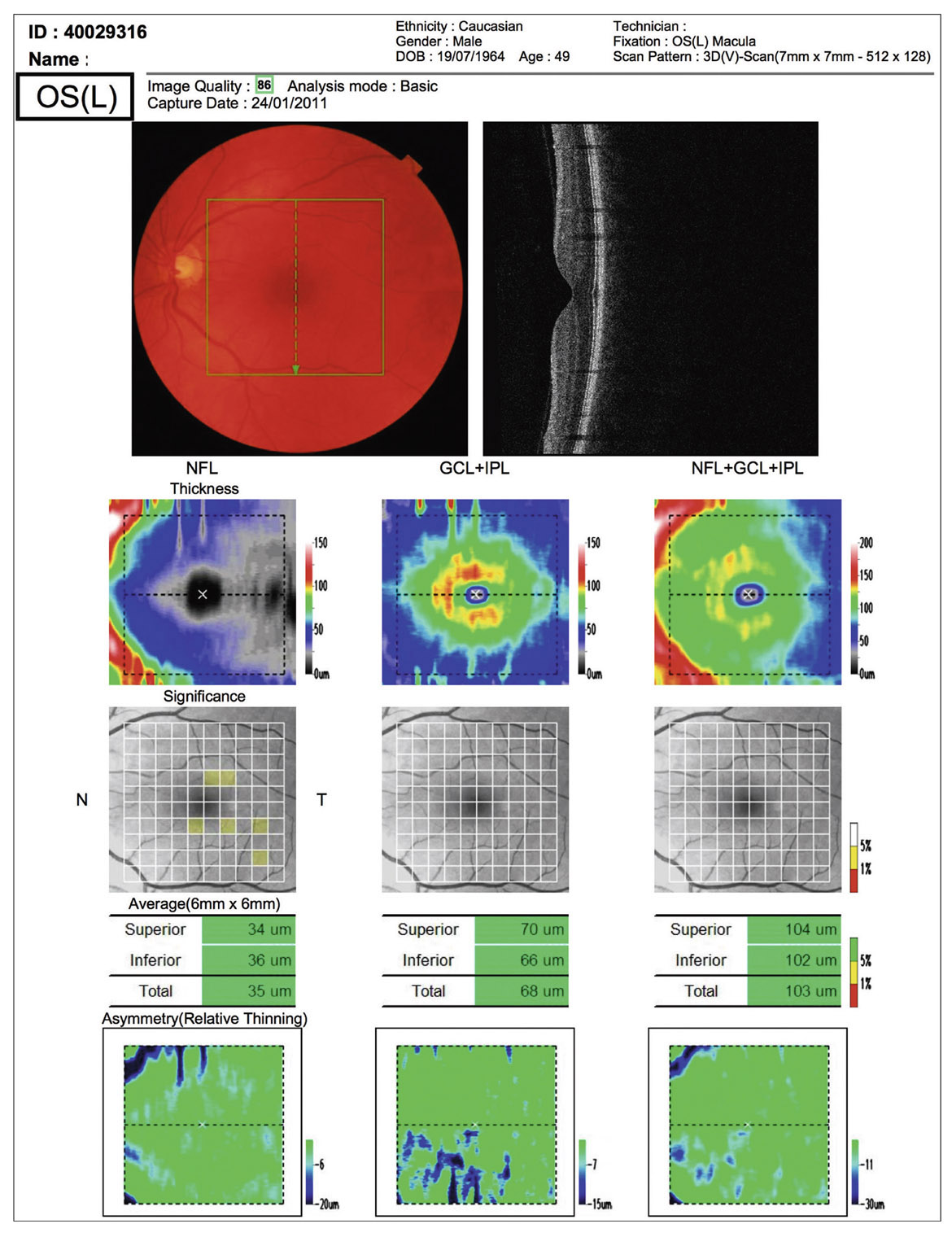
Fig. 9-84 Relevé normal du GCC 3D-OCT 2000 Topcon.

Fig. 9-85 a. Relevé normal pôle postérieur avec analyses d’asymétries hémi-champ visuel et OD-OG OCT Spectralis. b. Carte de la couche des cellules ganglionnaires. c. Carte de la couche des FNR OCT Spectralis.
Fig. 9-86 Analyse de la lame criblée Cirrus HD-OCT.
Fig. 9-87 Imagerie de la TNO et de la lame criblée sur un prototype OCT-SS Zeiss.
Un certain nombre d’artéfacts sont possibles et doivent être reconnus pour une bonne interprétation. Certains ont déjà été détaillés :
-
le mauvais centrage au niveau de la fenêtre d’acquisition (observé selon les séries dans 5 à 8 % des relevés [23]) ;
-
le positionnement du patient [28] ;
-
la qualité du signal.
Une taie cornéenne, une cataracte ou une opacité vitréenne peuvent diminuer la qualité globale d’une acquisition (la puissance globale du signal est alors diminuée), mais également donner des artéfacts isolés malgré un bon signal, à reconnaître afin de répéter l’acquisition en dehors de ces zones de mauvaise transmission du signal lumineux de l’OCT (fig. 9-88).
Ils sont à l’origine d’artéfacts linéaires horizontaux en vagues qui perturbent totalement l’acquisition des scans OCT [25].
Ce sont des facteurs à considérer car associés à un amincissement de la couche des FNR ou du GCC avec de faux résultats positifs [25, 28, 37].
Les attaches pathologiques de la hyaloïde postérieure à la membrane limitante interne et les œdèmes papillaires peuvent entraîner un épaississement de la couche des FNR. La choroïdose myopique ainsi que toutes les atrophies péripapillaires sont source d’artéfacts et de relevés souvent ininterprétables.
Toutes les anomalies maculaires (membranes, matériel rétrofovéolaire, maculopathie liée à l’âge, œdème maculaire débutant) peuvent perturber la segmentation du GCC et le relevé [19] (fig. 9-89).
Les dysversions papillaires sont encore mal analysables en OCT-SD.
Tous ces pièges soulignent l’importance de leur recherche par un examen clinique systématique soigneux avant la réalisation de l’examen.
Les récents systèmes de contrôle « eye-tracking », maintenant disponibles pour l’acquisition des images, ont permis de réduire la fréquence des défauts d’alignements initialement observés jusque dans 30 % des relevés et liés aux microsaccades oculaires au cours de la fixation, mais semble-t-il sans conséquence sur la mesure de l’épaisseur des FNR [37].
Nous retiendrons que tout scan, même avec un signal d’acquisition de haute qualité précis et reproductible, peut présenter des artéfacts qui doivent être connus et recherchés car susceptibles d’affecter l’interprétation finale.
Fig. 9-88 Piège d’acqusition OCT par trouble des milieux de l’œil droit lié à une cataracte polaire postérieure.
Fig. 9-89 a, b. Relevé avec erreur de segmentation par membrane épirétinienne (MER) de l’œil gauche (b).
Retenir
-
Détection des pertes cellulaires rétiniennes ganglionnaires précoces en OCT-SD.
-
Savoir réaliser une bonne acquisition :
-
ne considérer que les images au rapport signal/bruit (SS) suffisant ;
-
dilater le patient si le signal d’acquisition est trop faible ;
-
en cas d’anomalie sur le rapport, contrôler la segmentation sur les scans-B.
-
-
Associer acquisitions FNR, GCC et TNO pour une meilleure évaluation de l’atteinte structurale.
-
Intérêt dans l’acquisition des FNR des valeurs moyennes mais également de l’aspect de la carte des épaisseurs qui permet un diagnostic plus précoce de l’atteinte de la couche des FNR.
-
Les nouvelles acquisitions de la TNO en OCT-SD évaluent des paramètres plus fiables et reproductibles dont l’analyse a montré la sensibilité diagnostique.
-
Intérêt en GCC des cartes de déviation, des cartes de significativité et des indices complémentaires de certains OCT-SD (FLV, GLV, GCIPL minimum) précisant l’importance et les particularités du déficit global et/ou du déficit focal du complexe cellulaire ganglionnaire.
-
Intérêt des acquisitions GCC dans certaines formes cliniques : atrophie péripapillaire, myopie forte, dysversion.
-
Examen clinique maculaire toujours associé pour une acquisition GCC : détecter une pathologie maculaire débutante.
-
Moyen d’évaluation structurale complémentaire.
-
Connaître les limites et pièges de ce moyen d’imagerie.
-
Les résultats des différents OCT ne sont pas interchangeables.
Ne pas oublier !
Toujours confronter les résultats avec les données cliniques et celles du champ visuel avant de prendre une décision thérapeutique.
[1] Asrani S, Rosdahl JA, Allingham RR. Novel software strategy for glaucoma diagnosis : asymmetry analysis of retinal thickness. Arch Ophthalmol. 2011 ; 129 : 1205-11.
[2] Balasubramanian M, Bowd C, Vizzeri G, et al. Effect of image quality on tissue thickness measurements obtained with spectral domain-optical coherence tomography. Opt Express. 2009 ; 17 : 4019-36.
[3] Banitt M. The choroid in glaucoma. Curr Opin Ophthalmol. 2013 ; 24 : 125-9.
[4] Budenz DL, Anderson DR, Varma R, et al. Determinants of normal retinal nerve fiber layer thickness measured by Stratus OCT. Ophthalmology. 2007 ; 114 : 1046-52.
[5] Burgansky-Eliash Z, Wollstein G, Chu T, et al. Optical coherence tomography machine learning classifiers for glaucoma detection : a preliminary study. Invest Ophthalmol Vis Sci. 2005 ; 46 : 4147-52.
[6] Chen HY, Huang ML. Discrimination between normal and glaucomatous eyes using Stratus optical coherence tomography in Taiwan Chinese subjects. Graefes Arch Clin Exp Ophthalmol. 2005 ; 243 : 894-902.
[7] Cioffi GA, Wang L, Fortune B, et al. Chronic ischemia induces regional axonal damage in experimental primate optic neuropathy. Arch Ophthalmol. 2004 ; 122 : 1517-25.
[8] Curcio CA, Allen KA. Topography of ganglion cells in human retina. J Comp Neurol. 1990 ; 300 : 5-25.
[9] Curcio CA, Messinger JD, Sloan KR, et al. Human chorioretinal layer thicknesses measured in macula-wide, high-resolution histologic sections. Invest Ophthalmol Vis Sci. 2011 ; 52 : 3943-54.
[10] Delbarre M, El Chehab H, Francoz M, Renard JP. Diagnostic use of macular layers analysis by SD-OCT in primary open angle glaucoma. J Fr Ophtalmol. 2013 ; 36 : 723-31.
[11] Desatnik H, Quigley HA, Glovinsky Y. Study of central retinal ganglion cell loss in experimental glaucoma in monkey eyes. J Glaucoma. 1996 ; 5 : 46-53.
[12] Downs JC, Yang H, Girkin C, et al. Three-dimensional histomorphometry of the normal and early glaucomatous monkey optic nerve head : neural canal and subarachnoid space architecture. Invest Ophthalmol Vis Sci. 2007 ; 48 : 3195-208.
[13] Duijm HF, van den Berg TJ, Greve EL. Choroidal haemodynamics in glaucoma. Br J Ophthalmol. 1997 ; 81 : 735-42.
[14] Fenolland JR, Giraud JM, May F, Renard JP. [Enhanced depth imaging of the choroid in open-angle glaucoma : a preliminary study]. J Fr Ophtalmol. 2011 ; 34 : 313-7.
[15] Francoz M, Fénolland JR, Giraud JM, Renard JP. Reproducibility of macular ganglion cell-inner plexiform layer thickness measurement with cirrus HD-OCT in normal, hypertensive and glaucomatous eyes. Br J Ophthalmol. 2013 ; Dec 4. doi : 10.1136.
[16] Francoz M, El Chehab H, Fénolland JR, Renard JP. Ganglion cell complex measurement and glaucoma diagnosis using two SD-OCT. Acta Ophthalmologica. 2013 ; 91 : 0. doi : 10.1111.
[17] Frishman LJ, Shen FF, Du L, et al. The scotopic electroretinogram of macaque after retinal ganglion cell loss from experimental glaucoma. Invest Ophthalmol Vis Sci. 1996 ; 37 : 125-41.
[18] Fuchsjager-Mayrl G, Wally B, Georgopoulos M, et al. Ocular blood flow and systemic blood pressure in patients with primary open-angle glaucoma and ocular hypertension. Invest Ophthalmol Vis Sci. 2004 ; 45 : 834-9.
[19] Garas A, Papp A, Hollo G. Influence of age-related macular degeneration on macular thickness measurement made with fourier-domain optical coherence tomography. J Glaucoma. 2013 ; 22 : 195-200.
[20] Garcia-Martin E, Satue M, Fuertes I, et al. Ability and reproducibility of Fourier-domain optical coherence tomography to detect retinal nerve fiber layer atrophy in Parkinson’s disease. Ophthalmology. 2012 ; 119 : 2161-7.
[21] Glovinsky Y, Quigley HA, Dunkelberger GR. Retinal ganglion cell loss is size dependent in experimental glaucoma. Invest Ophthalmol Vis Sci. 1991 ; 32 : 484-91.
[22] Gordon MO, Beiser JA, Brandt JD, et al. The Ocular Hypertension Treatment Study : baseline factors that predict the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002 ; 120 : 714-20 ; discussion : 829-30.
[23] Han IC, Jaffe GJ. Evaluation of artifacts associated with macular spectral-domain optical coherence tomography. Ophthalmology. 2010 ; 117 : 1177-89.
[24] Huang ML, Chen HY. Development and comparison of automated classifiers for glaucoma diagnosis using Stratus optical coherence tomography. Invest Ophthalmol Vis Sci. 2005 ; 46 : 4121-9.
[25] Inoue M, Bissen-Miyajima H, Yoshino M, Suzuki T. Wavy horizontal artifacts on optical coherence tomography line-scanning images caused by diffractive multifocal intraocular lenses. J Cataract Refract Surg. 2009 ; 35 : 1239-43.
[26] Jonas JB, Budde WM, Panda-Jonas S. Ophthalmoscopic evaluation of the optic nerve head. Surv Ophthalmol. 1999 ; 43 : 293-320.
[27] Kanamori A, Nagai-Kusuhara A, Escano MF, et al. Comparison of confocal scanning laser ophthalmoscopy, scanning laser polarimetry and optical coherence tomography to discriminate ocular hypertension and glaucoma at an early stage. Graefes Arch Clin Exp Ophthalmol. 2006 ; 244 : 58-68.
[28] Koh VT, Tham YC, Cheung CY, et al. Determinants of ganglion cell-inner plexiform layer thickness measured by high-definition optical coherence tomography. Invest Ophthalmol Vis Sci. 2012 ; 53 : 5853-9.
[29] Lalezary M, Medeiros FA, Weinreb RN, et al. Baseline optical coherence tomography predicts the development of glaucomatous change in glaucoma suspects. Am J Ophthalmol. 2006 ; 142 : 576-82.
[30] Leung CK, Chan WM, Yung WH, et al. Comparison of macular and peripapillary measurements for the detection of glaucoma : an optical coherence tomography study. Ophthalmology. 2005 ; 112 : 391-400.
[31] Leung CK, Choi N, Weinreb RN, et al. Retinal nerve fiber layer imaging with spectral-domain optical coherence tomography : pattern of RNFL defects in glaucoma. Ophthalmology. 2010 ; 117 : 2337-44.
[32] Li JP, Wang XZ, Fu J, et al. Reproducibility of RTVue retinal nerve fiber layer thickness and optic nerve head measurements in normal and glaucoma eyes. Chin Med J (Engl.). 2010 ; 123 : 1898-903.
[33] Manassakorn A, Nouri-Mahdavi K, Caprioli J. Comparison of retinal nerve fiber layer thickness and optic disk algorithms with optical coherence tomography to detect glaucoma. Am J Ophthalmol. 2006 ; 141 : 105-15.
[34] Maul EA, Friedman DS, Chang DS, et al. Choroidal thickness measured by spectral domain optical coherence tomography : factors affecting thickness in glaucoma patients. Ophthalmology. 2011 ; 118 : 1571-9.
[35] McCourt EA, Cadena BC, Barnett CJ, et al. Measurement of subfoveal choroidal thickness using spectral domain optical coherence tomography. Ophthalmic Surg Lasers Imaging. 2010 ; 41 (Suppl.) : S28-33.
[36] Medeiros FA, Zangwill LM, Bowd C, et al. Evaluation of retinal nerve fiber layer, optic nerve head, and macular thickness measurements for glaucoma detection using optical coherence tomography. Am J Ophthalmol. 2005 ; 139 : 44-55.
[37] Moreno-Montanes J, Anton A, Olmo N, et al. Misalignments in the retinal nerve fiber layer evaluation using cirrus high-definition optical coherence tomography. J Glaucoma. 2011 ; 20 : 559-65.
[38] Moura AL, Raza AS, Lazow MA, et al. Retinal ganglion cell and inner plexiform layer thickness measurements in regions of severe visual field sensitivity loss in patients with glaucoma. Eye (Lond). 2012 ; 26 : 1188-93.
[39] Mwanza JC, Chang RT, Budenz DL, et al. Reproducibility of peripapillary retinal nerve fiber layer thickness and optic nerve head parameters measured with cirrus HD-OCT in glaucomatous eyes. Invest Ophthalmol Vis Sci. 2010 ; 51 : 5724-30.
[40] Mwanza JC, Durbin MK, Budenz DL, et al. Glaucoma diagnostic accuracy of ganglion cell-inner plexiform layer thickness : comparison with nerve fiber layer and optic nerve head. Ophthalmology. 2012 ; 119 : 1151-8
[41] Mwanza JC, Hochberg JT, Banitt MR, et al. Lack of association between glaucoma and macular choroidal thickness measured with enhanced depth-imaging optical coherence tomography. Invest Ophthalmol Vis Sci. 2011 ; 52 : 3430-5.
[42] Mwanza JC, Oakley JD, Budenz DL, Anderson DR. Ability of cirrus HD-OCT optic nerve head parameters to discriminate normal from glaucomatous eyes. Ophthalmology. 2011 ; 118 : 241-8.
[43] Naithani P, Sihota R, Sony P, et al. Evaluation of optical coherence tomography and Heidelberg retinal tomography parameters in detecting early and moderate glaucoma. Invest Ophthalmol Vis Sci. 2007 ; 48 : 3138-45.
[44] Nouri-Mahdavi K, Nikkhou K, Hoffman DC, et al. Detection of early glaucoma with optical coherence tomography (StratusOCT). J Glaucoma. 2008 ; 17 : 183-8.
[45] Oner V, Aykut V, Tas M, et al. Effect of refractive status on peripapillary retinal nerve fibre layer thickness : a study by RTVue spectral domain optical coherence tomography. Br J Ophthalmol. 2013 ; 97 : 75-9.
[46] Parikh RS, Parikh S, Sekhar GC, et al. Diagnostic capability of optical coherence tomography (Stratus OCT 3) in early glaucoma. Ophthalmology. 2007 ; 114 : 2238-43.
[47] Renard JP, Fenolland JR, El Chehab H, et al. [Analysis of macular ganglion cell complex (GCC) with spectral-domain optical coherence tomography (SD-OCT) in glaucoma]. J Fr Ophtalmol. 2013 ; 36 : 299-309.
[48] Rhew JY, Kim YT, Choi KR. Measurement of subfoveal choroidal thickness in normal-tension glaucoma in Korean patients. J Glaucoma. 2012.
[49] Seo JH, Kim TW, Weinreb RN, et al. Detection of localized retinal nerve fiber layer defects with posterior pole asymmetry analysis of spectral domain optical coherence tomography. Invest Ophthalmol Vis Sci. 2012 ; 53 : 4347-53.
[50] Sihota R, Sony P, Gupta V, et al. Comparing glaucomatous optic neuropathy in primary open angle and chronic primary angle closure glaucoma eyes by optical coherence tomography. Ophthalmic Physiol Opt. 2005 ; 25 : 408-15.
[51] Spaide RF, Koizumi H, Pozzoni MC. Enhanced depth imaging spectral-domain optical coherence tomography. Am J Ophthalmol. 2008 ; 146 : 496-500.
[52] Sung KR, Na JH, Lee Y. Glaucoma diagnostic capabilities of optic nerve head parameters as determined by Cirrus HD optical coherence tomography. J Glaucoma. 2012 ; 21 : 498-504.
[53] Tan O, Li G, Lu AT, et al. Mapping of macular substructures with optical coherence tomography for glaucoma diagnosis. Ophthalmology. 2008 ; 115 : 949-56.
[54] Wollstein G, Schuman JS, Price LL, et al. Optical coherence tomography (OCT) macular and peripapillary retinal nerve fiber layer measurements and automated visual fields. Am J Ophthalmol. 2004 ; 138 : 218-25.
[55] Zeimer R, Asrani S, Zou S, Quigley H. Quantitative detection of glaucomatous damage at the posterior pole by retinal thickness mapping. A pilot study. Ophthalmology. 1998 ; 105 : 224-31.
S. Carette, C. Baudouin, P. Hamard, M. Paques
-
L’imagerie par optique adaptative permet d’obtenir des images en haute résolution de la surface antérieure du nerf optique.
-
Complémentaire de l’analyse en rétinophotographie, elle apporte un certain nombre de données morphométriques de la lame criblée et des éléments qui la traversent, très intéressantes aussi bien au stade de glaucome débutant qu’au cours de l’évolution.
-
Elle laisse entrevoir de nouvelles perspectives enthousiasmantes pour une meilleure approche de la physiopathologie glaucomateuse.
Les mécanismes des altérations glaucomateuses ne sont pas encore bien compris, mais la lame criblée en est une des cibles particulières, lieu possible de l’atteinte des fibres nerveuses rétiniennes [2, 4].
L’étude de la lame criblée est possible grâce à un nouveau type d’imagerie : l’imagerie par optique adaptative (fig. 9-90). Issue de la recherche en astronomie, elle permet de corriger en temps réel les déformations évolutives et non prédictibles d’un front d’onde et donc de corriger les aberrations liées à la traversée de la cornée et du cristallin par la lumière émise et rétrodiffusée, cela permettant d’augmenter la résolution latérale des images du fond d’œil (eFig. 9-10). Ce type d’imagerie permet l’analyse in vivo des structures de la papille optique avec une résolution théorique maximale de l’ordre de 1,6 microns.
De récentes études de la lame criblée modélisée par ordinateur ont montré que l’augmentation de la pression intra-oculaire (PIO) avait un effet direct sur celle-ci, à savoir sa courbure et son étirement, augmentant la surface des pores exposés et modifiant leur morphologie. Les pores se retrouvent ainsi plus allongés dans ce modèle biomécanique [7]. À terme, l’augmentation de la PIO entraînerait un affaissement de la lame criblée avec constitution d’un tissu cicatriciel résiduel [1, 5, 6].
En optique adaptative, les pores de la lame criblée de patients atteints de GPAO présentent souvent un élargissement et/ou une élongation. Chez certains patients avec un glaucome avancé peuvent également être observées une disparition totale ou localisée de la visibilité des pores, ou encore une rotation de ceux-ci autour de l’anneau scléral. Ces éléments diffèrent de l’observation de pores de la lame criblée de sujets normaux qui, lorsqu’ils sont visibles, ont une morphologie différente, apparaissant plus isolés, plus petits et plus ronds.
La déformation des pores de la lame criblée pourrait être à l’origine de l’atteinte des fibres nerveuses rétiniennes, perturbant le transport axonal, la circulation sanguine et la diffusion des nutriments [3]. L’ensemble de la lame criblée doit donc être étudié pour en comprendre les modifications, ce qui est réalisable à l’aide de l’optique adaptative, comme le montre la figure 9-91. Les déficits structural et fonctionnel, retrouvés lors des examens en pratique clinique courante, ont une corrélation morphologique au niveau de la lame criblée, comme le montrent les eFigures 9-11 et 9-12. L’optique adaptative permet l’analyse fine de l’atrophie péripapillaire et également des vaisseaux et les fibres nerveuses (eFig. 9-13 à 9-15).
L’imagerie par optique adaptative permet d’obtenir des images en haute résolution de la surface antérieure du nerf optique. Ces images sont complémentaires de l’analyse en rétinophotographie pour l’étude de l’anneau neurorétinien, pour définir les limites fines de l’atrophie péripapillaire, pour l’étude des fibres nerveuses rétiniennes et enfin pour l’analyse des vaisseaux, leur diamètre et leurs rapports avec l’ensemble du nerf optique. L’imagerie par optique adaptative, telle qu’elle est développée actuellement, ne pourra néanmoins supplanter les rétinophotographies en couleur en ce qui concerne l’étude de la pâleur du nerf optique ; en outre, elle reste descriptive alors que l’OCT est quantitative et permet un suivi de la perte en fibres. Cependant, sa précision pourrait être un outil intéressant dans l’analyse morphométrique des glaucomes débutants, dans le dépistage (étude des pores de la lame criblée qui ne sont encore que très peu visibles ou encore invisibles en rétinophotographie) et dans le suivi des glaucomes (meilleure visualisation des pores de la lame criblée corrélée à la mesure de la PIO).
Retenir
-
L’étude morphologique in vivo, en temps réel, non invasive de la tête du nerf optique avec cette nouvelle technique d’imagerie par optique adaptative ouvre des perspectives importantes dans les connaissances fondamentales de la physiopathologie du glaucome et sans doute dans le suivi de son traitement.
-
Elle apporte de nouveaux renseignements morphométriques concernant une zone anatomique déterminante dans la neuropathie optique glaucomateuse, la lame criblée.
-
À ce jour, elle reste un examen d’imagerie en cours d’évaluation et en développement complémentaire de la rétinophotographie et des autres techniques d’imagerie.
Fig. 9-90 a. Image de la papille et de la lame criblée en optique adaptative d’une patiente de 31 ans sans antécédents de glaucome. Les pores apparaissent petits, ronds. b. Image de la papille d’une patiente glaucomateuse connue de 62 ans. Les pores apparaissent plus allongés. c. Image de la papille d’un glaucome agonique chez un patient de 68 ans. Absence de visualisation des pores.
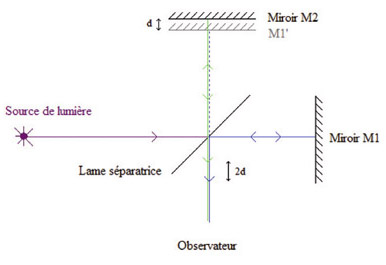
eFig. 9-9 Schéma optique de l’interféromètre de Michelson.
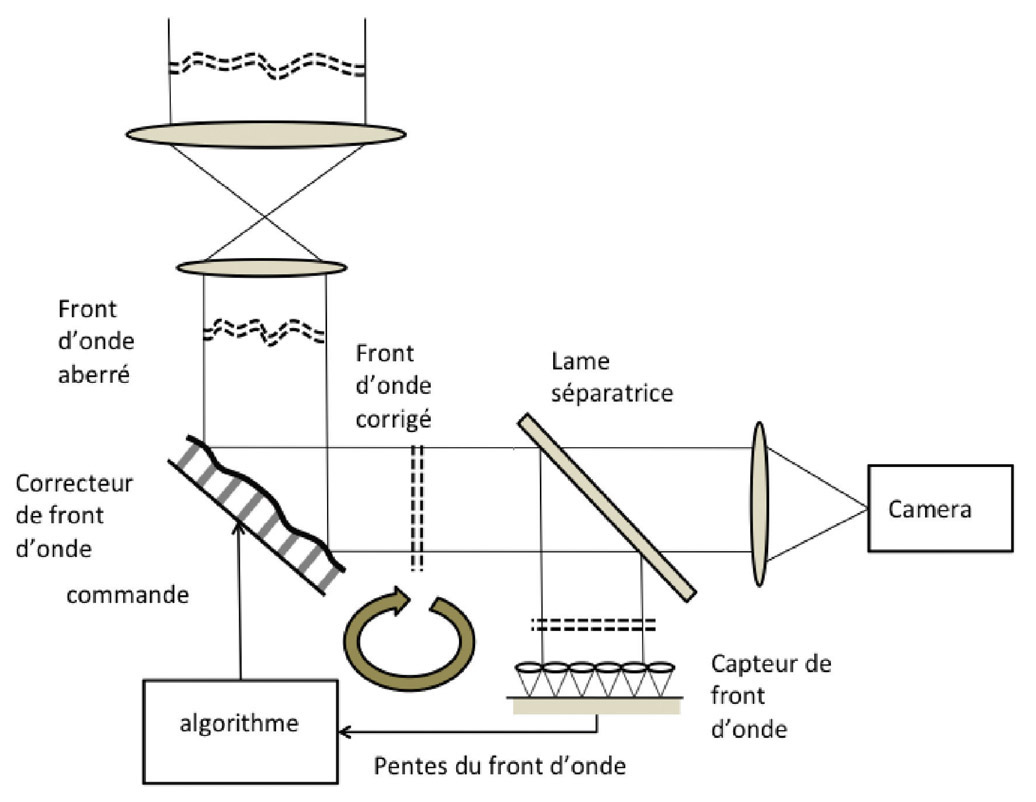
eFig. 9-10 Principe de fonctionnement de l’imagerie par optique adaptative. Les aberrations optiques du front d’onde entrant sont dues aux turbulences atmosphériques ou aux défauts du système optique oculaire. La lumière est captée en premier par un correcteur de front de d’onde. Ce dernier est mesuré et un algorithme contrôle permet de calculer le signal à modifier pour compenser les aberrations au niveau du correcteur de front d’onde. Une fois les corrections du front d’onde faites, l’image est délivrée par la caméra.
Fig. 9-91 L’optique adaptative permet l’imagerie des pores de la lame criblée en arrière de l’anneau neurorétinien.
eFig. 9-11 Élongation des pores en inférieur correspondant à un déficit supérieur du champ visuel.
eFig. 9-12 Élongation des pores en supérieur correspondant à un déficit supérieur des fibres nerveuses rétiniennes à l’OCT.
eFig. 9-13 Imagerie de l’atrophie péripapillaire en optique adaptative.
eFig. 9-14 Aspect des vaisseaux prépapillaires en optique adaptative.
eFig. 9-15 Aspect des fibres nerveuses en optique adaptative.
[1] Burgoyne CF, Downs JC. Premise and prediction-how optic nerve head biomechanics underlies the susceptibility and clinical behavior of the aged optic nerve head. J Glaucoma. 2008 ; 17 : 318-28.
[2] Burgoyne CF, Morrison JC. The anatomy and pathophysiology of the optic nerve head in glaucoma. J Glaucoma. 2001 ; 10 (Suppl. 1) : S16-18.
[3] Hernandez MR. The optic nerve head in glaucoma : role of astrocytes in tissue remodeling. Prog Retin Eye Res. 2000 ; 19 : 297-321.
[4] Miller KM, Quigley HA. The clinical appearance of the lamina cribrosa as a function of the extent of glaucomatous optic nerve damage. Ophthalmology. 1988 ; 95 : 135-8.
[5] Roberts MD, Grau V, Grimm J, et al. Remodeling of the connective tissue microarchitecture of the lamina cribrosa in early experimental glaucoma. Invest Ophthalmol Vis Sci. 2009 ; 50 : 681-90.
[6] Roberts MD, Liang Y, Sigal IA, et al. Correlation between local stress and strain and lamina cribrosa connective tissue volume fraction in normal monkey eyes. Invest Ophthalmol Vis Sci. 2010 ; 51 : 295-307.
[7] Roberts MD, Sigal IA, Liang Y, et al. Changes in the biomechanical response of the optic nerve head in early experimental glaucoma. Invest Ophthalmol Vis Sci. 2010 ; 51 : 5675-84.
F. Maÿ, J.-P. Nordmann
J.-P. Nordmann
La périmétrie cinétique manuelle, dite « de Goldmann », a précédé de trente ans la périmétrie automatisée et les premières découvertes concernant le glaucome ont été faites avec cette technique.
Le principe de la périmétrie cinétique consiste à présenter sur une coupole des spots lumineux d’une taille et d’une luminosité donnée en les déplaçant de façon centripète de la périphérie vers le centre de la vision. Lorsque le sujet perçoit ce spot, l’emplacement en est noté sur un relevé et les points de même sensibilité lumineuse différentielle sont reliés entre eux, dessinant des isoptères. Ainsi, en choisissant plusieurs tailles et plusieurs luminosités sont décrits différents isoptères.
En périmétrie cinétique, le champ visuel s’étend approximativement à 100° en temporal, 60° en nasal, 60° en supérieur et 75° en inférieur. Comme pour de nombreuses autres performances humaines, il existe une grande variabilité entre les sujets quant à la sensibilité lumineuse différentielle de chaque point.
Il existe en outre une diminution de sensibilité avec l’âge (à partir de 20 ans), expliquant l’importance des analyses faites en fonction de la tranche d’âge à laquelle appartient le sujet (fig. 9-92 et 9-93).
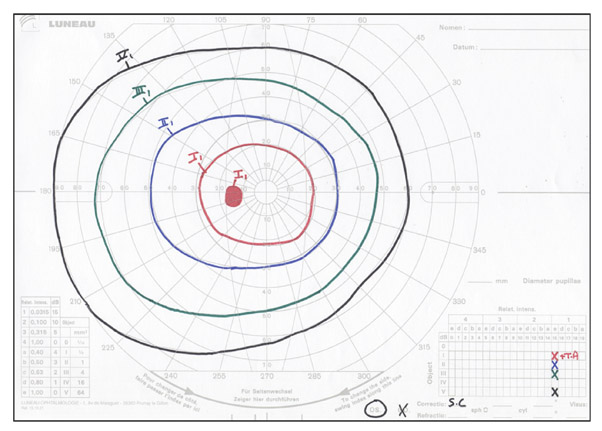
Fig. 9-92 Périmétrie cinétique manuelle de Goldmann. Relevé normal du champ visuel d’un œil gauche.
Fig. 9-93 Périmétrie cinétique automatisée. Relevé normal du champ visuel d’un œil gauche.
La périmétrie cinétique présente cependant des limites dans le glaucome. La plus évidente de ces limites est la participation d’un périmétriste susceptible d’interférer, par son approche, avec les résultats du patient. Il en résulte une grande variabilité des résultats, en particulier lorsque l’on recherche des scotomes relatifs. Tout va en effet dépendre de la vitesse de présentation d’un spot en perpétuel déplacement et de la rapidité de la réponse du patient. Lorsque l’on est uniquement à la recherche de scotomes absolus, ce problème est moins présent. C’est la raison pour laquelle la périmétrie cinétique garde sa place dans l’évaluation de larges scotomes profonds, en particulier en neuro-opthalmologie.
Dans le glaucome, la périmétrie cinétique manuelle ne conserve un intérêt que dans les cas où il est impossible de réaliser une périmétrie automatisée – par exemple chez l’enfant, lorsque des pathologies intriquées et complexes sont présentes ou lorsqu’il existe une perte du point de fixation.
Dans les glaucomes agoniques, il devient difficile de se fier à la périmétrie automatisée et l’analyse d’une vision résiduelle temporale est évaluée au mieux par la périmétrie manuelle.
Des programmes de périmétrie cinétique automatique sont proposés par les appareils de Humphrey et d’Octopus. Leur principal intérêt est une étude rapide des régions au-delà des 30° centraux.
J.-P. Nordmann
-
La périmétrie standard automatisée « blanc-blanc » est le principal examen fonctionnel dans le glaucome.
-
Les principaux tests réalisés sont les tests de seuil des 30° ou 24° centraux et des 10° centraux. Des examens plus périphériques sont rarement nécessaires.
-
Les stratégies SITA (Humphrey) et dynamique (Octopus) sont adaptées au glaucome. Les stratégies accélérées SITA-Fast et TOP ne doivent être utilisées qu’en complément, car trop rapides et sujettes à erreur.
-
Un examen de la qualité de réalisation de la mesure est indispensable avant toute interprétation des résultats.
-
Les indices globaux permettent une analyse de tendance, les plus importants étant le MD et le VFI.
La périmétrie automatisée standard (PAS) consiste à mesurer la sensibilité lumineuse différentielle de points répartis dans plusieurs régions du champ visuel. La sensibilité lumineuse différentielle correspond à la capacité de détecter un spot d’une luminosité donnée au sein d’un fond qui est lui-même illuminé. À l’évidence, pour que ce spot soit perceptible, il doit avoir une luminosité supérieure au fond. À partir d’un certain contraste de luminosité entre le spot et le fond, cette cible est perçue.
La luminosité des spots utilisés définit le type de test qui est pratiqué. Lorsque la luminosité des spots est modulée jusqu’à atteindre le seuil de sensibilité, on réalise un test de seuil. Une autre façon d’étudier le champ visuel consiste à estimer, pour un patient donné, quelle est la sensibilité lumineuse théorique de chaque point et à présenter des spots plus lumineux. Le test a alors pour objet de savoir si le sujet perçoit ces points plus lumineux. Ce dernier principe, utilisant des cibles supraliminaires, est à la base des tests de dépistage.
La luminosité de la cible et du fond est mesurée en unités de luminance appelées apostilbs (asb). Les spots proposés en PAS vont de 1 asb à plus de 10 000 asb. Les différents appareils expriment leurs résultats en décibels (dB). Par cette transformation mathématique, les points ayant une mauvaise sensibilité ont une valeur exprimée en décibels faible, et les points qui ne seraient pas perçus malgré une intensité lumineuse maximale sont exprimés par une valeur de 0 dB.
Les chiffres présentés sur les relevés périmétriques correspondent ainsi à des valeurs en décibels de la sensibilité de l’œil. L’analyse précise de ces points est importante.
L’informatique intégrée dans les périmètres utilise une certaine logique (appelée algorithme) pour cerner les seuils de sensibilité. L’étude de chaque point du champ débute par la présentation d’un spot ayant une certaine luminance et supposé vu. L’algorithme 4-2 consiste à obtenir deux changements de réponse en débutant le test par des pas de 4 dB et en les réduisant à 2 dB dès que le premier changement de réponse est obtenu. Le seuil estimé est calculé par la moyenne entre les deux derniers. La stratégie appelée FASTPAC a été développée par Humphrey. Elle utilise des pas de 3 dB en ne traversant qu’une fois le seuil de sensibilité du sujet. En parallèle, Octopus a développé une stratégie dite « dynamique » utilisant des pas qui dépendent de la profondeur du déficit, les plus petits pas étant de 3 dB et les plus grands de 9 dB.
Chaque affection ophtalmologique altère d’une façon relativement spécifique le champ visuel. Dans le glaucome, par exemple, les déficits ne coupent pas la ligne horizontale et partent ou se dirigent vers la tâche aveugle.
Humphrey a développé une stratégie spécifique au glaucome appelée SITA. Cette méthode consiste, pendant l’examen d’un sujet supposé glaucomateux, à comparer les résultats en cours d’acquisition à une importante base de données de patients ayant la même maladie. Cela permet de présenter aux nouvelles régions à tester des spots dont la luminosité est cohérente avec un profil de glaucome. Grâce au SITA, le temps d’examen est en outre raccourci. On peut l’utiliser avec un algorithme usuel 4-2 (SITA-Standard) ou avec l’algorithme 3-3 (SITA-Fast). Ce dernier examen est particulièrement rapide.
En pratique, le SITA-Standard est conseillé. Le SITA-Fast peut être utilisé comme test de dépistage initial et, dans certains cas, pour le suivi chez les patients qui fatiguent rapidement à l’examen. Il faut en outre se rappeler que les programmes SITA ne sont théoriquement adaptés qu’à l’exploration du glaucome.
La stratégie TOP développé par Octopus permet aussi de mesurer les seuils de sensibilité en réduisant la durée de la mesure en évaluant certains seuils par interpolation des résultats de points adjacents. Cependant, la stratégie TOP, trop rapide, est à éviter chez la plupart des patients.
La qualité d’un champ visuel repose à l’évidence avant tout sur la qualité du recueil des données. Si certaines erreurs de mesure peuvent être corrigées en cours d’examen, d’autres sont responsables de modifications des résultats indétectables sur les simples relevés périmétriques. De façon générale, il est donc souhaitable d’établir une « procédure » standardisée, écrite éventuellement, et de l’appliquer à tous les patients.
Une correction de près est impérative pour l’évaluation de la vision centrale. La correction optimale de près doit être mise à l’intérieur des 30° centraux, en utilisant des verres cerclés de métal et en évitant les verres diaphragmés. Le verre utilisé dépendra de la correction de loin à laquelle viendra s’ajouter la correction de près en fonction de l’âge. Certains proposent d’augmenter la correction de près d’environ 0,5 dioptrie pour éviter tout effort d’accommodation pendant la durée de l’examen.
Il faut bien expliquer au patient en quoi consiste l’examen, surtout lors d’une première mesure. Une explication formulée de façon toujours identique est souhaitable.
Avec l’appareil de Humphrey, l’examen doit commencer par l’évaluation du seuil fovéal. Pour cela quatre points sont allumés au-dessous du point central, le patient devant fixer au centre de ces quatre points. Une fois le seuil fovéal évalué, il faut préciser au patient qu’un autre point, au-dessus des quatre points, s’est allumé, et que c’est uniquement ce dernier qu’il faut regarder pendant tout l’examen. Il est important de préciser au sujet qu’il est normal de ne pas voir tous les stimuli. La plupart des spots étant à la limite de la visibilité, il n’est donc pas possible de tous les percevoir.
Il est souhaitable de rester à proximité du patient pendant la vérification de la fixation. L’appareil recherche en effet dans la première minute l’emplacement de la tache aveugle. Si, dans cette première minute, plusieurs pertes de fixation surviennent, il est à craindre que la tache aveugle ait été mal localisée et il est possible de la définir à nouveau en utilisant la fonction « Rechercher à nouveau la TA ».
Il est important de rassurer le patient et de lui conseiller de ne pas hésiter à cligner des paupières s’il en ressent le besoin. Des pauses régulières doivent être prévues au cours de l’examen en fonction de sa fatigabilité et de son attention.
Une mauvaise correction peut perturber un champ visuel. L’absence de correction d’un astigmatisme supérieur à deux dioptries peut entraîner des scotomes périphériques temporaux. Une presbytie non corrigée est au contraire responsable d’un déficit diffus. La situation d’aphakie corrigée par verres est bien sûr responsable d’un fort rétrécissement du champ évalué à 50 %. La pseudo-phakie peut aussi provoquer un rétrécissement du champ lorsque l’optique de l’implant est éloignée du centre de l’œil. Cela concerne surtout les implants de chambre antérieure résultant en une diminution du champ de l’ordre de 20 %. Les implants multifocaux sont responsables d’un trouble diffus, surtout lorsqu’un test mésopique est utilisé (Octopus).
Une pupille de petite taille peut affecter le champ visuel à travers une réduction de la sensibilité lumineuse moyenne (effet Stiles-Crawford). En pratique, il est souhaitable de réaliser les tests avec une dilatation au moins égale à 3 mm. Dans le cas de patients ayant des instillations de myotiques au long cours, il faut en tenir compte dans l’interprétation des résultats et essayer de conserver un même diamètre pupillaire d’un test à l’autre. Si l’on est amené à prescrire des myotiques à un patient, on notera qu’une diminution de moitié du diamètre pupillaire entraîne en moyenne une baisse de sensibilité rétinienne de 2 à 3 dB.
Le niveau de sensibilité lumineuse différentielle dépend de la luminance du fond. On considère souvent qu’une faible luminance permet de mettre en évidence certains déficits passant inaperçus sous une plus forte luminance. Ces variations de sensibilité en fonction du niveau d’adaptation à la lumière soulignent l’importance d’une calibration régulière des appareils. La plupart des appareils disponibles (Humphrey, Octopus 1-2-3, etc.) ont une forte luminance (31,4 asb ou 10 cd/m2), correspondant à celle du périmètre de Goldmann. Il faut cependant noter que l’Octopus 101 a une luminance de fond plus faible (4 asb). Le choix d’une coupole ayant une forte luminance a été dicté par le fait qu’il n’est pas nécessaire d’adapter l’œil à cette luminance avant de commencer le test.
La sensibilité lumineuse différentielle dépend de la durée de présentation du spot. Elle augmente en fonction de cette durée en atteignant une limite vers 0,5 seconde (phénomène de sommation temporelle). En pratique, il ne faut cependant pas dépasser 0,25 seconde pour éviter que l’œil n’ait une tendance spontanée à se diriger vers le spot. En conséquence, la durée de présentation des spots est faible, 0,1 seconde pour l’Octopus et 0,2 seconde pour le Humphrey. Avec ces deux appareils, la durée de spots n’est pas modifiable.
À l’évidence, plus un spot est grand, plus il est facilement perçu. Un large spot présente de plus l’avantage d’être peu sensible à une petite erreur de correction optique. Cependant, un spot trop grand ne permet pas de mettre en évidence des scotomes étroits. À l’opposé, un spot de petit diamètre permet de préciser correctement les scotomes débutants, mais est très sensible à un trouble de réfraction.
Le meilleur équilibre entre ces extrêmes est obtenu avec une source lumineuse de taille III (soit 0,43° d’angle visuel). Cette taille est automatiquement choisie par les différents périmètres, à moins que l’opérateur n’en change volontairement. Une même taille de spot est donc nécessaire pour comparer deux champs.
Dans le glaucome, un scotome significatif peut en effet disparaître si un spot plus large est utilisé.
Les pertes de fixation sont susceptibles de rendre ininterprétable un relevé du champ visuel. Ils sont la première cause de non-fiabilité. De façon générale, des pertes de fixation trop nombreuses ont tendance à sous-estimer les déficits. Il est donc fondamental de débuter toute analyse d’un champ par un regard sur le nombre de pertes de fixation. Un chiffre supérieur à 20 % rend difficile une interprétation fiable de l’examen.
En périmétrie automatisée, il existe un important effet d’apprentissage, responsable d’une fréquente amélioration des performances lors d’un deuxième test. L’interprétation d’un premier relevé du champ visuel doit donc être prudente et l’examen ne doit pas être conservé pour l’analyse du suivi de la progression, à moins qu’il ne soit parfaitement normal. L’amélioration liée au phénomène d’apprentissage est d’autant plus importante que l’on explore des régions plus périphériques. À l’opposé, lors d’un premier test, les 10° centraux sont souvent les plus fiables.
Deux grands types de programme sont disponibles, les tests de dépistage et les tests de seuil. Les programmes de dépistage sont rapides et ont pour but de dépister une anomalie du champ et éventuellement de la quantifier. Les programmes de seuil sont plus longs et ont pour objet de mesurer précisément l’ensemble du champ, que celui-ci apparaisse normal ou pas. Le terme dépistage ne correspond donc pas à un dépistage précoce infraclinique, mais à un dépistage rapide.
Le principal intérêt des tests de dépistage réside non pas dans l’étude de la région centrale du champ, explorée au mieux par la méthode des seuils, mais dans l’évaluation de la périphérie rétinienne, au-delà des 30° centraux de vision.
La mesure précise de l’ensemble des points du champ prend du temps. Les tests de dépistage permettent d’aller plus vite en ne s’intéressant en réalité qu’aux points anormaux. Lorsqu’un tel test est choisi, l’ordinateur fait une estimation d’un profil « idéal » du champ pour la classe d’âge dans laquelle se trouve le patient (une fois la date de naissance du sujet précisée à l’appareil par le périmétriste). Plusieurs techniques d’estimation de ce profil « idéal » sont possibles, soit à partir de données générales incluses dans la mémoire de l’ordinateur (tests de dépistage dépendant de l’âge), soit à partir de la mesure du niveau de sensibilité de quatre points répartis dans le champ du sujet à tester (tests de dépistage dépendant du seuil).
Une fois ces calculs réalisés, l’appareil présente des spots dont l’intensité est de 6 dB plus lumineuse que le seuil supposé. Si le sujet perçoit ces spots, l’appareil considère que le résultat est normal. En revanche, si le sujet ne les voit pas, l’appareil considère les points anormaux. Les points normaux ne sont plus mesurés ultérieurement. En conséquence, cette stratégie permet de détecter tout déficit de plus de 6 dB.
En fonction des tests de dépistage, les points anormaux sont soit simplement considérés comme anormaux, soit évalués plus précisément et quantifiés. Les différentes stratégies utilisées concernant ces points anormaux définissent plusieurs types de tests de dépistage.
Les tests de seuils mesurent la sensibilité rétinienne de chaque point étudié, que celui-ci soit normal ou non. Ils permettent donc une quantification de l’ensemble du champ visuel, central ou périphérique. La plupart du temps, les points testés sont mesurés sans aucune référence préalable (technique du « seuil complet »). Cette méthode, la plus précise, est celle qui prend le plus de temps.
Lorsque l’appareil dispose des données d’un champ précédent, il peut les utiliser pour arriver plus rapidement aux seuils. Cette méthode donne des résultats identiques aux précédents et prend moins de temps. Elle ne peut bien sûr être utilisée que si un champ antérieur identique est disponible.
De façon générale, la mesure des seuils est préférable au simple dépistage. Elle permet une quantification du champ visuel et une analyse statistique des résultats avec présentation des indices globaux.
Lorsque les seuils de sensibilité rétinienne de chaque point sont établis et chiffrés en décibels, une quantification et une évaluation mathématique du champ visuel sont possibles. Il existe quatre indices globaux principaux (déviation moyenne, déviation individuelle, fluctuation à court terme et déviation individuelle corrigée) et un indice secondaire (indice d’hémi-champ), ainsi qu’un indice spécifique et plus récent du Humphrey, le visual field index (VFI).
Humphrey : MD (mean deviation)
Octopus : MD (mean defect)
La déviation moyenne est un indice correspondant à la différence entre la sensibilité rétinienne normale pour l’âge et la sensibilité rétinienne du sujet testé. Cette valeur est calculée sur l’ensemble des points testés dans le champ. Une déviation moyenne anormale peut être liée à un déficit diffus par atteinte de la sensibilité rétinienne de chaque point testé. Ce déficit diffus se rencontre en cas de diminution de la transparence des milieux (début de cataracte par exemple), mais aussi en cas de glaucome.
En raison du mode de calcul de la déviation moyenne, un déficit localisé important peut entraîner à lui seul une augmentation de la déviation moyenne.
Humphrey : PSD (pattern standard deviation)
Octopus : LV (loss variance)
La déviation individuelle permet d’évaluer la non-uniformité du champ visuel point par point pour le sujet lui-même (d’où le terme « individuel »). Cet indice calcule les différences de sensibilité rétinienne entre les différents points et les compare avec la perte moyenne de sensibilité du champ visuel. Une augmentation de cet indice permet essentiellement la quantification des scotomes. En cas de déficit purement diffus, il n’est pas modifié. Dans le glaucome, l’indice de déviation individuelle s’aggrave de manière linéaire. Cependant, dans les formes avancées, il perd son intérêt car il ne s’aggrave plus, et seul l’indice de déficit total permet de suivre l’évolution.
Humphrey : SF (short term fluctuation)
Octopus : SF (short term fluctuation)
La fluctuation à court terme est l’indice de variabilité de la réponse au cours du test. Cet indice est obtenu en testant plusieurs fois certains points (Humphrey) ou en réalisant successivement deux fois le même test (Octopus). Il peut être modifié par des fautes d’inattention. Pour certains auteurs, une atteinte isolée de la fluctuation à court terme pourrait être un premier signe de souffrance glaucomateuse.
Humphrey : CPSD (corrected pattern standard deviation)
Octopus : CLV (corrected loss variance)
La déviation individuelle corrigée traduit la déviation individuelle en tenant compte de la variation à court terme définie précédemment. Cet indice exprime des régions du champ visuel dont le déficit de sensibilité rétinienne est supérieur à une simple variation à court terme. L’augmentation de la déviation individuelle corrigée correspond donc à une atteinte liée à un scotome et non pas à un trouble lié aux fluctuations au cours du test. Cet indice est celui qui reflète le plus précisément la présence de scotomes.
Les programmes du Humphrey proposent un nouvel indice, le VFI (visual field index), se voulant plus précis que les autres indices pour évaluer la capacité visuelle. Cet indice pondère les points anormaux en fonction de leur proximité du centre de la vue. Plus un déficit est proche du point de fixation, plus celui-ci correspond à une destruction importante de fibres nerveuses rétiniennes et plus il pèse sur l’indice de champ visuel. Il s’agit d’un indice de la fonction visuelle restante évaluée au niveau de chaque point à partir des cartes de déviation individuelle. Il vient compléter l’indice MD, non perturbé par les troubles des milieux et pondéré en fonction de la répartition des cellules ganglionnaires, plus denses dans la région centrale.
Cela explique que, chez un patient glaucomateux ayant un déficit prédominant dans les zones périphériques avec conservation du champ visuel central, le score du VFI soit plus élevé que l’indice MD. Cet indice VFI sera en revanche abaissé en cas de scotome identique (en taille et en profondeur) plus proche du point de fixation.
Enfin, il semble présenter un intérêt important dans le suivi des glaucomes très évolués alors que l’indice MD est effondré.
Cet indice va de 0 à 100 %. Il est relativement peu sensible aux troubles des milieux, contrairement au MD, et serait plus représentatif de la capacité visuelle réelle de l’œil. Il permet en outre simplement d’expliquer par un « pourcentage de vision » la situation du champ visuel à un patient.
Normalement, il existe très peu de différence entre les valeurs supérieures et inférieures du champ d’un même œil. Si cette différence est élevée et même si les résultats semblent normaux point par point, il est possible de considérer qu’un déficit altitudinal débutant est apparu. L’atteinte d’un seul hémi-champ étant souvent présente lors des phases initiales du glaucome, un test comparant les régions supérieures et inférieures du champ a été développé par Humphrey sous le sigle GHT pour glaucoma hemifield test. Si c’est un bon indicateur de glaucome débutant, son interprétation est moins fiable dès lors qu’il existe des dysmorphies papillaires.
Le champ n’est en fait pas comparé globalement entre les régions supérieures et inférieures, mais par séries de points regroupés en régions paracentrales, nasales, périphériques, etc.
Deux grands types de programme sont disponibles, les tests de dépistage et les tests de seuil.
Les tests de dépistage sont des tests qui ont pour but de savoir si le champ est normal ou pas. Les tests de dépistage sont disponibles pour le champ visuel central (30° centraux ou moins), pour le champ visuel périphérique (au-delà des 30°) ou pour le champ visuel dans sa totalité. Pour chaque test de dépistage, trois stratégies sont disponibles : supraliminaire, trois zones, quantification des déficits. En pratique, la stratégie automatiquement choisie par l’appareil de Humphrey est celle de la « stratégie supraliminaire ». On préférera la stratégie « trois zones supraliminaires » qui, bien qu’un peu plus longue, fournit des résultats beaucoup plus précis.
Avec la stratégie « trois zones supraliminaires », un point anormal est testé secondairement avec un nouveau spot sous-luminance maximale (10 000 asb). Si ce dernier spot n’est pas perçu, il s’agit d’un scotome absolu ; si celui-ci est perçu, il s’agit d’un scotome relatif. Cette stratégie en trois zones répartit donc les régions du champ en « normal », « scotome relatif » et « scotome absolu » (fig. 9-94).
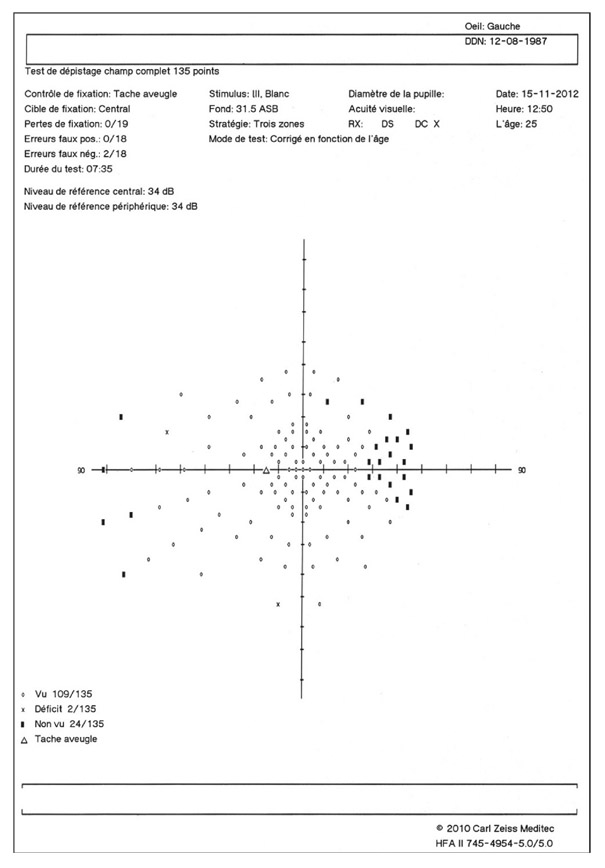
Fig. 9-94 Test de dépistage des 135 points corrigé en fonction de l’âge. L’ensemble du champ est étudié, en insistant sur la région centrale et nasale. Il s’agit d’un test trois zones, avec des valeurs normales (o), des déficits relatifs (x) et des déficits absolus (■).
Les tests de seuils mesurent la sensibilité rétinienne de chaque point testé, que celui-ci soit normal ou non. Ces tests permettent donc une quantification de l’ensemble du champ visuel, central, périphérique ou complet. En pratique, il est souhaitable d’étudier la région centrale du champ avec un test de seuil et de compléter éventuellement l’examen en périphérie à l’aide d’un test de dépistage. La mesure d’un test central prend entre 4 et 15 minutes en fonction du programme choisi.
Dans le glaucome, les programmes les plus utiles sont le test de seuil 24-2 et le test de seuil des 10° centraux dans les formes avancées (fig. 9-95).
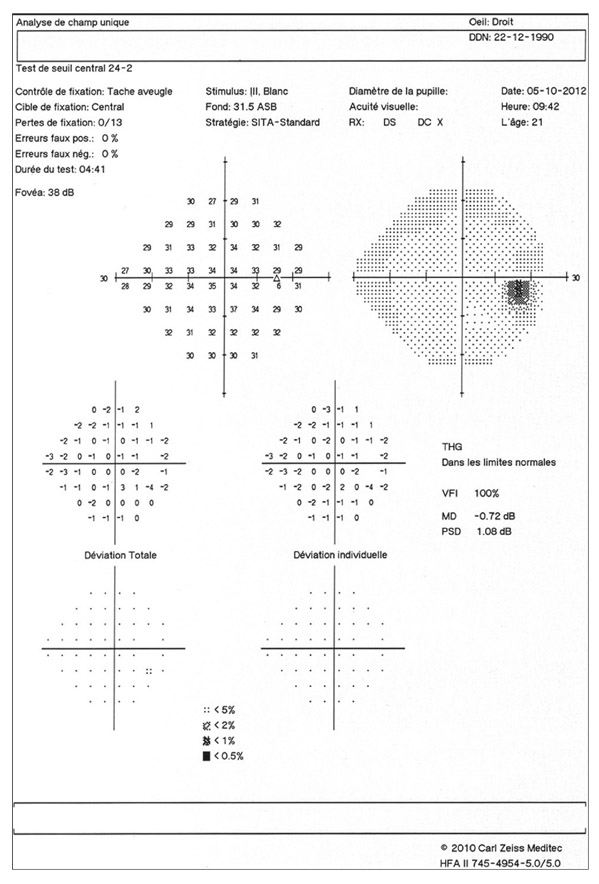
Fig. 9-95 Périmétrie de Humphrey. Le test de seuil des 24° centraux est le plus utile dans le glaucome. Les points mesurés sont distants les uns des autres de 6° d’angle visuel. La mesure est faite à distance de l’axe vertical et horizontal.
La partie supérieure du document comprend un certain nombre de renseignements sur le patient et sur le test réalisé. Parmi les données concernant le patient, seule la date de naissance est vraiment importante puisque les analyses statistiques dépendent de l’âge. Les précisions concernant la réfraction ou la taille de la pupille ont un intérêt pour s’assurer que le test a été fait de façon adéquate. La nature du test ainsi que l’algorithme qui a été utilisé sont précisés. Il est important de les analyser car certains programmes très rapides peuvent modifier les résultats.
Dans la partie supérieure gauche du graphique sont présentés les paramètres de contrôle de la qualité du test. Il s’agit des :
-
pertes de fixation : environ une fois sur dix, un spot est projeté sur la tâche aveugle. Si ce point est perçu, l’axe de l’œil s’est déplacé. Il s’agit d’une perte de fixation ;
-
faux positifs : lorsque le bras de l’appareil se déplace pour une nouvelle projection, il fait un certain bruit. Dans certains cas, il se déplace sans présenter de spot lumineux. Si le sujet appuie sur le bouton de réponse, il s’agit d’un faux positif ;
-
faux négatifs : lorsque le seuil précis d’un point a été déterminé, l’appareil peut présenter à nouveau un spot nettement plus lumineux. Si le sujet ne perçoit pas ce spot, alors qu’il le devrait, il s’agit d’un faux négatif ;
-
temps d’examen.
Lorsque le nombre d’erreurs commises est trop grand, l’appareil indique par deux croix les éléments incriminés et imprime un peu plus bas « Fiabilité faible ». Cela survient à partir de 20 % de pertes de fixation ou de 33 % de faux positifs ou négatifs.
En bas de page est en outre présenté le tracé du contrôle de la fixation du regard. Il s’agit d’un relevé d’« eye-tracking » qui permet de noter sur une ligne, par des traits verticaux, la fréquence des battements des paupières et les mouvements parasites des yeux. On peut ainsi savoir si le test a été réalisé de manière harmonieuse pendant toute sa durée.
Lorsqu’une mesure de seuil a été réalisée, la valeur de sensibilité lumineuse différentielle de chaque point testé est exprimée en décibels. Plus le chiffre est élevé, plus la sensibilité du point est grande. Cette présentation en décibels est la plus importante, car seuls ces points ont réellement été mesurés, les autres informations du relevé périmétrique en découlant par analyse mathématique ou statistique.
La valeur du seuil fovéal, correspondant au pic de sensibilité de la rétine, est présentée à gauche. En cas d’anomalie de cette valeur, un petit carré grisé ou noir des symboles de probabilité est inscrit. La mesure du seuil fovéal est capitale et doit être faite systématiquement.
La présentation en niveaux de gris permet une lecture rapide du champ. Cependant, elle est relativement trompeuse car elle donne faussement l’impression que toutes les régions du champ ont été mesurées. En réalité, les points testés sont distants de 6° dans un test 24-2. Dans la représentation en niveaux de gris, un point noir correspond à un déficit absolu.
En bas à gauche sont présentés, point par point, le relevé de déviation totale (en décibels et en anomalies statistiques) et le relevé de déviation individuelle. Un carré noir correspond à p < 0,5 %, ce qui veut dire qu’il y a moins de 0,5 % de chance pour que ce résultat soit normal. Il ne correspond donc pas forcément à une zone de déficit absolu.
Les indices globaux sont disponibles avec la plupart des tests de seuils, sauf les tests périphériques 30-60 et les tests maculaires.
Les deux premiers indices globaux [déviation moyenne (MD) et déviation individuelle (PSD)] sont exprimés sous forme de graphique en décibels et en niveau de gris.
Les deux derniers indices [fluctuation à court terme (SF) et déviation individuelle corrigée (CPSD)] ne sont présentés que sous forme de valeurs moyennes.
Sur le bord de la représentation à droite sont placés les quatre indices globaux. Plus l’indice a une valeur absolue élevée, plus le résultat est anormal. Le p < 5 %, 1 %, 0,5 % joint exprime le degré statistique d’anormalité.
L’analyse de la progression du glaucome est rendue difficile par les variations naturelles des résultats d’un examen sur l’autre. Il peut s’agir d’erreurs liées à un défaut de concentration, mais aussi de fluctuations à moyen terme, d’un examen sur l’autre, ou à long terme, par exemple en fonction des saisons. En outre, les simples variations sont aussi à mettre en perspective avec l’importance du glaucome : plus un déficit est important à un endroit du champ visuel, plus ce déficit pourra varier. Ainsi les variations ne sont pas homogènes au sein du champ visuel si ce dernier est perturbé à certains endroits (fig. 9-96).
Humphrey propose un programme d’analyse de progression intitulé GPA2 (guided progression analysis 2). Celui-ci utilise deux champs visuels comme base d’analyse et compare les nouveaux résultats à ceux-ci. Il permet d’évaluer, devant une aggravation, la probabilité statistique que tel ou tel point du champ se soit réellement aggravé ou que cette modification soit uniquement la conséquence d’une simple variation.
La représentation de cette variation se fait point par point et de façon globale.
Sur une série de relevés, l’analyse d’évolution se fait en représentant ligne par ligne le déficit, le MD, la variation en dB par rapport aux valeurs de bases et la représentation statistique de cette variation (un triangle vide correspond à une probabilité d’aggravation réelle de 95 % sur un premier champ, ce triangle étant à moitié plein ou totalement plein si cette aggravation est confirmée lors des 2e et 3e examens suivants) (voir chapitre 11-II, paragaphe « Évaluation de la progression de l’atteinte fonctionnelle »).
Cette représentation est aussi faite en utilisant l’indice de champ visuel VFI et permet, si le nombre de champs est suffisamment important, d’extrapoler quelque peu le risque d’évolution.
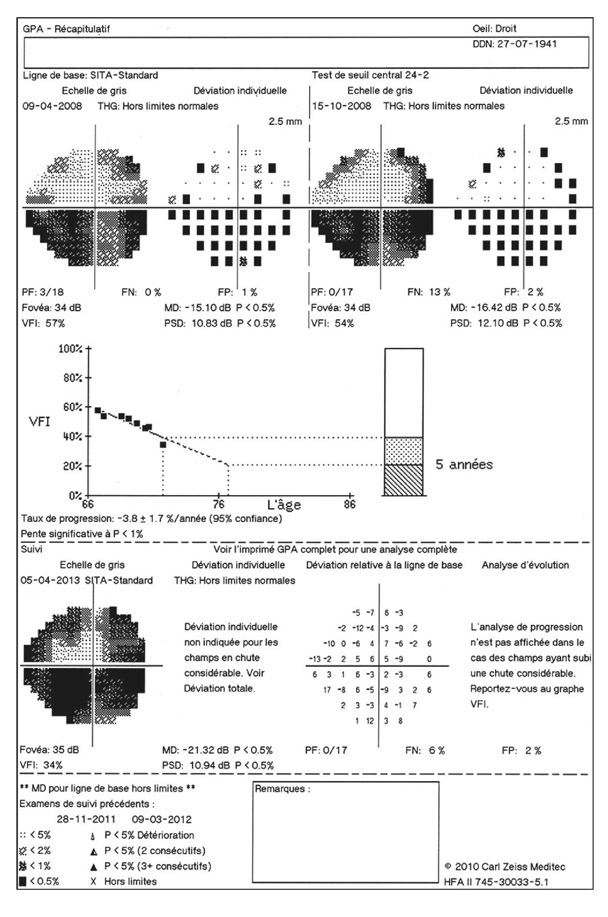
Fig. 9-96 Relevé d’analyse d’évolution. En utilisant deux champs visuels faits initialement (en haut du relevé), le programme GPA2 permet d’analyser l’évolution du déficit et d’estimer une vitesse d’aggravation avec une projection sur les années à venir.
Les tests de dépistage sont des tests rapides qui ont pour but de savoir si le champ est normal ou pas (fig. 9-97). Un calcul du profil de réponse normal du sujet est établi et le champ est exploré avec un spot placé à 6 dB au-dessus des valeurs théoriques. En fonction des tests de dépistage, les points anormaux sont soit simplement considérés comme anormaux, soit évalués plus précisément. En réalité, avec Octopus, plusieurs étapes se succèdent, mesurant certains points avec le mode dépistage et les points les plus importants avec le mode seuil.
En pratique, en cas de suspicion de glaucome, le programme ST (pour short test) présente le meilleur rapport intérêt/durée du test. Les points testés sont les mêmes que ceux des programmes complets de seuil développés plus loin (programme G2). Les points normaux sont testés avec une stratégie supraliminaire, la mesure des seuils réels étant réalisée pour les points déficitaires. Il est donc possible de réaliser un premier test avec le programme ST et de faire les tests suivants avec le programme G2.
Le test de dépistage avec trois zones supraliminaires est plus simple. Le point est testé à nouveau avec un spot ayant une brillance maximale (1 000 asb). Si ce spot n’est pas perçu, le point est considéré comme une zone de scotome absolu ; s’il est perçu, il s’agit d’un scotome relatif. Cette stratégie définit donc trois zones : normal, scotome relatif et scotome absolu. Cette stratégie s’appelle « 2 niveaux ».

Fig. 9-97 Test de dépistage 07 sur l’ensemble du champ avec une stratégie à deux niveaux, définissant des valeurs normales, des scotomes relatifs et des scotomes absolus.
Les tests de seuils mesurent la sensibilité rétinienne de chaque point testé, que celui-ci soit normal ou non. Ces tests permettent donc une quantification de l’ensemble du champ visuel, central ou périphérique (fig. 9-98).
Un nombre important de programmes est disponible avec l’Octopus ; il est même possible de créer son propre programme. L’analyse des patients atteints de glaucome se fait au mieux avec le programme G1X (Octopus 1-2-3) ou G2, programme particulièrement bien adapté à cette pathologie. Dans un premier temps, 59 points centraux sur les 26° centraux sont étudiés avec mesure des seuils. Ces 59 points centraux ne sont pas répartis de façon homogène, mais sont plus denses au centre avec une résolution de 2 degrés. Ces mêmes points sont testés dans un second temps, afin de calculer la fluctuation à court terme (cette seconde phase est optionnelle). La troisième phase consiste à tester 14 points en périphérie – surtout nasale – suivant une stratégie « trois zones » (normal, scotome relatif, scotome absolu). Enfin, une quatrième phase propose de quantifier les déficits de la troisième phase. Le programme G2 permet de calculer les indices globaux. En cas d’atteinte majeure, et de conservation d’un champ étroit autour du point de fixation, on pourra préférer le test maculaire (M2).
Fig. 9-98 Octopus. Test de seuil G2.
La partie supérieure du document comprend un certain nombre de renseignements sur le patient et sur le test réalisé. Parmi les données concernant le patient, seule la date de naissance est vraiment importante puisque les résultats statistiques dépendent de l’âge. Les précisions concernant la réfraction ou la taille de la pupille ont un intérêt pour s’assurer que le test a été fait de façon adéquate. La nature du test, ainsi que l’algorithme qui a été utilisé, sont précisés. Il est important de les analyser car certains programmes très rapides peuvent modifier les résultats.
Dans la partie supérieure droite du graphique sont présentés les paramètres de contrôle de la qualité du test. Il s’agit des :
-
fréquence de déplacement de l’axe visuel. Question = nombre de présentations. Répétitions = présentations ayant dû être refaites parce que l’axe de l’œil n’était pas droit ;
-
questions pièges pos (pour positives) : lorsque le bras de l’appareil se déplace pour une nouvelle projection, il fait un certain bruit. Dans certains cas, il se déplace sans présenter de spot lumineux. Si le sujet appuie sur le bouton de réponse, il s’agit d’un faux positif ;
-
questions pièges neg (pour négatives) : lorsque le seuil précis d’un point a été déterminé, l’appareil peut présenter à nouveau un spot nettement plus lumineux. Si le sujet ne perçoit pas ce spot, alors qu’il le devrait, il s’agit d’un faux négatif ;
-
durée de l’examen (un peu plus haut dans la liste)
L’ensemble de ces éléments permet d’évaluer un indice de fiabilité présenté sur la dernière ligne de la page.
La présentation en niveaux de gris permet une lecture rapide du champ. Cependant, elle est relativement trompeuse car elle donne faussement l’impression que toutes les régions du champ ont été mesurées. En réalité, les points testés sont distants de plusieurs degrés, comme le montrent les valeurs en décibels. Avec l’Octopus, les zones noires du niveau de gris indiquent un déficit profond, mais pas forcément absolu. Une présentation en couleurs est aussi possible, mais de peu d’intérêt.
Lorsqu’une mesure de seuil a été réalisée, la valeur de sensibilité lumineuse différentielle de chaque point testé est exprimée en décibels. Plus le chiffre est élevé, plus la sensibilité du point est grande. Cette présentation en décibels est la plus importante.
Les tests de seuil permettent une présentation des déficits. Les points sont considérés comme normaux lorsqu’ils ne s’éloignent pas de plus de 4 dB des valeurs prévues et sont exprimés par de petits « + ». Les déficits sont exprimés en décibels (par soustraction entre les valeurs normales et les valeurs du sujet). Dans cette présentation, plus le chiffre est élevé, plus le scotome est profond. Par exemple, un chiffre de 9 dB correspond à une dépression modérée, alors qu’une valeur de 25 dB signale un déficit profond.
La présentation du programme G1X sur Octopus 1-2-3 et G2 sur Octopus 101 propose une courbe intéressante : la courbe de Bebie. Les 59 points centraux dont le seuil a été testé sont repris et classés du plus performant au moins sensible après correction liée à l’âge. Ce classement est présenté en fonction du rang si bien que, dans tous les cas, la courbe à tendance à s’incliner en bas à droite. Les valeurs normales sont superposées avec les limites de confiance de 95 % de normalité.
Lorsqu’un résultat est normal, la courbe du patient (en gras) reste dans les limites de confiance. En cas de déficit diffus isolé, tous les points sont anormalement bas et la courbe du sujet est globalement située en dessous de la courbe normale. En cas de déficit localisé isolé, une partie des points est normale et les derniers points sont nettement anormaux. En cas de déficit diffus et localisé, la première partie de la courbe est en dessous de la norme mais parallèle à celle-ci, et la seconde présente une cassure. Il est donc ainsi relativement facile de suivre l’évolution globale des déficits diffus et localisés. S’il existe plus d’une région scotomateuse, cette analyse devient plus difficile.
Les différents indices globaux sont disponibles avec les programmes G1X/G2 (stratégie normale ou dynamique) et M2/M2X. Le tableau proposant ces indices présente les valeurs normales (95 % des sujets normaux), puis les valeurs du sujet durant la phase 1 et la phase 2, et enfin la moyenne des résultats des deux phases. Ces valeurs moyennes doivent être comparées aux valeurs normales pour estimer leur caractère pathologique.
Avec l’appareil d’Octopus, six indices globaux sont disponibles :
-
MS (mean sensitivity) ou sensibilité moyenne. Cet indice fait la moyenne des sensibilités lumineuses différentielles des différents points testés. Il a peu d’intérêt car il n’est pas corrélé à l’âge et moins précis que l’indice de déviation moyenne ;
-
MD (mean defect) ou perte moyenne. Le MD exprime le déficit moyen de sensibilité calculé sur l’ensemble du champ et corrélé à l’âge. Plus le MD est élevé, plus le déficit est important ;
-
LV (loss variance) ou variance de la perte, perturbé en cas de déficit localisé. Plus le LV est élevé, plus le déficit est important ;
-
SF (short term fluctuation) ou fluctuation à court terme. En pratique, l’ensemble des points sont mesurés une première fois (phase 1), puis une seconde fois (phase 2). Cette phase 2 reprend les mêmes points que la phase 1 et permet donc le calcul des fluctuations ;
-
CLV (corrected loss variance) ou variance de la perte corrigée. Cet indice correspond à l’indice de déviation individuelle corrigée de la fluctuation à court terme. Il n’est donc disponible que si les deux phases ont été menées à terme ;
-
indice de fiabilité (reliability index ou RF). Il évalue la fiabilité à partir des valeurs de faux positifs et faux négatifs. N’étant pas étalonné, il a peu d’intérêt.
Le périmètre d’Octopus présente des programmes permettant d’évaluer la progression de l’atteinte, essentiellement grâce à un logiciel à installer sur un ordinateur annexe, le programme Peridata. Celui-ci peut importer les données de nombreux relevés de champs visuels (jusqu’à 30) (fig. 9-99). Il peut alors reprendre l’évolution de chaque point et déterminer si la nouvelle valeur à ce niveau est statistiquement équivalente ou non à la précédente. Le logiciel permet ainsi d’avoir une idée sur l’évolution du déficit. Cependant, il ne s’agit pas à proprement parler d’une analyse statistique d’évolution, car cela nécessiterait une comparaison de l’évolution du patient étudié d’un côté et des données de patients glaucomateux stables de l’autre. Cette analyse ne permet pas, par exemple, de différencier variabilité des résultats et aggravation réelle.
Retenir
-
Les tests de dépistage ne sont pas utiles dans le glaucome.
-
Le premier examen périmétrique habituellement réalisé dans le glaucome est le test de seuil 24-2 (Humphrey) ou dG2 (Octopus).
-
Les indices globaux permettent de comparer les résultats d’un patient à la norme et d’analyser la profondeur des scotomes.
-
L’indice de suivi le plus utilisé avec l’indice MD est l’indice VFI, qui semble le mieux corrélé à l’importance de l’atteinte fonctionnelle.
-
La périmétrie cinétique de Goldmann n’est utile que dans les phases très avancées du glaucome.
Fig. 9-99 Octopus. Analyse de suivi du MD et du LV.
F. Maÿ
-
La périmétrie bleu-jaune teste spécifiquement les cellules ganglionnaires rétiniennes de la voie koniocellulaire.
-
Elle permet une analyse fine et précise du champ visuel.
-
Elle teste spécifiquement les déficits légers ≤ 13 dB dans les 20 degrés centraux.
-
Des critères minimaux d’anormalité ont été définis.
-
Son indication la plus pertinente est la recherche de déficits précoces chez le sujet de moins de 60 ans, aux milieux oculaires encore transparents, présentant des facteurs de risque de glaucome.
La périmétrie automatisée bleu-jaune (PBJ) est une technique dite non conventionnelle de périmétrie, en opposition à la périmétrie automatisée standard (PAS) « blanc-blanc », et connue sous les termes de blue on yellow perimetry et/ou de short wave-length perimetry (SWAP) dans le monde anglophone. Elle permet l’étude de la sensibilité au contraste coloré bleu-jaune pour chaque point du champ visuel par des stimuli lumineux colorés de courte longueur d’onde.
Les premiers travaux sur la PBJ ont commencé au début des années 1980. De nombreuses études avaient montré qu’une dyschromatopsie acquise tritan d’axe bleu-jaune était fréquemment associée au glaucome primitif à angle ouvert (GPAO) [15]. Plusieurs tentatives de mise au point d’une technique testant la vision des couleurs dans le champ visuel ont vu le jour depuis le début du xxe siècle, mais sans succès du fait de la difficulté de sélectionner la bonne longueur d’onde et de trouver un éclairement approprié du fond de la coupole [19]. En 1972, les travaux de Marré, confirmés par Stiles en 1978, ont démontré que la longueur d’onde de 440 nm était la meilleure pour étudier sélectivement le système des courtes longueurs d’onde [12, 20-22]. Il était dès lors possible de combiner l’analyse de la sensibilité au contraste coloré bleu-jaune avec une technique de périmétrie classique, ouvrant la voie vers la conception de techniques de périmétrie utilisant un stimulus bleu projeté sur un fond éclairé jaune. Au début des années 1990, les premières études ont rapidement montré que la PBJ détectait des déficits avant la PAS et que les déficits en PBJ étaient plus étendus qu’en PAS [4, 5, 10, 18]. Finalement, en 1996, les procédures se sont standardisées et ont été diffusées, aboutissant aux appareils de périmétrie disponibles depuis sur le marché [17].
La PBJ teste plus spécifiquement la voie fonctionnelle ganglionnaire dite « koniocellulaire ». Près de 90 % des axones des cellules ganglionnaires rétiniennes (CGR) se projettent sur le corps genouillé latéral (CGL) où ils font synapse avec les neurones géniculocorticaux qui se projettent sur le cortex visuel primaire. Le CGL est composé de six couches superposées, répartissant les neurones en fonction de leurs caractéristiques anatomiques, fonctionnelles et des composantes de la fonction visuelle qu’ils véhiculent, aboutissant au système MPK (voir chapitre 5).
Les deux couches ventrales du CGL, magnocellulaires, sont composées de grosses cellules qui reçoivent les informations relatives à la luminance et au mouvement, transmises par les axones des cellules ganglionnaires parasols α représentant environ 10 % des CGR.
Les quatre couches dorsales parvocellulaires, constituées de petites cellules, sont connectées aux axones des cellules ganglionnaires naines représentant près de 50 % des CGR. La voie parvocellulaire véhicule les informations liées au contraste coloré rouge-vert issues des cônes L sensibles aux grandes longueurs d’onde et des cônes M sensibles aux moyennes longueurs d’onde.
Les couches parvo- et magnocellulaires sont séparées par des espaces interlaminaires koniocellulaires constituées de cellules de très petite taille (κονις signifiant poussière) recevant les afférences des cellules ganglionnaires bistratifiées intervenant dans le contraste bleu-jaune. La voie koniocellulaire transmet les signaux bleu ON issus des cônes S (sensibles aux courtes longueurs d’onde), et se projette au niveau des blobs des couches 2 et 3 du cortex visuel primaire. Le contraste coloré bleu-jaune provient de l’antagonisme entre les signaux bleu ON des cônes S et des messages OFF issus de la combinaison des signaux des cônes L et M, traités au niveau cortical [23].
La PBJ évalue l’antagonisme bleu-jaune au niveau de chaque point du champ visuel, testant ainsi la voie koniocellulaire issue des cônes S, relayée par les CGR bistratifiées. Celles-ci, représentant environ 5 % des CGR, ont la particularité d’avoir des champs récepteurs dispersés, non redondants et sans chevauchement. Une perte de ces cellules serait donc théoriquement détectée plus facilement et plus précocement par un stimulus spécifique : c’est le principe de la PBJ.
Les caractéristiques du stimulus de la périmétrie bleu-jaune dérivent des travaux de Stiles qui a mis au point des stratégies permettant d’isoler un des mécanismes de la vision des couleurs et d’en mesurer la sensibilité [20, 21]. La vision des couleurs repose sur trois types de cônes : les cônes S, M et L ayant une sensibilité maximale, respectivement, pour les longueurs d’onde de 445 nm, de 555 nm et 595 nm. Dans les conditions normales naturelles d’éclairement, les systèmes M et L prédominent car leurs sensibilités sont les plus élevées.
Dans la PBJ, tous les paramètres ont été choisis de façon à isoler et tester le système S. L’emploi d’un fond éclairé par une lumière jaune de 530 nm brillante de forte luminance de 100 cd/m2 sature les systèmes L et M et inhibe l’activité des bâtonnets, isolant de ce fait les cônes S. La sensibilité du système S est ainsi testée isolément par un stimulus bleu de 440 nm de longueur d’onde, selon une bande spectrale étroite de 10-20 nm. Le stimulus est de taille V, soit 1,74°, et la durée de présentation est de 200 ms [27]. Lors du test, la luminance du stimulus est augmentée par paliers jusqu’à une valeur seuil à partir de laquelle le stimulus est vu.
L’activité des cônes S reste isolée jusqu’à une certaine valeur de seuil de luminance du stimulus. Au-delà, les autres systèmes sont activés et répondent. Ainsi, la PBJ teste spécifiquement les déficits légers (≤ 13 dB) dans les 20 degrés centraux. Les déficits supérieurs à 13 dB sont testés par des stimuli de luminance plus élevée qui activent dès lors les systèmes L et M, ainsi que le système sensible au contraste achromatique de luminance [5]. Si la PBJ convient bien pour détecter les déficits précoces et débutants, elle devient non pertinente en cas de glaucome modéré ou avancé.
La PBJ est disponible sur la plupart des appareils de périmétrie automatisée : Humphrey Field Analyzer avec les programmes 24-2, 30-2 ou 10-2 et les stratégies de seuil FASTPAC, STATPAC et SITA Octopus avec les programmes G1, G2, stratégie dynamique et TOP, Métrovision®, etc., pour ne citer que les plus diffusés.
De façon générale, le protocole est superposable à celui de la PAS. L’existence d’une banque de données de valeurs normales en fonction de l’âge permet une analyse statistique des résultats et le calcul d’indices globaux MD et PSD, ainsi que l’établissement de cartes de déviation totale et individuelle. En revanche, les appareils ne proposent pas de programme d’analyse de suivi, car la PBJ est essentiellement vouée à la détection des déficits débutants.
En pratique, la réalisation du test est semblable à celle de la PAS, en suivant les mêmes recommandations de bonnes pratiques. Sa durée est en moyenne 15 à 20 % plus longue qu’en PAS pour des programmes et des stratégies équivalentes. De même qu’en PAS, elle a tendance à s’allonger avec l’âge. De l’ordre de 7 à 9 minutes avec la stratégie FASTPAC, la durée s’est significativement réduite avec les stratégies plus récentes. Les stratégies SITA permettent d’avoir des tests assez rapides, de l’ordre de 3 à 5 minutes par test, réduisant le phénomène de fatigue. La stratégie SITA se révèle aussi performante que le test de seuil complet STATPAC [1, 13].
Les relevés de la PBJ, quel que soit l’appareil, sont strictement superposables à ceux de la PAS. Le relevé d’examen se compose des caractéristiques du patient, des indices de fiabilité, de la représentation des valeurs en décibels, de la représentation en échelle de gris, des indices globaux MD et PSD assortis de leurs indices de probabilités, et des cartes de déviation totale et individuelle (fig. 9-100). Les règles d’interprétation et l’analyse des indices sont semblables à celles de la PAS, mais certaines particularités doivent être prises en compte.
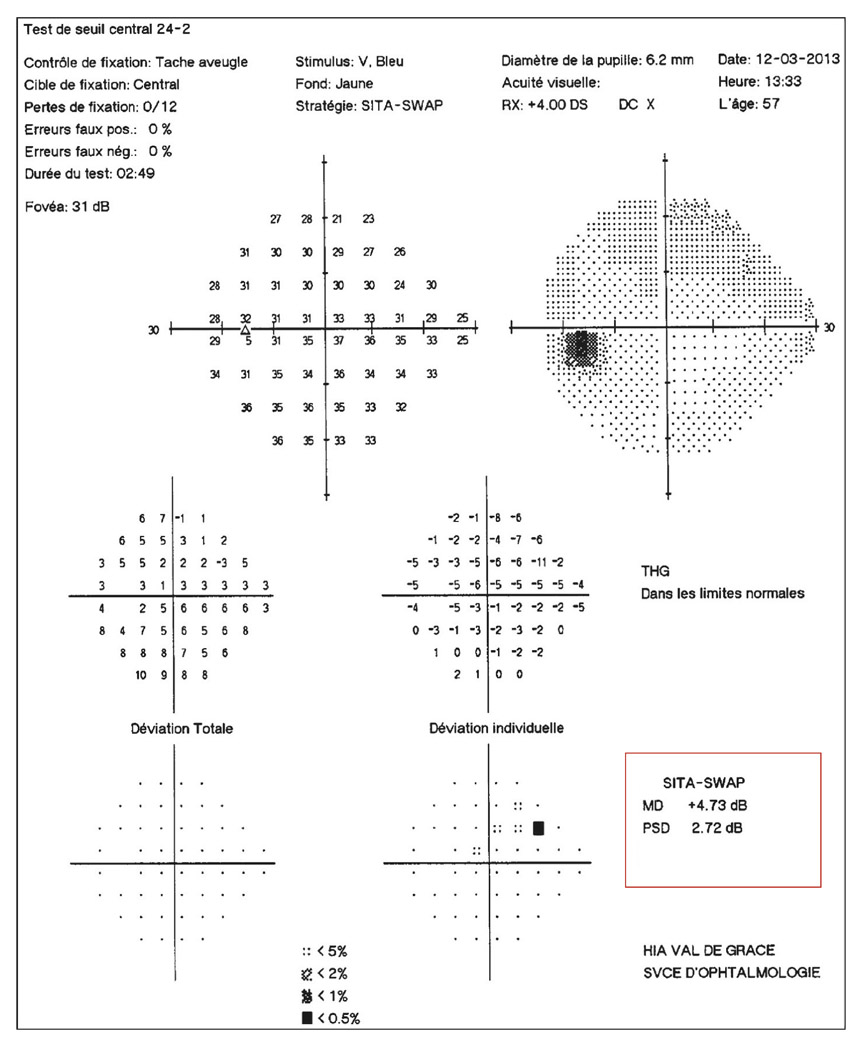
Fig. 9-100 Relevé d’une périmétrie bleu-jaune chez un sujet normal (SITA-SWAP). La représentation en échelle de gris apparaît diffusément plus sombre car la sensibilité est plus faible en PBJ. L’assombrissement est plus marqué en périphérie et dans l’hémi-champ supérieur.
La sensibilité moyenne diminue de 1,5 à 2,2 dB par décennie. La réduction de sensibilité avec l’âge est bien plus importante que celle rencontrée en PAS (0,8 par décennie) [7, 24]. Elle est plus accentuée en périphérie qu’au centre. Cette tendance est principalement liée à l’absorption des milieux oculaires transparents et, pour une moindre mesure, à la réduction du nombre et de la densité des cônes. Elle pourrait être expliquée également par la non-redondance et le faible chevauchement des champs récepteurs, limitant les capacités de compensation à la suite de la diminution du nombre de CGR [11]. Cette réduction de sensibilité selon l’âge est prise en compte dans l’analyse statistique car les valeurs sont comparées à celles fournies par la banque de données de valeurs normales par tranche d’âge.
De façon générale, la représentation en échelle de gris apparaît plus sombre du fait d’une plus faible sensibilité en PBJ, tendance qui se majore avec l’âge. La carte en échelle de gris paraît également plus sombre en périphérie et dans le champ visuel supérieur, pouvant faire évoquer par erreur un déficit arciforme supérieur (voir fig. 9-100). La représentation en échelle de gris offre un aspect souvent trompeur et son analyse doit toujours être confrontée aux autres données du relevé : représentation en décibels et cartes de déviation [27].
En reprenant la méthodologie employée par Caprioli pour la PAS, Polo et son équipe ont déterminé les critères permettant de différencier les déficits pathologiques avec une bonne sensibilité et une bonne spécificité [2, 14].
Un scotome est reconnu comme pathologique s’il réunit au moins quatre points contigus assortis d’une probabilité p < 5 %, ou au moins trois points contigus assortis d’une probabilité p < 1 %.
La PBJ est caractérisée par d’importantes variations interindividuelles. Wild et al. [24] ont démontré que la variation de la valeur du seuil pour chaque point testé, entre des individus normaux, était en moyenne 2,7 fois plus élevée que la celle de la PAS. Cela explique pour l’analyse statistique que la réduction minimale de sensibilité, suffisante pour être reconnue comme pathologique, devra nécessairement être plus importante, comparativement à la PAS [24]. La prise en compte de ces variations dans l’analyse statistique affecte finalement peu la sensibilité du test et ses capacités à détecter des déficits très précoces [19].
Les fluctuations à court terme, intra-test, des valeurs de seuil surviennent au cours de l’examen. Elles paraissent plus importantes qu’en PAS chez le sujet normal. Leur amplitude augmente chez les sujets glaucomateux, mais de façon comparable à la PAS [19, 27].
Les fluctuations à long terme, inter-test, apparaissant d’un examen à l’autre sont plus fréquentes et plus importantes en PBJ qu’en PAS, chez le sujet normal et chez le sujet glaucomateux.
L’existence de ces fluctuations rend difficile l’identification d’une progression et doit être bien prise en compte lors de l’interprétation. Lors de la confrontation de deux examens successifs, une aggravation apparente devra être suffisamment importante et confirmée par un, voire deux autres tests, avant d’être retenue comme pathologique.
L’effet d’apprentissage se traduit par une amélioration des réponses et une augmentation de la sensibilité par rapport à l’examen initial. L’augmentation de la sensibilité moyenne peut s’élever à 6,5 % par rapport à l’examen initial [26]. Le premier examen doit être considéré comme un test de débrouillage et il convient d’attendre le 2e voire le 3e test avant de réaliser raisonnablement une interprétation fiable. L’effet d’apprentissage est plus atténué avec la stratégie SITA-SWAP qui permet de considérer comme fiable le 2e examen [6].
La fatigabilité survient plus rapidement qu’en PAS. Ce phénomène est actuellement compensé par la réduction de la durée du test avec les stratégies SITA : 3 à 5 minutes.
De façon générale, la périmétrie est un test psychophysique influencé par nature par le niveau des performances cognitives du sujet et par ses capacités de concentration et d’attention.
Chez le sujet normal, les courtes longueurs d’onde sont en partie absorbées par le cristallin, et cette absorption augmente régulièrement avec l’âge jusqu’à 60 ans, âge à partir duquel le phénomène s’accentue. Le degré d’absorption est variable d’un individu à l’autre, pour une même tranche d’âge [16, 27]. Cette absorption se traduit en PBJ par une diminution diffuse de la sensibilité. La base de données de valeurs normales, utilisée pour l’analyse statistique, prend en compte cette absorption.
Les opacités cristalliniennes de la cataracte majorent l’absorption et créent un effet de dispersion lumineuse, se traduisant par une baisse significative et diffuse de la sensibilité, altérant la capacité de la PBJ à détecter les déficits précoces (fig. 9-101). La PBJ serait plus influencée par une opacité sous-capsulaire postérieure que par une opacité corticale [23].
La présence d’un déficit diffus traduit généralement un trouble de la transparence des milieux et rarement une atteinte glaucomateuse : le déficit diffus est rare dans le glaucome et ne survient que dans 4 % des cas [3]. Cependant, en cas d’association cataracte-glaucome, la baisse diffuse de la sensibilité liée au trouble des milieux limite les capacités de détection et rend difficile le suivi des déficits glaucomateux.
En dehors de la cataracte, la PBJ, comme la PAS, est également perturbée par d’autres opacités des milieux oculaires prérétiniens : taies cornéennes, corps flottants vitréens, etc.
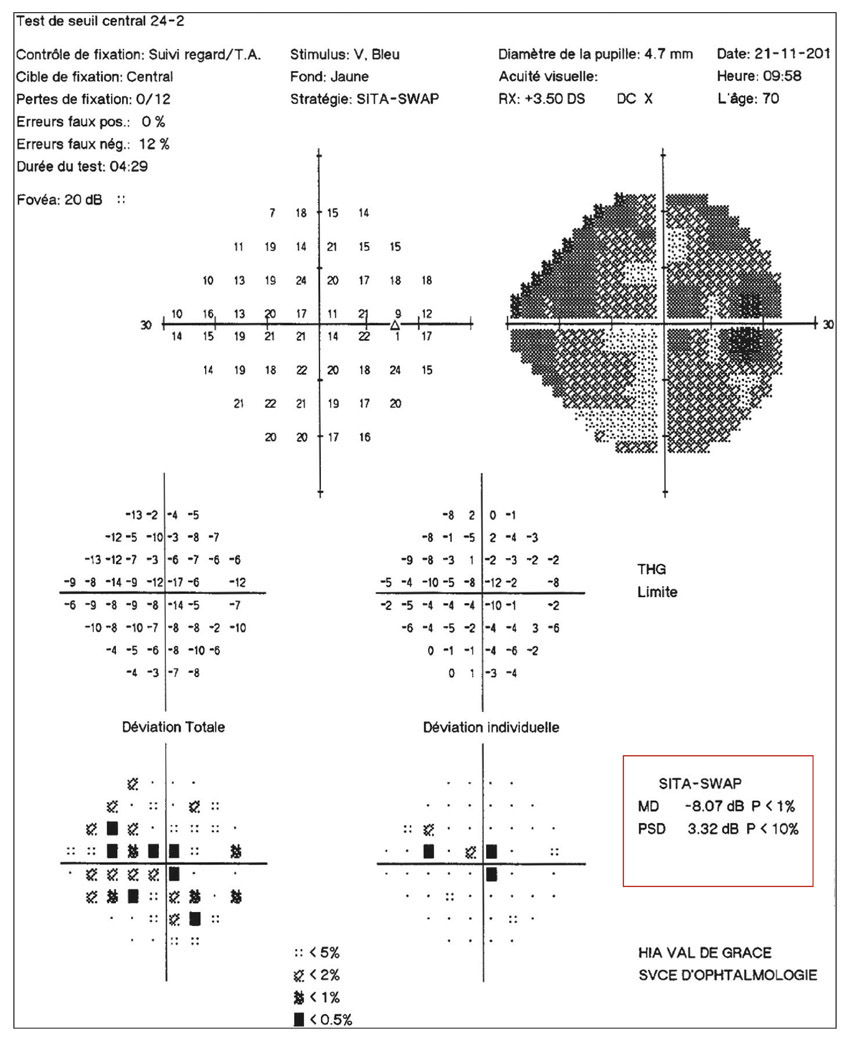
Fig. 9-101 Cas clinique de cataracte sans glaucome. Patient de 71 ans, sans facteur de risque de glaucome, mais présentant une cataracte nucléaire débutante, responsable d’une réduction diffuse de la sensibilité en périmétrie bleu-jaune.
Les courtes longueurs d’onde sont également partiellement absorbées par le pigment maculaire. Elles entraînent une réduction du pic fovéolaire et une diminution de la sensibilité de la région paracentrale. Si les tests 24-2 et 30-2 sont peu influencés, le test 10-2 en revanche est plus souvent altéré [25]. En pratique, l’absorption par le pigment maculaire n’influence pas la détection et le suivi des déficits glaucomateux.
La PBJ peut également être altérée par des rétinopathies générant une dyschromatopsie acquise. L’œdème maculaire de la rétinopathie diabétique s’accompagne d’une réduction de la sensibilité au 10-2 en PBJ [8]. Pendant une certaine période, la PBJ avait d’ailleurs été proposée pour la surveillance des rétinopathies diabétiques. D’autres affections oculaires sont susceptibles d’altérer la sensibilité au contraste coloré bleu-jaune : la rétinite pigmentaire et certaines neuropathies optiques [19].
Enfin, la PBJ peut être altérée chez les patients pseudo-phakes porteurs d’un implant « jaune » absorbant les courtes longueurs d’onde, comme cela a bien été démontré [9].
Retenir
-
La PBJ teste la sensibilité au contraste coloré dans les différents points du champ visuel.
-
Elle est disponible sur l’ensemble des appareils de périmétrie.
-
La durée du test est moins longue avec les stratégies courtes de type SITA.
-
Avec de nombreuses fluctuations à court et long termes, elle est influencée par les troubles des milieux oculaires et la cataracte.
-
Son indication doit se limiter au sujet jeune présentant des milieux clairs et transparents.
[1] Bengtsson B, Heijl A. Diagnostic sensitivity of fast blue-yellow and standard automated perimetry in early glaucoma. A comparison between different test programs. Ophthalmology. 2006 ; 113 : 1092-7.
[2] Caprioli J. Automated perimetry in glaucoma. Am J Ophthalmol. 1991 ; 16 : 239-42.
[3] Chauhan BC, LeBlanc RP, Shaw AM, et al. Repeatable diffuse visual field loss in open-angle glaucoma. Ophthalmology. 1997 ; 104 : 532-8.
[4] deJong LAMS, Snepvangers CEJ, Van den Berg CT. Blue-Yellow perimetry in the detection of early glaucomatous damage. Doc Ophthamol. 1990 ; 75 : 303-14.
[5] Felius J, deJong LA, Van den Berg TJ, Greve EL. Functional characteristics of blue-on-yellow perimetric thresholds in glaucoma. Invest Ophthalmol Vis Sci.1995 ; 36 : 1665-74
[6] Fogagnolo P, Tanga L, Rossetti L, et al. Mild learning effect of short-wavelength automated perimetry using SITA program. J Glaucoma. 2010 ; 19 : 319-23.
[7] Heijl A, Lingren G, Olsson J. Normal variability of static perimetric threshold value across the central field. Arch Ophthalmol. 1987 ; 105 : 1544-9.
[8] Hudson C, Flanagan JG, Turner GS, et al. Short-wavelength sensitive field loss in patients with clinically significant diabetic macular oedema. Diabetologia. 1998 ; 41 : 918-28.
[9] Jang SY, Ohn YH, Kim SW. Effect of yellow-tinted intraocular lens on short-wavelength automated perimetry. Am J Ophthalmol. 2010 ; 150 : 243-7.
[10] Johnson CA, Adams AJ, Casson EJ, Brandt JD. Blue-on-yellow perimetry can predict the development of glaucomatous visual field loss. Arch Ophthalmol. 1993 ; 111 : 645-50.
[11] Johnson CA. Selective versus nonselective losses in glaucoma. J Glaucoma. 1994 ; 3 (Suppl. 1) : S32-44.
[12] Marré M. Clinical examination of three color vision mechanisms in acquired color vision defects. Mod Probl Ophthalmol. 1972 ; 11 : 224-7.
[13] Ng M, Racette L, Pascual JP, et al. Comparing the full-threshold and swedish interactive thresholding algorithms for short wavelength automated perimetry. Invest Ophthalmol Vis Sci. 2009 ; 50 : 1726-33.
[14] Polo V, Larrosa JM, Pinilla I, et al. Optimum criteria for short-wavelength automated perimetry. Ophthalmology. 2001 ; 108 : 265-89.
[15] Sample PA, Boynton RM, Weinreb RN. Isolating the color vision loss in primary open angle glaucoma. Am J Ophthalmol. 1988 ; 106 : 686-91.
[16] Sample PA, Esterson FD, Weinreb RN. The ageing lens : in vivo assessment of light absorption in 84 human eyes. Invest Ophthalmol Vis Sci. 1988 ; 29 : 1306-11.
[17] Sample PA, Johnson CA, Haegerstrom-Portnoy G, Adams A. Optimum parameters for short-wavelength automated perimetry. J Glaucoma. 1996 ; 5 : 375-83.
[18] Sample PA, Taylor JD, Martinez GA, et al. Short-wavelength color visual fields in glaucoma suspects at risk. Am J Ophthalmol. 1993 ; 115 : 225-33.
[19] Sample PA. Short-wavelength automated perimetry : it’s role in the clinic and for understanding ganglion cell function. Prog Ret Eye Res. 2000 ; 19 : 369-83.
[20] Stiles W. The directional sensitivity of the retina and the spectral sensitivities of the rods and cones. Proc Roy Soc. 1939 ; 127 : 64-105.
[21] Stiles WS. Color vision : the approach through increment-threshold sensitivity. Proc Natl Acad Sci USA. 1959 ; 45 : 100-14
[22] Stiles WS. Mechanisms of colour vision. Londres, Academic Press, 1978.
[23] Vital-Durand F, Bullier J. Systématisation fonctionnelle des voies optiques. In : Risse JF (Ed.). Explorations de la fonction visuelle. Rapport de la Société française d’pphtalmologie. Paris, Masson, 1999 : 37-57.
[24] Wild JM, Cubbidge RP, Pacey IE, Robinson R. Statistical aspects of the normal visual field in short wavelength automated perimetry. Invest Ophthalmol Vis Sci. 1998 ; 39 : 54-64.
[25] Wild JM, Hudson C. The attenuation of blue-on yellow perimetry by the macular pigment. Ophthalmology. 1995 ; 102 : 911-6.
[26] Wild JM, Moss ID. Baseline alterations in blue-on-yellow normal perimetric sensitivity. Graefe’s Arch Exp Ophthalmol. 1996 ; 234 : 141-9.
[27] Wild JM. Short wavelength automated perimetry. Acta Ophthalmol Scand. 2001 ; 79 : 546-59.
F. Maÿ
-
La périmétrie à doublage de fréquence teste préférentiellement un sous-groupe de cellules ganglionnaires rétiniennes de la voie magnocellulaire.
-
Leur disparition peut être détectée très précocement car elles ont une répartition dispersée et leurs champs récepteurs sont étendus avec très peu de chevauchement.
-
Le Matrix™ ne nécessite pas d’opérateur expérimenté. Les tests sont rapides et ressentis comme faciles par les patients.
-
Peu influencée par le degré de transparence des milieux intra-oculaires, la périmétrie FDT est moins altérée en cas d’opacité ou de trouble des milieux.
-
Son indication la plus pertinente est la recherche des déficits glaucomateux précoces ou débutants chez le sujet porteur de facteurs de risque de glaucome et présentant une phakosclérose ou une cataracte débutante.
Disponible en usage clinique courant depuis une dizaine d’années, la périmétrie à doublage de fréquence est connue dans le monde anglophone sous le terme de frequency doubling technology (FDT). La périmétrie FDT est dite périmétrie non conventionnelle car, contrairement à la périmétrie automatisée standard (PAS), elle ne teste pas la sensibilité à un contraste de luminance. Elle évalue, pour chaque point du champ visuel, la sensibilité au contraste temporel, à l’aide d’un stimulus spatiotemporel s’apparentant à un papillotement. Simple d’utilisation, performante dans la détection et la catégorisation des déficits glaucomateux, la périmétrie FDT est par ailleurs moins influencée par le degré de transparence des milieux intra-oculaires.
L’illusion optique de doublage de fréquence a été décrite par Kelly en 1966 [17]. Ce phénomène se produit avec un stimulus achromatique structuré composé d’une alternance de barres noires et blanches de basse fréquence spatiale, au moins inférieure à 3 cycles/degré. Lorsque ce stimulus est soumis à une inversion de phase répétée suivant une fréquence temporelle suffisamment élevée, supérieure à 7 Hz, l’observateur perçoit un doublement du nombre de barres. Par la suite, il a été démontré que la perception de ce phénomène résultait de l’activation d’une certaine catégorie de cellules ganglionnaires rétiniennes (CGR) de la voie fonctionnelle magnocellulaire, les cellules My [1, 9, 16, 18].
De nombreuses études cliniques ont montré les bonnes performances de la périmétrie FDT qui se révèle à la fois sensible et spécifique dans la détection des déficits glaucomateux [9,15, 23-25].
Le stimulus visuel créant l’illusion de doublage de fréquence est un signal achromatique structuré de forme carrée, présenté sur un écran cathodique, avec un fond éclairé à 100 cd/m2. Il est composé d’une grille alternant des barres verticales noires et blanches, équivalente à un profil sinusoïdal de basse fréquence spatiale, de 0,25 cycle/degré. Les franges noires et blanches sont inversées suivant une fréquence temporelle élevée de 18 ou 25 Hz selon les versions. Le contraste entre franges noires et blanches est progressivement augmenté jusqu’à un seuil déclenchant la perception d’un doublement de la fréquence du stimulus qui est alors vu par le sujet comme un papillotement localisé dans le fond éclairé (fig. 9-102). Le stimulus est présenté aux différents points du champ visuel, de façon aléatoire. La durée de présentation est de 720 ms, comprenant une montée progressive du contraste pendant les premières 100 ms, une phase en plateau à un niveau de contraste défini et enfin une réduction progressive jusqu’à 0 dans les 100 dernières millisecondes. Si le sujet répond dans un délai de 0,1 à 1 seconde après la présentation, le stimulus est considéré comme vu. Sinon, il est considéré comme non vu et sera présenté ultérieurement avec un niveau de contraste plus élevé. Le seuil est exprimé en décibels [24].
Fig. 9-102 Le stimulus en périmétrie par doublage de fréquence. Lorsqu’un stimulus structuré composé de franges verticales noires et blanches de basse fréquence spatiale est soumis à une inversion de phase selon une haute fréquence temporelle, le sujet perçoit un doublement apparent du nombre des franges noires et blanches, avec la perception d’un papillotement.
Ce type de stimulus, combinant contraste spatial et contraste temporel, active préférentiellement les cellules My appartenant au contingent des CGR dont les axones se projettent sur les deux couches magnocellulaires de la partie ventrale du corps genouillé latéral. Les axones des CGR magnocellulaires sont caractérisés par un grand diamètre et une vitesse de conduction rapide ; ils transmettent préférentiellement les informations relatives au mouvement et au contraste temporel. La réponse des cellules My est de type non linéaire, expliquant la sensation d’un saut lors du doublage de fréquence qui se manifeste par la perception du stimulus. Représentant à peine 1,5 à 2,5 % des CGR, les cellules My sont caractérisées par une répartition disséminée et dispersée, et par des champs récepteurs étendus avec un faible chevauchement. Cette disposition favorise la détection de déficits, qui correspondent à une perte localisée de cellules My. Cela est à la base du principe de la périmétrie FDT [16]. Selon certains auteurs, le traitement de l’information relative au contraste spatiotemporel est plus complexe ; le stimulus FDT isolerait les cellules magnocellulaires dans leur ensemble, mais activerait une réponse non linéaire élaborée au niveau rétinien [35].
Le Humphrey FDT Perimeter (Welch Allyn, Carl Zeiss Meditec), commercialisé dès 1997, est la première génération de périmètre utilisant la technologie de doublage de fréquence. Le programme C-20 explore les 20 degrés centraux du champ visuel, en testant 16 zones carrées contiguës de 10 degrés de côté et une zone centrale circulaire de 10° de diamètre (eFig. 9-16). Le programme N-30 teste deux zones carrées supplémentaires en nasal (voir eFig. 9-16). Le stimulus associe un contraste spatial de 0,25 cycle/degré et un contraste temporel d’inversion de phase de 25 Hz. Le programme N-30 teste deux zones supplémentaires en nasal. Le FDT Perimeter propose des tests de dépistage et des tests de seuil. La base de données normatives des tests de dépistage et de seuil se compose de 700 yeux de 450 sujets normaux répartis par tranche d’âge, de 18 à 85 ans [1]. L’appareil dispose d’un logiciel d’analyse statistique : les seuils obtenus pour chaque zone testée sont assortis d’un niveau de probabilité, corrigé en fonction de l’âge.
eFig. 9-16 Programmes C-20 et N-30 [8].
L’appareil fournit deux types de test de dépistage en mode supraliminaire. La durée de l’examen est courte, de l’ordre d’une minute. Les relevés affichent, pour chaque œil testé, le pourcentage d’erreurs de fixation et de faux positifs. Pour chaque programme, deux niveaux de probabilité sont proposés.
Les tests C-20-1 et N-30-1 présentent un stimulus à un niveau de contraste vu par 99 % des sujets normaux, correspondant à une spécificité élevée. Le relevé présentera les valeurs en échelle de gris correspondant aux probabilités p ≥ 1 %, p < 1 %, p < 0,5 % et « non vu ».
Les tests C-20-5 et N-30-5 présentent un stimulus à un niveau de contraste vu par 95 % des sujets normaux de la même tranche d’âge. Le relevé affiche les niveaux de probabilité p ≥ 5 %, p < 5 %, p < 2 % et p < 1 %. Moins spécifique mais plus sensible, il convient bien pour le dépistage des déficits débutants. En cas de déficits, les résultats doivent être confirmés par un test plus spécifique ou par un test de seuil [1].
Le FDT Perimeter propose des tests de seuil utilisant les programmes C-20 et N-30 avec la stratégie de seuil MOBS (modified binary search algorithm). Aucune correction n’est nécessaire si l’amétropie du patient est comprise entre – 6 et + 6 dioptries. La durée du test pour chaque œil est assez courte, 4 à 5 minutes.
Le relevé fournit des indices de fiabilité, des indices globaux et trois types de cartes. Les indices de fiabilité se composent des pourcentages d’erreurs de fixation, de faux positifs et de faux négatifs ; ils doivent être inférieurs à 33 % pour que les résultats soient considérés comme fiables (fig. 9-103). Les indices globaux sont le MD (mean deviation) assorti d’un niveau de probabilité et le PSD (pattern standard deviation). La carte de seuil exprime, pour chaque zone testée, la sensibilité en dB (de 0 à 56 dB). Les cartes de déviation totale et individuelle expriment en échelle de gris, pour chaque zone testée, un niveau de probabilité allant de p < 0,5 % à p ≥ 5 % [1].
Les résultats obtenus avec les tests de seuil du FDT Perimeter ont une reproductibilité semblable à celle de la PAS, chez les sujets normaux et glaucomateux [10, 30, 33]. De nombreuses publications ont démontré de bonnes corrélations avec la PAS ainsi que sa capacité à détecter les déficits précoces [9, 16, 29, 30]. Utile pour le dépistage, ce test reste cependant trop peu précis pour caractériser les déficits et n’autorise pas de suivi suffisamment fiable ; l’appareil ne permet pas de contrôler correctement la fixation.
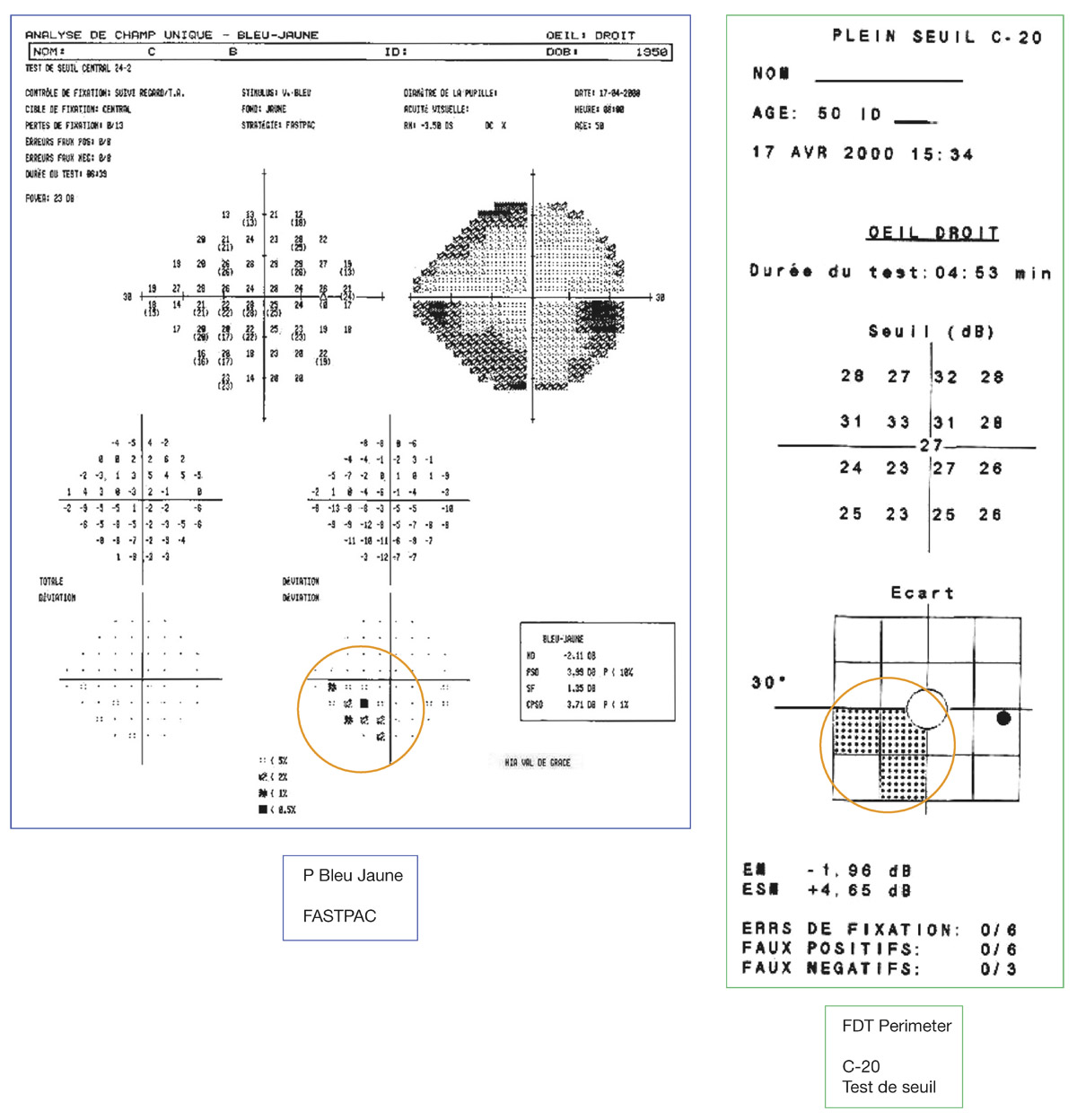
Fig. 9-103 Test de seuil C-20 versus périmétrie bleu-jaune FASTPAC chez un patient de 50 ans suivi pour hypertonie intra-oculaire.
Le Humphrey FDT-Matrix™ (Welch Allyn, Carl Zeiss Meditec), commercialisé depuis 2003, est la deuxième version de périmètre FDT. Il propose cinq types de programme : le N-30 de la première version et quatre programmes de la périmétrie classique : le 24-2, le 30-2, le 10-2 et le programme Macula. Le stimulus employé pour le N-30 est le même que celui utilisé par la première version. En revanche, les caractéristiques du stimulus et des zones testées diffèrent radicalement pour les quatre autres programmes. Les fréquences spatiales et temporelles ont été modifiées en fonction de la taille des zones testées afin d’obtenir de bons niveaux de reproductibilité, de sensibilité et de spécificité. Quel que soit le programme, le stimulus est présenté pendant 300 ms, sur un fond éclairé avec une luminance de 100 cd/m2.
Le programme 24-2 teste 55 zones : une zone centrale circulaire de 5° de diamètre centrée par un carré central de 1° de côté (dédié à la mesure du seuil fovéal) et 54 zones carrées de 5° de côté, espacées verticalement de 0,5°, réparties sur les quatre quadrants en respectant une bande horizontale de 2° de large et une bande verticale de 6° de large (fig. 9-104). Cette bande verticale permet de mieux caractériser les déficits hémianopsiques et quadranopsiques. Le programme 30-2 se compose de 69 zones avec 14 zones supplémentaires en périphérie : six en nasal et huit en temporal (voir fig. 9-104). Pour les programmes 24-2 et 30-2, la fréquence spatiale du stimulus est à 0,50 cycle/degré, plus élevée que celle du N-30, et la fréquence temporelle est plus basse, 18 Hz. Ces programmes testent des zones plus petites et plus nombreuses que le N-30, offrant la capacité d’une meilleure résolution et d’une meilleure identification des déficits en localisation et en étendue.
Le programme 10-2 étudie les 10° centraux en testant 44 zones carrées : 16 zones jointives de 2° de côté avec un carré central de 1° de côté pour l’évaluation du seuil fovéolaire, entourées par 28 zones de 2° de côté mais espacées l’une de l’autre de 1°. Ce programme est parfaitement adapté pour l’analyse des déficits centraux menaçant le point de fixation (eFig. 9-17). Le programme Macula étudie les 5° centraux en testant 16 zones carrées jointives de 2° de côté, avec un carré central de 1° de côté (voir eFig. 9-17). Pour ces deux derniers programmes, la fréquence spatiale est la même, 0,50 cycle/degré, mais la fréquence temporelle est plus basse, 12 Hz.
Le Matrix™ fournit deux types de programme de dépistage, en mode supraliminaire : le test N-30 de la première version et le test 24-2 qui fournit d’emblée des informations plus précises sur la localisation et l’étendue des déficits. Les durées d’examen sont respectivement de l’ordre de 1 et 2 minutes. Deux niveaux de probabilité sont proposés.
Les tests N-30-1 et 24-2-1 présentent un stimulus à niveau de contraste vu par 99 % des sujets normaux. Ils correspondent à un bon niveau de spécificité. Les tests N-30-5 et 24-2-5, moins spécifiques mais plus sensibles, présentent un stimulus vu par 95 % des sujets normaux de la même tranche d’âge.
Plusieurs tests de seuil sont proposés. Le N-30-F teste 19 zones et utilise la stratégie MOBS du FDT Perimeter de la première version (eFig. 9-18). Les tests de seuils 24-2, 30-2, 10-2 et Macula utilisent une stratégie proche de la stratégie SITA, la stratégie ZEST (zippy estimation of sequential thresholds), fondée sur un mode de calcul bayésien, avec une échelle de valeur des seuils allant de 0 à 56 dB. La stratégie ZEST est une version optimisée qui réduirait la durée du test, améliorerait les performances et diminuerait les variations intra- et inter-tests [26, 34]. La base normative se compose de sujets normaux de 18 à 85 ans : 262 pour le 30-2, 278 pour le 24-2, 265 pour le 10-2 et 261 pour le programme Macula [2]. L’appareil dispose d’un logiciel d’analyse statistique comparable à celui de l’Humphrey Field Analyzer.
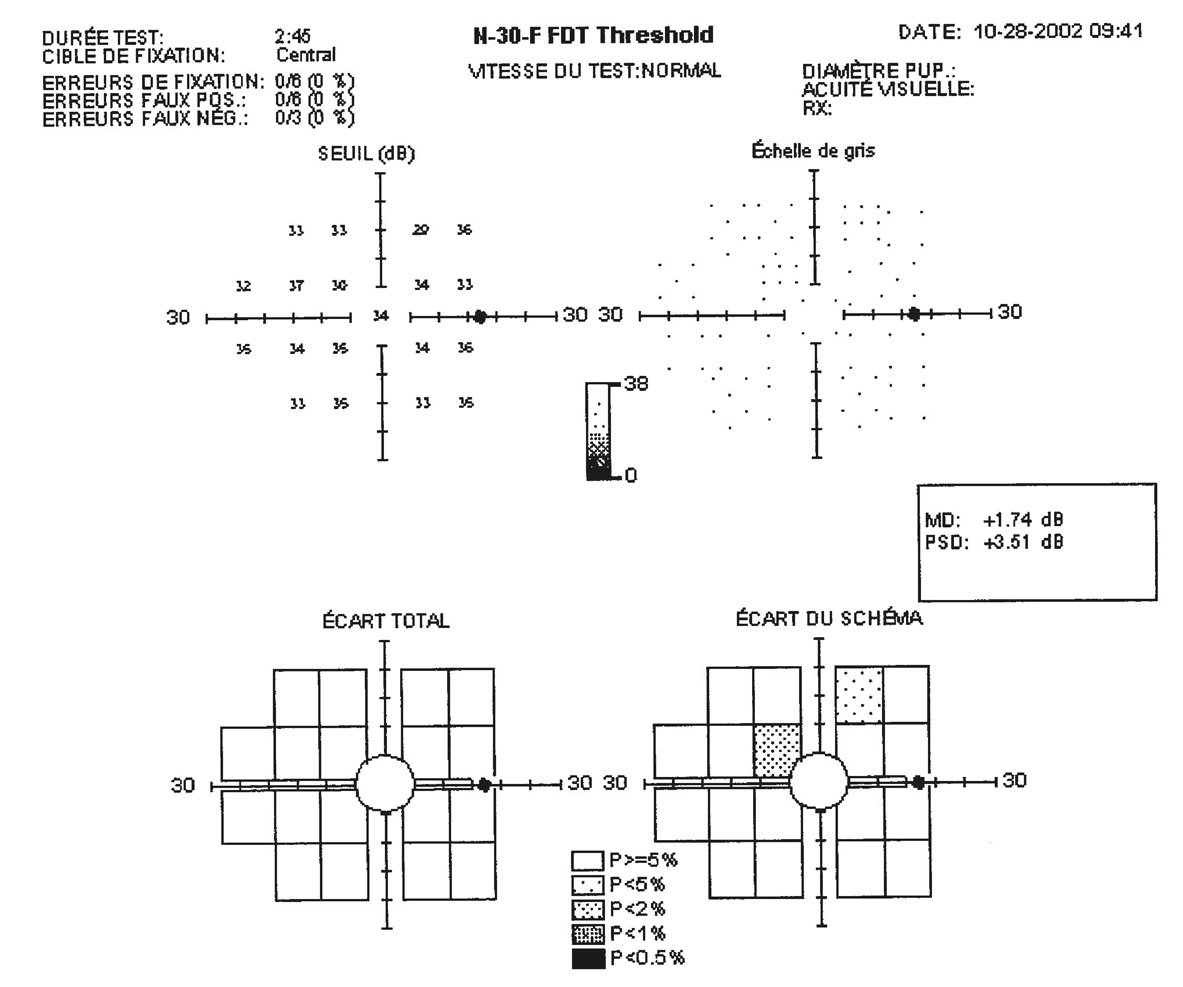
eFig. 9-18 Relevé de test de seuil N-30-F.
Le patient est installé de la même façon qu’avec le FDT Perimeter. Assis, penché en avant, il repose le haut du visage sur le repose-front du viseur de l’appareil, l’isolant de l’ambiance éclairée de la pièce (eFig. 9-19). L’appareil dispose d’un contrôle oculaire vidéo de la fixation et de l’alignement du patient, ce qui faisait défaut au FDT Perimeter. La correction optique n’est pas indispensable entre – 3 et + 3 dioptries d’amétropie pour les programmes 24-2 et 30-2, et entre – 2 et + 2 pour les tests 10-2 et Macula. Au-delà, une monture d’essai avec correction de loin est nécessaire ; les patients peuvent garder leurs verres correcteurs même s’ils sont progressifs, ainsi que leurs lentilles. Même si le Matrix™ est moins influencé par le degré d’amétropie que les autres techniques de périmétrie, la correction optique a tendance à diminuer le MD, sans modifier les autres indices [11]. La durée du test de seuil 24-2 est de l’ordre de 5 minutes, légèrement plus longue pour le 30-2. Une version plus récente, le Humphrey Matrix™ modèle 800, fournit les mêmes prestations, avec une connectique plus élaborée, et dispose d’un repose-menton facilitant l’installation du patient.
eFig. 9-19 Installation du patient et positionnement de la tête.
Le relevé des tests de seuil 24-2 et 30-2 est comparable à celui de l’Humphrey Field Analyzer II, associant : indices de fiabilité, représentations en décibels et en échelle de gris, indices globaux (MD, PSD), test GHT (glaucoma hemifield test), et cartes de déviation totale et individuelle. L’erreur de fixation est détectée selon la méthode de Heijl-Krakau : un petit stimulus de 1° de large et de contraste élevé (25 %) est périodiquement présenté sur la zone correspondant à la tache aveugle [24]. Les faux positifs et les faux négatifs sont détectés en projetant des stimulus de 0 % et 100 % respectivement. La représentation des seuils mesurés dans chaque zone testée du champ visuel est exprimée en décibels, sur une échelle allant de 0 à 56 dB, correspondant aux valeurs de contraste de 100 % à 0 % (fig. 9-105).
L’interprétation suit les mêmes règles que celles observées en PAS. Si le relevé en échelle de gris facilite la lecture, la représentation en dB est la plus fiable. De même que le Humphrey Field Analyzer, le Matrix™ propose une analyse statistique des résultats, en comparant les valeurs obtenues à celles de la base normative. Cette analyse tient compte de la discrète perte physiologique de sensibilité avec l’âge qui est de l’ordre de 0,7 dB par décennie [2].
Comme pour toute technique de périmétrie, il existe un effet d’apprentissage avec le Matrix™. Il est conseillé de ne retenir que le 3° test [12].
Les déficits présentés par les relevés du Matrix™ paraissent plus larges et plus sévères qu’en PAS, phénomène lié à la forme des zones testées, larges, carrées et contiguës, contrastant avec les points de 0,43° espacés de 6° de la PAS.
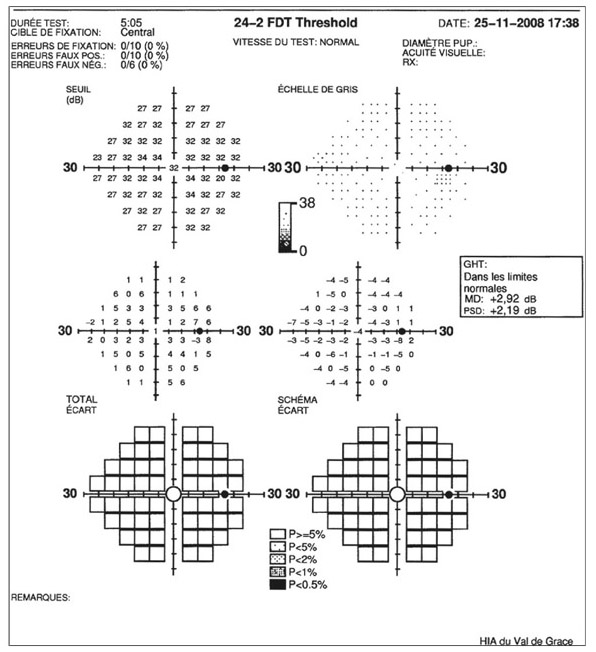
Fig. 9-105 Relevé de Matrix™ chez un sujet normal.
Simple et rapide, moins de 2 minutes pour le dépistage et moins de 5 minutes pour les tests de seuil, l’examen est généralement ressenti comme moins fatigant. À ce titre, il peut être une alternative chez des patients vite fatigables ou répondant mal à la PAS.
De nombreuses études ont montré qu’il présente des performances comparables à la PAS pour distinguer sujets sains et glaucomateux et pour catégoriser les déficits selon les grades de gravité [3, 7, 22, 28, 32].
Le principal intérêt de la technologie à doublage de fréquence réside dans sa capacité à détecter des déficits très précoces, parfois même avant la PAS [6, 20, 22, 27].
La périmétrie par doublage de fréquence partage avec la périmétrie bleu-jaune la capacité de détecter des déficits précoces [4, 13, 21, 31]. En revanche, à la différence de la PBJ, le Matrix™ est peu influencé par le degré de transparence des milieux intra-oculaires, car la sensibilité au contraste temporel est en effet peu affectée par l’opacité des milieux, ce qui lui offre un avantage en cas de phakosclérose ou de cataracte. De même, le Matrix™ n’est influencé ni par les implants intra-oculaires apodisés, ni par les implants jaunes [5, 19].
Théoriquement, le FDT-Matrix™ offre les mêmes possibilités de suivi que la PAS, mais il souffre de l’absence de logiciel d’analyse statistique de suivi de la progression. Présentant les mêmes performances que la PAS pour catégoriser les déficits et apprécier la sévérité du glaucome, il se révèle cependant moins précis dans les glaucomes avancés. La forme des zones testées, larges et confluentes, explique que les déficits apparaissent d’emblée plus étendus et plus profonds que ceux obtenus en PAS. Cette tendance s’accroît avec les stades de gravité et nuit à la lisibilité ainsi qu’à la précision de l’interprétation dans les glaucomes avancés.
Retenir
-
La périmétrie FDT permet de détecter des déficits glaucomateux très précoces, parfois avant la périmétrie automatisée standard.
-
Les tests de dépistage sont simples et rapides, et conviennent parfaitement pour des campagnes de dépistage.
-
Le Matrix™ présente des performances comparables à la PAS pour l’identification et la catégorisation des déficits précoces et modérés.
-
Il ne dispose pas de programme de suivi de la progression.
[1] Anderson AJ, Johnson CA. Frequency-doubling technology perimetry. Ophthalmol Clin North Am. 2003 ; 16 : 213-25.
[2] Anderson JA, Johnson CA, Fingeret M, et al. Characteristics of the normative database for the Humphrey Matrix perimeter. Invest Ophthalmol Vis Sci. 2005 ; 46 : 1540-8.
[3] Artes PH, Hutchison DM, Nicolela MT, et al. Threshold and variability properties of Matrix Frequency-Doubling Technology and Standard Automated Perimetry in glaucoma. Invest Ophthalmol Vis Sci. 2005 ; 46 : 2451-7.
[4] Bluwol E, Blumen-Ohana E, Nordmann JP. Apport du GDx-VCC chez les patients hypertones oculaires : complémentarité avec la périmétrie bleu-jaune ou le FDT Matrix ? J Fr Ophthalmol. 2009 ; 32 : 326-34.
[5] Bojikian KD, Vita JB, Dal Forno CP, et al. Does the apodized diffractive intra-ocular lens Acrysof ReSTOR Natural interfere with FDT Matrix perimetry results ? Arq Bras Oftalmol. 2009 ; 72 : 755-9.
[6] Brusini P, Salvetat ML, Zeppieri M, et al. Frequency doubling technology perimetry with the Humphrey Matrix 30-2 test. J Glaucoma. 2006 ; 15 : 77-83
[7] Burgansky-Eliash Z, Wollstein G, Patel A, et al. Glaucoma detection with matrix and standard achromatic perimetry. Br J Ophthalmol. 2007 ; 91 : 933-8.
[8] Carl Zeiss Meditec Inc. Humphrey® Matrix™ Instrument d’examen de champ visuel. Guide d’utilisateur. Référence 112738-1FR Rév. A ; www.meditec.zeiss.com
[9] Cello KE, Nelson-Quigg JM, Johnson CA. Frequency doubling technology perimetry for detection of glaucomatous visual field loss. Am J Ophthalmol. 2000 ; 129 : 314-22.
[10] Chauhan BC, Johnson CA. Test-retest variability of frequency-doubling perimetry and conventional perimetry in glaucoma patients and normal subjects. Invest Ophthalmol Vis Sci. 1999 ; 40 : 648-56.
[11] Contestabile MT, Perdicchi A, Amodeo S, et al. Effect of refractive correction on the accuracy of frequency-doubling technology Matrix. J Glaucoma. 2013 ; 22 : 413-5.
[12] De Tarso Perre-Filho P, Gomes PR, Pierre ET, Pierre LM. Learning effect of Humphrey Matrix frequency doubling technology perimetry in patients with open-angle glaucoma. Eur J Ophthalmol. 2010 ; 20 : 538-41
[13] Ferreras A, Polo V, Larrosa JM, et al. Can frequency-doubling technology and short-wavelength automated perimetries detect visual field defects before standard automated perimetry in patients with preperimetric glaucoma ? J Glaucoma. 2007 ; 16 : 372-83.
[14] Heijl A, Krakau CE. A note of fixation during perimetry. Acta Ophthalmol. 1977 ; 55 : 854-61.
[15] Johnson CA, Cioffi GA, Van Buskirk EM. Evaluation of two screening tests for frequency doubling technology perimetry. In : Wall M, Wild JM (eds). Perimetry Update 1998/1999. The Hague, The Netherlands, Kugler Publications, 1999 : 103-9.
[16] Johnson CA, Samuels SJ. Screening for glaucomatous visual field loss with frequency-doubling perimetry. Invest Ophthalmol Vis Sci.1997 ; 38 : 413-25.
[17] Kelly DH. Frequency doubling in visual responses. J Opt Soc Am. 1966 ; 56 : 1628-33.
[18] Kelly DH. Nonlinear visual responses to flickering sinusoidal gratings. J Opt Soc Am. 1981 ; 71 : 1051-5.
[19] Kim JY, Choi JA, Na FS, Joo CK. The effect of yellow tinted intraocular lenses on the result of frequency doubling perimetry after cataract surgery. Korean J Ophthalmol. 2011 ; 25 : 29-32.
[20] Kim TW, Zangwill LM, Bowd C, et al. Retinal nerve fiber layer damage as assessed by optical coherence tomography in eyes with a visual field defect detected by frequency doubling technology perimetry but not by standard automated perimetry. Ophthalmology. 2007 ; 114 : 1053-7.
[21] Leeprechanon N, Giaconi JA, Manassakorn A, et al. Frequency doubling perimetry and short-wavelength automated perimetry to detect early glaucoma. Ophthalmology. 2007 ; 114 : 931-7.
[22] Leeprechanon N, Giangiacomo A, Fontana H, et al. Frequency-doubling perimetry : comparison with standard automated perimetry to detect glaucoma. Am J Ophthalmol. 2007 ; 143 : 263-71.
[23] Maddess T, Goldberg I, Dobinson J, et al. Testing for glaucoma with the spatial frequency doubling illusion. Vision Res. 1999 ; 39 : 4258-73.
[24] Maddess T, Henry GH. Performance of nonlinear visual units in ocular hypertension and glaucoma. Clin Vision Sci. 1992 ; 7 : 371-83.
[25] Maddess T, Severt WL. Testing for glaucoma with the frequency-doubling illusion in the whole, macular and eccentric visual fields. Aust NZ J Ophthalmol. 1999 ; 27 : 194-6.
[26] McKendrick AM, Turpin A. Advantages of terminating Zippy Estimation by Sequential Testing (ZEST) with dynamic criteria for white-on-white perimetry. Optom Vis Sci. 2005 ; 82 : 981-7.
[27] Medeiros FA, Sample PA, Weinreb RN. Frequency doubling technology perimetry abnormalities as predictors of glaucomatous visual field loss. Am J Ophthalmol. 2004 ; 137 : 863-71.
[28] Nam YP, Park SB, Kang SY, et al. Glaucoma diagnostic performance of Humphrey Matrix and standard automated perimetry. Jpn J Ophthalmol. 2009 ; 53 : 482-5.
[29] Paczka JA, Friedman DS, Quigley HA, et al. Diagnostic capabilities of frequency-doubling technology, scanning laser polarimetry, and nerve fiber layer photographs to distinguish glaucomatous damage. Am J Ophthalmol. 2001 ; 131 : 188-97.
[30] Racette L, Medeiros FA, Zangwill LM, et al. Diagnostic accuracy of the Matrix 24-2 and original N-30 frequency-doubling technology tests compared with standard automated perimetry. Invest Ophthalmol Vis Sci. 2008 ; 49 : 954-60.
[31] Shah NN, Bowd C, Medeiros FA, et al. Combining structural and functional testing for detection of glaucoma. Ophthalmology. 2006 ; 113 : 1593-602.
[32] Spry PG, Hussin HM, Sparrow JM. Clinical evaluation of frequency doubling technology perimetry using the Humphrey Matrix 24-2 threshold strategy. Br J Ophthalmol 2005 ; 89 : 1031-5.
[33] Spry PG, Johnson CA, McKendrick AM, Turpin A. Variability components of standard automated perimetry and frequency-doubling technology perimetry. Invest Ophthalmol Vis Sci. 2001 ; 42 : 1404-10.
[34] Turpin A, McKendrick AM, Johnson CA, Vingrys AJ. Properties of perimetric threshold estimates from full threshold, ZEST, and SITA-like strategies, as determined by computer simulation. Invest Ophthalmol Vis Sci. 2003 ; 44 : 4787-95.
[35] White AJ, Sun H, Swanson WH, Lee BB. An examination of physiological mechanisms underlying the frequency-doubling illusion. Invest Ophthalmol Vis Sci. 2002 ; 43 : 3590-9.
J.-P. Nordmann
La périmétrie automatisée classique est indispensable dans l’évaluation du retentissement fonctionnel du glaucome. Cette périmétrie ne teste pas une lignée spécifique de cellules ganglionnaires, alors que certaines d’entre elles sont atteintes de façon plus précoce que d’autres, comme la voie magnocellulaire.
Certains faits s’imposent en conséquence. L’évolution du déficit en périmétrie automatisée n’est pas linéairement corrélée à l’importance du glaucome. Dans un premier temps, le champ visuel en périmétrie standard reste normal, puis l’aggravation est plutôt rapide, avant de se ralentir à nouveau lorsqu’il n’existe plus qu’un îlot de vision temporal. Il est donc tentant de penser que l’altération structurelle précède l’atteinte fonctionnelle dans le glaucome. Pourtant, cela ne repose sur aucun fondement logique. Dans l’appréciation d’autres fonctions cognitives, comme par exemple la mémoire, l’atteinte fonctionnelle précède toute détérioration de la structure.
Les constatations faites dans le glaucome sont simplement la conséquence de l’utilisation de tests trop simples (spot homogène blanc sur fond blanc) et inadaptés à la complexité du système visuel. Une première approche différenciée est faite avec la périmétrie à courte longueur d’onde (bleu-jaune) ou grâce à l’utilisation de mires en papillotement (FDT-Matrix™). D’autres techniques existent par ailleurs et semblent pleines de promesses.
L’Edge Perimetry (Heidelberg) combine les fonctions de la périmétrie standard à des tests en flicker permettant de donner une illusion de bord. Les spots, présentés sur un écran vidéo, réalisent de larges plages peu contrastées, censées ne stimuler que les cellules ganglionnaires de grande taille. Les résultats dans le glaucome chronique sont variables, certaines études montrant une atteinte précoce de la fonction visuelle [6]. Le test est parfois difficile à réaliser chez les patients habitués à détecter de petits spots faiblement lumineux et non pas de larges zones à faible contraste. L’examen a une durée à peu près identique à celle de la périmétrie classique.
La périmétrie « high pass » utilise des anneaux isoluminants par rapport au fond. Ils consistent en des cercles noirs bordés de blanc dont la luminosité totale est identique au gris du fond. La taille des anneaux est d’autant plus petite que la perception est bonne dans la région du champ considéré, mais le contraste de l’anneau ne varie pas. Cette technique a l’avantage de la simplicité, car le patient perçoit nettement le spot lorsqu’il le peut, et pas du tout dans le cas contraire. Il n’y a donc pas de zone d’incertitude propre aux autres méthodes de périmétrie. Le type de spot utilisé nécessite l’usage d’un écran vidéo. Les performances en périmétrie « high pass » sont étroitement corrélées à la quantité de fibres nerveuses rétiniennes résiduelles. Il existe une forte corrélation entre les données obtenues en périmétrie « high pass » et en FDT [4].
Compte tenu des mouvements oculaires naturels, il n’est jamais tout à fait certain que la zone de champ visuel testée corresponde bien à la région équivalente de la rétine, et ce d’autant plus que la qualité de la vision est mauvaise. Le principe de la micro-périmétrie est de surveiller en temps réel la bonne projection du spot lumineux sur la région rétinienne correspondante. La surveillance de la rétine se fait par exemple par SLO et le spot lumineux est envoyé soit directement sur l’œil, soit projeté sur un écran. Ainsi il est possible de s’affranchir totalement des pertes de fixation. Cette technique, un peu lourde, est surtout utile pour évaluer les microscotomes maculaires, mais ne semble pas d’utilité quotidienne dans le glaucome [5]. Dans le glaucome évolué où les pertes de fixation sont importantes mais ne sont pas correctement évaluées en périmétrie classique, la micro-périmétrie pourrait être une excellente technique de surveillance qui doit encore être confirmée [1].
La taille des spots utilisés en périmétrie classique aussi bien que celle des méthodes présentées ci-dessus est beaucoup plus large que la taille des champs récepteurs des cellules ganglionnaires. Il est donc impossible qu’un spot se projette sur une zone restreinte du champ visuel et, en conséquence, une altération minime de la vision ne peut pas être détectée. La périmétrie multispots utilise des mires qui mesurent environ 1/100e des spots usuels et le permet donc. Pour éviter un temps d’examen trop long et pour des raisons physiopathologiques, deux spots séparés de 4° d’angle visuel sont présentés sur un écran d’ordinateur. Le patient doit déterminer s’il est capable d’en discerner aucun, un ou deux. L’examen est donc un peu complexe et inhabituel, mais ne nécessite qu’un ordinateur de bureau. Il semble en certaines mains donner des résultats intéressants, également à confirmer [3].
La conjonction des connaissances neurophysiologiques concernant les modifications des cellules ganglionnaires dans le glaucome et les possibilités qu’offrent les nouvelles technologies permettent d’espérer trouver un test « ultime » qui alliera à la fois simplicité d’usage et détection des premières anomalies de la fonction visuelle. Cependant, ce n’est pas encore le cas aujourd’hui. Les différentes techniques disponibles ont été largement comparées entre elles. Dans l’ensemble, elles sont plutôt équivalentes et il n’est pas possible d’en privilégier une plutôt qu’une autre [2]. Il est parfois surprenant de constater que certaines régions apparaissent anormales avec un test et sont dans les limites physiologiques avec un autre. Il ne s’agit peut-être pas de problèmes techniques, mais plutôt d’atteintes variables d’un patient à un autre. En effet, si certains travaux ont mis en évidence une atteinte précoce de la voie magnocellulaire, d’autres n’ont pas retrouvé ce résultat chez tous les patients. Il se pourrait donc qu’une évolution différente puisse exister chez les patients, peut-être en fonction de la pression intra-oculaire ou de la fragilité de la vascularisation de la tête du nerf optique. Il en résulterait ainsi que les tests de détection précoce ne seraient pas les mêmes pour tous, ce qui ajoute à la complexité de ce problème [8].
De plus, si de nombreux travaux se sont attachés à distinguer glaucome pré-périmétrique et hypertension intra-oculaire isolée, peu d’études ont réalisé un suivi longitudinal avec ces nouvelles technologies se renouvelant sans cesse [7].
La périmétrie standard reste donc l’examen clé dans le glaucome. Certaines améliorations plus ou moins récentes lui ont même fait « reprendre pied » dans la détection du glaucome débutant, comme la mise au point de programmes rapides de type SITA réduisant la variabilité des résultats normaux et permettant donc un meilleur rapport sensibilité/spécificité.
Néanmoins, l’intérêt en pratique du FDT-Matrix™ se dégage de l’ensemble des travaux sur les méthodes d’exploration précoce de la fonction visuelle. Sa simplicité d’usage et sa spécificité en font à l’heure actuelle le meilleur test de détection précoce de la fonction visuelle dans le glaucome.
Enfin, il est probable que les prochains progrès dans la détection et le suivi du glaucome ne viendront pas de l’analyse de la structure ou de celle de la fonction, mais plutôt d’une étude conjointe des deux approches à travers des statistiques bayésiennes. Jusqu’à présent, cette attitude n’est qu’intuitive : sachant que le champ visuel est à la limite inférieure de la normale et que l’OCT l’est aussi, est-on devant un glaucome débutant ou pas ? Ces statistiques bayésiennes combinant ces deux données pourront a priori nous apporter une réponse plus rigoureuse sur ce point.
[1] Acton JH, Smith RT, Greenberg JP, Greenstein VC. Comparison between MP-1 and Humphrey visual field defects in glaucoma and retinitis pigmentosa. Optom Vis Sci. 2012 ; 89 : 1050-8.
[2] Artes PH, Chauhan BC. Signal/noise analysis to compare tests for measuring visual field loss and its progression. Invest Ophthalmol Vis Sci. 2009 ; 50 : 4700-8
[3] Brusini P, Salvetat ML, Parisi L, Zeppieri M. Probing glaucoma visual damage by rarebit perimetry. Br J Ophthalmol. 2005 ; 89 : 180-4.
[4] Kalaboukhova L, Lindblom B. Frequency doubling technology and high-pass resolution perimetry in glaucoma and ocular hypertension. Acta Ophthalmol Scand. 2003 ; 81 : 247-52.
[5] Lima VC, Prata TS, De Moraes CG, et al. A comparison between microperimetry and standard achromatic perimetry of the central visual field in eyes with glaucomatous paracentral visual-field defects. Br J Ophthalmol. 2010 ; 94 : 64-7.
[6] Mulak M, Szumny D, Sieja-Bujewska A, Kubrak M. Heidelberg edge perimeter employment in glaucoma diagnosis – preliminary report. Adv Clin Exp Med. 2012 ; 21 : 665-70.
[7] Nomoto H, Matsumoto C, Takada S, et al. Detectability of glaucomatous changes using SAP, FDT, flicker perimetry, and OCT. J Glaucoma. 2009 ; 18 : 165-71.
[8] Sample PA, Medeiros FA, Racette L, et al. Identifying glaucomatous vision loss with visual-function-specific perimetry in the diagnostic innovations in glaucoma study. Invest Ophthalmol Vis Sci. 2006 ; 47 : 3381-9.
X. Zanlonghi
Les examens complémentaires permettant d’étudier l’étage des fibres nerveuses rétiniennes issues des cellules ganglionnaires et celui du nerf optique sont nombreux, certains anciens comme la vision des couleurs, et d’autres plus récents, comme le potentiel évoqué multifocal ou l’étude des saccades oculaires.
Le système visuel a la capacité de discriminer des stimuli de luminances différentes présentés simultanément. Cette discrimination fait appel à trois mécanismes psychophysiques que sont les effets de contrastes, le pouvoir séparateur et l’analyse de la fréquence spatiale. L’étude de la perception du contraste de luminance permet une appréciation de la capacité visuelle globale et de la fonction visuelle neurosensorielle. On distingue deux types de sensibilité au contraste : le contraste spatial de luminance et le contraste temporel.
Le contraste de luminance est la différence entre le maximum de luminance des bandes claires (Lmax des bandes claires) et le minimum de luminance des bandes sombres (Lmin des bandes sombres), rapportée à la somme de ces deux luminances. Le contraste de modulation (M) ou contraste de Michelson est défini par :
M = (Lmax – Lmin)/(Lmax + Lmin)
Lmoy = Lmax + Lmin
L’inverse du contraste (C) est la sensibilité (S) : S = 1/C.
Ce contraste est souvent exprimé en pourcentage, 98 % étant un contraste très élevé, 3 % étant un contraste très faible.
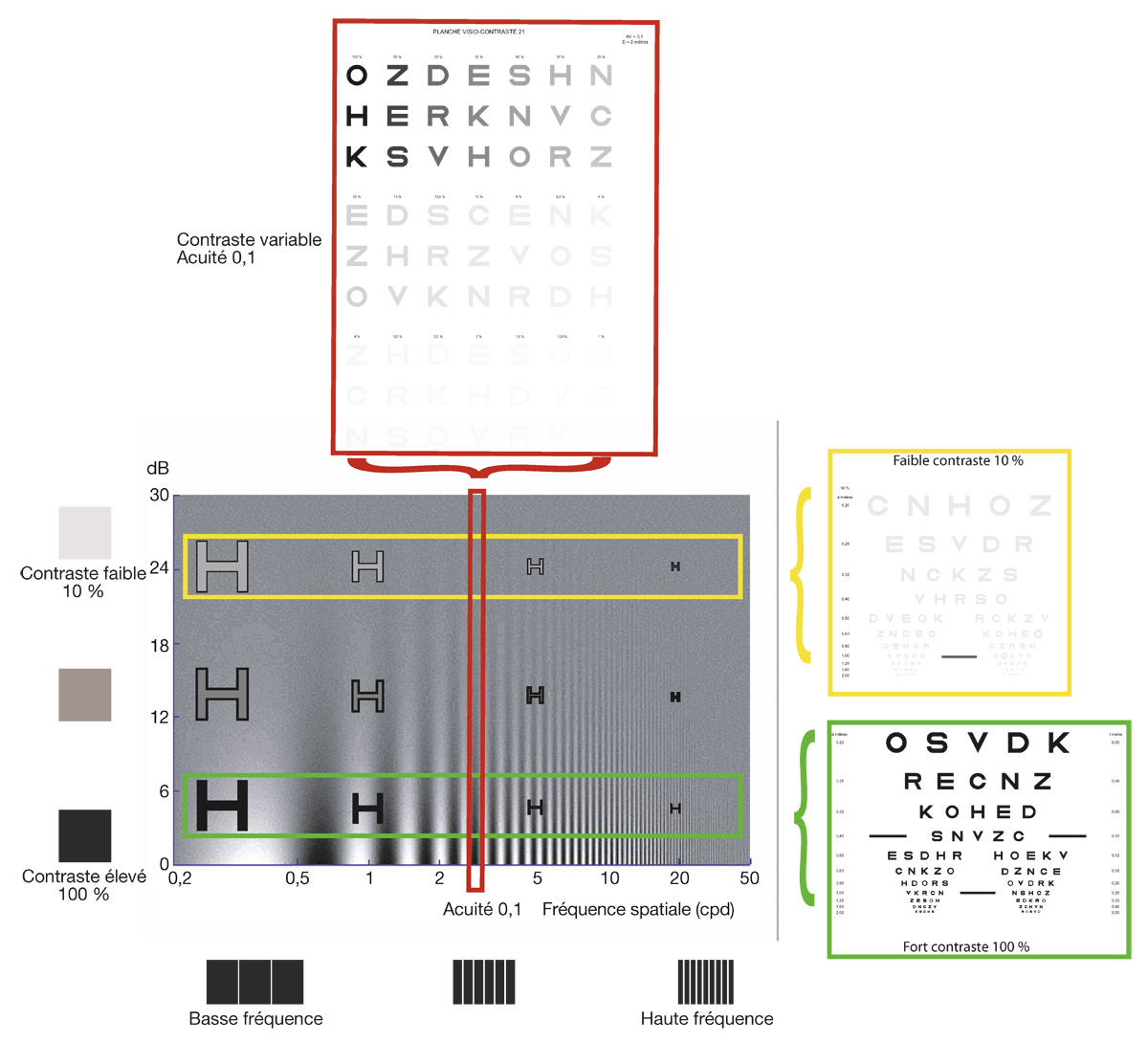
Fig. 9-106 Le test de référence est le réseau sinusoïdal de luminance (au centre). Simplification de l’examen en ne mesurant qu’une seule fréquence spatiale (carré rouge). Simplification de l’examen en ne présentant que deux niveaux de contraste 100 % (carré vert) et 10 % (carré jaune).
Si la luminosité fluctue de façon sinusoïdale à une fréquence donnée, la perception de la fluctuation sera variable selon le contraste. Il apparaît une fréquence maximale (fréquence critique de fusion) pour chaque éclairement pour laquelle le sujet ne perçoit plus de fluctuation, même pour un contraste de 1. En pratique, la stimulation se fait par un écran haute définition sur lequel apparaissent des barres verticales en alternance, noires et blanches, de fréquence spatiale et de contraste variable.
Ces deux types de contrastes explorent en théorie les canaux M et P :
-
les canaux P (contraste spatial) sont caractérisés par leur faible sensibilité au contraste et leur haute résolution spatiale ; ils jouent donc un rôle dans l’acuité visuelle et la discrimination des formes et des couleurs ;
-
les canaux M (contraste temporel) sont caractérisés par leur absence de sensibilité à la couleur, leur haute sensibilité au contraste, leur basse résolution spatiale et leur rapide résolution temporelle.
On présente au patient des réseaux, des barres alternativement claires et sombres définies par leurs fréquences spatiales [en cycle/degré ou nombre de paires (blanche-noire) de raies par degré d’angle visuel] et leur contraste (voir fig. 9-106).
Il est possible de simplifier l’examen :
-
soit en ne mesurant qu’une seule fréquence spatiale comme le test type Pelli-Robson [9] ou Visio-contraste (Novartis), et est retenu le test de contraste le plus faible encore visible par le patient ;
-
soit en faisant varier l’acuité et ne présentant que deux voire trois niveaux de contraste, généralement 100 %, 10 % et 2,5 %, et est alors retenue l’acuité visuelle par niveaux de contraste.
Elles sont le plus souvent liées au patient (coopération, attention, âge), plus rarement à la technique.
Les mêmes limites que celles qui font varier les mesures d’acuité visuelle sont retrouvées, et il est à noter qu’au-delà de 60 ans, le pic de sensibilité est décalé vers les basses fréquences, passant de 4 à 2 cycles/degré. Il est souhaitable d’utiliser des tests normalisés en fonction de l’âge (eFig. 9-20).
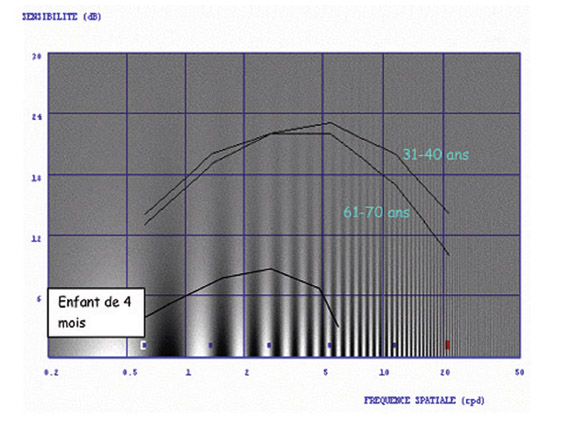
eFig. 9-20 Courbe de sensibilité au contraste pour trois âges différents.
Les paramètres étudiés sont (fig. 9-107) :
-
la fréquence de coupure haute, qui est donnée par l’intersection avec l’axe de la fréquence spatiale à un contraste théorique de 100 %. On obtient alors une valeur d’acuité visuelle en « réseaux », entre 3 et 5 cycles/degré à l’âge de un mois et entre 30 et 40 cycles/degré chez l’adulte, que l’on peut comparer avec une acuité visuelle morphoscopique ;
-
la fréquence de coupure basse ;
-
le pic de sensibilité ;
-
les valeurs de seuil par fréquence spatiale.
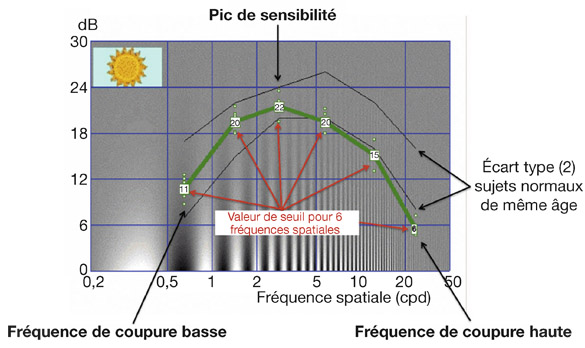
Fig. 9-107 Résultat de sensibilité au contraste spatial dans un glaucome modéré avec une acuité de 10/10. La fréquence de coupure haute est altérée, le pic de sensibilité est décalé vers les basses fréquences spatiales qui, elles, sont normales.
La lumière visible est un rayonnement électromagnétique susceptible de produire directement une sensation lumineuse. Ce rayonnement « visible » correspond à un domaine spectral compris entre 400 et 700 nm. Cette lumière est un mélange de rayonnement énergétique de toutes les longueurs d’onde visibles. En filtrant une part très étroite de cette lumière visible, on obtient un rayonnement monochromatique identifié par une longueur d’onde. Cette dernière est l’équivalent psychophysique de la teinte ou tonalité chromatique ; elle détermine une sensation colorée dont l’élaboration dépend de photorécepteurs particuliers. Ce sont les cônes rétiniens répartis en trois groupes selon le type de pigment que comporte chacun d’eux. La vision des couleurs est de ce fait trichromatique. Le trichromatisme qui la caractérise est dit normal si les trois photopigments d’un sujet sont normaux. La rétine comporte 4,5 millions de cônes dont les articles externes contiennent les photopigments. Les photopigments des trois types de cônes sont codés par des gènes différents.
Par convention, en conformité avec les trois couleurs primaires (rouge, vert, bleu), on désigne trois types de cônes suivant les trois pics d’absorption maximale de leurs pigments (tableau 9-4).
On sépare classiquement les dyschromatopsies congénitales par daltonisme du vaste groupe hétérogène des dyschromatopsies acquises.
Tableau 9-4 Les trois types de photorécepteurs permettant la perception colorée.
Nous n’aborderons que les tests utilisés en pratique courante et ceux cités dans la bibliographie.
Le plateau technique doit contenir un album d’Ishihara, destiné à éliminer une dyschromatopsie congénitale, et des tests pigmentaires plus spécifiques des dyschromatopsies acquises du glaucome (15 Hue saturé et désaturé). Un album HRR (American Optical Hardy-Rand-Rittler Color Vision Plates) est très utile car il a l’avantage de tester les dyschromatopsies dans les axes rouge-vert, mais également dans les axes bleu-jaune.
Le HRR [8] est fondé, tout comme l’Ishihara, sur les directions des axes de confusion, mais les couleurs ont été sélectionnées de telle façon qu’elles permettent de reconnaître non seulement les trois types de déficience – protan, deutan, tritan –, mais aussi leur gravité. Ce test permet également de trouver une éventuelle concomitance entre plusieurs troubles (rouge-vert associé à bleu-jaune) (eFig. 9-21).
Le test de classement type 15 Hue saturé et désaturé a pour but d’évaluer la capacité des sujets à classer des pions de couleurs différentes selon une progression régulière de la saturation des teintes.
Ce test se décline en deux tests différents : le saturé et le désaturé [7]. Il se compose de 16 pions de couleurs différentes contenus dans un plumier. Seul le 1er jeton est fixe, les autres étant d’abord présentés au patient dans le bon ordre, puis mélangés. Le pion fixe va servir de référence pour que le patient puisse trouver celui qui lui ressemble le plus. Ce deuxième pion va alors jouer le rôle de référence et ainsi de suite (eFig. 9-22). Une fois que le patient considère avoir classé les pions dans l’ordre, l’examinateur note les numéros inscrits au dos des jetons et dessine le schéma (eFig. 9-23).
Il existe d’autres tests de classement : type 100 Hue [13] et 28 Hue [12], et le New Color Test [8] (tableau 9-5).
Les anomaloscopes sont des colorimètres cliniques permettant de réaliser une égalisation colorée. Ils sont très précis dans les dyschromatopsies acquises, car ils permettent de séparer les trichromates anormaux, surtout extrêmes, des vrais dichromates [10].

eFig. 9-21 Une des planches de l’album HRR.

eFig. 9-22 Les pions sont sortis et mélangés de façon aléatoire. Le patient doit les reclasser en partant du premier pion qui est fixe (100 Hue).
eFig. 9-23 Ce schéma en cercle ouvert permet la visualisation directe de l’axe de confusion. R correspond au point fixe. (Source : http://www.torok.info/)
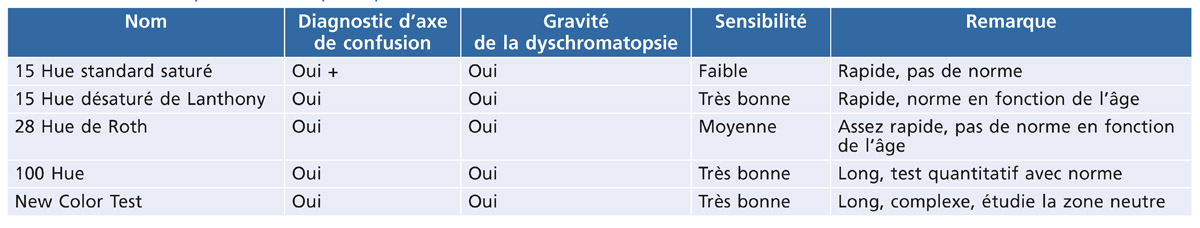
Tableau 9-5 Comparaison des principaux tests de classement.
Le test d’adaptation à l’obscurité est utilisé depuis les années 1950 [6]. Il consiste à mesurer le sens lumineux brut. L’examen très sensible reste peu spécifique et très long, avec une durée minimale de l’ordre de 30 minutes.
L’électrorétinogramme (ERG) est un enregistrement de l’activité électrique de la rétine en réponse à une stimulation lumineuse. L’électrorétinogramme global permet d’enregistrer séparément les réponses issues des cônes et des bâtonnets. L’amplitude de la réponse obtenue est proportionnelle au nombre de cellules rétiniennes fonctionnelles. Les résultats permettent de retrouver des atteintes spécifiques des cônes, des bâtonnets et des cellules bipolaires.
Il est surtout utile pour le diagnostic différentiel de glaucome, en cas d’atteinte atypique du champ visuel ou d’imagerie du fond d’œil montrant à la fois une atteinte de la papille et une atteinte rétinienne locale ou diffuse.
L’électrorétinogramme multifocal (MERG) fournit une topographie fonctionnelle de la rétine grâce à un enregistrement simultané d’ERG issus de plusieurs zones rétiniennes stimulées de façon pseudo-aléatoire permettant par un traitement mathématique de calculer la réponse issue de chacune des zones unitaires stimulées [11].
En pratique, le stimulus est constitué par un agencement de surfaces rétiniennes hexagonales équivalentes fonctionnellement. Le signal est enregistré grâce à trois électrodes, dont l’électrode active est une lentille de contact sclérocornéenne.
Les résultats se présentent comme un relevé de champ visuel automatisé (fig. 9-108). Une carte des réponses locales, avec la réponse focale de chaque zone stimulée, se présente sous la forme de courbes d’ERG locaux.
Fig. 9-108 Électrorétinogramme multifocal. a. Chaque hexagone testé est représenté par un petit ERG focal, ici superposé au fond d’œil. b. Les résultats se présentent comme un relevé de champ visuel automatisé : une carte 2D représente sous forme de niveaux de couleur et de chiffres (en µv) l’amplitude d’une onde donnée, ici l’onde P1. c. Chaque hexagone testé est représenté par un petit ERG focal. d. Une carte 3D représente les mêmes résultats qu’en b, mais en relief.
L’électrorétinogramme pattern ou P-ERG étudie le fonctionnement de l’aire maculaire. Il s’agit d’un enregistrement d’un électrorétinogramme local évoqué à l’aide d’un damier dont les cases noires et blanches alternent.
Le P-ERG est une réponse globale qui comporte, d’une part, la réponse conjointe des deux premiers étages de la neurorétine et, d’autre part, celle des corps des cellules ganglionnaires qui sont nombreuses et denses dans l’aire maculaire [1, 11].
L’enregistrement du P-ERG est réalisé sans dilation pupillaire, le patient devant porter la meilleure correction optique possible. L’électrode active doit être au contact de la cornée et laisser l’axe optique le plus libre et clair possible afin d’assurer la meilleure qualité optique de la projection de la stimulation structurée sur la macula.
La réponse normale est constituée d’une première petite déflection négative culminant à 35 ms, l’onde N35, qui est suivie d’un large déflection positive culminant entre 45 et 60 ms, l’onde P50, suivie d’une déflection négative culminant à 90-100 ms, l’onde N95. La mesure des amplitudes pour la P50 s’effectue du creux de la N35 au pic de la P50.
Les données expérimentales suggèrent que la N95 est un composant lié aux variations de contraste et est générée au niveau des cellules ganglionnaires [3]. Pour ce qui concerne l’onde P50, environ 70 % de son origine seraient également au niveau des cellules ganglionnaires avec une partie dont l’origine serait plus distale à partir des photorécepteurs, essentiellement issue des cônes.
Les potentiels évoqués visuels (PEV) expriment une variation de potentiel électrique consécutive à une stimulation visuelle : c’est la réponse du cortex visuel à une stimulation rétinienne. Ils reflètent principalement le fonctionnement des fibres nerveuses rétiniennes d’origine maculaire, de la rétine jusqu’au cortex visuel [2].
Les PEV les plus utilisés sont ceux par pattern, qui varient selon la taille ou la fréquence spatiale du stimulus, sa fréquence temporelle et son mode d’apparition. Classiquement sont utilisés des damiers de 60’ et 15’ (norme ISCEV [5]). Il faut au minimum trois électrodes (montage monopolaire). Leur positionnement sur le scalp est fondé sur le système 10-20, utilisé en électroencéphalographie avec une seule électrode active placée en regard de la scissure calcarine.
Le PEV est constitué d’une série de déflexions successivement négatives et positives : les ondes du PEV par damier sont nommées comme N (négative) et P (positive) suivies de la valeur de la latence moyenne du pic (fig. 9-109).
Les PEV par renversement de damier comprennent trois ondes principales : N75 (70-90 ms), P100 (100-120 ms) et N135 (130-150 ms). Pour les mêmes conditions de stimulation, l’onde P100, qui a son origine dans le cortex occipital, est assez reproductible chez un même sujet au cours du temps et également d’un sujet à l’autre : c’est ainsi celle qui est étudiée en clinique.
Fig. 9-109 PEV transitoires damiers avec fond d’œil ; deux tailles de damiers et tracés.
Le principe du PEV multifocal (MVEP) est d’obtenir des réponses électriques corticales liées à des stimulations locales par pattern de différentes parties de la rétine centrale.
Le principe du PEV multifréquence est de produire plusieurs stimulations simultanées du système visuel à des fréquences temporelles différentes. L’analyse fréquentielle des PEV à l’aide d’une transformée de Fourier rapide permet alors de séparer les réponses à chaque stimulation.
Pour le MVEP, l’installation nécessite un amplificateur quatre voies avec quatre électrodes actives. De façon pseudo-aléatoire, 31 zones avec des patterns sont présentées, permettant un champ total stimulé de 45° [4].
Pour le PEV multifréquence, deux zones du champ visuel sont stimulées simultanément à des fréquences différentes. Ainsi, la région maculaire est stimulée par un damier alternant à 10 Hz, alors que le champ visuel droit est stimulé avec un pattern de plus grandes dimensions alternant à 15 Hz.
Le MVEP se présente comme un « champ visuel objectif » avec une amplitude fonction de l’excentricité. Le temps d’examen est de 10 minutes par œil.
Pour le PEV multifréquence, on obtient deux amplitudes, l’une correspondant au champ maculaire, l’autre au champ visuel périphérique. Le temps d’examen est d’environ 90 secondes par œil (eFig. 9-24).
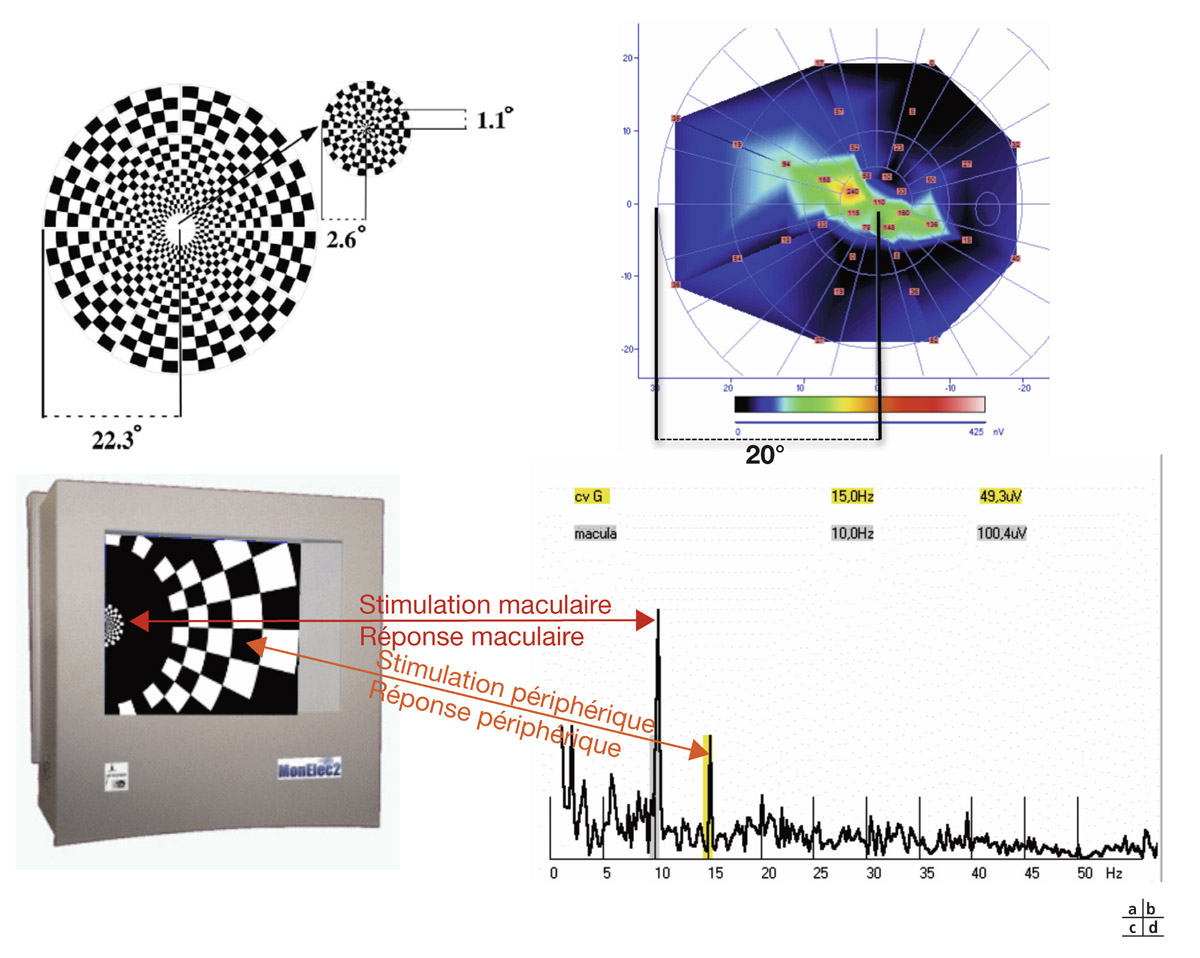
eFig. 9-24 a. Stimulation pour le MVEP. b. Résultat d’un MVEP se présentant comme un tracé de champ visuel : ici un œil droit. c. Stimulation pour le PEV multifréquence (field test). La région maculaire est stimulée par renversement d’un pattern en forme de damier à la fréquence de 10 Hz tandis que le champ visuel périphérique est stimulé par un damier de taille plus importante alternant à la fréquence de 15 Hz. d. Résultat d’un PEV multifréquence (field test). Amplitude de la réponse PEV en fonction de la fréquence : mise en évidence d’un pic à 10 Hz correspondant à la réponse de la zone de stimulation maculaire et d’un pic à 15 Hz correspondant à la réponse de la zone périphérique.
Le diamètre pupillaire peut être mesuré de façon statique à différents niveaux d’ambiance lumineuse depuis le photopique haut (100 cd/m2) au mésopique bas (0,1 cd/m2). Il peut être étudié de façon dynamique, ou l’on mesure la réponse temporelle de la contraction puis de la décontraction après une stimulation lumineuse. On étudiera, œil par œil, le diamètre au repos, l’amplitude de la contraction, la vitesse de contraction et de dilatation, et la latence de la contraction (fig. 9-110).
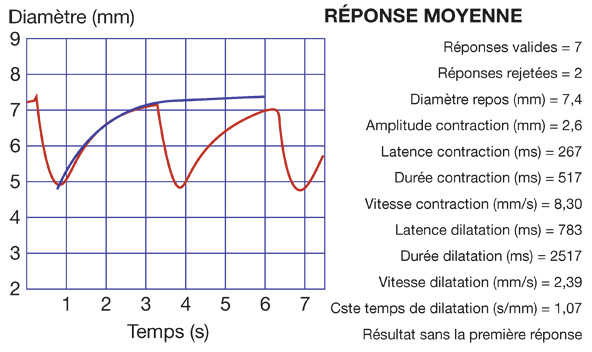
Fig. 9-110 Pupillographie dynamique obtenue par un flash très bref répété toutes les 3 secondes.
L’enregistrement des mouvements oculaires se faisait auparavant par une méthode électrophysiologique ; maintenant, grâce à des caméras rapides, il est réalisé de plus en plus souvent par une méthode de vidéo-oculographie. Elle permet d’enregistrer les mouvements oculaires horizontaux et verticaux. On étudiera la fixation, les poursuites, le nystagmus optocinétique et, surtout, les saccades.
Retenir
Quatre grands groupes de techniques d’examen dans la pathologie du glaucome coexistent :
-
les techniques dites psychophysiques dont les plus connues sont la mesure de l’acuité visuelle et l’évaluation du champ visuel. Au sein de ce groupe se retrouvent également la mesure de la sensibilité au contraste, la vision des couleurs, la sensibilité à l’éblouissement et la vision crépusculaire et nocturne ;
-
l’électrophysiologie visuelle ;
-
la motricité oculaire intrinsèque et extrinsèque ;
-
l’imagerie, largement traitée par ailleurs.
[1] Audo I. L’ERG pattern. Du signe clinique au diagnostic, imagerie et exploration de la vision. In : Defoort-Dhellemmes S, Meunier I (eds). Rapport spécial BSOF 2012. Marseille, Lamy, 455 pages.
[2] Defoort-Dhellemmes S, Basset D, Woillez JP, et al. PEV chez l’adulte. Du signe clinique au diagnostic, imagerie et exploration de la vision. In : Defoort-Dhellemmes S, Meunier I (eds). Rapport spécial BSOF 2012. Marseille, Lamy, 455 pages.
[3] Holder GE. Pattern electroretinography (PERG) and an integrated approach to visual pathway diagnosis. Prog Retin Eye Res. 2001 ; 20 : 531-61.
[4] Hood DC, Greenstein VC. The multifocal VEP and ganglion cell damage : applications and limitations for the study of glaucoma. Prog Retin Eye Res. 2003 ; 22 : 201-51
[5] International Society for Clinical Electrophysiology of Vision. http://www.iscev.org
[6] Jayle GE, Ourgaud AG. La vision nocturne et ses troubles. Rapport de la SFO. Paris, Masson, 1950, 863 pages.
[7] Lanthony P. Évaluation du panel D15 désaturé. I : Méthode de quantification et scores normaux. J Fr Ophtalmol. 1986 ; 12 : 843-7.
[8] Leid J, Lanthony P, Roth A, et al. Les dyschromatopsies. Bulletin des Sociétés d’ophtalmologie de France. Marseille, Lamy, 2001, rapport annuel, n° spécial, 268 pages.
[9] Pelli DG, Robson JG, Wilkins AJ. The design of a new letter chart for measuring contrast sensitivity. Clin Vis Sci. 1988 ; 3 : 187-99.
[10] Perdriel G, Lanthony P, Chevaleraud J. Pathologie du sens chromatique. Diagnostic pratique. Intérêt clinique et applications socio-professionnelles. Bull Soc Ophtalmol France. 1975, numéro spécial, 279 pages.
[11] Rigaudière F, Le Gargasson JF. « V-4 : L’ELECTRORETINOGRAMME LOCAL ». Œil et physiologie de la vision, V-Les signaux électrophysiologiques, mis à jour le 18/06/2013. http://lodel.irevues.inist.fr/œiletphysiologiedelavision/index.php?id=119)
[12] Roth A. Le test 28 Hue selon Farnsworth. Bull Soc Ophtalmol Fr. 1966 ; 66 : 231-8.
[13] Verriest G, Van Laethem J, Uvijls A. A new assessment of the normal range of the 100 Hue total scores. Documenta Olphtalmologica Proc. Series. 1982 ; 33 : 199-208.
H. Khayi, F. Aptel, M. Geiser, J.-P. Romanet, C. Chiquet
-
Le choix de la technique de mesure du flux sanguin oculaire dépend du lit vasculaire étudié et des caractéristiques de la mesure de flux (absolue ou relative).
-
La reproductibilité de la technique de mesure reste un facteur limitant important en pratique clinique courante, de même que les contraintes liées au sujet.
La vascularisation oculaire du segment postérieur dépend de trois systèmes vasculaires différents : choroïdien, rétinien et celui du nerf optique, tous issus de l’artère ophtalmique, branche de la carotide interne. Différentes techniques de mesure du flux sanguin au sein de ces systèmes vasculaires permettent de mieux appréhender l’hémodynamique oculaire, sur les plans physiologique, physiopathologique et thérapeutique. Les différentes techniques d’examen du fond d’œil donnent lieu à l’exploration de trois lits vasculaires principaux [21] :
-
la vascularisation de la rétine dépend de l’artère centrale de la rétine qui se divise au niveau de la papille en une branche supérieure et une branche inférieure, chacune se divisant en une branche temporale et nasale. Dans 30 % des cas, une artère ciliorétinienne (d’origine choroïdienne) vascularise une portion temporale de la rétine péripapillaire. La circulation rétinienne se caractérise par un faible flux et une forte extraction d’oxygène, un flux sanguin de la rétine temporale deux à trois fois plus élevé et une autorégulation efficace, permettant de maintenir un flux constant lors de modifications de la pression de perfusion (dans certaines limites) [5] ;
-
la choroïde est un des tissus les plus richement vascularisés de l’organisme, impliquant 85 % du flux sanguin total de l’artère ophtalmique. Elle se distingue de la rétine par une faible extraction d’oxygène, un endothélium hautement fenêtré, ce qui facilite les échanges (contrairement à la barrière hématorétinienne), une moins bonne autorégulation et une innervation autonome. La choroïde peut être divisée en trois couches : la suprachoroïde (couche de Haller), la couche intermédiaire (couche de Sattler) et la choriocapillaire (couche de Ruysch) ;
-
la vascularisation du nerf optique se caractérise par une autorégulation efficace et une compartimentation en trois régions [10, 11] :
-
la région rétrolaminaire vascularisée par les artères piales provenant des artères ciliaires courtes postérieures para-optiques et des anastomoses artériolaires péri-optiques (cercle de Haller et Zinn),
-
la région laminaire correspondant au passage du nerf optique dans le foramen scléral, vascularisée par des branches des anastomoses artériolaires péri-optiques et par des récurrences choroïdiennes,
-
la région prélaminaire vascularisée par des artérioles choroïdiennes récurrentes et des branches des artères ciliaires courtes postérieures para-optiques. La partie la plus superficielle est vascularisée par des branches de l’artère centrale de la rétine.
-
De nombreux progrès dans l’étude de la circulation oculaire ont été réalisés ces dernières décennies, permettant une meilleure compréhension de la physiopathologie vasculaire dans de nombreuses pathologies oculaires comme le glaucome, la rétinopathie diabétique ou la dégénérescence maculaire liée à l’âge. La mesure du flux sanguin oculaire reste toutefois complexe tant sur le plan technique (mesure le plus souvent relative du flux) que sur le plan anatomique (distinction de la part rétinienne et de la part choroïdienne). L’évaluation de cette circulation oculaire a évolué depuis la description des vaisseaux visibles lors de l’examen physique en ophtalmoscopie jusqu’à une mesure quantitative directe ou indirecte de différents paramètres hémodynamiques. Ainsi, la technique idéale de mesure du flux sanguin oculaire n’existe pas encore mais se doit d’être non invasive, reproductible, ergonomique, précise, rapide (mesure en temps réel), adaptée au lit vasculaire et permettant une mesure absolue.
La mesure du flux sanguin oculaire pulsatile est fondée sur des modifications du volume et de la pression intra-oculaire (PIO) durant le cycle cardiaque, les niveaux les plus élevés étant notés durant la systole. Cette mesure est basée sur une modélisation de l’œil.
La PIO est mesurée par pneumotonométrie continue et varie en fonction de la variation de flux sanguin artériel oculaire. Le maximum de variation de cette pression durant le cycle cardiaque est appelée l’amplitude pulsée, permettant le calcul du flux pulsatile. Ce calcul dépend également de la rigidité et de la taille de l’œil [14], ce qui rend cette technique de mesure très indirecte, limitée aux comparaisons intra-individuelles – elle n’est plus utilisée.
Le flux choroïdien peut être également estimé par interférométrie laser, mesurant le maximum de variations de distance entre la cornée et la rétine pendant le cycle cardiaque [28]. Durant la systole, le flux sanguin choroïdien pousse la rétine en avant et réduit donc la distance entre la cornée et la rétine. Ces variations permettent ainsi d’évaluer de façon reproductible les modifications de volume choroïdien et de calculer le flux sanguin choroïdien en fonction de divers stimuli. Cette technique est utilisée principalement pour comparer le flux choroïdien chez un même individu et non pour comparer différentes populations.
L’angiographie infrarouge au vert d’indocyanine , se fixant fortement aux protéines plasmatiques, essentiellement dans le compartiment intravasculaire, permet l’évaluation semi-quantitative du flux sanguin choroïdien. L’analyse du temps de remplissage de la choriocapillaire apporte des informations sur le flux sanguin choroïdien et son caractère pulsatile [6].
Cette mesure est fondée sur l’effet Doppler (eFig. 9-25). De la lumière monochromatique (fréquence d’oscillation unique) est envoyée sur un tissu vascularisé. La lumière réfléchie par le tissu (sans mouvement) revient avec la même fréquence, tandis que celle réfléchie par les globules rouges en mouvement est modifiée d’un facteur qui dépend de la vitesse du globule rouge et de l’angle entre la lumière incidente, la lumière réfléchie et la direction du mouvement du globule rouge. En superposant ces lumières réfléchies, il est possible de mesurer le déplacement en fréquence de la lumière réfléchie par un globule rouge. Riva et al. [22, 25, 27] ont décrit pour la première fois, en 1972, cette technique pour mesurer la vitesse des hématies dans le sang.
La fluxmétrie laser Doppler est une technique non invasive qui permet la mesure du flux sanguin dans des tissus, en particulier au niveau de la choroïde (fig. 9-111 ; eFig. 9-26 à 9-28) et de la tête du nerf optique (voir fig. 9-111). Dans le volume de mesure, les globules rouges se déplacent à des vitesses et dans des directions différentes. La lumière rétrodiffusée par les globules rouges en mouvement est détectée puis analysée suivant la théorie de Bonner et Nossal. La lumière laser diffusée par les globules rouges et par les structures statiques du tissu est captée par un photodétecteur qui la transforme en un signal électrique. Le courant électrique ainsi généré est analysé par ordinateur de façon à obtenir le flux des globules rouges dans l’échantillonnage. La pénétration tissulaire du laser est estimée à 300 μm.
Le spectre de puissance des décalages Doppler obtenu permet d’obtenir les paramètres suivants [1, 21] : la vitesse moyenne relative (Vel) des globules rouges, le volume (Vol) représentant le nombre moyens de globules rouges ayant réfléchi la lumière et le flux total de globules rouges (F) égal à Vel × Vol. La lumière laser diffusée dépend des caractéristiques du laser (longueur d’onde, diamètre du rayon), des propriétés du tissu (densité vasculaire, orientation des vaisseaux, propriété morphologique du tissu) et des globules rouges, ce qui rend méthodologiquement la comparaison entre individus difficile à interpréter. Des modifications morphologiques d’un tissu peuvent également modifier une mesure du flux sans qu’il y ait de réels changements de flux. Cette technique nécessite donc de comparer le flux en prenant le sujet comme son propre contrôle et en vérifiant que les propriétés morphologiques du tissu n’ont pas été modifiées [21].
Le fluxmètre laser Doppler offre la possibilité d’étudier la réactivité vasculaire choroïdienne à différents stimuli (O2, CO2, augmentation de pression artérielle, posture) [13, 33] chez le sujet sain et chez des patients atteints de différentes pathologies (DMLA, syndrome d’apnées du sommeil, diabète, cataracte, choriorétinopathie séreuse centrale, étude des médicaments) [23, 34].
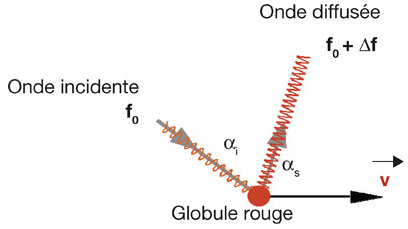
eFig. 9-25 L’effet Doppler. Une onde de fréquence fo diffusée par un globule rouge en mouvement subit un décalage Δf par rapport à la fréquence initiale fo.
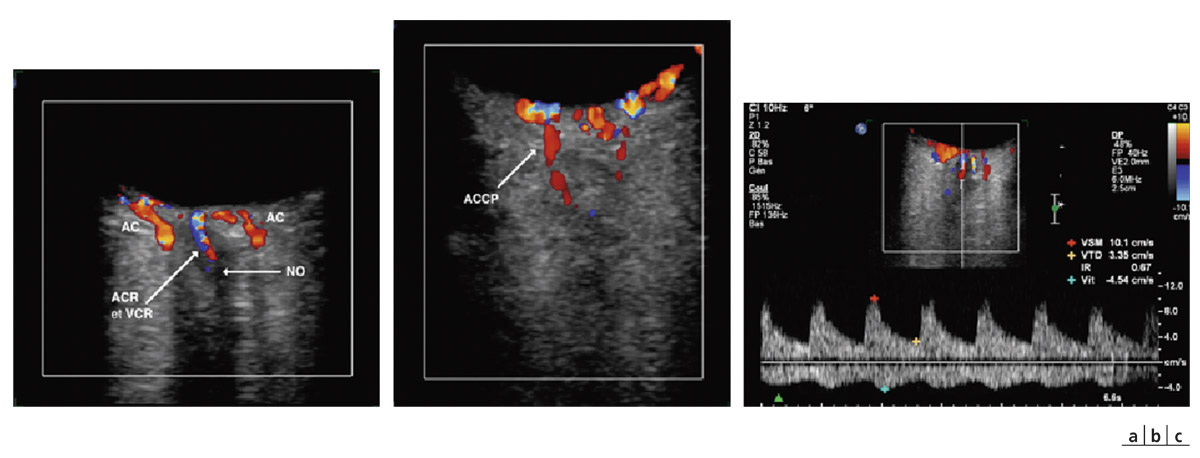
Fig. 9-111 Imagerie Doppler couleur. a. Aspect écho-Doppler couleur du flux de l’artère (ACR) et de la veine (VCR) centrales de la rétine et des artères ciliaires (AC) dans une coupe frontale passant par la tête du nerf optique (NO). b. Aspect écho-Doppler couleur du flux d’une artère ciliaire courte postérieure (ACCP). c. Enregistrement simultané du profil de vitesse de l’artère et de la veine centrales de la rétine au niveau de la tête du nerf optique, permettant au niveau artériel la mesure du pic de vitesse systolique (PSV) et des vitesses télédiastoliques (VTD), et au niveau veineux la mesure de la vitesse maximale. L’indice de résistance (IR) est calculé automatiquement. Les flux artériels et veineux, en sens opposés, correspondent respectivement à un codage en rouge et en bleu en écho-Doppler couleur, et à des vitesses positives ou négatives en Doppler-pulsé. (Remerciements : Dr O. Pichot, clinique universitaire de médecine vasculaire, CHU de Grenoble, et centre de médecine vasculaire, Grenoble.)
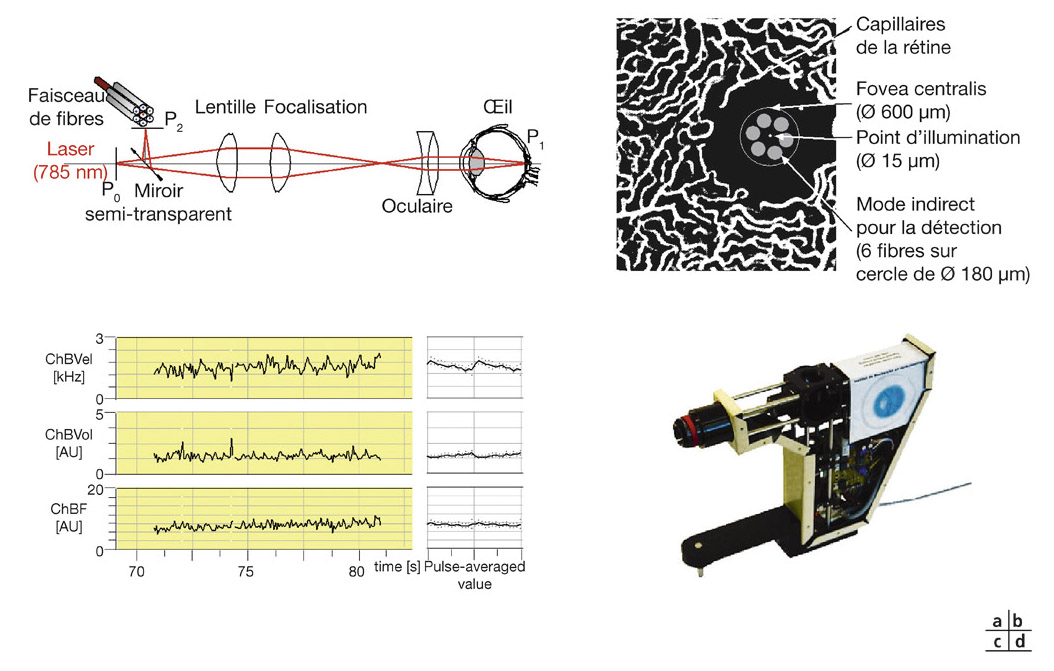
eFig. 9-26 a. Le système optique du fluxmètre laser Doppler choroïdien.
b. Représentation de la zone d’analyse maculaire en fluxmétrie laser Doppler.
L’extrémité des fibres est imagée de telle manière qu’elles ne remplissent pas complètement la foveola centralis et qu’aucune lumière issue de la rétine ne puisse être collectée.
c. Analyse du signal en temps réel lors de la fluxmétrie laser Doppler de la choroïde.
ChBVel : vélocité des globules rouges choroïdiens ; ChBVol : volume des globules rouges dans l’échantillon ; ChBF : flux sanguin choroïdien.
d. Photographie du fluxmètre choroïdien (protection enlevée).

eFig. 9-27 Principe du fluxmètre laser Doppler de la tête du nerf optique. a. Schéma du dispositif de mesure et d’analyse. b. Photographies du fluxmètre de la tête du nerf optique. c. Exemple d’interface sur ordinateur pour la mesure du flux sanguin de la tête du nerf optique. d. Photographies : exemple de mesure d’un volontaire sain (Charles Riva mesuré par Hafide Khayi) et image obtenue par la caméra du fond d’œil, le point correspond à la zone de mesure sur la papille.
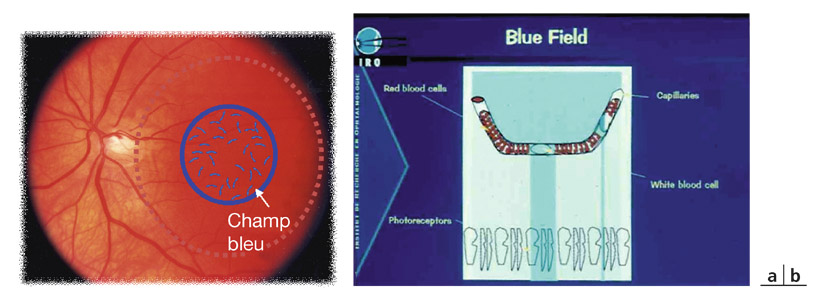
eFig. 9-28 Méthode entoptique du champ bleu. a. Photographie rétinienne du pôle postérieur et de la zone impliquée dans le phénomène entoptique. b. Coupe schématique rétinienne représentant les leucocytes dans les capillaires rétiniens.
(Remerciements : Charles Riva.)
L’angiographie permet de quantifier le flux sanguin rétinien par le calcul des différents temps de passage du colorant. La fluorescence apparaît dans la choroïde 8 à 15 secondes après injection avec un maximum entre 20 et 30 secondes. Le colorant remplit l’artère centrale de la rétine 12 secondes après l’injection, puis les artérioles précapillaires, les capillaires, les veinules post-capillaires et les veines rétiniennes.
Les vaisseaux rétiniens sont imperméables à la fluorescéine (barrière hématorétinienne). Le temps de passage artérioveineux est défini par la différence de temps entre l’apparition du colorant fluorescéinique dans une artère et dans la veine correspondante, permettant d’évaluer la vélocité sanguine. Il existe un biais lié au fait qu’un même territoire n’est pas vascularisé par une seule artère et drainé par une seule veine. La vitesse moyenne plasmatique dans les artères rétiniennes de diamètre 70 et 160 μm mesurée après injection de fluorescéine est de 6,4 à 7,4 mm/s [39]. Ce temps de circulation moyen est réduit par l’inhalation de carbogène (7 % CO2, 93 % O2) par augmentation de la vélocité des globules rouges [12]. Cette technique a été associée à un enregistrement continu des images par vidéo angiographie et ophtalmoscopie à balayage laser [12, 39].
Cette technique permet la mesure de la vitesse des globules rouges dans les vaisseaux rétiniens. L’écoulement dans les capillaires étant laminaire, le profil des vitesses des globules rouges dans les vaisseaux est parabolique avec une vitesse maximale au centre et une vitesse quasi nulle au contact des parois (loi de Poiseuille). Le spectre des fréquences rétrodiffusées est corrélé aux variations de vitesse des globules rouges. Le déplacement Doppler maximal mesuré est proportionnel à la vitesse maximale des globules rouges au centre du vaisseau. Le développement de la vélocimétrie laser Doppler bidirectionnelle a permis la détermination de la valeur absolue de la vitesse maximale (les variations de fréquences rétrodiffusées par le globule rouge sont analysées dans deux directions différentes) [24]. Durant le cycle cardiaque, la vitesse maximale des globules rouges varie de 7 à 35 mm/s dans les artères de diamètre compris entre 40 et 130 μm, et de 5 à 25 mm/s dans les veines de diamètre compris entre 60 et 180 μm.
Le couplage de la vélocimétrie laser Doppler à la mesure du diamètre des vaisseaux rétiniens permet de mesurer le flux sanguin rétinien, soit simultanément, par exemple à l’aide du Canon fluxmètre laser Doppler (CLDF, Canon, Tokyo, Japon ; très reproductible, avec un système de stabilisation du laser sur une zone précise) [8] – toutefois, d’autres systèmes non commercialisés existent –, soit successivement (mesure du diamètre rétinien, mesure de la vélocité). Le flux sanguin rétinien moyen dans les artères rétiniennes est de 33 ± 9,6 μL/min contre 34 ± 6,3 μL/min dans les veines rétiniennes [24].
La vélocimétrie laser Doppler a été utilisée en physiologie et dans l’évaluation du diabète et son traitement.
Cette technique combine le principe du laser Doppler à celui de la tomographie à cohérence optique, ce qui permet d’obtenir une carte des flux sanguins rétiniens. Des valeurs absolues de la vélocité des globules rouges dans les vaisseaux sont obtenues grâce à l’émission de deux faisceaux incidents, ce qui permet de se passer de l’obtention de l’angle que fait le rayon incident OCT avec le vaisseau sanguin [37]. Des données récentes [36] montrent une excellente corrélation entre le flux rétinien calculé en OCT et le diamètre des vaisseaux mesuré en RVA (retinal vessel analyzer). La mesure peut être réalisée également au niveau de l’artère centrale de la rétine, permettant ainsi d’évaluer le flux sanguin rétinien total [3]. Cette technique de mesure récente semble être sensible et reproductible, et a notamment été évaluée chez les patients diabétiques [35].
Ce système combine l’ophtalmoscopie à balayage laser (790 nm) et la technologie du Doppler laser pour mesurer la perfusion des capillaires de la rétine et de la tête du nerf optique. La résolution en profondeur est de 300 μm. Le temps de transit artérioveineux moyen est évalué à 1,58 ± 0,4 s et la vitesse moyenne des globules rouges à 6,61 ± 1,59 mm/s [38]. Du fait que le faisceau de mesure se déplace rapidement dans le fond de l’œil, la sensibilité au déplacement Doppler due au globule rouge est fortement réduite et rend la technique peu appropriée aux lits vasculaires de la tête du nerf optique et de la région rétinienne péripapillaire. Par ailleurs, la détection des variations de fréquence est limitée à moins de 2 000 Hz, alors que la valeur de déplacement Doppler de la choroïde est d’environ 20 kHz, et celui de la tête du nerf optique d’environ 5 kHz. Cette méthode est également très sensible aux modifications d’illumination et aux mouvements de l’œil, et est peu reproductible si la fenêtre d’échantillonnage (100 × 100 μm) est légèrement modifiée [5]. La technique a connu un grand succès dans les années 1990 [16] ; des résultats très variables ont été rapportés [19], et la technique n’est plus actuellement utilisée.
Le diamètre des vaisseaux rétiniens peut être mesuré grâce à l’agrandissement des photographies de fond d’œil. L’analyseur des vaisseaux rétiniens (RVA, retinal vessel analyzer, Imedos™) [17] comporte une caméra du fond d’œil pour l’acquisition numérique des images et a considérablement simplifié ces évaluations en permettant des mesures dynamiques très précises, sensibles (précision de 1 μm pour un vaisseau de diamètre supérieur à 90 μm) et reproductibles (coefficient de variation inférieur à 3 %). Cette technique exige toutefois une bonne dilatation pupillaire et une transparence des milieux oculaires, et ne peut être réalisée que sur des vaisseaux de calibre suffisant.
Le RVA est très utilisé en physiologie, dans les pathologies cardiovasculaires, le diabète, le glaucome et l’évaluation de traitements [7].
Le phénomène de speckle est obtenu lorsque le fond d’œil est illuminé par une lumière cohérente (laser). L’image du fond de l’œil sur un écran (caméra) sera granulaire du fait de l’interférence des ondes lumineuses diffusées par une structure irrégulière introduisant des déphasages qui vont produire des zones claires et sombres. Une variation temporelle de cette structure permet d’évaluer la vitesse des globules rouges et de cartographier le flux sanguin de la rétine, de la tête du nerf optique et de la choroïde [2, 31, 32]. Cette technique nécessite une transparence des milieux et une bonne fixation afin d’obtenir des mesures fiables. Très utilisée au Japon (commercialisée par Softcare Ltd, Iizuka, Japon), elle connaît un certain succès, avec des applications dans le domaine du décollement de rétine, du glaucome et de l’évaluation de médicaments [31].
La technique de la simulation du champ bleu est fondée sur le phénomène entoptique qui permet de mesurer la vitesse des leucocytes dans les vaisseaux rétiniens périfovéolaires. Ce phénomène est mieux observé lors de l’éclairage de l’œil par une lumière diffuse monochromatique bleue de longueur d’onde 430 nm. Dans ces conditions, de minuscules corpuscules brillants apparaissent dans une aire de 10 à 15° centré par la macula. Ceux-ci correspondent à la visualisation des leucocytes qui absorbent la lumière différemment des globules rouges. Des mesures quantitatives du flux des leucocytes sont obtenues en demandant au sujet de faire correspondre ce mouvement des leucocytes observés à des images présentées sur un moniteur vidéo [26].
Cette technique reproductible et non invasive a trouvé de nombreuses applications (réponse à différents stimuli : médicaments, gaz, pathologies). Il s’agit d’une technique subjective qui dépend donc de la coopération du patient. Par ailleurs, le flux des leucocytes n’est probablement pas proportionnel au flux sanguin en toute circonstance.
Le flux sanguin au niveau de la tête du nerf optique peut être évalué par les techniques de fluxmétrie laser Doppler [19, 23] ou la technique de laser speckle [31]. La technique du débitmètre d’Heidelberg [19] et l’angiographie ne sont plus utilisées. Ces techniques, dont les principes et les limites ont été exposés précédemment (tableau 9-6), ont permis de caractériser le flux sanguin de la tête du nerf optique dans le glaucome [5, 19] (voir chapitre 8-III) et les neuropathies optiques inflammatoires et ischémiques.
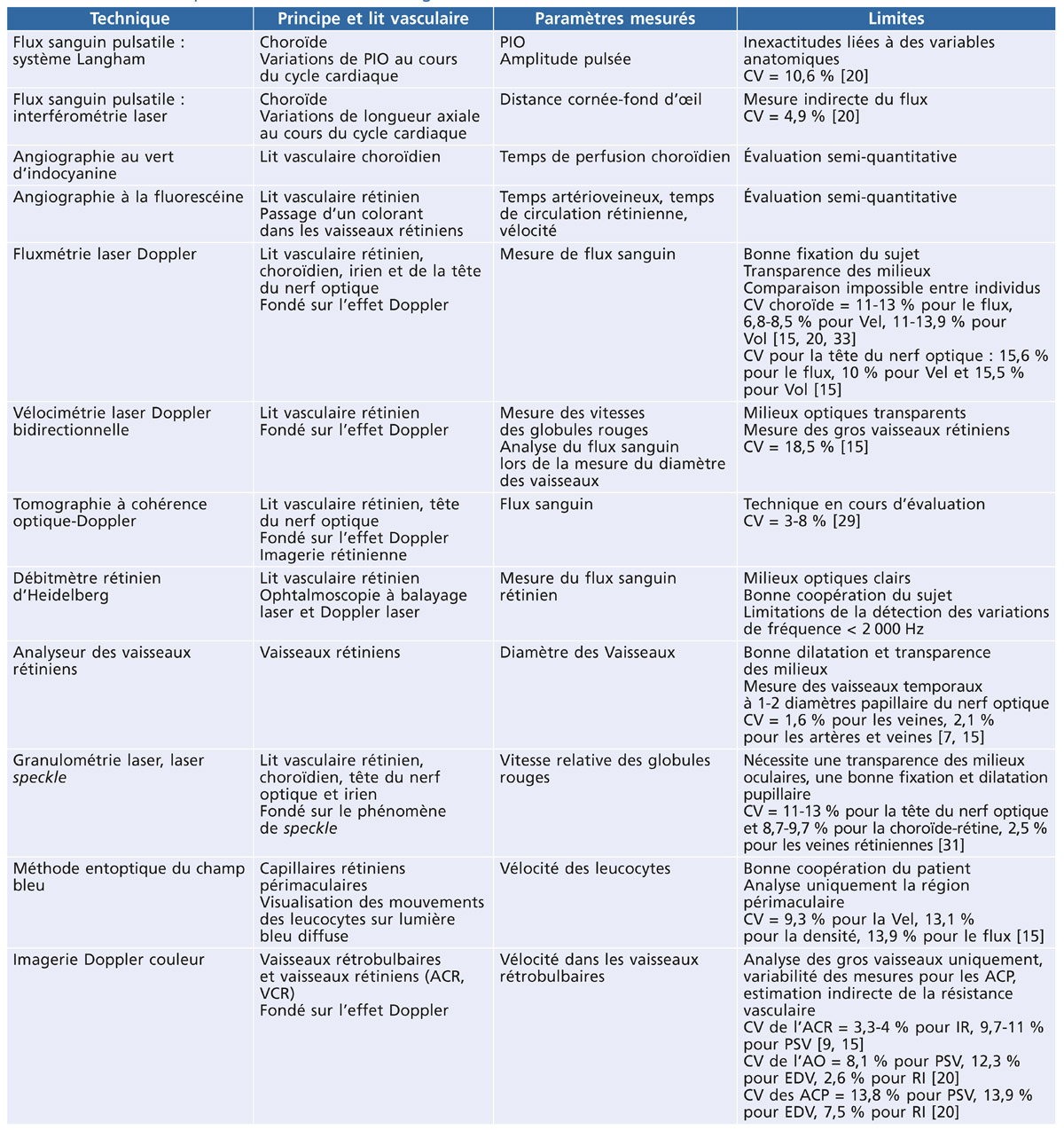
Tableau 9-6 Techniques de mesure du flux sanguin oculaire.
ACP : artère ciliaire courte postérieure ; ACR : artère centrale de la rétine ; AO : artère ophtalmique ; CV : coefficient de variation (valeurs moyennes données pour des sujets sains) ; EDV : vitesse télédiastolique (end diastolic velocity) ; PSV : vitesse maximale systolique (peak systolic velocity) ; RI : indice de résistance ; VCR : veine centrale de la rétine ; Vel : vélocité ; Vol : volume.
L’imagerie Doppler couleur associe l’imagerie échographique en mode B au Doppler couleur et/ou pulsé (voir fig. 9-111). L’examen des vaisseaux rétrobulbaires est réalisé à l’aide de transducteurs de haute fréquence (7,5-12 MHz). Le Doppler couleur permet de visualiser le flux des différents vaisseaux de l’orbite. L’écho-Doppler pulsé autorise une analyse quantitative des vitesses circulatoires. On mesure la vitesse maximale pendant la systole : PVS (pic de vitesse systolique), et la vitesse en fin de diastole : VTD (vitesse télédiastolique). On calcule l’index de résistance : IR = (PVS – VTD)/PVS, qui reflète le niveau global des résistances vasculaires en aval. Ces mesures sont habituellement réalisées au niveau de l’artère ophtalmique, de l’artère centrale de la rétine et des artères ciliaires courtes postérieures (surtout temporales, car les artères nasales sont plus petites et de localisation plus variable). Les flux veineux (veine ophtalmique, veine centrale de la rétine) peuvent aussi être analysés. Chez des sujets normaux, la VTD de l’artère centrale de la rétine est comprise entre 1,7 et 10 cm/s et le PVS entre 6 et 20 cm/s. La reproductibilité de la mesure dépend du vaisseau mesuré (coefficient de variation de 4 % pour l’IR et 11 % pour la PVS) [9] et de l’appareillage utilisé.
L’écho-Doppler permet d’évaluer le flux sanguin rétrobulbaire après chirurgie oculaire, ou dans différentes pathologies oculaires (syndrome d’ischémie oculaire, occlusion de l’artère ou de la veine centrale de la rétine, glaucome, diabète, myopie) [4, 30]. Toutefois, si l’écho-Doppler donne la mesure précise des vitesses circulatoires, il est impossible de mesurer par cette technique le diamètre des vaisseaux et, par voie de conséquence, d’obtenir des valeurs de flux [18].
Retenir
-
Les techniques de mesure du flux sanguin oculaire chez l’homme permettent actuellement d’évaluer le flux sanguin dans différents lits vasculaires, mais nécessitent le plus souvent une bonne coopération du patient ainsi que la transparence des milieux.
-
Le choix de la technique est donc fait en fonction des données utiles (mesures absolues ou relatives), de la reproductibilité et du lit vasculaire étudié.
-
Pour la choroïde, nous privilégions l’usage de la fluxmétrie laser Doppler.
-
Pour la rétine, la vélocimétrie bidirectionnelle, le RVA et l’OCT-Doppler sont actuellement utilisés dans le cadre de la recherche clinique.
-
Pour le nerf optique, la fluxmétrie laser Doppler reste la technique de référence. L’évaluation du flux sanguin rétrobulbaire fait toujours appel à l’échographie-Doppler.
[1] Bonner R, Nossal R. Model for laser Doppler measurements of blood flow in tissue. Appl Opt. 1981 ; 20 : 2097-107.
[2] Briers JD. Laser Doppler, speckle and related techniques for blood perfusion mapping and imaging. Physiol Meas. 2001 ; 22 : R35-66.
[3] Choi W, Baumann B, Liu JJ, et al. Measurement of pulsatile total blood flow in the human and rat retina with ultrahigh speed spectral/Fourier domain OCT. Biomedical Optics Express. 2012 ; 3 : 1047-61.
[4] Dimitrova G, Kato S. Color Doppler imaging of retinal diseases. Surv Ophthalmol. 2010 ; 55 : 193-214.
[5] Flammer J, Orgul S, Costa VP, et al. The impact of ocular blood flow in glaucoma. Progr Retin Eye Res. 2002 ; 21 : 359-93.
[6] Flower RW. Extraction of choriocapillaris hemodynamic data from ICG fluorescence angiograms. Invest Ophthalmol Vis Sci. 1993 ; 34 : 2720-9.
[7] Garhofer G, Bek T, Boehm AG, et al. Use of the retinal vessel analyzer in ocular blood flow research. Acta Ophthalmol. 2010 ; 88 : 717-22.
[8] Guan K, Hudson C, Flanagan JG. Variability and repeatability of retinal blood flow measurements using the Canon Laser Blood Flowmeter. Microvasc Res. 2003 ; 65 : 145-51.
[9] Harris A, Kagemann L, Cioffi GA. Assessment of human ocular hemodynamics. Surv Ophthalmol. 1998 ; 42 : 509-33.
[10] Hayreh SS. Inter-individual variation in blood supply of the optic nerve head. Its importance in various ischemic disorders of the optic nerve head, and glaucoma, low-tension glaucoma and allied disorders. Documenta Ophthalmologica Advances in Ophthalmology. 1985 ; 59 : 217-46.
[11] Hayreh SS. The blood supply of the optic nerve head and the evaluation of it – myth and reality. Progr Retin Eye Res. 2001 ; 20 : 563-93.
[12] Hickam JB, Frayser R. A photographic method for measuring the mean retinal circulation time using fluorescein. Invest Ophthalmol. 1965 ; 4 : 876-84.
[13] Khayi H, Pepin JL, Geiser MH, et al. Choroidal blood flow regulation after posture change or isometric exercise in men with obstructive sleep apnea syndrome. Invest Ophthalmol Vis Sci. 2011 ; 52 : 9489-96.
[14] Langham ME, Farrell RA, O’Brien V, et al. Blood flow in the human eye. Acta Ophthalmol Suppl. 1989 ; 191 : 9-13.
[15] Luksch A, Lasta M, Polak K, et al. Twelve-hour reproducibility of retinal and optic nerve blood flow parameters in healthy individuals. Acta Ophthalmol. 2009 ; 87 : 875-80.
[16] Michelson G, Schmauss B, Langhans MJ, et al. Principle, validity, and reliability of scanning laser Doppler flowmetry. J Glaucoma. 1996 ; 5 : 99-105.
[17] Nagel E, Vilser W, Lanzl IM. Retinal vessel reaction to short-term IOP elevation in ocular hypertensive and glaucoma patients. Eur J Ophthalmol. 2001 ; 11 : 338-44.
[18] Pichot O, Gonzalvez B, Franco A, Mouillon M. [Color Doppler ultrasonography in the study of orbital and ocular vascular diseases]. J Fr Ophtalmol. 1996 ; 19 : 19-31.
[19] Piltz-Seymour JR. Laser Doppler flowmetry of the optic nerve head in glaucoma. Surv Ophthalmol. 1999 ; 43 (Suppl. 1) : S191-8.
[20] Polska E, Polak K, Luksch A, et al. Twelve hour reproducibility of choroidal blood flow parameters in healthy subjects. Br J Ophthalmol. 2004 ; 88 : 533-7.
[21] Pournaras C. pathologies vasculaires oculaires. Rapport de la Société francaise d’ophtalmologie, 2008 : 21-52.
[22] Riva C, Ross B, Benedek GB. Laser Doppler measurements of blood flow in capillary tubes and retinal arteries. Invest Ophthalmol. 1972 ; 11 : 936-44.
[23] Riva CE, Geiser M, Petrig BL. Beijing PRCOBFRA. Ocular blood flow assessment using continuous laser Doppler flowmetry. Acta Ophthalmol. 2010 ; 88 : 622-9.
[24] Riva CE, Grunwald JE, Sinclair SH, Petrig BL. Blood velocity and volumetric flow rate in human retinal vessels. Invest Ophthalmol Vis Sci. 1985 ; 26 : 1124-32.
[25] Riva CE, Grunwald JE, Sinclair SH. Laser Doppler measurement of relative blood velocity in the human optic nerve head. Invest Ophthalmol Vis Sci. 1982 ; 22 : 241-8.
[26] Riva CE, Petrig B. Blue field entoptic phenomenon and blood velocity in the retinal capillaries. J Opt Soc Am. 1980 ; 70 : 1234-8.
[27] Riva CE, Timberlake GT, Feke GT. Laser Doppler technique for measurement of eye movement. Applied Optics. 1979 ; 18 : 2486-90.
[28] Schmetterer L. topical measurement of fundus pulsations. Opt Eng ; 1995 : 711-6.
[29] Singh AS, Kolbitsch C, Schmoll T, Leitgeb RA. Stable absolute flow estimation with Doppler OCT based on virtual circumpapillary scans. Biomedical Optics Express. 2010 ; 1 : 1047-58.
[30] Stalmans I, Vandewalle E, Anderson DR, et al. Use of colour Doppler imaging in ocular blood flow research. Acta Ophthalmol. 2011 ; 89 : e609-30.
[31] Sugiyama T, Araie M, Riva CE, et al. Use of laser speckle flowgraphy in ocular blood flow research. Acta Ophthalmol. 2010 ; 88 : 723-9.
[32] Tamaki Y, Araie M, Kawamoto E, et al. Noncontact, two-dimensional measurement of retinal microcirculation using laser speckle phenomenon. Invest Ophthalmol Vis Sci. 1994 ; 35 : 3825-34.
[33] Tonini M, Khayi H, Pepin JL, et al. Choroidal blood-flow responses to hyperoxia and hypercapnia in men with obstructive sleep apnea. Sleep. 2010 ; 33 : 811-8.
[34] Vinh Moreau-Gaudry V, Geiser M, Romanet JP, et al. Effects of photodynamic therapy on subfoveal blood flow in neovascular age-related macular degeneration patients. Eye. 2010 ; 24 : 706-12.
[35] Wang Y, Fawzi A, Tan O, et al. Retinal blood flow detection in diabetic patients by Doppler Fourier domain optical coherence tomography. Optics Express. 2009 ; 17 : 4061-73.
[36] Werkmeister RM, Dragostinoff N, Palkovits S, et al. Measurement of absolute blood flow velocity and blood flow in the human retina by dual-beam bidirectional Doppler fourier-domain optical coherence tomography. Invest Ophthalmol Vis Sci. 2012 ; 53 : 6062-71.
[37] Werkmeister RM, Dragostinoff N, Pircher M, et al. Bidirectional Doppler Fourier-domain optical coherence tomography for measurement of absolute flow velocities in human retinal vessels. Optics Letters. 2008 ; 33 : 2967-9.
[38] Wolf S, Arend O, Reim M. Measurement of retinal hemodynamics with scanning laser ophthalmoscopy : reference values and variation. Surv Ophthalmol. 1994 ; 38 (Suppl.) : S95-100.
[39] Wolf S, Jung F, Kiesewetter H, et al. Video fluorescein angiography : method and clinical application. Graefe’s Archive for Clinical and Experimental Ophthalmology/Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 1989 ; 227 : 145-51.