Évaluation du déficit visuel
P. -Y. Robert
L’examen au cabinet d’ophtalmologie d’un patient déficient visuel est particulier, à cause de son handicap d’une part, et du service qu’il est venu chercher d’autre part.
Les salles d’attente sont régulièrement encombrées de pièges pour les déficients visuels. Quelques modifications simples permettent de les éviter :
enlever les obstacles au sol (une table basse, un pot de fleurs encombrant le passage, un tapis, une rallonge électrique) ou les obstacles à hauteur de tête (placard) ;
privilégier les repères à fort contraste : rampes, plinthes, poignées de porte, etc. ;
assurer un bon éclairage ;
installer une signalétique en gros caractères et en noir et blanc (Fig. 5-1) ;
installer un parcours au sol en fort contraste ou en revêtement podotactile.

Fig. 5-1 Signalétique en gros caractères et en noir et blanc, rampes contrastées, éclairage ciblé.
Lorsque le patient arrive dans la salle d’attente, il sera beaucoup plus à l’aise si on l’appelle par son nom, si on va le chercher et si on applique la technique de guide (voir chap. 10-1) pour l’amener sur le fauteuil d’examen.
L’examen d’un patient déficient visuel nous impose de considérer, au-delà de sa fonction visuelle, son autonomie résiduelle, et l’évolution sur la longue durée. Un patient déficient visuel sera également attentif, dans la moindre consultation, au suivi de sa pathologie chronique, mais aussi à tous les facteurs intercurrents susceptibles d’aggraver sa déficience visuelle.
Il connaît souvent très bien sa pathologie, sollicite des informations précises ou des éclaircissements sur des renseignements glanés dans la presse ou sur internet, ou des informations sur les études de recherche en cours.
Les mots que nous employons pour décrire le handicap visuel et la capacité visuelle résiduelle peuvent être d’une grande violence pour le patient. La consultation est toujours marquée par la relation que le patient est en train de nouer avec son handicap, et ce que nous lui disons peut avoir un retentissement déterminant dans son sentiment de fragilité et dans son projet de vie. Le patient déficient visuel sera sensible au souci que nous prendrons de son quotidien, en particulier des conditions de sécurité et d’autonomie dont il est entouré (entourage présent/absent, projet personnel/professionnel, insertion scolaire et parascolaire pour les enfants, équipement du domicile, organisation des trajets, etc.).
Dans le cadre d’une consultation habituelle de suivi, en dehors de toute considération de réadaptation visuelle, un matériel spécifique peut être nécessaire pour établir un bilan correct de la fonction visuelle des patients déficients.
L’acuité visuelle est mesurée par l’angle minimal de résolution (MAR), une acuité étant considérée normale pour un angle de 1 minute (0°1′). Seule l’échelle logarithmique des angles de résolution (LogMAR) reflète une progression linéaire, et permet les comparaisons statistiques.
Les échelles anglo-saxonnes notent l’acuité sous forme d’une fraction, comprenant au numérateur la distance de travail, et au dénominateur la distance à laquelle il faudrait placer l’optotype pour un angle de résolution de 1 minute. L’échelle la plus répandue dans nos cabinets résume cette fraction par un chiffre décimal ; cependant, cette échelle décimale n’est pas linéaire, et ne permet pas les comparaisons statistiques.
Des échelles d’acuité spécifiques permettent de chiffrer des acuités visuelles inférieures aux 1/10 ou 1/20 de nos projecteurs de tests : l’utilisation d’une échelle ETDRS (Early Treatment Diabetic Retinopathy Study) propose une progression des optotypes selon des LogMAR croissants, avec 5 lettres par ligne. Elle s’utilise à 4 mètres pour les acuités supérieures à 1/10, et à 1 mètre pour les acuités entre 1/10 et 1/40. Son utilisation requiert donc un repérage au sol des distances de lecture (Fig. 5-2). Le résultat est la somme des lettres vues à 4 mètres et à 1 mètre. Des échelles spécifiques de basse vision en vision de près permettent de préciser la capacité de discrimination de très basses acuités jusqu’à 1/400 (par exemple Berkeley Rudimentory Test ; voir chap. 11-6, paragraphe « Sport et déficience visuelle »). Le Tableau. 5-1 montre les correspondances entre les échelles décimales et logMAR pour la vision de loin et la vision de près, en fonction de la distance de lecture.

Sur fond violet : cécité légale (catégories 3, 4 et 5 de l’OMS).
Chiffres en noir : utilisation de l’échelle ETDRS à 4 m.
Chiffres en vert : Utilisation de l’échelle ETDRS à 1 m.
Chiffres en rouge : acuités inférieures à celles mesurées par l’échelle ETDRS.
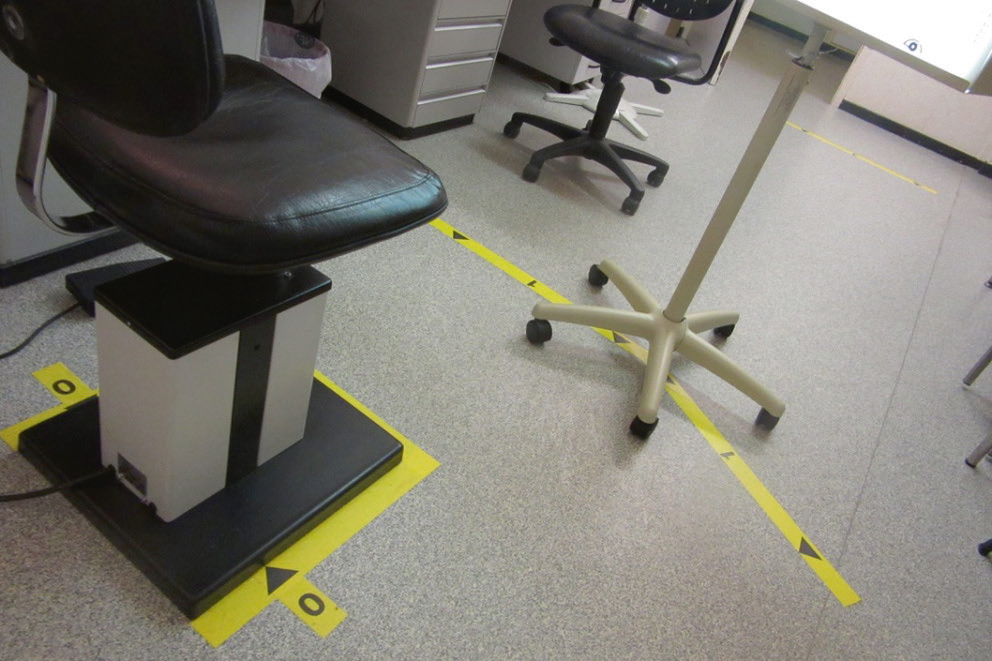
Fig. 5-2 Marquage au sol de la ligne de position du regard (« 0 »), de la ligne de 1 mètre, et de la ligne de 4 mètres, pour l’utilisation de l’échelle ETDRS.
La mesure de la réfraction subjective, beaucoup plus difficile en cas de déficience visuelle, est facilitée par la pratique d’une réfraction objective sous cycloplégique, par l’utilisation de verres d’essai non fenêtrés (Fig. 5-3), et par le respect de la règle d’incrément (Tableau. 5-2 et Fig. 5-4).
La périmétrie statique automatisée implique une fixation stable. Lorsque la fixation est instable, l’évaluation du champ visuel passe toujours par des examens spécifiques : périmétrie dynamique manuelle à la coupole de Goldman, ou micropérimétrie avec eye-tracker (voir chap. 504 et 505).
Enfin, l’examen d’un enfant déficient visuel requiert un matériel spécifique, et une attitude qui dépend de l’âge de l’enfant (voir chap. 503).

Fig. 5-3 Verres non fenêtrés.
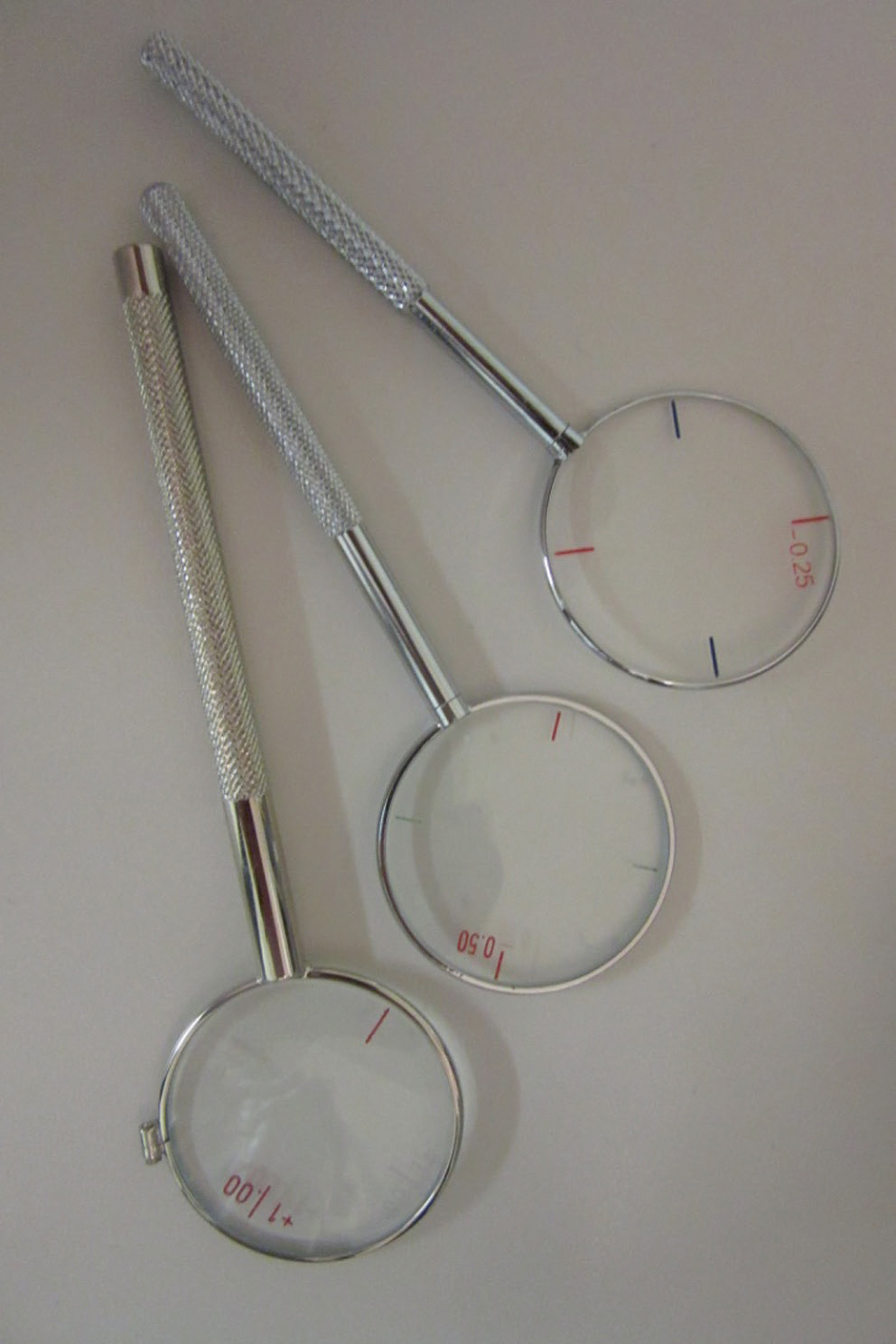
Fig. 5-4 Cylindres croisés de ±0,25, ±0,50 et ±1,00 à utiliser en fonction de la profondeur d’atteinte visuelle.
L’utilisation des verres progressifs implique un champ visuel large et une bonne qualité d’accroche et de fixation. La plupart des patients déficients visuels seront donc mieux corrigés avec des verres monofocaux.
Par ailleurs, des verres grossissants prismatiques permettent aux patients emmétropes d’accéder à une vision très rapprochée, en cumulant la correction de l’addition et de la convergence. Il existe ainsi des verres prismatiques prémontés de +4,00 à +8,00.
L’opération de la cataracte est un des moyens d’améliorer la capacité visuelle résiduelle, quelle que soit la pathologie cécitante sous-jacente. Il n’existe pas de contre-indication à la chirurgie lorsque la vision est basse par ailleurs, et trop de patients sont encore laissés avec une cataracte brune évolutive au prétexte d’une rétinopathie sous-jacente. L’indication de la chirurgie de la cataracte est cependant difficile à poser chez les patients déficients visuels, le patient étant le plus souvent incapable de distinguer la part de gêne qui revient à la cataracte. L’indication opératoire doit toujours être posée en fonction de critères objectifs, en faisant abstraction des inquiétudes du patient ou du médecin. Parmi les critères à prendre en compte, peuvent figurer :
des risques opératoires spécifiques (par exemple myopie forte) ;
en cas de pathologie cécitante évolutive (par exemple rétinopathie pigmentaire), la nécessité d’opérer avant que la vision ne soit définitivement compromise ;
l’évaluation objective du degré d’évolution de la cataracte : l’échelle LOCSIII propose par exemple une gradation en quatre valeurs qualitatives – opalescence nucléaire (de 1 à 6), couleur du noyau (de 1 à 6), opacité corticale (de 1 à 5), et opacité capsulaire postérieure (de 1 à 5) [1].
Les documents suivants peuvent constituer une base utile à un cabinet d’ophtalmologie standard :
les coordonnées des professionnels de basse vision de la région (hôpitaux, soins de suite et de réadaptation [SSR], service d’aide à l’acquisition de l’autonomie et à l’intégration scolaire [SAAAIS], service d’accompagnement familial et d’éducation précoce [SAFEP], service d’accompagnement médico-social pour adultes handicapés [SAMSAH], orthoptistes et opticiens spécialisés);
des dossiers de préadmission en service de soins de suite et de réadaptation pour déficients visuels (SSR-DV) ;
les coordonnées du tissu associatif local (Association Valentin Haüy [AVH], écoles spécialisées, etc.) ;
des exemplaires du certificat CERFA modifié (voir chap. 11.6, paragraphe « Le certificat ophtalmologique… ») ;
les fiches cliniques du présent rapport, et les points clés du développement visuel de l’enfant (voir encadré 3-1).
[1] Chylack LT Jr, Wolfe JK, Singer DM, et al. The Lens Opacities Classification System III. The Longitudinal Study of Cataract Study Group. Arch Ophthalmol 1993 ; 111(6) : 831-6.
V. Smirnov, S. Defoort – Dhellemmmes
La sensibilité au contraste est une fonction visuelle fondamentale. Il s’agit de la capacité de discriminer les différences en luminance des objets clairs ou sombres d’une scène visuelle, stationnaires ou en mouvement.
Les tests de la vision du contraste ont beaucoup été étudiés mais sont malheureusement peu utilisés dans la pratique ophtalmologique courante. Cela s’explique par leur faible apport dans un diagnostic positif d’affections oculaires. L’intérêt de l’examen de la vision du contraste est pourtant majeur dans une situation de handicap visuel. D’une part, les anomalies de la vision de contraste permettent d’expliquer la gêne des patients dans la vie quotidienne ; d’autre part, ils orientent les stratégies de rééducation et de compensation d’une malvoyance. En outre, ce sont de bons tests de suivi, permettant de détecter des variations fines de la fonction visuelle.
Le système visuel procède par décomposition d’un signal visuel complexe en une somme infinie de réseaux sinusoïdaux avec caractéristiques particulières, chacune reconnue par une zone dédiée du cortex visuel. Seule cette information en termes binaires de réseaux sinusoïdaux est accessible au cerveau.
Le système visuel humain n’est pas un analyseur de luminance absolue mais différentielle. Le stimulus adapté à son étude est donc une alternance des plages sombres et claires, appelée un réseau visuel. Les caractéristiques principales de ce type de réseaux visuels sont la fréquence spatiale, la fréquence temporaire et le contraste.
La fréquence spatiale est définie par la largeur des bandes à la distance donnée de l’observateur (Fig. 5-5). Il est plus aisé de l’exprimer en nombre de cycles par degré d’angle visuel (cpd) afin de s’affranchir d’une distance d’observation. Un cycle correspond à une barre sombre suivie d’une barre claire. Les hautes fréquences spatiales correspondent alors à des détails fins d’une scène visuelle ; les basses fréquences définissent les objets de grande taille.
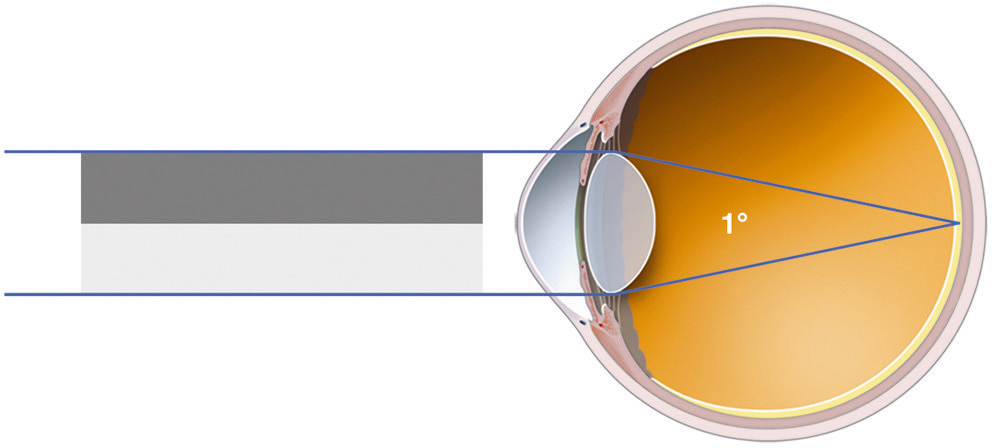
Fig. 5-5 Réseau d’une fréquence spatiale d’un cycle par degré d’angle visuel.
La fréquence temporelle est le reflet du mouvement d’un réseau. Il suffit d’inverser le contraste des bandes pour produire une sensation de mouvement du réseau dit papillotement. La fréquence temporelle n’est alors autre chose qu’un nombre d’inversions par seconde, exprimé en hertz (Hz). L’oeil est sensible au papillotement jusqu’à une certaine fréquence à laquelle il n’est plus possible de distinguer les bandes. C’est une fréquence de fusion. Au-dessus de cette fréquence, le réseau apparaît de luminance homogène.
Le contraste du réseau se calcule selon la formule de Michelson:
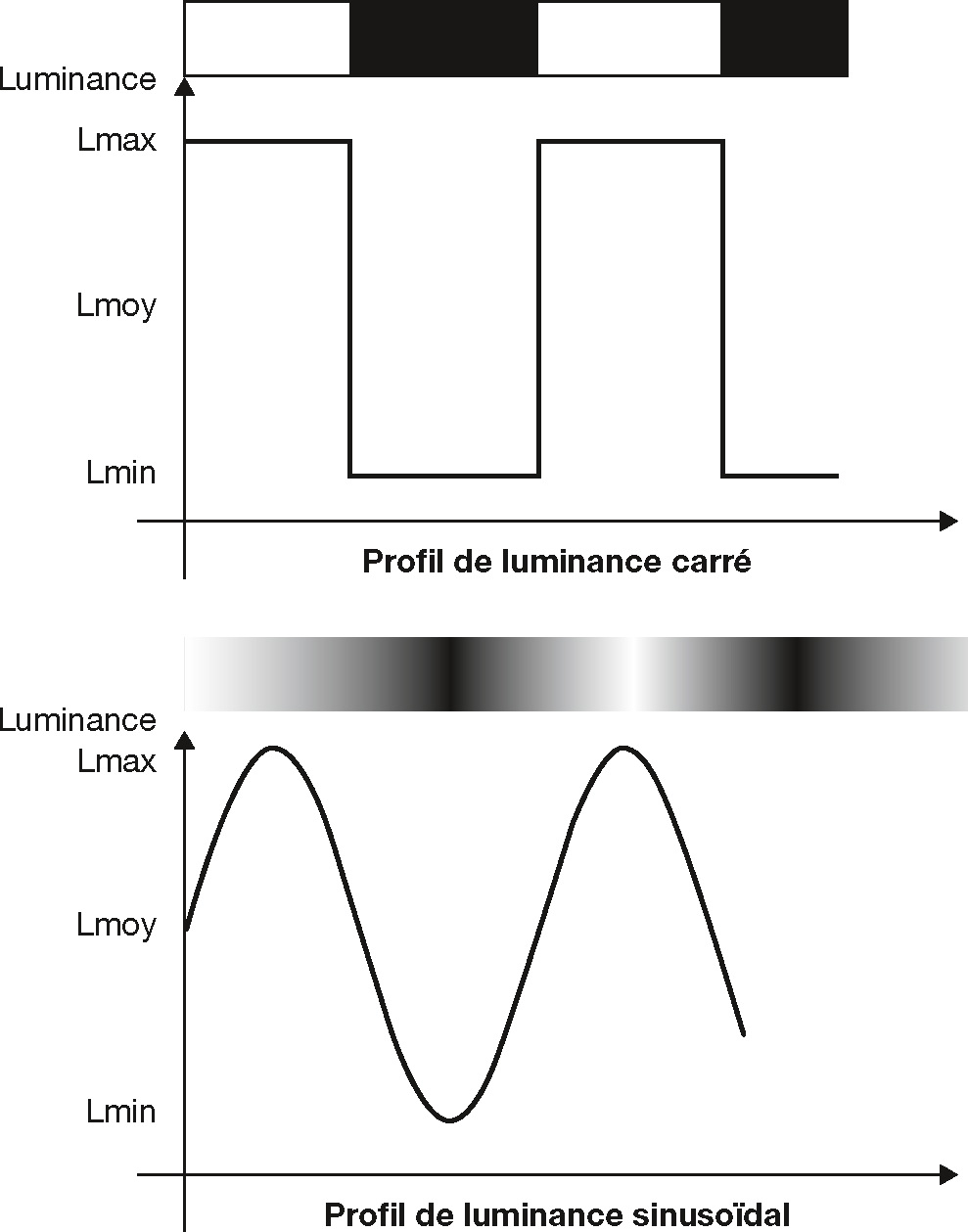
Fig. 5-6 Réseaux à profils de luminance les plus utilisés pour la stimulation visuelle.
On imagine aisément le nombre infini de tels réseaux variants en couleur, orientation des barres et direction du mouvement que l’oeil extrait de l’objet regardé. L’analogie est souvent faite avec une analyse de Fourier, permettant de passer d’un signal irrégulier, complexe, à une somme de fonctions périodiques (sinusoïdes).
Les travaux d’Enroth-Cugell et Robson [1] ont permis d’identifier au moins deux systèmes de cellules ganglionnaires rétiniennes, l’un sensible à la fréquence spatiale et l’autre à la fréquence temporelle du stimulus. Le premier est responsable de la vision des détails fins et de leur couleur (voie P ou parvocellulaire), et le deuxième est sensible au mouvement de l’image rétinienne (voie M ou magnocellulaire). Campbell et Robson [2] ont démontré l’existence de « canaux » à l’intérieur de ces voies, chacun sensible à une fréquence donnée. Dans le même temps, Hubel et Wiesel [3] ont découvert l’existence de cellules du cortex visuel spécialement « accordées » pour recevoir une fréquence temporelle/spatiale et l’orientation de stimulus visuel.
Ainsi, l’examen de la sensibilité au contraste permet d’appréhender l’ensemble des « canaux » visuels et de délimiter le domaine du visible (par analogie avec l’îlot de vision de Traquair dans la mer de cécité).
Le seuil de sensibilité au contraste, qu’on teste cliniquement, est un contraste minimal perçu pour une fréquence spatiale et/ou temporelle donnée [4, 5].
Les tests de contraste statiques sont les plus utilisés [6]. Ces tests (Fig. 5-7) sont conçus pour une fréquence spatiale donnée (carte de Pelli-Robson, test Mars®), ou pour un contraste donné (échelles de Sloan de 1,25, 2.5, 5, 10 et 25 % de contraste de Precision Vision®) ; ils peuvent aussi tester plusieurs combinaisons de contraste et de fréquence spatiale (Moniteur Ophtalmologique® de Métrovision ; Fig. 5-8), FVA de Stereoptical, certaines cartes et écrans de présentation des optotypes). Ces tests sont disponibles pour une vision de loin, aux distances intermédiaires et en vision de près. Depuis tout dernièrement, ils sont accessibles sur les tablettes numériques [7].
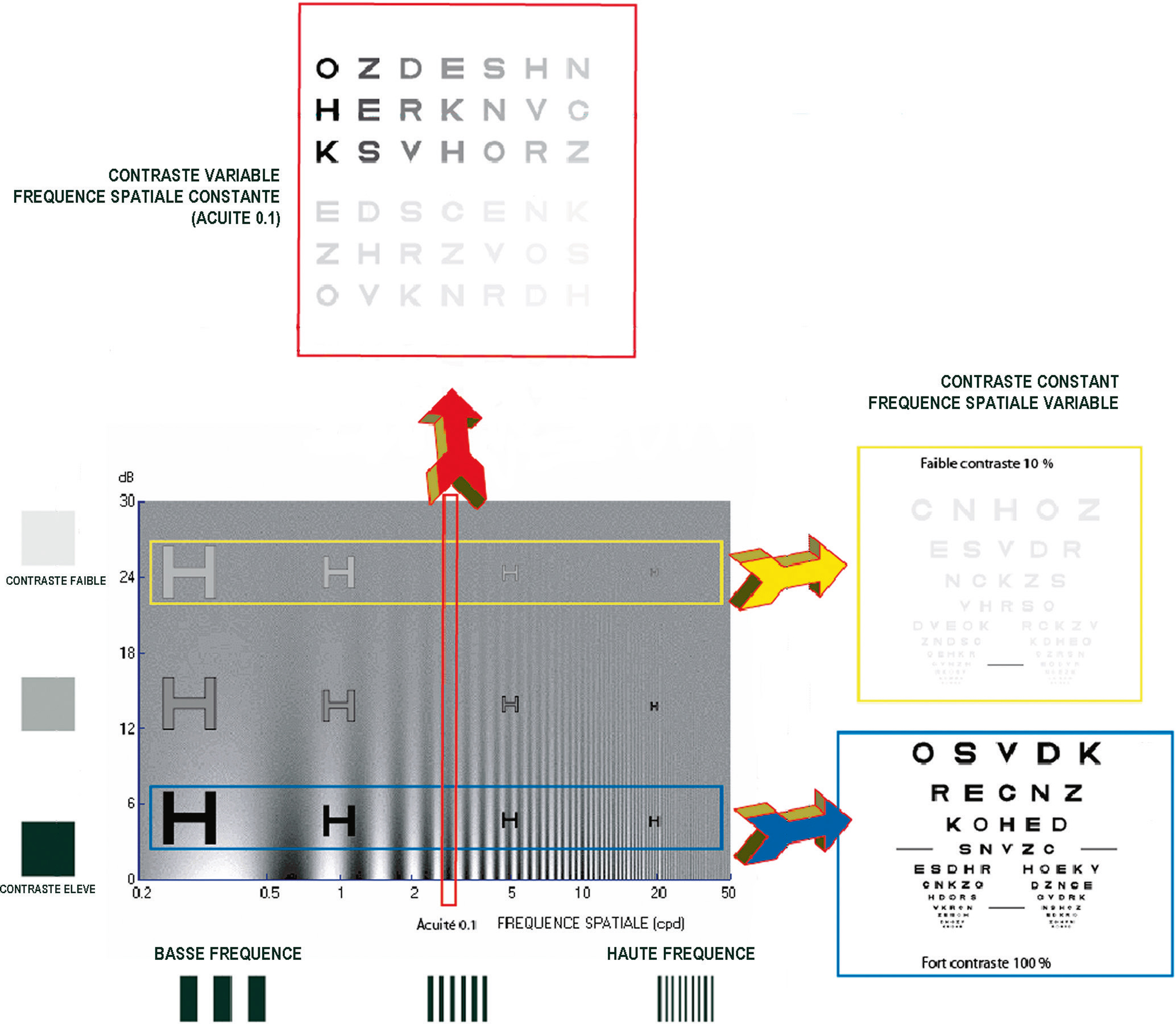
Fig. 5-7 Tests simplifiés à contraste ou à fréquence spatiale constante.
En haut, planche Visiocontraste® ; à droite, planches de lettres de Sloan de Precision Vision®.(Reproduit avec l’aimable autorisation du Dr J.-P. Woillez et du Dr X. Zanlonghi.)
Les résultats sont présentés soit en scores normalisés (tests à résolution spatiale ou à contraste fixes), soit en courbes de seuil de perception de contraste en fonction de la résolution spatiale. Ces courbes (visuogrammes, où les seuils de sensibilité sont exprimés en décibels) ont une forme de cloche avec un pic de sensibilité au contraste pour des fréquences spatiales entre 2 et 5 cpd. L’acuité visuelle n’est autre chose qu’un point d’un visuogramme correspondant à l’intersection d’une fréquence temporelle maximale perçue à 100 % de contraste. Les couloirs normatifs existent en fonction de l’âge des patients [8]. L’aire sous la courbe représente alors la « surface de la vision » (Fig. 5-9).
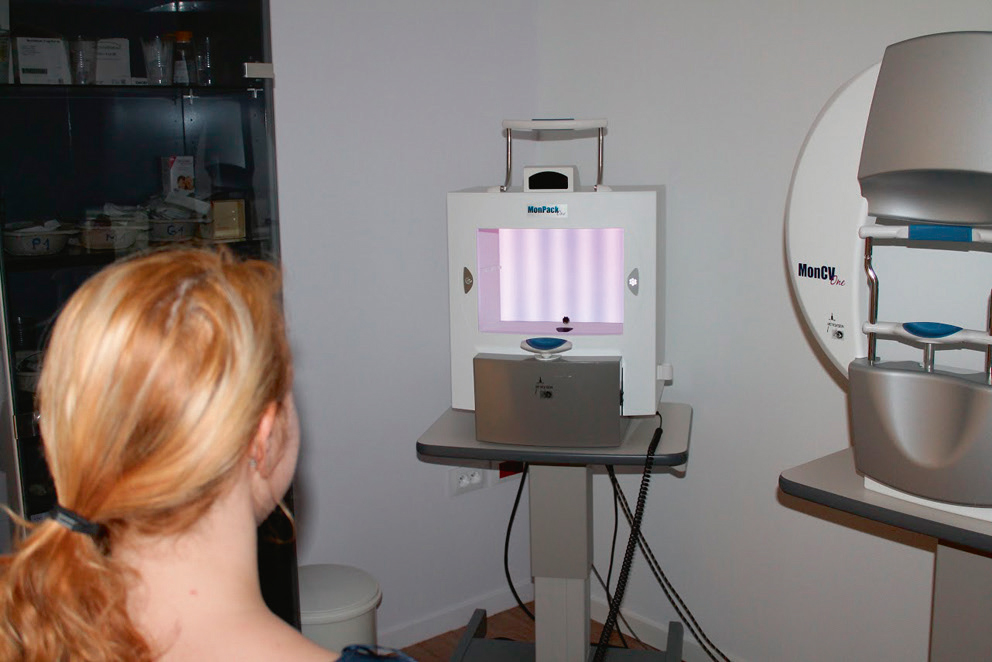
Fig. 5-8 Test de vision de contraste sur Moniteur Ophtalmologique MonPackOne® de Métrovision.
À chaque fréquence temporelle testée, le contraste augmente progressivement jusqu’à ce que le patient signale qu’il aperçoit le réseau.

Fig. 5-9 Visuogramme d’un sujet normal, Moniteur Ophtalmologique® de Métrovision.
L’acuité visuelle, qui définit avec le champ visuel la déficience visuelle, est insuffisante pour apprécier la qualité de la vision restante et donc pour définir au mieux les moyens de compensation.
Certains auteurs proposent les tests de sensibilité au contraste pour classifier les déficiences visuelles [9], notamment comme un des facteurs d’évaluation globale dans les scores composites.
Une équipe française utilise les tests de sensibilité de contraste, y compris de contraste chromatique, pour jauger l’efficacité des stratégies de rééducation de basse vision liée à la dégénérescence maculaire liée à l’âge (DMLA) [10]. Cette approche a été récemment reprise pour l’évaluation des résultats de traitement de DMLA atrophique [11].
La lecture est une activité fortement dépendante de la sensibilité au contraste [12]. Le contraste critique, ralentissant de 50 % la vitesse de lecture, est un paramètre individuel, peu dépendant du type d’affection oculaire [13]. La mesure de ce seuil peut être utile pour le bilan initial, la prescription des aides et pour l’évaluation de l’efficacité de la rééducation.
L’évaluation de la sensibilité au contraste fait l’objet de plusieurs études du handicap visuel et moteur lié à la sclérose en plaques. Elle est inversement corrélée avec les scores de sévérité de la maladie (ou Expanded disability status scale [EDSS]) [14] et de la progression du handicap neurologique [15,16].
Les tâches de la vie courante font appel aux différentes propriétés du système visuel. Celles qui s’adressent à une bonne sensibilité de contraste sont par exemple la conduite sous la pluie (Fig. 5-10) ou dans le brouillard, la descente des escaliers, etc.
Il est facile d’imaginer la difficulté de verser du lait dans un bol blanc pour le patient ayant une perturbation majeure de la sensibilité au contraste, comme c’est le cas dans les neuropathies optiques, par exemple. Dans cette situation, les systèmes grossissants n’ont que peu d’utilité. En revanche, la vaisselle bien contrastée ou une augmentation de l’éclairage de cuisine peuvent sensiblement aider le patient. Dans le même ordre d’idées, le marquage contrasté au sol, aux murs et les bandes lumineuses aux arrêtes des marches des escaliers (Fig. 5-11) peuvent guider les déplacements d’un déficient visuel (l’ensemble des dispositifs légaux quant aux normes de construction et de l’accessibilité pour les personnes handicapées peut être consulté sur le site de la Confédération française pour la promotion sociale des aveugles et amblyopes (CFPSAA ; http://www.cfpsaa.fr/spip.php?rubrique136).
L’étude de sensibilité au contraste dans les conditions d’éblouissement (glare disability) est utile pour les patients photophobes [17]. Une amélioration de cette sensibilité peut être obtenue avec des filtres colorés ou des verres polarisés [18, 19]. L’amélioration des visuogrammes justifie la prescription d’un type particulier de verre. Il en est de même pour l’implantation des implants intraoculaires filtrant les courtes longueurs d’onde (lumière bleue) en cas de maculopathies et rétinopathies [20]. Une étude japonaise [21] a retrouvé une amélioration de la sensibilité au contraste avec les filtres jaunes chez les patients atteints d’une agnosie visuelle du syndrome de Benson.
Les mêmes mesures peuvent être appliquées pour l’évaluation ergonomique de l’environnement lumineux assurant une meilleure acuité visuelle et une vision des contrastes [22]. Une présentation de texte à contraste maximale ou en contraste inversé peut aider à la lecture. Les recommandations de contraste minimal pour les textes présentés sur écran d’ordinateur sont données par la norme ISO 9241-3 : 2012.
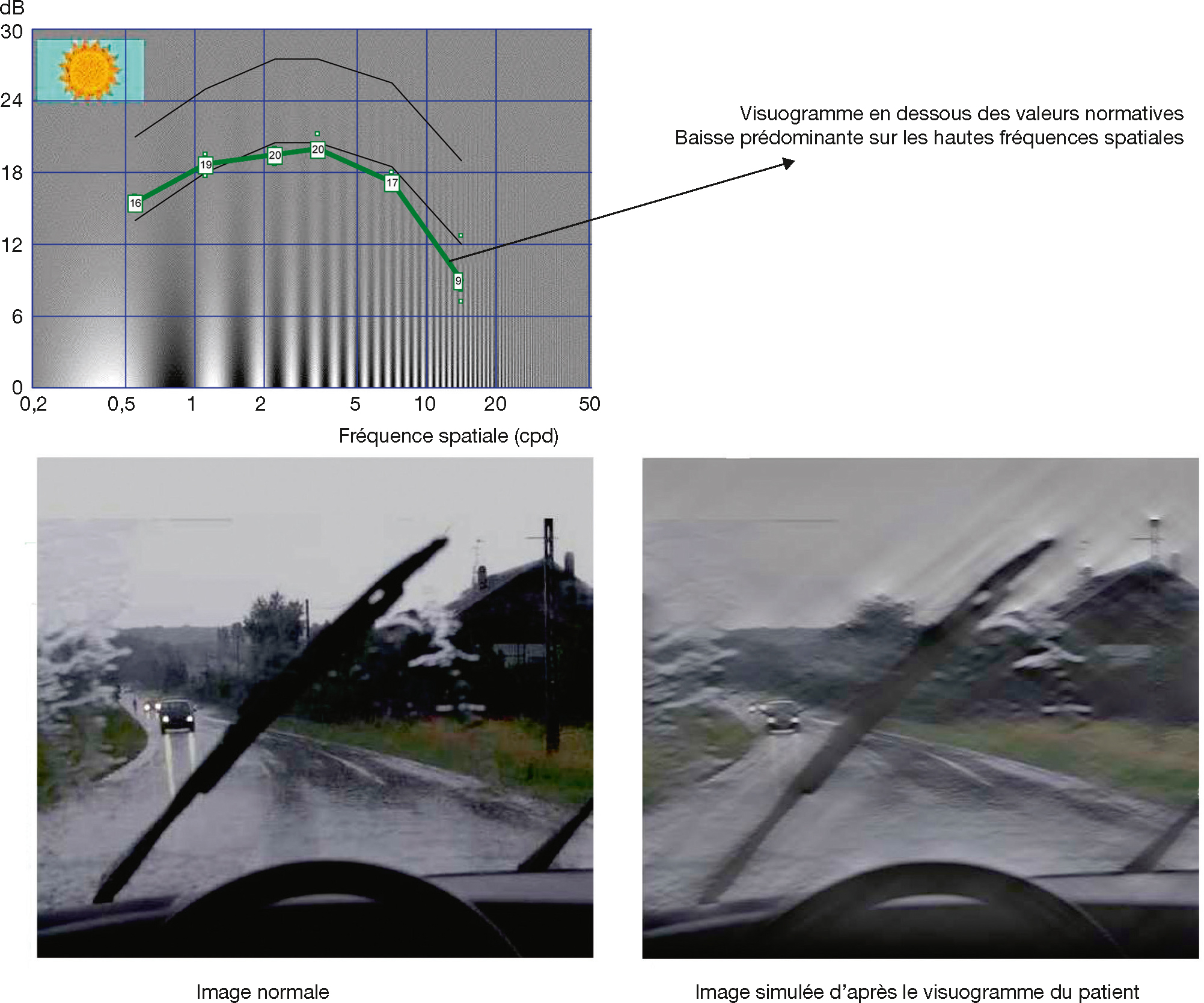
Fig. 5-10 Patient atteint d’une neuropathie optique inflammatoire.
L’acuité visuelle de l’oeil testé est de 7/10. Simulation proposée par le Moniteur Ophtalmologique® de Métrovision.

Fig. 5-11 a. Marches mal contrastées, bandes signalétiques seulement sur le palier et vues par contraste chromatique inaccessible à certains déficients visuels. b. Guidage par une bande verticale vue par contraste de luminance.
L’examen de sensibilité au contraste présente un intérêt majeur dans le domaine du handicap visuel. Il permet de mieux comprendre la gêne du patient dans la vie quotidienne, de proposer des aides visuelles adaptées et des stratégies de rééducation personnalisées et, enfin, de réaliser un contrôle d’efficacité de ces mesures compensatrices.
[1] Enroth-Cugell C, Robson JG. The contrast sensitivity of retinal ganglion cells of the cat. J Physiol 1966 ; 187(3) : 517-52.
[2] Campbell FW, Cooper GF, Robson JG, Sachs MB. The spatial selectivity of visual cells of the cat and the squirrel monkey. J Physiol 1969 ; 204(2) : 120P+.
[3] Hubel DH, Wiesel TN. Receptive fields and functional architecture of monkey striate cortex. J Physiol 1968 ; 195(1) : 215-43.
[4] Pelli DG, Bex P. Measuring contrast sensitivity. Vision Res 2013 ; 90 : 10.
[5] Corbé C, Nordmann JP. Fonctions de sensibilité au contraste de luminance. In : Exploration de la fonction visuelle : applications au domaine sensoriel de l’oeil normal et en pathologie. Rapport de la Société Française d’Ophtalmologie. Paris : Masson ; 1999.
[6] Zanlonghi X, Arndt C. Sensibilité aux contrastes. In : Neuropathies optiques. Rapport annuel de BSOF. 2015.
[7] Dorr M, Lesmes LA, Lu ZL, Bex PJ. Rapid and reliable assessment of the contrast sensitivity function on an iPad. Invest Ophthalmol Vis Sci 2013 ; 54(12) : 7266-73.
[8] Allard R, Renaud J, Molinatti S, Faubert J. Contrast sensitivity, healthy aging and noise. Vision Res 2013 ; 92 : 47-52.
[9] Kajla G, Rohatgi J, Dhaliwal U. Use of subjective and objective criteria to categorise visual disability. Indian J Ophthalmol 2014 ;62(4) : 400-6.
[10] Corbé C, De La Porte Des Vaux C. Notre démarche dans la prise en charge d’une personne atteinte de DMLA. Coup d’OEil 1991 ; 35 : 63-70.
[11] Lesmes LA, Jackson ML, Bex P. Visual function endpoints to enable dry AMD clinical trials. Drug Discov Today Ther Strateg 2013 ; 10(1) : e43-50.
[12] Legge GE, Rubin GS, Luebker A. Psychophysics of reading-– V. The role of contrast in normal vision. Vision Res 1987 ; 27(7) : 1165-77.
[13] Rubin GS, Legge GE. Psychophysics of reading. VI-– The role of contrast in low vision. Vision Res 1989 ; 29(1) : 79-91.
[14] Soler García A, González Gómez A, Figueroa-Ortiz LC, et al. Relationship between contrast sensitivity test and disease severity in multiple sclerosis patients. Arch Soc Esp Oftalmol 2014 ; 89(9) : 347-51.
[15] Schinzel J, Zimmermann H, Paul F, et al. Relations of low contrast visual acuity, quality of life and multiple sclerosis functional composite : a cross-sectional analysis. BMC Neurol 2014 ; 14 : 31.
[16] Nunes AF, Monteiro PML, Vaz Pato M. Influence of multiple sclerosis, age and degree of disability, in the position of the contrast sensitivity curve peak. Indian J Ophthalmol 2014 ; 62(2) : 180-5.
[17] Aslam TM, Haider D, Murray IJ. Principles of disability glare measurement : an ophthalmological perspective. Acta Ophthalmol Scand 2007 ; 85(4) : 354-60.
[18] Leat SJ, North RV, Bryson H. Do long wavelength pass filters improve low vision performance ? Ophthalmic Physiol Opt J Br Coll Ophthalmic Opt Optom 1990 ; 10(3) : 219-24.
[19] Severinsky B, Yahalom C, Florescu Sebok T, et al. Red-tinted contact lenses may improve quality of life in retinal diseases. Optom Vis Sci Off Publ Am Acad Optom 2016 ; 93(4) : 445-50.
[20] Hammond BR, Renzi LM, Sachak S, Brint SF. Contralateral comparison of blue-filtering and non-blue– filtering intraocular lenses : glare disability, heterochromatic contrast, and photostress recovery. Clin Ophthalmol Auckl NZ 2010 ; 4 : 1465-73.
[21] Sakai S, Hirayama K, Iwasaki S, et al. Yellow glasses improve contrast sensitivity of a patient with a visual variant of Alzheimer’s disease. Eur Neurol 2002 ; 48(4) : 224-5.
[22] Sheedy JE, Smith R, Hayes J. Visual effects of the luminance surrounding a computer display. Ergonomics 2005 ; 48(9) : 1114-28.
F. Vital – Durand
L’exameL’examen périnatal n’est pas pris en compte dans cette contribution.
L’intérêt de la précocité de l’examen de la vision découle de la notion de période sensible, ou critique, parfaitement décrite à partir des expérimentations chez le chat et le singe et vérifiée cliniquement chez l’homme. Celle-ci commence dès les premiers mois de la vie extra-utérine, passe par un pic entre 9 et 24 mois, puis s’atténue progressivement jusque vers 5 à 6 ans. En clair, une amblyopie est rapidement et efficacement rattrapée en fin de première année. Puis, le temps d’occlusion thérapeutique ira s’allongeant et un résultat optimal sera plus difficilement obtenu, même si l’amblyopie peut être récupérée jusque vers 5 à 6 ans, surtout dans la mesure où elle est survenue plus tardivement. De même, pour les cas de déficits plus sévères, la précocité de la prise en charge optique, orthoptique, rééducative optimise les résultats.
Cela justifie un examen précoce comprenant plusieurs étapes selon la situation observée.
Un strabisme est recherché en observant le reflet pupillaire (reflet de Hirschberg) et en occluant alternativement chaque oeil. Les reflets cornéens sont normalement centrés. Un reflet situé du côté nasal témoigne d’une déviation en divergence ou exotropie, alors qu’un reflet situé en temporal témoigne d’une déviation en convergence, encore appelée ésotropie. Les déviations verticales peuvent également être observées. Jusqu’à la fin de la première année, une discrète exophorie est physiologique. Le comportement de l’enfant à l’occlusion d’un oeil est analysé. En cas d’amblyopie, l’occlusion de l’oeil sain déclenche une réaction de défense, alors que l’occlusion de l’oeil amblyope est sans conséquence. Le signe de la toupie peut être également mis en évidence en cas d’amblyopie : pour continuer à fixer la cible avec l’oeil sain, l’enfant est obligé de tourner la tête. En cas de malvoyance profonde bilatérale, la fixation n’est pas obtenue et une errance du regard est retrouvée avec parfois des mouvements erratiques ou nystagmiques. Dans ces situations graves, le nourrisson tente de se créer des stimulations lumineuses par la manoeuvre de Franceschetti ou manoeuvre oculodigitale par la compression des globes oculaires. Le signe de l’éventail peut également être observé, l’enfant passant ses mains devant ses yeux de manière répétée.
Le réflexe pupillaire doit être identique dans les deux yeux (Fig. 5-12).
Fig. 5-12 Examen de la constriction pupillaire et de la fixation.
L’exploration oculaire dans les directions cardinales recherche les difficultés (limitations) oculomotrices attribuables à chaque muscle extraoculaire (oculomoteur). Jusque vers 4 mois, l’enfant regarde difficilement vers le haut. Les mouvements de poursuite d’une cible sont une série de saccades pendant les premiers mois, mais les saccades sont assez lentes. À partir du 4e mois, la poursuite lisse d’une cible déplacée lentement est une conséquence du bon développement de la fonction binoculaire et accompagne la maturation fovéale. La poursuite ne doit plus être surchargée de saccades de rattrapage après 6 mois. Le punctum proximum de convergence (PPC) est le point le plus proche permettant de voir simple l’image des deux yeux, grâce à la coordination des muscles oculomoteurs. Ce point existe en présence d’une vision binoculaire efficace. La convergence doit être obtenue jusqu’à quelques centimètres du nez, en général moins de 10 cm (Fig. 5-13).

Fig. 5-13 Évaluation du punctum proximum de convergence (PPC).
La stéréoscopie apparaît avec le 4e mois, mais elle ne peut être évaluée qu’à partir du 7e ou 8e mois, en utilisant le pointer manuel précis. L’examen est pratiqué avec la plaquette de Lang ou de Bébé Relief Tropique (Fig. 5-14). Le stéréogramme aléatoire sous réseau ligné présente trois images en relief de disparité croissante. Le test de Lang comporte trois dessins correspondant à une acuité stéréoscopique de 1200, 600, 550 secondes d’arc. L’enfant doit pointer du doigt ou nommer au moins deux des trois cibles. Une bonne réponse élimine l’amblyopie et le strabisme. Des cas de faux positifs peuvent être observés. À partir de 4 ans, des tests plus performants tels que le test de Wirt et le TNO seront utilisés. Mais tous les enfants ne répondent pas à ce test qui requiert un bon niveau de coopération. Il sera donc réalisé vers la fin de l’examen quand l’enfant est familiarisé et répété si nécessaire.

Fig. 5-14 Le pointer digital du stimulus stéréoscopique doit être obtenu à partir du 8e mois.
La résolution spatiale est mesurée par le regard préférentiel sur les cartes d’acuité. L’enfant est placé derrière un paravent qui cache l’examinateur. Les cartes sont présentées derrière une fenêtre et l’examinateur observe le regard de l’enfant par un orifice situé au milieu de la carte. L’examinateur ne doit pas savoir le côté du stimulus présenté. Il le vérifie quand l’enfant a donné une réponse d’orientation du regard. L’examen commence avec une carte de basse fréquence spatiale très facile à voir, et se poursuit dans la série jusqu’à l’errance du regard. L’acuité retenue est celle pour laquelle au moins trois réponses positives sur quatre sont obtenues. L’examen commence par la vision binoculaire qui habitue l’enfant au test et donne une valeur de référence. Ensuite, le cache est posé sur chaque oeil. Il est normal que la valeur obtenue en monoculaire soit inférieure à celle obtenue en binoculaire, mais l’acuité visuelle doit être identique dans les deux yeux. L’absence d’iso-acuité peut être le signe d’un début d’amblyopie (Fig. 5-15 et Tableau. 5-3). Le test du regard préférentiel ne doit pas être analysé de manière isolée ; il constitue un élément de l’examen orthoptique avec l’étude de la réponse comportementale à l’occlusion et la qualité de la fixation.
La répétition de cet examen dans une prise en charge d’amblyopie permet de s’assurer de la bonne efficacité du traitement.
Dans les cas de suspicion de cécité ou de malvoyance, une réponse même de très faible valeur révèle la présence d’une capacité visuelle qu’une prise en charge appropriée devrait permettre de développer. La technique du regard préférentiel est également utilisée dans les situations de handicap neurologique lourd chez des enfants plus âgés. En effet, elle met en jeu l’attention de l’enfant indépendamment de ses capacités de communication.
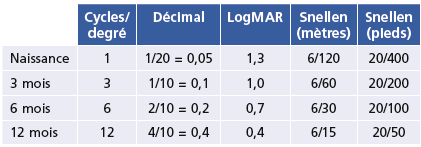

Fig. 5-15 Installation de l’examinateur et du patient lors du test des cartes d’acuité.
La skiascopie manuelle est en voie de régression au profit de nouveaux équipements (Fig. 5-16). La réfractométrie automatique offre de bonnes possibilités de dépistage d’une amétropie significative, éventuellement sans cycloplégie. Cependant, celle-ci est généralement pratiquée avec trois gouttes de tropicamide 0,5 % à 5 minutes d’intervalle en dépistage, En cas de valeurs hors normes ou de facteurs de risque du strabisme (hérédité, prématurité, lésions neurologiques ou anomalies chromosomiques), la réfraction pourra être vérifiée sous cycloplégie par atropine.
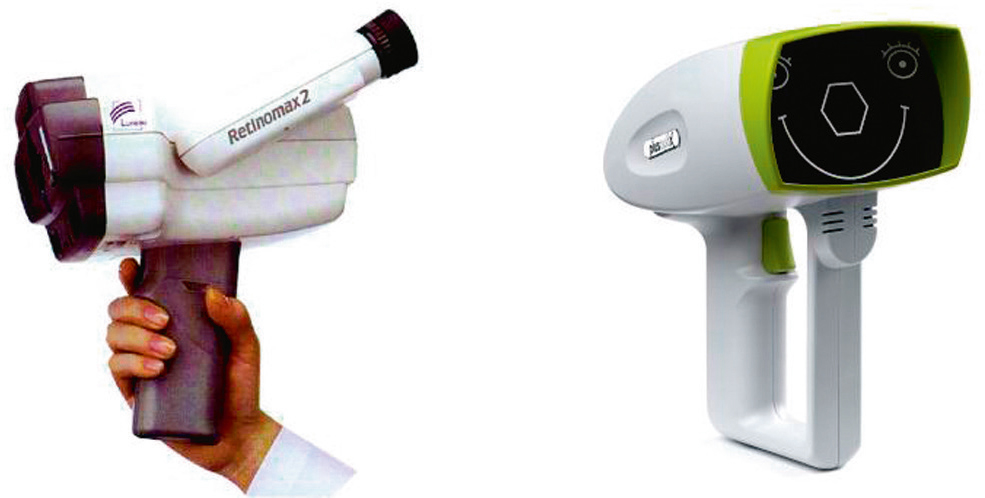
Fig. 5-16 Réfractomètres pédiatriques Rétinomax® et Plusoptix®.
L’examen ophtalmologique sera complet et systématique, avec analyse du segment antérieur et du fond d’oeil après dilatation pupillaire. Celle-ci est obtenue en consultation par l’instillation de tropicamide 0,5 % (Mydriaticum®) pouvant être potentialisée par l’effet sympathomimétique de la phényléphrine (osynéphrine®)seulement utilisable à 2,5 % chez l’enfant. Ces deux collyres n’ont pas d’effet cycloplégique. Le cyclopentolate (Skiacol®) a un effet cycloplégiant bien moindre que celui de l’atropine et est contre-indiqué en cas d’épilepsie. Les collyres à l’atropine sont utilisés habituellement pour mesurer initialement la réfraction sous cycloplégie. Il existe différents dosages en fonction de l’âge : 0,3 % avant 2 ans, 0,5 % à partir de 2 ans, 1 % après 12 ans. Des appareils spécialisés pour l’ophtalmopédiatrie permettent d’examiner les plus petits comme la lampe à fente portable ou le casque de Schepens avec une lentille de 28 ou 30 dioptries pour l’ophtalmoscopie indirecte. Les résultats pathologiques sortent du champ de compétence de ce chapitre.
Dès qu’une anomalie significative est remarquée, hors réfraction et strabisme, plusieurs tests complémentaires permettront d’orienter le diagnostic et la prise en charge.
Pratiqué par confrontation, l’examen du champ visuel renseigne sur d’éventuelles lésions, oculaires ou d’origine centrale.
Un stimulus surgit de chaque côté d’un écran de 50 × 25 cm. L’observateur évalue l’angle à partir duquel la cible déclenche la capture visuelle (Fig. 5-17). La distance de l’écran à l’oeil permet d’estimer l’angle d’excentricité obtenu [1]. La normalité dépend de l’âge de l’enfant comme indiqué à la figure 3-4. Le champ visuel est presque complet à un an, mais son utilisation nécessite un engagement attentionnel dont l’apprentissage est beaucoup plus lent.

Fig. 5-17 Le champ visuel par confrontation.
La cible apparaît de chaque côté de l’écran tenu à distance contrôlée des yeux de l’enfant.
Lors de la pose du cache pour l’examen de l’acuité aux cartes, l’examinateur demande à l’enfant de regarder le porteur à qui on feint de mettre le cache. Dès 7 mois, l’enfant obéit et se retourne (transfert d’intentionnalité) (Fig. 5-18). L’absence de retournement peut inciter à se pencher sur la relation de l’enfant aux autres, surtout s’il présente un regard particulièrement fuyant sans raison apparente. Dans ces cas, le soupçon d’une tendance vers le champ autistique est évoqué.

Fig. 5-18 Le retournement sur ordre.
Un damier de grande dimension est déplacé lentement devant les yeux de l’enfant dont la fixation est absente, erratique ou nystagmique (Fig. 5-19). La rotation de la tête dans le sens du déplacement indique qu’il existe une vision fonctionnelle, si faible soit-elle, puisqu’elle ne permet pas la fixation.

Fig. 5-19 Le damier déplacé lentement.
Un panneau de 50 × 25 cm est découpé de deux créneaux. Le stimulus est déplacé derrière les merlons. Rapidement, l’enfant anticipe la réapparition du stimulus dans le créneau et le fixe dès qu’il apparaît (Fig. 5-20). En cas de déficit visuel d’origine cérébrale, il n’y a pas d’anticipation et le regard ne s’investit pas sur le stimulus : il n’y a pas d’engagement attentionnel.

Fig. 5-20 Le château de Labro.
C’est un ensemble de déficits consécutifs à une lésion du système nerveux central, caractérisés selon les cas par une absence d’engagement attentionnel sur le stimulus, une errance du regard, des saccades hypométriques, des difficultés de pointer digital, plus tard des difficultés à la marche, etc. [2]. Il s’agit généralement d’enfants victimes d’une atteinte génétique ou neurologique pré-, péri-ou néonatale visible à l’échographie. Un cas typique est celui des leucomalacies périventriculaires. Le déficit visuel n’est pas la conséquence d’une pathologie au niveau du bulbe oculaire, mais dans les structures nerveuses, le plus souvent sous-corticales mais parfois corticales, responsables du traitement des influx transmis par le nerf optique. Celui-ci est parfois appelé cécité corticale, mais la nature et les possibilités thérapeutiques devraient faire préférer, chez l’enfant, le terme de déficit visuel d’origine cérébrale, car cette pathologie s’accompagne le plus souvent d’un contrôle défectueux de la motricité oculaire volontaire et de l’attention qui n’appartiennent pas à la définition de la cécité corticale [3].
La prise en charge rééducative précoce peut être remarquablement efficace. Mais les cas sévères de déficit visuel d’origine cérébrale peuvent laisser des séquelles irréversibles de malvoyance. Cependant, l’enfant possède de grands pouvoirs d’adaptation que n’ont plus les adultes.
Il n’est jamais trop tôt pour diagnostiquer un trouble sévère (cataracte, glaucome, persistance du vitré primitif, rétinoblastome, etc.). Les symptômes devant faire consulter en urgence sont le strabisme constant, les mouvements anormaux des globes oculaires (nystagmus, flutter, etc.), l’absence de regard ou la leucocorie. L’absence de sourire social à 2 mois doit également inquiéter. Les examens comportementaux deviennent faciles à 3 mois et très fiables à 7 à 8 mois. Un dépistage est réalisé par le pédiatre avant la sortie de la maternité par l’examen de la lueur pupillaire et de la fixation. En cas de facteur de risque de strabisme, un examen entre 9 et 15 mois est indispensable. Un dépistage scolaire est effectué à 3 ans et 6 ans en France.
Le dépistage, c’est-à-dire l’examen de tous les enfants d’une classe d’âge, est illusoire du fait de l’investissement nécessaire. En revanche, la surveillance est recommandée pour tous les enfants porteurs de signe, fût-ce un épicanthus, nés à moins de 1,5 kg ou descendants de parents porteurs d’une pathologie, c’est-à-dire au total près de 15 % de la population. La sensibilisation des pédiatres et médecins généralistes a beaucoup contribué à faire adresser ces enfants à un âge précoce. Le recours à l’orthoptiste permet d’éliminer les épicanthus (faux strabisme) et d’orienter le patient vers l’ophtalmologue pédiatrique.
Il n’est jamais trop tôt pour examiner un enfant porteur d’un signe inquiétant. Mais pour les sujets suspects, 9 mois est un âge idéal pour pratiquer les examens. À cet âge, les examens sont fiables, la fixation est précise, l’amblyopie éventuelle facile à récupérer (Fig. 5-21). L’enfant se laisse facilement apprivoiser – à un an, il développe une opposition croissante jusque vers 2 ans et demi. Avant un an, il acceptera la correction optique et l’occlusion d’autant plus facilement que l’amblyopie n’est pas encore profonde. Enfin, c’est le moment du pic de la période sensible ; le traitement sera parfaitement efficace.
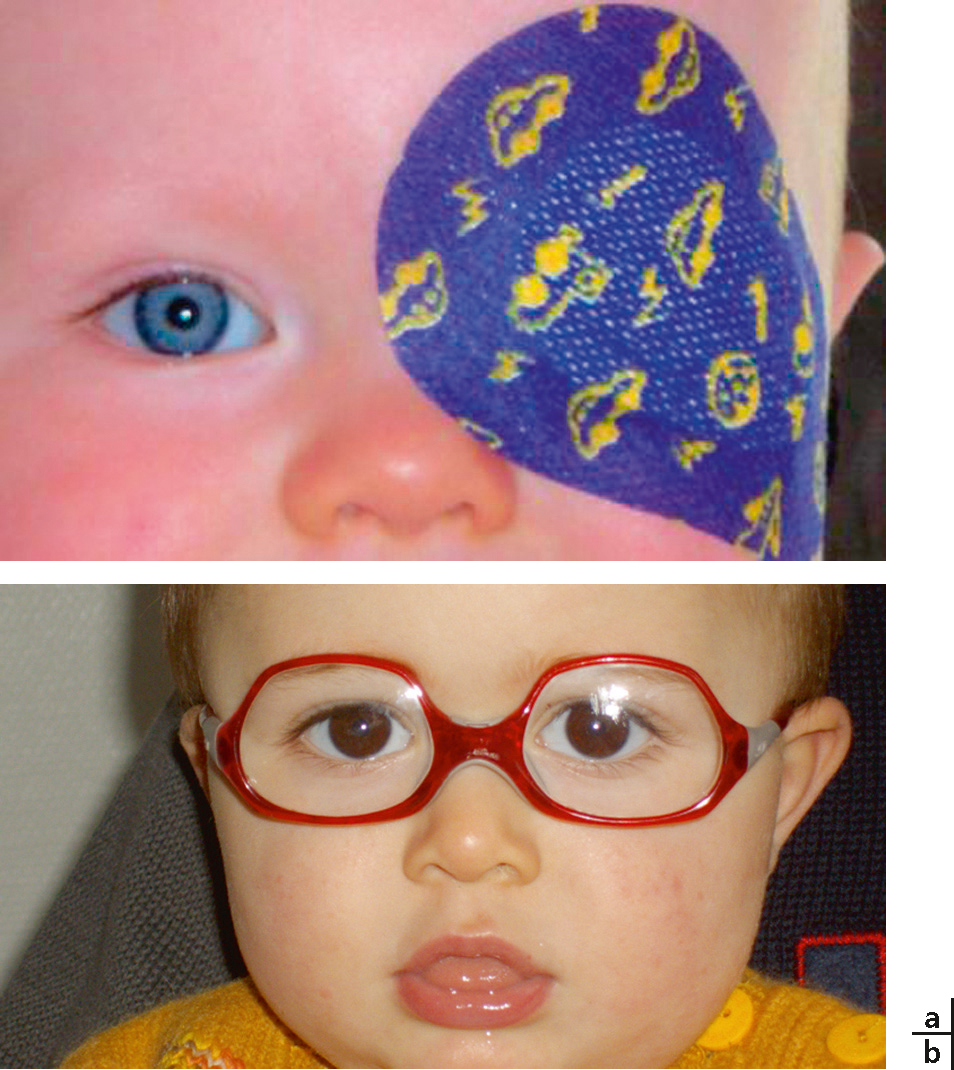
Fig. 5-21 a, b. Occlusion et correction optique, les deux instruments thérapeutiques précoces.
La monture doit être incassable et couvrir le champ visuel jusqu’au sourcil.
La sensibilisation des parents, des pédiatres et des médecins généralistes incite les parents à consulter au cours de la première année à la moindre alerte. En conséquence, l’amblyopie à l’âge scolaire a beaucoup régressé. La prévalence actuelle de l’amblyopie est de 1 à 4 %. Les orthoptistes se sont formés à l’examen précoce et orientent les enfants qui le justifient vers l’ophtalmologue spécialisé. Les modes de prise en charge font l’objet d’un large consensus [4] et sont bien supportés.
Les enfants porteurs de déficits sévères sont orientés vers les structures spécialisées disponibles localement – Centre d’action médico-sociale précoce [CAMSP], service d’accompagnement à l’acquisition de l’autonomie et à l’intégration scolaire [SAAAIS], service d’intégration des enfants aveugles et mal-voyants de Paris [SAFEP]. Outre le soutien parental essentiel après la découverte de la malvoyance, l’enfant sera éduqué pour optimiser ses capacités fonctionnelles et apprendre les conduites vicariantes pour pallier au mieux son déficit [5]1.
[1] Mohn G, Van Hof-Van Duin J. Development of the binocular and monocular visual fields in infants during the first year of life. Clin Vis Sci 1986 ; 1 : 51-64.
[2] Cioni G, Ipata, AE. MRI findings in children with cerebral visual impairment. In : Vital-Durand F, Atkinson J, Bradick O (Eds). Infant Vision. Oxford : Oxford University Press ; 1996. p. 372-82.
[3] Ego A, Lidzba K, Brovedani P, et al. Visual-perceptual impairment in children with cerebral palsy : a systematic review. Dev Med Child Neurol 2015 ; 57 Suppl 2 : 46-51.
[4] Laloum L. Le dépistage de l’amblyopie dès l’enfance. Point de Vue 2004 ; 51 : 12-5.
[5] Le Bail B, Gérin Roig F, Meyniel C. Prise en charge multidisciplinaire du handicap visuel et de la basse vision : livre blanc : à la découverte du monde de la déficience visuelle. ARIBa ; 2015. http://www.ariba-vision.org/sites/default/files/LIVRE%20BLANC.pdf.
1. Je remercie le Dr Sophie Boucher pour la relecture efficace de cette contribution.
R. Forte, P. -Y. Robert
La périmétrie du fond d’oeil ou micropérimétrie est utilisée pour évaluer la fonction maculaire et extramaculaire. L’intégration de l’imagerie du fond d’oeil avec l’évaluation du seuil différentiel à la lumière (sensibilité rétinienne) permet une corrélation entre anomalies rétiniennes et altérations fonctionnelles correspondantes. Bien que l’analyseur de champ Humphrey (Humphrey field analyzer [HFA]) puisse être utilisé pour évaluer la sensibilité maculaire centrale, son rôle dans le suivi de la maladie maculaire a été limité par l’impossibilité de quantifier avec précision les seuils rétiniens sur les lésions rétiniennes petites et discrètes et de tester à nouveau ces zones avec précision pendant le suivi. En réponse à ces limitations, le micropérimètre avec ophtalmoscope laser à balayage (scanning laser ophthalmoscopy [SLO]) a été développé [1], mais celui-ci ne permet pas l’évaluation automatique ni le suivi de la sensibilité rétinienne aux mêmes points. Aujourd’hui, de nouveaux appareils LCD équipés d’eye tracker (micropérimètre MP-1 ®, Nidek Technologies, Italie ; Spectral OCT/SLO® ; OPKO/ OTI®, Miami, États-Unis) permettent de corriger automatiquement les mouvements oculaires et d’évaluer la sensibilité rétinienne aux mêmes points pendant le suivi.
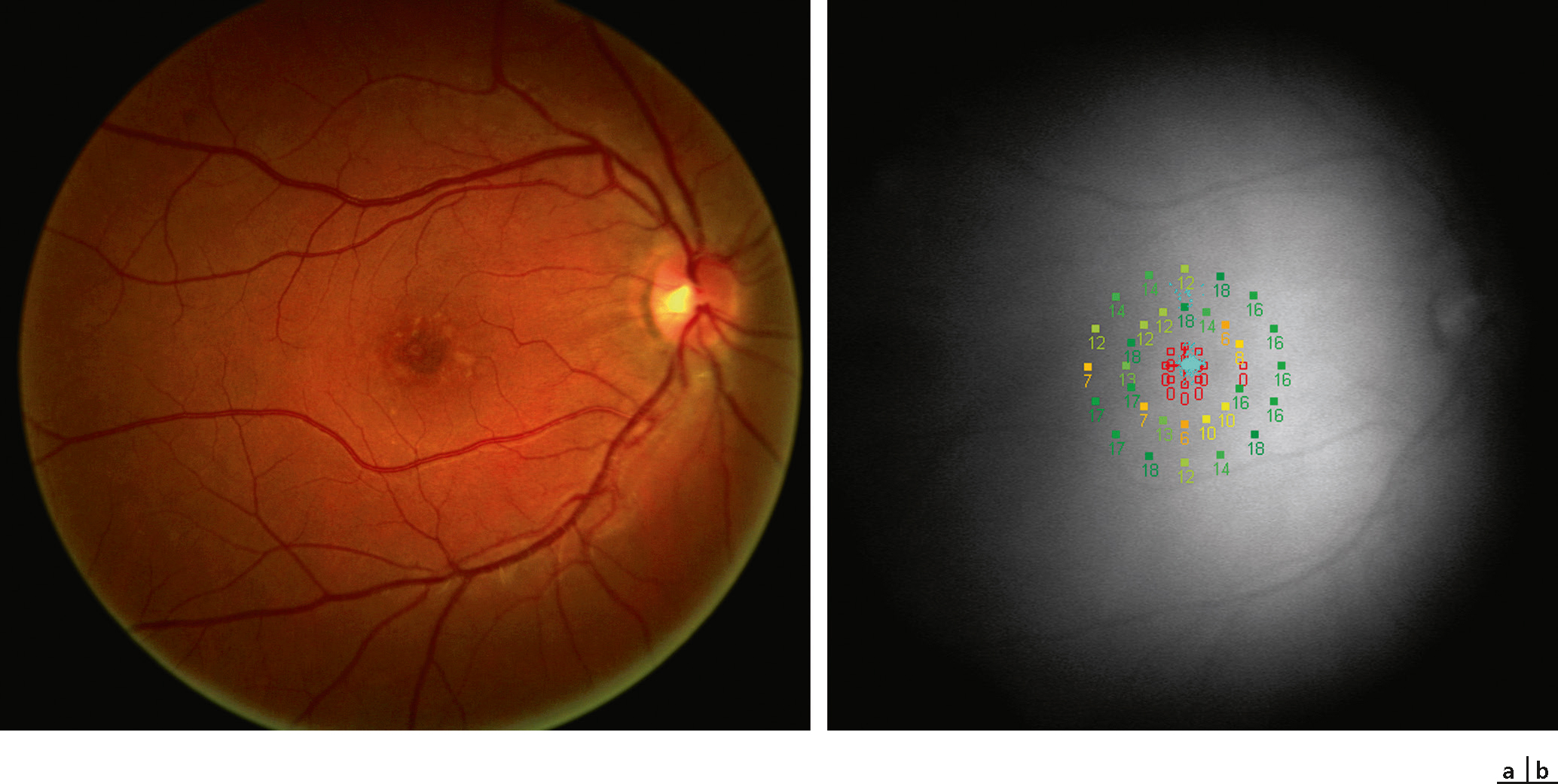
Fig. 5-22 Patient atteint de maladie de Stargardt.
Une réduction de la sensibilité rétinienne centrale avec fixation centrale stable (points bleus) est présente à la micropérimétrie MP-1®. a. Image couleur du fond d’oeil. b. Image infrarouge avec superposition des points évalués par micropérimétrie.
L’OCT/SLO® spectrale utilise un ophtalmoscope à balayage laser, et permet d’obtenir soit la tomographie par cohérence optique (OCT) avec cartographie des épaisseurs rétiniennes, soit une cartographie de la sensibilité rétinienne obtenue par micropérimétrie. Ces deux cartographies peuvent ainsi être superposées de manière exacte par le même appareil. Le micropérimètre MP-1 ® permet de visualiser l’image du fond d’oeil en utilisant une caméra infrarouge avec un champ de vision de 45 degrés. La périmétrie est effectuée en utilisant un écran à cristaux liquides commandé par un logiciel spécial. Avec micropérimètre, il est possible d’effectuer une périmétrie statique automatisée du fond d’oeil, une périmétrie automatisée cinétique ainsi que l’évaluation de points spécifiques de fixation et de lecture. Il est possible de superposer les résultats périmétriques sur les images obtenues avec d’autres instruments tels que les angiographies (par exemple avec le Heidelberg Retina Angiograph®) ou des images numériques du fond d’oeil. La micropérimétrie peut être utilisée pour évaluer les déficits et les changements de sensibilité maculaire au cours de maladies rétiniennes héréditaires (par exemple maladie de Stargardt, dystrophie à cônes prédominant, Fig. 5-22 et 5-23) [2], dégénératives (par exemple rétinopathie myopique, Fig. 5-24) [3–6], vasculaires (par exemple télangiectasies rétiniennes, occlusions veineuses, Fig. 5-25 et 5-26)) [7], dans la rétinopathie diabétique (Fig. 5-27 et 5-28)) [8-10], dans la dégénérescence maculaire liée à l’âge (Fig. 5-29) [11-23] et dans les anomalies de l’interface vitréorétinienne (par exemple membranes epirétiniennes, Fig. 5-30) [24].
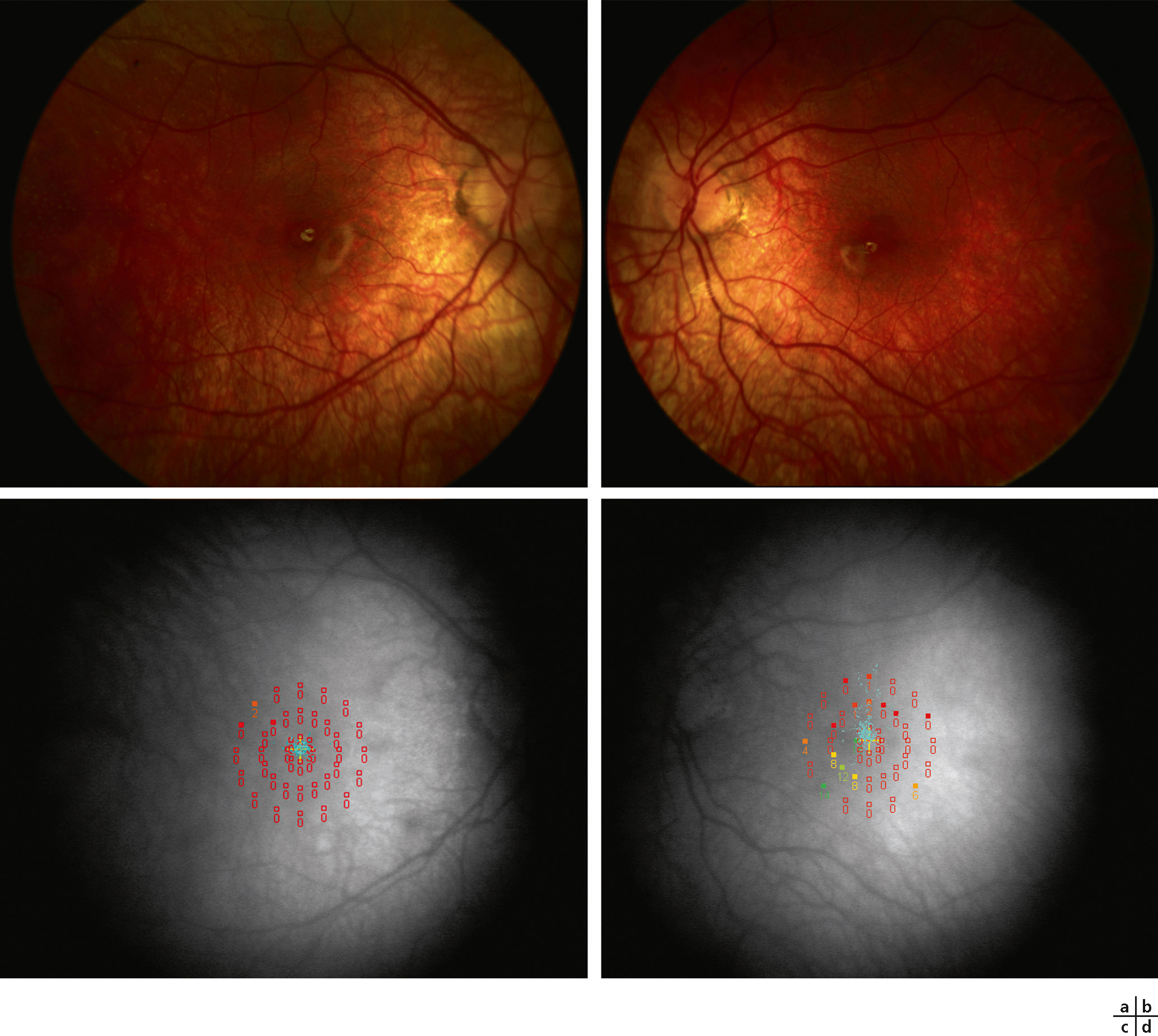
Fig. 5-23 Dystrophie à cônes prédominant.
Une réduction massive bilatérale de la sensibilité maculaire est présente à la micropérimétrie MP-1 ®. La fixation reste centrale et stable à droite, relativement instable à gauche.
a, b. Images en couleur du fond d’oeil. c, d. Images infrarouges avec superposition des points évalués par micropérimétrie.
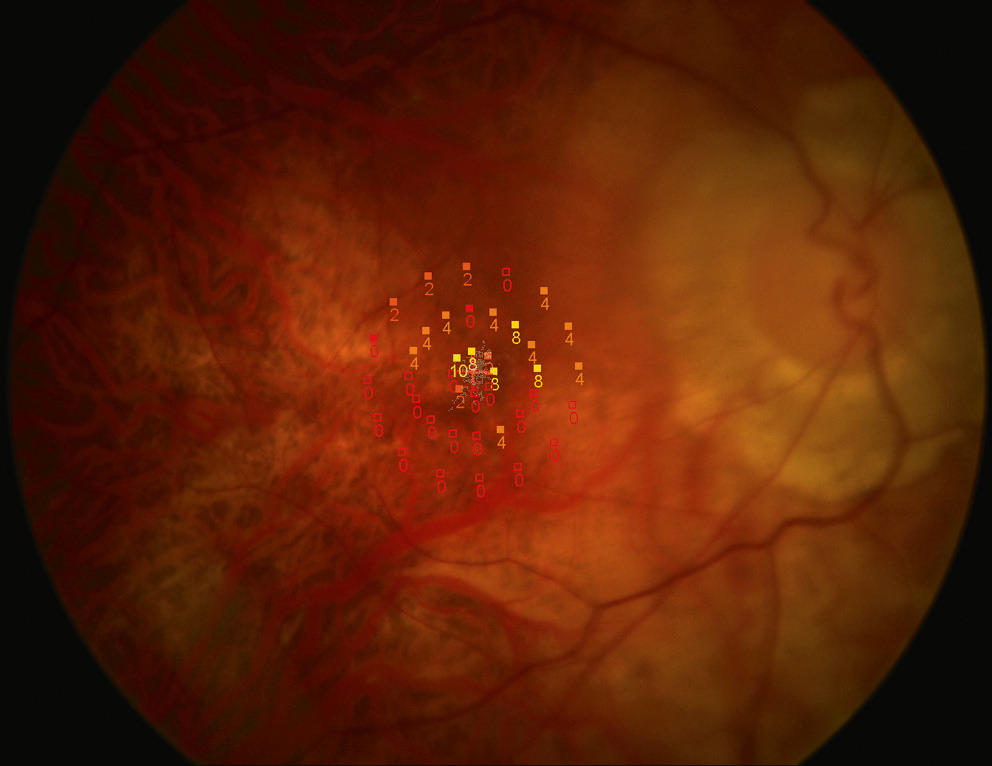
Fig. 5-24 Réduction importante de la sensibilité maculaire en présence d’une fixation centrale relativement instable chez un patient atteint de rétinopathie myopique.
La procédure d’évaluation de la fixation a suscité un intérêt non seulement dans les maladies maculaires, mais aussi dans le strabisme ou pour la détection de la simulation. Le SLO a le potentiel de recueillir des informations concernant le comportement de la fixation avec des niveaux de lumière mésopiques même au fil du temps. Cela implique que la stabilité et la position de la fixation anatomique peuvent être surveillées. Certaines maladies maculaires entraîneront des changements typiques des habitudes de fixation avec un mouvement presque pathognomonique, comme dans la maladie de Stargardt. Les patients avec un scotome profond ou absolu central changent les coordonnées de la fixation et développent un nouveau site de fixation dit locus rétinien préféré (preferred retinal locus [PRL] ; voir sous-chapitre suivant).

Fig. 5-25 Moindre réduction de la sensibilité rétinienne centrale et fixation centrale stable chez un patient atteint de télangiectasies rétiniennes juxtafovéolaires.
a. Image couleur du fond d’oeil. b. Image infrarouge avec superposition des points évalués par micropérimétrie.

Fig. 5-26 Scotome maculaire absolu et perte de la fixation dans un oeil atteint d’une thrombose veineuse centrale rétinienne.
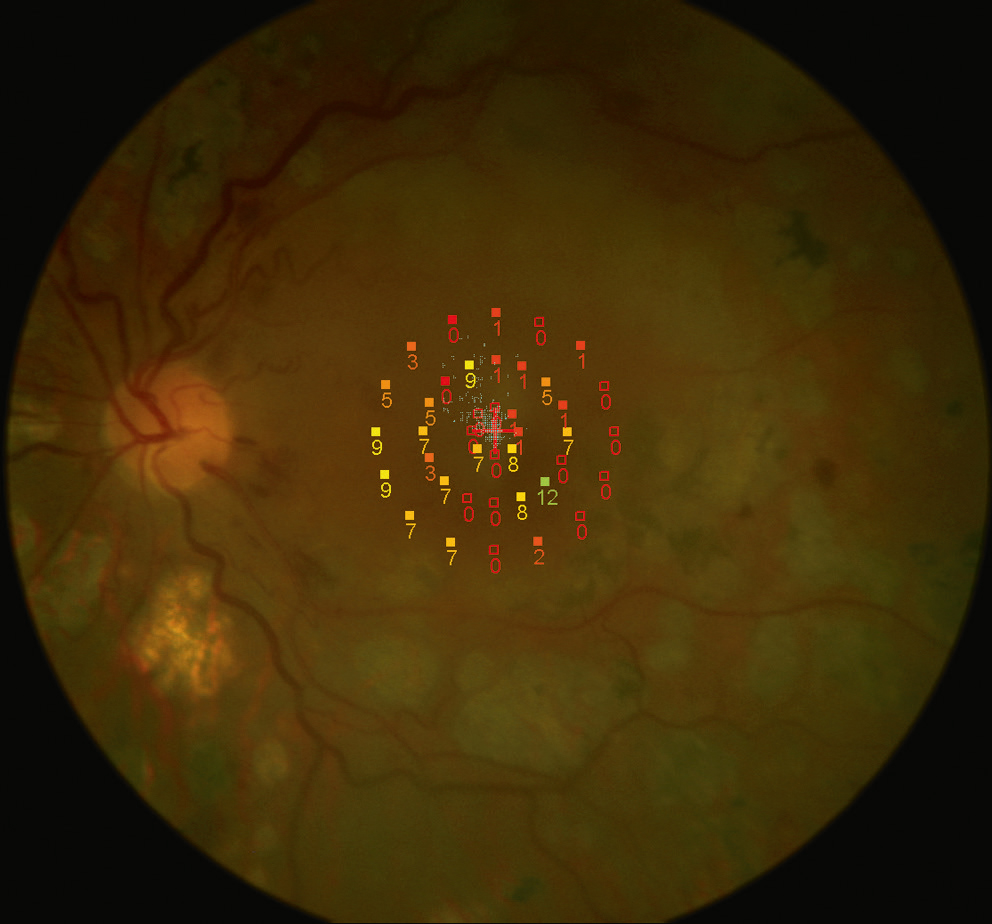
Fig. 5-27 Micropérimétrie MP-1 ® montrant une réduction de la sensibilité maculaire et une fixation centrale relativement instable dans un oeil atteint de rétinopathie diabétique ischémique.
Les micropérimètres les plus récents intègrent un appareil photographique couleur pour l’enregistrement de l’image du fond d’oeil et un système de suivi automatique pour évaluer avec précision la sensibilité rétinienne dans le champ visuel central, même chez les patients avec fixation instable ou extrafovéolaire. Une lumière infrarouge (IR) est produite par une source IR et est projetée sur la rétine de l’oeil examiné. La lumière IR permet d’utiliser de faibles niveaux de luminance rétinienne, avec la possibilité d’avoir une irradiation suffisante pour obtenir l’image du fond d’oeil. Une camera CCD (charge coupled device) enregistre en noir et blanc une image rétinienne, avec une résolution de 768 × 576 pixels à 25 Hz (une image toutes les 40 ms). Au même moment, une caméra couleur prend des photographies du fond d’oeil avec une résolution de 1392 × 1040 pixels, et un angle de champ de 45 degrés. Le système peut corriger les erreurs réfractives entre –12,5 et +16 dioptries. Un LCD interne à l’appareil (6,5″ LCD, 640 × 480 pixels) sert de système de projection, et les images projetées sont unies optiquement avec le capteur CCD de la caméra infrarouge. La superposition optique entre le pattern montré et l’image du fond d’oeil acquise permet une corrélation 1:1 entre chaque point du plan de projection et chaque point de la rétine visualisé à travers le CCD.
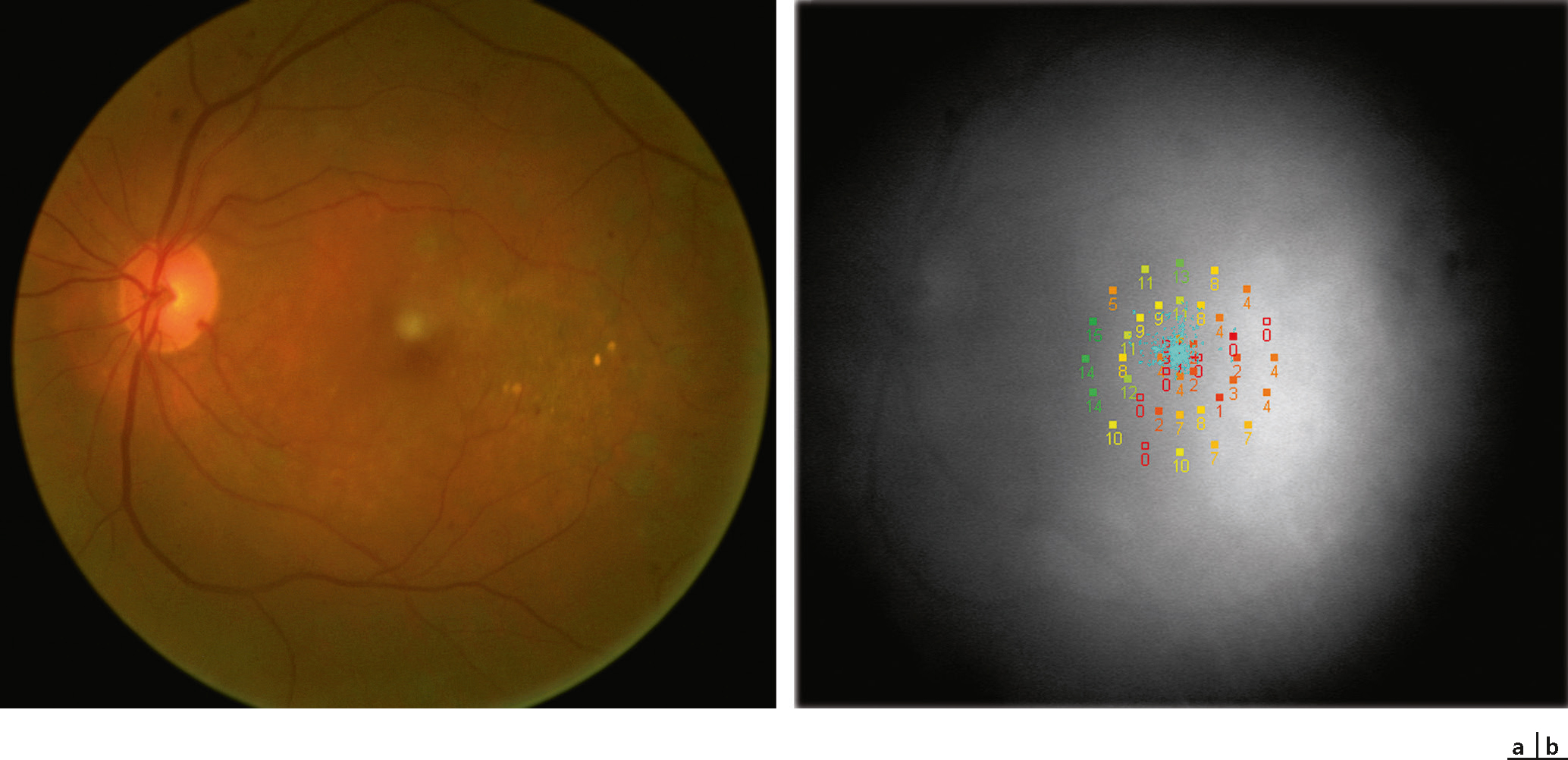
Fig. 5-28 Réduction centrale et temporale de la sensibilité maculaire et fixation centrale relativement instable chez un patient ayant un oedème maculaire diabétique.
a. Image couleur du fond d’oeil. b. Image infrarouge avec superposition des points évalués par micropérimétrie.
Fig. 5-29 Patient avec pseudodrusen réticulaires évalué avec Spectral OCT/SLO®.
En haut, image topographique des épaisseurs rétiniennes à la tomographie par cohérence optique (OCT) superposée à la cartographie de la sensibilité rétinienne obtenue par micropérimétrie. En bas, coupe longitudinale OCT passant par la fovéa qui montre les dépôts localisés entre neuroépithélium et épithélium pigmenté.
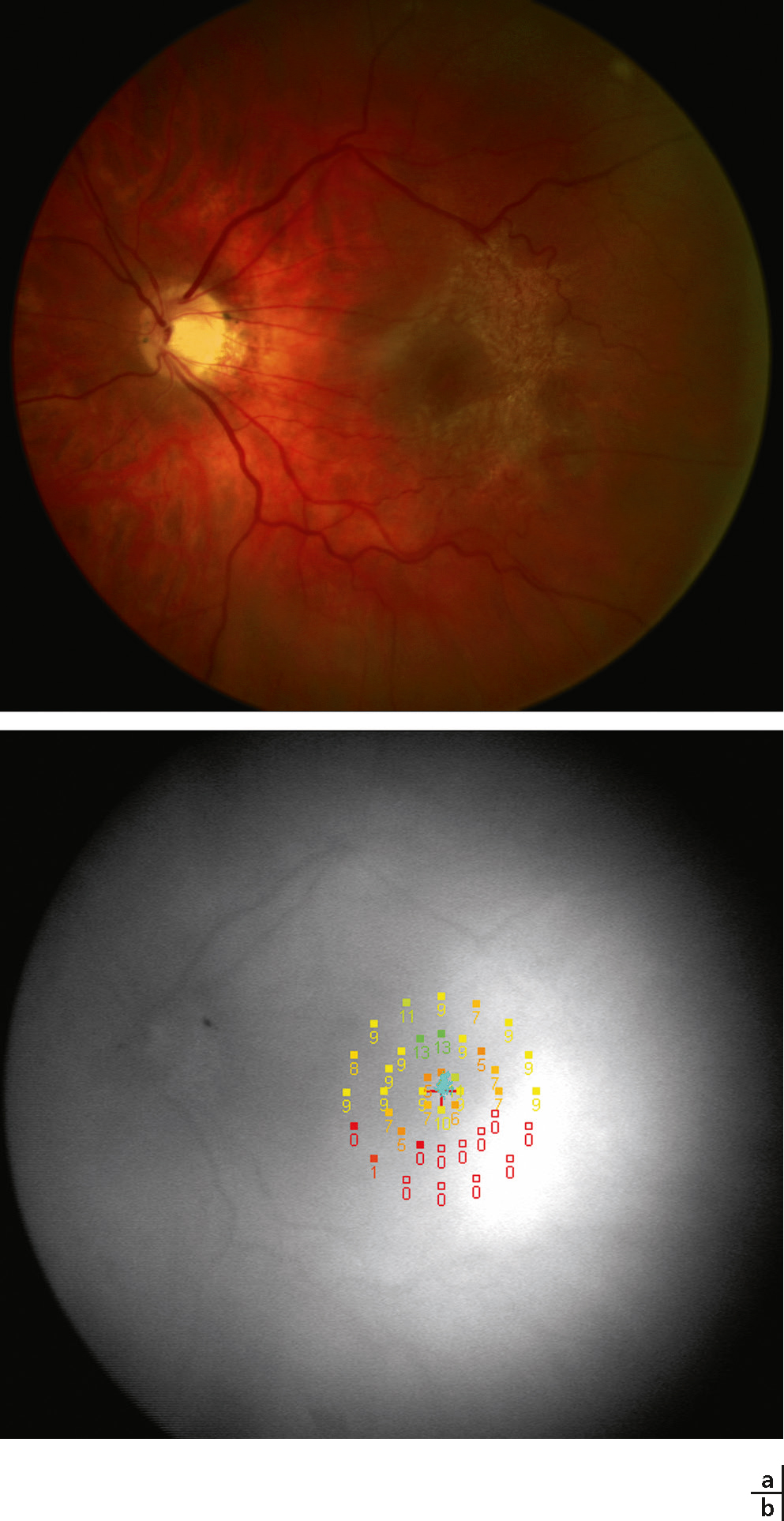
Fig. 5-30 Réduction sectorielle de la sensibilité maculaire et fixation centrale stable associées à une fibrose prérétinienne au pôle postérieur.
a. Image couleur du fond d’oeil. b. Image infrarouge avec superposition des points évalués par micropérimétrie.
Avec le MP-1 de Nidek, les stimulations sont présentées sur un arrière-plan blanc de 1,27 cd/m2 (= 4 asb).
Le test avec le MP-1 ® est un test mésopique et une adaptation (5 à 10 minutes) des yeux du patient à la baisse de la lumière est requise. Le test peut être fait en présence d’un diamètre pupillaire minimal de 3 mm, mais un diamètre de 4 mm ou plus est conseillé pour obtenir une qualité d’image et de test idéale.
L’opérateur choisit dans un menu de patterns le test qui peut être projeté sur la zone cible. L’opérateur peut modifier le nombre, ainsi que la densité, des points testés à l’intérieur du polygone d’essai, qui peut être centré sur toutes les zones maculaires choisies par l’opérateur. L’opérateur peut également choisir une stratégie de déclenchement à employer lors de l’examen. Une stratégie 4-2-1 en fourchette sera plus précise qu’une stratégie 4-2, mais elle prend plus de temps et il existe ainsi un risque de fatiguer les patients. Par conséquent, la stratégie du test désigné sera toujours un compromis entre la précision et le temps requis pour le test.
Chaque stimulation consiste en une présentation brève du test de luminance sélectionné dans l’arrière-plan LCD. Le patient fixe une cible, plus fréquemment représentée par une croix de taille (0,5 à 20 degrés), d’épaisseur et de couleur variables. Il est aussi possible d’utiliser quatre croix ou un cercle comme cible de fixation paracentrale ; c’est indiqué chez les patients avec un scotome central récent, une fixation instable et en l’absence d’un site de fixation préférentiel. Les croix ou le cercle standard sont rouges avec une luminance de 100 asb. Le patient rapporte la perception de la stimulation en appuyant sur un bouton. La stimulation lumineuse varie de 0 à 20 dB, sur une échelle avec incréments de 1 dB. La taille des stimulations peut varier selon l’échelle Goldmann entre I et V (6,5 à 103 min/arc), la taille III étant la plus utilisée à cause de la haute fiabilité topographique, tandis qu’une taille I peut être utilisée pour évaluer des petits scotomes (par exemple un trou maculaire). La forme de la stimulation (ou des figures) peut être customisée par l’opérateur. La durée de chaque stimulation peut varier de 100 ms à 2000 ms, les temps entre 100 ms et 200 ms étant les plus utilisés. L’examinateur peut choisir entre trois différentes stratégies topographiques de présentation des stimulations : automatique (présentation randomisée par la machine sur une grille préexistante), semi-automatique (limites de la zone stimulée fixées par l’examinateur, grille cartésienne produite par la machine entre ces limites) et manuelle (l’examinateur choisit la position et la luminance de chaque stimulation). Un scotome dense ou absolu (0 dB) est défini comme l’absence de perception d’un stimulus avec luminosité maximale. Un scotome relatif est défini comme la réduction de la sensibilité de seuil par rapport à l’âge et la zone rétinienne examinée. En début ou à la fin du test, l’examinateur peut prendre un cliché couleur du fond d’oeil qui peut être aligné sur le cliché IR de référence, pour superposer les résultats fonctionnels obtenus sur le cliché couleur. Le tracking automatique des mouvements oculaires est fait en temps réel pendant le test et mesure l’écart vertical et horizontal de l’oeil par rapport à une image de référence acquise en début du test, en permettant de corriger continuellement la position de la stimulation par rapport à la position courante du fond d’oeil. Le temps requis pour le tracking est négligeable par rapport au temps qui passe entre deux images consécutives (25 Hz). L’appareil compare les valeurs obtenues avec une base de données normatives selon l’âge [25].Le suivi du test est automatique dans les mêmes points rétiniens testés lors du premier examen et se fonde sur des points de référence anatomiques. Une carte différentielle montre le seuil lumineux différentiel pour le suivi de la maladie.
[1] Andersen MVN. Scanning laser ophthalmoscope microperimetry compared with octopus in normal subjects. Acta Ophthalmol Scand 1996 ; 74 : 135-9.
[2] Bernstein A, Sunness JS, Applegate CA, Tegins EO. Mapping the dense scotoma and its enlargement in stargardt disease. Retina 2016 ; 36(9) : 1741-50.
[3] Zaben A, Zapata MÁ, Garcia-Arumi J. Retinal sensitivity and choroidal thickness in high myopia. Retina 2015 : 35(3) : 398-406.
[4] Ikuno Y, Sayanagi K, Ohji M, et al. Vitrectomy and internal limiting membrane peeling for myopic foveoschisis. Am J Ophthalmol 2004 ; 137(4) : 719-24.
[5] Sakimoto S, Ikuno Y, Fujimoto S, et al. Characteristics of the retinal surface after internal limiting membrane peeling in highly myopic eyes. Am J Ophthalmol 2014 ; 158(4) : 762-8.e1.
[6] Ripandelli G, Rossi T, Scarinci F, et al. Macular vitreoretinal interface abnormalities in highly myopic eyes with posterior staphyloma : 5-year follow-up. Retina 2012 ; 32(8) : 1531-8.
[7] Winterhalter S, Vom Brocke GA, Klamann MK, et al. Monthly microperimetry (MP1) measurement of macular sensitivity after dexamethasone implantation (Ozurdex) in retinal vein occlusions. Graefes Arch Clin Exp Ophthalmol 2015 ; 253(11) : 1873-82.
[8] Forte R, Cennamo G, Finelli ML, et al. Retinal micropseudocysts in diabetic retinopathy : prospective functional and anatomic evaluation. Ophthalmic Res 2012 : 48(1) : 6-11.
[9] Midena E, Bini S. Multimodal retinal imaging of diabetic macular edema : toward new paradigms of pathophysiology. Graefes Arch Clin Exp Ophthalmol 2016 ; 254(9) : 1661-8.
[10] Vujosevic S, Casciano M, Pilotto E, et al. Diabetic macular edema : fundus autofluorescence and functional correlations. Invest Ophthalmol Vis Sci 2011 ; 52(1) : 442-8.
[11] Wu Z, Ayton LN, Luu CD, Guymer RH. Longitudinal changes in microperimetry and low luminance visual acuity in age-related macular degeneration. JAMA Ophthalmol 2015 ; 133(4) : 442-8.
[12] Forte R, Cennamo G, de Crecchio G, Cennamo G. Microperimetry of subretinal drusenoid deposits. Ophthalmic Res 2014 ; 51(1) : 32-6.
[13] Querques G, Srour M, Massamba N, et al. Functional characterization and multimodal imaging of treatment-naive “quiescent” choroidal neovascularization. Invest Ophthalmol Vis Sci 2013 ; 54(10) : 6886-92.
[14] Querques G, Kamami-Levy C, Georges A, et al. Adaptive optics imaging of foveal sparing in geographic atrophy secondary to age-related macular degeneration. Retina 2016 ; 36(2) : 247-54.
[15] Querques G, Massamba N, Srour M, et al. Impact of reticular pseudodrusen on macular function. Retina 2014 ; 34(2) : 321-9.
[16] Wu Z, Ayton LN, Luu CD, Guymer RH. Microperimetry of nascent geographic atrophy in age-related macular degeneration. Invest Ophthalmol Vis Sci 2014 ; 56(1) : 115-21.
[17] Forte R, Querques G, Querques L, et al. Multimodal evaluation of foveal sparing in patients with geographic atrophy due to age-related macular degeneration. Retina 2013 ; 33(3) : 482-9.
[18] Querques L, Querques G, Forte R, Souied EH. Microperimetric correlations of autofluorescence and optical coherence tomography imaging in dry age-related macular degeneration. Am J Ophthalmol 2012 ; 153(6) : 1110-5.
[19] Wu Z, Cunefare D, Chiu E, et al. Longitudinal associations between microstructural changes and microperimetry in the early stages of age-related macular degeneration. Invest Ophthalmol Vis Sci 2016 ; 57(8) : 3714-22.
[20] Takahashi A, Ooto S, Yamashiro K, et al. Photoreceptor damage and reduction of retinal sensitivity surrounding geographic atrophy in age-related macular degeneration. Am J Ophthalmol 2016 ; 168 : 260-8.
[21] Pilotto E, Convento E, Guidolin F, et al. Microperimetry features of geographic atrophy identified with en face optical coherence tomography. JAMA Ophthalmol 2016 ; 134(8) : 873-9.
[22] Pilotto E, Guidolin F, Convento E, et al. Progressing geographic atrophy : choroidal thickness and retinal sensitivity identify two clinical phenotypes. Br J Ophthalmol 2015 ; 99(8) : 1082-6.
[23] Pilotto E, Guidolin F, Convento E, et al.. Fundus autofluorescence and microperimetry in progressing geographic atrophy secondary to age-related macular degeneration. Br J Ophthalmol 2013 ; 97(5) : 622-6.
[24] Ripandelli G, Scarinci F, Piaggi P, et al. Macular pucker : to peel or not to peel the internal limiting membrane ? A microperimetric response. Retina 2015 ; 35(3) : 498-507.
[25] Midena E, Vujosevic S, Cavarzeran F ; Microperimetry Study Group. Normal values for fundus perimetry with the microperimeter MP1. Ophthalmology 2010 ; 117(8) : 1571-6, 1576.e1
M. -P. Beaunoir , C. Dubois-Roussel , S. Bonnin, J. Benammar
Les recherches sur la micropérimétrie ont débuté il y a plusieurs dizaines d’années et s’intéressaient initialement à la réhabilitation de personnes malvoyantes dans le cadre de la rééducation basse vision. L’examen micropérimétrique combine l’analyse de la sensibilité rétinienne et l’analyse de la fixation en un même examen.
La perte de la vision centrale entraînée par les pathologies maculaires conduit à des phénomènes d’adaptation qui surviennent rapidement après l’atteinte maculaire pour tenter de compenser la perte fonctionnelle en optimisant la vision résiduelle [1].
Un de ces phénomènes d’adaptation est le développement de zones de fixation préférentielles extrafovéolaires ou preferred retinal loci (PRL). Les PRL sont définis comme des zones de rétine uniques ou multiples alignées avec la cible visuelle et pouvant servir de référence au système oculomoteur pour une tâche donnée [2]. Les zones les plus proches de la fovéa et avec la plus grande sensibilité semblent être les mieux adaptées pour assumer la fonction maculaire perdue, mais ces PRL peuvent être situés plus à distance du centre anatomique. Ces PRL sont souvent multiples en cas d’atteinte maculaire récente ou de scotome annulaire [3]. Une fixation excentrique apparaît de façon naturelle et fiable lorsque la fovéa n’est plus fonctionnelle dans les deux yeux et que le patient présente un scotome central bilatéral. Lorsqu’il existe une différence d’acuité visuelle, le système visuel utilise le PRL du meilleur oeil, et le PRL de l’oeil dominant en cas d’iso-acuité [4].
En pratique, le micropérimétrie permet de réaliser un test de périmétrie: il se réalise de la même façon qu’une périmétrie automatisée : le modèle et la stratégie d’examen peuvent être choisis ou créés, et l’utilisation d’un eye-tracking garantit la position des points testés sur la rétine. Ce test permet de réaliser une image du fond d’oeil sur laquelle est plaquée la cartographie de sensibilité (Fig. 5-31).
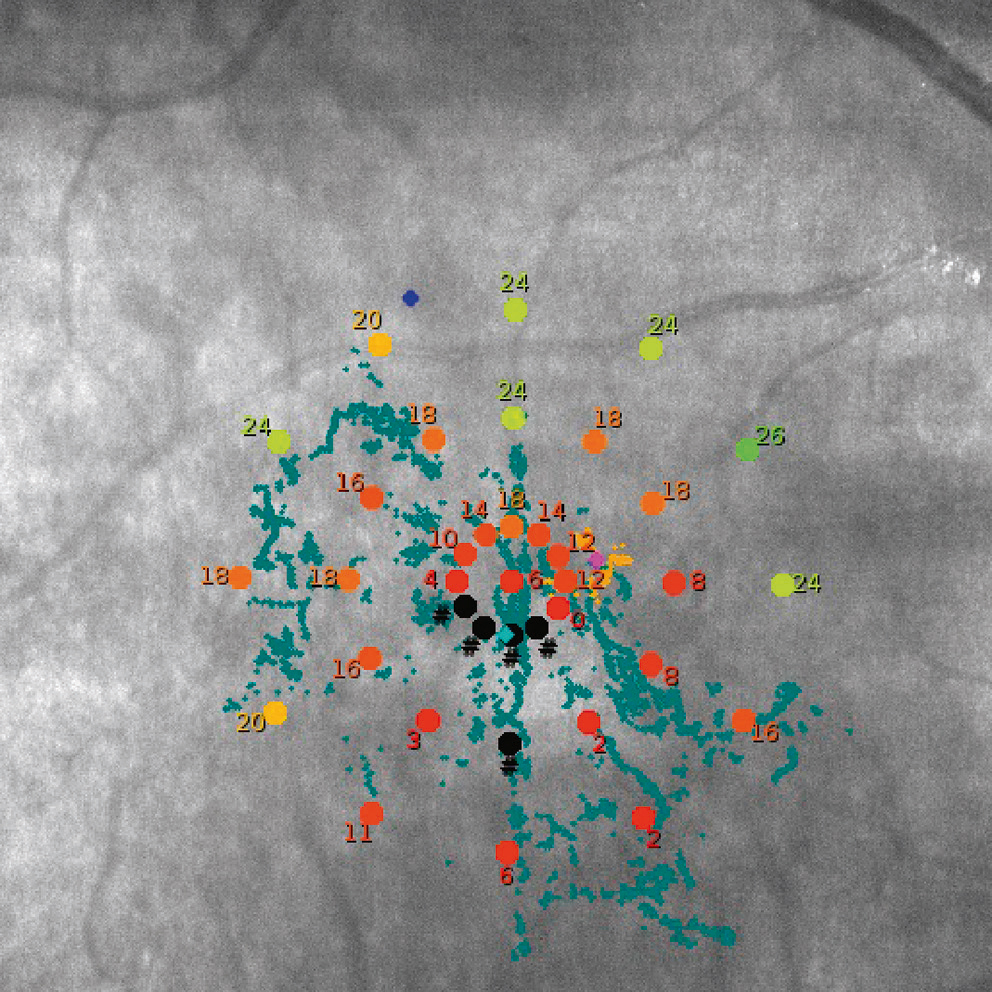
Fig. 5-31 Cartographie de sensibilité rétinienne réalisée à l’aide du MAIA® (CenterVue, Padoue, Italie).
Maculopathie diabétique, oeil droit. Les nuages de points jaunes et bleus correspondent aux points rétiniens utilisés pour fixer en début puis tout au long de l’examen.
La majorité des PRL retrouvés chez des patients atteints de dégénérescence maculaire liée à l’âge (DMLA) sont localisés dans le quadrant supérieur droit de la rétine correspondant au champ visuel inférieur gauche quel que soit l’oeil atteint [4, 5]. Cette situation préférentielle du PRL serait due à l’importance du champ visuel inférieur dans les déplacements et au sens habituel de lecture de gauche à droite des populations étudiées (Fig. 5-32). Dans la maladie de Stargardt comme dans d’autres dystrophies maculaires, le PRL est aussi le plus souvent situé dans la partie supérieure de la rétine [6]. Une étude récente a montré que, chez les patients présentant une atteinte maculaire, le PRL pouvait être différent selon la tâche à effectuer : fixation d’une cible ou lecture [7]. Pour d’autres, après une phase d’adaptation à la perte de la vision centrale, l’oeil développerait une seule zone rétinienne préférentielle utilisée avec des schémas de fixation différents selon la tâche à effectuer [8].
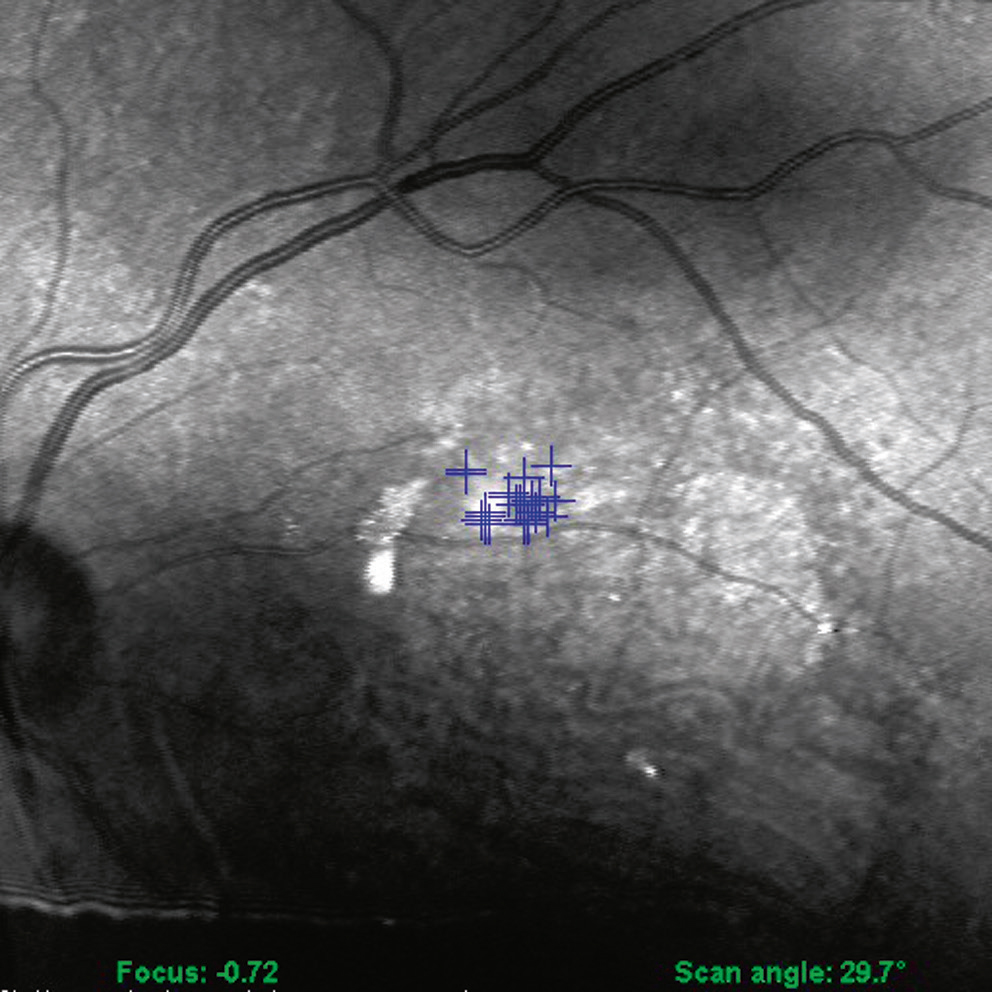
Fig. 5-32 Micropérimétrie réalisée avec l’appareil OPKO/OTI® utilisant la technologie OCT-SLO, temps de fixation 20 secondes.
DMLA atrophique, avec fixation au-dessus et à droite de la lésion.
L’autre aspect de la fixation évaluée par la micropérimétrie est sa stabilité. Elle est mesurée par la surface de dispersion des points formant le PRL. Lors de ce test de fixation, la personne doit fixer le plus précisément une cible sur un temps défini (ou au cours de la périmétrie). Le résultat du test s’affiche sous forme d’un nuage de points ou de croix placé sur l’image du fond d’oeil, plus ou moins étendu, et dont la surface témoigne du degré de stabilité (Fig. 5-33).
Une relation directe entre une meilleure acuité visuelle et une fixation plus stable a été montrée après chirurgie pour trou maculaire [9] et après traitement d’une DMLA par anti-VEGF (vascular endothelial growth factor) [5, 10]. Les appareils récents donnent automatiquement une estimation précise de la stabilité de la fixation en calculant le pourcentage de points situés dans les 2 et 4° autour du PRL. Pour la majorité des appareils, si plus de 75 % des points de fixation se trouvent dans un cercle de 2° centré sur le barycentre de tous les points de fixation (PRL), la fixation est classée comme étant stable ; si moins de 75 % des points de fixation se trouvent dans un cercle de 2°, mais plus de 75 % des points se trouvent dans un cercle de 4°, la fixation est classée comme étant relativement instable, et si moins de 75 % des points de fixation se trouvent dans un cercle de 4°, la fixation est classée comme étant instable. La stabilité de la fixation peut aussi être suivie par un indice : la BCEA (bivariate contour ellipse area). Exprimée en degrés au carré, elle correspond à une ellipse calculée à partir des déviations standard des mouvements oculaires sur l’axe horizontal et sur l’axe vertical. Il a été montré qu’en l’absence de vision binoculaire, la fixation du moins bon oeil est plus instable que la fixation du meilleur oeil. Lorsqu’elle est préservée, la binocularité améliore la stabilité du mauvais oeil sans compromettre la stabilité de fixation du meilleur oeil [11].
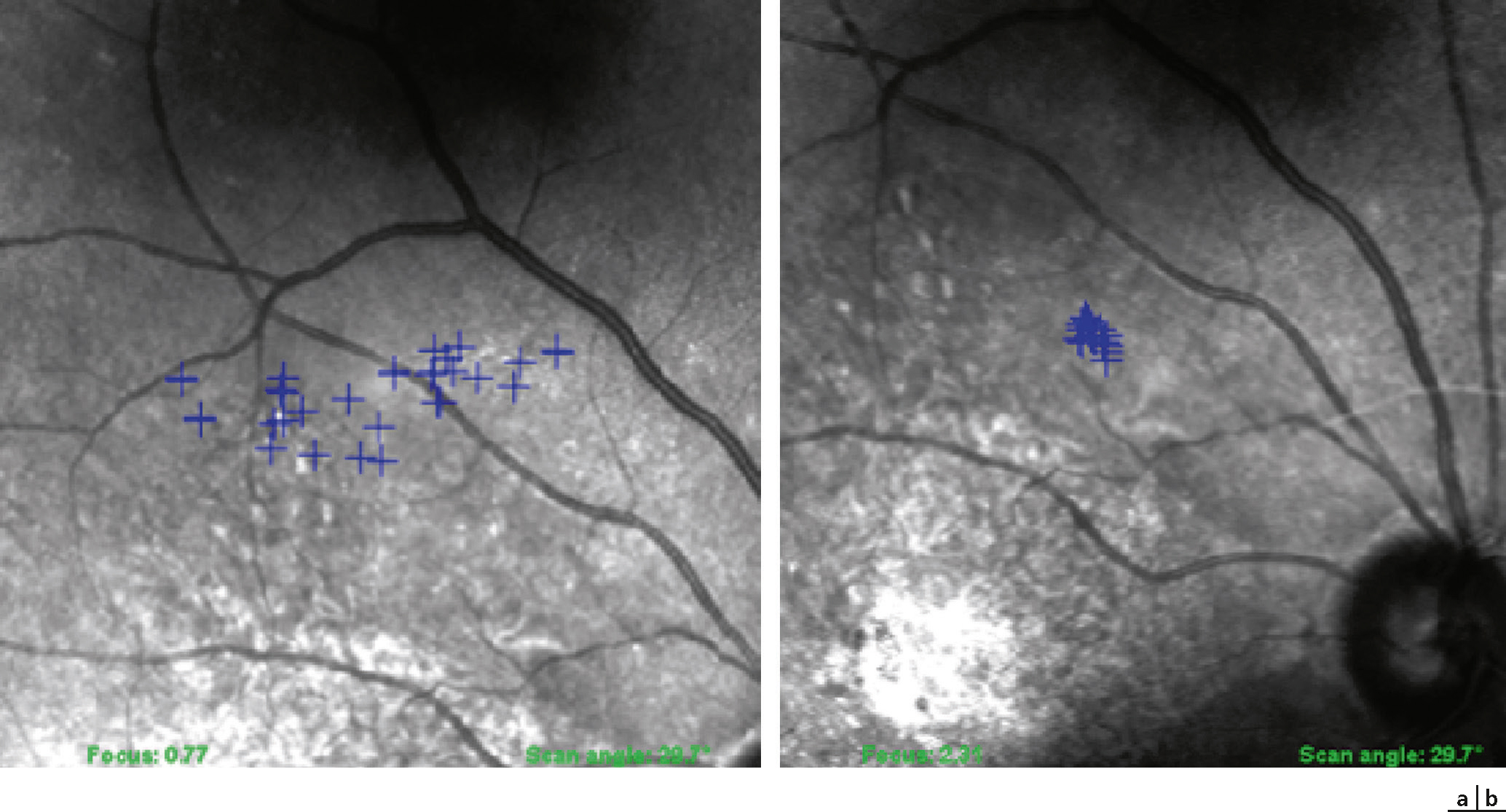
Fig. 5-33 Micropérimétrie réalisée avec l’appareil OPKO/OTI® avec la technologie OCT-SLO, temps de fixation 20 secondes.
Aspect de la fixation : modification de la fixation (stabilité et localisation) d’une patiente avant (a) et après (b) une période de lecture intensive avec son système grossissant 8 fois : le nuage de points se resserre et se rapproche du bord de la lésion.
Plusieurs études ont préalablement évalué la fixation dans l’oedème maculaire diabétique (OMD). Certains auteurs considèrent que la localisation et la stabilité de la fixation seraient indépendantes des caractéristiques de l’oedème (topographie, existence d’un décollement séreux rétinien) en dehors des cas présentant des exsudats rétrofovéolaires de grande taille [12], alors que d’autres montrent une relation directe entre le degré d’oedème maculaire cystoïde et l’instabilité de la fixation [13]. Dans cette dernière étude portant sur 84 yeux, 59,5 % avaient une fixation instable ou relativement instable et l’acuité visuelle était plus fortement corrélée à la stabilité de la fixation qu’à son degré d’excentricité. Dans cette étude, une durée plus longue d’évolution de l’OMD était corrélée à une fixation plus stable ; les auteurs expliquent ce résultat par le délai d’apprentissage et de stabilisation de la fixation autour d’un nouveau PRL excentré.
À travers une étude prospective de patients présentant un oedème maculaire diabétique chronique réfractaire et traités par une injection intravitréenne de fluocinolone, la micropérimétrie semblait plus sensible que l’acuité visuelle pour évaluer la réponse fonctionnelle à un traitement en cas d’OMD chronique [14].
Nous avons vu que les micropérimètres permettaient d’effectuer à la fois des tests de sensibilité et de fixation rétinienne. De plus, selon les micropérimètres, l’image du fond d’oeil et de la sensibilité rétinienne peut être couplée à un examen en tomographie par cohérence optique, ce qui facilite la localisation de la fovéa sur la cartographie de sensibilité (Fig. 5-34).
Il est possible d’orienter son examen en choisissant parmi les options proposées par l’appareil celles qui conviendront le mieux en fonction du patient et de l’attente de l’orthoptiste.
Le micropérimètre visualise sur l’image du fond d’oeil tous les points rétiniens utilisés au cours de l’observation d’une croix projetée sur la rétine pendant 5 à 20 secondes. Ainsi, il est possible de juger de la zone rétinienne mise en jeu pour fixer et de sa stabilité (d’après l’étude de la dispersion des points) (Fig. 5-35). La cartographie rétinienne permet donc d’objectiver les zones rétiniennes atteintes et indemnes, en précisant à la fois leur degré d’excentricité, leur surface et leur localisation. L’intérêt majeur de ces appareils est de pouvoir situer chaque point rétinien par rapport à la fovéa dont l’emplacement sera déterminé à l’aide soit de l’image SLO (scanning laser ophthalmoscopy) du fond d’oeil, soit de l’examen en tomographie par cohérence optique selon le type de micropérimètre utilisé (voir Fig. 5-34). Ces nouveaux outils offrent ainsi le moyen de définir l’emplacement réel des zones atteintes et des zones préservées en ayant la connaissance exacte de la localisation fovéolaire, et c’est une nouveauté pour l’orthoptiste. Jusqu’à aujourd’hui, les appareils de périmétrie, s’ils étaient en mesure de quantifier les déficits, ne permettaient pas d’avoir une certitude sur leur position, d’autant plus que l’atteinte maculaire rend difficile la fixation et que le scotome se retrouve, au gré de l’excentration du patient, faussement déplacé, la plupart du temps au-dessus et à droite du point de fixation.
Les micropérimètres sont en conséquence un support d’explication très utile face au questionnement des patients et de leur entourage : devant l’image de leur fond d’oeil sur laquelle figurent non seulement les zones rétiniennes atteintes, mais aussi la stratégie mise en place pour compenser ou contourner leur difficulté, les commentaires aident à saisir à la fois les raisons des gênes, et l’intérêt de la prise en charge réadaptative.
Lors de l’examen d’évaluation, l’orthoptiste observe et écoute le patient au cours de la tâche de lecture en particulier, ce qui lui permet de poser des hypothèses et de fixer des axes de rééducation. La micropérimétrie permet de confirmer ou d’infirmer ces hypothèses. Il arrive effectivement que les suppositions initiales ne soient pas en accord avec les résultats du test de fixation. Dans ce cas, l’orthoptiste évite de donner des directions inappropriées au patient, et optimise la rééducation.
De façon assez rare, le rééducateur peut tenter de mettre en place une excentration non nécessaire, ou inversement penser que l’excentration n’est pas à envisager alors que le patient utilise une fixation interpapillomaculaire (Fig. 5-36) ou une zone parafovéolaire avec un comportement très proche de celui d’une préservation centrale.
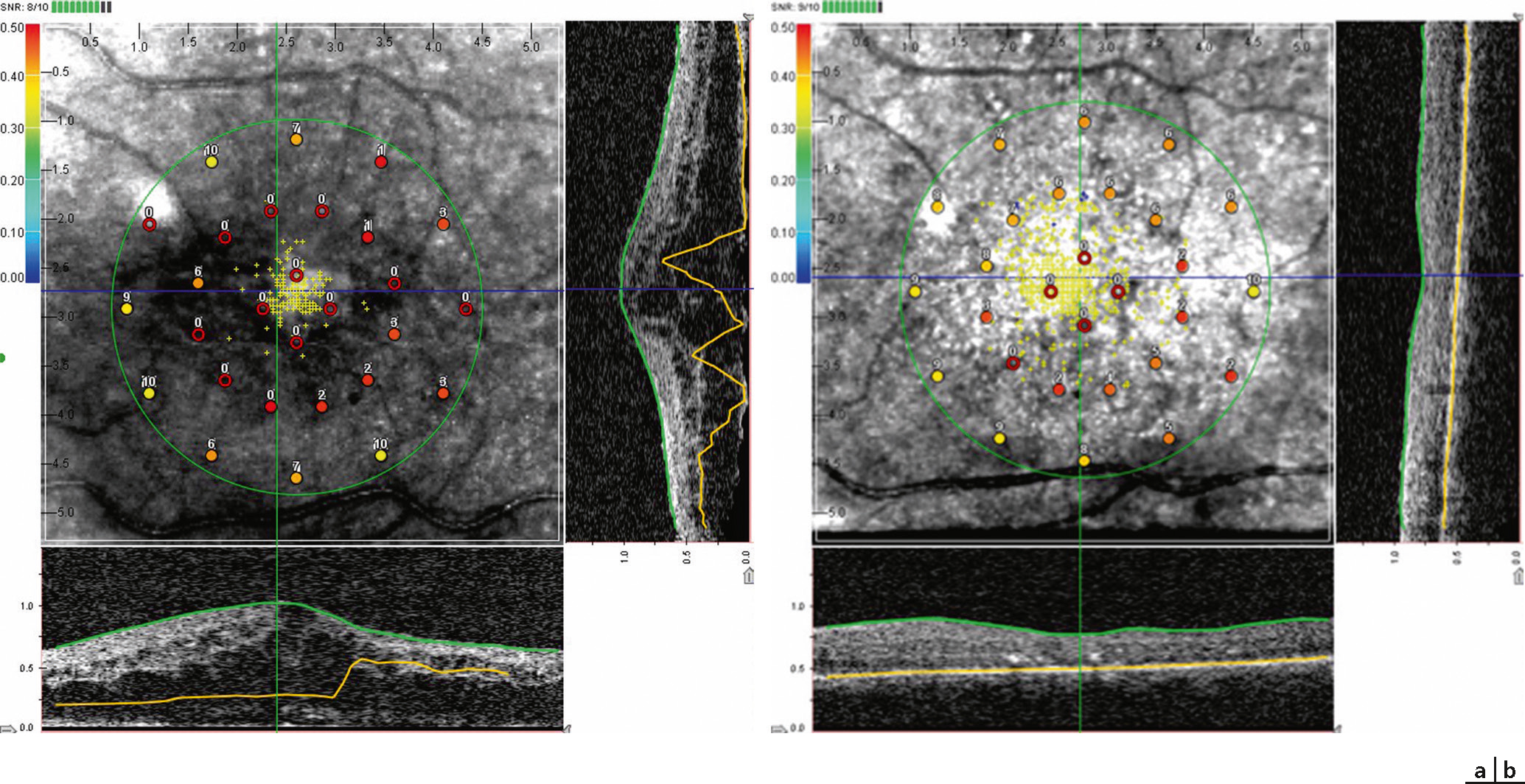
Fig. 5-34 Exemple d’examen en micropérimétrie couplé à l’examen en tomographie par cohérence optique, réalisé à l’aide de l’OCT/SLO OPKO/OTI®, temps de fixation 2 minutes.
Patient atteint d’oedème maculaire diabétique ; évolution de la fixation avant (a) et après (b) assèchement (le test de périmétrie n’a volontairement pas été réalisé pour limiter la fatigue du patient et pouvoir associer fixation et OCT [optical coherence tomography ou tomographie en cohérence optique] sur une même représentation).
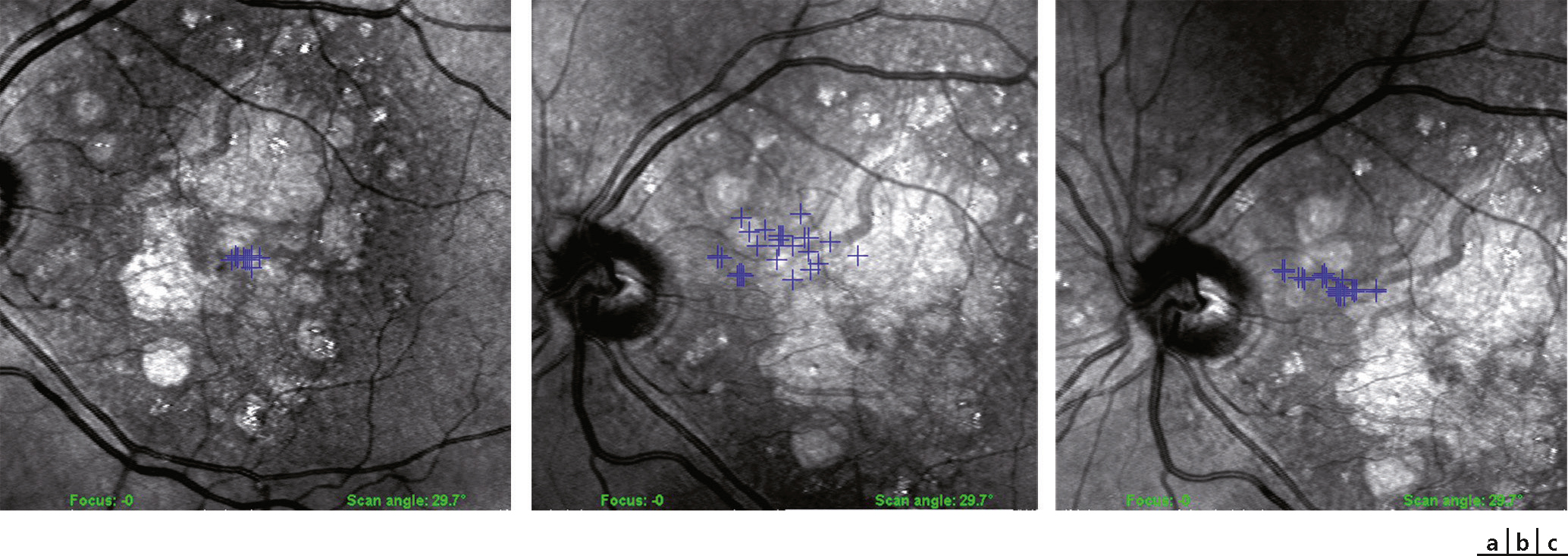
Fig. 5-35 Micropérimétrie réalisée avec l’appareil OPKO/OTI® avec la technologie OCT-SLO, temps de fixation 20 secondes.
Patiente atteinte de DMLA ; évolution de la fixation au cours de temps : il existe initialement une petite préservation centrale (a) ; 6 mois après, le nuage de points de fixation est diffus, dans la région interpapillomaculaire (b) ; puis les points se resserrent (c), témoignant d’une adaptation au scotome devenu central et complet.
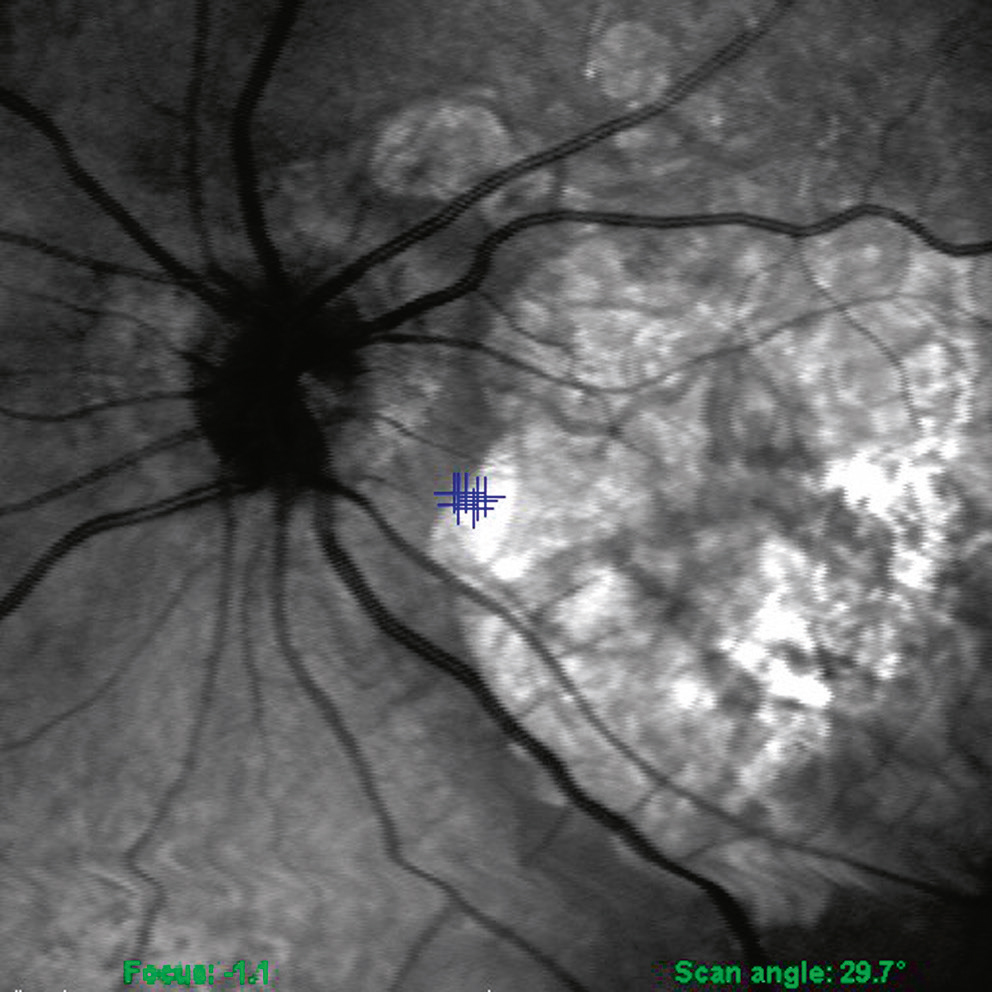
Fig. 5-36 Micropérimétrie réalisée avec l’appareil OPKO/OTI® avec la technologie OCT-SLO, temps de fixation 20 secondes.
Exemple de fixation interpapillomaculaire.
Lorsqu’un patient a fait le choix d’un PRL, celui-ci évolue très peu au cours de la rééducation, du moins en ce qui concerne sa localisation. En général, la stabilité de la fixation est améliorée au terme de la prise en charge, mais le patient ne change pas radicalement de PRL (Fig. 5-37). Il arrive rarement qu’il choisisse un deuxième voire un troisième PRL.
Peu d’éléments permettent d’évaluer le résultat de la rééducation orthoptique basse vision, sauf peut-être la mesure de la vitesse de lecture et les questionnaires de qualité de vie. Concernant la qualité de la fixation, on note en général une réduction de la surface occupée par le PRL, le nuage des points de fixation se resserrant (voir Fig. 5-33 et 5-37). On observe aussi un léger rapprochement du PRL de la lésion après rééducation.
Le nuage de points de fixation peut parfois rester stable au cours de la rééducation. Dans ces cas, seule l’amélioration de la vitesse de lecture témoigne du gain en confort.
La micropérimétrie donne de bonnes indications sur l’évolution de la zone de suppléance au cours du temps (Fig. 5-38). Elle est à confronter au bilan orthoptique pour juger des modifications de la situation.
L’examen n’est pas toujours réalisable. Lorsqu’il existe des troubles des milieux, que la pupille est de petite ouverture ou décentrée, que le patient ne stabilise pas son regard, l’examen ne peut pas aboutir. La réalisation de cet examen est aussi parfois pénible lorsque la fixation est trop instable et, bien que celui-ci apporte des informations très utiles, il ne peut parfois pas être répété.
Par ailleurs, cet examen étudie la fixation d’une personne au cours de l’observation d’une cible ponctuelle. Ce n’est donc pas un reflet exact du comportement visuel face à une scène visuelle complexe, comprenant des détails plus ou moins larges, des contrastes variables, des couleurs, des mouvements, etc. De plus, le patient est examiné tête fixe, face à la cible immobile. Si la fixation de suppléance se modifie très probablement au gré de la qualité de ce qui est observé, l’examen est donc d’un apport qu’il faut relativiser, et que l’on associera bien sûr aux autres éléments du bilan.
La micropérimétrie est un examen précieux dans l’étude des possibilités visuelles et dans la mise en oeuvre d’une rééducation du point de fixation. Bien que cet examen soit parfois long ou pénible, il permet d’optimiser la prise en charge du handicap et d’améliorer sa compréhension, que ce soit pour le patient ou pour les soignants.
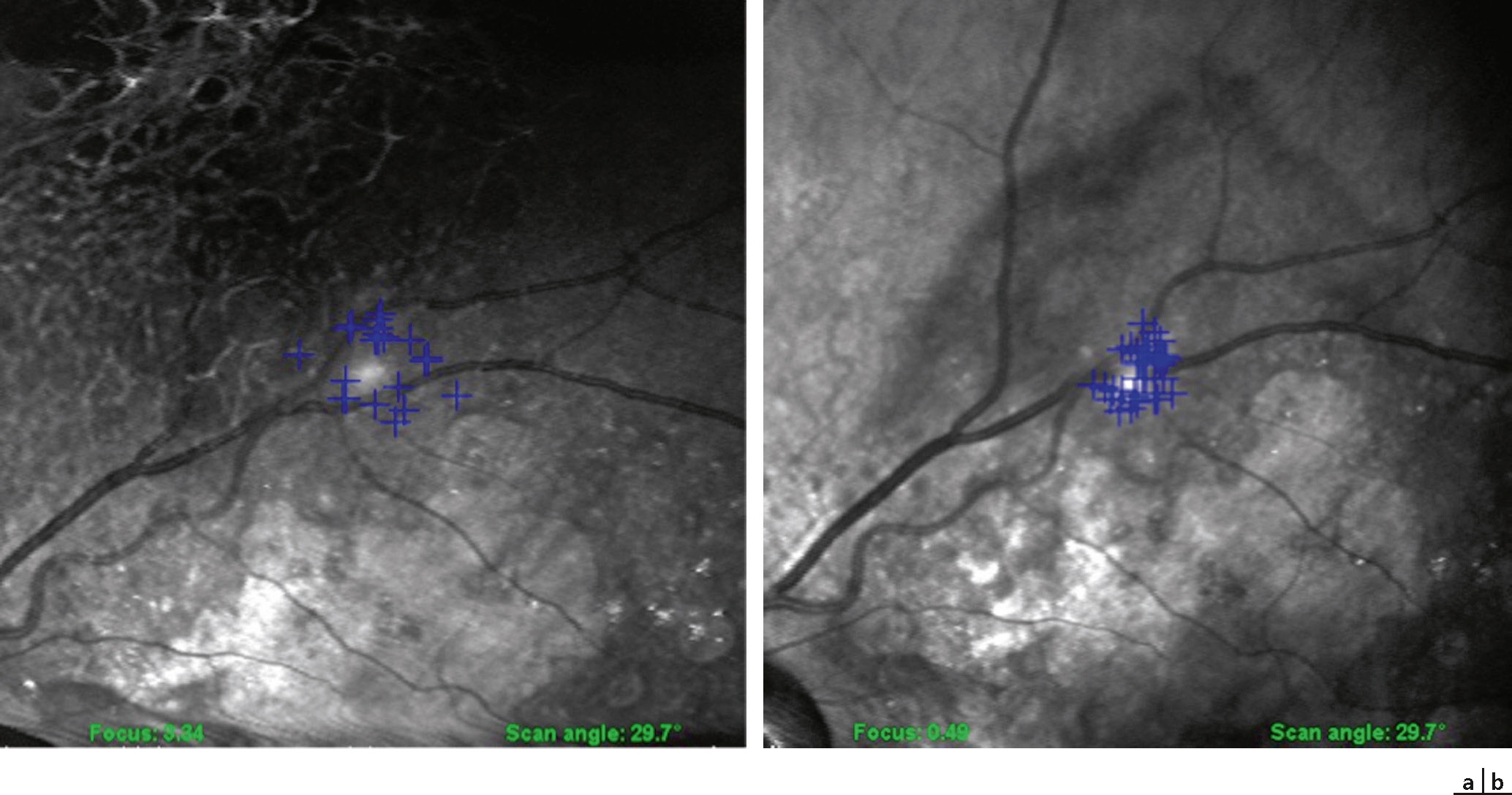
Fig. 5-37 Micropérimétrie réalisée avec l’appareil OPKO/OTI® avec la technologie OCT-SLO, temps de fixation 20 secondes.
Exemple de fixation avant (a) et après (b) rééducation : les points se resserrent, la fixation est plus stable.

Fig. 5-38 Micropérimétrie réalisée avec l’appareil OPKO/OTI® avec la technologie OCT-SLO, temps de fixation 20 secondes.
Amélioration de la stabilité de la fixation et rapprochement des points ; comparaison de l’examen avant (a) et après (b) rééducation.
[1] Cheung SH, Legge GE. Functional and cortical adaptations to central vision loss. Vis Neurosci 2005 ; 22(2) : 187-201.
[2] Crossland MD, Engel SA, Legge GE. The preferred retinal locus in macular disease : toward a consensus definition. Retina 2011 ; 31(10) : 2109-14.
[3] Lei H, Schuchard RA. Using two preferred retinal loci for different lighting conditions in patients with central scotomas. Invest Ophthalmol Vis Sci 1997 ; 38(9) : 1812-8.
[4] Fletcher DC, Schuchard RA. Preferred retinal loci relationship to macular scotomas in a low-vision population. Ophthalmology 1997 ; 104(4) : 632-8.
[5] Tarita-Nistor L, González EG, Markowitz SN, Steinbach MJ. Fixation characteristics of patients with macular degeneration recorded with the MP-1 microperimeter. Retina 2008 ; 28(1) : 125-33.
[6] Messias A, Reinhard J, Velasco e Cruz AA, et al. Eccentric fixation in Stargardt’s disease assessed by Tübingen perimetry. Invest Ophthalmol Vis Sci 2007 ; 48(12) : 5815-22.
[7] Crossland MD, Crabb DP, Rubin GS. Task-specific fixation behavior in macular disease. Invest Ophthalmol Vis Sci 2011 ; 52(1) : 411-6.
[8] Markowitz SN, Reyes SV, Shima N. Functional retinal locus rather than multiple PRLs ? Invest Ophthalmol Vis Sci 2011 ; 52(2) : 1191 ; author reply 1191.
[9] Tarita-Nistor L, González EG, Mandelcorn MS, et al. Fixation stability, fixation location, and visual acuity after successful macular hole surgery. Invest Ophthalmol Vis Sci 2009 ; 50(1) : 84-9.
[10] González EG, Tarita-Nistor L, Mandelcorn ED, et al. Fixation control before and after treatment for neovascular age-related macular degeneration. Invest Ophthalmol Vis Sci 2011 ; 52(7) : 4208-13.
[11] Tarita-Nistor L, Brent MH, Steinbach MJ, González EG. Fixation stability during binocular viewing in patients with age-related macular degeneration. Invest Ophthalmol Vis Sci 2011 ; 52(3) : 1887-93.
[12] Vujosevic S, Pilotto E, Bottega E, et al. Retinal fixation impairment in diabetic macular edema. Retina 2008 ; 28(10) : 1443-50.
[13] Carpineto P, Ciancaglini M, Di Antonio L, et al. Fundus microperimetry patterns of fixation in type 2 diabetic patients with diffuse macular edema. Retina 2007 ; 27(1) : 21-9.
[14] Dubois-Roussel C, Dupas BM, Erginay A, et al. Increased fixation stability after intravitreal treatment for chronic diabetic macular edema as a predictor of favorable visual outcome, ARVO 2015 ; A0210.
S. DEFOORT – DHELLEMMES
Dans le bilan d’une déficience visuelle, les examens électrophysiologiques, potentiels évoqués visuels (PEV) et électrorétinogrammes (ERG), ont un intérêt fonctionnel et, surtout, diagnostique. En effet, connaître la cause d’une déficience visuelle donne d’emblée une idée de son retentissement sur les différentes fonctions visuelles et de son évolutivité. Ces notions sont essentielles à connaître avant de décider de mettre en place un protocole de rééducation ou réhabilitation et pour en définir les modalités, en particulier chez les patients dont les fonctions visuelles ne sont pas mesurables (enfants, polyhandicapés).
L’ERG permet, à tout âge, sous simple anesthésie topique, de diagnostiquer les dystrophies et dysfonctions rétiniennes en précisant le niveau de l’atteinte : photorécepteurs (PR ; cônes, bâtonnets) et/ou couches internes de la rétine (cellules bipolaires), système photopique et/ou scotopique, voies de conduction intrarétiniennes (ON, OFF)
L’ERG par flash réalisé selon le protocole standard de l’ISCEV (International Society for Clinical Electrophysiology of Vision) [1], c’est-à– dire après dilatation pupillaire, avec des électrodes actives cornéosclérales, en respectant les deux phases successives d’adaptation à l’obscurité de 20 minutes puis à la lumière de 10 minutes, comprend cinq types de stimulation qui se font avec des flashs lumineux blancs, en champ total, dans une coupole [2–4] (Fig. 5-39 et 5-40).

Fig. 5-39 ERG par flash ou global, méthodes d’étude.
a. Stimulation en coupole. b. Électrodes actives cornéosclérales, pupilles dilatées. Chez l’enfant, l’ISCEV autorise une adaptation du protocole.
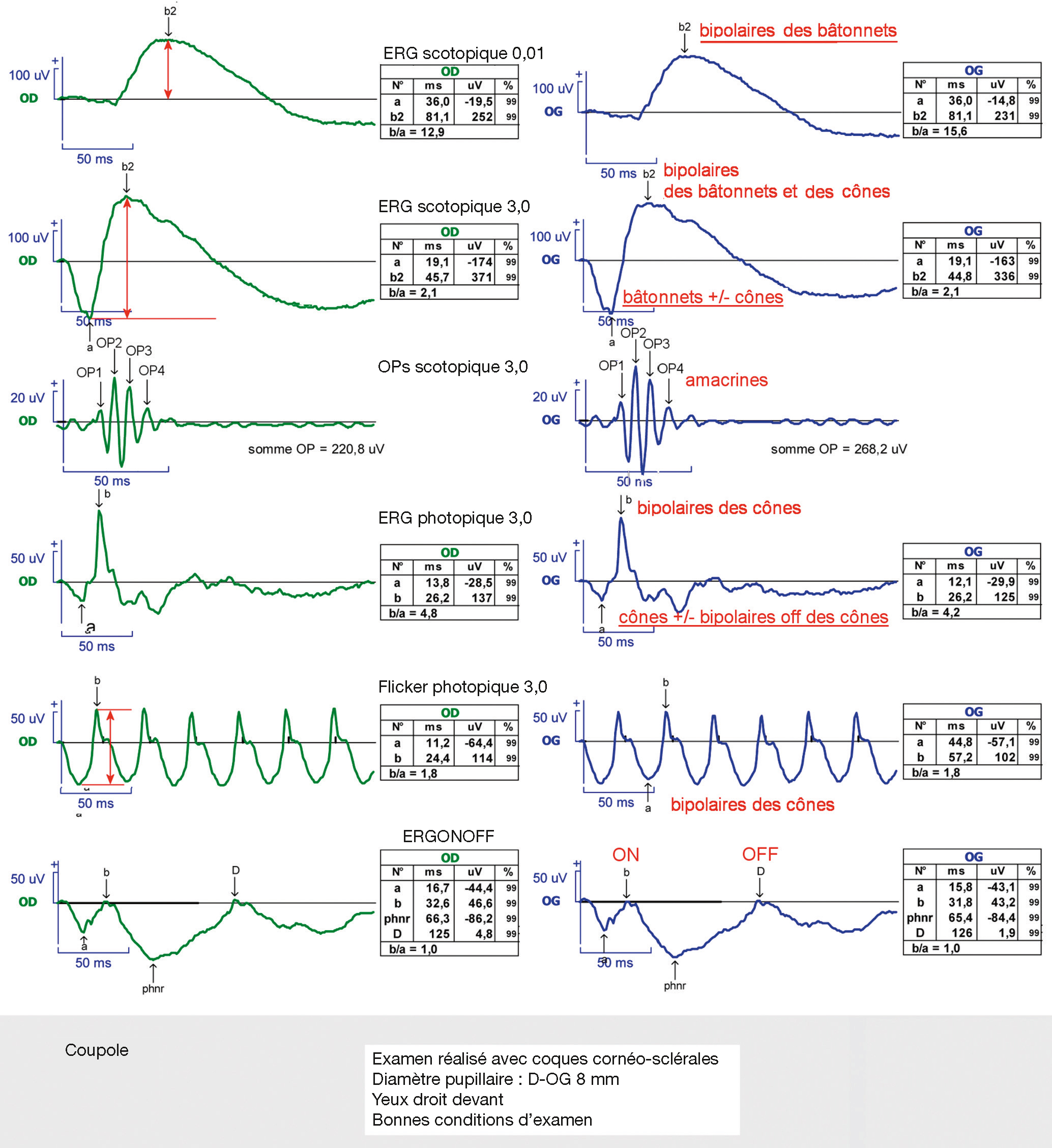
Fig. 5-40 ERG normal selon le protocole standard de l’ISCEV.
On enregistre cinq types de réponses de la rétine : réponse des bâtonnets (ERG scotopique 0,01), réponse mixte cône-bâtonnets (ERG scotopique), potentiels oscillatoires (OP), réponse des cônes (ERG photopique 3,0) et flickers, auxquels on ajoute parfois l’ERG on/off. Chaque enregistrement est désigné par le nom de l’examen (ERG), l’état d’adaptation de la rétine (scotopique ou photopique) et l’intensité lumineuse du stimulus (par exemple 3,0 cd.s/m2). La réponse ERG comporte deux déflexions principales : l’onde a négative, mesurée du pied de l’onde à la ligne isoélectrique, suivie de l’onde b positive, mesurée du creux de la déflexion négative au sommet de la déflexion positive. L’onde a correspond à l’activité des photorécepteurs principalement et des bipolaires OFF, l’onde b à celle des cellules bipolaires.
L’ERG est nécessaire au diagnostic de rétinopathies pigmentaires (RP) à fond d’oeil (FO) normal ou peu évocateur. Il permet d’en distinguer quatre types qui ont des âges de début, des signes et des pronostics fonctionnels différents [5, 6].
–Les rétinopathies avec atteinte isolée des cônes ont à l’ERG des composantes scotopiques normales et des composantes photopiques altérées. Leurs signes fonctionnels sont une acuité visuelle (AV) basse, un scotome central, une photophobie et une dyschromatopsie sévère voire une achromatopsie. Elles regroupent les syndromes de dysfonction des cônes congénitaux : l’achromatopsie, souvent révélée par un nystagmus, dont l’évolution est stable (AV de 1/20 dans la forme complète à 3/10 ou plus dans les formes incomplètes) ; les dystrophies des cônes (Fig. 5-41, 1), acquises chez l’adulte jeune avec baisse d’AV progressive vers 1/20 ; et les dystrophies « cônes-bâtonnets » débutantes (voir ci-dessous).
-Les rétinopathies avec atteintes mixtes des cônes et des bâtonnets sont diagnostiquées devant un ERG globalement altéré. Si les composantes scotopiques sont altérées de façon plus importante et plus précoce que les composantes photopiques, il s’agira d’une dystrophie « bâtonnets-cônes » (rétinite pigmentaire) ; dans le cas contraire, d’une dystrophie « cônes-bâtonnets » (Fig. 5-41, 2 et 3). Les signes fonctionnels sont, à des degrés plus ou moins importants, ceux d’une atteinte des cônes associés à ceux d’une atteinte des bâtonnets : héméralopie et déficit du champ visuel à type de scotomes annulaires évoluant vers un rétrécissement concentrique. Ces RP sont toutes évolutives. L’âge de début est le principal facteur de mauvais pronostic. Les formes congénitales (amaurose congénitale de Leber) ou précoces sont toujours cause de cécité ou de malvoyance profonde, les formes tardives rarement.
–Les rétinopathies avec atteinte des couches internes de la rétine sont évoquées devant un ERG dont l’onde b est altérée et l’onde a normale ou subnormale, lui conférant un aspect négatif [6]. Cet aspect est retrouvé dès les premiers mois de vie dans l’héméralopie stationnaire congénitale (transmission anormale du signal entre les PR et les cellules bipolaires) soit complète, par atteintes des voies ON, dont les symptômes sont le nystagmus,l’héméralopie et la myopie forte (Fig. 5-41, 4), soit incomplète, par atteinte des voies ON et OFF, où ces signes sont inconstants. Ces RP ne sont pas évolutives ; l’AV s’améliore même avec la maturation pour atteindre, selon la forme, 2 à 8/10 à l’adolescence. Acquis, l’ERG négatif constitue un argument diagnostique majeur de céroïde lipofuscinose neuronale juvénile chez l’enfant qui a une baisse d’acuité à FO normal et de rétinopathie associée au mélanome chez l’adulte. Il est aussi mis en évidence dans le rétinoschisis congénital, la rétinopathie de Birdshot et la thrombose artérielle rétinienne.
–Les rétinopathies à ERG flash normal. L’ERG flash est une réponse de masse ; il peut donc être normal chez les sujets ayant une affection purement maculaire. L’ERG reste néanmoins utile au diagnostic différentiel de certaines maculopathies mises en évidence par le FO et l’imagerie. Par exemple, une hypoplasie maculaire peut être idiopathique ou due à un albinisme quand l’ERG est normal, mais liée à une achromatopsie ou à une héméralopie s’il est anormal.
L’ERG flash a un intérêt pronostique, son altération est corrélée à la surface rétinienne atteinte. Il est de mauvais pronostic quand il est globalement altéré dans des RP apparemment localisées (par exemple dans la maladie de Stargardt type III).
Les autres types d’ERG, ERG multifocal et ERG pattern, étudient spécifiquement la fonction rétinienne centrale, ont vu leurs indications limitées en clinique par l’imagerie oculaire. Ils permettent d’évaluer finement la récupération fonctionnelle dans les protocoles d’étude thérapeutiques.
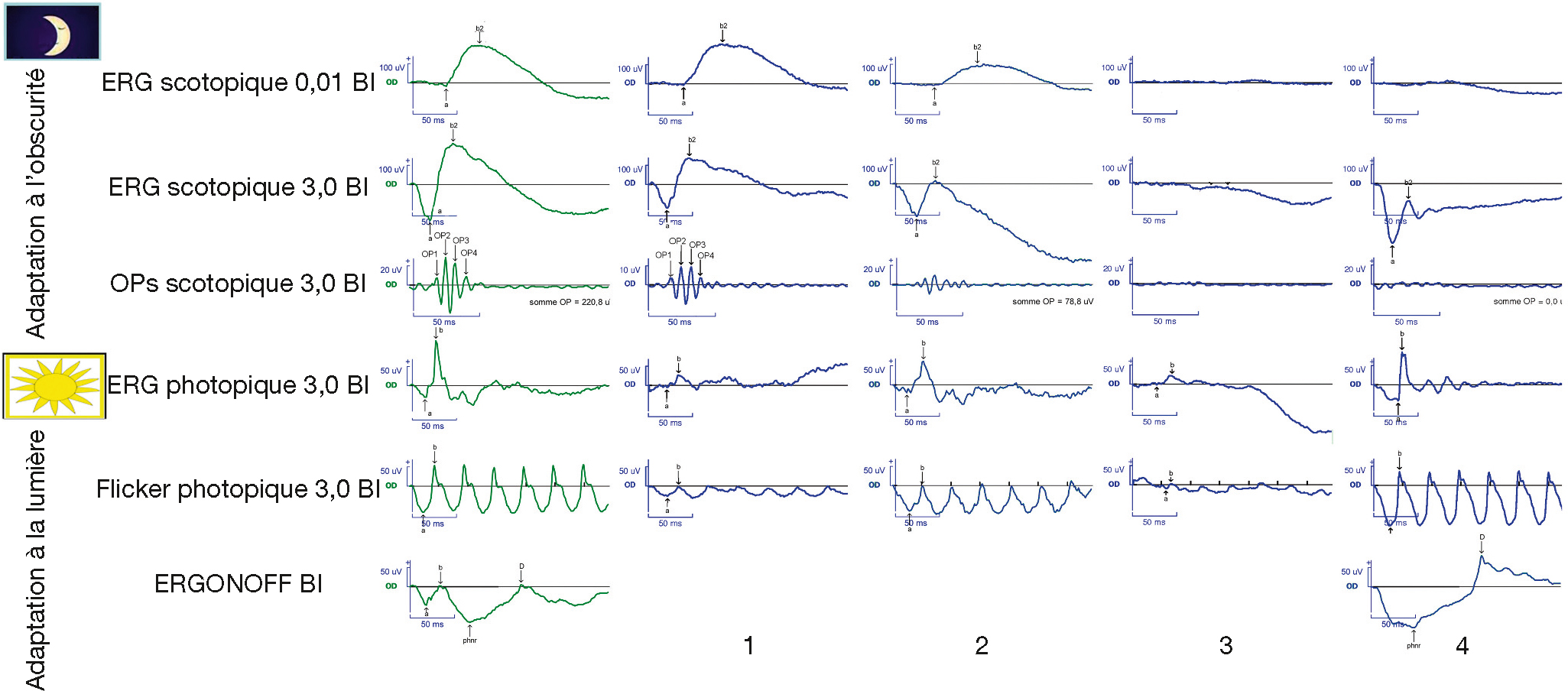
Fig. 5-41 Types d’atteinte de l’ERG et causes de déficience visuelle.
1. Dystrophie des cônes : composantes scotopiques normales, photopiques altérées. 2. Dystrophie mixte type cône–bâtonnets : composantes photopiques plus altérées que les scotopiques. 3. Dystrophie mixte bâtonnets–cônes : composantes scotopiques plus altérées que les photopiques. 4. Héméralopie congénitale stationnaire complète : atteinte de la conduction entre les photorécepteurs et les cellules bipolaires ON ; l’onde a est normale, l’onde b altérée.
Au stade de la déficience visuelle, les PEV ont essentiellement un intérêt fonctionnel. Ils permettent d’évaluer l’AV objective quand ce n’est pas possible par d’autres moyens.
Deux types de stimulus sont utilisés, les flashs et les patterns qui sont des images ou mires dont les modifications alternantes (renversement ou apparition-disparition) créent un potentiel d’action. Il est possible avec cette méthode, en utilisant des stimuli appropriés, d’évaluer diverses fonctions comme le pouvoir séparateur, la vision des contrastes et des couleurs, la vision binoculaire, et aussi de différencier les réponses des voies parvocellulaires et magnocellulaires. Les PEV sont recueillis par des électrodes actives positionnées en regard du cortex occipital (Fig. 5-42 et 5-43). Les réponses obtenues par stimulation d’un oeil puis l’autre et en binoculaire sont analysées [7].

Fig. 5-42 PEV, modes de stimulation.
a. PEV par damier basse fréquence spatiale. b. PEV par damier haute fréquence spatiale. c. PEV par flashs.
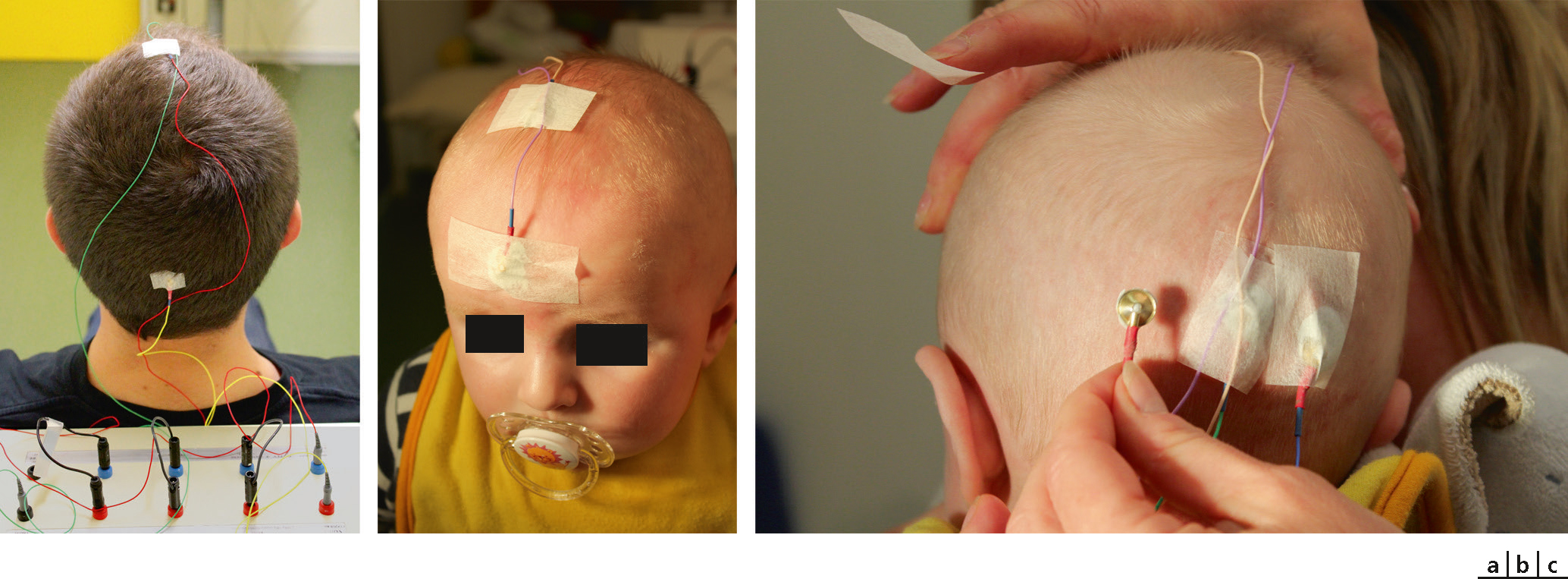
Fig. 5-43 PEV, position des électrodes.
a. Montage monopolaire (selon l’ISCEV) utilisé pour la mesure d’acuité visuelle. Trois électrodes : active en regard de la scissure calcarine en Oz, de référence sur le front en Fz, neutre reliée à la terre. b, c. Montage multipolaire pour étudier les voies visuelles ; plusieurs électrodes actives (2 à 4) sont positionnées en regard des lobes occipitaux et pariétaux.
Les PEV par pattern reflètent le fonctionnement des fibres d’origine maculaire de la rétine au cortex visuel. En clinique, il est possible d’évaluer l’AV objective des déficiences visuelles en analysant l’amplitude des réponses visuelles obtenues avec des stimulations par damiers noir et blanc, à contraste maximal, de « taille » décroissante (par exemple 120, 60, 30, 15, 7,5 secondes = valeurs correspondant à l’angle sous lequel est vu un carré du damier). Pour obtenir une réponse fiable aux PEV par damier, il faut que le sujet regarde avec attention l’écran durant toute la stimulation ; c’est là sa limite principale. Il est donc indispensable d’utiliser une méthode d’examen rapide, appelée PEV par balayage (sweep VEP), qui fait appel à des stimuli à haute fréquence temporelle (Fig. 5-44) [8].
Les PEV par flashs ont un intérêt en cas de déficience visuelle profonde, surtout chez l’enfant et le polyhandicapé. Ils ne nécessitent pas l’attention du sujet. Ils sont peu influencés par les troubles de réfraction et des milieux. Leur altération signe l’organicité d’une baisse d’AV et évoque un mauvais pronostic visuel s’il est associé à une atrophie optique.
Les PEV flashs et damier peuvent mettre en évidence, lorsque la réponse obtenue est différente entre les deux lobes, une atteinte chiasmatique (albinisme, achiasmie ou compression) ou rétrochiasmatique.
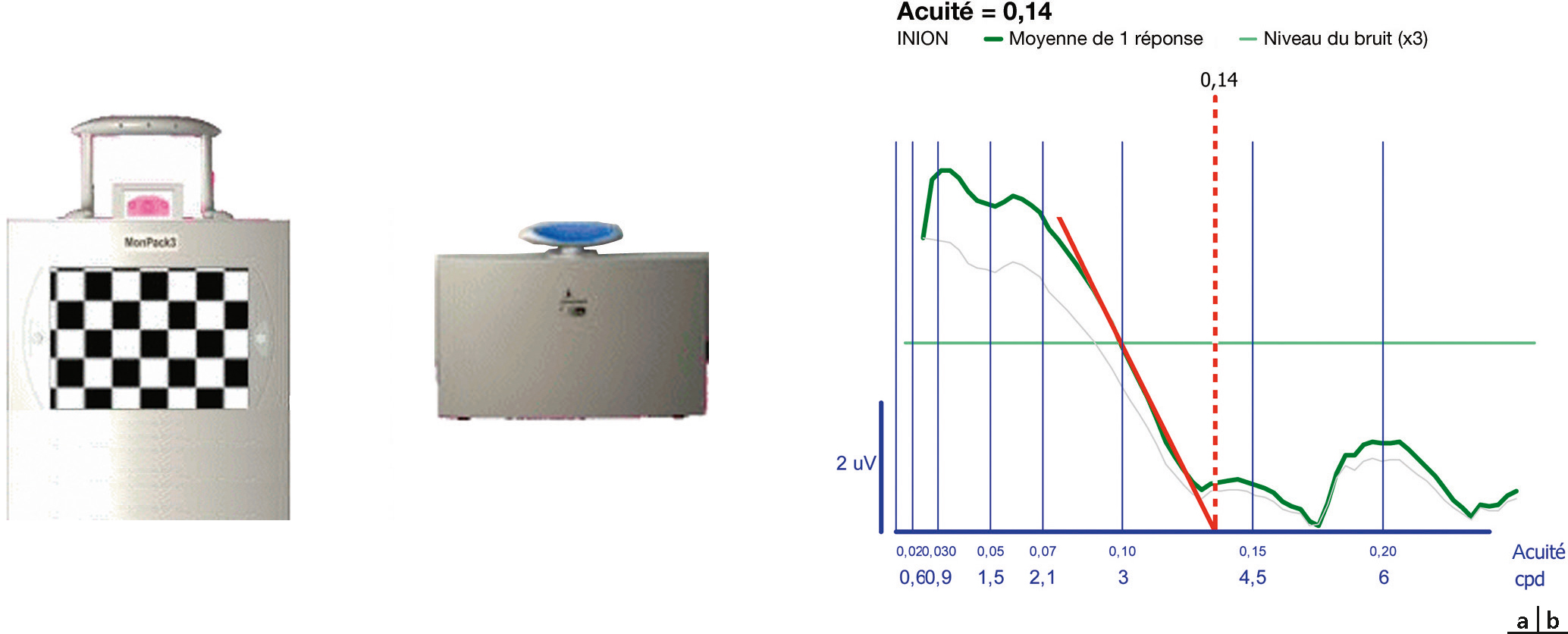
Fig. 5-44 Les PEV par balayage (sweep VEP).
a. Stimulus par balayage. b. Tracé de PEV par balayage. La courbe qui relie l’amplitude de la réponse évoquée à chaque taille de damier décrit un U inversé. Les réponses obtenues avec les plus petits damiers étant de faible amplitude et noyées dans le bruit de fond (EEG), l’AV est obtenue entraçant une droite de régression qui passe par les amplitudes des derniers petits damiers donnant une réponse enregistrable. La courbe des amplitudes en fonction de la taille des damiers est en vert foncé. La taille des damiers est exprimée en cycle par degré (cpd) ; 1 cpd correspond au nombre de couples carré noir–carré blanc par minute d’arc. Dans un damier de 15 cpd, il y a 30 carrés par degré d’angle ; chaque carré est donc vu sous un angle de 2′. Cela correspond à une « acuité visuelle » de 5/10.
Les examens électrophysiologiques contribuent à la connaissance précise et précoce de l’étiologie d’une déficience visuelle. Cette notion est indispensable à l’ophtalmologiste traitant pour qu’il sache s’il doit adresser rapidement un patient pour une prise en charge de la basse vision, car sa vision ne va pas s’améliorer ou se dégrader rapidement (par exemple achromatopsie, dystrophies mixtes de l’enfant) ou, au contraire, s’il est préférable de choisir une simple surveillance de l’évolution des déficits visuels et à quel rythme (par exemple héméralopie congénitale). Elle est utile aux ophtalmologistes impliqués dans la prise en charge des déficiences visuelles pour guider la rééducation, l’orientation scolaire ou professionnelle, car elle attire l’attention sur certains déficits fonctionnels qui pourraient être méconnus, en particulier chez l’enfant, et donne une idée du pronostic. Par exemple, il sera conseillé d’éviter d’utiliser des codes colorés et des éclairages intenses en cas d’atteintes des cônes ; un bon éclairage et un bilan en locomotion dans un milieu peu éclairé seront proposés.
[1] McCulloch DL, Marmor MF, Brigell MG, et al. ISCEV Standard for full-field clinical electroretinography (2015 update). Doc Ophthalmol 2015 ; 130(1) : 1-12.
[2] Holder GE, Celesia GG, Miyake Y, et al. International Federation of Clinical Neurophysiology : Recommendations for visual system testing. Clinical Neurophysiology 2010 ; 121 : 1393-409.
[3] Arndt C, Defoort-Dhellemmes S. Electrorétinogramme par flashes de l’adulte. In : Defoort-Dhellemmes S, Meunier I (Eds). Du signe clinique au diagnostic. Imagerie et exploration de la vision. Marseille : Lamy-BSOF ; 2012. p. 84-9.
[4] Rigaudière F, Le Gargasson JF. V-3 : Electrorétinogramme global. OEil et physiologie de la vision. V. Les signaux électrophysiologiques, 2014. http://lodel.irevues.inist.fr/oeiletphysiologiedelavision/index.php?id=115.
[5] Audo I, Robson AG, Holder GE, Moore AT. The negative ERG : clinical phenotypes and disease mechanisms of inner retinal dysfunction. Surv Ophthalmol 2008 ; 53 : 16-40.
[6] Defoort-Dhellemmes S, Drumare I, Basset D. Electrorétinogramme par flashes de l’enfant. In : Defoort-Dhellemmes S, Meunier I (Eds). Du signe clinique au diagnostic. Imagerie et exploration de la vision. Marseille : Lamy-BSOF ; 2012. p. 90-7.
[7] Hache JC. Potentiels évoqués visuels. In : Risse JF (Ed). Exploration de la fonction visuelle. Application au domaine sensoriel de l’oeil normal et en pathologie. Rapport de la Société Française d’Ophtalmologie 1999 ; 11 : 308-24.
[8] Defoort-Dhellemmes S, Drumare I, Basset D, et al. Les potentiels évoqués visuels chez l’enfant. In : Defoort-Dhellemmes S, Meunier I (Eds). Du signe clinique au diagnostic. Imagerie et exploration de la vision. Marseille : Lamy-BSOF ; 2012. p. 71-83.
P. PRADAT– DIEHL , A. POTET, L. JEANJEAN
Parmi les modalités sensorielles, la vision est la fonction qui a été le mieux explorée dans le cadre de la neuropsychologie depuis le début du XXe siècle et pour laquelle les apports de la psychologie cognitive ont été les plus riches. Les conséquences fonctionnelles d’un dysfonctionnement du système neurovisuel sont sévères, et ces troubles, relativement fréquents, posent des problèmes de diagnostic différentiel avec les pathologies ophtalmologiques.
Le terme de cécité cérébrale a remplacé celui de cécité corticale, trop restrictif car les lésions cérébrales responsables peuvent être corticales ou sous-corticales. Ces lésions sont occipitales et toujours bilatérales. Les causes les plus fréquentes des cécités cérébrales sont les accidents vasculaires cérébraux (AVC) dans le territoire vertébrobasilaire par infarctus des deux artères cérébrales postérieures, les anoxies cérébrales ou les traumatismes crâniens par contusion occipitale bilatérale [1].
La cécité peut être complète. Le clignement à la menace est aboli, mais le réflexe photomoteur est présent, car les afférences visuelles de ce réflexe sont directement projetées sur le tronc cérébral et ne passent pas par le lobe occipital. Il n’existe alors aucune perception des afférences visuelles élémentaires (lumière, couleur, mouvement).
La cécité peut être incomplète d’emblée ou récupérer rapidement. Les perceptions visuelles élémentaires telles que la lumière, puis le mouvement, puis la couleur redeviennent possibles. La perception de mouvement correspond à un mécanisme d’intégration visuelle résiduelle, qui peut permettre au patient de se déplacer sans heurter des obstacles qu’il ne reconnaît cependant pas.
La cécité cérébrale est classiquement associée à une anosognosie, le patient ne rapportant pas spontanément sa cécité, ou la déniant en affirmant qu’il voit bien, qu’il peut lire… alors même qu’il ne reconnaît aucun objet. Des hallucinations visuelles sont possibles tout au long de l’évolution de la cécité cérébrale. Deux problèmes diagnostiques se posent en cas de cécité cérébrale : évoquer le diagnostic d’un trouble visuel, et faire le diagnostic différentiel avec une cécité périphérique.
Il n’est pas toujours facile d’évoquer le diagnostic d’un trouble visuel : en cas de cécité cérébrale avec anosognosie, le tableau clinique est celui d’une confusion. Le patient est agité, désorienté, sans que l’on puisse immédiatement rapporter ce trouble à une cécité.
Le diagnostic différentiel peut se poser avec une cécité d’origine périphérique. En faveur de la cécité cérébrale, on retrouve l’installation brutale d’une cécité bilatérale dans un contexte neurologique. Le réflexe photomoteur est présent en cas de cécité cérébrale. Il faut rechercher des mécanismes de cécité périphérique qui peuvent intervenir dans le même contexte : atrophie optique secondaire à l’hypertension intracrânienne chez les traumatisés crâniens, hémorragie du vitré (syndrome de Terson) en cas d’hémorragie méningée par rupture d’anévrisme. L’examen ophtalmologique est systématique pour éliminer toute atteinte périphérique.
Exceptionnellement, la cécité peut persister de façon complète. Le plus souvent, il existe une récupération totale ou partielle [2]. Cette récupération peut être limitée aux afférences élémentaires (lumière, mouvement, couleurs). Le champ visuel peut évoluer vers un rétrécissement concentrique du champ visuel correspondant à une épargne maculaire, ou de façon fragmentaire avec des scotomes centraux ou paracentraux. L’évolution se fait en règle générale vers des troubles de la reconnaissance visuelle et/ou des troubles visuospatiaux.
Ces troubles correspondent à une atteinte de la voie visuelle occipitotemporale du « quoi ? » qui permet la reconstruction de l’image visuelle et sa reconnaissance. Les lésions cérébrales en cause sont temporales inférieures bilatérales.
L’agnosie visuelle est une incapacité de reconnaître des formes ou des objets par la vue, alors que l’acuité visuelle est préservée, et que la reconnaissance est possible « à l’aide des autres sens », le tact, l’audition, l’olfaction, ou par la définition verbale de l’objet.
Un test de reconnaissance d’objets, de photographies ou de dessins permet de faire le diagnostic, et de quantifier le trouble, sans en démontrer le mécanisme. L’épreuve de reconnaissance doit être différenciée de la dénomination. Ce n’est pas le nom exact de l’objet que l’on recherche, mais bien si l’objet a été reconnu. La définition par l’usage, la description par le mime d’utilisation, etc. seront retenues comme bonnes réponses.
L’agnosie aperceptive est caractérisée par l’incapacité de discriminer des formes élémentaires et en particulier par l’incapacité de recopier un dessin. L’agnosie associative est caractérisée par la préservation du traitement des formes élémentaires, contrastant avec l’incapacité de les utiliser pour assurer la reconnaissance des objets ou des dessins. Le patient est capable de recopier ou de décrire un dessin qu’il ne peut pas reconnaître. Il est en revanche gêné pour le dessiner de mémoire. Le trouble de la reconnaissance des objets régresse plus souvent, alors que peut persister un trouble de la reconnaissance des dessins ou des photographies complexes, peu gênant en vie quotidienne.
La prosopagnosie est une forme particulière d’agnosie visuelle. Le trouble de la reconnaissance touche de façon isolée, ou souvent simplement prédominante, la reconnaissance des visages. Il ne s’agit pas d’un trouble de la reconnaissance des personnes car la reconnaissance est possible par la voix, ou par des indices visuels hors visage (cheveux, lunettes, vêtements). Les patients peuvent ne pas se reconnaître dans la glace ou en photographie. Ce trouble rare est à l’origine d’un handicap social important. La prosopagnosie peut être recherchée par la reconnaissance de visages célèbres sur photographies. Les lésions cérébrales en cause sont en général bilatérales, temporales inférieures. Des lésions temporales unilatérales droites pourraient cependant entraîner une prosopagnosie.
Ces troubles correspondent à une atteinte de la voie visuelle occipitopariétale du « où ? » qui permet l’organisation spatiale de l’image visuelle. Les lésions cérébrales en cause sont pariétales, le plus souvent bilatérales. Les troubles spatiaux peuvent être classés dans quatre grandes catégories : les troubles de la coordination visuomotrice, les troubles de la stratégie d’exploration visuelle, la simultagnosie, les phénomènes de négligence.
La coordination visuomotrice permet l’organisation de la trajectoire de la main pour saisir l’objet et l’adaptation de l’ouverture de la main en fonction de la taille de l’objet. L’examen met en évidence des erreurs de pointage de cibles dans le champ visuel central et périphérique, des difficultés de raccordement de points ou pour suivre du doigt un trait dessiné. L’examen recherchera également des difficultés dans la vie quotidienne, comme pour verser du café dans une tasse, mettre le café dans le filtre.
Ces troubles se manifestent par l’absence d’exploration visuelle systématisée et sont révélés par l’incapacité de dénombrer des objets, ou par l’exploration au hasard des tests de barrage. La description d’une scène complexe comme celle de la cuisine du BDAE (Boston diagnosis aphasia examination) est faite par une succession de détails saisis au hasard, sans lien entre eux. Ce phénomène peut se voir aussi en lecture. Le patient peut alors lire des mots isolés, mais ne peut pas lire un texte.
Les patients ont la capacité de voir un objet isolé mais pas plusieurs éléments en même temps. Un patient expliquait que, lorsqu’il peignait un portrait, il voyait la bouche ou les yeux, mais il ne pouvait pas voir l’ensemble, même s’il se reculait. Le phénomène de simultagnosie peut aussi participer à l’alexie lettre à lettre : le mot ne peut plus être vu dans sa globalité mais comme des éléments (les lettres) séparés.
Définie par l’incapacité de réagir et de prendre en compte un élément situé dans l’hémichamp visuel controlatéral à la lésion cérébrale, la négligence se manifeste le plus souvent dans l’hémichamp visuel gauche, mais peut exister également à droite. La négligence est mise en évidence par l’oubli des éléments situés dans l’hémichamp gauche dans des tests de barrage, de dessin, de copie, de lecture ou d’écriture. Elle peut se manifester dans les actes simples de la vie quotidienne. Isolée, elle est secondaire à une lésion cérébrale droite, le plus souvent pariétale.
Les troubles de la lecture sont souvent la plainte essentielle des patients et le motif de consultation. Ils ne sont pas toujours isolés et justifient la recherche des autres troubles visuels.
Les troubles visuels d’origine neurologique peuvent bien sûr toucher cette tâche visuelle très particulière qu’est la lecture [3]. Plusieurs formes de troubles peuvent être observés.
Dans la première forme, le trouble de la reconnaissance peut toucher les lettres. Dans cette « alexie globale », le patient ne peut pas reconnaître les lettres, ni lire les mots. Il n’est pas toujours capable de les écrire. Il peut se tromper lorsqu’il doit décider si un signe présenté est ou non une lettre de l’alphabet. Le patient est en revanche capable de reconstituer des mots à partir de leur épellation.
Dans la deuxième forme, le trouble de la lecture peut toucher le mot et constitue alors le tableau d’alexie verbale (ou alexie pure). Le patient peut lire les lettres mais pas directement un mot. Il peut reconstituer le mot en le lisant lettre par lettre. Ce mécanisme de lecture entraîne un allongement du temps de lecture. Plus le mot est long, plus le temps de lecture est augmenté et plus il y a d’erreurs. Il s’agit d’un trouble isolé de la lecture car le patient peut écrire, mais ne peut pas relire ce qu’il vient d’écrire.
Enfin, les troubles spatiaux peuvent également engendrer des troubles de la lecture. Il s’agit de phénomènes de négligence gauche et droite avec des difficultés lors du retour à la ligne. Les troubles d’exploration spatiale et de simultagnosie retentissent également sur les capacités de lecture, avec par exemple une lecture de mots « au hasard » dans la page, et donc l’impossibilité d’en déduire un sens.
L’atrophie corticale postérieure (ACP) est une pathologie neurodégénérative caractérisée par une atteinte progressive et relativement sélective de la vision [4]. La pathologie a été décrite pour la première fois en 1988 par Benson [5] et s’intègre dans le cadre des démences focales. L’âge de début se situe entre 50 et 65 ans. Cette pathologie est marquée par le délai souvent très important entre les premières plaintes visuelles et le diagnostic (errance médicale avec de fréquents changements de verres correcteurs voire de chirurgie de la cataracte). En l’absence de données anatomopathologiques, Benson et al. ont jugé que la présentation clinique était suffisamment différente d’une maladie d’Alzheimer (MA) pour considérer l’ACP comme une pathologie distincte. Les études histopathologiques ont pu démontrer que les lésions cérébrales étaient des lésions typiques de MA mais de topographie postérieure, ce qui a conduit certaines équipes à utiliser des termes comme « MA bipariétale » ou « variante visuelle de MA » [6]. Le terme de « dysfonction corticale postérieure progressive » a également été utilisé chez des patients sans atrophie corticale postérieure avérée sur l’imagerie par résonance magnétique (IRM) [7]. D’autres pathologies ont été mises en cause comme la dégénérescence corticobasale, la démence à corps de Lewy, la maladie de Creutzfeldt-Jakob, etc.
La prévalence et l’incidence de l’ACP sont actuellement inconnues. La maladie semble clairement sous-diagnostiquée car rarement recherchée. Snowden a décrit un taux de 5 % d’ACP sur 523 patients diagnostiqués MA avec une sur-représentation féminine [8]. L’âge de début semble plus jeune que dans la MA typique.
Les déficits les plus fréquents dans l’ACP sont les déficits visuospatiaux, l’alexie, le syndrome de Balint (simultagnosie, apraxie oculomotrice, ataxie optique) et le syndrome de Gerstmann (acalculie, agraphie, agnosie digitale, indistinction droite–gauche). On peut également retrouver des altérations de la mémoire de travail et une apraxie idéomotrice. Au début de la maladie, la mémoire antérograde, les fonctions exécutives, les performances verbales sont préservées et se dégradent secondairement. La dégradation vers la démence globale est constante. La dissociation entre les performances visuelles et le reste des fonctions supérieures entraîne de manière constante de graves troubles psychologiques. Les patients ACP présentent également des déficits des processus visuels basiques comme des difficultés à reconnaître les formes, les couleurs et les mouvements. Ces difficultés visuelles ont des conséquences sur les résultats des tests neuropsychologiques. Les performances lors des tests de QI classiques peuvent être inférieures de 30 points à celles obtenues lors d’un test verbal (sans support visuel). Les patients ACP se plaignent aussi fréquemment de phénomènes visuels positifs « parasites » : persistances rétiniennes anormales, anomalies de taille, mouvements des objets et parfois inversion à 180° de l’image perçue ! Les difficultés de lecture sont extrêmement fréquentes car sous la dépendance de nombreux facteurs (et donc potentiellement impactée par les déficits visuospatiaux, une simultagnosie, une agnosie visuelle, etc.).
La présentation clinique initiale des patients ACP est variable et dépend de la durée d’évolution, du type de déficit visuel, de la pathologie sous-jacente et de la réponse psychologique aux troubles visuels. L’absence de diagnostic et la progression des troubles entraînent en effet des troubles anxiodépressifs constants et sévères. Les difficultés visuelles étant constantes, les patients consultent souvent plusieurs ophtalmologistes sans que les différents changements de verres correcteurs, voire la chirurgie de la cataracte ne changent quelque chose… Les patients vont se plaindre de difficultés pour la lecture, l’évaluation des distances (accidents de voiture, chocs répétés dans les parkings, etc.). On peut également retrouver une photophobie, des distorsions visuelles (anomalies d’échelle), des difficultés à compter ou épeler, etc. L’examen clinique ophtalmologique est le plus souvent normal. Des tests de dépistage des troubles neurovisuels doivent être réalisés en cas de suspicion clinique d’atteinte corticale postérieure (Tableau. 5-4). À un stade avancé, l’agnosie visuelle peut impacter l’acuité visuelle ; on peut également mettre en évidence des troubles systématisés du champ visuel.
L’atrophie cérébrale chez les patients ACP prédomine dans les régions occipitales, pariétales et temporales (Fig. 5-45). Les récents progrès de la neuro-imagerie ont permis de localiser et de quantifier les différences morphologiques de l’atrophie chez les patients ACP par rapport aux patients Alzheimer. Une étude comparant directement les différences morphologiques entre ces deux populations de patients a permis de mettre en évidence une atrophie plus importante au niveau pariétal droit, et moins importante au niveau médiotemporal gauche et hippocampique en cas d’ACP [9]. Les données de l’imagerie en tenseur de diffusion (DTI) permettent également de suggérer une atteinte de la matière blanche dans les régions postérieures en cas d’ACP [10]. Il existe toutefois des variations selon les patients en fonction de l’évolution de la maladie. L’imagerie fonctionnelle type PET-FDG (tomographie par émission de positrons avec injection de fluorodésoxyglucose) permet de mettre en évidence un hypométabolisme dans les aires temporo-pariéto– occipitales [11]. Une donnée intéressante est la mise en évidence d’un dysfonctionnement dans l’aire de Brodmann 8 du cortex frontal responsable des saccades. Ce dysfonctionnement pourrait être la conséquence de la perte de l’input en provenance des aires occipitopariétales et expliquer ainsi l’apraxie optique de l’ACP.

Fig. 5-45 Cas d’une atrophie corticale postérieure chez une femme de 62 ans.
a. Les tests neuropsychologiques permettent de mettre en évidence des troubles visuospatiaux importants. b. On met en évidence, sur l’IRM cérébrale, une atrophie corticale postérieure impactant les lobes pariétaux, occipitaux et temporaux des deux côtés. c. L’imagerie PET-FDG permet de mettre en évidence un hypométabolisme postérieur bilatéral localisé.
(D’après [4].)
Des critères pour le diagnostic d’ACP ont été proposés [4, 12] :
–début insidieux et évolution progressive ;
–atteinte visuelle sans atteinte oculaire ;
–préservation de la mémoire épisodique, de la fluente verbale et du discernement ;
–présence de symptômes incluant : agnosie visuelle, simultagnosie, ataxie optique, apraxie optique, dyspraxie et désorientation temporospatiale ;
–absence de tumeur ou d’AVC.
D’autres critères comme l’alexie, l’apraxie idéomotrice, l’agraphie, l’acalculie, l’âge de début avant 65 ans et la mise en évidence d’une atrophie ou d’une hypoperfusion postérieure sont également évocateurs.
Malgré tout, le spectre de l’ACP est large et nécessitera dans le futur l’établissement de critères de consensus afin de faciliter les études multicentriques.
Malgré l’absence d’étude confirmant l’efficacité des inhibiteurs de l’acétylcholinestérase chez les patients ACP, ces derniers sont fréquemment donnés dans cette pathologie. Il faut bien sûr insister sur le traitement anxiolytique et/ou antidépresseur ainsi que le soutien psychologique car les symptômes psychiques sont constants dans cette pathologie. Les patients peuvent bénéficier d’aides utilisées habituellement en basse vision, à savoir des logiciels de reconnaissance vocale, des livres audio, des aides culinaires, un aménagement du domicile (éclairage, etc.). Une rééducation pluridisciplinaire spécialisée est également préconisée avec orthoptiste, ergothérapeute, psychomotricien, orthophoniste afin d’augmenter la qualité de vie et l’autonomie de ces patients. Les grands axes de la rééducation basse vision dans un contexte d’ACP sont : l’apprentissage d’une méthode de regard visuotactile, l’amélioration de la coordination proprioceptive, la stimulation des fonctions supérieures (logiciels dédiés) et la mise en pratique dans la vie quotidienne (repas, vie sociale, loisirs, déplacements, etc.). La rééducation spécialisée basse vision est primordiale afin d’améliorer l’autonomie et la qualité de vie de ces patients.
Les troubles visuels d’origine cérébrale sont déroutants pour le patient mais aussi pour le médecin. La sémiologie neurovisuelle reste complexe, car elle associe le plus souvent plusieurs types de troubles, avec une forte limitation d’activité et des restrictions de participation des patients.
La prise en charge rééducative spécifique des troubles neurovisuels existe ; elle est toujours multidisciplinaire, et associe des techniques de restauration et de compensation.
[1] Bergego C, Pradat-Diehl P, Masure MC. Les troubles visuels post-traumatiques. In : Bergego C, Azouvi P (Eds). Neuropsychologie des traumatismes crâniens. Paris : Frison-Roche ; 1995. p. 205-19.
[2] Pradat-Diehl P, Masure MC, Lauriot-Prevost MC, et al. Évolution des troubles de la reconnaissance visuelle à distance d’un traumatisme crânien. Rev Neurol 1999 ; 5 : 375-82.
[3] Sieroff E. Les dyslexies périphériques : principaux syndromes et questions théoriques. In : Carbonnel S, Gillet P, Martory MD, Valdois S (Eds). Approche cognitive des troubles de la lecture et de l’écriture chez l’enfant et l’adulte. Paris : Solal ; 1996. p. 195-206.
[4] Crutch SJ, Lehmann M, Schott JM, et al. Posterior cortical atrophy. Lancet Neurol 2012 ; 11(2) : 170-8.
[5] Benson F, Davis J, Snyder BD. Posterior cortical atrophy. Archives of Neurology 1988 ; 45 : 789-93.
[6] Levine DN, Lee JM, Fisher CM. The visual variant of Alzheimer’s disease : a clinicopathologic case study. Neurology 1993 ; 43(2) : 305-13.
[7] Renner JA, Burns JM, Hou CE, et al. Progressive posterior cortical dysfunction : a clinicopathologic series. Neurology 2004 ; 63(7) : 1175-80.
[8] Snowden JS, Stopford CL, Julien CL, et al. Cognitive phenotypes in Alzheimer’s disease and genetic risk. Cortex 2007 ; 43(7) : 835-45.
[9] Lehmann M, Crutch SJ, Ridgway GR, et al. Cortical thickness and voxel-based morphometry in posterior cortical atrophy and typical Alzheimer’s disease. Neurobiology of Aging 2011 ; 32(8) : 1466-76.
[10] Duning T, Warnecke T, Mohammadi S, et al. Pattern and progression of white-matter changes in a case of posterior cortical atrophy using diffusion tensor imaging. J Neurol Neurosurg Psychiatry 2009 ; 80(4) : 432-6.
[11] Nestor PJ, Caine D, Fryer TD, et al. The topography of metabolic deficits in posterior cortical atrophy (the visual variant of Alzheimer’s disease) with FDG-PET. J Neurol Neurosurg Psychiatry 2003 ; 74(11) : 1521-9.
[12] Mendez MF, Ghajarania M, Perryman KM. Posterior cortical atrophy : Clinical characteristics and differences compared to Alzheimer’s disease. Dement Geriatr Cogn Disord 2002 ; 14(1) : 33-40.
A. – C. SCHERLEN, X. ZANLONGHI
Une des premières plaintes exprimées par les personnes malvoyantes est une forte sensibilité à la lumière. L’oeil réagit aux variations d’éclairements ambiants par un ajustement de sa sensibilité. Cette capacité d’adaptation aux conditions lumineuses repose sur la mise en jeu de deux systèmes fonctionnels : l’un scotopique, lié aux fonctionnements des bâtonnets, l’autre photopique, dépendant des activités des cônes. Cette dualité offre une gestion de la luminosité aussi bien dans les basses et hautes luminances. Cependant, de nouvelles origines neurophysiologiques sollicitant des voies non visuelles ont été récemment explorées. La diversité des origines neurophysiologiques de ces processus tend à expliquer la complexité et la variabilité des gênes exprimées par les patients. Détaillons dans un premier temps les différents types d’éblouissements, les fondements neurophysiologiques associés, pour finir sur les méthodes actuellement disponibles en clinique pour caractériser cette gêne majeure.
L’éblouissement est défini comme étant les conditions de vision dans lesquelles on éprouve une gêne ou l’on remarque une baisse de performance visuelle due à un excès de luminance sur la rétine ou une mauvaise présentation de la lumière [1]. L’éblouissement est un processus englobant aussi bien les conditions de lumière auxquelles le sujet est confronté que sa sensibilité physiologique, en lien ou non avec une physiopathologie.
Quatre principaux modèles d’éblouissements ont été définis [2] :
– éblouissement d’incapacité, dû à la diffusion lumineuse dans les structures oculaires. Cet éblouissement impacte les performances visuelles, telles que l’acuité visuelle et/ou la sensibilité aux contrastes ;
– éblouissement d’inconfort, dû à une illumination rétinienne trop intense. L’inconfort, exprimé subjectivement (échelle de Boer), est d’autant plus important que la source se trouve à un angle élevé. Les structures rétiniennes et corticales visuelles et non visuelles sont impliquées dans ces processus ;
– éblouissement incommodant, lié à un éblouissement sur une large zone rétinienne. Il fait suite à une réponse nerveuse des paupières et implique des douleurs. Une adaptation aux flux lumineux s’impose si la stimulation est brève. Une saturation des processus rétiniens et un éblouissement aveuglant apparaissent si la stimulation se prolonge ;
– éblouissement aveuglant, lié à une exposition excessive de la macula. Un blanchiment des pigments des photorécepteurs induit une perte de performance visuelle transitoire ainsi que la présence de post-image. Un temps de récupération des performances après une exposition à une lumière intense sera recherché.
La gêne à la sensibilité à la lumière est dépendante de l’intensité de la source (puissance de la source), de la distribution spectrale [3], des caractéristiques spatiales (taille de la source, angle par rapport au regard) [4] et des caractéristiques temporelles, à savoir le temps d’exposition de la source lumineuse (apparition brève, flashs, stimulation continue, ou variation de luminosité). L’exploration de la sensibilité à la lumière devra ainsi bien prendre en compte l’ensemble de ces paramètres.
Trois principales origines physiologiques, que nous pouvons classifier en théorie rétinienne, physique et neurale, permettent de distinguer les différentes origines possibles de cette sensibilité à la lumière, mais révèlent surtout la complexité de ces processus.
L’exposition à une luminance intense entraîne un dysfonctionnement rétinien qui serait la conséquence d’un désordre photochimique au niveau des photorécepteurs, de l’épithélium pigmentaire et des cellules bipolaires. Le temps de récupération des processus biochimique du pourpre rétinien au niveau des articles externes des photorécepteurs après une stimulation lumineuse correspond à celui de la récupération des capacités visuelles. Un seuil de sensibilité rétinien propre à chacun détermine le niveau à partir duquel la vitesse de régénération du pigment impacte le confort et la performance visuelle. Par ailleurs, plusieurs études récentes ont montré le rôle majeur du pigment maculaire, situé dans la couche plexiforme externe de la rétine, dans la protection à la lumière. Une faible densité du pigment maculaire est associée à une photosensibilité plus importante, un temps de recouvrement plus long suite à un photostress et à un temps d’adaptation à l’obscurité plus lent [5, 6]. La densité du pigment maculaire diminue en présence de dégénérescence maculaire [7].
La théorie physique explique les phénomènes de sensibilité accrue à l’éblouissement lorsqu’il existe une altération des milieux transparents (présence de cataracte, d’oedème cornéen, opacification du corps vitré, etc.). L’augmentation de la sensibilité à la lumière et la diminution des performances visuelles seraient liées à la dispersion et à la diffraction de la lumière dans les milieux oculaires [4]. Un voile lumineux s’interpose entre la source lumineuse et la scène visuelle, empêchant la formation d’une image ponctuelle sur la rétine. La luminance de ce voile est dépendante de l’illuminance de la source et de l’angle d’incidence [8].
Dans ces deux théories, la pupille joue un rôle majeur dans la régulation du flux lumineux. Un diamètre pupillaire important va augmenter la sensation de diffusion et de perte des performances visuelles. Les anomalies des comportements pupillaires en présence de glaucome, de rétinite pigmentaire sont à rechercher et à mettre en lien avec le niveau de sensibilité à la lumière du patient.
Mis à part la sensibilité à une stimulation donnée, il est important de noter les gênes fortement relatées par les patients dans la gestion des transitions lumineuses, aussi bien celles liées à une augmentation de la lumière que celles liées à une diminution de la lumière. Ces processus sont liés aux transferts entre les fonctions des cônes et des bâtonnets, qui doivent donc être explorées ensemble.
La découverte récente de la mélanopsine, protéine photosensible située dans des cellules spécialisées ganglionnaires de la rétine, a permis de mieux comprendre son rôle sur les fonctions non visuelles, telles que la régulation du cycle circadien, et son rôle dans la constriction de la pupille. Les cellules photosensibles contenant la mélanopsine reçoivent une stimulation maximale par les courtes longueurs d’ondes du rayonnement lumineux, c’est-à– dire les lumières à dominante de bleu. Elles produisent un signal nerveux qui n’est pas traduit par une réponse visuelle mais par une stimulation de l’hypothalamus, une des parties du cerveau responsable de la gestion des rythmes circadiens, régulant ainsi la production de la mélatonine.
Les photorécepteurs visuels et non visuels contribuent tous les deux à l’éblouissement d’inconfort et à la photosensibilité. Les photorécepteurs rétiniens ganglionnaires envoient des informations principalement aux thalamus. Ils transmettent également les données de l’irradiance environnementale aux noyaux géniculés latéraux, permettant d’agir sur l’adaptation à la luminance impliquée dans l’éblouissement d’inconfort [9]. Ces photorécepteurs ganglionnaires non visuels, participant à la sensibilité à la lumière des personnes aveugles [10], interagiraient de même pour les personnes malvoyantes et bien voyantes. Par ailleurs, des recherches récentes montrent que l’inconfort lié à un éblouissement serait une réponse à une hyperexcitabilité ou une saturation des neurones visuels [11].
En prenant en compte les différents mécanismes physiologiques en lien avec la sensibilité à la lumière, trois grandes familles d’instrumentation permettent de caractériser l’impact de la présence de pathologies visuelles sur le degré de sensibilité : la sensibilité à la lumière corrélée à l’intégrité des milieux transparents ; la récupération des fonctions visuelles à travers l’analyse de la récupération des fonctions visuelles après un éblouissement central défini ; et le temps d’adaptation à l’obscurité ou à un décrément de luminance.
La sensibilité à l’éblouissement (communément appelé disability) évalue le degré de perte des performances visuelles (acuité visuelle et/ou sensibilité aux contrastes) lorsque le sujet regarde un stimulus visuel en présence d’une source lumineuse périphérique d’intensité et d’orientation variables selon le type instrumentation. Notons, par exemple, le Glare Test® de Métrovision ou le CSV-1000HGT ® de M&S Technology. L’ensemble de ces méthodes permettent d’apprécier l’impact de la dispersion lumineuse intraoculaire sur la baisse de performance visuelle (avec et sans source lumineuse) et de révéler la présence de halos lumineux. Ces évaluations sont effectuées sur écran ou sur des planches de tests et durent moins de 5 secondes. L’évaluation de la perte de performance visuelle oriente la prescription de filtre avec des spectres spécifiques dont l’objectif est d’absorber les longueurs d’ondes courtes responsables de la diffusion de la lumière dans l’oeil.
La résistance à l’éblouissement étudie la vitesse de récupération des fonctions visuelles après un éblouissement central calibré. Notons les trois instrumentations les plus connues : le test de Bailliart, le Brightness acuity test (BAT) et le nyctomètre de Comberg. Chaque instrument utilise un niveau de luminance et un temps d’exposition de la lumière différents. Le BAT, composé d’une hémisphère à poser sur l’oeil, diffuse trois niveaux de luminance (400, 100 et 12 ft-lambert). Après l’éblouissement, on note en secondes le temps pour retrouver l’acuité visuelle relevée avant la mise en éblouissement. Chaque instrumentation a ses propres valeurs de référence et interprétations. En cas d’atteinte maculaire, les yeux peuvent nécessiter jusqu’à 2 à 10 fois plus de temps pour récupérer l’acuité initiale.
Le but du test est de mesurer le temps de réponse du patient, placé à l’obscurité, à un stimulus de luminance décroissant. Au début de l’examen, le patient passe brutalement d’un stade d’éblouissement à une ambiance obscure : les bâtonnets sont alors neutralisés. La première partie de la courbe explore essentiellement le temps d’adaptation des cônes rétiniens, jusqu’à un certain seuil de luminance, à partir duquel l’adaptation des bâtonnets, sensibles à des niveaux de luminance plus faibles sera évaluée. Les deux parties de la courbe d’adaptation, délimitée par le point α seront analysées (Fig. 5-46). Une courbe monophasique représente par exemple une atteinte des bâtonnets en lien avec la présence de rétinopathie pigmentaire. Le déplacement du point α exprime une augmentation du temps d’adaptation des cônes, à savoir une déficience du système photopique des cônes, comme dans la myopie forte. L’examen a pour principal inconvénient le temps, à savoir 30 à 40 secondes. En clinique, l’adaptométrie de Goldmann-Weekers est l’appareil initialement connu ; notons également l’AdaptDx® de MacuLogix, Inc, ou le MonPackOne® de Metrovision.
Fig. 5-46 Représentation du temps d’adaptation à l’obscurité du système visuel.
La première courbe (verte) correspond à l’adaptation des cônes, suivie du point α, initiant ensuite le temps d’adaptation des bâtonnets (rouge).
La gestion de la lumière est une plainte majeure exprimée par les personnes malvoyantes. Cependant, les processus physiologiques ou neurologiques sous-jacents aux processus d’éblouissements sont complexes et malheureusement pas entièrement connus. Les différentes pathologies rétiniennes et/ou les opacités des structures oculaires fragilisent très fortement les mécanismes d’adaptation aux flux lumineux. Chaque patient exprimera des gênes spécifiques dans des situations lumineuses différentes. Une analyse complète des situations lumineuses pénalisantes pour le patient et l’analyse de sa sensibilité propre à la lumière (intensité, spectre, variation lumineuse, etc.) vont permettre d’orienter avec le professionnel de santé les meilleurs paramètres de filtres optiques et recommandations d’équipements connexes (port de chapeau, de visières). Les avancées scientifiques vont permettre d’optimiser les méthodologies d’explorations des mécanismes de sensibilité à la lumière et apporteront certainement de nouvelles approches de prise en charge.
[1] International Lighting Vocabulary. 4th ed. CIE 17.4, 1987.
[2] Mainster MA, Turner PL. Glare’s causes, consequences, and clinical challenges after a century of ophthalmic study. Am J Ophthalmol 2012 ; 153(4) : 587-93.
[3] Berman SM, Bullimore MA, Bailey IL, Jacobs RJ. The influence of spectral composition on discomfort glare for large size sources. Journal of the Illuminating Engineering Society 1996 ; 25(1) : 34-40.
[4] van den Berg TJ, Franssen L, Kruijt B, Coppens JE. History of ocular straylight measurement : A review. Z Med Phys 2013 ; 23(1) : 6-20.
[5] Stringham JM, Garcia PV, Smith PA, et al. Macular pigment and visual performance in low-light conditions. Invest Ophthalmol Vis Sci 2015 ; 56(4) : 2459-68.
[6] Stringham JM, Garcia PV, Smith PA, et al. Macular pigment and visual performance in glare : benefits for photostress recovery, disability glare, and visual discomfort. Invest Ophthalmol Vis Sci 2011 ; 52(10) : 7406-15.
[7] O’Connell E, Neelam K, Nolan J, et al. Macular carotenoids and age-related maculopathy. Ann Acad Med Singapore 2006 ; 35(11) : 821-30.
[8] Bullough JD. The blue-light hazard : A review. Journal of the Illuminating Engineering Society 2000 ; 29(2) : 6-14, 141.
[9] Brown TM, Gias C, Hatori M, et al. Melanopsin contributions to irradiance coding in the thalamo-cortical visual system. PLoS Biol 2010 ; 8(12) : e1000558.
[10] Amini A, Digre K, Couldwell WT. Photophobia in a blind patient : An alternate visual pathway. Case report. J Neurosurg 2006 ;105(5) : 765-8.
[11] Bargary G, Furlan M, Raynham PJ, et al. Cortical hyperexcitability and sensitivity to discomfort glare. Neuropsychologia 2015 ; 69 : 194-200.
- Chapitre 5
Évaluation du déficit visuel- 1 – Examen d’un déficient visuel au cabinet
- 2 – Fréquences spatiales et temporelles, et sensibilité aux contrastes
- 3 – L’examen de la vision chez l’enfant préverbal
- 4 – Micropérimétrie
- 5 – Monitorage du point de fixation
- 6 – Électrophysiologie et déficience visuelle
- 7 – Sémiologie des troubles visuels d’origine cérébrale
- 8 – Sensibilité à la lumière : fondements physiologiques et outils d’explorations