M. Cordonnier
Dépister le strabisme ne serait d’aucun intérêt s’il n’était associé à l’amblyopie. Si le strabisme est prononcé, il est remarqué par l’entourage et un dépistage est inutile ; si le strabisme est peu ou pas visible, en cas d’absence d’amblyopie, les conséquences esthétiques ou fonctionnelles minimes ne justifient pas non plus un dépistage.
Le dépistage du strabisme est donc étroitement lié au dépistage de l’amblyopie.
Dans le texte qui suit, l’âge préscolaire désigne les enfants de deux à cinq ans, l’âge scolaire allant de six à dix-huit ans.
Aucun dépistage visuel actuel n’a 100 % de sensibilité et de spécificité. Un bon dépistage présente une combinaison satisfaisante de sensibilité et de spécificité, sachant qu’améliorer l’une se fait en général au détriment de l’autre. La valeur prédictive positive d’un dépistage est liée à sa spécificité mais aussi à la prévalence de l’affection ciblée. En conséquence, le dépistage d’une affection à prévalence très basse ne peut jamais avoir une valeur prédictive positive très élevée. Pour ne pas être trompé par les chiffres d’une publication, il faut s’assurer de l’absence de biais dans l’échantillon dépisté et dans la procédure de vérification du test.
Un dépistage est l’application d’un ou plusieurs tests à une population donnée visant à identifier les individus potentiellement atteints d’une anomalie. La performance d’un dépistage se mesure en comparant ses résultats avec ceux d’un examen de référence et s’exprime le plus souvent en termes de sensibilité, spécificité, valeur prédictive positive (VPP) et valeur prédictive négative (VPN) (cf. encadré).
Plus la spécificité d’un dépistage est élevée, plus sa propension à éviter les faux positifs augmente, ainsi que sa VPP (du fait de la diminution de faux positifs). Le même raisonnement lie la sensibilité et la VPN.
On peut changer le seuil d’un test de dépistage en décidant de conditions plus strictes de positivité. On réduit ainsi le nombre total de positifs (vrais et faux) et on augmente le nombre total de négatifs (vrais et faux), ce qui entraîne généralement une diminution de sa sensibilité et une augmentation de sa spécificité. On ne peut pas améliorer à la fois la sensibilité et la spécificité d’un dépistage avec ce genre d’ajustement.
Ajouter un test supplémentaire à un dépistage, que le sujet doit également rater pour être considéré positif, rend ce dépistage plus exigeant. Cette action apporte donc un gain de spécificité, au détriment de la sensibilité.
En fonction des circonstances et de l’affection à dépister, c’est au promoteur du dépistage de choisir s’il préfère une sensibilité ou une spécificité élevée. Pour une affection mortelle, il faut absolument privilégier la sensibilité car il serait très grave de ne pas la dépister. Pour un dépistage visuel, vu que les anomalies réfractives, l’amblyopie ou le strabisme ne compromettent pas le pronostic vital et qu’il vaut mieux éviter de surcharger les ophtalmologues déjà peu nombreux par des faux positifs, une spécificité de 90 % ou plus est souhaitée.
L’appréciation d’un dépistage par le public concerné (parents, acteurs du dépistage, ophtalmologues qui examinent l’enfant référé) se fait en général par le seul intermédiaire de sa VPP, c’est-à-dire le nombre d’enfants positifs correctement référés. Or, il faut savoir que la VPP est non seulement liée à la spécificité du dépistage mais aussi à la prévalence de l’affection à dépister.
Pour exemple, le tableau 2-I rapporte certains paramètres d’un dépistage réfractif. Dans ce tableau, la sensibilité et la spécificité du test pour dépister la myopie au-delà de 3 d sont nettement plus élevées que celles obtenues pour l’hypermétropie. On constate cependant que la VPP pour dépister la myopie est largement inférieure à celle pour dépister l’hypermétropie (33 % versus 55 %). Ceci est uniquement lié au fait que la prévalence de la myopie est beaucoup plus basse que celle de l’hypermétropie.
Enfin, pour ne pas être trompés sur les résultats d’une publication concernant un dépistage, il faut vérifier si l’échantillon dépisté et examiné ne comporte pas de biais. Il y a essentiellement deux types de biais possibles dans les articles portant sur le dépistage :
le biais de vérification existe quand tous les enfants examinés n’ont pas été soumis à l’examen de référence. La proportion d’enfants examinés est souvent inférieure à celle de l’échantillon global car c’est généralement les dépistages positifs qui sont soumis à l’examen de référence, et dans une moindre mesure les dépistages négatifs ;
le biais de sélection se produit quand, par exemple, un dépistage est effectué parmi des enfants fréquentant une consultation ophtalmologique où les prévalences d’anomalies sont élevées, ne correspondant pas à celles d’une population non sélectionnée.
La présence de ces biais impose un recalcul des performances du dépistage, qui peuvent dès lors se révéler beaucoup moins attrayantes.
Les tableaux 2-II à 2-IV aideront le lecteur à comprendre comment ces qualités diagnostiques sont recalculées.
Dans le tableau 2-II, nous postulons une population non sélectionnée de 1 000 enfants dépistés, qui ont tous été soumis à l’examen de référence : si, en réalité, ce groupe de 1 000 enfants soumis à l’examen de référence ne représente qu’une partie du total des enfants dépistés, il y a un biais de vérification qui affecte les chiffres de sensibilité et de spécificité. Ces chiffres doivent être ajustés en pondérant les montants d’enfants dépistés positifs et négatifs, afin de faire correspondre le rapport entre les dépistages positifs et les dépistages négatifs.
Le tableau 2-III permet de faire ce calcul correctif de sensibilité et de spécificité. Supposons ici une proportion de tests positifs de 4 % au sein du total des enfants dépistés. On avait 90 positifs sur les 1 000 tests de dépistage (9 %) pour le tableau 2-II et on désire atteindre 4 %. On pondérera donc la ligne des dépistages positifs par 4 %/9 % et celle des dépistages négatifs par 96 %/91 %.
Si maintenant la population totale dépistée présente un biais de sélection — par exemple, la prévalence de la maladie dans l’échantillon est de 32,77/1 000 = 3,277 % ; or, la prévalence de cette maladie dans une population non sélectionnée est connue et avoisine généralement 1 % —, il faut faire le même type de calcul correctif pour obtenir les valeurs prédictives du test de dépistage au sein d’une population non sélectionnée.
Pour le tableau 2-IV, supposons une prévalence de 1 %. Au tableau 2-III, nous avions 3,277 % d’examens positifs et on désire atteindre 1 % pour correspondre à la prévalence ; il faut donc pondérer la colonne des examens positifs de 1 %/3,277 % et les examens négatifs de 99 %/96,723 %.
La prise en considération des deux biais (tableaux 2-III et 2-IV par rapport au tableau 2-II) a diminué nettement la sensibilité (67,8 % au lieu de 83,3 %) et la VPP (27,1 % au lieu de 55,5 %).


Tableau 2-I Données d’un dépistage réfractif de l’hypermétropie et de la myopie.
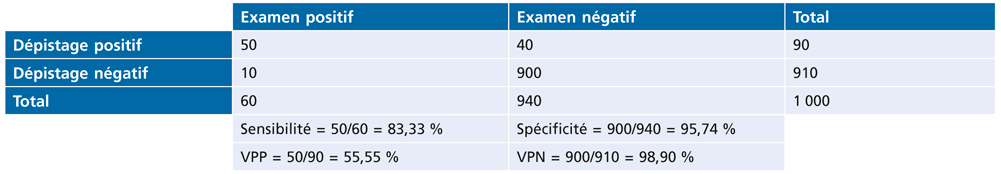
Tableau 2-II Calcul des performances diagnostiques d’un test de dépistage dans une population exempte de biais.

Tableau 2-III Calcul de la sensibilité et de la spécificité d’un test de dépistage en cas de biais de vérification.

Tableau 2-IV Calcul des valeurs prédictives d’un test de dépistage en cas de biais de sélection.
Pour justifier qu’une affection soit dépistée, les principes généraux suivants doivent être respectés :
la prévalence de l’affection doit être suffisamment élevée ;
l’histoire naturelle de l’affection doit être suffisamment connue pour permettre une détection précoce et un traitement efficace, avant le moment habituel de détection et de traitement lorsqu’il n’y a pas de dépistage ;
l’affection doit présenter un impact considérable sur la morbidité et sur la qualité de vie ;
le traitement doit être acceptable, efficace, accessible à tous et d’un coût raisonnable ;
les tests de dépistage doivent être simples, fiables, reproductibles et également d’un coût raisonnable.
Le dépistage du strabisme est lié à celui de l’amblyopie. Ils ont chacun une prévalence de 3 % à 5 %. La prévalence des anomalies réfractives amblyopigènes et strabogènes se situe aux environs de 10 %. La relation entre ces anomalies et l’amblyopie ou le strabisme n’est donc pas univoque.
Le niveau d’acuité visuelle défini comme critère diagnostique a un impact majeur sur l’estimation de la prévalence. Pour être utiles, nos efforts de dépistage et de traitement de l’amblyopie devraient permettre aux sujets dépistés et traités d’être capables de lire un texte de taille normale, à distance normale et à vitesse normale avec chaque œil séparément. Cette faculté nécessite une acuité visuelle de reconnaissance aux symboles groupés qui se situe entre 6/10 et 7/10 (Parinaud 2).
La prévalence de l’amblyopie — définie comme une acuité visuelle strictement inférieure à 6/10 — se situe entre 3 % et 5 % en l’absence de dépistage et de traitement conséquent ; cette valeur est suffisamment élevée pour justifier un dépistage.
Il n’y a pas de différence de prévalence entre les sexes [2, 15].
Les principaux facteurs amblyopigènes sont les anomalies réfractives et le strabisme. La prévalence de ceux-ci est supérieure à celle de l’amblyopie. Ceci s’explique car il existe des strabismes sans amblyopie ou des anomalies réfractives dont la simple correction par verres fait remonter l’acuité visuelle à un niveau normal. Une estimation approximative dans une population d’enfants préscolaires d’origine caucasienne situe la prévalence du strabisme entre 3 % et 5 % et celle des anomalies réfractives entre 8 % à 12 % [2, 4]. D’autres causes rares de l’amblyopie, comme les anomalies des paupières, des milieux transparents de l’œil ou de l’ensemble rétine/nerf optique et les nystagmus moteurs, comptabilisent une prévalence de 1 % ou moins.
Les anomalies de la réfraction oculaire participent pour 60 % à l’amblyopie, le strabisme pour 35 % à 40 %, les autres causes (ptosis, nystagmus, anomalies des milieux) pour environ 1 %.
Les anomalies de réfraction et le strabisme sont les deux causes les plus fréquentes d’amblyopie. Elles s’intriquent dans la genèse de l’amblyopie et ont avec celle-ci des interactions favorisant l’autoentretien, qui sont illustrées dans la figure 2-1.
En cas d’hypermétropie modérée à forte, l’accommodation mise en jeu pour la compenser favorise le strabisme convergent car il existe une synergie entre l’accommodation et la convergence. Cette tendance à la convergence n’entraîne pas de strabisme tant qu’elle est compensée par les capacités fusionnelles en divergence. Si ces capacités fusionnelles sont insuffisantes, il apparaît un strabisme convergent. Or, l’hypermétropie forte est amblyopigène en soi puisqu’elle est responsable d’un flou des images ; en favorisant le strabisme, elle cumule un facteur amblyopigène de plus.
Les autres anomalies réfractives favorisent également l’amblyopie par absence d’images de bonne qualité. Cette amblyopie s’accompagne d’une instabilité motrice de l’œil, favorisant le strabisme qui est lui-même un facteur amblyopigène. Le strabisme favorise l’amblyopie, ce qui peut avoir des répercussions sur la réfraction en entraînant une anisométropie secondaire, laquelle facilite l’entretien de l’amblyopie. Une anomalie de structure de l’œil peut troubler légèrement la vue et favoriser le strabisme, celui-ci ajoutant à la malvoyance « organique » une malvoyance « fonctionnelle » par le biais de l’amblyopie.
Comme le strabisme et les anomalies de la réfraction oculaire sont des causes d’amblyopie étroitement liées entre elles, les chiffres attribuant la responsabilité de l’une ou l’autre cause à l’amblyopie dépendent de l’âge des sujets étudiés et de la recherche effective d’anomalies de la réfraction oculaire. Les revues générales et traités anciens ont attribué au strabisme le rôle principal dans la genèse de l’amblyopie. Cependant, les études plus récentes mesurant la réfraction chez des enfants plus jeunes, âgés de trois à sept ans, donnent aux anomalies de la réfraction oculaire un rôle prépondérant par rapport au strabisme dans la genèse de l’amblyopie : 55 % à 65 % de cause réfractive à l’amblyopie pour 25 % à 45 % de cause d’origine strabique (fig. 2-2). D’autres causes rares de l’amblyopie sont les opacités des milieux intraoculaires, le ptosis et le nystagmus moteur.
La discordance entre les études plus anciennes et les études plus récentes émane du fait que les troubles de la réfraction, tels que l’anisométropie et en particulier l’hypermétropie, peuvent conduire ultérieurement au strabisme. Comparée à l’ésotropie précoce survenant avant l’âge de six mois et dont la prévalence est faible (autour de 1 %), l’ésotropie accommodative, environ trois fois plus fréquente, apparaît le plus souvent après l’âge de deux ou trois ans. Si les données concernant la réfraction sont inconnues, on peut attribuer à tort une amblyopie à une ésotropie d’origine accommodative. En réalité, c’est le trouble de la réfraction oculaire qui a favorisé le strabisme et conduit à l’amblyopie. La correction optique de l’anomalie réfractive avant le développement du strabisme peut prévenir tant le strabisme que l’amblyopie.
Un autre point de confusion provient du fait que, si le strabisme est classé après les anomalies réfractives dans l’ordre d’importance des facteurs amblyopigènes, le risque amblyopigène du strabisme, une fois présent, est en revanche plus important que celui des anomalies réfractives.
Enfin, bien qu’il y ait de nombreuses preuves que les troubles de réfraction précèdent le strabisme et l’amblyopie chez de nombreux enfants, l’inverse peut parfois se produire, causant une confusion supplémentaire : la réfraction de l’œil fixateur non amblyope évolue avec le temps vers des valeurs plus négatives ou moins positives, tandis que celle de l’œil amblyope reste plus stable, conduisant à une anisométropie secondaire.

Fig. 2-1 Interaction des facteurs amblyopigènes dans la genèse de l’amblyopie.
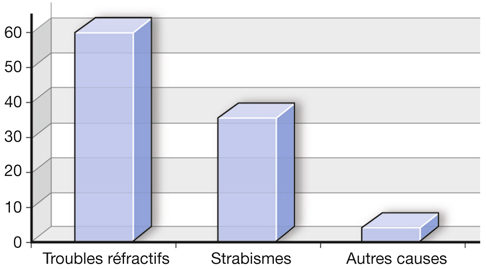
Fig. 2-2 Rôle proportionnel moyen (%) des facteurs amblyopigènes dans la genèse de l’amblyopie parmi les enfants âgés de trois à sept ans.
Les troubles réfractifs interviennent pour environ 60 % des causes d’amblyopie, tandis que le strabisme n’intervient que pour 35 % à 40 % et les troubles de milieux pour 1 %.
Lorsqu’on compare les données réfractives d’une population d’adultes à celle d’une population de nouveau-nés, il paraît évident que les erreurs réfractives ne sont pas un phénomène statique au cours de la vie. À la naissance, les erreurs réfractives sont normalement distribuées, suivant une courbe gaussienne dont le sommet correspond à + 2 d et la déviation standard à 2,75 d. Chez l’adulte, la variabilité est beaucoup plus réduite : la courbe est anormalement pointue et étroite, son sommet équivaut à + 1 d et la déviation standard n’est plus que de 1 d seulement.
Cette tendance naturelle de la réfraction à passer d’un état variable, habituellement amétropique, à un état moins variable et emmétropique s’appelle l’emmétropisation. Ce processus s’exerce principalement pendant la première année de vie et encore, à moindre effet, durant les deux années suivantes.
Les études longitudinales montrent que la relation entre les anomalies réfractives et le développement subséquent de strabisme ou d’amblyopie n’est pas simple. En effet, des anomalies réfractives importantes peuvent exister chez le nourrisson puis disparaître. Ce processus d’emmétropisation est à la fois passif, lié au fait que l’œil subit une croissance au même titre que les autres parties du corps, et actif, lié à l’expérience visuelle. La part active du processus explique que des anomalies réfractives importantes dans les premiers mois de vie peuvent avoir totalement régressé à l’âge d’un an, ce qui ne serait pas explicable par la simple croissance passive de l’œil.
Les facteurs responsables du processus d’emmétropisation sont encore inconnus. L’accommodation joue peut-être un rôle mais ni le blocage de celle-ci, ni la section du nerf optique n’arrêtent l’emmétropisation. Des neurotransmetteurs et des facteurs de croissance dont le taux serait modulé par l’activité rétinienne pourraient jouer un rôle.
En conclusion, l’état des connaissances actuelles sur l’emmétropisation chez l’homme montre que ce processus s’exerce principalement pendant la première année de vie, mais encore à moindre effet durant les deux années suivantes. Il n’est donc pas utile de pratiquer un dépistage réfractif avant neuf à douze mois, vu que la réfraction change considérablement au cours de la première année : des erreurs réfractives importantes à la naissance peuvent disparaître complètement à l’âge d’un an. La persistance d’anomalies réfractives importantes au cours des premières années de vie signe un défaut de ce processus d’emmétropisation. Ce défaut est lié à l’amblyopie et au strabisme et il contient une dynamique d’autoentretien puisque le défaut d’emmétropisation empêche les images nettes et favorise l’amblyopie qui favorise à son tour le défaut d’emmétropisation, etc.
Les références de base du sujet suivant ne sont pas indiquées, vu leur abondance. Elles sont détaillées par l’auteur dans un article de synthèse et dans un livre [4, 5].
Les chiffres suivants donnent une estimation approximative de la prévalence des anomalies réfractives potentiellement amblyopigènes parmi les enfants caucasiens âgés d’un à cinq ans :
7 % à 8 % d’hypermétropie significative, supérieure à 3 à 3,75 d ;
5 % à 6 % d’astigmatisme significatif, supérieur à 1,5 à 2 d ;
2 % d’anisométropie significative, supérieure à 1,5 d ;
0,3 % de myopie significative, supérieure à 3 à 4 d.
Il est utile de séparer l’hypermétropie faible qui correspond à un état réfractif normal chez l’enfant, sans risque amblyopigène, constituant la population la plus large des dépistages réfractifs à l’âge d’un an, de l’hypermétropie forte qui prédispose au strabisme et à l’amblyopie. La frontière entre les deux groupes se situe dans la zone de + 3,5 d à + 4,0 d. L’hypermétropie forte supérieure à 3,5 d est l’anomalie de la réfraction oculaire qu’on rencontre le plus fréquemment (environ 7 % à 8 %) lors des dépistages réfractifs effectués entre six mois et cinq ans. Selon Atkinson, les nourrissons âgés de sept à neuf mois qui ont une hypermétropie supérieure à + 3,5 d sont treize fois plus susceptibles de présenter un strabisme et six fois plus susceptibles de présenter une amblyopie à l’âge de quatre ans que les enfants qui ne présentent pas d’anomalie de la réfraction oculaire [1]. Il est intéressant de noter que le déficit d’acuité visuelle à l’âge de quatre ans n’est pas nécessairement unilatéral chez les hypermétropes forts, mais souvent bilatéral. La sous-correction de 1 d de cette hypermétropie entraîne quatre fois moins de risque de strabisme et deux fois et demie moins de risque d’amblyopie que la non-correction. Cette sous-correction n’entrave pas le processus d’emmétropisation. Des constatations de même ordre sont faites par d’autres auteurs : chez les enfants dépistés hypermétropes forts et corrigés précocement, l’acuité visuelle est meilleure et le risque de strabisme est plus faible.
En conclusion, l’hypermétropie au-delà de + 3,5 d à + 4 d chez les enfants en âge préscolaire est fréquente (7 % à 8 %) et est un facteur de risque important d’amblyopie et de strabisme.
Cette anomalie de la réfraction oculaire est également séparée en deux groupes, comme c’est le cas pour l’hypermétropie, la zone frontière se situant aux environs de – 3 d. La myopie supérieure à 3 d est rare parmi les enfants en bonne santé, sa prévalence étant estimée à 0,25 % chez les enfants âgés d’un an. La myopie inférieure à – 3,5 d vers l’âge d’un an aurait tendance à diminuer à l’âge de trois ans selon certains auteurs.
Il ne semble donc pas utile de corriger d’emblée une faible myopie symétrique (inférieure à – 1,5 d) présente à l’âge d’un an car, d’une part cette anomalie n’est pas amblyopigène, autorisant une vision nette dans un espace rapproché, et, d’autre part, elle pourrait disparaître avec le temps. Cette myopie faible peut également être le résultat d’une cycloplégie insuffisante, fréquente à cet âge.
Cependant, la myopie bilatérale supérieure à – 3 d chez le nourrisson, qui empêche une vision nette au-delà de 30 cm et qui ne montre pas de tendance à la diminution si elle n’est pas corrigée, justifie une correction. Celle-ci a pour but de réduire ou arrêter l’évolution de la myopie et d’améliorer l’acuité visuelle.
La véritable amblyopie due à une myopie forte bilatérale sans strabisme a été décrite par plusieurs auteurs, le risque existant surtout à partir de – 6 d de myopie.
En conclusion, la myopie anormale et symétrique est rare et n’est pas nécessairement amblyopigène à moins d’être sévère (supérieure à – 6 d) et présente dès le jeune âge.
L’astigmatisme atteint une prévalence d’environ 50 % au cours de la première année de vie. La majeure partie disparaît au cours de la deuxième année. L’astigmatisme est en général considéré comme significatif à partir d’une valeur de 1 d ou plus. Toutefois, de nombreux ophtalmologues ne prescrivent pas de correction pour les enfants n’ayant pas atteint l’âge de douze mois si l’astigmatisme est inférieur à 2 d. L’astigmatisme peut diminuer spontanément entre l’âge d’un an et l’âge de quatre ans.
Les enfants âgés d’un an à quatre ans présentant un astigmatisme constant, croissant ou oblique supérieur à 1 d sont à risque d’amblyopie.
Chez les enfants strabiques présentant une hypermétropie avec astigmatisme supérieur à 1 d, la correction précoce (avant deux ans et demi) de leur astigmatisme améliore l’acuité visuelle de l’œil dominant par rapport aux enfants présentant des caractéristiques identiques mais ayant eu une correction tardive à l’âge de huit ans.
Une amblyopie amétropique sans strabisme peut survenir pour des cylindres allant de 3,25 d à 5 d.
En conclusion, l’astigmatisme supérieur à 1 d peut diminuer, persister ou croître entre un an et quatre ans. L’évolution de la réfraction aide à détecter l’astigmatisme persistant ou croissant, qui est amblyopigène, au même titre que l’astigmatisme oblique. À partir de 3 d d’astigmatisme symétrique bilatéral, il existe un risque d’amblyopie amétropique bilatérale.
Parallèlement à l’astigmatisme, l’anisométropie peut considérablement changer durant les premières années de vie. Une anisométropie importante à l’âge d’un an peut avoir complètement disparu à l’âge de quatre ans. Inversement, un enfant isométrope à l’âge d’un an peut développer une anisométropie anormale à l’âge de quatre ans. L’astigmatisme et l’anisométropie sont souvent associés.
L’anisométropie supérieure à 1 d peut être amblyopigène, le risque allant de 10 % à 30 % (tableau 2-V). L’anisométropie supérieure à 3 d à l’âge d’un an est encore présente à l’âge de dix ans dans 90 % des cas, et le risque de développement d’une amblyopie est important (60 %).
Il est généralement admis que l’anisohypermétropie est beaucoup plus amblyopigène que l’anisomyopie. Sans référence à des données provenant d’études, le consensus du comité directeur du groupe d’étude Vision in Preschoolers (VIP) donne de l’anisométropie importante la définition suivante : « Différence entre les deux yeux supérieure à 1 d dans l’hypermétropie, à 3 d dans la myopie et à 1,5 d dans l’astigmatisme » [24].
En conclusion, chez les enfants âgés d’un an à quatre ans, l’anisométropie entre 1 d et 3 d justifie plusieurs contrôles réfractifs pour évaluer son évolution dans le temps. Si l’anisométropie est égale ou supérieure à 3 d, elle est clairement amblyopigène. L’anisohypermétropie et l’anisoastigmatisme sont plus amblyopigènes que l’anisomyopie.

Tableau 2-V Prévalence des facteurs amblyopigènes et risques amblyopigènes et strabogènes associés.
De prévalence élevée, l’hypermétropie anormale comporte environ 35 % de risque d’amblyopie et de strabisme. L’anisométropie est également amblyopigène et strabogène, mais sa prévalence est environ deux à trois fois plus faible.
Le tableau 2-V rassemble des données de plusieurs études qui concernent des populations européennes ou américaines d’enfants d’un an à six ans. Ce tableau n’a qu’une valeur indicative ; il permet de préciser les risques d’amblyopie et de strabisme relatifs aux principaux facteurs amblyopigènes. Dans l’ensemble sont repris les chiffres les moins et les plus élevés. Les différences sont souvent explicables par des définitions différentes de l’amblyopie ou par un âge différent des populations. L’anisométropie et l’astigmatisme conduisent à des taux d’amblyopie différents selon qu’ils disparaissent, persistent ou augmentent entre un an et quatre ans.
Il n’y a pas d’études longitudinales montrant l’évolution naturelle de l’amblyopie non traitée car ce genre d’études ne serait pas éthiquement acceptable. Toutefois, l’observation du devenir des enfants non adhérents au traitement montre que l’amblyopie s’aggrave au cours de l’enfance. Les études comparant la prévalence de l’amblyopie dans les populations n’ayant pas bénéficié d’un dépistage à celles bénéficiant d’un dépistage montrent une prévalence plus élevée chez les premières, appuyant le fait que l’amblyopie ne se résout pas spontanément avec l’âge.
Ces observations sont en faveur d’un dépistage.
Le strabisme altère principalement la qualité de vie psychosociale de l’adulte. Chez l’enfant, l’amblyopie strabique altère les performances des tâches de dextérité manuelle sous contrôle visuomoteur. Il n’y a en revanche pas d’études robustes de population démontrant que l’amblyopie unilatérale sans strabisme altère la qualité de vie de l’adulte aussi longtemps qu’il n’y a pas perte du bon œil. L’amblyopie comporte toutefois un risque à peu près double de handicap visuel bilatéral.
Pour rappel, l’Organisation mondiale de la santé considère qu’une vision est normale si elle est supérieure ou égale à 8/10.
L’impact de l’amblyopie unilatérale sur la qualité de vie comporte plusieurs aspects, la plupart de ceux-ci étant estimé à l’échelle individuelle — il n’existe que peu d’études robustes de population.
Hormis le cas du strabisme, le retentissement négatif sur la confiance en lui-même de l’individu amblyope semble surtout lié aux conséquences du traitement de l’amblyopie (moqueries à l’école) qu’à l’amblyopie elle-même. Cet aspect plaide en faveur d’un dépistage et d’un traitement en âge préscolaire car les moqueries et leurs conséquences sur le psychisme de l’individu s’accroissent à l’âge scolaire. Sinon, il n’y a pas de preuve que l’adulte amblyope unilatéral s’insère moins bien dans la société, souffre de troubles du comportement ou d’une mortalité plus élevée [2].
Elle serait plutôt liée à l’amblyopie strabique qui amoindrit les performances d’habileté motrice fine, surtout pour les tâches de dextérité manuelle demandant de la vitesse et de la précision. Si ce fait est actuellement prouvé chez l’enfant [10, 26, 28], il manque toujours de données précises pour en indiquer les conséquences sur la perte d’utilité chez l’adulte. Il n’y a pas de différence significative dans la profession effectuée chez les amblyopes — ceux-ci étant définis comme ayant une acuité visuelle de l’œil amblyope de 6/10 ou moins — et les non-amblyopes. Cependant, moins de sujets amblyopes accèdent aux études universitaires par rapport aux non-amblyopes (différence légèrement significative p = 0,05) [2].
L’amblyopie unilatérale place celui qui en souffre dans une situation à risque de cécité et à risque d’accident. Le risque de cécité existe s’il y a maladie du bon œil. En effet, les sujets amblyopes sont victimes au même titre que les autres des pathologies oculaires courantes, l’amblyopie ne constituant aucunement un facteur de protection contre ces affections. Dans nos pays où l’espérance de vie est considérable, les quatre premières grandes causes de cécité sont la dégénérescence maculaire sénile, le diabète, la cataracte et le glaucome. Ces pathologies menacent l’amblyope de malvoyance voire de cécité si le bon œil est atteint. Une autre source de morbidité chez les amblyopes âgés provient de la crainte des chirurgiens ophtalmologiques d’opérer le bon œil en cas de cataracte ou autres affections relevant de la chirurgie, le délai de décision opératoire étant alors retardé, ce qui met l’amblyope dans une situation de malvoyance bilatérale. Chez l’amblyope, le risque d’accident (de son bon œil ou d’autre partie de lui-même) est environ deux à trois fois plus élevé que dans la population générale [20], car le champ visuel peut être réduit et les obstacles moins bien évités.
Pour toutes ces raisons, l’amblyopie comporte un risque à peu près double de handicap visuel bilatéral, soit par maladie soit par accident. Comparés aux individus non amblyopes, les amblyopes expérimentent ce handicap visuel en moyenne six mois de plus [27].
Les aspects économiques liés à la perte du bon œil sont abordés dans la section consacrée à l’efficience et au coût du dépistage.
Lorsque l’acuité visuelle du mauvais œil est inférieure à 1/10, la stéréoscopie est rarement présente et l’accès aux métiers comportant le montage fin de pièces, la soudure, le ponçage, la gravure ou l’utilisation d’instruments binoculaires peut être compromis. Par ailleurs, l’interdiction d’accès à certains métiers pénalise l’amblyope ou le strabique car il existe souvent des critères légaux limitatifs de vision et de binocularité pour l’armée, la police, l’aviation, le corps des pompiers et le transport de personnes.
La morbidité qui en découle est essentiellement liée à la profondeur de l’amblyopie et donc au score de vision binoculaire :
du point de vue fonctionnel, lorsque l’acuité visuelle binoculaire avec correction est de 5/10 à 8/10 (ce qui est le cas de la majorité des amblyopies bilatérales dans nos contrées), le handicap est jugé minime : le sujet est capable d’exercer la plupart des professions (hormis celles citées plus haut comportant des critères légaux d’aptitude visuelle) ;
lorsque la vision binoculaire est de 3/10 à 5/10, il est difficile d’accéder à la plupart des métiers : tout ce qui exige la lecture, l’utilisation d’instruments de mesure, la soudure, le montage minutieux de pièces est exclu, de même que tout ce qui nécessite la reconnaissance de signaux visuels de danger sur des produits ou des visages (portiers, magasiniers, électriciens etc.). Le travail sur écran est possible avec adaptation des conditions de travail (agrandissement des images sur l’écran). En dessous du seuil de 3/10, il n’y a quasi aucune chance que le candidat puisse trouver place sur le marché normal du travail ;
par ailleurs, l’obtention du simple permis de conduire (voiture légère), indispensable dans certains cas pour exercer un métier, suppose une acuité visuelle binoculaire d’au moins 5/10. Ce score exigé est le même en cas de vision monoculaire (perte d’un œil, par exemple, ou occlusion volontaire d’un œil suite à une diplopie).
La présence d’un strabisme retentit sur le bien-être psychique de l’enfant et de son entourage. L’enfant lui-même en est toutefois rarement conscient avant l’âge de quatre à cinq ans.
À l’âge adulte, les sujets strabiques nouent plus difficilement des liens d’amitié, ont moins d’interactions sociales et une moins bonne image d’eux-mêmes que les sujets non strabiques [2]. Ils peuvent également souffrir de troubles fonctionnels : dans une série de quatre cent quarante-neuf cas de strabisme ayant consulté le service d’ophtalmologie de Nantes après l’âge de quinze ans, Quéré et Mehel ont relevé les plaintes suivantes [22] :
19,3 % de gêne à la lecture prolongée, à la conduite automobile, pour regarder la télévision ou travailler sur écran ordinateur ;
10,4 % de diplopie permanente.
L’influence de l’amblyopie et du strabisme sur les interactions sociales de l’enfant lui-même reste encore à étudier.
Le résultat du traitement de l’amblyopie est meilleur avant l’âge de trois à quatre ans, période alliant une plasticité visuelle et une adhésion au traitement plus élevées.
Sans traitement, la vision de l’œil amblyope peut se détériorer, amenant une majoration de l’amblyopie. De même, une amblyopie peut s’installer en présence de facteurs amblyopigènes non traités. Le traitement consiste essentiellement en la prescription de verres correcteurs pour envoyer au cerveau une image de bonne qualité, et en une pénalisation de l’œil dominant par occlusion sur peau ou atropine et/ou pénalisation optique. Il s’agit d’un traitement simple, d’un coût à la portée de la plupart des parents, qui comporte 70 % à 93 % de succès. L’adhésion au traitement et un traitement instauré le plus précocement possible sont les deux facteurs majeurs déterminant son succès. Ces deux facteurs sont liés car l’âge intervient dans l’adhésion au traitement. Le niveau initial d’acuité visuelle joue aussi un rôle, l’adhésion au traitement étant moins bonne si l’acuité visuelle est très mauvaise au départ. Encore une fois, ce facteur dépend aussi de l’âge : à traitement tardif correspond en général une acuité visuelle de départ moins bonne [2].
Le type d’amblyopie a aussi de l’importance : l’amblyopie strabique a en général un taux de guérison moins bon que l’amblyopie sans strabisme, l’amblyopie la plus difficile à traiter étant l’amblyopie strabique associée à une anisométropie.
La majeure partie du gain visuel suite au traitement est acquise en trois mois. Lorsque le traitement est instauré à l’âge de deux ans, la guérison est plus rapide et plus stable que lorsqu’il est instauré à l’âge de quatre ans [16]. Les études MOTAS et PEDIG montrent une différence significative dans le résultat du traitement par occlusion avant cinq ans qu’après [9, 25].
Il existe un bénéfice léger mais significatif à dépister avant l’âge de quatre à cinq ans. Ce bénéfice concerne le traitement de l’amblyopie et, probablement, aussi celui du strabisme, entraînant une moindre fréquence de chirurgie.
Ce sont les pays scandinaves qui ont été les grands précurseurs en matière de dépistage visuel, organisant celui-ci à l’âge de quatre ans depuis les trois dernières décennies. Ils ont pu ainsi constater les bénéfices de leur dépistage visuel à l’âge de sept ans [15] :
la prévalence globale de l’amblyopie est réduite de moitié ;
les amblyopies sévères d’acuité visuelle inférieure ou égale à 1/10 sont quasi éliminées.
Comme la plasticité cérébrale visuelle est optimale avant cet âge, un dépistage positif avant quatre ans suivi d’un traitement devrait être encore plus efficace. De nombreuses études récentes ont été faites pour comparer les résultats d’un traitement entamé à l’âge préscolaire suite à un dépistage, par rapport à des traitements plus tardifs. Dans l’ensemble, ces études [2, 20] concluent à un bénéfice léger mais significatif, plaidant en faveur d’un dépistage avant quatre à cinq ans.
Le gain d’un traitement avant quatre à cinq ans continue également de s’affirmer si on considère les études qui montrent la diminution du risque relatif de strabisme par la correction de l’hypermétropie forte avant cet âge. Dans son vaste article sur le dépistage visuel, Carlton rapporte un déclin dans la fréquence des interventions chirurgicales du strabisme. Cette constatation serait expliquée par une diminution absolue de la prévalence du strabisme et/ou par une prise en charge globale plus précoce des anomalies strabogènes dans nos populations pédiatriques, entraînant une moindre nécessité d’opérer [2].
Il existe plusieurs méthodes de dépistage visuel qui se fondent essentiellement sur deux stratégies différentes :
la première consiste à mesurer directement le défaut visuel par des tests sensoriels subjectifs (mesure de l’acuité visuelle et/ou de la vision stéréoscopique) ;
l’autre consiste à prédire indirectement l’existence possible de ce défaut par la mise en évidence objective de facteurs amblyopigènes, à savoir les erreurs réfractives, le strabisme et les opacités des milieux.
NB : Une nouvelle méthode directe actuellement en cours de validation étudie la fixation et l’alignement en utilisant les qualités de biréfringence des fibres maculaires. Tout en étant directe, elle ne nécessite que peu de coopération et aucune réponse verbale de la part de l’enfant. Elle est extrêmement rapide (2,5 secondes) et représente à notre avis la solution idéale future du dépistage (cf. infra).
Le dépistage de l’acuité visuelle en âge préscolaire doit mesurer l’acuité visuelle de reconnaissance, ou morphoscopique. Le test doit comporter des optotypes adéquats à progression logarithmique et se faire à une distance rapprochée (1,5 m à 4 m selon l’âge et le test choisi). Les seuils d’acuité visuelle doivent être adaptés à l’âge. La mesure de l’acuité visuelle demande plus de temps que les méthodes objectives (au moins le double). Les tests stéréoscopiques sont peu discriminants pour le dépistage de l’amblyopie.
La méthode subjective de mesure de l’acuité visuelle correspond à la première stratégie. Des symboles graphiques ou imagés de taille progressivement décroissante sont présentés à l’enfant, chaque œil étant testé séparément. L’enfant doit nommer correctement le symbole, ou identifier en le montrant du doigt le même symbole sur une planche à sa disposition (appariement d’image). L’acuité visuelle est déduite du plus petit symbole que l’enfant est capable de reconnaître. L’acuité visuelle de loin est plus fiable que celle de près car moins influencée par le contrôle exact de la distance.
Une revue des méthodes utilisées pour tester l’acuité visuelle en âge préscolaire suggère les directives suivantes : utilisation d’optotypes à progression logarithmique, en forme de lettres (« E », « C » de Landolt ou variantes « HOTV ») ou de symboles. Si des optotypes isolés sont utilisés, il faut alors y adjoindre des barres d’interaction de contour. Le test doit pouvoir fonctionner comme un test d’appariement pour permettre des réponses non verbales. Pour les « E », il faut considérer que trois choix sont acceptables (haut, bas ou de côté) et non pas quatre, car les enfants de trois ou quatre ans n’ont pas encore suffisamment intégré la différence gauche/droite. À cet âge, il faut aussi réduire la distance d’examen à 3-4 m au lieu des 5-6 m habituellement utilisés chez les adultes. Les critères d’anomalies doivent être adaptés à l’âge : la valeur seuil d’acuité visuelle doit idéalement être différente pour les enfants de trois ans que pour ceux de quatre à cinq ans. Dans les études du Vision in Preschoolers (VIP) Study Group, le seuil d’acuité considéré comme anormal est « inférieure à 4/10 » chez les enfants de trois ans, et « inférieure à 5/10 » chez les enfants de quatre et cinq ans, ainsi que deux lignes ou plus de différence d’acuité visuelle [7]. Faisant le bilan du dépistage d’acuité visuelle en Scandinavie qui exigeait 8/10 ou plus chez les enfants de quatre ans et 10/10 ou plus chez les enfants de cinq ans et demi, Ohlsson et Sjöstrand estiment rétrospectivement ces seuils trop contraignants car responsables de nombreux positifs. Ils proposent de fixer à 6,5/10 le seuil chez les enfants de quatre à cinq ans [20].
Il ressort des études [2, 14] que le test Lea Symbols® figure parmi les meilleurs tests d’acuité visuelle préscolaire, avec un taux de réalisabilité excellent (plus de 95 %), aussi bien pour les enfants de trois ans que pour ceux de quatre à cinq ans. Une variante très intéressante de ce test a été développée par le groupe d’études américain VIP [8] : le Single, crowded Lea Symbols® VA screening test (Good-Lite Co., Elgin, IL) à 1,5 m (fig. 2-3). Il donne d’excellents résultats chez les enfants de trois ans pour des dépisteurs non qualifiés (test réalisable dans plus de 95 % des cas, sensibilité de détection de toute anomalie d’environ 70 % pour une spécificité à 90 %). Ce test se présente comme un disque rotatif faisant apparaître l’optotype dans une petite fenêtre et comporte l’avantage d’une présentation isolée avec des barres d’interaction de contour, ce qui l’assimile à une présentation groupée. Il nous paraît toutefois utile de préciser que la tranche d’âge des enfants de trois ans concernés par cette étude allait de trois ans et cinq mois à trois ans et onze mois, avec une moyenne de trois ans et neuf mois [7], ce qui plaide en faveur d’un âge minimum de trois ans et demi pour un dépistage d’acuité visuelle.
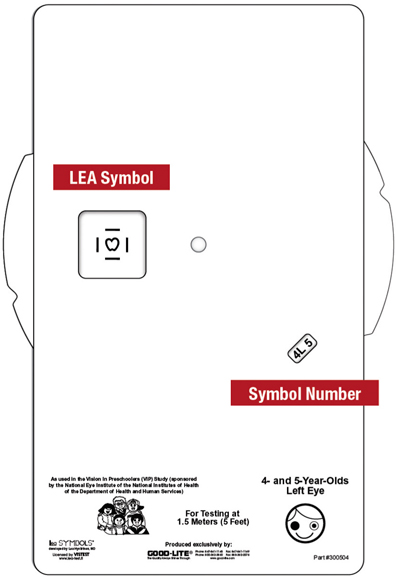
Fig. 2-3 Test Single, crowded Lea Symbols® VA screening.
(Avec l’aimable autorisation des laboratoires Good-Lite.)
La méthode se fondant sur une telle mesure est celle du regard préférentiel mesurant l’acuité visuelle de résolution. Elle est faisable chez de très jeunes enfants, de quatre à dix-huit mois. Des panneaux légers sont successivement présentés à l’enfant par une ouverture ménagée dans un cadre ressemblant à un petit théâtre de marionnettes. Ces panneaux sont recouverts d’un fond gris uniforme et comportent sur une de leur moitié un motif imprimé constitué par un réseau de profil de luminance sinusoïdal, de fréquence spatiale croissante (fig. 2-4). L’examinateur est situé derrière le panneau et observe au travers d’un pertuis central par où se dirige le regard de l’enfant — sur la figure 2-4, le regard de l’enfant devrait se diriger à la droite de l’examinateur s’il perçoit le motif à lignes. L’examinateur assume que si l’enfant regarde systématiquement du côté du motif, c’est qu’il le voit. La luminance du motif est identique à celle du fond et constante dans toute la série des panneaux. L’acuité visuelle mesurée par cette méthode atteint 1/10 à trois mois, 2/10 à dix mois, 3/10 à neuf mois et 4/10 à un an.
Elle a été critiquée par plusieurs auteurs, pour plusieurs raisons :
l’acuité visuelle au réseau n’est pas équivalente à l’acuité visuelle morphoscopique : des enfants ayant une acuité visuelle normale au réseau se sont finalement avérés amblyopes après mesure d’acuité morphoscopique ;
il s’agit d’une mesure d’acuité visuelle de près : on peut ainsi passer à côté d’une myopie ;
ce test sollicite la rétine périphérique : en cas de maculopathie, l’acuité visuelle au réseau peut être faussement rassurante.
En cas de strabisme convergent avec fixation croisée, l’enfant peut ne pas manifester d’intérêt pour les motifs situés en temporal de l’œil stimulé, faisant faussement croire à une mauvaise acuité.
Cette forme de dépistage précoce a été incluse puis retiré dans le carnet de santé des jeunes français pour tous les enfants âgés de neuf mois. Ce test n’a pas sa place dans un dépistage préscolaire d’acuité visuelle.

Fig. 2-4 Détermination de l’acuité par la recherche du regard préférentiel.
Une autre méthode correspondant à la première stratégie emploie les tests de vision stéréoscopique ou de mise en évidence de suppression en vision binoculaire. Ces tests sont réalisés avec ou sans lunettes. Ils sont en général réalisables par du personnel non qualifié et plus rapides que la prise d’acuité visuelle puisqu’ils testent les deux yeux en même temps, raccourcissant de moitié le temps du dépistage. Ils souffrent cependant d’un manque de sensibilité car ils peuvent être réussis alors qu’une amblyopie non négligeable existe. Parmi tous les tests, celui de Lang est sans doute le plus facile à réaliser en âge préscolaire.
La plupart des études s’accordent pour reconnaître que l’ajout d’un test de vision stéréoscopique à un dépistage par mesure d’acuité visuelle ou par autoréfractométrie non cycloplégique n’augmente guère la sensibilité du dépistage :
Köhler et Stigmar ont étudié les résultats d’un dépistage chez 2 447 enfants âgés de quatre ans et ont constaté que 97 % des désordres visuels significatifs sont dépistés par l’acuité visuelle uniquement ; les 3 % restant étaient dépistés par le test à l’écran (1 %) et le test de Titmus (2 %). L’ajout du test de Titmus à la mesure de l’acuité visuelle ne permettait finalement de dépister que 0,12 % de désordres visuels significatifs par rapport aux 6 % dépistés par l’acuité visuelle uniquement. Ces constatations ont conduit leurs auteurs à abandonner le test de Titmus dans leur dépistage ultérieur [13] ;
les études du VIP study group font la même constatation : la combinaison du Stereo Smile test II à la mesure d’acuité visuelle ou à l’autoréfraction n’augmente pas la sensibilité du dépistage [6] ;
une analyse d’un échantillon de 3 037 enfants d’une population non sélectionnée, dépistés par du personnel qualifié en communauté française de Belgique sur une durée de vingt-deux mois, permet de constater que 326 (10,73 %) enfants sont dépistés positifs, dont 73 (2,4 %) strabismes et 260 (8,5 %) anomalies réfractives. En étudiant la rentabilité des tests de réfraction et des tests orthoptiques, on constate que l’association « réfractomètre et Lang » n’identifie que 0,01 % d’enfants supplémentaires par rapport au réfractomètre seul.
Les autres méthodes subjectives, telles que la recherche d’une asymétrie du nystagmus optocinétique ou d’une fixation préférentielle, ne sont pas assez fiables pour servir de dépistage.
Les avantages de ces méthodes subjectives sont les suivants : leur coût est faible (moins de 500 �), car leurs supports sont le plus souvent petits, solides et économiques (cartes, par exemple) ; la compréhension des tests est facile pour le personnel qui l’administre ; enfin, ces méthodes sont fondées sur une mesure directe de la fonction visuelle plutôt que sur une présomption d’anomalie de celle-ci par des tests indirects.
Ces méthodes requièrent pour la plupart une coopération de l’enfant qui n’est le plus souvent possible qu’à partir d’environ trois ans et demi. Elles prennent plus de temps que les méthodes objectives.
Ces méthodes analysent parfois simultanément la présence des trois facteurs amblyopigènes cités plus haut (strabisme, anomalies réfractives, opacités des milieux) : c’est le cas de l’étude du reflet rouge de Brückner et du photoscreening.
D’autres n’en analysent que deux : c’est le cas de la rétinoscopie et des réfractomètres automatiques qui analysent les yeux successivement et ne tiennent pas compte de l’alignement des axes visuels en vision binoculaire.
En général, la mesure de la réfraction passe par l’analyse de la lumière reflétée par le fond d’œil et donne toujours une idée de la transparence des milieux. En cas de manque de transparence, la mesure n’est souvent pas possible par les appareils ou l’image directement visible par l’examinateur est altérée.
La présence d’un strabisme peut être estimée isolément par le test de Hirschberg ou le test à l’écran, quoiqu’il existe actuellement des appareils sophistiqués, différents de ceux utilisés pour le photoscreening, qui ne dépistent que le strabisme grâce à l’analyse comparée de la position respective de la première et de la quatrième image de Purkinje.
Les tests de référence généralement utilisés pour permettre une décision de prise en charge thérapeutique sont :
pour le strabisme : le test à l’écran ;
pour les anomalies réfractives : une réfractométrie sous cycloplégie par rétinoscopie ou réfractométrie automatique ;
pour les opacités de milieux : leur confirmation par une ophtalmoscopie.
La cycloplégie suppose l’instillation de gouttes dans les yeux de l’enfant. Cette action peut entraîner des effets secondaires (convulsions, confusion, hyperthermie). Les gouttes doivent être administrées sous surveillance médicale, ce qui n’est pas possible dans le cadre d’un dépistage à grande échelle. La cycloplégie demande aussi du temps et de l’énergie, ce qui la rend impropre au dépistage.
Par ailleurs, les mesures réfractives sans cycloplégie sont plus à même de révéler la non-compensation d’une erreur réfractive liée au défaut d’emmétropisation et donc à l’amblyopie et au strabisme.
Pour ces raisons, les dépistages des troubles réfractifs sont actuellement réalisés sans cycloplégie, avec des seuils pathologiques de réfraction manifeste prédéterminés en fonction de chaque appareil, de manière à garantir les meilleurs scores de sensibilité et de spécificité. Ces seuils en dioptries sont évidemment moins positifs/plus négatifs que ceux qui sont fixés sous cycloplégie.
Les méthodes de dépistage réfractif décrites dans la section suivante sont donc effectuées sans cycloplégie.
En 1962, l’ophtalmologue suisse allemand Roland Brückner démontre l’utilité d’une transillumination comparative des yeux pour dépister l’anisométropie et le strabisme.
Ce test est actuellement reconnu comme un test rapide et utile de dépistage chez le nourrisson.
Le principe est illustré par la figure 2-5 : lorsqu’un observateur regarde à environ un mètre de distance, à travers le point d’observation de l’ophtalmoscope, les yeux d’un enfant brillamment éclairés par la lumière de cet ophtalmoscope — il faut idéalement un ophtalmoscope à lumière assez puissante, les petits ophtalmoscopes à piles ne délivrant pas une lumière assez forte —, il peut comparer le reflet pupillaire des deux yeux simultanément. Si les deux yeux de l’enfant fixent bien la lumière de cet ophtalmoscope, la lumière réfléchie par ces yeux est renvoyée précisément à sa source, c’est-à-dire le miroir de l’ophtalmoscope. Dans ce cas, les aires pupillaires paraissent toutes les deux symétriquement rouge/orange sombre à l’observateur dont l’œil est situé au-dessus du miroir et donc décentré par rapport à celui-ci et peu éclairé par cette lumière réfléchie. Si un des yeux de l’enfant ne focalise pas sur la lumière, soit en cas de strabisme soit en cas d’anisométropie, son reflet paraîtra relativement plus brillant que celui de l’autre œil. Ceci s’explique car la lumière reflétée par l’œil non fixateur ou défocalisé (fig. 2-6a) n’est pas renvoyée exactement à sa source et une partie de cette lumière est perçue par l’œil de l’observateur. Au-delà d’un certain seuil d’amétropie (ou en cas d’opacité des milieux), la lumière réfléchie est tellement éparpillée dans l’espace que l’œil défocalisé paraîtra au contraire plus sombre (fig. 2-6b). En cas d’amétropie, il est parfois aussi possible de dire s’il y a hypermétropie ou myopie selon la position du croissant lumineux dans l’aire pupillaire en vertu des lois de la photoréfraction excentrique (cf. infra).

Fig. 2-5 Test de transillumination de Brückner.
a. L’ophtalmoscope envoie la lumière vers le fond d’œil. b. Le fond d’œil focalisé sur la lumière la renvoie à sa source. c. L’œil de l’examinateur situé juste au-dessus de la source lumineuse est peu éclairé par le rayon réfléchi.

Fig. 2-6 Asymétrie du test de Brückner.
a. L’œil pathologique est le plus brillant. b. L’œil pathologique est le plus sombre.
La rétinoscopie, ou skiascopie, se fait à l’aide du rétinoscope, ou skiascope. Cet appareil permet une détermination objective de l’erreur réfractive d’un œil par l’observation de la lumière réfléchie en provenance du fond d’œil. Lorsqu’une lumière est réfléchie par le fond d’œil, au plus la longueur axiale de l’œil est petite, au plus proche du fond d’œil se trouve le système dioptrique de l’œil (cristallin et cornée) et donc au plus les rayons émergents du fond d’œil seront divergents. Inversement, au plus loin du fond d’œil se trouve ce système dioptrique (grande longueur axiale), au moins les rayons émergents du fond d’œil seront divergents. Après avoir passé ce système dioptrique, la lumière émergente possède donc des qualités de divergence ou de convergence qui font que l’image du fond d’œil va se constituer dans l’espace à une certaine distance appelée le punctum remotum, cette distance dépendant de la réfraction. L’observateur va progressivement à l’aide de lentilles correctrices essayer de placer ce punctum remotum à l’endroit même du point d’observation du rétinoscope. À ce moment, soit la totalité du fond d’œil se reflète au point d’observation sous forme d’un cercle rouge, soit le mouvement du rétinoscope fait que cette image tombe à côté du point d’observation et aucune lueur n’est visible (ombre en masse). La réfraction est déduite par la puissance de la lentille nécessaire pour obtenir cela.
Le matériel est peu coûteux, mais cet avantage est contrebalancé par le fait que la rétinoscopie n’est pratiquée que par des personnes spécialisées. Dans la plupart des pays d’Europe, il s’agit des ophtalmologues mais, dans les pays anglo-saxons, elle est aussi pratiquée par des orthoptistes et/ou des optométristes. Les publications du groupe d’études VIP rapportent la rétinoscopie non cycloplégique par du personnel qualifié comme un des meilleurs tests de dépistage (avec le Retinomax, le SureSight® et le test d’acuité visuelle Lea Symbols®) [14, 32].
Cette méthode nécessite un apprentissage et une expérience non négligeable. Dans nos contrées, seuls les ophtalmologues la pratiquent et leur habileté à la réaliser est considérablement diminuée depuis l’arrivée sur le marché des réfractomètres automatiques. Elle nécessite quelques minutes d’examen, et un sujet relativement collaborant qui regarde la lumière en provenance du rétinoscope.
La photo/vidéoréfraction a présenté une avancée dans le dépistage préscolaire des anomalies amblyopigènes. Son intérêt principal réside dans sa rapidité d’exécution (quelques secondes), par du personnel non qualifié, et son application à l’enfant en âge préverbal. À l’heure actuelle, pour des valeurs de spécificité élevées (90 %), sa sensibilité globale est d’environ 60 % pour les appareils les plus performants. Les contraintes de diamètre pupillaire imposent une pièce d’examen relativement sombre. Sa capacité réelle à diagnostiquer précisément les petits angles de strabisme n’est pas démontrée.
Cette méthode a représenté une innovation majeure en matière de dépistage visuel il y a environ vingt-cinq ans. Elle est simple à administrer et applicable à de très jeunes enfants. Elle se fait généralement sans cycloplégie. Elle ne s’attache pas à mesurer directement une acuité visuelle mais à rechercher indirectement les facteurs responsables de l’amblyopie : strabisme, anomalie réfractive et trouble des milieux.
En matière de photoréfraction, il existe deux méthodes différentes selon que le système optique responsable de l’analyse d’images et celui de la source lumineuse sont alignés ou non :
lorsque ces deux systèmes sont alignés, on parle de photoréfraction « on-axis » ;
lorsqu’ils ne sont pas alignés, on parle de photoréfraction « off-axis ».
Ils ont tous les deux été perfectionnés tout en gardant les mêmes principes d’analyse, en remplaçant l’appareil photographique par une caméra, justifiant l’appellation de vidéoréfraction ou videoscreening on-axis ou off-axis.
La photoréfraction on-axis, ou isotropique, a été cliniquement utilisée pour la première fois par Atkinson pour les dépistages de masse. Elle consiste en une analyse des images générées par la réflexion rétinienne d’un flash chez un sujet placé à 75 cm en focalisant l’objectif pour une distance de 50 cm, 75 cm et 150 cm. Ce système impose au moins trois prises de vue. L’image correctement focalisée par rapport à la distance du sujet est nette et permet de dépister un strabisme en analysant la position respective des reflets cornéens. Les deux images défocalisées produisent au niveau des pupilles un cercle flou dont la taille et la forme dépendent de la réfraction du sujet. Les erreurs sphériques et cylindriques peuvent être ainsi estimées à partir de 0,5 d jusqu’à + 4 d ou – 4 d. Malheureusement, au-delà de ces limites, la sensibilité de la méthode diminue ; or, les fortes erreurs réfractives sont justement plus amblyopigènes. Cette méthode repère mieux les astigmatismes que la photoréfraction off-axis, mais elle ne permet pas d’utiliser les renseignements fournis par le test de Brückner et sa réalisation impose, entre autres, des photographies défocalisées, donc floues, où il est difficile de contrôler la fixation adéquate de l’enfant. Par ailleurs, ces photographies floues sont parfois difficiles à interpréter. Cette méthode est en voie de disparition.
Dans la photoréfraction off-axis, ou excentrique, la source lumineuse est décentrée par rapport au système optique d’analyse d’images. La position dans l’espace du flash par rapport à l’optique de l’appareil est déterminée par le constructeur ; une seule position étant insuffisante pour dépister l’astigmatisme, il faut au moins deux sources lumineuses — une décentrée verticalement et l’autre horizontalement à 90°, correspondant aux axes les plus courants d’astigmatisme à 0° ou 90°. L’excentricité du flash est également choisie par le constructeur ; elle peut être fixe ou variable. Les images ainsi produites sont toujours nettes car focalisées.
Une seule et même image permet d’analyser la position du reflet cornéen et le reflet pupillaire. L’analyse du reflet pupillaire permet de diagnostiquer les erreurs de réfraction. En effet, lorsqu’un sujet est positionné à un mètre de l’appareil, l’image de l’aire pupillaire qui contient une zone lumineuse et une zone d’ombre sera différente s’il est hypermétrope, emmétrope ou myope de plus d’une dioptrie. Les lois d’optique qui sous-tendent la photoréfraction off-axis sont comparables à celle de la skiascopie pour ce qui est de l’observation d’une image inversée en cas d’œil myope, car le punctum remotum se trouve entre le sujet et l’observateur, et d’une image droite en cas d’hypermétropie, car le punctum remotum se trouve derrière l’observateur. En cas d’emmétropie, toute la zone pupillaire est gris sombre (ombre en masse, fig. 2-7a). Lorsque la lumière vient du bas, elle éclaire le haut du fond d’œil, le bas de celui-ci étant plus sombre. En cas de myopie, l’image reflétée par le fond d’œil sera inversée et un croissant lumineux s’observera dans le bas de l’aire pupillaire (fig. 2-7b). En cas d’hypermétropie (fig. 2-7c), l’image observée ne sera pas inversée et le croissant lumineux sera dans le haut de l’aire pupillaire. En cas d’astigmatisme (fig. 2-7d) le croissant lumineux ne sera visible que pour une seule des deux sources lumineuses.
Lorsque certains paramètres sont maintenus constants (diamètre pupillaire, distance du sujet par rapport à la caméra, excentricité du flash et parallaxe entre l’objectif et l’œil testé), la hauteur S qu’occupe ce croissant lumineux dans l’aire pupillaire (fig. 2-8 en bas, croissant lumineux sur l’œil droit) est directement liée à l’erreur réfractive, permettant de la quantifier par la formule :

avec : r, rayon pupillaire ; E, distance entre la source lumineuse et le bord de l’objectif ; D, quantité d’erreur réfractive ; Y, parallaxe entre l’œil testé et le bord de l’objectif ; d, distance entre le sujet et l’observateur.
Malheureusement, la surface de ce croissant lumineux augmente assez vite avec l’erreur réfractive, et il vient un moment où l’aire pupillaire est saturée de lumière, rendant toute analyse impossible au-delà d’un certain seuil. Au plus l’amétropie est forte, au plus le flash devra être excentré par rapport à l’appareil photographique pour voir réapparaître ce croissant lumineux. Une des limites importante de cette méthode est donc qu’une seule excentricité n’est pas suffisante pour diagnostiquer les faibles et les fortes amétropies. Une excentricité suffisamment petite qui permet de dépister une faible anisométropie ne permettra pas de dépister une hypermétropie forte et vice-versa. Idéalement, un système de photoréfraction excentrique devrait donc au moins utiliser deux excentricités différentes.
Pratiquement tous les appareils de photo/vidéoréfraction utilisés actuellement correspondent au système off-axis (MTI photoscreener, iScreen photoscreener, VisiScreen® OSS-C, Otago photoscreener, Plusoptix Vision Screener).

Fig. 2-7 Photoréfraction « off-axis ».
a. Emmétropie : ombre pupillaire exempte de croissant lumineux. b. Myopie : le croissant lumineux est situé dans le même sens que la source lumineuse. c. Hypermétropie : croissant lumineux opposé à la source lumineuse. d. Astigmatisme hypermétropique conforme : un croissant n’est visible qu’en cas d’illumination latérale.

Fig. 2-8 Photoréfracteur excentrique « off-axis » (la caméra est au-dessus de la source du flash). L’enfant photographié ici présente une anisométropie ; son œil droit est myope.
La photo/vidéoréfraction se fait à distance de l’enfant et sa collaboration est peu sollicitée. Elle peut être pratiquée par du personnel non qualifié. Elle est rapide (le processus d’acquisition de l’image prend cinq à dix secondes) et la testabilité est élevée (99 %) dans des conditions d’examen adéquates (semi-obscurité).
Ces appareils sont nettement plus chers (environ 2 000 � pour les moins coûteux et 8 000 � pour les plus coûteux) que des échelles d’acuité visuelle. Pour pouvoir effectuer leurs mesures, ils nécessitent généralement un diamètre pupillaire d’au moins 5 mm et donc une obscurité relative de la pièce d’examen, ce qui peut être un inconvénient lors d’un dépistage de masse où des pièces sombres ne sont pas nécessairement disponibles partout. Pour des valeurs élevées de spécificité de 90 % et plus — nécessaires pour éviter les faux positifs référés inutilement —, la sensibilité des meilleurs appareils environne les 60 % [24]. Par ailleurs, en ce qui concerne le diagnostic du strabisme (cf. infra), le facteur limitant de ces méthodes photographiques (où l’image est captée en condition binoculaire) est qu’il n’évite pas les erreurs de diagnostic dues à une asymétrie physiologique des reflets cornéens d’une part et, d’autre part, qu’il n’y a aucun moyen d’être absolument sûr que l’enfant fixe précisément la cible au moment de la prise de vue ; or, chaque erreur de fixation de 1° apporte une mésestimation de 2° de la déviation oculaire [21].
Les réfracteurs automatiques portables ont des avantages en matière de dépistage visuel : ils peuvent être utilisés par du personnel non qualifié chez des enfants en âge préverbal, leur testabilité est élevée et les mesures sont rapides (quelques minutes). À des valeurs de spécificité élevée (90 %), leur sensibilité globale (environ 75 %) est supérieure à celle du photo/videoscreening. Ils ne dépistent pas le strabisme.
Les quatre principaux réfractomètres automatiques portables utilisés pour le dépistage qui sont disponibles sur le marché sont le Retinomax (fig. 2-9), le Palm ARK autorefractor, le Topcon PR2000 pediatric refractometer et le SureSight® (fig. 2-10). Seront détaillés surtout le premier et le dernier.
Comme avec les réfractomètres automatiques sur table, les résultats sont exprimés en sphère, cylindre et axe (fig. 2-11).
Le Retinomax utilise la lumière infrarouge. Le principe de la rétinoscopie est appliqué dans le système d’illumination et celui de Scheiner dans le système de détection. On ne recherche pas le point de neutralisation de la lumière réfléchie par le fond de l’œil, mais on mesure la vitesse des rayons émergents en étudiant très rapidement tous les méridiens sur 360°. L’appareil est équipé d’une caméra sensible à la lumière infrarouge et d’un écran qui permet à l’opérateur de visualiser sur un écran l’œil examiné et de vérifier son alignement avec l’appareil grâce au reflet cornéen tandis que l’enfant regarde une mire imagée.
La technologie du SureSight® est fondée sur l’analyse du front d’onde selon Hartmann-Shack, exploitant le principe de Scheiner de manière très sophistiquée. La lumière réfléchie par l’œil testé percute un senseur constitué d’un damier de microlentilles. Selon la réfraction de cet œil, un réseau de motifs lumineux se forme sur un capteur et un algorithme permet de transposer cette information lumineuse en données relatives à la sphère, au cylindre et à l’axe.
Pour un dépistage au Retinomax, il est important de veiller à obtenir des mesures qui sont associées à un bon facteur de confiance (au moins 8), ce qui améliore la spécificité de manière significative et ne demande qu’un nombre moyen d’essai de 1,20 [14]. En revanche, pour le SureSight®, l’exigence d’un facteur de confiance de 6 ou plus est inutile car elle n’améliore pas l’efficacité du dépistage [31]. La testabilité est élevée pour les deux appareils (supérieure à 98 %). Les études du groupe VIP montrent que celle du SureSight® est toutefois significativement moindre (98,73 %) que celle du Retinomax (99,65 %) [32]. Il n’y a pas de différence de testabilité entre la tranche des enfants de trois ans et celle des quatre à cinq ans. Les deux appareils ont des performances relativement identiques en matière de dépistage, aussi bien par du personnel qualifié que non qualifié mais entraîné : à une spécificité de 90 %, la sensibilité de ces deux appareils pour détecter n’importe quelle anomalie potentiellement amblyopigène est de 68 % pour le Retinomax et 65 % pour le Suresight®, augmentant respectivement à 87 % et 82 % pour la détection des conditions amblyopigènes sévères [32].
Les performances du Palm ARK autorefractor en termes de testabilité, sensibilité et spécificité ont été trouvées semblables à celles du Retinomax par le groupe d’études VIP [3].
Le réfractomètre pédiatrique Topcon PR2000 a une sensibilité moins bonne pour une même spécificité que les trois autres appareils cités plus haut [2].

Fig. 2-9 Réfractomètre automatique Retinomax.
Distance de travail : 6 cm ; plage de mesure : sphère de – 18 d à + 23 d, cylindre : 12 d ; durée d’acquisition des données : 10 secondes pour les deux yeux ; nombre de mesures imprimées : huit pour chaque œil.

Fig. 2-10 Un instrument de dépistage des troubles visuels : le SureSight®.
Distance de travail : 35 cm ; plage de mesure : sphère de – 5 d à + 6 d, cylindre : 3 d ; durée d’acquisition des données : 10 secondes pour les deux yeux ; nombre de mesures imprimées : une pour chaque œil.
(Source : laboratoires Welch Allyn.)

Fig. 2-11 Résultats imprimés du Retinomax (à gauche) et du SureSight® (à droite).
Le Retinomax imprime au maximum les huit dernières mesures et affiche une valeur isolée représentative pour chaque œil suivi d’un facteur de fiabilité. Le SureSight® affiche pour chaque œil une mesure précédée d’un chiffre de fiabilité allant de 1 à 9.
De testabilité élevée (supérieure à 98 %), les mesures sont également très rapides, en moyenne deux minutes pour les deux yeux dans les études du groupe VIP [14], alors qu’il faut environ le double du temps pour la mesure d’acuité visuelle.
Le diamètre pupillaire minimal requis pour ces appareils est de 2,5 mm pour le Retinomax, non spécifié pour le SureSight®, ce qui n’est pas aussi contraignant que pour le photoscreening (qui exige au moins 5 mm et donc une semi-obscurité). Cette caractéristique peut être un critère de choix pour une installation ambulatoire. Comparés à la photo/vidéoréfraction, les résultats réfractifs du Retinomax et du SureSight® sont plus simples à interpréter (données brutes et non images).
Leur coût est relativement élevé : environ 4 000 � pour le SureSight® et 8 000 � pour le Retinomax.
Le dépistage du strabisme par des méthodes photographiques (y compris la photo/vidéoréfraction) n’est pas sûr lorsqu’il s’agit de dépister des petits angles. Les meilleurs tests de dépistage sont le biprisme de Gracis et le test à l’écran mais ils nécessitent du personnel qualifié. Les tests stéréoscopiques sont réalisables par du personnel non qualifié mais ils comportent de nombreux faux positifs.
Comme dit plus haut, le dépistage par les tests stéréoscopiques apporte très peu de valeur ajoutée au dépistage de l’acuité visuelle chez l’enfant préscolaire (par manque de sensibilité, une stéréoscopie pouvant être présente alors qu’une amblyopie non négligeable existe). Dans le cas du dépistage du strabisme, ces tests souffrent plutôt d’un manque de spécificité (test non vu par manque d’intérêt ou par immaturité de l’enfant, alors qu’il n’y a pas de strabisme). Les autres tests de dépistage du strabisme sont détaillés ci-après.
Nous ne reviendrons pas sur les principes de ce test. Il faut savoir qu’il est surtout utile pour confirmer un strabisme soupçonné à l’inspection. Il peut être faussement positif en cas d’asymétrie anatomique des axes visuels (asymétrie physiologique de l’angle kappa) ou d’ectopie maculaire par exemple.
Ce test est un des plus couramment utilisé pour dépister le strabisme vu la simplicité du matériel nécessaire (petit objet) et sa sensibilité (2 d à 4 d), mais il demande du personnel qualifié. Le groupe d’études VIP constate que, si un programme de dépistage impose de dépister spécifiquement le strabisme en plus des autres facteurs de risque, la meilleure combinaison pour du personnel qualifié dans le domaine visuel est une mesure réfractive au Retinomax et un test à l’écran (plus efficace que les trois autres tests de stéréopsie étudiés, à savoir le Random Dot E, le Stereo Smile II, et le Preschool Randot) [14].
Ce test est illustré à la figure 2-12. Il consiste à présenter devant l’enfant deux prismes opposés par le sommet et accolés sur un support en plastique. En déplaçant verticalement le support, chaque prisme déplace l’image fixée de chaque côté de la macula. Si l’œil derrière le prisme est amblyope ou porteur d’un scotome de suppression en vision binoculaire, le déplacement d’image sera mal enregistré par le cerveau et aucun mouvement de l’œil derrière le prisme ne sera visible ni transmis à l’autre œil. Si l’œil fixe bien, le déplacement d’image sera enregistré par le cerveau et un mouvement de l’œil derrière le prisme sera visible et transmis à l’autre œil. C’est un test transparent qui gêne peu l’enfant. Il est utilisable dès l’âge de six mois. Sa réalisabilité dépend de l’attention de l’enfant qui doit accepter de fixer l’objet pendant quelques secondes consécutives. L’exécution totale du test prend environ trente secondes.
Quasi absent de la littérature anglo-saxonne, ce test est cependant efficace pour le dépistage d’un facteur amblyogénique asymétrique comme l’anisométropie et le strabisme. Il nécessite toutefois un personnel relativement qualifié.
En communauté française de Belgique existe depuis 2005 un dépistage préscolaire combinant plusieurs tests (inspection, vérification de la noirceur et de la relative symétrie des pupilles, transillumination pupillaire comparative, examen des reflets cornéens, examen de la motilité, test à l’écran, biprisme, test de Lang et réfraction manifeste au Retinomax). En analysant un échantillon de 3 037 enfants d’une population non sélectionnée et dépistée par du personnel qualifié sur une durée de vingt-deux mois, on constate que 326 (10,73 %) enfants sont dépistés positifs dont 73 (2,4 %) strabismes et 260 (8,5 %) anomalies réfractives. En étudiant la rentabilité des tests, on constate que l’association « réfractomètre et biprisme » est la meilleure. Par rapport à la réfraction seule, le biprisme permet d’identifier 1,2 % supplémentaire d’enfants anisométropes et strabiques avec réfractométrie manifeste normale. En comparaison, les associations « réfractomètre et test écran » et « réfractomètre et Lang » n’identifient respectivement que 0,6 % et 0,01 % d’enfants supplémentaires.

Fig. 2-12 Biprisme de Gracis.
Ces tests exploitent le principe du test de Hirschberg : en cas de strabisme, la position du reflet cornéen n’est pas symétrique et une analyse précise sur photographie ou sur vidéo de l’image des yeux du sujet strabique fixant une lumière permet le diagnostic. Pour analyser l’image, il faut pouvoir délimiter l’aire pupillaire, calculer la position du centre de la pupille et la distance qui sépare celui-ci du reflet cornéen (angle kappa des strabologues), et ce pour chaque œil séparément. S’il y a une différence dans les valeurs de l’angle kappa, il y a suspicion de strabisme. La quantification d’un strabisme est également possible par ces méthodes car des études cliniques ont montré qu’il y avait une relation quasi linéaire entre le déplacement du reflet cornéen par rapport au centre de la pupille et l’angle du strabisme. Cette relation avait déjà été décrite par Hirschberg en 1886, mais celui-ci avait estimé qu’un déplacement relatif du reflet cornéen de 1 mm équivalait à environ 14 dioptries de déviation (14 ?). Cette notion a été admise dans la littérature sans être critiquée pendant très longtemps. Toutefois, dans les années quatre-vingt, plusieurs auteurs ont réanalysé cliniquement cette relation entre le déplacement linéaire du reflet cornéen et la variation angulaire du déplacement d’un œil (méthodes de strabométrie linéaire), ce qui a conduit à corriger considérablement les estimations de Hirschberg : la règle actuellement admise est qu’un déplacement sur une image dans le plan frontal de 1 mm du reflet cornéen par rapport au centre pupillaire correspond à 21-22 dioptries de déviation angulaire (21-22 ?). La précision de ces mesures par des observateurs expérimentés atteindrait plus ou moins 4 ? [21]. Si la méthode compare la position du reflet de chaque œil en condition monoculaire et binoculaire, elle permet d’éviter les erreurs de diagnostic dues à une asymétrie physiologique de l’angle kappa. Le facteur limitant reste toutefois l’incertitude sur le fait que l’enfant fixe précisément la cible au moment de la prise de vue. L’analyse de l’image n’apporte aucun renseignement à ce sujet si l’erreur de fixation n’est que de quelques degrés, puisque la position normale du reflet cornéen peut varier d’un sujet à l’autre. Or, chaque erreur de fixation de 1° apporte une mésestimation de 2° de la déviation oculaire [21].
La qualification du dépisteur dépend essentiellement de la méthode de dépistage, de la disponibilité locale des différents acteurs en santé visuelle et des contraintes économiques imposées au dépistage.
Le coût et l’accessibilité au dépistage dépendent étroitement de la qualification du dépisteur. Le niveau d’entraînement exigé dépend aussi du test utilisé. Les tests stéréoscopiques, la photo/vidéoréfraction, les mesures à l’autoréfracteur et celles de l’acuité visuelle peuvent être exécutés par du personnel non qualifié ayant reçu une formation minimale. En revanche, le test à l’écran, le biprisme et la rétinoscopie demande du personnel qualifié (ophtalmologistes ou orthoptistes).
En Suède, ce sont des infirmières spécialisées des centres de santé qui font le dépistage d’acuité visuelle. Au Royaume-Uni, la plupart des dépistages sont effectués par des orthoptistes. En France et en Belgique, les acteurs du dépistage sont variés : pédiatres, généralistes, orthoptistes, infirmières spécialisées. Aux États-Unis, ce sont souvent les pédiatres, les généralistes ou les optométristes qui font le dépistage visuel, mais plusieurs programmes de photoscreening utilisent également des volontaires non qualifiés pour prendre les images ; celles-ci sont ensuite interprétées par du personnel qualifié.
Les études du groupe VIP ont comparé les performances de trois tests de dépistage (Lea Symbols® pour l’acuité visuelle, Retinomax et SureSight®) effectués soit par des orthoptistes/optométristes, soit par des infirmières qualifiées, soit par des dépisteurs non qualifiés mais entraînés [8]. Dans l’ensemble, pour une spécificité de 90 % et en tenant compte du fait que les dépisteurs non qualifiés ont utilisé le test Single crowded Lea Symbols® à 1,5 m et les deux autres catégories de dépisteurs le Linear Crowded Lea Symbols® à 3 m, les performances du dépistage sont identiques pour les trois catégories de dépisteurs [32] : environ 70 % de sensibilité pour la détection de toute anomalie (amblyopie, strabisme, anomalie réfractive, diminution d’acuité visuelle).
En Europe, la tendance est plutôt de recommander des dépisteurs qualifiés (orthoptistes ou optométristes ou infirmières certifiées selon les pays). Toutefois, plusieurs études américaines ont montré que de nombreux tests peuvent être faits de manière également performante par du personnel non qualifié mais entraîné, ce qui réduit considérablement le coût du dépistage.
L’âge idéal de dépistage par la mesure de l’acuité visuelle se situe entre quarante-deux et soixante mois (à partir de trois ans et demi et avant cinq ans). L’âge idéal de dépistage des facteurs amblyopigènes par méthode objective se situe entre dix- huit et quarante- deux mois (à partir d’un an et demi et avant trois ans et demi). Si ce dernier est intéressant pour le dépistage précoce des amétropies importantes et des anomalies des milieux, il impose cependant un dépistage ultérieur pour cibler les amblyopies d’installation plus tardives, ce qui augmente le coût pour la société.
Comme le processus d’emmétropisation s’exerce principalement pendant la première année de vie, mais encore à moindre effet durant les deux années suivantes, il n’est pas utile de pratiquer un dépistage de l’amblyopie ou des facteurs amblyopigènes avant un an. La persistance d’anomalies réfractives importantes au cours des premières années de vie signe un défaut de ce processus d’emmétropisation avec une augmentation de l’incidence de l’amblyopie et du strabisme dans la tranche d’âge des deux à trois ans. Pour cette raison, l’âge préscolaire (deux à cinq ans) est la période idéale du dépistage, tenant également compte du fait que les résultats du traitement sont meilleurs qu’en cas de dépistage à partir de cinq ans.
S’il s’agit d’un dépistage de l’acuité visuelle de reconnaissance, il faut idéalement s’adresser à des enfants qui ont un âge minimum de trois ans et demi. En effet, avant cet âge la collaboration n’est pas assez bonne et entraîne beaucoup de tests douteux, imposant un nouveau contrôle. De plus, 65 % seulement des enfants de trois ans acceptent l’occlusion d’un œil permettant de prendre la vision monoculaire [15]. À trois ans et demi, selon le test choisi, entre 80 % et 95 % des enfants coopèrent au test et, donc, un dépistage à trois ans et demi ou quatre ans par mesure d’acuité visuelle comporte un taux raisonnable de faisabilité et de fiabilité, tout en étant simple à comprendre pour les dépisteurs et moins coûteux que le dépistage par méthodes objectives. Pour rappel, les études MOTAS et PEDIG montrent une différence significative dans le résultat du traitement par occlusion avant cinq ans [9, 25], et l’ensemble d’autres études [2, 20] concluent à un bénéfice léger mais significatif, plaidant en faveur d’un dépistage de l’acuité visuelle avant quatre à cinq ans.
S’il s’agit d’un dépistage des facteurs amblyopigènes par une méthode objective, vu que l’amblyopie et le strabisme incubent principalement entre deux et trois ans, l’âge idéal du dépistage devrait se situer entre un an et demi et trois ans et demi. Dans cette tranche d’âge, un dépistage réfractif par photo/vidéoréfraction ou réfractométrie automatique est tout à fait réalisable.
Au-delà de trois ans et demi, un dépistage d’acuité visuelle est à ce moment réalisable et moins coûteux que le dépistage des facteurs amblyopigènes par méthode objective.
Il faut également considérer le fait que, si un dépistage des facteurs amblyopigènes est organisé entre un an et demi et trois ans et demi, un second dépistage doit obligatoirement être organisé vers quatre à cinq ans afin de dépister les amblyopies d’installation plus tardive, ce qui augmente considérablement le coût pour la société.
Vu l’absence de facteurs de risque facilement identifiables et hautement prédictifs de l’amblyopie et du strabisme, il est préférable de s’adresser à toute la population d’enfants correspondant à l’âge ciblé.
Un dépistage peut théoriquement s’appliquer à toute une population, ou seulement à une partie de celle-ci qui présenterait des facteurs de risque. Certains facteurs significatifs de risque pour le strabisme sont connus : l’âge et le tabagisme maternel, le petit poids de naissance associé au non à la prématurité, l’ethnie (plus de strabisme dans la race blanche que dans la race noire), les anomalies chromosomiques et les craniosténoses. Ces enfants sont en général pris en charge et suivis dès la naissance, invalidant la nécessité d’un dépistage visuel spécifiquement pour eux.
Les antécédents familiaux de strabisme, d’amblyopie ou d’anomalies réfractives importantes augmentent la probabilité que l’enfant en soit également atteint. Toutefois, moins de la moitié des enfants strabiques ont une histoire familiale de strabisme et les anomalies réfractives ne mènent pas de manière univoque à l’amblyopie et au strabisme.
C’est pourquoi il vaut mieux s’adresser à une population non sélectionnée [2, 20].
De nombreuses lacunes dans l’estimation de la perte d’utilité liée à l’amblyopie unilatérale et dans l’estimation précise du risque de handicap visuel bilatéral chez l’amblyope conduisent à des incertitudes concernant l’efficience du dépistage. Le consensus qui se dégage est le suivant : un dépistage de l’acuité visuelle entre trois ans et demi et quatre ans et demi avec un taux de participation supérieur à 90 % est susceptible d’être efficient s’il existe une perte d’utilité associée à l’amblyopie la plus minime qui soit.
Certains termes épidémiologiques nécessitent d’être clarifiés pour aborder ce paragraphe.
La qualité de vie est la perception par l’individu lui-même, et non par un observateur, de son état de santé sous des multiples facettes. Cette perception de l’individu dépend de sa place dans l’existence, de son contexte culturel, de son environnement socio-économique, du système de valeurs dans lesquels il évolue, de ses objectifs, de la satisfaction de ses désirs et de ses inquiétudes. C’est donc un concept très large qui interagit de façon complexe avec un nombre important de critères physiques, psychologiques, moraux, socio-économiques et culturels. Il ne tient pas compte uniquement du facteur maladie ou infirmité et reflète la volonté de l’Organisation mondiale de la santé de définir la qualité de vie comme « un état de bien-être total, physique, mental et social et pas seulement l’absence de maladie ou d’infirmité ». Cette estimation de la qualité de vie par l’individu lui-même débouche sur un coefficient de qualité de vie estimé de 0 à 1 (0 étant l’état de mort, 1 étant l’état de parfaite santé).
L’indicateur QALY (Quality-Adjusted Life Years, années de vie gagnées ajustées sur la qualité de vie) consiste à multiplier le nombre d’années de vie par ce coefficient de qualité de vie. Ainsi, une demi-année vécue en parfaite santé (coefficient 1) correspond à 0,5 QALY, et le résultat est identique si on parle d’une année complète vécue avec un coefficient d’utilité de 0,5 (alitement, par exemple).
On évalue ainsi un état de santé par la somme des années de vie ajustées par ces coefficients de qualité de vie. Ces QALY apparaissent dès lors comme une mesure globale du bénéfice thérapeutique alliant quantité et qualité de vie et sont mathématiquement exploitables dans les analyses coût/utilité (cost-utility analysis). Le rapport coût/utilité exprime un coût par QALY. Il permet une comparaison plus aisée entre différentes interventions, qu’elles soient préventives, diagnostiques ou thérapeutiques. Les économistes de la santé estiment que le seuil de coût/utilité acceptable d’une intervention plafonne aux alentours de 30 000 à 40 000 � par QALY.
Trois termes anglais fréquemment utilisés, efficacy, effectiveness et efficiency, signifient en français « efficacité », « effectivité » et « efficience ». Ils comportent des nuances importantes pour les économistes de la santé, car ils correspondent à des niveaux de preuves différents du bénéfice d’une action en termes de santé publique (cf. encadré).
Efficacité, efficacy : Lorsqu’on peut démontrer qu’un médicament fonctionne mieux qu’un placebo, on dit que ce médicament est efficace, premier échelon de preuve. Par exemple, en parlant d’un traitement contre l’ostéoporose, il peut être considéré comme efficace s’il maintient significativement mieux la densité osseuse qu’un placebo.
Effectivité, effectiveness : Dans l’exemple du traitement de l’ostéoporose, lorsqu’on veut démontrer qu’il est effectif, cela signifie qu’il faut démontrer que ce traitement diminue les risques de fractures ou augmente la qualité ou l’espérance de vie dans les conditions de vie réelle, même si l’adhésion au traitement est imparfaite. Il s’agit du deuxième échelon de preuve.
Efficience1, efficiency ou cost-effectiveness : Une analyse coût/efficacité démontre la façon dont on atteint l’objectif et à l’aide de quels moyens. Elle doit permettre d’évaluer le rapport entre le coût (financier et autres) d’une intervention et les résultats cliniques ou physiques, sociaux, de qualité de vie, de satisfaction, etc. Elle compare donc des stratégies qui se distinguent par leurs coûts et leurs effets. Il s’agit du troisième échelon de preuve du bénéfice d’une action en termes de santé publique.
L’importance de distinguer entre efficacité (efficacy) et effectivité (effectiveness) est illustrée ci-après : l’étude britannique randomisée et contrôlée associée à une étude prospective de cohorte menée par Williams et analysant le résultat du traitement de l’amblyopie après un dépistage montre que les résultats sont significativement meilleurs si le dépistage et le traitement ont eu lieu avant trois ans (37 mois) qu’après trois ans [29, 30]. Ceci démontre l’efficacité de ce dépistage mais ce n’est pas une preuve au sens épidémiologique du terme de l’avantage du dépistage avant l’âge d’entrer à l’école — effet réel du traitement après le dépistage, avec une couverture incomplète de la population, dans le monde réel, où les patients ne suivent pas bien leur traitement, abandonnent leur traitement ou sont perdus de vue. En effet, si les résultats de cette étude sont réanalysés en fonction des enfants à qui ce dépistage a été proposé et non plus en fonction des enfants effectivement dépistés, la différence n’est plus significative car le taux de participation à l’étude n’était que de 67 %. Cette étude n’apporte donc pas la preuve de l’effectivité au sens épidémiologique du terme du dépistage avant trois ans.
Ceci montre l’importance d’avoir un taux de participation très élevé au dépistage pour prouver une effectivité, c’est-à-dire un impact épidémiologique global sur la population. Ce taux de participation élevé peut être obtenu en associant par exemple le programme de dépistage avec celui de la vaccination. En Suède, le taux de participation des enfants de quatre à cinq ans au dépistage visuel est de 99 %, car ce dépistage est incorporé dans le programme d’un système de santé national obligatoire. Par rapport à la prévalence existante dans les populations plus âgées n’ayant bénéficié d’aucun dépistage, ce dépistage a permis de réduire de moitié la prévalence globale de l’amblyopie et de pratiquement éliminer les amblyopies sévères d’acuité visuelle inférieure ou égale à 1/10. Il est donc très effectif [20]. Pour démontrer ensuite que ce dépistage est efficient, il serait nécessaire d’évaluer son rapport coût/effectivité.
S’il est établi que le strabisme est associé à une altération de la qualité de vie et que la chirurgie du strabisme améliore la qualité de vie, ceci n’implique pas la nécessité d’un dépistage car la plupart des individus concernés ont un strabisme déjà visible sans dépistage.
Concernant l’amblyope adulte sans strabisme, si l’accès à certains métiers lui est interdit, il n’y a pas d’études robustes montrant que cette condition altère sa qualité de vie aussi longtemps qu’il n’y a pas perte du bon œil. A fortiori, il n’y a pas non plus de preuve robuste que le traitement de l’amblyopie restaure sa qualité de vie. De ce fait, la perte d’utilité associée à l’amblyopie est généralement considérée comme nulle dans les études de coût/utilité, conduisant le plus souvent à l’absence de preuve d’efficience du dépistage visuel.
Il existe bien dans la littérature des études démontrant un rapport coût/utilité avantageux pour le dépistage car ces études attribuent aux différentes situations d’acuité visuelle des sujets amblyopes des coefficients d’utilité extrapolés de tables où la perte d’acuité visuelle provient d’autres causes que de l’amblyopie. Ceci limite la pertinence des résultats car les sujets amblyopes ne sont pas comparables aux sujets non amblyopes ayant perdu de la vision suite à une affection oculaire. En effet, ces derniers peuvent souffrir d’une restriction du champ visuel ou d’une anomalie de la vision des couleurs en plus de la diminution d’acuité visuelle nouvellement acquise. Ils ne peuvent être mis sur le même pied d’égalité que les amblyopes du point de vue du coefficient de qualité de vie [19].
En 2008, Carlton a fait une étude extrêmement détaillée et approfondie de ce paramètre pour le dépistage visuel au Royaume-Uni, en comparant différents types de dépistage (avec ou sans réfractométrie), à différents âges (trois ans, quatre ans, cinq ans), par rapport à l’absence de dépistage [2]. Tous les paramètres de coût ont été minutieusement pris en compte, non seulement pour le dépistage lui-même (coût administratif de l’invitation au dépistage et de l’encodage des données, coût de la main-d’œuvre, des appareils et des locaux), mais aussi ceux entraînés par la prise en charge après le dépistage en fonction de la durée du suivi (consultations, lunettes, chirurgie). Pour affiner l’analyse, un canevas sophistiqué a été développé pour prévoir toutes les possibilités d’évolution des différentes situations liées aux anomalies réfractives, au strabisme et à l’amblyopie. Les coûts liés à la probabilité d’un handicap visuel bilatéral futur ont également été pris en compte (en utilisant 1,2 % comme chiffre de risque de déficience visuelle bilatérale avec une acuité visuelle binoculaire inférieure à 5/10), de même que l’action négative du traitement de l’amblyopie sur la qualité de vie.
Pour un dépistage à l’âge de trois ou quatre ans, l’analyse du coût absolu à payer pour prévenir une amblyopie grâce à son dépistage et à son traitement consécutif est raisonnable, entre 5 000 � et 7 500 � par cas d’amblyopie prévenue (le coût à cinq ans est nettement plus important). Toutefois, si on admet qu’il n’y a aucune perte d’utilité liée à l’amblyopie sans strabisme, les rapports coût/utilité de toutes les formes de dépistage comparés au rapport coût/utilité de l’absence de dépistage sont largement en faveur de ce dernier.
Il en ressort que le coût/utilité du dépistage dépend essentiellement du coefficient d’utilité associé à l’amblyopie unilatérale sans strabisme. Si ce coefficient vaut 1 (aucune perte d’utilité), l’absence de dépistage est de loin la solution la plus économique, présentant le meilleur rapport coût/utilité. Il suffit qu’on attribue un décrément d’utilité de 2 % à l’amblyopie unilatérale sans strabisme (coefficient d’utilité 0,98) pour que le rapport coût/utilité devienne très attractif pour le dépistage à trois ans ou à quatre ans (entre 8 000 � et 12 000 � par QALY) [2] — pour rappel, les économistes de la santé jugent qu’un seuil de coût/utilité acceptable plafonne aux alentours de 30 000 � à 40 000 � par QALY.
Par ailleurs, le dépistage à trois ou quatre ans avec traitement consécutif en cas d’anomalie permet de diminuer la perte de qualité de vie qu’impose un traitement plus tardif, car les moqueries et leurs conséquences sur le psychisme de l’individu sont plus importantes en âge scolaire qu’en âge préscolaire [2].
Le risque pour un amblyope unilatéral d’aboutir à un statut de malvoyance bilatérale (acuité visuelle binoculaire inférieure à 5/10) au cours de sa vie a été estimé à 1,2 % [23]. Ce chiffre de 1,2 % est également estimé par Jakobsson, mais pour un statut d’acuité visuelle binoculaire inférieure ou égale à 3/10 [12].
Il est possible que ce chiffre de risque soit sous-estimé car une étude hollandaise récente bien conduite [27] montre que le risque d’un handicap visuel bilatéral permanent (acuité visuelle binoculaire inférieure à 5/10) dans une population de cinquante-cinq ans et plus (moyenne 67,4 ans) est de 10 % chez les sujets non amblyopes et 18 % chez les sujets amblyopes. Pour information, cette étude donne l’incidence cumulée à cinq ans du handicap visuel précité (tableau 2-VI).
De plus, une fois la survenue du handicap visuel bilatéral, cette étude montre que les sujets amblyopes le subissent en moyenne six mois de plus au cours de leur vie que les non-amblyopes.
Vu la moyenne d’âge des sujets de cette étude, les causes traumatiques à la perte de vision ne sont pas prises en compte car celles-ci surviennent en général avant cinquante-cinq ans. L’importance de ce groupe est cependant nettement moindre que celle du groupe où le handicap provient d’affections liées à l’âge.
Pour justifier cette différence de résultat entre 1,2 % et 18 %, les auteurs arguent du fait que l’étude de Rahi est moins robuste dans sa réalisation et qu’elle délivre une estimation seulement minimale du risque. Comme le chiffre de risque de 1,2 % a été repris dans l’estimation coût/utilité du dépistage de l’étude de Carlton mentionnée au paragraphe précédent, la conclusion de l’étude aurait pu être déclinée différemment si le risque de 18 % avait été pris en compte.
Il n’est pas impossible que, dans les cinq ans à venir, toute la problématique du dépistage soit résolue par l’arrivée sur le marché du Pediatric Vision Scanner, appareil qui étudie directement la fixation et l’alignement en utilisant les qualités de biréfringence des fibres maculaires. Développé par Hunter vers la fin des années quatre-vingt-dix, la réalisation du prototype date de la moitié des années deux mille [11] et les publications cliniques ont suivi, d’abord en matière de dépistage du strabisme [18] puis de l’amblyopie [17]. Cette méthode permet de mesurer la qualité/quantité de fovéolarité en vision monoculaire, aussi bien que la qualité/quantité de bifovéolarité en vision binoculaire. Elle n’est aucunement soumise aux aléas de l’analyse du reflet cornéen décrits plus haut, ni à la question de savoir si l’acuité visuelle a été correctement mesurée ou si l’anomalie réfractive dépistée sera effectivement amblyopigène. Elle ne nécessite que peu de coopération et aucune réponse verbale de la part de l’enfant. Elle est extrêmement rapide (2,5 secondes) et représente à notre avis la solution idéale future du dépistage : en effet, si cet appareil répond à ses promesses, il permettra un dépistage direct de l’amblyopie et du strabisme, réalisable aussi bien par des pédiatres que par des infirmières ou des orthoptistes, et même par des acteurs non qualifiés. Il n’imposera aucune contrainte d’âge (pourvu que l’enfant fixe l’appareil) et, vu sa rapidité, une large couverture de population serait envisageable. À l’heure actuelle (2012), son prix n’a pas encore été fixé par la firme (REBIScan, Inc.).
Tableau 2-VI Risque de handicap visuel bilatéral permanent après 55 ans [27].
[1] Atkinson J, Braddick O, Bobier B, et al. Two infant screening programmes: Prediction and prevention of strabismus and amblyopia from videorefractive screening. Eye, 1996 ; 10 : 189-198.
[2] Carlton J, Karnon J, Czoski-Murray C, Smith KJ, Marr J. The clinical effectiveness and cost-effectiveness of screening programmes for amblyopia and strabismus in children up to the age of 4-5 years: a systematic review and economic evalutation. Health Technol Assess 2008 ; 12 : 194.
[3] Ciner E and the Vision in Preschoolers Study Group. Comparison of the Retinomax and Palm-AR autorefractors: a pilot study. Optom Vis Sci, 2011 ; 88 : 830-836.
[4] Cordonnier M. Screening for refractive errors in children. Comp Ophthalmol Update, 2006 ; 7 : 63-75.
[5] Cordonnier M. Dépistage des anomalies réfractives chez l’enfant préscolaire. Éditions Universitaires Européennes, Saarbrücken, Germany, 2010.
[6] Cyert L and the Vision in Preschoolers Study Group. Does assessing eye alignment along with refractive error or visual acuity increase sensitivity for detection of strabismus in preschool vision screening? Invest Ophthalmol Vis Sci, 2007 ; 48 : 3115-3125.
[7] Cyert L and the Vision In Preschoolers Study Group. Effect of age using Lea Symbols or HOTV for preschool vision screening. Optom Vis Sci, 2010 ; 87 : 87-95.
[8] Dobson V and the Vision in Preschoolers Study Group. Preschool vision screening tests administered by nurse screeners compared with lay screeners in the Vision in Preschoolers Study. Invest Ophthalmol Vis Sci, 2005 ; 46 : 2639-2648.
[9] Holmes JM, Kraker RT, Beck RW, Birch EE, Cotter SA, Everett DF, et al. A randomized trial of prescribed patching regimens for treatment of severe amblyopia in children. Ophthalmology, 2003 ; 110 : 2075-2087.
[10] Hrisos S, Clarke MP, Kelly T, Henderson J, Wright CM. Unilateral visual impairment and neurodevelopmental performance in preschool children. Br J Ophthalmol, 2006 ; 90 : 836-838.
[11] Hunter DG, Nassif DS, Piskun NV, Winsor R, Gramatikov BI, Guyton DL. The Pediatric Vision Screener I. Instrument design and operation. J Biomed Opt, 2004 ; 9 : 1363-1368.
[12] Jakobsson P, Kvarnström G, Abrahamsson M, Bjernbrink-Hörnblad E, Sunnqvist B. The frequency of amblyopia among visually impaired persons. Acta Ophthalmol Scand, 2002 ; 80 : 44-46.
[13] Köhler L, Stigmar G. Visual disorders in 7-year-old children with and without previous vision screening. Acta Paediatr Scand, 1978 ; 67 : 373-377.
[14] Kulp and the Vision In Preschoolers Study Group. Findings from The Vision In Preschoolers Study. Optom Vis Sci, 2009 ; 86 : 619-623.
[15] Lennerstrand G, Jakobsson P, Kvarnström G. Screening for ocular dysfunction in children: Approaching a common program. Acta Ophthalmol Scand, 1995 ; 214 : 26.
[16] Lithander J, Sjöstrand J. Anisometropic and strabismic amblyopia in the age group 2 years and above: a prospective study of the results of treatment. Br J Ophthalmol, 1991 ; 75 : 111-116.
[17] Loudon SE, Rook CA, Nassif DS, Piskun NV, Hunter DG. Rapid, high-accuracy detection of strabismus and amblyopia using the Pediatric Vision Scanner. Invest Ophthalmol Vis Sci, 2011 ; 52 : 5043-5048.
[18] Nassif DS, Piskun NV, Hunter DG. The Pediatric Vision Screener III. Detection of strabismus in children. Arch Ophthalmol, 2006 ; 124 : 509-513.
[19] Nilsson J. The negative impact of amblyopia from a population perspective: untreated amblyopia almost doubles the lifetime risk of bilateral visual impairment. Br J Ophthalmol, 2007 ; 91 : 1417-1418.
[20] Ohlsson J, Sjöstrand J. Preschool Vision Screening: Is it worthwhile ? In : Lorenz B, Moore AT, eds. Pediatric ophthalmology, neuro-ophthalmology, genetics. Book series: Essentials in ophthalmology. Heidelberg, Germany, Springer, 2006 : 19-36.
[21] Paliaga GP. Linear strabismometric methods. Binocular Vision, 1992 ; 7 : 139-154.
[22] Quéré M-A, Méhel E. Épidémiologie du strabisme de l’adulte. In : XXe Colloque, Nantes, 1995. Les strabismes de l’adolescent et de l’adulte. Lissac, Paris, 1995 : 7-12.
[23] Rahi J, Logan S, Timms C, et al. Risk, causes, and outcomes of visual impairment after loss of vision in the non-amblyopic eye: a population-based study. Lancet, 2002 ; 360 : 597-602.
[24] Schmidt P, Maguire M, Dobson V, et al. Comparison of preschool vision screening tests as administered by licensed eye care professionals in the Vision In Preschoolers Study. Ophthalmology, 2004 ; 111 : 637-650.
[25] Stewart CE, Fielder AR, Moseley MJ, Stephens DA, the MOTAS study. Dose-response relationship for occlusion therapy for the treatment of amblyopia: initial results from the MOTAS study. Invest Ophthalmol Vis Sci, 2002, 43.
[26] Suttle CM, Melmoth DR, Finlay AL, Sloper JJ, Grant S. Eye-hand coordination skills in children with and without amblyopia. Invest Ophthalmol Vis Sci, 2011 ; 52 : 1851-1864.
[27] Van Leeuwen R, Eijkemans MJC, Vingerling JR, Hofman A, de Jong P, Simonsz HJ. Risk of bilateral visual impairment in individuals with amblyopia: the Rotterdam study. Br J Ophthalmol, 2007 ; 91 : 1450-1451.
[28] Webber AL, Wood JM, Gole GA, Brown B. The Effect of amblyopia on fine motor skills in children. Invest Ophthalmol Vis Sci, 2008 ; 49 : 594-603.
[29] Williams C, Northstone K, Harrad RA, et al. Amblyopia treatment outcomes after preschool screening v school entry screening: observational data from a prospective cohort study. Br J Ophthalmol, 2003 ; 87 : 988-993.
[30] Williams C, Northstone K, Harrad RA, et al. Amblyopia treatment outcomes after screening before or at age 3 years: follow up from randomised trial. BMJ, 2002 ; 324 : 1549.
[31] Ying G and the VIP Study Group. Impact of confidence number on accuracy of the SureSight Vision screener. Optom Vis Sci, 2010 ; 87 : 96-103.
[32] Ying G, Maguire M, Quinn G, Kulp MT, Cyert L and the Vision In Preschoolers (VIP) Study Group. ROC analysis of the accuracy of noncycloplegic retinoscopy, Retinomax autorefractor, and SureSight Vision screener for preschool vision screening. Invest Ophthalmol Vis Sci, 2011 ; 52 : 9658-9664.

